Reducción del volumen de giro cingulado en Cavalier King Charles Spaniels con siringomielia y dolor neuropático

Reducción del volumen de giro cingulado en Cavalier King Charles Spaniels con siringomielia y dolor neuropático revelado por morfometría basada en vóxel: un estudio piloto
 Björn Nitzsche1,2,3*,
Björn Nitzsche1,2,3*,  Sabine Schulze4,
Sabine Schulze4,  Johannes Boltze5 y
Johannes Boltze5 y  Martin J. Schmidt3
Martin J. Schmidt3- 1Departamento de Medicina Nuclear, Hospital Universitario de Leipzig, Leipzig, Alemania
- 2Facultad de Medicina Veterinaria, Instituto de Anatomía, Histología y Embriología, Universidad de Leipzig, Leipzig, Alemania
- 3Departamento de Ciencias Clínicas Veterinarias, Clínica de Pequeños Animales, Neurocirugía, Neurorradiología y Neurología Clínica, Universidad Justus-Liebig, Giessen, Alemania
- 4Clínica de Pequeños Animales, Departamento de Medicina Veterinaria, Universidad Libre de Berlín, Berlín, Alemania
- 5Facultad de Ciencias de la Vida, Universidad de Warwick, Coventry, Reino Unido
Objetivo: Las alteraciones patomorfológicas del sistema nervioso central en perros, como la siringomielia y la malformación similar a Chiari, pueden causar hiperestesia craneal y cervical y dolor neuropático. La actividad a largo plazo de la red del dolor puede inducir alteración funcional y, finalmente, incluso cambios morfológicos en la red del dolor. Esto puede suceder especialmente en la corteza prefrontal y cingulada, donde se observó atrofia de la materia gris (GM) en humanos con dolor crónico, independientemente de la naturaleza del síndrome de dolor. Probamos la hipótesis de que los Cavalier King Charles Spaniels (CKCS) con malformación similar a Chiari y siringomielia asociada (SM) y dolor muestran diferencias morfológicas cerebrales en comparación con los animales sin signos de siringomielia y dolor.
Métodos: Los conjuntos de datos volumétricos de 28 estructuras cerebrales diferentes se analizaron de manera retrospectiva, incluida la morfometría basada en vóxeles, utilizando datos de imágenes de resonancia magnética obtenidos de 41 perros.
Resultados: Los análisis volumétricos revelaron una disminución en los volúmenes de GM en el giro cingulado (GC) en CKCS con SM y dolor crónico cuando se normalizó al volumen cerebral. Este hallazgo fue apoyado por la morfometría basada en vóxeles, que mostró un grupo de significación dentro del GC.
Conclusión: La atrofia GM en el GC se asocia con dolor crónico y, por lo tanto, puede servir como un parámetro de lectura objetivo para el diagnóstico o tratamiento de los síndromes de dolor canino.
Introducción
La siringomielia (SM) es una condición patológica debilitante de la médula espinal que se diagnostica con frecuencia en Cavalier King Charles Spaniels (CKCS). El SM a menudo se asocia con una malformación similar a Chiari (CM; Rusbridge y otros, 2000; Loderstedt et al., 2011). Esta variante canina de la malformación de Chiari humana tipo 1 incluye un hueso basioccipital acortado, invaginación basal y superposición atlantooccipital, así como inestabilidad atlantoaxial (Rusbridge et al., 2000). Se sugirió que un cierre prematuro de la sincondrosis basioccipital en la base del cráneo causaba acortamiento básico y alteraciones morfológicas de todo el cráneo (Schmidt et al., 2013a, b, 2014). Como resultado, el eje longitudinal del cerebro se comprime y el aspecto caudal del cerebelo se desvía hacia el foramen magnum (Figura 1A). Esto da como resultado corrientes en chorro de líquido cefalorraquídeo (LCR) en la unión craneocervical dirigidas hacia el espacio subaracnoideo y el canal central y causa expansión segmentaria de la médula espinal, cizalladura del tejido y daño parenquimatoso, lo que finalmente conduce a cavidades patognomónicas llenas de LCR (Hu et al., 2012; Cirovic et al., 2018). Los perros con CM pueden tener una médula espinal normal al comienzo de sus vidas y desarrollar SM durante varios años. Por razones desconocidas, el SM no se asocia con signos clínicos en algunos perros, mientras que el SM crea dolor neuropático expresado como hiperestesia craneal y cervical (a la palpación o espontáneamente) y rascado espontáneo asociado con vocalización a veces excesiva y aversión al tacto en otros perros (Rusbridge et al., 2019). Los correlatos neuropatológicos del dolor neuropático en perros incluyen la afección de las células del asta dorsal de la materia gris de la médula espinal (GM) que transporta información sensorial del cuerpo al cerebro (Rusbridge y Jeffery, 2008; Schmidt et al., 2013a,b), así como los procesos inflamatorios intraparenquimatosos (Hu et al., 2012; Schmidt et al., 2013a,b).
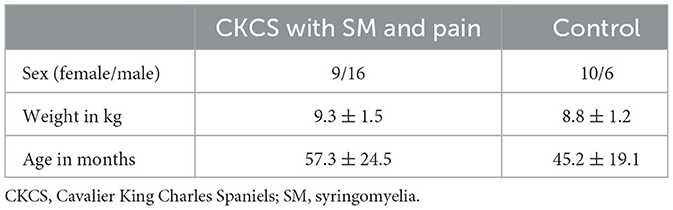
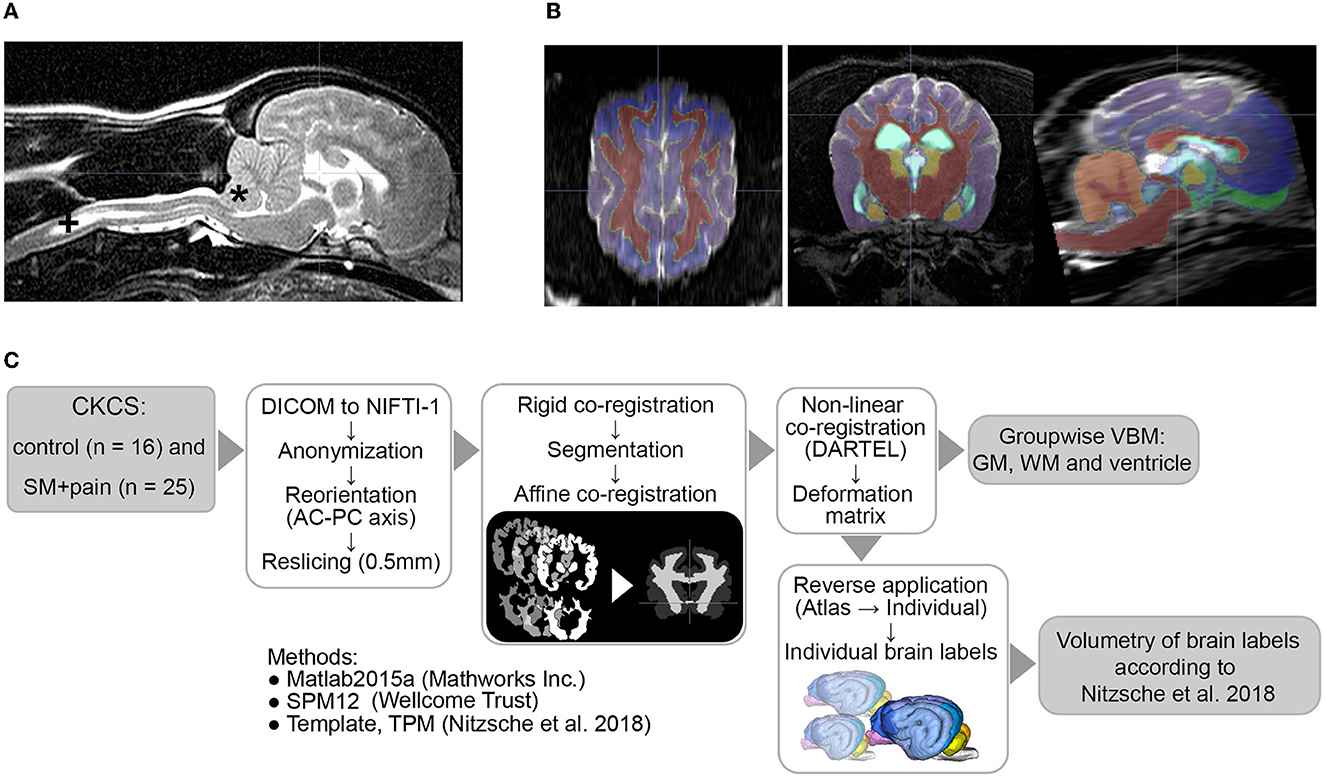 Figura 1. (A) Hallazgos de resonancia magnética de una malformación individual similar a Chiari Tipo I (*) en un Cavalier King Charles Spaniel (CKCS) con siringomielia (+, SM) y dolor, (B) etiquetas atlas alineadas con datos individuales de RM, y (C) posprocesamiento y análisis de imágenes. AC-PC: comisura anterior/comisura posterior; TPM: mapas de probabilidad tisular; DARTEL: Registro anatómico difeomorfo mediante álgebra de Lie exponencial; VBM: morfometría basada en vóxeles; GM: materia gris; WM, materia blanca.
Figura 1. (A) Hallazgos de resonancia magnética de una malformación individual similar a Chiari Tipo I (*) en un Cavalier King Charles Spaniel (CKCS) con siringomielia (+, SM) y dolor, (B) etiquetas atlas alineadas con datos individuales de RM, y (C) posprocesamiento y análisis de imágenes. AC-PC: comisura anterior/comisura posterior; TPM: mapas de probabilidad tisular; DARTEL: Registro anatómico difeomorfo mediante álgebra de Lie exponencial; VBM: morfometría basada en vóxeles; GM: materia gris; WM, materia blanca.
A diferencia de otras formas de entrada sensorial, no existe un área cortical específica dedicada al procesamiento de la entrada sensorial nociceptiva (Ahmad y Abdul Aziz, 2014). La experiencia del dolor resulta más bien de la actividad coordinada en varias regiones del cerebro, conocida como la red del dolor (García-Larrea y Peyron, 2013). Mientras que la corteza somatosensorial procesa los componentes discriminatorios primarios de la percepción del dolor, como la modalidad y la ubicación (Flor et al., 1995; Bushnell et al., 2013), otras estructuras cerebrales en esta red (corteza insular, tálamo, áreas mediales y orbitofrontales de la corteza prefrontal, corteza cingulada y GM periacueductal) son responsables de las respuestas vegetativas, emocionales y cognitivas al dolor (Price, 2000; Apkarian y otros, 2004; Bushnell et al., 2013). La red de dolor también facilita una modulación efectiva de la percepción del dolor tanto en humanos con síndromes de dolor crónico (mayo de 2008) como en animales después de la inducción experimental de dolor crónico (Stephen McMahon et al., 2013). La corteza prefrontal, como elemento de la red del dolor, puede activar el GM periacueductal, los núcleos del rafe y otros centros medulares, que a su vez envían señales inhibitorias descendentes al asta dorsal de la médula espinal para la modulación de la transmisión del dolor (Moore, 2016). Se sugiere que la activación de la corteza prefrontal es responsable de los efectos psicoanalgésicos de los placebos y la hipnosis que son capaces de reducir la intensidad del dolor percibido (Moriarty et al., 2011). Sin embargo, la actividad a largo plazo puede inducir alteración funcional y, finalmente, incluso cambios morfológicos en la red del dolor, especialmente en las cortezas prefrontal y cingulada (Zhuo, 2008; Rodríguez-Raecke et al., 2009). Se observó atrofia de la GM en varias partes de la red de dolor en humanos con dolor crónico, independientemente de la naturaleza del síndrome de dolor (mayo, 2008; Li y otros, 2010; Obermann et al., 2013; Smallwood et al., 2013; Cauda et al., 2014; Fritz et al., 2016). Se sugiere que la disminución cortical observada de GM perjudica la antinocicepción efectiva y, posiblemente, aumenta la sensibilización central, disminuyendo así el umbral del dolor (Zhuo, 2008). Dado que partes de la red del dolor también juegan un papel importante en los procesos emocionales, motivacionales y cognitivos generales (Heitmann et al., 2022), la atrofia cortical GM también puede provocar comorbilidades de dolor crónico como ansiedad y depresión, deterioro de la memoria de trabajo y disfunción ejecutiva tanto en humanos (Moriarty et al., 2011) como en animales (Hu et al., 2010).
La asociación entre el dolor crónico y la atrofia cortical de GM en la red de dolor se demostró en roedores de laboratorio con dolor crónico (Sang et al., 2018; Zhou et al., 2022). Sin embargo, no hay datos sobre animales con síndromes de dolor crónico natural o animales que no sean de laboratorio. En este estudio, investigamos posibles diferencias en los volúmenes cerebrales regionales en CKCS con una malformación similar a Chiari y SM / dolor neuropático crónico asociado en comparación con CKCS de control sano.
Materiales y métodos
Animales
Los registros médicos de todos los CKCS con CM que se sometieron a imágenes de resonancia magnética (MRI) de la cabeza y la columna cervical en la Clínica para Pequeños Animales de la Universidad Justus Liebig de Giessen, Alemania, entre 2011 y 2016 se revisaron retrospectivamente. La resonancia magnética se realizó para la selección de reproducción contra SM a petición de los dueños de los animales, o los perros fueron examinados para el diagnóstico de signos clínicos como hiperestesia o dolor. También se revisaron la historia clínica y los resultados de los exámenes físicos y neurológicos generales. Se examinaron los conjuntos de datos de resonancia magnética de dos grupos. En primer lugar, el grupo control incluyó CKCS clínicamente sano sin SM y sin ningún signo clínico documentado de dolor agudo o crónico (n = 16). En segundo lugar, el grupo de estudio estaba compuesto por perros con SM que exhibían síntomas clínicos de dolor neuropático durante al menos 3 meses (n = 25).
Declaración ética
Los datos de resonancia magnética se obtuvieron originalmente con fines diagnósticos y se analizaron retrospectivamente. Por lo tanto, no se solicitó la aprobación del comité de ética de la Universidad Justus Liebig y de la autoridad gubernamental regional responsable (Regierungspräsidium) del estado federal de Hesse porque la autoridad renuncia a la revisión ética de los estudios retrospectivos basados en imágenes clínicas realizadas con fines diagnósticos.
Técnica de imagen
Se utilizó un protocolo anestésico estándar (narcótico por inhalación de isoflurano 1,5%-2,5%, premedicación con diazepam 0,1 mg/kg y propofol 6 mg/kg). La adquisición de imágenes se realizó utilizando un escáner 1.0 Tesla (Gyroscan Intera, Phillips, Hamburgo, Alemania) con una bobina SENSE-flex-M colocada bilateralmente. Se realizaron exploraciones sagitales, transversales y dorsales de todo el cerebro y la columna cervical. Se utilizaron secciones del cerebro ponderadas en T2 (eco T2-Turbospin, TE/TR: 108/8.627 ms, promedios: 4; grosor del corte: 2,0 mm, espaciado: 2,2 mm, matriz de adquisición: 288 × 288; ángulo de giro: 90°; tamaño del vóxel: 0,4 × 0,4 × 2,2 mm, tiempo de adquisición: 16 min) para investigaciones adicionales.
Procesamiento y análisis de imágenes
El procesamiento de imágenes se realizó como se describió anteriormente (Nitzsche et al., 2018) por un investigador ciego a los grupos. El flujo de trabajo se muestra en la figura 1. Brevemente, todos los conjuntos de datos DICOM fueron anonimizados y almacenados en formato NIFTI-1. Los datos se reorientaron de acuerdo con el espacio estereotáxico canino (Nitzsche et al., 2018) y se realinearon / recortaron a un tamaño de vóxel isométrico de 0,5 mm de acuerdo con el espacio atlas canino utilizando interpolación B-spline de 6º orden. A partir de entonces, los conjuntos de datos se registraron rígidamente (6º grado de libertad) en la plantilla canina T2w TSE promediada por raza utilizando SPM12 (Versión 7771, Welcome Trust Center) en Matlab 2019 (Mathworks Inc.). Todos los datos se segmentaron automáticamente en GM, materia blanca (WM) y LCR mediante la rutina SPM12, y se crearon mapas de probabilidad de tejido canino como se describió anteriormente utilizando una limpieza de campo aleatorio de Markov (Nitzsche et al., 2018, Markov Random Field cleanup: 2). Las máscaras individuales de GM, WM y tejido ventricular se registraron afines (normalizada, distancia de muestreo: 2 mm) y, posteriormente, no linealmente co-registrado a la máscara de plantilla de cerebro canino utilizando el Algoritmo de Registro Difeomorfo (DARTEL, Ashburner, 2007).
Volumetría
Las matrices de deformación individual calculadas se aplicaron inversamente a las etiquetas modificadas del atlas del cerebro canino (Nitzsche et al., 2018) para transformar las etiquetas en un espacio individual. Las etiquetas del atlas incluían GM de los hemisferios cerebrales (el lóbulo frontal, temporal, parietal y occipital), bulbo olfatorio, giro cingulado (CG), GM subcortical (el núcleo caudado, tálamo y cuerpo geniculado lateral y medial) e hipocampo, así como tractos WM (el tracto olfativo lateral y el cuerpo calloso), estructuras cerebelosas (los hemisferios laterales, vermis y sustancia blanca cerebelosa), y espacios internos del LCR (ventrículo lateral, 3er ventrículo, acueducto mesencefálico, 4to ventrículo y canal central). El volumen se calculó en ml y en el porcentaje del volumen cerebral respectivo de cada etiqueta cerebral. La calidad de la deformación y segmentación del atlas inverso fue verificada visualmente por el investigador responsable (Figura 1B).
Morfometría basada en vóxeles
Para corregir las diferencias espaciales locales, el registro anatómico difeomorfo a través del álgebra de Lie exponencial (DARTEL) registrado GM y máscaras ventriculares se suavizaron inicialmente utilizando un filtro gaussiano de 3 mm y posteriormente se analizaron utilizando la tubería SPM12. La morfometría basada en vóxeles (VBM) para GM y ventrículos se realizó utilizando una prueba t con corrección familiar con volumen cerebral, edad y peso corporal como covariables (Whitwell, 2009; Abbott et al., 2012).
Análisis estadístico
El análisis estadístico de los volúmenes absolutos y relativos se realizó utilizando un paquete de software comercial (Graph Pad Prism 4.0, Graph Pad Software Inc., San Diego, California). La desviación de la distribución normal se verificó utilizando la gráfica de probabilidad normal de los residuos del modelo para cada variable. Se realizó un Análisis de Covarianza unidireccional (ANCOVA) con respecto al peso corporal y multicomparación utilizando el método de Bonferroni. Los valores de p de ≥0,05 y <0,1 se interpretaron como indicativos de tendencias. Se utilizó un nivel de significación familiar para todas las comparaciones. El valor de p de <0,05 fue considerado estadísticamente significativo. Los datos se presentan como media ± desviación estándar. El coeficiente de dispersión del cuartil (QCD) se calculó para todos los volúmenes relativos de etiquetas utilizando la fórmula: QCD = (Cuartil 3 – Cuartil 1)/mediana.
Resultados
La Tabla 1 proporciona datos resumidos sobre la población de estudio, incluyendo sexo, peso corporal y edad. En la sección de datos de apoyo (Cuadro complementario 1) se incluye un cuadro con datos demográficos detallados. No hubo diferencias estadísticamente significativas entre ambos grupos en cuanto a la edad (p = 0,117) o el peso corporal (p = 0,278). Los signos clínicos en los 25 CKCS con MS y dolor neuropático crónico incluyeron varias manifestaciones de dolor paroxístico con vocalización y rascado fantasma informado por el propietario dirigido al área cervical o del hombro (frecuencia media: 5 / día, rango de 2 / semana a 20 / día). La duración de los signos clínicos varió de 3,5 a 24 meses (media 8,3 meses). Hubo una correlación moderada entre la duración de los signos clínicos y la frecuencia de los ataques de dolor (r2 = 0,57; p < 0,05).
Comparación absoluta del volumen cerebral
No se pudieron observar diferencias significativas para los volúmenes temporales, parietales, occipitales, frontales y del lóbulo olfativo entre los controles y el CKCS con SM y dolor crónico. Además, no hubo diferencias estadísticamente significativas en los volúmenes absolutos de los ventrículos lateral, 3º y 4º ni en los volúmenes del acueducto mesencefálico. Los volúmenes del núcleo caudado, tálamo, hipocampo y cuerpo geniculado lateral, así como los volúmenes cortical y cerebeloso, también fueron indiferentes. Sin embargo, los controles exhibieron volúmenes significativamente más pequeños del cuerpo calloso y del tracto olfativo lateral en comparación con los CCR con SM y dolor. Además, el volumen absoluto de WM en el grupo control fue significativamente menor que en CKCS con SM y dolor. Consulte la Tabla 2 para obtener más detalles.
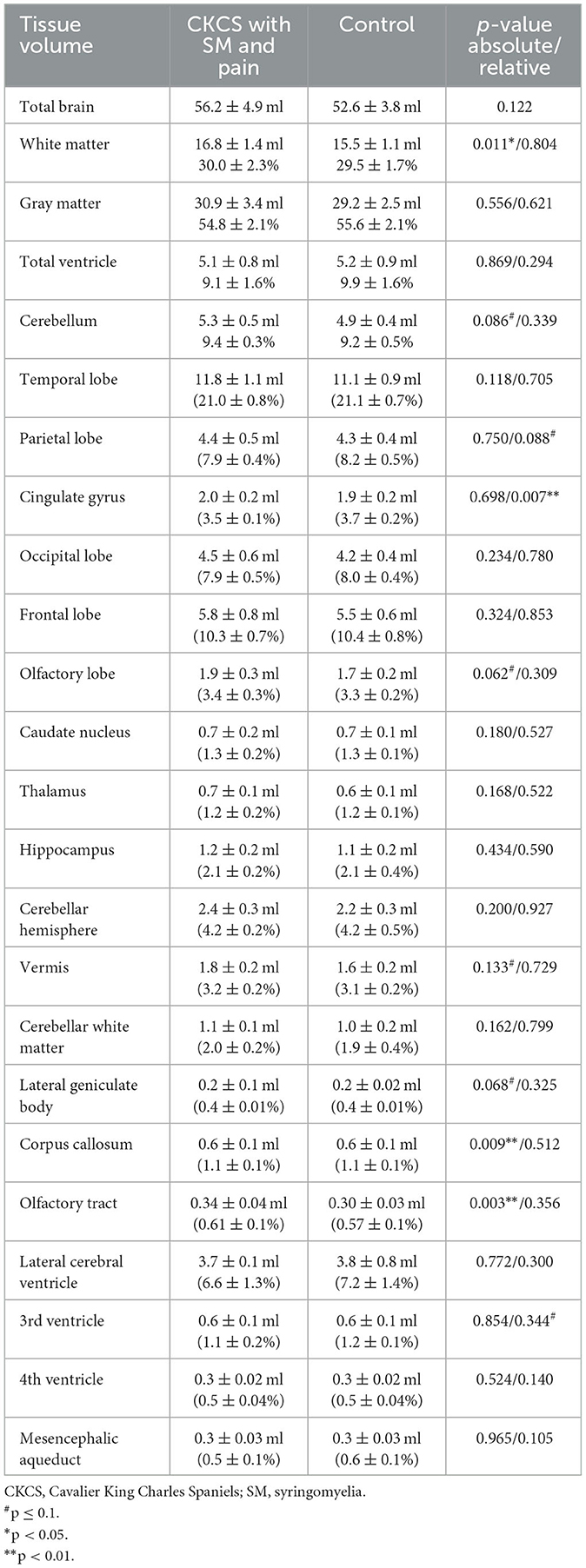 Tabla 2. Comparación del volumen tisular absoluto en ml y los volúmenes tisulares relativos en el porcentaje del volumen cerebral total individual en CKCS.
Tabla 2. Comparación del volumen tisular absoluto en ml y los volúmenes tisulares relativos en el porcentaje del volumen cerebral total individual en CKCS.
Volúmenes de estructura relativa y VBM
La comparación de los volúmenes relativos de la estructura cerebral (en relación con el volumen cerebral individual) no reveló diferencias significativas en ninguna estructura cerebral, cerebelosa o ventrcular, excepto por el volumen del GC, que fue significativamente menor en CKCS con SM y dolor. Los detalles se presentan en la Tabla 2. El hallazgo fue apoyado por una comparación estadística, en cuanto a vóxeles, de máscaras GM (VBM) de control y CKCS con SM y dolor (Figura 2). Un cúmulo sobrevivió significativamente en las coordenadas (x, y y z) [−1.5, −16, 14] (p = 0.048). No se detectaron vóxeles significativos al analizar WM o el sistema ventricular.
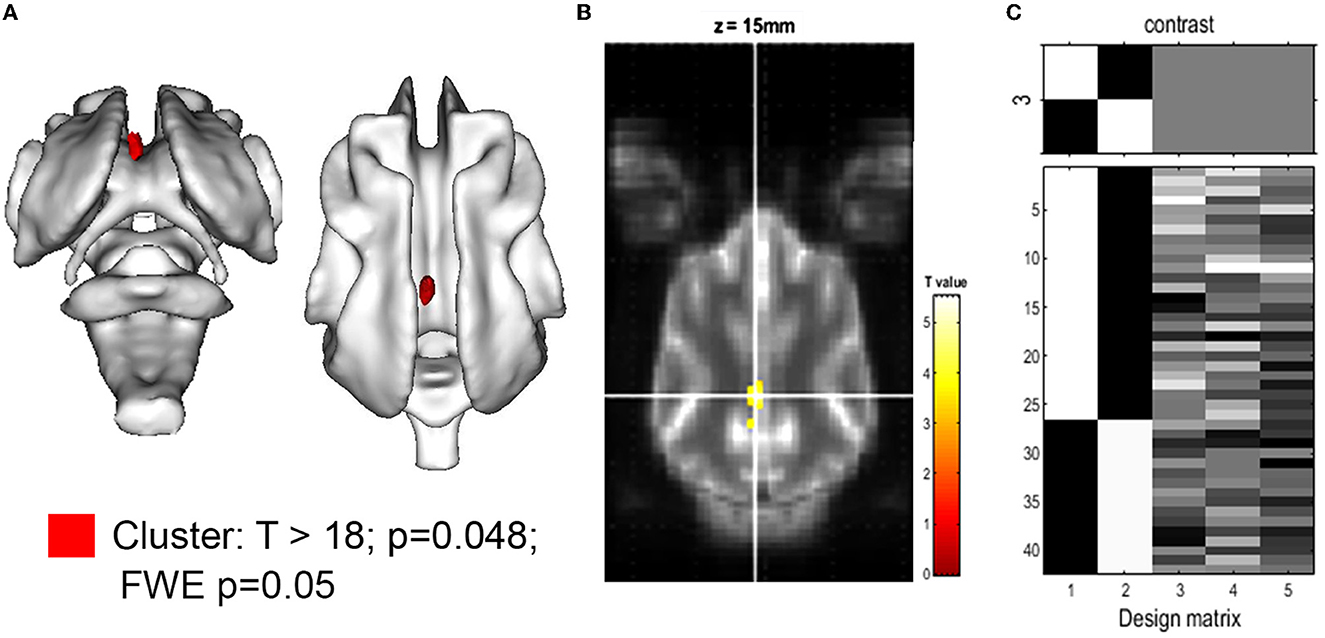 Figura 2. Morfometría basada en vóxeles de la materia gris para la hipótesis: CKCS, SM y control de < dolor. (A) Representación 3D del conglomerado de significación (rojo, p = 0,048). El cúmulo se proyectó sobre la materia blanca del atlas del cerebro canino (Nitzsche et al., 2018) y se encuentra en el giro cingulado. El mapa del valor T con T >18 se proyecta en el atlas del cerebro canino dado por SPM. (B) Una imagen del atlas transversal con el grupo de significación superpuesto en coordenadas (x, y, z) [−1.5, −16, 14] según lo dado por SPM12. La prueba T entre CKCS con MS y controles de dolor crónico se realizó utilizando el error familiar (pocos; p = 0,05) y volumen cerebral, edad y peso corporal como factores de covarianza. (C) La matriz de diseño (derecha) muestra el número de individuos por grupo (asignación en las primeras 2 filas), así como el valor de la covariante respectiva para cada individuo (filas 3-5).
Figura 2. Morfometría basada en vóxeles de la materia gris para la hipótesis: CKCS, SM y control de < dolor. (A) Representación 3D del conglomerado de significación (rojo, p = 0,048). El cúmulo se proyectó sobre la materia blanca del atlas del cerebro canino (Nitzsche et al., 2018) y se encuentra en el giro cingulado. El mapa del valor T con T >18 se proyecta en el atlas del cerebro canino dado por SPM. (B) Una imagen del atlas transversal con el grupo de significación superpuesto en coordenadas (x, y, z) [−1.5, −16, 14] según lo dado por SPM12. La prueba T entre CKCS con MS y controles de dolor crónico se realizó utilizando el error familiar (pocos; p = 0,05) y volumen cerebral, edad y peso corporal como factores de covarianza. (C) La matriz de diseño (derecha) muestra el número de individuos por grupo (asignación en las primeras 2 filas), así como el valor de la covariante respectiva para cada individuo (filas 3-5).
Los QCD de los volúmenes relativos de GM fueron casi los mismos en ambos grupos (0,05 en control vs. 0,046 en CKCS con SM y dolor), mientras que los QCD más altos se encontraron generalmente para los volúmenes totales del ventrículo (0,28 en los controles vs. 0,22 en CKCS con SM y dolor), y en particular los volúmenes lateral (0,31) y 3er ventrículo. Además, los QCD de los volúmenes lateral y del tercer ventrículo fueron mayores en los controles (0,31 y 0,24) en comparación con los CCRC con MS y dolor (0,26 y 0,19). Curiosamente, los QCD de los volúmenes cerebelosos en CKCS con SM y dolor (0,05) fueron mayores que en los controles (0,01). Específicamente, hubo una QCD más del doble mayor para los volúmenes vermis en CKCS con SM y dolor (0.07) en comparación con los controles (0.03; Figura 3).
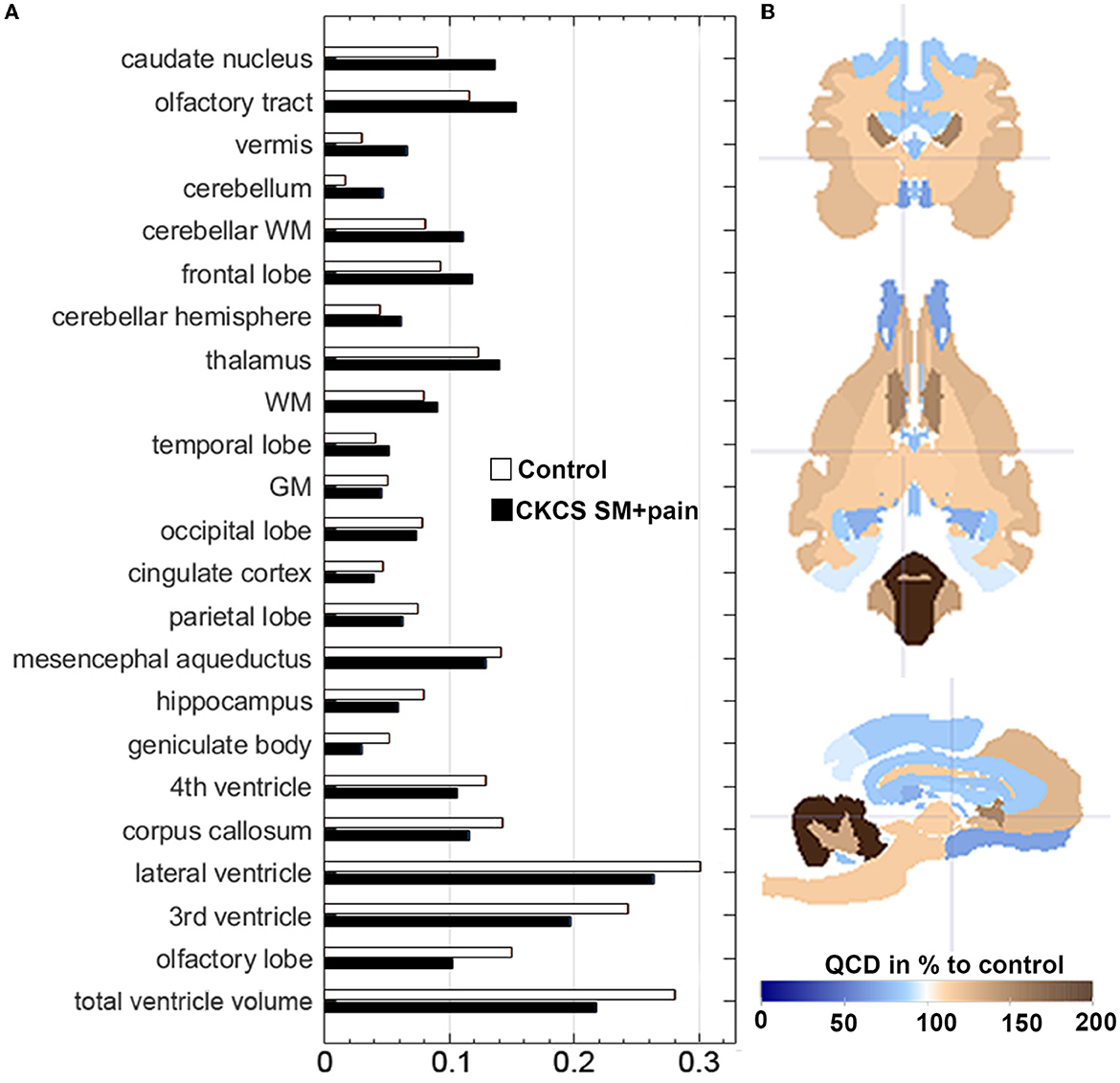 Figura 3. (A) Distribución de datos de volúmenes relativos de estructura cerebral utilizando el coeficiente de dispersión del cuartil (QCD). QCDs de volúmenes relativos de estructura cerebral para CKCS con SM y dolor vs. controles. Los QCD de los volúmenes relativos de la corteza cingulada fueron casi los mismos en ambos grupos, mientras que los del cerebelo y el vermis fueron casi dos veces más altos en CKCS con SM y dolor que en los controles. (B) El mapa de etiquetas parametrizado (basado en etiquetas atlas de Nitzsche et al., 2018) muestra la diferencia porcentual de CKCS con SM y QCD de dolor en comparación con QCD de control. Punto de mira en coordenadas (x, y, z) [2, 2, 2].
Figura 3. (A) Distribución de datos de volúmenes relativos de estructura cerebral utilizando el coeficiente de dispersión del cuartil (QCD). QCDs de volúmenes relativos de estructura cerebral para CKCS con SM y dolor vs. controles. Los QCD de los volúmenes relativos de la corteza cingulada fueron casi los mismos en ambos grupos, mientras que los del cerebelo y el vermis fueron casi dos veces más altos en CKCS con SM y dolor que en los controles. (B) El mapa de etiquetas parametrizado (basado en etiquetas atlas de Nitzsche et al., 2018) muestra la diferencia porcentual de CKCS con SM y QCD de dolor en comparación con QCD de control. Punto de mira en coordenadas (x, y, z) [2, 2, 2].
Discusión
Esta es la primera investigación que documenta una posible relación entre el SM con el dolor crónico y los cambios estructurales en los elementos de la red de dolor cerebral en CKCS. Hubo una disminución de volumen pequeña pero significativa en el GC GM en CKCS con SM y dolor crónico en comparación con los controles.
Se sabe que el GC, en particular, la parte anterior, es un área clave en los procesos de modulación central involucrados en la sensación de dolor crónico en humanos (Woodworth et al., 2019). Se observó una disminución en CG GM en humanos con diversas condiciones de dolor crónico (Apkarian et al., 2004; Rodríguez-Raecke et al., 2009). Varios estudios longitudinales que utilizan VBM han demostrado la reversibilidad de la atrofia GM después de un tratamiento exitoso del dolor crónico (Rodriguez-Raecke et al., 2009; Obermann et al., 2013). Esto sugiere que la disminución del volumen de GM no está relacionada con la muerte neuronal. Se sugirió que los cambios en el tamaño de las espinas dendríticas, las conexiones intercorticales y la disminución en el tamaño celular eran los principales factores que contribuyen a la reducción del volumen de GM (Rodríguez-Raecke et al., 2009). Si bien la atrofia se ha detectado en diferentes partes de la red de dolor humano, el GC y la corteza prefrontal estuvieron involucrados de manera más consistente a lo largo de los estudios (Rodriguez-Raecke et al., 2009). Un estudio de Szabo et al. (2019) reveló que el GC es un elemento de una red de estado de reposo en perros, que también incluye otras áreas como el área premotora izquierda, las regiones caudales medial y bilateral del GC y el giro esplenial. Sin embargo, el alcance y el tipo de posibles alteraciones morfológicas en un escenario patológico en perros siguen sin estar claros. En este estudio piloto, mostramos atrofia exclusiva de CG en el CKCS con SM y dolor crónico mediante el uso de 21 regiones cerebrales marcadas. Sin embargo, no fue posible excluir la degeneración secundaria de la sustancia blanca cerebral por siringomielia asociada con dolor. Por lo tanto, se requieren más estudios prospectivos para identificar alteraciones dependientes de la red en la red de dolor de la siringomielia (Czeibert et al., 2019; Johnson et al., 2020), incluidos los tractos de materia blanca.
No pudimos detectar diferencias en ningún volumen cerebral además del GC o entre los volúmenes del ventrículo cuando se corrigió el volumen cerebral total. Además, VBM no detectó ninguna diferencia en los ventrículos entre los dos grupos. Por lo tanto, concluimos que la siringomielia tuvo solo un efecto menor sobre las estructuras cerebrales y, por lo tanto, la aparición exclusiva de cambios en GC en CKCS con SM y dolor estuvo relacionada con el dolor.
La precisión de VBM para evaluar pequeñas diferencias de volumen en conjuntos de datos neurorradiológicos se ha demostrado en humanos, caninos y otras especies (Hellewell et al., 2019). Por ejemplo, VBM utilizando un enfoque de vóxel ha demostrado ser una poderosa herramienta morfométrica para investigar las diferencias en los volúmenes cerebrales en perros con epilepsia (Frank et al., 2018) y trastornos compulsivos (Ogata et al., 2013). Sin embargo, la aplicabilidad de la técnica al evaluar conjuntos de datos caninos es limitada debido a la variabilidad entre razas de las estructuras cerebrales caninas. Por lo tanto, consideramos covariables conocidas como la morfología del cráneo, el tamaño del cerebro, el peso corporal y la edad (Schmidt et al., 2014). Utilizamos una canalización de procesamiento de imágenes aprobada para permitir el procesamiento casi automatizado, evitando la interferencia del observador al procesar todos los datos por igual. Sin embargo, no podemos excluir haber pasado por alto diferencias menores debido al tamaño relativamente pequeño del grupo en nuestro estudio.
La precisión de la medición de los volúmenes de la subestructura cerebral mediante una serie de imágenes de RM transversales está limitada por el tamaño del vóxel, el grosor del corte y las grandes distancias entre cortes. Las imágenes analizadas retrospectivamente en este estudio fueron producidas en exámenes clínicos de rutina, considerando necesidades clínicas como la corta duración de la anestesia. Por lo tanto, los ajustes de imagen no se optimizaron como se podría esperar en un entorno experimental o un ensayo prospectivo. Cabe destacar que la modalidad de RM y el tamaño de la imagen son comparables a otros estudios (Abbott et al., 2012; Ogata et al., 2013; Frank et al., 2018; Czeibert et al., 2020). Sin embargo, una distancia entre cortes (espaciado) de 2,2 mm y la adquisición de datos no isovoxel podrían limitar la precisión de nuestro enfoque, ya que la extensión longitudinal de las estructuras subcorticales puede subestimarse debido a posibles desalineaciones durante el proceso de registro de las etiquetas del atlas. Hemos compensado este inconveniente recortando con la interpolación 6th B-spline. Sin embargo, no se pueden excluir las diferencias omitidas entre los grupos, especialmente en el polo de una estructura cerebral longitudinal. Por otro lado, se demostró que las distancias entre cortes de hasta 5 mm no reducen notablemente la precisión ni proporcionan un obstáculo para las comparaciones confiables en humanos cuando se utiliza la interpolación bicúbica o bilineal como se implementa en SPM (Ghoshal et al., 2020). Es importante destacar que los protocolos de imagen fueron idénticos para todos los perros, lo que limita fuertemente las posibles imprecisiones en cualquier evaluación (Schmidt et al., 2015). Además, los estudios prospectivos deben abordar estos problemas mediante la implementación de una técnica de resonancia magnética 3D rápida, sensible y de alta resolución, incluida una distancia de corte más corta.
La variabilidad de los volúmenes de la estructura cerebral en nuestro estudio fue similar a nuestros hallazgos anteriores para razas individuales (Nitzsche et al., 2018), excepto para el cerebelo. Curiosamente, el volumen cerebeloso relativo de CKCS con SM y dolor varió dos veces más que en los perros control (Figura 3). Esto puede explicar la falta de significación estadística de las diferencias de volumen cerebeloso en nuestro estudio en contraste con otros (Shaw et al., 2012). Por lo tanto, la alta variabilidad puede dar una pista de entidades subyacentes que alteran el cerebelo en CKCS con SM y dolor. Esto debe aclararse en estudios adicionales.
Se encontraron diferencias significativas en los volúmenes del cuerpo calloso y del tracto olfativo al comparar el volumen absoluto del tejido (ver Tabla 2). Sin embargo, no se pudieron detectar diferencias al comparar volúmenes después de ajustar los volúmenes cerebrales individuales. De hecho, las publicaciones sobre casos clínicos informan características similares en pacientes humanos con CM (Erol, 2012; Tijssen et al., 2016). Desafortunadamente, todavía falta un análisis sistemático hasta donde sabemos. Es razonable no excluir la posibilidad de que una diferencia real en nuestro estudio pueda haber sido cubierta por la dispersión de datos interindividual relativamente amplia y el tamaño de los grupos pequeños. Si existen tales diferencias, la circulación glifática alterada, los procesos inflamatorios y el edema pueden explicarlas. Sin embargo, nuestros datos no nos permiten concluir que tales diferencias existan realmente. Dadas las características clínicas y morfométricas comparables de la CM en CKCS y humanos, creemos que la investigación adicional en poblaciones caninas puede contribuir significativamente a aclarar esta pregunta y potencialmente incluso crear un «modelo» para estudiar el impacto de la condición en la morfometría cerebral en poblaciones de pacientes veterinarios del mundo real. Sin embargo, esto se dejaría para futuras investigaciones.
Existe una correlación entre la atrofia cortical GM y la duración del dolor (Rodriguez-Raecke et al., 2009; Fuchs et al., 2014). En nuestro grupo de estudio, el tiempo promedio de presencia de los síntomas clínicos fue de 8 meses (rango: 3,5-24 meses), y el dolor crónico se diagnosticó cuando dura o recurre durante más de 3 meses de acuerdo con los estándares establecidos (Merskey et al., 1994). Aunque no está claro cuánto tiempo es necesario para que la atrofia cerebral asociada al dolor se vuelva macroscópicamente visible en los perros, se puede suponer que la atrofia aumenta con la presencia más prolongada de dolor crónico. El análisis de los cerebros de CKCS con dolor crónico de larga duración (12 meses o más) podría haber revelado diferencias de volumen en otras áreas corticales también. Sin embargo, solo una minoría de los perros en nuestro grupo de estudio tuvo dolor crónico durante más de 12 meses (n = 3). Una limitación de este estudio es la evaluación retrospectiva del dolor neuropático, que se basa principalmente en la frecuencia de ataques de rascado por día. Además, la intensidad del dolor percibido podría tener una influencia en la atrofia GM. Por lo tanto, una comparación de perros con duración e intensidad de dolor crónico comparable sería ideal. Sin embargo, faltan métodos para evaluar objetivamente la intensidad del dolor neuropático en CKCS con SM (Thoefner et al., 2019), y la objetividad puede verse obstaculizada aún más por el hecho de que la evaluación del dolor generalmente es realizada por los propietarios de los pacientes en lugar de los veterinarios.
Al igual que en los pacientes humanos, los CKCS con SM pueden presentar comorbilidades de dolor neuropático crónico, como letargo, trastornos del sueño, disminución de la disposición a hacer ejercicio y aumento del comportamiento relacionado con el miedo (Sanchis-Mora et al., 2016; Rusbridge et al., 2019). Tales comorbilidades son otra explicación potencial para las diferencias observadas entre los perros en el grupo de estudio y los perros de control. Por lo tanto, no podemos excluir que la atrofia del GC pueda haber sido causada por comorbilidades o una combinación de dolor y comorbilidades. Sin embargo, solo dos de los propietarios informaron comorbilidades típicas en sus perros (letargo y deambular nocturno), mitigando un poco esta preocupación.
En la etapa actual, el impacto de nuestros resultados puede no ir más allá de la primera evidencia tentativa de una «firma de dolor crónico» en los cerebros caninos. A pesar de las limitaciones potenciales, nuestros datos justifican una investigación más detallada de la atrofia cerebral relacionada con el dolor en perros, así como los factores potenciales que son causantes o contribuyen a este proceso en estudios clínicos más grandes y potencialmente multicéntricos. Si la atrofia CG se encuentra consistentemente en estos estudios, puede servir como un parámetro objetivo para el diagnóstico del dolor neuropático, como una indicación para la intervención terapéutica o como un parámetro de lectura objetiva para la eficiencia terapéutica en los síndromes de dolor canino.
Conclusión y relevancia clínica
Los volúmenes de CG GM disminuyen en CKCS con SM y dolor crónico, como se muestra al comparar volúmenes relativos y VBM. Si se confirma en estudios futuros, la atrofia CG-GM puede servir como un parámetro objetivo para el diagnóstico del dolor neuropático, como una indicación para la intervención terapéutica o como un parámetro de lectura objetiva para la eficiencia terapéutica en los síndromes de dolor canino.
Declaración de disponibilidad de datos
Las contribuciones originales presentadas en el estudio se incluyen en el artículo / material complementario, las consultas adicionales pueden dirigirse al autor correspondiente.
Declaración ética
No se requirió revisión ética y aprobación para el estudio en animales porque, Estudio retrospectivo: no se buscó la aprobación del Comité de Ética de la Universidad Justus Liebig y la autoridad gubernamental regional responsable (Regierungspräsidium) del estado federal de Hesse porque la autoridad renuncia a la revisión ética de los estudios retrospectivos basados en imágenes clínicas realizadas con fines de diagnóstico. Se obtuvo el consentimiento informado por escrito de los propietarios para la participación de sus animales en este estudio.
Contribuciones del autor
BN redactó el manuscrito, generó, escribió y discutió los resultados, coordinó la redacción del manuscrito, contribuyó a todos los párrafos y creó figuras y tablas. SS redactó el manuscrito, recolectó datos y trabajó en datos, discutió los resultados y contribuyó a la sección de métodos. JB redactó el mansucript, escribió el manuscrito, discutió los resultados, diseñó su estructura y contribuyó a todos los párrafos. MS redactó la idea del manuscrito, diseñó su estructura, escribió el manuscrito y contribuyó con la mayoría de los párrafos. Todos los autores contribuyeron al artículo y aprobaron la versión presentada.
Conflicto de intereses
Los autores declaran que la investigación se llevó a cabo en ausencia de cualquier relación comercial o financiera que pudiera interpretarse como un posible conflicto de intereses.
Nota del editor
Todas las afirmaciones expresadas en este artículo son únicamente las de los autores y no representan necesariamente las de sus organizaciones afiliadas, o las del editor, los editores y los revisores. Cualquier producto que pueda ser evaluado en este artículo, o reclamo que pueda ser hecho por su fabricante, no está garantizado ni respaldado por el editor.
Material complementario
El material complementario para este artículo se puede encontrar en línea en: https://www.frontiersin.org/articles/10.3389/fnana.2023.1175953/full#supplementary-material
Referencias
Abbott, D. F., Pell, G. S., Pardoe, H. R. y Jackson, G. D. (2012). Selección de métodos apropiados basados en vóxeles para estudios de neuroimagen. Neuroimagen 59, 885–886. doi: 10.1016/j.neuroimage.2011.06.083
Resumen de PubMed | Texto completo de CrossRef | Google Académico
Apkarian, A. V., Sosa, Y., Sonty, S., Levy, R. M., Harden, R. N., Parrish, T. B., et al. (2004). El dolor de espalda crónico se asocia con una disminución de la densidad de materia gris prefrontal y talámica. J. Neurosci. 24, 10410–10415. doi: 10.1523/JNEUROSCI.2541-04.2004
Resumen de PubMed | Texto completo de CrossRef | Google Académico
Ashburner, J. (2007). Un algoritmo rápido de registro de imágenes difeomorfas. Neuroimagen 38, 95–113. doi: 10.1016/j.neuroimage.2007.07.007
Resumen de PubMed | Texto completo de CrossRef | Google Académico
Bushnell, M. C., Ceko, M. y Low, L. A. (2013). Control cognitivo y emocional del dolor y su interrupción en el dolor crónico. Neurosci. 14, 502–511. DOI: 10.1038/NRN3516
Resumen de PubMed | Texto completo de CrossRef | Google Académico
Cauda, F., Palermo, S., Costa, T., Torta, R., Duca, S., Vercelli, U., et al. (2014). Alteraciones de la materia gris en el dolor crónico: un enfoque metaanalítico orientado a la red. Neuroimagen Clin. 4, 676–686. doi: 10.1016/j.nicl.2014.04.007
Resumen de PubMed | Texto completo de CrossRef | Google Académico
Cirovic, S., Lloyd, R., Jovanovik, J., Volk, H. A. y Rusbridge, C. (2018). Simulación por ordenador de siringomielia en perros. BMC Vet. 14, 82. DOI: 10.1186/S12917-018-1410-7
Resumen de PubMed | Texto completo de CrossRef | Google Académico
Czeibert, K., Andics, A., Petnehazy, O. y Kubinyi, E. A. (2019). Mapa detallado de la etiqueta del cerebro canino para el análisis de neuroimagen. Biol. Futur. 70, 112–120. doi: 10.1556/019.70.2019.14
Resumen de PubMed | Texto completo de CrossRef | Google Académico
Czeibert, K., Sommese, A., Petnehazy, O., Csorgo, T. y Kubinyi, E. (2020). Endocasting digital en morfología cerebral canina comparativa. Frente. Vet. Sci. 7, 565315. DOI: 10.3389/FVETS.2020.565315
Resumen de PubMed | Texto completo de CrossRef | Google Académico
Erol, F. S. (2012). Múltiples anomalías espinales asociadas con la disgenesia del cuerpo calloso. Ir. J. Med. 181, 385–388. doi: 10.1007/s11845-010-0485-3
Resumen de PubMed | Texto completo de CrossRef | Google Académico
Flor, H., Elbert, T., Knecht, S., Wienbruch, C., Pantev, C., Birbaumer, N., et al. (1995). Dolor de miembro fantasma como correlato perceptivo de la reorganización cortical después de la amputación del brazo. Nature 375, 482–484. DOI: 10.1038/375482A0
Resumen de PubMed | Texto completo de CrossRef | Google Académico
Frank, L., Lupke, M., Kostic, D., Loscher, W. y Tipold, A. (2018). Volumen de materia gris en beagles sanos y epilépticos utilizando morfometría basada en vóxeles – un estudio piloto. BMC Vet. 14, 50. DOI: 10.1186/S12917-018-1373-8
Resumen de PubMed | Texto completo de CrossRef | Google Académico
Fritz, H. C., McAuley, J. H., Wittfeld, K., Hegenscheid, K., Schmidt, C. O., Langner, S., et al. (2016). El dolor de espalda crónico se asocia con una disminución de la materia gris prefrontal e insular anterior: resultados de un estudio de cohorte basado en la población. J. Pain 17, 111–118. doi: 10.1016/j.jpain.2015.10.003
Resumen de PubMed | Texto completo de CrossRef | Google Académico
Fuchs, P. N., Peng, Y. B., Boyette-Davis, J. A. y Uhelski, M. L. (2014). La corteza cingulada anterior y el procesamiento del dolor. Frente. Integrar. Neurosci. 8, 35. DOI: 10.3389/FNINT.2014.00035
Resumen de PubMed | Texto completo de CrossRef | Google Académico
Garcia-Larrea, L., y Peyron, R. (2013). Matrices de dolor y matrices de dolor neuropático: una revisión. Dolor 154, S29–S43. doi: 10.1016/j.pain.2013.09.001
Resumen de PubMed | Texto completo de CrossRef | Google Académico
Ghoshal, S., Banu, S., Chakrabarti, A., Sur-Kolay, S. y Pandit, A. (2020). Reconstrucción 3D de la imagen de la columna vertebral a partir de cortes de resonancia magnética 2D a lo largo de un eje. IET Image Process 14, 2746–2755. DOI: 10.1049/IET-IPR.2019.0800
Heitmann, H., Andlauer, T. F. M., Korn, T., Muhlau, M., Henningsen, P., Hemmer, B., et al. (2022). Fatiga, depresión y dolor en la esclerosis múltiple: cómo la neuroinflamación se traduce en un procesamiento de recompensa disfuncional y síntomas anhedónicos. Mult. Scler. 28, 1020–1027. DOI: 10.1177/1352458520972279
Resumen de PubMed | Texto completo de CrossRef | Google Académico
Hellewell, S. C., Welton, T., Maller, J. J., Lyon, M., Korgaonkar, M. S., Koslow, S. H., et al. (2019). Los patrones profundos y reproducibles de materia gris regional reducida caracterizan el trastorno depresivo mayor. Trad. Psiquiatría 9, 176. DOI: 10.1038/S41398-019-0512-8
Resumen de PubMed | Texto completo de CrossRef | Google Académico
Hu, H. Z., Rusbridge, C., Constantino-Casas, F. y Jeffery, N. (2012). Investigación histopatológica de la siringomielia en el Cavalier King Charles spaniel. J. Comp. Pathol. 146, 192–201. doi: 10.1016/j.jcpa.2011.07.002
Resumen de PubMed | Texto completo de CrossRef | Google Académico
Hu, Y., Yang, J., Hu, Y., Wang, Y. y Amitriptilina, L. i. W. (2010). En lugar de lornoxicam mejora los déficits neuropáticos inducidos por el dolor en las capacidades de aprendizaje espacial y memoria. Eur. J. Anestesiol. 27, 162–168. doi: 10.1097/EJA.0b013e328331a3d5
Resumen de PubMed | Texto completo de CrossRef | Google Académico
Johnson, P. J., Luh, W. M., Rivard, B. C., Graham, K. L., White, A., FitzMaurice, M, et al. (2020). Atlas cortical estereotáctico del cerebro canino doméstico. Rep. 10, 4781. DOI: 10.1038/S41598-020-61665-0
Resumen de PubMed | Texto completo de CrossRef | Google Académico
Li, X. Y., Ko, H. G., Chen, T., Descalzi, G., Koga, K., Wang, H., et al. (2010). Aliviar la hipersensibilidad al dolor neuropático mediante la inhibición de PKMzeta en la corteza cingulada anterior. Science 330, 1400–1404. doi: 10.1126/science.1191792
Resumen de PubMed | Texto completo de CrossRef | Google Académico
Loderstedt, S., Benigni, L., Chandler, K., Cardwell, J. M., Rusbridge, C., Lamb, C. R., et al. (2011). Distribución de siringomielia a lo largo de toda la médula espinal en Cavalier King Charles Spaniels clínicamente afectados. Veterinario J. 190, 359–363. doi: 10.1016/j.tvjl.2010.12.002
Resumen de PubMed | Texto completo de CrossRef | Google Académico
Mayo, A. (2008). El dolor crónico puede cambiar la estructura del cerebro. Dolor 137, 7–15. doi: 10.1016/j.pain.2008.02.034
Resumen de PubMed | Texto completo de CrossRef | Google Académico
Merskey, H., Bogduk, N., y Taxonomía IAftSoPTFo (1994). Clasificación del dolor crónico: descripciones de los síndromes de dolor crónico y definiciones de los términos del dolor. Washington, DC: IASP Press.
Moore, S. A. (2016). Manejo del dolor neuropático en perros. Front Vet Sci. 3, 12. DOI: 10.3389/fvets.2016.00012
Resumen de PubMed | Texto completo de CrossRef | Google Académico
Moriarty, O., McGuire, B. E. y Finn, D. P. (2011). El efecto del dolor en la función cognitiva: una revisión de la investigación clínica y preclínica. Prog. Neurobiol. 93, 385–404. doi: 10.1016/j.pneurobio.2011.01.002
Resumen de PubMed | Texto completo de CrossRef | Google Académico
Nitzsche, B., Boltze, J., Ludewig, E., Flegel, T., Schmidt, M. J., Seeger, J., et al. (2018). Un atlas cerebral canino T2w simétrico promediado por razas estereotáxicas que incluye conjuntos detallados de datos morfológicos y volumétricos. Neuroimagen 187, 93–103. doi: 10.1016/j.neuroimage.2018.01.066
Resumen de PubMed | Texto completo de CrossRef | Google Académico
Obermann, M., Rodriguez-Raecke, R., Naegel, S., Holle, D., Mueller, D., Yoon, M. S., et al. (2013). La reducción del volumen de materia gris refleja el dolor crónico en la neuralgia del trigémino. Neuroimagen 74, 352–358. doi: 10.1016/j.neuroimage.2013.02.029
Resumen de PubMed | Texto completo de CrossRef | Google Académico
Ogata, N., Gillis, T. E., Liu, X., Cunningham, S. M., Lowen, S. B., Adams, B. L., et al. (2013). Anomalías estructurales cerebrales en Doberman pinschers con trastorno canino compulsivo. Prog. Neuropsychopharmacol. Biol. Psychiatry 45, 1–6. doi: 10.1016/j.pnpbp.2013.04.002
Resumen de PubMed | Texto completo de CrossRef | Google Académico
Price, D. D. (2000). Mecanismos psicológicos y neuronales de la dimensión afectiva del dolor. Ciencia 288, 1769-1772. doi: 10.1126/science.288.5472.1769
Resumen de PubMed | Texto completo de CrossRef | Google Académico
Rodriguez-Raecke, R., Niemeier, A., Ihle, K., Ruether, W. y May, A. (2009). La disminución de la materia gris cerebral en el dolor crónico es la consecuencia y no la causa del dolor. J. Neurosci. 29, 13746–13750. doi: 10.1523/JNEUROSCI.3687-09.2009
Resumen de PubMed | Texto completo de CrossRef | Google Académico
Rusbridge, C., y Jeffery, N. D. (2008). Fisiopatología y tratamiento del dolor neuropático asociado a la siringomielia. Veterinario J. 175, 164–172. doi: 10.1016/j.tvjl.2006.12.007
Resumen de PubMed | Texto completo de CrossRef | Google Académico
Rusbridge, C., MacSweeny, J. E., Davies, J. V., Chandler, K., Fitzmaurice, S. N., Dennis, R., et al. (2000). Siringohidromielia en Cavalier King Charles spaniels. J. Am. Anim. Hosp. Assoc. 36, 34–41. doi: 10.5326/15473317-36-1-34
Resumen de PubMed | Texto completo de CrossRef | Google Académico
Rusbridge, C., McFadyen, A. K. y Knower, S. P. (2019). Signos conductuales y clínicos de dolor asociado a malformaciones similares a Chiari y siringomielia en Cavalier King Charles spaniels. J. Pasante Veterinario. Med. 33, 2138–2150. DOI: 10.1111/JVIM.15552
Resumen de PubMed | Texto completo de CrossRef | Google Académico
Sanchis-Mora, S., Pelligand, L., Thomas, C. L., Volk, H. A., Abeyesinghe, S. M., Brodbelt, D. C., et al. (2016). Perros que asisten a la práctica de atención primaria en Inglaterra con signos clínicos sugestivos de malformación / siringomielia similar a Chiari. Rec. 179, 436. DOI: 10.1136/VR.103651
Resumen de PubMed | Texto completo de CrossRef | Google Académico
Sang, K., Bao, C., Xin, Y., Hu, S., Gao, X., Wang, Y., et al. (2018). El cambio plástico de la corteza prefrontal media comportamientos similares a la ansiedad asociados con el dolor crónico en ratas neuropáticas. Mol. Dolor. 14, 1744806918783931. DOI: 10.1177/1744806918783931
Resumen de PubMed | Texto completo de CrossRef | Google Académico
Schmidt, M. J., Amort, K. H., Failing, K., Klingler, M., Kramer, M., Ondreka, N., et al. (2014). Comparación de los volúmenes endocraneales y cerebrales en perros braquicefálicos, perros mesaticéfalos y Cavalier King Charles spaniels en relación con su peso corporal. Acta Vet. 56, 30. DOI: 10.1186/1751-0147-56-30
Resumen de PubMed | Texto completo de CrossRef | Google Académico
Schmidt, M. J., Laubner, S., Kolecka, M., Failing, K., Moritz, A., Kramer, M., et al. (2015). Comparación de la relación entre la sustancia blanca cerebral y la sustancia gris en perros normales y perros con agrandamiento ventricular lateral. PLoS ONE. 10, E0124174. doi: 10.1371/journal.pone.0124174
Resumen de PubMed | Texto completo de CrossRef | Google Académico
Schmidt, M. J., Roth, J., Ondreka, N., Kramer, M. y Rummel, C. (2013a). Un papel potencial para la sustancia P y la interleucina-6 en el líquido cefalorraquídeo de Cavalier King Charles Spaniels con dolor neuropático. J. Pasante Veterinario. Med. 27, 530–535. DOI: 10.1111/JVIM.12080
Resumen de PubMed | Texto completo de CrossRef | Google Académico
Schmidt, M. J., Volk, H., Klingler, M., Failing, K., Kramer, M., Ondreka, N., et al. (2013b). Comparación de los tiempos de cierre para sincondrosis de base craneal en perros mesaticéfalos, braquicefálicos y Cavalier King Charles Spaniel. Veterinario Radiol. Ultrasonido 54, 497–503. DOI: 10.1111/VRU.12072
Resumen de PubMed | Texto completo de CrossRef | Google Académico
Shaw, T. A., McGonnell, I. M., Driver, C. J., Rusbridge, C. y Volk, H. A. (2012). Aumento del volumen cerebeloso en Cavalier King Charles Spaniels con malformación similar a Chiari y su papel en el desarrollo de la siringomielia. PLoS ONE 7, e33660. doi: 10.1371/journal.pone.0033660
Resumen de PubMed | Texto completo de CrossRef | Google Académico
Smallwood, R. F., Laird, A. R., Ramage, A. E., Parkinson, A. L., Lewis, J., Clauw, D. J., et al. (2013). Anomalías cerebrales estructurales y dolor crónico: un metaanálisis cuantitativo del volumen de materia gris. J. Pain 14, 663–675. doi: 10.1016/j.jpain.2013.03.001
Resumen de PubMed | Texto completo de CrossRef | Google Académico
Stephen McMahon, F. M. S. F. S. B., Martin Koltzenburg, M. D. F., Tracey, I., y Turk, D. C. (2013). Wall and Melzack’s Textbook of Pain: Expert Consult – Online and Print. Ámsterdam: Elsevier Health Sciences.
Szabo, D., Czeibert, K., Kettinger, A., Gacsi, M., Andics, A., Miklosi, A., et al. (2019). Los datos de fMRI en estado de reposo de perros despiertos (Canis familiaris) a través del análisis de componentes independientes a nivel de grupo revelan múltiples redes de estado de reposo distribuidas espacialmente. Rep. 9, 15270. DOI: 10.1038/S41598-019-51752-2
Resumen de PubMed | Texto completo de CrossRef | Google Académico
Thoefner, M. S., Westrup, U., Toft, N., Bjerrum, O. J. y Berendt, M. (2019). Umbral sensorial mecánico en perros Cavalier King Charles con perros de control y rascado asociados a la siringomielia. Veterinario J. 246, 92–97. doi: 10.1016/j.tvjl.2019.01.011
Resumen de PubMed | Texto completo de CrossRef | Google Académico
Tijssen, M. P., Poretti, A. y Huisman, T. A. (2016). Malformación de Chiari tipo 1, agenesia del cuerpo calloso y canal craneofaríngeo permeable en un niño de 11 años. Neuroradiol. J. 29, 307–309. DOI: 10.1177/1971400916656487
Resumen de PubMed | Texto completo de CrossRef | Google Académico
Whitwell, J. L. (2009). Morfometría basada en vóxel: una técnica automatizada para evaluar los cambios estructurales en el cerebro. J. Neurosci. 29, 9661–9664. doi: 10.1523/JNEUROSCI.2160-09.2009
Resumen de PubMed | Texto completo de CrossRef | Google Académico
Woodworth, D. C., Holly, L. T., Mayer, E. A., Salamon, N. y Ellingson, B. M. (2019). Las alteraciones en el grosor cortical y el volumen subcortical se asocian con síntomas neurológicos y dolor de cuello en pacientes con espondilosis cervical. Neurocirugía 84, 588–598. doi: 10.1093/neuros/nyy066
Resumen de PubMed | Texto completo de CrossRef | Google Académico
Zhou, Y. S., Meng, F. C., Cui, Y., Xiong, Y. L., Li, X. Y., Meng, F. B., et al. (2022). El ejercicio aeróbico regular atenúa el dolor y la ansiedad en ratones al restaurar la plasticidad sináptica modulada por serotonina en la corteza cingulada anterior. Med. Sci. Sports Exerc. 54, 566–581. doi: 10.1249/MSS.0000000000002841
Resumen de PubMed | Texto completo de CrossRef | Google Académico
Zhuo, M. (2008). Excitación cortical y dolor crónico. Tendencias Neurosci. 31, 199–207. doi: 10.1016/j.tins.2008.01.003
Resumen de PubMed | Texto completo de CrossRef | Google Académico
Cita: Nitzsche B, Schulze S, Boltze J y Schmidt MJ (2023) Volumen reducido de giro cingulado en Cavalier King Charles Spaniels con siringomielia y dolor neuropático revelado por morfometría basada en vóxel: un estudio piloto. Frente. Neuroanat. 17:1175953. doi: 10.3389/fnana.2023.1175953
Recibido: 28 de febrero de 2023; Aprobado: 26 de junio de 2023;
Publicado: 17 julio 2023.
Editado por:
Markus Butz-Ostendorf, Biomax Informatics, Alemania
Revisado por:
Elodie Chaillou, UMR7247 Physiologie de la Reproduction et des Comportements (PRC), Francia
Philippa Johnson, Universidad de Cornell, Estados Unidos Piotr Walczak, Universidad de Maryland, Estados
Unidos
Derechos de autor © 2023 Nitzsche, Schulze, Boltze y Schmidt. Este es un artículo de acceso abierto distribuido bajo los términos de la Licencia de Atribución Creative Commons (CC BY).
*Correspondencia: Björn Nitzsche, bjoern.nitzsche@gmx.net
Renuncia: Todas las afirmaciones expresadas en este artículo son únicamente las de los autores y no representan necesariamente las de sus organizaciones afiliadas, o las del editor, los editores y los revisores. Cualquier producto que pueda ser evaluado en este artículo o reclamo que pueda ser hecho por su fabricante no está garantizado ni respaldado por el editor.
Date de alta y recibe nuestro 👉🏼 Diario Digital AXÓN INFORMAVET ONE HEALTH
Date de alta y recibe nuestro 👉🏼 Boletín Digital de Foro Agro Ganadero
Noticias animales de compañía
Noticias animales de producción
Trabajos técnicos animales de producción
Trabajos técnicos animales de compañía