Relación entre la microbiota ruminal y la toxemia de la gestación en ovejas
 Jiaxin Chen1
Jiaxin Chen1 Siwei Wang1,2
Siwei Wang1,2 Xuejiao Yin3
Xuejiao Yin3 Chunhui Duan1
Chunhui Duan1 Jinhui Li1
Jinhui Li1 Yue-qin Liu1
Yue-qin Liu1 Yingjie Zhang1*
Yingjie Zhang1*- 1Facultad de Ciencia y Tecnología Animal, Universidad Agrícola de Hebei, Baoding, China
- número arábigoLaboratorio Clave de Fisiología del Cultivo de Cultivos y Producción Verde de Hebei, Instituto de Cereales y Cultivos Oleaginosos, Academia de Ciencias Agrícolas y Forestales de Hebei, Shijiazhuang, China
- 3Facultad de Ciencia y Tecnología Animal, Universidad Normal de Ciencia y Tecnología de Hebei, Qinhuangdao, China
Introducción: La toxemia del embarazo (TP) es una enfermedad metabólica nutricional de las ovejas al final de la gestación. Este estudio tuvo como objetivo revelar la relación entre la microbiota ruminal y el TP.
Métodos: Se seleccionaron 10 ovejas sanas (CON) y 10 ovejas con toxemia preñada (PT) a los 135 días de gestación según las concentraciones de β-hidroxibutirato (BHBA) en sangre, glucosa (Glu) y síntomas clínicos. Se recolectó sangre y líquido ruminal antes de la alimentación matutina para determinar los índices bioquímicos séricos y los parámetros de fermentación ruminal. Se extrajo el ADN total del líquido ruminal y las regiones V3-V4 del ARNr 16S se amplificaron mediante PCR para la secuenciación de alto rendimiento.
Resultados: Los resultados mostraron que las concentraciones séricas de Glu, colesterol total (CT), colesterol de lipoproteínas de baja densidad (LDL-C), ácido úrico (UA), creatinina (Cr), acetato, propionato, butirato y proteína bruta microbiana (MCP) disminuyeron (p < 0,05) y las concentraciones de BHBA, aspartato aminotransferasa (AST), relación acetato/propionato (A/P) y nitrógeno amoniacal (NH3-N) fueron mayores (p < 0,05) en las ovejas PT que en las ovejas CON. El análisis del ARNr 16S mostró las diferencias de diversidad de β en la microbiota ruminal entre las ovejas CON y PT. A nivel de filo, la abundancia relativa de Bacteroidota y Proteobacteria fue mayor (p < 0.01), mientras que Firmicutes fue menor (p < 0.01) en las ovejas PT. A nivel de género, los parientes Prevotella, Butyrivibrio, Ruminococcus, Lachnospiraceae_AC2044_group, Lachnospiraceae_XPB1014_group, Lachnospiraceae_ND3007_group y Oribacterium fueron menores (p < 0.01) en las ovejas PT. Por su parte, la abundancia relativa de Oribacterium, Butyrivibrio, Ruminococcus y Lachnospiraceae_AC2044_group se correlacionó positivamente (p < 0,01) con Glu, INS, acetato, propionato y butirato, y negativamente (p < 0,01) con BHBA, P, GC, AST y A/P.
Discusión: En conclusión, la disminución de Oribacterium, Butyrivibrio, Ruminococcus y Lachnospiraceae_AC2044_group en el rumen de las ovejas PT redujo las concentraciones de ácidos grasos volátiles (acetato, propionato y butirato) y glu sérico, y aumentó la concentración de BHBA, lo que indica que las diferencias en los géneros de bacterias ruminales estaban relacionadas con la toxemia del embarazo de las ovejas.
1 Introducción
La toxemia del embarazo (TP) es un trastorno metabólico nutricional común y potencialmente catastrófico que ocurre con un número limitado de individuos o como un brote en la parvada, dependiendo del manejo de la alimentación de la granja y las condiciones ambientales (1). El diagnóstico clínico se basa en la hipoglucemia y la hipercetonemia, que se caracteriza por pérdida de apetito, cojera y temblores musculares (2). La incidencia de TP en ovejas es entre un 5 y un 20% mayor que en cabras, y las consecuencias de la toxemia en el embarazo son críticas, con una pérdida del 80% tanto de las ovejas como de las crías (3).
La principal causa de la TP son las deficiencias nutricionales en las ovejas al final de la gestación (4). Las necesidades energéticas aumentan en un 180 y un 240% para las ovejas con hijos de gemelos y trillizos, respectivamente (1). Además, el crecimiento continuo del feto reduce el volumen ruminal, lo que puede conducir a una ingesta insuficiente de energía. Como resultado, la TP se asocia con un desequilibrio en el metabolismo de la glucosa, lo que resulta en la interrupción del metabolismo de carbohidratos, lípidos, proteínas y otros nutrientes, lo que conduce a hipoglucemia y enfermedad. Además, la homeostasis metabólica puede verse alterada aún más por cambios intermitentes en el estado metabólico (5, 6). En el balance energético negativo (NEB), las ovejas movilizan las reservas energéticas del cuerpo a través de un mecanismo regulador adaptativo para satisfacer las necesidades energéticas del desarrollo fetal; Sin embargo, la movilización excesiva de grasa corporal causará daño celular a los tejidos y acelerará la producción de cuerpos cetónicos (7). La peroxidación de los ácidos grasos poliinsaturados provocó la producción de una gran cantidad de especies reactivas de oxígeno que provocaron estrés oxidativo, lo que promovió la liberación de citoquinas proinflamatorias que provocaron daño tisular (8). Por lo tanto, la detección de índices bioquímicos séricos en ovejas es útil para la detección temprana y el tratamiento de la TP. Además, la NEB a largo plazo en las ovejas puede inhibir la replicación y el ciclo del ADN celular para afectar el desarrollo fetal (5, 6). La aparición de PT está relacionada con la condición corporal de las ovejas; las ovejas obesas con una puntuación de condición corporal (BCS) >4 tienen más tejido adiposo para movilizar cuando la ingesta de materia seca (DMI) disminuye, lo que aumenta el riesgo de hipercetonemia (9), mientras que las ovejas magras son más susceptibles a la toxemia del embarazo por inanición debido a la desnutrición por llevar múltiplos altos (1), y las ovejas multíparas pueden tener mayores dificultades para producir glucosa y eliminar los cuerpos cetónicos. lo que hace que las ovejas sean más susceptibles al PT (10). La acidosis metabólica, la hipocalcemia, la hipoproteinemia y la deshidratación pueden ser secundarias a la TP (11). Cuando las ovejas sufren de inanición crónica, la glucosa producida por la gluconeogénesis hepática representa aproximadamente el 90% de la glucosa circulante (12), mientras que el propionato producido por la fermentación ruminal es la principal fuente de sustrato de la gluconeogénesis hepática en rumiantes (13). Los parámetros de fermentación ruminal no solo pueden reflejar el estado de salud ruminal de las ovejas, sino también reflejar la degradación microbiana ruminal del alimento ingerido y la capacidad de utilización de nutrientes del cuerpo. Durante la restricción estricta de la alimentación, el epitelio ruminal se ve afectado por la ingesta de alimento para disminuir los parámetros de fermentación ruminal y cambiar la composición de la microbiota epitelial ruminal. Mientras tanto, durante la restricción severa de la alimentación, la diversidad bacteriana del colon y la composición de las ovejas preñadas cambian, cambiando así el patrón de fermentación del colon (14). La disminución del IMD en las vacas lecheras altera la homeostasis de la microbiota gastrointestinal (15), y la remodelación de la microbiota gastrointestinal mediante el trasplante de microbiota puede mejorar la utilización del alimento del ganado de baja eficiencia (16). Estos estudios también confirmaron que el microbioma ruminal está asociado con la ingesta, digestión y absorción de nutrientes.
Descubrimos que existen diferencias en la probabilidad de toxemia durante el embarazo entre las ovejas que portan los mismos múltiplos en el mismo entorno y manejo de la cría, y especulamos que el TP puede estar relacionado con las diferencias en el metabolismo de los nutrientes y la microbiota de las ovejas. Por lo tanto, este estudio tuvo como objetivo dilucidar la relación entre la toxemia del embarazo y la microbiota ruminal mediante la medición de los índices bioquímicos de la sangre, los parámetros de fermentación del rumen y la comunidad bacteriana, y proporcionar orientación técnica para la prevención y la regulación nutricional de la toxemia del embarazo en el futuro.
2 Materiales y métodos
2.1 Animales y diseño experimental
Este experimento se llevó a cabo entre septiembre y noviembre de 2020 en la granja Lanhai (Zhangjiakou, China). Se observaron cien ovejas preñadas (ovejas Hu) sanas de la misma paridad. Los síntomas clínicos como pérdida de apetito e inestabilidad de la bipedestación se registraron a partir del día 120 de gestación. Veinte ovejas portadoras de trillizos (el tamaño de la camada se determinó mediante ecografía transabdominal, HS-1600 V-7.5 MHz, Japón) fueron seleccionadas como sanas [CON, n = 10, β-hidroxibutirato (BHBA) ≤1.2 mM, glucosa (Glu) >3 mM] y toxemia en el embarazo (PT, n = 10, BHBA ≥3.0 mM, Glu ≤2.5 mM) de acuerdo con las concentraciones de BHBA y Glu en sangre y los síntomas clínicos a los 135 días de gestación (1). Las ovejas experimentales se mantuvieron individualmente en corrales (2,0 × 1,3m2) con libre acceso al agua y fueron alimentadas y manejadas de manera uniforme. El mismo índice de mezcla total (TMR) se formuló con base en las recomendaciones de NRC (17) y se alimentó diariamente a las 8:00 am y 5:00 pm con aproximadamente un 5% de rechazo de alimentación. El IMD registrado para las ovejas experimentales osciló entre los 120 y los 135 días de gestación, y la composición y el contenido de nutrientes de las dietas se presentan en la Tabla 1.
2.2 Recogida de muestras
En el día 135 de gestación, se recolectaron muestras de suero y líquido ruminal de ovejas PT y ovejas sanas 2 h antes de la alimentación matutina. Las muestras de sangre se recogieron por el método de muestreo de la vena yugular y se centrifugaron a 3.000 × g durante 10 min. Luego, el suero se dividió en tubos de almacenamiento congelado de 1,8 mL usando una pipeta e inmediatamente se colocó en tanques de nitrógeno líquido, luego se transportó de regreso al laboratorio y se almacenó en un refrigerador de temperatura ultrabaja. Las muestras de líquido ruminal se recogieron utilizando una cánula oral (Kelibo Animal Husbandry Technology Co., Ltd., Wuhan, China) que alcanzó aproximadamente el fondo del rumen, teniendo en cuenta el tamaño del animal. En la sala de recolección de muestras, la cánula oral se limpió con agua fresca, tibia y destilada, y los primeros 20 mL de líquido ruminal recolectado se desecharon para evitar la contaminación de la saliva. Un total de 50 mL de líquido ruminal se almacenaron a -20 °C para determinar los parámetros de fermentación ruminal, y 5 mL se almacenaron a -80 °C para la extracción de ADN.
2.3 Mediciones de los parámetros del suero y del líquido ruminal
Se utilizaron kits de ensayo bioquímico sérico (Nanjing Jiancheng Bioengineering Institute, Nanjing, China) para determinar las concentraciones de β-hidroxibutirato sérico (BHBA, β-hidroxibutirato Assay Kit, E030-1-1), glucosa (Glu, Glucose Assay Kit, F006-1-1), ácidos grasos no esterificados (NEFA, Non-esterified Fatty Acids Assay Kit, A042-2-1), triglicéridos (TG, Triglyceride Assay Kit, A110-1-1), colesterol total (TC, Total cholesterol Assay Kit, A111-1-1), colesterol de lipoproteínas de alta densidad (HDL-C, Kit de ensayo de colesterol de lipoproteínas de alta densidad, A112-1-1), colesterol de lipoproteínas de baja densidad (LDL-C, kit de ensayo de colesterol de lipoproteínas de baja densidad, A113-1-1), aspartato aminotransferasa (AST, kit de ensayo de aspartato aminotransferasa, C010-2-1), alanina aminotransferasa (ALT, kit de ensayo de alanina aminotransferasa, C009-2-1), fosfatasa alcalina (ALP, kit de ensayo de fosfatasa alcalina, A059-2-2), nitrógeno ureico en sangre (BUN, kit de ensayo de urea, C013-2-1), bilirrubina total (TBIL, kit de bilirrubina total, C019-1-1), ácido úrico (UA, kit de prueba de ácido úrico, C012-2-1), creatinina (Cr, kit de ensayo de creatinina, C011-2-1), calcio (Ca, kit de ensayo de calcio, C004-2-1) y fósforo (P, kit de ensayo de fosfato, C006-1-1) según las instrucciones del fabricante. La insulina (INS, Insulin Assay Kit, H203-1-2), el glucagón (GC, Glucagon Assay Kit, H183-1-2), la interleucina 1β (IL-1β, Interleukin-1β Assay Kit, H002-1-2), la interleucina 2 (IL-2, Interleukin-2 Assay Kit, H003-1-1), la interleucina 6 (IL-6, Interleukin-6 Assay Kit, H007-1-2) y el factor de necrosis tumoral α (TNF-α, Tumor Necrosis Factor-α Assay Kit, H052-1-2) utilizando los kits de prueba ELISA (Instituto de Bioingeniería de Nanjing Jiancheng, Nanjing, China) de acuerdo con las instrucciones del fabricante. Las concentraciones séricas de proteína total (TP, Total Protein Quantitative Assay Kit, A045-3-2) y albúmina (ALB, Albumin Assay Kit, A028-1-1) se determinaron mediante un método colorimétrico utilizando un kit comercial (Nanjing Jiancheng Bioengineering Institute, Nanjing, China).
Las muestras de líquido ruminal se analizaron inmediatamente utilizando un medidor electrónico de pH (PHS-3C; Instituto de Investigación de Aplicación de Instrumentos Analíticos de Nanjing Nanda). La concentración del nitrógeno amoniacal (NH3-N) se determinó mediante colorimetría de hipoclorito de fenol sodio (18) y utilizando un espectrofotómetro UV (UV1100; Shanghai Tyco Instruments Co., Shanghai, China) según los métodos de AOAC (2006). La concentración de la proteína bruta microbiana (MCP) se determinó por el método del azul brillante de Coomassie. El líquido ruminal se dividió en tubos asépticos de 2 mL y se centrifugó a 3.000 × g a 4 °C durante 15 min, y luego el sobrenadante se mezcló con 0,2 mL de solución de ácido metafosfórico (250 g/L) durante 30 min. El sobrenadante se recolectó y centrifugó a 10.000 × g a 4 °C durante 10 min para la determinación de ácidos grasos volátiles (AGV) ruminales. Las concentraciones de acetato, propionato y butirato se determinaron por cromatografía de gases (Varian 450, Agilent Technologies China, Co., Ltd., China) utilizando ácido 2-etilbutírico como patrón interno. En resumen, utilizando H2 como gas portador con una columna capilar de 30 m × 320 μm × 0,5 μm (AT-FFAP), la temperatura del detector se estableció en 250 °C y la temperatura de entrada se estableció en 220 °C.
2.4 Extracción de ADN, secuenciación de alto rendimiento y análisis bioinformático
Se seleccionaron aleatoriamente fluidos ruminales de cada grupo para su descongelación, se tomó 1,5 mL de cada muestra y se utilizó un kit de extracción de ADN (MoBio Laboratories, Carlsbad, CA, Estados Unidos) para extraer el ADN microbiano ruminal de acuerdo con las instrucciones del fabricante. Se utilizó NanoDrop 2000 (Thermo Fisher Scientific, Waltham, MA, Estados Unidos) y electroforesis en gel de agarosa al 1% para comprobar la concentración y la calidad del ADN. Los cebadores universales de PCR (341F: 5′-GTGCCAGCMGCCGCGGTAA-3′ y 806R: 5′-GGACTACNNGGGTATCTAAT-3′) se diseñaron para amplificar la región hipervariable V3-V4 del gen 16S rRNA basado en el genoma microbiano. La muestra de ADN diluida se utilizó como molde para la amplificación de la PCR, que se llevó a cabo en un gradiente de Mastercycler (Eppendorf, Hamburgo, Alemania) en volúmenes de reacción de 25 μL que contenían 12,5 μL de 2 × Taq Plus Master Mix, 1 μL de cebador directo (5 μM), 1 μL de cebador inverso (5 μM), 5,5 μL de ddH2O, y 5 μL de ADN (la cantidad total de molde fue de 50 ng). Parámetros de reacción: desnaturalización inicial a 95°C durante 3 min; 35 ciclos de desnaturalización a 94 °C durante 45 s, recocido a 50 °C durante 60 s y alargamiento a 72 °C durante 45 s; y estirar durante 10 min a 72°C.
Los datos brutos se filtraron cualitativamente y se analizaron utilizando Quantitative Insights into Microbial Ecology (QIIME, versión 1.8.0). Las secuencias con una longitud superior a 200 pb y una fracción de masa base media superior a 25 se etiquetaron como secuencias de alta calidad para su posterior análisis. Se obtuvieron un total de 620.560 y 527.283 etiquetas sin procesar para los grupos CON y PT, con 607.661 y 519.535 etiquetas limpias, respectivamente. A continuación, las unidades taxonómicas operativas (OTUs) se agruparon de novo con un corte de similitud de secuencia del 97% utilizando UPARSE (versión 7.1). Finalmente, se obtuvieron 2.056 y 1.689 OTUs para los grupos CON y PT, respectivamente. Se utilizó el QIIME2 para calcular la diversidad alfa y la diversidad beta. La diversidad alfa incluyó los índices Chao1, observed_species, PD_whole tree y Shannon, que se utilizaron para determinar la riqueza y diversidad de las comunidades bacterianas. Se utilizó el análisis de coordenadas principales (PCoA) para comparar grupos de muestras en función de las distancias de Bray-Curtis y para evaluar las diferencias significativas.
2.5 Análisis estadístico
Se utilizaron ovejas individuales como unidades experimentales, y la distribución normal de los datos se confirmó mediante la prueba de Shapiro-Wilk. Se utilizó el software SPSS 22.0 (SPSS Inc. Chicago, IL, Estados Unidos) para realizar pruebas t de muestras independientes para los índices bioquímicos séricos y los parámetros de fermentación ruminal de las ovejas en los grupos CON y PT. De acuerdo con la abundancia relativa de la microbiota ruminal, se utilizó la prueba de suma de rangos de Wilcoxon para probar la significación de las diferencias entre grupos a nivel de filo y género, respectivamente. p < 0,05 se consideró estadísticamente significativo en el análisis de correlación de Spearman de los índices bioquímicos séricos, los parámetros de fermentación y las bacterias ruminales (abundancia relativa >1%).
3 Resultados
3.1 Diferencia en la ingesta de materia seca entre ovejas CON y PT
El IMD de las ovejas de 120 a 135 días de gestación se muestra en la Tabla 2, y no hubo diferencia (p > 0,05) en la IMD entre las ovejas PT y las ovejas CON.
3.2 Diferencias en los índices bioquímicos séricos entre ovejas CON y PT
Los índices bioquímicos séricos para las ovejas CON y PT se muestran en la Tabla 3. Las concentraciones de Glu, TC, LDL-C, INS, UA, Cr, IL-6 y TNF-α en el grupo PT fueron menores (p < 0,05) que las del grupo CON, y BHBA, GC, AST y P fueron mayores (p < 0,05) que las del grupo CON. Las concentraciones de NEFA, TG, HDL-C, BUN, TBIL, TP, ALB, ALT, ALP, IL-1β e IL-2, y no hubo diferencia (p > 0,05) en la concentración de Ca entre los dos grupos.
3.3 Diferencia en los parámetros de fermentación ruminal entre ovejas CON y PT
Los parámetros de fermentación ruminal de las ovejas CON y PT se muestran en la Tabla 4. En comparación con el grupo CON, las concentraciones de acetato, propionato, butirato y MCP disminuyeron (p < 0,01) en el grupo PT, mientras que A/P y NH3-N aumentaron (p < 0,05). No hubo diferencia (p > 0,05) en el pH ruminal entre los dos grupos.
3.4 Diferencia en la microbiota ruminal entre ovejas CON y PT
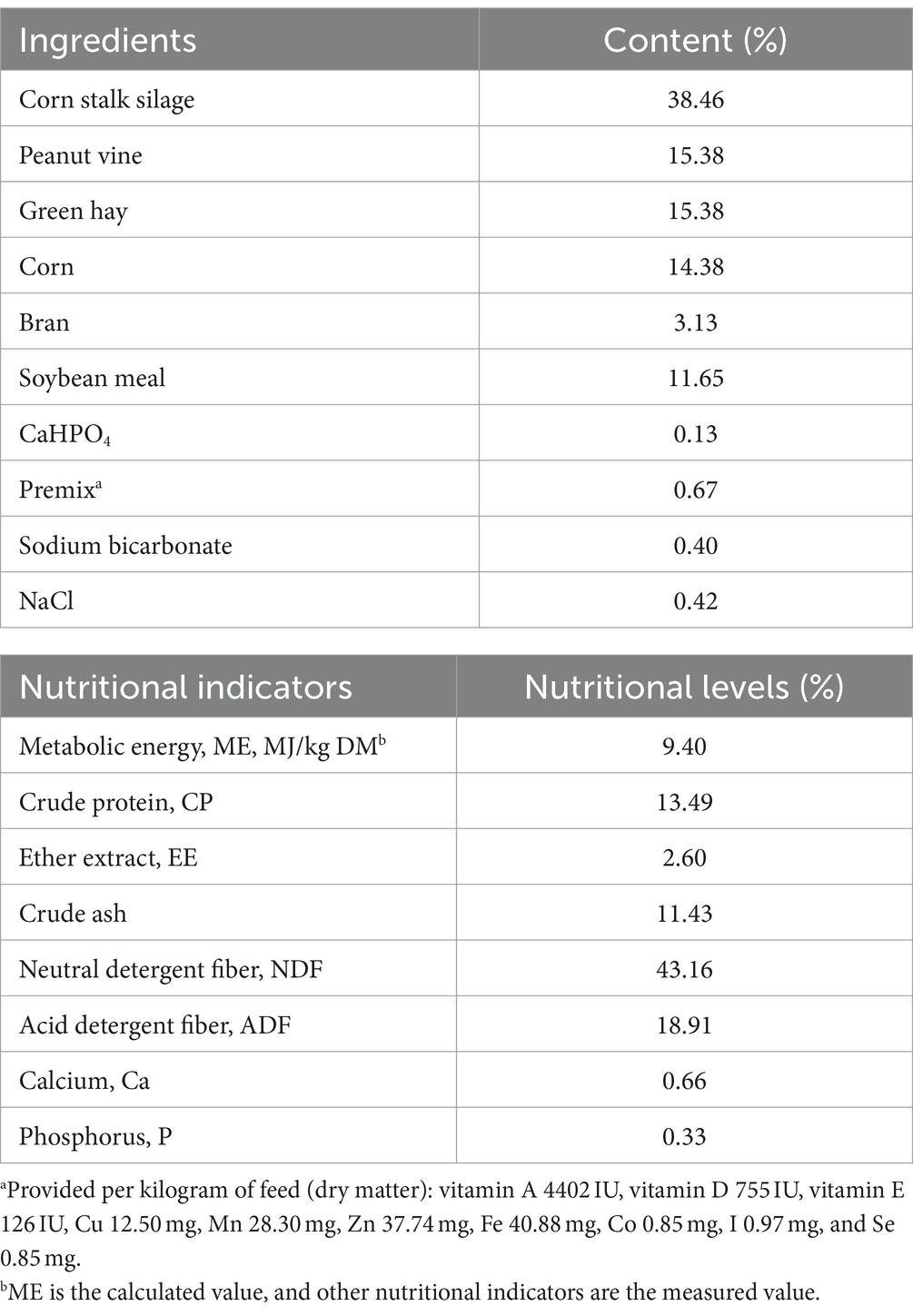
En este estudio, se obtuvieron 519.535 y 607.661 lecturas limpias en los grupos CON y PT, respectivamente, con un promedio de 86.589 y 101.276 lecturas limpias por oveja en los grupos CON y PT. Se construyeron curvas de rarefacción para cuantificar la cobertura de OUT de la muestra, como se muestra en la Figura Suplementaria S1. Todas las curvas se acercaron a una meseta, lo que indica que la profundidad de muestreo fue suficiente.
El análisis de diversidad alfa mostró diferencias significativas en los índices de árbol Chao1, observed_species, Shannon y PD_whole entre los dos grupos (p < 0.05). La riqueza y diversidad de la microbiota ruminal varió significativamente dentro de los grupos (Figura 1A). Los resultados del PCoA mostraron que las ovejas PT redujeron la similitud intragrupal en función de la distancia de Bray-Curtis (ANOSIM: R = 0,494, p-valor = 0,004), lo que indica una pobre estabilidad de las bacterias ruminales en el grupo PT (Figura 1B).
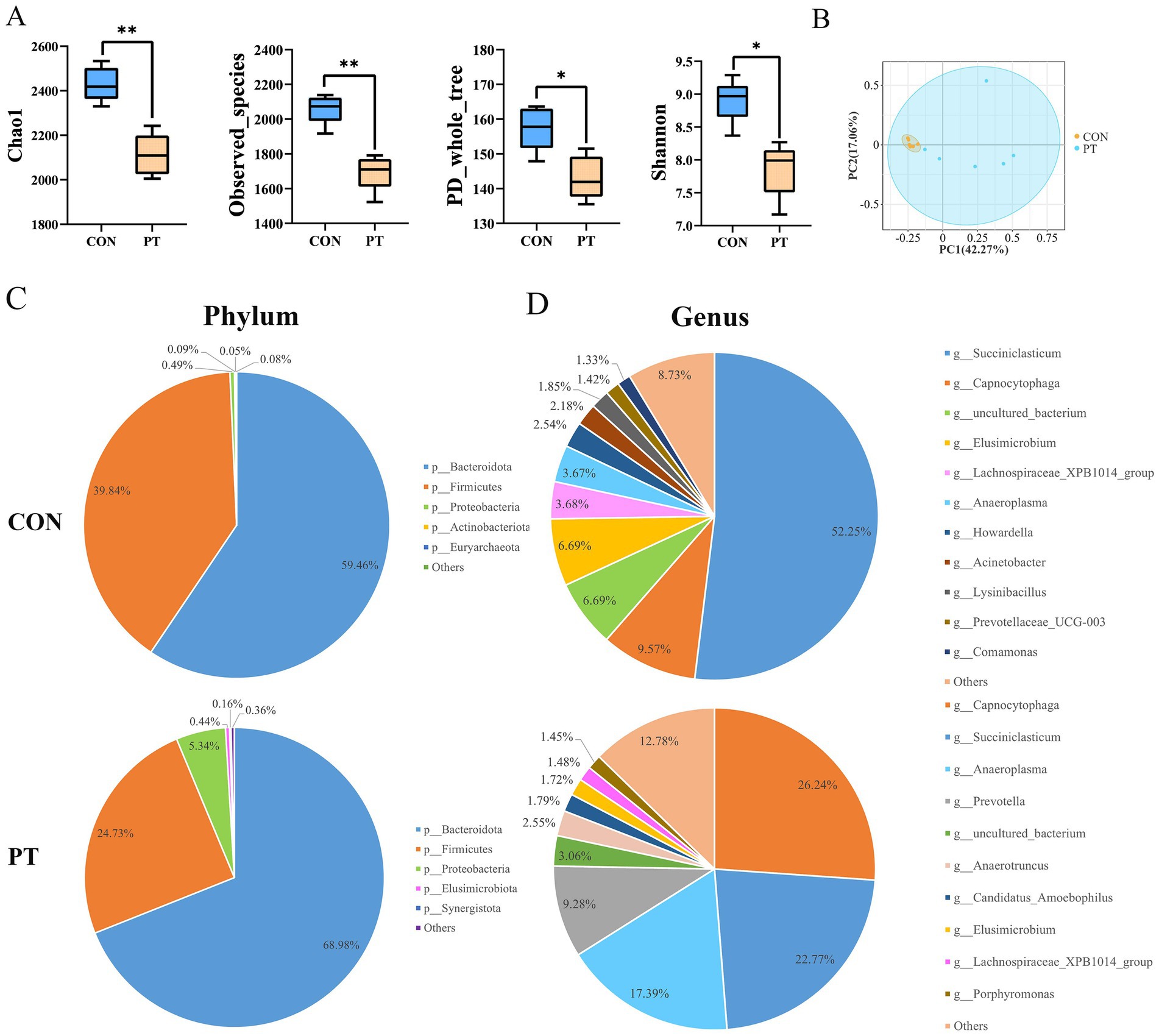
Figura 1. Diferencias en las comunidades bacterianas del rumen entre ovejas CON y PT. (A) Diversidad alfa, incluidos los índices Chao1, observed_species, PD_whole_tree y Shannon. (B) Análisis de coordenadas principales (PCoA) de las diferencias en la composición de la comunidad bacteriana, el porcentaje representa la contribución relativa de dos coordenadas principales (PC1-PC2). (C,D) Composición de la comunidad bacteriana ruminal en los grupos CON y PT a nivel de filo (C) y género (D). CON, grupo sano (n = 6), TP, grupo de toxemia durante el embarazo (n = 6).
Para estudiar más a fondo la clasificación y composición de las bacterias ruminales, comparamos la abundancia relativa de la microbiota ruminal en los dos grupos a nivel de filo y género (Figuras 1C,D). Bacteroidota y Firmicutes fueron los más abundantes en el rumen de los dos grupos de ovejas a nivel de filo. Las proporciones de Bacteroidota (68,98%) y Proteobacteria (5,34%) en el grupo PT se incrementaron, mientras que la proporción de Firmicutes (24,73%) disminuyó (Figura 1C). Los géneros bacterianos dominantes en el grupo CON fueron Succiniclasticum (52,25%), Capnocytophaga (9,57%), uncultured_bacterium (6,69%) y Elusimicrobium (6,69%). Las especies y proporciones de bacterias dominantes en el grupo de PT fueron modificadas y fueron dominadas por Capnocytophaga (26,24%), Succiniclasticum (22,77%), Anaeroplasma (17,39%) y Prevotella (9,28%) (Figura 1D).
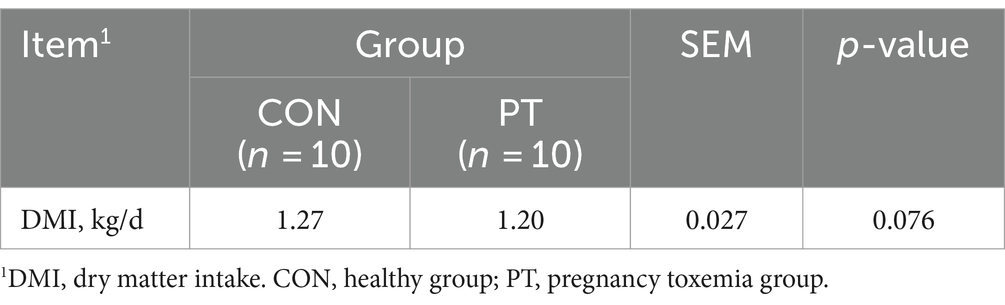
En este estudio se identificaron un total de 23 filos, 41 clases, 82 órdenes, 145 familias y 258 géneros. Se seleccionaron filos y géneros con una abundancia relativa superior al 1% para su posterior análisis. A nivel de filo, la abundancia relativa de Bacteroidota, Proteobacteria, Fusobacteriota, Bdellovibrionota, Elusimicrobiota y Actinobacteriota en el grupo PT fue mayor (p < 0,01) que en el grupo CON. Por el contrario, la abundancia relativa de Euryarchaeota y Firmicutes disminuyó (p < 0,01) en el grupo PT (Figura 2A). A nivel de género, la abundancia relativa de uncultured_bacterium, Prevotellaceae_UCG-003 y Christensenellaceae_R-7_group en el rumen de las ovejas del grupo PT aumentó (p < 0.01); sin embargo, la abundancia relativa de Prevotella, Butyrivibrio, Ruminococcus, Lachnospiraceae_XPB1014_group, LachnospiraceaeAC2044group, Anaeroplasma, Lachnospira, Oribacterium, Lachnospiraceae_NK3A20_group, Lachnospiraceae_ND3007_group, Lachnospiraceae_NK4A136_group y Eubacterium_ruminantium_group en el grupo PT disminuyeron (p < 0,01) que los del grupo CON (Figura 2B).
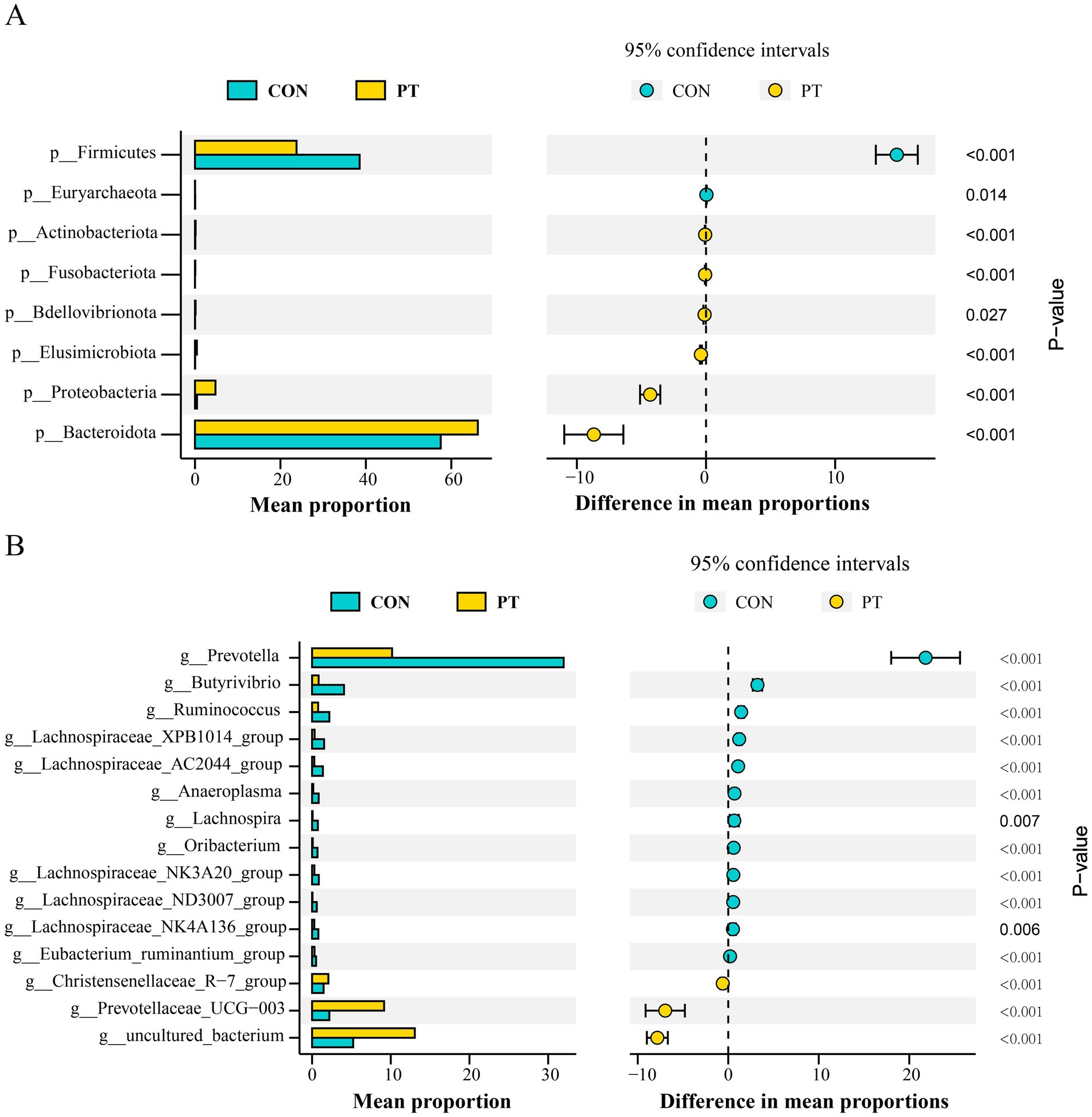
Figura 2. Diferencias en la clasificación y proporción bacteriana en los grupos CON y PT a nivel de filo (A) y género (B). CON, grupo sano (n = 6), TP, grupo de toxemia durante el embarazo (n = 6).
3.5 Análisis de correlación entre la microbiota ruminal, los índices bioquímicos séricos y los parámetros de fermentación ruminal
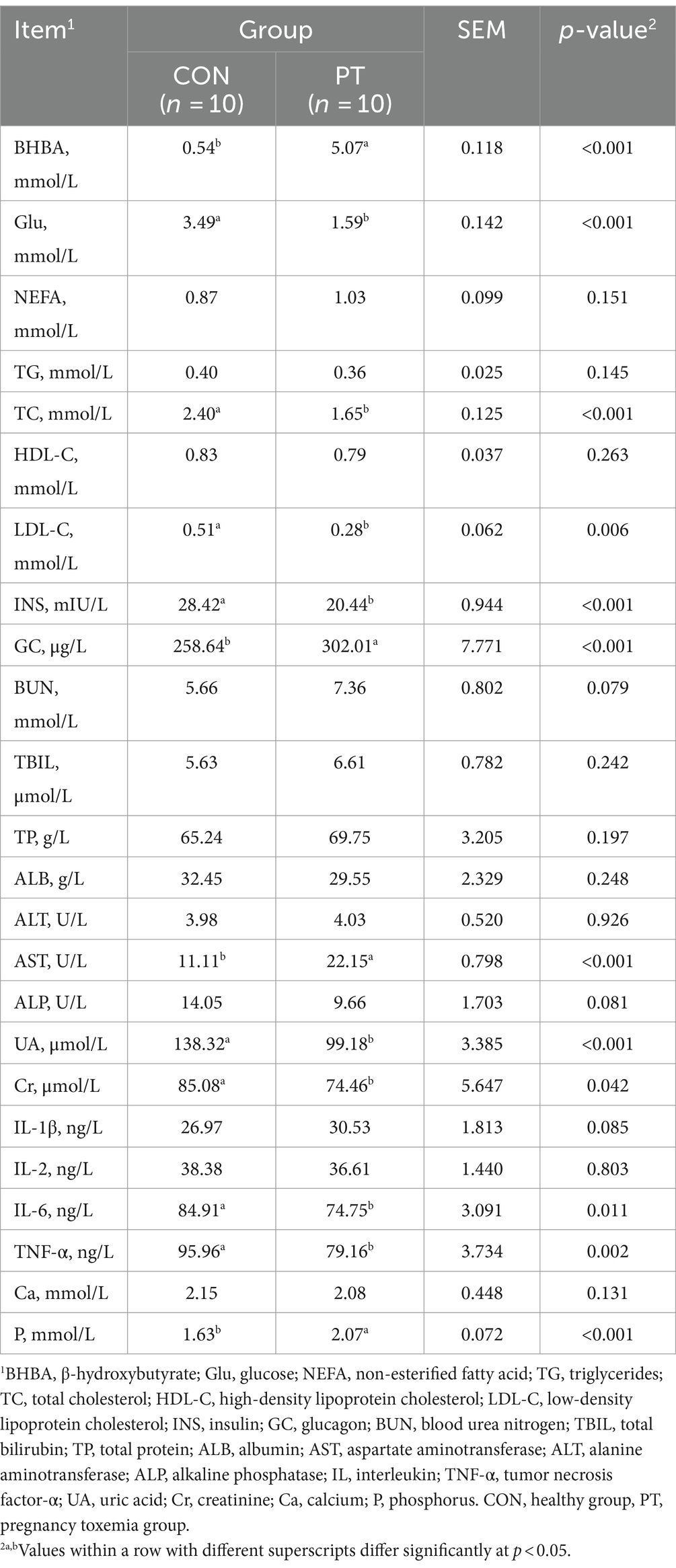
Para explorar cómo afecta la microbiota ruminal al metabolismo del huésped, establecimos una matriz de correlación de Pearson para explorar la relación entre ellos. Encontramos que la mayoría de los géneros bacterianos ruminales se correlacionaron con indicadores bioquímicos séricos y parámetros de fermentación ruminal (Figura 3). Las abundancias relativas de Oribacterium, Butyrivibrio, Ruminococcus y Lachnospiraceae_AC2044_group se correlacionaron positivamente (p < 0,01) con Glu, INS, acetato, propionato y butirato y se correlacionaron negativamente (p < 0,01) con BHBA, P, GC, AST y A/P. Lachnospiraceae_NK4A136_group, Eubacterium_ruminantium_group, Lachnospiraceae_XPB1014_group, Prevotella y Lachnospiraceae_ND3007_group se correlacionaron positivamente (p < 0,05) con Glu, INS, acetato, propionato y butirato y se correlacionaron negativamente (p < 0,05) con BHBA, P, GC, AST y A/P. En contraste, las abundancias relativas de Christensenellaceae_R-7_group, Prevotellaceae_UCG-003 y Alloprevotella se correlacionaron negativamente (p < 0.05) con Glu, INS, acetato, propionato y butirato y se correlacionaron positivamente (p < 0.05) con AST y A/P. Las abundancias relativas de Rikenellaceae_RC9_gut_group y uncultured_bacterium se correlacionaron negativamente (p < 0,05) con acetato, propionato y butirato y positivamente (p < 0,05) con BHBA, P, GC, A/P y BUN.
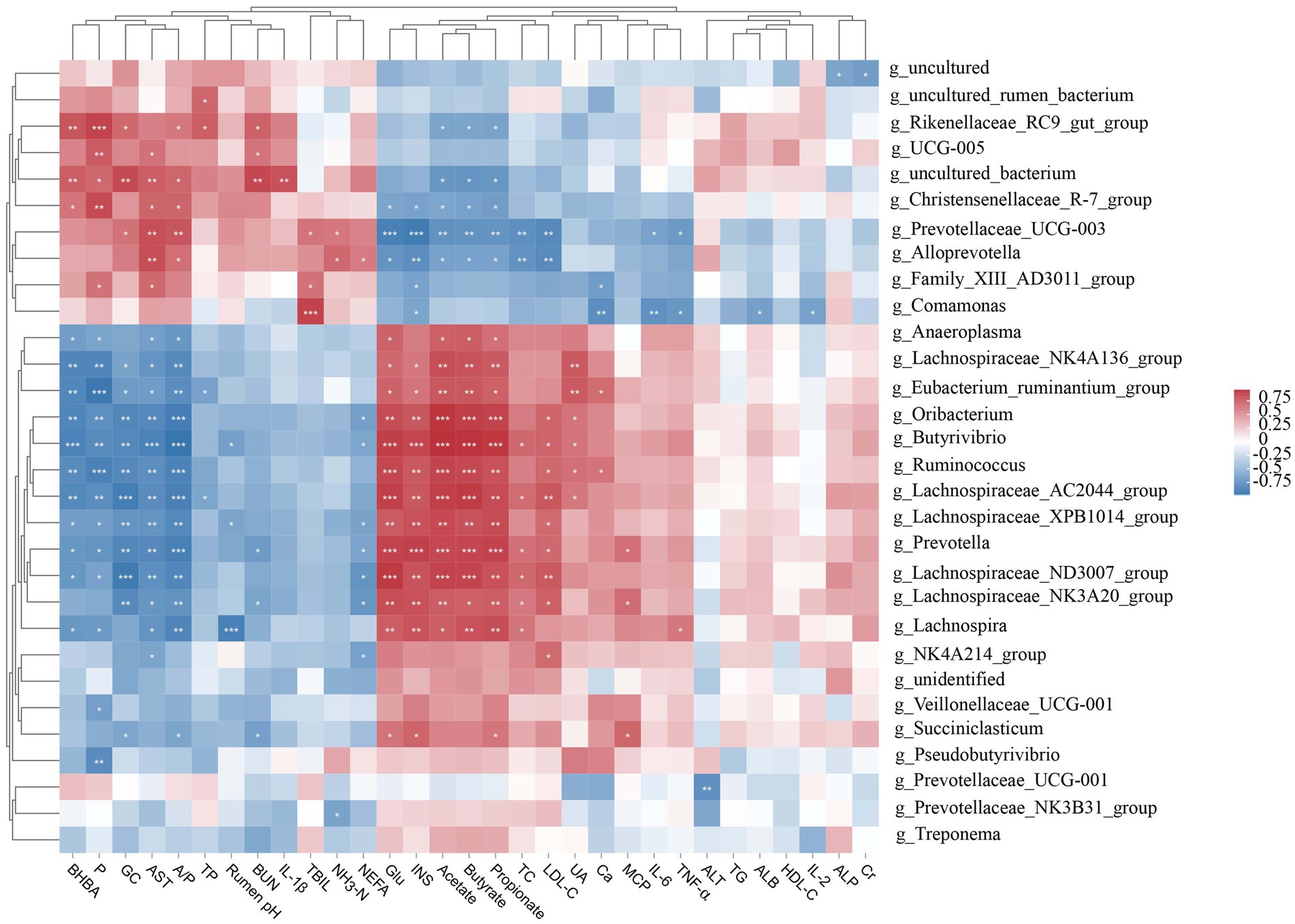
Figura 3. Análisis de correlación entre la microbiota ruminal (abundancia relativa >1%), los índices bioquímicos séricos y los parámetros de fermentación ruminal. Glu, glucosa; BHBA: β-hidroxibutirato; NEFA, ácidos grasos no esterificados; TG: triglicéridos; CT: colesterol total; HDL-C: colesterol de lipoproteínas de alta densidad; LDL-C: colesterol de lipoproteínas de baja densidad; AST: aspartato aminotransferasa; ALT: alanina aminotransferasa; ALP: fosfatasa alcalina; BUN: nitrógeno ureico en sangre; TBIL: bilirrubina total; Ca: calcio; P: fósforo; INS: insulina; GC: glucagón; UA: ácido úrico; Cr: creatinina; IL: interleucina; TNF-α, factor de necrosis tumoral-α; TP: proteína total; ALB: albúmina; NH3-N, nitrógeno amonical; MCP: proteína bruta microbiana; A/P, relación acetato a propionato. *p < 0,05, **p < 0,01 y p < 0,001.
4 Discusión
La toxemia del embarazo se define como un trastorno metabólico de deficiencia energética, con síntomas clínicos que se presentan con mayor frecuencia en las últimas 3 semanas de gestación, aunque algunos pueden ocurrir antes dependiendo del estado nutricional de las ovejas (1). El trastorno básico de la toxemia del embarazo es un desequilibrio en la homeostasis materna de la glucosa, que conduce a la NEB caracterizada por hipoglucemia e hipercetonemia (19). Sin embargo, la patogenia de la homeostasis de la glucosa aún no está clara. El crecimiento exponencial del feto al final del embarazo, aproximadamente el 70% del cual ocurre en los últimos 30-40 días, exacerba la pérdida de glucosa (20, 21). La utilización de la glucosa fetal depende completamente de la disponibilidad materna de glucosa dada la incapacidad del hígado fetal para sintetizar glucosa (22, 23); En contraste con la difusión facilitada de la glucosa, los aminoácidos se transportan activamente a la placenta (24), de modo que en respuesta a la hipoglucemia materna, se produce un cambio hacia la oxidación de aminoácidos para compensar el déficit de sustrato energético y aliviar la hipoglucemia fetal (25). Nuestros resultados encontraron que el IMD de las ovejas PT entre los 120 y 135 días de gestación fue similar al de las ovejas sanas. Ambos grupos presentaron niveles de DMI por debajo de los requerimientos recomendados (17), lo que nos lleva a inferir que las ovejas experimentales experimentaron NEB durante la gestación tardía. Cuando se enfrentan a limitaciones nutricionales, las hembras preñadas movilizan la grasa corporal y las proteínas corporales lábiles para apoyar la gluconeogénesis y suministrar aminoácidos (26). Los metabolitos producidos a partir de la movilización de lípidos ingresan a los tejidos corporales como sustratos energéticos de tres maneras: la mayoría ingresa al ciclo del ácido tricarboxílico para una oxidación completa y el suministro de energía, mientras que algunos se esterifican a triglicéridos (TG). Una acumulación de TG en el hígado aumenta el riesgo de esteatosis. Además, una parte de estos metabolitos se oxida a cuerpos cetónicos (27, 28). La lipidolisis al final del embarazo promueve un NEFA elevado, que se asocia con la respuesta a la insulina y la resistencia periférica a la insulina, y la cetogénesis es el resultado de concentraciones reducidas de glucosa e insulina (29). En nuestro estudio, observamos una disminución de la glucosa e insulina séricas y un aumento de BHBA en ovejas con TP. Altas concentraciones de BHBA inhiben las vías gluconeogénicas y exacerban la NEB (30). Los niveles elevados de BHBA también reducen la movilización de tejido adiposo y la liberación de NEFA, lo que a su vez reduce la producción de cuerpos cetónicos (31). Nuestro estudio no encontró diferencias en NEFA y TG entre los dos grupos. Esta falta de diferencia puede atribuirse a las altas concentraciones de BHBA en las ovejas con toxemia preñada, lo que puede inhibir la producción de NEFA y TG. Una observación interesante de un estudio relacionado es que después de un ayuno de 36 h en humanos sanos, el contenido de lípidos en el hígado aumenta, aunque el grado de acumulación de lípidos puede variar (32). Los ratones C57BL/6J y SJL/J difieren drásticamente en su susceptibilidad a la esteatosis hepática inducida rápidamente. Aunque ambas cepas de ratones perdieron el 60% de su TG corporal después de un ayuno de 24 horas, los ratones SJL/J no desarrollaron esteatosis. En estos ratones, una mayor proporción de los NEFA producidos por la movilización de lípidos fue absorbida por el corazón y el músculo esquelético (33). Encontramos que las ovejas sanas y PT exhibieron diferencias en el metabolismo de los glicolípidos, lo que puede conducir a variaciones en la producción de cuerpos cetónicos, lo que indica que los procesos de oxidación y utilización de lípidos difieren entre individuos.
Los requerimientos recomendados de energía, proteína bruta, calcio y fósforo para las ovejas en la gestación tardía fueron de 1,5 a 2 veces más que los de las ovejas en la gestación temprana (17), y con el aumento de los días de gestación, la demanda de energía y proteína de las ovejas aumentó (34). Al principio, se pensó que la ingesta de alimento en rumiantes estaba regulada por receptores de glucosa en el hígado, lo que se conoce como la teoría de la oxidación hepática (HOT) (35). En los últimos años, los investigadores han descubierto que la fermentación ruminal se ha utilizado para comprender la complejidad de la regulación del metabolismo de la ingesta de alimento en rumiantes (36, 37). La proporción de hidratos de carbono no fibrabrados (NFC) y fibra detergente neutra (FDN) altera la composición de la microbiota ruminal, y su desequilibrio también induce acidosis ruminal en las ovejas (38), mientras que el contenido de FDN de los piensos es un importante regulador de la ingesta de alimento en las vacas lecheras (39). Sin embargo, la capacidad de las vacas preñadas para consumir FDN se reduce con el número de días de gestación y los tiempos de gestación (1). Estudios previos han encontrado que la degradación de FDN en ovejas se ve afectada principalmente por la microbiota (40); además, Wang et al. (41) descubrieron que la microbiota ruminal afectaba al metabolismo de los ácidos grasos de cadena corta y que la acumulación de BHBA podía estar relacionada con la cetosis incluso cuando la ingesta de alimento era suficiente. Por lo tanto, especulamos que las diferencias metabólicas de las ovejas en la gestación tardía pueden estar relacionadas con la microbiota ruminal involucrada en la degradación de nutrientes. El NH3-N es el producto final producido por la descomposición de sustancias que contienen nitrógeno en la comunidad bacteriana del rumen, y el MCP es la conversión del NH3-N que puede proporcionar un 50-80% de proteínas absorbibles para los rumiantes (42). Curiosamente, encontramos que la capacidad de las ovejas PT para producir NH3-N aumentó; sin embargo, la capacidad de la microbiota ruminal para sintetizar MCP utilizando amoníaco disminuyó. Un estudio encontró que 5 mg/dL se considera la concentración óptima de proteína microbiana sintética NH3-N, y cuando se reduce el contenido de NH3-N, el BUN sérico se transfiere al rumen para aliviar la deficiencia de aminoácidos nitrógeno, y la defaunación también reduce el contenido de NH3-N (43). Nuestro estudio encontró que el BUN no fue diferente entre los dos grupos, mientras que el contenido de NH3-N en las ovejas PT aumentó, lo que puede estar relacionado con la abundancia relativa de protozoos ruminales. La riqueza y la diversidad se pueden utilizar como indicadores de la función de la comunidad bacteriana en el rumen, y los microbiomas específicos se asocian con vías metabólicas para proporcionar más energía al huésped (44). Un estudio previo encontró que los estados de cetosis estaban acompañados de cambios sustanciales en los taxones bacterianos en el rumen (41). En este estudio, observamos una disminución tanto en la riqueza como en la diversidad de la microbiota ruminal en las ovejas PT, lo que puede ser una de las razones de su condición. Además, existe una creciente evidencia de un vínculo entre los microbios gastrointestinales y la enfermedad del huésped (45, 46). Además, se ha demostrado que la microbiota fecal es muy informativa para predecir el índice de masa corporal humana, el estado glucémico y los niveles de glucosa en ayunas (46). Por ejemplo, la enfermedad metabólica (acidosis ruminal) se asocia con trastornos microbianos del rumen (47). En las vacas con cetosis, la composición del microbioma ruminal es alterado. Se ha demostrado que el tratamiento con propilenglicol aumenta la abundancia relativa de Prevotella, Succinivibrionaceae_UCG-001 y Prevotellaceae_UCG-001, y aumenta la producción de propionato. Este tratamiento puede ayudar a reducir los niveles de BHBA en sangre, favoreciendo así un estado más saludable de la microbiota ruminal (48). Las vacas con concentraciones circulantes de BHBA superiores a 1,4 mmol/L tenían un riesgo 2,83-6,70 veces mayor de desarrollar abomaso secundario desplazado izquierdo (49). Además, los cambios en la microbiota intestinal se asocian con la cetogénesis y el metabolismo de la glucosa en vacas con abomaso desplazado izquierdo (50).
Los AGV producidos por los piensos de fermentación microbiana ruminal son la principal fuente de energía de los rumiantes (51). Oribacterium y Lachnospiraceae_AC2044_group pertenecen a Firmicutes (52), y Ruminococcus y Lachnospiraceae no solo tienen la capacidad de degradar la celulosa, sino que también contienen muchos genes de polisacáridos hidrolasa de plantas (53, 54). Prevotella puede codificar un sistema de utilización de polisacáridos altamente conservado para degradar el ácido glucónico soluble y los polisacáridos de almidón, y también puede utilizar polisacáridos de la pared celular de las plantas para promover la degradación del xilano (55). Además, la capacidad de producción de propionato de Prevotella es 2-3 veces mayor que la de Bacteroides (56). Mientras tanto, la síntesis de metano y propionato puede funcionar como los principales sumideros de hidrógeno en el rumen, y se puede detectar una fuerte correlación negativa entre estos dos procesos, lo que proporciona evidencia de que Prevotella está asociado con un bajo metano y un alto rendimiento propiónico (57). El butirivibrio puede degradar la hemicelulosa y producir butirato utilizando polisacáridos como el almidón, la pectina y el xilano como sustratos (58). Además, un estudio previo estimó la asociación entre la abundancia de OTU bacterianas y arqueales del rumen y las concentraciones de BHBA y acetona en la leche, y encontraron que las OTU bacterianas más fuertemente correlacionadas están dominadas por miembros de las familias Prevotellaceae y Ruminococcaceae, las cuales mostraron una correlación negativa con los niveles plasmáticos de BHBA (59). Nuestro estudio tuvo resultados similares, observamos una disminución en la abundancia relativa de Prevotella (Bacteroides), Butyrivibrio (Firmicutes), Ruminococcus (Firmicutes) y Lachnospiraceae (Firmicutes) en ovejas PT, y se correlacionaron positivamente con las concentraciones de Glu, acetato, propionato y butirato y se correlacionaron negativamente con BHBA. Nuestros resultados indicaron que se redujo la capacidad de utilización de polisacáridos y hemicelulosas en ovejas PT y se inhibió la vía de producción de AGV, lo que resultó en un suministro inadecuado de energía a las ovejas, además de una mayor movilización de grasa y producción de BHBA. Además, la estimulación de BHBA de las células epiteliales mamarias aumenta la concentración de malondialdehído, promueve la acumulación de especies reactivas de oxígeno y mejora la expresión de indicadores inflamatorios. Esto da lugar a estrés oxidativo y respuesta inflamatoria (60). Además, Prevotella y Lachnospiraceae regulan la inmunidad del huésped (61, 62) y pueden promover la resistencia a la colonización a los patógenos del rumen (63, 64). La correlación negativa entre estos grupos microbianos y el BHBA sugiere que la disminución de la abundancia relativa de Prevotella y Lachnospiraceae puede estar relacionada con la respuesta inflamatoria inducida por el BHBA. Proteobacteria es el filo dominante endémico de las ovejas PT e incluye patógenos oportunistas bien conocidos como E. coli y Salmonella (65). Por lo tanto, la disminución de Prevotella y Lachnospiraceae y el aumento de Proteobacteria promueven la acumulación de bacterias patógenas en el rumen. Estos cambios en las bacterias del rumen pueden estar relacionados con el desarrollo de TP.
5 Conclusión
En este estudio, encontramos que las concentraciones de glucosa sérica, acetato, propionato, butirato y MCP fueron más bajas, mientras que las concentraciones de BHBA, AST, A/P y NH3-N fueron mayores en las ovejas con toxemia preñada que en las ovejas sanas. Las disminuciones en la abundancia relativa de bacterias del rumen como Oribacterium, Prevotella, Butyrivibrio, Ruminococcus y Lachnospiraceae_AC2044_group se asociaron con una reducción de la producción de acetato, propionato y butirato, así como con una disminución de las concentraciones de glucosa sérica y un aumento de las concentraciones de BHBA y AST. Estos hallazgos indican que las diferencias en los géneros bacterianos del rumen están relacionadas con la toxemia del embarazo en las ovejas.
Declaración de disponibilidad de datos
Los conjuntos de datos presentados en este estudio se pueden encontrar en repositorios en línea. Los nombres de los repositorios y los números de acceso se pueden encontrar en el artículo/Material complementario.
Declaración ética
El estudio en animales se llevó a cabo bajo la dirección del Comité de Cuidado y Uso de Animales de la Universidad Agrícola de Hebei (número de aprobación: 2020036). El estudio se llevó a cabo de acuerdo con la legislación local y los requisitos institucionales.
Contribuciones de los autores
JC: Curación de datos, Análisis formal, Metodología, Redacción – borrador original. SW: Validación, Redacción – revisión y edición. XY: Validación, Visualización, Escritura – revisión y edición. CD: Validación, Redacción – revisión y edición. JL: Software, Escritura – revisión y edición. Y-qL: Conceptualización, Investigación, Administración de proyectos, Recursos, Redacción – revisión y edición. YZ: Conceptualización, Obtención de fondos, Supervisión, Redacción, revisión y edición.
Financiación
El/los autor/es declara(n) que se recibió apoyo financiero para la investigación, autoría y/o publicación de este artículo. Este estudio contó con el apoyo del Sistema de Investigación Agrícola de China (CARS-38).
Reconocimientos
Los autores agradecen a Zhangjiakou Lanhai Animal Husbandry por proporcionar los sitios experimentales y las ovejas. Los autores agradecen a Xiaoya Zhao, Peizhi Tian y Chendi Shi, de la Facultad de Ciencia y Tecnología Animal de la Universidad Agrícola de Hebei, por su ayuda en la operación experimental.
Conflicto de intereses
Los autores declaran que la investigación se llevó a cabo en ausencia de relaciones comerciales o financieras que pudieran interpretarse como un posible conflicto de intereses.
Nota del editor
Todas las afirmaciones expresadas en este artículo son únicamente las de los autores y no representan necesariamente las de sus organizaciones afiliadas, ni las del editor, los editores y los revisores. Cualquier producto que pueda ser evaluado en este artículo, o afirmación que pueda hacer su fabricante, no está garantizado ni respaldado por el editor.
Material complementario
El material complementario para este artículo se puede encontrar en línea en: https://www.frontiersin.org/articles/10.3389/fvets.2024.1472334/full#supplementary-material
Referencias
1. Mongini, A, y Van Saun, RJ. Toxemia del embarazo en ovejas y cabras. Veterinario Clin North Am Comida Anim Pract. (2023) 39:275–91. doi: 10.1016/j.cvfa.2023.02.010
2. Vasava, PR, Jani, RG, Goswami, HV, Rathwa, SD, y Tandel, FB. Estudios sobre signos clínicos y alteraciones bioquímicas en cabras toxémicas preñadas. Mundo Veterinario. (2016) 9:869–74. doi: 10.14202/vetworld.2016.869-874
3. Torre, JS. Toxemia de preñez de ovejas, hembras y vacas de carne. Veterinario Clin North Am Comida Anim Pract. (2000) 16:293–317. doi: 10.1016/s0749-0720(15)30107-9
4. Ji, X, Liu, N, Wang, Y, Ding, K, Huang, S y Zhang, C. Toxemia de embarazo en ovejas: una revisión de los mecanismos metabólicos moleculares y las estrategias de manejo. Metabolitos. (2023) 13:149. doi: 10.3390/metabo13020149
Resumen de PubMed | Texto completo de Crossref | Google Académico
5. Xue, YF, Guo, CZ, Hu, F, Sun, DM, Liu, JH y Mao, SY. Mecanismos moleculares del trastorno del metabolismo lipídico en hígados de ovejas con toxemia durante el embarazo. Animal. (2019) 13:992–9. DOI: 10.1017/S1751731118002136
6. Xue, Y, Guo, C, Hu, F, Zhu, W y Mao, S. La desnutrición materna induce un trastorno del metabolismo de los lípidos hepáticos fetales y afecta el desarrollo del hígado fetal en un modelo de oveja. FASEB J. (2019) 33:9990–10004. doi: 10.1096/fj.201900406R
Resumen de PubMed | Texto completo de Crossref | Google Académico
7. Sun, B, Cao, Y, Cai, C, Yu, C, Li, S y Yao, J. Dinámica temporal del equilibrio de nutrientes, rasgos bioquímicos e inmunológicos del plasma y función hepática en vacas lecheras en transición. J Integr Agric. (2020) 19:820–37. doi: 10.1016/S2095-3119(20)63153-7
8. Esposito, G, Irons, PC, Webb, EC y Chapwanya, A. Interacciones entre el balance energético negativo, las enfermedades metabólicas, la salud uterina y la respuesta inmunitaria en vacas lecheras en transición. Anim Reprod Sci. (2014) 144:60–71. doi: 10.1016/j.anireprosci.2013.11.007
Resumen de PubMed | Texto completo de Crossref | Google Académico
9. Forbes, JM. El efecto del embarazo y la gordura en el volumen del contenido ruminal en la oveja. J Agric Sci. (1969) 72:119–21. doi: 10.1017/S0021859600020475
10. Schlumbohm, C, y Harmeyer, J. El embarazo de gemelos aumenta la susceptibilidad de las ovejas al estrés hipoglucémico y a la toxemia del embarazo. Res Vet Sci. (2008) 84:286–99. doi: 10.1016/j.rvsc.2007.05.001
11. Lima, MS, Pascoal, RA, Stilwell, GT y Hjerpe, CA. Hallazgos clínicos, valores de química sanguínea y datos epidemiológicos de cabras lecheras con toxemia durante el embarazo. Práctica bovina. (2012) 46:102–10. doi: 10.21423/bovine-vol46no2p102-110
12. Nichols, BL, Quezada-Calvillo, R, Robayo-Torres, CC, Ao, Z, Hamaker, BR, Butte, NF, et al. La maltasa-glucoamilasa de la mucosa desempeña un papel crucial en la digestión del almidón y en la homeostasis de la glucosa prandial de los ratones. J Nutr. (2009) 139:684–90. doi: 10.3945/jn.108.098434
13. Reynolds, CK, Aikman, PC, Lupoli, B, Humphries, DJ y Beever, DE. Metabolismo esplácnico de las vacas lecheras durante la transición desde el final de la gestación hasta el principio de la lactancia. J Dairy Sci. (2003) 86:1201–17. DOI: 10.3168/JDS. S0022-0302(03)73704-7
14. Xue, Y, Hu, F, Guo, C, Mei, S, Xie, F, Zeng, H, et al. La desnutrición alteró la fermentación colónica y las comunidades bacterianas asociadas a la digestión en ovejas preñadas. Aplicación Microbiol Biotechnol. (2020) 104:5973–84. doi: 10.1007/s00253-020-10662-4
15. Shabat, SK, Sasson, G, Doron-Faigenboim, A, Durman, T, Yaacoby, S, Berg, MM, et al. Los mecanismos específicos dependientes del microbioma subyacen a la eficiencia de la cosecha de energía de los rumiantes. ISME J. (2016) 10:2958–72. doi: 10.1038/ismej.2016.62
Resumen de PubMed | Texto completo de Crossref | Google Académico
16. Li, Y, Yang, Y, Chai, S, Pang, K, Wang, X, Xu, L, et al. El trasplante de líquido ruminal acelera la remodelación microbiana del rumen y mejora la eficiencia alimenticia en los yaks. Microorganismos. (2023) 11:1964. DOI: 10.3390/Microorganismos11081964
17. NRC (Consejo Nacional de Investigación). Requerimientos de nutrientes de los pequeños rumiantes: ovejas, cabras, cérvidos y camélidos del nuevo mundo. Washington, DC: National Academy Press (2007).
18. Broderick, GA, y Kang, JH. Determinación simultánea automatizada de amoníaco y aminoácidos totales en fluido ruminal y medios in vitro. J Dairy Sci. (1980) 63:64–75. DOI: 10.3168/JDS. S0022-0302(80)82888-8
19. Fthenakis, GC, Arsenos, G, Brozos, C, Fragkou, IA, Giadinis, ND, Giannenas, I, et al. Manejo sanitario de las ovejas durante la gestación. Anim Reprod Sci. (2012) 130:198–212. doi: 10.1016/j.anireprosci.2012.01.016
20. Koong, LJ, Garrett, WN, y Rattray, PV. Una descripción de la dinámica del crecimiento fetal en ovejas. J Anim Sci. (1975) 41:1065–8. doi: 10.2527/jas1975.4141065x
Resumen de PubMed | Texto completo de Crossref | Google Académico
21. Rattray, PV, Garrett, WN, East, NE y Hinman, N. Crecimiento, desarrollo y composición del conceptus ovino y la glándula mamaria durante el embarazo. J Anim Sci. (1974) 38:613–26. doi: 10.2527/jas1974.383613x
22. Bell, AW, y Ehrhardt, RA. Regulación del transporte de nutrientes placentarios e implicaciones para el crecimiento fetal. Nutr Res Rev. (2002) 15:211–30. doi: 10.1079/NRR200239
23. Steinhoff-Wagner, J, Görs, S, Junghans, P, Bruckmaier, RM, Kanitz, E, Metges, CC, et al. Maduración de la producción endógena de glucosa en terneros prematuros y a término. J Dairy Sci. (2011) 94:5111–23. doi: 10.3168/jds.2011-4355
24. Battaglia, FC, y Meschia, G. Principales sustratos del metabolismo fetal. Physiol Rev. (1978) 58:499–527. doi: 10.1152/physrev.1978.58.2.499
25. Faichney, GJ y White, GA. Efectos del estado nutricional materno en el crecimiento fetal y placentario y en la síntesis de urea fetal en ovejas. Aust J Biol Sci. (1987) 40:365–77. doi: 10.1071/bi9870365
Resumen de PubMed | Texto completo de Crossref | Google Académico
26. McNeill, DM, Slepetis, R, Ehrhardt, RA, Smith, DM y Bell, AW. Requerimientos proteicos de las ovejas al final de la gestación: partición del nitrógeno entre el útero grávido y los tejidos maternos. J Anim Sci. (1997) 75:809–16. doi: 10.2527/1997.753809x
Resumen de PubMed | Texto completo de Crossref | Google Académico
27. Hodson, L, y Gunn, PJ. La regulación de la síntesis y partición de ácidos grasos hepáticos: el efecto del estado nutricional. Nat Rev Endocrinol. (2019) 15:689–700. doi: 10.1038/s41574-019-0256-9
Resumen de PubMed | Texto completo de Crossref | Google Académico
28. Laffel, L. Cuerpos cetónicos: una revisión de la fisiología, la fisiopatología y la aplicación de la monitorización a la diabetes. Diabetes Metab Res Rev. (1999) 15:412–26. doi: 10.1002/(sici)1520-7560(199911/12)15:6<412::aid-dmrr72>3.0.co; 2-8
29. Campana, AW. Regulación del metabolismo de los nutrientes orgánicos durante la transición desde el final del embarazo hasta el comienzo de la lactancia. J Anim Sci. (1995) 73:2804–19. doi: 10.2527/1995.7392804x
Resumen de PubMed | Texto completo de Crossref | Google Académico
30. Schlumbohm, C y Harmeyer, J. La hipercetonemia afecta el metabolismo de la glucosa en ovejas preñadas y no preñadas. J Dairy Sci. (2004) 87:350–8. DOI: 10.3168/JDS. S0022-0302(04)73174-4
Resumen de PubMed | Texto completo de Crossref | Google Académico
31. Harmeyer, J y Schlumbohm, C. El embarazo afecta la eliminación de cuerpos cetónicos en ovejas de gestación tardía: implicaciones para el inicio de la toxemia del embarazo. Res Vet Sci. (2006) 81:254–64. doi: 10.1016/j.rvsc.2005.10.010
Resumen de PubMed | Texto completo de Crossref | Google Académico
32. Moller, L, Stodkilde-Jorgensen, H, Jensen, FT, y Jorgensen, JO. El ayuno en sujetos sanos se asocia con la acumulación intrahepática de lípidos evaluada por espectroscopia de resonancia magnética de 1 h. Clin Sci. (2008) 114:547–52. doi: 10.1042/CS20070217
33. Guan, HP, Goldstein, JL, Brown, MS y Liang, G. La oxidación acelerada de ácidos grasos en el músculo evita la esteatosis hepática inducida en ayunas en ratones SJL / J. J Biol Chem. (2009) 284:24644–52. DOI: 10.1074/JBC. M109.034397
34. Zhang, H, Sun, L, Wang, Z, Ma, T, Deng, M, Wang, F, et al. Requerimientos energéticos y proteicos para el mantenimiento de las ovejas Hu durante la gestación. J Integr Agric. (2018) 17:173–83. doi: 10.1016/S2095-3119(17)61691-5
35. Friedman, MI. Partición de combustible e ingesta de alimentos. Am J Clin Nutr. (1998) 67:513S–8S. doi: 10.1093/ajcn/67.3.513S
36. Allen, MS, Bradford, BJ, y Harvatine, KJ. La vaca como modelo para estudiar la regulación de la ingesta de alimentos. Annu Rev Nutr. (2005) 25:523–47. doi: 10.1146/annurev.nutr.25.050304.092704
37. Allen, MS, Bradford, BJ y Oba, M. Revisión invitada por la junta: la teoría de la oxidación hepática del control de la ingesta de alimento y su aplicación a los rumiantes. J Anim Sci. (2009) 87:3317–34. DOI: 10.2527/jas.2009-1779
Resumen de PubMed | Texto completo de Crossref | Google Académico
38. Liu, D, Zhou, X, Zhao, P, Gao, M, Han, H y Hu, H. Efectos del aumento de la proporción de carbohidratos sin fibra a fibra detergente neutro en la fermentación ruminal y la microbiota en cabras. J Integr Agric. (2013) 12:319–26. doi: 10.1016/S2095-3119(13)60231-2
39. Pan, X, Yang, L, Yves, B, Xiong, B y Jiang, L. Comparación de precisión de modelos de predicción de ingesta de materia seca evaluados por un ensayo de alimentación de vacas lecheras lactantes alimentadas con dos raciones mezcladas totales con diferentes fuentes de forraje. J Integr Agric. (2017) 16:921–9. doi: 10.1016/S2095-3119(16)61483-1
40. Arce-Cordero, JA, Fan, P, Monteiro, HF, Dai, X, Jeong, KC y Faciola, AP. Efectos del cloruro de colina en el microbioma ruminal a 2 concentraciones de fibra detergente neutro en la dieta en cultivo continuo. J Dairy Sci. (2022) 105:4128–43. DOI: 10.3168/jds.2021-21591
Resumen de PubMed | Texto completo de Crossref | Google Académico
41. Wang, Q, Cui, Y, Indugu, N, Loor, JJ, Jiang, Q, Yu, Z, et al. Los análisis metaómicos integrados revelan un papel de los microorganismos ruminales en la acumulación de cuerpos cetónicos y la cetosis en vacas lecheras lactantes. J Dairy Sci. (2023) 106:4906–17. doi: 10.3168/jds.2022-22282
42. Pilgrim, AF, Weller, RA, Gray, FV y Belling, CB. Síntesis de proteína microbiana a partir de amoníaco en el rumen de las ovejas y la proporción de nitrógeno de la dieta convertida en nitrógeno microbiano. Hno. J Nutr. (1970) 24:589–98. doi: 10.1079/bjn19700057
43. Firkins, JL, Yu, Z y Morrison, M. Metabolismo del nitrógeno ruminal: perspectivas para la integración de la microbiología y la nutrición para los productos lácteos. J Dairy Sci. (2007) 90:E1–E16. doi: 10.3168/jds.2006-518
44. Elolimy, AA, Arroyo, JM, Batistel, F, Iakiviak, MA, y Loor, JJ. Asociación de la ingesta residual de alimento con la abundancia de bacterias ruminales y las actividades enzimáticas hidrolizantes de biopolímeros durante el período periparto y la lactancia temprana en vacas lecheras Holstein. J Anim Sci Biotechnol. (2018) 9:43. doi: 10.1186/s40104-018-0258-9
Resumen de PubMed | Texto completo de Crossref | Google Académico
45. DePeters, EJ, y George, LW. Transfaunación ruminal. Immunol Lett. (2014) 162:69–76. doi: 10.1016/j.imlet.2014.05.009
46. Difford, GF, Plichta, DR, Lovendahl, P, Lassen, J, Noel, SJ, Hojberg, O, et al. La genética del huésped y el microbioma ruminal se asocian conjuntamente con las emisiones de metano en las vacas lecheras. PLoS Genet. (2018) 14:e1007580. doi: 10.1371/journal.pgen.1007580
47. Khafipour, E, Li, S, Plaizier, JC y Krause, DO. Composición del microbioma ruminal determinada utilizando dos modelos nutricionales de acidosis ruminal subaguda. Appl Environ Microbiol. (2009) 75:7115–24. doi: 10.1128/aem.00739-09
Resumen de PubMed | Texto completo de Crossref | Google Académico
48. Xiang, K, Li, S, Tuniyazi, M, Mu, R, Wang, Y, Zhang, N, et al. Cambios en la comunidad de la microbiota ruminal en vacas con cetosis durante el tratamiento con propilenglicol. Funct. (2022) 13:7144–56. doi: 10.1039/d1fo03800a
Resumen de PubMed | Texto completo de Crossref | Google Académico
49. Seifi, HA, Leblanc, SJ, Leslie, KE y Duffield, TF. Predictores metabólicos de enfermedad posparto y riesgo de sacrificio en ganado lechero. Veterinario J. (2011) 188:216–20. doi: 10.1016/j.tvjl.2010.04.007
50. Luo, Z, Yong, K, Luo, Q, Du, Z, Ma, L, Huang, Y, et al. Microbioma fecal alterado y correlaciones del metaboloma con metabolitos plasmáticos en vacas lecheras con abomaso desplazado izquierdo. Microbiol Spectr. (2022) 10:E0197222. doi: 10.1128/spectrum.01972-22
51. Ceciliani, F, Lecchi, C, Urh, C y Sauerwein, H. Proteómica y metabolómica que caracterizan la fisiopatología de las reacciones adaptativas a los desafíos metabólicos durante la transición desde el final del embarazo hasta el principio de la lactancia en vacas lecheras. J Proteoma. (2018) 178:92–106. doi: 10.1016/j.jprot.2017.10.010
52. Carlier, JP, K’Ouas, G, Bonne, I, Lozniewski, A, y Mory, F. Oribacterium sinus gen. nov., sp. nov., dentro de la familia ‘Lachnospiraceae‘ (filo Firmicutes). Int J Syst Evol Microbiol. (2004) 54:1611–5. doi: 10.1099/ijs.0.63060-0
53. Crost, EH, Tailford, LE, Le Gall, G, Fons, M, Henrissat, B, y Juge, N. La utilización de glicanos de mucina por el simbionte intestinal humano Ruminococcus gnavus depende de la cepa. PLoS Uno. (2013) 8:E76341. doi: 10.1371/journal.pone.0076341
54. Wu, H, Rebello, O, Crost, EH, Owen, CD, Walpole, S, Bennati-Granier, C, et al. Fucosidasas del simbionte intestinal humano Ruminococcus gnavus. Célula Mol Life Sci. (2021) 78:675–93. doi: 10.1007/s00018-020-03514-x
Resumen de PubMed | Texto completo de Crossref | Google Académico
55. Tong, J, Zhang, H, Wang, J, Liu, Y, Mao, S, Xiong, B, et al. Efectos de diferentes pesos moleculares de quitosano en la producción de metano y la estructura de la comunidad bacteriana in vitro. J Integr Agric. (2020) 19:1644–55. doi: 10.1016/S2095-3119(20)63174-4
56. Chen, T, Long, W, Zhang, C, Liu, S, Zhao, L, y Hamaker, BR. La capacidad de utilización de la fibra varía en la microbiota intestinal dominada por prevotella frente a la dominada por bacteroides. Sci Rep. (2017) 7:2594. doi: 10.1038/s41598-017-02995-4
Resumen de PubMed | Texto completo de Crossref | Google Académico
57. Shinkai, T, Takizawa, S, Enishi, O, Higuchi, K, Ohmori, H y Mitsumori, M. Características de la microbiota ruminal y los aislados de Prevotella encontrados en vacas lecheras con alto contenido de propionato y baja producción de metano. Microbiol frontal. (2024) 15:1404991. doi: 10.3389/fmicb.2024.1404991
58. Emerson, EL, y Weimer, PJ. Fermentación de hemicelulosas modelo por cepas de prevotella y Butyrivibrio fibrisolvens en cultivo puro y en cultivos de enriquecimiento ruminal. Aplicación Microbiol Biotechnol. (2017) 101:4269–78. doi: 10.1007/s00253-017-8150-7
59. Scharen, M, Frahm, J, Kersten, S, Meyer, U, Hummel, J, Breves, G, et al. Interrelaciones entre la microbiota ruminal y los atributos productivos, conductuales, de fermentación ruminal, metabólicos e inmunológicos de las vacas lecheras. J Dairy Sci. (2018) 101:4615–37. doi: 10.3168/jds.2017-13736
60. Li, C, Huang, J, Chen, X, Yan, Y, Li, L y Zhao, W. El análisis del transcriptoma revela que NEFA y beta-hidroxibutirato inducen estrés oxidativo y respuesta inflamatoria en células epiteliales mamarias bovinas. Metabolitos. (2022) 12:1060. doi: 10.3390/metabo12111060
61. Niccolai, E, Russo, E, Baldi, S, Ricci, F, Nannini, G, Pedone, M, et al. Correlación significativa y conflictiva de IL-9 con Prevotella y Bacteroides en el cáncer colorrectal humano. Frente Immunol. (2020) 11:573158. doi: 10.3389/fimmu.2020.573158
62. Yin, X, Ji, S, Duan, C, Tian, P, Ju, S, Yan, H, et al. La sucesión de la comunidad bacteriana fecal y su correlación con los cambios de los indicadores inmunes séricos en corderos desde el nacimiento hasta los 4 meses. J Integr Agric. (2023) 22:537–50. doi: 10.1016/j.jia.2022.08.055
63. Iljazovic, A, Amend, L, Galvez, E, de Oliveira, R, y Strowig, T. Modulación de las respuestas inflamatorias por Prevotella spp. gastrointestinal: de asociaciones a estudios funcionales. Int J Med Microbiol. (2021) 311:151472. doi: 10.1016/j.ijmm.2021.151472
64. Iljazovic, A, Roy, U, Gálvez, E, Lesker, TR, Zhao, B, Gronow, A, et al. La perturbación del microbioma intestinal por Prevotella spp. aumenta la susceptibilidad del huésped a la inflamación de la mucosa. Inmunol. (2021) 14:113–24. doi: 10.1038/s41385-020-0296-4
Resumen de PubMed | Texto completo de Crossref | Google Académico
65. Moon, CD, Young, W, Maclean, PH, Cookson, AL, y Bermingham, EN. Conocimientos metagenómicos sobre el papel de las proteobacterias en los microbiomas gastrointestinales de perros y gatos sanos. Microbiología. (2018) 7:E00677. DOI: 10.1002/mbo3.677
Palabras clave: ovejas, toxemia durante la gestación, microbiota ruminal, fermentación ruminal, índices séricos
Cita: Chen J, Wang S, Yin X, Duan C, Li J, Liu Y y Zhang Y (2024) Relación entre la microbiota ruminal y la toxemia del embarazo en ovejas. Frente. Vet. Sci. 11:1472334. doi: 10.3389/fvets.2024.1472334
Recibido: 29 de julio de 2024; Aceptado: 09 de septiembre de 2024;
Publicado: 27 de septiembre de 2024.
Editado por:
Zhifeng Chen, Universidad de Monash, Australia
Revisado por:
Dongli Yu, Instituto Oncológico Dana Farber, Estados
Unidos Yanping Qiu, Instituto de Tecnología de California, Estados Unidos
Derechos de autor © 2024 Chen, Wang, Yin, Duan, Li, Liu y Zhang. Este es un artículo de acceso abierto distribuido bajo los términos de la Licencia Creative Commons Atribución (CC BY).
*Correspondencia: Yingjie Zhang, zhangyingjie66@126.com
Renuncia: Todas las afirmaciones expresadas en este artículo son únicamente las de los autores y no representan necesariamente a las de sus organizaciones afiliadas, o las del editor, de los editores y de los revisores. Cualquier producto que puede ser evaluada en este artículo o afirmación que puede ser hecha por su El fabricante no está garantizado ni respaldado por el editor.
Date de alta y recibe nuestro 👉🏼 Diario Digital AXÓN INFORMAVET ONE HEALTH
Date de alta y recibe nuestro 👉🏼 Boletín Digital de Foro Agro Ganadero
Noticias animales de compañía
Noticias animales de producción
Trabajos técnicos animales de producción
Trabajos técnicos animales de compañía