Sarcomas de partes blandas caninas
Sarcomas de partes blandas caninas: la expresión de RUNX2 y carioferina alfa-2 en osteosarcomas extraesqueléticos (tejidos blandos) y esqueléticos
 Leonardo Lenardi1*
Leonardo Lenardi1*  Elisabetta Manuali2
Elisabetta Manuali2  Antonello Bufalari1
Antonello Bufalari1  Ilaria Porcellato1
Ilaria Porcellato1- 1Departamento de Medicina Veterinaria, Università degli Studi di Perugia, Perugia, Italia
- 2Laboratorio de Histopatología Veterinaria Comparada, Istituto Zooprofilattico dell’Umbria e delle Marche (IZSUM) «Togo Rosati», Perugia, Italia
El osteosarcoma extraesquelético (EOS, por sus siglas en inglés) es un tumor maligno que produce matriz ósea y/o material condroide, sin adhesión directa al hueso o al periostio. En humanos y perros, el EOS es altamente infiltrante, de rápido crecimiento, a menudo caracterizado por depósito osteoide y osificación variable, similar al osteosarcoma esquelético primario (SOS). En los perros, la EOS surge de localizaciones viscerales y de tejidos blandos, ocasionalmente en traumatismos o sitios de cuerpos extraños, o en granulomas. Actualmente se dispone de pocos datos sobre el fenotipo de estos tumores. El presente estudio tiene como objetivo evaluar la expresión de RUNX2 y Karyopherin alfa-2 en EOS, comparándola con SOS y los datos disponibles de su contraparte humana. Diecisiete casos de osteosarcoma canino (13 EOS y 4 SOS) fueron seleccionados retrospectivamente y sometidos a inmunohistoquímica para RUNX2 y Karyopherin alfa-2. Nuestros resultados mostraron que, en EOS, RUNX2 se expresa en una media de 73,07 ± 5,36 núcleos de células neoplásicas, frente a una media de 36,15 ± 6,25 de núcleos alfa-2 positivos de carioferina. Los osteoclastos, cuando estaban presentes, fueron negativos para ambos marcadores. No se observó correlación entre los dos marcadores (p > 0,05), ni se evaluó la diferencia estadísticamente significativa en la expresión cuantitativa comparando los grupos EOS y SOS. RUNX2 se expresa en EOS canino de manera similar a SOS y podría usarse como marcador de diagnóstico en un panel más grande. La carioferina alfa-2 se expresa en EOS y SOS caninos de forma similar a la SOS humana y podría validarse en futuros estudios como marcador diagnóstico adicional. Se deben planificar estudios adicionales para evaluar la expresión de estas proteínas como parámetros pronósticos predictivos.
Introducción
El osteosarcoma extraesquelético (EOS, por sus siglas en inglés) es un sarcoma óseo primitivo definido por la producción de hueso osteoide o inmaduro, pero que surge en tejidos distintos del hueso sin compromiso esquelético (1–3). Las EOS se han descrito en una variedad de especies animales y en varios tejidos y órganos, como la glándula mamaria, en primer lugar por su frecuencia, seguida del bazo, la piel y el subcutis, el intestino, los músculos, el hígado (4), la glándula tiroides, el sistema urinario y las glándulas salivales (1, 3). Al igual que los osteosarcomas de origen esquelético, los osteosarcomas extraesqueléticos generalmente se presentan como masas infiltrativas de rápido crecimiento, con áreas de osificación en diferentes etapas de maduración, a menudo también mezcladas con necrosis y necrosis hemorrágica (1). Desde el punto de vista histológico, los EOS se asemejan a los osteosarcomas esqueléticos, con una recidiva local frecuente y un alto potencial metastásico. Las EOS se han diagnosticado de acuerdo con las directrices de la OMS y en función de la localización primaria de los tumores y de la certeza de que el tumor es primitivo de tejido blando y no de tejido esquelético. En perros, los EOS representan un tumor altamente maligno con una mediana de supervivencia de solo <1 mes después del primer diagnóstico (1, 5). Es posible que el diagnóstico histológico definitivo del osteosarcoma no sea sencillo, debido a la alta variabilidad en la densidad celular de estos tumores. Además, la morfología celular altamente impredecible y los diferentes histotipos de osteosarcoma pueden ser un desafío para el patólogo, particularmente cuando la matriz condroide está presente y el condrosarcoma debe incluirse como diagnóstico diferencial. En cualquier caso, el EOS es siempre un tumor con alto potencial maligno y metástasis frecuentes. Si bien numerosos datos biomoleculares presentes en la literatura científica describen varias formas de osteosarcoma esquelético primario en muchas especies animales, aún se ha hecho poco para comprender mejor los aspectos celulares más íntimos y característicos de la EOS animal. Durante la última década, han surgido numerosos estudios centrados en nuevos marcadores asociados a los mecanismos patogénicos del osteosarcoma en medicina humana, mientras que en medicina veterinaria los estudios son todavía escasos (6). Entre estos factores, se ha atribuido un papel emergente en algunos tumores a la expresión de la carioferina alfa2 (KPNA2), uno de los siete miembros de la familia de las alfa carioferinas. Su expresión alterada ya se ha descrito en diversas formas de cáncer, pero no existen datos específicos y detallados sobre su papel en los osteosarcomas primarios esqueléticos y extraesqueléticos en perros (7, 8). Lo mismo ocurre con RUNX2, un importante factor de transcripción para el desarrollo esquelético que está significativamente involucrado en la actividad de varios componentes de las células óseas, como los osteoblastos, las células mesenquimales multipotentes y los condrocitos (9). RUNX2 parece estar implicado en muchos procesos osteogénicos y condrogénicos a través de la modulación de la activación transcripcional y múltiples vías de señalización (10). Sin embargo, RUNX2 también se ha identificado como un cofactor potencial en los mecanismos biomoleculares y genéticos que caracterizan la tumorigénesis y la progresión neoplásica (11), a través de la modulación de los mecanismos relacionados con la angiogénesis, la metástasis, la proliferación, la derivación del cáncer y la resistencia a los fármacos (9, 10, 12). El propósito de este original trabajo de investigación es tratar de identificar nuevos aspectos biomoleculares e inmunohistoquímicos del osteosarcoma extraesquelético canino, centrándose en este caso en la expresión de los dos principales marcadores indicados, nunca considerados en medicina veterinaria para estas formas raras de tumores espontáneos de partes blandas.
Materiales y métodos
Selección de casos
Un total de 17 casos de osteosarcoma canino (13 extraesqueléticos y cuatro esqueléticos) fueron seleccionados retrospectivamente de los archivos del Departamento de Medicina Veterinaria de la Universidad de Perugia y del Istituto Zooprofilattico dell’Umbria e delle Marche (IZSUM) «Togo Rosati» – Laboratorio de Histopatología Veterinaria Comparada.
Los casos se incluyeron en este estudio de acuerdo con los siguientes criterios de inclusión.
– Diagnóstico histológico de osteosarcoma esquelético (SOS) u osteosarcoma extraesquelético (EOS).
– Tejido neoplásico disponible con un área >0,5 cm2.
– Tumores primarios. En el caso de la EOS, la presencia de tumores esqueléticos primarios debía descartarse mediante radiografías o TC.
Se excluyeron los casos si tenían artefactos de fijación o si estaban descalcificados con fines diagnósticos. Los cuatro SOS fueron seleccionados aleatoriamente como grupo control entre los casos que cumplían con los criterios de inclusión previamente informados.
Selección de anticuerpos
Los anticuerpos seleccionados para el estudio comparativo fueron RUNX2 (Santa Cruz, clon F-2) (13) y carioferina alfa-2 (7) (Santa Cruz, clon B-9).
Teniendo en cuenta que los anticuerpos específicos caninos contra RUNX2 y la carioferina alfa-2 no están disponibles comercialmente, seleccionamos anticuerpos para humanos, ratones o ratas. La selección se basó en los resultados de un análisis in silico. Se realizó un alineamiento de las secuencias de aminoácidos reportadas, teniendo en cuenta los residuos utilizados como dianas para diseñar los anticuerpos (www.uniprot.org) y así se seleccionó y probó el anticuerpo. Los tejidos control fueron osteosarcoma canino para RUNX2 y un testículo canino para carioferina alfa-2.
Inmunohistoquímica
En total, se cortaron secciones de 5 μm de cada bloque FFPE y se montaron en portaobjetos polarizados, que luego se desparafinaron y deshidrataron. La inmunohistoquímica se realizó en secciones seriadas con anticuerpos contra RUNX2 (recuperación de antígenos inducida por calor en tampón TRIS, pH 9,0; dilución 1:200) y carioferina alfa-2 (recuperación de antígenos inducida por calor en tampón TRIS, pH 9,0; dilución 1:150). La inmunohistoquímica se realizó siguiendo los protocolos estándar previamente informados (6). Los controles negativos se realizaron omitiendo los anticuerpos primarios e incubando los portaobjetos con PBS. RUNX2 también fue útil para confirmar el diagnóstico histológico (13). Un patólogo (PI) realizó una evaluación inmunohistoquímica a ciegas y evaluó la proporción de núcleos positivos dentro de la población neoplásica y le asignó un valor porcentual (0-100%).
Análisis estadístico
La normalidad se evaluó con una prueba de Shapiro-Wilk para todas las variables continuas. Se utilizó estadística descriptiva para describir los datos. Se utilizaron pruebas no paramétricas para probar las hipótesis. Se realizó la prueba U de Mann-Whitney para evaluar las diferencias entre los grupos. El análisis de correlación se realizó mediante la prueba de Spearman (ρ). La estadística descriptiva se realizó utilizando Microsoft Excel; otras pruebas estadísticas se realizaron con IBM SPSS (versión 21).
Resultados
Casos seleccionados
De los 13 casos de EOS seleccionados para este estudio, 10 estaban representados por perras (10/13; 76,9%), mientras que solo dos perros eran machos (15,4%). En un caso, el sexo del perro no se informó en nuestra base de datos y, por lo tanto, se desconocía. La edad media en el momento del diagnóstico histológico fue de 11,45 ± 2,3 años. En total, siete casos fueron EOS primarios de la glándula mamaria (53,8%), todos de hembras, mientras que cuatro EOS fueron intrabdominales, con diferentes orígenes (hepático, esplénico, vesical y uno con un origen intrabdominal, no relacionado con órganos). En el momento del diagnóstico histológico, los tumores tenían un diámetro mayor medio de 8,55 ± 6,34 cm. Los datos anamnésicos y el diámetro máximo de los tumores seleccionados para este estudio preliminar se presentan en la Tabla 1.
Inmunohistoquímica
La expresión de RUNX2 se observó como un fuerte inmunomarcaje del núcleo de las células neoplásicas. El porcentaje de núcleos positivos fue variable, con una media de 73,07 ± 5,36. Al aplicar a EOS, la puntuación sugerida para SOS por Barger et al. fue de 1, 2/13 (15,38%) obtuvo una puntuación de 2, 3/13 (23,1%) obtuvo una puntuación de 3, mientras que los ocho casos restantes (61,53%) obtuvieron una puntuación de 4. Del mismo modo, la expresión de carioferina alfa-2 se expresó en los núcleos de osteoblastos neoplásicos de EOS y SOS probados y también se observó a menudo en células neoplásicas durante la mitosis (Figura 1B). El porcentaje de núcleos positivos fue menor en EOS, en comparación con RUNX2 (36,15 ± 6,25), pero la intensidad del inmunomarcaje siempre fue fuerte. Las células gigantes multinucleadas ocasionalmente presentes entre las células osteoblásticas neoplásicas, e interpretadas como osteoclastos, fueron siempre negativas para RUNX2 (Figura 1A) y carioferina alfa 2. Asimismo, las células neoplásicas incrustadas en áreas de diferenciación condroblástica en EOS condroblástico fueron negativas para ambos marcadores (Figuras 1C, D). En general, RUNX2 mostró un mayor porcentaje de expresión de células neoplásicas positivas en comparación con la carioferina alfa 2 y la distribución de células carioferinas alfa 2 positivas se dispersó entre las otras células neoplásicas (Figuras 2A, B). La expresión de RUNX2 se observó con frecuencia en osteoblastos alrededor de áreas de depósito osteoide, en contraste con la carioferina alfa 2 (Figuras 2C, D), tanto en EOS como en SOS. No se observó correlación entre la expresión de los dos marcadores en las muestras analizadas (p > 0,05), ni hubo diferencia estadísticamente significativa en cuanto a la expresión cuantitativa de los dos marcadores evaluados entre los grupos EOS y SOS.
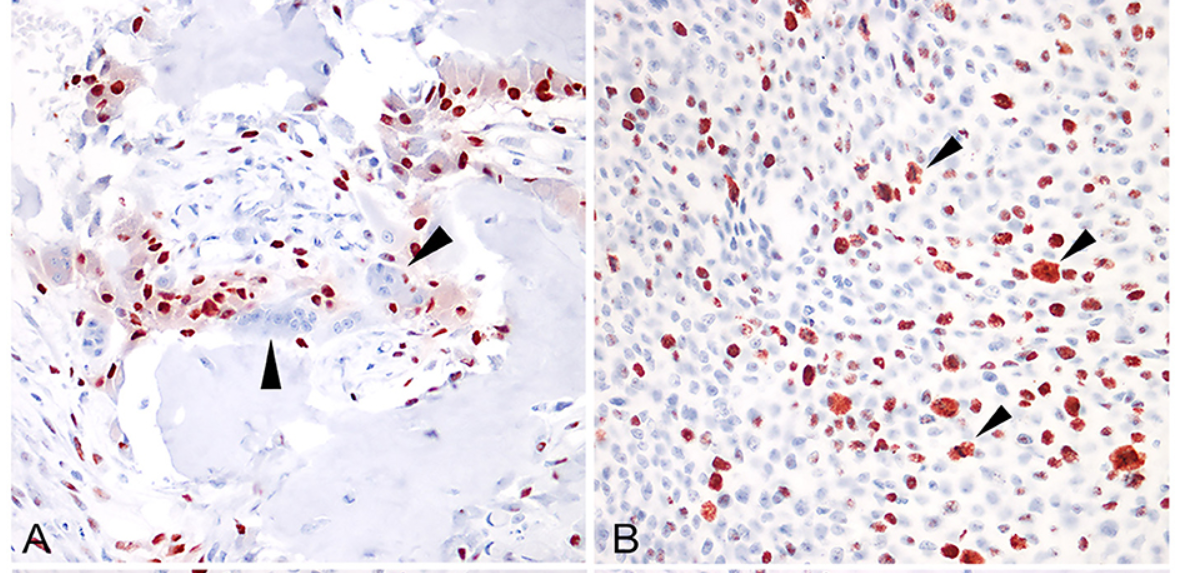
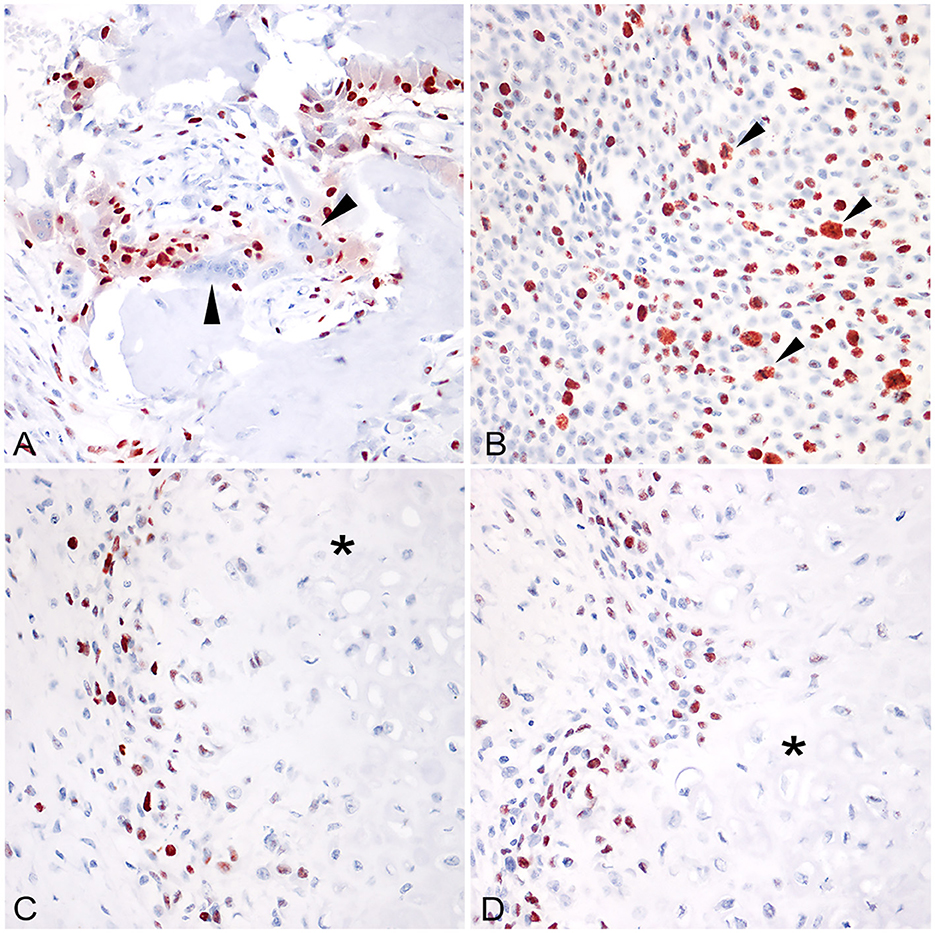 Figura 1. (A) Osteosarcoma osteoblástico extraesquelético (glándula mamaria), con abundante producción de osteoides. Los osteoclastos fueron invariablemente negativos para RUNX2 (puntas de flecha; 400x, HE); (B) Osteosarcoma fibroblástico esquelético (intrabdominal); La expresión nuclear de carioferina alfa2 suele mantenerse en células neoplásicas durante la mitosis (puntas de flecha; 400x; AEC y hematoxilina). (C) Osteosarcoma condroblástico extraesquelético (glándula mamaria), RUNX2 no se expresó en células incrustadas en áreas de diferenciación condroblástica (asterisco). (D) Osteosarcoma condroblástico extraesquelético (glándula mamaria), la carioferina alfa 2 no se expresó en células incrustadas en áreas de diferenciación condroblástica (asterisco).
Figura 1. (A) Osteosarcoma osteoblástico extraesquelético (glándula mamaria), con abundante producción de osteoides. Los osteoclastos fueron invariablemente negativos para RUNX2 (puntas de flecha; 400x, HE); (B) Osteosarcoma fibroblástico esquelético (intrabdominal); La expresión nuclear de carioferina alfa2 suele mantenerse en células neoplásicas durante la mitosis (puntas de flecha; 400x; AEC y hematoxilina). (C) Osteosarcoma condroblástico extraesquelético (glándula mamaria), RUNX2 no se expresó en células incrustadas en áreas de diferenciación condroblástica (asterisco). (D) Osteosarcoma condroblástico extraesquelético (glándula mamaria), la carioferina alfa 2 no se expresó en células incrustadas en áreas de diferenciación condroblástica (asterisco).
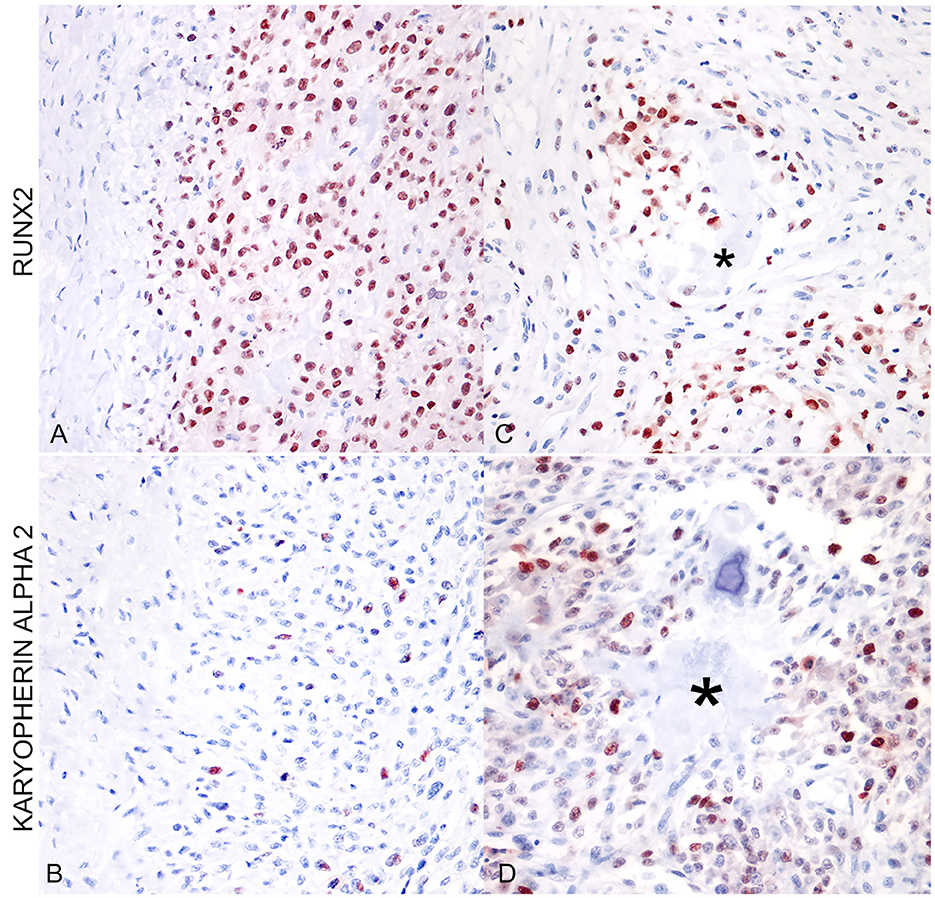 Figura 2. (A) Osteosarcoma osteoblástico extraesquelético (glándula mamaria). La inmunotinción para RUNX2 muestra un alto porcentaje de núcleos positivos (400x; AEC y hematoxilina). (B) Osteosarcoma osteoblástico extraesquelético (glándula mamaria). La misma área que en (A) muestra un menor porcentaje de núcleos positivos para carioferina alfa 2. (C) Osteosarcoma osteoblástico extraesquelético moderadamente productivo (glándula mamaria). Las células positivas para RUNX2 se localizaron con mayor frecuencia alrededor de las áreas de depósito osteoide (asterisco). (D) Osteosarcoma osteoblástico extraesquelético moderadamente productivo (glándula mamaria). La distribución de la carioferina alfa 2 es irregular y dispersa entre las células neoplásicas, no asociada con el depósito osteoide (asterisco).
Figura 2. (A) Osteosarcoma osteoblástico extraesquelético (glándula mamaria). La inmunotinción para RUNX2 muestra un alto porcentaje de núcleos positivos (400x; AEC y hematoxilina). (B) Osteosarcoma osteoblástico extraesquelético (glándula mamaria). La misma área que en (A) muestra un menor porcentaje de núcleos positivos para carioferina alfa 2. (C) Osteosarcoma osteoblástico extraesquelético moderadamente productivo (glándula mamaria). Las células positivas para RUNX2 se localizaron con mayor frecuencia alrededor de las áreas de depósito osteoide (asterisco). (D) Osteosarcoma osteoblástico extraesquelético moderadamente productivo (glándula mamaria). La distribución de la carioferina alfa 2 es irregular y dispersa entre las células neoplásicas, no asociada con el depósito osteoide (asterisco).
Discusión y conclusiones
Los interesantes resultados obtenidos en cuanto al aumento de la expresión celular de RUNX2 en células neoplásicas en comparación con la expresión más dispersa y dispersa de carioferina alfa2 nos llevaron a considerar estos aspectos también en función de la diferente inmunorreactividad celular. De hecho, los datos relativos a la inmunorreactividad RUNX2 más intensa de los osteoblastos en las zonas cercanas a los depósitos osteoides, en comparación con la de la carioferina alfa 2, animan fuertemente a una continuación más sofisticada del trabajo de investigación y a la comprensión de la naturaleza compleja y el comportamiento heterogéneo de todas las diferentes formas de osteosarcoma. Aunque el diagnóstico histológico y, en cierta medida, los aspectos clínicos y radiológicos siguen siendo los principios diagnósticos de los osteosarcomas, la inmunohistoquímica puede resultar a veces útil para definir el diagnóstico y los marcadores, ya que la carioferina alfa-2 y RUNX2 parecen representar herramientas diagnósticas adicionales para mejorar la especificidad y la sensibilidad en el diagnóstico del osteosarcoma, incluso cuando es extraesquelético (7, 14, 15). La carioferina alfa-2, resultó ser un marcador muy interesante para fines diagnósticos, ya que siempre se expresó de forma significativa en todos los osteosarcomas extraesqueléticos investigados. Estos datos concuerdan con los ya reportados en la literatura por Jiang et al. (7), quienes describieron una mayor positividad de KPNA2 en los casos de osteosarcoma humano en comparación con otros tumores óseos como el condrosarcoma, que a menudo se considera entre los diagnósticos diferenciales (8). En particular, nuestra investigación preliminar muestra que también en los osteosarcomas extraesqueléticos la expresión de RUNX2 y carioferina alfa-2 puede representar un apoyo diagnóstico específico para el diagnóstico definitivo del osteosarcoma, que a menudo se ve dificultado por un conjunto de factores que incluyen el frecuente grado de indiferenciación, la heterogeneidad de la atipia celular y la dificultad para encontrar elementos morfológicos que caractericen este tipo variable de tumor. incluso en sitios de inicio primario, como los sitios extraesqueléticos (5). El mismo razonamiento debe llevarse a cabo con los resultados obtenidos para RUNX2, un factor de transcripción de la familia RUNX responsable también de diversos procesos celulares, incluyendo la proliferación y diferenciación celular, la modulación de osteoblastos y la diferenciación de condrocitos con fases fundamentales en el desarrollo esquelético. Como también informan Barger et al. (13) en un interesante trabajo sobre osteosarcomas publicado en Veterinary Pathology, en ausencia de osteoide es muy difícil distinguir algunas formas de osteosarcoma de otros tumores óseos. Esto también se aplica a los osteosarcomas extraesqueléticos, que con frecuencia se originan principalmente en los tejidos blandos, especialmente los de la glándula mamaria, y se manifiestan como sarcomatas poco diferenciados, que son difíciles de clasificar debido a la ausencia de rasgos morfológicos característicos, como el osteoide. Estudios recientes, como el de Lin (10), también informan sobre el papel crítico de RUNX2 en la dinámica de progresión en diferentes tipos de tumores (16). Se ha informado de que RUNX2 puede participar en la modulación de varios procesos clave en la progresión del cáncer, incluyendo la transdiferenciación y el potencial de las células madre cancerosas, la angiogénesis, los mecanismos de proliferación y metástasis, y la posible resistencia a los fármacos (Figura 3). Estas observaciones experimentales sugieren un papel multifuncional de RUNX2 en la dinámica biológica del cáncer, aunque Wang et al. han planteado la hipótesis de un posible papel protector de RUNX2 en algunos cánceres (4). Es importante subrayar que muchas de estas variables asociadas con las posibles actividades biológicas de RUNX2 siguen siendo desconocidas y será necesario explorar mucho más con futuros estudios adicionales cada vez más específicos. Ciertamente, ya hemos puesto en marcha nuevos y próximos estudios de investigación de este tipo sobre una serie de EOS importantes y en asociación con otros marcadores que pueden estar implicados junto con RUNX2 y carioperina alfa 2 en los mecanismos etiopatogénicos tanto de EOS como de SOS.
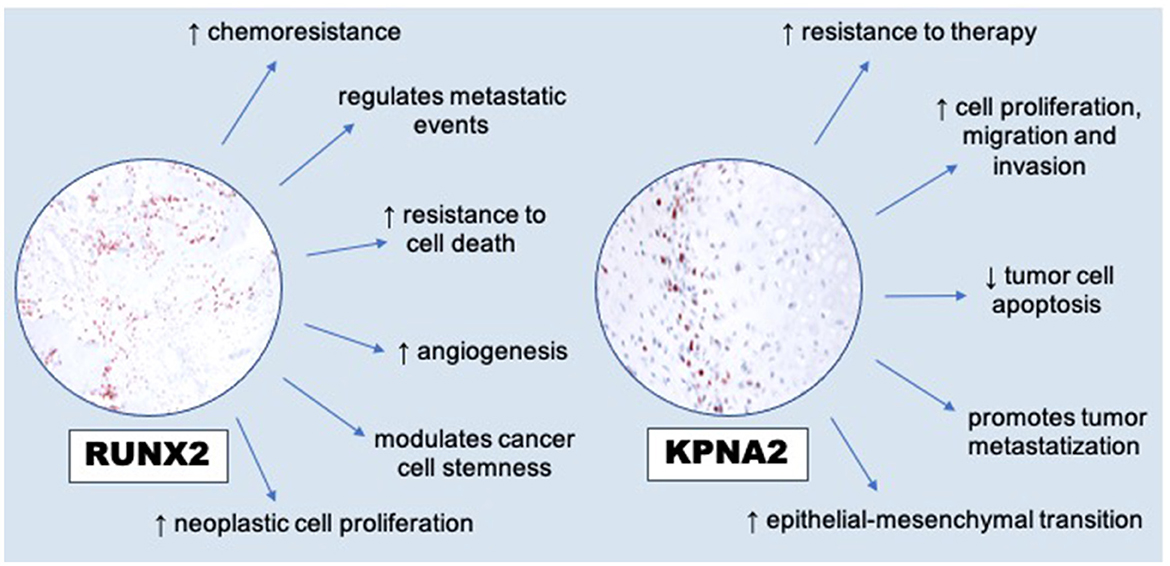 Figura 3. Modulaciones de RUNX2 a las características distintivas del cáncer [modificado de Lin (10)] y desregulación de KPNA2 (sobreexpresión) en la promoción de células cancerosas [modificado de Han y Wang (17)].
Figura 3. Modulaciones de RUNX2 a las características distintivas del cáncer [modificado de Lin (10)] y desregulación de KPNA2 (sobreexpresión) en la promoción de células cancerosas [modificado de Han y Wang (17)].
Declaración de disponibilidad de datos
Los datos brutos que respaldan las conclusiones de este artículo serán puestos a disposición por los autores, sin reservas indebidas.
Declaración ética
No se requirió aprobación ética para el estudio con animales de acuerdo con la legislación local y los requisitos institucionales, ya que aplicamos las investigaciones solo en tejidos de inclusión fija de nuestro banco de casos, previamente utilizados para investigaciones diagnósticas en la Universidad de Perugia.
Contribuciones de los autores
LL: Conceptualización, Obtención de fondos, Supervisión, Redacción – borrador original. EM: Conceptualización, Escritura – borrador original. AB: Conceptualización, Obtención de Fondos, Redacción – Revisión y Edición. IP: Conceptualización, Investigación, Escritura – borrador original.
Financiación
El/los autor/es declaran/n que no se recibió apoyo financiero para la investigación, autoría y/o publicación de este artículo.
Reconocimientos
La propiedad intelectual contó con el apoyo de la Fondazione Umberto Veronesi. Agradecemos el valioso trabajo técnico y operativo realizado por Valeria Migni y Luca Stefanelli, también asistidos por Sara Leto y Giampaolo Ceccarani, del Departamento de Medicina Veterinaria de la Universidad de Perugia, Italia.
Conflicto de intereses
Los autores declaran que la investigación se llevó a cabo en ausencia de relaciones comerciales o financieras que pudieran interpretarse como un posible conflicto de intereses.
Nota del editor
Todas las afirmaciones expresadas en este artículo son únicamente las de los autores y no representan necesariamente las de sus organizaciones afiliadas, ni las del editor, los editores y los revisores. Cualquier producto que pueda ser evaluado en este artículo, o afirmación que pueda ser hecha por su fabricante, no está garantizado ni respaldado por el editor.
Referencias
1. Leonardi L. Tumores óseos en animales domésticos: patología clínica comparada. Cham: Springer Nature Suiza (2022).
2. Simpson E, Brown L. Comprensión de los osteosarcomas. J Am Acad Asistencia Médica. (2018) 31:15–9. doi: 10.1097/01.JAA.0000541477.24116.8d
3. Slayter MV, Boosinger TR, Pool RR, Dämmrich K, Misdorp W, Larsen S. Clasificación histológica de tumores óseos y articulares de animales domésticos. Washington, DC: Instituto de Patología de las Fuerzas Armadas y Registro Americano de Patología y Centro Colaborador de la Organización Mundial de la Salud para la Oncología Comparativa (1994).
4. Wang L, Feng Y, Zhang C, Chen X, Huang H, Li W, et al. La regulación positiva de OGT por Calveolina-1 promueve la migración e invasión de células de carcinoma hepatocelular. Cell Biol Int. (2021) 45:2251–63. doi: 10.1002/cbin.11673
Resumen de PubMed | Texto completo de Crossref | Google Académico
5. Kim HS, Kim HJ, Hwang HJ, Ahn JH, Do SH. Inmunofenotipificación de un osteosarcoma extraesquelético de tipo mixto inusual en un perro. Veterinaria Sci. (2021) 8:307. doi: 10.3390/vetsci8120307
6. Porcellato I, Brachelente C, Cappelli K, Menchetti L, Silvestri S, Sforna M, et al. FoxP3, CTLA-4 e IDO en tumores melanocíticos caninos. Veterinario Pathol. (2021) 58:42–52. doi: 10.1177/0300985820960131
Resumen de PubMed | Texto completo de Crossref | Google Académico
7. Jiang L, Liu J, Wei Q, Wang Y. La expresión de KPNA2 es un marcador potencial para osteosarcomas diferenciales y otros tumores óseos malignos. Diagn Pathol. (2020) 15:135. doi: 10.1186/s13000-020-01051-6
Resumen de PubMed | Texto completo de Crossref | Google Académico
8. Xia S, Ma Y. IRF2 desestabiliza KPNA2 oncogénico para modular el desarrollo del osteosarcoma. J Oncol. (2022) 22:14. doi: 10.1155/2022/9973519
Resumen de PubMed | Texto completo de Crossref | Google Académico
9. Komori T. Mecanismo molecular del desarrollo óseo dependiente de Runx2. Células molares. (2020) 43:168–75. doi: 10.14348/molcells.2019.0244
Resumen de PubMed | Texto completo de Crossref | Google Académico
11. Guo Q, Ma J, Wu J. MiRNA-218 inhibe la proliferación, migración e invasión celular al dirigirse al factor de transcripción 2 relacionado con Runt (Runx2) en la línea de osteosarcoma humano. Regenerar Ther. (2021) 18:508–15. doi: 10.1016/j.reth.2021.11.003
Resumen de PubMed | Texto completo de Crossref | Google Académico
12. Otoukesh B, Baddouhi B, Moghtadaei M, Kaghazian P, Kaghazian M. Nuevos conocimientos moleculares y nuevas estrategias terapéuticas en el osteosarcoma. Células cancerosas Int. (2018) 18:158. doi: 10.1186/s12935-018-0654-4
Resumen de PubMed | Texto completo de Crossref | Google Académico
13. Barger A, Baker K, Driskell E, Sander W, Roady P, Berry M, et al. El uso de fosfatasa alcalina y runx2 para distinguir el osteosarcoma de otros tumores óseos primarios malignos comunes en perros. Veterinario Pathol. (2022) 59:427–32. doi: 10.1177/03009858221083035
Resumen de PubMed | Texto completo de Crossref | Google Académico
14. Rickel K, Fang F, Tao J. Genética molecular del osteosarcoma. Hueso. (2017) 102:69–79. doi: 10.1016/j.bone.2016.10.017
15. Serra M, Scotlandi K, Sollazzo M, Sarti M, Maurici D, Benini S, et al. Valor de la detección inmunohistoquímica de proteínas no colágenas del hueso para el diagnóstico de tumores óseos. Int J Oncol. (1996) 9:257–61. doi: 10.3892/ijo.9.2.257
16. Xie Y, Sun W, Deng Z, Zhu X, Hu C, Cai L. MiR-302b suprime la migración e invasión de células de osteosarcoma al dirigirse a Runx2. Sci Rep. (2017) 7:13388. doi: 10.1038/s41598-017-13353-9
Resumen de PubMed | Texto completo de Crossref | Google Académico
17. Han Y, Wang X. El papel emergente de KPNA2 en el cáncer. Ciencia de la vida. (2020) 241:117140. doi: 10.1016/j.lfs.2019.117140
Resumen de PubMed | Texto completo de Crossref | Google Académico
Palabras clave: canino, sarcoma de partes blandas, osteosarcoma extraesquelético, osteosarcoma esquelético, inmunohistoquímica, herramientas diagnósticas
Cita: Leonardi L, Manuali E, Bufalari A y Porcellato I (2024) Sarcomas caninos de tejidos blandos: la expresión de RUNX2 y carioferina alfa-2 en osteosarcomas extraesqueléticos (tejidos blandos) y esqueléticos. Frente. Vet. Sci. 11:1292852. doi: 10.3389/fvets.2024.1292852
Recibido: 12 de septiembre de 2023; Aceptado: 11 de enero de 2024;
Publicado: 01 Febrero 2024.
Editado por:
Valeria Grieco, Universidad de Milán, Italia
Revisado por:
Maja Cemazar, Instituto de Oncología de Liubliana, Eslovenia
Sante Roperto, Universidad de Nápoles Federico II, Italia
Derechos de autor © 2024 Leonardi, Manuali, Bufalari y Porcellato. Este es un artículo de acceso abierto distribuido bajo los términos de la Licencia Creative Commons Attribution License (CC BY).
*Correspondencia: Leonardo Leonardi, leonardo.leonardi@unipg.it
Renuncia: Todas las afirmaciones expresadas en este artículo son únicamente las de los autores y no representan necesariamente las de sus organizaciones afiliadas, ni las del editor, los editores y los revisores. Cualquier producto que pueda ser evaluado en este artículo o afirmación que pueda hacer su fabricante no está garantizado ni respaldado por el editor.
Date de alta y recibe nuestro 👉🏼 Diario Digital AXÓN INFORMAVET ONE HEALTH
Date de alta y recibe nuestro 👉🏼 Boletín Digital de Foro Agro Ganadero
Noticias animales de compañía
Noticias animales de producción
Trabajos técnicos animales de producción
Trabajos técnicos animales de compañía