Seroprevalencia de Mycobacterium avium subsp. paratuberculosis en rebaños lecheros
 Martina Ottardiç1
Martina Ottardiç1 Isabel Lechner2
Isabel Lechner2 Jessica Wang2
Jessica Wang2 Sarah Schmitt3
Sarah Schmitt3 Marianne Schneeberger3 años
Marianne Schneeberger3 años Robin Michael Schmid1
Robin Michael Schmid1 Roger Stephan3
Roger Stephan3 Mireille eylan1*
Mireille eylan1*- 1Clínica para Rumiantes, Facultad Vetsuisse, Universidad de Berna, Berna, Suiza
- número arábigoSAFOSO AG, Liebefeld, Suiza
- 3Instituto de Seguridad e Higiene de los Alimentos, Sección de Bacteriología Veterinaria, Facultad de Veterinaria, Universidad de Zúrich, Zúrich, Suiza
Introducción: La paratuberculosis bovina (PTB) es una enfermedad entérica crónica causada por Mycobacterium avium subsp. paratuberculosis (MAP). El control del PTB es importante dadas sus consecuencias económicas negativas y el posible papel zoonótico de la PAM en la enfermedad de Crohn en humanos.
Métodos: Para determinar la seroprevalencia de la PAM en los rebaños lecheros suizos e identificar los factores de riesgo asociados con el estado seropositivo del rebaño y la alta seroprevalencia dentro del rebaño, se analizaron 10.063 muestras de suero recogidas de bovinos de más de 12 meses de edad en 171 granjas lecheras suizas utilizando una prueba ELISA comercial. Se excluyeron ocho rebaños debido a resultados de ELISA no interpretables. Los factores de riesgo asociados con el estado seropositivo del rebaño y la alta seroprevalencia dentro del rebaño se investigaron con modelos de regresión utilizando los resultados de un cuestionario sobre prácticas de manejo posiblemente asociadas con la introducción o propagación de PAM en los 163 rebaños restantes. Se realizó una regresión logística univariable, llevando adelante para el análisis de regresión multivariable cuando p < 0,2.
Resultados: La seroprevalencia verdadera calculada entre rebaños fue de 3,6 % (IC 95 %, 0,96–8,4 %). Debido a la baja seroprevalencia dentro del rebaño, no fue posible calcular la verdadera seroprevalencia a nivel animal; La seroprevalencia aparente dentro del rebaño osciló entre el 2,3 y el 5,5%, con una mediana del 3,6% en nueve granjas positivas. El tamaño del rebaño (p = 0,037) y el pastoreo común de vacas lactantes con vacas de otros rebaños (p = 0,014) se asociaron con el estado seropositivo del rebaño, mientras que las novillas que compartían pastos alpinos con ganado lechero de otros rebaños se asociaron con una menor probabilidad de que el rebaño diera seropositividad (p = 0,042). No fue posible identificar de forma fiable los factores de riesgo significativos asociados a la propagación de la PAM y a la alta seroprevalencia de TBP en los rebaños seropositivos debido a la baja seroprevalencia observada en los rebaños y a la baja sensibilidad de la prueba ELISA.
Discusión: Estos resultados ponen de manifiesto la limitación de la serología para el diagnóstico de PAM en rebaños pequeños con baja prevalencia de infección.
1 Introducción
La paratuberculosis (PTB) es una infección intestinal crónica mortal causada por Mycobacterium avium subsp. paratuberculosis (MAP), que afecta principalmente a rumiantes domésticos y salvajes como el ciervo rojo, pero también a otros animales salvajes, como conejos, zorros y tejones (1-4). También conocida como enfermedad de Johne (EJ), la TBP se caracteriza por un largo período de incubación durante el cual los animales pueden permanecer infectados subclínicamente durante años (5). Los signos clínicos cardinales, pérdida de peso y diarrea acuosa, se desarrollan en una etapa tardía de la infección; Finalmente, la enfermedad provoca la muerte de los animales afectados. Los animales jóvenes menores de 6 meses de edad corren el mayor riesgo de infectarse en los rebaños con TBP (6). Notificada por primera vez en Alemania a finales del siglo XIX, la PTB está ahora ampliamente distribuida en todo el mundo y se considera una enfermedad importante debido a sus múltiples impactos negativos en la economía y el bienestar animal (5, 7-9).
La compra intensiva de animales, especialmente de múltiples rebaños de origen, es un factor de riesgo importante asociado con la introducción de PAM en los rebaños bovinos (10-13). El contacto con heces de animales infectados también es un factor de riesgo potencial para la introducción de la enfermedad, y el tamaño del rebaño también es un factor de riesgo reconocido asociado con un estado positivo del rebaño (14, 15). La transmisión de la PAM dentro del rebaño se asocia principalmente con el contacto de los terneros con las heces de las vacas adultas (16), por lo que la transmisión a los terneros jóvenes se produce principalmente por la ingestión de leche o piensos contaminados con materia fecal de animales infectados (5). Además de la contaminación indirecta del calostro y la leche a través de la materia fecal, la PAM también puede ser secretada directamente por la glándula mamaria de las vacas infectadas, especialmente en las últimas etapas de la enfermedad (17-19). También se ha descrito infección intrauterina, particularmente en vacas con EJ clínica (20). El manejo del área de parto y el contacto de los terneros recién nacidos con sus madres son puntos importantes en el control de la transmisión dentro del rebaño (21, 22).
Se ha sospechado que Mycobacterium avium subsp. paratuberculosis representa un riesgo zoonótico como agente desencadenante de la enfermedad de Crohn (EC), una enfermedad inflamatoria intestinal crónica humana (23-29). Dado que la PAM puede secretarse directamente en la leche de las vacas infectadas (18), una posible vía de transmisión a los seres humanos podría ser a través del consumo de leche y productos lácteos (30). En muchos países, la leche de vaca generalmente se pasteuriza antes de su consumo, sin embargo, se ha demostrado que el PAM puede sobrevivir a la pasteurización comercial (31, 32). La comprensión insuficiente del potencial zoonótico de la MAP y de su papel en el desarrollo de enfermedades humanas dificulta una evaluación bien fundamentada de la magnitud de su impacto en la salud pública (33, 34).
Las pérdidas económicas debidas al PTB se atribuyen principalmente a la reducción de la producción de leche, a los costes de reposición de los animales y a la disminución del valor del sacrificio (9, 35-39). En Suiza, se ha calculado recientemente una pérdida económica anual de aproximadamente 4,6 millones de francos suizos debido a la reducción de la producción de leche para una población de 559.900 vacas lecheras (40). Se considera que el hecho de que el PTB pueda propagarse a través del movimiento de animales infectados subclínicamente que contaminan su nuevo entorno, por ejemplo, después de la compra en un nuevo rebaño, ha contribuido a la diseminación de la EJ (por ejemplo, animales infectados de origen europeo continental sospechosos de ser una fuente de AJ en Irlanda) y, por lo tanto, tiene graves implicaciones para el comercio de animales (9, 13, 41–44).
Aunque numerosos países cuentan con programas formales de control de la PTB, en su mayoría voluntarios, basados en estrategias de pruebas y sacrificio (9, 45, 46), estos programas tienen en su mayoría un éxito limitado debido al largo período de incubación y a la baja eficacia de los métodos de diagnóstico para identificar a los animales infectados durante la fase subclínica de la enfermedad (41, 47, 48). La sensibilidad (Se) de las diferentes pruebas diagnósticas varía considerablemente, oscilando, por ejemplo, entre el 7 y el 94% para los ensayos de inmunoabsorción enzimática (ELISA) séricos, del 29 al 61% para el ELISA de la leche, y del 23 al 74% para el cultivo fecal (FC), sin embargo, las variaciones en el diseño del estudio y los métodos diagnósticos utilizados hacen casi imposible la comparación de diferentes resultados (49, 50). La demora de varios años entre el momento de la infección y la diseminación detectable de PAM o la reacción inmunitaria significa que es probable que la misma prueba funcione mejor cuando se usa para animales con JD clínica que para animales en la etapa subclínica de la infección, por ejemplo, se encontró que la Se de un ELISA sérico era del 87% en vacas con PTB clínico y solo del 15% en animales infectados subclínicamente (51-53). Asimismo, el ELISA sérico mostró un mayor Se en animales con una carga bacteriana pesada (>50 unidades formadoras de colonias (UFC) por tubo; Se = 75%) en comparación con los de baja desprendimiento (<10 UFC/tubo; Se = 15%) (54). Si bien la CF permite detectar a los animales infectados en una etapa más temprana del curso de la enfermedad que otros métodos, requiere largos tiempos de incubación (hasta 16 semanas) hasta que se dispone de un resultado definitivo (5, 52), y solo puede detectar animales excretando el organismo, lo que da como resultado un resultado falso negativo en animales infectados que aún no han comenzado a eliminar la bacteria (55). Además, el intenso trabajo de laboratorio y la experiencia requerida para el cultivo están asociados con altos costos. Por el contrario, los métodos de PCR son más rápidos, más fáciles y más baratos, pero se ha demostrado que pueden tener un Se claramente más bajo para la detección de MAP que el FC (56). Por lo tanto, a pesar de la desventaja de la SE limitada, las pruebas serológicas rápidas y poco costosas todavía se utilizan comúnmente para determinar la prevalencia de la infección por MAP a nivel de rebaño (49).
Se han realizado numerosos estudios en todo el mundo para estimar la prevalencia de TBP en bovinos (9, 15, 46, 57, 58). Se consideró que más del 20% de los rebaños estaban infectados con MAP en aproximadamente la mitad de los 48 países de todo el mundo para los que se disponía de datos (9). La enfermedad ha sido clasificada recientemente como enzoótica en 27 países europeos (incluida Suiza), es decir, «países en los que la enfermedad estaba presente y para los que todos los períodos de ausencia fueron inferiores a 2 años» (46). Las estimaciones de prevalencia han sido generalmente más altas para el ganado lechero que para el ganado vacuno de carne (7). En América del Norte, un estudio realizado en los 17 principales estados lecheros de EE.UU. en 2007 indicó que el 68,1% de los rebaños tenían al menos una vaca que dio positivo en FC (59). En Europa, se informó que la seroprevalencia aparente entre rebaños en el ganado oscilaba entre el 38 y el 68% (60). Sin embargo, los estudios de prevalencia disponibles son heterogéneos y es difícil comparar sus resultados debido a las diferencias en el diseño del muestreo, las estrategias diagnósticas y las definiciones de casos (41). En muchas regiones del mundo, la prevalencia del TBP sigue siendo completamente desconocida (45).
En Suiza, donde el TBP es una enfermedad de declaración obligatoria, se han notificado aproximadamente 60 casos bovinos al año en los últimos 3 años (61), sin embargo, dada la larga fase subclínica de la infección y los signos clínicos inespecíficos, el TBP puede ser más común, pero los animales afectados se sacrifican sin confirmación diagnóstica. También se dispone de datos escasos de prevalencia a nivel de rebaño y animal de estudios anteriores (62-66), pero no se dispone de información actual sobre la prevalencia real de TBP en los rebaños lecheros suizos, a pesar de la importancia de la industria láctea en Suiza. El objetivo del presente estudio fue determinar la seroprevalencia de TBP entre rebaños y dentro de rebaños en un subconjunto representativo de rebaños lecheros suizos. Se utilizó un método de ELISA sérico para permitir la inclusión de un gran número de animales y rebaños. Además, se recopiló información sobre los rebaños con el fin de investigar los factores de riesgo asociados con el estado positivo del rebaño y la seroprevalencia dentro de los rebaños positivos.
2 Materiales y métodos
2.1 Diseño del estudio
Se reclutaron granjas para un estudio observacional de seroprevalencia y un análisis de factores de riesgo sobre el TBP en un subconjunto representativo de la población lechera suiza.
2.2 Tamaño de la muestra
El número de rebaños y animales a muestrear se calculó en un procedimiento de dos pasos utilizando Epitools® (67), basado en los datos disponibles de estudios previos en Suiza (62, 64, 68, 69). En primer lugar, se determinó el tamaño de la muestra para evaluar la prevalencia dentro del rebaño, por lo que se estableció como objetivo un Se y Sp mínimo de ≥95% para la determinación del estado del rebaño. Para el cálculo se asumió una prevalencia dentro del rebaño del 20% y una mediana de 30 animales ≥1 año de edad. Las pruebas diagnósticas Se y Sp fueron de 58,2 y 99,0%, según las características de una prueba ELISA aprobada (IDEXX Paratuberculosis Screening Ab Test, IDEXX Montpellier SAS, Montpellier, Francia) por el Instituto Friedrich-Loeffler (70). En segundo lugar, se determinó el tamaño de la muestra para evaluar la prevalencia entre rebaños, asumiendo una prevalencia entre rebaños del 20% y utilizando el objetivo Se y Sp de los cálculos dentro del rebaño. Esto dio como resultado un tamaño de muestra objetivo de 300 rebaños (nivel de confianza del 95%, precisión del 5%).
2.3 Población de estudio: granjas y animales
El «tamaño del rebaño» se definió como el número de vacas lecheras (en lactancia y vacas secas), y el «número de animales» se utilizó para describir el total de animales probados, incluidas las vaquillonas desde los 12 meses hasta los 2 años de edad a lo largo del manuscrito. Los criterios de inclusión para las granjas fueron un tamaño de rebaño de al menos 25 vacas lecheras (con el fin de alcanzar los 30 animales probados calculados al incluir vacas y novillas de más de 12 meses) y la pertenencia a al menos una de las principales asociaciones suizas de cría lechera: Holstein, Braunvieh y Swissherdbook, que representaron alrededor del 88% de las vacas lecheras registradas en Suiza en 2022 (71-73). Las novillas entre la edad de 12 y 24 meses se incluyeron en la población de estudio en base a los resultados de un estudio suizo previo (66) en el que se había encontrado que el 3,9% de las novillas en esta categoría de edad estaban excretando MAP (cultivo fecal positivo), en 6 de los 13 rebaños participantes. Los participantes para el estudio fueron reclutados a través de un correo electrónico enviado por las asociaciones de criadores. El correo electrónico incluía un documento que describía el proyecto y un enlace para la inscripción en línea a través de un breve cuestionario (plataforma SurveyMonkey, Momentive Global Inc., Delaware St, San Mateo, EE. UU.). El cuestionario, disponible en alemán, francés e italiano, constaba de 19 preguntas, las cinco primeras sobre los datos de contacto de los ganaderos y el número de identificación de la granja (en la base de datos suiza de movimientos de animales, TVD), y las restantes sobre la gestión de la granja y los animales (tipo de producción, número medio de animales, raza principal, uso de pastos alpinos y si los animales jóvenes iban a las instalaciones de cría de novillas). Los ganaderos que respondieron dieron su consentimiento informado por escrito para el acceso a los datos individuales de las vacas (identificación de la vaca, fecha de nacimiento, última fecha de parto) por parte del equipo del estudio, así como al número de miembro de la granja en una (o más) asociaciones de cría para obtener información sobre la producción y la calidad de la leche, así como sobre los parámetros de reproducción. El correo electrónico se envió a aproximadamente 11.000 posibles participantes que cumplían con los criterios de inclusión en todas las regiones de Suiza. La encuesta permaneció abierta durante 3 meses, desde el 19 de julio de 2021 hasta el 21 de septiembre de 2021. El estudio fue aprobado por las autoridades veterinarias competentes (número de autorización de experimentación animal BE 32-2021).
2.4 Muestreo
Se contactó por teléfono con cada agricultor que se había inscrito en el estudio a través del cuestionario en línea para confirmar su voluntad de participar en el estudio y concertar una cita para una visita a la explotación. Las visitas a las fincas se realizaron entre noviembre de 2021 y octubre de 2022, cada granja se visitó una vez. Los ganaderos que informaron haber enviado animales (en su mayoría jóvenes) a pastos alpinos durante el verano fueron visitados durante el período invernal para tener acceso a todos los animales analizables. Se incluyeron en el estudio todas las vacas (en lactancia y secas) y novillas mayores de 12 meses y menores de 2 años. Las muestras de sangre se recogieron de la vena coxígea utilizando Serum Monovettes® (9 mL Z, SARSTEDT AG & Co. KG, Nümbrecht, Alemania). Las muestras se transportaron en un recipiente refrigerado a 1 °C a la Facultad Vetsuisse de Berna, donde se centrifugaron (2.123 g, 10 min) y el suero se separó en un plazo máximo de 12 h desde la recolección. El suero se transfirió a microtubos de® 2 ml (SARSTEDT AG & Co. KG, Nümbrecht, Alemania) y se congeló a -20 °C. Las muestras de suero congeladas se transportaron a intervalos mensuales al Instituto de Bacteriología Veterinaria de la Universidad de Zúrich para su análisis.
2.5 Análisis serológico
Los sueros congelados se descongelaron y se analizaron con la prueba comercial ELISA ID Screen Paratuberculosis Indirect Screening Test [IDvet, Grabels, Francia; Se 58.2%, Sp 99.3% (70)] de acuerdo con las instrucciones del fabricante. Los sueros se probaron por duplicado y las densidades ópticas (OD) se registraron a 450 nm. Los resultados se interpretaron de acuerdo con las instrucciones del fabricante (mayor o igual al 70% se consideró positivo, menor o igual al 60% se consideró negativo y mayor al 60% y menos del 70% se consideró dudoso).
2.6 Cuestionario de explotación
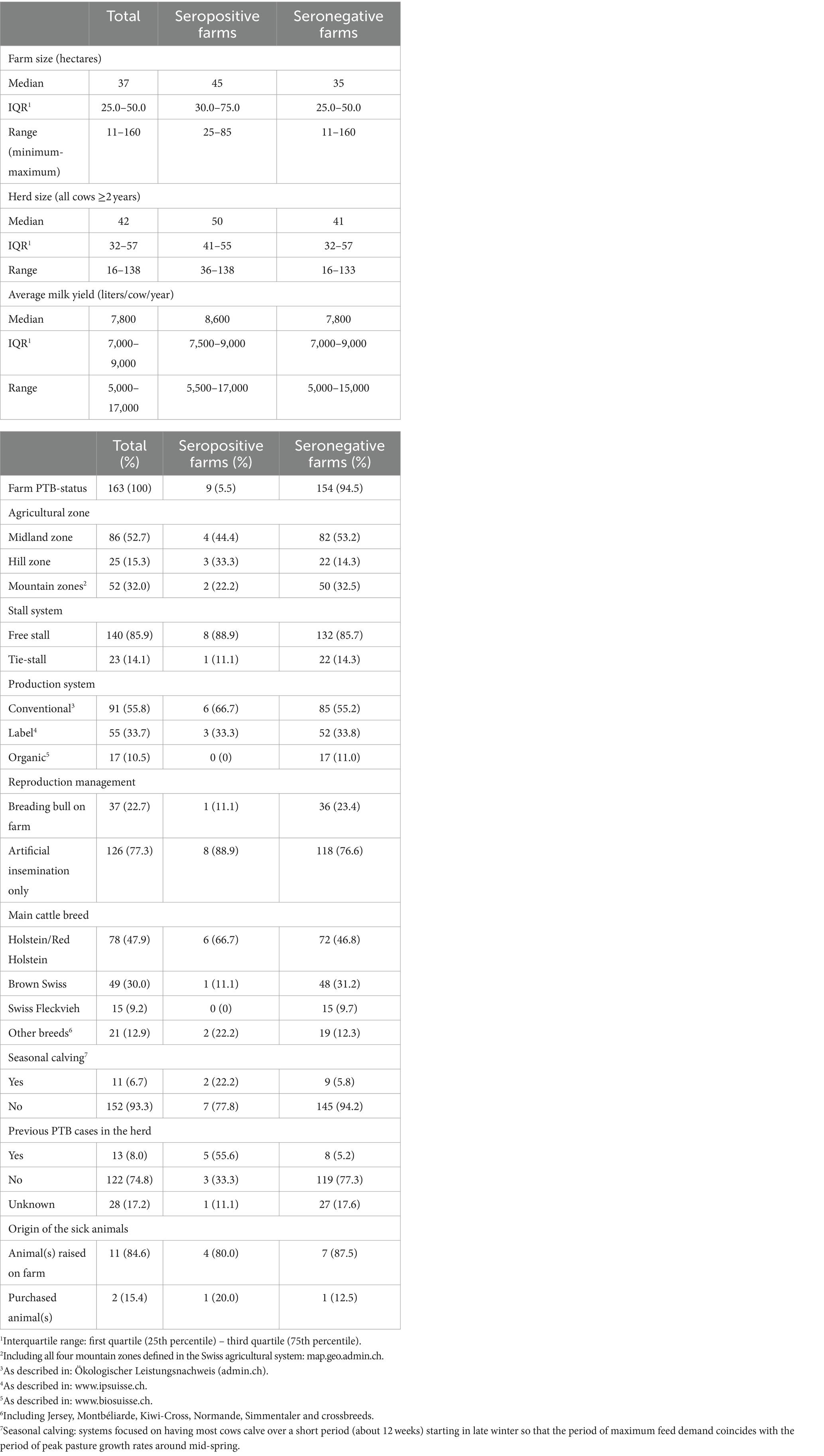
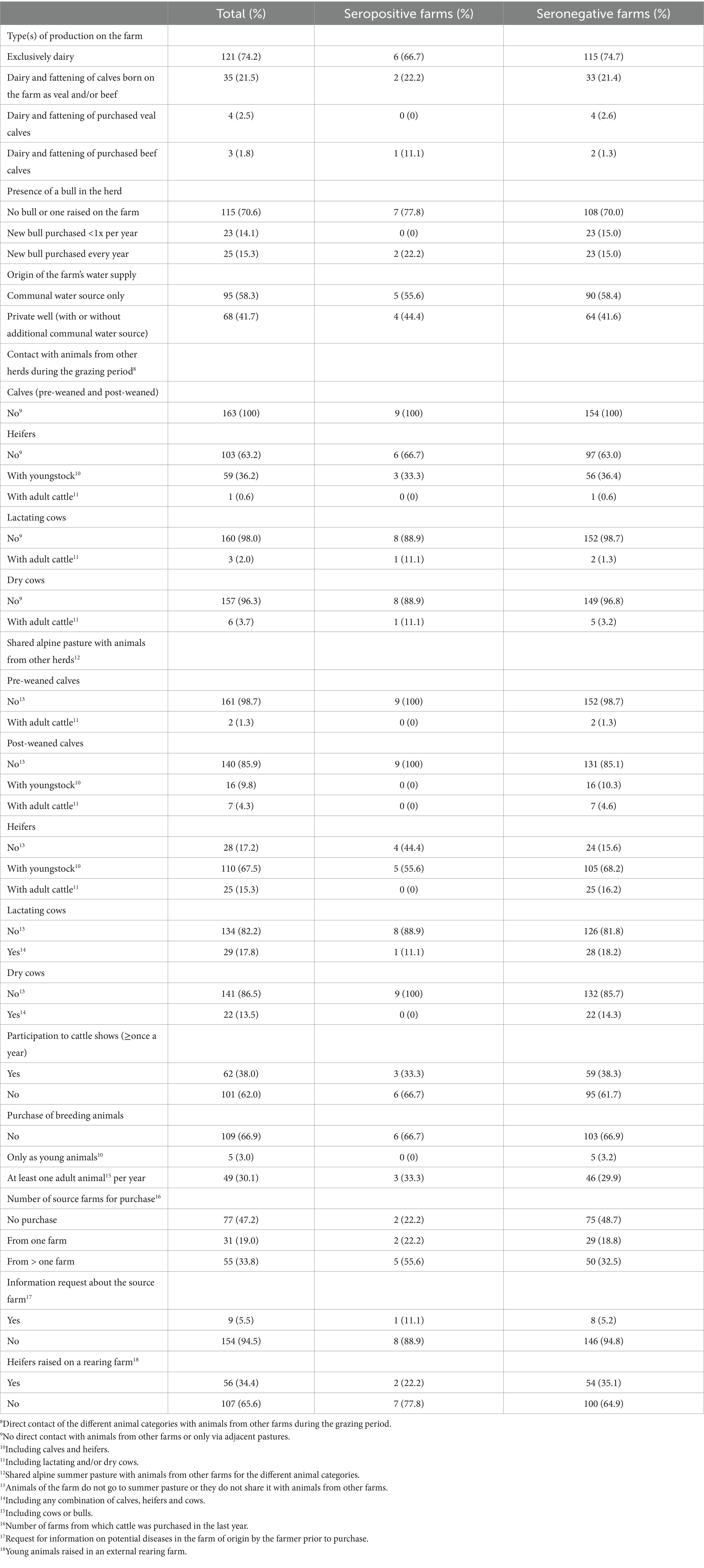
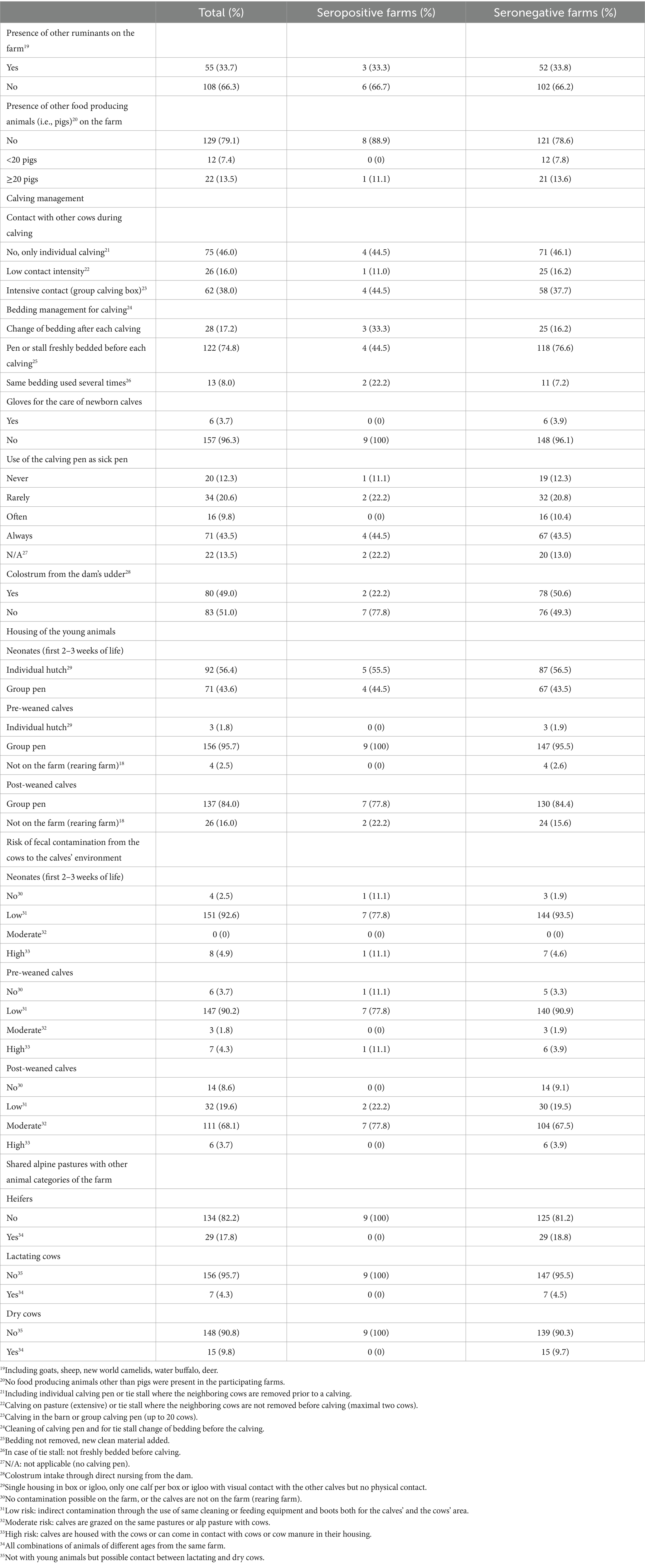
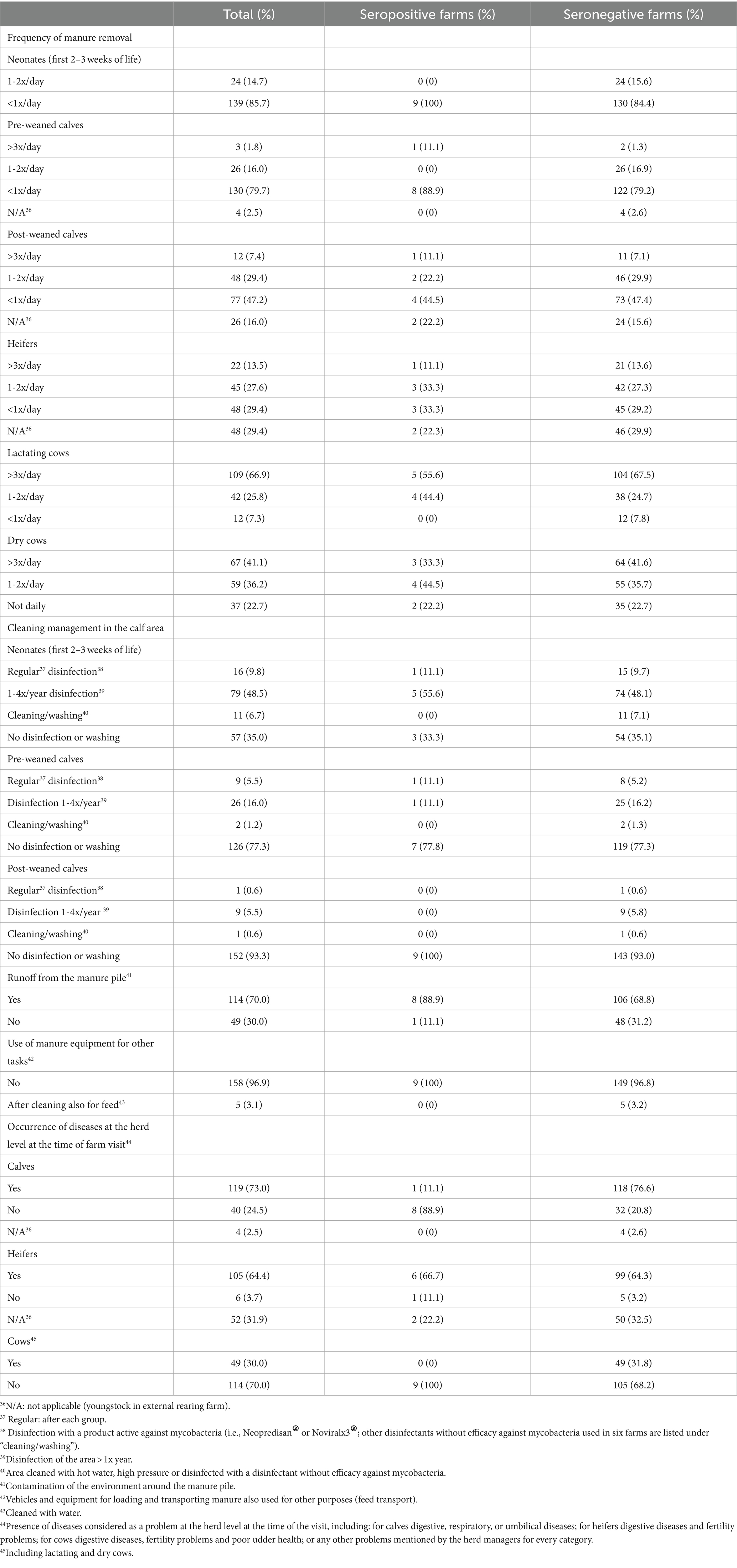
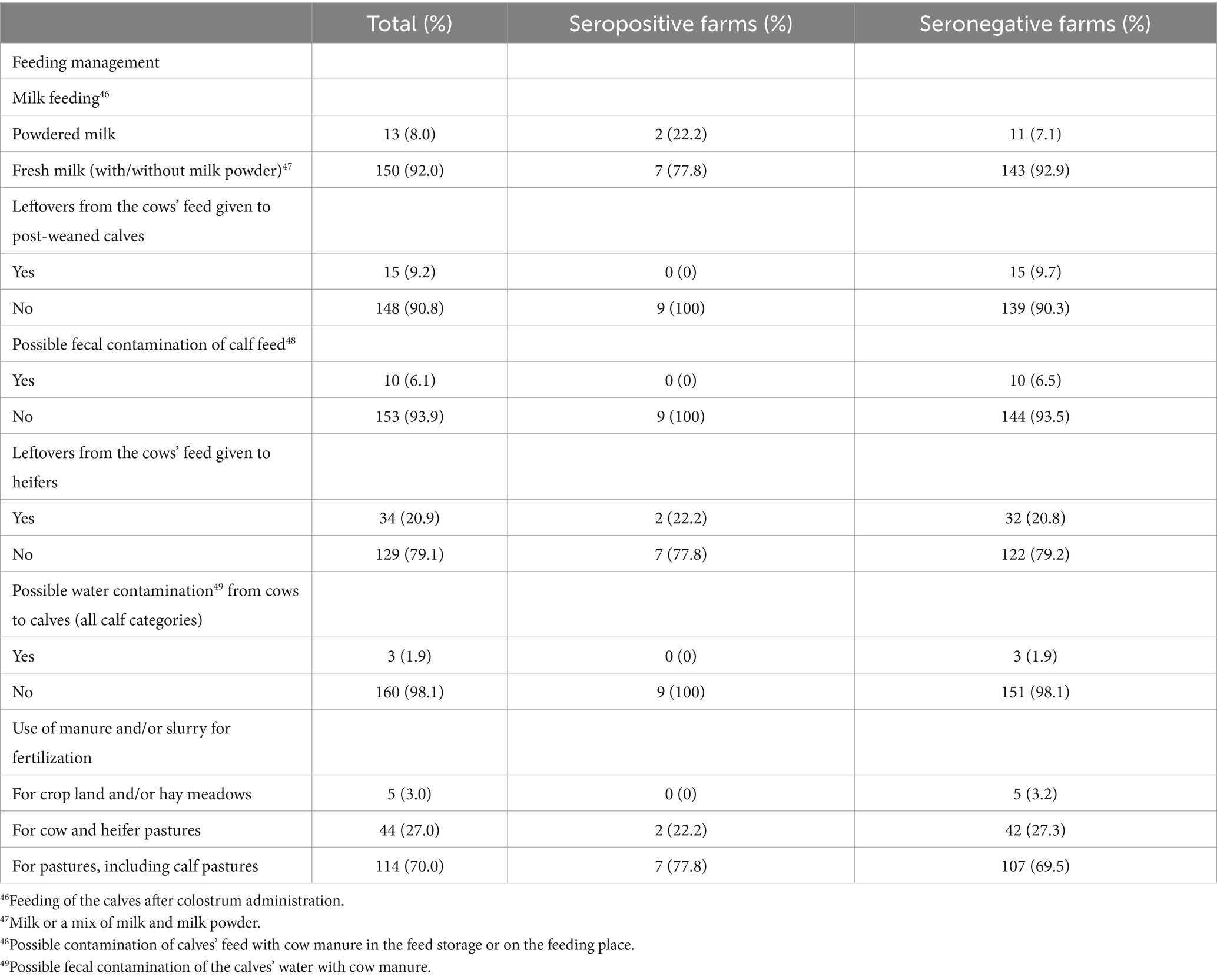
El cuestionario para evaluar los factores de riesgo para la introducción y propagación de MAP en las granjas se desarrolló en Microsoft Access 2016 (Microsoft Corporation, Redmond, Washington, EE. UU.). Las preguntas se basaron en cuestionarios utilizados en estudios previos (13, 16, 48, 66, 74-78), el cuestionario fue validado con 3 agricultores antes de su uso en el marco del estudio. El cuestionario se rellenó al final de la visita a la granja, después de la toma de muestras de sangre, durante una entrevista personal con el administrador de la granja. Si el gerente no estaba presente en ese momento, la entrevista se hacía más tarde por teléfono. Con el cuestionario se recopiló información sobre la demografía y el manejo de las granjas (Tabla 1), así como información sobre 10 temas principales, incluyendo el área de partos, el alojamiento, el manejo de la alimentación, el manejo del estiércol y los purines, el uso de pastos y/o pastos alpinos, el comercio de animales, el conocimiento de PTB, los casos previos de la enfermedad y una última sección sobre higiene (Tablas 2-5). Los animales de la granja se asignaron a 6 categorías de acuerdo con su edad (neonatos en las primeras 2-3 semanas de vida (alojados en conejeras individuales o grupos pequeños), terneros mayores (pre-destetados) hasta el destete, terneros post-destetados hasta 1 año de edad, novillas reproductoras desde aproximadamente 1 año hasta el parto, vacas lactantes y vacas secas) de acuerdo con el manual para las Evaluaciones de Riesgos y Planes de Manejo para la Enfermedad de Johne del Grupo Nacional de Trabajo de Johne’s (41). Las secciones del cuestionario sobre alojamiento, alimentación, pastos y pastos alpinos se registraron para cada grupo de edad por separado.
2.7 Gestión de datos y análisis estadísticos
Los datos del cuestionario de evaluación de riesgos se registraron en un archivo de Microsoft Excel (Microsoft Corporation, Redmond, Washington, EE.UU.). Otros datos sobre la producción de las granjas facilitados por las asociaciones de cría incluían informes anuales de producción de las explotaciones, pesaje mensual individual de la leche y datos de lactancia estándar, así como las fechas de inseminación y parto de las vacas. Los datos individuales de las vacas fueron proporcionados directamente por los participantes en forma de archivos de Microsoft Excel u obtenidos a través del mostrador suizo en línea para la agricultura (79). Los rebaños participantes se clasificaron como positivos o negativos para PTB en función de los resultados de ELISA. Dado que se incluyeron granjas de diferentes tamaños, el punto de corte para un estado de rebaño seropositivo se ajustó de modo que tanto Se como Sp se mantuvieran por encima del 95%: un animal serológicamente positivo definió el rebaño como seropositivo si el tamaño del rebaño (número de animales de 2 años o más, es decir, vacas en lactancia y vacas secas) era de 38 o menos, dos positivos para 39-81 animales, y tres para 85-138 animales. El número de reactores se evaluó con la Calculadora de Sensibilidad/Especificidad del Rebaño del Colegio Rural de Escocia [SRUC (80)]. Además de la seroprevalencia aparente, se calculó la seroprevalencia real que tiene en cuenta las características de las pruebas diagnósticas, para la prevalencia dentro del rebaño utilizando las características de la prueba diagnóstica y para la prevalencia entre rebaños utilizando la mediana de los valores de Se y Sp en todos los rebaños; estos cálculos se realizaron con Epitools® (67).
Se realizó un análisis de factores de riesgo para identificar posibles asociaciones de los factores de manejo con el estado seropositivo del rebaño, así como con la prevalencia dentro del rebaño en los rebaños infectados. Para la identificación de posibles asociaciones de factores de manejo con un estado seropositivo del rebaño, se evaluaron los factores posiblemente asociados con la introducción de PAM en los rebaños lecheros (Tabla 2). Para el análisis de los factores de riesgo, teniendo en cuenta la prevalencia dentro del rebaño, se consideraron los factores de riesgo que influyen en la propagación de la PAM dentro de los rebaños infectados (Tablas 3-5). Dado que los animales jóvenes de algunos rebaños se criaron en granjas de cría externas, y debido a las diferencias debidas a los tipos de establos (establo libre vs. establo de amarre), faltaban algunas respuestas a las preguntas sobre los animales jóvenes y el manejo de los partos. Para minimizar los datos faltantes, algunas de las variables del cuestionario original y sus categorías se agruparon para su análisis (véanse las Tablas Suplementarias S1 y S2). Los datos de los factores de riesgo posiblemente asociados con un estado seropositivo del rebaño se analizaron en dos categorías (Tabla suplementaria S1).
Los análisis estadísticos se realizaron con el software R, versión 4.2.3 (R Core Team 2023). Antes de realizar los análisis principales, se logaritmos el número de vacas, que se utilizó como indicador del tamaño del rebaño. Además, se aplicaron pruebas de correlación por pares a las variables de respuesta para evitar la multicolinealidad y el sobreajuste del modelo. Se realizó la matriz de correlación de rangos de Spearman y cualquier par de variables con un coeficiente de correlación (|r|) mayor que 0.8 se consideró altamente correlacionado (81). Sin embargo, ninguna variable fue colineal y, por lo tanto, todas las variables de respuesta se conservaron para su posterior análisis. Para ambos conjuntos de datos, se realizó una regresión logística univariable, continuando con el análisis de regresión multivariable cuando p < 0,2. En cuanto al análisis de regresión multivariable, se eliminaron variables si el modelo construido presentaba el criterio de información de Akaike (AIC) más bajo después de utilizar el método de eliminación escalonada, con el objetivo de lograr el modelo más parsimonioso. Los modelos de regresión multivariable establecieron un punto de corte de significación de p < 0,05. Para el primer análisis del modelo, las variables de respuesta fueron granjas seropositivas para PTB de acuerdo con la definición dada anteriormente. Después de seleccionar el modelo más parsimonioso en el modelo multivariable, se evaluaron las interacciones entre las variables de respuesta. Para el segundo modelo, la variable de respuesta fue la prevalencia de seropositividad para PTB (número de casos seropositivos/número de animales analizados *100) en cada rebaño. Por último, todos los modelos resultantes fueron inspeccionados visualmente para comprobar su homocedasticidad y normalidad.
3 Resultados
3.1 Población de estudio: granjas y animales
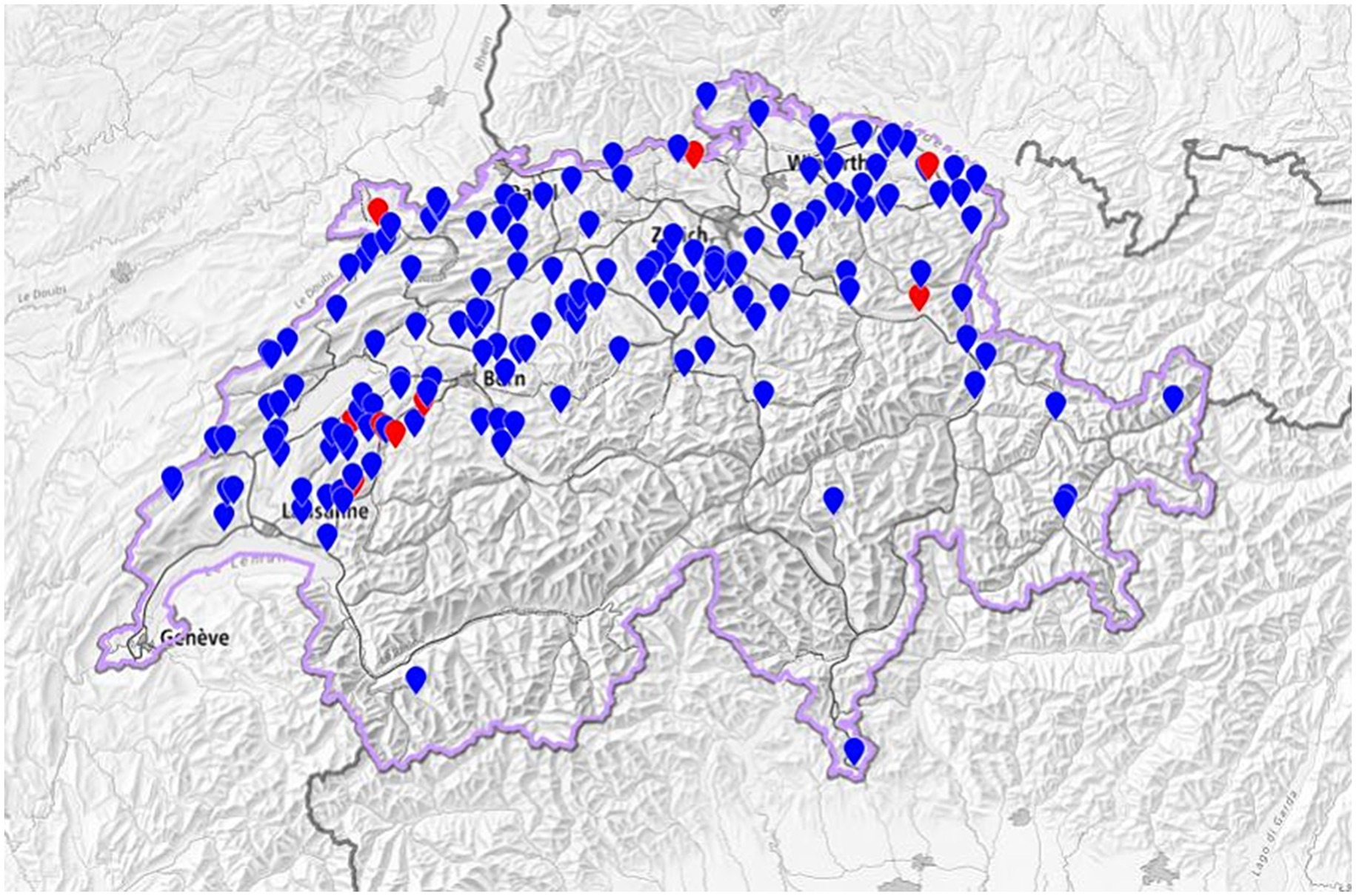
Se recogieron muestras de suero en 171 granjas lecheras distribuidas en los 26 cantones de Suiza, excepto en Appenzell Rodas Interiores, Basilea-Ciudad, Ginebra y Obwalden. La mediana del tamaño del rebaño fue de 42 vacas lecheras de 2 años o más (RIC: 32-57), siendo Holstein la raza predominante (en el 47,9% de todas las granjas, el 66,7% de las granjas positivas y el 54,9% de los animales seropositivos). Un total de 10.063 animales (7.943 vacas, 2.091 novillas y 29 toros) fueron sometidos a pruebas de anticuerpos contra MAP, el número de animales analizados por rebaño osciló entre 22 y 199, con una mediana de 8 novillas de entre 1 y 2 años y 42 vacas de 2 años o más. Previamente se había notificado un caso de TBP en 13 explotaciones (8%). La participación en el estudio fue voluntaria y resultó imposible reclutar 300 granjas con un mínimo de 30 animales para realizar pruebas. Por lo tanto, también se incluyeron en el estudio granjas un poco más pequeñas con un mínimo de 25 animales. En tres casos, sin embargo, menos de 25 animales estuvieron disponibles para la prueba (una vez 22 y dos veces 23, respectivamente) porque las novillas no estaban en el lugar en el momento del muestreo. Por lo tanto, no se pudo alcanzar el tamaño de muestra objetivo de 300 rebaños. Sin embargo, dado que se muestrearon varias granjas muy grandes (en condiciones de producción lechera suizas), el nivel promedio de Se del rebaño fue superior al objetivo establecido inicialmente del 95%. En consecuencia, se pudo lograr un IC razonable para los cálculos finales de prevalencia entre rebaños a pesar de que el número de rebaños participantes fue menor de lo esperado.
3.2 Análisis serológicos
De las 10.063 muestras de suero que se analizaron para detectar anticuerpos contra la PAM, 51 (46 vacas y 5 novillas) fueron positivas, 10.000 (7.886 vacas, 2.085 novillas y 29 toros) fueron negativas y 12 (11 vacas y una vaquilla) fueron dudosas. Ocho granjas (con 453 animales, 347 vacas y 106 novillas) tuvieron que ser excluidas de análisis adicionales porque uno (o varios) resultados de ELISA en el rebaño eran dudosos y la granja no podía clasificarse de manera confiable como negativa o positiva. Los resultados de ELISA de los 163 rebaños restantes se presentan en la Tabla 6. Cincuenta y una de las 9′610 muestras restantes (0,53%) dieron positivo, la mayoría de ellas eran vacas (n = 46/7.596, 0,61%) pero cinco vaquillas (entre la edad de uno y 2 años) también fueron positivas para anticuerpos (n = 5/1.985, 0,25%); Todos los toros analizados fueron seronegativos. En la Tabla 1 se muestra información sobre la demografía de las explotaciones y las características del rebaño.
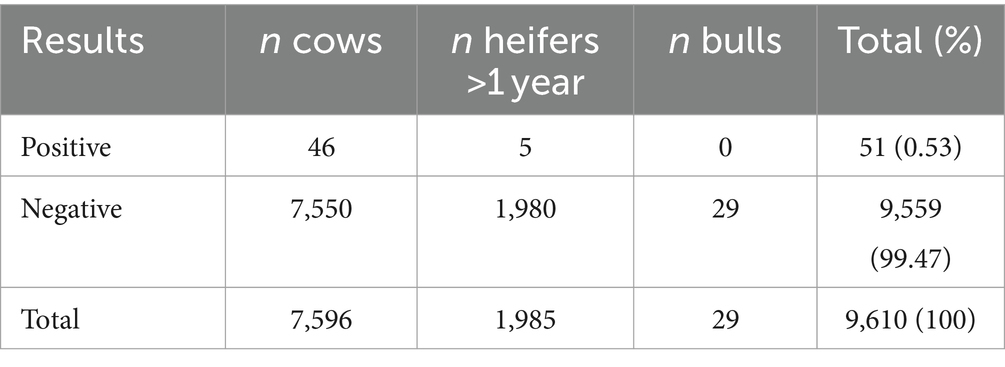
A nivel de rebaño, nueve de las 163 granjas restantes (5,5%) cumplieron con los criterios de seropositividad basados en el número de animales en el rebaño, como se describió anteriormente. La distribución geográfica de las 163 explotaciones incluidas en el estudio se muestra en la Figura 1. En estas nueve granjas seropositivas, 25 animales (de los 9.610 analizados, el 0,26%) fueron seropositivos; Los 25 animales seropositivos eran vacas con edades comprendidas entre los 3,0 y los 9,5 años, con una mediana de edad de 5,0 años. Una sola vaca fue seropositiva en un rebaño, dos vacas en seis rebaños y más de dos (cuatro y ocho, respectivamente) en dos granjas. El tamaño del rebaño de los nueve rebaños seropositivos osciló entre 36 y 138, con una mediana de 50 vacas de 2 años o más. Holstein fue la raza predominante entre los animales seropositivos (14/25, 56%), y Jersey la segunda más predominante (9/25, 36%); el rebaño con mayor número de animales seropositivos (ocho entre los 146 analizados) estaba compuesto exclusivamente por Jerseys. La seroprevalencia verdadera entre rebaños calculada mediante una Se de 0,99 y una Sp de 0,98 fue de 3,6 % (IC 95 %, 0,96–8,4 %). La seroprevalencia aparente dentro del rebaño en los nueve rebaños seropositivos osciló entre el 2,3 y el 5,5 %, con una mediana del 3,6 %, y la seroprevalencia real calculada dentro del rebaño osciló entre el 2,8 y el 8,3 %, con una mediana del 4,9 %. Debido a la baja seroprevalencia aparente de animales, no fue posible calcular la prevalencia real a nivel animal. Los animales seropositivos estaban presentes en otras 23 granjas que no cumplían los criterios de seropositividad. El tamaño del rebaño de estas granjas oscilaba entre 29 y 90 vacas, con un tamaño medio del rebaño de 54 vacas. En 20 de estos 23 hatos (87%), solo un animal fue seropositivo, de los cuales cinco fueron novillas; Se encontró que dos vacas eran seropositivas en los tres rebaños restantes.
3.3 Análisis de factores de riesgo sobre el estado serológico del rebaño para la paratuberculosis
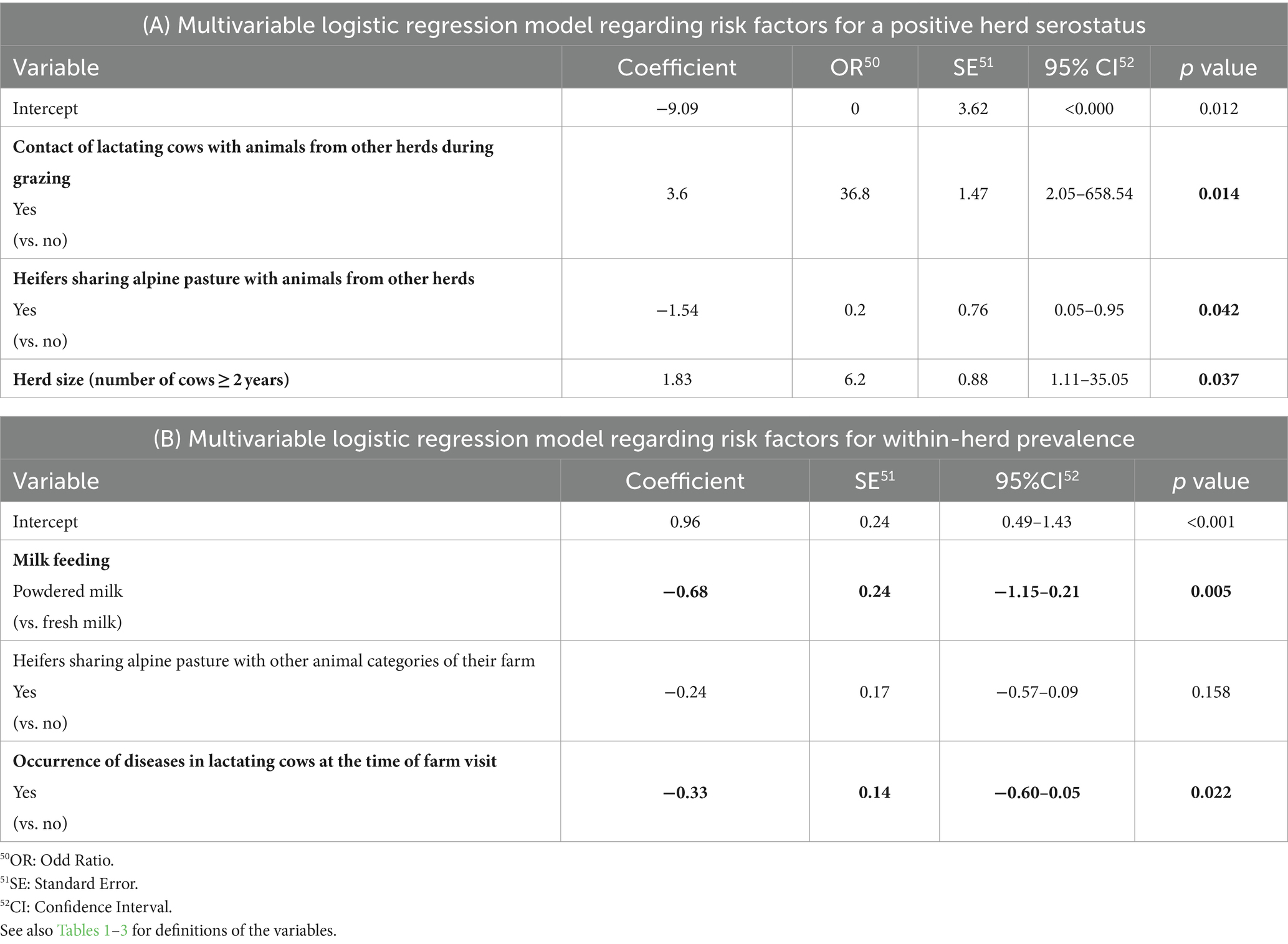
Los resultados del análisis de regresión univariable con respecto al estado serológico del rebaño (positivo o negativo para PTB) se muestran en la Tabla Suplementaria S1. Se seleccionaron cuatro variables que exhibían valores de p inferiores a 0,2 para su inclusión en el análisis de regresión multivariable posterior, es decir, «contacto de vacas lactantes con animales de otros rebaños durante el pastoreo», «novillas que comparten pastos alpinos con animales de otros rebaños», «fuente de animales para la compra» y «tamaño del rebaño». Los resultados de la regresión multivariable que incorporó este conjunto de variables reafirmaron la significación de tres de estas cuatro variables como factores explicativos del estado serológico del rebaño con valores de p inferiores a 0,05, es decir, «contacto de vacas lactantes con animales de otros rebaños durante el pastoreo», «novillas que comparten pastos alpinos con animales de otros rebaños» y «tamaño del rebaño» (Tabla 7A). Las variables «tamaño del rebaño» y «contacto de vacas lactantes con animales de otros rebaños durante el pastoreo» emergieron como contribuyentes positivos significativos al estado serológico de PTB del rebaño, mientras que «novillas que comparten pastos alpinos con animales de otros rebaños» se identificaron como un contribuyente negativo significativo.
3.4 Análisis de factores de riesgo para la seroprevalencia dentro del rebaño
Tres variables tuvieron valores de p inferiores a 0,2 en el análisis de regresión univariable con respecto a la seroprevalencia dentro del rebaño, incluyendo «alimentación con leche», «novillas que comparten pastos alpinos con otras categorías de animales del rebaño» y «aparición de enfermedades en las vacas» (Tabla Suplementaria S2). Estas variables se conservaron posteriormente para su inclusión en el modelo de regresión multivariable. Dos de ellos, la «alimentación con leche» y la «aparición de enfermedades en las vacas» se mantuvieron significativamente, aunque negativamente asociados con la seroprevalencia de TBP (Tabla 7B).
3.5 Conocimiento del agricultor sobre la paratuberculosis
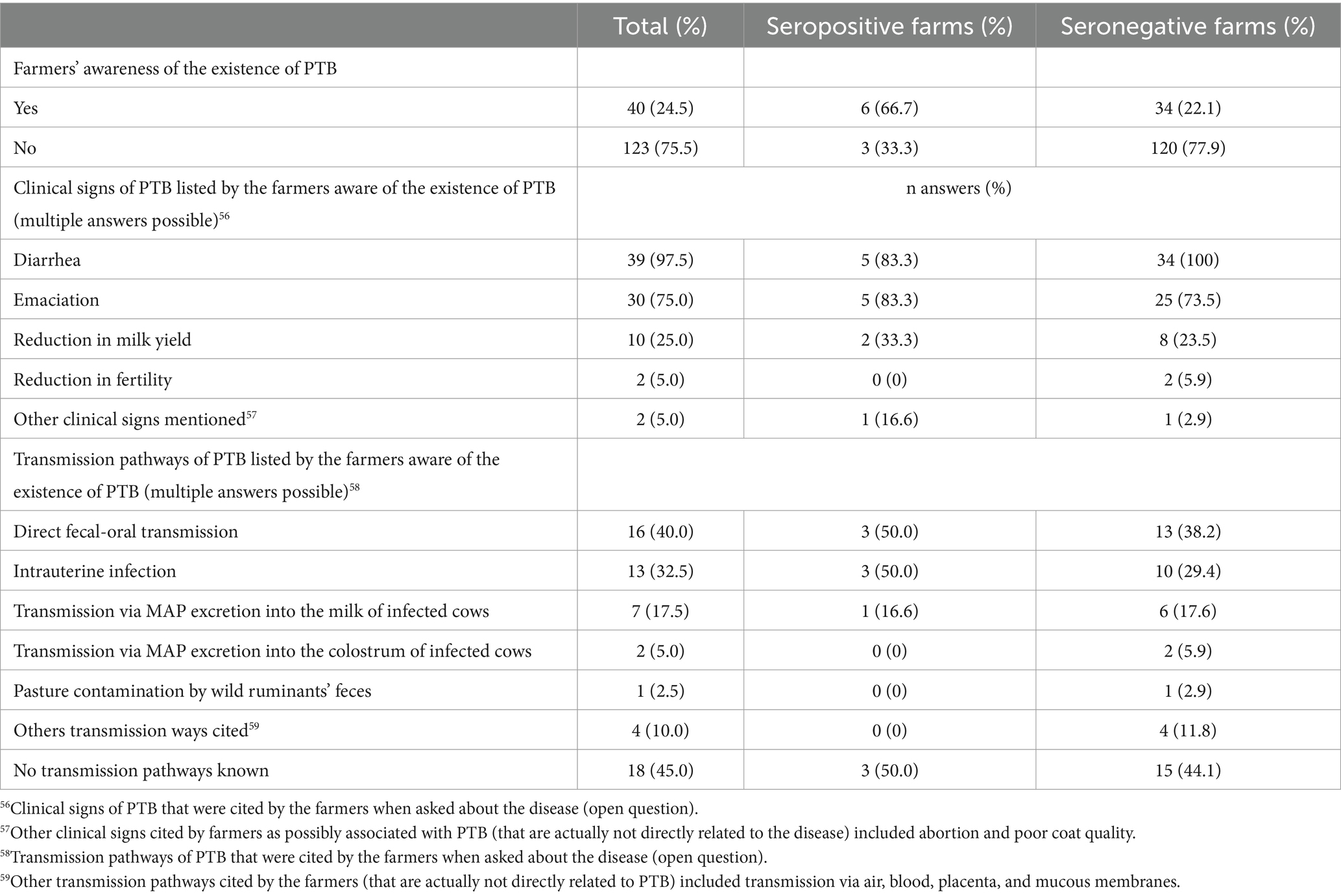
Los resultados del cuestionario sobre los conocimientos de los agricultores sobre el PTB se muestran en la Tabla 8. Solo el 24,5% de los participantes había conocido la existencia de la TBP antes del estudio, el resto de ellos refirieron no haber oído hablar de la enfermedad antes y no tener conocimiento de signos clínicos relacionados con la misma. Entre los administradores de rebaños que indicaron tener algún conocimiento de la enfermedad, la mayoría reconoció los dos síntomas cardinales de diarrea crónica y emaciación, mientras que solo unos pocos de ellos eran conscientes de una reducción en la producción de leche y la fertilidad. Solo el 35% de los agricultores que conocían la enfermedad conocían al menos una vía de infección, siendo la infección oral a través de las heces y la infección intrauterina las que se mencionaron con mayor frecuencia.
4 Discusión
El objetivo principal del presente estudio fue estimar las prevalencias nacionales a nivel de rebaño y animal de PTB en una amplia muestra de rebaños de ganado lechero suizo, y evaluar los factores de riesgo potencialmente asociados con un estado serológico positivo del rebaño y con la seroprevalencia dentro del rebaño en rebaños positivos. La seroprevalencia aparente entre rebaños del 5,5% detectada en esta encuesta es claramente inferior a la seroprevalencia aparente entre rebaños informada en estudios anteriores, por ejemplo, en una revisión de varios estudios realizados en países europeos (38-68%) (60), o en un estudio realizado en el norte de Italia (48% en Lombardía y 65% en Véneto (82)). A nivel de cada animal, la seroprevalencia aparente del 0,53 % también es inferior a la notificada entre las vacas adultas de otros países europeos, por ejemplo, el 2,6 % en Lombardía y el 4,0 % en el Véneto (82) o del 4,4 % al 10,3 % en Hungría (83). La mediana de seroprevalencia aparente dentro del rebaño fue del 3,6% en los nueve rebaños seropositivos. Los registros previos de prevalencia de infección por MAP en ganado lechero suizo se limitan a unos pocos estudios anteriores (62-66). Sin embargo, ninguno de estos estudios proporcionó datos fiables para Suiza debido al pequeño tamaño de la muestra o a la falta de representatividad de la población estudiada. Debido a que la participación en el presente estudio fue voluntaria, no se puede excluir un sesgo de selección en el que los ganaderos conocen o sospechan la presencia de PTB en su rebaño y eligen no participar por temor a las posibles consecuencias. Aunque los resultados serológicos positivos no tuvieron consecuencias reglamentarias para las explotaciones participantes (esto se confirmó en el correo enviado para reclutar a los participantes), es posible que algunos agricultores hayan preferido no participar en un estudio sobre una enfermedad de declaración obligatoria. El reclutamiento de los rebaños participantes resultó ser más difícil de lo esperado, aunque se hizo en colaboración con las principales asociaciones de cría, con la confirmación por escrito de sus juntas directivas de que recomendaban la participación en este estudio sobre una enfermedad de importancia para la industria láctea. Con el tiempo, esto dio lugar a un número de rebaños participantes inferior al tamaño de la muestra calculada. Esto sugiere que sería necesario un muestreo (obligatorio) en una subpoblación de granjas lecheras seleccionada al azar para un estudio realmente representativo sobre el PTB en Suiza. La exclusión de las granjas pequeñas con el fin de mitigar la precisión limitada de las pruebas a través del reclutamiento de rebaños con 25 vacas o más puede haber complicado aún más la adquisición de participantes para el estudio, dado el tamaño promedio relativamente pequeño de los rebaños lecheros suizos. Sin embargo, se probaron 40 animales o más en la mayoría de los rebaños participantes (121 de 163, 74,2%). Las explotaciones incluidas en el estudio se distribuyeron en todas las zonas agrícolas de Suiza (zonas medias, montañosas y montañosas I-IV). Esta división en zonas agrícolas tiene por objeto representar el grado de dificultad en la producción y las condiciones de vida que deben tenerse en cuenta en la aplicación de la Ley de Agricultura, por ejemplo, algunas subvenciones concedidas a los agricultores dependen de la zona en la que se encuentre su explotación. En la población estudiada, una mayor proporción de las granjas (52,7%) estaba ubicada en la zona central en comparación con la proporción en toda la población lechera suiza (32,5% de los rebaños). Por el contrario, las cuatro zonas montañosas juntas estaban menos representadas en la población de estudio en comparación con la distribución general de las granjas lecheras suizas (32% frente a 52,2%). La distribución en la zona montañosa fue la misma en ambas poblaciones (15,3%). Es probable que esta observación se deba a la selección de explotaciones con un tamaño mínimo de rebaño de 25 vacas lecheras, ya que las explotaciones de las zonas montañosas tienden a ser más pequeñas en comparación con las explotaciones de la zona media, con una media de 30,5 vacas y 18,5 vacas, respectivamente, en 2022 (84).
La seroprevalencia observada es sorprendentemente baja, a pesar del gran número de muestras recogidas en más de 160 rebaños. Los análisis serológicos se realizaron por duplicado en un laboratorio certificado (el laboratorio suizo de referencia para enfermedades micobacterianas en animales) con un kit comercial de ELISA, por lo que un problema técnico inadvertido parece inverosímil. Una preocupación sobre el uso de métodos ELISA para la detección de rebaños positivos es la posible clasificación errónea de las granjas debido a la baja Se de las pruebas serológicas en las primeras etapas de la infección, ya que los anticuerpos rara vez están presentes en cantidades suficientes para ser detectados durante la fase subclínica del PTB (21, 51). Sobre la base de las características de la prueba utilizada (Se = 58,2%, Sp = 99,3%), deben esperarse resultados falsos negativos a nivel de animal individual. Dada la naturaleza contagiosa de la TBP, no es sorprendente que las probabilidades de seropositividad del rebaño aumenten con el tamaño del rebaño, lo que se ha observado en numerosos estudios en todo el mundo (14, 15, 66, 74, 85), incluidos los estudios serológicos (12, 21, 22, 86). Sin embargo, también hay que tener en cuenta la mayor probabilidad de encontrar animales positivos cuando se someten a pruebas a más animales en rebaños más grandes que en rebaños pequeños. Esta es la razón por la que elegimos muestrear y analizar a todos los animales (a partir de 1 año de edad) en los rebaños participantes, con el fin de aumentar la probabilidad de detectar rebaños seropositivos. De hecho, se analizaron 146 (120 vacas y 26 novillas) y 171 (138 vacas y 33 novillas) en las dos granjas con 8 y 4 animales seropositivos, respectivamente, entre 41 y 76 animales en los rebaños con dos animales seropositivos, y 36 en la granja más pequeña que se clasificó como positiva con una vaca seropositiva. Con el fin de no mitigar una mejor Se con una disminución de la Sp a nivel de rebaño debido al gran número de animales ensayados, se determinó un punto de corte (número mínimo de animales seropositivos necesarios para clasificar un rebaño como positivo en función del número de animales ensayados) para cada rebaño individualmente a fin de garantizar un Se y un Sp del 95% o más a nivel de rebaño. El tamaño del rebaño, calculado sobre la base del número de vacas solo en los modelos para incluir los rebaños con cría de novillas fuera de la granja, se asoció significativamente con un estado positivo del rebaño, lo que indica que otros factores además del número de animales analizados por sí solos contribuyen al riesgo de ser positivo para PTB en rebaños más grandes. Estos otros factores pueden incluir, por ejemplo, una mayor compra de animales, grupos más grandes de animales o un menor control de las prácticas de manejo en las grandes granjas con empleados contratados que en las pequeñas granjas familiares.
La raza predominante en las granjas participantes fue Holstein con el 47,9% de los rebaños. Se trataba en su mayoría de rebaños grandes, con un tamaño medio del rebaño de 46,5 vacas. Por el contrario, las granjas lecheras suizas son generalmente más pequeñas, con un tamaño promedio del rebaño de 23 vacas (84). Aunque se ha informado que la raza Jersey es más susceptible al PTB que otras razas lecheras (85, 87, 88), la raza no se identificó como un factor de riesgo en nuestros análisis. La raza Jersey no es muy común en Suiza, ya que en 2022 solo se registraron 5.108 vacas en la asociación de cría (71), lo que correspondía al 0,9 % de la población total de vacas lecheras en Suiza (84). En nuestro estudio, el ganado Jersey predominó en cuatro hatos (2,4%), uno de los cuales estaba compuesto exclusivamente por Jerseys. Sin embargo, el 36% (9/25) de los animales seropositivos en los rebaños positivos eran Jersey, y el rebaño con el mayor número de animales seropositivos (8/146, 5,5%) fue el que tenía solo ganado Jersey. Sin embargo, dado el bajo número de observaciones, estos resultados no deben sobreinterpretarse.
A pesar de las precauciones tomadas para minimizar la clasificación errónea de los rebaños, sabemos de al menos un rebaño que probablemente se clasificó falsamente como seronegativo en el estudio, ya que una vaca (dio negativo en la prueba ELISA en noviembre de 2021) mostró posteriormente signos clínicos de EJ; Según el propietario, el diagnóstico se confirmó mediante el examen de una muestra fecal (método desconocido). Treinta y cinco animales (24 vacas y 11 novillas) habían sido analizados en el rebaño, la vaca positiva fue, hasta donde sabemos, el único animal que más tarde mostró signos de EJ. Ya se había producido un caso de TBP en ese rebaño en 2010 (confirmado por un análisis de laboratorio no identificado), pero no se había producido ningún otro caso desde entonces hasta 2022. Esto subraya las limitaciones del ELISA sérico en una sola ocasión, incluso si se someten a pruebas a todos los animales del rebaño. Se recomienda el uso de más de una prueba, repetida a lo largo del tiempo para establecer el estado de la enfermedad tanto de los animales como de los rebaños, debido a las conocidas limitaciones diagnósticas de la TBP (89). En el presente estudio, cada animal pudo ser probado una sola vez con una prueba ELISA debido a limitaciones prácticas.
Un objetivo secundario del estudio fue identificar la subpoblación de mayor riesgo dentro de los rebaños seropositivos, es decir, la que preferiblemente debe ser analizada para determinar el estado de PTB de un rebaño en el marco de una estrategia de muestreo dirigido. Este objetivo no pudo alcanzarse dada la baja proporción de animales con resultado positivo en cualquier rebaño, ya que solo un animal fue seropositivo en la mayoría de ellos (65,6%). Los análisis específicos para explorar posibles asociaciones entre el estado serológico individual y la edad o la fertilidad (intervalo entre partos) de los animales analizados no revelaron asociaciones significativas (datos no mostrados). Por lo tanto, los resultados de este estudio sugieren que todo el rebaño debe ser analizado para establecer su estado de PTB. Sobre la base de los resultados actuales, no se puede hacer una recomendación sobre si las novillas de entre 1 y 2 años deben someterse a pruebas para determinar el estado de PTB de un rebaño, ya que ninguna de las novillas que dieron positivo estaba en un rebaño que finalmente se clasificó como seropositivo. Sin embargo, en un estudio anterior realizado en Suiza se encontraron resultados positivos de CF para MAP en una proporción sorprendentemente alta de muestras fecales de novillas, lo que sugiere que los animales más jóvenes pueden desempeñar un papel en la propagación de MAP en rebaños infectados y, por lo tanto, deben tenerse en cuenta al tratar de establecer un estado de rebaño con respecto a PTB (66). Es probable que las pruebas repetidas sean la clave para mejorar la precisión de los resultados (90). Las pruebas de leche a granel en tanque utilizando métodos comerciales de ELISA son económicas y se han investigado para la detección de la enfermedad de Alzheimer en el rebaño, sin embargo, los resultados parecen estar influenciados por el tamaño del rebaño y la prevalencia dentro del rebaño (91). Se ha demostrado que el ELISA de leche no es lo suficientemente sensible como para detectar rebaños de baja prevalencia (92, 93), por lo que no parece ser una opción adecuada para identificar rebaños lecheros suizos infectados por PTB.
La asociación más fuerte entre un factor de riesgo y el estado seropositivo del rebaño se observó para el «contacto de vacas lactantes con vacas de otros rebaños durante el pastoreo» en el análisis multivariante. Las vacas lactantes de tres rebaños (uno seropositivo y dos seronegativos) compartían pastos alrededor de la granja (no pastos alpinos) con vacas de otros rebaños. En dos rebaños (tamaño de rebaño de 34 y 16 vacas, respectivamente), las vacas compartieron el pasto con vacas de otros dos rebaños, en el tercer rebaño (44 vacas) las vacas compartieron el pasto con vacas de otros nueve rebaños (datos no mostrados). Esta práctica parecía ser un factor de riesgo potencial para el hato de dar positivo, sin embargo, este resultado debe interpretarse con cautela dado el bajo número de granjas con esta característica. Se necesitarían más datos para explorar más a fondo este posible factor de riesgo. Sin embargo, se ha recomendado mantener el estiércol del ganado de otras granjas lejos del rebaño evitando los pastos comunitarios o compartidos para disminuir el riesgo de introducción de PAM en las operaciones lecheras (94). Se ha sugerido más bien que el pastoreo común es un factor de riesgo para los animales jóvenes (terneros y novillas) que comparten pastos con bovinos adultos (95), lo que está en consonancia con que los animales jóvenes son los más susceptibles a la infección por PAM (6). Sin embargo, en el presente estudio, se encontró que la variable «novillas que comparten pastos alpinos con animales de otras granjas» (en su mayoría animales jóvenes, en el 67,5% de los casos, pero también con animales adultos en el 15,3%) se asoció con una disminución de las probabilidades de que el rebaño diera seropositiva, lo cual fue inesperado, especialmente porque la excreción de MAP en novillas se ha informado en un estudio anterior en Suiza (66). El pastoreo alpino común de animales jóvenes está muy extendido en Suiza (96) y la importancia del pastoreo comunal alpino para la propagación de otras enfermedades infecciosas como la diarrea por virus bovino (DVB) está bien documentada (97). En nuestro estudio, las novillas que compartían pastos alpinos con animales de otros rebaños, se reportaron en 5 de 9 rebaños seropositivos (55,6%, solo con animales jóvenes) y 130 de 154 rebaños seronegativos (84,4%, de los cuales 68,2% con contacto solo con animales jóvenes y 16,2% con bovinos adultos), por lo que la exposición potencial a MAP puede no haber sido la misma en ambos grupos. Aunque se puede postular que la asociación significativa puede estar relacionada con la baja intensidad de contacto debido al pastoreo extensivo en pastos alpinos o al hecho de que el PTB no es tan altamente contagioso como la BVD, estos resultados deben, nuevamente, interpretarse con cautela dado el bajo número de granjas positivas. De hecho, los odds ratios de todas las variables que quedan en el modelo multivariable final presentan amplios intervalos de confianza (Tabla 7), lo que indica una incertidumbre sustancial. En consecuencia, la interpretabilidad de estos factores de riesgo es limitada. Esta incertidumbre se debe principalmente al pequeño número de rebaños seropositivos y a los factores de riesgo con un poder discriminativo limitado debido a la presencia de solo unas pocas observaciones dentro de grupos específicos.
La identificación de factores de riesgo significativos asociados con una alta prevalencia dentro del rebaño se vio dificultada por la baja sensibilidad de la prueba ELISA y la baja prevalencia dentro del rebaño, por lo que los resultados de los análisis realizados para identificar dichos factores deben interpretarse con mayor precaución que las asociaciones con el estado serológico de los rebaños. De hecho, es difícil proponer explicaciones biológicamente racionales para el hecho de que la aparición de enfermedades (en su mayoría problemas de garras y ubres mencionados por los ganaderos) a nivel de rebaño en vacas lactantes contribuiría a disminuir el riesgo de propagación de la PAM en una granja positiva. Cabe señalar que, por ejemplo, no se observaron enfermedades relevantes en las vacas a nivel de rebaño en ninguno de los 9 rebaños seropositivos. Asimismo, los terneros fueron alimentados solo con leche en polvo (sin leche fresca) en el 22,2% de los rebaños seropositivos (2/9) pero solo en el 7,1% de los rebaños seronegativos (11/154); esta repartición aleatoria en nuestra población de estudio podría explicar, al menos en parte, por qué la alimentación con leche en polvo, una recomendación común para los rebaños positivos para PTB, parecía estar relacionada con un bajo riesgo de propagación de MAP.
En general, el conocimiento de los ganaderos sobre el PTB era bajo, con más del 75,5% de los participantes desconocían la existencia misma de la enfermedad, de los cuales el 2,4% resultaron tener un rebaño seropositivo. Esto sugiere que los signos de enfermedad clínica no serían reconocidos como sospechosos de TBP por estos agricultores. Después de completar el cuestionario, el 17,2% de los participantes no pudo excluir que hubiera tenido casos de TBP en su rebaño en el pasado, mientras que la mayoría de ellos (74,8%) aún declaró que nunca había tenido un caso, aunque el 2,4% de sus rebaños finalmente se clasificaron como seropositivos. Trece de los 163 ganaderos indicaron que habían tenido al menos un caso (entre uno y cinco animales enfermos por explotación) en los 10 años anteriores al estudio. Mientras que casi la totalidad de los 40 ganaderos que conocían la existencia de PTB pudieron mencionar los síntomas cardinales de diarrea (97,5%) y emaciación (75%), solo el 25% mencionó la reducción de la producción de leche y el 5% también una reducción de la fertilidad. Las vías de infección fueron poco conocidas por la mayoría, solo el 35% de los agricultores que conocían la enfermedad pudieron mencionar al menos una vía de infección. Las dos vías más mencionadas fueron a través de las heces (40%) y la infección intrauterina (32,5%). La transmisión a través de la leche era poco conocida (17,5%) y solo el 5% de los ganaderos eran conscientes de la posible transmisión a través del calostro. Estos resultados sugieren que, a pesar de estudios previos realizados en Suiza (66, 98), el PTB sigue siendo poco conocido por los agricultores suizos y que son necesarios más esfuerzos para sensibilizar. Es especialmente importante crear conciencia sobre la transmisión a través de la leche, debido al potencial zoonótico de la PAM mencionado anteriormente, especialmente en un país con una importante tradición en la producción láctea.
5 Conclusión
Los resultados del presente estudio revelaron una prevalencia muy baja de seropositividad de MAP entre rebaños y dentro de rebaños en granjas lecheras suizas, incluso en rebaños grandes. Esto cuestiona la verdadera relevancia epidemiológica del PTB en Suiza. La baja prevalencia dentro del rebaño y el pequeño tamaño de los rebaños lecheros suizos impidieron la identificación de una población objetivo que se analizaría, preferiblemente para determinar el estado de PTB de un rebaño lechero. En combinación con el bajo rendimiento, especialmente la baja sensibilidad, de las pruebas serológicas para el diagnóstico de PTB, estos resultados sugieren que los métodos alternativos (por ejemplo, PCR repetida de muestras ambientales) pueden ser más adecuados y deben evaluarse para los rebaños lecheros suizos. Las dificultades para reclutar a los agricultores dispuestos a participar en el estudio y su bajo nivel de conocimiento sobre el PTB revelan lagunas de conocimiento y poca comprensión sobre las enfermedades infecciosas, su transmisión y la importancia de las medidas de bioseguridad. Una mejor información y educación de los productores lecheros suizos sobre el PTB y la bioseguridad en general debería ser una prioridad en un futuro próximo.
Declaración de disponibilidad de datos
Las contribuciones originales presentadas en el estudio se incluyen en el artículo/Material complementario, las consultas posteriores pueden dirigirse al autor correspondiente.
Declaración ética
Los estudios en animales fueron aprobados por Amt für Veterinärwesen, 3000 Berna, Suiza. Los estudios se llevaron a cabo de acuerdo con la legislación local y los requisitos institucionales. Se obtuvo el consentimiento informado por escrito de los propietarios para la participación de sus animales en este estudio.
Contribuciones de los autores
MO: Curación de datos, Análisis formal, Investigación, Metodología, Administración de proyectos, Validación, Redacción – borrador original, Redacción – revisión y edición. IL: Curación de datos, Análisis formal, Investigación, Metodología, Redacción – borrador original, Redacción – revisión y edición, Conceptualización, Adquisición de fondos, Recursos, Software, Supervisión, Validación. JW: Curación de datos, Análisis formal, Metodología, Software, Supervisión, Redacción – borrador original, Redacción – revisión y edición. SS: Conceptualización, Análisis formal, Obtención de fondos, Investigación, Metodología, Supervisión, Validación, Redacción – borrador original, Redacción – revisión y edición. MS: Análisis formal, Investigación, Metodología, Supervisión, Redacción – borrador original, Redacción – revisión y edición. RSc: Investigación, Redacción – borrador original, Redacción – revisión y edición. RSt: Conceptualización, Obtención de Fondos, Metodología, Supervisión, Validación, Redacción – borrador original, Redacción – revisión y edición. MM: Conceptualización, Curación de datos, Análisis formal, Obtención de fondos, Investigación, Metodología, Administración de proyectos, Recursos, Supervisión, Validación, Visualización, Redacción – borrador original, Redacción – revisión y edición.
Financiación
El/los autor/es declaran/n que se recibió apoyo financiero para la investigación, autoría y/o publicación de este artículo. Este proyecto fue financiado por la Oficina Suiza de Seguridad Alimentaria y Veterinaria (subvención 1.21.05). La financiación del acceso abierto fue proporcionada por la Universidad de Berna.
Reconocimientos
Agradecemos a Alix Verdillon y Nicole von Arx por su ayuda con las visitas a las granjas y el muestreo, y a Sandra Schoch-Müller por su ayuda técnica en el laboratorio.
Conflicto de intereses
IL y JW fueron empleados por SAFOSO AG.
El resto de los autores declaran que la investigación se llevó a cabo en ausencia de relaciones comerciales o financieras que pudieran interpretarse como un potencial conflicto de intereses.
Nota del editor
Todas las afirmaciones expresadas en este artículo son únicamente las de los autores y no representan necesariamente las de sus organizaciones afiliadas, ni las del editor, los editores y los revisores. Cualquier producto que pueda ser evaluado en este artículo, o afirmación que pueda ser hecha por su fabricante, no está garantizado ni respaldado por el editor.
Material complementario
El material complementario para este artículo se puede encontrar en línea en: https://www.frontiersin.org/articles/10.3389/fvets.2024.1409694/full#supplementary-material
Referencias
1. Beard, PM, Daniels, MJ, Henderson, D, Pirie, A, Rudge, K, Buxto, D, et al. Infección por paratuberculosis en fauna silvestre no rumiante en Escocia. J Clin Microbiol. (2001) 39:1517–21. doi: 10.1128/JCM.39.4.1517-1521.2001
2. Alonso-Hearn, M, Molina, E, Geijo, M, Vázquez, P, Sevilla, I, Garrido, JM, et al. Aislamiento de Mycobacterium avium subsp. paratuberculosis a partir de tejido muscular de bovinos infectados de forma natural. Foodborne Pathog Dis. (2009) 6:513–8. doi: 10.1089/fpd.2008.0226
3. McAloon, CG, Roche, S, Ritter, C, Barkema, HW, Whyte, P, More, SJ, et al. Una revisión de la paratuberculosis en rebaños lecheros – parte 2: control en la granja. Veterinario J. (2019) 246:54–8. doi: 10.1016/j.tvjl.2019.01.009
4. Lienhard, J, Friedel, U, Paganini, C, Hilbe, M, Scherrer, S, y Schmitt, S. Aislamiento de Mycobacterium avium ssp. paratuberculosis y otras micobacterias no tuberculosas de los ganglios linfáticos de la cabeza de rumiantes y tejones silvestres en Suiza. Front Vet Sci. (2023) 10:1321106. doi: 10.3389/fvets.2023.1321106
5. Fecteau, ME . Paratuberculosis en bovinos. Vet Clin North Am Food Anim Pract. (2018) 34:209–22. doi: 10.1016/j.cvfa.2017.10.011
6. Windsor, Pensilvania, y Whittington, RJ. Evidencia de la susceptibilidad por edad del ganado bovino a la enfermedad de Johne. Veterinario J. (2010) 184:37–44. doi: 10.1016/j.tvjl.2009.01.007
7. Lombardo, JE . Epidemiología y economía de la paratuberculosis. Vet Clin North Am Food Anim Pract. (2011) 27:525–35. doi: 10.1016/j.cvfa.2011.07.012
8. Sweeney, RW . Patogenia de la paratuberculosis. Vet Clin North Am Food Anim Pract. (2011) 27:537–46. doi: 10.1016/j.cvfa.2011.07.001
9. Whittington, RJ, Donat, K, Weber, MF, Kelton, D, Nielsen, SS, Eisenberg, S, et al. Control de la paratuberculosis: quién, por qué y cómo. Una revisión de 48 países. BMC Vet Res. (2019) 15:198. doi: 10.1186/s12917-019-1943-4
10. Sweeney, RW . Transmisión de la paratuberculosis. Vet Clin North Am Food Anim Pract. (1996) 12:305–12. doi: 10.1016/S0749-0720(15)30408-4
11. Tiwari, A, VanLeeuwen, JA, Dohoo, IR, Keefe, GP, Haddad, JP, Scott, HM, et al. Factores de riesgo asociados con la seropositividad de la subespecie de paratuberculosis Mycobacterium avium en vacas lecheras y rebaños canadienses. Prev Vet Med. (2009) 88:32–41. doi: 10.1016/j.prevetmed.2008.06.019
12. Pieper, L, Sorge, EE. UU., DeVries, TJ, Godkin, A, Lissemore, K y Kelton, DF. Evaluación del plan de evaluación y manejo del riesgo de la enfermedad de Johne en granjas lecheras en Ontario, Canadá. J Dairy Sci. (2015) 98:6792–800. doi: 10.3168/jds.2014-8813
13. Rangel, SJ, Paré, J, Doré, E, Arango, JC, Côté, G, Buczinski, S, et al. Una revisión sistemática de los factores de riesgo asociados con la introducción de Mycobacterium avium spp. paratuberculosis (MAP) en rebaños lecheros. ¿Puede Vet J. (2015) 56:169–77.
14. Barrett, DJ, yo, JF, Mullowney, P, Good, M, McGrath, G, Clegg, T, et al. Factores de riesgo asociados con el estado de la prueba de la enfermedad de Johne en rebaños lecheros en Irlanda. Rec. Veterinario (2011) 168:410. doi: 10.1136/vr.c6866
15. Puerto-Parada, M, Arango-Saboga, JC, Paré, J, Doré, E, Côté, G, Wellemans, V, et al. Factores de riesgo asociados con el estado del rebaño de Mycobacterium avium subsp. paratuberculosis en los rebaños lecheros de Quebec. Prev Vet Med. (2018) 152:74–80. doi: 10.1016/j.prevetmed.2018.02.010
16. Doré, E, Paré, J, Côté, G, Buczinski, S, Labrecque, O, Roy, JP, et al. Factores de riesgo asociados con la transmisión de Mycobacterium avium subsp. paratuberculosis a terneros dentro del rebaño lechero: una revisión sistemática. J Veterinario Pasante Med. (2012) 26:32–45. doi: 10.1111/j.1939-1676.2011.00854.x
17. Smith, HW . El examen de la leche para detectar la presencia de Mycobacterium johnei. J Pathol Bacteriol. (1960) 80:440–2. doi: 10.1002/path.1700800234
18. Sweeney, RW, Whitlock, RH, y Rosenberger, AE. Mycobacterium paratuberculosis cultivada a partir de leche y ganglios linfáticos supramamarios de vacas asintomáticas infectadas. J Clin Microbiol. (1992) 30:166–71. doi: 10.1128/jcm.30.1.166-171.1992
19. Streeter, R, Hoffsis, G, Bech-Nielsen, S, Shulaw, WP y Rings, DM. Aislamiento de Mycobacterium paratuberculosis a partir de calostro y leche de vacas infectadas subclínicamente. Am J Vet Res. (1995) 56:1322–4. doi: 10.2460/ajvr.1995.56.10.1322
20. Whittington, RJ, y Windsor, Pensilvania. Infección intrauterina de bovinos con Mycobacterium avium subsp. paratuberculosis: una revisión crítica y metaanálisis. Veterinario J. (2009) 179:60–9. doi: 10.1016/j.tvjl.2007.08.023
21. Vilar, ALT, Santos, CSAB, Pimenta, CLRM, Freitas, TD, Brasil, AWL, Clementino, IJ, et al. Prevalencia a nivel de rebaño y factores de riesgo asociados a Mycobacterium avium subsp. paratuberculosis en bovinos del Estado de Paraíba, Nordeste de Brasil. Prev Vet Med. (2015) 121:49–55. doi: 10.1016/j.prevetmed.2015.06.003
22. McAloon, CG, Doherty, ML, Whyte, P, More, SJ, O’Grady, L, Citer, L, et al. Importancia relativa de los factores de riesgo a nivel de rebaño para la probabilidad de infección por paratuberculosis en rebaños lecheros irlandeses. J Dairy Sci. (2017) 100:9245–57. doi: 10.3168/jds.2017-12985
23. McClure, HM, Chiodini, RJ, Anderson, DC, Swenson, RB, Thayer, WR, y Coutu, JA. Infección por Mycobacterium Paratuberculosis en una colonia de macacos cola de tocón (Macaca Arctoides). J Infectar Dis. (1987) 155:1011–9. doi: 10.1093/infdis/155.5.1011
24. Hermon-Taylor, J, Bull, TJ, Sheridan, JM, Cheng, J, Stellakis, ML y Sumar, N. Causalidad de la enfermedad de Crohn por Mycobacterium avium subespecie paratuberculosis. Can J Gastroenterol. (2000) 14:521–39. doi: 10.1155/2000/798305
25. Sechi, LA, Mura, M, Tanda, F, Lissia, L, Solinas, A, Fadda, G, et al. Identificación de Mycobacterium avium subsp. paratuberculosis en muestras de biopsia de pacientes con enfermedad de Crohn identificados por hibridación in situ. J Clin Microbiol. (2001) 39:4514–7. doi: 10.1128/JCM.39.12.4514-4517.2001
26. Autschbach, F, Eisold, S, Hinz, U, Zinser, S, Linnebacher, M, Giese, T, et al. Alta prevalencia de ADN IS900 de la subespecie paratuberculosis Mycobacterium avium en tejidos intestinales de individuos con enfermedad de Crohn. Tripa. (2005) 54:944–9. doi: 10.1136/gut.2004.045526
27. Feller, M, Huwiler, K, Stephan, R, Altpeter, E, Shang, A, Furrer, H, et al. Mycobacterium avium subespecie paratuberculosis y enfermedad de Crohn: una revisión sistemática y metaanálisis. Lancet infecta Dis. (2007) 7:607–13. doi: 10.1016/S1473-3099(07)70211-6
28. Zarei-Kordshouli, F, Geramizadeh, B, y Khodakaram-Tafti, A. Prevalencia del ADN de Mycobacterium avium subespecie paratuberculosis IS900 en tejidos de biopsia de pacientes con enfermedad de Crohn: comparación histopatológica y molecular con la enfermedad de Johne en la provincia de Fars de Irán. BMC infecta dis. (2019) 19:23. doi: 10.1186/s12879-018-3619-2
29. Estevinho, MM, Cabeda, J, Santiago, M, Machado, E, Silva, R, Duro, M, et al. Mycobacterium avium subsp. paratuberculosis coloniza la sangre periférica de pacientes con enfermedad inflamatoria intestinal. Microorganismos. (2023) 11:1520. doi: 10.3390/microorganismos11061520
30. Subvención, IR . Potencial zoonótico de Mycobacterium avium ssp. paratuberculosis: la situación actual. J Appl Microbiol. (2005) 98:1282–93. doi: 10.1111/j.1365-2672.2005.02598.x
31. Grant, IR, Hitchings, EI, McCartney, A, Ferguson, F y Rowe, MT. Efecto de la pasteurización a alta temperatura y corta a escala comercial sobre la viabilidad de Mycobacterium Paratuberculosis en leche de vaca infectada naturalmente. Appl Environ Microbiol. (2002) 68:602–7. doi: 10.1128/AEM.68.2.602-607.2002
32. Gerrard, ZE, Swift, BMC, Botsaris, G, Davidson, RS, Hutchings, MR, Huxley, JN, et al. Supervivencia de Mycobacterium avium subespecie paratuberculosis en leche pasteurizada al por menor. Microbiol alimentario. (2018) 74:57–63. doi: 10.1016/j.fm.2018.03.004
33. Waddell, LA, Rajic, A, Stärk, KDC y McEwen, SA. El potencial zoonótico de Mycobacterium avium ssp. paratuberculosis: una revisión sistemática y metaanálisis de la evidencia. Epidemiol Infect. (2015) 143:3135–57. doi: 10.1017/S095026881500076X
34. Waddell, LA, Rajić, A, Stärk, KDC, y McEwen, SA. El impacto potencial en la salud pública de Mycobacterium avium ssp. paratuberculosis: encuesta de opinión global de especialistas en el tema. Zoonosis Salud Pública. (2016) 63:212–22. doi: 10.1111/zph.12221
35. Raizman, EA, Fetrow, JP y Wells, SJ. Pérdida de ingresos por vacas que excretaron Mycobacterium avium subespecie paratuberculosis antes del parto en comparación con vacas que no excretaron el organismo en dos granjas lecheras de Minnesota. J Dairy Sci. (2009) 92:4929–36. doi: 10.3168/jds.2009-2133
36. Donat, K, Soschinka, A, Erhardt, G y Brandt, HR. Paratuberculosis: disminución de la producción de leche de vacas lecheras Holstein alemanas que excretan Mycobacterium avium ssp. paratuberculosis depende de la prevalencia dentro del rebaño. Animal. (2014) 8:852–8. doi: 10.1017/S1751731114000305
37. Beaver, A, Ruegg, PL, Gröhn, YT, y Schukken, YH. Evaluación comparativa del riesgo de nuevas infecciones por Mycobacterium avium ssp. paratuberculosis a nivel de vaca entre 3 tipos de producción lechera: orgánico, convencional y convencional-pastoreo. J Dairy Sci. (2016) 99:9885–99. doi: 10.3168/jds.2016-11360
38. McAloon, CG, Whyte, P, More, SJ, Green, MJ, O’Grady, L, García, AB, et al. El efecto de la paratuberculosis en la producción de leche: una revisión sistemática y metaanálisis. J Dairy Sci. (2016) 99:1449–60. doi: 10.3168/jds.2015-10156
39. Bates, A, O’Brien, R, Liggett, S, y Griffin, F. Efecto de la infección subclínica por Mycobacterium avium subsp. paratuberculosis en la producción de leche en un rebaño lechero de Nueva Zelanda. BMC Vet Res. (2018) 14:93. doi: 10.1186/s12917-018-1421-4
40. Rieger, A, Meylan, M, Hauser, C, y Knubben-Schweizer, G. Eine Meta-Analyse zur Schätzung der wirtschaftlichen Einbussen durch Milch- und Reproduktionsverluste infolge boviner Paratuberkulose in der Schweiz. Schweizer Archiv für Tierheilkunde. (2021) 164:737–51. doi: 10.17236/sat00324
41. Goeldner, D, Carter, M, Patton, E, Wheeler, R, y May, GM. Cómo hacer evaluaciones de riesgo y planes de manejo para la enfermedad de Johne. Departamento de Agricultura de los Estados Unidos (USDA), 4ª ed. (2011). Disponible en: https://johnes.org/wp-content/uploads/2018/11/How-to-do-RAs-and-MPs-for-Dairy-and-Beef-Herds-4th-ed-2011.pdf
42. Good, M, Clegg, T, Sheridan, H, Yearsely, D, O’Brien, T, Egan, J, et al. Prevalencia y distribución de la paratuberculosis (enfermedad de Johne) en los rebaños bovinos de Irlanda. Ir Vet J. (2009) 62:597–606. doi: 10.1186/2046-0481-62-9-597
43. Kirkeby, C, Græsbøll, K, Nielsen, SS, Toft, N, y Halasa, T. Consecuencias epidemiológicas y económicas de la compra de ganado infectado con Mycobacterium avium subsp. paratuberculosis. BMC Vet Res. (2017) 13:202. doi: 10.1186/s12917-017-1119-z
44. Perets, V, Allen, A, Crispell, J, Cassidy, S, O’Connor, A, Farrell, D, et al. Evidencia de propagación local e internacional de Mycobacterium avium subespecie paratuberculosis a través de la secuenciación del genoma completo de aislados de la isla de Irlanda. Microbiol veterinario. (2022) 268:109416. doi: 10.1016/j.vetmic.2022.109416
45. Barkema, HW, Orsel, K, Nielsen, SS, Koets, AP, Rutten, VPMG, Bannantine, JP, et al. Knowledge gaps that hamper prevention and control of Mycobacterium avium subspecies paratuberculosis infection. Transbound Emerg Dis. (2018) 65:125–48. doi: 10.1111/tbed.12723
46. Fanelli, A, Buonavoglia, D, Pleite, CMC, and Tizzani, P. Paratuberculosis at European scale: an overview from 2010 to 2017. Vet Ital. (2020) 56:13–21. doi: 10.12834/VetIt.1829.9692.3
47. Sergeant, ESG, Nielsen, SS, and Toft, N. Evaluation of test strategies for estimating probability of low prevalence of paratuberculosis in Danish dairy herds. Prev Vet Med. (2008) 85:92–106. doi: 10.1016/j.prevetmed.2008.01.005
48. McAloon, CG, Macken-Walsh, Á, Moran, L, Whyte, P, More, SJ, O’Grady, L, et al. La enfermedad de Johne a los ojos de los ganaderos irlandeses: un enfoque cualitativo de investigación narrativa para comprender las implicaciones para el manejo de la enfermedad. Prev Vet Med. (2017) 141:7–13. doi: 10.1016/j.prevetmed.2017.04.001
49. Nielsen, SS y Toft, N. Diagnóstico ante mortem de la paratuberculosis: una revisión de las precisiones de ELISA, ensayo de γ de interferón y técnicas de cultivo fecal. Microbiol veterinario. (2008) 129:217–35. doi: 10.1016/j.vetmic.2007.12.011
50. Johnson, P, McLeod, L, Campbell, J, Rousseau, M, Larson, K y Waldner, C. Estimación de la sensibilidad y especificidad del ELISA sérico y la PCR fecal agrupada e individual para detectar Mycobacterium avium subespecie paratuberculosis en rebaños canadienses de vacas y terneros utilizando modelos bayesianos de clases latentes. Front Vet Sci. (2022) 9:937141. doi: 10.3389/fvets.2022.937141
51. Sweeney, RW, Whitlock, RH, Buckley, CL, y Spencer, PA. Evaluación de un ensayo comercial de inmunoadsorción enzimática para el diagnóstico de Paratuberculosis en ganado lechero. J Vet Diagnostic Investig. (1995) 7:488–93. doi: 10.1177/104063879500700411
52. Collins, MT . Diagnóstico de la paratuberculosis. Vet Clin North Am Food Anim Pract. (1996) 12:357–71. doi: 10.1016/S0749-0720(15)30411-4
53. Nielsen, SS, y Ersbøll, AK. Edad de aparición de Mycobacterium avium subespecie paratuberculosis en vacas lecheras infectadas de forma natural. J Dairy Sci. (2006) 89:4557–66. doi: 10.3168/jds. S0022-0302(06)72505-X
54. Whitlock, RH, Wells, SJ, Sweeney, RW y Van Tiem, J. ELISA y cultivo fecal para la paratuberculosis (enfermedad de Johne): sensibilidad y especificidad de cada método. Microbiol veterinario. (2000) 77:387–98. doi: 10.1016/S0378-1135(00)00324-2
55. Tiwari, A, VanLeeuwen, JA, McKenna, SLB, Keefe, GP, y Barkema, HW. Enfermedad de Johne en Canadá parte I: síntomas clínicos, fisiopatología, diagnóstico y prevalencia en rebaños lecheros. ¿Puede Vet J. (2006) 47:874–82.
56. Keller, SM, Stephan, R, Kuenzler, R, Meylan, M y Wittenbrink, MM. Comparación del cultivo fecal y la reacción en cadena de la polimerasa en tiempo real F57 para la detección de Mycobacterium avium subespecie paratuberculosis en rebaños de ganado suizo con antecedentes de paratuberculosis. Acta Vet Scand. (2014) 56:68. doi: 10.1186/s13028-014-0068-9
57. Gurung, RB, Begg, DJ y Whittington, RJ. Un estudio serológico nacional para determinar la prevalencia de la paratuberculosis en el ganado bovino de Bhután tras la detección de casos clínicos. Vet Med Sci. (2018) 4:288–95. doi: 10.1002/vms3.114
58. Correa-Valencia, NM, Ramírez, NF, Arango-Sabogal, JC, Fecteau, G, y Fernández-Silva, JA. Prevalencia de infección por Mycobacterium avium subsp. paratuberculosis en rebaños lecheros del norte de Antioquia (Colombia) y factores de riesgo asociados mediante muestreo ambiental. Prev Vet Med. (2019) 170:104739. doi: 10.1016/j.prevetmed.2019.104739
59. Departamento de Agricultura de los Estados Unidos (USDA) . Servicios de inspección zoosanitaria y vegetal. Enfermedad de Johne en U. S. Dairies, 1991–2007. (2008). Disponible en: https://www.aphis.usda.gov/animal_health/nahms/dairy/downloads/dairy07/Dairy07_is_Johnes_1.pdf
60. Nielsen, SS, y Toft, N. Una revisión de las prevalencias de paratuberculosis en animales de granja en Europa. Prev Vet Med. (2009) 88:1–14. doi: 10.1016/j.prevetmed.2008.07.003
61. Oficina Federal de Seguridad Alimentaria y Veterinaria . Ordenanza suiza de sanidad animal, art. 4, art. 237a. (1995). Disponible en: https://www.infosm.blv.admin.ch/bulletin/2023/39
62. Meylan, M, Nicolet, J, Busato, A, Burnens, A, y Martig, J. Étude de prévalence de la paratuberculose dans la région du Plateau de Diesse. Schweiz Arch Tierheilkd. (1995) 137:22–5.
63. Stärk, KDC, Frei-Stäheli, C, Frei, PP, Pfeiffer, DU, Danuser, J, Audigé, L, et al. Häufigkeit und Kosten von Gesundheitsproblemen bei Schweizer Milchkühen und deren Kälbern (1993-1994). Schweiz Arch Tierheilkd. (1997) 139:343–53.
64. Corti, S, y Stephan, R. Detección de secuencias de inserción IS900 específicas de la subespecie Mycobacterium avium paratuberculosis en muestras de leche de tanques a granel obtenidas de diferentes regiones de Suiza. BMC Microbiol. (2002) 2:15. doi: 10.1186/1471-2180-2-15
65. Bögli-Stuber, K, Kohler, C, Seitert, G, Glanemann, B, Antognoli, MC, Salman, MD, et al. Detección de Mycobacterium avium subespecie paratuberculosis en ganado lechero suizo mediante PCR en tiempo real y cultivo: una comparación de los dos ensayos. J Appl Microbiol. (2005) 99:587–97. doi: 10.1111/j.1365-2672.2005.02645.x
66. Künzler, R, Torgerson, P, Keller, S, Wittenbrink, MM, Stephan, R, Knubben-Schweizer, G, et al. Prácticas de manejo observadas en relación con el riesgo de infección por paratuberculosis y con la propagación de Mycobacterium avium subsp. paratuberculosis en rebaños lecheros y de carne suizos. BMC Vet Res. (2014) 10:132. doi: 10.1186/1746-6148-10-132
67. Ausvet . Epitools – Calculadoras Epidemiológicas. Disponible en: https://epitools.ausvet.com.au/
68. Glanemann, B, Hoelzle, LE, Bögli-Stuber, K, Jemmi, T y Wittenbrink, MM. Detección de Mycobacterium avium subespecie paratuberculosis en ganado lechero suizo por cultivo y serología. Schweiz Arch Tierheilkd. (2004) 146:409–15. doi: 10.1024/0036-7281.146.9.409
69. Stephan, R, Bühler, K, y Corti, S. Incidencia de Mycobacterium avium subespecie paratuberculosis en muestras de leche de tanques a granel de diferentes regiones de Suiza. Rec. Veterinario (2002) 150:214–5. doi: 10.1136/vr.150.7.214
70. Friedrich-Loeffler-Institute, Laboratorio Nacional de Referencia para la Paratuberculosis, Greifswald – Insel Riems, Alemania. Disponible en: https://www.fli.de/de/institute/institut-fuer-molekulare-pathogenese-imp/referenzlabore/nrl-fuer-paratuberkulose/ (consultado el 5 de abril de 2021).
72. Holstein Suiza . Herdebuchbestand. (2022). Bestandesliste der weiblichen Tiere. Disponible en: https://www.holstein.ch/wp-content/uploads/2019/06/effectif_hb_par_canton_2018.pdf
73. Libro de pastores suizos . Herdebuchbestand. (2022). Disponible en: https://www.swissherdbook.ch/de/
74. Berghaus, RD, Lombard, JE, Gardner, IA, y Farver, TB. Análisis factorial de un cuestionario de evaluación del riesgo de la enfermedad de Johne con evaluación de puntuaciones factoriales y un subconjunto de preguntas originales como predictores de paratuberculosis clínica observada. Prev Vet Med. (2005) 72:291–309. doi: 10.1016/j.prevetmed.2005.07.011
75. Roussel, AJ, Libal, MC, Whitlock, RL, Hairgrove, TB, Barling, KS y Thompson, JA. Prevalencia y factores de riesgo de paratuberculosis en bovinos de carne de raza pura. J Am Vet Med Assoc. (2005) 226:773–8. doi: 10.2460/javma.2005.226.773
76. Nielsen, SS, Bjerre, H, y Toft, N. El calostro y la leche como factores de riesgo de infección por Mycobacterium avium subespecie paratuberculosis en el ganado lechero. J Dairy Sci. (2008) 91:4610–5. doi: 10.3168/jds.2008-1272
77. Fecteau, ME, y Whitlock, RH. Tratamiento y quimioprofilaxis para la Paratuberculosis. Vet Clin North Am Food Anim Pract. (2011) 27:547–57. doi: 10.1016/j.cvfa.2011.07.002
78. Wolf, R, Barkema, HW, De Buck, J y Orsel, K. Las granjas lecheras que dan positivo en las pruebas de Mycobacterium avium ssp. paratuberculosis tienen prácticas de higiene más deficientes y son menos cautelosas al comprar ganado que los rebaños con resultados negativos. J Dairy Sci. (2016) 99:4526–36. doi: 10.3168/jds.2015-10478
80. Colegio Rural de Escocia . Calculadora de sensibilidad/especificidad del rebaño. Disponible en: https://epidemiology.sruc.ac.uk/shiny/apps/herd-sens-spec/
81. Myers, JL, y Well, AD. Diseño de investigación y análisis estadístico. 2ª ed. Nueva York: Taylor y Francis (2003). 508 págs.
82. Pozzato, N, Capello, K, Comin, A, Toft, N, Nielsen, SS, Vicenzoni, G, et al. Prevalencia de la infección por paratuberculosis en el ganado lechero del norte de Italia. Prev Vet Med. (2011) 102:83–6. doi: 10.1016/j.prevetmed.2011.07.001
83. Ozsvari, L, Lang, Z, Monostori, A, Kostoulas, P y Fodor, I. Estimación bayesiana de la verdadera prevalencia de la paratuberculosis en los rebaños de ganado lechero húngaro. Prev Vet Med. (2020) 183:105124. doi: 10.1016/j.prevetmed.2020.105124
84. Oficina Federal de Estadística, Suiza . Estructuras Agrícolas. (2022). Disponible en: https://www.bfs.admin.ch/bfs/de/home/statistiken/land-forstwirtschaft/landwirtschaft/strukturen.html#:~:text=DieverbleibendenBetriebevergrösserten2022,über20Hektarenerneutan.
85. Jakobsen, MB, Alban, L, y Nielsen, SS. Estudio transversal de la paratuberculosis en 1155 vacas lecheras danesas. Prev Vet Med. (2000) 46:15–27. doi: 10.1016/S0167-5877(00)00138-0
86. Villamil, FJ, Yus, E, Benavides, B, Casal, J, Moya, SJ, Allepuz, A, et al. Factores de riesgo asociados a la introducción de Mycobacterium avium ssp. paratuberculosis en rebaños lecheros en Galicia, noroeste de España. J Dairy Sci. (2020) 103:7411–5. doi: 10.3168/jds.2020-18210
87. Çetinkaya, B, Erdogan, HM, y Morgan, KL. Relaciones entre la presencia de la enfermedad de Johne y los factores agrícolas y de manejo en el ganado lechero en Inglaterra. Prev Vet Med. (1997) 32:253–66. doi: 10.1016/S0167-5877(97)00028-7
88. Sorge, EE. UU., Lissemore, K, Godkin, A, Hendrick, S, Wells, S y Kelton, D. Asociaciones entre el resultado de ELISA de leche paratuberculosa, la producción de leche y la raza en vacas lecheras canadienses. J Dairy Sci. (2011) 94:754–61. doi: 10.3168/jds.2010-3404
89. Gilardoni, LR, Paolicchi, FA, y Mundo, SL. Paratuberculosis bovina: una revisión de las ventajas y desventajas de diferentes pruebas diagnósticas. Rev Argent Microbiol. (2012) 44:201–15.
90. Adaska, JM, Muñoz-Zanzi, CA, y Hietala, SK. Evaluación de la variabilidad de los resultados con un kit comercial de ensayo de inmunoadsorción enzimática de la enfermedad de Johne y repetición de pruebas de muestras. J Vet Diagnostic Investig. (2002) 14:423–6. doi: 10.1177/104063870201400513
91. Nielsen, SS y Toft, N. ELISA de leche de tanque a granel para la detección de anticuerpos contra Mycobacterium avium subsp. paratuberculosis: correlación entre pruebas repetidas y prevalencia de anticuerpos dentro del rebaño. Prev Vet Med. (2014) 113:96–102. doi: 10.1016/j.prevetmed.2013.10.013
92. Jayarao, BM, Pillai, SR, Wolfgang, DR, Griswold, DR, Rossiter, CA, Tewari, D, et al. Evaluación del ensayo IS900-PCR para la detección de la infección por paratuberculosis de la subespecie Mycobacterium avium en bovinos utilizando muestras de leche de cuarto de leche y de tanque a granel. Foodborne Pathog Dis. (2004) 1:17–26. doi: 10.1089/153531404772914428
93. van Weering, H, van Schaik, G, van der Meulen, A, Waal, M, Franken, P, y van Maanen, K. Rendimiento diagnóstico del ELISA de Pourquier para la detección de anticuerpos contra Mycobacterium avium subespecie paratuberculosis en muestras individuales de leche y leche a granel de rebaños lecheros. Microbiol veterinario. (2007) 125:49–58. doi: 10.1016/j.vetmic.2007.05.010
94. McKenna, SLB, Keefe, GP, Tiwari, A, VanLeeuwen, J, y Barkema, HW. Enfermedad de Johne en Canadá parte II: impactos de la enfermedad, factores de riesgo y programas de control para productores de leche. ¿Puede Vet J. (2006) 47:1089–99.
95. Fecteau, ME, Whitlock, RH, Buergelt, CD, y Sweeney, RW. Exposición de ganado lechero joven a Mycobacterium avium subsp. paratuberculosis (MAP) a través del pastoreo intensivo de pastos contaminados en un rebaño positivo para la enfermedad de Johne. ¿Puede Vet J. (2010) 51:198–200.
96. Gloor, M, Kaufmann, T, Peterhans, E, Zanoni, R, Steiner, A, y Kirchhofer, M. Aufzuchtbetriebe als Verbreitungsquelle des BVD-Virus? Schweiz Arch Tierheilkd. (2007) 149:345–51. doi: 10.1024/0036-7281.149.8.345
97. Obritzhauser, W, Klemens, F, y Josef, K. Riesgo de infección por el BVDV en el curso del programa voluntario de erradicación del BVDV en Estiria/Austria. Prev Vet Med. (2005) 72:127–32. doi: 10.1016/j.prevetmed.2005.08.008
Palabras clave: paratuberculosis, lácteos, serología, ELISA, baja seroprevalencia, rebaños pequeños, factores de riesgo, Suiza
Cita: Ottardi M, Lechner I, Wang J, Schmitt S, Schneeberger M, Schmid RM, Stephan R y Meylan M (2024) Seroprevalencia de Mycobacterium avium subsp. paratuberculosis en rebaños lecheros suizos y factores de riesgo para un estado positivo del rebaño y prevalencia dentro del rebaño. Frente. Vet. Sci. 11:1409694. doi: 10.3389/fvets.2024.1409694
Recibido: 30 de marzo de 2024; Aceptado: 18 de junio de 2024;
Publicado: 28 de junio de 2024.
Editado por:
Cinzia Marianelli, Instituto Nacional de Salud (ISS), Italia
Revisado por:
Matteo Ricchi, Instituto Zooprofiláctico Experimental de Lombardía y Emilia Romagna (IZSLER), Italia
Jens Böttcher, Tiergesundheitsdienst Bayern, Alemania
Muhammad Hammad Hussain, Universidad Sultán Qaboos, Omán
Kamal Eltom, Universidad de Jartum, Sudán
Derechos de autor © 2024 Ottardi, Lechner, Wang, Schmitt, Schneeberger, Schmid, Stephan y Meylan. Este es un artículo de acceso abierto distribuido bajo los términos de la Licencia Creative Commons Attribution License (CC BY).
*Correspondencia: Mireille Meylan, mireille.meylan@unibe.ch
Renuncia: Todas las afirmaciones expresadas en este artículo son únicamente las de los autores y no representan necesariamente a las de sus organizaciones afiliadas, o las del editor, de los editores y de los revisores. Cualquier producto que puede ser evaluada en este artículo o afirmación que puede ser hecha por su El fabricante no está garantizado ni respaldado por el editor.
Date de alta y recibe nuestro 👉🏼 Diario Digital AXÓN INFORMAVET ONE HEALTH
Date de alta y recibe nuestro 👉🏼 Boletín Digital de Foro Agro Ganadero
Noticias animales de compañía
Noticias animales de producción
Trabajos técnicos animales de producción
Trabajos técnicos animales de compañía

