Tasas de transmisión del virus de la leucemia bovina en vacas lecheras infectadas linfocitóticas persistentes
 Bibiana Benavides1
Bibiana Benavides1 Gustavo Monti2*
Gustavo Monti2*- 1Departamento de Sanidad Animal, Universidad de Nariño, San Juan de Pasto, Colombia
- número arábigoGrupo de Epidemiología Veterinaria Cuantitativa, Universidad de Wageningen, Wageningen, Países Bajos
El virus de la leucemia bovina (BLV) establece una infección persistente de por vida en el ganado lechero. El recuento de glóbulos blancos (WBC, por sus siglas en inglés) se correlaciona con la carga proviral en la sangre y la leche del ganado infectado por el BLV, y las pruebas de WBC se pueden utilizar para evaluar tanto los niveles de infecciosidad del BLV como el riesgo de transmisión del BLV de diferentes tipos de animales infectados. El objetivo del estudio fue comparar las tasas efectivas de transmisión (β) y el índice básico de reproducción (Ro) entre dos tipos de vacas lecheras infectadas por BLV en Chile: aquellas afectadas con linfocitosis persistente (PL) vs. aleucémicas (AL). El coeficiente estimado (β) fue mayor en el ganado PL [1,1; intervalo de confianza [IC] del 95% (−1,6, 3,8)], en comparación con el ganado AL (−3,1; IC del 95% = −3,7, −2,5). Además, el Ro fue mayor en el ganado PL (60,4; IC 95% = 3,5; 820,6), en comparación con el ganado AL (1,5; IC 95% = 0,7, 3,1). La relación entre la tasa de casos esperados de PL/AL fue de 73,9. La tasa de transmisión efectiva estimada y el Ro fueron mayores en el ganado PL en comparación con el ganado AL. La prueba de leucocitos es una alternativa conveniente que se puede considerar para la identificación y el manejo del riesgo de infección por BLV en rebaños lecheros; particularmente en las regiones ganaderas donde la capacidad de laboratorio es limitada (por ejemplo, el uso de técnicas de PCR o secuenciación de genes) y/o las pruebas moleculares no son rentables. Por lo tanto, cuando la prevalencia de la infección es alta, se debe realizar la eliminación del ganado PL para controlar el BLV dentro de los rebaños.
1 Introducción
El virus de la leucemia bovina (BLV) es un retrovirus del género Deltaretrovirus, que causa linfocitosis y linfosarcoma mortal en tejidos linfoides bovinos (1).
El virus de la leucemia bovina se transmite a través de linfocitos infectados por provirus (2) a través de varias vías. Sin embargo, la transmisión horizontal es la vía más común de infección y se produce a través de la transferencia iatrogénica de sangre de vacas infectadas a animales susceptibles. Estas transferencias surgen debido a las prácticas de manejo del rebaño (3-5) o por insectos hematófagos (6).
El ganado infectado con BLV se convierte en portador del virus de por vida. Los informes cualitativos que utilizan técnicas moleculares han puesto de relieve la posibilidad de que existan diferencias en los niveles de infecciosidad en función de las cargas provirales altas o bajas (7, 8).
Los enfoques de prueba y sacrificio se han utilizado en programas de erradicación en todo el mundo. La realización de pruebas frecuentes a todos los bovinos susceptibles y el sacrificio de los individuos seropositivos son medidas adoptadas para reducir la prevalencia del BLV y, en última instancia, erradicar el virus en los rebaños infectados (9). Sin embargo, el sacrificio de animales con resultados positivos en las pruebas a menudo no es económicamente factible ni práctico en rebaños donde la prevalencia del BLV es alta (10). En esas situaciones, se ha propuesto centrarse en el sacrificio estratégico del ganado bovino de alta carga viral, ya que esto puede reducir el riesgo de transmisión y disminuir la prevalencia dentro del rebaño a un nivel en el que sea posible eliminar todos los animales con resultados positivos en la prueba (10).
Para muchas industrias en todo el mundo, la capacidad de laboratorio es limitada (por ejemplo, el uso de PCR o secuenciación de genes) y/o estas pruebas no son rentables para su uso rutinario en pruebas masivas. Por lo tanto, se requiere una prueba más simple que pueda usarse como un proxy para la identificación y el manejo del riesgo de infección por BLV en el ganado, y la prueba de recuento de glóbulos blancos (WBC) es una sonda simple y conocida que puede cumplir ese propósito. Aunque pocos animales infectados pueden tener una carga proviral alta y un recuento normal de linfocitos (8), el ganado con linfocitosis persistente (PL) tiene más probabilidades de tener una carga proviral más alta que el ganado con un recuento normal de leucocitos (8, 11-14).
Además, es importante medir el impacto de los diferentes niveles de infecciosidad en la dinámica de transmisión en las poblaciones animales, para evaluar la influencia potencial de dicha estrategia de control. Dado que no se dispone de información sobre los distintos grados de infección entre los animales infectados por el BLV, un enfoque consiste en obtener una medición cuantitativa de la infectividad diferencial (15). La transmisión puede medirse en estudios longitudinales de campo y expresarse utilizando la métrica del índice de reproducción básico (R0), que es un parámetro esencial en el manejo de las enfermedades infecciosas. R0 describe el número promedio de casos secundarios dentro de una población susceptible que un individuo infeccioso típico causará en el transcurso de su período infeccioso (16). R0 tiene un valor umbral de 1, y si R0 > 1, pueden producirse brotes menores y mayores, y puede establecerse y mantenerse una situación endémica. Sin embargo, cuando R0 < 1, una infección no se propaga y la infección se desvanecerá (16, 17). Para el BLV, se ha estimado un R0 global (18), pero esto se basó en la suposición de que todos los animales infectados por BLV son igualmente infecciosos.
Como tal, este estudio tuvo como objetivo comparar las tasas efectivas de transmisión (β) y el R0 entre vacas lecheras infectadas por BLV en Chile afectadas por PL o AL.
2 Materiales y métodos
2.1 Rebaños de estudio
El estudio, realizado entre 2006 y 2007, involucró a 1.527 vacas lecheras en 11 hatos lecheros comerciales en Chile (1). Las granjas se seleccionaron con base en la información de antecedentes obtenida de un estudio previo de BLV en el sur de Chile que había muestreado granjas infectadas (19). Las vacas lecheras incluidas en este estudio estuvieron en pastura durante todo el año, la raza principal fue Holstein y las prácticas de manejo grupal que se consideraron fueron si montadas en toro, inseminación artificial, palpación rectal y uso de inyecciones con aguja simple o común para tratamientos o vacunación.
2.2 Diseño del estudio
El estudio se diseñó como un estudio observacional de cohorte con un período de seguimiento de 6 meses, dado que los rebaños seleccionados en este estudio analizaron y sacrificaron animales positivos y un período prolongado habría resultado en una gran pérdida de seguimiento y un inconveniente para alcanzar el tamaño de muestra requerido. Para estimar el tamaño de la muestra necesaria, se utilizó la siguiente fórmula (20), que consideró el número de individuos (N) en cada grupo por una diferencia en las proporciones p1-p 2 entre dos grupos a lo largo del tiempo:
N=[Zα(2pq)1/2+Zβ(p1q1+p2q2)1/2]2(1+(n−1)ρ)n(p1−p2)2𝑁=𝑍𝛼2𝑝𝑞1/2+𝑍𝛽𝑝1𝑞1+𝑝2𝑞21/221+𝑛−1𝜌𝑛𝑝1−𝑝22
Dónde:
Zα = valor Z para el tipo de error I; Zβ = valor Z para el tipo de error II; p1 = cociente de respuesta en el grupo expuesto (q1 = 1 − p1); p2 = cociente de respuesta en el grupo no expuesto (q2 = 1 − p2); p = (p1 + p2)/2; q = 1 – p; es la correlación común esperada entre n observaciones.ρ𝜌
El grupo 1 incluyó animales infectados que presentaron PL (p1), mientras que el grupo 2 (p2) fueron animales infectados con AL. Se esperaba una proporción de animales infectados para p1 = 35% y p2 = 5%, en función del potencial de transmisión de los individuos según su estado linfocitario (8). La correlación entre las muestras se fijó en 0,6, y se asumió un error tipo I y II de 5 y 20%, respectivamente. Por lo tanto, se requirió un mínimo de 18 observaciones para cada grupo. El estudio incluyó 45 animales que desarrollaron PL, lo que superó el tamaño de la muestra calculada, lo que garantizó que encontraríamos (si existiera) la diferencia entre los grupos en cuanto a la capacidad de transmisión según su estado linfocítico.
A cada vaca se le tomaron muestras mensualmente y se le realizaron pruebas de anticuerpos contra el BLV, mientras que los glóbulos blancos de cada vaca se analizaron el día 0 y el día 180.
2.3 Recogida de muestras de sangre
Se recolectaron muestras de sangre (6 mL) de la vena coxígea media vía venopunción, 3 mL se recolectaron en tubos de EDTA para realizar los leucocitos y frotis, y 3 mL se recolectaron en un tubo sin EDTA para obtener el suero de cada animal, luego se refrigeraron hasta llegar a un laboratorio designado en la Universidad Austral de Chile. Las muestras de sangre se centrifugaron y las muestras de suero se identificaron con un código numérico único y se almacenaron en tubos de Eppendorf a -20 °C hasta su posterior procesamiento (1).
2.4 Recogida de muestras de leche
El personal de la granja obtuvo muestras de leche compuesta (5 mL) de cada vaca del estudio durante el ordeño. Las muestras de leche se recolectaron en tubos de ensayo y se les asignó un número único, luego se refrigeraron hasta que llegaron a un laboratorio designado en la Universidad Austral de Chile (1).
2.5 Procedimientos de laboratorio
Las muestras de suero y leche se analizaron utilizando kits ELISA bloqueantes comerciales (INGEZIM BLV COMPAC 2.0) basados en los anticuerpos monoclonales gp51, siguiendo los protocolos recomendados por los fabricantes. La prueba permite la detección de anticuerpos específicos en el suero o la leche bovina (1).
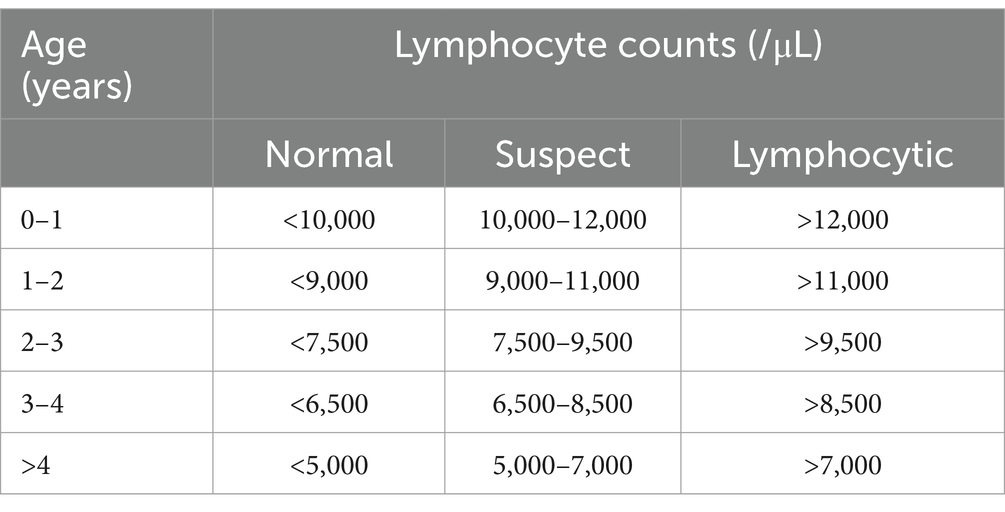
Para realizar el hemograma completo, se utilizó un contador Sysmex KX-21 N. Diluimos las muestras de sangre en una proporción de cuatro unidades de agua destilada por una unidad de sangre, y el contador proporcionó automáticamente los leucocitos / mm3. Los frotis se montaron en portaobjetos teñidos con colorante rápido Corzap, y luego se observaron bajo un microscopio convencional a un aumento de 100X para obtener el recuento diferencial. Se contaron 100 células por frotis y se calculó el valor absoluto multiplicando el número relativo de linfocitos en el frotis por el número total de leucocitos. El recuento absoluto de linfocitos debe interpretarse conjuntamente con la edad del animal (21). En el cuadro 1 se resume la clave de la Comunidad Europea (CE) (clave Bendixen) que se utilizó a tal efecto (22). Un animal PL se definió como aquel que estaba infectado y presentaba linfocitosis en dos muestras de sangre tomadas con 6 meses de diferencia. Un animal AL se definió como aquel que estaba infectado pero que no mostraba linfocitosis o solo mostraba linfocitosis en una muestra de sangre.
2.6 Recopilación de datos
Para cada vaca de estudio, se recopilaron los siguientes datos: identificación del rebaño del estudio (A-K), identificación de la vaca, edad (años), fecha(s) de muestreo, resultado de la prueba ELISA (negativo, positivo), glóbulos blancos y estado de BLV (positivo, negativo).
2.7 Análisis y procesamiento de datos
Para conjeturar los parámetros de transmisión, compilamos datos utilizando información de los registros de cada granja (que cubren un período de 1 año) y luego estimamos la fecha más probable de infección para los nuevos casos.
En el caso de las vacas que dieron negativo en la primera muestra, se calculó el tiempo de riesgo desde el muestreo inicial (censura a la izquierda) hasta el tiempo estimado de infección (como se detalla a continuación), o se censuró a la derecha al final del estudio.
2.7.1 Estimación del momento más probable de infección y de la tasa efectiva de transmisión
Debido a que se desconocía el momento exacto en que se produjo cada nueva infección, estimamos el posible momento de la infección siguiendo el método descrito anteriormente (18). Sin embargo, es importante tener en cuenta que la fecha de la seroconversión observada no se corresponde con el momento de la infección porque las vacas no fueron sangradas y sometidas diariamente a pruebas para la detección del virus. Además, hay un retraso de tiempo entre la fecha de la infección y el momento en que una prueba puede detectar un cierto nivel de anticuerpos. Por lo tanto, el momento más probable de infección puede deducirse probabilísticamente utilizando la última observación de un resultado serológico negativo (tk1-1) y el momento de la primera observación positiva (tk1) (18). Brevemente, para analizar los datos y obtener el momento más probable de infección, utilizamos un enfoque bayesiano basado en el concepto de intervalos censales para el análisis de supervivencia (23). A partir de cada animal que se seroconvirtió, la mediana (en días) de la probabilidad de infectarse se calculó como una distribución posterior, con cifras obtenidas de la distribución anterior y la fecha de seroconversión observada a partir del conjunto de datos. La distribución gamma previa se obtuvo utilizando los resultados de un estudio previo que estimó el tiempo hasta la seroconversión después de la infección experimental por BLV (2); mientras que el conjunto de datos incluyó el intervalo entre muestreos y los resultados de ELISA de cada vaca por muestreo. La mediana derivada de la distribución posterior representó el momento más probable de infección. Los cálculos se realizaron utilizando WinBUGS V.1.4 (24).
La tasa de transmisión efectiva (β) representa el número de nuevas infecciones (por unidad de tiempo) generadas por un individuo infeccioso después del contacto con individuos susceptibles (25). Existen muchos enfoques para estimar esta tasa de transmisión. Una de las más utilizadas consiste en derivar la velocidad a partir de datos de transmisión observacionales o experimentales. El modelo epidémico Susceptible (S)-Infeccioso (I) se puede utilizar para evaluar la dinámica de la infección dentro del rebaño, con una vaca como unidad de interés y un término de transmisión βSI/N. Según el estudio, las vacas se observaron en grupos en un sistema de producción basado en pasturas, a partir del cual asumimos una mezcla homogénea. En este modelo, como se explica en Velthuis et al. (17), el número de vacas recién infectadas E(CS)𝐸𝐶𝑆 en un intervalo de tiempo (dt) se distribuye aproximadamente binomialmente con una probabilidad,
pinf(t,Δt)=1−e−βt∗ItNt∗dt𝑝Inf𝑡,Δ𝑡=1−𝑒−𝛽𝑡∗Yo𝑡𝑁𝑡∗𝑑𝑡
Sobre la base de este cálculo, el valor máximo de verosimilitud para el parámetro de velocidad de transmisión β puede obtenerse ajustando un modelo lineal generalizado (GLM) con una función complementaria de enlace logarítmico-logarítmico y log (I(t)/N(t)) como variable de desplazamiento (17, 25).
Sin embargo, el modelo anterior puede ajustarse para tener en cuenta la heterogeneidad en la infecciosidad de los individuos infectados, como lo demuestran otros autores (17). Para nuestro modelo, combinamos el resultado serológico y los recuentos de linfocitos para identificar dos tipos de animales infecciosos (I) (alto = PL y bajo = AL) y animales no infectados. Por lo tanto, la tasa de infección de S viene dada por βSI/N, y la probabilidad de que un solo animal susceptible se infecte durante un período de tiempo (dt) después de la exposición a dos tipos de individuos infecciosos es:
cloglogE(CS)=α+logβPL∗V1+log(ItNt)∗dtcloglog𝐸𝐶𝑆=𝛼+registro𝛽PL∗𝑉1+registroYo𝑡𝑁𝑡∗𝑑𝑡
Los coeficientes de regresión pueden interpretarse de la siguiente manera: α es la intersección y el logaritmo de la velocidad de transmisión de la referencia que es la transmisión directa de los individuos AL, y V1 es el efecto de la transmisión directa de los individuos PL.
Se ejecutaron dos modelos: uno general para obtener un parámetro de tasa de transmisión total para animales infecciosos sin discriminar su estado de PL, y otro que incluía ambos tipos de animales infectados relacionados con su infecciosidad. El intervalo de confianza (IC) del 95% de los parámetros de β estimados se calculó utilizando el error estándar de la media de log β. Todos los análisis se realizaron en el software R (26), utilizando el paquete lme4 (27), y se evaluó la bondad del ajuste de los modelos mediante los Criterios de Información de Akaike (AIC).
2.7.2 Relación de reproducción (R0)
El R0 básico es un parámetro clave en la teoría de la transmisión, que representa una condición umbral que determina si una enfermedad infecciosa se propagará en una población susceptible una vez que la enfermedad se ha introducido. En nuestro contexto epidemiológico, el R0 se calcula utilizando el producto del periodo infeccioso medio (1/γ) y la tasa efectiva de transmisión β (obtenida a partir del modelo GLM):
R0=β∗1/γ𝑅0=𝛽∗1𝛾
Estimamos 1/γ como la diferencia entre la mediana de edad en el momento de la infección y la esperanza de vida del ganado infectado por el BLV, porque los animales permanecen infectados durante el resto de sus vidas [basado en Monti et al. (28)]. La esperanza de vida de los animales infectados por AL, en promedio, fue de 3,4 años y, como no fue posible obtener información individual de los animales, asumimos que la esperanza de vida de los animales con PL era la mitad de la de aquellos con AL, dado el tiempo que se tarda en desarrollar la condición de PL (29).
3 Resultados
Sobre la base de los resultados de la prueba ELISA, 963 vacas dieron negativo, 459 vacas estaban infectadas [46,4%; IC 95% (43,3; 49,6%)] y 105 vacas (24,1%) fueron nuevos casos de vacas infectadas durante el período de seguimiento. También se identificaron 45 vacas [10,3%; IC 95% (7,8; 13,5%)] como infectadas y PL (Tabla 2).
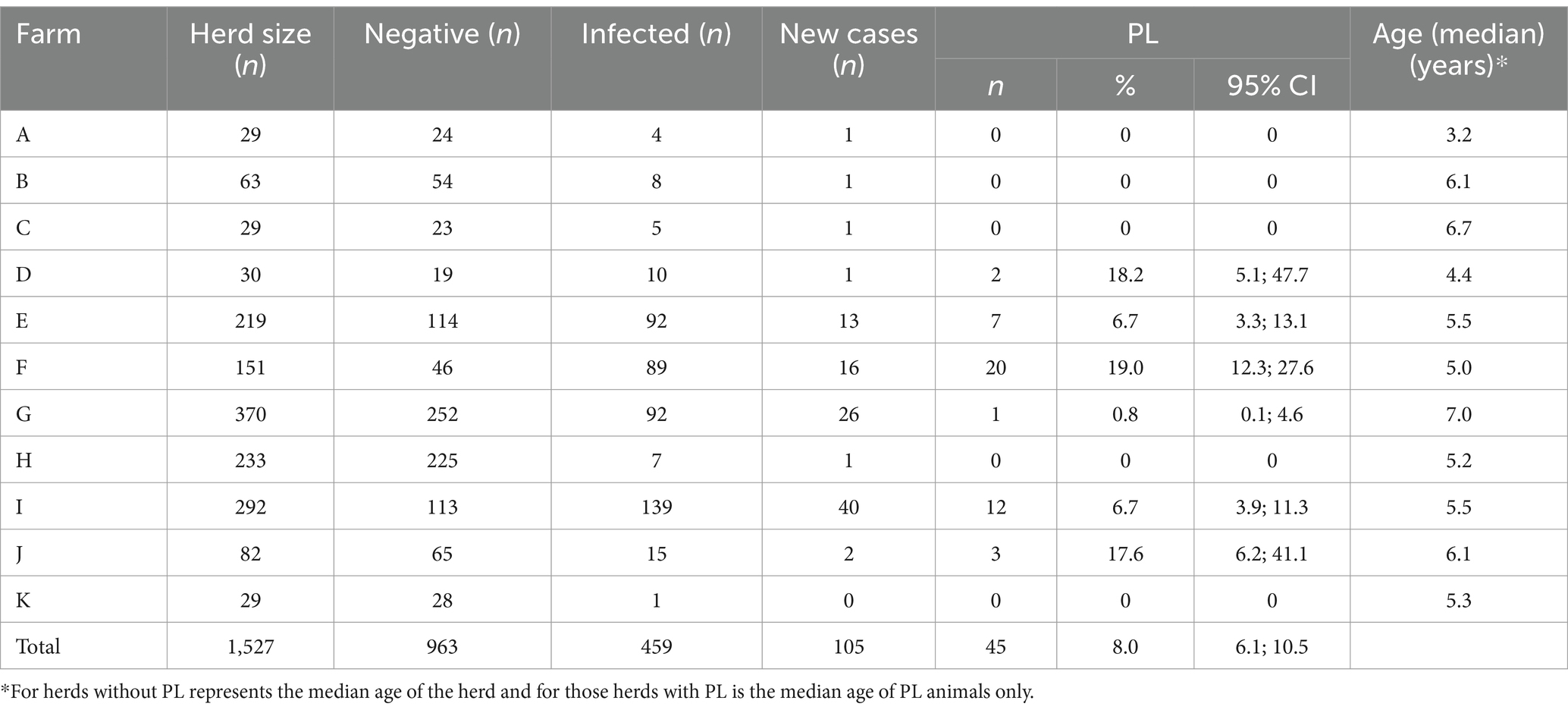
La proporción global de hatos infectados con el virus de la leucosis bovina en los hatos lecheros del sur de Chile fue de 34,7% [IC 95% (22,6, 44,1)] y la prevalencia aparente dentro del rebaño fue de 14,6% (19). En la población de estudio se encontró una prevalencia del 30,5% (IC 95% = 27,8; 32,4%), y la incidencia acumulada fue del 10,9% (IC 95% = 9,1; 13,0%), sin embargo, se observó una gran variabilidad entre fincas para ambos indicadores.
La proporción total de vacas que presentaron PL fue de 8,0% (IC95% = 6,1; 10,5%) (Tabla 2). Sin embargo, se observó una gran variabilidad entre fincas. La granja F presentó el mayor número de vacas PL (n = 20), aunque el porcentaje de PL fue similar al observado en las granjas D y J. Las vacas de las fincas evaluadas que tenían PL tenían más de 3 años, lo que es consistente con los resultados reportados en la literatura (30).
3.1 Tasa de transmisión efectiva (β) y relación de reproducción básica (R0)
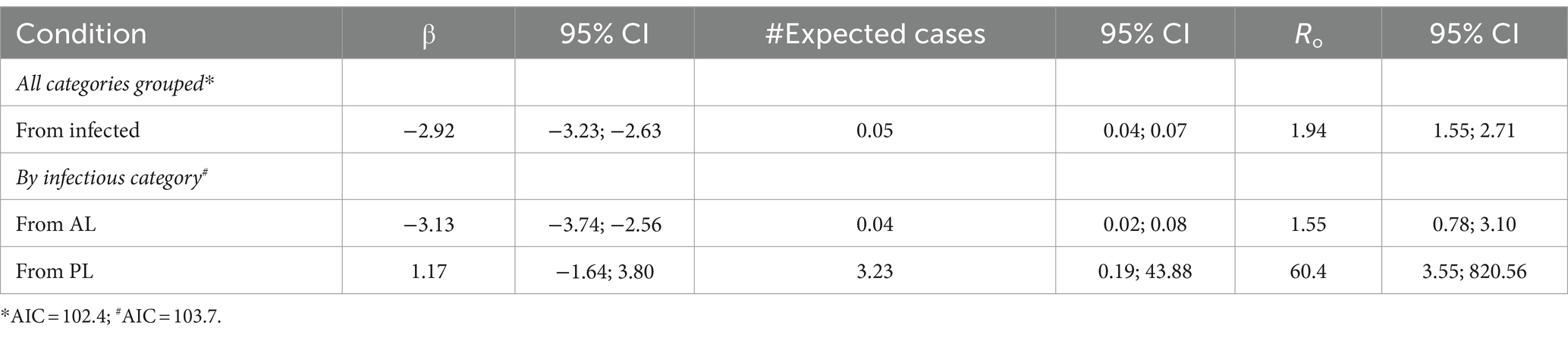
El β estimado (coeficiente) fue mayor en el ganado PL (1,1; IC 95% = −1,6, 3,8), en comparación con el ganado AL (−3,1; IC 95% = −3,7, −2,5). Además, el R0 fue mayor en el ganado PL (60,4: IC 95% = 3,5; 820,6), en comparación con el ganado AL (1,5; IC 95% = 0,7, 3,1) (Tabla 3).
4 Discusión
Es importante destacar que este estudio demuestra la diferencia significativa en el riesgo de transmisión de la infección por BLV en el ganado PL en comparación con aquellos con AL. PL es una condición que se puede monitorear fácilmente y recopilar información que se utiliza para establecer un programa de control de BLV basado en el riesgo.
La mayor infectividad en las vacas PL se refleja en la mayor tasa efectiva de transmisión, el número de casos esperados y el R0 que en las vacas AL. Estos resultados se asocian con un mayor número de linfocitos B circulantes (31) y una mayor carga proviral en comparación con aquellos con recuentos normales y baja carga proviral (8, 12, 14, 32-34), incluso cuando los animales estuvieron expuestos a las mismas prácticas de manejo.
En este estudio, el R0 fue mayor en el ganado PL (60,4) que en el vacuno AL, lo que sugiere que el estado de PL es un factor relevante en el proceso de transmisión poblacional. En promedio, una vaca PL infectará a otros 60 animales con BLV, mientras que una vaca AL solo infectará a dos. Los valores absolutos del β estimado y del R0 básico en el estudio fueron inferiores a los reportados en investigaciones previas (18), pero esto podría ser consecuencia de una menor prevalencia de BLV en los hatos chilenos en comparación con los estudiados previamente en Argentina. Además, alrededor del 10% de los animales infectados en el presente estudio desarrollaron una condición de linfocitosis persistente en un rango de edades superior a los 3 años, que fue menor que la descrita en la literatura previa (30% de los animales infectados mayores de 3 años) (8, 35).
Los hallazgos de este estudio tienen relevancia práctica porque respaldan el uso de una prueba más simple para tomar decisiones dentro de los programas de control de BLV, especialmente para rebaños con una gran prevalencia de infección y agricultores o profesionales con menos acceso a laboratorios mejor equipados. El conocimiento de esta herramienta podría fomentar una mayor implementación de un programa de control de pruebas y remoción que sea más sostenible y accesible para los productores de leche en muchos países. Nuestros hallazgos muestran que este enfoque de prueba tiene éxito en la reducción de la carga de la infección y proporciona un criterio alternativo para el sacrificio selectivo, por ejemplo, cuando no se dispone de un laboratorio para las estimaciones de la carga proviral.
Sin embargo, el estudio tuvo algunas limitaciones. En primer lugar, la identificación de animales con alta/baja infecciosidad mediante el análisis de la carga viral es más precisa que el uso de glóbulos blancos. En segundo lugar, la duración limitada del período de observación del estudio (6 meses) no permitió una evaluación más exhaustiva de los efectos de la PL en la esperanza de vida de los animales infectados. Además, el pequeño tamaño de la muestra afectó el error estándar y el ancho de los IC para las velocidades de transmisión.
Finalmente, nuestros hallazgos sugieren que la AL sigue siendo infecciosa, ya que la infectividad y el Rbásico 0 es superior a 1. Por lo tanto, un programa de control basado únicamente en la eliminación de PL sería insuficiente para controlar o erradicar toda la transmisión del BLV en un rebaño. La eliminación de animales altamente infecciosos con PL se puede utilizar principalmente para reducir la prevalencia a un cierto nivel, después de lo cual se pueden utilizar otros enfoques efectivos, como pruebas y eliminación.
5 Conclusión
El β estimado y el R0 fueron mayores en el ganado PL que en el vacuno AL. La prueba de leucocitos es una opción viable que se puede considerar para la identificación de riesgos, la evaluación de riesgos y el manejo de riesgos de infección por BLV en rebaños lecheros; particularmente en regiones ganaderas donde la capacidad de laboratorio es limitada (por ejemplo, uso de técnicas de PCR o secuenciación de genes).
Declaración de disponibilidad de datos
Los datos brutos que respaldan las conclusiones de este artículo serán puestos a disposición por los autores, sin reservas indebidas.
Declaración ética
Los estudios en animales fueron aprobados por el Comité de Bioética «Uso de animales en la investigación» de la Universidad Austral de Chile. Los estudios se llevaron a cabo de acuerdo con la legislación local y los requisitos institucionales. No se obtuvo el consentimiento informado por escrito de los propietarios para la participación de sus animales en este estudio porque no era necesario en el momento del estudio.
Contribuciones de los autores
BB: Curación de datos, Análisis formal, Investigación, Validación, Visualización, Escritura – borrador original, Escritura – revisión y edición. GM: Conceptualización, Análisis formal, Obtención de fondos, Metodología, Supervisión, Redacción – borrador original, Redacción – revisión y edición.
Financiación
El/los autor/es declaran/n que se recibió apoyo financiero para la investigación, autoría y/o publicación de este artículo. Este trabajo contó con el apoyo de la Agencia Nacional de Investigación y Desarrollo a través del proyecto FONDECYT de Iniciación en Investigación #11060125. El organismo financiador no desempeñó ningún papel en el diseño, análisis y presentación de informes del estudio.
Reconocimientos
Los autores están especialmente en deuda con los agricultores, los profesionales y las empresas lácteas que colaboraron en este estudio.
Conflicto de intereses
Los autores declaran que la investigación se llevó a cabo en ausencia de relaciones comerciales o financieras que pudieran interpretarse como un posible conflicto de intereses.
Nota del editor
Todas las afirmaciones expresadas en este artículo son únicamente las de los autores y no representan necesariamente las de sus organizaciones afiliadas, ni las del editor, los editores y los revisores. Cualquier producto que pueda ser evaluado en este artículo, o afirmación que pueda ser hecha por su fabricante, no está garantizado ni respaldado por el editor.
Referencias
1. Benavides, B, y Monti, G. Evaluación de la transmisión natural del virus de la leucemia bovina en lecherías del sur de Chile. Animales. (2022) 12:1374. doi: 10.3390/ani12131734
Resumen de PubMed | Texto completo de Crossref | Google Académico
2. Monti, GE y Frankena, K. Análisis de supervivencia en datos agregados para evaluar el tiempo hasta la seroconversión después de la infección experimental por el virus de la leucemia bovina. Prev Vet Med. (2005) 68:241–62. doi: 10.1016/j.prevetmed.2005.01.009
Resumen de PubMed | Texto completo de Crossref | Google Académico
3. DiGiacomo, RF, Darlington, RL, y Evermann, JF. Transmisión natural del virus de la leucemia bovina en terneros lecheros por descorne. Can J Comp Med. (1985) 49:340–2.
4. Divers, TJ, Bartholomew, RC, Galligan, D, y Littel, C. Evidencia de transmisión del virus de la leucemia bovina por palpación rectal en un rebaño lechero comercial. Prev Vet Med. (1995) 23:133–41. doi: 10.1016/0167-5877(95)00464-8
5. Lucas, MH, Roberts, DH y Wibberley, G. Tatuarse las orejas como método de propagación de la infección por el virus de la leucosis bovina. Hno. Vet J. (1985) 141:647–9. doi: 10.1016/0007-1935(85)90013-2
Resumen de PubMed | Texto completo de Crossref | Google Académico
6. Buxton, BA, y Schultz, RD. Factores que afectan la infectividad de los linfocitos del ganado bovino con el virus de la leucosis bovina. Can J Comp Med. (1984) 48:365–9.
7. Kuczewski, A, Orsel, K, Barkema, HW, Mason, S, Erskine, R, y van der Meer, F. Transmisión, control y erradicación del virus de la leucemia bovina. J Dairy Sci. (2021) 104:6358–75. doi: 10.3168/jds.2020-18925
8. Juliarena, MA, Gutiérrez, SE, y Ceriani, C. Determinación de la carga proviral en bovinos infectados por el virus de la leucemia bovina con y sin linfocitosis. Am J Vet Res. (2007) 68:1220–5. doi: 10.2460/ajvr.68.11.1220
9. Bartlett, PC, Ruggiero, VJ, Hutchinson, HC, Droscha, CJ, Norby, B, Sporer, KRB, et al. Avances actuales en la epidemiología y el control de la leucosis bovina enzoótica causada por el virus de la leucemia bovina. Patógenos. (2020) 9:1058. doi: 10.3390/pathogens9121058
Resumen de PubMed | Texto completo de Crossref | Google Académico
10. Ruggiero, VJ, Norby, B, Benítez, OJ, Hutchinson, H, Sporer, KRB, Droscha, C, et al. Control del virus de la leucemia bovina en rebaños lecheros mediante la identificación y eliminación de las vacas con mayor carga proviral y recuento de linfocitos. J Dairy Sci. (2019) 102:9165–75. doi: 10.3168/jds.2018-16186
Resumen de PubMed | Texto completo de Crossref | Google Académico
11. Nakada, S, Kohara, J y Makita, K. Estimación de los niveles circulantes del virus de la leucemia bovina mediante recuentos convencionales de células sanguíneas. J Dairy Sci. (2018) 101:11229–36. doi: 10.3168/jds.2018-14609
Resumen de PubMed | Texto completo de Crossref | Google Académico
12. Álvarez, I, Gutiérrez, G, Gammella, M, Martínez, C, Politzki, R, González, C, et al. Evaluación del recuento total de glóbulos blancos como marcador de carga proviral del virus de la leucemia bovina en ganado lechero de rebaños con una alta seroprevalencia de anticuerpos contra el virus de la leucemia bovina. Am J Vet Res. (2013) 74:744–9. doi: 10.2460/ajvr.74.5.744
Resumen de PubMed | Texto completo de Crossref | Google Académico
13. González-Méndez, AS, Tortora Pérez, JL, Rojas-Anaya, E, y Ramírez, AH. Estudio de la expresión genética de factores de restricción antirretroviral y proteínas de fase aguda en bovinos infectados con el virus de la leucemia bovina. Patógenos. (2023) 12:529. doi: 10.3390/pathogens12040529
Resumen de PubMed | Texto completo de Crossref | Google Académico
14. Marín-Flamand, E, Araiza-Hernández, DM, Vargas-Ruiz, A, Rangel-Rodríguez, IC, González-Tapia, LA, Ramírez-Álvarez, H, et al. Relación de la linfocitosis persistente, los títulos de anticuerpos y la carga proviral con la expresión de interleucina-12, interferón-gamma, interleucina-2, interleucina-4, interleucina-10 y factor de crecimiento transformante beta-en vacas infectadas con el virus de la leucemia bovina de un complejo lácteo de alta prevalencia. Can J Vet Res. (2022) 86:269–85.
15. Hethcote, HW . Las matemáticas de las enfermedades infecciosas. SIAM Rev. (2000) 42:599–653. doi: 10.1137/S0036144500371907
16. De Jong, MC, y Kimman, TG. Cuantificación experimental de la reducción de la transmisión del virus inducida por vacunas. Vacuna. (1994) 12:761–6. doi: 10.1016/0264-410x(94)90229-1
Resumen de PubMed | Texto completo de Crossref | Google Académico
17. Velthuis, AG, De Jong, MC, Kamp, EM, Stockhofe, N, y Verheijden, JH. Diseño y análisis de un experimento de transmisión de Actinobacillus pleuropneumoniae. Prev Vet Med. (2003) 60:53–68. doi: 10.1016/s0167-5877(03)00082-5
18. Monti, GE, Frankena, K, y De Jong, MCM. Evaluación de la transmisión natural del virus de la leucemia bovina en rebaños lecheros de Argentina. Epidemiol Infect. (2007) 135:228–37. doi: 10.1017/S0950268806006637
Resumen de PubMed | Texto completo de Crossref | Google Académico
19. Grau, MA, y Monti, G. Seroprevalencia entre y dentro del rebaño para la infección por el virus de la leucosis bovina en rebaños lecheros del sur de Chile. Arch Med Vet. (2010) 42:87–91. doi: 10.4067/S0301-732X2010000200010
20. Diggle, P, Heagerty, P, Kung-yee, L, y Zeger, S En: Oxford editor. Análisis de datos longitudinales. 2ª ed. Oxford, Reino Unido: Oxford University Press (2002)
21. Bendixen, HJ . Medidas preventivas en la leucemia bovina: Leucosis Enzoótica Bovis. Ann N Y Acad Sci. (1963) 108:1241–67. doi: 10.1111/j.1749-6632.1963.tb13448.x
Resumen de PubMed | Texto completo de Crossref | Google Académico
22. Mekata, H, Yamamoto, M, Kirino, Y, Sekiguchi, S, Konnai, S, Horii, Y, et al. Nueva clave hematológica para el ganado negro japonés infectado por el virus de la leucemia bovina. J Vet Med Sci. (2018) 80:316–9. doi: 10.1292/jvms.17-0455
Resumen de PubMed | Texto completo de Crossref | Google Académico
23. Lassauzet, ML, Johnson, WO y Thurmond, MC. Modelos de regresión para el tiempo hasta la seroconversión después de la infección experimental por el virus de la leucemia bovina. Stat Med. (1989) 8:725–41. doi: 10.1002/sim.4780080610
24. Thomas, A, Best, N y Spiegelhalter, D. Winbugs: un marco de modelado bayesiano: conceptos, estructura y extensibilidad. Cálculo de estadísticas. (2000) 10:325–37. doi: 10.1023/A:1008929526011
25. Velthuis, AGJ, de Jong, MCM, De Bree, J, Nodelijk, G, y Van Boven, M. Cuantificación de la transmisión en experimentos uno a uno. Epidemiol Infect. (2002) 128:193–204. doi: 10.1017/S0950268801006707
Resumen de PubMed | Texto completo de Crossref | Google Académico
26. Equipo central de R (2021). R: Un lenguaje y un entorno para la computación estadística. R Foundation for Statistical Computing, Viena, Austria.
27. Bates, D, Mächler, M, Bolker, B y Walker, S. Ajuste de modelos lineales de efectos mixtos utilizando Lme 4. J Stat Softw. (2015) 67:1–48. doi: 10.18637/jss.v067.i01
28. Monti, GE, Frankena, K, y De Jong, MC. Transmisión del virus de la leucemia bovina dentro de los rebaños lecheros mediante modelos de simulación. Epidemiol Infect. (2007) 135:722–32. doi: 10.1017/S0950268806007357
Resumen de PubMed | Texto completo de Crossref | Google Académico
29. Pollari, FL, Wangsuphachart, VL, DiGiacomo, RF, y Evermann, JF. Efectos de la infección por el virus de la leucemia bovina en la producción y reproducción en ganado lechero. Can J Vet Res. (1992) 56:289–95.
30. Polat, M, Takeshima, SN y Aida, Y. Epidemiología y diversidad genética del virus de la leucemia bovina. Virol J. (2017) 14:16. doi: 10.1186/s12985-017-0876-4
Resumen de PubMed | Texto completo de Crossref | Google Académico
31. Beyer, J, Kollner, B, Teifke, JP, Starick, E, Beier, D, Reimann, I, et al. El ganado infectado con el virus de la leucemia bovina no solo puede desarrollar linfocitosis persistente de células B, sino también linfopenia persistente de células B. J Vet Med Ser B Infect Dis Vet Publ Health. (2002) 49:270–7. doi: 10.1046/j.1439-0450.2002.00559.x
32. Mekata, H, Yamamoto, M, Hayashi, T, Kirino, Y, Sekiguchi, S, Konnai, S, et al. El ganado con una carga proviral baja del virus de la leucemia bovina rara vez es una fuente infecciosa. Jpn J Vet Res. (2018) 66:157–63. doi: 10.14943/jjvr.66.3.157
33. John, EE, Droscha, C, Cameron, M, Stryhn, H, Keefe, G y McClure, JT. Desarrollo de un modelo predictivo para la carga proviral del virus de la leucemia bovina. J Veterinario Pasante Med. (2022) 36:1827–36. doi: 10.1111/jvim.16506
34. Juliarena, MA, Barrios, CN, Ceriani, MC, y Esteban, EN. Tema candente: las vacas infectadas por el virus de la leucemia bovina (Blv) con baja carga proviral no son una fuente de infección para el ganado libre de Blv. J Dairy Sci. (2016) 99:4586–9. doi: 10.3168/jds.2015-10480
Palabras clave: bovinos lecheros, virus de la leucemia bovina, transmisión, razón básica de reproducción, infecciosidad, gestión de riesgos
Cita: Benavides B y Monti G (2024) Tasas de transmisión del virus de la leucemia bovina en vacas lecheras infectadas linfocitóticas persistentes. Frente. Vet. Sci. 11:1367810. doi: 10.3389/fvets.2024.1367810
Recibido: 09 de enero de 2024; Aceptado: 08 de julio de 2024;
Publicado: 17 julio 2024.
Editado por:
Alejandra Victoria Capozzo, Consejo Nacional de Investigaciones Científicas y Técnicas (CONICET), Argentina
Revisado por:
Tara G. McDaneld, Servicio de Investigación Agrícola (USDA), Estados
Unidos Tomoko Kobayashi, Universidad de Agricultura de Tokio, Japón
Derechos de autor © 2024 Benavides y Monti. Este es un artículo de acceso abierto distribuido bajo los términos de la Licencia Creative Commons Attribution License (CC BY).
*Correspondencia: Gustavo Monti, gustavo.monti@wur.nl
Renuncia: Todas las afirmaciones expresadas en este artículo son únicamente las de los autores y no representan necesariamente a las de sus organizaciones afiliadas, o las del editor, de los editores y de los revisores. Cualquier producto que puede ser evaluada en este artículo o afirmación que puede ser hecha por su El fabricante no está garantizado ni respaldado por el editor.
Date de alta y recibe nuestro 👉🏼 Diario Digital AXÓN INFORMAVET ONE HEALTH
Date de alta y recibe nuestro 👉🏼 Boletín Digital de Foro Agro Ganadero
Noticias animales de compañía
Noticias animales de producción
Trabajos técnicos animales de producción
Trabajos técnicos animales de compañía