Tratamiento de OA felina
ABSTRACT
La OA representa la falla de todo el órgano de las articulaciones sinoviales y es común en los gatos. El deterioro progresivo de uno o más componentes de la articulación se asocia con dolor, inflamación, sensibilización periférica y / o central, y disminución de la movilidad, lo que finalmente afecta la actividad y la calidad de vida. En este artículo, los autores utilizan un caso inusual para demostrar su enfoque en el manejo de la OA felina.
El diagnóstico de OA felina puede presentar un desafío; En muchas articulaciones con evidencia macroscópica de OA, no se detectan hallazgos radiográficos y se desata un debate sustancial sobre la importancia de las mineralizaciones intraarticulares. Una vez que se hace un diagnóstico, es importante considerar cómo se monitoreará el progreso en la respuesta al tratamiento. Se han realizado avances recientes en la evaluación del dolor crónico en el gato utilizando instrumentos de metrología clínica. Estos representan un método práctico para evaluar la eficacia terapéutica en la práctica.
El tratamiento de la OA felina es multimodal, incluida la modulación ambiental y de la actividad, la rehabilitación física, la modulación de la dieta y el tratamiento farmacológico con un tratamiento analgésico basado en el uso de AINE. Sin embargo, en muchos casos, los AINE no son lo suficientemente efectivos cuando se usan como monoterapia, posiblemente porque no tienen ningún efecto sobre la sensibilización central, y a menudo se necesita analgesia multimodal.
Desafortunadamente, la evidencia de la eficacia de los analgésicos adyuvantes en gatos es escasa, pero las opciones incluyen gabapentina, amantadina, tramadol y amitriptilina. Cuando no se puede lograr una respuesta satisfactoria al tratamiento, a pesar de un plan multimodal adaptado, puede ser necesario el tratamiento quirúrgico. Las opciones incluyen reemplazo articular, artrodesis, artroplastia de escisión y extracción de fragmentos intraarticulares.
OA, which is a subset of degenerative joint disease (DJD), has been identified to be an important clinical disease in cats (Clarke and Bennett, 2006; Sul et al, 2014). As a disease of synovial joints, OA can be regarded as whole-organ failure (Loeser et al, 2012).
La afección se caracteriza por la degradación progresiva y la pérdida del cartílago articular, relacionada con mecanismos intrínsecos alterados del cartílago, influenciados por cambios en otros tejidos intraarticulares como la membrana sinovial, el hueso subcondral y el menisco (Wei y Bai, 2016).
El deterioro progresivo de uno o más componentes de la articulación se asocia con dolor, inflamación, sensibilización periférica y / o central, y disminución de la movilidad, lo que finalmente afecta la actividad y la calidad de vida (Clarke y Bennett, 2006; Gunew et al, 2008; Guillot et al, 2013; 2014; Monteiro et al, 2016).
La OA es común en los gatos, y se estima que la prevalencia de la OA apendicular oscila entre el 40% y el 90% según la detección radiográfica de los cambios articulares (Clarke et al, 2005; Hardie et al, 2002; Lascelles et al, 2010a; 2012; Slingerland et al, 2011). En los gatos, las articulaciones sinoviales más comúnmente afectadas son la cadera, la rodilla, el corvejón y el codo (Lascelles et al, 2010a).
Aunque se sabe mucho menos sobre la etiología de la OA en los gatos en comparación con los perros, la OA idiopática se considera común, y se han documentado causas congénitas, traumáticas, infecciosas, nutricionales e inmunomediadas, similares a las de otras especies (Lascelles et al. 2010b).
La OA se considera incurable (Brown et al, 2008). El dolor produce un deterioro local y distante del sistema musculoesquelético como resultado de una movilidad disminuida y alterada. Los procesos patológicos de la OA, como el engrosamiento de la cápsula articular y la fibrosis, contribuyen a alterar el rango de movimiento que agrava los cambios musculoesqueléticos.
Además, la entrada nociceptiva en curso en el SNC produce cambios en el sistema somatosensorial y sensibilización central (Guillot et al, 2013; Knazovicky et al, 2016), que contribuyen a la percepción del dolor. Los efectos combinados del dolor, la sensibilización central y el deterioro de la actividad pueden tener efectos negativos sobre el estado afectivo, el aumento de la ansiedad, la depresión, el deterioro del sueño (Knazovicky et al, 2015) y la función cognitiva como se informa en humanos (Huang et al, 2015; Sharma et al, 2016).
Dada la alta prevalencia de OA en gatos y el grave impacto en la calidad de vida que puede tener el dolor asociado a OA, es de vital importancia que reconozcamos y tratemos esta afección. Sin embargo, las dificultades para controlar el dolor crónico en los gatos, los obstáculos que complican llegar a un diagnóstico definitivo en muchos casos y la escasez de pruebas que respaldan la mayoría de las terapias complementarias hacen que el tratamiento de esta afección sea un desafío sustancial.
Reporte de un caso
– Presentación
Una gata de pelo corto doméstica esterilizada de 14 años se presentó para evaluar la inclinación reducida al salto y, en general, la disminución de la movilidad. Esto se hizo evidente aproximadamente 12 meses antes y se había deteriorado progresivamente desde entonces.
En la presentación, se observó una marcha de la extremidad pélvica moderadamente rígida bilateralmente, con una cojera leve que soporta el peso que afecta la extremidad pélvica izquierda. El examen ortopédico reveló una respuesta moderada al dolor en la extensión del muñón izquierdo, engrosamiento circunferencial y derrame sinovial del muñón izquierdo. No se observó inestabilidad en ninguna articulación y el resto del examen ortopédico se consideró irrelevante.
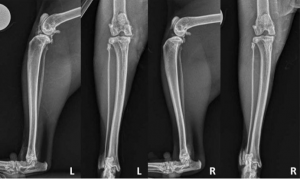
Radiografía e interpretación radiográfica.
Se tomaron radiografías de ambos sofocamientos (Figura 1). Las radiografías de la rodilla izquierda revelaron una invasión de opacificación de la almohadilla adiposa infrapatelar y un abultamiento caudal del plano fascial subgastrocnemial consistente con derrame sinovial. Varios cuerpos mineralizados intraarticulares grandes eran aparentes, concentrados cranealmente y medialmente además de la osteofitosis periarticular leve a moderada.
Las radiografías de la rodilla derecha revelaron un pequeño cuerpo mineralizado intraarticular situado craneo-medialmente, pero no hay evidencia de derrame u osteofitosis secundaria. Con base en la presentación clínica y los hallazgos radiográficos, se realizó un diagnóstico de OA con muñón izquierdo con osteocondromatosis concurrente. En este momento, se consideró que el golpe derecho no se veía afectado radiográficamente y clínicamente.
Si bien para este gato las anomalías radiográficas de la izquierda eran claramente evidentes, a menudo este no es el caso. De hecho, en el 71% de las articulaciones reprimidas felinas con evidencia macroscópica de OA, no se detectan hallazgos radiográficos (Freire et al, 2011). Como tal, los autores no pudieron decir definitivamente que el asfixia derecho no se vio afectado, solo que no encontraron evidencia clínica o radiográfica de la enfermedad.
En la rodilla izquierda para este gato, se observaron varias mineralizaciones intraarticulares grandes, mientras que en la derecha, solo se observó una pequeña área de mineralización. Surgió la pregunta, ¿cuál fue el significado clínico de estas áreas mineralizadas? Las mineralizaciones articulares se detectan comúnmente en las radiografías de las articulaciones de la rodilla felina (Leijon et al, 2017; Freire et al, 2010; 2011) y se ha informado que su prevalencia aumenta con la edad (Freire et al, 2010). Las mineralizaciones articulares son muy variables en tamaño, distintas en ubicación de los osteofitos y a menudo ubicadas en el asta craneal del menisco medial (Freire et al, 2010; Voss et al, 2017).
Según algunos autores, las mineralizaciones articulares pueden constituir hallazgos incidentales sin consecuencias clínicas para el gato (Allan, 2000; Mahoney, 2012; Whiting y Pool, 1985). Las mineralizaciones articulares más pequeñas tienden a detectarse en la región del asta craneal del menisco medial (Leijon et al, 2017; Freire et al, 2010; 2011; Voss et al, 2017), y un estudio reciente no encontró asociación entre la presencia de pequeñas mineralizaciones articulares y la gravedad del daño del cartílago (Voss et al, 2017).
Este estudio concluyó que las pequeñas mineralizaciones articulares probablemente representan una variación anatómica individual normal en los gatos domésticos, similar a la situación en especies de gatos grandes no domésticos (Ganey et al, 1994; Kirberger et al, 2000; Rahal et al, 2013; Walker et al. , 2002). Esta fue la conclusión de los autores para el área mineralizada más pequeña en el muñón derecho, particularmente porque su examen ortopédico no reveló ninguna anomalía que afectara este muñón y las radiografías no mostraron evidencia de derrame sinovial.
El mismo estudio reciente concluyó que las mineralizaciones articulares más grandes deben considerarse patológicas y que están asociadas con un aumento de los cambios articulares degenerativos (Voss et al, 2017). Estos tienden a encontrarse en una ubicación diferente, con frecuencia ubicados entre el asta meniscal craneomedial y la cápsula articular o en la almohadilla de grasa infrapatelar (Voss et al, 2017). Este es el caso de las mineralizaciones que se ven en el rifle izquierdo para el gato que se detalla aquí.
La osteocondromatosis sinovial, como se diagnosticó en este gato, se caracteriza por la formación de nódulos osteocondrales en el revestimiento sinovial de las articulaciones (Tas et al, 2013). Los osteocondromas sinoviales que surgen sin una causa predisponente conocida se denominan osteocondromas sinoviales primarios, mientras que los que surgen de una articulación enferma se denominan osteocondromas sinoviales secundarios. En la forma secundaria, la OA crónica es el principal iniciador de la afección (Tas et al, 2013). La osteocondromatosis sinovial comienza con metaplasia reactiva benigna de la membrana sinovial, que da lugar a la formación de nódulos osteocondrales en el revestimiento sinovial de la articulación (Tas et al, 2013). Inicialmente, estos nódulos son fibrocartilaginosos y se unen a la membrana sinovial mediante un pedúnculo, pero a medida que crecen, pueden calcificarse y romperse, convirtiéndose en ratones con articulaciones sueltas (Tas et al, 2013).
Los signos radiográficos en gatos con osteocondromatosis sinovial generalmente incluyen radiodensidades nodulares múltiples de tamaño variable dentro de un espacio articular distendido (Tas et al, 2013). En casos secundarios, también puede haber evidencia de DJD, aunque a menudo no es posible distinguir si este fue el principal problema de incitación o, como alternativa, el resultado de los fragmentos intraarticulares. Para este gato, se consideró probable que la osteocondromatosis sinovial fuera secundaria al desarrollo de OA, pero es imposible ser definitivo al respecto.
Un plan para monitorear
Antes de comenzar un plan de tratamiento para este gato, los autores consideraron cómo monitorear el progreso y evaluar su respuesta al tratamiento. Se han realizado progresos recientes en la evaluación del dolor crónico en el gato utilizando cuestionarios de propietarios llamados instrumentos de metrología clínica (CMI).
Las dos más estudiadas hasta la fecha son las medidas de resultado específicas del cliente (CSOM) y el índice de dolor musculoesquelético felino (FMPI; Gingerich y Strobel, 2003; Lascelles et al, 2007a; 2008; 2010b; Benito et al, 2013; Gruen et al. , 2015).
En los últimos años, otra escala de dolor, el Instrumento de Montreal para la prueba de artritis del gato, ha sido desarrollada y evaluada para su finalización tanto por los propietarios como por los veterinarios (Klinck et al, 2015; 2018a; 2018b). Esta escala puede tener potencial para detectar gatos en riesgo de presencia de OA, pero se requieren más estudios.
Para este gato, se utilizó el FMPI. El FMPI es un instrumento subjetivo completado por el propietario desarrollado para evaluar el dolor crónico asociado a la OA felina (Benito et al, 2013). La versión disponible del FMPI consta de 17 preguntas con un puntaje máximo de 68; un gato sin enfermedad debe alcanzar puntajes altos (100%) mientras que puntajes más bajos representan mayores grados de debilitamiento.
El cuestionario hace preguntas sobre la capacidad del gato para completar diversas actividades, en comparación con un gato adulto normal sin discapacidad de movilidad. Se ha demostrado que es confiable y repetible tanto en gatos normales como en aquellos que sufren de OA, y también es capaz de distinguir entre gatos normales y aquellos con OA. Para este gato, el propietario completó el FMPI en la cita inicial, con una puntuación del 35% que representa un debilitamiento sustancial.
Plan de tratamiento inicial
El plan terapéutico inicial para este gato incluía modulación ambiental y de actividad, rehabilitación física, reducción de peso, modulación dietética y terapia farmacológica. Se proporcionó acceso escalonado para permitir el acceso continuo a las alturas sin alentar la actividad de alto impacto.
Se proporcionaron varios tazones de comida y agua, y se hicieron accesibles camas cómodas. El rango de movimiento pasivo, precedido por el empaquetamiento tibio, y los ejercicios de masaje se demostraron para que el propietario los realizara en casa y se hicieron citas de rehabilitación física para terapia con láser dos veces por semana. El gato tenía un puntaje de condición corporal de 6/9 y, por lo tanto, se aconsejó la pérdida de peso. También se aconsejó una dieta rica en ácidos grasos omega-3.
El tratamiento analgésico de la OA en gatos se ha basado clásicamente en el uso de AINE como el meloxicam (Gunew et al, 2008; Guillot et al, 2013; Lascelles et al, 2007b; Gowan et al, 2011; Benito et al, 2013) .
El meloxicam es un AINE preferencial ciclooxigenasa-2 (COX-2) con alta biodisponibilidad oral, eficacia, palatabilidad y buena tolerabilidad (Lascelles et al, 2007b; Gunew et al, 2008; Guillot et al, 2013). Este compuesto parece mejorar la actividad motora (Guillot et al, 2013; Lascelles et al, 2007b). Meloxicam está disponible en tabletas y suspensión oral.
La Administración de Drogas y Alimentos de los EE. UU. Aprobó una nueva formulación oral y transmucosa de meloxicam para el control del dolor y la inflamación asociados con la OA en perros, pero no en gatos. Para este gato, se tomó la decisión de usar meloxicam a una dosis de 0.05mg / kg una vez al día durante un período de cuatro semanas.
Respuesta al tratamiento.
Después de cuatro semanas del plan de tratamiento mencionado anteriormente, el gato regresó para una nueva evaluación. La propietaria informó una posible mejora muy leve, pero no hubo cambios dramáticos en su nivel de actividad o rigidez. El FMPI se repitió y fue consistente con este informe que demuestra una mejora mínima del 41%.
Este es un hecho bastante común en la gestión de OA. A pesar de su uso generalizado y su beneficio obvio en muchos casos, los AINE no siempre son lo suficientemente efectivos cuando se usan como monoterapia (Lascelles et al, 2008). Si bien, como se mencionó anteriormente, parecen mejorar la actividad motora, no parecen tener ningún efecto sobre la sensibilización central (Guillot et al, 2013; Monteiro et al, 2016).
En esta etapa, los autores consideraron algunas opciones. Uno habría sido probar un AINE diferente en lugar del meloxicam utilizado para este gato. Se ha demostrado que el robenacoxib es bien tolerado en gatos con OA cuando se administra de manera constante durante 28 días, incluso en pacientes con enfermedad renal crónica concurrente (King et al, 2016). Otro fue probar la analgesia multimodal.
La base de este enfoque es usar una combinación de medicamentos que actúan en diferentes niveles de la vía del dolor y, por lo tanto, tendrán un efecto sinérgico, con la esperanza de mejorar el control del dolor y posiblemente permitir que se usen dosis más bajas de medicamentos individuales, reduciendo así El riesgo de efectos secundarios.
En este caso, los autores sospecharon que la falta de respuesta al componente neuropático del dolor asociado a la OA fue la razón de la respuesta subóptima. Por lo tanto, se consideró poco probable que un AINE alternativo produzca una mejora sustancial. Se tomó la decisión de juzgar la analgesia multimodal; sin embargo, esto es más fácil decirlo que hacerlo.
Más allá de los AINE que inhiben la COX, las opciones de tratamiento para el control del dolor en los gatos son muy limitadas. Además, la evidencia de la eficacia de estos llamados analgésicos adyuvantes es extremadamente limitada (Lascelles et al, 2008; KuKanich, 2013).
Plan de tratamiento modificado
Tanto la gabapentina como la amantadina se agregaron al régimen de tratamiento en esta etapa. La gabapentina es un análogo del neurotransmisor ácido λ-aminobutírico. La gabapentina se ha recomendado para el tratamiento del dolor neuropático en gatos debido a la experiencia en el tratamiento del dolor neuropático en humanos (Backonja et al, 1998; Kukkar et al, 2013; Moore et al, 2014; Larsen et al, 2016).
Actualmente, aunque se ha descrito la farmacocinética de la gabapentina oral e IV en gatos adultos (Siao et al, 2010), no existen estudios clínicos que evalúen la eficacia de la gabapentina en condiciones de dolor crónico en gatos.
Existen varios estudios de caso que describen el uso de gabapentina (Vettorato y Corletto, 2011; Lorenz et al, 2012). Una serie de casos de tres gatos, donde se utilizó gabapentina para el tratamiento del dolor musculoesquelético o traumatismo craneal, concluyó que la gabapentina era un beneficio potencial en estos casos y puede proporcionar un complemento valioso para el tratamiento del dolor crónico en gatos (Lorenz et al, 2012).
Otro informe de caso detalla el uso crónico de gabapentina después de incidentes traumáticos (Vettorato y Corletto, 2011), concluyendo que la gabapentina merece consideración como adyuvante para el tratamiento de la hiperalgesia y la alodinia en los gatos. Sin embargo, en estos informes, no se produjo una evaluación objetiva o validada de la respuesta y los altos efectos del placebo en los informes de los propietarios pueden hacer que estas pequeñas series de casos sean inútiles (Adrian et al, 2017).
Ciertamente, se necesitan más datos con un mayor número de gatos antes de poder hacer recomendaciones definitivas de tratamiento. Cuando se usa, la gabapentina se dosifica normalmente entre 5 mg / kg y 10 mg / kg dos o tres veces al día y la terapia debe retirarse lentamente. Los efectos secundarios son poco frecuentes, pero cuando ocurren generalmente implican sedación leve y ataxia, que a menudo se resuelve con la reducción de la dosis. Para este gato, se usó una dosis de 10 mg / kg cada ocho horas.
La amantadina se usa tanto como medicamento antiviral en medicina humana como para el tratamiento del Parkinson debido a sus efectos moduladores sobre las concentraciones de dopamina en el SNC (Hubsher et al, 2012). La amantadina también se ha descrito como un antagonista de N-metil-D-aspartato (NMDA) (Blanpied et al, 2005), lo que resulta en su evaluación como analgésico (Bujak-Giżycka et al, 2012).
El receptor NMDA y su ligando, el glutamato, han estado implicados durante mucho tiempo en el desarrollo y mantenimiento de la plasticidad central, a través de una excitación aumentada y sostenida de las neuronas, y las posteriores alteraciones de la expresión de genes y receptores (Latremoliere y Woolf, 2009; Baron et al, 2013 ) Se ha demostrado que el bloqueo de estos receptores con antagonistas de NMDA previene el desarrollo de la plasticidad central y trata la condición en los animales afectados (Wang et al, 2015; Tabakoff et al, 2016).
El uso de amantadina en gatos proviene de informes anecdóticos de eficacia (Robertson, 2008), o de eficacia demostrada en perros cuando se usa junto con meloxicam (Lascelles et al, 2008).
Si bien la farmacocinética de la amantadina, administrada tanto por vía intravenosa como por vía oral, se ha documentado en gatos (Siao et al, 2012), faltan datos clínicos que demuestren la eficacia. En ausencia de datos que evalúen las concentraciones mínimas efectivas, la recomendación de dosificación es de 1 mg / kg a 4 mg / kg una vez al día.
Como se dispone de información limitada sobre la toxicidad en gatos, se recomienda comenzar con la dosis más baja y luego aumentar lentamente según sea necesario según la respuesta. En humanos, los efectos adversos generalmente incluyen SNC menor y signos gastrointestinales.
En general, en perros y gatos parece ser bien tolerado en función de la información limitada disponible. La amantadina está disponible en una formulación líquida, que a menudo es necesaria para los gatos, ya que los tamaños de las cápsulas son generalmente demasiado grandes para permitir una dosificación adecuada en estos pacientes más pequeños. En este gato, se usó una dosis de 2 mg / kg cada 24 horas.
Opciones alternativas
Si bien la gabapentina y la amantadina se probaron en este caso particular, también se podrían haber considerado otras opciones. El tramadol es un analgésico utilizado en todo el mundo por sus efectos sobre la función física mejorada y la buena tolerabilidad en humanos con dolor crónico por artrosis (Schaefert et al, 2015).
Los mecanismos de acción del tramadol no se han dilucidado completamente y, hasta la fecha, la mayoría de los estudios se han centrado en la activación de los receptores opioides µ y la inhibición de la recaptación de monoamina como mecanismos potenciales (Raffa et al, 1992; Desmeules et al, 1996 ; Steagall et al, 2008).
Se espera que los efectos analgésicos del tramadol estén relacionados principalmente con la producción de su (s) metabolito (s) activo (s) como O-desmetiltramadol (M1), que se une a los receptores opioides µ con una afinidad aproximadamente 300 veces mayor que el compuesto original ( Desmeules y otros, 1996; Frink y otros, 1996).
Sin embargo, la afinidad del tramadol por el receptor opioide µ es muy baja, aproximadamente 10 veces menor que la de la codeína y 6,000 veces menor que la de la morfina. Sin embargo, los aumentos en los umbrales de dolor inducidos por el tramadol difieren de los de otros opioides en que solo están parcialmente bloqueados por la naloxona (Desmeules et al, 1996). Estos últimos hallazgos indican que la activación del receptor opioide µ es solo uno de los mecanismos de acción del tramadol y M1.
Otros mecanismos de acción incluyen:
inhibición de la recaptación de norepinefrina y serotonina permitiendo que estos neuromediadores de monoamina central sean más activos para acentuar el control inhibitorio endógeno
inhibición de los receptores acoplados a la proteína G, como el adrenoceptor α2, el receptor de neuroquinina 1, el receptor muscarínico
inhibición de canales iónicos a través del receptor de acetilcolina nicotínico y el receptor de N-metil-D-aspartato (Minami et al, 2015)
Estos mecanismos de acción pueden aumentar la actividad del control inhibitorio endógeno y disminuir la transmisión del dolor, lo que probablemente explica los efectos analgésicos centrales del tramadol (Monteiro et al, 2017).
La evidencia reciente indicó que el tramadol no proporcionó ningún beneficio clínico a los perros con OA en las articulaciones del codo o la rodilla (Budsberg et al, 2018). Sin embargo, en gatos, el tramadol tiene una alta biodisponibilidad después de la administración oral y M1 sigue el perfil de disposición del tramadol (Pypendop et al, 2007; 2009).
Los estudios han indicado que los gatos pueden tener un perfil analgésico superior después de la administración de tramadol en comparación con los perros debido a una vida media de eliminación más larga y mayores concentraciones activas de M1 (Pypendop et al, 2009; KuKanich y Papich, 2004).
El tramadol es un analgésico oral ambulatorio de bajo costo que es potencialmente una opción viable para el tratamiento del dolor de artrosis; sin embargo, hasta hace poco, no se conocía su eficacia para el tratamiento del dolor inadaptado felino. Un estudio reciente mostró que los gatos con dolor inadaptado secundario a OA parecen beneficiarse del tratamiento con tramadol (3 mg / kg dos veces al día) en comparación con el tratamiento con placebo (Monteiro et al, 2017).
El tratamiento con tramadol aumentó la carga de peso y la movilidad, y disminuyó la sensibilización central en gatos con OA natural (Monteiro et al, 2017). Estos resultados se consideraron alentadores para promover el tramadol como tratamiento para el dolor en gatos osteoartríticos (Monteiro et al, 2017).
Otra alternativa que podría haberse considerado fue la amitriptilina. La amitriptilina es un antidepresivo tricíclico que ejerce su efecto al inhibir la recaptación de los neurotransmisores serotonina, noradrenalina y, en menor medida, dopamina (Moore et al, 2012). También se ha demostrado que inhibe la liberación de H1 de los mastocitos in vitro (Gurgel et al, 2013).
Si bien su uso en medicina veterinaria se ha limitado principalmente a los trastornos del comportamiento (Chew et al, 1998; Virga et al, 2001; Overall y Dunham, 2002), la investigación en humanos ha demostrado un efecto analgésico en aquellos que sufren de cistitis intersticial, un trastorno urinario enfermedad de la vejiga con un componente de dolor neurogénico crónico (Hanno et al, 1989), y el medicamento se usa comúnmente para tratar el dolor neuropático (Moore et al, 2012).
Debido a la similitud de la cistitis intersticial en humanos y la cistitis idiopática en gatos, ambos propusieron tener un componente de dolor neurogénico o neuropático, se ha evaluado la eficacia de la amitriptilina en gatos con cistitis idiopática y se observó una mejoría clínica, que se sospecha que se debe a la eficacia de amitriptilina en el tratamiento del dolor asociado con el trastorno (Chew et al, 1998).
El efecto de la amitriptilina sobre la inhibición segmentaria, un proceso fisiológico que reduce la transmisión de señales de dolor, se evaluó en 12 gatos anestesiados adultos (Fromm et al, 1991).
La inhibición segmentaria de las neuronas de amplio rango dinámico, que pueblan el asta dorsal y responden a todas las entradas somatosensoriales, aumentó significativamente en dosis IV de 1 mg / kg a 4 mg / kg del medicamento. Esto puede ser beneficioso con estados de dolor inadaptado crónico, como el dolor asociado con OA, donde la amitriptilina puede ayudar a corregir los procesos inhibitorios disfuncionales del SNC que se han demostrado en modelos de dolor inadaptado (Adrian et al, 2017).
Actualmente no existen datos sobre la farmacocinética de amitriptilina en el gato, lo que hace que sea difícil recomendar la dosificación. El sabor amargo de la droga y los posibles efectos secundarios, como la reducción de la preparación, la sedación y el aumento de peso, también pueden limitar su uso (Chew et al, 1998). Se requieren pruebas adicionales antes de poder hacer recomendaciones definitivas de tratamiento.
Respuesta al tratamiento.
El gato regresó para evaluación seis semanas después de comenzar el plan de tratamiento modificado. No se han observado efectos adversos de los medicamentos. Si bien el propietario percibió alguna mejora en la movilidad, esto todavía no era suficiente para que aceptara la calidad de vida actual como aceptable.
El examen ortopédico y la evaluación de la marcha no cambiaron con respecto a los anteriores. Se repitió el FMPI y se logró un valor del 56%. En esta etapa, se discutieron las opciones con el propietario, incluida la prueba continua de medicamentos alternativos y las opciones de tratamiento quirúrgico.
Para los gatos con dolor asociado con OA, cuando no se puede lograr una respuesta satisfactoria utilizando una combinación de terapias no quirúrgicas, se debe considerar la terapia quirúrgica. Las opciones de tratamiento quirúrgico para gatos incluyen reemplazo de articulaciones, artrodesis, artroplastia por escisión y extirpación de fracturas intraarticulares mediante artrotomía o artroscopia.
Cuando los signos clínicos asociados no pueden controlarse con la terapia multimodal adecuada, el tratamiento de elección para la osteocondromatosis sinovial es la sinovectomía total con la eliminación de todos los cuerpos sueltos; sin embargo, esto es difícil de realizar por completo y nunca se ha descrito en gatos (Flo et al, 1987). Se puede intentar la eliminación de fragmentos libres, pero muchos de los fragmentos vistos radiográficamente pueden estar incrustados en la membrana sinovial (Tan et al, 2010), y son engañosamente difíciles de localizar y eliminar.
Si bien el reemplazo articular constituye la base del tratamiento quirúrgico de la OA en perros, los reemplazos comerciales de articulaciones solo están disponibles para la cadera en el gato. Se han realizado reemplazos de articulaciones personalizados para otras articulaciones, incluido el rifle, y, por lo tanto, podrían haber sido una opción para este gato, pero como esto esencialmente habría sido una cirugía experimental, esta opción estaba reservada para si otra, menos agresiva, Las opciones quirúrgicas no lograron proporcionar una buena calidad de vida.
La artroplastia de escisión es una opción quirúrgica de rescate para la OA en la etapa final de la cadera, los dedos y el hombro, pero no es una opción para el sofoco. La artrodesis también es una opción quirúrgica para los casos en que el reemplazo articular no es factible o apropiado. Si bien la artrodesis alivia el dolor asociado con la OA en etapa terminal, también elimina el movimiento en la articulación y, por lo tanto, se adapta mejor a las articulaciones de bajo movimiento, como el carpo y el tarso. La artrodesis carpiana y tarsal se ha realizado en el gato como opciones de rescate apropiadas para la OA en etapa terminal (DeCamp et al, 1993; Mathews et al, 1995; Calvo et al, 2009; Fitzpatrick et al, 2013).
La artrodesis del hombro es bien tolerada, pero técnicamente desafiante. La artrodesis del asfixia y el codo provocan anormalidades profundas en la marcha en los perros y la selección cuidadosa de los casos y la comunicación con el cliente para controlar las expectativas son fundamentales.
La artrodesis por asfixia en gatos puede tolerarse mejor que en perros según las experiencias de los autores y el informe de un caso de dos gatos (Belch et al, 2012). Sin embargo, esta sigue siendo una opción de rescate solo apropiada después de que se hayan probado medidas quirúrgicas más conservadoras.
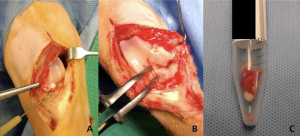
En este gato, se tomó la decisión de proceder a la exploración quirúrgica de la articulación de la rodilla mediante artrotomía, y eliminar la mayor cantidad posible de material sinovial y mineralizado (Figura 2). Se descubrió que el menisco medial estaba mineralizado además de la almohadilla de grasa infrapatelar y gran parte de la cápsula articular, y esto se eliminó por completo junto con la mayor cantidad posible de membrana sinovial y grasa. Los ligamentos cruzados craneal y caudal, y el menisco lateral, estaban intactos y palpablemente normales, y se dejaron in situ.
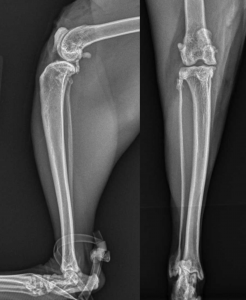
Las radiografías postoperatorias (Figura 3) revelaron una menor mineralización dentro de la articulación. El gato fue dado de alta con las mismas dosis de gabapentina, amantadina y meloxicam que se mencionó anteriormente, y se le restringió a descansar en la caja por un período de seis semanas. Después de cuatro semanas, el FMPI había mejorado al 72%.
En ese momento no quedaba evidente cojera en las extremidades posteriores. Mientras que la rodilla izquierda permanecía engrosada palpablemente en relación con la derecha, la respuesta al dolor tras la manipulación de la pistola se había resuelto. La gabapentina y la amantadina se detuvieron en este momento. Después de otras dos semanas, el FMPI había permanecido en gran medida estático al 75% y la dosis de meloxicam se redujo gradualmente.
Al momento de escribir este informe, ocho meses después de la operación, la dueña solo usa el meloxicam periódicamente a una dosis de 0.02mg / kg cuando nota reducciones en la movilidad del gato. El FMPI se ha mantenido en gran medida estático, fluctuando entre 75% y 80%.
Direcciones futuras
Este informe de caso y la discusión en torno a él detallan algunos de los desafíos encontrados cuando se trata con casos de OA felina, muchos de los cuales se derivan de las limitadas opciones de tratamiento disponibles y la falta de evidencia de eficacia para muchas de nuestras terapias complementarias.
La OA felina sigue siendo una entidad difícil de tratar, a pesar del creciente interés e investigación en este campo, y existe una necesidad urgente de desarrollar tratamientos más efectivos para el alivio del dolor asociado a la OA. Según la opinión de los autores, la opción futura más prometedora que se evalúa es la terapia contra el factor de crecimiento nervioso (NGF).
El NGF es esencial para la supervivencia de las neuronas sensoriales y simpáticas durante el desarrollo. Sin embargo, en el adulto, se ha descubierto que el NGF y su interacción con el receptor de tropomiosina quinasa A (TrkA) desempeñan un papel crítico en la nocicepción y la plasticidad del sistema nervioso en condiciones de dolor. Por lo tanto, se han investigado varias terapias de anticuerpos monoclonales (mAb) dirigidas a esta vía en el desarrollo de nuevas faracoterapias para el dolor crónico.
Aunque ninguno de los mAb contra NGF está aprobado para su uso en humanos, promete un control efectivo del dolor. Recientemente, se han desarrollado mAbs específicos de la especie para el tratamiento del dolor asociado a la OA en perros y gatos, y se han llevado a cabo ensayos clínicos tempranos. La terapia anti-NGF parece ser muy efectiva y muy prometedora como una novedosa terapia contra el dolor crónico en perros y gatos (Enomoto et al, 2019).
Abbott Laboratories (Lacey et al, 2012) y Nexvet Biopharma (Gearing, 2016) poseen una patente para mAbs anti-NGF en gatos. Sin embargo, los únicos datos publicados en gatos son para el mAb anti-NGF felino Nexvet.
La evaluación farmacocinética y de eficacia inicial de frunevetmab, el mAb anti-NGF completamente felinizado de Nexvet, mostró que tenía una concentración plasmática máxima de aproximadamente tres días y una vida media plasmática media de nueve días (Gearing et al, 2016). Fue bien tolerado en dosis de hasta 28 mg / kg. En el trabajo no cegado, controlado con placebo, una dosis única de 2 mg / kg disminuyó significativamente las puntuaciones subjetivas de cojera en comparación con el tratamiento con placebo (Gearing et al, 2016). No se observaron efectos adversos.
Se ha publicado un solo ensayo clínico (Gruen et al, 2016). Este fue un estudio piloto cegado, controlado con placebo, realizado en 24 gatos con dolor asociado con OA para evaluar la eficacia de una dosis única de frunevetmab durante un período de nueve semanas.
Los resultados se midieron objetivamente utilizando acelerómetros montados en collar y CMI (Gruen et al, 2016). La acelerometría reveló un aumento significativo en la actividad en comparación con el tratamiento con placebo de dos semanas a seis semanas después de la inyección, mayor que la observada en estudios previos que evalúan los aumentos de actividad después de la administración de meloxicam (Gruen et al, 2015).
Las evaluaciones subjetivas del propietario mostraron un efecto significativo del tratamiento durante las primeras tres semanas después de la administración. Se está realizando un estudio de eficacia a mayor escala con una inscripción objetivo de 250 gatos; Los resultados de este estudio, cuando estén disponibles, serán una valiosa contribución al conocimiento limitado sobre esta opción de tratamiento en gatos.
Fuente vet times

