Tratamiento exitoso de la leiomiositis intestinal en un perro con inmunoglobulina intravenosa adyuvante
 Michelle Patrick Olivarez1*
Michelle Patrick Olivarez1* Jarod Williams2*
Jarod Williams2* Nutnapong Udomteerasuwat3
Nutnapong Udomteerasuwat3 Rincón de Sarah3
Rincón de Sarah3 Cristóbal Byers4
Cristóbal Byers4- 1Centro de Referencia Veterinaria del Sureste, Miami, FL, Estados Unidos
- número arábigoOzark Veterinary Specialty Care, Springdale, AR, Estados Unidos
- 3Laboratorio de Diagnóstico Veterinario, Universidad Estatal de Michigan, East Lansing, MI, Estados Unidos
- 4CriticalCareDVM.com, Omaha, NE, Estados Unidos
Una hembra de perro salchicha esterilizada de 10 años presentó dolor abdominal e íleo severo generalizado. Se realizó laparotomía exploratoria, confirmándose un íleo severo de origen indeterminado. Los resultados de la biopsia intestinal múltiple confirmaron la leiomiositis intestinal aguda. Las tinciones inmunohistoquímicas (IHQ) confirmaron un infiltrado inflamatorio predominante de células T. Se administró inmunoglobulina intravenosa (hIVIG) antes de la terapia inmunosupresora. A los 10 días del tratamiento con hIVIG, la actividad peristáltica funcional volvió y los síntomas se resolvieron. El tratamiento a largo plazo, incluido el uso de micofenolato, dio lugar a una recuperación peristáltica funcional sostenida. Se necesitan más estudios para explorar los beneficios potenciales del tratamiento con IgIVh en la fase de estabilización de esta enfermedad comúnmente mortal y resistente al tratamiento.
Introducción
Este informe de caso describe el tratamiento exitoso de la leiomiositis intestinal pseudoobstructiva en un perro que utiliza la terapia convencional con inmunoglobulina intravenosa adyuvante. La inmunopatología realizada documenta un infiltrado mioinflamatorio con predominio de células T. Hasta donde sabemos, la recuperación peristáltica funcional a largo plazo no se ha documentado previamente en un perro.
Descripción del caso
Una hembra de perro salchicha esterilizada de 10 años de edad que pesaba 5,5 kg fue presentada a su veterinario de atención primaria para que evaluara la pérdida de peso, la anorexia, los vómitos y el letargo durante varios días. Las anomalías de la exploración física incluyeron taquicardia sinusal leve (frecuencia cardíaca de 160 lpm), pérdida de peso (peso corporal de 5,7 kg; pérdida de 1,8 kg en 1 mes), depresión y deshidratación leve. Se realizó hemograma completo (CBC), perfil bioquímico (CHEM) y análisis de orina (AU) en el punto de atención (IDEXX1). Las anomalías bioquímicas incluyeron hiperglucemia de 240 mg/dl (70-143 mg/dl), elevación del BUN de 44 mg/dl (7-27 mg/dl), creatinina normal de 0,5 mg/dl (0,5-1,8 mg/dl), hiponatremia de 110 mmol/l (144-160 mmoL/l), hipocloridemia de 68 mmol/l (109-122 mmoL/l) e hipopotasemia de 2,7 mmol/l (3,5-5,8 mmoL/l). El análisis de orina recogido por cistocentesis reveló isoestenia 1,014 (1,015-1,045) sin proteinuria ni glucosuria. Se iniciaron cuidados de apoyo, incluyendo líquidos intravenosos (IV) (Normosol-R); un bolo inicial de 10 mL/kg IV seguido de 10 mL/kg/h IV; cloruro de potasio (20 mEq/L); y maropitant (1 mg/kg IV). Posteriormente, el paciente fue remitido para recibir atención continua y una investigación diagnóstica adicional.
A su llegada al Servicio de Urgencias del Centro de Referencia (AESC2), las constantes vitales eran normales y se midió la presión arterial Doppler en 156 mmHg (rango de referencia: 90-140 mmHg). Las pruebas en el punto de atención mostraron un volumen de células empaquetadas (PCV) del 57 % y sólidos totales (TS) de 7,0 g/dl (rangos de referencia: 42-54 % y 5,9-7,8 g/ml, respectivamente). La proteína C reactiva se elevó a 8,6 mg/dL (referencias: < 1,0 mg/dL), el cortisol basal fue de >10,0 (referencia: 2,0-9,0 ug/dL); y la dimetilarginina simétrica (SDMA) se situó en el límite superior de la normalidad a los 14 años (referencia: 0-14 ug/dl). La gasometría venosa mostró lo siguiente: pH 7,59 (referencia: 7,35-7,43), HCO3 46,4 mmol/L (referencia: 22,2-22,4 mmol/L), PCO2 52,0 mmHg (referencia: 29-42 mmHg), tCO2 48,0 mmol/L, sodio 128 mmol/L (referencia: 146-154 mmol/L), potasio 2,3 mmol/L (referencia: 3,8-5,3 mmol/L) y cloruro 85 mmol/L (referencia: 105-115 mmol/L), acumulativamente consistente con alcalosis metabólica hipoclorémica.
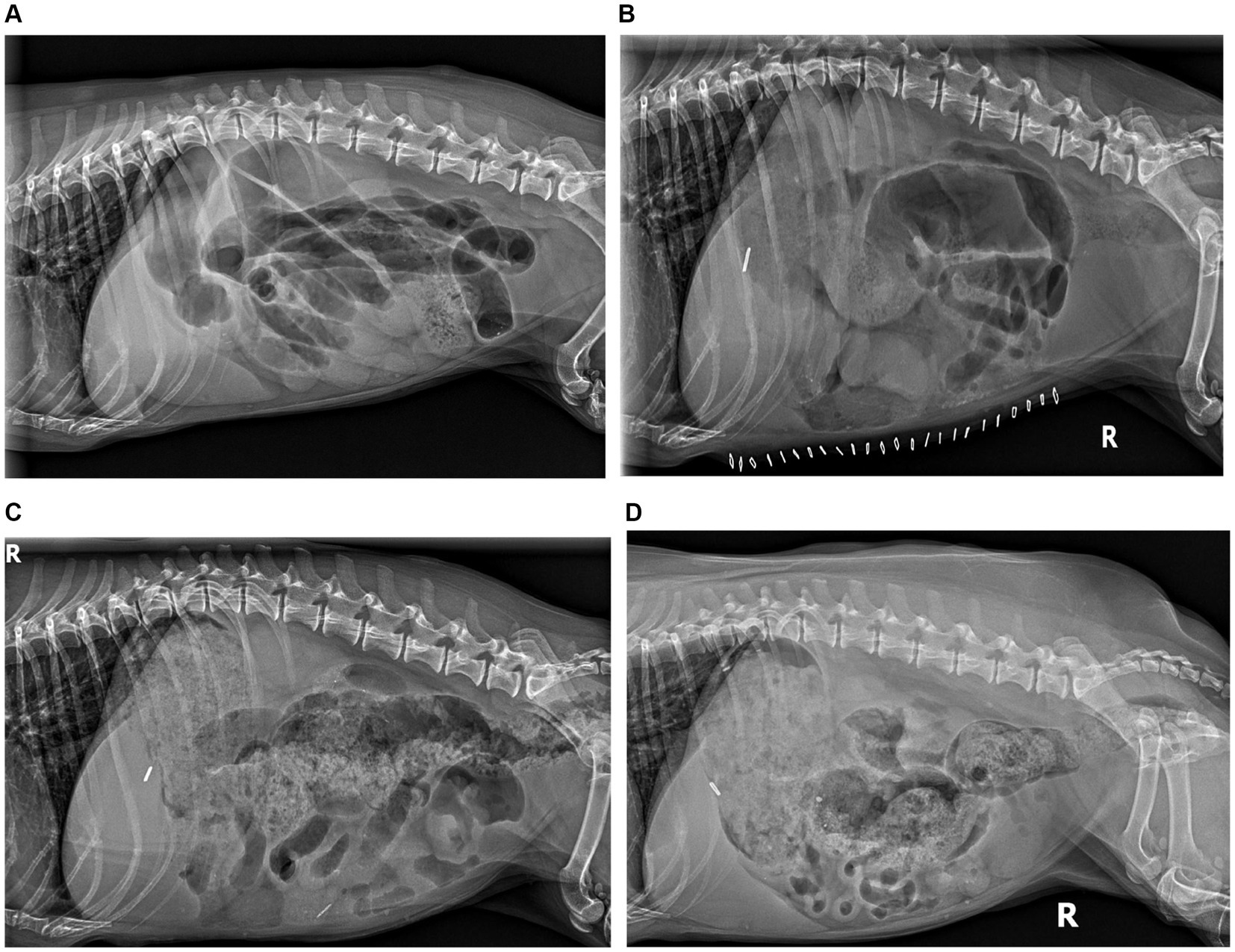
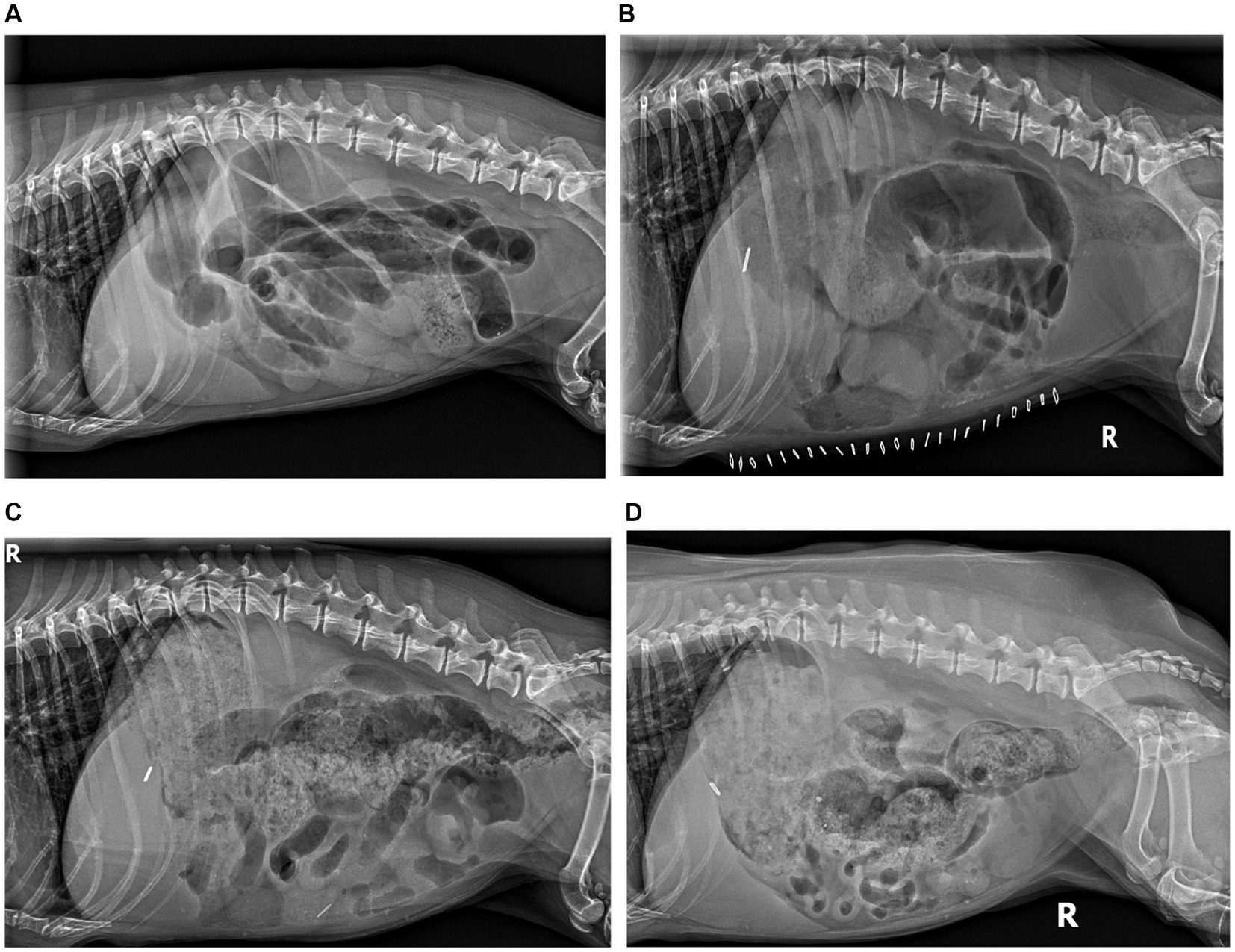
La radiografía abdominal reveló dilatación generalizada del tracto gastrointestinal sin cuerpo extraño radiopaco (Figura 1). La radiografía torácica no presentaba presentaciones. Se continuó con los cuidados de apoyo, incluyendo solución intravenosa de ringers lactato (30 ml/h) con suplementación con KCl (20 mEq/l), maropitant (1 mg/kg IV cada 24 h) y ampicilina/sulbactam (20-22 mg/kg IV cada 8 h).
La ecografía abdominal completa fue realizada por un especialista en medicina interna veterinaria de pequeños animales (OVSC3) certificada por la junta y reveló íleo grave y generalizado del intestino delgado y el estómago. El contenido luminal intestinal se reportó como fluido y gas mezclados sin propulsión coordinada. Los hallazgos adicionales incluyeron linfadenomegalia mesentérica leve, distensión de la vesícula biliar de moderada a marcada con bilis indentada dinámica heterogénea, parénquima hepático heterogéneo leve y glándulas suprarrenales prominentes bilaterales. Debido al íleo severo, no se realizó un estudio gastrointestinal (GI) con contraste positivo y se recomendó una laparotomía exploratoria. La premedicación incluyó lidocaína al 2% (2 mg/kg IV), midazolam (0,25 mg/kg IV) e hidromorfona (0,1 mg/kg IV). La anestesia general se indujo con propofol (4 mg/kg IV) y se mantuvo con isoflurano mientras se administraba ventilación mecánica (ADS20004).
Se realizó una celiotomía de la línea media ventral. Se encontró que el estómago y el intestino delgado estaban severamente distendidos y atónicos. Un tapón de ingesta compresible era palpable en el íleon distal y avanzó digitalmente con éxito anterógrado a través de la válvula ileocecocólica; este tapón se consideró insuficiente para obstruir principalmente el tracto gastrointestinal. Las biopsias incisionales se obtuvieron del estómago, el duodeno, el yeyuno y el íleon mediante una técnica incisional estándar. El hígado parecía normal en color y tamaño; Se realizó una biopsia en cuña del lóbulo lateral derecho. La vesícula biliar estaba moderadamente distendida con material granular palpable, por lo que fue necesaria una colecistectomía. Además, se observó distensión y atonía colónica, y las glándulas suprarrenales eran prominentes y nodulares. La recuperación de la anestesia y la cirugía transcurrió sin incidentes. 5,6
Los cuidados postoperatorios incluyeron dexametasona fosfato sódico (0,1 mg/kg IV una vez), cobalamina (500 mcg SC una vez), complejo vitamínico B (0,5 mL SC una vez), ampicilina/sulbactam (22 mg/kg IV 8 h), enrofloxacino (10 mg/kg IV cada 24 h), lidocaína (25 mcg/kg/min IV IRC), hidromorfona (0,013 mg/kg/h IV IRC), metoclopramida (1 mg/kg/día IV IRC), 0,9% NaCl (120 mL/kg/día IV CRI x 18 h) y KCl (30 mEq/L). A medida que el paciente toleraba la alimentación, el soporte de líquidos intravenosos se retiró gradualmente y el paciente pasó a medicamentos equivalentes orales, incluidos prednisolona (0,46 mg/kg VO cada 24 h), enrofloxacino (11,7 mg/kg VO cada 24 h), metronidazol (22 mg/kg VO cada 12 h), ursodiol (13 mg/kg VO cada 24 h), metoclopramida (0,43 mg/kg VO cada 12 h), tramadol (4,3 mg/kg VO cada 6 h), y gabapentina (17 mg/kg VO 12 h). Se eligió el tramadol en lugar de un agonista mu puro para evitar el íleo exacerbado por opioides. La monitorización diaria de laboratorio reveló la normalización de las deficiencias electrolíticas a las 72 h del postoperatorio. En el postoperatorio se prescribió una dieta baja en grasas con prescripción comercial (Hills I/D LF7) que se continuó durante el período de recuperación.
La histopatología del duodeno, yeyuno e íleon reveló leiomiositis linfoplasmocítica a neutrofílica grave, difusa y crónica de la túnica muscular, así como enteritis linfoplasmocítica moderada con bacterias luminales y protozoos (sospecha de ciliados). En todas las secciones del intestino delgado, la túnica muscular estaba infiltrada por un número moderado de linfocitos, células plasmáticas y neutrófilos. El músculo liso dentro de las áreas afectadas se vio gravemente alterado, con miocitos lisos vacuolados, fragmentados o reemplazados por fibroblastos regordetes en medio de finas fibras de colágeno, lo que resultó en la pérdida de la arquitectura muscular de las capas musculares longitudinales circulares. Las neuronas dentro del plexo mientérico dentro de la túnica muscular permanecieron intactas. La lámina propia vellosa contenía un número moderado de linfocitos y células plasmáticas, así como menos eosinófilos y neutrófilos (Figura suplementaria S1). La tinción inmunohistoquímica del intestino delgado para los marcadores linfocitarios CD3 y CD21 mostró una inflamación mixta linfocítica y neutrofílica con predominio de células T (Figura suplementaria S2). El estómago estaba dentro de los límites normales. La lámina propia de la vesícula biliar se expandió difusamente con un número moderado de neutrófilos, linfocitos y células plasmáticas, compatible con colecistitis supurativa y linfoplasmocítica moderada; También se presentó hiperplasia mucinosa quística segmentaria. La histopatología hepática reveló vacuolización hepatocelular centrolobulillar leve. El cultivo bacteriano aeróbico biliar cultivó Escherichia coli y Enterococcus hirae, susceptibles a enrofloxacino y amoxicilina/clavulanato, respectivamente. La cobalamina sérica fue normal a 697 ng/L (251-908 ng/L) y se documentó hipofolatemia leve a 6 (7,7-24,4 ug/L). El perfil de vitamina D reveló una elevación de la hormona paratiroidea a 24,8 (1,1-10,6 pmol/L), hipocalcemia ionizada leve a 1,15 (1,25-1,45 mmoL/L) y 25-hidroxivitamina D normal a 239 (109-423 nmol/L), más compatible con hiperparatiroidismo secundario.
El paciente fue evaluado 1 semana después de la operación. Los síntomas primarios reportados fueron inapetencia sin vómitos, regurgitación o diarrea. El hemograma completo en el punto de atención mostró neutrofilia leve (13.410/uL) y eosinopenia leve (10/uL), mientras que los perfiles de CHEM y electrolitos fueron normales [IDEXX (ver nota 1)]. Una sola radiografía abdominal lateral reveló un íleo persistentemente severo sin evidencia de derrame peritoneal. El paciente fue tratado con inmunoglobulina G intravenosa humana [hIVIg; 5 gramos IV (1,1 g/kg)] durante 6 h (Gamunex9). Se administró dexametasona fosfato sódico (0,1 mg/kg IV) y complejo vitamínico B (0,5 mL SC) antes de la infusión. Se administró dexametasona para ayudar a mitigar las posibles reacciones a la hiIVH. Se prescribió amoxicilina/clavulanato (11,5 mg/kg VO cada 12 h) durante 3 semanas en base a cultivo biliar. También se prescribió tratamiento inmunomodulador multimodal (prednisolona a 0,46 mg/kg VO cada 24 h durante 7 días, luego cada 48 h; micofenolato a 9,25 mg/kg VO cada 12 h). Se continuó el tratamiento con tramadol, gabapentina, metoclopramida, enrofloxacina, ursodiol, metronidazol y una dieta baja en grasas según lo prescrito anteriormente.
El paciente fue reevaluado 8 días después de la infusión de hIVIg. El apetito y la sed del paciente habían mejorado y, según los informes, las deposiciones eran normales. La radiografía abdominal reveló alimentos en el estómago, compatibles con comidas recientes, y heces en el colon. El gas luminal del intestino delgado estaba presente pero mejoró notablemente, con contracciones peristálticas visibles en el intestino delgado. Las pruebas de laboratorio de referencia (Antech10) revelaron una FA ligeramente elevada (152 U/L), trombocitosis leve (508.000/uL) y neutrofilia leve (11.760/uL). El tratamiento continuado incluyó complejo vitamínico B (0,5 ml SC cada 7 días x 4 semanas, luego cada 14 días), prednisolona (0,46 mg/kg VO cada 24 h), metoclopramida (0,43 mg/kg VO cada 12 h) y ursodiol (13 mg/kg VO cada 24 h). El micofenolato no se había iniciado según las instrucciones, pero finalmente se inició aproximadamente 4 semanas después de la operación.
A los 111 días después de la administración de hIVIg, el paciente presentó ciclos digestivos normales y ganancia de peso, alcanzando un peso corporal de 8,5 kg. La radiografía abdominal reveló una normalización subjetiva continuada del peristaltismo (Figura 1). Se suspendió la metoclopramida y se proporcionaron instrucciones para el destete gradual de la terapia inmunomoduladora, comenzando primero con una reducción de la prednisolona de 0,29 mg/kg/día a cada dos días. En el momento de escribir este artículo, más de 2 años después de la operación, el paciente permanece en remisión funcional y tomando micofenolato cada dos días (aproximadamente 5,8 mg/kg, aumento de peso ajustado) y ursodiol diariamente (9,8 mg/kg una vez al día, ajustado por aumento de peso) El cronograma de tratamiento y progreso se proporciona en la Tabla 1.
Discusión
Hasta donde saben los autores, este es el primer caso que reporta el uso de hIVIg para la estabilización funcional de la pseudoobstrucción intestinal (CIPO) secundaria a la leiomiositis del intestino delgado en un perro. El término «pseudoobstrucción intestinal» fue introducido a finales de la década de 1950 por Dudley et al., quienes informaron de 13 casos humanos de obstrucción intestinal inexplicable por origen mecánico; Esto se denominó «íleo espástico» (1-3). En medicina humana, la pseudoobstrucción intestinal puede ser aguda o crónica. La forma aguda se ha asociado con cirugía abdominal, peritonitis, hipopotasemia, traumatismo espinal o pélvico, enteritis viral, infarto de miocardio, hemorragia retroperitoneal y tratamiento anticolinérgico u opioide (1-5). La forma crónica se caracteriza principalmente como congénita o adquirida y puede clasificarse además como trastornos primarios (idiopáticos) o secundarios (2-5) Las formas adquiridas pueden ocurrir secundarias a etiologías neurológicas, metabólicas, endocrinas, paraneoplásicas, autoinmunes o infecciosas (1-5). El CIPO es un síndrome raro y altamente mórbido que puede considerarse una insuficiencia de la bomba intestinal, que altera la propulsión gastrointestinal y causa síntomas de obstrucción funcional sin origen mecánico (1, 2, 4-8). Se ha reportado pseudoobstrucción intestinal crónica en varias especies animales, incluyendo perros, caballos, gatos y aves (4, 6, 9–19).
Los perros afectados se presentan con signos inespecíficos, como dolor abdominal, náuseas, vómitos, regurgitación, hinchazón, diarrea, anorexia, distensión abdominal y pérdida de peso de inicio variable. El diagnóstico por imagen revela una marcada dilatación gástrica y del intestino delgado con hipomotilidad severa (4, 7-11, 13-16, 20). En medicina veterinaria, la evidencia clínica y radiológica/ultrasonográfica de obstrucción intestinal es una indicación para la cirugía exploratoria (9). Si no se encuentra evidencia de obstrucción mecánica, se deben obtener biopsias de espesor completo de cada segmento del intestino delgado (9).
La leiomiositis intestinal, caracterizada por la infiltración de linfocitos en las fibras musculares lisas de la túnica muscular, es la lesión CIPO más frecuente en perros (6, 9-11, 15, 16). La infiltración de linfocitos entre miocitos funcionales afecta a la contractilidad de las células del músculo liso entérico, causando íleo posterior (4, 21). Las características patológicas de las miopatías viscerales reflejan cambios degenerativos, incluyendo diversos grados de atrofia miofibraria y degeneración vacuolar (22). En los informes de pacientes humanos y caninos con miopatías viscerales, las células inflamatorias predominantes que se infiltran en las capas musculares atróficas son las células T, lo que sugiere una reacción inflamatoria mediada por células dirigida a las células musculares lisas que puede conducir a la destrucción de la mucosa muscular (4, 13, 22, 23). Esta inflamación de predominio miopático de células T se identificó en el perro presentado en este caso. Con la progresión de la enfermedad, el músculo liso es reemplazado por fibrosis (23). En los casos de leiomiositis intestinal, la mucosa, la submucosa y los plexos neurales se salvan relativamente (4, 11, 12, 22). La ausencia de lesiones mucosas hace que las biopsias endoscópicas sean inadecuadas para establecer un diagnóstico (4, 9). El rendimiento diagnóstico de las biopsias endoscópicas convencionales de la mucosa superficial es bajo, ya que las estructuras neuromusculares submucosas suelen pasar desapercibidas (4, 24, 25). Se sospecha que la CIPO está infradiagnosticada en perros, dada la falta de biopsias intestinales de espesor total en muchos perros con enteropatías crónicas y el conocimiento de esta afección entre los veterinarios (4).
El tratamiento de la CIPO en las personas está dirigido en gran medida a mantener una ingesta calórica adecuada, proporcionar nutrición parenteral, promover la motilidad gastrointestinal y tratar las complicaciones (p. ej., sobrecrecimiento bacteriano, dolor intratable) (1, 3, 4, 7). El tratamiento procinético es uno de los pilares del tratamiento. Se ha demostrado que la cisaprida aumenta el índice de motilidad antroduodenal y mejora la alimentación enteral en las personas; También se ha demostrado que aumenta la presión del esfínter esofágico inferior y disminuye el reflujo gástrico en perros (4, 25-28). En perros, la cisaprida es un agente procinético más potente y eficaz en comparación con la metoclopramida (1, 26). Se ha demostrado que otros fármacos, como la eritromicina, la azitromicina o el mitemcinal (un agonista de la motilina derivado de la eritromicina), estimulan la motilidad antral en humanos y perros con obstrucciones gástricas funcionales o inducidas experimentalmente (4, 29, 30). Sin embargo, hasta la fecha, no se ha demostrado que ninguno mejore de manera confiable la función gastrointestinal en perros con leiomiositis (4, 19).
Los agentes inmunomoduladores, incluidos los corticosteroides, la ciclosporina, la ciclofosfamida y la azatioprina, se han utilizado en pacientes humanos y caninos con leiomiositis intestinal documentada (3, 4, 12, 20, 23, 31, 32). Se cree que dicha terapia es más exitosa cuando se inicia temprano en el curso de la enfermedad, antes de que se desarrolle la atrofia muscular mural y la fibrosis (3, 4, 12, 31, 32). A pesar del tratamiento, el pronóstico general para los pacientes humanos y caninos sigue siendo malo (4).
No se dispone de patología estadísticamente justificada ni de directrices específicas para el tratamiento de la leiomiositis intestinal en especies caninas. Teniendo en cuenta el conocimiento acumulado de casos y los resultados informados en las bases de datos veterinarias, las terapias antimicrobianas, antieméticas, antisecretoras y analgésicas de uso común pueden tener una aplicación razonable, pero no parecen afectar significativamente los resultados, con períodos de supervivencia promedio a menudo informados en semanas de un solo dígito (4, 6, 19, 33, 34). En los casos en los que se ha empleado terapia inmunosupresora, los resultados siguen siendo pobres en general cuando se observa el componente fisiopatológico de la atrofia o fibrosis de las miofibras murales (4, 6, 9, 13, 15). Sin embargo, se informó del éxito del tratamiento con un resultado funcional en un solo perro que utilizó terapia inmunosupresora combinada con prednisolona y azatioprina antes del desarrollo de atrofia muscular mural y fibrosis (32).
Una revisión exhaustiva de los hallazgos patológicos acumulativos en relación con las respuestas al tratamiento puede ser útil, pero está fuera del alcance de este informe. Se ofrece una breve descripción general (Tabla 2).
Dado que la célula inflamatoria predominante en la leiomiositis intestinal es la célula T, la hIVIg representa una opción terapéutica razonable. Se eligió el tratamiento con hIVIg debido al pronóstico históricamente precario asociado con el tratamiento inmunomodulador y procinético multimodal estándar para el tratamiento de la leiomiositis intestinal. Dada la fase de curación quirúrgica, la inmunosupresión convencional podría introducir un riesgo de recuperación significativo sin beneficios predecibles. No se sospecha que la IgIV humana afecte negativamente a la cicatrización de los tejidos y se utiliza perioperatoriamente en humanos con afecciones específicas (35). Los efectos específicos de la hIVIg en la cicatrización de los tejidos no están bien descritos. La hIVIg no parece proporcionar beneficios inmunosupresores a largo plazo (36).
La inmunoglobulina intravenosa humana (hIVIg) está compuesta por inmunoglobulina G altamente purificada, obtenida de grandes cantidades de plasma humano donado, y se ha utilizado durante más de 45 años para tratar una variedad de enfermedades tanto en humanos como en perros (36-42) (Tabla 3). Su mecanismo de acción es complejo e incluye la modulación de la expresión y función de los receptores Fc, la interferencia con la activación de las células B y T y el complemento, y una disminución en la producción de inmunoglobulinas (37, 38). Los trastornos que, según se informa, han respondido a la IgIVH incluyen un amplio espectro de enfermedades mediadas por autoanticuerpos o que se cree que dependen principalmente de las células T autoagresivas; La hIVIg es un componente de la terapia utilizada para los trastornos categóricos autoinmunes de la motilidad gastrointestinal en humanos, en los que la leiomiositis se encuentra ampliamente (38, 54).
No se ha informado previamente de un tratamiento con hIVIg en un paciente veterinario con leiomiositis intestinal. La mediana de supervivencia de este paciente superó con creces la reportada en publicaciones previas (4, 11, 15). La radiografía seriada documenta bien la recuperación peristáltica funcional que no se había informado previamente. Este paciente fue tratado con hIVIg 1 semana después de la operación, y proponemos que la intervención temprana contribuyó positivamente a la respuesta de nuestro paciente.
El fosfato sódico de dexametasona, administrado inmediatamente y 1 semana después de la operación, no tendría un efecto inmunomodulador predecible a largo plazo. El tratamiento con prednisolona se inició a una dosis antiinflamatoria después del tratamiento con hIVIg. Se prescribió tratamiento con micofenolatos para controlar la inmunopatología iniciada por células T, pero no se inició hasta después de 1 mes después de la operación. Las mejorías clínicas y radiográficas se correlacionaron temporalmente con el tratamiento con IgIVh, pero no pueden ser verificadas por este único caso.
No está claro si la colecistectomía y la resolución de la colecistitis bacteriana tuvieron un impacto a largo plazo en la respuesta de este paciente a las terapias prescritas. Un informe reciente de Viljoen et al. documentó una correlación entre las enteropatías inflamatorias y la colecistitis (55). En pacientes humanos, se ha descrito un mimetismo molecular infeccioso, como la enteritis prodrómica (31, 56). Hasta donde sabemos, no se conoce ninguna asociación entre la colecistitis y la leiomiositis en perros.
La respuesta funcional a largo plazo a la terapia, incluida la hIVIg en este paciente, justifica una mayor investigación como opción de tratamiento durante la fase de estabilización de la leiomiositis intestinal en perros.
Declaración de disponibilidad de datos
Las contribuciones originales presentadas en el estudio están incluidas en el artículo/Material complementario, las consultas adicionales pueden dirigirse a los autores correspondientes.
Declaración ética
Los estudios en animales fueron aprobados por el Comité de Ética Clínica de Medicina Interna de la OVSC. Los estudios se llevaron a cabo de acuerdo con la legislación local y los requisitos institucionales. Se obtuvo el consentimiento informado por escrito de los propietarios para la participación de sus animales en este estudio.
Contribuciones de los autores
MO: Escritura – borrador original, Escritura – revisión y edición. JW: Escribir, revisar y editar. NU: Escritura – revisión y edición. SC: Escritura, revisión y edición. CB: Escritura – revisión y edición.
Financiación
El/los autor/es declaran/n que no se recibió apoyo financiero para la investigación, autoría y/o publicación de este artículo.
Conflicto de intereses
Los autores declaran que la investigación se llevó a cabo en ausencia de relaciones comerciales o financieras que pudieran interpretarse como un posible conflicto de intereses.
Nota del editor
Todas las afirmaciones expresadas en este artículo son únicamente las de los autores y no representan necesariamente las de sus organizaciones afiliadas, ni las del editor, los editores y los revisores. Cualquier producto que pueda ser evaluado en este artículo, o afirmación que pueda ser hecha por su fabricante, no está garantizado ni respaldado por el editor.
Material complementario
El material complementario para este artículo se puede encontrar en línea en: https://www.frontiersin.org/articles/10.3389/fvets.2024.1373882/full#supplementary-material
Notas
1. ^Laboratorios IDEXX, Inc., Westbrook, Maine 04092.
2. ^Centro de Emergencias y Especialidades Animales, Springdale, AR 72762.
3. ^Atención veterinaria especializada de Ozark, Springdale, AR 72762.
4. ^A.D.S. 2000, Corporación de Ingeniería Engler, Hialeah, FLA 33013.
5. ^Universidad Estatal de Michigan, Laboratorio de Diagnóstico Veterinario, Lansing, MI 48910.
6. ^Universidad de Texas A&M, Laboratorio Gastrointestinal, College Station, TX 77843.
7. ^Nutrición para mascotas de Hills, Inc., Topeka, KS 66601.
9. ^Gamunex-C, Grifols Inc., Research Triangle Park, NC 27709.
10. ^Antech Diagnostics, Inc., Fountain Valley, CA 92728.
Referencias
1. de Giorgio, R, Cogliandro, RF, Barbara, G, Corinaldesi, R, y Stanghellini, V. Pseudoobstrucción intestinal crónica: características clínicas, diagnóstico y tratamiento. Gastroenterol Clin N Am. (2011) 40:787–807. doi: 10.1016/j.gtc.2011.09.005
2. Dudley, HA, Sinclair, IS, McLaren, IF, McNair, TJ y Newsam, JE. Pseudoobstrucción intestinal. J R Coll Surg Edin. (1958) 3:206–17. doi: 10.1136/bmj.292.6529.1157
3. Antonucci, A, Fronzoni, L, Cogliandro, L, Cogliandro, RF, Caputo, C, Giorgio, RD, et al. Pseudoobstrucción intestinal crónica. Mundo J Gastroenterol. (2008) 14:2953–61. doi: 10.3748/wjg.14.2953
Resumen de PubMed | Texto completo de Crossref | Google Académico
4. Zacuto, AC, Pesavento, PA, Hill, S, McAlister, A, Rosenthal, K, Cherbinsky, O, et al. Leiomiositis intestinal: causa de pseudoobstrucción intestinal crónica en 6 perros. J Veterinario Pasante Med. (2016) 30:132–40. doi: 10.1111/jvim.13652
Resumen de PubMed | Texto completo de Crossref | Google Académico
5. de Giorgio, R, Sarnelli, G, Corinaldesi, V, y Stanghellini, V. Avances en nuestra comprensión de la patología de la pseudoobstrucción intestinal crónica. Tripa. (2004) 53:1549–52. doi: 10.1136/gut.2004.043968
Resumen de PubMed | Texto completo de Crossref | Google Académico
6. Gianella, P, Tecilla, M, Bellino, C, Buracco, P, Martano, M, Zanatta, R, et al. Un caso inusual de leiomiositis intestinal en un boyero de Berna. Schweizer Archiv für Tierheilkunde. (2015) 157:563–7. doi: 10.17236/sat00038
Resumen de PubMed | Texto completo de Crossref | Google Académico
7. Connor, FL, y Di Lorenzo, C. Pseudoobstrucción intestinal crónica: evaluación y manejo. Gastroenterología. (2006) 130:S29-36. doi: 10.1053/j.gastro.2005.06.081
8. Gabbard, SL, y Lacy, BE. Pseudoobstrucción intestinal crónica. Nutr Clin Pract. (2013) 28:307–16. doi: 10.1177/0884533613485904
Resumen de PubMed | Texto completo de Crossref | Google Académico
9. Dvir, E, Leiswitz, AL, y Van Der Lugt, JJ. Pseudoobstrucción intestinal idiopática crónica en un bulldog inglés. J Pequeña Anim Pract. (2001) 42:243–7. doi: 10.1111/j.1748-5827.2001.tb02029.x
Resumen de PubMed | Texto completo de Crossref | Google Académico
10. Eastwood, JM, McInnes, EF, White, RN, Elwood, CM y Stock, G. Impactación cecal y pseudoobstrucción intestinal crónica en un perro. J Vet Med. (2005) 52:43–4. doi: 10.1111/j.1439-0442.2004.00681.x
Resumen de PubMed | Texto completo de Crossref | Google Académico
11. Johnson, CS, Fales-Williams, AJ, Reimer, SB, Lotsikas, PJ, y Haynes, JS. Leiomiositis gastrointestinal fibrosante como causa de pseudoobstrucción intestinal crónica en un perro de 8 meses de edad. Veterinario Pathol. (2007) 44:106–9. doi: 10.1354/vp.44-1-106
Resumen de PubMed | Texto completo de Crossref | Google Académico
12. Harvey, AM, Hall, EJ, Day, MJ, Moore, AH, Battersby, IA y Tasker, S. Pseudoobstrucción intestinal crónica en un gato causada por miopatía visceral. J Veterinario Pasante Med. (2005) 19:111–4. doi: 10.1892/0891-6640(2005)19<111:cipiac>2.0.co;2.
Resumen de PubMed | Texto completo de Crossref | Google Académico
13. Couraud, L, Jermyn, K, Yam, PS, Ramsey, IK, y Philbey, AW. Pseudoobstrucción intestinal, leiomiositis linfocítica y atrofia de la muscular externa en un perro. Rec. Veterinario (2006) 159:86–7. doi: 10.1136/vr.159.3.86
Resumen de PubMed | Texto completo de Crossref | Google Académico
14. Arrick, RH, y Kleine, LJ. Pseudoobstrucción intestinal en un perro. J Am Vet Med Assoc. (1978) 172:1201–5.
15. Cordero, WA, y Francia, MP. Pseudoobstrucción intestinal crónica en un perro. Aust Vet J. (1994) 71:84–6. doi: 10.1111/j.1751-0813.1994.tb03334.x
Resumen de PubMed | Texto completo de Crossref | Google Académico
16. Moore, R, y Carpenter, J. Esclerosis intestinal con pseudo-obstrucción en tres perros. J Am Vet Med Assoc. (1984) 184:830–3.
17. Chénier, S, Macieira, SM, Sylvestre, D, y Jean, D. Pseudoobstrucción intestinal crónica en un caballo: un caso de ganglionitis mientérica. ¿Puede Vet J. (2011) 42:242–7.
18. Weissenböck, H, Bakonyi, T, Sekulin, K, Ehrensperger, F, Doneley, RJT, Dürrwald, R, et al. Bornavirus aviares en aves psitácidas de Europa y Australia con enfermedad de dilatación proventricular. Emerg Infect Dis. (2009) 15:1453–9. doi: 10.3201/eid1509.090353
Resumen de PubMed | Texto completo de Crossref | Google Académico
19. Jung, J y Choi, M. Pseudoobstrucción intestinal crónica miopática primaria en un perro maltés. J Vet Clin. (2016) 33:179–82. doi: 10.17555/jvc.2016.06.33.3.179
20. Ruuska, TH, Karikoski, R, Smith, VV, y Milla, PJ. La pseudoobstrucción intestinal miopática adquirida puede deberse a una leiomiositis entérica autoinmune. Gastroenterología. (2002) 122:1133–9. doi: 10.1053/gast.2002.92396
21. McDonald, GB, Schuffler, MD, Kadin, ME, y Tytgat, GNJ. La pseudoobstrucción intestinal es causada por una infiltración linfoide difusa del intestino delgado. Gastroenterología. (1985) 89:882–9. doi: 10.1016/0016-5085(85)90587-6
Resumen de PubMed | Texto completo de Crossref | Google Académico
22. Domizio, P, y Martín, JE. Trastornos musculares y mecánicos del intestino delgado En: NA Shepherd y BF Warren, editores. Williams GT, et al. Morson and Dawson’s gastrointestinal pathology (Patología gastrointestinal de Morson y Dawson). 5ª ed. Hoboken, NJ: Blackwell (2013). 305–14.
23. Kapur, RP. Trastornos motores intestinales En: P Russo y ED Ruchelli, editores. Poccoli DA: Patología de la enfermedad gastrointestinal y hepática pediátrica. 2ª ed. Cham, Suiza: Springer (2014). 249–316.
24. Valli, PV, Pohl, D, Fried, M, Caduff, R y Bauerfeind, P. Uso diagnóstico de la resección endoscópica de la pared de espesor completo (eFTR): una nueva técnica mínimamente invasiva para la toma de muestras de tejido colónico en pacientes con trastornos graves de la motilidad gastrointestinal. Neurogastroenterol Motil. (2018) 30:1–6. doi: 10.1111/nmo.13153
25. Knowles, CH, de Giorgio, R, Kapur, RP, Bruder, E, Farrugia, G, Geboes, K, et al. La clasificación de Londres de la patología neuromuscular gastrointestinal: informe en nombre del grupo de trabajo internacional gastro 2009. Tripa. (2010) 59:882–7. doi: 10.1136/gut.2009.200444
Resumen de PubMed | Texto completo de Crossref | Google Académico
26. Kempf, J, Lewis, F, Reusch, CE y Kook, PH. Evaluación manométrica de alta resolución de los efectos de la cisaprida y el clorhidrato de metoclopramida administrados por vía oral sobre la presión del esfínter esofágico inferior en perros despiertos. Am J Vet Res. (2014) 75:361–6. doi: 10.2460/ajvr.75.4.361
Resumen de PubMed | Texto completo de Crossref | Google Académico
27. Zacuto, AC, Marks, SL, Osborn, J, Douthitt, KL, Hollingshead, KL, Hayashi, K, et al. Influencia del esomeprazol y la cisaprida en el reflujo gastroesofágico durante la anestesia en perros. J Veterinario Pasante Med. (2012) 26:518–25. doi: 10.1111/j.1939-1676.2012.00929.x
Resumen de PubMed | Texto completo de Crossref | Google Académico
28. Abell, TL, Camilleri, M, DiMagno, EP, Hench, VS, Zinsmeister, AR y Malagelada, JR. Eficacia a largo plazo de la cisaprida oral en la dismotilidad sintomática del intestino superior. Dig Dis Sci. (1991) 36:616–20. doi: 10.1007/BF01297028
Resumen de PubMed | Texto completo de Crossref | Google Académico
29. Moshiree, B, McDonald, R, Hou, W y Toskes, PP. Comparación del efecto de la azitromicina frente a la eritromicina en los perfiles de presión antroduodenal de pacientes con dolor gastrointestinal funcional crónico y gastroparesia. Dig Dis Sci. (2010) 55:675–83. doi: 10.1007/s10620-009-1038-3
Resumen de PubMed | Texto completo de Crossref | Google Académico
30. Onoma, M, Yogo, K, Ozaki, K, Kamei, K, Akima, M, Koga, H, et al. El mitemcinal oral (GM-611), un procinético derivado de la eritromicina, acelera el vaciamiento gástrico normal y retrasado experimentalmente en perros conscientes. Clin Exp Pharmacol Physiol. (2008) 35:35–42. doi: 10.1111/j.1440-1681.2007.04744.x
Resumen de PubMed | Texto completo de Crossref | Google Académico
31. Uchida, K, Otake, K, Inoue, M, Koike, Y, Matsushita, K, Araki, T, et al. Pseudoobstrucción intestinal crónica por leiomiositis intestinal linfocítica: reporte de un caso y revisión de la literatura. intratable raro dis res. (2012) 1:35–9. doi: 10.5582/irdr.2012.v1.1.35
Resumen de PubMed | Texto completo de Crossref | Google Académico
32. Murtagh, K, Oldroyd, L, Ressel, L, y Batchelor, D. Manejo exitoso de la pseudoobstrucción intestinal en un perro. Representante de casos de Vet Rec. (2013) 1:25. doi: 10.1136/vetreccr-2013-000025
33. Vandenberge, V, Paepe, D, Vercauteren, G, Daminet, S, Ducatelle, R, y Chiers, K. Pseudoobstrucción intestinal crónica en un boyero de Berna. Vlaams Diergeneeskundig Tijdschrift. (2009) 78:117–20. doi: 10.21825/vdt.87506
34. Kopke, MA, Ruaux, CG y Gal, A. Ganglionitis mientérica y leiomiositis intestinal en un Jack Russell terrier. J Pequeña Anim Pract. (2020) 61:772–5. doi: 10.1111/jsap.12962
35. Jennes, E, Guggenberger, D, Zotz, R, Thompson, L, Brümmendorf, TH, Koschmieder, S, et al. Tratamiento perioperatorio con inmunoglobulinas intravenosas en un paciente con síndrome de von Willebrand adquirido grave: reporte de un caso y revisión de la literatura. Clin Case Rep. (2017) 5:664–70. doi: 10.1002/ccr3.890
Resumen de PubMed | Texto completo de Crossref | Google Académico
36. Arumugham, VB y Rayi, A. Inmunoglobulina intravenosa (IVIG) [Actualizado el 3 de julio de 2023]. En: StatPearls (Internet). La isla del tesoro (FL): StatPearls Publishing (2023).
37. Whelan, MF, O’Toole, TE, Chan, DL, Rozanski, EA, DeLaforcade, AM, Crawford, SL, et al. Uso de inmunoglobulina humana además de glucocorticoides para el tratamiento inicial de perros con anemia hemolítica inmunomediada. J Vet Emerg Crit Care. (2009) 19:158–64. doi: 10.1111/j.1476-4431.2009.00403.x
Resumen de PubMed | Texto completo de Crossref | Google Académico
38. Kazatchkine, MD, y Kaveri, SV. Inmunomodulación de enfermedades autoinmunes e inflamatorias con inmunoglobulina intravenosa. N Engl J Med. (2001) 345:747–55. doi: 10.1056/NEJMra993360
39. Kurtzberg, J, Friedman, HS, Chaffee, S, Falletta, JM, Kinney, TR, Kurlander, R, et al. Eficacia de la gammaglobulina intravenosa en las discrasias sanguíneas pediátricas automediadas por el sistema inmunitario. Am J Med. (1987) 83:4–9. doi: 10.1016/0002-9343(87)90544-4
Resumen de PubMed | Texto completo de Crossref | Google Académico
40. Flores, G, Cunningham-Rundles, C, Newland, AC, y Bussel, JB. Eficacia de la inmunoglobulina intravenosa en el tratamiento de la anemia hemolítica autoinmune: resultados en 73 pacientes. Am J Hematol. (1993) 44:237–42. doi: 10.1002/ajh.2830440404
Resumen de PubMed | Texto completo de Crossref | Google Académico
41. Bianco, D, Armstrong, PJ, y Washabau, RJ. Estudio prospectivo, aleatorizado, doble ciego y controlado con placebo de inmunoglobulina intravenosa humana para el tratamiento agudo de la presunta trombocitopenia inmunomediada primaria en perros. J Veterinario Pasante Med. (2009) 23:1071–8. doi: 10.1111/j.1939-1676.2009.0358.x
42. Norris, PA, Kaur, G, y Lazarus, AH. Nuevos conocimientos sobre los mecanismos y alternativas de la IgIV en enfermedades autoinmunes e inflamatorias. Curr Opin Hematol. (2020) 27:392–8. doi: 10.1097/MOH.000000000000000609
Resumen de PubMed | Texto completo de Crossref | Google Académico
43. Spurlock, N, y Prittie, J. Uso de la terapia con inmunoglobulina intravenosa humana en la práctica clínica veterinaria. Veterinario Clin North Am. (2020) 50:1371–83. doi: 10.1016/j.cvsm.2020.07.015
Resumen de PubMed | Texto completo de Crossref | Google Académico
44. Scott-Moncrieff, JC, Reagan, WJ, Snyder, PW y Glickman, LT. Administración intravenosa de inmunoglobulina humana en perros con anemia hemolítica mediada por el sistema inmunitario. J Am Vet Med Assoc. (1997) 210:1623–7. doi: 10.2460/javma.1997.210.11.1623
Resumen de PubMed | Texto completo de Crossref | Google Académico
45. Kane, B y Greer, RM. Uso de inmunoglobulina intravenosa humana para la enfermedad inmunomediada hematológica en perros. J Am Vet Med Assoc. (2023) 261:1004–10. doi: 10.2460/javma.23.01.0043
Resumen de PubMed | Texto completo de Crossref | Google Académico
46. Balog, K, Huang, A, Sum, S, Moore, GE, Thompson, C, y Scott-Moncrieff, JC. Un ensayo clínico aleatorizado prospectivo de vincristina versus inmunoglobulina intravenosa humana para el tratamiento adyuvante agudo de la presunta trombocitopenia inmunomediada primaria en perros. J Veterinario Pasante Med. (2013) 27:536–41. doi: 10.1111/jvim.12066
Resumen de PubMed | Texto completo de Crossref | Google Académico
47. Stikeman, E, y Bianco, D. Uso de inmunoglobulina intravenosa humana para el tratamiento de 12 perros con enfermedad maligna recién diagnosticada y presunta trombocitopenia secundaria mediada por el sistema inmunitario. J Pequeña Anim Pract. (2024) 65:338–45. doi: 10.1111/jsap.13700
Resumen de PubMed | Texto completo de Crossref | Google Académico
48. Bianco, D, y Hardy, M. Tratamiento del síndrome de Evans con inmunoglobulina intravenosa humana y lefunomida en un perro diabético. J Am Anim Hosp Assoc. (2009) 45:147–50. doi: 10.5326/0450147
Resumen de PubMed | Texto completo de Crossref | Google Académico
49. Nuttall, T, y Malham, T. Tratamiento exitoso con inmunoglobulina intravenosa humana del síndrome de Stevens-Johnson inducido por medicamentos en un perro. J Pequeña Anim Pract. (2004) 45:357–61. doi: 10.1111/j.1748-5827.2004.tb00248.x
Resumen de PubMed | Texto completo de Crossref | Google Académico
50. Trotman, T, Phillips, H, Fordyce, H, King, LG, Morris, DO, y Giger, U. Tratamiento de reacciones cutáneas adversas graves a medicamentos con inmunoglobulina intravenosa humana en dos perros. J Am Anim Hosp Assoc. (2006) 42:312–20. doi: 10.5326/0420312
Resumen de PubMed | Texto completo de Crossref | Google Académico
51. Rahilly, LJ, Keating, JH y O’Toole, TE. El uso de inmunoglobulina humana intravenosa en el tratamiento del pénfigo foliáceo grave en un perro. J Veterinario Pasante Med. (2006) 20:1483–6. doi: 10.1111/j.1939-1676.2006.tb00770.x
Resumen de PubMed | Texto completo de Crossref | Google Académico
52. Abelson, A, Shelton, G y Whelan, M. Uso de micofenolato mofetilo como agente de rescate en el tratamiento de la miastenia gravis generalizada grave en tres perros. J Vet Emerg Crit Care (San Antonio). (2009) 19:369–74. doi: 10.1111/j.1476-4431.2009.00433.x
Resumen de PubMed | Texto completo de Crossref | Google Académico
53. Grozdanic, S, Harper, M y Kecova, H. Retinopatía mediada por anticuerpos en pacientes caninos: mecanismo, diagnóstico y modalidades de tratamiento. Vet Clin North Am Small Anim Pract. (2008) 38:361–87. doi: 10.1016/j.cvsm.2007.12.003
Resumen de PubMed | Texto completo de Crossref | Google Académico
54. Nakane, S, Mukaino, A, Ihara, E y Ogawa, Y. Dismotilidad gastrointestinal autoinmune: la interfaz entre la inmunología clínica y la neurogastroenterología. Immunol Med. (2021) 44:74–85. doi: 10.1080/25785826.2020.1797319
Resumen de PubMed | Texto completo de Crossref | Google Académico
55. Vilojoen, AD, Tamborini, A, Watson, PJ, y Bexfield, NH. Características clínicas e histológicas de perros colecistectomíizados con lodos biliares no dependientes de la gravedad: 16 casos (2014-2019). J Pequeña Anim Pract. (2021) 62:478–88. doi: 10.1111/jsap.13302
Resumen de PubMed | Texto completo de Crossref | Google Académico
Palabras clave: leiomiositis intestinal, íleo, pseudoobstrucción, CIPO, inmunoglobulina intravenosa (IgIV), colecistitis, activación de células T
Cita: Olivarez MP, Williams J, Udomteerasuwat N, Corner S y Byers C (2024) Caso clínico: Tratamiento exitoso de la leiomiositis intestinal en un perro con inmunoglobulina intravenosa adyuvante. Frente. Vet. Sci. 11:1373882. doi: 10.3389/fvets.2024.1373882
Recibido: 20 de enero de 2024; Aceptado: 28 de junio de 2024;
Publicado: 23 Julio 2024.
Editado por:
Muhammad Saqib, Universidad de Agricultura, Pakistán
Revisado por:
Francesk Mulita, Hospital Universitario General de Patras, Grecia
Alyse Zacuto, Medicina Interna y Oncología Veterinaria del Atlántico, Estados Unidos
Derechos de autor © 2024 Olivarez, Williams, Udomteerasuwat, Corner y Byers. Este es un artículo de acceso abierto distribuido bajo los términos de la Licencia Creative Commons Attribution License (CC BY).
*Correspondencia: Michelle Patrick Olivarez, de michelle.patrick@thrivepet.com años; Jarod Williams, jarod.williams@thrivepet.com
Renuncia: Todas las afirmaciones expresadas en este artículo son únicamente las de los autores y no representan necesariamente a las de sus organizaciones afiliadas, o las del editor, de los editores y de los revisores. Cualquier producto que puede ser evaluada en este artículo o afirmación que puede ser hecha por su El fabricante no está garantizado ni respaldado por el editor.
Date de alta y recibe nuestro 👉🏼 Diario Digital AXÓN INFORMAVET ONE HEALTH
Date de alta y recibe nuestro 👉🏼 Boletín Digital de Foro Agro Ganadero
Noticias animales de compañía
Noticias animales de producción
Trabajos técnicos animales de producción
Trabajos técnicos animales de compañía