Tratamiento inmunoestimulante de poliprenilo de gatos con peritonitis infecciosa felina presuntiva no efectiva en un estudio de campo
Tratamiento inmunoestimulante de poliprenilo de gatos con peritonitis infecciosa felina presuntiva no efectiva en un estudio de campo
- 1Ciencias Clínicas de Animales Pequeños, Facultad de Medicina Veterinaria, Universidad de Tennessee, Knoxville, TN, EE. UU.
- 2Sass & Sass, Inc., Oak Ridge, TN, EE. UU.
- 3 Consultor independiente, Oak Ridge, TN, EE. UU.
- 4Graduación de Medicina, Universidad de Tennessee, Knoxville, TN, EE. UU.
La peritonitis infecciosa felina (FIP) es una enfermedad mortal sin tratamiento clínicamente efectivo. Este estudio de campo evaluó el tratamiento con inmunoestimulante de poliprenilo (PI) en gatos con la forma no efusiva de FIP. Debido a que la inmunpresión es un componente importante en la patología de la FIP, planteamos la hipótesis de que el tratamiento con un estimulante del sistema inmunitario aumentaría los tiempos de supervivencia de los gatos con FIP seco. Sesenta gatos, diagnosticados con FIP seco por veterinarios especializados y de atención primaria y que cumplían con los criterios de aceptación, fueron tratados con PI sin selección intencional de casos menos graves. El tiempo de supervivencia desde el inicio del tratamiento de PI en gatos diagnosticados con FIP seco mostró que de los 60 gatos con FIP seco tratados con PI, 8 sobrevivieron durante 200 días y 4 de 60 sobrevivieron durante 300 días. Una búsqueda bibliográfica identificó a 59 gatos con FIP no eficaz o seco; ningún gato con solo FIP seco vivió más de 200 días. Los veterinarios de gatos tratados con IP que sobrevivieron más de 30 días informaron de mejoras en los signos y el comportamiento clínicos. Los tiempos de supervivencia en nuestro estudio fueron significativamente más largos en gatos que no fueron tratados con corticosteroides al mismo tiempo que la PI. Si bien no es una cura, PI muestra una promesa en el tratamiento de la forma seca de FIP, pero se necesitará un estudio controlado para verificar el beneficio.
Introducción
La peritonitis infecciosa felina (FIP) se considera una de las enfermedades más devastadoras de los gatos domésticos con una incidencia del 2 al 12 % (1) en entornos multigato. La FIP se ha considerado durante mucho tiempo mortal (2–4) y una de las principales causas de mortalidad en gatos jóvenes. No existen tratamientos clínicamente efectivos para la FIP (5). La FIP tiene una forma efusiva con acumulaciones de líquido abdominal y torácico; se observó un tiempo de supervivencia medio de 9 días en 21 gatos con FIP efusiva (6). La FIP seca (no efusiva) a menudo se caracteriza por infiltrados yogranulomatosos en el hígado, los riñones, los ganglios linfáticos, los ojos y el sistema nervioso central. La forma seca de FIP tiene tiempos de supervivencia más largos en un rango de 1 a 200 días observados en 59 gatos (6-13). Dos gatos con formas mixtas secas y húmedas FIP tratados con combinaciones de corticosteroides, interferón alfa humano y nelfinavir sobrevivieron 181 y 477 días (7).
La mutación del coronavirus entérico que induce un tropismo para los macrófagos inicia el proceso de la enfermedad (3, 14). La inmunosupresión mediada por células debido a una disminución de los linfocitos CD4+ se observa comúnmente en gatos con FIP (14). Las deficiencias en la inmunidad mediada por células promueven una producción exuberante de anticuerpos contra el coronavirus, lo que resulta en la deposición de complejos inmunes. Dado que la inmunosupresión es un componente importante de la fisiopatología, el tratamiento con un estimulante inmunológico es un enfoque racional.
El inmunoestimulante de poliprenilo (PI) es un biológico veterinario con licencia de la U. S. Departamento de Agricultura para la reducción de la gravedad de los signos del herpesvirus felino y es seguro en gatos mayores de 8 semanas de edad. Se utilizó en nuestro estudio piloto para tratar gatos con la forma seca de FIP y produjo resultados prometedores (15). regula la vía del tipo Th-1 a través de receptores similares al peaje (16) y, por lo tanto, puede ser beneficioso en las enfermedades que implican la supresión de la inmunidad celular. En este estudio de campo, tratamos de determinar si el tratamiento de PI aumenta el tiempo de supervivencia y la calidad de vida en gatos diagnosticados con FIP seco.
Materiales y métodos
Diseño de estudio general
El estudio de campo tenía un solo brazo de tratamiento, sin un grupo de control de placebo, y se limitó a gatos con FIP no efusivo o seco. Solo se aceptaron gatos en los Estados Unidos y Canadá. Los gatos fueron diagnosticados y tratados por sus veterinarios de atención primaria junto con, en muchos casos, especialistas veterinarios. Los laboratorios habituales de los veterinarios realizaron pruebas de diagnóstico. El estudio midió los tiempos de supervivencia desde el inicio del tratamiento de PI hasta la muerte o la eutanasia en estado terminal. Los datos de supervivencia de este estudio se compararon con los datos históricos de varios artículos publicados. El estudio incluyó gatos de todas las señales con signos clínicos que representaban el espectro clínico de la forma seca FIP y fueron aceptados y tratados independientemente de la gravedad de la enfermedad o los tratamientos actuales. La adición de estimulantes del apetito, antieméticos, antibióticos, vitaminas o dietas especiales no estaba prohibida en nuestro estudio, pero el protocolo desaconsejó el uso de corticosteroides porque causan inmunosupresión. Este estudio se llevó a cabo de acuerdo con las recomendaciones de la Oficina de Cuidado de Animales de Laboratorio de la Universidad de Tennessee. El protocolo fue aprobado por el Protocolo #1946 del Comité Institucional de Cuidado y Uso de Animales de la Universidad de Tennessee.
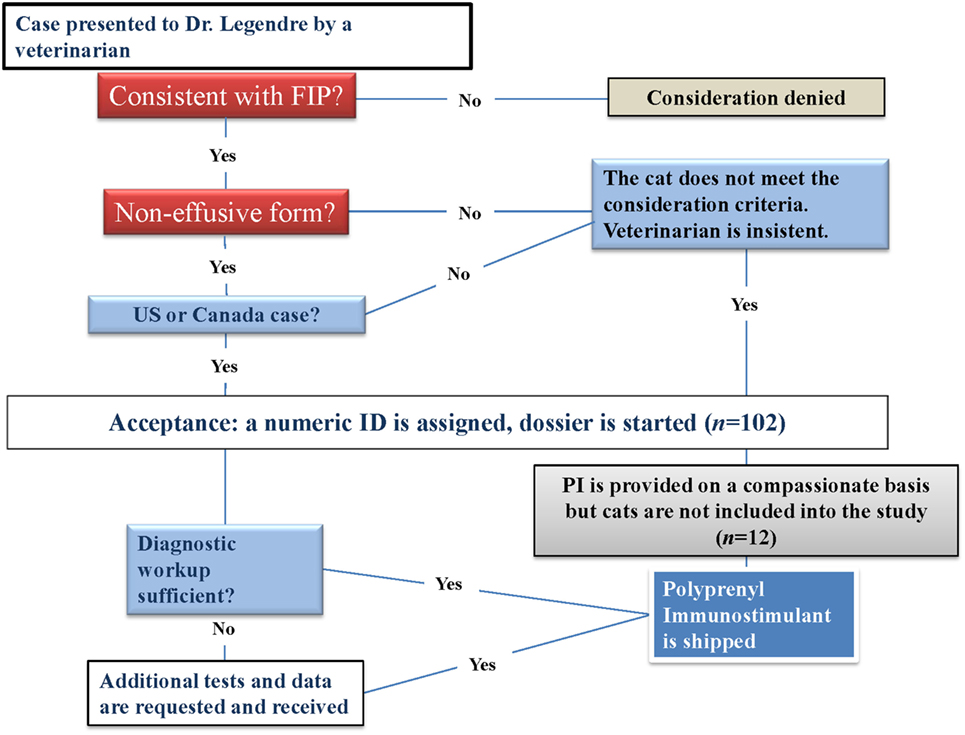
Reclutamiento de casos
Los hallazgos preliminares de un estudio piloto anterior se publicaron en 2009 (15). El sitio de la Red de Información Veterinaria publicó una nota de este ensayo en febrero de 2010. Después de la publicación del artículo y la nota, los veterinarios en ejercicio con casos sospechosos o confirmados de FIP se pusieron en contacto con el Investigador Principal (AML) por correo electrónico o teléfono. Todos los gatos diagnosticados con FIP seco por su veterinario fueron considerados y asignados un número (Figura 1). Los diagnósticos iniciales fueron realizados por veterinarios y revisados y evaluados para su aceptación por parte de AML sobre la base de datos suficientes para apoyar el diagnóstico. En ocho casos, la LMA aceptó a los gatos en el estudio sin todos los diagnósticos de laboratorio si el diagnóstico se hizo mediante técnicas invasivas [inmunohistoquímica (IHC), histopatología del material biopsidado o citología de aspirados].
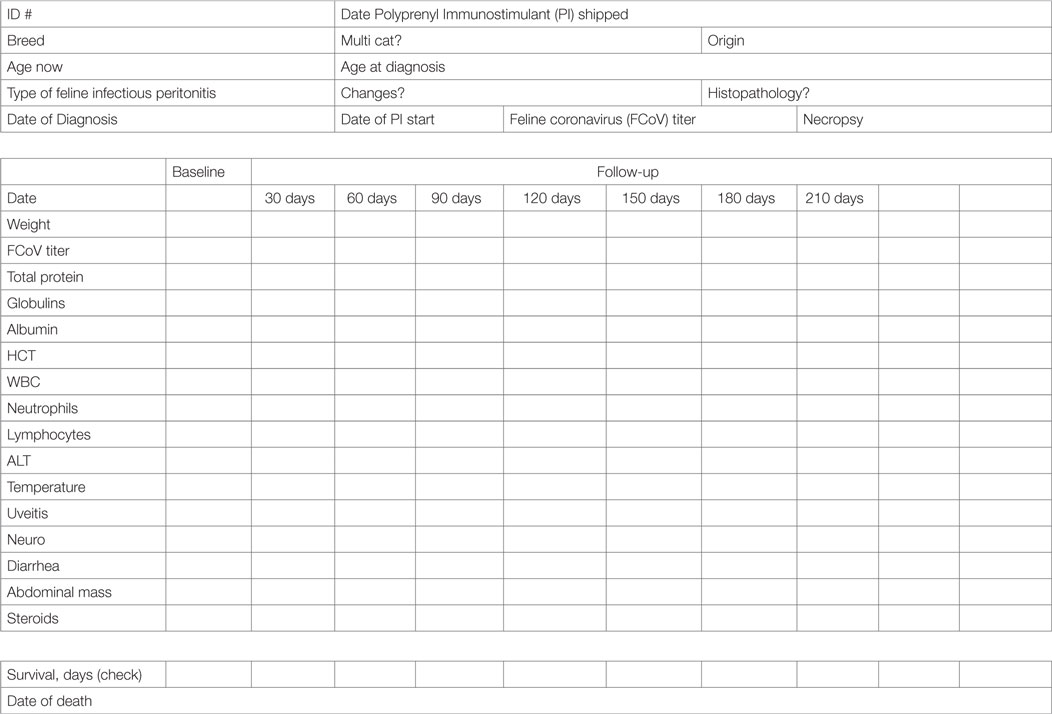
El diagnóstico veterinario inicial se apoyó utilizando el enfoque de diagnóstico propuesto por Addie et al. (2) como se refleja en nuestro formulario de recopilación de datos (Tabla 1), que incluía preguntas sobre la edad del paciente, la historia, el entorno y observaciones como la pirexia, la pérdida de peso, el letargo, la anorexia, la presencia de lesiones abdominales (masas, ganglios Las pruebas de laboratorio necesarias incluyeron recuento sanguíneo completo, bioquímica y títulos de anticuerpos para el coronavirus felino (FCoV) y para patógenos que pueden imitar la FIP. Se alentó la biopsia quirúrgica o la aspiración de sospechas de lesiones. La necropsia se ofreció en la Universidad de Tennessee de forma gratuita o los veterinarios podían proporcionar los resultados de la necropsia realizada por sus proveedores.
Los gatos aceptados recibieron IP a 3 mg/kg por vía oral tres veces por semana y fueron evaluados clínicamente por sus veterinarios inicialmente y luego en exámenes de seguimiento (se recomendó mensualmente), que recopilaron los datos para el análisis como se muestra en la Tabla 2. Se requirió la presentación de los resultados iniciales y de seguimiento de las pruebas de laboratorio. Las recargas de PI se enviaron a los veterinarios colaboradores después de recibir los resultados de las evaluaciones de seguimiento. El seguimiento del progreso de los gatos aceptados en el estudio continuó hasta la muerte o la eutanasia.
Se aconsejó a los veterinarios que reduciran los tratamientos con corticosteroides si se iniciaban antes del estudio, pero se les permitió continuar la terapia con corticosteroides a la dosis efectiva más baja para mantener el apetito y el bienestar.
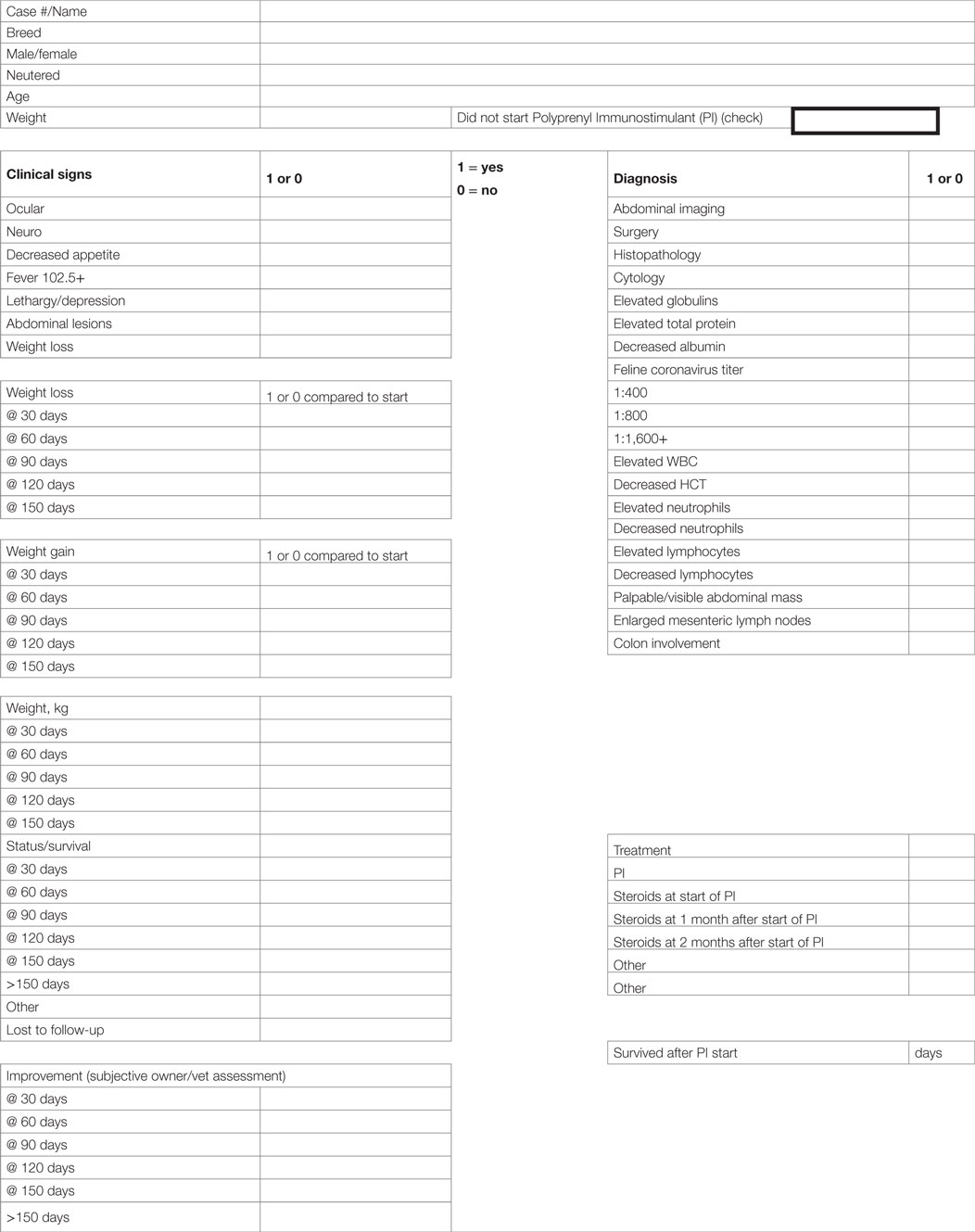
La evaluación de la calidad de vida se realizó utilizando las respuestas de los cuestionarios y las comunicaciones de los veterinarios y propietarios de atención primaria. En muchos casos, se registraron comentarios más extensos en los registros médicos del gato, y se analizaron todos los registros para los comentarios. Consideramos las comunicaciones de veterinarios y propietarios con respecto a la restauración de rutinas, niveles de actividad, mejora del apetito, etc. como indicadores de la calidad de vida. La tabla 3 muestra el cuestionario utilizado para proporcionar los datos recopilados en el estudio.
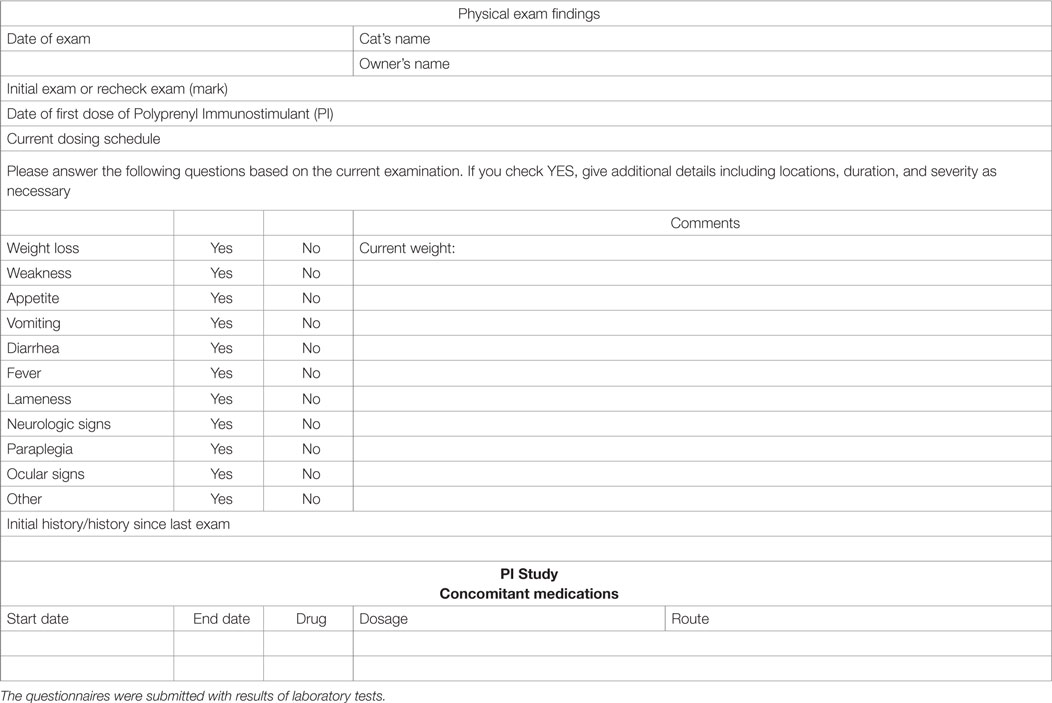 TABLA 3. CUESTIONARIO PARA LA RECOPILACIÓN DE INFORMACIÓN DEL PACIENTE DE LOS EXÁMENES INICIALES Y DE SEGUIMIENTO.
TABLA 3. CUESTIONARIO PARA LA RECOPILACIÓN DE INFORMACIÓN DEL PACIENTE DE LOS EXÁMENES INICIALES Y DE SEGUIMIENTO.
Análisis estadístico de los resultados del estudio
Las estadísticas de Skewness y kurtosis encontraron distribuciones no normales para todas las variables temporales asociadas con la supervivencia. Por lo tanto, se emplearon estadísticas no paramétricas para obtener inferencias basadas en las respectivas preguntas de investigación. Las comparaciones entre sujetos para los grupos de edad y los grupos de enfermedad se llevaron a cabo utilizando las pruebas de Kruskal-Wallis y Mann-Whitney U. Además de las medias y la SD, se informaron medianas y rangos intercuartiles para dar contexto a los hallazgos estadísticos no paramétricos. Se utilizaron curvas de supervivencia de Kaplan-Meier para mostrar la supervivencia acumulada de los gatos a lo largo del tiempo. Se emplearon pruebas t para la comparación de la media y la SD. Un valor alfa de 0,05 asumió significación estadística, y todos los análisis se realizaron utilizando SPSS Versión 21 (Armonk, NY, EE. UU.: IBM Corp.).
Resultados
Consideración y aceptación
La consideración comenzó el 1 de marzo de 2010 y terminó el 6 de mayo de 2011. Se consideraron un total de 102 gatos para el estudio. Todos los gatos fueron diagnosticados por sus veterinarios de atención primaria. Había 60 gatos que cumplían con los criterios de calificación y, por lo tanto, fueron aceptados en el estudio, y 23 de ellos habían sido referidos a especialistas, incluidos oftalmólogos veterinarios (12), internistas (6), neurólogos (3), oftalmólogo y un neurólogo conjuntamente (1), y un cardiólogo veterinario (1). Los gatos considerados restantes fueron descalificados antes o durante el estudio por las siguientes razones: información de diagnóstico insuficiente (10), murió antes de que llegara el PI (10), forma húmeda FIP (10; PI se proporcionó de forma compasiva), el tratamiento se intejó después de una o dos dosis (2), casos en el extranjero (2; PI se proporcionó de forma compasiva), diagnóstico incorrecto 1 de marzo de 2010 (1). Los gatos aceptados fueron evaluados y tratados por veterinarios de todo Estados Unidos (58), y en Canadá (2) en sus prácticas. Menos del 32 % (19 de 60) de los gatos fueron diagnosticados 10 días o menos antes del inicio del tratamiento de PI. Los 41 gatos restantes fueron diagnosticados con FIP seco 11 o más días antes del inicio del tratamiento con PI. El intervalo de tiempo medio entre el diagnóstico y el tratamiento fue de 22,97 ± 21,60 días. El gato que murió después de la administración de la primera dosis fue diagnosticado 161 días antes del inicio del tratamiento de PI.
Diagnóstico
Señalización
Había 25 hembras, 1 hermafrodita y 34 gatos machos; 38 eran no de raza pura y 22 eran de raza pura (5 Ragdoll, 4 siberiano, 3 bengalí, 3 Maine Coon, 2 siameses, 2 Sphynx, 1 Tonkinese, 1 Manx y 1 birmano). Se proporcionaron datos sobre el hogar para 30 gatos; 22 de los 30 eran de hogares de varios gatos y 8 de hogares de un solo gato. La distribución por edad de los 60 gatos se muestra en la Figura 2. El setenta por ciento de los gatos tenían menos de 24 meses, y el 43 % tenían menos de un año de edad.
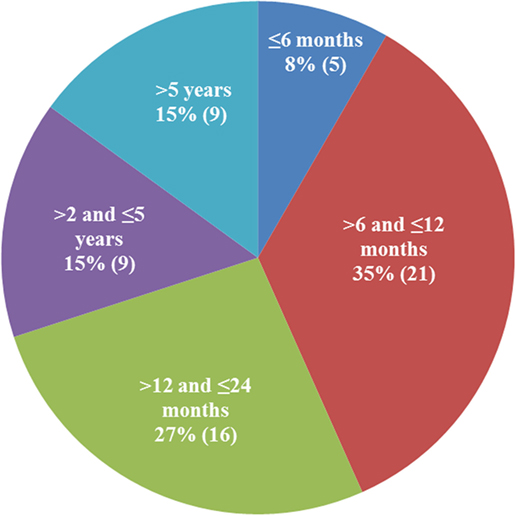 FIGURA 2. DISTRIBUCIÓN POR EDAD DE LOS PACIENTES CALIFICADOS. La mayoría de los gatos diagnosticados con peritonitis infecciosa felina seca tenían menos de 2 años (70%).
FIGURA 2. DISTRIBUCIÓN POR EDAD DE LOS PACIENTES CALIFICADOS. La mayoría de los gatos diagnosticados con peritonitis infecciosa felina seca tenían menos de 2 años (70%).
Signos clínicos
Cincuenta y nueve de los 60 gatos aceptados en el estudio tenían signos clínicos de FIP enumerados en el algoritmo propuesto por Addie et al. (2). La presencia de signos clínicos hizo que los dueños de los gatos llevaran al gato a su veterinario principal para su examen. Durante este examen inicial, los signos clínicos se documentaron en los registros médicos. Las figuras 3A, B muestran los signos clínicos y su distribución en los gatos aceptados en este estudio. Cincuenta y cuatro de 59 gatos mostraron dos o más signos clínicos (Figura 3B) y cinco gatos tenían un signo. De los cinco gatos con un signo, 2/5 fueron neurológicos, 1/5 ocular, 1/5 se evaluó debido a vómitos persistentes (se descubrió una masa abdominal en la región ileocólica en el examen), y no se proporcionaron datos de un examen inicial exhaustivo para uno cuya masa abdominal se descubrió en el examen físico.
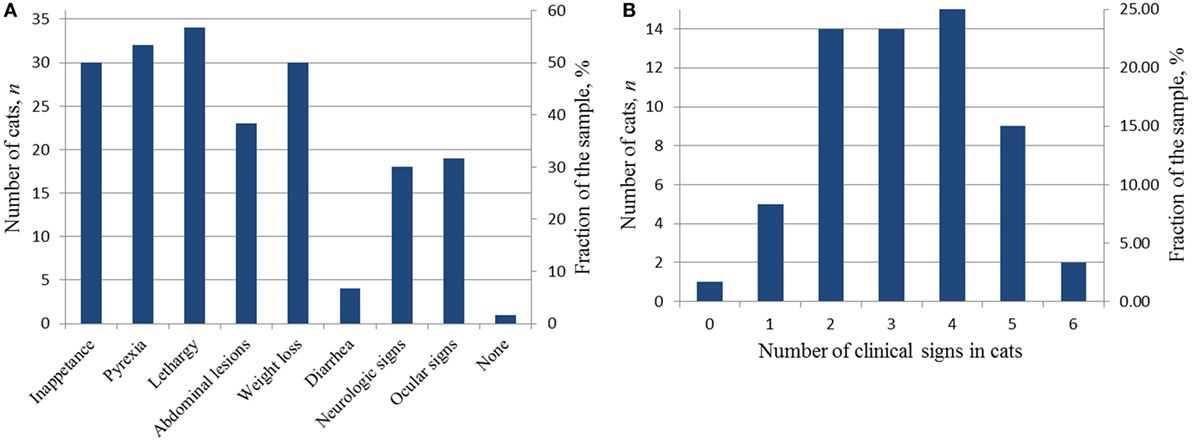 FIGURA 3. SIGNOS CLÍNICOS DE DIAGNÓSTICO EN LOS GATOS ACEPTADOS EN EL ESTUDIO EN EL MOMENTO DE LA PRESENTACIÓN INICIAL. (A) Distribución de los signos clínicos en la muestra del estudio; (B) distribución del número de signos clínicos en gatos individuales.
FIGURA 3. SIGNOS CLÍNICOS DE DIAGNÓSTICO EN LOS GATOS ACEPTADOS EN EL ESTUDIO EN EL MOMENTO DE LA PRESENTACIÓN INICIAL. (A) Distribución de los signos clínicos en la muestra del estudio; (B) distribución del número de signos clínicos en gatos individuales.
Se incluyó un gato en el estudio que no tenía signos clínicos cuando se vio para la castración. Este gato siberiano macho de 8 meses de edad tenía una proteína sérica total de 10,7 g/dL en una prueba de preanestesia. La albúmina era de 2,1 g/dL, y la globulina era de 8,6 con una relación A/G de 0,24. La electroforesis sérica se interpretó como gammopatía policlonal. El gato estaba anémico con un hematocrito del 23 %. El título de anticuerpos contra el coronavirus fue positivo en 1:1.600, y el antígeno de leucemia felina fue negativo y el título de anticuerpos de inmunodeficiencia felina fue negativo. Las radiografías torácicas mostraron un aumento en la densidad mediastínica craneal, y se observaron ganglios linfáticos mesentéricos agrandados en la ecografía abdominal. Los aspirados de los ganglios linfáticos mostraron un aumento de los neutrófilos en la citología de los aspirados.
Cincuenta y nueve de los 60 gatos del estudio se clasificaron en una de las cinco subformas de FIP seca en función de los signos clínicos iniciales, los hallazgos del examen físico de los veterinarios primarios (y especialistas cuando corresponda) y el trabajo de diagnóstico. Un gato no tenía signos clínicos. Las categorías de subformas se distribuyeron de la siguiente manera: mixta (18/59), gastrointestinal (16/59), no localizada (11/59), ocular (9/59), neurológica (5/59).
En la presentación inicial, los gatos de la categoría gastrointestinal tenían anorexia (15/16), diarrea (4) y/o vómitos (3), que fueron las principales razones de la visita veterinaria. Se encontraron masas abdominales en 23/59 gatos en el estudio, y los gatos se clasificaron en la subforma gastrointestinal o mixta dependiendo de si tenían signos clínicos adicionales asociados con más frecuencia con otra subforma.
Se notificaron cambios oculares en 17 gatos e incluyeron uveítis anterior (17/17), desprendimiento de retina (2/17) y precipitados cerácicos (4/17). Un gato tenía una úlcera córnea. En 10/17 gatos, los signos oculares fueron la razón de la visita veterinaria inicial, y los gatos fueron asignados a la subforma ocular. Los otros 7 gatos con signos oculares también tenían signos neurológicos, abdominales o no localizados y se clasificaron como de forma mixta. Los signos neurológicos, como las convulsiones, la ataxia y la desorientación, fueron la razón principal de la evaluación veterinaria en 5/59 gatos, y se clasificaron como subforma neurológica. La categoría «no localizada» (11/59) incluía gatos con fiebre persistente incontrolable con antibióticos, letargo, anorexia y/o pérdida de peso. Los gatos de subforma mixta tenían signos simultáneos de dos o más subcategorías, como los signos oculares combinados con signos neurológicos (por ejemplo, uveítis y convulsiones).
Hematología, serología, pruebas diferenciales
Los resultados de las pruebas hematológicos de la sangre extraída durante el examen inicial se muestran en la Tabla 4. Los datos de los análisis de sangre no estaban disponibles para nueve gatos diagnosticados inicialmente en base a los hallazgos de histología y citología consistentes con FIP, que se aceptaron como diagnóstico. Dos gatos se hicieron pruebas de serología y hematología después de la aceptación y el inicio del tratamiento, y esos datos posteriores no se incluyen en la mesa. En algunos casos, las pruebas no incluyeron elementos de interés, por lo que los conjuntos de datos no están completos.
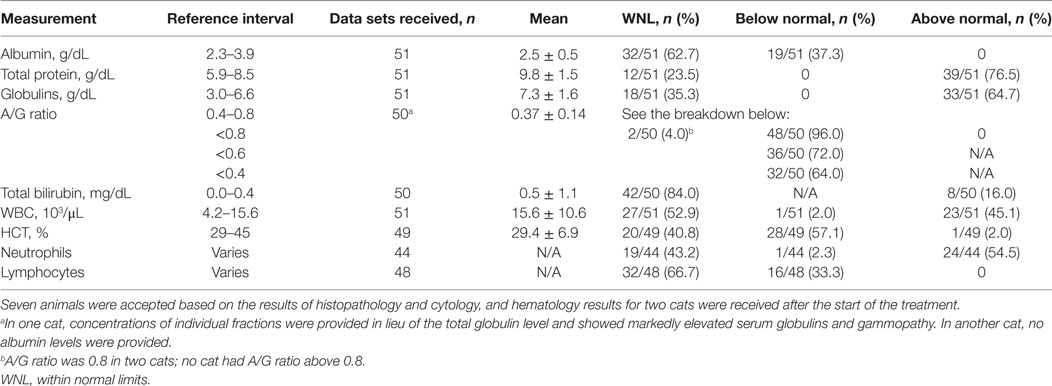 TABLA 4. RESULTADOS DE LAS PRUEBAS DE HEMATOLOGÍA EN LA PRIMERA PRESENTACIÓN CONSIDERADA EN EL DIAGNÓSTICO DE PERITONITIS INFECCIOSA FELINA.
TABLA 4. RESULTADOS DE LAS PRUEBAS DE HEMATOLOGÍA EN LA PRIMERA PRESENTACIÓN CONSIDERADA EN EL DIAGNÓSTICO DE PERITONITIS INFECCIOSA FELINA.
Se observó ictericia en un gato, mientras que se observó hiperbilirrubinemia en gatos 8/50. Se observó anemia (HCT < 29 %) en 28 de los 49 gatos. Se observó un aumento de los recuentos de glóbulos blancos en 20/50, neutropenia en 24/44 y linfopenia en 16/48 gatos.
Se observó hiperglobulinemia y/o una relación de albúmina/globulina (A/G) ≤0.6 en 48 de los 50 (96%) gatos; dos gatos tenían una relación A/G igual a 0,8. La media y la SD del valor en todo el grupo fueron de 0,37 ± 0,14, y el diferencial se muestra en la Tabla 4.
Los títulos de anticuerpos se probaron por IFA en 49 gatos y, en la escala propuesta por Addie et al. (17), se clasificaron de alto positivo (400–1.280; n = 13) a muy positivo (>1,280, n = 36); 10 de los 49 tenían títulos > 12.800. En los dos gatos con bajos títulos positivos (100), el diagnóstico se confirmó mediante la inmunotenstingación de lesiones biopsiadas para el antígeno FCoV. El ELISA 7b se usó en tres gatos. La prueba PCR 3c se realizó en tres gatos y mostró resultados negativos en dos; estos dos gatos fueron probados de la prueba por IFA con resultados positivos y también tuvieron el diagnóstico por citología.
Recopilamos conjuntos de datos sobre pruebas diferenciales en 50 gatos; las pruebas incluyeron antígeno FeLV (45), virus de la inmunodeficiencia felina (VIV) (45) y toxoplasma (18). Excepto en un gato que fue positivo en FIV, todos los demás resultados de las pruebas fueron negativos. No había datos serológicos disponibles para 10 gatos. En el grupo con un diagnóstico probable con cuatro conjuntos de datos que faltaban, un gato fue diagnosticado por un neurólogo en función de los resultados de la punción lumbar y la resonancia magnética, y otro tenía uveítis como un gatito Maine Coon de 3,3 libras y 7 meses. En el grupo con el diagnóstico confirmado por métodos histológicos, citológicos e inmunoquímicos, de los seis gatos sin conjuntos de datos diferenciales, cuatro fueron diagnosticados por IHC y dos por histología en los tejidos biopsiados.
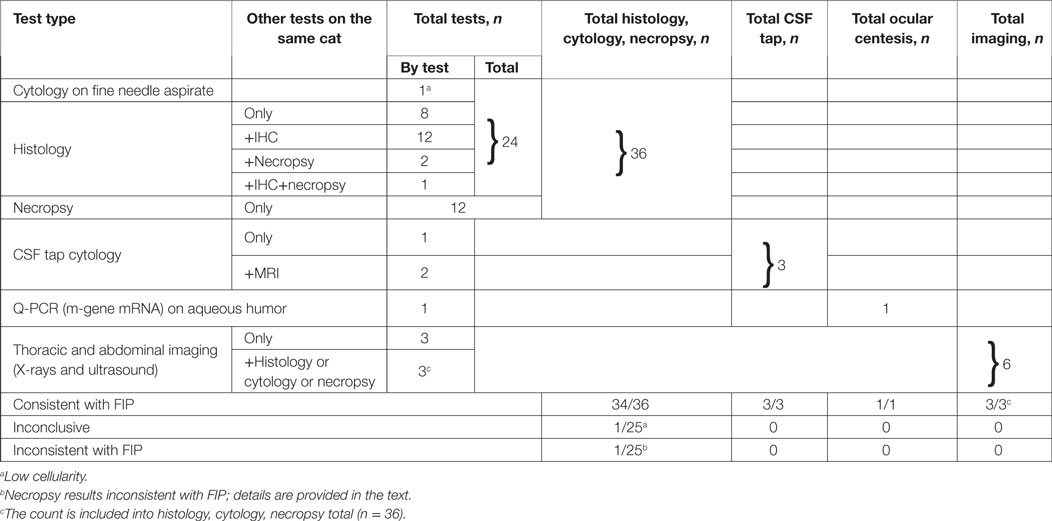
Pruebas de laboratorio especializadas
Los métodos especializados de pruebas de laboratorio utilizados para confirmar el diagnóstico seco de FIP se resumen en la Tabla 5. La histología y la citología se realizaron en 36 gatos y fueron concluyentes en 34, se validaron aún más mediante la inmunotenstaining para el antígeno FCoV en 13/36 gatos. Un gato con linfadenopatía mesentérica yogranulomatosa en el aspiración linfático también tenía transcripciones elevadas de FCoV en la prueba RT-PCR en la misma muestra.
Tres gatos con enfermedad neurológica tuvieron el diagnóstico confirmado por el grifo del LCR, y dos de ellos tuvieron resultados de resonancia magnética consistentes con el diagnóstico de FIP. Para un gato con centesis ocular de forma ocular seguida de PCR cuantitativa, se confirmó la presencia de altos títulos de ARNm subgenómico FCoV del gen M.
Se realizó una necropsia de 15/60 gatos. En el 15/3, la necropsia se realizó en gatos cuyo diagnóstico fue confirmado previamente ante mortem por histología o citología. El análisis histopatológico de los tejidos necropsiados fue concluyente para FIP para 14/15 gatos y no concluyente para el sobreviviente de 965 días.
Tratamientos simultáneos utilizados en el estudio
De los 60 gatos aceptados en el estudio de campo, 13 recibieron IP como el único tratamiento; los otros 45 gatos recibieron tratamientos antes de la inscripción y/o simultáneamente con el IP, incluidos uno o más estimulantes del apetito, antieméticos, antibióticos, corticosteroides, vitaminas y/o dietas especiales. No había datos sobre tratamientos simultáneos para dos gatos.
El sesenta y dos por ciento de los gatos (36/60) recibieron corticosteroides por vía oral en el momento del diagnóstico inicial (27/36), por vía tópica (ocular, 7/36), o ambos (2/36). En 4/36 gatos; el tratamiento con corticosteroides se intensó antes o poco después de comenzar el tratamiento con PI. Las estadísticas sobre el uso de corticosteroides se presentan en la Tabla 6. Durante el estudio, 31 gatos recibieron corticosteroides simultáneamente con IP (7 tópicos oculares y 25 sistémicos o sistémicos con tópico ocular), y 27 gatos fueron tratados con PI sin corticosteroides simultáneos.
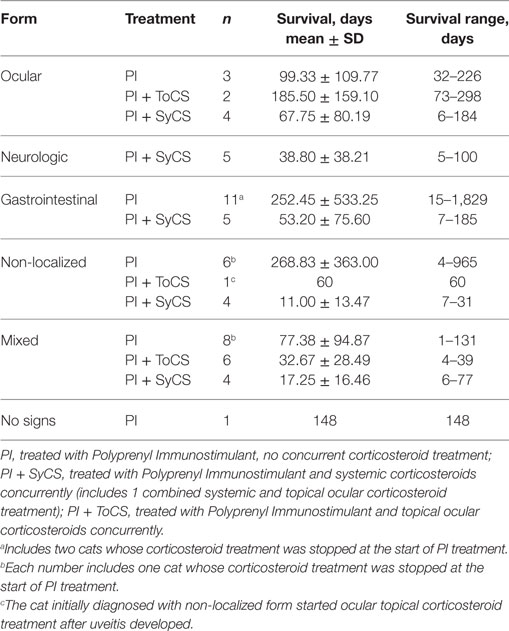 TABLA 6. TIEMPO DE SUPERVIVENCIA POR LA SUBFORMA DE LA ENFERMEDAD. NO SE OBSERVARON DIFERENCIAS ESTADÍSTICAMENTE SIGNIFICATIVAS ENTRE NINGÚN GRUPO.
TABLA 6. TIEMPO DE SUPERVIVENCIA POR LA SUBFORMA DE LA ENFERMEDAD. NO SE OBSERVARON DIFERENCIAS ESTADÍSTICAMENTE SIGNIFICATIVAS ENTRE NINGÚN GRUPO.
Los cuatro gatos cuyo tratamiento con corticosteroides se detuvo de acuerdo con el protocolo de prueba solicitado antes o al inicio del tratamiento de PI tenían signos clínicos consistentes con FIP: pérdida de peso (4/4), ataxia (1/4), masas abdominales (3/4), pirexia (2/4), letargo (2/4), anorexia (2/4) con el número de signos clínicos de 2 a 5. Sus pruebas de laboratorio también apoyaron el diagnóstico.
Dos veterinarios comenzaron el tratamiento con corticosteroides cuando los gatos se deterioraron, uno a las 9 y otro 24 días antes de la muerte; estos casos fueron cuidados al final de la vida y no se contaron como receptores de corticosteroides. Un gato recibió una dosis de nelfinavir el día antes de morir por su dueño veterinario.
Duración de la supervivencia después del diagnóstico y el progreso clínico
La duración de la supervivencia se determinó como el tiempo desde el inicio del tratamiento de PI hasta la muerte o la eutanasia. De los 60 gatos tratados con PI, 16 sobrevivieron durante más de 100 días, 8 gatos sobrevivieron durante más de 200 días, 4 gatos sobrevivieron durante más de 300 días (un gato adicional sobrevivió durante 298 días y no se cuenta aquí), 2 durante más de 900 días y 1 gato durante 1.829 días.
Los tiempos de supervivencia de los gatos en los tres grupos, es decir, (1) tratados con corticosteroides orales simultáneamente con IP, (2) tratados con corticosteroides oculares tópicos simultáneamente con IP; y (3) tratados con IP sin uso simultáneo de corticosteroides fueron significativamente diferentes entre sí (p = 0,03, prueba de Kruskal-Wallis). La tabla 7 enumera todos los datos estadísticos, y las curvas de supervivencia se presentan en la Figura 4. Para los gatos que no recibieron corticosteroides, la mediana de tiempo de supervivencia fue de 73,5 días (n = 27). Para los gatos que recibieron corticosteroides por cualquier vía simultánea con el PI, el tiempo medio de supervivencia fue de 21,5 días (n = 31). La diferencia en los tiempos de supervivencia entre los grupos (receptor de corticosteroides frente a no receptor) fue significativa (p = 0,003, prueba U de Mann-Whitney). No hubo diferencia significativa en los tiempos de supervivencia de los gatos tratados con corticosteroides sistémica o tópicamente (p = 0,57, prueba U de Mann-Whitney). Los cuatro gatos cuyo tratamiento inicial con corticosteroides se detuvo antes del tratamiento con IP sobrevivieron durante 79, 91, 279 y 1.829 días. No se disponía de datos sobre tratamientos simultáneos para dos gatos diagnosticados por histología (1) e histología con IHC (1).
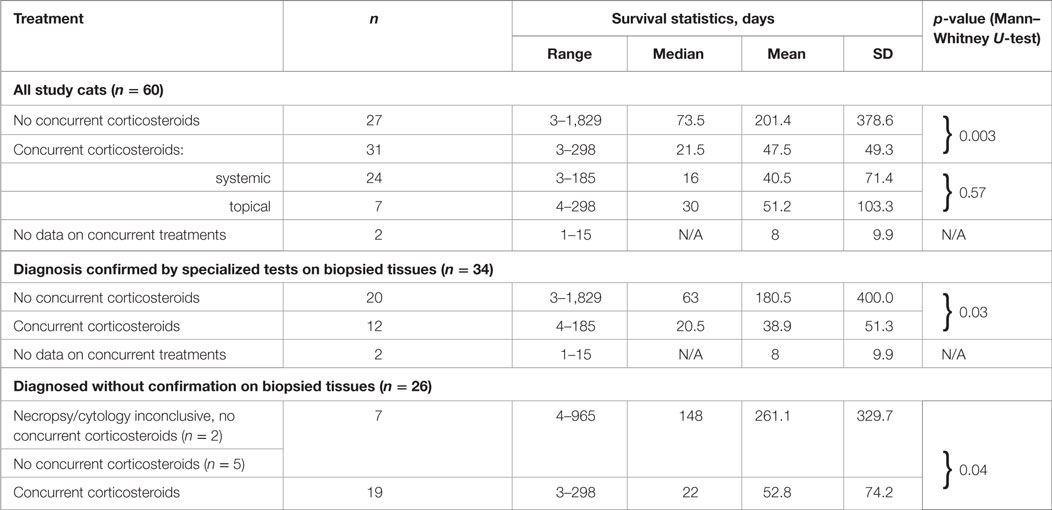 TABLA 7. SUPERVIVENCIA DE GATOS TRATADOS CON O SIN CORTICOSTEROIDES SIMULTÁNEAMENTE CON EL INMUNOSTIMULANTE DE POLIPRENIL POR EL MÉTODO DE DIAGNÓSTICO.
TABLA 7. SUPERVIVENCIA DE GATOS TRATADOS CON O SIN CORTICOSTEROIDES SIMULTÁNEAMENTE CON EL INMUNOSTIMULANTE DE POLIPRENIL POR EL MÉTODO DE DIAGNÓSTICO.
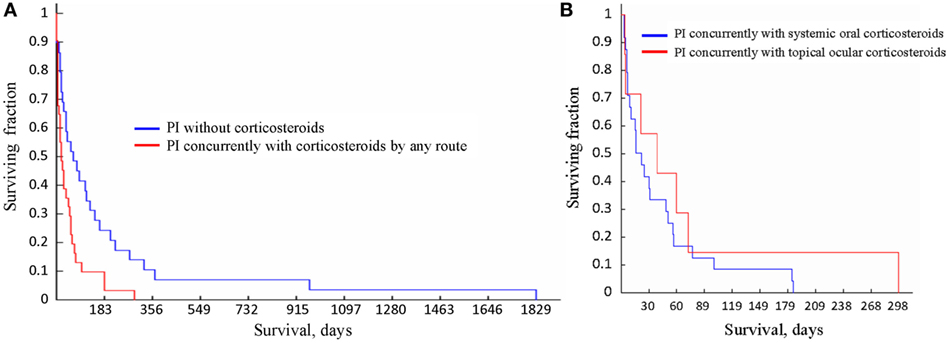 FIGURA 4. CURVAS DE SUPERVIVENCIA PARA LOS GATOS QUE RECIBEN DIFERENTES TRATAMIENTOS. (A) La supervivencia de los gatos tratados con inmunoestimulante de poliprenilo (PI) sin corticosteroides concurrentes (azul) fue significativamente más larga (p = 0,003, prueba U de Mann-Whitney) que de los gatos tratados con PI con corticosteroides administrado simultáneamente por cualquier vía (rojo).( B) La supervivencia de los gatos tratados con IP con la administración concurrente de corticosteroides tópica (roja) u oralmente (azul) no difirió significativamente (p = 0,57, prueba U de Mann-Whitney).
FIGURA 4. CURVAS DE SUPERVIVENCIA PARA LOS GATOS QUE RECIBEN DIFERENTES TRATAMIENTOS. (A) La supervivencia de los gatos tratados con inmunoestimulante de poliprenilo (PI) sin corticosteroides concurrentes (azul) fue significativamente más larga (p = 0,003, prueba U de Mann-Whitney) que de los gatos tratados con PI con corticosteroides administrado simultáneamente por cualquier vía (rojo).( B) La supervivencia de los gatos tratados con IP con la administración concurrente de corticosteroides tópica (roja) u oralmente (azul) no difirió significativamente (p = 0,57, prueba U de Mann-Whitney).
Para los gatos que recibieron IP solos y cuyo diagnóstico no fue confirmado por citología, los tiempos de supervivencia histología (ante-o post-mortem) fueron de 26,1 ± 329,7 días (4-965 días, mediana 148 días, n = 7); los gatos que fueron tratados con PI y corticosteroides simultáneamente con PI sobrevivieron 52,8 ± La diferencia en la supervivencia entre los gatos tratados o no tratados con corticosteroides simultáneamente con IP fue significativa (p = 0,03).
Los gatos cuyo diagnóstico fue confirmado por cualquier tipo de análisis de muestras biopsiadas o necropsiadas y tratados con PI sin corticosteroides concurrentes sobrevivieron 180,5 ± 400,0 días (3-1.829 días, mediana 63 días, n = 20); los gatos tratados con PI y corticosteroides sobrevivieron simultáneamente 38,9 ± 51,3 días (4-185 días, Dos gatos con resultados no concluyentes de citología (1) y necropsia (1) fueron contabilizados como no confirmados por esos métodos. La diferencia en la supervivencia entre los gatos tratados o no tratados con corticosteroides al mismo tiempo que la PI fue significativa (p = 0,04). Un subgrupo en el que el diagnóstico también fue confirmado por IHC incluyó ocho gatos tratados solo con IP (sobrevivieron de 8 a 12829 días) y cuatro gatos tratados con PI simultáneamente con corticosteroides (sobrevivió de 7 a 185 días). No había datos de tratamiento simultáneo disponibles para un gato que sobrevivió un día. El tamaño de esos subgrupos era insuficiente para dar poder estadístico al análisis.
No hubo diferencia significativa en los tiempos de supervivencia entre los grupos tratados solo con IP y diagnosticados sin pruebas basadas en biopsia (n = 20) en comparación con los diagnosticados con pruebas basadas en biopsia (n = 7; p = 0,27, prueba U de Mann-Whitney). Del mismo modo, no hubo diferencia en los tiempos de supervivencia entre los grupos tratados con corticosteroides simultáneamente con IP, que fueron diagnosticados con biopsias tisulares (n = 12) o sin ella (n = 19; p = 0,93 Prueba U de Mann-Whitney).
No se encontró ninguna diferencia significativa entre los tiempos de supervivencia de los gatos que recibieron corticosteroides oculares orales (n = 24) o tópicos (n = 7, p = 0,57, prueba U de Mann-Whitney); y los tiempos medios de supervivencia fueron de 16 y 30 días, respectivamente. No se observaron diferencias significativas entre los tiempos de supervivencia de los gatos con diferentes subformas de la enfermedad, independientemente del uso de esteroides (Tabla 6). Los tiempos de supervivencia de los gatos pertenecientes a grupos de edad menores de 6 años, 7-12, 13-24 meses y más de 25 meses no difieren significativamente (p = 0,90, prueba de Kruskal-Wallis).
Después del inicio del tratamiento, la forma no efusiva progresó a efusiva en seis gatos (10%), y cinco de ellos murieron o fueron sacrificados en 2 semanas posteriores. Un gato (#31) cuyo tratamiento inicial con corticosteroides se detuvo al comienzo del ensayo de PI desarrolló masas abdominales palpables y derrame después de 3 meses de tratamiento, que se resolvió en la siguiente visita mensual. Después de 6 meses de tratamiento, se palpó una pequeña masa y se identificó una pequeña cantidad de líquido en el abdomen craneal medio según los registros del veterinario. La masa se mantuvo sin cambios durante las siguientes dos visitas mensuales, y el gato desarrolló un vientre distendido con líquido palpable para el octavo mes del tratamiento de PI. La cantidad de líquido disminuyó para la siguiente comprobación mensual. Entre 1 y 8 meses del tratamiento, el gato estaba clínicamente bien, había aumentado de peso, había vuelto a las rutinas normales, jugaba y tenía apetito. El gato comenzó a disminuir en el noveno mes del tratamiento de PI, perdió peso y hubo un aumento de la cantidad de líquido abdominal, y el gato murió naturalmente después de 279 días desde el inicio del tratamiento.
Tres de los 17 gatos con enfermedad ocular sobrevivieron durante más de 180 días. Sus signos iniciales incluían uveítis anterior (3), precipitado cerácico (1), decoloración (1), anisocorquia (1). En dos de esos gatos, la uveítis anterior mejoró significativamente o se resolvió después de 2 meses de tratamiento de PI sin corticosteroides. La uveítis no mejoró en el gato que estaba recibiendo corticosteroides oculares tópicos al mismo tiempo que la PI, y los ojos estaban enucleados.
En los 13/22 gatos con masas abdominales palpables que sobrevivieron más de 30 días (vida útil de 57 a 12829 días), la reducción o resolución de las masas abdominales se observó en 6/13 durante el primer o segundo examen de seguimiento mensual, tres de los seis gatos recibieron corticosteroides junto con PI. Uno de los seis gatos (n.o 31, descrito anteriormente), cuyos signos neurológicos iniciales se resolvieron y las masas palpables ya no se notificaron después de 1 mes del tratamiento, ree desarrolló una pequeña masa abdominal palpable y líquido abdominal a los 6 meses del tratamiento y 3 meses antes de su muerte natural a los 279 días; el tratamiento con corticosteroides de este gato En otro gato que no recibió corticosteroides, las masas fueron inicialmente resectadas y no reaparecieron hasta 1 mes antes de la eutanasia a los 374 días. Las masas se mantuvieron sin cambios en la palpación en 4/13 gatos; los cuatro gatos no recibieron tratamiento con corticosteroides. Los hallazgos fueron confirmados por pruebas de ultrasonido en uno de esos cuatro, dos gatos murieron antes del examen de seguimiento y no se disponía de datos de seguimiento para un gato.
Cuatro gatos sobrevivieron más de 300 días y fueron considerados sobrevivientes a largo plazo. Sus registros fueron examinados con considerable detalle después de la muerte. El resumen de los datos de estos gatos se presenta en la Tabla 8 y la Figura 5.Los cuatro gatos fueron llevados inicialmente a sus veterinarios con signos típicos de FIP seco, incluyendo inapeta (3/4), letargo (3/4) y pérdida de peso (4/4). Un gato tenía diarrea y vómitos persistentes; en dos de los cuatro gatos, sus veterinarios detectaron masas abdominales. Las proporciones A/G para los cuatro gatos oscilaron entre 0,3 y 0,5. Tres de los cuatro gatos estaban anémicos, y todos tenían títulos moderados a altos de anticuerpos contra el coronavirus de 1:320 (K-ELISA), 1:800, 1:1.600 y 1:6.400 (los tres por IFA). En dos de los cuatro gatos, la histopatología de los tejidos biopsiados tenía inflamación pyogranulomatosa, y el diagnóstico fue validado por inmunotenstaining para el antígeno FCoV. El gato 105, el sobreviviente más largo (1.829 días), recibió inicialmente prednisolona para controlar la pérdida de peso, pero la terapia con corticosteroides se interrumpió al inicio del tratamiento con PI. Según los informes de los propietarios y veterinarios, los cuatro gatos volvieron a su comportamiento normal en la primera visita de revisión, aproximadamente 1 mes desde el inicio del tratamiento, y el peso se estabilizó o aumentó. Los signos clínicos de vómitos, diarrea, letargo, etc. también se resolvieron. Tres gatos perdieron peso antes de la muerte; los datos no estaban disponibles para uno. Las proporciones de A/G aumentaron después de 2 meses en el tratamiento de PI en los dos supervivientes más largos, y alcanzaron >0,8, y la anemia mejoró en uno y se resolvió en otro. La anemia límite, aunque mejoró un poco, estaba presente en los sobrevivientes de Cats 2 y 52 y se hizo más pronunciada antes de la muerte. El tratamiento se detuvo después de unos 700 días en Cat 78, y no hay datos de pruebas de laboratorio disponibles desde ese momento hasta su muerte a los 965 días cuando se realizó la necropsia. La frecuencia del tratamiento de PI se redujo primero a dos veces por semana y luego a una vez a la semana en Cat 105. Todos los gatos fueron sacrificados en extremis. Las necropsias en el Cat 2 mostraron lesiones consistentes con la FIP. La necropsia en Cat 78 mostró nefritis intersticial linfoplasmacítica y cistitis cisica sin lesiones de FIP. La toxicosis, la azotemia y la isquemia probablemente asociadas con la insuficiencia renal llevaron a la eutanasia del gato 105. La ecografía no mostró masas en los órganos internos y los resultados fueron notables; no se realizó ninguna necropsia.
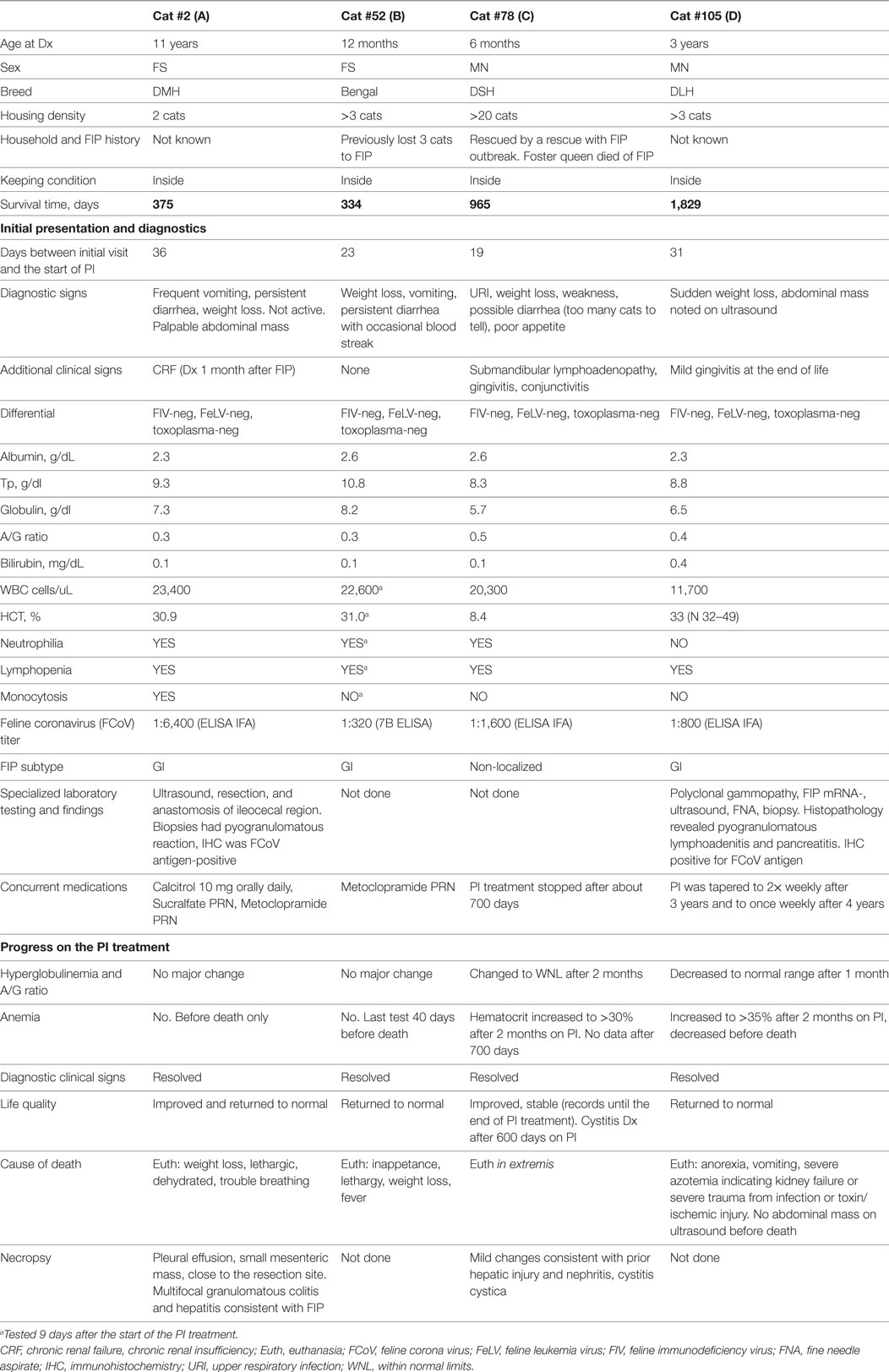 TABLA 8. RESÚMENES DE CASOS PARA LOS GATOS CON PERITONITIS INFECCIOSA FELINA (FIP) QUE SOBREVIVEN MÁS DE 300 DÍAS EN TRATAMIENTO CON INMUNOSTIMULANTES DE POLIPRENIL (PI).
TABLA 8. RESÚMENES DE CASOS PARA LOS GATOS CON PERITONITIS INFECCIOSA FELINA (FIP) QUE SOBREVIVEN MÁS DE 300 DÍAS EN TRATAMIENTO CON INMUNOSTIMULANTES DE POLIPRENIL (PI).
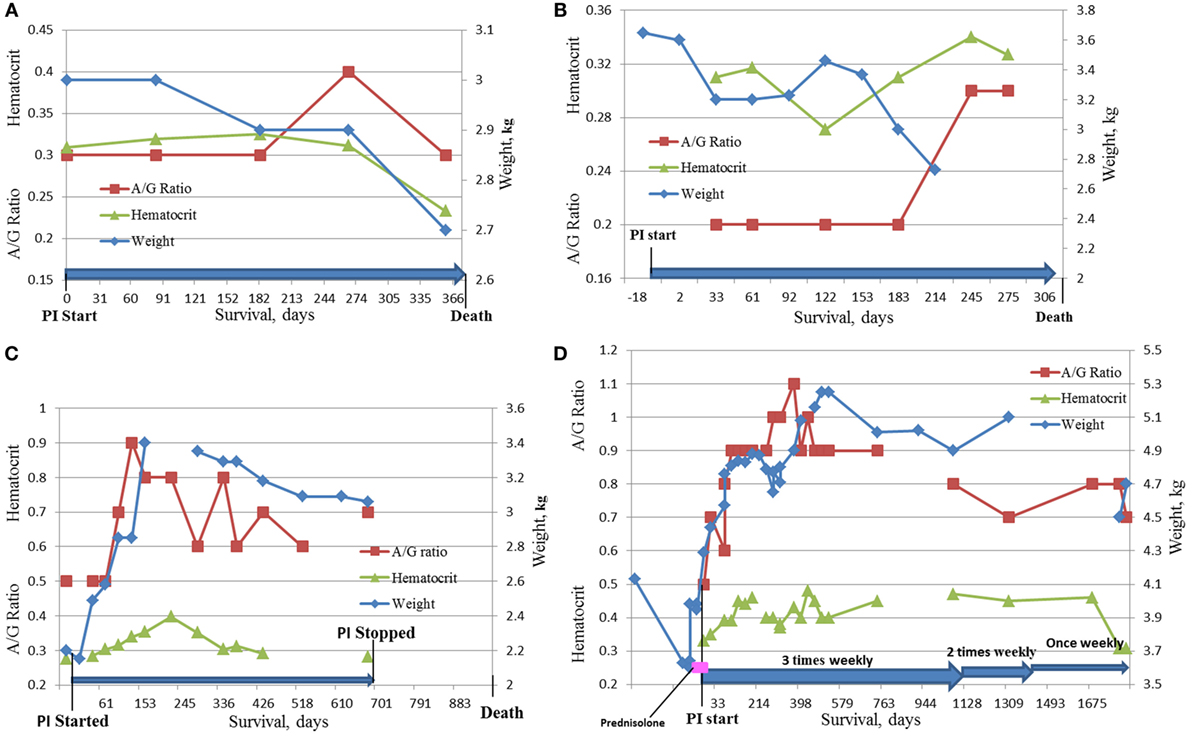 FIGURA 5. DINÁMICA DE LA HCT, LA RELACIÓN A/G Y EL PESO EN LOS CUATRO SUPERVIVIENTES MÁS LARGOS DEL ESTUDIO. (A) Gato #2, 375 días de supervivencia; (B) Gato # 52, 334 días de supervivencia; (C) Gato #78, 965 días de supervivencia; (D) Gato #105, 1.829 días de supervivencia.
FIGURA 5. DINÁMICA DE LA HCT, LA RELACIÓN A/G Y EL PESO EN LOS CUATRO SUPERVIVIENTES MÁS LARGOS DEL ESTUDIO. (A) Gato #2, 375 días de supervivencia; (B) Gato # 52, 334 días de supervivencia; (C) Gato #78, 965 días de supervivencia; (D) Gato #105, 1.829 días de supervivencia.
Varios veterinarios y propietarios proporcionaron voluntariamente información sobre la calidad de vida en las comunicaciones, y los veterinarios comentaron desde la primera revisión después de 30 días de tratamiento de PI utilizando el cuestionario. Los veterinarios registraron más comentarios relacionados con la calidad de vida en los registros médicos que se analizaron. Encontramos comentarios mejorados sobre la calidad de vida para 32 de los 34 gatos que sobrevivieron durante más de 30 días. Todos los comentarios para esos 32 gatos indicaron una mejora en la calidad de vida percibida («volver a la normalidad», «como antes de la enfermedad», «parece saludable», volvió a las rutinas normales y/o una mejora en el apetito, la movilidad, la socialización y la capacidad de respuesta) durante el período anterior, más comúnmente cada mes en el tratamiento. El peso se estabilizó o aumentó en 31/32 pacientes, mientras que 1/32 continuó perdiendo peso mientras mostraba una mejora en el comportamiento y el apetito.
Los veterinarios o propietarios no informaron de toxicidad ni eventos adversos debidos a la administración de PI.
Discusión
Informamos de que de los 60 gatos con presunto FIP no efusivo diagnosticados utilizando el algoritmo reconocido (2) y tratados con PI, 1 gato sobrevivieron durante 1.829 días, 2 gatos durante más de 900 días, 4 gatos sobrevivieron durante 300 días, 8 durante más de 200 días (uno de ellos sobrevivió 298 días) y 16 vivieron más de 100 días desde el inicio del Los 31 gatos que recibieron corticosteroides orales o que recibieron corticosteroides oculares tópicos al mismo tiempo que la PI sobrevivieron a una media de 47. 5 ± 49,3 días (3-298 días, media de 21,5 días), mientras que los 27 gatos tratados con IP sin corticosteroides sobrevivieron una media de 201,4 ± 378,6 días (3-1829 días, mediana de 73,5 días), que es significativamente más larga (Tabla 7; Figura 4A). Actualmente, la terapia más común para la FIP es el corticosteroide (2,4).
De los 35 gatos que comenzaron a tomar corticosteroides en el momento del diagnóstico, el tratamiento se intejó en 4 gatos antes del inicio de la PI, mientras que 31 continuaron con corticosteroides simultáneamente con IP. Los cuatro gatos cuyo tratamiento con corticosteroides se detuvo sobrevivieron una media de 569,50 ± 844,65 días (79–1.829 días, una mediana de 91 días). Estos cuatro gatos tenían múltiples signos de la enfermedad, y ninguno de los cuatro gatos en el momento del diagnóstico parecía menos afectado que los otros gatos de nuestro estudio.
En los subgrupos de FIP, hubo una diferencia en la probabilidad de uso de corticosteroides, con el 31 % (5/16) en la subforma gastrointestinal de FIP recibiendo corticosteroides al 100 % (5/5) en las subformas neurológicas que reciben corticosteroides. Tanto los corticosteroides tópicos como los oculares parecían reducir los tiempos de supervivencia cuando se administran simultáneamente con la PI (Figura 4B).
Aceptamos a todos los gatos que cumplían con los criterios de inclusión y no seleccionamos intencionalmente casos menos graves para el estudio. No se realizó ninguna evaluación de la gravedad de la enfermedad. Nuestra primera suposición fue que los corticosteroides se usaron en los casos más graves, pero no pudimos encontrar ninguna justificación para esa suposición. Pero el pequeño tamaño de la muestra no permite descartar que los tiempos de supervivencia más cortos de los gatos tratados simultáneamente con PI y corticosteroides puedan reflejar indirectamente la gravedad de la enfermedad.
No observamos diferencias estadísticamente significativas entre la supervivencia de los gatos, ya sea para las subformas de la enfermedad (ocular, neurológica, gastrointestinal, no localizada o mixta), o entre diferentes grupos de edad (≤6 meses, 7-12 meses, de 13 a 24 meses y más de 25 meses), lo que puede deberse a una varianza muy amplia en cada uno No teníamos un número suficiente de gatos en cada grupo para que el poder estadístico validara ninguna conclusión.
La literatura ofrece datos limitados sobre los tiempos de supervivencia de los gatos con forma seca de FIP con o sin tratamientos. Los gatos en la literatura con forma seca de FIP tratados con corticosteroides y cuidados de apoyo tenían un rango de supervivencia de 2.200 días (n = 51). Un estudio temprano (8) examinó los registros de campo para la manifestación intestinal granulomatosa (n = 26), e informó el tiempo de supervivencia en esta forma de FIP no eficaz como «hasta 9 meses» en un gato que se perdió en el seguimiento. Estudios de registro retrospectivos más cuidadosos informaron del tiempo de supervivencia de 7 a 45 días en gatos con diagnóstico confirmado histológicamente (8 efusivos, 5 no efusivos, sin datos separados proporcionados; 9), y 7-60 días (n = 4, 1 de 4 estaba en IFNα-rHU; 10). Los informes de estudios clínicos en infecciones naturales ponen la supervivencia con FIP seca a 38 días (n = 1; 11), 1–171 días (n = 11; 6), 6–33 días sin tratamiento (n = 4) y 4–42 días en gatos que previamente recibieron una vacuna FIP como preventiva (n = 4; 13).
La literatura menciona a un gato individual diagnosticado con la forma seca que sobrevivió durante 200 días con tratamiento con glucocorticoide y ω-interferón (6) y dos gatos sobrevivieron 181 y 477 días con forma seca/húmeda mixta tratada con glucocorticoide, α-interferón humano y nelfinavir (7). Una mención reciente (18) de un tiempo de supervivencia natural de más de un año sin tratamiento en gatos con forma seca de FIP se refería a gatos que fueron tratados con PI (15).
Los tiempos de supervivencia de este estudio se compararon con los datos publicados de gatos con forma seca de FIP. Los datos sugieren una alargación de los tiempos de supervivencia en gatos tratados con IP. Los tiempos de supervivencia igualaron o superaron los tiempos de supervivencia más largos reportados en la literatura para la FIP seca, con 8 de 60 gatos en nuestro estudio que superan el número máximo reportado de 200 días.
El diagnóstico de FIP seco en nuestro estudio de campo se realizó a diferentes niveles de certeza diagnóstica, y comparamos los tiempos de supervivencia en los subgrupos, diagnosticados o no, mediante pruebas histológicas, citológicas o de inmunomanencia e inmunonación y no encontramos diferencias estadísticamente significativas basadas en la prueba del diagnóstico, aunque hubo diferencias significativas entre los gatos tratados No hubo diferencia significativa en los tiempos de supervivencia de los gatos que no recibieron esteroides, independientemente de si fueron diagnosticados por algún método basado en biopsia o diagnosticados sin métodos invasivos. El tiempo de supervivencia fue el mismo independientemente del método de diagnóstico utilizado.
Una comparación de los valores medios y SD para los tiempos de supervivencia de los gatos con FIP seco mostró que el tiempo de supervivencia de los gatos en nuestro estudio fue significativamente más largo para el grupo tratado con PI sin tratamiento corticosteroides concurrente (201,4 ± 378,6 días, n = 27) que los 33,4 ± 48,8 días publicados (n = 11 El tiempo de supervivencia para el grupo tratado con corticosteroides simultáneamente con IP fue de 47,45 ± 49,26 días (n = 31), lo que no difiere significativamente (p = 0,59) del valor publicado (7). Los corticosteroides son el tratamiento habitual para los signos de FIP; sin embargo, deben usarse con precaución si se utiliza IP.
La peritonitis infecciosa felina se considera 100 % mortal, lo que, en nuestro plan de estudio, excluía por razones éticas un diseño experimental que utilizara un grupo de placebo no tratado. Para la comparación estadística de los datos, un grupo de placebo es ideal. Este estudio se basó en estudios en humanos que utilizan ensayos de un solo brazo de medicamentos contra el cáncer con la supervivencia como punto final. En esos estudios, no se utiliza ningún placebo o la mejor terapia aceptada debido a la falta de tratamiento beneficioso conocido y al pronóstico universalmente grave (19). Nuestro estudio fue un ensayo de campo que dependía de los veterinarios de atención primaria para identificar a los candidatos para el estudio y tratar a los aceptados de acuerdo con el protocolo. Por razones éticas y teniendo en cuenta la renuencia de los dueños de gatos a participar en un estudio controlado con placebo, elegimos el diseño del estudio presentado.
Nuestra decisión de excluir a los gatos con forma húmeda FIP se basó en la rápida progresión de la forma húmeda (mediana de 9 días; 5) que asumimos correctamente que era más rápido que el tiempo medio esperado necesario para la aceptación de un gato en el estudio (que resultó ser de 22,97 ± 21,60 días). Además, nuestros estudios limitados previos de PI en FIP efusivo no parecían prometedores, mientras que el tratamiento de la forma seca de FIP era alentador.
El diagnóstico de FIP seco se realizó en tres niveles de certeza: (1) altamente probable, diagnóstico respaldado por la historia, signos clínicos y hallazgos de laboratorio sin pruebas de laboratorio especializadas; esta categoría incluía formas neurológicas en las que no son posibles biopsias y formas oculares cuando se utilizó centesis ocular; (2) con confirmación histológica o citológica del diagnóstico con o sin inmunoten No hubo una diferencia estadísticamente significativa en la supervivencia entre los gatos diagnosticados a diferentes niveles de certeza y tratados solo con IP. No pudimos comparar los tiempos de supervivencia entre los subgrupos tratados con corticosteroides debido a la insuficiencia de potencia de la muestra.
Hacer un diagnóstico antemortem de FIP seco es notoriamente difícil en ausencia de una sola prueba estandarizada y se basa en la combinación de «indicadores de enfermedad» no específicos, especialmente si los propietarios no permiten procedimientos invasivos. Los datos de las pruebas en química clínica, hematología, serología, evaluación clínica, histología, etc. tienen diferentes valores predictivos y no son patognomónicos (2, 14, 18, 20). En ausencia de un enfoque de diagnóstico único y 100% confiable, todos los esfuerzos de diagnóstico tienen como objetivo aumentar el «índice de sospecha» como lo llamaron Díaz y Poma (21). Los requisitos para un «estándar de oro» varían entre los grupos de investigación, algunos aceptan histopatología y otros haciendo hincapié en el IHC (14, 20), mientras que el documento de consenso de Addie et al. (2) evita por completo la definición del «diagnóstico definitivo». En la práctica clínica, la mayoría de los diagnósticos se realizan mediante hallazgos de laboratorio consistentes con FIP y excluyendo otras enfermedades (3, 18).
Los veterinarios de atención primaria y los especialistas veterinarios que trataban a estos gatos se sintían cómodos con el diagnóstico de la forma seca FIP, pero estamos utilizando el término «presuntutivo FIP» porque el «norma de oro» del antígeno del coronavirus por IHC en lesiones consistentes con la forma seca FIP no se logró con todos los gatos. Los gatos de este estudio fueron diagnosticados por sus veterinarios en base a la evaluación de la combinación de señalización, signos clínicos y tantas pruebas como sea necesario para descartar otras enfermedades y apoyar el diagnóstico, basándose en la experiencia (18), en el modo documentado por Rohrbach et al. (22). El diagnóstico, realizado por el veterinario de atención primaria junto con especialistas según sea necesario, fue revisado por la LMA utilizando criterios consistentes con el algoritmo basado en la evidencia (2). Se realizaron pruebas especializadas como histología, citología, grifo de CSF, PCR en humor acuoso, IHC y necropsia en 36/60 gatos. Cuando se hace el presunto diagnóstico, los propietarios a menudo son reacios a obtener la confirmación a través de los procedimientos invasivos.
El diagnóstico de cada gato en el estudio se estableció individualmente, y también comparamos nuestros datos con los datos publicados para gatos con un diagnóstico confirmado de FIP (1, 7, 20, 23). La señalización y la densidad de la vivienda fueron similares a los datos reportados (23), siendo la mayoría de los gatos jóvenes, no pedigarios y originarios de hogares de varios gatos. La distribución por edad de los pacientes con FIP en nuestro estudio subrayó un sesgo de edad bien establecido para la FIP (12, 22). Las presentaciones clínicas observadas en nuestra muestra fueron similares a las reportadas para los gatos con forma seca de FIP (20, 23).
Las enfermedades que pueden ser clínicamente similares a la FIP fueron excluidas por pruebas específicas en la mayoría de los gatos. El antígeno del virus de la leucemia felina (FeLV) y el anticuerpo FIV se midieron en 50/60 gatos y uno de ellos fue positivo para los anticuerpos FIV. El diagnóstico FIP del único gato FIV positivo fue dado por un neurólogo basado en los resultados de la resonancia magnética y el grifo del LCR. Los anticuerpos contra el toxoplasma se midieron en 18 gatos y todos fueron negativos. Diez gatos no fueron probados para FeLV y FIV; seis tenían el diagnóstico confirmado por pruebas especializadas en los tejidos biopsiados (cuatro IHC y dos histología), y los otros cuatro tenían una serie de fuertes indicadores FIP y se consideraban presuntivos.
Analizamos los parámetros bioquímicos iniciales del valor de diagnóstico para FIP. En gatos jóvenes, con alta globulina sérica y bajas proporciones de A/G, hay pocas condiciones, excepto FIP, que son probables. Las neoplasias malignas de las células plasmáticas y los linfocitos B pueden producir una mmopatía monoclonal, pero estas afecciones son raras en gatos jóvenes. Las afecciones inflamatorias o infecciosas crónicas, como abscesos crónicos y el piotórax, podrían aumentar los niveles de globulina sérica, pero es probable que estas afecciones se identifiquen mediante una evaluación diagnóstica. Se observó hiperglobulinemia y/o una relación de albúmina/globulina (A/G) ≤0.6 en 48 de los 50 (96 %) gatos; dos gatos tenían una relación A/G igual a 0,8. En la evaluación inicial de los gatos en nuestro estudio, hubo hiperglobulinemia en el 64,7% de los gatos, que es similar al valor reportado en la literatura en el grupo combinado húmedo-seco (7). La relación albúmina/globulina ofrece el valor de predicción positiva más alto para FIP (20). En nuestro grupo fue de 0,37 ± 0,14, lo que es consistente con los valores reportados para FIP en general (20) y inferior a la media y SD reportada para la presentación inicial de Tsai et al. (7).
La hiperbilirrubinemia se produjo en el 16 % de los gatos, que es consistente con la forma seca de FIP y es menor que la reportada en los grupos con FIP húmeda (7, 23). La hiperglobulinemia es un signo de diagnóstico importante porque rara vez se asocia con enfermedades distintas de la FIP en los gatitos jóvenes, que es el grupo más afectado.
Se analizaron los parámetros hematológicos iniciales del valor de diagnóstico para FIP. La leucocitosis y la neutrofilia se encontraron en 45,1 y 54,5% de los gatos, respectivamente; ambos valores son consistentes con los publicados (23). La linfopaopenia estaba presente en el 33,3% de los gatos del estudio, en consonancia con estudios anteriores (23).
Los títulos de anticuerpos contra el coronavirus son algo útiles en el diagnóstico de FIP (2, 4, 17). Los títulos negativos de anticuerpos séricos hacen que el diagnóstico de FIP sea poco probable, mientras que los títulos altos y muy altos apoyan el diagnóstico. Sin embargo, los títulos de anticuerpos de rango medio a alto pueden ocurrir con la infección por coronavirus sin FIP. Todos los gatos probados aceptados en el estudio tenían títulos de anticuerpos contra el coronavirus con la mayoría de los gatos con títulos positivos muy altos (400–1.280;n = 13), muy altos (>1,280, n = 36) o extremadamente altos (>12.800, n = 10).
El único gato en el estudio sin signos de FIP fue diagnosticado por el veterinario después de un chequeo previo al neutro. La citología de seguimiento del aspiración de los ganglios linfáticos mesenteros no fue concluyente porque la celularidad era insuficiente para demostrar definitivamente una inflamación pyogranulomatosa, aunque no había evidencia de neoplasia u otros organismos infecciosos. El gato desarrolló derrame y murió después de 148 días de tratamiento con PI y corticosteroides al mismo tiempo.
Los cuatro gatos que sobrevivieron más de 300 días tuvieron signos clínicos y pruebas de diagnóstico consistentes con FIP en el examen inicial. El historial detallado y la información de diagnóstico se dan en la Tabla 8 y las Figuras 5A-D. Aunque los gatos 52 y 78 no tenían histopatología o IHC, su edad (12 y 6 meses), la exposición en múltiples gatos, los entornos de FCoV, los signos clínicos, los hallazgos de laboratorio y los altos títulos de anticuerpos FCoV fueron suficientes para establecer un diagnóstico clínico. Los gatos 2 y 105 tuvieron sus diagnósticos confirmados por histología y citología e IHC. Los cuatro mostraron una mejora clínica y volvieron a un comportamiento normal. Los gatos 2 y 52 solo tuvieron mejoras modestas en los hallazgos de laboratorio a pesar de las mejoras clínicas (Figuras 5A, B). La disminución clínica en esos dos gatos comenzó 2 semanas antes de su muerte y fue acompañada de pérdida de peso, anorexia, empeoramiento de la anemia, reaparición de masas abdominales en el sitio de la resección (Cat 2) y derrame pleural en el mismo gato. La reurbanización de la masa abdominal y la progresión de la enfermedad es común en los gatos donde las masas fueron resectadas (8).
Los dos supervivientes más largos, los gatos 78 y 105, tuvieron pérdida de peso en el momento del diagnóstico, pero ganaron peso mientras estaban en el tratamiento de PI. El aumento de peso en el gato 105 comenzó 1 semana antes del ensayo y se atribuyó a la prednisolona (5 mg diarios). El tratamiento con prednisolona se redujo y se detuvo durante la primera semana del tratamiento de PI y el gato continuó aumentando de peso. Las mejoras clínicas y el aumento de peso en ambos gatos fueron acompañados de mejoras en las proporciones A/G y los hematocritos (Figuras 5B,C). En ambos gatos, el tratamiento de PI se detuvo o su frecuencia disminuyó después de más de 2 años de supervivencia. El gato 105 murió de insuficiencia renal. Ambos gatos declinaron al final de su vida y fueron sacrificados en extremis. La falta de cambios pyogranulomatosos en los tejidos biopsiados en el gato 78 es consistente con la observación de que los gatos infectados experimentalmente con FIPV y que tenían enfermedad clínica y sobrevivieron estaban «libres de lesiones» post-mortem (14, 24). Los cambios en la necropsia de lafirrosis hepática leve y la nefritis intersticial linfoplasmacítica crónica leve no son adecuados para explicar la desaparición del gato. No había evidencia de lesiones de FIP. La relación A/G de 0,5 en el diagnóstico inicial se volvió a la normalidad, lo que sugiere la resolución de la FIP. No se realizó ninguna necropsia en el gato 105.
No utilizamos una evaluación formalizada de la calidad de vida. Recopilamos información sobre cambios clínicos y de comportamiento a partir de informes de progreso, comunicaciones y cartas veterinarias. Todos los informes y notas de progreso indicaron una mejor calidad de vida, volviendo al comportamiento normal previo al diagnóstico como se expresa en los comentarios tanto de los propietarios como de los veterinarios, por ejemplo, «Muy enérgico… haciéndolo bien», «actúa con normalidad», etc. En los registros médicos, se observó que los gatos tenían más energía, eran más juguetones, interactuaban más con los propietarios y, esencialmente, volvían a su comportamiento pre-FIP. En los 34 gatos que vivieron durante más de 30 días, la mejora clínica, es decir, una mejora en uno o más signos, como un aumento del apetito o una reducción de la fiebre, se observó anecdóticamente después de 10-14 días (cuatro a seis dosis de PI); 10/34 informaron de aumento de peso, 5/34 informaron de pérdida de peso, el peso se mantuvo En términos generales, los gatos tratados con PI volvieron a las rutinas regulares con «días malos» ocasionales hasta que un declive precipitado condujo a la muerte o la eutanasia en cuestión de días.
Nuestros resultados sugieren que la PI beneficia a los gatos diagnosticadas clínicamente con FIP seca al aumentar los tiempos de supervivencia y mejorar la calidad de vida, pero se necesitará un estudio controlado para verificar el beneficio de la PI en el tratamiento de la FIP. Si bien no es una cura, la PI puede mantener a los gatos FIP como una afección crónica en lugar de la enfermedad mortal que progresa rápidamente. Puede ser posible predecir y controlar la supervivencia mediante la normalización de la relación A/G y el hematocrito. Los tiempos de supervivencia con el tratamiento de PI son significativamente más largos cuando los corticosteroides no se utilizan simultáneamente.
Contribuciones del autor
AL: concepción y diseño de la obra, interpretación de los datos, revisión crítica del manuscrito para un contenido intelectual importante, aprobación final de la versión que se publicará. TK: adquisición posterior al estudio de los datos, análisis e interpretación de los datos para el trabajo, redacción del trabajo y revisión críticamente para contenido intelectual importante, aprobación final de la versión que se publicará. GG: adquisición de datos, entrada y organización, aprobación final de la versión que se publicará. VB: adquisición, entrada y organización de datos, revisión crítica de los datos y el manuscrito para un contenido intelectual importante, aprobación final de la versión que se publicará. RH: análisis e interpretación de datos, revisión crítica del manuscrito para un contenido intelectual importante, aprobación final de la versión que se publicará. Todos los autores acuerdan ser responsables de todos los aspectos del trabajo para garantizar que las preguntas relacionadas con la exactitud o integridad de cualquier parte del trabajo se investiguen y resuelvan adecuadamente.
Declaración de conflicto de intereses
AL, GG, VB y RH no tienen un interés financiero en Sass & Sass, Inc. TK es un empleado y una parte interesada menor en Sass & Sass, Inc. VB y RH fueron consultores de Sass & Sass. No se proporcionaron incentivos financieros a los propietarios y veterinarios que participaron en el estudio.
Agradecimientos
El trabajo se realizó en la Universidad de Tennessee en colaboración con los propios veterinarios de los dueños de gatos. Nuestro agradecimiento a los dueños de los gatos y a los veterinarios que participaron en el estudio.
Financiación
La subvención de la Fundación Winn Feline #10-038 a AL (14.825 dólares) apoyó un salario parcial para el apoyo técnico de GG. Sass & Sass, Inc. proporcionó Polyprenyl Immunostimulant y apoyo no monetario en la recopilación y el análisis de los datos. Los dueños de los gatos eran financieramente responsables de los costos de diagnóstico y monitoreo.
Referencias
1. Addie DD, Jarrett O. Un estudio sobre la infección natural por coronavirus felino en gatitos.Vet Rec (1992) 130:133–7. doi:10.1136/vr.130.7.133
2. Addie D, Belák S, Boucraut-Baralon C, Egberink H, Frymus T, Gruffydd-Jones T, et al. Peritonitis infecciosa felina. Directrices de ABCD sobre prevención y gestión. J Feline Med Surg (2009) 11:594–604. doi:10.1016/j.jfms.2009.05.008
Resumen de PubMed | Texto completo de CrossRef | Google Scholar
3. Pedersen NC. Una revisión de la infección por el virus de la peritonitis infecciosa felina: 1963-2008. J Feline Med Surg (2009) 11:225–58. doi:10.1016/j.jfms.2008.09.008
4. Addie DD. Infecciones felina por coronavirus. 4a edición. En: Greene CE, editor.Enfermedades infecciosas del perro y el gato. St. Louis: Elsevier Saunders (2012). p. 92-108.
5. Hartmann K, Ritz S. Tratamiento de gatos con peritonitis infecciosa felina. Vet Immunol Immunopathol (2008) 123:172–5. doi:10.1016/j.vetimm.2008.01.026
Resumen de PubMed | Texto completo de CrossRef | Google Scholar
6. Ritz S, Egberink H, Hartmann K. Efecto del interferón felino omega en el tiempo de supervivencia y la calidad de vida de los gatos con peritonitis infecciosa felina. J Vet Intern Med (2007) 21:1193–7. doi:10.1111/j.1939-1676.2007.tb01937.x
7. Tsai HY, Chueh LL, Lin CN, Su BL. Hallazgos clínico-patológicos y estadificación de la enfermedad de la peritonitis infecciosa felina: 51 casos de 2003 a 2009 en Taiwán. J Fel Med Surg (2011) 13:74-80. doi:10.1016/j.jfms.2010.09.014
8. Harvey CJ, Lopez JW, Hendrick MJ. Una manifestación intestinal poco común de peritonitis infecciosa felina: 26 casos (1986-1993). JAVMA (1996) 209:1117–20.
9. DeOliveira FN, Raffi MB, de Souza TM, de Barros CSL. Peritonita infecciosa felina: 13 casos.Ciencia Rural Santa Maria (2003) 5:905–11. doi:10.1590/S0103-84782003000500018
10. Zanutto MS, Hagiwara MK. Peritonite infecciosa em gatos – relato de caso. Vet Not (2007) 13:63–9. (en portugués).
11. Wang YT, Su BL, Hsieh LE, Chueh LL. Un brote de peritonitis infecciosa felina en un refugio taiwanés: evidencia epidemiológica y molecular de la transmisión horizontal de un nuevo coronavirus tipo II. Vet Res (2013) 44:57-66.
12. Ritz, S. (2007). Untersuchung des Einflusses von felinem Interferon-ω auf die Überlebenszeit von Katzen mit feliner infektiöser Peritonitis und der Aussagekraft prognostischer Parameter für die Überlebenszeit. Tesis de tesis doctoral. München, Alemania: Ludwig-Maximilians-Universität.
13. Leukert, W. (2002)1. Untersuchung der Wirksamkeit eines Impfstoffes gegen die Feline Infektiöse Peritonitis unter Tierheimbedingungen. Tesis de tesis doctoral. Giessen, Alemania: Justus-Liebig-Universität Gießen.
14. Kipar A, Meli ML. Peritonitis infecciosa felina: ¿sigues siendo un enigma? Vet Pathol (2014) 51:505–26. doi:10.1177/0300985814522077
Resumen de PubMed | Texto completo de CrossRef | Google Scholar
15. Legendre AM, Bartges JW. Efecto del inmunoestimulante de poliprenilo en los tiempos de supervivencia de tres gatos con la forma seca de peritonitis infecciosa felina. J Fel Med Surg (2009) 11:624–6. doi:10.1016/j.jfms.2008.12.002
Resumen de PubMed | Texto completo de CrossRef | Google Scholar
16. Kuritz T. Métodos y composiciones para la modulación de la inmunidad innata EE. UU. Solicitud de patente 20090306017. Washington, DC: EE. UU. Oficina de Patentes y Marcas (2008).
17. Addie DD, le Poder S, Burr P, Decaro N, Graham E, Hofmann-Lehmann R, et al. La utilidad de las pruebas de anticuerpos contra el coronavirus felino. J Fel Med Surg (2015) 17:152–62. doi:10.1177/1098612X14538873
18. Pedersen NC. Una actualización sobre la peritonitis infecciosa felina: virología e inmunopatogénesis.Vet J (2014) 201:123-32. doi:10.1016/j.tvjl.2014.04.017
Resumen de PubMed | Texto completo de CrossRef | Google Scholar
19. EE.UU. Departamento de Salud y Servicios Humanos, Administración de Alimentos y Medicamentos. Guía para la industria: Resultados finales de los ensayos clínicos para la aprobación de medicamentos contra el cáncer y productos biológicos. Rockville, MD: Centro de Evaluación e Investigación Biológica, Administración de Alimentos y Medicamentos (2007).
20. Hartmann K, Binder C, Hirshberger J, Cole D, Reinacher M, Schroo S, et al. Comparación de diferentes pruebas para diagnosticar la peritonitis infecciosa felina. J Vet Intern Med (2003) 17:781-90. doi:10.1111/j.1939-1676.2003.tb02515.x
Resumen de PubMed | Texto completo de CrossRef | Google Scholar
21. Díaz JV, Poma R. Diagnóstico y signos clínicos de peritonitis infecciosa felina en el sistema nervioso central. CVJ (2009) 50:1091–3.
22. Rohrbach BW, Legendre AM, Baldwin CA, Lein CA, Reed WM, Wilson RB. Epidemiología de la peritonitis infecciosa felina entre gatos examinados en hospitales de enseñanza médica veterinaria.JAVMA (2001) 218:1111-5. doi:10.2460/javma.2001.218.1111
Resumen de PubMed | Texto completo de CrossRef | Google Scholar
23. Riemer F, Kuehner KA, Ritz S, Sauter-Louis C, Hartmann K. Características clínicas y de laboratorio de gatos con peritonitis infecciosa felina: un estudio retrospectivo de 231 casos confirmados (2000-2010). J Fel Med Surg (2016) 18:348–56. doi:10.1177/1098612X15586209
Palabras clave: peritonitis infecciosa felina, inmunoestimulante de poliprenilo, aumento de la supervivencia, enfermedad crónica, coronavirus felino, estudio de campo
Cita: Legendre AM, Kuritz T, Galyon G, Baylor VM y Heidel RE (2017) Tratamiento inmunoestimulante de poliprenilo de gatos con peritonitis infecciosa felina presuntiva no efectiva en un estudio de campo. Delante. Veterinario. Ciencia. 4:7. doi: 10.3389/fvets.2017.00007
Recibido: 01 de noviembre de 2016; Aceptado: 17 de enero de 2017;
Publicado: 14 de febrero de 2017
Editado por:
Carl James Yeoman, Universidad Estatal de Montana, EE. UU.
Revisado por:
Alessia Giordano, Universidad de Milán, Italia
Stefano Comazzi, Universidad de Milán, Italia
Copyright: © 2017 Legendre, Kuritz, Galyon, Baylor y Heidel.
*Correspondencia: Alfred M. Legendre, alegendr@utk.edu
Descargo de responsabilidad: Todas las afirmaciones expresadas en este artículo son únicamente las de los autores y no representan necesariamente las de sus organizaciones afiliadas, o las del editor, los editores y los revisores. Cualquier producto que pueda ser evaluado en este artículo o reclamación que pueda ser hecha por su fabricante no está garantizado o respaldado por el editor.
Date de alta y recibe nuestro 👉🏼 Diario Digital AXÓN INFORMAVET ONE HEALTH
Date de alta y recibe nuestro 👉🏼 Boletín Digital de Foro Agro Ganadero
Noticias animales de compañía
Noticias animales de producción
Trabajos técnicos animales de producción
Trabajos técnicos animales de compañía


 Tanya Kuritz
Tanya Kuritz Vivian M. Baylor
Vivian M. Baylor