Tratamiento laparoscópico de derivaciones portosistémicas congénitas con medición de presión portal y angiografía portal
 Tratamiento laparoscópico de derivaciones portosistémicas congénitas con medición de presión portal y angiografía portal en 36 perros
Tratamiento laparoscópico de derivaciones portosistémicas congénitas con medición de presión portal y angiografía portal en 36 perros
 Jin Shigemoto1,2,3,4†
Jin Shigemoto1,2,3,4†  Yasuyuki Kaneko3†
Yasuyuki Kaneko3†  Mitsunobu Kawazu1,4
Mitsunobu Kawazu1,4  Kiyokazu Naganobu3
Kiyokazu Naganobu3  Shidow Torisu2,4*
Shidow Torisu2,4*- 1Clínica de mascotas Oji, Tokio, Japón
- 2Laboratorio de Cirugía de Animales de Compañía, Departamento de Ciencias Clínicas de Animales de Compañía, Facultad de Medicina Veterinaria, Universidad Rakuno Gakuen, Hokkaido, Japón
- 3Laboratorio del Hospital Docente de Medicina Veterinaria de la Universidad de Miyazaki, Miyazaki, Japón
- 4Equipo de Cirugía Mínimamente Invasiva Animal (Amist), Oji Pet Clinic (Centro Animal Mínimamente Invasivo), Tokio, Japón
Introducción: La cirugía laparoscópica se utiliza para las derivaciones portosistémicas extrahepáticas congénitas caninas (CEHPSS, por sus siglas en inglés). Sin embargo, los resultados de la cirugía laparoscópica que involucra la angiografía de la vena porta simultánea y la medición de la presión portal para atenuar u ocluir completamente el vaso de derivación en los caninos siguen sin estar claros. El objetivo de este estudio fue evaluar los resultados y las complicaciones de la oclusión laparoscópica de derivación portosistémica (LAPSSO) para el SPEHC.
Métodos: Entre junio de 2014 y marzo de 2021, se recogieron datos de los registros hospitalarios sobre perros sometidos a bandas de celofán (CB) y oclusión completa de derivaciones de puertos extrahepáticos congénitos tratadas por laparoscopia. Se incluyeron los casos en los que se realizó una oclusión completa por vía laparoscópica o se utilizó un CB para la oclusión gradual. Se incluyó un total de 36 perros (14 machos; mediana de edad de 32,5 meses [rango, 5-99] con una mediana de peso corporal de 4,2 kg [rango, 1,5-7,9]) que se sometieron a LAPSSO para CEHPSS. A todos los perros se les realizó una angiografía por tomografía computarizada (ATC) y se recogieron datos de análisis sanguíneos y radiológicos. La morfología de los vasos de derivación se clasificó mediante los hallazgos de la ATC. Se realizaron mediciones de presión portal y angiografía portal accediendo a venas mesentéricas y esplénicas en 30 y 6 casos, respectivamente.
Resultados: Los tipos de derivación más frecuentes fueron las derivaciones espleno-frénica 16/36 (44,4%), seguidas de las espleno-ácigos 9/36 (25,0%), espleno-cavas 4/36 (11,1%), gástrico-caval derecha 6/36 (16,6%) y gástrico-cava derecha con derivaciones de asa caudal 1/36 (2,7%). La mediana de la presión portal después de la oclusión completa fue de 11,5 mmHg (rango, 4–16); las presiones portales en los dos perros sometidos a atenuación CB fueron de 22 y 24 mmHg. La mediana del tiempo operatorio en los perros con posición recostada derecha (n = 25) e izquierda (n = 11) fue de 55 min (rango, 28-120) y 54 min (rango, 28-88), respectivamente. Un perro tenía neumotórax debido a una lesión en el diafragma. Otro perro desarrolló hipernatremia postoperatoria y sucumbió 5 h después del procedimiento. Sin embargo, ningún otro perro mostró signos de hipertensión portal dentro de las 72 h. Los análisis de sangre y las ecografías abdominales realizadas 1-2 meses después de la operación no revelaron derivaciones residuales.
Discusión: La LAPSSO, junto con la medición de la presión portal y la angiografía portal, demostró ser un enfoque seguro y eficaz que facilitó la oclusión exitosa de la CEHPSS. Se necesitan más estudios prospectivos a gran escala y análisis de las complicaciones perioperatorias.
Introducción
Las derivaciones portosistémicas congénitas caninas implican la derivación de la sangre portal hacia la vena cava caudal o la vena ácigos, lo que conduce a la circulación sistémica de sustancias como el amoníaco plasmático. Esto puede dar lugar a afecciones como encefalopatía hepática, cálculos urinarios, trastornos de la coagulación y retraso en el desarrollo (1-10). Las derivaciones portosistémicas congénitas se clasifican en derivaciones portosistémicas extrahepáticas y derivaciones portosistémicas intrahepáticas (3, 8, 9). La prevalencia de derivaciones portosistémicas extrahepáticas congénitas (CEHPSS, por sus siglas en inglés) es del 0,06 al 0,2% y es más común en perros pequeños de raza pura como Yorkshire Terriers, Malteses, Schnauzers miniatura y Cairn Terriers (7). La CEHPSS puede afectar negativamente a la calidad de vida de los animales, y las modalidades de tratamiento con bajos riesgos y complicaciones son limitadas, si procede.
La oclusión del vaso de derivación para restaurar el flujo sanguíneo fisiológico al hígado ha demostrado ser prometedora para mejorar la calidad de vida o incluso curar a los perros con CEHPSS. La laparotomía es el procedimiento quirúrgico estándar para la CEHPSS en perros, con el objetivo de ocluir completamente los vasos de derivación en el área de entrada que conduce a la circulación sistémica (1-5). Los principales tipos anatómicos de SPEHC incluyen las derivaciones espleno-cavales, espleno-ácigos, gástrico-cava derecha y ácigos gástricas derechas (6-10). La identificación de los vasos de derivación se logra haciendo una gran incisión en la línea media desde la apófisis xifoides hasta el margen anterior del hueso púbico y colocando tracción o presión sobre el tracto gastrointestinal (8-10). El vaso de derivación confirmado puede ocluirse completamente con un hilo quirúrgico u ocluirse parcialmente colocando una banda de celofán (CB) o un anillo ameroidal constrictor (ARC) (11-15). Cuando se realiza una oclusión completa, se mide la presión portal en la vena mesentérica para prevenir la hipertensión portal debido a los cambios rápidos en la presión portal. En consecuencia, la decisión de ocluir total o parcialmente el vaso de derivación se determina en función de la medición de la presión portal, los cambios en el color del páncreas y el tracto gastrointestinal, y el grado de movimiento peristáltico (1, 5). Además, se puede realizar una angiografía portal intraoperatoria para confirmar el vaso de derivación. Los avances recientes en el campo, como la difusión de la TC preoperatoria y las clasificaciones de los vasos de derivación, han eliminado la necesidad de realizar una angiografía portal para confirmar el vaso de derivación (1, 11-15). Por lo general, cuando se utiliza CB o ARC, se renuncia a la medición de la presión portal postoperatoria y a la venografía portal intraoperatoria, ya que la oclusión se produce gradualmente (5, 6, 11-15). Sin embargo, este abordaje ha dado lugar a complicaciones como la identificación errónea de los vasos de derivación, la recanalización postoperatoria y los vasos de derivación residuales (11-15).
Recientemente se han descrito varios abordajes de cirugía laparoscópica, que son menos invasivos, menos dolorosos y menos inflamatorios que los procedimientos abiertos, para perros (16-18). Sin embargo, hasta la fecha no hay informes de cirugía laparoscópica que combine la angiografía de la vena porta simultánea y la medición de la presión portal para la identificación de los vasos de derivación y la oclusión parcial o completa (19-24). El propósito de este estudio fue describir la técnica, los resultados y las complicaciones de la LAPSSO combinada con la medición de la presión portal y la angiografía portal, así como evaluar los resultados y las complicaciones.
Materiales y métodos
Criterios de inclusión
Se revisaron los registros médicos de los perros sometidos a LAPSSO para CEHPSS en la Clínica de Mascotas Oji desde junio de 2014 hasta marzo de 2021. Los criterios de inclusión fueron los casos con medición laparoscópica de la presión venosa portal, angiografía portal, oclusión completa con hilo quirúrgico y/o atenuada con CB. Todos los perros fueron clasificados según el tipo de derivación mediante angiografía por tomografía computarizada (ATC). El periodo de seguimiento fue de 1 a 2 meses. A partir de las historias clínicas, edad, peso, signos clínicos, tipo de derivación anatómica, método de oclusión, medición de la presión venosa portal y angiografía portal. Se incluyeron el tiempo operatorio, las complicaciones y los resultados clínicos. Todos los propietarios que se han sometido a LAPPSO dieron su consentimiento por escrito.
Evaluación diagnóstica
Los datos sobre el amoníaco en sangre y los ácidos biliares séricos totales antes y después de la prandial, así como los hemogramas, la química sanguínea, la radiografía abdominal y la ecografía abdominal (AUS), se recogieron en la clínica de referencia o en nuestra clínica. Sobre la base de estos resultados, se realizó una ATC en todos los perros con sospecha de SPEHC para caracterizar la morfología del vaso de derivación. El abordaje de la LAPSSO con medición de la presión portal y angiografía portal se planificó utilizando imágenes de ATC (5-10).
Anestesia
Midazolam (0,2 mg/kg IV o subcutáneo; Dormitorio; Astellas Pharma Inc., Tokio, Japón) y atropina (0,01 mg/kg IV o subcutánea; inyección de sulfato de atropina 0,5 mg; Nipro ES Pharma Co., Ltd., Osaka, Japón) se utilizaron para la premedicación. La anestesia fue inducida con propofol (6-10 mg/kg IV; propofol 1%; Intervet K.K., Tokio, Japón), mantenido con oxígeno al 100% e isoflurano (Isoflu; DS Pharma Animal Health Co., Ltd., Osaka, Japón) o sevoflurano (Sevofrane; Pfizer Japan Inc., Tokio, Japón), y se manejó con un monitor de anestesia.
Morfina epidural (0,01 mg/kg; inyección de clorhidrato de morfina 10 mg; Daiichi Sankyo Co., Ltd., Tokio, Japón) o remifentanilo intravenoso (0,3–0,7 μg/kg/min IV; Ultiva 2 mg; Janssen Pharmaceutical K.K., Tokio, Japón) se administró como analgésico a una velocidad de infusión continua. La presión arterial se midió directamente mediante la colocación de un implante en la arteria dorsal del pie después de la inducción anestésica. Dopamina (5 μg/kg/min IV; dopamina HCl 100 mg; Teva Takeda, Ltd., Nagoya, Japón) se administró a una velocidad de infusión continua, según fuera necesario, para mantener una presión arterial media ≥ 60 mmHg. Si la respiración espontánea no se detuvo, el rocuronio (0,5 mg/kg IV; Eslax 25 mg; MSD K.K., Tokio, Japón).
Procedimiento quirúrgico
Un telescopio laparoscópico de 5 mm y 30° (Hopkins II Telescope; Karl Stortz, Tuttlingen, Alemania) estaba conectado a una cámara de vídeo (Telecam SLII; Karl Stortz) y fuente de luz (Xenon Nova 300; Karl Stortz), con manipulaciones que se registran mientras se ajusta la intensidad de la luz. La posición del cuerpo se decidió de acuerdo con el sitio de aproximación determinado en base a los resultados de la CTA.
La posición lateral derecha se utilizó para los casos que carecían de vasos de derivación en el agujero epiploico, incluidas las derivaciones esplénico-férica (Figuras 1A, B) y esplénico-ácigos (Figuras 2A, B). Se colocaron cojines y toallas contra la espalda. La posición de la derivación se simuló de antemano mediante CTA, y el sitio de la cánula del puerto No. 1 (Kii Sleeve with Advanced Fixation, Applied Medical, Rancho Santa Margarita) se marcó con un marcador a base de aceite médico. Posteriormente, se insertó un puerto Nº 1 de 5 mm de diámetro en las direcciones craneal y media de la cara renal de la fosa paralumbar mediante la técnica abierta de Hasson, seguido del establecimiento de neumoperitoneo mediante CO2 a una presión neumoperitoneal de 8-10 mmHg. A continuación, se insertó la cámara en la cavidad abdominal a través del puerto n.º 1 y se utilizó para determinar la posición del puerto n.º 2, que estaba aproximadamente a 3 cm a la derecha y ligeramente craneal al puerto n.º 1 y se utilizó para insertar fórceps (pinzas de lágrima; Olympus, Hamburgo, Alemania) para pelar. Puerto n.º 3, utilizado para insertar fórceps (inserto de mandíbula plana para cirugía torácica; Olympus, Tokio, Japón) para la tracción en los órganos que rodean la derivación, se creó a la izquierda y cranealmente al puerto Nº 1, con una distancia de ≥3 cm. Finalmente, se colocaron tres puertos en la fosa paralumbar (Figuras 1D, 2D). El vaso de derivación se confirmó fácilmente comprimiendo el bazo y el estómago hacia la izquierda utilizando un retractor de sonda de palpación (Palpation Probe; Karl Storz; Figuras 1C y 2C). La derivación se separó cuidadosamente y luego se aseguró con un trozo de hilo de nailon trenzado 3-0 de 10 cm. Se utilizó la vena mesentérica o esplénica para las mediciones de la presión portal y la angiografía portal. Para la vena mesentérica se realizó una pequeña incisión (2-3 cm), seguida de la colocación de un retractor endoscópico de silicona de un solo orificio (LAP PROTECTOR [LP]; Hakko, Nagano, Japón). Se extirpó parte del tracto gastrointestinal del cuerpo para medir la presión portal y realizar una angiografía portal en la vena mesentérica (Figura 3). Al realizar la angiografía portal transesplénica y las mediciones de la presión portal, se perforó la piel por vía subcutánea y se perforó el bazo dentro del cuerpo con una aguja permanente, seguida de la medición de la presión portal en el punto de reflujo sanguíneo mientras se confirmaba el sangrado con un endoscopio (Figura 4) (22-24). A continuación, se realizó la oclusión temporal colocando tracción sobre el hilo de nailon trenzado utilizado para asegurar el flujo sanguíneo en el vaso de derivación, seguido de la medición de la presión portal y la angiografía portal (Figuras 3, 4). El vaso de derivación se bloqueó temporalmente, seguido de una oclusión completa o atenuada de CB después de confirmar que no había una identificación errónea del vaso de derivación en la angiografía portal, así como en la medición de la presión portal y la determinación del tono de color del páncreas y el tracto intestinal. Si fue necesario, concurrente con cistotomía para cálculo vesical, se realizó la castración. Finalmente, se realizó una biopsia hepática. El animal fue revisado postoperatoriamente para detectar sangrado abdominal o deterioro en el color del tracto gastrointestinal, seguido de la extracción de los puertos y el cierre rutinario de la herida (Figuras 1D, 2D).
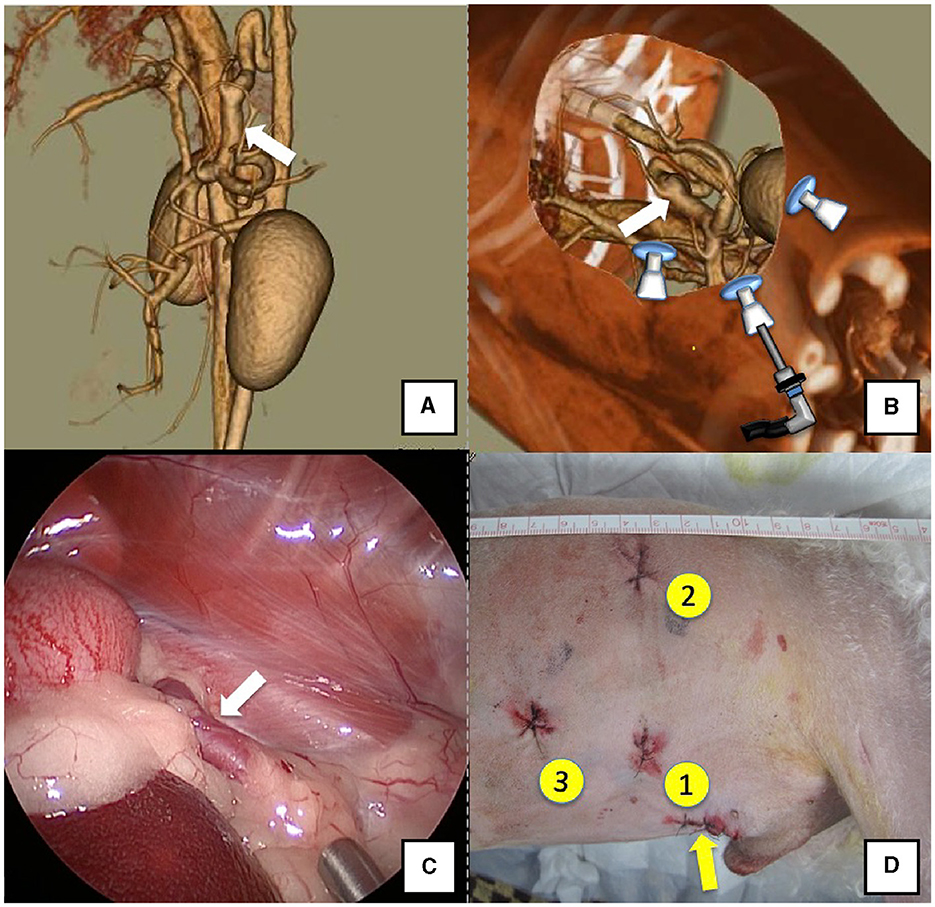
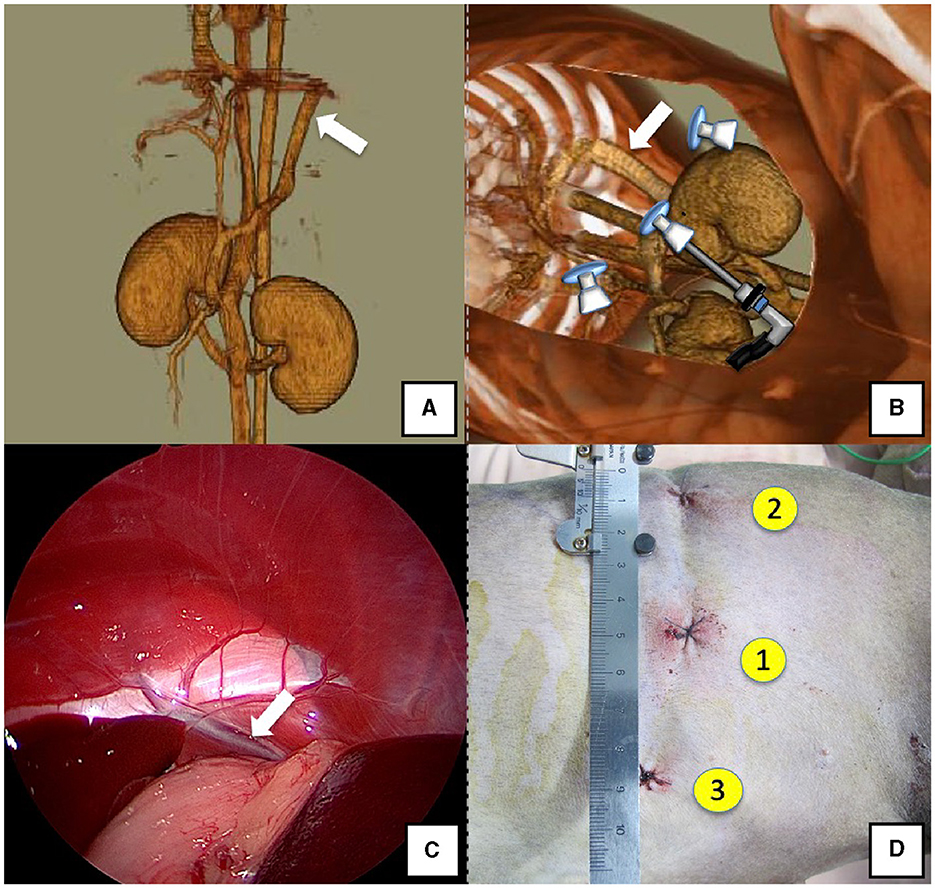 Figura 1. Derivación esplenofrénica (flecha blanca). (A) Imagen de angiografía 3D-CT. (B) Imagen 3D-CT de las ubicaciones de los puertos a partir de imágenes de TC reclinadas derechas reconstruidas. (C) Imagen laparoscópica del vaso de derivación y de la aproximación. (D) Heridas quirúrgicas reales y orden de colocación de puertos. Solo hay heridas quirúrgicas en tres puertos porque la vena esplénica se utilizó por vía percutánea. Tomografía computarizada 3D, tomografía computarizada tridimensional.
Figura 1. Derivación esplenofrénica (flecha blanca). (A) Imagen de angiografía 3D-CT. (B) Imagen 3D-CT de las ubicaciones de los puertos a partir de imágenes de TC reclinadas derechas reconstruidas. (C) Imagen laparoscópica del vaso de derivación y de la aproximación. (D) Heridas quirúrgicas reales y orden de colocación de puertos. Solo hay heridas quirúrgicas en tres puertos porque la vena esplénica se utilizó por vía percutánea. Tomografía computarizada 3D, tomografía computarizada tridimensional.
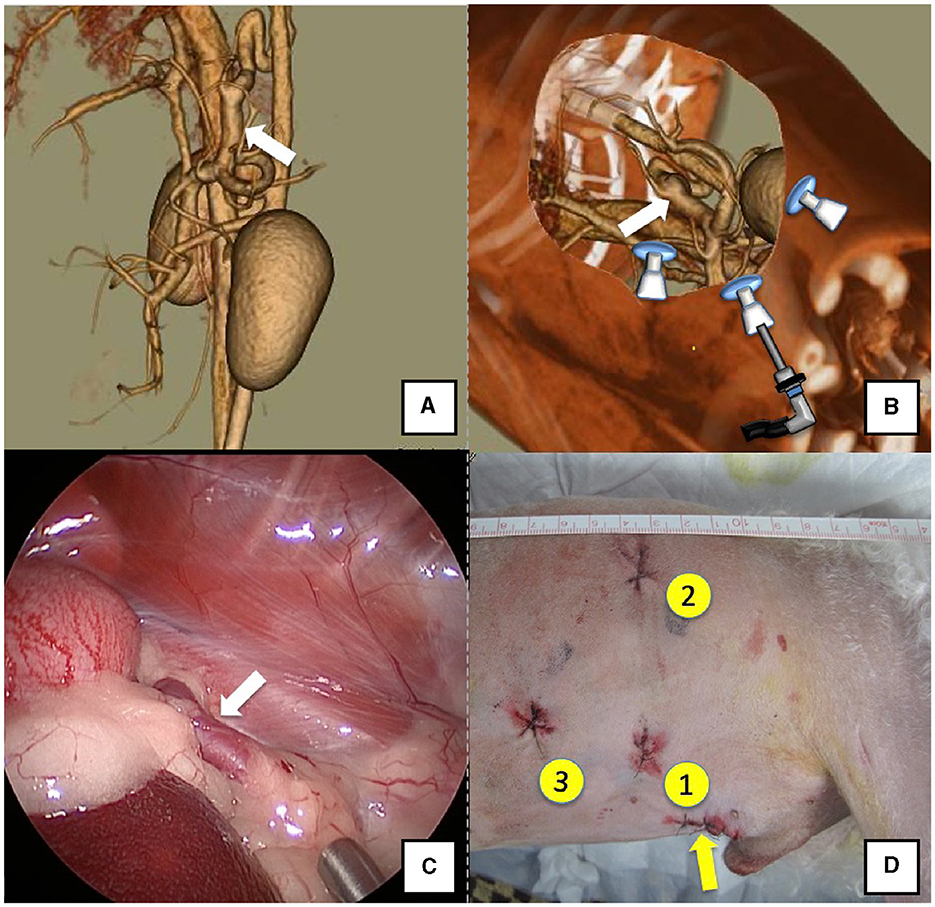 Figura 2. Derivación esplenoácigos (flecha blanca). (A) Imagen de angiografía 3D-CT. (B) Imagen 3D-CT de las ubicaciones de los puertos a partir de imágenes de TC reclinadas derechas reconstruidas. (C) Imagen laparoscópica del vaso de derivación y de la aproximación. (D) Heridas quirúrgicas reales y orden de colocación de puertos. Flecha amarilla: lugar donde se colocó el PROTECTOR DE REGAZO. Tomografía computarizada 3D, tomografía computarizada tridimensional.
Figura 2. Derivación esplenoácigos (flecha blanca). (A) Imagen de angiografía 3D-CT. (B) Imagen 3D-CT de las ubicaciones de los puertos a partir de imágenes de TC reclinadas derechas reconstruidas. (C) Imagen laparoscópica del vaso de derivación y de la aproximación. (D) Heridas quirúrgicas reales y orden de colocación de puertos. Flecha amarilla: lugar donde se colocó el PROTECTOR DE REGAZO. Tomografía computarizada 3D, tomografía computarizada tridimensional.
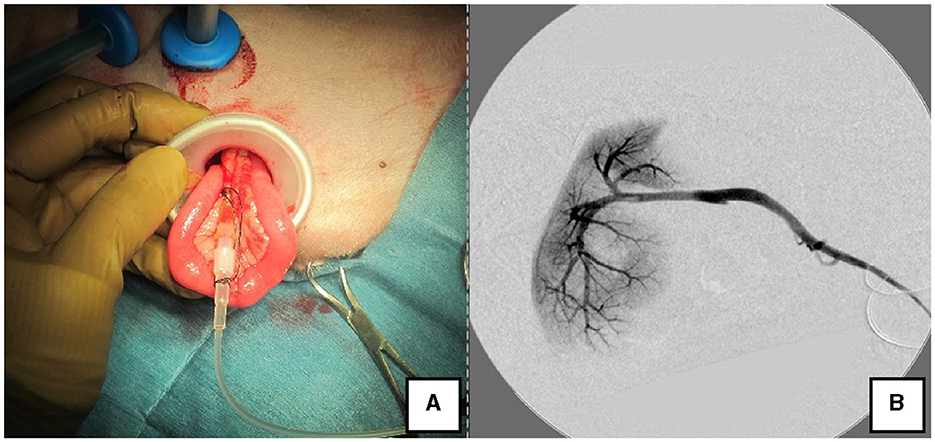 Figura 3. Angiografía portal y medición de la presión portal mediante LP. (A) El yeyuno se extrajo fuera del cuerpo usando el LP y se insertó una aguja permanente para medir la presión portal. (B) Angiografía de la vena porta durante la ligadura de derivación con un arco en C. LP, PROTECTOR DE REGAZO.
Figura 3. Angiografía portal y medición de la presión portal mediante LP. (A) El yeyuno se extrajo fuera del cuerpo usando el LP y se insertó una aguja permanente para medir la presión portal. (B) Angiografía de la vena porta durante la ligadura de derivación con un arco en C. LP, PROTECTOR DE REGAZO.
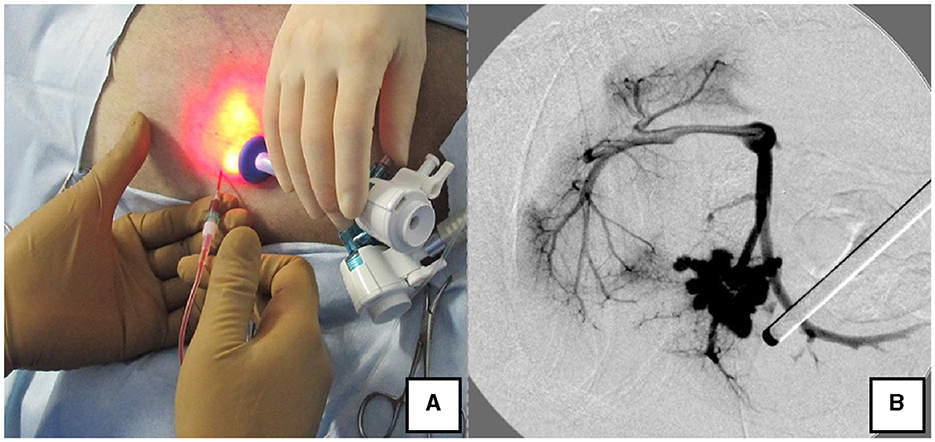 Figura 4. Medición de la presión portal y angiografía portal a través de la vena esplénica. (A) La presión portal se midió insertando percutáneamente una aguja permanente en el bazo mientras se confirmaba el bazo con el laparoscopio. (B) Angiografía portal durante la ligadura en derivación con un arco en C.
Figura 4. Medición de la presión portal y angiografía portal a través de la vena esplénica. (A) La presión portal se midió insertando percutáneamente una aguja permanente en el bazo mientras se confirmaba el bazo con el laparoscopio. (B) Angiografía portal durante la ligadura en derivación con un arco en C.
Los perros con derivaciones localizadas en el agujero epiploico, incluyendo derivaciones gástricas-cavales derechas, espleno-cavales y gástricas derechas con asa caudal, se colocaron en posición recostada lateral izquierda (Figuras 5A, B). Estas derivaciones se ocluyeron en el agujero epiploico en la entrada de la vena cava caudal; En consecuencia, el duodeno y el páncreas se movieron hacia la izquierda para lograr esto. Colocamos un cojín en la parte posterior durante la inmovilización o inclinamos la mesa de operaciones ≈10° hacia el cirujano para desplazar el tracto gastrointestinal hacia el lado ventral, lo que permitió la visualización del campo quirúrgico. El puerto n.º 1 se estableció utilizando la técnica abierta de Hasson para permitir la observación de la glándula suprarrenal derecha desde la fosa paralumbar derecha. La cámara se insertó en el puerto n.º 1 para observar el vaso de derivación después del establecimiento del neumoperitoneo utilizando una presión neumoperitoneal de 8-10 mmHg. A continuación, se creó el puerto n.º 2 ≥3 cm a la izquierda del puerto n.º 1 para observar la cavidad abdominal. Se insertó una sonda de palpación a la izquierda de la vena cava caudal desde el puerto Nº 2; además, el flujo sanguíneo de derivación hacia la vena cava caudal se confirmó levantando ligeramente la vena cava caudal hacia la derecha (Figura 5C). El puerto n.º 3 se creó ≥3 cm a la derecha del puerto n.º 1 para permitir el desprendimiento y la ligadura del buque de derivación. El recipiente de derivación se separó después de la instalación de estos tres puertos y se aseguró con un hilo de nailon trenzado 3-0 de 10 cm. Dada la dificultad para observar el bazo en decúbito recostado izquierdo, se realizó medición de la presión portal y venografía portal con un retractor LP. Después de asegurar el vaso de derivación, se realizó una incisión paramediana de 2,0 a 3,0 cm caudalmente al ombligo, se insertó un LP retractor y se sacó el yeyuno fuera de la cavidad abdominal. Como se mencionó anteriormente, se colocó una aguja permanente en la vena mesentérica para la medición de la presión portal, con detención temporal del neumoperitoneo, ya que afecta estas mediciones. A continuación, se ocluyó temporalmente el vaso de derivación previamente asegurado, seguido de mediciones repetidas de la presión portal y angiografía portal con el arco en C. Posteriormente, se retiró la aguja permanente de la vena mesentérica y se devolvió el tracto intestinal a la cavidad abdominal. Una cubierta especial (E-Z Access; Hakko) se colocó en el LP retractor. A continuación, se estableció de nuevo el neumoperitoneo, seguido de una oclusión completa o CB atenuada del vaso de derivación asegurado mediante pinzas de sutura (Needle Holder; Olimpo). Si fue necesario, concurrente con cistotomía para cálculo vesical, se realizó la castración. Finalmente, se comprobó la hemorragia intraabdominal y el color del tracto gastrointestinal. La cámara se retiró mientras se comprobaba si había hemorragia intraabdominal y daño orgánico, seguido de sutura de la herida (Figura 5D).
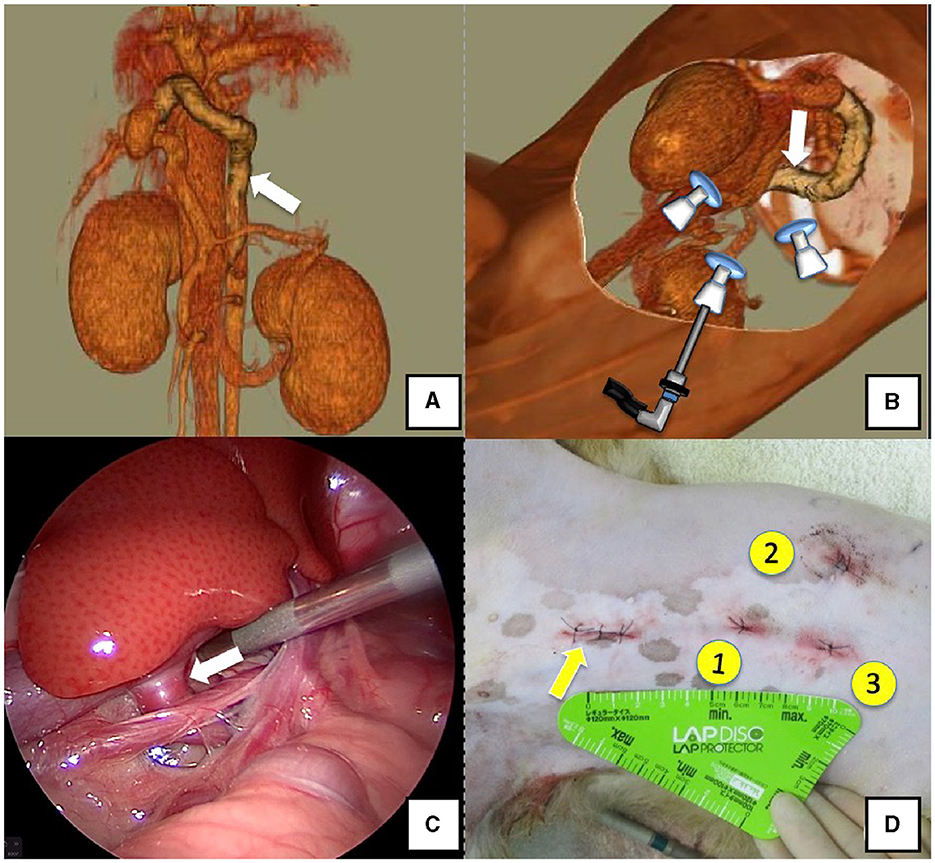 Figura 5. Derivación gástrico-cava derecha (flecha blanca). (A) Imagen de angiografía 3D-CT. (B) Imagen de TC 3D de las ubicaciones de los puertos a partir de imágenes de TC reconstruidas en decúbito reclinado izquierdo. (C) Vaso de derivación y aproximación vistos desde el laparoscopio. (D) Heridas quirúrgicas reales y orden de colocación de puertos. Flecha amarilla: lugar donde se colocó el PROTECTOR DE REGAZO. Tomografía computarizada 3D, tomografía computarizada tridimensional.
Figura 5. Derivación gástrico-cava derecha (flecha blanca). (A) Imagen de angiografía 3D-CT. (B) Imagen de TC 3D de las ubicaciones de los puertos a partir de imágenes de TC reconstruidas en decúbito reclinado izquierdo. (C) Vaso de derivación y aproximación vistos desde el laparoscopio. (D) Heridas quirúrgicas reales y orden de colocación de puertos. Flecha amarilla: lugar donde se colocó el PROTECTOR DE REGAZO. Tomografía computarizada 3D, tomografía computarizada tridimensional.
Cuidados postoperatorios
Después de la cirugía, los animales fueron colocados en cuidados intensivos durante 72 h para monitorear complicaciones postoperatorias como hipoglucemia, signos neurológicos post-atenuación (PANS) e hipertensión portal (25-27). Los niveles de glucosa en sangre se midieron cada hora; El AUS se realizó a intervalos de 8 a 24 h; y se comprobaron los reflejos de luz, párpados y amenaza. La alimentación oral se inició a las ≈ 2 h del postoperatorio. Si se observaba hipoglucemia (glucosa ≤ 50 mg/dL), se administraba glucosa al 50% por vía oral, ocasionalmente con prednisolona 0,5 mg/kg y dexametasona 0,1 mg/kg. Se administró levetiracetam (20 mg/kg, cada 8 h) durante 7 días en el postoperatorio.
Consideraciones éticas
No se requirió aprobación ética porque los animales fueron manejados de acuerdo con las leyes locales y los requisitos institucionales para la investigación con animales. Se obtuvo el consentimiento informado por escrito de sus propietarios para la participación de los animales en este estudio. Nuestro estudio es retrospectivo. En el presente estudio, realizamos oclusión vascular de derivación portosistémica laparoscópica en perros. Los procedimientos laparoscópicos de oclusión de derivación portosistémica informados anteriormente no incluían la medición de la presión de la vena porta ni la angiografía de la vena porta, lo que resultó en una identificación errónea del vaso de derivación. Cuando realizamos la cirugía laparoscópica de derivación portosistémica, abrimos el abdomen a través de una pequeña incisión y colocamos un disco de regazo como en la cirugía abierta para medir la presión de la vena porta y realizar la angiografía portal. La técnica laparoscópica, en la que se realiza una pequeña incisión en la pared abdominal, se coloca un disco de regazo y se extrae el tracto digestivo de la cavidad corporal para realizar una biopsia de capa completa del tracto digestivo, también se realiza como un procedimiento de biopsia normal, y la extracción segura del tracto digestivo de la cavidad corporal bajo laparoscopia no es un procedimiento que requiera revisión ética. La perforación percutánea del bazo para venografía portal también es un procedimiento que ya ha sido reportado y no es un procedimiento especial. La novedad de este estudio es que demostró que la medición de la presión venosa portal y la angiografía portal se pueden realizar de forma segura mediante la combinación de técnicas convencionales en la oclusión vascular laparoscópica de derivación portosistémica. Por lo tanto, se determinó que la revisión ética no era necesaria porque el estudio era simplemente una combinación de técnicas convencionales para realizar un procedimiento más seguro.
Resultados
Casos y hallazgos clínicos
La cirugía laparoscópica se realizó en 36 perros de CEHPSS durante el período de estudio. Treinta y cuatro perros se sometieron a una oclusión completa y 2 perros se sometieron a cirugía con un CB. Había 14 machos (9 castrados) y 22 hembras (12 esterilizadas). La mediana de edad y peso fue de 32,5 (rango 5-99) meses y 4,2 (rango 1,5-7,9) kg, respectivamente. Las razas incluían siete Schnauzers miniatura, siete caniches toy, seis Yorkshire Terriers, tres maltés, tres Shih Tzus, dos Shiba Inus y uno de raza mixta, galgo italiano, corgi galés, bichón frisé, chihuahua, papillón, pomerania y perro salchicha miniatura.
Los principales hallazgos clínicos preoperatorios fueron cálculos vesicales acompañados de hematuria y micción frecuente (12 perros), signos neurológicos indicativos de encefalopatía hepática como vómitos y babeo (12 perros) y convulsiones con pérdida de conciencia (4 perros). Se prescribió una nutrición específica para el hígado en caso de hiperamonemia preoperatoria. Todos los perros recibieron lactulosa (0,5-1 ml/kg, cada 12 h) y un suplemento de aminoácidos encadenados blanqueados (0,6 g/kg; Vercure Liv., NST, Saitama, Japón).
Hallazgos diagnósticos y quirúrgicos
En la Tabla 1 se detallan los tipos de derivación anatómica, el tiempo de operación de la oclusión, la presión portal en el momento de la oclusión y las complicaciones. Los tipos de derivación diagnosticados por TC en este estudio fueron: derivaciones espleno-frénica 16/36 (44,4%), seguidas de espleno-ácigos 9/36 (25,0%), espleno-cava 4/36 (11,1%), gástrico-cava derecha 6/36 (16,6%) y gástrico-cava derecha con derivaciones de asa caudal 1/36 (2,7%). En todos los casos, la presión de la vena porta se midió por vía laparoscópica y el vaso de derivación se confirmó por contraste y se ligó o se colocó una banda. El tiempo quirúrgico se definió como el tiempo transcurrido desde la incisión hasta la oclusión completa o la atenuación del CB después de la medición de la presión portal y la angiografía portal. La mediana del tiempo operatorio en los perros con posición recostada derecha (n = 25) e izquierda (n = 11) fue de 55 min (rango 28-120) y 54 min (rango 28-88), respectivamente. Se realizaron mediciones de presión de la vena porta y angiografía portal de LP en las venas mesentérica y esplénica de 30 y 6 perros, respectivamente. Los perros con una presión portal mediana de 11,5 mmHg (rango 4-16) después de la oclusión temporal se clasificaron como completamente ocluidos; dos perros con atenuación CB presentaron presiones de 22 y 24 mmHg (Tabla 1).
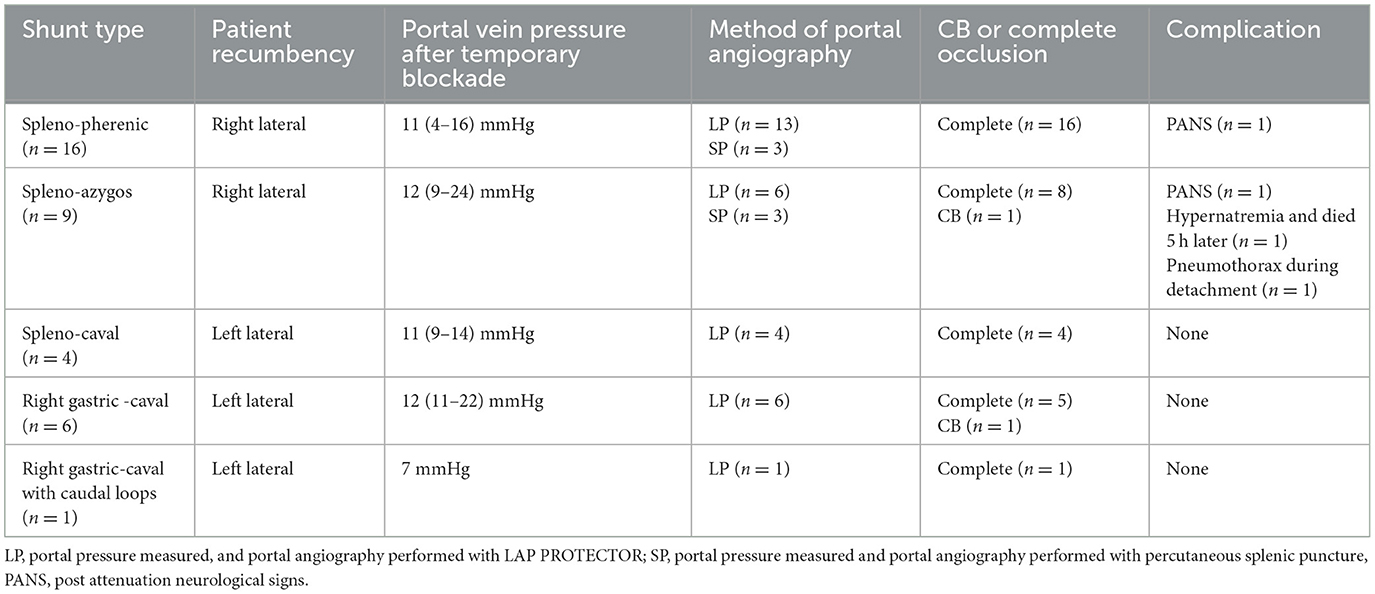 Tabla 1. Tipos y posiciones anatómicas de la derivación, métodos de medición de la presión portal y angiografía portal, características preoperatorias y postoperatorias del paciente, y tiempo hasta la oclusión en la oclusión laparoscópica de la derivación portosistémica.
Tabla 1. Tipos y posiciones anatómicas de la derivación, métodos de medición de la presión portal y angiografía portal, características preoperatorias y postoperatorias del paciente, y tiempo hasta la oclusión en la oclusión laparoscópica de la derivación portosistémica.
Complicaciones y resultados clínicos
No hubo conversión a cirugía abierta debido a la incapacidad de controlar el sangrado por laparoscopia o a la falta de identificación del vaso de derivación. Las complicaciones intraoperatorias incluyeron hemorragia leve en 5 perros (13%) debido a la disección de los vasos de derivación, pero la hemorragia pudo ser manejada. Otro perro (3%) tenía neumotórax debido a una lesión en el diafragma. Se trataba de un neumotórax iatrogénico que se desarrollaba mientras se diseccionaba una derivación que fluía hacia una vena extraña. En ese momento se observó una anomalía en el capnómetro. Se observó un aumento de la presión de la vía aérea y una disminución de la saturación de oxígeno en sangre arterial transcutánea (SpO2) se observó. Inmediatamente se añadió un solo trócar al tórax y se drenó el dióxido de carbono de la cavidad torácica. El perro se mantuvo a 5 mmHg de neumoperitoneo y lo que permitió diseccionar y manipular el vaso de derivación a la vez que aliviaba la presión en la cavidad torácica. Este perro tenía una presión portal de 24 mmHg en el momento de la oclusión temporal, por lo que se le colocó un CB. Por lo tanto, fue necesario pasar una cantidad considerable de tiempo, 120 min, antes de la oclusión parcial. Teniendo en cuenta el hecho de que el sitio de oclusión de un vaso de derivación que desemboca en una vena diafragmática o una vena extraña a menudo está en contacto con el diafragma, los perros con enfermedad pulmonar o problemas suprarrenales deben ser monitoreados cuidadosamente. No se observaron complicaciones como hipertensión portal, ascitis o derivaciones residuales a las 72 h del postoperatorio. Se insertó un tubo torácico en la cavidad torácica para reducir la presión torácica, lo que permitió diseccionar el vaso de derivación al final del procedimiento. Al perro se le colocó un CB. En todos los perros, la LAPPSO se puede realizar con presión portal y angiografía portal. Ocho perros (20%) presentaron hemorragia subcutánea en el postoperatorio. Un perro (2,7%) con oclusión completa desarrolló hipernatremia postoperatoria y falleció a las 5 h. Este perro no presentaba hipertensión portal perioperatoria ni ascitis. Otras complicaciones fueron enfermedad biliar obstructiva en un caso a las 72 h del postoperatorio y niveles elevados de bilirrubina, que mejoraron al octavo día postoperatorio y el paciente fue dado de alta. Todos los demás perros se sometieron a examen clínico y AUS a intervalos postoperatorios de 6 h hasta 72 h. Con la excepción del perro que murió, ninguno de los 35 perros presentó dolor abdominal severo o retención de ascitis debido a hipertensión portal dentro de las 72 h. Esto se atribuyó a la implementación de mediciones de presión venosa portal y angiografía portal.
Los niveles de glucosa en sangre se midieron cada 2 h en el postoperatorio. Cuatro perros (10%) presentaron hipoglucemia por debajo de 50 mg/dl en las 24 h postoperatorias. Estos perros fueron tratados con glucosa oral o intravenosa y se recuperaron. Dos perros desarrollaron PANS después de la oclusión. Uno de ellos tuvo una convulsión leve después del alta y fue tratado en un hospital local por epilepsia. El otro tuvo una convulsión severa 77 h después, perdió la visión inmediatamente y desarrolló neumonía por aspiración al quinto día, pero fue dado de alta sin mejoría de la ceguera después de 23 días de tratamiento; un perro tenía signos neurológicos preoperatorios que persistieron después de la operación, y este perro no desarrolló PANS durante un período de seguimiento de 2 meses. Sin embargo, un perro con signos neurológicos persistentes y otro con PANS requirieron medicación continua para la epilepsia. Como indicadores postoperatorios, se midieron los niveles de ácidos biliares totales y los niveles de amoníaco en 30 perros dentro de 1 a 2 meses después de la cirugía. En 26 (86,6%) perros, los niveles de amoníaco en sangre volvieron a la normalidad dentro de 1 a 2 meses después de la cirugía (mediana preprandial 31 μmol/mL, rango 14-148 μmol/mL; mediana postprandial 26 μmol/mL, rango 9 – 128 μmol/mL). Los niveles séricos de ácidos biliares se normalizaron 1-2 meses después de la cirugía en 16 perros (53,3%) con una mediana preprandial de 3,4 μmol/ml (rango de 0,1-65,9 μmol/ml) y una mediana postprandial de 15,1 μmol/ml (rango de 0,9-87,7 μmol/ml). La ecografía abdominal se realizó entre 1 y 2 meses después de la operación en 34 perros y no mostró ascitis residual ni derivaciones evidentes; un perro no acudió para la extracción de suturas o un nuevo examen y no pudo ser contactado; El estado general de 34 perros fue confirmado a partir de los registros médicos más de 1 año después de la cirugía. Treinta y cinco propietarios fueron entrevistados por teléfono entre junio de 2022 y agosto de 2022. Se entrevistó a 34 propietarios que pudieron ser contactados. Al momento de realizar la entrevista telefónica, no había casos fatales. Todos los perros cuyos dueños pudieron ser entrevistados dijeron que los signos clínicos de su perro habían mejorado y que no había signos de sospecha de recurrencia.
Discusión
Este estudio demuestra la viabilidad de realizar la medición laparoscópica de la presión venosa portal y la angiografía portal mientras se ocluye el vaso de derivación en perros con CEHPSS. No hubo signos de hipertensión portal, incluyendo ascitis, edema intestinal y dolor abdominal en 35 de los perros dentro de las 72 h postoperatorias. Los pronósticos eran relativamente favorables. Estos hallazgos indican que el procedimiento LAPSSO con medición de la presión portal y angiografía portal es una opción para el tratamiento de la CEHPSS.
LAPSSO requiere CTA preoperatoria y reconstrucción 3D de los datos de CTA para determinar los sitios portuarios y las posiciones de los cuerpos, y también exige considerar el método de oclusión para cada caso. El peso medio de los perros sometidos a LAPSSO fue de 4,2 kg, y en todos los casos se trataba de perros pequeños. Es probable que esto se atribuya a la alta prevalencia de CEHPSS en perros pequeños y al número significativo de perros pequeños en Japón (3, 7).
La posición de LAPSSO se determinó en función de los hallazgos de la CTA. Específicamente, según los resultados de la CTA, el sitio de oclusión de la derivación fue el foramen epiploico en 11/36 (31%) perros; En consecuencia, fueron intervenidos quirúrgicamente en decúbito recostado izquierdo. En los 25/36 (69%) perros restantes, la sangre del vaso de derivación fluyó hacia la vena frénica o ácigos; por lo tanto, se utilizó la posición recostada derecha. La selección preoperatoria de la posición corporal evitó cambios intraoperatorios en la posición corporal o una transición a la cirugía abierta. Sin embargo, en los casos con derivaciones esplenofrénicas, el vaso de derivación comienza en la vena gástrica izquierda y sigue el estómago dorsal para conectarse con la vena frénica, que atraviesa el diafragma a través de la curvatura menor del estómago. En consecuencia, el sitio de oclusión es muy corto e implica un riesgo de neumotórax que daña el diafragma (19, 21). En algunos casos, el desprendimiento del recipiente de derivación tomó un tiempo relativamente largo. A veces, era difícil identificar los vasos de derivación conectados con la vena ácigos cuando el sitio de desprendimiento estaba detrás del estómago y oculto por el tejido adiposo. En estos casos, el vaso de derivación pudo ser observado y ligado ajustando la inclinación del perro y moviendo los puertos ligeramente a la visualización caudal de la vena ácigos.
En estudios previos en los que se utilizó CB o ARC en perros, no se realizó la medición de la presión venosa portal ni la angiografía portal (11-15, 19-21). En cambio, la derivación se ocluyó temporalmente con CB, y la hipertensión portal se controló mediante cambios en el color pancreático e intestinal y aumento del peristaltismo; CB y ARC son modalidades de oclusión muy útiles en perros que no pueden tolerar la oclusión completa. Sin embargo, hay muchos informes de que el CB y el ARC dan lugar a vasos de derivación residuales en el postoperatorio (11-15). Landon et al. informaron de oclusión incompleta en 3 (18,6%) de los 16 perros operados por CB y múltiples derivaciones adquiridas en 3 perros (13). Nathan et al. informaron de una oclusión completa en 13 (65%) de los 20 perros operados por CB, mientras que la oclusión incompleta se produjo en 7 perros (14). No se ha aclarado la causa del remanente de derivación en los casos de CB atenuado, pero se ha sugerido que la identificación errónea de la derivación o los problemas con su ubicación pueden desempeñar un papel importante (13.14). Poggi et al. informaron que la medición de la presión portal intraoperatoria y la portovenografía son importantes, a pesar de los desafíos asociados con estas técnicas, si es posible, para la oclusión completa (19-24). El tiempo operatorio también tiende a aumentar, aumentando así la carga. También se ha informado que la derivación laparoscópica de la vena porta es difícil de medir la presión de la vena portal debido a la dificultad de colocar un dispositivo de medición portal invasivo (20). En los seres humanos, la presión portal se mide después de la oclusión temporal del vaso de derivación; Además, se han reportado oclusiones parciales debido a hipertensión portal (28, 29). Mori et al. describieron la medición de la presión portal retrógrada desde la vena femoral a través de la derivación; Sin embargo, los perros son demasiado pequeños para este procedimiento (3, 7). Por lo tanto, utilizamos un retractor LP para la medición de la presión portal similar al procedimiento de medición en cirugía abierta. Un LP es un dispositivo de silicona de pequeña incisión estirable para uso laparoscópico que está disponible en varios tamaños. Durante el procedimiento, se realizó una pequeña incisión en la piel de aproximadamente 2,0 a 3,0 cm, se tomó el yeyuno fuera de la cavidad abdominal y se colocó el LP en la vena mesentérica. Al colocar una tapa especial (acceso EZ) al LP, fue posible restablecer el neumoperitoneo y envolver un hilo quirúrgico o CB alrededor de la derivación para cerrarla. En algunos perros, se extirparon los cálculos vesicales o se realizó simultáneamente una cirugía anticonceptiva con LAPSSO utilizando los orificios LP. En consecuencia, el retractor LP se consideró una herramienta útil en este procedimiento.
Alternativamente, la medición de la presión portal y la angiografía se pueden realizar colocando percutáneamente una aguja larga permanente en el bazo para medir simultáneamente la presión portal y realizar una angiografía de la vena esplénica (SP) (24). Este método de SP fue factible solo en la posición recostada derecha, con una visualización clara del bazo en la cavidad abdominal, sin tendencias sangrantes y con un grosor esplénico suficiente. La SP se utilizó en 6 de los 25 (24%) perros mantenidos en decúbito lateral derecho. Sin embargo, en el resto de los casos en los que se pensó que el puerto entraría en contacto con la aguja permanente colocada en el bazo o debido a preocupaciones sobre la hemostasia. Por lo tanto, aunque la posición del cuerpo es una consideración vital a la hora de elegir el método para la medición de la presión portal y el contraste, es igualmente crucial tener en cuenta el tamaño corporal del paciente y su propensión a las hemorragias. Sugerimos que la medición de la presión venosa portal intraoperatoria y la identificación de los vasos de derivación pueden reducir la hipertensión portal postoperatoria, la ascitis y los vasos de derivación residuales. Además, incluso en perros en los que los hallazgos preoperatorios de la ATC predijeron que era posible una oclusión completa, algunos perros tenían presiones portales elevadas en el momento de la oclusión temporal del vaso de derivación. En estos casos, si la presión de la vena porta era superior a 16 mmHg, el método de oclusión se cambiaba a oclusión parcial con CB o hilo quirúrgico. Son muchos los factores que influyen en la presión portal intraoperatoria, entre ellos la presión arterial sistémica y la localización del tracto intestinal (1,4,5.). Por lo tanto, la presión arterial media se mantuvo por encima de 60 mmHg, después de lo cual se midió simultáneamente la presión portal. La presión portal se ajustó para que se mantuviera por debajo de 16 mmHg ampliamente.
En nuestro estudio se aplicaron métodos de evaluación de seguimiento tanto subjetivos como objetivos. En cuanto a los métodos de evaluación objetiva, 34 perros se sometieron a pruebas preoperatorias y postoperatorias de amoníaco y ácidos biliares, así como a ecografía abdominal. Dos perros con oclusión parcial se sometieron a análisis de sangre después de lograr la oclusión completa. Hubo una mejoría postoperatoria en los niveles de amoníaco y ácidos biliares (30-32). Los seguimientos a largo plazo incluyeron entrevistas en persona y telefónicas con los propietarios sobre los hallazgos clínicos y los signos de recurrencia; sin embargo, no hubo casos de recurrencia de signos clínicos o complicaciones.
Este estudio tiene varias limitaciones. En primer lugar, el estudio tuvo un tamaño de muestra pequeño. Debido al fenómeno de interferencia del puerto y la posibilidad de interferencia de fórceps debido al estrecho espacio de trabajo en la cavidad abdominal. Y solo hubo una institución y ningún estudio multicéntrico, lo que puede tener un sesgo en la selección de casos. En segundo lugar, aunque se realizó un seguimiento durante 2 meses después del tratamiento, no se realizó ATC, y la precisión del estudio es problemática porque los vasos de derivación residuales fueron confirmados por AUS en el momento del reexamen. La detección de pequeños vasos de derivación es difícil y el resultado puede ser algo menos satisfactorio. Si es posible, se puede realizar una ATC en el control postoperatorio para una evaluación más precisa. En tercer lugar, el pequeño número de estudios de oclusiones parciales no tiene en cuenta las complicaciones ni el pronóstico, y se necesitan más estudios. Se requiere un estudio prospectivo grande para validar nuestros hallazgos, incluida la oclusión completa, el tiempo operatorio, las complicaciones y la tasa de conversión a laparotomía.
En conclusión, los resultados del presente estudio sugieren que la medición de la hipertensión portal y la angiografía portal pueden realizarse en LAPSSO en CEHPSS y pueden reducir la hipertensión portal postoperatoria y los vasos de derivación residuales y las derivaciones múltiples. Además, la mayoría de los perros reexaminados mostraron la ausencia de derivaciones residuales, recanalización o signos de recurrencia más de 1 año después de la operación. Si bien la LAPSSO con LP es más compleja, invasiva y requiere más tiempo que la cirugía laparoscópica convencional, tiene el potencial de mejorar los resultados y el pronóstico postoperatorios.
Declaración de disponibilidad de datos
Las contribuciones originales presentadas en el estudio se incluyen en el artículo/material complementario, las consultas posteriores pueden dirigirse al autor correspondiente.
Declaración ética
No se requirió aprobación ética porque el estudio era retrospectivo y los animales se manejaron de acuerdo con las leyes locales y los requisitos institucionales para la investigación con animales. Se obtuvo el consentimiento informado por escrito de los propietarios para la participación de sus animales en este estudio.
Contribuciones de los autores
JS: Conceptualización, Análisis formal, Investigación, Redacción, borrador original, Redacción, revisión y edición. YK: Administración de proyectos, redacción, revisión y edición. MK: Redacción, revisión y edición, Recursos. KN: Administración de proyectos, redacción, revisión y edición. ST: Redacción, revisión y edición, administración de proyectos.
Financiación
El/los autor/es declaran/n que no se recibió apoyo financiero para la investigación, autoría y/o publicación de este artículo.
Reconocimientos
Agradecemos a Minamoto T., DVM, PhD por su asesoramiento en la elaboración de este estudio.
Conflicto de intereses
Los autores declaran que la investigación se llevó a cabo en ausencia de relaciones comerciales o financieras que pudieran interpretarse como un posible conflicto de intereses.
Nota del editor
Todas las afirmaciones expresadas en este artículo son únicamente las de los autores y no representan necesariamente las de sus organizaciones afiliadas, ni las del editor, los editores y los revisores. Cualquier producto que pueda ser evaluado en este artículo, o afirmación que pueda ser hecha por su fabricante, no está garantizado ni respaldado por el editor.
Referencias
1. Hottinger HA, Walshaw R, Hauptman JG. Resultados a largo plazo de la ligadura completa y parcial de derivaciones portosistémicas congénitas en perros. Cirugía veterinaria. (1995) 24:331–6. doi: 10.1111/j.1532-950X.1995.tb01339.x
Resumen de PubMed | Texto completo de Crossref | Google Académico
2. Grenhalgh SN, Dunning MD, McKinley TJ, et al. Comparación de la supervivencia después de un tratamiento quirúrgico o médico en perros con una derivación portosistémica congénita. J Am Vet Med Assoc. (2010) 236:1215–20. doi: 10.2460/javma.236.11.1215
Resumen de PubMed | Texto completo de Crossref | Google Académico
3. Mankin KM. Conceptos actuales en derivaciones portosistémicas congénitas. Vet Clin North Am Small Anim Pract. (2015) 45:477–87 doi: 10.1016/j.cvsm.2015.01.008
Resumen de PubMed | Texto completo de Crossref | Google Académico
4. Worley DR, Holt DE. Evolución clínica de la atenuación de la derivación portosistémica extrahepática congénita en perros de cinco años y más: 17 casos (1992-2005). J Am Vet Med Assoc. (2008) 232:722–7. doi: 10.2460/javma.232.5.722
Resumen de PubMed | Texto completo de Crossref | Google Académico
5. Harvey J, Erb HN. Ligadura completa de derivaciones portosistémicas congénitas extrahepáticas en perros no encefalopáticos. Cirugía veterinaria. (1998) 27:413–6. doi: 10.1111/j.1532-950X.1998.tb00148.x
Resumen de PubMed | Texto completo de Crossref | Google Académico
6. Kraun MB, Nelson LL, Hauptman JG, Nelson NC. Análisis de la relación de la morfología de la derivación portosistémica extrahepática con variables clínicas en perros: 53 casos (2009-2012). J Am Vet Med Assoc. (2014) 245:540–9. doi: 10.2460/javma.245.5.540
Resumen de PubMed | Texto completo de Crossref | Google Académico
7. Fukushima K, Kanemoto H, Ohno K, et al. Morfología tomográfica computarizada y características clínicas de las derivaciones portosistémicas extrahepáticas en 172 perros en Japón. Veterinario J. (2014) 199:376–81. doi: 10.1016/j.tvjl.2013.11.013
Resumen de PubMed | Texto completo de Crossref | Google Académico
8. Blanco RN, Parry AT. Morfología de las derivaciones portosistémicas congénitas que afectan a la vena gástrica derecha en perros. J Pequeña Anim Pract. (2015) 56:430–40. doi: 10.1111/jsap.12355
Resumen de PubMed | Texto completo de Crossref | Google Académico
9. Blanco RN, Parry AT. Morfología de las derivaciones portosistémicas congénitas esplenocavas en perros y gatos. J Pequeña Anim Pract. (2016) 57:28–32. doi: 10.1111/jsap.12414
Resumen de PubMed | Texto completo de Crossref | Google Académico
10. Nelson NC, Nelson LL. Anatomía de las derivaciones portosistémicas extrahepáticas en perros según lo determinado por angiografía por tomografía computarizada. Ecografía Radiol Veterinaria. (2011) 52:498–506. doi: 10.1111/j.1740-8261.2011.01827.x
Resumen de PubMed | Texto completo de Crossref | Google Académico
11. Traverson M, Lussier B, Huneault L, Gatineau M. Resultados comparativos entre el anillo ameroides constrictor y las bandas de celofán para el tratamiento de derivaciones portosistémicas extrahepáticas congénitas únicas en 49 perros (1998-2012). Cirugía veterinaria. (2018) 47:179–87. doi: 10.1111/vsu.12747
Resumen de PubMed | Texto completo de Crossref | Google Académico
12. Otomo A, Singh A, Jeong J, et al. Resultados clínicos a largo plazo de perros con derivaciones portosistémicas extrahepáticas congénitas atenuadas con bandas de película delgada o constrictores de anillos ameroides. Cirugía veterinaria. (2020) 49:436–44. doi: 10.1111/vsu.13384
Resumen de PubMed | Texto completo de Crossref | Google Académico
13. Landon BP, Abraham LA, Charles JA. Uso de gammagrafía portal transcolónica para evaluar la eficacia del bandeo de celofán de derivaciones portosistémicas extrahepáticas congénitas en 16 perros. Aust Vet J. (2008) 86:169–79. doi: 10.1111/j.1751-0813.2008.00278.x
Resumen de PubMed | Texto completo de Crossref | Google Académico
14. Nelson NC, Nelson LL. Imágenes y resultados clínicos en 20 perros tratados con bandas de película delgada para derivaciones portosistémicas extrahepáticas. Cirugía veterinaria. (2016) 45:736–45. doi: 10.1111/vsu.12509
Resumen de PubMed | Texto completo de Crossref | Google Académico
15. Hunt GB, Culp WT, Mayhew KN, Mayhew P, Steffey MA, Zwingenberger A. Evaluación del comportamiento in vivo de constrictores de anillos ameroides, en perros con derivaciones portosistémicas extrahepáticas congénitas mediante tomografía computarizada. Cirugía veterinaria. (2014) 43:834–42. doi: 10.1111/j.1532-950X.2014.12196.x
Resumen de PubMed | Texto completo de Crossref | Google Académico
16. Haraguchi T, Kimura S, Itoh H, et al. Comparación del dolor postoperatorio y la reacción inflamatoria en perros sometidos a gastropexia preventiva asistida por laparoscopia e incisional. J Vet Med Sci. (2017) 79:1524–31. doi: 10.1292/jvms.17-0103
Resumen de PubMed | Texto completo de Crossref | Google Académico
17. Pitt KA, Mayhew PD, Steffey MA, et al. Adrenalectomía laparoscópica para la extirpación de feocromocitomas unilaterales no invasivos en 10 perros. Cirugía veterinaria. (2016) 45:O70–6. doi: 10.1111/vsu.12552
Resumen de PubMed | Texto completo de Crossref | Google Académico
18. Préfontaine L, Hélie P, Vachon P. Dolor postoperatorio en ratas Sprague Dawley después de la biopsia hepática por laparotomía versus laparoscopia. Lab Anim (Nueva York). (2015) 44:174–8. doi: 10.1038/laban.731
Resumen de PubMed | Texto completo de Crossref | Google Académico
19. Park J, Jang K, Jo HM, et al. Atenuación laparoscópica de una derivación portosistémica extrahepática congénita en un perro: una banda de película delgada para la derivación esplenofrénica: informe de un caso. Front Vet Sci. (2022) 9:918153. doi: 10.3389/fvets.2022.918153
Resumen de PubMed | Texto completo de Crossref | Google Académico
20. Miller JM, Fowler JD. Atenuación laparoscópica de la derivación portosistémica en dos perros. J Am Anim Hosp Assoc. (2006) 42:160–4. doi: 10.5326/0420160
21. Poggi E, Rubio DG, Pérez Duarte FJ, et al. Atenuación laparoscópica de la derivación portosistémica en 20 perros (2018-2021). Cirugía veterinaria. (2022) 51:O138–49. doi: 10.1111/vsu.13785
Resumen de PubMed | Texto completo de Crossref | Google Académico
22. Doran IP, Barr FJ, Hotston Moore A, Knowles TG, Holt PE. Tamaño hepático, peso corporal y tolerancia a la oclusión completa aguda de derivaciones portosistémicas extrahepáticas congénitas en perros. Cirugía veterinaria. (2008) 37:656–62. doi: 10.1111/j.1532-950X.2008.00432.x
Resumen de PubMed | Texto completo de Crossref | Google Académico
23. Schulz KS, Martin RA, Henderson RA. Cateterismo portal transesplénico. Técnica quirúrgica y uso en dos perros con derivaciones portosistémicas. Cirugía veterinaria. (1993) 22:363–9. doi: 10.1111/j.1532-950X.1993.tb00413.x
Resumen de PubMed | Texto completo de Crossref | Google Académico
24. Sakamoto Y, Sakai M, Watari T. Tres métodos mínimamente invasivos para medir la presión de la vena porta en perros sanos. J Vet Med Sci. (2012) 74:1299–302. doi: 10.1292/jvms.11-0549
Resumen de PubMed | Texto completo de Crossref | Google Académico
25. Holford AL, Tobias KM, Bartges JW, Johnson BM. Respuesta suprarrenal a la hormona adrenocorticotrópica en perros antes y después de la atenuación quirúrgica de una única derivación portosistémica congénita. J Veterinario Pasante Med. (2008) 22:832–8. doi: 10.1111/j.1939-1676.2008.0142.x
Resumen de PubMed | Texto completo de Crossref | Google Académico
26. Mullins RA, Escribano Carrera A, Anderson DM, et al. Signos neurológicos posteriores a la atenuación después de la atenuación quirúrgica de derivaciones portosistémicas congénitas en perros: una revisión. Cirugía veterinaria. (2022) 51:23–33. doi: 10.1111/vsu.13729
27. Tisdall PL, Hunt GB, Youmans KR, Malik R. Disfunción neurológica en perros después de la atenuación de derivaciones portosistémicas extrahepáticas congénitas. J Pequeña Anim Pract. (2000) 41:539–46. doi: 10.1111/j.1748-5827.2000.tb03150.x
Resumen de PubMed | Texto completo de Crossref | Google Académico
28. Kimura T, Soh H, Hasegawa T, et al. Corrección laparoscópica de la derivación portosistémica congénita en niños. Surg Laparosc Endosc Percutan Tech. (2004) 14:285–8. doi: 10.1097/00129689-200410000-00012
Resumen de PubMed | Texto completo de Crossref | Google Académico
29. Mori T, Yamada Y, Abe K, et al. Cierre parcial laparoscópico para indicaciones de derivación portosistémica congénita, manejo postoperatorio y posterior cierre completo. J Laparoendosc Adv Surg Tech A. (2019) 29:573–8. doi: 10.1089/lap.2018.0581
Resumen de PubMed | Texto completo de Crossref | Google Académico
30. Bristow P, Tivers M, Packer R, et al. Concentraciones séricas de ácidos biliares a largo plazo en 51 perros después de una ligadura de derivación portosistémica congénita extrahepática completa. J Pequeña Anim Pract. (2017) 58:454–60. doi: 10.1111/jsap.12685
Resumen de PubMed | Texto completo de Crossref | Google Académico
31. Gerritzen-Bruning MJ van den Ingh TS Rothuizen Rothuizen J: Valor diagnóstico de las concentraciones plasmáticas de amoníaco y ácidos biliares en ayunas en la identificación de maniobras portosistémicas en perros. J Veterinario Pasante Med. (2006) 20:13–19. doi: 10.1111/j.1939-1676.2006.tb02818.x
32. KM, Rohrbach BW. Asociación de la raza con el diagnóstico de derivaciones portosistémicas congénitas en perros: 2.400 casos (1980-2002). J Am Vet Med Assoc. (2003) 223:1636–9. doi: 10.2460/javma.2003.223.1636
Resumen de PubMed | Texto completo de Crossref | Google Académico
Palabras clave: canino, congénito, cirugía laparoscópica, presión portal, angiografía de la vena porta, derivación portosistémica
Cita: Shigemoto J, Kaneko Y, Kawazu M, Naganobu K y Torisu S (2024) Tratamiento laparoscópico de derivaciones portosistémicas congénitas con medición de la presión portal y angiografía portal en 36 perros. Frente. Vet. Sci. 11:1291006. doi: 10.3389/fvets.2024.1291006
Recibido: 08 de septiembre de 2023; Aceptado: 05 de febrero de 2024;
Publicado: 28 de febrero de 2024.
Editado por:
Gerardo Fatone, Universidad de Nápoles Federico II, Italia
Revisado por:
Francesco Collivignarelli, Universidad de Teramo, Italia Gert Niebauer, Universidad de Nápoles Federico II, Italia
Derechos de autor © 2024 Shigemoto, Kaneko, Kawazu, Naganobu y Torisu. Este es un artículo de acceso abierto distribuido bajo los términos de la Licencia Creative Commons Attribution License (CC BY).
*Correspondencia: Shidow Torisu, s-torisu@rakuno.ac.jp
†Estos autores han contribuido igualmente a este trabajo
Renuncia: Todas las afirmaciones expresadas en este artículo son únicamente las de los autores y no representan necesariamente las de sus organizaciones afiliadas, ni las del editor, los editores y los revisores. Cualquier producto que pueda ser evaluado en este artículo o afirmación que pueda hacer su fabricante no está garantizado ni respaldado por el editor.
Date de alta y recibe nuestro 👉🏼 Diario Digital AXÓN INFORMAVET ONE HEALTH
Date de alta y recibe nuestro 👉🏼 Boletín Digital de Foro Agro Ganadero
Noticias animales de compañía
Noticias animales de producción
Trabajos técnicos animales de producción
Trabajos técnicos animales de compañía

