Una evaluación in vitro de emulsión lipídica intravenosa en tres tóxicos caninos comunes
 Emery Jones1*
Emery Jones1* Stuart A. Walton2
Stuart A. Walton2 Jennifer Davis3
Jennifer Davis3 Consejo McAlister-Troche3
Consejo McAlister-Troche3- 1Especialista en Medicina Veterinaria del Desierto, Phoenix, AZ, Estados Unidos
- número arábigoDepartamento de Ciencias Clínicas de Pequeños Animales, Facultad de Medicina Veterinaria, Universidad de Florida, Gainesville, FL, Estados Unidos
- 3Departamento de Ciencias Biomédicas y Patobiología, Facultad de Medicina Veterinaria de Virginia-Maryland, Virgina Tech, Blacksburg, VA, Estados Unidos
Objetivo: Determinar si el tratamiento con emulsión lipídica intravenosa (ILE) reduce significativamente la concentración de baclofeno, ibuprofeno o brometalina en la sangre total canina a lo largo del tiempo.
Animales: Siete bolsas de 500 mL de sangre canina DEA 1.1 negativa se dividieron en alícuotas de 125 mL y se asignaron aleatoriamente a uno de tres grupos de tratamiento (baclofeno, ibuprofeno, brometalina) o cuatro grupos de control (un control positivo para cada grupo de tratamiento y un grupo de control negativo).
Procedimientos: El ibuprofeno inyectable (200 mg/kg), baclofeno (8 mg/kg) o brometalina (3 mg/kg) se distribuyeron en alícuotas de 125 mL de sangre total canina y se incubaron durante 30 min a 38,5 °C. Se añadió ILE (12,4 mL, Intralípido®) a cada muestra y la solución se vertiginó en vórtice [215 rpm durante 15 min a 37 °C (98,6 °F)]. Las muestras se obtuvieron en puntos de tiempo designados (0, 15, 30, 60, 180, 360 min), se centrifugaron y se separaron en fracciones de suero y glóbulos rojos. Las muestras de suero se ultracentrifugaron (22.000 g durante 10 min a 37 °C) para separar las fracciones ricas y pobres en lípidos. Las muestras se almacenaron a -80 °C antes del análisis.
Resultados: Se estableció una disminución significativa en la concentración total del fármaco para la brometalina y su metabolito desmetilbrometalina en comparación con los controles positivos. ILE redujo significativamente la desmetilbrometalina en los puntos de tiempo de 30 y 360 minutos. El resto de los puntos de tiempo de desmetilbrometalina no alcanzaron significación. La concentración de brometalina se redujo significativamente en todos los puntos temporales en comparación con los controles positivos. Ni el baclofeno ni el ibuprofeno presentaron cambios significativos en la concentración.
Conclusión: El tratamiento con ILE fue eficaz para reducir la concentración total del fármaco de brometalina y su metabolito desmetilbrometalina, lo que respalda la teoría del sumidero de lípidos. Al tratarse de un estudio in vitro de un solo compartimento, este estudio no evalúa otros mecanismos de acción propuestos para la terapia ILE. La terapia ILE puede tener otros medios para disminuir significativamente la concentración de fármacos lipofílicos en casos de toxicosis.
1 Introducción
En 2023, el centro de control de envenenamiento de ASPCA (APCC, por sus siglas en inglés) recibió más de 351,000 llamadas sobre posibles envenenamientos de mascotas (1). En los últimos 10 años, los medicamentos para uso humano y los productos de venta libre han encabezado consistentemente la lista de intoxicaciones reportadas a la APCC (1, 2).
El uso de la infusión de emulsión lipídica intravenosa (ILE) como antídoto en casos de toxicidad tanto en humanos como en animales ha evolucionado en los últimos 20 años (3, 4). El primer tratamiento exitoso reportado de la toxicidad de un medicamento lipofílico en la literatura veterinaria ocurrió en 2009 cuando se usó ILE para tratar a un cachorro con sobredosis de moxidectina (3, 5, 6). La literatura veterinaria actual sobre este tema es escasa y consiste en artículos de revisión, series de casos e informes de casos que documentan el uso de ILE en el tratamiento de una variedad de intoxicaciones por drogas lipofílicas, como baclofeno, brometalina y medicamentos antiinflamatorios no esteroideos (AINE) (3-13).
El mecanismo de acción de la ILE en el tratamiento de la intoxicación por fármacos lipofílicos no se ha dilucidado completamente (12, 13). Es probable que más de un mecanismo de acción contribuya a los efectos de la ILE en casos de toxicidad (4, 12, 13). La teoría más popular es la «lanzadera lipídica», anteriormente llamada la teoría del «sumidero de lípidos» (3, 4, 11-16). La teoría del «sumidero de lípidos», propuesta por primera vez por Weinberg y sus colegas en 1998, teorizó que las infusiones intravenosas de lípidos creaban una fase o compartimento lipídico dentro del espacio intravascular, actuando como un depósito para que los medicamentos lipofílicos se dividieran en ellos, lo que resultaba en el secuestro de sustancias potencialmente tóxicas lejos de órganos vulnerables como el corazón y el cerebro. 4, 12, 13, 15–17). Investigaciones más recientes en curso apoyan la teoría de la «lanzadera lipídica». La teoría de la lanzadera lipídica consta de dos elementos: (1) los fármacos solubles en lípidos se introducen en la fase lipídica recién creada y luego (2) se alejan de los órganos vitales (corazón y cerebro) y se dirigen hacia los órganos de almacenamiento (tejido adiposo y músculo) y de desintoxicación (hígado) (4, 14-16). En algunos pacientes se ha descrito un aumento inicial y transitorio de la concentración del fármaco tras el inicio del tratamiento con ILE (4). Se ha informado de una mejoría de los signos clínicos debido al tratamiento con ILE tan pronto como 30 min después del inicio del tratamiento con ILE (8). Otras teorías alternativas para el mecanismo de acción de ILE incluyen la «recuperación mitocondrial», el apoyo mejorado de la presión arterial y las teorías de la «inotropía directa» (3, 4, 12, 13). La teoría de la «recuperación mitocondrial» se describió por primera vez con sobredosis de bupivacaína. La teoría de la «recuperación mitocondrial» sugiere que la ILE proporciona una fuente de energía a las células miocárdicas reduciendo los efectos cardiodepresores de la bupivacaína sobre los miocitos cardíacos (3, 12, 14, 18). La terapia ILE mejora la presión arterial, posiblemente a través de la vasoconstricción relacionada con la señalización del óxido nítrico o la mediación de la sensibilidad adrenérgica, mejorando así el resultado en individuos intoxicados (4, 14-16). En la teoría de la «inotropía directa», la ILE tiene efectos ionotrópicos cardíacos directos a través del aumento de la concentración de calcio intracelular en los miocitos cardíacos (4, 14-16). Los efectos ionotrópicos de la ILE conducen a una mejora del gasto cardíaco (4, 14-16).
La lipofilia de un fármaco, caracterizada por logP, evalúa la distribución entre el octanol y el agua (es decir, el coeficiente de partición octanol-agua) (4). Los fármacos con logP más altos son más lipofílicos y se espera que tengan una mayor afinidad para ser eliminados por ILE en comparación con los fármacos con un logP más bajo (12, 13). Los fármacos con un logP >1 se consideran lipofílicos (12, 13). Actualmente en la literatura veterinaria existen reportes de casos y un único estudio retrospectivo multicéntrico que detalla el uso clínico exitoso de ILE en el tratamiento de la intoxicación por baclofeno, ibuprofeno y/o brometalina (4, 5, 8, 9, 19, 20).
El baclofeno (logP = −1,3), el ibuprofeno (logP = 3,97) y la brometalina (logP = 7,6) presentan diversos grados de lipofilia (12, 13). Todavía no se ha evaluado la cuantificación de la reducción de los niveles del fármaco a lo largo del tiempo en pacientes tratados con ILE por toxicidad.
El baclofeno, un relajante del músculo esquelético, se prescribe para pacientes humanos con espasticidad muscular y trastornos de la columna vertebral (21, 22). En perros, el baclofeno se ha utilizado de forma intermitente a una dosis de 1-2 mg/kg una vez cada 8 h en casos de espasticidad del músculo uretral (21, 22). Si bien aún no se ha determinado la dosis tóxica de baclofeno en perros, la ASPCA informa dosis letales tan bajas como 8-16 mg/kg (21). Los efectos secundarios comunes en los caninos por intoxicación por baclofeno incluyen; ataxia, vómitos, vocalización, disnea, convulsiones, depresión, hipotermia, parálisis de los músculos respiratorios e hipotensión (10, 21, 22).
El ibuprofeno, un medicamento antiinflamatorio no esteroideo (AINE), se usa comúnmente para disminuir la inflamación, la analgesia y como antipirético en la medicina humana (23-25). También es uno de los medicamentos de venta libre más comunes implicados en las intoxicaciones de mascotas (23). El ibuprofeno inhibe de forma competitiva y no selectiva tanto la ciclooxigenasa (COX) 1 como la COX 2 (9, 23, 25). La toxicidad se ve aumentada por la recirculación enterohepática, lo que permite una reexposición continua (9, 23, 25). Los efectos secundarios del ibuprofeno dependen de la dosis (9, 23, 24). La ingesta de dosis de ibuprofeno que oscilan entre 25 y 125 mg/kg puede provocar vómitos, diarrea, náuseas, dolor abdominal y anorexia. Se ha demostrado que las dosis de ibuprofeno >175 mg/kg provocan hematemesis, melena e insuficiencia renal aguda. Mientras que las dosis de ibuprofeno >400 mg/kg se han asociado con convulsiones, coma y shock (23).
La brometalina, un rodenticida dependiente de la dosis, desacopla la fosforilación oxidativa, lo que reduce la producción de ATP y la interrupción de las bombas de canales iónicos (26, 27). Los caninos que ingieren grandes dosis a menudo desarrollan hipertermia, temblores musculares severos, hiperexcitabilidad, convulsiones focales y de gran mal, y muerte (27). Las dosis grandes incluyen dosis mayores o iguales a la DL50 (3,65 mg/kg) (26). Las dosis pequeñas de ingestión de brometalina, aquellas menos de la LD50, se asocian con síntomas lentamente progresivos que incluyen ataxia de las extremidades posteriores y/o depresión del SNC (26, 27). Se han reportado signos clínicos y muerte en perros después de la ingestión de brometalina en dosis tan bajas como 0.46 mg/kg (27). Debido a su amplia disponibilidad y fácil acceso, la intoxicación por rodenticidas se encuentra entre los diez principales tóxicos reportados en medicina veterinaria cada año (28).
Si bien hay varios estudios en múltiples especies que evalúan la ILE para las intoxicaciones por anestésicos locales, sobre todo la bupivacaína, no hay datos actuales que evalúen su capacidad para reducir las concentraciones de fármacos de toxinas comunes en medicina veterinaria (29-32). Sin embargo, existen múltiples informes de casos en la literatura humana y veterinaria que demuestran el uso clínico exitoso de ILE en el tratamiento de pacientes expuestos a dosis mortales de medicamentos lipofílicos (5, 8, 11, 13). Dada esta deficiencia, existe la necesidad de evaluar la utilidad de ILE para las intoxicaciones comunes por drogas lipofílicas.
El propósito de este modelo in vitro de compartimento único es evaluar el efecto de Intralipid (20%) sobre la concentración de tres tóxicos caninos comunes en sangre total a lo largo del tiempo y calcular el porcentaje de reducción de estos fármacos lipofílicos cuando se realiza la terapia ILE. El presente estudio será el primero en evaluar la eficacia de la ILE como antídoto para las intoxicaciones por baclofeno, ibuprofeno y brometalina, que se encuentran con frecuencia en medicina veterinaria.
2 Materiales y métodos
2.1 Prueba de susceptibilidad in vitro
Se compraron siete unidades de 500 mL de sangre entera canina negativa para DEA 1.1 en un banco de sangre privado (American Blood Resources International, ABR®). Se realizó una gasometría en una muestra de sangre obtenida de cada unidad de sangre. Cada unidad se dividió en partes iguales en 4 alícuotas de 125 mL cada una. Cada una de las siete bolsas de sangre originales estaban etiquetadas con una letra de la A a la G. Cada alícuota estaba etiquetada con la letra de la bolsa principal (A-G) y un número (1-4), lo que daba como resultado una identificación única para cada alícuota. Las alícuotas se enumeraron en una columna de hoja de cálculo de Excel en orden de letras y números. En la columna junto a los números de identificación de alícuotas, se asignó un número aleatorio a cada alícuota utilizando la función Rand(). A continuación, los números y las alícuotas asociadas se ordenaron del número aleatorio más bajo al más alto. A continuación, las alícuotas se asignaron a uno de los 7 grupos que consistían en baclofeno, ibuprofeno, brometalina, un grupo de control positivo para cada uno de los tres grupos anteriores y un único grupo de control negativo. A cada grupo de tratamiento se le asignaron 5 alícuotas. El grupo de control positivo contenía 2 alícuotas por grupo de tratamiento. El grupo de control negativo contenía un total de 2 alícuotas. Las alícuotas del grupo de tratamiento (baclofeno, ibuprofeno, brometalina) se infundieron con el fármaco designado y la ILE. Los aliqouts de control positivo se infundieron solo con el fármaco designado individual. La alícuota de control negativo se infundió solo con ILE. Cada alícuota era equivalente a un perro de 1,38 kg, basándose en la suposición de que un perro tiene 90 mL/kg de volumen sanguíneo.
Las alícuotas se colocaron en un baño de agua tibia a 37 °C (98,6 °F) durante aproximadamente 15 minutos. A continuación, las alícuotas se trasladaron a un agitador orbital con control de temperatura ajustado a 215 revoluciones por minuto (rpm) y 37 °C (98,6 °F) durante 15 minutos para permitir el equilibrio. Cada fármaco se instiló a través de una aguja y una jeringa en la alícuota designada. Se añadieron un total de 4 mg (3 mg/kg) de brometalina, 11 mg (8 mg/kg) de baclofeno o 276 mg (200 mg/kg) de ibuprofeno a las alícuotas individuales. Cada concentración de fármaco se seleccionó en función de las concentraciones reportadas en la literatura que se han asociado con toxicidad significativa o mortalidad. A la alícuota designada como control negativo, no se le añadió ningún medicamento. Las alícuotas se invirtieron a mano 10 veces cada una y se volvieron a colocar en el agitador orbital con control de temperatura a 215 rpm y 37 °C (98,6 °F) durante 5 minutos.
2.2 Recogida de muestras
Después del equilibrio y la incubación, se recolectaron muestras de sangre total (3 mL) Time (T0) mediante aguja y jeringa. La muestra se colocó directamente en un tubo superior rojo de 10 mL sin aditivos ni separadores. Los tubos se centrifugaron a 3.000 g durante 10 min. Después de la centrifugación, el suero se extrajo y se colocó en un tubo de microcentrífuga de 2 mL. El tubo de la microcentrífuga se ultracentrifugó a 22.000 g y 37 °C (98,6 °F) durante 10 min. Después de la ultracentrifugación, se separaron las muestras ricas en lípidos y pobres en lípidos. Todas las muestras se almacenaron en un congelador con temperatura controlada a -80 °C (-112 °F).
Después de la recolección de la muestra T0, se agregaron 12,4 mL [bolo de 1,5 mL/kg + 0,25 mL/kg/min (calculado para un período de 30 minutos)] de emulsión lipídica intravenosa (ILE, Intralipid®20%) a cada alícuota, excepto para las alícuotas designadas como control positivo. Las alícuotas se volvieron a colocar en el agitador orbital de temperatura controlada a 215 rpm y 37 °C (98,6 °F). El proceso anterior de extracción, separación y almacenamiento de cada muestra se repitió a los 15 min (min) después de la infusión (T15), 30 min (T30), 60 min (T60), 180 min (T180) y 360 min (T360). Las alícuotas permanecieron en el agitador orbital hasta que se extrajo la última muestra (T360).
Se asignaron dos muestras de control positivo a través del generador de números aleatorios a cada grupo de fármacos (baclofeno, ibuprofeno, brometalina). Los controles positivos contenían una cantidad equivalente del fármaco designado que cada muestra de estudio en su grupo de fármaco designado. Cada testigo positivo se sometió al mismo tratamiento y pruebas que las muestras de prueba sin la adición de ILE. Los controles positivos se utilizaron para identificar la descomposición natural de cada fármaco en la muestra de sangre sin la interferencia de la emulsión lipídica intravenosa.
Se asignaron aleatoriamente dos alícuotas al grupo de control negativo. El grupo de control negativo contenía una cantidad de ILE equivalente a la de las muestras del estudio. Además de la ILE, no se añadieron otros fármacos a las muestras negativas del grupo de control. Por lo demás, la manipulación y el muestreo de las alícuotas eran idénticos a los métodos descritos anteriormente.
2.3 Análisis de muestras
Las muestras se analizaron en el Laboratorio de Investigación Analítica VetMed del Laboratorio de Investigación Analítica de la Facultad de Medicina Veterinaria de Virginia-Maryland utilizando técnicas diseñadas para evaluar la concentración de cada medicamento individual. Se evaluaron las concentraciones de ibuprofeno tanto en la porción pobre en lípidos como en la porción celular de las muestras, ya que se sabe que se acumula en los glóbulos rojos. Todos los demás fármacos se midieron únicamente en la porción pobre en lípidos del suero. Se utilizó cromatografía líquida de ultra alta resolución (UHPLC) con espectrometría de masas en tándem para medir las concentraciones de baclofeno, ibuprofeno y desmetilbrometalina en la porción pobre en lípidos del suero. Las concentraciones de brometalina se determinaron mediante UHPLC con detección ultravioleta. Todas las muestras se ejecutaron por duplicado. En el apéndice 1 se ofrece un informe detallado del análisis de las muestras.
2.4 Análisis estadístico y de datos
Se utilizó un modelo lineal mixto para modelar los efectos del tratamiento a lo largo del tiempo, siendo los efectos fijos el punto de tiempo y el tratamiento. Para tener en cuenta la correlación en el tiempo causada por medidas repetidas, se incluyó una estructura de correlación AR (1) y se permitió que las varianzas cambiaran con el tiempo. Se utilizaron contrastes lineales para comparar las diferencias en el cambio desde un punto de tiempo inicial, 15, entre el tratamiento y el control. Los valores de p de los contrastes no independientes se ajustaron mediante el método de simulación.
3 Resultados
Los valores de tiempo 0 se excluyeron del cálculo debido a al menos un valor atípico (concentración de fármaco anormalmente alta en comparación con el resto de las muestras) en cada grupo de fármacos en T0. Es probable que estos valores atípicos se debieran a una mala distribución inicial del fármaco en la bolsa de sangre canina de muestra. Se encontró que el pH de cada bolsa de sangre entera oscilaba entre 6,95 y 7,12.
3.1 Baclofeno
El control positivo tuvo una concentración media de baclofeno total de 118,3 μg/mL (DE +/−13,20) en T15. Las muestras de ILE pobres en lípidos tuvieron una concentración media total de baclofeno de 109,3 μg/mL (DE +/−7,01) en T15. La reducción de la concentración de baclofeno en las muestras de ILE pobres en lípidos en comparación con las muestras control a lo largo del tiempo no alcanzó significación (p = 1,00).
El cambio en la concentración de baclofeno entre las muestras de control y las muestras de prueba ILE no alcanzó significación con la inclusión de T0 con o sin la exclusión de valores atípicos en este momento. La Tabla 1 y la Figura 1 muestran los cambios en las muestras de baclofeno positivo y pobres en lípidos a lo largo del tiempo.
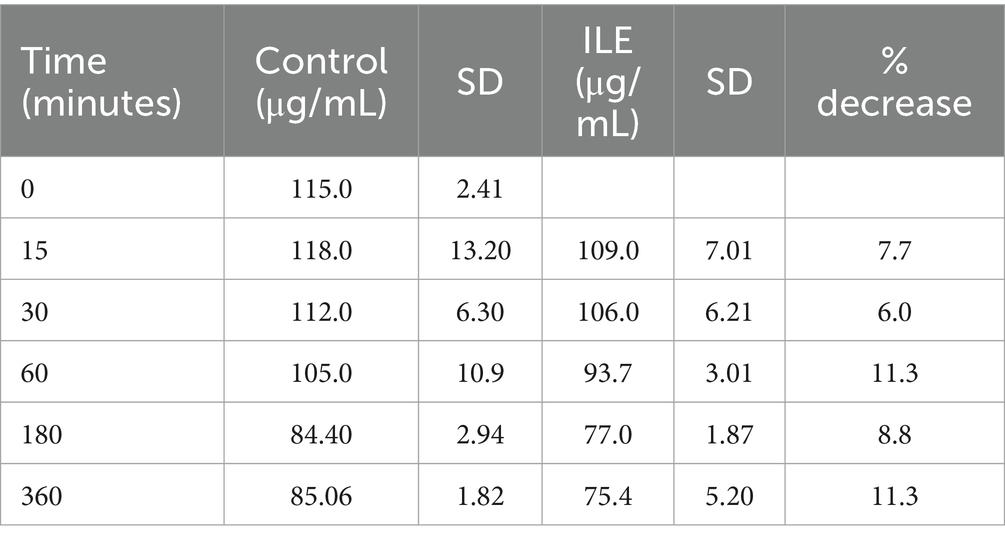
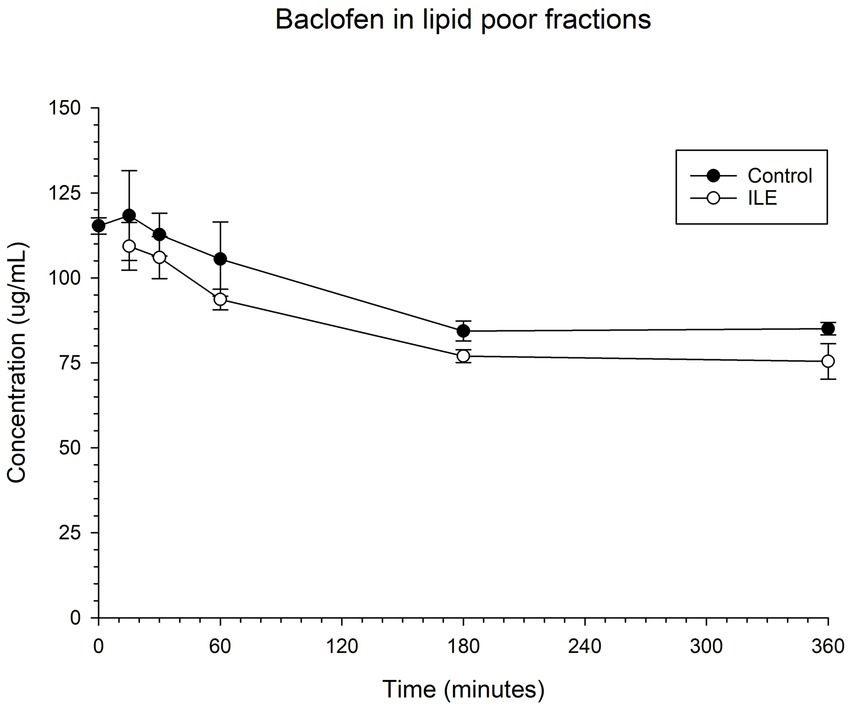
3.2 Ibuprofeno en plasma
El control positivo tuvo una concentración media de ibuprofeno de 1909,75 μg/mL (DE +/−98,99) en T15. Las muestras de plasma ILE pobres en lípidos tuvieron una concentración media de ibuprofeno de 1579,95 μg/mL (DE +/−74,12). La reducción de la concentración de ibuprofeno en las muestras de plasma ILE pobres en lípidos en comparación con las muestras control no alcanzó significación (p = 1,00) en ningún momento. La Tabla 2 y la Figura 2 muestran los cambios en el control positivo y el ibuprofeno en muestras de plasma pobres en lípidos a lo largo del tiempo.
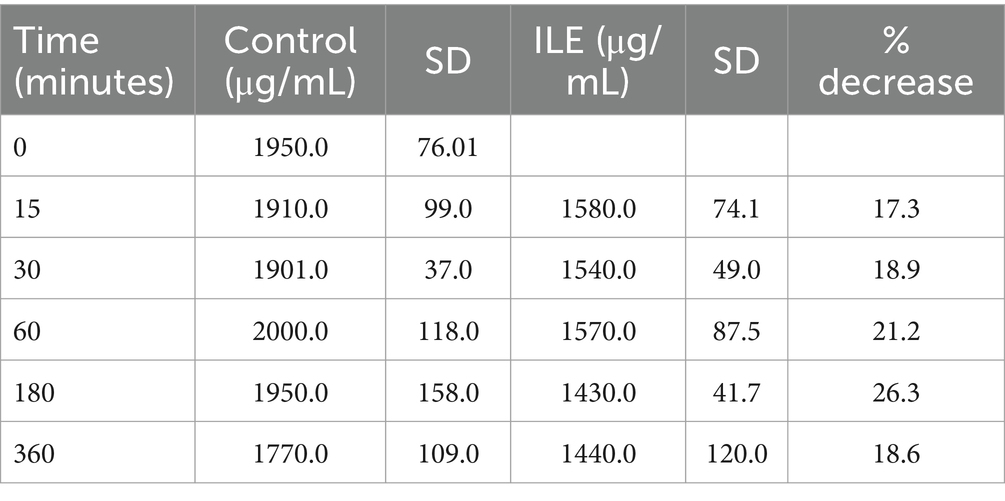
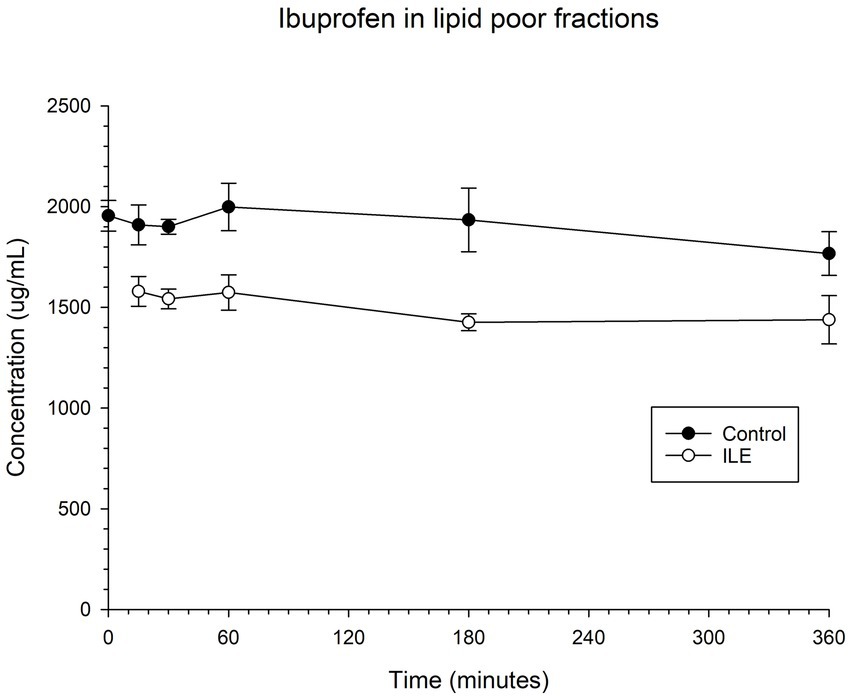
El cambio en la concentración de ibuprofeno en plasma en las muestras de ILE pobres en lípidos y en las muestras de control no alcanzó significación con la inclusión del tiempo 0 con o sin la exclusión de valores atípicos.
3.3 Ibuprofeno en los glóbulos rojos
Los glóbulos rojos del control positivo tenían una concentración media de ibuprofeno de 24,00 μg/mL (DE +/−7,38) en T15. Los glóbulos rojos de las muestras de ILE tenían una concentración media de ibuprofeno de 14,25 μg/mL en T15. El cambio total en la concentración de ibuprofeno en los glóbulos rojos en las muestras de ILE en comparación con las muestras de control no fue significativo (p = 1,00) en ningún momento. La Tabla 3 y la Figura 3 muestran los cambios en el control positivo y el ibuprofeno en muestras de plasma pobres en lípidos a lo largo del tiempo.
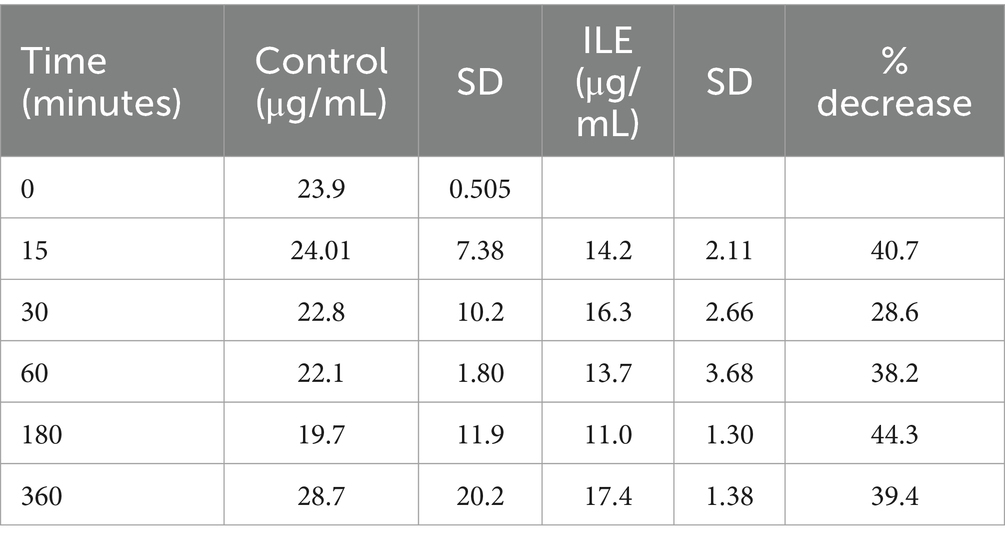
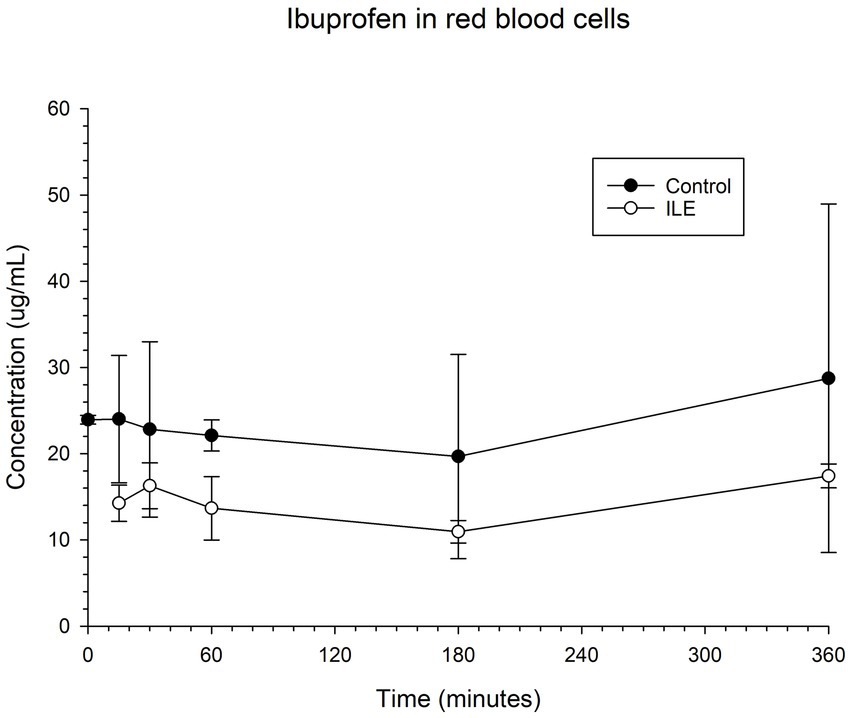
El cambio en la concentración de ibuprofeno en los glóbulos rojos en las muestras de ILE y en las muestras de control no alcanzó significación con la inclusión del tiempo 0 con o sin la exclusión de valores atípicos.
3.4 Brometalina
Las muestras de control positivas tuvieron una concentración media de brometalina total de 10,19 μg/mL (DE +/−0,30) en T15. Las muestras de ILE pobres en lípidos tuvieron una concentración media de 0,93 μg/mL (DE 0,07) en T15. La concentración de brometalina en las muestras de ILE pobres en lípidos fue significativamente diferente de la concentración de brometalina en las muestras de control en todos los puntos temporales (el valor de p más alto = 0,05). En la Tabla 4 y en la Figura 4 se muestran los cambios en las muestras de brometalina de control positivo y pobres en lípidos a lo largo del tiempo.
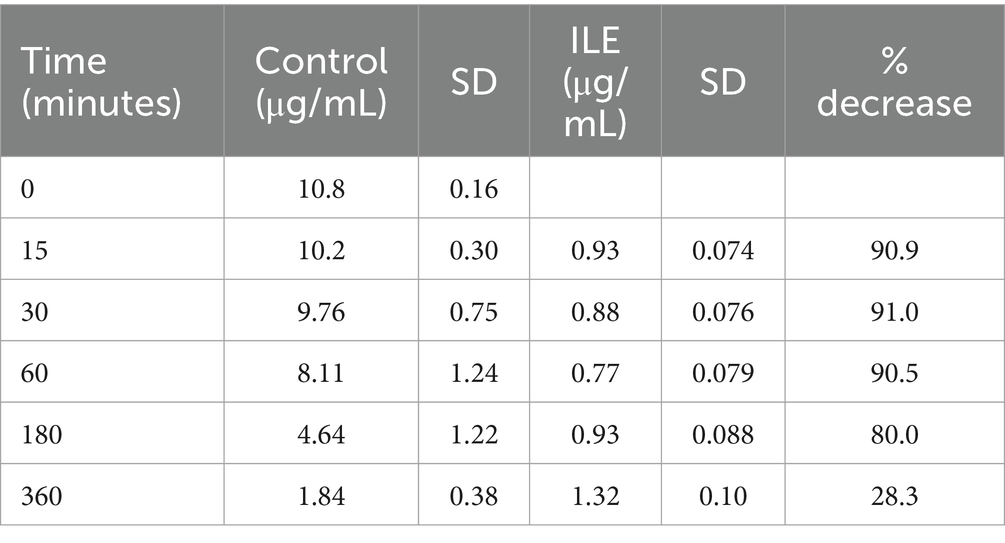
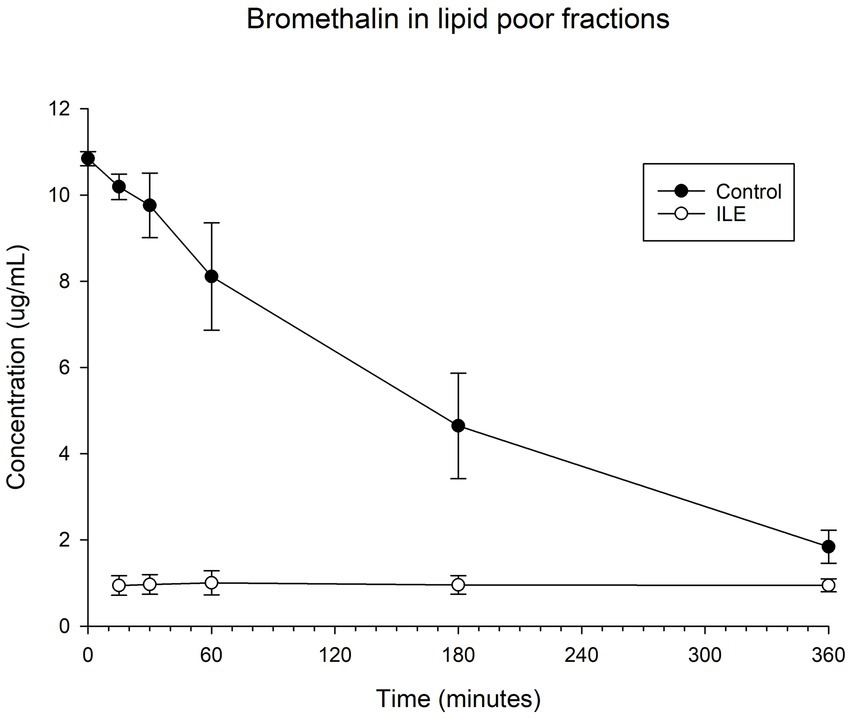
Cuando se incluyeron los valores del tiempo 0, pero se excluyó el único valor atípico en el tiempo 0, hubo una diferencia significativa en la concentración de brometalina entre la muestra de control y la muestra de tratamiento con ILE en todos los puntos temporales, excepto en T360 (p = 0,19).
3.5 Desmetilbrometalina
El control positivo tuvo una concentración media de desmetilbrometalina de 0,41 μg/mL (SD +/−0,02) en T15. La muestra de ILE pobre en lípidos tuvo una concentración media de 0,18 μg/mL (SD+/−0,02), en T15. La reducción de desmetilbrometalina en las muestras de ILE pobres en lípidos en comparación con las muestras de control fue significativa en T30 (p = 0,01) y T360 (p = 0,02). Todos los puntos de tiempo restantes no alcanzaron significación. En la Tabla 5 y en la Figura 5 se muestran los cambios en las muestras de desmetilbrometalina pobres en lípidos y de control positivo a lo largo del tiempo.
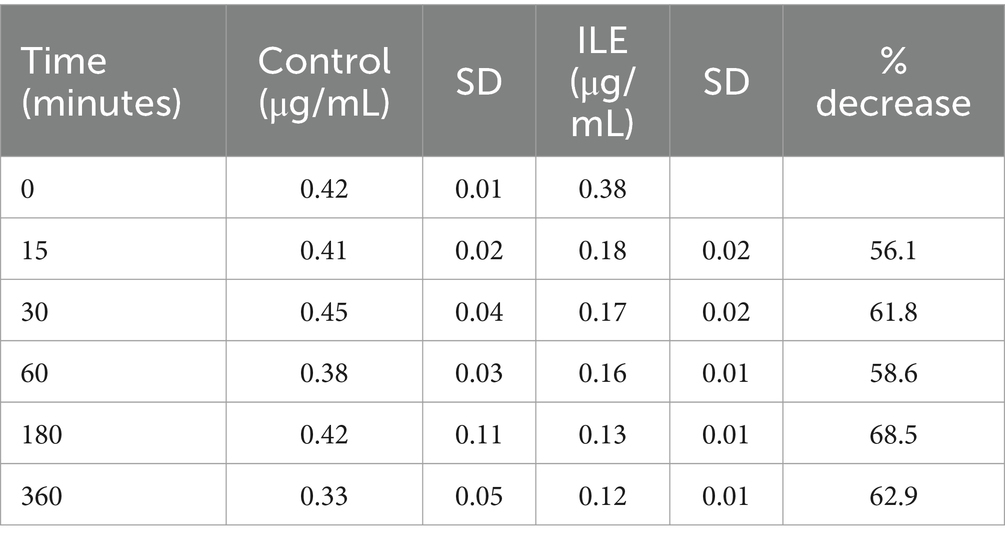
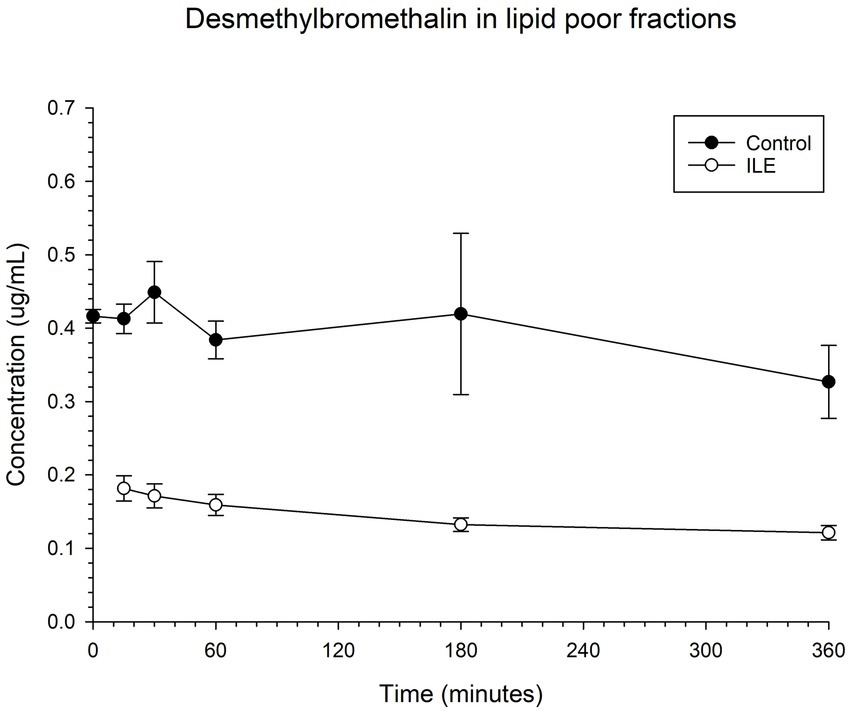
Figura 5. Compara la concentración de desmetilbrometalina en la fracción pobre en lípidos del grupo de tratamiento con brometalina control y en el grupo de tratamiento con brometalina ILE a lo largo del tiempo.
Cuando se incluyen los valores del tiempo 0, pero se excluyó el único valor atípico en el tiempo 0, hubo una diferencia significativa (p = 0,008) en la concentración de desmetilbrometalina entre la muestra de control y la muestra de tratamiento con ILE en todos los puntos temporales, excepto en el punto temporal final T360.
4 Discusión
Este estudio in vitro de un solo compartimento identificó una disminución significativa en la concentración total del fármaco brometalina y su metabolito desmetilbrometalina después de la administración de emulsión lipídica intravenosa (ILE). Las concentraciones de brometalina mostraron una disminución significativa en todos los puntos temporales. La reducción de la concentración de desmetilbrometalina después de la administración de ILE solo se observó significativa a los 30 (T30) y 360 (T360) minutos (6 h) después de la adición de ILE. El resto de los puntos de tiempo para la desmetilbrometalina no alcanzaron significación. No se identificó una disminución significativa en las concentraciones de baclofeno e ibuprofeno después de la adición de ILE.
Nuestro estudio evaluó el potencial de barrido de las emulsiones lipídicas intravenosas en la teoría de la «lanzadera lipídica» mediante la determinación de la reducción de la concentración de tres fármacos después de la infusión de emulsión lipídica intravenosa en sangre total canina a lo largo del tiempo. La «lanzadera lipídica» teoriza que el lípido infundido crea una fase lipídica o partición dentro del plasma. Esta fase lipídica recién creada atrae fármacos lipofílicos, transportando estas toxinas lejos de los tejidos objetivo (cerebro y corazón) y hacia los tejidos que almacenan, metabolizan y/o excretan la toxina (13-16). Los fármacos evaluados en este estudio (baclofeno, ibuprofeno y brometalina) tenían diferentes niveles de lipofilia. El baclofeno tuvo el logP más bajo con un logP de -1,3, que está por debajo del umbral (LogP >1) para la clasificación como fármaco lipofílico (12, 13, 33). Debido al bajo logP del baclofeno, no es sorprendente la falta de una reducción significativa del baclofeno en este estudio. El ibuprofeno se considera un fármaco lipofílico con un logP de 3,97 (13). En el estudio actual, el ibuprofeno no demostró una disminución significativa en la concentración del fármaco con la administración de ILE. Sobre la base de los hallazgos de este estudio, es poco probable que la mejoría informada previamente en los pacientes tratados con ILE por la toxicidad del baclofeno o el ibuprofeno se deba a la «lanzadera lipídica» teórica, pero puede deberse a un mecanismo de acción alternativo. Se necesitan más estudios para determinar qué mecanismos de acción de la terapia con ILE propuestos anteriormente, si los hay, producen la mejoría clínica observada en pacientes con toxicidad por baclofeno e ibuprofeno. La brometalina es la más lipofílica con el mayor log p (7,6) de los fármacos estudiados (13). La reducción de brometalina después de la infusión de ILE apoya la teoría de la «lanzadera lipídica» para este medicamento. Factores más allá de LogP, como el pH, pueden contribuir a los efectos de partición de ILE (15, 34). El coeficiente de reparto octanol-agua dependiente del pH, conocido como LogD, determina la lipofilia de un fármaco a un determinado pH (15, 34). Los cambios en el pH pueden afectar a factores, como la unión a proteínas, alterando la cantidad de fármaco libre disponible para ser eliminado por la lanzadera lipídica (34). Mazoit et al. demostraron que al disminuir el pH de 7,40 a 7,00, la afinidad de la emulsión lipídica con la bupivacaína disminuyó 1,68 veces (35). En una búsqueda bibliográfica que evaluó cada fármaco de tratamiento, faltaba información con respecto al logaritmo D de cada fármaco en sangre almacenada. Se necesitan más investigaciones sobre los efectos del pH en la unión de fármacos en emulsiones lipídicas para dilucidar aún más los efectos del pH (15, 33, 34). No se esperaría que la terapia ILE alterara el pH de la sangre en un animal vivo y, por lo tanto, es posible que no afecte la unión del fármaco a la emulsión lipídica en un modelo in vivo (36). Debido a que LogD depende del pH, a menudo es más difícil de medir (15, 34). La dificultad para medir la LogD debido a la variación del pH ha dado lugar a un uso clínico continuado de la LogP para determinar la lipoholicidad y el probable éxito del tratamiento (15, 34).
Varios informes de casos en medicina humana y veterinaria han informado de un aumento transitorio de las concentraciones de fármacos lipofílicos después del inicio de la terapia con ILE, seguido de una disminución de las concentraciones plasmáticas de fármacos (4, 37-39). Clarke et al. evaluaron la respuesta de un Border Collie con toxicidad por ivermectina a la terapia ILE. Se observó que las concentraciones séricas de ivermectina aumentaron poco después de que se administró un bolo de 1,5 mL/kg de ILE, pero habían disminuido desde el inicio 30 minutos después del inicio de la infusión de tasa constante (IRC) de ILE (37). Se teorizó que el aumento de los niveles séricos de ivermectina tras el inicio de la ILE se debía al secuestro de la toxina de los tejidos a la fase lipídica, lo que apoya la teoría de la «lanzadera lipídica» (37). En este estudio no se encontró un aumento significativo en la concentración plasmática del fármaco después de la infusión de ILE seguido de una disminución en la concentración plasmática del fármaco, ya que este modelo no tenía un compartimento tisular. El hecho de no demostrar este fenómeno puede apoyar la teoría de que los aumentos en las concentraciones plasmáticas de fármacos después de la adición de ILE están relacionados con el secuestro de fármacos del tejido hacia la «lanzadera lipídica».
Se ha publicado una recuperación clínica exitosa de humanos y animales con reducción de las concentraciones plasmáticas de fármacos tras el tratamiento con ILE y la lista de intoxicaciones por fármacos tratadas con ILE está en constante expansión. Esta lista incluye agentes anestésicos locales (bupivacaína), amlodipino, anfetaminas, baclofeno, diltiazem, lactonas macrocíclicas (ivermectina, moxidectina), ibuprofeno, permetrina, marihuana, fenobarbital, betabloqueantes, carbamazepina y brometalina (3, 13, 15, 33). En nuestro estudio in vitro, las concentraciones del fármaco baclofeno no demostraron una reducción significativa con la infusión de la terapia ILE. El tratamiento exitoso de intoxicantes poco lipofílicos como el baclofeno (LogP-1.32), probablemente esté relacionado con otros mecanismos de acción como el apoyo de la presión arterial a través de alteraciones en la señalización del óxido nítrico o efectos cardiotónicos directos (4, 13, 15, 16).
Nuestro estudio encontró que el control positivo para brometalina demostró una disminución constante en la concentración del fármaco a lo largo del tiempo. Esto contrasta con el grupo de tratamiento con brometalina después de la adición de ILE, que demostró una disminución casi inmediata en las concentraciones de brometalina. Es probable que la disminución constante de la brometalina en la muestra de control positivo se deba a la descomposición natural y/o al desarrollo de productos de degradación (40). Se ha observado previamente que la brometalina tiene una rápida fotodegradación (27, 40). Lehner et al. encontraron que la brometalina tiene la capacidad de degradarse en hasta 20 productos de degradación (40). A diferencia de la brometalina, se ha encontrado previamente que la desmetilbrometalina sufre una fotodegradación mínima (27). Si bien la fotodegradación y la descomposición/conversión natural a desmetilbrometalina pueden haber afectado las concentraciones de brometalina, la disminución significativa de la brometalina después de la introducción de ILE en comparación con el control positivo apoya el mecanismo de acción de la «lanzadera lipídica».
Se encontró que la desmetilbrometalina, el metabolito activo de la brometalina, tenía una disminución significativa en la concentración en comparación con el control positivo a los 30 y 360 min después de la infusión de ILE. Las concentraciones de desmetilbrometalina disminuyeron en todos los puntos temporales en comparación con el punto temporal, pero no alcanzaron una significación en todos los puntos temporales. La presencia de desmetilbrometalina en las muestras evaluadas en este estudio sugiere que la brometalina se convirtió en desmetilbrometalina en las bolsas de sangre o estaba presente en la formulación del fármaco infundida en las bolsas de sangre. En el modelo animal vivo, la brometalina es n-desmetilada en el hígado por el citocromo p450 para formar desmetilbrometalina (27). La brometalina y la desmetilbrometalina reducen la producción de ATP a través del desacoplamiento de la fosforilación oxidativa mitocondrial y la interrupción de las bombas de canales de iones de sodio y potasio dependientes de ATP, lo que conduce a un edema cerebral (27, 40). Los autores especulan que en el modelo vivo habría una mayor conversión de brometalina en desmetilbromthalina debido al metabolismo hepático, lo que puede aumentar la unión y, por lo tanto, los efectos beneficiosos de la terapia ILE en el paciente intoxicado por brometalina.
Las concentraciones séricas de baclofeno e ibuprofeno no cambiaron significativamente después de la adición de ILE en comparación con el control positivo. El éxito histórico del uso de la ILE para las intoxicaciones por baclofeno e ibuprofeno en medicina veterinaria se ha documentado en varios informes de casos y series de casos (5, 8-10, 41). Sin embargo, la falta de mejora en la concentración de toxinas en este estudio apoya la existencia de mecanismos alternativos de acción de la ILE. Los mecanismos de acción alternativos propuestos incluyen interacciones electrostáticas, apoyo a la presión arterial a través de alteraciones en la señalización del óxido nítrico, efectos cardiotónicos directos y efectos posteriores al acondicionamiento que minimizan la lesión por reperfusión (15, 16, 34). Si el tratamiento exitoso de estas toxinas está relacionado con las interacciones electrostáticas y, por lo tanto, con LogD, en lugar de LogP, el pH relativamente bajo de la sangre entera almacenada podría haber afectado la lipofilia de baclofeno e ibuprofeno, dificultando la unión de la toxina a la reserva de lípidos.
El fármaco activo libre (proteína plasmática no unida) o no unido es responsable de la toxicidad dentro del cuerpo. De los fármacos estudiados aquí, la unión a proteínas plasmáticas de baclofeno es baja (aproximadamente 30%) y la unión a proteínas de ibuprofeno es alta (90-99%) (42, 43). No se ha informado de la unión a proteínas de la brometalina y la desmtilbrometalina. Sobre la base de esto, la concentración del fármaco libre de baclofeno no se vería afectada significativamente por la terapia ILE, mientras que la respuesta menor de lo esperado del ibuprofeno a la terapia ILE puede indicar una preferencia del fármaco por unirse a la proteína, en lugar de a los lípidos. Es necesario seguir trabajando para determinar el porcentaje de fármaco libre de brometalina y su metabolito con el fin de aplicar ese conocimiento a los resultados de este estudio.
Tras la evaluación de los conjuntos de datos de cada fármaco, se observó que cada fármaco tenía al menos una muestra con una concentración de fármaco significativamente mayor que las otras muestras del grupo de tratamiento en el momento cero. No se observó que ninguna de las muestras de control tuviera una variación significativa entre muestras individuales en el mismo momento. Debido a la presencia de al menos un valor atípico en cada grupo de tratamiento farmacológico en el tiempo cero, los datos de este grupo de tiempo se excluyeron del análisis estadístico. No se observaron valores atípicos significativos en ningún otro momento. Se cree que las concentraciones anormalmente altas del fármaco en los grupos de tiempo cero se deben a una mala mezcla antes de la toma de muestras o a la continuación de los residuos del fármaco en el puerto de muestreo.
La terapia ILE fue sugerida por primera vez como efectiva en el tratamiento de la intoxicación por bupivacaína en 1998 por Weinberg et al. y se documentó en el primer informe de caso humano en 2006 (17, 44). Desde el descubrimiento de los beneficios de la terapia ILE para la intoxicación por drogas, la terapia ILE se ha utilizado tanto en medicina humana como veterinaria para pacientes que experimentan intoxicación por drogas lipofílicas y poco lipofílicas (13, 15, 16, 32). La literatura está dominada por informes de casos, series de casos y artículos de revisión sobre la utilidad de la ILE, los mecanismos de acción propuestos, así como las complicaciones asociadas con la administración de ILE (13, 15, 16, 34). Sin embargo, aún se justifica la investigación sobre los mecanismos de acción, los protocolos de tratamiento adecuados y los posibles efectos adversos. Los mecanismos de acción de la ILE no parecen ser selectivos y las cualidades diana que comparten muchos fármacos y toxinas (4, 13). Debido a los diversos mecanismos de acción propuestos, el tratamiento con ILE podría revertir terapias cruciales utilizadas para estabilizar a los pacientes que experimentan una toxicidad (4, 13). El posible efecto de reversión de estas terapias debe considerarse antes de utilizar la terapia ILE con fármacos que son altamente lipofílicos (4, 13).
Sobre la base de los informes de casos, la terapia ILE es ampliamente aceptada como tratamiento para algunas intoxicaciones por drogas y, por lo general, es bien tolerada en la población veterinaria (4). Los protocolos terapéuticos recomendados son extrapolables de la medicina humana (3, 4, 13, 32). Las recomendaciones generales para el tratamiento con ILE en medicina veterinaria son utilizar formulaciones de emulsión lipídica al 20% y administrar un bolo de 1,5-4 mL/kg durante 1-15 min, seguido de un CRI de 0,25-0,5 mL/kg/min durante 30-120 min (3, 4, 12). A la espera de respuesta a este tratamiento, se puede repetir este protocolo. Sin embargo, la dosis diaria total de ILE no debe exceder los 10 mL/kg/d (13).
Los efectos adversos asociados con la administración de la terapia ILE en humanos y animales incluyen lipemia, pancreatitis, hemólisis, sobrecarga de volumen, prurito facial, reacciones de hipersensibilidad, infección asociada con la contaminación del producto ILE y dolor asociado con la extravasación de ILE (3, 4, 16, 34). Se ha informado que los pacientes humanos intoxicados con medicamentos que tienen un gran volumen de distribución experimentan un «efecto rebote» después de que se ha completado la terapia ILE (4, 45). El «efecto rebote» ocurre cuando el lípido se elimina más rápidamente que un medicamento o una toxina, lo que resulta en una recurrencia de signos clínicos de toxicidad (4, 45). En las personas, la ILE también se ha asociado con complicaciones neurológicas, lesión renal aguda, síndrome de dificultad respiratoria aguda, síndrome de sobrecarga grasa y embolia cardíaca (4, 16, 34). Todos los pacientes que reciben tratamiento con ILE deben ser monitoreados de cerca hasta que la lipemia macroscópica se haya resuelto (13, 34). Si se observan complicaciones durante una perfusión de ILE, se debe interrumpir la perfusión.
Todas las muestras, excepto los controles positivos, recogidas en este estudio en T15 y cada punto de tiempo después de demostrar evidencia de lipemia macroscópica. La hemólisis macroscópica estuvo presente en todas las muestras de ibuprofeno y brometalina. Hubo algún nivel de hemólisis en todas las muestras de baclofeno, excepto en las muestras de control positivo y T0. La lipemia fue más significativa en la muestra de control negativo. Se ha reportado que la terapia ILE causa lipema y hemólisis en pacientes (4, 13, 34). Debido a la presencia de hemólisis en el control positivo y en las muestras T0, la terapia ILE no puede ser la única causa de hemólisis en el estudio realizado aquí. Otras posibles causas de hemólisis incluyen el daño manual a los glóbulos rojos causado por la ultracentrifugación o una reacción a las toxinas infundidas individuales.
4.1 Limitaciones
Como estudio de un solo compartimento, este estudio no evaluó otros mecanismos de acción propuestos más allá de la teoría de la lanzadera lipídica. Este estudio tampoco pudo evaluar la redistribución de la toxina que se ha propuesto en la teoría de la lanzadera lipídica. Los estudios in vivo que comparan los hallazgos con una población de control podrían ayudar a evaluar más a fondo los mecanismos de acción, el régimen de dosificación adecuado y los efectos adversos esperados. Debido al éxito reportado en los informes de casos y series, es probable que mecanismos de acción alternativos desempeñen un papel en la recuperación de pacientes con intoxicación por baclofeno, ibuprofeno y brometalina.
Los hallazgos de este estudio in vitro de un solo compartimento respaldan el mecanismo de acción teórico de la terapia ILE en las intoxicaciones por brometalina. No se identificó una disminución significativa en las concentraciones de baclofeno e ibuprofeno después de la adición de ILE. Se necesitan más estudios para dilucidar los beneficios de la terapia ILE para los pacientes caninos que sufren intoxicación con baclofeno e ibuprofeno.
Declaración de disponibilidad de datos
Los datos brutos que respaldan las conclusiones de este artículo serán puestos a disposición por los autores, sin reservas indebidas.
Declaración ética
No se requirió aprobación ética para los estudios en animales de acuerdo con la legislación local y los requisitos institucionales, ya que solo se utilizaron líneas celulares establecidas disponibles comercialmente.
Contribuciones de los autores
EJ: Curación de datos, Análisis formal, Obtención de fondos, Investigación, Metodología, Recursos, Validación, Visualización, Redacción – borrador original, Redacción – revisión y edición. SW: Conceptualización, Obtención de fondos, Investigación, Metodología, Administración de proyectos, Supervisión, Validación, Visualización, Redacción – revisión y edición. JD: Curación de datos, Análisis formal, Investigación, Supervisión, Redacción, revisión y edición. MC-T: Curación de datos, Análisis formal, Redacción – revisión y edición.
Financiación
El/los autor/es declara(n) no haber recibido apoyo financiero para la investigación, autoría y/o publicación de este artículo.
Reconocimientos
Agradecemos a James Colee, del Instituto de Ciencias Agrícolas y Alimentarias de la Unidad de Consultoría Estadística de la Universidad de Florida, por el análisis estadístico.
Conflicto de intereses
Los autores declaran que la investigación se llevó a cabo en ausencia de relaciones comerciales o financieras que pudieran interpretarse como un posible conflicto de intereses.
Nota del editor
Todas las afirmaciones expresadas en este artículo son únicamente las de los autores y no representan necesariamente las de sus organizaciones afiliadas, ni las del editor, los editores y los revisores. Cualquier producto que pueda ser evaluado en este artículo, o afirmación que pueda hacer su fabricante, no está garantizado ni respaldado por el editor.
Material complementario
El material complementario para este artículo se puede encontrar en línea en: https://www.frontiersin.org/articles/10.3389/fvets.2024.1482871/full#supplementary-material
Referencias
1. Las 10 principales toxinas para mascotas de 2023 [Internet]. ASPCApro. ASPCA Profesional; 2024 [citado 13 de marzo de 2024]. (2024). Disponible en: https://www.aspcapro.org/resource/top-10-pet-toxins-2023
2. McLean, MK, y Hansen, SR. Una visión general de las tendencias en los casos de envenenamiento de animales en los Estados Unidos: 2002-2010. Veterinario Clin North Am-Pequeño Anim Pract. (2012) 42:219–28. doi: 10.1016/j.cvsm.2011.12.009
Resumen de PubMed | Texto completo de Crossref | Google Académico
3. Gwaltney-Brant, S, y Meadows, I. Uso de emulsiones lipídicas intravenosas para el tratamiento de ciertos casos de envenenamiento en animales pequeños. Veterinario Clin North Am-Pequeño Anim Pract. (2012) 42:251–62. doi: 10.1016/j.cvsm.2011.12.001
Resumen de PubMed | Texto completo de Crossref | Google Académico
4. Robben, JH, y Dijkman, MA. Terapia lipídica para intoxicaciones. Vet Clin North Am – Pequeña Anim Pract. (2017) 47:435–50. doi: 10.1016/j.cvsm.2016.10.018
5. Dr. Becker y Young, Columbia Británica. Tratamiento de intoxicaciones lipofílicas graves con emulsión lipídica intravenosa: una serie de casos (2011-2014). Veterinario Med. (2017) 8:77–85. doi: 10.2147/VMRR. S129576
6. Crandell, DE, y Weinberg, GL. Toxicosis por moxidectina en un cachorro tratado con éxito con lípidos intravenosos. J Vet Emerg Crit Care. (2009) 19:181–6. doi: 10.1111/j.1476-4431.2009.00402.x
Resumen de PubMed | Texto completo de Crossref | Google Académico
7. Cortinovis, C, Pizzo, F, y Caloni, F. Envenenamiento de perros y gatos por medicamentos destinados al uso humano. Veterinario J. (2015) 203:52–8. doi: 10.1016/j.tvjl.2014.11.004
Resumen de PubMed | Texto completo de Crossref | Google Académico
8. Bates, N, Chatterton, J, Robbins, C, Wells, K, Hughes, J, Stone, M, et al. Infusión de lípidos en el manejo de la intoxicación: reporte de 6 casos caninos. Rec. Veterinario. (2013) 172:339. doi: 10.1136/vr.101036
Resumen de PubMed | Texto completo de Crossref | Google Académico
9. Bolfer, L, McMichael, M, Ngwenyama, TR, y O’Brien, MA. Tratamiento de la toxicosis por ibuprofeno en un perro con emulsión lipídica intravenosa. J am anim hosp assoc. (2014) 50:136–40. doi: 10.5326/JAAHA-MS-5979
Resumen de PubMed | Texto completo de Crossref | Google Académico
10. Butler, J. Tratamiento exitoso de la sobredosis de baclofeno con emulsión lipídica intravenosa. Veterinario Med. (2014) 109:6–12.
11. Cao, D, Heard, K, Foran, M y Koyfman, A. Emulsión lipídica intravenosa en el servicio de urgencias: una revisión sistemática de la literatura reciente. J Emerg Med. (2015) 48:387–97. doi: 10.1016/j.jemermed.2014.10.009
12. Fernández, AL, Lee, JA, Rahilly, L, Hovda, L, Brutlag, AG, y Engebretsen, K. El uso de emulsión lipídica intravenosa como antídoto en toxicología veterinaria. J Vet Emerg Crit Care. (2011) 21:309–20. doi: 10.1111/j.1476-4431.2011.00657.x
13. Gwaltney-Brant, S y Meadows, I. Emulsiones lipídicas intravenosas en toxicología clínica veterinaria. Veterinario Clin North Am Pequeño Anim Pr. (2018) 48:933–42. doi: 10.1016/j.cvsm.2018.07.006
14. Fettiplace, MR y Weinberg, G. Pasado, presente y futuro de la terapia de reanimación lipídica. J Parenter Enter Nutr. (2015) 39:72S–83S. doi: 10.1177/0148607115595979
Resumen de PubMed | Texto completo de Crossref | Google Académico
15. Fettiplace, MR, y Weinberg, G. Los mecanismos que subyacen a la terapia de reanimación lipídica. Reg Anesth Medicina para el dolor. (2018) 43:138–49. doi: 10.1097/AAP.0000000000000719
Resumen de PubMed | Texto completo de Crossref | Google Académico
16. Liu, Y, Zhang, J, Yu, P, Niu, J y Yu, S. Mecanismos y eficacia del tratamiento con emulsión lipídica intravenosa para la toxicidad sistémica de los anestésicos locales. Frente Med. (2021) 8:756866. doi: 10.3389/fmed.2021.756866
Resumen de PubMed | Texto completo de Crossref | Google Académico
17. Weinberg, GL, VadeBoncouer, T, Ramaraju, GA, García-Amaro, MF, y Cwik, MJ. El pretratamiento o la reanimación con una infusión de lípidos cambia la dosis-respuesta a la asistolia inducida por bupivacaína en ratas. Anestesiología. (1998) 88:1071–5. doi: 10.1097/00000542-199804000-00028
18. Weinberg, G, Ripper, R, Feinstein, DL y Hoffman, W. La infusión de emulsión lipídica rescata a los perros de la toxicidad cardíaca inducida por la bupivacaína. Reg Anesth Medicina para el dolor. (2003) 28:198–202. doi: 10.1097/00115550-200305000-00005
Resumen de PubMed | Texto completo de Crossref | Google Académico
19. Lyons, BM, Poppenga, RH, Thawley, VJ y Waddell, LS. Manejo exitoso de la toxicosis grave por brometalina en un perro. J am anim hosp assoc. (2019) 55:E55502. doi: 10.5326/JAAHA-MS-6921
Resumen de PubMed | Texto completo de Crossref | Google Académico
20. Chalifoux, NV, Butty, EM, Mauro, KD, Moyle, RB, Ehrhardt, CM, Robertson, JB, et al. Resultados de 434 perros con toxicosis por fármacos antiinflamatorios no esteroideos tratados con fluidoterapia, emulsión lipídica o intercambio terapéutico de plasma. J Veterinario Pasante Med. (2023) 37:161–72. doi: 10.1111/jvim.16603
Resumen de PubMed | Texto completo de Crossref | Google Académico
21. Wismer, T, y Volmer, Pensilvania. Sobredosis de baclofeno en perros. Veterinario Med. (2004) 99:406–410.
22. Khorzad, R, Lee, J, Whelan, M, Brutlag, AG, Martin, EP, Miyahara, LT, et al. Toxicosis por baclofeno en perros y gatos: 145 casos (2004-2010). J am vet med assoc. (2012) 241:1059–64. doi: 10.2460/javma.241.8.1059
Resumen de PubMed | Texto completo de Crossref | Google Académico
23. Dunayer, E. Toxicosis por ibuprofeno en perros, gatos y hurones. Veterinario Med. (2004) 99:580–6.
24. Khan, SA, y McLean, MK. Toxicología de los medicamentos antiinflamatorios no esteroideos que se encuentran con frecuencia en perros y gatos. Vet Clin North Am Pequeño Anim Pract. (2012) 42:289–306. doi: 10.1016/j.cvsm.2012.01.003
25. Walton, S, Ryan, KA, Davis, JL y Acierno, M. Tratamiento de la intoxicación por ibuprofeno en un perro mediante intercambio de plasma terapéutico. J Vet Emerg Crit Care. (2017) 27:451–7. doi: 10.1111/vec.12608
26. DeClementi, C, y Sobczak, BR. Toxicosis de rodenticidas comunes en animales pequeños. Vet Clin North Am Pequeño Anim Pract. (2012) 42:349–60. doi: 10.1016/j.cvsm.2011.12.008
Resumen de PubMed | Texto completo de Crossref | Google Académico
27. Dorman, DC, Harlin, KA, Buck, WB y Simon, J. Diagnóstico de la toxicosis por brometalina en el perro. J Vet Diagnóstico Investig. (1990) 2:123–8. doi: 10.1177/104063879000200208
Resumen de PubMed | Texto completo de Crossref | Google Académico
29. Clark, LA, Beyer, J y Graudins, A. Análisis in vitro de los efectos de la emulsión lipídica intravenosa sobre las concentraciones de anestésico local libre y total en sangre y plasma humanos. Crit Care Res Pract. (2014) 2014:1–7. doi: 10.1155/2014/236520
Resumen de PubMed | Texto completo de Crossref | Google Académico
30. Rothschild, L, Bern, S, Oswald, S y Weinberg, G. Emulsión lipídica intravenosa en toxicología clínica (2010) 18: 51-8. doi: 10.1186/1757-7241-18-51,
31. Ozcan, MS, y Weinberg, G. Emulsión lipídica intravenosa para el tratamiento de la toxicidad de medicamentos. J Medicina de Cuidados Intensivos. (2014) 29:59–70. doi: 10.1177/0885066612445978
32. Kaplan, A, y Whelan, M. El uso de emulsión lipídica intravenosa para toxicidades de fármacos lipofílicos. J am anim hosp assoc. (2012) 48:221–7. doi: 10.5326/JAAHA-MS-5761
Resumen de PubMed | Texto completo de Crossref | Google Académico
33. French, D, Smollin, C, Ruan, W, Wong, A, Drasner, K, y Wu, AHB. Constante de partición y volumen de distribución como predictores de la eficacia clínica del rescate lipídico para emergencias toxicológicas. Clin Toxicol. (2011) 49:801–9. doi: 10.3109/15563650.2011.617308
Resumen de PubMed | Texto completo de Crossref | Google Académico
34. Jaffal, K, Chevillard, L, y Mégarbane, B. Emulsión lipídica para tratar intoxicaciones agudas: mecanismos de acción, indicaciones y controversias. Farmacia. (2023) 15:1396. doi: 10.3390/pharmaceutics15051396
Resumen de PubMed | Texto completo de Crossref | Google Académico
35. Mazoit, J-X, Le Guen, R, Beloeil, H y Benhamou, D. Unión de anestésicos locales de larga duración a emulsiones lipídicas. Anestesiología. (2009) 110:380–6. doi: 10.1097/ALN.0b013e318194b252
36. Hayes, BD, Gosselin, S, Calello, DP, Nacca, N, Rollins, CJ, Abourbih, D, et al. Revisión sistemática de los eventos clínicos adversos informados después de la administración de emulsión lipídica intravenosa aguda. Clin Toxicol. (2016) 54:365–404. doi: 10.3109/15563650.2016.1151528
Resumen de PubMed | Texto completo de Crossref | Google Académico
37. Clarke, DL, Lee, JA, Murphy, LA, y Reineke, EL. Uso de emulsión lipídica intravenosa para tratar la toxicosis por ivermectina en un border collie. J am vet med assoc. (2011) 239:1328–33. doi: 10.2460/javma.239.10.1328
38. Bruenisholz, H, Kupper, J, Muentener, CR, Dally, A, Kraemer, T, Naegeli, H, et al. Tratamiento de la sobredosis de ivermectina en un poni miniatura de las Shetland mediante la administración intravenosa de una emulsión lipídica. J Veterinario Pasante Med. (2012) 26:407–11. doi: 10.1111/j.1939-1676.2011.00865.x
Resumen de PubMed | Texto completo de Crossref | Google Académico
39. Sirianni, AJ, Osterhoudt, KC, Calello, DP, Muller, AA, Waterhouse, MR, Goodkin, MB, et al. Uso de emulsión lipídica en la reanimación de un paciente con colapso cardiovascular prolongado tras sobredosis de bupropión y lamotrigina. Ann Emerg Med. (2008) 51:412–5. doi: 10.1016/j.annemergmed.2007.06.004
Resumen de PubMed | Texto completo de Crossref | Google Académico
40. Lehner, A, Bokhart, M, Johnson, M, y Buchweitz, J. Caracterización de la brometalina y sus productos de degradación en muestras de toxicología veterinaria por GC-MS-MS. J Toxicol Anal. (2019) 43:112–25. doi: 10.1093/jat/bky072
41. Fox, CM y Daly, ML. Tratamiento exitoso de la toxicosis grave por baclofeno inicialmente refractaria al tratamiento convencional. Clin Case Rep. (2017) 5:44–50. DOI: 10.1002/CCR3.736
Resumen de PubMed | Texto completo de Crossref | Google Académico
42. Rumack, BH. (Eds.). Aspirina (tratamientos toxicológicos). Sistema Poisindex Vol 100. Englewood (CO): Micromedex. Caduca el 9/2000.
43. Ibuprofeno. Información sobre medicamentos AHFS 2001. Sociedad Americana de Farmacéuticos del Sistema de Salud: Bethesda, MD. (2001). págs. 1917-1923.
44. Rosenblatt, MA, Abel, M, Fischer, GW, Itzkovich, CJ, y Eisenkraft, JB. Uso exitoso de una emulsión lipídica al 20% para reanimar a un paciente después de un presunto paro cardíaco relacionado con la bupivacaína. Anestesiología. (2006) 105:217–8. doi: 10.1097/00000542-200607000-00033
Resumen de PubMed | Texto completo de Crossref | Google Académico
45. Marwick, PC, Levin, AI y Coetzee, AR. Recurrencia de la cardiotoxicidad después del rescate de lípidos de un paro cardíaco inducido por bupivacaína. Anesth Analg. (2009) 108:1344–6. doi: 10.1213/ane.0b013e3181979e17
Resumen de PubMed | Texto completo de Crossref | Google Académico
Palabras clave: emulsión lipídica intravenosa, baclofeno, brometalina, ibuprofeno, toxicosis
Cita: Jones E, Walton SA, Davis J y Council-Troche M (2024) Una evaluación in vitro de la emulsión lipídica intravenosa sobre tres tóxicos caninos comunes. Frente. Vet. Sci. 11:1482871. doi: 10.3389/fvets.2024.1482871
Recibido: 18 de agosto de 2024; Aceptado: 10 de septiembre de 2024;
Publicado: 25 de septiembre de 2024.
Editado por:
Nora Mestorino, Universidad Nacional de La Plata, Argentina
Revisado por:
Hongxu Du, Universidad del Suroeste, China
William Ravis, Universidad de Auburn, Estados Unidos
Derechos de autor © 2024 Jones, Walton, Davis y Council-Troche. Este es un artículo de acceso abierto distribuido bajo los términos de la Licencia Creative Commons Atribución (CC BY).
*Correspondencia: Emery Jones, Ejones@dvms.vet
Renuncia: Todas las afirmaciones expresadas en este artículo son únicamente las de los autores y no representan necesariamente a las de sus organizaciones afiliadas, o las del editor, de los editores y de los revisores. Cualquier producto que puede ser evaluada en este artículo o afirmación que puede ser hecha por su El fabricante no está garantizado ni respaldado por el editor.
Date de alta y recibe nuestro 👉🏼 Diario Digital AXÓN INFORMAVET ONE HEALTH
Date de alta y recibe nuestro 👉🏼 Boletín Digital de Foro Agro Ganadero
Noticias animales de compañía
Noticias animales de producción
Trabajos técnicos animales de producción
Trabajos técnicos animales de compañía

