Una vacuna de subunidades basada en P97R1, P46, P42 y P65 de Mycoplasma hyopneumoniae
 Yintao He1,2†
Yintao He1,2† Kaiyuan Xie1,2†
Kaiyuan Xie1,2† Zhongmao Yuan1,2
Zhongmao Yuan1,2 Ting Ouyang1,2
Ting Ouyang1,2 Anran Dong1,2
Anran Dong1,2 Bing Ling1,2
Bing Ling1,2 Weijun Zeng1,2
Weijun Zeng1,2 Yiqi Colmillo1,2
Yiqi Colmillo1,2 Canción de Yiwan1,2
Canción de Yiwan1,2 Lianxiang Wang3
Lianxiang Wang3 Hongxing Ding1,2
Hongxing Ding1,2 Mingqiu Zhao1,2
Mingqiu Zhao1,2 Ventilador Shuangqi1,2
Ventilador Shuangqi1,2 Lin Yi1,2
Lin Yi1,2 Dongfang Zhao1,3,4*‡
Dongfang Zhao1,3,4*‡ Jinding Chen1,2*‡
Jinding Chen1,2*‡- 1Facultad de Medicina Veterinaria, Universidad Agrícola del Sur de China, Guangzhou, China
- número arábigoLaboratorio clave de prevención y control de zoonosis de la provincia de Guangdong, Universidad Agrícola del Sur de China, Guangzhou, China
- 3Academia del Grupo Wen, Wen’s Foodstuffs Group Co., Ltd., Xinxing, China
- 4Sucursal de Yunfu, Laboratorio de Guangdong para la Agricultura Moderna de Lingnan, Guangzhou, China
La neumonía por Mycoplasma (MPS), causada por Mycoplasma hyopneumoniae (Mhp), es una enfermedad respiratoria crónica transmitida por el aire que representa una amenaza significativa para la industria porcina mundial. Las proteínas P97 y P46 son los principales antígenos de Mhp, y la región R1 de P97 posee plena capacidad adhesiva. Los estudios han demostrado que las principales regiones antigénicas de las proteínas Mhp P42 y P65 exhiben una fuerte inmunogenicidad. En este estudio, primero vinculamos los genes que codifican las proteínas P97R1 y P46 para formar el gen P97R1P65 y posteriormente construimos tres plásmidos lanzadera: pFBD-P97R1P46, pFBD-P97R1P46-p65 y pFBD-P65-P42. Estas proteínas se expresaron utilizando el sistema Bac a Bac y se formularon en vacunas de subunidades para la inmunización en ratones. Los experimentos con ratones indicaron que la combinación de proteínas P97R1P46 + P65-P42 provocó niveles más altos de anticuerpos específicos, IL-2, IL-4 y células T CD8+ en comparación con otros grupos de vacunas de subunidades, un hallazgo validado aún más en experimentos posteriores de protección contra el desafío con ratones. Por lo tanto, utilizamos el sistema de expresión MultiBac para coexpresar las proteínas P97R1P46, P65 y P42 en el vector pFastMultibacDual para experimentos de inmunización en lechones. Los experimentos de inmunización de lechones demostraron que la vacuna de subunidad Mhp preparada en este estudio podría inducir anticuerpos específicos contra Mhp, con la combinación de proteínas P97R1P46, P65 y P42 induciendo el nivel más alto de inmunidad humoral. Este estudio proporciona información valiosa para el desarrollo de vacunas de subunidades Mhp.
1 Introducción
Mycoplasma hyopneumoniae (Mhp) es el organismo procariota más pequeño que se encuentra en la naturaleza, con un diámetro de aproximadamente 0,2 a 0,8 μm. Su estructura es simple y consta solo de un núcleo celular, ribosomas y una membrana celular. Debido a la falta de paredes celulares, a menudo exhiben pleomorfismo. Mhp pertenece a la clase Mollicutes y al género Mycoplasma (1). En comparación con otros tipos de organismos procariotas, el genoma de Mhp es relativamente pequeño, oscilando entre 850 y 980 kb. Cada tipo diferente de Mhp contiene entre 528 y 691 genes que codifican proteínas. Entre estos genes, solo alrededor del 20% se utilizan para codificar proteínas de membrana. Sin embargo, la función de la mayoría de estas proteínas de membrana sigue sin estar clara (2). Las cepas virulentas de Mhp poseen un fragmento de RABD (secuencia arbitraria repetida de ADN) de aproximadamente 5.000 pb más que las cepas avirulentas. Las cepas virulentas son capaces de inducir lesiones pulmonares más graves en los animales afectados (3, 4).
En la actualidad, la prevención y el control de la Mhp se basan principalmente en la vacunación y en la mejora de las prácticas de manejo del ganado. La vacunación ayuda a aliviar los síntomas clínicos y las lesiones pulmonares en animales afectados por Mhp (5-7). La adhesión y colonización del huésped por Mhp son pasos críticos en el proceso patogénico. La proteína P97 desempeña un papel importante en el proceso de adhesión de Mhp y exhibe una fuerte inmunogenicidad, lo que la convierte en una proteína candidata comúnmente utilizada para nuevas vacunas de subunidades. Entre sus dominios, la región R1 sirve como el principal grupo de determinantes antigénicos (8, 9). P46 y P65 se encuentran actualmente entre las proteínas de membrana más estudiadas, demostrando potencial como candidatas a vacunas de subunidades (10-14). P42 es una proteína de choque térmico de Mhp, capaz de expresarse significativamente en condiciones de estrés. Los estudios han demostrado que los anticuerpos específicos contra P42 pueden inhibir el crecimiento de Mhp (15, 16).
El sistema de expresión de células de insectos es adecuado para expresar proteínas exógenas complejas. Puede realizar modificaciones postraduccionales en proteínas exógenas, lo que les permite tener estructuras y funciones similares a las proteínas naturales. Este sistema ofrece ventajas como altos niveles de expresión y buena actividad biológica de las proteínas expresadas (17). El sistema Bac-to-Bac es actualmente el sistema de expresión celular de insectos más utilizado. Permite la expresión simultánea de dos genes exógenos y es adecuado para la producción industrial a gran escala (18). En este estudio, se utilizó el sistema Bac a Bac para expresar P46P97R1 individualmente, co-expresar P46P97R1 y P65, y co-expresar P65 y P42. Sin embargo, la investigación ha demostrado que el sistema Bac a Bac tiene dificultades para coexpresar más de dos proteínas de la cubierta viral. Para abordar esta necesidad, Kapil Gupta y su equipo desarrollaron el sistema MultiBac. Los casetes de expresión de los vectores de transferencia del sistema MultiBac tienen múltiples sitios de enzimas de restricción en ambos lados, lo que permite el ensamblaje de múltiples casetes de expresión. Alternativamente, se pueden fusionar múltiples plásmidos donantes en un solo vector receptor a través de sitios LoxP en una reacción mediada por Cre recombinasa. Esto permite que el sistema exprese matrices complejas de proteínas a partir de un solo baculovirus recombinante (19). En términos simples, el sistema MultiBac permite la coexpresión de múltiples subunidades proteicas dentro de la misma célula huésped, obteniendo así de manera eficiente complejos multiproteicos (20). Por lo tanto, en este estudio se llevó a cabo la coexpresión de las proteínas recombinantes P46P97R1, P65 y P42 utilizando el sistema MultiBac.
2 Materiales y métodos
2.1 Cultivo celular y virus
Las células de Spodoptera frugiperda (SF9) se cultivaron en medio de insecto SFM (Sino Biological) y se mantuvieron a 27 °C para la propagación del virus. Las células de High Five (BTI-TN-5B1-4) se cultivaron en medio de insecto HF (Sino Biological) y se mantuvieron a 27°C para la expresión de proteínas. El anticuerpo anti-His fue comprado a Sino Biological (Pekín, China). Los nucleótidos que codifican las proteínas P97R1, P46, P65 y P42 de la cepa Mhp 168 (GenBank ID: CP002274.1) se optimizaron para el uso de codones, se sintetizaron y se clonaron en los vectores pFBD o pFBDM. Toda la síntesis de genes y la optimización de codones de insectos en el estudio fue realizada por Sangon Biotech (Shanghai, China).
2.2 Ensayo de inmunofluorescencia y análisis de Western blot
En este experimento, se utilizó un baculovirus recombinante de generación P3 construido con éxito para infectar células SF9 a una multiplicidad de infección (MOI) de 5. Después de 72 h de cultivo a 27 °C, se empleó un análisis de inmunofluorescencia indirecta para evaluar la expresión de la proteína objetivo en células de insectos. Las células se fijaron con paraformaldehído al 4%, seguido de incubación con anticuerpos monoclonales anti-His de ratón como anticuerpo primario y anticuerpos anti-ratón de conejo conjugados con FITC para la detección. Además, las células High Five se infectaron con valores de MOI de 5, 10 y 15, y se recolectaron muestras de células en diferentes puntos de tiempo. Los anticuerpos anti-His sirvieron como anticuerpo primario, y los anticuerpos anti-ratón de cabra conjugados con HRP se utilizaron como anticuerpo secundario para el análisis de SDS-PAGE y Western blot de la expresión de proteínas recombinantes. La detección de bandas proteicas se realizó utilizando el sistema de imágenes de quimioluminiscencia Tanon Fine-do X6. El análisis de semicuantificación de proteínas también se realizó utilizando el mismo método.
2.3 Preparación de la vacuna
Los cuatro baculovirus recombinantes construidos en este experimento se utilizaron individualmente para infectar las células High Five en el MOI óptimo para producir antígenos, y las proteínas se recolectaron en los puntos de tiempo óptimos. Los lisados celulares sonicados se centrifugaron a 4°C a 11.500 × g durante 15 min. De acuerdo con las instrucciones del fabricante, los productos de expresión de tres baculovirus recombinantes (P97R1P46, P97R1P46-P65, P65-P42) se mezclaron (w/o) con el adyuvante PGA (Pharmgate, Minnesota, American) en una proporción de volumen de 5:1. Los productos de expresión de P97R1P46-P65-P42 se mezclaron (w/o/w) con el adyuvante ISA 201 VG (Seppic, París, Francia) a una relación de volumen de 1:1.
2.4 Inmunización animal y experimento de desafío
Para los experimentos de inmunización y desafío con ratones, 42 ratones sanos de Kunming (Universidad Médica del Sur, Guangzhou, China) de 3 semanas de edad se dividieron aleatoriamente en 6 grupos, con 7 ratones en cada grupo. Se administraron a los ratones inyecciones subcutáneas multisitio de las vacunas preparadas contra subunidades Mhp. Se administró una inmunización de refuerzo con la misma dosis 2 semanas después de la inmunización inicial. Se recogieron muestras de sangre mediante punción del seno retroorbitario a los 7, 14, 21 y 28 días después de la inmunización inicial para aislar el suero de ratón para la detección de anticuerpos y citocinas. El día 28 después de la inmunización inicial, 3 ratones seleccionados al azar de cada grupo fueron sacrificados bajo anestesia con éter, y sus linfocitos del bazo fueron aislados para el análisis de citometría de flujo. Dos semanas después de la inmunización de refuerzo, los ratones restantes de cada grupo fueron desafiados con el virus tisular liofilizado de la cepa Mhp Jinan (5 mL/100 MID) mediante inyección intraperitoneal (150 μL/ratón) e instilación intranasal (50 μL/ratón). Se observaron signos clínicos después de la provocación con dificultad. A los 28 días después del desafío, los ratones fueron sacrificados bajo anestesia con éter y sus pulmones fueron examinados para evaluar la extensión de las lesiones pulmonares utilizando un sistema de puntuación de 28 puntos (método de Madec y Kobisch). Los tejidos pulmonares de cada grupo de ratones se recolectaron y se fijaron en la solución de paraformaldehído al 4%.
Para el experimento de inmunización de cerdos, 15 lechones sanos de 1 mes de edad, negativos para anticuerpos Mhp, se dividieron aleatoriamente en 5 grupos, con 3 lechones en cada grupo. La inmunización se realizó mediante inyección intramuscular. La inmunización inicial se administró el día 0 y una inmunización de refuerzo con la misma dosis el día 14. Se recogieron muestras de sangre a los 7, 14, 21 y 28 días después de la inmunización inicial para aislar el suero. Los anticuerpos específicos contra Mhp y los niveles de citocinas IFN-γ, IL-2 e IL-4 se detectaron mediante kits ELISA. Los síntomas clínicos de los cerdos inmunizados se observaron diariamente. Los procedimientos experimentales con animales fueron aprobados por el Comité de Ética de Animales Experimentales de la Universidad Agrícola del Sur de China (Aprobación No. 2021F503).
2.5 Citometría de flujo
Después de 28 días después de la inmunización inicial, los linfocitos del bazo se aislaron de ratones y se diluyeron a 106 a 108 células/mL. A continuación, se pipetearon 100 μL de las células diluidas en tubos EP opacos de 1,5 mL. Se añadieron simultáneamente anticuerpos CD3-APC, CD4-FITC y CD8-PE marcados con fluorescencia, y se establecieron simultáneamente un grupo de control negativo (sin anticuerpos), un grupo de control CD3 positivo, un grupo de control CD4 positivo y un grupo de control CD8 positivo. Después de incubar en hielo durante 30 min, se añadieron 400 μL de PBS para resuspender las células. La adquisición de datos se realizó con un citómetro de flujo y el análisis de datos se realizó con CytExpert 2.2.
2.6 Histopatología e investigación histológica
Después de 28 días después de la infección, los ratones fueron anestesiados con éter, diseccionados y sus pulmones fueron aislados. Los pulmones aislados de ratón se fijaron en la solución de paraformaldehído al 4% y se enviaron a Wuhan Cervellera Biotechnology (Wuhan, China) para su inclusión y corte en parafina. Las secciones se tiñeron con hematoxilina y eosina (H&E) y se observaron bajo un microscopio electrónico.
2.7 Análisis estadístico
El análisis de los datos se llevó a cabo utilizando GraphPad Prism 6, empleando el análisis de varianza de un factor (ANOVA) para el análisis estadístico intergrupal. En la notación, * denota p < 0,05, ** denota p < 0,01, *** denota p < 0,001, **** denota p < 0,0001 y «ns» indica p > 0,05, lo que significa que no hay diferencia significativa.
3 Resultados
3.1 Diseño de genes y construcción de plásmidos lanzadera para proteínas recombinantes
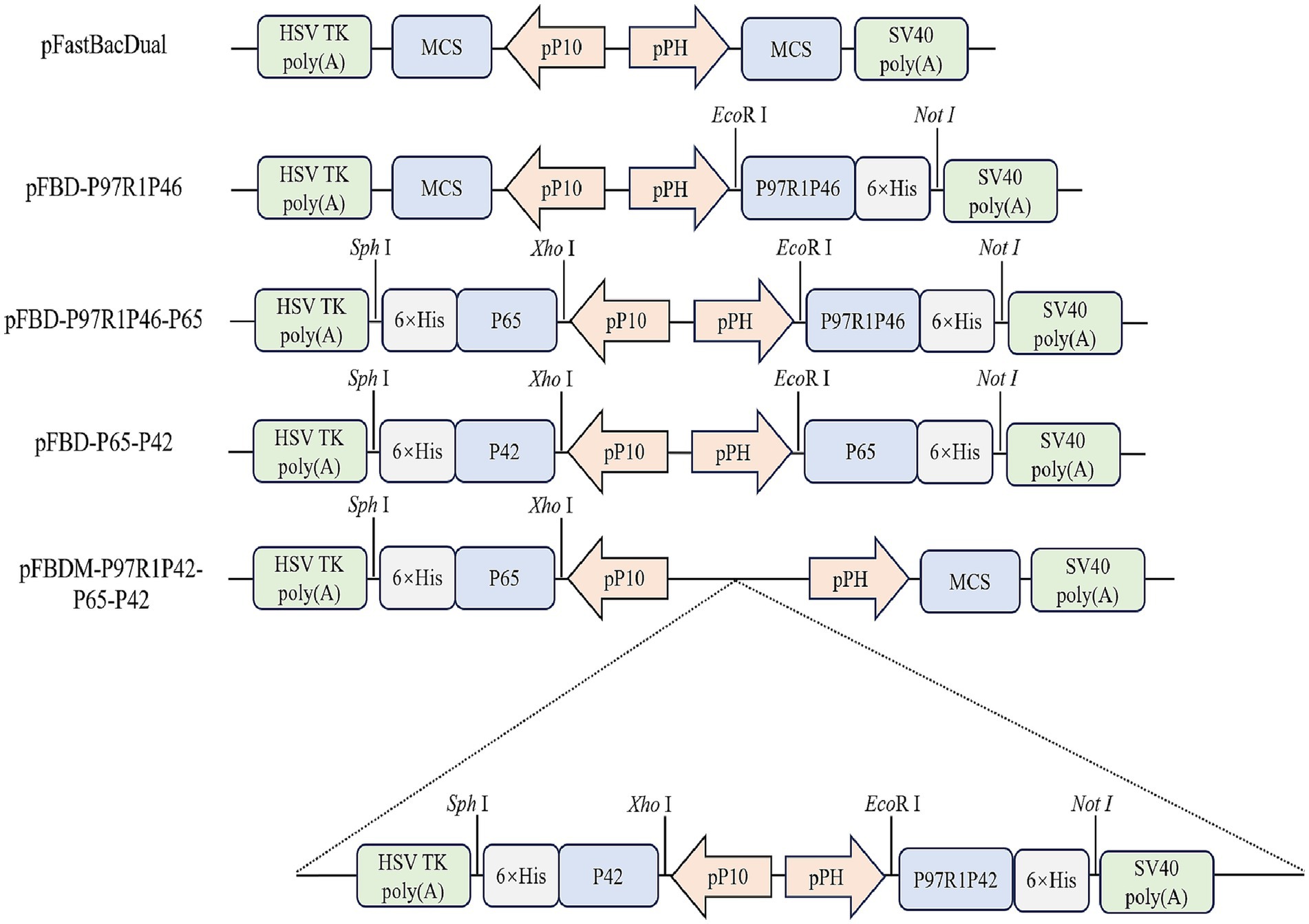
La proteína P97 desempeña un papel importante en el proceso de adhesión de Mhp, y su región R1 sirve como el principal grupo de determinantes antigénicos (21). La proteína P46 muestra potencial como vacuna de subunidad. Por lo tanto, la región R1 de P97 se concatenó con la proteína P46 a través de un péptido enlazador flexible (GGSG), lo que resultó en la construcción denominada P97R1P46. Simultáneamente, se seleccionaron las proteínas P42 y P65 de la cepa Mhp 168 como dos proteínas antigénicas adicionales. La estructura secundaria de las proteínas recombinantes se analizó utilizando la herramienta en línea PSIPRED. En este estudio, construimos vectores lanzadera para el sistema Bac a Bac: pFBD-P97R1P46, pFBD-P97R1P46-P65, pFBD-P65-P42. Posteriormente, se construyó el vector lanzadera pFBDM-P46P97R1-P65-P42 para el sistema MultiBac (Figura 1). Después de la transposición, la verificación con cebadores M13F/R confirmó la construcción exitosa de plásmidos de baculovirus recombinantes portadores de los genes diana.
3.2 Identificación de la proteína recombinante
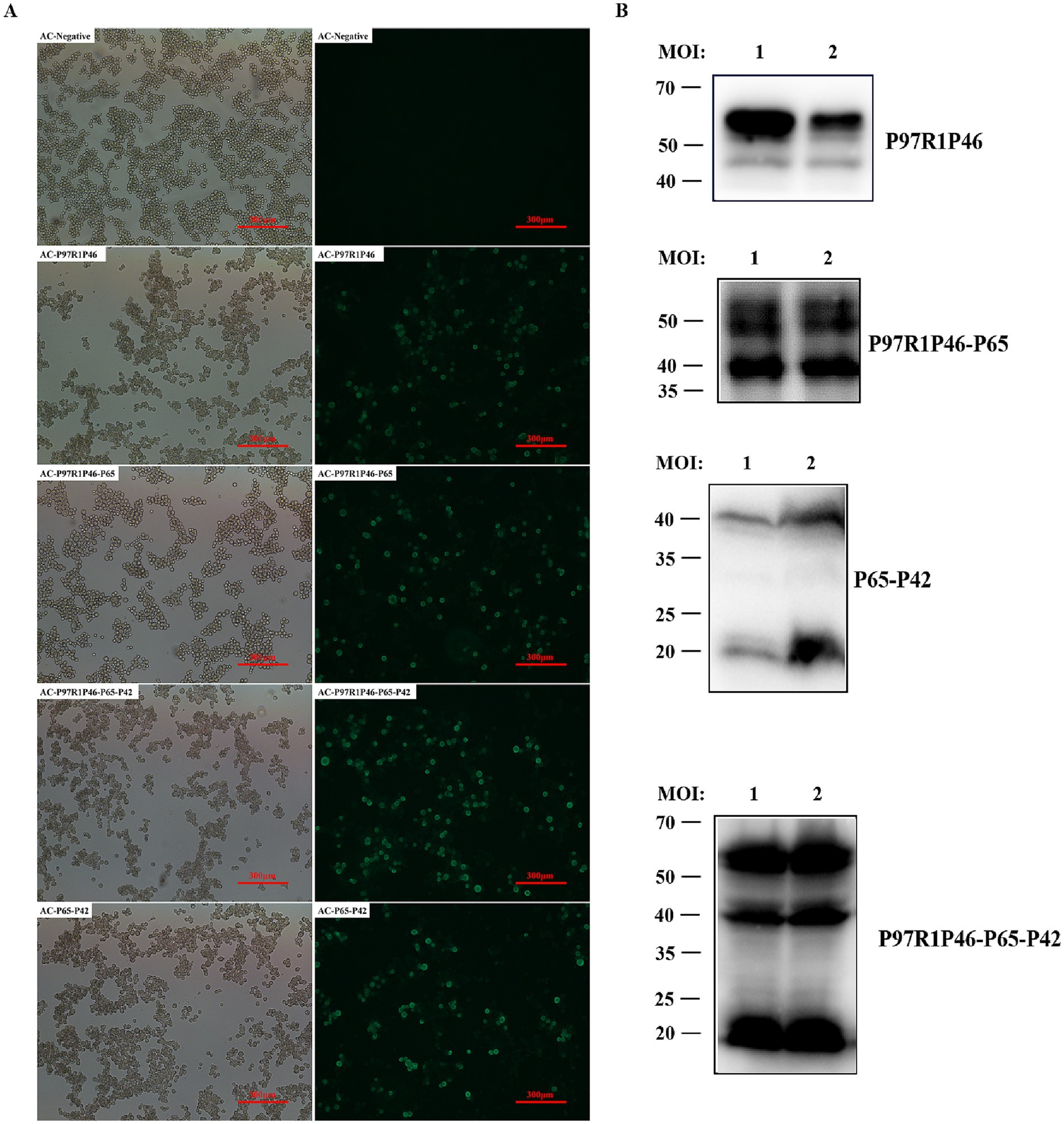
Transfectación de plásmidos recombinantes de baculovirus en células de insecto SF9 durante la fase de crecimiento logarítmico. Después de 72 h, se observó que las células dejaron de crecer, se desprendieron del fondo de la placa de cultivo y exhibieron ruptura celular y muerte. En el grupo de control, las células de insectos SF9 crecieron bien, se adhirieron normalmente, mantuvieron contornos claros y cubrieron completamente el fondo del plato después de aproximadamente 72 h. El sobrenadante clarificado recolectado del cultivo representó la primera generación de baculovirus recombinante. Las colecciones posteriores de baculovirus recombinantes de la generación P3 se denominaron secuencialmente como rAC-P97R1P46, rAC-P97R1P46-P65, rAC-P65-P42 y rAC-P46P97R1-P65-P42.
Después de infectar las células SF9 con el baculovirus recombinante mencionado anteriormente, las células infectadas se lisaron y marcaron con anticuerpos proteicos marcados con His. A través del análisis de inmunofluorescencia indirecta, se observó que los cuatro tipos de células infectadas por baculovirus recombinantes emitían fluorescencia verde (Figura 2A). Utilizando un anticuerpo anti-THis tag de ratón como anticuerpo primario y Western bloting, se observaron bandas específicas en las muestras de cultivo celular (Figura 2B). Las muestras infectadas con rAC-P97R1P46 mostraron bandas específicas a 46 y 55 kDa. El análisis sugirió que la aparición de la banda de 46 kDa puede deberse a una posible escisión del enlazador flexible (GGSG) que conecta P97R1 y P46 durante el proceso de expresión, con la proteína marcada con His ubicada en el extremo C de la proteína P46. Las muestras infectadas con rAC-P97R1P46-P65 exhibieron bandas específicas a 41, 46 y 55 kDa. Las muestras infectadas con rAC-P65-P42 mostraron bandas específicas a 41 kDa y 20 kDa. Las muestras infectadas con rAC-P46P97R1-P65-P42 mostraron bandas específicas a 20, 41, 46 y 55 kDa.
3.3 Determinación de la valencia viral del baculovirus recombinante
Recoja el virus de la generación P3 y determine el número de copias del virus recombinante en forma de bastón de la generación P3 mediante PCR cuantitativa absoluta. De acuerdo con la curva estándar, los números de copias de rAC-P97R1P46, rAC-P97R1P46-P65, rAC-P65-P42 y rAC-P46P97R1-P65-P42 son 6,27 × 107 copias/μL, 1,24 × 108 copias/μL, 7,844 × 107 copias/μL y 1,07 × 108 copias/μL, respectivamente (Figura 3).
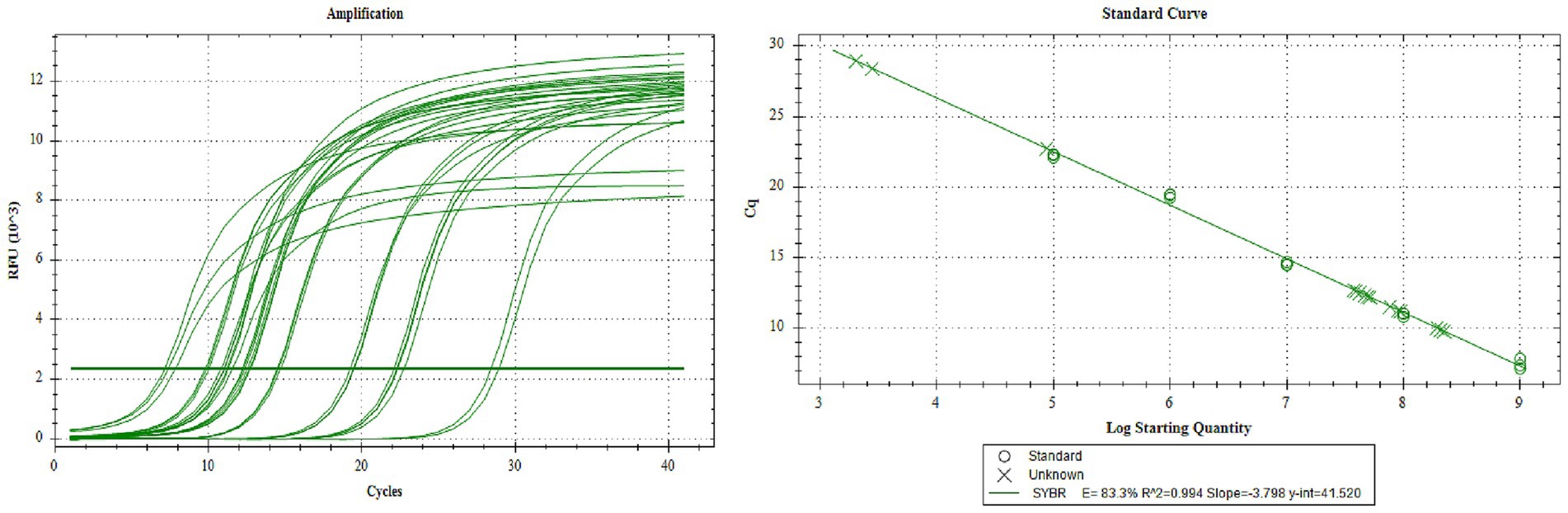
Figura 3. Ensayo de virulencia q-PCR de baculovirus recombinante de generación P3.
3.4 Optimización de la expresión de proteínas recombinantes en baculovirus
Para obtener altos rendimientos de proteínas recombinantes, se utilizó el baculovirus recombinante de generación P3 para infectar células High Five, y se optimizaron las condiciones de tiempo y MOI. Se recolectaron cultivos celulares en diversas condiciones para el análisis de Western blot. Las condiciones óptimas son las siguientes para cada baculovirus recombinante (Figura 4A): rAc-P97R1P46: Se inocularon en células High Five en fase logarítmica con MOI = 10, y las células se recolectaron a las 96 h después de la infección. rAc-P97R1P46-P65: se inoculó en células High Five en fase logarítmica con MOI = 5, y las células se recolectaron a las 96 h después de la infección. rAc-P65-P42: se inoculó en células High Five en fase logarítmica con MOI = 15, y las células se recolectaron a las 72 h después de la infección. rAc-P46P97R1-P65-P42: se inoculó en células High Five en fase logarítmica con MOI = 10, y las células se recolectaron a las 72 h después de la infección.
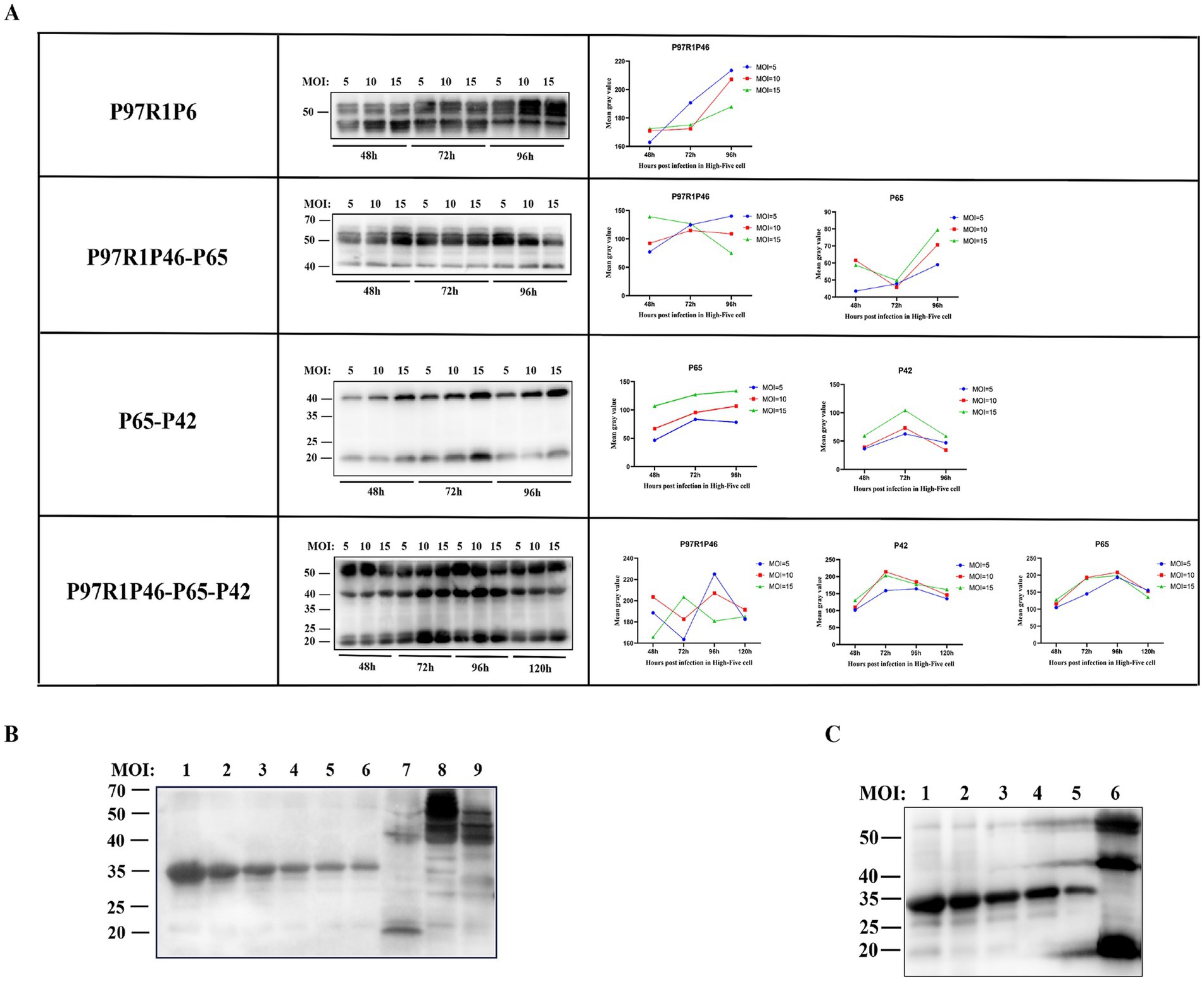
Figura 4. Optimización de condiciones y análisis semicuantitativo de proteínas recombinantes. (A) Análisis de Western blot de las proteínas P97R1P46, P97R1P46-P65, P65-P42 y P97R1P46-P65-P42 en diferentes condiciones de MOI y tiempo. (B) Análisis semicuantitativo de proteínas recombinantes. Los carriles 1 a 6 son, en orden, concentraciones de 800 μg/mL, 500 μg/mL, 250 μg/mL, 125 μg/mL, 62,5 μg/mL y 31,25 μg/mL de proteína estándar; el carril 7 es el lisado de células infectadas Ac-P65-P42; El carril 8 es el lisado de células infectadas con Ac-P97R1P46. El carril 9 es el lisado de células infectadas con Ac-P97R1P46-P65. (C) Análisis semicuantitativo de proteínas recombinantes. Los carriles 1 a 5 son, en orden, concentraciones de 500 μg/mL, 250 μg/mL, 125 μg/mL, 62,5 μg/mL y 31,25 μg/mL de proteína estándar; el carril 6 es el lisado de células infectadas Ac-P97R1P46-P65-P42.
Los cuatro baculovirus recombinantes se utilizaron por separado para infectar las células High Five en la fase de crecimiento logarítmico en condiciones óptimas de expresión, y se recolectaron las proteínas. Los niveles de expresión de cada proteína se determinaron utilizando una concentración conocida diluida en gradiente de proteína marcada con His como estándar. En el lisado celular de células infectadas con rAc-P97R1P46, las bandas de proteínas mostraron manchas, posiblemente debido a la escisión del enlazador flexible en la proteína P97R1P46 recombinante, lo que resultó en productos de descomposición. El producto de escisión, de aproximadamente 46 kDa de tamaño, estaba demasiado cerca en tamaño y concentración de la proteína P97R1P46 recombinante, aproximadamente 55 kDa (Figura 4B). Después de una dilución cuádruple, se realizó un análisis semicuantitativo mediante Western blot, y los resultados mostraron bandas claras. La concentración proteica de la proteína P97R1P46 recombinante en el lisado celular de células infectadas con rAc-P97R1P46 fue de aproximadamente 136 μg/mL. En el lisado celular de células infectadas con rAc-P65-P42, la concentración de la proteína P65 fue de aproximadamente 162 μg/mL, y la concentración de la proteína P42 fue de aproximadamente 207,8 μg/mL en el lisado celular de células infectadas con rAc-P97R1P46-P65, la concentración de la proteína P97R1P46 fue de aproximadamente 330,6 μg/mL y la concentración de la proteína P65 fue de aproximadamente 283,4 μg/mL. En el lisado celular de células infectadas con rAc-P46P97R1-P65-P42 (Figura 4C), la concentración de la proteína P97R1P46 fue de aproximadamente 258 μg/mL, la concentración de la proteína P65 fue de aproximadamente 232,3 μg/mL y la concentración de la proteína P42 fue de aproximadamente 389,3 μg/mL.
3.5 Inspección de calidad de las vacunas de subunidades Mhp
3.5.1 Inspección de propiedades físicas y químicas
La vacuna de subunidad en este estudio se preparó utilizando el adyuvante ISA 201 de agua en aceite en agua (W/O/W). La vacuna se presenta como una emulsión de color blanco lechoso, ligeramente viscosa, con una textura uniforme. Con una pipeta, se tomó una gota de la vacuna de subunidad y se dejó caer sobre la superficie del agua fría. Parte de la gota flotó en la superficie del agua, formando gotas blancas, mientras que otra parte se disolvió en el agua congelada, creando una dispersión similar a la niebla que se extendió hacia afuera. Esta observación confirma que la formulación es una emulsión bifásica de agua en aceite en agua (W/O/W).
3.5.2 Inspección de seguridad
Para evaluar la seguridad de la vacuna, se administró la vacuna de subunidad preparada a tres ratones Kunming sanos a la edad de 3 semanas. Los resultados mostraron que todos los ratones experimentales estaban sanos, sobrevivieron y exhibieron un estado mental y apetito normales 28 días después de la inmunización inicial.
Un examen más detallado de los signos clínicos de los ratones de cada grupo no reveló hinchazón visible, inflamación u otras reacciones anormales causadas por la vacuna en la superficie corporal de los ratones experimentales.
Los resultados anteriores indican que la vacuna de subunidad preparada en este estudio tiene una excelente seguridad y puede utilizarse para posteriores experimentos de inmunización con ratones.
3.6 Experimentos de inmunización con ratones
3.6.1 Experimento de inmunización
Para investigar la inmunogenicidad de las vacunas de subunidades Mhp preparadas con las combinaciones de P97R1P46, P97R1P46-p65 y P97R1P46 + P65-P42, este estudio empleó ELISA para medir los niveles de anticuerpos específicos en los sueros de ratones a los 7, 14, 21 y 28 días después de la inmunización inicial (Figura 5A). Los resultados indican que el grupo de vacunas comercializadas puede inducir anticuerpos específicos de forma más temprana. Los niveles de anticuerpos inducidos por el grupo P97R1P46 + P65-P42 son comparables a los inducidos por el grupo de la vacuna comercializada, superiores a los inducidos por el grupo P97R1P46 y el grupo P97R1P46-P65, y significativamente diferentes del grupo PBS (p < 0,05) (Figura 5B). Estos hallazgos sugieren que todas las vacunas de subunidades Mhp desarrolladas en este experimento poseen una buena inmunogenicidad. Pueden inducir la producción de anticuerpos específicos en el cuerpo después de la inmunización, y el grupo P97R1P46 + P65-P42 induce niveles más altos de anticuerpos específicos.
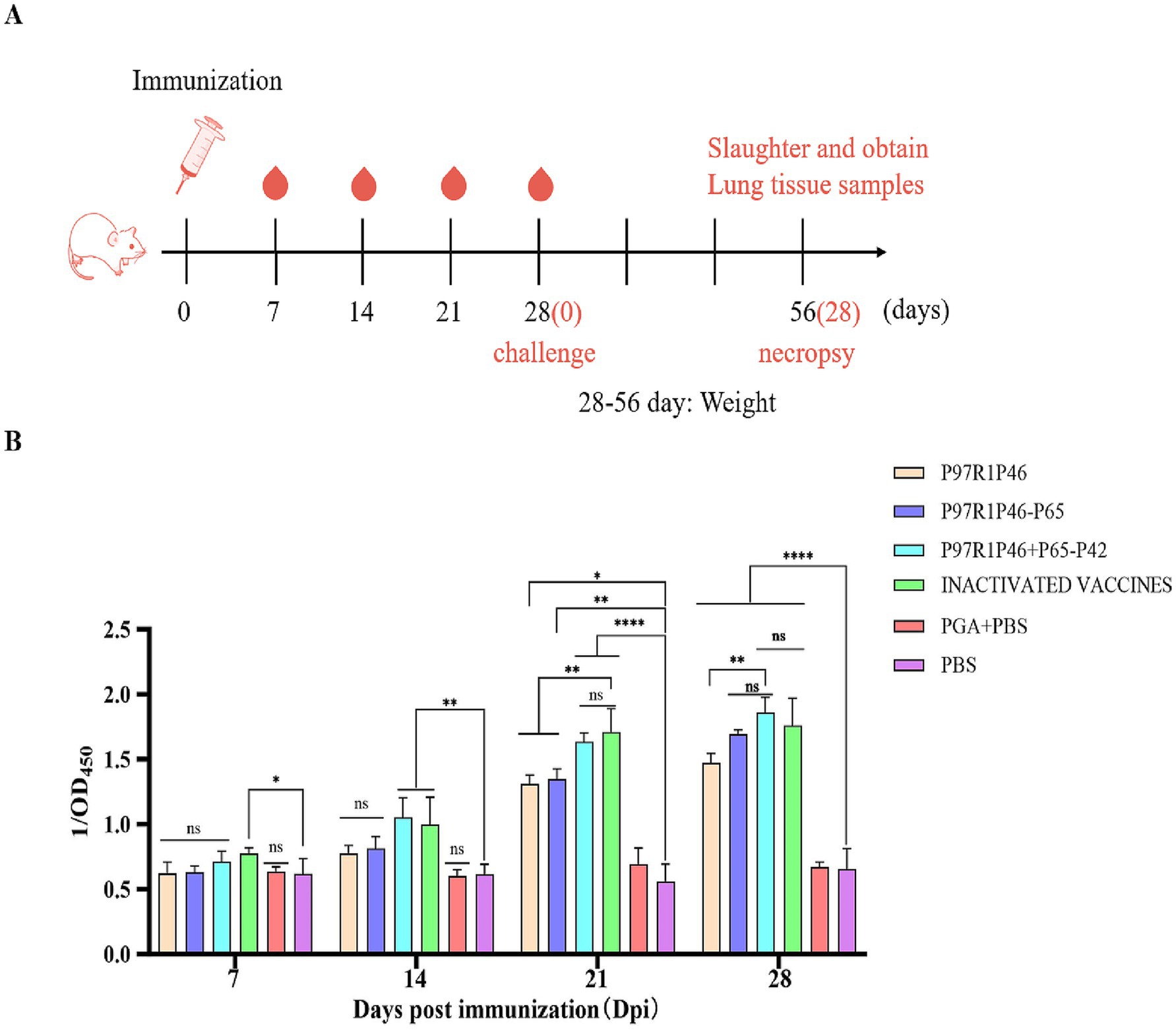
Figura 5. Inmunoensayo en ratón y detección de anticuerpos específicos. A) Estrategia de inmunización en ratones. (B) El OD450 de cada grupo en diferentes días después de la inmunización (dpi) por Mhp ELISA. ANOVA de dos factores: *: p < 0,05, **: p < 0,01; NS: p > 0,05 (sin diferencia significativa).
3.6.2 Se llevó a cabo la detección de citocinas IL-2 e IL-4 en suero de ratón
Para investigar el nivel de inmunidad celular en ratones después de la inmunización, este experimento empleó ELISA para medir los niveles de citocinas de tipo Th1 (IL-2) y tipo Th2 (IL-4) en sueros de ratón a los 28 días después de la inmunización inicial.
Los niveles de secreción de IL-2 en los sueros de los ratones del grupo P97R1P46 + P65-P42, el grupo P97R1P46 y el grupo P97R1P46-P65 fueron significativamente más altos que los del grupo PBS (p < 0,01), siendo el grupo P97R1P46 + P65-P42 los que exhibieron los niveles más altos (Figura 6A). Esto indica que los niveles de secreción de IL-2 en los sueros de los ratones de todos los grupos de vacunas de subunidades fueron significativamente más altos que los del grupo PBS. Las vacunas de subunidades desarrolladas en este estudio estimulan eficazmente la producción de IL-2, induciendo así una respuesta inmunitaria de tipo Th1. Por el contrario, los niveles de IL-2 en el grupo de vacunas inactivadas comerciales fueron comparables a los del grupo de PBS, mientras que los niveles en el grupo de PGA + PBS fueron ligeramente elevados en comparación con el grupo de PBS. Estos resultados demuestran que las vacunas de tres subunidades preparadas en este estudio pueden estimular de manera robusta la producción de IL-2 en ratones, mientras que la vacuna inactivada comercial no proporciona un estímulo positivo para la producción de IL-2 en ratones.
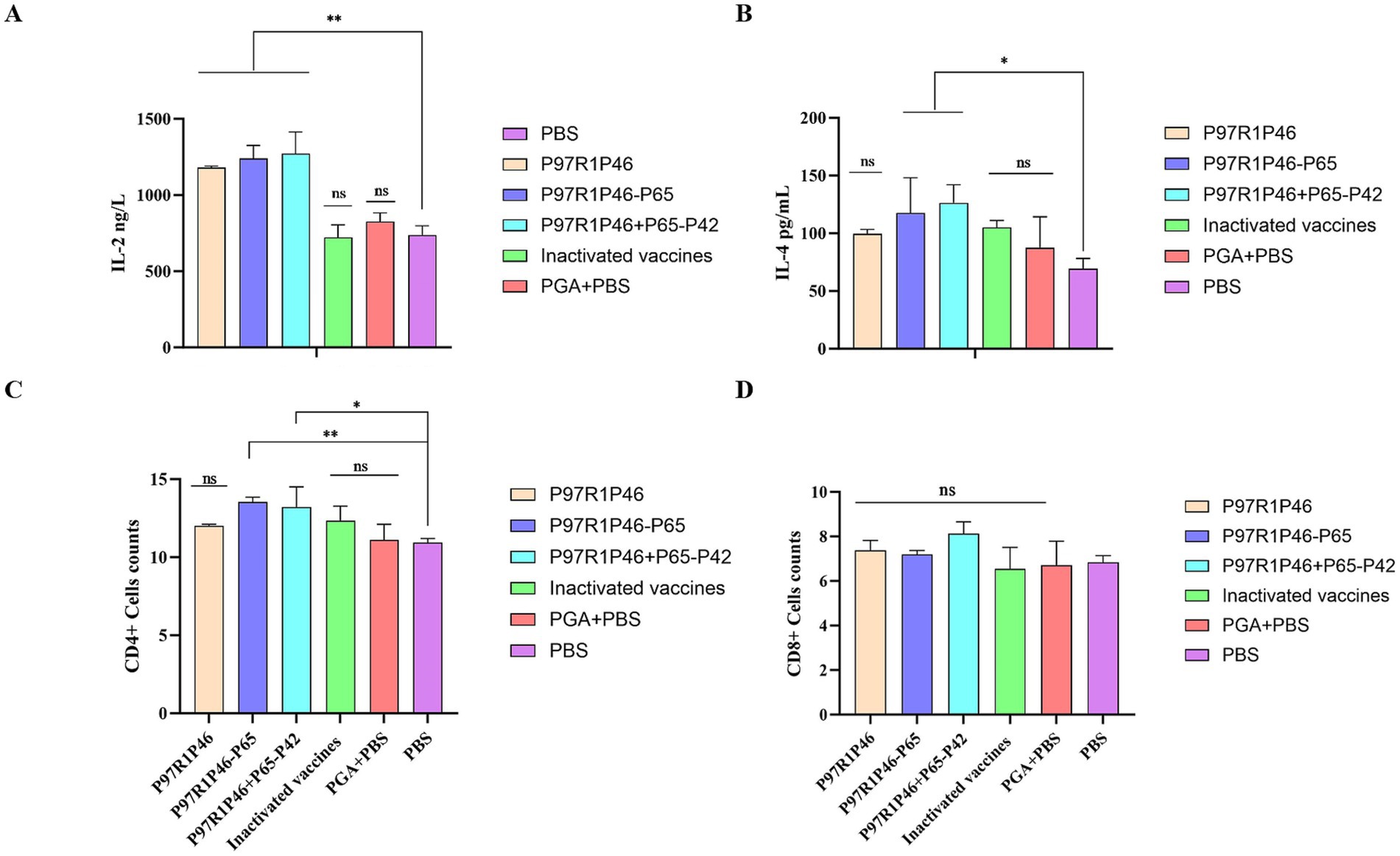
Figura 6. Ensayos de citocinas y ensayos de células inmunitarias en inmunoensayos de ratón. (A) Detección de IL-2 en suero de ratón. (B) Detección de IL-4 en suero de ratón. (C) Niveles de linfocitos T CD4+ en el bazo de ratones. (D) Niveles de linfocitos T CD8+ en el bazo de ratones. ANOVA de dos vías: *: p < 0,05, **: p < 0,01; NS: p > 0,05 (sin diferencia significativa).
Los niveles de secreción de IL-4 en los sueros de los ratones de los grupos P97R1P46 + P65-P42 y P97R1P46-P65 fueron significativamente más altos que los del grupo PBS (p < 0,05), siendo el grupo P97R1P46 + P65-P42 el que exhibió el nivel más alto (Figura 6B). El nivel de secreción de IL-4 en los sueros de los ratones del grupo P97R1P46 fue mayor que el del grupo PBS, pero la diferencia no fue significativa. Esto indica que las vacunas de subunidades preparadas en este estudio pueden estimular la producción de IL-4 en ratones e inducir respuestas inmunitarias de tipo Th2 Los niveles de IL-4 en el grupo de vacunas inactivadas comerciales y en el grupo de PGA + PBS fueron más altos que los del grupo de PBS, lo que indica que tanto la vacuna inactivada comercial como el adyuvante PGA pueden estimular la producción de IL-4 en ratones.
En resumen, sobre la base de la detección ELISA de los niveles de secreción de citocinas en sueros de ratón a los 28 días después de la inmunización inicial, se puede concluir que la vacuna de subunidad preparada en este estudio puede estimular eficazmente la producción de citocinas IL-2 e IL-4 en ratones, induciendo respuestas inmunitarias celulares de tipo Th1 y Th2, mejorando así el nivel inmunitario celular de ratones. Entre ellas, la vacuna de subunidad preparada con la combinación de proteínas P97R1P46 + P65-P42 mostró el efecto más óptimo.
3.6.3 Análisis por citometría de flujo de linfocitos T esplénicos de ratón
Utilizamos la citometría de flujo para investigar la distribución y los cambios de los subconjuntos CD4+ y CD8+ de linfocitos T en el bazo de ratones de cada grupo. En este estudio, se utilizaron los anticuerpos marcados con fluorescencia APC, FITC y PE correspondientes para marcar CD3, CD4 y CD8, respectivamente. Se realizaron ajustes de compensación para eliminar la superposición de señales de fluorescencia. Se utilizaron diagramas de dispersión de caja para describir la distribución de los subconjuntos CD4+ y CD8+ de linfocitos T en el bazo de los ratones de cada grupo, y se compararon los porcentajes de composición de los subconjuntos CD4+ y CD8+.
Los resultados indican que 28 días después de la inmunización inicial, los porcentajes de linfocitos CD4+ y CD8+ en el bazo de los ratones en cada grupo de vacuna de subunidad fueron mayores en comparación con el grupo PBS. En concreto, en cuanto a los linfocitos T CD4+ (Figura 6C), las diferencias entre el grupo P97R1P46-P65 y el grupo P97R1P46 + P65-P42 respecto al grupo PBS fueron significativas (p < 0,05), mientras que el grupo P97R1P46 y el grupo de vacunas inactivadas comerciales mostraron un nivel superior en comparación con el grupo PBS, aunque la diferencia no fue significativa. Esto indica que las vacunas de subunidades P97R1P46-P65 y P97R1P46 + P65-P42 pueden estimular positivamente los linfocitos T colaboradores. En cuanto a los linfocitos T CD8+ (Figura 6D), los porcentajes fueron mayores en cada grupo de subunidad vacunal en comparación con el grupo PBS, pero las diferencias no fueron significativas. Esto sugiere que cada grupo de vacunas de subunidades no estimula los linfocitos T CD8+. Además, después de la inmunización con vacunas de subunidades, la proporción de linfocitos CD4+/CD8+ en el bazo de los ratones aumentó, lo que indica aún más que cada vacuna de subunidades mejora eficazmente la respuesta inmunitaria al organismo.
3.7 Experimento de protección contra desafíos con ratones
3.7.1 Análisis histopatológico de secciones de tejido pulmonar de ratón después de la provocación
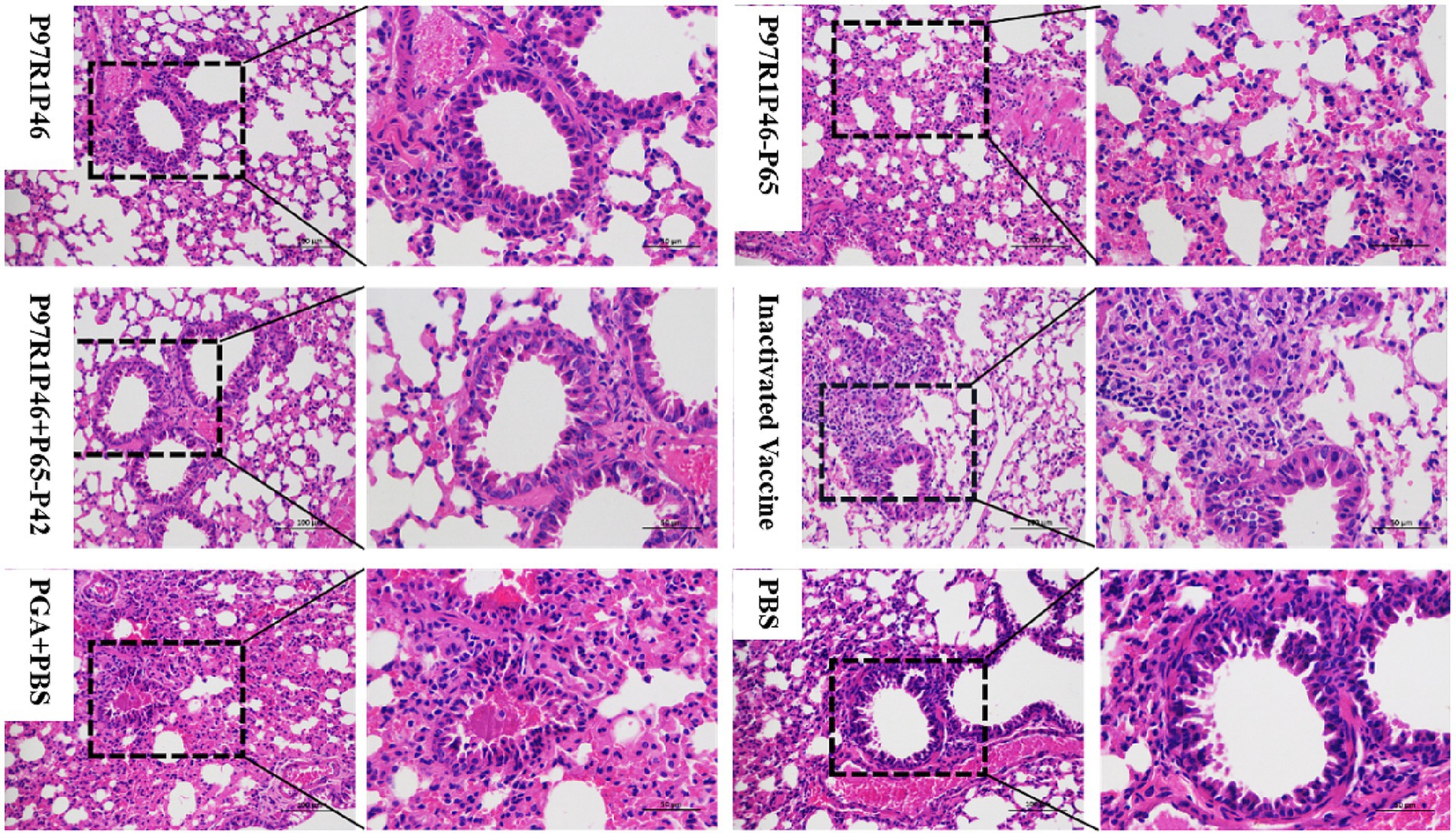
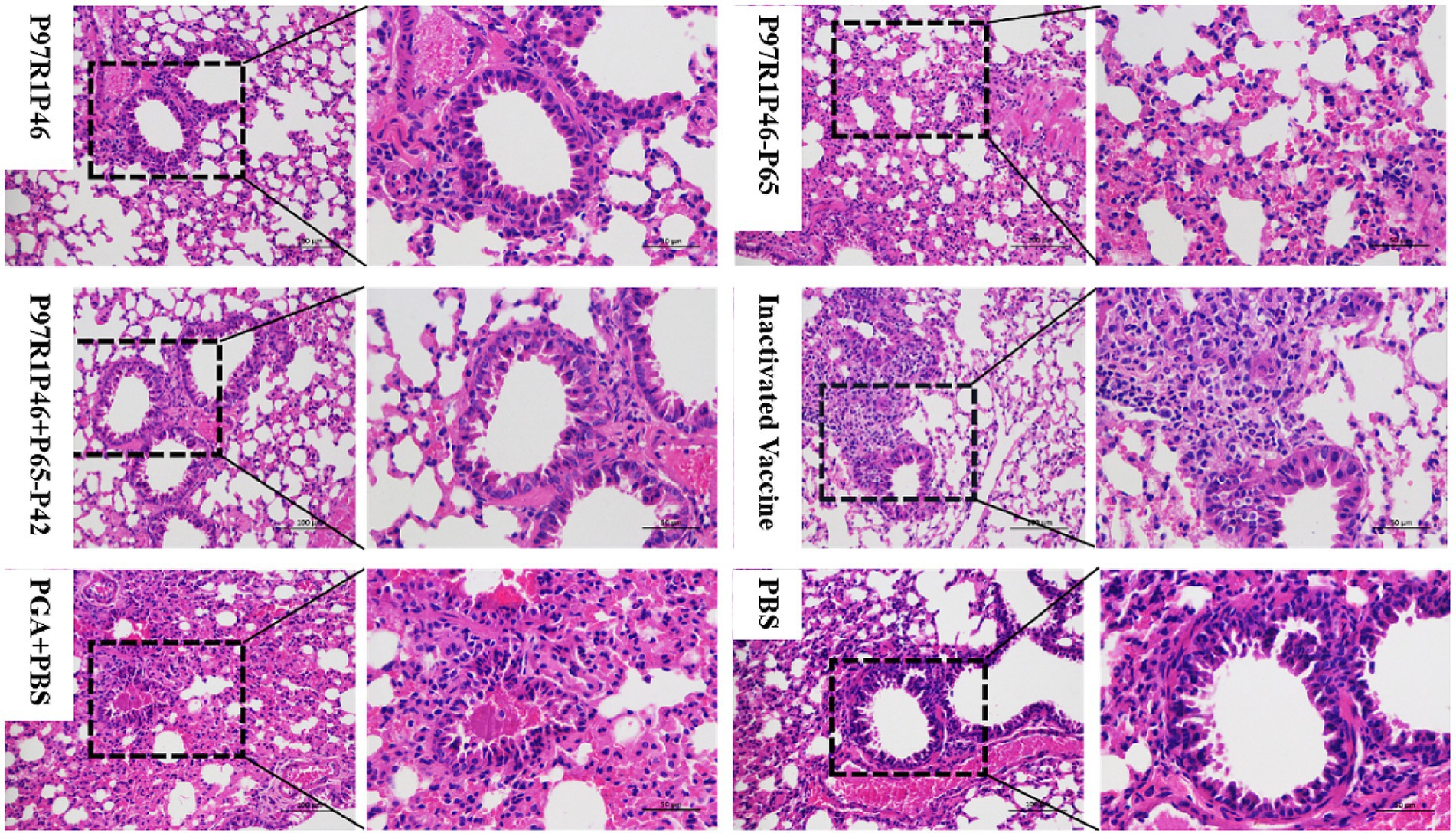
Para analizar los cambios patológicos en los pulmones de ratón, los tejidos pulmonares aislados de cada grupo se fijaron en paraformaldehído al 4%, fueron procesados por la empresa de Sevier para la inclusión en parafina, el seccionamiento y la tinción de hematoxilina y eosina, y se observaron bajo un microscopio electrónico (Figura 7). En el grupo P97R1P46, se observó que un gran número de células epiteliales bronquiales se desprendían, y algunas de ellas mostraban hinchazón y degeneración, y engrosamiento parcial de las paredes alveolares con una pequeña cantidad de exudado. En el grupo P97R1P46-P65 se observó un engrosamiento significativo de las paredes alveolares acompañado de infiltración de células inflamatorias. En el grupo P97R1P46 + P65-P42 no se observó desprendimiento de células epiteliales bronquiales y el tamaño alveolar fue uniforme, con una pequeña cantidad de exudación de sustancia eosinofílica en la luz bronquial. En el grupo de vacunas inactivadas comerciales, había cavidades alveolares de tamaño uniforme, con una pequeña cantidad de exfoliación y exudación de células epiteliales alveolares, y no se observaron anomalías en la luz bronquial. En el grupo PGA + PBS, se observó una pequeña cantidad de desprendimiento de células epiteliales bronquiales, junto con exudación de sustancias similares a proteínas eosinófilas en la luz bronquial, sangrado leve ocasional, engrosamiento significativo de las paredes alveolares que resultó en tamaños alveolares variados y ligera hinchazón y degeneración de algunas células epiteliales bronquiales y células epiteliales alveolares. En el grupo de PBS, las secciones patológicas mostraron engrosamiento de las paredes bronquiales, una pequeña cantidad de desprendimiento de células epiteliales bronquiales, una pequeña cantidad de exudación de una sustancia similar a la proteína eosinófila en la luz, un engrosamiento significativo de las paredes alveolares acompañado de infiltración de células inflamatorias y hemorragias leves ocasionales. En general, las secciones patológicas revelaron diversos grados de daño pulmonar en cada grupo de ratones, con niveles más altos de daño patológico observados en los grupos de PBS y adyuvantes.
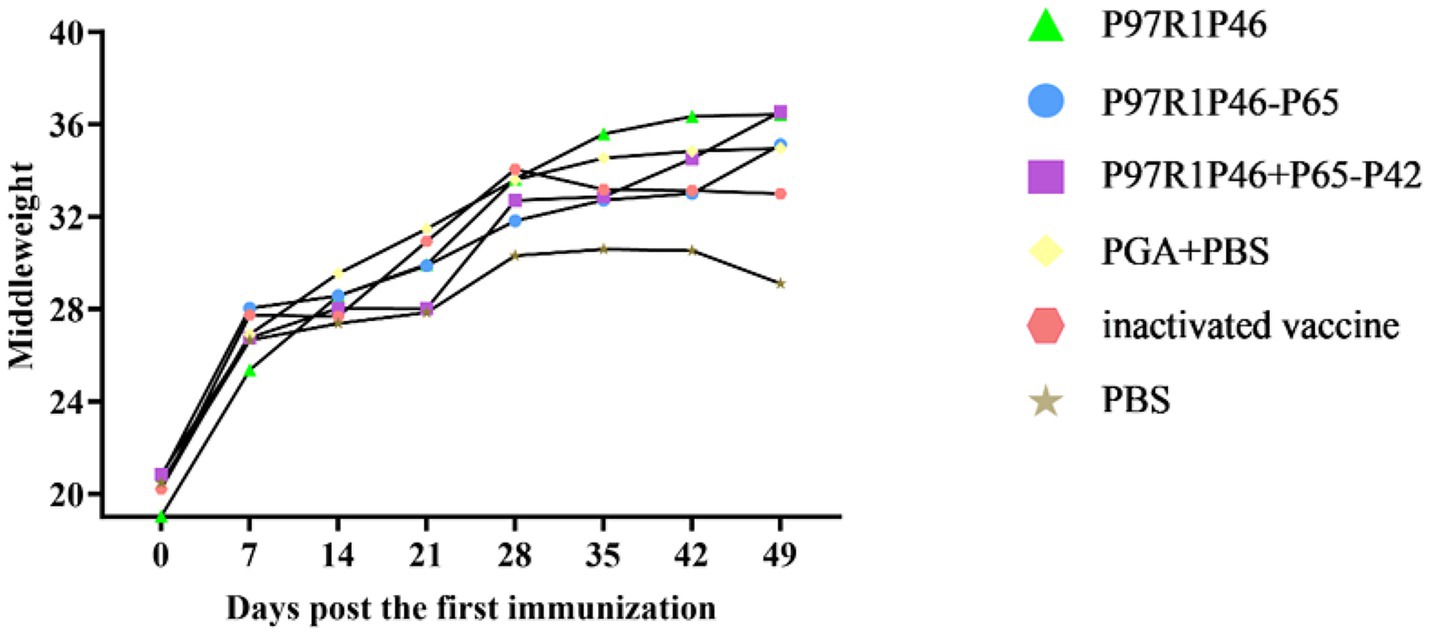
3.7.2 Aumento de peso de ratones después del desafío con virus
En este experimento se utilizaron ratones Kunming sanos de 3 semanas de edad. Se midió el peso de los ratones de cada grupo a los 0º, 7º, 14º, 21º, 28º, 35º, 42º y 49º día después de la primera inmunización, y se tomó el peso promedio de cada grupo para trazar la curva de cambio de peso (Figura 8). Como se muestra en la Figura 8, el peso de los ratones en cada grupo aumentó significativamente hasta el día 28, el día del desafío. Después del 7º día, los ratones de cada grupo alcanzaron gradualmente la madurez, por lo que el aumento de peso se desaceleró, pero aún pudo mantener un aumento constante. En este experimento, se utilizó el virus del tejido liofilizado de la cepa Mhp Ji-nan para desafiar a los ratones el día 28 después de la primera inmunización. Después del desafío con el virus, el apetito de los ratones de cada grupo disminuyó en diversos grados y el aumento de peso diario se desaceleró. Del día 35 al 49, el aumento de peso de los ratones en el grupo PBS y el grupo adyuvante se estancó o incluso disminuyó, mientras que los ratones en el grupo P97R1P46-P65 y el grupo P97R1P46 + P65-P42 aún mantuvieron el aumento de peso. En resumen, los experimentos con ratones mostraron que la proteína combinada de P97R1P46 + P65-P42 tenía mejor inmunogenicidad que otras vacunas de subunidades, por lo que posteriormente, los genes P97R1P46, P65 y P42 se clonaron simultáneamente en el vector pFastMultibacDual para su coexpresión utilizando el sistema MultiBac, seguido de experimentos de inmunización de lechones.
3.8 Experimentos de inmunización de lechones
3.8.1 Detección de ELISA a nivel de anticuerpos séricos específicos
La proteína recombinante P46P97R1-P65-P42 y el adyuvante ISA 201 VG (W/O/W) se mezclaron en una proporción de 1:1 para preparar la vacuna de subunidad Mhp. Esta vacuna, junto con la vacuna comercial inactivada contra Mhp, se inmunizó en lechones de 1 mes de edad, sin detección de antígeno Mhp y anticuerpos, a los 0 días y a los 14 días (Figura 9A). Para investigar el efecto inmunitario de la vacuna de subunidad Mhp en lechones, se recogieron muestras de suero de cada lechón del grupo experimental a los 0 días, 7 días, 14 días, 21 días y 28 días, y los niveles de anticuerpos Mhp se detectaron utilizando un método ELISA indirecto, con los resultados representados por el OD450 del suero de prueba (Figura 9B).
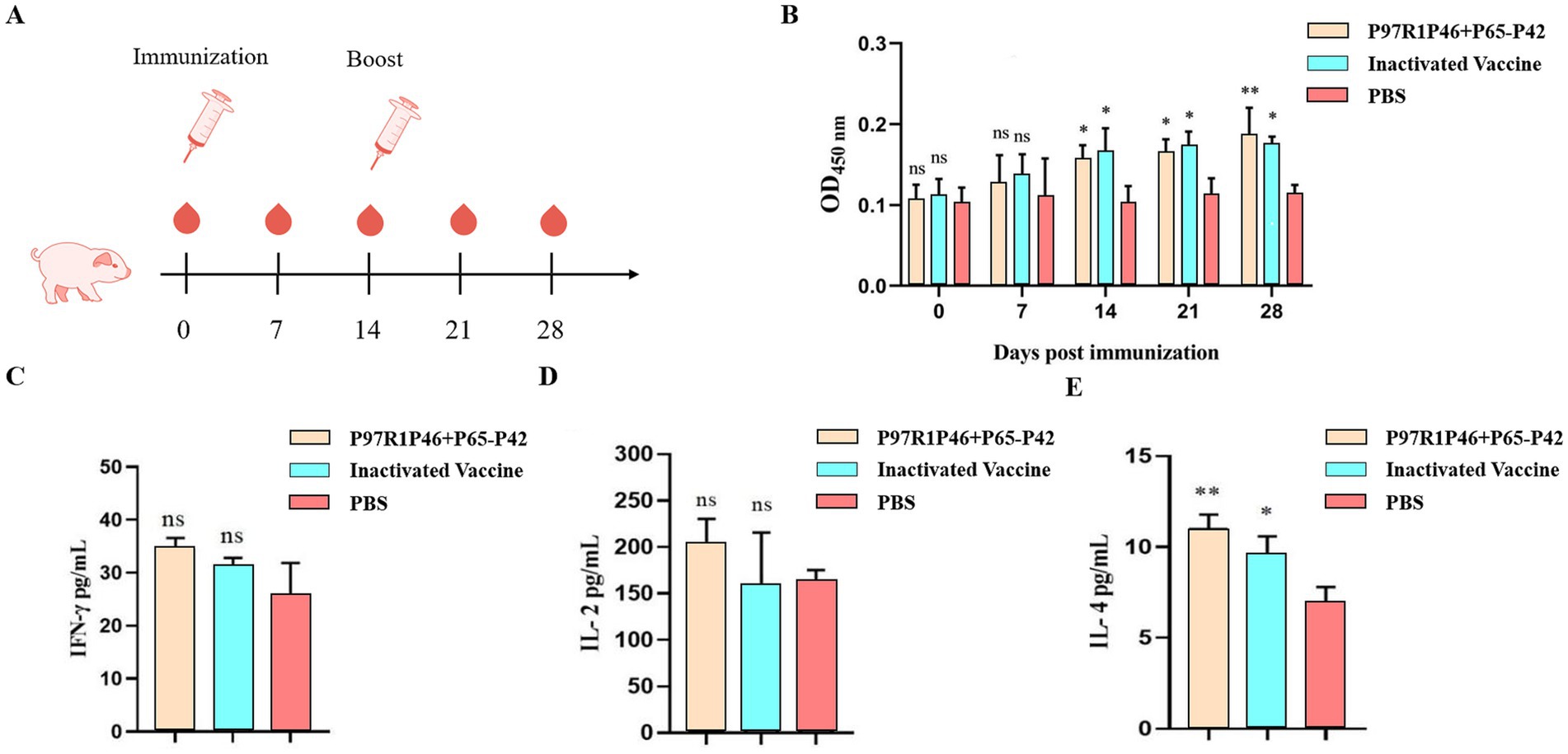
A los 7 días después de la inmunización primaria, los niveles de anticuerpos específicos de Mhp en el suero de los lechones del grupo P46P97R1-P65-P42 y del grupo de vacuna comercial inactivada contra Mhp mostraron un aumento lento en el tiempo en comparación con el grupo PBS, pero la diferencia no fue significativa (p > 0,05). A los 14 días después de la inmunización primaria, los niveles de anticuerpos en todos los grupos de vacunas fueron significativamente más altos que los del grupo de PBS (p < 0,05), y el grupo de vacunas comerciales inactivadas contra Mhp mostró niveles más altos que el grupo de P46P97R1-P65-P42. A los 28 días después de la inmunización primaria, los niveles de anticuerpos específicos de Mhp en el suero de los lechones del grupo P46P97R1-P65-P42 fueron significativamente más altos que los del grupo PBS (p < 0,01) y más altos que los del grupo de vacunas comerciales inactivadas contra Mhp. Estos resultados indican que desde el día 0 hasta el día 21 después de la inmunización primaria, los niveles de anticuerpos específicos de Mhp inducidos por P46P97R1-P65-P42 fueron más bajos que los inducidos por la vacuna comercial inactivada contra Mhp. Sin embargo, después de 14 días después de la inmunización primaria, los niveles de anticuerpos inducidos por la vacuna comercial inactivada Mhp fueron más altos que los inducidos por la vacuna de subunidad P46P97R1-P65-P42. Por lo tanto, la vacuna comercial inactivada contra Mhp puede inducir un nivel alto y significativo de anticuerpos en un período más corto después de la primera inmunización en comparación con la vacuna de subunidad Mhp. Sin embargo, para el día 28, la vacuna de subunidad P46P97R1-P65-P42 estimuló niveles más altos de anticuerpos específicos de Mhp después del refuerzo que la vacuna comercial de Mhp.
3.8.2 Se realizó la detección de citocinas IL-2, IFN-γ e IL-4 en suero de lechones
Para investigar la respuesta inmunitaria celular después de la vacunación en cerdos experimentales, este estudio empleó ELISA para medir los niveles de citocinas IFN-γ, IL-2 e IL-4 en el suero de cerdos a los 28 días después de la vacunación inicial. Esto se hizo para estudiar los niveles de respuesta inmune celular de tipo Th1 (IFN-γ e IL-2) y tipo Th2 (IL-4) en los cerdos vacunados.
Los resultados de la detección de IFN-γ son los siguientes (Figura 9C): a los 28 días después de la vacunación inicial, los niveles de IFN-γ en el suero de los cerdos experimentales de cada grupo vacunado fueron ligeramente superiores a los del grupo PBS, pero la diferencia no fue significativa (p > 0,05). Entre ellos, los niveles de IFN-γ en el suero de los cerdos vacunados con la vacuna de subunidad Mhp fueron ligeramente superiores a los vacunados con la vacuna comercial inactivada Mhp.
Los resultados de la detección de IL-2 son los siguientes (Figura 9D): en comparación con el grupo PBS, los niveles séricos de IL-2 en el grupo de vacuna de subunidad Mhp estaban ligeramente elevados, pero la diferencia no fue significativa (p > 0,05). Los niveles de IL-2 en el grupo de la vacuna comercial de Mhp inactivada fueron comparables a los del grupo de PBS.
Los resultados de la detección de IL-4 son los siguientes (Figura 9E): en comparación con el grupo PBS, los niveles séricos de IL-4 en el grupo de vacuna de subunidad Mhp mostraron un aumento significativo (p < 0,01), mientras que los niveles de IL-4 en el grupo de vacuna comercial inactivada Mhp fueron mayores que los del grupo PBS, con una diferencia relativamente significativa (p < 0,05). Además, el grupo de vacunas de subunidades Mhp exhibió niveles más altos de IL-4 en comparación con el grupo de vacunas Mhp inactivadas comerciales.
Los resultados demuestran que la vacuna de subunidad Mhp desarrollada en este estudio eleva significativamente los niveles de citocinas IL-4 en la sangre periférica de cerdos inmunizados. Este hallazgo sugiere que P97R1P46-P65-P42 induce eficazmente una respuesta inmunitaria humoral robusta en lechones, pero no logra provocar una respuesta inmunitaria celular sustancial.
4 Discusión
Mycoplasma hyopneumoniae (Mhp) representa una amenaza significativa para la industria porcina mundial debido a su papel como patógeno respiratorio. La vacunación sigue siendo la estrategia más eficaz para prevenir y controlar las infecciones por Mhp en cerdos, por lo que el desarrollo de vacunas seguras y eficaces es crucial para mitigar los efectos de la neumonía por micoplasma porcino.
La eficacia de las vacunas de subunidades está fuertemente influenciada por la selección de antígenos. La región R1 de la proteína P97 facilita de forma independiente el proceso de adhesión, y la adhesión de Mhp implica múltiples adhesinas, más de 60 identificadas hasta la fecha (22-24). Los estudios indican que centrarse únicamente en una sola proteína antígeno es insuficiente; una vacuna basada únicamente en P97 no confiere una protección inmunitaria adecuada en los cerdos (10, 25). Las proteínas de membrana P46 y P65 se encuentran entre las más estudiadas para el desarrollo de vacunas de subunidades (25, 26). Se ha demostrado que P42, una proteína de choque térmico, inhibe el crecimiento de Mhp (27). Al unir la región R1 de P97 a P46 utilizando un enlazador flexible (GGSG), creamos la proteína de fusión P97R1P46, que se coexpresó con otras dos proteínas en varias combinaciones.
Utilizando un sistema de expresión de células de insectos, conocido por sus altos niveles de expresión y modificaciones postraduccionales, optimizamos la secuencia de nucleótidos para los codones de insectos para garantizar una expresión efectiva. A través de la transposición y transfección en células SF9, obtuvimos los baculovirus recombinantes de generación P3 y expresamos las combinaciones de proteínas (P97R1P46, P97R1P46-P65, P97R1P46 + P65-P42) en células High Five. Estos se formularon en vacunas de subunidades y se utilizaron para inmunizar ratones en experimentos de desafío. Los resultados mostraron que, si bien la vacuna comercial indujo anticuerpos específicos más rápidamente, el grupo P97R1P46 + P65-P42 indujo niveles de anticuerpos comparables 7 días después de la inmunización, superando ligeramente a la vacuna comercial a los 28 días. Los ensayos de citocinas en sangre de ratón revelaron que el grupo de P97R1P46 + P65-P42 indujo significativamente la producción de IL-2 e IL-4 en comparación con los controles, y la citometría de flujo confirmó un mayor contenido de células T CD4+ en este grupo. Estos hallazgos sugieren que nuestra vacuna de subunidad P97R1P46 + P65-P42 induce inmunidad tanto humoral como celular en ratones. Los experimentos de desafío posteriores demostraron una eficacia protectora superior en este grupo, validando el enfoque de múltiples antígenos sobre las estrategias de un solo antígeno.
La expresión conjunta de estas tres proteínas para crear la vacuna de subunidad P97R1P46-P65-P42 para lechones indujo altos niveles de anticuerpos específicos e IL-4. Sin embargo, los niveles de IL-2 e IFN-γ no difirieron significativamente de los controles, lo que sugiere que la vacuna provocó principalmente inmunidad humoral en lugar de celular. Esto podría deberse a una presentación ineficiente de antígenos a las células T o a un contenido insuficiente de antígenos para desencadenar una fuerte respuesta de las células T, lo que resulta en una menor producción de IFN-γ e IL-2. ¿Por qué se observaron diferentes tendencias de citocinas en experimentos con ratones y lechones? Nuestra hipótesis es que esta discrepancia surge de las distintas funcionalidades de los sistemas inmunes innato y adaptativo en ratones y cerdos (28). Las respuestas inmunitarias de ratones y cerdos a antígenos extraños varían significativamente. Además, las células Th1 y Th2 pueden regularse mutuamente y restringir las funciones de la otra a través de las citocinas que segregan. Por ejemplo, las células Th1 secretan IFN-γ, que inhibe la proliferación de las células Th2, mientras que las células Th2 secretan IL-10, que suprime la función de las células Th1 (29). Los resultados también confirman que las vacunas deben probarse más bien en el huésped objetivo para obtener resultados verdaderos. El trabajo futuro debería centrarse en mejorar la inmunidad celular inducida por esta vacuna de subunidad. Las vacunas de partículas similares a virus (VLP, por sus siglas en inglés) podrían ser una solución potencial, ya que imitan eficazmente las estructuras y tamaños naturales de los virus, con antígenos completamente desplegados en sus superficies para una mejor presentación a las células T (30, 31). Las VLP también pueden actuar como adyuvantes, mejorando las respuestas inmunitarias a través de la activación y maduración de las células dendríticas, fundamentales para iniciar las respuestas de las células T (32, 33). Sin embargo, nuestra vacuna de subunidad P97R1P46-P65-P42 indujo con éxito altos niveles de inmunidad humoral, y la combinación de estas cuatro proteínas de antígeno representa un enfoque prometedor para la vacunación con Mhp.
5 Conclusión
En resumen, este estudio utilizó dos sistemas diferentes de expresión celular de insectos, a saber, el sistema Bac a Bac y el sistema MultiBac. Inicialmente, las proteínas preparadas utilizando el sistema Bac a Bac se combinaron con el adyuvante PGA en varias combinaciones (P97R1P46, P97R1P46-P65 y P97R1P46 + P65-P42) para formar vacunas de subunidades. Tras la inmunización con ratones y los experimentos de provocación, se identificó que la combinación que producía la mejor respuesta inmunitaria era P97R1P46 + P65-P42. Posteriormente, estas tres proteínas se coexpresaron utilizando el sistema MultiBac, y las proteínas expresadas se mezclaron con el adyuvante PGA para producir la vacuna de subunidad P97R1P46-P65-P42. Los experimentos de inmunización en cerdos demostraron que esta vacuna podía inducir un alto nivel de inmunidad humoral. Al incorporar cuatro proteínas antigénicas, esta vacuna de subunidad abordó el problema de la escasa eficacia observada con las vacunas de subunidad de antígeno único contra Mycoplasma hyopneumoniae, proporcionando información para el desarrollo de nuevas vacunas Mhp.
Declaración de disponibilidad de datos
Los datos brutos que respaldan las conclusiones de este artículo serán puestos a disposición por los autores, sin reservas indebidas.
Declaración ética
El estudio en animales fue aprobado por el Comité de Ética de Animales Experimentales de la Universidad Agrícola del Sur de China. El estudio se llevó a cabo de acuerdo con la legislación local y los requisitos institucionales.
Contribuciones de los autores
YH: Conceptualización, Curación de datos, Metodología, Software, Redacción – revisión y edición. KX: Curación de datos, Investigación, Software, Validación, Redacción (borrador original), Redacción (revisión y edición). ZY: Validación, Redacción – revisión y edición. TO: Redacción – revisión y edición. AD: Redacción – revisión y edición. BL: Validación, Redacción – revisión y edición. WZ: Visualización, Escritura – revisión y edición. YF: Redacción – revisión y edición. YS: Visualización, Escritura – revisión y edición. LW: Visualización, Redacción – revisión y edición. HD: Supervisión, Redacción – revisión y edición. MZ: Supervisión, Redacción – revisión y edición. SF: Recursos, Redacción – revisión y edición. LY: Supervisión, Redacción – revisión y edición. DZ: Adquisición de fondos, Administración de proyectos, Redacción – revisión y edición. JC: Conceptualización, Obtención de fondos, Administración de proyectos, Redacción, revisión y edición.
Financiación
El (los) autor(es) declara(n) que se recibió apoyo financiero para la investigación, autoría y/o publicación de este artículo. Esta investigación fue financiada por subvenciones del Programa de Ciencia y Tecnología de Guangzhou, China (No. 202206010161), el Proyecto de Incubación de Logros del Centro de Innovación Tecnológica de Wens y la Universidad Agrícola del Sur de China, Guangzhou, China (No. WS-HN-JKYZ-202404-118).
Conflicto de intereses
LW y DZ fueron empleados por Wen’s Foodstuffs Group Co., Ltd.
El resto de los autores declaran que la investigación se llevó a cabo en ausencia de relaciones comerciales o financieras que pudieran interpretarse como un potencial conflicto de intereses.
Nota del editor
Todas las afirmaciones expresadas en este artículo son únicamente las de los autores y no representan necesariamente las de sus organizaciones afiliadas, ni las del editor, los editores y los revisores. Cualquier producto que pueda ser evaluado en este artículo, o afirmación que pueda hacer su fabricante, no está garantizado ni respaldado por el editor.
Material complementario
El material complementario para este artículo se puede encontrar en línea en: https://www.frontiersin.org/articles/10.3389/fvets.2024.1493650/full#supplementary-material
Referencias
1. Jirawattanapong, P, Stockhofe-Zurwieden, N, van Leengoed, L, Wisselink, H, Raymakers, R, Cruijsen, T, et al. Pleuritis en cerdos de abasto: relaciones entre lesiones pulmonares y bacteriología en 10 rebaños con pleuritis alta. Res Vet Sci. (2010) 88:11–5. doi: 10.1016/j.rvsc.2009.06.007
Resumen de PubMed | Texto completo de Crossref | Google Académico
2. Minion, FC, Lefkowitz, EJ, Madsen, ML, Cleary, BJ, Swartzell, SM y Mahairas, GG. Secuencia del genoma de la cepa 232 de Mycoplasma hyopneumoniae, el agente de la micoplasmosis porcina. J Bacteriol. (2004) 186:7123–33. doi: 10.1128/JB.186.21.7123-7133.2004
Resumen de PubMed | Texto completo de Crossref | Google Académico
3. Vicca, J, Stakenborg, T, Maes, D, Butaye, P, Peeters, J, de Kruif, A, et al. Evaluación de la virulencia de aislados de campo de Mycoplasma hyopneumoniae. Microbiol veterinario. (2003) 97:177–90. doi: 10.1016/j.vetmic.2003.08.008
Resumen de PubMed | Texto completo de Crossref | Google Académico
4. Meyns, T, Dewulf, J, de Kruif, A, Calus, D, Haesebrouck, F y Maes, D. Comparación de la transmisión de Mycoplasma hyopneumoniae en poblaciones vacunadas y no vacunadas. Vacuna. (2006) 24:7081–6. doi: 10.1016/j.vaccine.2006.07.004
5. Tao, Y, Shu, J, Chen, J, Wu, Y y él, Y. Una revisión concisa de las vacunas contra Mycoplasma hyopneumoniae. Res Vet Sci. (2019) 123:144–52. doi: 10.1016/j.rvsc.2019.01.007
Resumen de PubMed | Texto completo de Crossref | Google Académico
6. Leal Zimmer, FMA, Paes, JA, Zaha, A, y Ferreira, HB. Patogenicidad y virulencia de Mycoplasma hyopneumoniae. Virulencia. (2020) 11:1600–22. doi: 10.1080/21505594.2020.1842659
Resumen de PubMed | Texto completo de Crossref | Google Académico
7. Simionatto, S, Marchioro, SB, Maes, D, y Dellagostin, OA. Mycoplasma hyopneumoniae: de la enfermedad al desarrollo de vacunas. Microbiol veterinario. (2013) 165:234–42. doi: 10.1016/j.vetmic.2013.04.019
8. Young, TF, Thacker, EL, Erickson, BZ, y Ross, RF. Un sistema de cultivo de tejidos para estudiar la adherencia epitelial ciliar respiratoria de micoplasmas porcinos seleccionados. Microbiol veterinario. (2000) 71:269–79. doi: 10.1016/s0378-1135(99)00176-5
Resumen de PubMed | Texto completo de Crossref | Google Académico
9. Hsu, T, y Minion, FC. Identificación del epítopo de unión al cilio de la adhesina P97 de Mycoplasma hyopneumoniae. Infectar a Immun. (1998) 66:4762–6. doi: 10.1128/IAI.66.10.4762-4766.1998
Resumen de PubMed | Texto completo de Crossref | Google Académico
10. Galli, V, Simionatto, S, Marchioro, SB, Fisch, A, Gomes, CK, Conceição, FR, et al. Inmunización de ratones con los antígenos P37, P42, P46 y P95 de Mycoplasma hyopneumoniae administrados como vacunas de ADN o subunidades recombinantes. Vacuna. (2012) 31:135–40. doi: 10.1016/j.vaccine.2012.10.088
11. Bouh, KCS, Shareck, F y Dea, S. Anticuerpos monoclonales contra las proteínas membranosas P46 y P65 expresadas por Escherichia coli para la inmunodetección específica de Mycoplasma hyopneumoniae en pulmones de cerdos infectados. Clin Diagn Lab Immunol. (2003) 10:459–68. doi: 10.1128/cdli.10.3.459-468.2003
Resumen de PubMed | Texto completo de Crossref | Google Académico
12. Gao, Z, Chen, L, Song, T, Pan, X, Li, X, Lu, G, et al. Una vacuna candidata multiepítopo contra el virus del síndrome respiratorio y reproductivo porcino y Mycoplasma hyopneumoniae induce una respuesta humoral y celular robusta en ratones. Vacuna. (2022) 40:2370–8. doi: 10.1016/j.vaccine.2022.03.021
Resumen de PubMed | Texto completo de Crossref | Google Académico
13. Tao, Y, Yang, R, Shu, J, Zheng, W, Chen, J, Wu, Y, et al. Respuestas inmunitarias inducidas por una vacunación combinada con una quimera recombinante de antígenos de Mycoplasma hyopneumoniae y partículas similares al virus de la cápside del circovirus porcino tipo 2. BMC Vet Res. (2020) 16:342. doi: 10.1186/s12917-020-02560-8
14. Liu, W, Jiang, P, Song, T, Yang, K, Yuan, F, Gao, T, et al. Una vacuna quimera recombinante compuesta por los antígenos LTB y Mycoplasma hyopneumoniae P97R1, Mhp390 y P46 provoca una respuesta inmunológica celular en ratones. Vacunas. (2023) 11:1291. doi: 10.3390/vacunas11081291
Resumen de PubMed | Texto completo de Crossref | Google Académico
15. Maes, D, Boyen, F, Devriendt, B, Kuhnert, P, Summerfield, A y Haesebrouck, F. Perspectivas para la mejora de las vacunas contra Mycoplasma hyopneumoniae en cerdos. Res. Veterinaria. (2021) 52:67. doi: 10.1186/s13567-021-00941-x
Resumen de PubMed | Texto completo de Crossref | Google Académico
16. Zhou, G, Tian, Y, Tian, J, Ma, Q, Huang, S, Li, Q, et al. La inmunización oral con Salmonella choleraesuis atenuada que expresa los antígenos P42 y P97 protege a los ratones contra el desafío de Mycoplasma hyopneumoniae. Microbiol Spectr. (2022) 10:E02361. doi: 10.1128/spectrum.02361-22
17. Chambers, AC, Aksular, M, Graves, LP, Irons, SL, Possee, RD y King, LA. Visión general del sistema de expresión de baculovirus. Curr Protoc Protein Sci. (2018) 91:5.4.1–6. doi: 10.1002/cpps.47
18. Kost, TA, y Kemp, CW. Fundamentos de la expresión y aplicaciones de baculovirus En: MC Vega editor. Tecnologías avanzadas para la producción y caracterización de complejos proteicos. Cham: Springer (2016). 187–97.
19. Sari, D, y Gupta, K., Raj, DBTG, Aubert, A, Drncová, P, Garzoni, F, et al. (2015). El sistema de vectores de expresión de células de insectos/baculovirus MultiBac para la producción de productos biológicos de proteínas complejas. Tecnologías avanzadas para la producción y caracterización de complejos proteicos. Springer: Cham. 199–215
20. Gupta, K, Tölzer, C, Sari-Ak, D, Fitzgerald, DJ, Schaffitzel, C, y Berger, I. MultiBac: entrega de carga de ADN multigénica mediada por baculovirus en células de insectos y mamíferos. Virus. (2019) 11:198. doi: 10.3390/v11030198
Resumen de PubMed | Texto completo de Crossref | Google Académico
21. Hsu, T, Artiushin, S, y Minion, FC. Clonación y análisis funcional del gen de la adhesina del cilio porcino P97 de Mycoplasma hyopneumoniae. J Bacteriol. (1997) 179:1317–23. DOI: 10.1128/jb.179.4.1317-1323.1997
Resumen de PubMed | Texto completo de Crossref | Google Académico
22. Reolon, LA, Martello, CL, Schrank, IS, y Ferreira, HB. Estudio de las proteínas de superficie de la cepa patógena 7448 de Mycoplasma hyopneumoniae utilizando un enfoque de marcaje de superficie de células de biotina. PLoS Uno. (2014) 9:E112596. doi: 10.1371/journal.pone.0112596
Resumen de PubMed | Texto completo de Crossref | Google Académico
23. Tacchi, JL, Raymond, BBA, Haynes, PA, Berry, IJ, Widjaja, M, Bogema, DR, et al. El procesamiento postraduccional se dirige a proteínas funcionalmente diversas en Mycoplasma hyopneumoniae. Abrir Biol. (2016) 6:150210. doi: 10.1098/rsob.150210
Resumen de PubMed | Texto completo de Crossref | Google Académico
24. Paes, JA, Lorenzatto, KR, de Moraes, SN, Moura, H, Barr, JR y Ferreira, HB. Los secretomas de Mycoplasma hyopneumoniae y Mycoplasma flocculare revelan diferencias asociadas a la patogenia. J Proteoma. (2017) 154:69–77. doi: 10.1016/j.jprot.2016.12.002
25. de Oliveira, NR, Jorge, S, Gomes, CK, Rizzi, C, Pacce, VD, Collares, TF, et al. Nueva proteína quimérica compuesta por antígenos recombinantes de Mycoplasma hyopneumoniae como candidato a vacuna evaluado en ratones. Microbiol veterinario. (2017) 201:146–53. doi: 10.1016/j.vetmic.2017.01.023
Resumen de PubMed | Texto completo de Crossref | Google Académico
26. Kim, MF, Heidari, MB, Stull, SJ, Mcintosh, MA, y Wise, KS. Identificación y mapeo de una región inmunogénica de la lipoproteína de superficie P65 de Mycoplasma hyopneumoniae expresada en Escherichia coli a partir de un fragmento genómico clonado. Infectar el sistema inmunológico. (1990) 58:2637–43. doi: 10.1128/iai.58.8.2637-2643.1990
Resumen de PubMed | Texto completo de Crossref | Google Académico
27. Jorge, S, de Oliveira, NR, Marchioro, SB, Fisch, A, Gomes, CK, Hartleben, CP, et al. La proteína de choque térmico recombinante P42 de Mycoplasma hyopneumoniae induce una respuesta inmunitaria en cerdos en condiciones de campo. Comp Immunol Microbiol Infect Dis. (2014) 37:229–36. doi: 10.1016/j.cimid.2014.07.001
Resumen de PubMed | Texto completo de Crossref | Google Académico
28. Haley, PJ . De los murciélagos a los pangolines: nuevos conocimientos sobre las diferencias entre las especies en la estructura y función del sistema inmunitario. Inmunidad innata. (2022) 28:107–21. doi: 10.1177/17534259221093120
Resumen de PubMed | Texto completo de Crossref | Google Académico
29. Zhang, Y, Zhang, Y, Gu, W y Sun, B. Diferenciación celular TH1/TH2 y señales moleculares. Adv Exp med biol. (2014) 841:15–44. doi: 10.1007/978-94-017-9487-9_2
30. Zhang, L, Xu, W, Ma, X, Sun, X, Fan, J y Wang, Y. Partículas similares a virus como vacuna antiviral: mecanismo, diseño y aplicación. Ing. Biotechnol Bioprocess (2023) 28:1–16. doi: 10.1007/s12257-022-0107-8
Resumen de PubMed | Texto completo de Crossref | Google Académico
31. Collett, S, Earnest, L, Carrera Montoya, J, Edeling, MA, Yap, A, Wong, CY, et al. Development of virus-like particles with inbuilt immunostimulatory properties as vaccine candidates. Front Microbiol. (2023) 14:1065609. doi: 10.3389/fmicb.2023.1065609
32. Liu, ZH, Deng, ZF, Lu, Y, Fang, WH, and He, F. A modular and self-adjuvanted multivalent vaccine platform based on porcine circovirus virus-like nanoparticles. J Nanobiotechnol. (2022) 20:493. doi: 10.1186/s12951-022-01710-4
33. Gupta, R, Arora, K, Roy, SS, Joseph, A, Rastogi, R, Arora, NM, et al. Plataformas, avances y desafíos técnicos en vacunas basadas en partículas similares a virus. Frente Immunol. (2023) 14:1123805. doi: 10.3389/fimmu.2023.1123805
Resumen de PubMed | Texto completo de Crossref | Google Académico
Palabras clave: neumonía porcina por Mycoplasma, sistema de expresión de baculovirus, vacunas de subunidades, inmunidad, coexpresión de múltiples promotores
Cita: He Y, Xie K, Yuan Z, Ouyang T, Dong A, Ling B, Zeng W, Fang Y, Song Y, Wang L, Ding H, Zhao M, Fan S, Yi L, Zhao D y Chen J (2024) Una vacuna de subunidad basada en P97R1, P46, P42 y P65 de Mycoplasma hyopneumoniae puede inducir una respuesta inmunitaria significativa en lechones. Frente. Vet. Sci. 11:1493650. doi: 10.3389/fvets.2024.1493650
Recibido: 09 de septiembre de 2024; Aceptado: 21 de octubre de 2024;
Publicado: 13 de noviembre de 2024.
Editado por:
Guoxin Li, Academia China de Ciencias Agrícolas (CAAS), China
Revisado por:
Mirinda Van Kleef, Consejo de Investigación Agrícola de Sudáfrica (ARC-SA), Sudáfrica
Jun Peng, Universidad Agrícola de Shandong, China
Derechos de autor © 2024 Él, Xie, Yuan, Ouyang, Dong, Ling, Zeng, Fang, Song, Wang, Ding, Zhao, Fan, Yi, Zhao y Chen. Este es un artículo de acceso abierto distribuido bajo los términos de la Licencia Creative Commons Attribution License (CC BY).
*Correspondencia: Dongfang Zhao, zhaodongfang1104@163.com; Jinding Chen, jdchen@scau.edu.cn
†Estos autores han contribuido a partes iguales a este trabajo y comparten la primera autoría
Página webEstos autores han contribuido a partes iguales a este trabajo y comparten la última autoría
Renuncia: Todas las afirmaciones expresadas en este artículo son únicamente las de los autores y no representan necesariamente a las de sus organizaciones afiliadas, o las del editor, de los editores y de los revisores. Cualquier producto que puede ser evaluada en este artículo o afirmación que puede ser hecha por su El fabricante no está garantizado ni respaldado por el editor.
Date de alta y recibe nuestro 👉🏼 Diario Digital AXÓN INFORMAVET ONE HEALTH
Date de alta y recibe nuestro 👉🏼 Boletín Digital de Foro Agro Ganadero
Noticias animales de compañía
Noticias animales de producción
Trabajos técnicos animales de producción
Trabajos técnicos animales de compañía