Vacuna BCG para el control de la tuberculosis en el ganado

Eficacia y seguridad de la vacuna BCG para el control de la tuberculosis en el ganado doméstico y la fauna silvestre
 Bryce M. Buddle1*,
Bryce M. Buddle1*,  Hans Martin Vordermeier2,
Hans Martin Vordermeier2,  Mark A. Chambers2,3 y
Mark A. Chambers2,3 y  Lin-Mari de Klerk-Lorist4
Lin-Mari de Klerk-Lorist4La tuberculosis bovina (TB) sigue siendo un problema insoluble en muchos países, en particular donde no se pueden aplicar políticas de «prueba y sacrificio» o donde los reservorios silvestres de la infección por Mycobacterium bovis sirven como fuente recurrente de infección para el ganado doméstico. Se necesitan urgentemente medidas de control alternativas y la vacunación es una opción prometedora. Aunque la vacuna M. bovis bacille Calmette-Guérin (BCG) se ha utilizado en humanos durante casi un siglo, su uso en animales ha sido limitado, principalmente porque la protección contra la TB ha sido incompleta y la vacunación puede dar lugar a que los animales reaccionen en la prueba cutánea de tuberculina. En los últimos 25 años se han obtenido valiosos conocimientos para optimizar la protección inducida por la vacuna BCG en animales y en el desarrollo de pruebas para diferenciar a los animales infectados de los vacunados (DIVA). Esta revisión examina los factores que afectan la eficacia de la vacuna BCG en el ganado, los ensayos de campo recientes, el uso de pruebas DIVA y la efectividad de la vacuna BCG en otro ganado doméstico, así como en la vida silvestre. Se ha demostrado que la administración oral de la vacuna BCG a los reservorios de infección de la vida silvestre, como los tejones europeos, las zarigüeyas de cola de cepillo, el jabalí y el ciervo induce la protección contra la tuberculosis y podría ser un medio práctico para vacunar a estas especies a escala. Las pruebas de la vacuna BCG en una amplia gama de especies animales han indicado que es segura y que la vacunación tiene el potencial de ser una herramienta valiosa para ayudar en el control de la tuberculosis tanto en el ganado doméstico como en la vida silvestre.
Introducción
La tuberculosis (TB) en el ganado doméstico y la vida silvestre es causada por Mycobacterium bovis, Mycobacterium caprae y otros miembros del complejo Mycobacterium tuberculosis, incluida M. tuberculosis, cuyo papel en la tuberculosis animal se reconoce cada vez más, particularmente en estudios de África y Asia (1). La tuberculosis ganadera sigue siendo un importante problema económico de sanidad animal en todo el mundo. Se ha estimado que >50 millones de bovinos están infectados en todo el mundo, con un costo de US $ 3 mil millones anuales (2). La enfermedad es una zoonosis importante, que causa TB en humanos, particularmente a través del consumo de leche no pasteurizada o a través de la cohabitación con animales infectados. Los programas de control de la tuberculosis bovina introducidos en muchos países a mediados del siglo XX lograron resultados espectaculares y varios países pudieron erradicar esta enfermedad. Sin embargo, estos programas de control no han sido asequibles ni socialmente aceptables en muchos países en desarrollo, y más del 94% de la población mundial vive en países en los que el control de la tuberculosis en el ganado vacuno o búfalo es limitado o está ausente (3). Además, un factor de confusión en el control de la tuberculosis bovina en varios países ha sido la existencia de reservorios de fauna silvestre de la infección por M. bovis.
La vida silvestre que sirve como huéspedes de mantenimiento para M. bovis incluye la zarigüeya australiana (Trichosurus vulpecula) en Nueva Zelanda, el tejón europeo (Meles meles) en el Reino Unido (UK) e Irlanda, el ciervo de cola blanca (Odocoileus virginianus) en Michigan, EE. UU. [revisado en (4)] y el jabalí euroasiático (Sus scrofa) en la Península Ibérica, España (5). Además, el ciervo rojo (Cervus elaphus) en varias partes de Europa (6), el búfalo africano (Syncerus caffer) en Sudáfrica (7), y el bisonte de madera (Bison bison athabascae) y wapiti (Cervus elephus manitobensis) en Canadá (8) sirven como huéspedes de mantenimiento para la infección en fincas de caza y parques nacionales. Estos diversos huéspedes de mantenimiento actúan como fuentes de infección para las especies domésticas, y en los parques nacionales, la infección puede extenderse a otras especies únicas de vida silvestre, como el lince ibérico (Lynx pardinus), los leones (Panthera leo), el leopardo (Panthera pardus) y los perros salvajes (Lycaon pictus). Se ha logrado un control parcial para algunos de estos huéspedes de mantenimiento minimizando el contacto con el ganado, reduciendo la densidad de animales o prohibiendo la alimentación artificial que causa altas densidades locales de animales (9-11). Sin embargo, pocas o ninguna de estas medidas de control pueden implementarse para algunas especies protegidas o cuando la interferencia de un ecosistema natural regulado se considera indeseable. Por estas razones, el desarrollo y uso de vacunas para el control de la tuberculosis tanto en ganado doméstico como en animales salvajes es muy atractivo.
Aunque actualmente no hay vacunas contra la tuberculosis registradas para la protección contra la tuberculosis en el ganado doméstico, existe un renovado interés en su uso debido a la comprensión del impacto financiero de la tuberculosis bovina en la salud y el comercio de animales, y debido a la dificultad para controlar la enfermedad. Además, el uso de vacunas para controlar la tuberculosis en los reservorios de infección de la fauna silvestre podría ser muy valioso para limitar la propagación de la infección al ganado doméstico y el bacilo de M. bovis Calmette-Guérin (BCG) se registró para la administración intramuscular a tejones en el Reino Unido en 2010. La evidencia del uso de una vacuna para controlar una enfermedad en la vida silvestre se ha demostrado a partir del éxito del uso de la vacunación para controlar la rabia en zorros en Europa (12). La vacuna BCG es la única vacuna contra la tuberculosis registrada para humanos y fue desarrollada por Calmette y Guérin a partir de una cepa de M. bovis originalmente aislada por Nocard de un caso de mastitis tuberculosa. Tras el paso en serie de la cepa en medio de glicerina biliar de buey y patata durante 230 pasos, entre 1908 y 1919, se demostró que esta cepa variante estaba atenuada en animales y confería resistencia al desafío de animales con M. bovis virulenta y M. tuberculosis [revisado en (13)]. La cepa se distribuyó a muchos países en la década de 1920 y el paso continuo en diferentes condiciones produjo un número considerable de cepas hijas, con diferentes perfiles antigénicos (14).
La vacunación de humanos comenzó en 1921 y en un metanálisis, la vacunación de recién nacidos y bebés redujo significativamente el riesgo de TB en un promedio de más del 50%, aunque la eficacia varió de 0 a 80% (15). Muchos ensayos de campo de la vacunación BCG del ganado se llevaron a cabo en la primera mitad del siglo XX y las principales advertencias que restringieron el uso de vacunas contra la tuberculosis en el ganado fueron que la protección no era completa y la vacunación podía sensibilizar a los animales para que respondieran en las pruebas tradicionales de diagnóstico de la tuberculosis. Estos problemas ahora pueden superarse potencialmente mediante el uso de la vacunación integrada con otras medidas de control y el uso de pruebas de diagnóstico que pueden diferenciar a los animales infectados de los vacunados (pruebas DIVA). Actualmente, existe un gran esfuerzo para desarrollar vacunas mejoradas contra la tuberculosis para humanos, mediante el desarrollo de vacunas que puedan reemplazar a BCG o aquellas que podrían aumentar la inmunidad después de la vacunación inicial con BCG (16). La investigación para desarrollar vacunas mejoradas contra la tuberculosis para el ganado está siguiendo un camino similar. La información sobre la eficacia de BCG en animales puede ser de ayuda en el desarrollo de estas vacunas de nueva generación para su uso en múltiples especies. Sin embargo, para la mayoría de las especies silvestres, los esfuerzos de vacunación se limitan al uso de una vacuna de una sola inyección, ya que el acceso a los mismos individuos para administrar un refuerzo no es realista. El objetivo de este documento es proporcionar una revisión de la eficacia y seguridad de la vacuna BCG en ganado doméstico y vida silvestre para ayudar a optimizar el uso de la vacuna BCG en animales, así como proporcionar una guía para el desarrollo de vacunas mejoradas contra la tuberculosis. Las vacunas contra la tuberculosis que no utilizan BCG se están estudiando para algunas aplicaciones, como una vacuna de células enteras de M. bovis inactivada por calor para el jabalí, pero estas no son el foco de esta revisión.
Vacunación del ganado
Estudios históricos de BCG
Los estudios de la vacuna BCG en bovinos fueron reportados por primera vez por Calmette y Guérin (17) y mostraron que dosis relativamente altas de BCG (20 mg) podrían inducir protección en bovinos contra el desafío experimental con M. bovis. En los estudios de Calmette y Guérin (18), la provocación intravenosa de terneros control con M. bovis virulenta dio lugar a una tuberculosis generalizada grave a los 30-60 días. En contraste, las vacunas BCG que fueron desafiadas permanecieron sanas, pero M. bovis virulento pudo aislarse de sus ganglios linfáticos bronquiales cuando los animales fueron sacrificados a los 3-4 meses después del desafío. Varios otros investigadores informaron resultados similares en estudios experimentales de desafío donde la vacunación con BCG no indujo inmunidad absoluta, pero moderó la gravedad de la infección [revisado en (19)]. Una comparación de las vías de vacunación con BCG mostró que las vías intravenosa, intradérmica y oral confirieron cierta resistencia a la alimentación con leche que contiene grandes dosis de M. bovis virulento, aunque no mayor que la conferida con la vacunación subcutánea (20). Los estudios de campo de la vacunación con BCG de bovinos utilizando una vía de vacunación subcutánea o intravenosa mostraron resultados variables que pueden haber sido influenciados en parte por la duración y la potencia de la exposición. Rankin (21) mostró resultados prometedores con un 86% (37 de 43) de no vacunados con lesiones tuberculosas en comparación con el 33% (22 de 66) para las vacunas con BCG a los 8-10 meses después de la exposición. Watson (22) llevó a cabo un estudio durante un período más largo en el que los terneros recién nacidos fueron vacunados con BCG por vía subcutánea (dosis de 50-100 mg), alimentados con leche pasteurizada durante 1-2 meses y luego expuestos a M. bovis a través de la ingestión de leche cruda de vacas infectadas o la cohabitación con ganado infectado. El estudio demostró que había buena resistencia en los terneros en comparación con los controles a 1 año después de la exposición, pero la resistencia disminuyó constantemente hasta la edad reproductiva, donde había poca evidencia de protección. Se realizaron varios ensayos no controlados para determinar si la vacunación con BCG podría eliminar la infección de TB en rebaños muy infectados. Algunos estudios informaron que la vacunación con BCG eliminó la enfermedad durante 7 años (23, 24), mientras que otros encontraron que este enfoque redujo la reactividad de la prueba cutánea y dio como resultado que los animales no vacunados recién introducidos (n = 100) permanecieran negativos en la prueba cutánea durante un período de 5 años después de la vacunación. Este enfoque se consideró poco práctico y lento (25).
Estos primeros estudios indicaron que BCG podría inducir cierta protección contra la TB, aunque la protección no era absoluta, parecía disminuir después de 1-2 años y la vacunación podría inducir una reactividad positiva en la prueba de tuberculina. Se concluyó que la tuberculosis podría erradicarse de manera más rápida y eficiente utilizando programas de control de «prueba y sacrificio» que confiar solo en la vacunación con BCG. Sin embargo, se consideró que la vacunación con BCG podría tener un papel en el control de la enfermedad en países donde los programas de «prueba y sacrificio» no podían implementarse debido a razones económicas o sociales, y se realizaron varios ensayos en Malawi en la década de 1970 con este fin. Ellwood y Waddington (26) mostraron que el desarrollo de lesiones tuberculosas e infección progresiva fue menor en las vacunas con BCG después del desafío experimental de M. bovis en comparación con los controles, lo que alentó a proceder con un estudio de campo. En el ensayo de campo, se inyectaron terneros de 3 a 12 meses de edad con 107 unidades formadoras de colonias (UFC) de BCG (cepa Glaxo) y revacunadas 6 meses después, mientras que los terneros alternos en cada rebaño fueron inoculados simuladamente (27). Cuando los animales fueron sacrificados y necropsiados 5 años después del inicio del estudio, no se encontraron diferencias significativas en el número de animales con lesiones tuberculosas, 36 de 204 (17,7%) en los vacunados y 44 de 210 (21,0%) en los controles. El número de bovinos que fueron bacteriológicamente positivos y aquellos con lesiones en más de un sitio también fueron similares para los dos grupos.
Las posibles razones de la falta de protección en los ensayos de campo podrían incluir la administración de altas dosis de BCG (1-100 mg por vía parenteral), un nivel muy alto de exposición a M. bovis, la exposición de terneros jóvenes a M. bovis a través del consumo de leche de vacas infectadas antes de la vacunación, la falta de protección a largo plazo y la sensibilización previa a micobacterias ambientales o helmintos. En relación a la dosis de BCG, Griffin et al. (28) demostraron en ciervos que la vacunación parenteral de una dosis alta de BCG (108 UFC) fue menos eficaz que las dosis de 104-107 UFC BCG, mientras que las dosis más altas de BCG en tejones parecían más eficaces (29). Esto sugiere que la dosis óptima de BCG para usar en cualquier especie dada probablemente tendrá que determinarse empíricamente. No se han realizado metanálisis informativos de ensayos de campo en bovinos debido a las diferentes dosis, vías de vacunación y cepas de BCG utilizadas, junto con diferentes métodos para medir la protección y los diferentes niveles de exposición a M. bovis. Además, rara vez se realizaron diseños sólidamente controlados y análisis estadísticos de los resultados y, en la mayoría de los estudios, los animales vacunados y no vacunados se mantuvieron en granjas separadas.
Estudios recientes para evaluar los factores que afectan la eficacia de la vacuna BCG en el ganado bovino
En los últimos 25 años, se ha llevado a cabo un gran número de ensayos de vacunación/provocación en bovinos utilizando modelos armonizados, lo que permite realizar comparaciones entre diversos estudios con BCG probado solo o en estudios comparativos con otras vacunas. Los modelos de desafío se han centrado en utilizar una dosis de provocación relativamente baja de M. bovis (103-104 UFC) administrada mediante inoculación endobronquial/intratraqueal o por aerosol (30, 31). Esto ha dado lugar al desarrollo de lesiones tuberculosas que imitan las de la enfermedad natural en el tracto respiratorio inferior. Se han utilizado cepas similares de BCG (inicialmente Pasteur, luego BCG Danish 1331) y la protección se ha evaluado mediante hallazgos cuantitativos brutos, histopatológicos y microbiológicos.
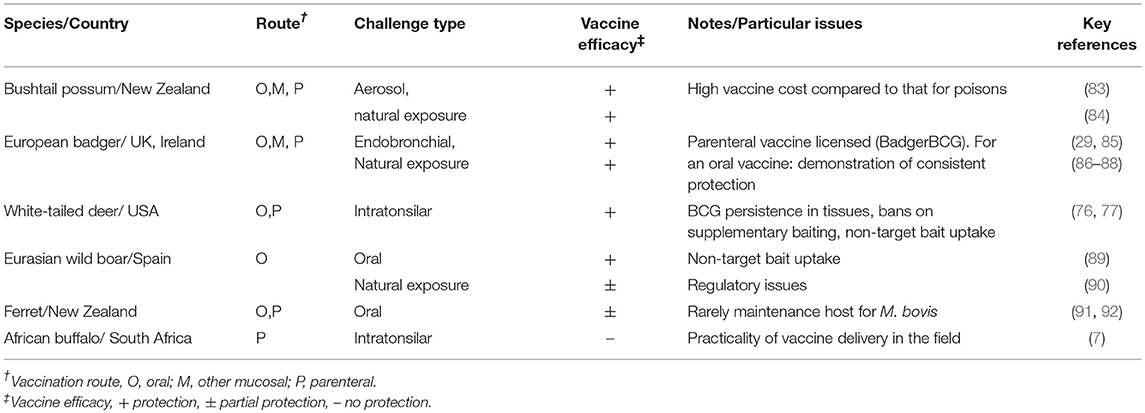
Es importante determinar los factores que influyen en la eficacia de BCG para optimizar el uso de la vacuna y la Tabla 1 resume muchos de estos factores. Los resultados de varios estudios han demostrado que dosis de 104-106 UFC de BCG administrada por vía parenteral inducida protección equivalente (30, 32), mientras que dosis más altas (108 UFC) fueron requeridas para inducir protección cuando BCG se administró por vía oral (33, 34). Cuando la vacuna BCG se administró a dosis óptimas, la protección inducida por vía subcutánea u oral fue muy similar, aunque una ventaja de la administración oral de BCG fue una reactividad cutánea de la tuberculina ligeramente menor. Las combinaciones de BCG por vía parenteral y mucosa han proporcionado resultados mixtos sin mejora de la protección observada cuando BCG se administró por vía subcutánea y oral el mismo día (35), pero una pequeña mejora en la protección con la administración simultánea de BCG por vía subcutánea y endobronquial (36). Las cepas Pasteur y danesas de BCG indujeron una protección similar, aunque la cinética de la respuesta inmune celular varió con las dos cepas (37, 38). Los terneros vacunados por vía subcutánea con la cepa Phipps de BCG tuvieron un rango medio más bajo para el número total de lesiones tuberculosas después de una dosis de provocación alta de M. bovis (105 UFC) administrada por aerosol en comparación con los controles, aunque esta diferencia no fue significativa (46). Los terneros neonatos o muy jóvenes estaban protegidos al menos tan bien como los terneros mayores (39, 40). En un estudio, la presensibilización natural a las micobacterias ambientales pareció tener un efecto adverso sobre la inmunidad posterior inducida por la vacuna BCG, con menos protección inducida en comparación con la de otras dos vacunas atenuadas contra M. bovis (41). Mientras que en otro estudio, hubo evidencia de que la exposición a M. avium indujo una protección parcial contra la infección por M. bovis, lo que posiblemente podría enmascarar la inmunidad posterior inducida por BCG (42). Los estudios en conejillos de indias y ratones han proporcionado información adicional sobre los efectos de la presensibilización con micobacterias ambientales donde algunas cepas de M. avium enmascararon o bloquearon cualquier efecto protector inducido por la vacunación con BCG, mientras que otras cepas no tuvieron ningún efecto (47, 48). Los estudios realizados en Irlanda del Norte indicaron que la coinfección del ganado bovino con una trematodo hepática, Fasciola hepatica y BCG dio lugar a una supresión de las respuestas inmunes de tipo Th1 a BCG, lo que podría afectar la inmunidad inducida por la vacunación con BCG (49). La vacunación del ganado bovino con BCG 3 semanas después de un desafío experimental con M. bovis, no produjo un efecto beneficioso, ni aumentó la patología tuberculosa (45). La protección contra el desafío experimental demostró ser efectiva a los ≤12 meses después de la vacunación, pero había disminuido a los 24 meses después de la vacunación (43). En conjunto, estos estudios sugieren que la inmunidad disminuye entre 1 y 2 años después de la vacunación cuando la protección se mide en un modelo estricto de desafío por M. bovis.
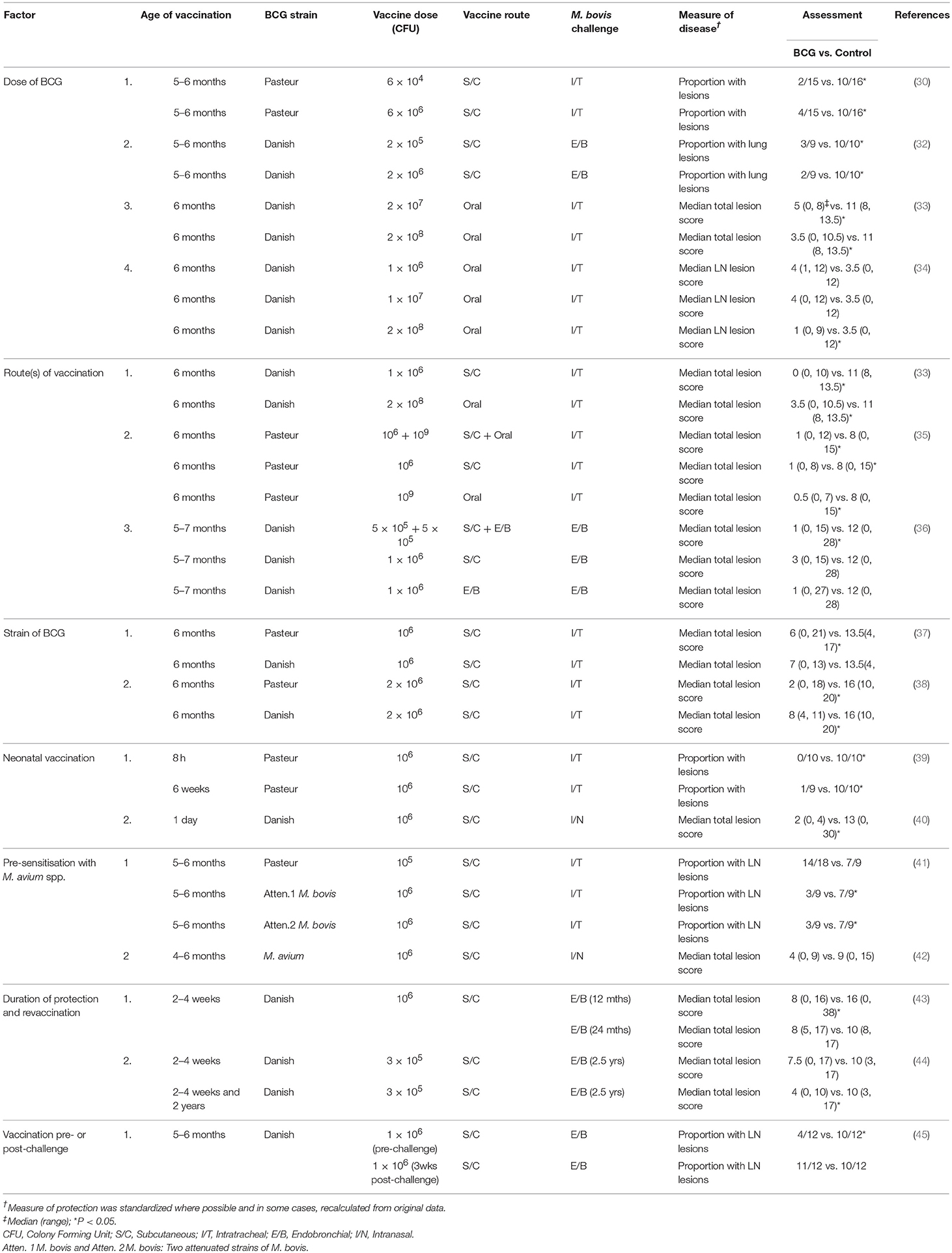 TABLA 1. Estudios experimentales de provocación para evaluar los factores que afectan la eficacia de la vacuna BCG para la protección del ganado contra la tuberculosis.
TABLA 1. Estudios experimentales de provocación para evaluar los factores que afectan la eficacia de la vacuna BCG para la protección del ganado contra la tuberculosis.
Dos estudios informan el efecto de la revacunación con BCG. En el primer estudio, los terneros vacunados dentro de las 8 h del nacimiento o a las 6 semanas de edad mostraron un alto nivel de protección contra M. bovis, mientras que los vacunados dentro de las 8 h posteriores al nacimiento y revacunados a las 6 semanas de edad tenían una protección reducida (39). Los terneros revacunados con el nivel más bajo de protección tuvieron las respuestas más fuertes de antígeno específico de IFN-γ después de la vacunación inicial, lo que sugiere que la revacunación había inducido una respuesta inmune inapropiada. En terneros neonatos, las respuestas de IFN-γ específicas de antígeno permanecen en niveles elevados durante más tiempo que las observadas en terneros más viejos, posiblemente debido a una infección más activa por BCG y la revacunación de BCG de terneros jóvenes puede estar contraindicada. En contraste, los terneros vacunados con BCG a las 2-4 semanas de edad y revacunados a los 2 años de edad cuando la inmunidad había disminuido, mostraron un nivel significativo de protección cuando fueron desafiados 6 meses después, mientras que aquellos que recibieron solo la dosis inicial de la vacuna no estaban protegidos cuando fueron desafiados al mismo tiempo (44).
En la última década, se han llevado a cabo varios ensayos o experimentos de vacunación con BCG en condiciones de transmisión natural (en contacto) y han proporcionado información sobre la efectividad de la vacuna BCG en diferentes niveles de prevalencia de la enfermedad durante diferentes períodos de tiempo (Tabla 2). Los experimentos de campo en México (50) y Etiopía (51, 52) involucraron la exposición de terneros vacunados y no vacunados a rebaños de vacas que tenían tasas de reactor del 40% en el experimento mexicano y del 100% en los dos experimentos en Etiopía. En el experimento mexicano, la vacunación indujo un nivel significativo de protección contra la tuberculosis y la eficacia de la vacuna se estimó en 59.4%. El nivel de exposición en los experimentos en Etiopía fue muy alto con ~ 85% de los terneros no vacunados desarrollando lesiones tuberculosas. A pesar de este alto nivel de exposición, la eficacia de la vacuna en el primer experimento se consideró similar a la del experimento mexicano y hubo significativamente menos animales vacunados con lesiones y cultivo positivo para M. bovis, así como significativamente más animales vacunados que habrían pasado la inspección de carne de matadero que la de los controles (51 ). La eficacia de la vacuna en el segundo experimento realizado en Etiopía cuando se midió comparando animales lesionados, con cultivo o histología positiva en el grupo vacunado con BCG con controles naïve fue relativamente baja (alrededor del 30%) (52). Sin embargo, en este último experimento, la gravedad de la patología y la diseminación de M. bovis fue significativamente menor en los animales vacunados e infectados en comparación con la de los animales no vacunados, lo que podría relacionarse con una menor capacidad de transmisión de la enfermedad (transmisión posterior). La diferencia entre los dos experimentos etíopes se atribuyó a una mayor prevalencia de signos clínicos manifiestos de TB en el rebaño infectado en el segundo experimento.
 TABLA 2. Ensayos de campo recientes para evaluar la eficacia de BCG para la protección del ganado contra la TB.
TABLA 2. Ensayos de campo recientes para evaluar la eficacia de BCG para la protección del ganado contra la TB.
Se realizó un gran ensayo de campo en Nueva Zelanda para evaluar la eficacia de la vacuna BCG administrada por vía oral (53). El ganado en libertad, vacunado y no vacunado se sembró a bajas densidades y estuvo expuesto naturalmente a M. bovis durante períodos de 1 a 4 años del ganado de reactor de tuberculina (prevalencia de rebaño de reactor de 5-10%) y un reservorio de infección de vida silvestre (zarigüeyas de cola de cepillo). La vacuna BCG se administró por vía oral al ganado en un intento de reducir la reactividad de la prueba cutánea de la tuberculina. Este ensayo incluyó 1.286 bovinos y en el momento del sacrificio la prevalencia de infección fue de 4,8% entre los vacunados y 11,9% en los no vacunados. La eficacia general de la vacuna se estimó en 67,4%, pero mayor para los muertos dentro de los 2 años posteriores a la vacunación (77,4%). La vacunación también pareció retrasar la progresión de la TB, con vacunas infectadas más propensas a no tener lesiones visibles y menos propensas a tener una puntuación de lesión alta.
En resumen, los experimentos de campo y los ensayos han demostrado que la vacunación con BCG puede reducir notablemente el número de bovinos infectados con M. bovis, que es diferente al observado en los ensayos experimentales de desafío donde la vacunación solo redujo la gravedad de la enfermedad. Sin embargo, una excepción fue en el ensayo de campo cuando hubo una exposición muy alta a M. bovis (52). Con los períodos de exposición más largos, parecía haber una disminución de la inmunidad después de 2 años (53).
Diferenciación de las pruebas de animales infectados de animales vacunados (DIVA)
Está bien establecido que la vacunación con BCG puede comprometer la interpretación de la prueba cutánea de tuberculina, que sirve como prueba de vigilancia primaria para las estrategias de control de la tuberculosis bovina de «prueba y sacrificio». Usando la prueba cervical comparativa intradérmica única, se demostró que el 80% de los terneros vacunados con BCG reaccionaron en la prueba cutánea de tuberculina a los 6 meses después de la vacunación, pero disminuyeron a 10-20% a los 9 meses después de la vacunación (54) y en otro estudio, la reactividad máxima de la prueba cutánea se observó después de 5 semanas, pero desapareció por completo a los 18 meses después de la vacunación (55 ). También se observaron respuestas positivas en la prueba cutánea del pliegue caudal a los 6 meses después de la vacunación con BCG en comparación con la de un grupo de control correspondiente, pero no hubo diferencias entre los grupos a los 12 meses después de la vacunación (44). Se requerirán pruebas DIVA para los países que tengan la intención de utilizar la vacunación BCG junto con las estrategias convencionales de control de «prueba y sacrificio». Las pruebas DIVA ahora se han desarrollado utilizando antígenos del complejo M. tuberculosis que no son expresados o secretados por BCG y pueden usarse en lugar de PPD bovino en la sangre total IFN-γ o pruebas cutáneas. Dos de los antígenos utilizados en las pruebas DIVA son las proteínas ESAT-6 y CFP10, que están codificadas en la región RD1 de M. tuberculosis y M. bovis, pero no en BCG, que ha perdido esta región de su genoma (56-58), y un tercer antígeno, Rv3615c, que no se localiza en la región RD1, pero su secreción depende del sistema de secreción de esx-1 localizado en la región RD1 (59 ). Una evaluación reciente de la prueba de IFN-γ de sangre total que incorpora ESAT-6, CFP10 y Rv3615c indicó que la sensibilidad fue similar a la de la lectura comparativa de tuberculina utilizando PPD aviar y bovino. Cuando se probaron en animales no infectados, tanto las lecturas de DIVA como las de tuberculina dieron especificidades similares de entre 97 y 99%. La especificidad relativa del análisis de sangre DIVA también fue alta (95%) en bovinos vacunados con BCG y fue significativamente mayor que la observada para la lectura de tuberculina (71%) (60). Un escenario para usar el análisis de sangre DIVA sería volver a analizar el ganado con tuberculina positiva; alternativamente, también es posible utilizar estos antígenos en una prueba cutánea en lugar de la prueba IFN-γ. La prueba cutánea DIVA en bovinos ha demostrado tener una alta sensibilidad para el ganado infectado con M. bovis, a un nivel similar al de la prueba cutánea cervical comparativa en ganado no vacunado, aunque no se ve comprometida por la vacunación con BCG o con vacunas contra la enfermedad de Johne (61, 62).
Vacunación de cabras
La infección de TB de las cabras es causada por M. bovis o M. caprae y en la enfermedad natural las lesiones se encuentran predominantemente en los pulmones y los ganglios linfáticos asociados, lo que indica una ruta de infección en aerosol (63). La enfermedad es responsable de pérdidas económicas en áreas endémicas y las cabras infectadas pueden ser una fuente de TB para el ganado o los humanos. La tuberculosis caprina está presente en varios países europeos, pero actualmente no existen campañas de control de la tuberculosis caprina en la Unión Europea. Para determinar la eficacia protectora de las vacunas, las lesiones macroscópicas y microscópicas se han evaluado mediante análisis cualitativos y cuantitativos, junto con cultivos micobacterianos de ganglios linfáticos asociados a pulmón. La determinación precisa de la carga total de la lesión pulmonar relacionada con el volumen pulmonar total se ha logrado mediante tomografía computarizada multidetector (64).
BCG vacuna danesa administrada por vía subcutánea a una dosis de 5 × 105 Se demostró que la UFC era segura y no se detectó pérdida de BCG en las heces de los niños vacunados ni en la leche de cabras lactantes vacunadas (65). BCG se aisló de un ganglio linfático que drenó el sitio de vacunación de un niño a las 8 semanas después de la vacunación, pero no de ninguna cabra a las 24 semanas después de la vacunación. Se demostró que una dosis única de la vacuna BCG administrada por vía subcutánea a cabras induce significativamente la protección contra un desafío endobronquial con M. caprae, con reducciones en la patología pulmonar y la carga bacteriana. La vacunación con BCG pareció prevenir la diseminación hematógena de micobacterias con lesiones de TB extratorácica que solo se encuentran en cabras no vacunadas (66). Una comparación de las vacunas administradas por vía parenteral BCG y M. bovis inactivadas por calor mostró que ambas vacunas proporcionaron niveles similares de protección contra un desafío experimental de M. caprae, con una reducción en el volumen de lesiones de TB torácica y lesiones extrapulmonares en comparación con los no vacunados (67). El uso de reactivos DIVA micobacterianos, ESAT-6 y CFP10, en la prueba IFN-γ fue capaz de diferenciar las cabras infectadas con TB de las vacunadas con BCG. Recientemente se realizó un ensayo de vacunación de campo con BCG en un rebaño de cabras infectadas con M. caprae (68). Veintitrés cabritos fueron vacunados por vía subcutánea con 105 CFU de BCG danés, con otros 22 niños que sirven como controles no vacunados. Dos meses después, los niños se mezclaron con un rebaño de cabras que tenía una tasa de reactor de TB del 79%. Dieciséis meses después, todas las cabras de prueba fueron asesinadas y necropsiadas. La vacunación redujo significativamente el número de animales con lesiones de TB en comparación con la de los no vacunados (35 y 77% respectivamente; lo que representa una eficacia de la vacuna del 53%) y cuando se consideraron los casos extrapulmonares, la reducción fue aún mayor (17 y 68%, respectivamente; eficacia de la vacuna del 75%). La vacunación se ha visto como una valiosa perspectiva de control a largo plazo, reduciendo la prevalencia de la tuberculosis antes de comenzar un programa de erradicación de pruebas y sacrificios que reduciría los costos económicos para los productores y el sector público.
Vacunación de ovejas
Las ovejas se han considerado tradicionalmente un huésped raro para el complejo M. tuberculosis, pero pueden ser parte de un sistema de múltiples especies que puede mantener la TB en una región, al menos en granjas mixtas donde las ovejas cohabitan con ganado vacuno y/o caprino infectados con TB (69). En un ensayo en el que los corderos fueron vacunados por vía parenteral con BCG Danish y posteriormente desafiados endobronquialmente con M. caprae, los corderos vacunados tuvieron una reducción significativa en las lesiones macroscópicas en comparación con los controles no vacunados (70). Todos los corderos desafiados desarrollaron lesiones macroscópicas en el sistema respiratorio, que fueron similares a las observadas en cabras desafiadas experimentalmente con M. caprae a una dosis similar.
Vacunación de ciervos
La tuberculosis en ciervos de granja y salvajes es causada predominantemente por M. bovis, y en los Estados Unidos y España, los ciervos salvajes también sirven como reservorio de vida silvestre de la infección por M. bovis, actuando como fuente de infección para el ganado doméstico (6, 10). Los ciervos sirven como importantes especies de ganado doméstico, cultivadas predominantemente para la producción de carne de venado, mientras que los ciervos salvajes son valorados para la caza. Las lesiones tuberculosas se describen comúnmente como licuadas o similares a abscesos en contraste con la naturaleza caseosa de las lesiones observadas en bovinos y caprinos (71, 72). El sitio más frecuente de las lesiones tuberculosas es en los ganglios linfáticos retrofaríngeos, seguido de lesiones en los pulmones y los ganglios linfáticos asociados, así como en los ganglios linfáticos mesentéricos (73). Se han realizado estudios de vacunación con BCG de ciervos para evaluar si la vacunación podría ser un método eficaz para proteger a los ciervos de granja de la tuberculosis y en ciervos salvajes para prevenir la reinfección en rebaños de ganado.
Los estudios de la vacuna BCG en ciervos rojos han demostrado que una dosis única de BCG administrada por vía subcutánea a ciervos de 3 meses de edad podría reducir la gravedad de la enfermedad, mientras que la revacunación de ciervos a intervalos de 8 a 16 semanas indujo protección contra la infección, pero no en un intervalo de 43 semanas (74). El aumento del período de tiempo entre la dosis de refuerzo y la provocación de M. bovis de 6 a 26 o 52 semanas no tuvo un efecto significativo sobre la protección. Dos dosis de 104-107 UFC de BCG indujo protección contra la TB, pero menos con una dosis de 108 UFC y BCG muerto en un adyuvante mineral en aceite no indujo protección (28). Un estudio en ciervo rojo en España comparó la administración oral de BCG danés (108 UFC) con administración oral de M. bovis inactivado por calor, 107 bacilos, seguido de un desafío experimental con M. bovis (75). Solo la vacuna inactivada por calor indujo una reducción significativa en la patología de la lesión en comparación con la de los no vacunados, sin embargo, los resultados se vieron limitados por tamaños de grupos muy pequeños (5 animales / grupo). Ninguna vacuna indujo una respuesta bovina PPD IFN-γ después de la vacunación. BCG parenteral administrado a una dosis de 106 UFC o BCG oral a los 108 CFU indujo un grado similar de protección en el venado de cola blanca (76). La vacunación parenteral con BCG Danish o Pasteur resultó en una disminución de la gravedad de la enfermedad, sin inmunidad estéril (77). Una dosis de refuerzo 6 semanas después no elevó el nivel de protección (78). Se demostró que el BCG persiste durante 3-9 meses en tejidos linfoides de ciervos vacunados por vía parenteral u oral (79). Se ha proporcionado evidencia de la transmisión de BCG de ciervos vacunados parenteralmente a ciervos no vacunados en contacto (77, 79). En otro estudio, los ciervos vacunados por vía oral con 109 CFU BCG Danish se alojó con ciervos no vacunados durante 27 semanas. Hubo evidencia inmunológica de transmisión de BCG a los animales no vacunados, pero no se pudo aislar BCG de los tejidos de ninguno de los grupos de animales cuando se mató 27 semanas después de la vacunación (80). No hubo evidencia (inmunológica o por cultivo) de transmisión de BCG al ganado que fue expuesto a la habitación previamente ocupada por los ciervos vacunados. Pueden ocurrir complicaciones con la entrega de cebos de vacunas orales a los ciervos salvajes, ya que la provisión de alimento suplementario a los ciervos salvajes puede llevar a que un gran número de ciervos se congreguen juntos, lo que resulta en la propagación de la TB (81), también hay preocupaciones sobre la absorción no objetivo de cebos vivos para vacunas, particularmente por el ganado. La modelización de simulación ha examinado el papel potencial que la vacunación podría desempeñar en los programas de control para minimizar las averías del ganado vacuno (82). Se predijo que la vacunación del 50-90% de los ciervos susceptibles dentro de un radio de 5 km de las granjas ganaderas daría como resultado una probabilidad del 95% de no tener averías del rebaño de ganado en 15-18 años.
BCG Vacunación de Vida Silvestre
Los requisitos para una vacuna para la fauna silvestre difieren de los del ganado doméstico en que, preferentemente, la vacuna se autoadministraría por vía oral y los animales solo recibirían una única vacuna. La vacunación debe prevenir la propagación de la infección a otros animales silvestres o ganado, pero no sería necesaria una protección completa contra la infección. Estudios recientes en múltiples especies de vida silvestre han demostrado que la vacuna BCG puede cumplir con estos requisitos y proporcionar protección contra la TB (Tabla 3).
Vacunación de zarigüeyas de cola de cepillo
La zarigüeya de cola de cepillo es el principal reservorio de vida silvestre de la infección por M. bovis en Nueva Zelanda, así como declarado como una plaga nociva. Las zarigüeyas son altamente susceptibles a la infección por M. bovis y las lesiones se encuentran predominantemente en los pulmones y los ganglios linfáticos superficiales. El sacrificio de zarigüeyas mediante captura y envenenamiento ha contribuido en gran medida a la drástica reducción del número de bovinos infectados en los últimos 20 años (11). La vacunación de zarigüeyas contra la tuberculosis tiene el potencial de ser una medida eficaz de control de la tuberculosis cuando no es adecuada para sacrificar zarigüeyas, como cerca de las zonas urbanas.
La vacunación con BCG de zarigüeyas a través de varias rutas diferentes, incluidas las subcutáneas, intranasales y orales, ha inducido un nivel significativo de protección contra el desafío experimental de M. bovis por vía intratraqueal y en aerosol (83, 93). La administración oral de BCG a través de cebos sería la vía preferida de administración de la vacuna BCG a zarigüeyas silvestres, pero se demostró que la administración directa de BCG por vía intragástrica fue menos efectiva en comparación con la administrada por la misma vía y mezclada con un fármaco para reducir la acidez gástrica o cuando se administra intraduodenalmente (94, 95 ). Para aumentar la eficacia de la vacuna BCG administrada por vía oral, los bacilos BCG se encapsularon en una matriz lipídica que protegió a las bacterias de la degradación en el ambiente ácido del estómago, lo que resultó en una mejor protección contra un desafío de M. bovis, así como en un aumento de la vida útil de la vacuna en el campo (83, 96 ). Se demostró que la inmunidad inducida por la vacuna disminuyó entre 6 y 12 meses después de la vacunación después de la vacunación oral y no hubo diferencias entre las dosis de BCG de 107 y 108 UFC o entre cepas danesas y Pasteur de BCG (97). Un estudio más reciente indicó que la protección contra una infección experimental por M. bovis se extendió hasta 28 meses después de la vacunación (98). Se demostró que los bacilos BCG son estables en la matriz lipídica durante 7 semanas en condiciones de temperatura ambiente y de 3 a 5 semanas en condiciones de campo en un hábitat de bosque / pasto, cuando se mantienen en sobres de entrega de cebo resistentes a la intemperie. Además, se demostró que la aceptación de las vacunas placebo de cebo oral era alta, ya que el 85-100% de las zarigüeyas silvestres accedían a cebos a densidades de cebo de 40-80 sobres / hectárea (96). Zarigüeyas que consumen la vacuna BCG de cebo oral, que contiene 108 UFC de BCG, no mostró signos clínicos adversos, pero arrojó concentraciones relativamente bajas de BCG en sus heces, 102-104 Las heces CFU/g, hasta por una semana y BCG podrían aislarse de sus ganglios linfáticos mesentéricos hasta 8 semanas después de la vacunación (99).
Se han realizado dos ensayos de campo en zarigüeyas para determinar la eficacia de la vacuna BCG contra la exposición natural a la infección por M. bovis. En el primer ensayo, la vacuna BCG se administró por vía intranasal e intraconjuntival (dosis total de 106 UFC de BCG Pasteur) a zarigüeyas atrapadas en el campo, con un número equivalente no vacunado. Después de la vacunación, los animales fueron liberados de nuevo en el sitio de campo, que era endémico para la tuberculosis en la vida silvestre (100). Los animales fueron atrapados, examinados para detectar TB clínica y liberados nuevamente cada 2 meses. Dos años después del inicio del estudio, las zarigüeyas fueron recapturadas, asesinadas y examinadas para detectar lesiones de tuberculosis. La vacunación redujo significativamente la proporción de zarigüeyas infectadas con M. bovis (4/149 para los vacunados y 13/151 para los no vacunados), con una eficacia de la vacuna del 69% para la prevención de la tuberculosis. El segundo estudio de campo fue de un diseño similar, pero con vacuna BCG administrada por vía oral en una matriz lipídica (dosis total 108 CFU BCG danés). Una vez más, hubo una reducción significativa en la proporción de zarigüeyas infectadas en las vacunas (1/51) en comparación con la de las no vacunadas (12/71), con una eficacia de la vacuna del 95% para la prevención de la TB (84). En contraste con los estudios experimentales de provocación, la protección contra la exposición natural a la vacunación contra M. bovis dio lugar a la protección contra la infección. La principal limitación para el uso de la vacuna BCG en zarigüeyas en Nueva Zelanda es el costo de la vacuna en comparación con el de los venenos, particularmente cuando las zarigüeyas se consideran una plaga nociva.
Vacunación de tejones
El tejón europeo es el principal reservorio de fauna silvestre de la infección por M. bovis en Gran Bretaña debido a su relativa abundancia y ecología, la prevalencia de infección y la presentación de patología tuberculosa en comparación con otras especies silvestres (101, 102). Las opciones para prevenir la transmisión de M. bovis de tejones infectados al ganado vacuno se limitan a minimizar el potencial de contacto entre ellos (bioseguridad), reducir el número y la densidad de tejones infectados mediante el sacrificio selectivo y no selectivo y la vacunación [revisado en (103)]. Los tejones están protegidos por la ley en el Reino Unido e Irlanda, lo que limita la aceptabilidad pública y la practicidad del sacrificio y para el control de enfermedades, y el sacrificio de tejones en Inglaterra e Irlanda a veces ha arrojado resultados contradictorios que probablemente reflejan diferencias sutiles en la epidemiología de la enfermedad a nivel local (104). La vacunación de tejones contra la tuberculosis tiene el potencial de ser una medida eficaz de control de la tuberculosis, especialmente en combinación con otras medidas de control (105) y se han logrado avances considerables en las pruebas de la eficacia de la vacuna BCG en tejones.
La vacuna BCG se ha administrado a tejones a través de una variedad de vías, incluyendo subcutánea, intramuscular y mucosa (conjuntival y oral) y la vacunación por todas estas vías ha inducido una protección significativa contra el desafío endobronquial experimental con M. bovis [revisado en (103)]. El uso de BCG para vacunar tejones contra la tuberculosis en el Reino Unido por vía intramuscular fue autorizado por la Autoridad Competente del Reino Unido (Dirección de Medicamentos Veterinarios) en 2010 como BadgerBCG y está disponible para su uso por veterinarios y vacunadores laicos capacitados bajo prescripción de un veterinario. La licencia de BadgerBCG requirió evidencia de seguridad y eficacia de la vacuna y los estudios de laboratorio y de campo mostraron que la vacunación de tejones por inyección con BCG fue segura y redujo significativamente las lesiones de TB causadas por M. bovis (29, 106). La protección fue incompleta, ya que la infección por M. bovis de tejones vacunados todavía producía patología visible o M. bovis se aisló de órganos en la necropsia. Los resultados de un estudio de campo de 4 años de BCG en tejones salvajes fueron consistentes con el efecto protector directo de BCG observado en estudios experimentales. Los tejones individuales que inicialmente dieron negativo a un panel de pruebas de diagnóstico, presuntamente no infectados, tenían significativamente menos probabilidades de dar positivo posteriormente a las pruebas serológicas e inmunológicas para la TB después de la vacunación, en comparación con los animales de control no vacunados (86, 107). Además, los cachorros no vacunados capturados en grupos sociales vacunados tenían significativamente menos probabilidades de dar positivo a la TB cuando más miembros de su grupo habían sido vacunados previamente. La explicación más plausible para este resultado es que BCG había causado un efecto de inmunidad colectiva, con la tasa de transmisión de M. bovis reducida más eficazmente en grupos sociales donde una mayor proporción de animales habían sido vacunados.
Una limitación práctica para el uso extensivo de BadgerBCG es la necesidad de atrapar tejones antes de que se pueda inyectar la vacuna y el uso de un sistema de administración de cebo oral sería ventajoso. BCG se ha incorporado en una amplia variedad de cebos, incluida la encapsulación en la misma matriz lipídica utilizada para administrar BCG por vía oral a las zarigüeyas. Se ha demostrado que la administración de BCG por vía oral a tejones cautivos, ya sea directamente en la parte posterior de la garganta o indirectamente a través de cebo ingerido, protege a los tejones contra el desafío experimental con M. bovis y no hubo diferencia en los niveles de protección inducidos por Pasteur y las subcepas danesas de BCG (85, 108). Para evaluar la seguridad de la vacuna, los tejones recibieron una dosis oral de 109 UFC de BCG, seguida 14 días después por una dosis oral única de 107 UFC BCG (109). No se observaron efectos físicos adversos, ni efectos sobre el comportamiento social y los hábitos alimenticios de los animales vacunados. BCG se cultivó a partir de las heces de dos de los nueve animales vacunados (102 UFC/g) ~48 h después de la administración de la dosis más alta de BCG y por uno de los nueve animales vacunados (80 UFC/g) ~24 h después de recibir la dosis más baja de BCG. No se encontró evidencia de la transmisión de BCG a tejones centinela no vacunados alojados con los animales vacunados a pesar de la excreción ocasional de BCG en las heces. La dosis objetivo de BCG para la vacunación oral de tejones aún no se ha definido.
Recientemente se completó un ensayo de campo en Irlanda que proporcionó la primera estimación de la eficacia oral de BCG en condiciones de campo (87). El BCG encapsulado en lípidos se administró en la parte posterior de la garganta de los tejones anestesiados, mientras que otros tejones recibieron solo el lípido como placebo. El área de estudio se dividió en tres zonas igualmente representativas con diferentes proporciones (0, 50 y 100%) de la población de tejones en cada zona vacunada con BCG o placebo. Se hicieron intentos para capturar tejones cada 6 meses y entre los dos primeros períodos de captura la eficacia de la vacuna se estimó en 36%, mientras que fue del 84% para los períodos de captura 3-6. Entre los tejones vacunados que se seroconvirtieron, la mediana de tiempo hasta la seroconversión (413 días) fue significativamente mayor en comparación con los animales no vacunados (230 días). Además, hubo una reducción significativa en la proporción de animales que presentaron lesiones confirmadas por cultivo de M. bovis en la zona totalmente vacunada (100%) (9%), en comparación con la zona no vacunada (0%) (26%).
Vacunación del jabalí
El jabalí sirve como el principal reservorio de fauna silvestre del complejo M. tuberculosis (MTC) en las regiones mediterráneas de la Península Ibérica, España y la prevalencia de TB en jabalíes se ha asociado con la aparición de TB en granjas ganaderas (110, 111). Los jabalíes están muy extendidos en Eurasia y se pueden encontrar en altas densidades, particularmente en fincas de caza (112). Estos animales son altamente susceptibles a la infección por CMT y las lesiones se encuentran con mayor frecuencia en los ganglios linfáticos mandibulares, aunque a menudo se observa enfermedad generalizada, con afectación de los pulmones y los ganglios linfáticos torácicos (113). Se cree que el contacto directo entre el jabalí y otras especies es muy raro en los hábitats mediterráneos y se considera que la transmisión entre especies de MTC que involucra jabalíes ocurre indirectamente en lugares como pozos de agua (114). Aunque la transmisión de la tuberculosis entre el jabalí y el ganado podría minimizarse mediante el sacrificio de jabalíes y la prevención del contacto entre especies, la vacunación podría ser una medida de control de enfermedades más rentable y sostenible.
Vacunación oral con BCG danés (106 UFC/dosis) ha producido una protección significativa (reducción de la puntuación de la lesión del 70-80%) en ensayos de provocación de laboratorio (89, 115). La atención se ha centrado en vacunar a los lechones, ya que tienen menos probabilidades de infectarse y pueden ser atacados en el momento adecuado de la entrega de cebo y con el uso de un sistema patentado de entrega de cebo que reduce la absorción por especies no objetivo y excluye el jabalí adulto (116). En un estudio de seguridad reciente, los jabalíes fueron dosificados con un cebo oral que contenía 106 La UFC de BCG y los grupos de animales vacunados se mataron a los 1, 3, 5 y 9 meses después de la vacunación (117). No se observaron signos clínicos adversos y los tejidos recogidos de los animales fueron cultivos negativos para BCG. Un ensayo de campo realizado entre 2012 y 2016 probó las tasas de aceptación y la eficacia de las vacunas BCG administradas por vía oral y M. bovis inactivadas por calor en entornos de alta prevalencia (40-80% de prevalencia de infección por jabalí) en Montes de Toledo, España (90). Las dos vacunas se probaron en diferentes sitios, uno administrado y otro natural (o no administrado) para cada vacuna, con 15 sitios de control adicionales no vacunados. Los cebos para vacunas se desplegaron utilizando comederos de lechones seleccionados y las tasas de aceptación fueron del 50-74% en los sitios naturales y del 89-92% en los sitios manejados. Solo se observó una reducción significativa en la prevalencia de TB en un sitio vacunado: vacuna contra M. bovis inactivada por calor en el sitio administrado; con una reducción del 34% en la prevalencia de animales con lesiones. Una limitación del estudio fue que las vacunas se administraron en diferentes sitios y la eficacia se midió por el cambio en la prevalencia de lesiones de TB en comparación con el tiempo cero.
Vacunación de hurones
En Nueva Zelanda, los hurones (Mustela furo) pueden infectarse con M. bovis al alimentarse de cadáveres tuberculosos, particularmente zarigüeyas y potencialmente pueden convertirse en una fuente de infección para otros animales silvestres o ganado (118). En la mayoría de los casos, los hurones son simplemente huéspedes indirectos y, hasta el momento, no hay confirmación de que los hurones actúen como verdaderos anfitriones de mantenimiento en Nueva Zelanda. Más bien, los hurones podrían caracterizarse como huéspedes indirectos prolongados en los que la infección por M. bovis adquirida originalmente de zarigüeyas podría ocasionalmente circular dentro de una población de hurones antes de desaparecer (119). La vacunación se ha considerado como una posible medida de control para hurones y en el primero de dos ensayos de vacunación, los hurones vacunados por vía oral con BCG incorporado en la carne dietética fueron parcialmente protegidos contra el desafío oral con M. bovis virulento (91). En el segundo ensayo, la vacunación de hurones con BCG por vía subcutánea dio lugar a una reducción de la gravedad de la enfermedad después de la infección experimental con M. bovis (92).
Vacunación del búfalo africano
La infección por M. bovis es actualmente endémica en el Complejo del Parque Nacional Greater Kruger y el Parque Hluhluwe-iMfolozi (120, 121), así como en varias granjas privadas y conservaciones en Sudáfrica (122). Es probable que los búfalos africanos sean los principales huéspedes de mantenimiento de la tuberculosis (123) y desempeñen un papel importante en la infección por contagio a otras especies de vida silvestre, y de particular importancia es la propagación de la infección a depredadores (leones), grandes exploradores (rinoceronte blanco) y otras especies ubicadas conjuntamente como kudu, babuinos y jabalíes (124). Además, se ha producido un «derrame» en el ganado doméstico (125). Como la «prueba y sacrificio» no es una opción viable para los búfalos criados en libertad debido a la impracticabilidad logística y el extenso rango geográfico de los animales, la vacunación sigue siendo la única alternativa realista.
Se realizó un ensayo preliminar de la vacuna en búfalos de rango semi-libre para evaluar la eficacia de la vacuna BCG. Se administraron dos dosis de BCG por vía subcutánea (107 UFC de BCG) y los búfalos fueron desafiados con M. bovis virulento a través de la ruta intraamigdalar. El estudio no reveló diferencias significativas en el número de animales lesionados entre los grupos vacunados y control (7). Hubo varios factores contribuyentes que podrían haber desempeñado un papel en los resultados negativos percibidos, como la edad de los animales vacunados, la mayoría de los cuales tenían más de 12 meses al inicio del estudio, la vía de aplicación de la vacuna, la dosis de provocación, la exposición a micobacterias no tuberculosas y el estrés en los animales con limitaciones de pastoreo. Los estudios futuros deben tener como objetivo determinar si la vacunación con BCG podría reducir la TB en los rebaños vacunados en comparación con los rebaños no vacunados al dirigirse a los búfalos de < 12 meses de edad y monitorizar durante un período de 5 a 10 años para determinar el verdadero estado de la enfermedad. Si tiene éxito, la vacunación podría tener un efecto positivo en cascada, reduciendo las tasas de enfermedad por M. bovis en otras especies animales. Los datos disponibles no sugieren ningún riesgo para las especies «fuera del objetivo» de la entrega de BCG, lo que reduce las barreras éticas para la implementación.
Seguridad de la vacuna BCG en especies objetivo y no objetivo
La vacuna BCG es una de las vacunas humanas más utilizadas, con 100 millones de niños que reciben la vacuna anualmente y sigue siendo una de las vacunas más seguras disponibles. Los informes de reacciones adversas derivadas de la vacunación con BCG en niños son relativamente poco comunes y Murphy et al. han proporcionado recientemente una revisión de las reacciones a la vacuna BCG en humanos y animales (126). Las reacciones más graves a la vacuna BCG en humanos fueron a menudo el resultado de la vacunación de individuos inmunocomprometidos y los factores que influyeron en el desarrollo de reacciones adversas incluyeron la potencia y la dosis de la cepa de la vacuna, la vía de administración, la edad y el estado inmunológico del huésped y la habilidad del operador que administra la vacuna. Las reacciones más comunes fueron reacciones locales y regionales, que generalmente fueron autolimitadas, donde la linfadenitis supurativa y los abscesos fueron las reacciones más frecuentes.
La vacuna BCG se ha probado en un gran número de especies animales (Tabla 4) y se han observado signos clínicos adversos relativamente menores en algunos casos. En bovinos, Francis (19) describió lesiones locales surgidas tras la administración subcutánea de grandes dosis de BCG, similares a las observadas con la inoculación de grandes dosis de bacilos muertos, pero no se produjeron lesiones progresivas y los bacilos se eliminaron gradualmente del organismo. La repetición de la aprobación de la vacuna BCG en especies animales aún no se ha llevado a cabo para garantizar que no se revierta a la virulencia, pero la evidencia de su uso en humanos durante casi un siglo ha enfatizado la seguridad de la vacuna.
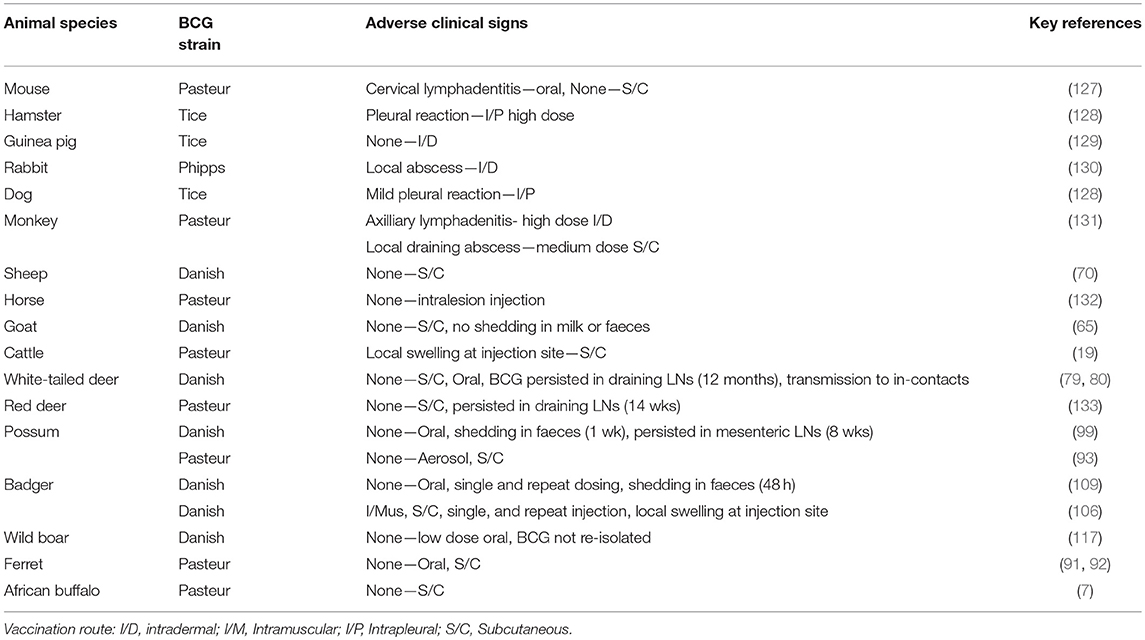 TABLA 4. Estudios de seguridad de la vacuna BCG de diferentes cepas en especies animales diana y no diana.
TABLA 4. Estudios de seguridad de la vacuna BCG de diferentes cepas en especies animales diana y no diana.
Se han observado abscesos o nódulos locales después de inyecciones subcutáneas de BCG en varias otras especies animales y estos se resolvieron con relativa rapidez (Tabla 4). No se han observado efectos adversos después de la administración oral de BCG en animales distintos de la linfadenitis cervical observada en ratones (127), similar a una reacción observada ocasionalmente en niños jóvenes vacunados (126). Después de la dosificación oral con BCG de zarigüeyas y tejones, se observó un desprendimiento transitorio de un bajo número de BCG en las heces (99, 109). La transmisión de BCG de animales vacunados a no vacunados en contacto solo se ha registrado en ciervos de cola blanca (79). Existe el riesgo de que la distribución de cebos orales que contengan BCG para la fauna silvestre pueda dar lugar a la absorción por especies animales no objetivo, como el ganado, lo que dará lugar a una respuesta positiva posterior a la prueba cutánea de tuberculina y, por lo tanto, es esencial tener especial cuidado con respecto a la distribución del cebo. La posibilidad de que el ganado se infecte con BCG por contaminación fecal de pastos o alimento de fauna silvestre vacunada sería muy rara, ya que la reactividad de la prueba cutánea de tuberculina después de la administración oral de BCG al ganado solo se ha registrado con altas dosis de BCG (≥107 UFC) (34). Similar a la situación en humanos, la vacuna BCG se considera una vacuna segura en todas las especies animales probadas.
Conclusiones
Los estudios experimentales de provocación en ganado doméstico, incluidos bovinos, caprinos, ovinos y ciervos de granja, han demostrado que la vacunación con BCG puede moderar la gravedad de la enfermedad, mientras que los ensayos de campo en bovinos y caprinos han indicado que la vacunación también puede reducir la infección. No se ha demostrado que una sola vacuna sea mejor que la BCG en el ganado vacuno, aunque las combinaciones de BCG con varias vacunas contra la tuberculosis de subunidades han producido resultados alentadores y podrían tener aplicación en el futuro [revisado en (2, 134)]. La vacunación del ganado bovino con BCG tendría mayor aplicación en países donde las estrategias de «prueba y sacrificio» no son asequibles o socialmente aceptables y, en esta situación, BCG podría desempeñar un papel en la reducción de la propagación de la tuberculosis bovina. Es bien sabido en humanos que el BCG confiere algunos efectos protectores no específicos contra otros patógenos (135), pero esto aún no se ha evaluado en el ganado. La mejora de la salud general de los animales per se y/o el aumento de la productividad después de la vacunación con BCG podrían tener beneficios en los países en desarrollo. El uso estratégico de la vacuna BCG para el ganado también podría implementarse en regiones donde la vida silvestre sirve como reservorios de infección, particularmente donde no es factible contener la propagación de la infección de la vida silvestre. En estas situaciones, las pruebas DIVA, en particular las pruebas cutáneas que utilizan antígenos específicos de M. bovis, podrían utilizarse en el ganado en asociación con la vacunación para permitir que la vacunación se integre con las medidas de control de «prueba y sacrificio».
Se pueden hacer una serie de recomendaciones a partir del desafío experimental y los experimentos de campo en ganado. Los terneros deben vacunarse con BCG lo más jóvenes posible, de manera óptima a las 2-4 semanas de edad, a dosis de 105-106 UFC parenteral o 108 UFC por vía oral y no se han detectado diferencias en la protección inducida por dos de las cepas de BCG más utilizadas, Pasteur y Danesa. Se ha demostrado que la protección disminuye entre 1 y 2 años después de la vacunación y se recomienda la revacunación cada 1-2 años para mantener los niveles de inmunidad. La vacuna BCG ha demostrado ser segura en el ganado y la vacunación del ganado preinfectado con M. bovis no es probable que exacerbe o cure la infección. Es probable que la vacunación produzca reacciones falsas en las pruebas tradicionales de diagnóstico de TB en los primeros 12 meses después de la vacunación y, como la protección inducida por BCG no es completa, se deben usar pruebas DIVA si existen políticas de control de «prueba y sacrificio». Sería preferible utilizar la vacunación BCG en asociación con otras medidas de control de la tuberculosis, como minimizar la posibilidad de exposición temprana a M. bovis alimentando a los terneros jóvenes con calostro o leche de ganado no reactor o con leche caliente, segregando el ganado del reactor y no reactor en rebaños separados y manteniendo a los terneros vacunados con los animales no reactores.
Las pruebas de campo de la vacuna BCG en zarigüeyas y tejones administradas por vía oral o parenteral han dado lugar a la inducción de reducciones significativas en la infección de estos animales y una vacuna BCG parenteral ha sido autorizada para su uso en tejones en el Reino Unido. En jabalíes, ciervos salvajes y hurones, se ha demostrado que la vacuna BCG induce niveles significativos de protección contra el desafío experimental con TB. Se han establecido sistemas prácticos para la administración de vacunas orales contra la tuberculosis con cebo a la fauna silvestre, pero se necesita más investigación para mejorar las formulaciones de cebo oral con atrayentes apropiados, sistemas para optimizar la distribución del cebo y evitar la absorción de cebo por especies no objetivo. La vacuna BCG ha demostrado ser segura en todas las especies animales probadas, aunque BCG se ha aislado de los ganglios linfáticos que drenan los sitios de vacunación y de las heces de los animales durante un corto período después de la vacunación oral. Hubo evidencia de que el venado de cola blanca vacunado podría transmitir BCG a compañeros de corral no vacunados, pero no al ganado expuesto a la habitación previamente ocupada por los ciervos vacunados.
En resumen, ha habido avances importantes en los últimos 10-20 años en nuestra comprensión de los factores que influyen en la eficacia de la vacuna BCG para el ganado doméstico y los animales salvajes. Para optimizar el uso de la vacuna BCG, será importante continuar probando la vacuna BCG en las diversas especies animales en diferentes entornos, sistemas de cría y en presencia de diferentes niveles de prevalencia de la enfermedad, así como evaluar la aplicación práctica de las pruebas DIVA. Aunque la vacuna BCG puede no proporcionar una protección completa contra la exposición a M. bovis, la protección debe ser suficiente para reducir notablemente la transmisión a otros animales. Esta característica podría garantizar que la vacuna BCG podría ser particularmente valiosa para reducir la infección en poblaciones de vida silvestre y en animales domésticos donde la infección es actualmente muy alta y donde no se pueden llevar a cabo estrategias de control de «prueba y sacrificio». Todavía hay numerosos obstáculos técnicos que superar antes de que una vacuna oral económicamente viable para su uso en tejones en el Reino Unido pueda estar disponible. Mientras tanto, las partes interesadas deben hacer el mejor uso de las herramientas existentes disponibles, esto incluye la vacuna intramuscular BadgerBCG. La vacunación con BCG en el ganado en los países que utilizan estrategias de control de «prueba y sacrificio» también enfrenta obstáculos significativos. Por ejemplo, una prueba DIVA compatible con la vacunación BCG debe validarse para permitir que la vacunación continúe junto con los programas tradicionales de control de «prueba y sacrificio»; actualmente la vacunación con BCG está prohibida por la legislación de la UE y de algunos otros países y esto tendría que cambiar; Por último, los análisis de costo-beneficio decidirían si se llevaría a cabo el despliegue.
Contribuciones del autor
BB, HV, MC y L-MdK-L escribieron secciones del manuscrito. Todos los autores contribuyeron a la revisión del manuscrito, leyeron y aprobaron la versión presentada.
Declaración de conflicto de intereses
Los autores declaran que la investigación se llevó a cabo en ausencia de cualquier relación comercial o financiera que pudiera interpretarse como un posible conflicto de intereses.
Reconocimientos
La iniciativa de preparar esta revisión surgió de las discusiones en un taller bajo los auspicios de la Facultad de Medicina de la Universidad Hebrea, Israel, que reconoció que la vacuna BCG podría desempeñar un papel importante en el control de la tuberculosis bovina, pero hasta ahora su uso ha sido limitado. Los autores desean agradecer la financiación recibida de AgResearch New Zealand y el Departamento de Medio Ambiente, Alimentación y Asuntos Rurales del Reino Unido.
Referencias
1. Sweetline AN, Ronald BS, Kumar TM, Kannan P, Thangavelu A. Identificación molecular de Mycobacterium tuberculosis en bovinos. Veterinario Microbiol. (2017) 198:81–7. doi: 10.1016/j.vetmic.2016.12.013.
2. Waters WR, Palmer MV, Buddle BM, Vordermeier HM. Bovine tuberculosis vaccine research: historical perspectives and recent advances. Vacuna (2012) 30:2611–22. doi: 10.1016/j.vaccine.2012.02.018.
Resumen de PubMed | Texto completo de CrossRef | Google Académico
3. Primos DV. Infección y control por Mycobacterium bovis en ganado doméstico. Rev Sci Tech. (2001) 20:71–85. Disponible en línea en: https://www.oie.int/doc/ged/D9347.PDF
4. de Lisle GW, Bengis RG, Schmitt SM, O’Brien DJ. Tuberculosis en fauna silvestre en libertad: detección, diagnóstico y manejo. Rev Sci Tech. (2002) 21:317–34. Disponible en línea en: https://pdfs.semanticscholar.org/5417/064a4772377003a12056ccf6e964f911ab1b.pdf
5. Naranjo V, Gortázar C, Vicente J, de la Fuente J. Evidence of the role of European wild jabalí as a reservoir of tuberculosis due to Mycobacterium tuberculosis complex. Veterinario Microbiol. (2008) 127:1–9. doi: 10.1016/j.vetmic.2007.10.002
Resumen de PubMed | Texto completo de CrossRef | Google Académico
6. Santos N, Almeida V, Gortázar C, Correia-Neves M. Patterns of Mycobacterium tuberculosis complex excretion and characterization of super-shedders in naturally-infected wild jabai and red deer. Vet Res. (2015) 46:129. doi: 10.1186/s13567-015-0270-4
Resumen de PubMed | Texto completo de CrossRef | Google Académico
7. de Klerk LM, Michel AL, Bengis RG, Kreik NP, Godfroid J. La vacunación BCG no protegió a los búfalos africanos (Syncerus caffer) contra el desafío intraamigdalar experimental con Mycobacterium bovis. Veterinario Immunol Immunopathol. (2010) 137:84–92. doi: 10.1016/j.vetimm.2010.04.013
Resumen de PubMed | Texto completo de CrossRef | Google Académico
8. Nishi JS, Shury T, Elkin BT. Wildlife reservoirs for bovine tuberculosis (Mycobacterium bovis) in Canada: strategies for management and research. Veterinario Microbiol. (2006) 112:325–38. doi: 10.1016/j.vetmic.2005.11.013
Resumen de PubMed | Texto completo de CrossRef | Google Académico
9. Griffin JM, Williams DH, Kelly GE, Clegg TA, O’Boyle I, Collins JD, et al. El impacto de la eliminación del tejón en el control de la tuberculosis en rebaños de ganado en Irlanda. Prev Vet Med. (2005) 67:237–66. doi: 10.1016/j.prevetmed.2004.10.009
Resumen de PubMed | Texto completo de CrossRef | Google Académico
10. O’Brien DJ, Schmitt SM, Fitzgerald SD, Berry DE, Hickling GJ. Gestión del reservorio de vida silvestre de Mycobacterium bovis: la experiencia de Michigan, EE. UU. Veterinario Microbiol. (2006) 112:313–23. doi: 10.1016/j.vetmic.2005.11.014
Resumen de PubMed | Texto completo de CrossRef | Google Académico
11. Livingstone PG, Hutchings SA, Hancox NG, de Lisle GW. Hacia la erradicación: el efecto de la infección por Mycobacterium bovis en la vida silvestre en la evolución y la dirección futura del manejo de la tuberculosis bovina en Nueva Zelanda. N Z Veterinario J. (2015) 63(Suppl. 1):4–18. doi: 10.1080/00480169.2014.971082
Resumen de PubMed | Texto completo de CrossRef | Google Académico
12. Pastoret PP, Brochier B. El desarrollo y uso de una vacuna oral recombinante vacuna-rabia para el control de la rabia silvestre; un vínculo entre Jenner y Pasteur. Epidemiol Infect. (1996) 116:235–40.
13. Oettinger T, Jørgensen M, Ladefoged A, Hasløv K, Andersen P. Development of the Mycobacterium bovis BCG vaccine: review of the historical and biochemical evidence for a genealogical tree. Tuberc Lung Dis. (1999) 79:243–50. doi: 10.1054/tuld.1999.0206
Resumen de PubMed | Texto completo de CrossRef | Google Académico
14. Behr MA, Wilson MA, Gill WP, Salamon H, Schoolnik GK, Rane S, et al. Genómica comparativa de vacunas BCG por microarray de ADN de genoma completo. Science (1999) 284:1520–3. doi: 10.1126/science.284.5419.1520
Resumen de PubMed | Texto completo de CrossRef | Google Académico
15. Colditz GA, Berkey CS, Mosteller F, Brewer TF, Wilson ME, Burdick E, et al. La eficacia de la vacunación del bacilo de Calmette-Guérin de recién nacidos y lactantes en la prevención de la tuberculosis: metanálisis de la literatura publicada. Pediatrics (1995) 96:29–35.
16. Wilkie ME, McShane H. Desarrollo de la vacuna contra la tuberculosis: ¿dónde estamos y por qué es tan difícil? Thorax (2015) 70:299–301. DOI: 10.1136/Thoraxjnl-2014-205202
Resumen de PubMed | Texto completo de CrossRef | Google Académico
17. Calmette A, Guérin C. Recherches expérimentales sur la defense del’organisme contre l’infection tuberculose. Ann Inst Pasteur. (1911) 25:625–41.
18. Calmette A, Guérin C. Vaccination des bovidés contre la tuberculose et methode nouvelle de prophylaxie de la tuberculose bovine. Ann Inst Pasteur. (1924) 38:371–98.
20. Haring CM, Traum J, Hayes FM, Henry BS. Vacunación de terneros contra la tuberculosis con cultivo de Calmette-Guérin, BCG. Hilgardia (1930) 4:307–94.
21. Rankin A. Rapport de la Commission de l’Alberta (Canadá) sur le vaccine BCG (1927/28). Ann Inst Pasteur. (1929) 43:878–89.
22. Watson EA. Estudios sobre el bacilo de Calmette-Guerin (B.C.G.) y la vacunación contra la tuberculosis. Can J Res. (1933) 9:128–36.
23. Schellner H, Gaggermeier G. Vaccination of botle in hats infected with TB with the «strain P» tubercle bacillus described by Gräub. Toro veterinario. (1955) 26:183 (Resumen 1117).
24. Rolle M, Wiethe H. Results of BCG vaccination in cattle in Bavaria. Toro veterinario. (1956) 27:105 (Resumen 663).
26. Ellwood DC, Waddington FG. Un segundo experimento para desafiar la resistencia a la tuberculosis en ganado vacunado con BCG en Malawi. H. Veterinario J. (1972) 128:619–26.
27. Berggren SA. Experimento de campo con la vacuna BCG en Malawi. H. Veterinario J. (1981) 137:88–96.
28. Griffin JF, MacKintosh CG, Slobbe L, Thomson AJ, Buchan GS. Protocolos vacunales para optimizar la eficacia protectora de BCG. Tuberc Lung Dis. (1999) 79:135–43. DOI: 10.1054/TULD.1998.0202
Resumen de PubMed | Texto completo de CrossRef | Google Académico
29. Lesellier S, Palmer S, Gowtage-Sequiera S, Ashford R, Dalley D, Davé D, et al. Protección de tejones euroasiáticos (Meles meles) contra la tuberculosis después de la vacunación intramuscular con diferentes dosis de BCG. Vacuna (2011) 29:3782–90. doi: 10.1016/j.vaccine.2011.03.028
Resumen de PubMed | Texto completo de CrossRef | Google Académico
30. Buddle BM, de Lisle GW, Pfeffer A, Aldwell FE. Respuestas inmunológicas y protección contra Mycobacterium bovis en terneros vacunados con una dosis baja de BCG. Vaccine (1995) 13:1123–30. doi: 10.1016/0264-410X(94)00055-R
Resumen de PubMed | Texto completo de CrossRef | Google Académico
31. Palmer MV, Waters WR, Whipple DL. Entrega en aerosol de Mycobacterium bovis virulenta al ganado. Tuberculosis (2002) 82:275–82. doi: 10.1054/tube.2002.0341
Resumen de PubMed | Texto completo de CrossRef | Google Académico
32. Buddle BM, Hewinson RG, Vordermeier HM, Wedlock DN. La administración subcutánea de una dosis 10 veces menor de una vacuna comercial contra la tuberculosis humana, Mycobacterium bovis Bacillus Calmette-Guérin danesa, indujo niveles de protección contra la tuberculosis bovina y respuestas en la prueba intradérmica de tuberculina similares a las inducidas por una dosis estándar de ganado. Clin Vaccine Immunol. (2013) 20:1559–62. doi: 10.1128/CVI.00435-13
Resumen de PubMed | Texto completo de CrossRef | Google Académico
33. Wedlock DN, Aldwell FE, de Lisle GW, Vordermeier HM, Hewinson RG, Buddle BM. La protección contra la tuberculosis bovina inducida por la vacunación oral del ganado bovino con Mycobacterium bovis BCG no se ve reforzada por la administración concomitante de vacunas de proteínas micobacterianas. Veterinario Immunol Immunopathol. (2011) 144:220–7. doi: 10.1016/j.vetimm.2011.09.005
34. Buddle BM, Wilson T, Aldwell FE, de Lisle GW, Vordermeier HM, Hewinson RG, et al. Las dosis bajas de BCG oral no protegen al ganado contra un desafío experimental con Mycobacterium bovis. Tuberculosis (2011) 91:400–5. doi: 10.1016/j.tube.2011.07.001
Resumen de PubMed | Texto completo de CrossRef | Google Académico
35. Buddle BM, Denis M, Aldwell FE, Vordermeier HM, Hewinson RG, Wedlock DN. Vacunación del ganado bovino con Mycobacterium bovis BCG por una combinación de vías sistémicas y orales. Tuberculosis (2008) 88:595–600. doi: 10.1016/j.tube.2008.01.005
Resumen de PubMed | Texto completo de CrossRef | Google Académico
36. Dean GS, Clifford D, Whelan AO, Tchilian EZ, Beverley PCL, Salguero FJ, et al. Protección inducida por vacunación simultánea subcutánea y endobronquial con BCG/BCG y BCG/Adenovirus expresando el antígeno 85A contra Mycobacterium bovis. PLoS ONE (2015) 10:e0142270. doi: 10.1371/journal.pone.0142270
Resumen de PubMed | Texto completo de CrossRef | Google Académico
37. Wedlock DN, Denis M, Vordermeier HM, Hewinson RG, Buddle BM. La vacunación de ganado bovino con cepas danesas y Pasteur de Mycobacterium bovis BCG induce diferentes niveles de IFN-γ después de la vacunación, pero induce niveles similares de protección contra la tuberculosis bovina. Veterinario Immunol Immunopathol. (2007) 118:50–8. doi: 10.1016/j.vetimm.2007.04.005
38. Hope JC, Thom ML, McAulay M, Mead E, Vordermeier HM, Clifford D, et al. Identificación de sustitutos y correlatos de protección en inmunidad protectora contra la infección por Mycobacterium bovis inducida en terneros neonatos mediante vacunación con M. bovis BCG Pasteur y M. bovis BCG danés. Clin Vaccine Immunol. (2011) 18:373–9. doi: 10.1128/CVI.00543-10
Resumen de PubMed | Texto completo de CrossRef | Google Académico
39. Buddle BM, Wedlock DN, Parlane NA, Corner LA, de Lisle GW, Skinner MA. La revacunación de terneros neonatos con Mycobacterium bovis BCG reduce el nivel de protección contra la tuberculosis bovina inducida por una sola vacunación. Infectar inmune. (2003) 71:6411–9. doi: 10.1128/IAI.71.11.6411-6419.2003
Resumen de PubMed | Texto completo de CrossRef | Google Académico
40. Hope JC, Thom ML, Villarreal-Ramos B, Vordermeier HM, Hewinson RG, Howard CJ. La vacunación de terneros neonatos con Mycobacterium bovis BCG induce protección contra la provocación intranasal con M. bovis virulento. Clin Exp Immunol. (2005) 139:48–56. doi: 10.1111/j.1365-2249.2005.02668.x
Resumen de PubMed | Texto completo de CrossRef | Google Académico
41. Buddle BM, Wards BJ, Aldwell FE, Collins DM, de Lisle GW. Influencia de la sensibilización a micobacterias ambientales en la posterior vacunación frente a la tuberculosis bovina. Vaccine (2002) 20:1126–33. doi: 10.1016/S0264-410X(010)00436-4
Resumen de PubMed | Texto completo de CrossRef | Google Académico
42. Hope JC, Thom ML, Villarreal-Ramos B, Vordermeier HM, Hewinson RG, Howard CJ. La exposición a Mycobacterium avium induce un bajo nivel de protección contra la infección por Mycobacterium bovis, pero compromete el diagnóstico de la enfermedad en el ganado. Clin Exper Immunol. (2005) 141:432–9. doi: 10.1111/j.1365-2249.2005.02882.x
Resumen de PubMed | Texto completo de CrossRef | Google Académico
43. Thom ML, McAulay M, Vordermeier HM, Clifford D, Hewinson RG, Villarreal-Ramos B, et al. Duración de la inmunidad frente a Mycobacterium bovis tras la vacunación neonatal con bacilo Calmette-Guérin danés: protección significativa contra la infección a los 12 años, pero no a los 24 meses. Clin Vaccine Immunol. (2012) 19:1254–60. doi: 10.1128/CVI.00301-12
44. Parlane NA, Shu D, Subharat S, Wedlock DN, Rehm BH, de Lisle GW, et al. La revacunación del ganado bovino con Bacille Calmette-Guérin dos años después de la primera vacunación, cuando la inmunidad ha disminuido, aumentó la protección contra el desafío con Mycobacterium bovis. PLoS ONE (2014) 9:e106519. doi: 10.1371/journal.pone.0106519
Resumen de PubMed | Texto completo de CrossRef | Google Académico
45. Buddle BM, Shu D, Parlane NA, Subharat S, Heiser A, Hewinson RG, et al. La vacunación del ganado bovino con una dosis alta de la vacuna BCG 3 semanas después de la infección experimental con Mycobacterium bovis aumentó la respuesta inflamatoria, pero no la patología tuberculosa. Tuberculosis (2016) 99:120–7. doi: 10.1016/j.tube.2016.05.004
46. Canto Alarcón GJ, Rubio Venegas Y, Bojorquez Narváez L, Pizano Martínez OE, García Casanova L, Sosa Gallegos S, et al. Eficacia de una fórmula vacunal contra la tuberculosis en bovinos. PLoS ONE (2013) 8:e76418. doi: 10.1371/journal.pone.0076418
Resumen de PubMed | Texto completo de CrossRef | Google Académico
47. Palmer CE, Long MW. Efecto de la infección con micobacterias ambientales sobre la vacunación con BCG y la tuberculosis. Amer Rev Resp Dis. (1966) 553–68.
48. Brandt L, Feino Cunha J, Weinreich Olsen A, Chilima B, Hirsch P, Appelberg R, et al. Fracaso de la vacuna BCG de Mycobacterium bovis: algunas especies de micobacterias ambientales bloquean la multiplicación de BCG y la inducción de inmunidad protectora a la tuberculosis. Infectar inmune. (2002) 70:672–8. doi: 10.1128/IAI.70.2.672–678.2002
Resumen de PubMed | Texto completo de CrossRef | Google Académico
49. Flynn RJ, Mannion C, Golden O, Hacariz O, Mulcahy G. La infección experimental por Fasciola hepatica altera las respuestas a las pruebas utilizadas para el diagnóstico de la tuberculosis bovina. Infectar inmune. (2007) 75:1373–81. doi: 10.1128/IAI.01445-06
Resumen de PubMed | Texto completo de CrossRef | Google Académico
50. Lopez-Valencia G, Renteria-Evangelista T, Williams JdJ, Licea-Navarro A, Mora-Valle AD, Medina-Basulto G. Field evaluation of the protective efficacy of Mycobacterium bovis BCG vaccine against bovine tuberculosis. Res Vet Sci. (2010) 88:44–9. doi: 10.1016/j.rvsc.2009.05.022
Resumen de PubMed | Texto completo de CrossRef | Google Académico
51. Ameni G, Vordermeier M, Aseffa A, Young DB, Hewinson RG. Evaluación de campo de la eficacia de Mycobacterium bovis Bacillus Calmette-Guérin contra la tuberculosis bovina en terneros neonatos en Etiopía. Clin Vaccine Immunol. (2010) 17:1533–8. doi: 10.1128/CVI.00222-10
Resumen de PubMed | Texto completo de CrossRef | Google Académico
52. Ameni G, Tafess K, Zewde A, Eguale T, Tilahun M, Hailu T, et al. La vacunación de terneros con Mycobacterium bovis Bacillus Calmette-Guérin reduce la frecuencia y la gravedad de las lesiones de tuberculosis bovina en un entorno de transmisión natural en Etiopía. Transbound Emerg Dis. (2018) 65:96–104. doi: 10.1111/tbed.12618
Resumen de PubMed | Texto completo de CrossRef | Google Académico
53. Nugent G, Yockney I, Whitford J, Aldwell FE, Buddle BM. Eficacia de la vacunación oral con BCG en la protección del ganado en libertad de la infección natural por Mycobacterium bovis. Veterinario Microbiol. (2017) 208:181–9. doi: 10.1016/j.vetmic.2017.07.029
Resumen de PubMed | Texto completo de CrossRef | Google Académico
54. Whelan AO, Coad M, Upadhyay BL, Clifford DJ, Hewinson RG, Vordermeier HM. Falta de correlación entre la sensibilización cutánea de tuberculina inducida por BCG y la inmunidad protectora en el ganado. Vaccine (2011) 29:5453–8. doi: 10.1016/j.vaccine.2011.05.057
Resumen de PubMed | Texto completo de CrossRef | Google Académico
56. Pollock JM, Andersen P. El potencial del antígeno ESAT-6 secretado por micobacterias virulentas para el diagnóstico específico de la tuberculosis. J Infectar Dis. (1997) 175:1251–4.
57. van Pinxteren LA, Ravn P, Agger EM, Pollock J, Andersen P. Diagnosis of tuberculosis based on the two specific antigens ESAT-6 and CFP10. Clin Diagn Lab Immunol. (2000) 7:155–60. doi: 10.1128/CDLI.7.2.155-160.2000
Resumen de PubMed | Texto completo de CrossRef | Google Académico
58. Vordermeier HM, Whelan A, Cockle PJ, Farrant L, Palmer N, Hewinson RG. Uso de péptidos sintéticos derivados de los antígenos ESAT-6 y CFP-10 para el diagnóstico diferencial de la tuberculosis bovina en bovinos. Clin Diagn Lab Immunol. (2001) 8:571–8. doi: 10.1128/CDLI.8.3.571-578.2001
Resumen de PubMed | Texto completo de CrossRef | Google Académico
59. Sidders B, Pirson C, Hogarth PJ, Hewinson RG, Stoker NG, Vordermeier HM, et al. El cribado de genes micobacterianos altamente expresados identifica a Rv3615c como un antígeno de diagnóstico diferencial útil para el complejo Mycobacterium tuberculosis. Infectar inmune. (2008) 76:3932–9. doi: 10.1128/IAI.00150-08
Resumen de PubMed | Texto completo de CrossRef | Google Académico
60. Vordermeier HM, Jones GJ, Buddle BM, Hewinson RG. Desarrollo de reactivos inmunodiagnósticos para el diagnóstico de la tuberculosis bovina en bovinos. Veterinario Immunol Immunopathol. (2016) 181:10–4. doi: 10.1016/j.vetimm.2016.02.003
61. Whelan AO, Clifford D, Upadhyay B, Breadon EL, McNair J, Hewinson RG, et al. Desarrollo de una prueba cutánea de tuberculosis bovina para diferenciar animales infectados de vacunados. J Clin Microbiol. (2010) 48:3176–81. doi: 10.1128/JCM.00420-10
Resumen de PubMed | Texto completo de CrossRef | Google Académico
62. Jones GJ, Whelan A, Clifford D, Coad M, Vordermeier HM. Prueba cutánea mejorada para el diagnóstico diferencial de la tuberculosis bovina mediante la adición de péptidos derivados de Rv3020c. Clin Vaccine Immunol. (2012) 19:620–2. doi: 10.1128/CVI.00024-12
Resumen de PubMed | Texto completo de CrossRef | Google Académico
63. Pesciaroli M, Alvarez J, Boniotti MB, Cagiola M, Di Marco V, Marianelli C, et al. Tuberculosis en especies animales domésticas. Res Vet Sci. (2014) 97:S78–85. doi: 10.1016/j.rvsc.2014.05.015
Resumen de PubMed | Texto completo de CrossRef | Google Académico
64. Pérez de Val B, López-Soria S, Nofrarias M, Martin M, Vordermeier HM, Romera N, et al. Modelo experimental de tuberculosis en cabra doméstica tras infección endobronquial por Mycobacterium caprae. Clin Vaccine Immunol. (2011) 18:1872–81. doi: 10.1128/CVI.05323-11
65. Pérez de Val B, Vidal E, López-Soria S, Marco A, Cervera Z, Martín M, et al. Evaluación de la seguridad y las respuestas de interferón gamma de la vacuna BCG de Mycobacterium bovis en cabritos de cabra y cabras de ordeño. Vacuna (2016) 34:881–6. doi: 10.1016/j.vaccine.2016.01.004
Resumen de PubMed | Texto completo de CrossRef | Google Académico
66. Pérez de Val B, Villarreal-Ramos B, Nofrarias M, López-Soria S, Romera N, Singh M, et al. Las cabras preparadas con Mycobacterium bovis BCG y potenciadas con un adenovirus recombinante que expresa Ag85A muestran una mayor protección contra la tuberculosis. Clin Vaccine Immunol. (2012) 19:1339–47. doi: 10.1128/CVI.00275-12
Resumen de PubMed | Texto completo de CrossRef | Google Académico
67. Arrieta-Villegas C, Perálvarez T, Vidal E, Puighibet Z, Moll X, Canturri A, et al. Eficacia de la vacunación parenteral contra la tuberculosis con Mycobacterium bovis inactivado por calor en cabras experimentalmente desafiadas. PLoS ONE (2018) 13:e0196948. doi: 10.1371/journal.pone.0196948
Resumen de PubMed | Texto completo de CrossRef | Google Académico
68. Vidal E, Arrieta-Villegas C, Grasa M, Mercader I, Domingao M, Pérez de Val B. Field evaluation of the efficacy of Mycobacterium bovis BCG vaccine against tuberculosis in winats. BMC Vet Res. (2017) 13:252. doi: 10.1186/s12917-017-1182-5
Resumen de PubMed | Texto completo de CrossRef | Google Académico
69. Muñoz-Mendoza M, Romero B, Del Cerro A, Gortázar C, García-Marín JF, Menéndez S, et al. El ovino como fuente potencial de TB bovina: epidemiología, patología y evaluación de técnicas diagnósticas. Transbound Emerg Dis. (2016) 63:635–46. doi: 10.1111/tbed.12325
Resumen de PubMed | Texto completo de CrossRef | Google Académico
70. Balseiro A, Altuzarra R, Vidal E, Moll X, Espada Y, Sevilla IA, et al. Evaluación de BCG y vacunas inactivadas contra Mycobacterium bovis en un modelo experimental de infección tuberculosa en ovinos. PLoS ONE (2017) 12:e0180546. doi: 10.1371/journal.pone.0180546
Resumen de PubMed | Texto completo de CrossRef | Google Académico
71. Beatson NS. Tuberculosis en ciervo rojo. En: Brown RD, editor. Biología de la producción de ciervos. Nueva York, NY: Springer Verlag (1985). págs. 147–50.
72. Fitzgerald SD, Kaneene JB. Reservorios silvestres de tuberculosis bovina en todo el mundo: huéspedes, patología, vigilancia y control. Veterinario Pathol. (2013) 50:488–99. DOI: 10.1177/0300985812467472
Resumen de PubMed | Texto completo de CrossRef | Google Académico
73. Martín-Hernando MP, Torres MJ, Aznar J, Negro JJ, Gandía A, Gortázar C. Sampling strategy, lesion pattern and lesion distribution in naturally Mycobacterium bovis infected red deer and fallow deer. J Comp Pathol. (2010) 142:43–50. doi: 10.1016/j.jcpa.2009.07.003
74. Griffin JF, Mackintosh CG, Rodgers CR. Factores que influyen en la eficacia protectora de un régimen homólogo de vacunación prime-boost BCG contra la tuberculosis. Vaccine (2006) 24:835–45. doi: 10.1016/j.vaccine.2005.07.033
Resumen de PubMed | Texto completo de CrossRef | Google Académico
75. Thomas J, Risalde MA, Serrano M, Servilla I, Geijo M, Ortíz JA, et al. La respuesta del ciervo rojo a la administración oral de calor inactivado Mycobacterium bovis y el desafío con una cepa de campo. Veterinario Microbiol. (2017) 208:195–202. doi: 10.1016/j.vetmic.2017.08.007
Resumen de PubMed | Texto completo de CrossRef | Google Académico
76. Nol P, Palmer MV, Waters WR, Aldwell FE, Buddle BM, Triantis JM, et al. Eficacia de las vías orales y parenterales de la vacunación de Mycobacterium bovis bacille Calmette-Guérin contra la tuberculosis bovina experimental en ciervo cola blanca (Odocoileus virginianus): un estudio de viabilidad. J Wildl Dis. (2008) 44:247–59. doi: 10.7589/0090-3558-44.2.247
Resumen de PubMed | Texto completo de CrossRef | Google Académico
77. Palmer MV, Thacker TC, Waters WR. Vacunación con Mycobacterium bovis BCG cepas danesas y Pasteur en ciervo cola blanca (Odocoileus virginianus) desafiado experimentalmente con Mycobacterium bovis. Zoonosis Public Health (2009) 56:243–51. doi: 10.1111/j.1863-2378.2008.01198.x
Resumen de PubMed | Texto completo de CrossRef | Google Académico
78. Palmer MV, Thacker TC, Waters WR. Vacunación del ciervo cola blanca (Odocoileus virginianus) con Mycobacterium bovis bacillus Calmette Guérin. Vaccine (2007) 25:6589–97. doi: 10.1016/j.vaccine.2007.06.056
Resumen de PubMed | Texto completo de CrossRef | Google Académico
79. Palmer MV, Thacker TC, Waters WR, Robbe-Austerman S, Lebepe-Mazur SM, Harris NB. Persistencia de Mycobacterium bovis Bacillus Calmette-Guérin en ciervo cola blanca (Odocoileus virginianus) después de la vacunación oral o parenteral. Zoonosis Public Health (2010) 57:206–12. doi: 10.1111/j.1863-2378.2010.01329.x
80. Nol P, Rhyan JC, Robbe-Austerman S, McCollum MP, Rigg TD, Saklou NT, et al. El potencial de transmisión de BCG del ciervo de cola blanca vacunado por vía oral (Odocoileus virginianus) al ganado (Bos taurus) a través de un ambiente contaminado: hallazgos experimentales. PLoS ONE (2013) 8:e60257. doi: 10.1371/journal.pone.0060257
Resumen de PubMed | Texto completo de CrossRef | Google Académico
81. Sorensen A, van Beest FM, Brook RK. Impactos del cebo de vida silvestre y la alimentación suplementaria en el riesgo de transmisión de enfermedades infecciosas: una síntesis del conocimiento. Prev Vet Med. (2014) 113:356–63. doi: 10.1016/j.prevetmed.2013.11.010
Resumen de PubMed | Texto completo de CrossRef | Google Académico
82. Ramsey DSL, O’Brien DJ, Cosgrove MK, Rudolph BA, Locher AB, Schmitt SM. Forecasting eradication of bovine tuberculosis in Michigan white-tailed deer. J Wildl Gestionar. (2014) 78:240–54. DOI: 10.1002/JWMG.656
83. Aldwell FE, Keen D, Parlane N, Skinner MA, de Lisle GW, Buddle BM. La vacunación oral con Mycobacterium bovis BCG en una formulación lipídica induce resistencia a la tuberculosis pulmonar en zarigüeyas. Vaccine (2003) 22:70–6. doi: 10.1016/S0264-410X(03)00539-5
Resumen de PubMed | Texto completo de CrossRef | Google Académico
84. Tompkins DM, Ramsey DSL, Cross ML, Aldwell FE, de Lisle GW, Buddle BM. La vacunación oral reduce la incidencia de tuberculosis bovina en una especie silvestre de vida libre. Proc Biol Sci. (2009) 276:2987–95. DOI: 10.1098/RSPB.2009.0414
85. Chambers MA, Aldwell F, Williams GA, Palmer S, Gowtage S, Ashford R, Lesellier S. El efecto de la vacunación oral con Mycobacterium bovis BCG sobre el desarrollo de tuberculosis en tejones europeos cautivos (Meles meles). Las células frontales infectan microbiol. (2017) 7:6. DOI: 10.3389/fcimb.2017.00006
Resumen de PubMed | Texto completo de CrossRef | Google Académico
86. Carter SP, Chambers MA, Rushton SP, Shirley MDF, Schuchert P, Pietravalle S, et al. La vacunación BCG reduce el riesgo de infección por tuberculosis en tejones vacunados y cachorros de tejón no vacunados. PLoS ONE (2012) 7:e49833. doi: 10.1371/journal.pone.0049833
Resumen de PubMed | Texto completo de CrossRef | Google Académico
87. Gormley E, Ní Bhuachalla D, O’Keeffe J, Murphy D, Aldwell FE. La vacunación oral de tejones de vida libre (Meles meles) con la vacuna Bacille Calmette Guérin (BCG) confiere protección contra la tuberculosis. PLoS ONE (2017) 12:e0168851. doi: 10.1371/journal.pone.0168851
Resumen de PubMed | Texto completo de CrossRef | Google Académico
88. Aznar I, Frankena K, More SJ, O’Keefe J, McGrath G, de Jong MCM. Cuantificación de la transmisión de Mycobacterium bovis en un ensayo de campo de la vacuna del tejón. Prev Vet Med. (2018) 149:29–37. doi: 10.1016/j.prevetmed.2017.10.010
Resumen de PubMed | Texto completo de CrossRef | Google Académico
89. Gortázar C, Beltrán-Beck B, Garrido JM, Aranaz A, Sevilla I, Boadella M, et al. La revacunación oral del jabalí euroasiático con Mycobacterium bovis BCG produce una fuerte respuesta protectora contra el desafío con una cepa de campo. BMC Vet Res. (2014) 10:96. DOI: 10.1186/1746-6148-10-96
Resumen de PubMed | Texto completo de CrossRef | Google Académico
90. Díez-Delgado I, Sevilla I, Romero B, Tanner E, Barasona JA, White AR, et al. Impacto de la vacunación de lechones contra la tuberculosis en poblaciones endémicas de jabalíes en libertad. Prev Vet Med. (2018) 155:11–20. doi: 10.1016/j.prevetmed.2018.04.002
Resumen de PubMed | Texto completo de CrossRef | Google Académico
91. Qureshi T, Labes RE, Cross ML, Griffin JF, Mackintosh CG. Protección parcial frente al provocación oral con Mycobacterium bovis en hurones (Mustela furo) tras la vacunación oral con BCG. Int J Tuberc Lung Dis. (1999) 3:1025–33.
92. Cross ML, Labes RE, Young G, Mackintosh CG. La vacunación sistémica pero no intraintestinal con BCG reduce la gravedad de la infección tuberculosa en hurones (Mustela furo). Int J Tuberc Lung Dis. (2000) 4:473–80. Disponible en línea en: http://www.ingentaconnect.com/content/iuatld/ijtld/2000/00000004/00000005/art00013;jsessionid=fcfeo4ych6ru.x-ic-live-02
93. Aldwell FE, Keen DL, Stent VC, Thomson A, Yates GF, de Lisle GW, et al. La vía de administración de BCG en zarigüeyas afecta la protección contra la tuberculosis bovina. N Z Veterinario J. (1995) 43:356–9. doi: 10.1080/00480169./1995.35920
Resumen de PubMed | Texto completo de CrossRef | Google Académico
94. Skinner MA, Keen DL, Parlane NA, Hamel KL, Yates GF, Buddle BM. Improving protective efficacy of BCG vaccination for wildlife against bovine tuberculosis. Res Vet Sci. (2005) 78:231–6. doi: 10.1016/j.rvsc.2004.07.007
Resumen de PubMed | Texto completo de CrossRef | Google Académico
95. Buddle BM, Aldwell FE, Keen DL, Parlane NA, Yates G, de Lisle GW. La vacunación intraduodenal de zarigüeyas de cola de cepillo con bacilo de Calmette-Guérin mejora las respuestas inmunes y la protección contra la infección por Mycobacterium bovis. Int J Tuberc Lung Dis. (1997) 1:377–83.
96. Cross ML, Henderson RJ, Lambeth MR, Buddle BM, Aldwell FE. BCG formulado con lípidos como vacuna de cebo oral para la tuberculosis: estabilidad de la vacuna, eficacia y palatabilidad para zarigüeyas de Nueva Zelanda (Trichosurus vulpecula). J Wildl Dis. (2009) 45:754–65. doi: 10.7589/0090-3558-45.3.754
Resumen de PubMed | Texto completo de CrossRef | Google Académico
97. Buddle BM, Aldwell FE, Keen DL, Parlane NA, Hamel KL, de Lisle GW. Vacunación oral de zarigüeyas de cola de cepillo con BCG: investigación de los factores que influyen en la eficacia de la vacuna y la determinación de la duración de la inmunidad. N Z Veterinario J. (2006) 54:224–30. doi: 10.1080/00480169.2006.36701
98. Tompkins DM, Buddle BM, Whitford J, Cross ML, Yates GF, Lambeth MR, et al. Protección sostenida contra la tuberculosis conferida a un huésped silvestre mediante una sola dosis de vacunación. Vacuna (2013) 31:893–9. doi: 10.1016/j.vaccine.2012.12.003
Resumen de PubMed | Texto completo de CrossRef | Google Académico
99. Wedlock DN, Aldwell FE, Keen DL, Skinner MA, Buddle BM. Vacunación oral de zarigüeyas de cola de cepillo (Trichosurus vulpecula) con BCG: respuestas inmunes, persistencia de BCG en órganos linfoides y excreción en heces. N Z Veterinario J. (2005) 53:301–6. doi: 10.1080/00480169.2005.36564
100. Corner LA, Norton S, Buddle BM, Morris RS. La eficacia de la vacuna de bacilos de Calmette-Guérin en zarigüeyas silvestres (Trichosurus vulpecula). Res Vet Sci. (2002) 73:145–52. doi: 10.1080/00480169.2002.36302
101. Delahay RJ, Smith GC, Barlow AM, Walker N, Harris A, Clifton-Hadley RS, et al. Infección por tuberculosis bovina en mamíferos silvestres en la región sudoccidental de Inglaterra: un estudio de prevalencia y una evaluación semicuantitativa de los riesgos relativos para el ganado. Veterinario J. (2007) 173:287–301. doi: 10.1016/j.tvjl.2005.11.011
Resumen de PubMed | Texto completo de CrossRef | Google Académico
102. Godfray HC, Donnelly CA, Kao RR, MacDonald DW, McDonald RA, Petrokofsky G, et al. Una reafirmación de la base de evidencia de las ciencias naturales relevante para el control de la tuberculosis bovina en Gran Bretaña. Proc Biol Sci. (2013) 280:20131634. DOI: 10.1098/RSPB.2013.1634
Resumen de PubMed | Texto completo de CrossRef | Google Académico
103. Gormley E, esquina LA. Estrategias de control de la tuberculosis silvestre en Irlanda. Transbound Emerg Dis. (2013) 60(Suppl. 1):128–35. doi: 10.1111/tbed.12095
Resumen de PubMed | Texto completo de CrossRef | Google Académico
104. O’Connor CM, Haydon DT, Kao RR. Una perspectiva ecológica y comparativa sobre el control de la tuberculosis bovina en Gran Bretaña y la República de Irlanda. Prev Vet Med. (2012) 104:185–97. doi: 10.1016/j.prevetmed.2011.11.010
Resumen de PubMed | Texto completo de CrossRef | Google Académico
105. Abdou M, Frankena K, O’Keeffe J, Byrne AW. Efecto del sacrificio y la vacunación sobre la infección tuberculosa bovina en una población europea de tejón (Meles meles) mediante modelización de simulación espacial. Prev Vet Med. (2016) 125:19–30. doi: 10.1016/j.prevetmed.2015.12.012
Resumen de PubMed | Texto completo de CrossRef | Google Académico
106. Lesellier S, Palmer S, Dalley DJ, Davé D, Johnson L, Hewinson RG, et al. Seguridad e inmunogenicidad de la vacuna Bacillus Calmette-Guérin (BCG) en tejones europeos (Meles meles). Veterinario Immunol Immunopathol. (2006) 112:24–37. doi: 10.1016/j.vetimm.2006.03.009
Resumen de PubMed | Texto completo de CrossRef | Google Académico
107. Chambers M, Rogers F, Delahay R, Lesellier S, Ashford R, Dalley D, et al. La vacunación contra el bacilo de Calmette-Guerin reduce la gravedad y la progresión de la tuberculosis en los tejones. Proc Biol Sci. (2011) 278:1913–20. DOI: 10.1098/RSPB.2010.1953
Resumen de PubMed | Texto completo de CrossRef | Google Académico
108. Murphy D, Costello E, Aldwell FE, Lesellier S, Chambers MA, Fitzsimons T, et al. Vacunación oral de tejones (Meles meles) contra la tuberculosis: comparación de la protección generada por las cepas de la vacuna BCG Pasteur y Danesa. Veterinario J. (2014) 200:362–7. doi: 10.1016/j.tvjl.2014.02.031
Resumen de PubMed | Texto completo de CrossRef | Google Académico
109. Perrett S, Lesellier S, Rogers F, Williams GA, Gowtage S, Palmer S, et al. Evaluación de la seguridad de la vacuna Bacillus Calmette-Guérin administrada por vía oral a tejones (Meles meles). Vacuna (2018) 36:1990–5. doi: 10.1016/j.vaccine.2018.02.101
Resumen de PubMed | Texto completo de CrossRef | Google Académico
110. Gortázar C, Che-Amat A, O’Brien D. Preguntas abiertas y avances recientes en el control de una enfermedad infecciosa de múltiples huéspedes: tuberculosis animal. Mamífero Rev. (2015) 45:160–75. doi: 10.1111/mam.12042
111. LaHue NP, Baños JV, Acevedo P, Gortázar C, Martínez-López B. Spatially explicit modelling of animal tuberculosis at the wildlife-livestock interface in Ciudad Real province, Spain. Prev Vet Med. (2016) 128:101–11. doi: 10.1016/j.prevetmed.2016.04.011
112. Massei G, Kindberg J, Licopp A, Gačic D, Šprem N, Kamler J, et al. ¿Aumentan las poblaciones de jabalíes, disminuye el número de cazadores? Una revisión de las tendencias e implicaciones para Europa. Manejo de plagas Sci. (2015) 71:492–500. DOI: 10.1002/PS.3965
Resumen de PubMed | Texto completo de CrossRef | Google Académico
113. Martín-Hernando MP, Höfle U, Vicente J, Ruiz-Fons F, Vidal D, Barral M, et al. Lesiones asociadas a la infección por complejo Mycobacterium tuberculosis en el jabalí europeo. Tuberculosis (2007) 87:360–7. doi: 10.1016/j.tube.2007.02.003
Resumen de PubMed | Texto completo de CrossRef | Google Académico
114. Santos N, Santos C, Valente T, Gortázar C, Almeida V, Correia-Neves M. Contaminación ambiental generalizada con complejo Mycobacterium tuberculosis revelada por un protocolo de detección molecular. PLoS ONE (2015) 10:e0142079. doi: 10.1371/journal.pone.0142079
Resumen de PubMed | Texto completo de CrossRef | Google Académico
115. Garrido JM, Sevilla IA, Beltrán-Beck B, Minguijón E, Ballesteros C, Galindo RC, et al. Protección contra la tuberculosis en jabalíes euroasiáticos vacunados con Mycobacterium bovis inactivado por calor. PLoS ONE (2011) 6:e24905. doi: 10.1371/journal.pone.0024905
Resumen de PubMed | Texto completo de CrossRef | Google Académico
116. Beltrán-Beck B, Romero B, Sevilla I, Barasona JA, Garrido JM, González-Barrio D, et al. Evaluación de una vacuna oral BCG de Mycobacterium bovis y una preparación inactivada de M. bovis para jabalíes en términos de reacciones adversas, supervivencia de cepas vacunales y absorción por especies no objetivo. Clin Vaccine Immunol. (2014) 21:12–20. doi: 10.1128/CVI.00488-13
Resumen de PubMed | Texto completo de CrossRef | Google Académico
117. Nol P, Robbe-Austerman S, Rhyan JC, McCollan MP, Triantis JM, Beltrán-Beck B, et al. Determinación de la persistencia de Mycobacterium bovis bacilo danés de Calmette-Guérin en tejidos seleccionados de cerdos salvajes vacunados por vía oral (Sus scrofa spp.) Res Vet Sci. (2016) 104:50–2. doi: 10.1016/j.rvsc.2015.11.007
118. Byrom AE, Caley P, Paterson BM, Nugent G. Ferrets feral (Mustela furo) as hosts and sentinels of tuberculosis in New Zealand. N Z Veterinario J. (2015). 63(Suppl. 1):42–53. doi: 10.1080/00480169.2014.981314
Resumen de PubMed | Texto completo de CrossRef | Google Académico
119. Caley P, Hone J. Estimación de la fuerza de infección; Infección por Mycobacterium bovis en hurones salvajes Mustela furo en Nueva Zelanda. J Anim Ecol. (2002) 71:44–54. doi: 10.1046/j.0021-8790.2001.00573.x
120. Michel AL, Coetzee ML, Keet DF, Mare L, Warren R, Cooper D, et al. Epidemiología molecular de Mycobacterium bovis aislados de vida silvestre en libertad en reservas de caza sudafricanas. Veterinario Microbiol. (2009) 133:335–43. doi: 10.1016/j.vetmic.2008.07.023
Resumen de PubMed | Texto completo de CrossRef | Google Académico
121. Hlokwe TM, Jenkins AO, Streicher EM, Venter EH, Cooper D, Godfroid J, et al. Caracterización molecular de Mycobacterium bovis aislado de búfalos africanos (Syncerus caffer) en el Parque Hluhluwe-iMfolozi en KwaZulu-Natal, Sudáfrica. Onderstepoort J Vet Res. (2011) 78:1–6. doi: 10.4102/ojvr.v78i1.232
122. Hlokwe TM, De Klerk-Lorist LM, Michel AL. Wildlife on the move: a hidden tuberculosis threat to conservation areas and game farms through introduction of untested animals. J Wildl Dis. (2016) 52:837–43. doi: 10.7589/2015-10-281
Resumen de PubMed | Texto completo de CrossRef | Google Académico
123. Michel AL, Bengis RG. El búfalo africano: un villano para la propagación entre especies de enfermedades infecciosas en el sur de África. Onderstepoort J Vet Res. (2012) 79:453. doi: 10.4102/ojvr.v79i2.453
Resumen de PubMed | Texto completo de CrossRef | Google Académico
124. Michel AL, Bengis RG, Keet DF, Hofmeyr M, Klerk LM, Cross PC, et al. Tuberculosis de la vida silvestre en las áreas de conservación de Sudáfrica: implicaciones y desafíos. Veterinario Microbiol. (2006). 12:91–100. doi: 10.1016/j.vetmic.2005.11.035
125. Musoke J, Hlokwe T, Marcotty T, du Plessis BJ, Michel AL. Spillover of Mycobacterium bovis from wildlife to livestock, Sudáfrica. Emerg infectar dis. (2015) 21:448–51. DOI: 10.3201/EID2103.131690
Resumen de PubMed | Texto completo de CrossRef | Google Académico
126. Murphy D, Corner LAL, Gormley E. Reacciones adversas a la vacunación contra la tuberculosis contra la tuberculosis en humanos, animales veterinarios y especies silvestres de Mycobacterium bovis bacille Calmette-Guerin (BCG). Tuberculosis (2008) 68:344–57. doi: 10.1016/j.tube.2007.11.010
127. Lagranderie M, Chavarot P, Balazuc AM, Marchal G. Immunogenicity and protective capacity of Mycobacterium bovis BCG after oral or intragastric administration to ratones. Vaccine (2000) 18:1186–95. doi: 10.1016/S0264-410X(99)00386-2
128. Filardi MJ, Codish SD, Civerchia L, Howard RK, McKneally MF. Toxicidad del tratamiento intrapleural con Bacillus Calmette-Guérin en animales. Cáncer Res. (1979) 39:3673–6.
129. Smith DW, Wiegeshaus E, Navalkar R, Grover AA. Relaciones huésped-parásito en la tuberculosis experimental transmitida por el aire. I. Estudios preliminares en animales vacunados y no vacunados con BCG. J Bacteriol. (1966) 91:718–24.
130. Lurie MB, Zappasodi P, Cardona-Lynch E, Dannenberg AM Jr. La respuesta a la inoculación intracutánea de BCG como índice de resistencia nativa a la tuberculosis. J Immunol. (1952) 68:369–87.
131. Abolhassani M, Lagranderie M, Chavarot P, Balazuc AM, Marchal G. Mycobacterium bovis BCG induce respuestas inmunitarias similares y protección por vías de inmunización rectal y parenteral. Infectar inmune. (2000) 68:5657–62. doi: 10.1128/IAI.68.10.5657-5662.2000
Resumen de PubMed | Texto completo de CrossRef | Google Académico
132. Klein WR, Bras GE, Misdorp W, Steerenberg PA, de Jong WH, Tiesjema RH, et al. Sarcoide equino: inmunoterapia BCG comparada con criocirugía en un ensayo clínico aleatorizado prospectivo. Cáncer Immunol Immunother. (1986) 21:133–40.
133. Slobbe L, Lockhart E, O’Donnell MA, Mackintosh C, de Lisle G, Buchan G. Una comparación in vivo del bacilo de Calmette-Guérin (BCG) y las vacunas BCG secretoras de citoquinas. Inmunología (1999). 96:517–23. doi: 10.1046/j.1365-2567.1999.00702.x
Resumen de PubMed | Texto completo de CrossRef | Google Académico
134. Vordermeier HM, Jones GJ, Buddle BM, Hewinson RG, Villarreal-Ramos B. Bovine tuberculosis in cattle: vaccines, DIVA Tests, and host biomarker discovery. Annu Rev Anim Biosci. (2016) 4:87–109. doi: 10.1146/annurev-animal-021815-111311
Resumen de PubMed | Texto completo de CrossRef | Google Académico
135. Garly ML, Martins CL, Balé C, Baldé MA, Hedegaard KL, Gustafson P, et al. BCG scar and positive tuberculin reaction associated with reduced child mortality in West Africa. ¿Un efecto beneficioso no específico de BCG? Vacuna (2003) 21:2782–90. doi: 10.1016/S0264-410X(03)00181-6
Resumen de PubMed | Texto completo de CrossRef | Google Académico
Cita: Buddle BM, Vordermeier HM, Chambers MA y de Klerk-Lorist L-M (2018) Eficacia y seguridad de la vacuna BCG para el control de la tuberculosis en ganado doméstico y vida silvestre. Frente. Vet. Sci. 5:259. DOI: 10.3389/FVETS.2018.00259
Recibido: 29 Julio 2018; Aprobado: 01 Octubre 2018;
Publicado: 26 octubre 2018.
Editado por:
Srinand Sreevatsan, Universidad Estatal de Michigan, Estados Unidos
Revisado por:
Catalina Picasso, Universidad de Minnesota Twin Cities, Estados Unidos
Mirinda Van Kleef, Consejo de Investigación Agrícola de Sudáfrica (ARC-SA), Sudáfrica
Crown Copyright © 2018 Autores: Buddle, Vordermeier, Chambers y de Klerk-Lorist. Este es un artículo de acceso abierto distribuido bajo los términos de la Licencia de Atribución Creative Commons (CC BY).
*Correspondencia: Bryce M. Buddle, bryce.buddle@agresearch.co.nz
Renuncia: Todas las afirmaciones expresadas en este artículo son únicamente las de los autores y no representan necesariamente las de sus organizaciones afiliadas, o las del editor, los editores y los revisores. Cualquier producto que pueda ser evaluado en este artículo o reclamo que pueda ser hecho por su fabricante no está garantizado ni respaldado por el editor.
Date de alta y recibe nuestro 👉🏼 Diario Digital AXÓN INFORMAVET ONE HEALTH
Date de alta y recibe nuestro 👉🏼 Boletín Digital de Foro Agro Ganadero
Noticias animales de compañía
Noticias animales de producción
Trabajos técnicos animales de producción
Trabajos técnicos animales de compañía