Valores regionales de ADC del cerebro canino morfológicamente normal
Valores regionales de ADC del cerebro canino morfológicamente normal
 Lea Carisch*
Lea Carisch*  Blanca Lindt
Blanca Lindt  Henning Richter
Henning Richter  Francesca Del Chicca
Francesca Del Chicca- Clínica de Diagnóstico por Imagen, Departamento de Diagnóstico y Servicios Clínicos, Facultad de Vetsuisse, Universidad de Zúrich, Zúrich, Suiza
Introducción: Las imágenes por resonancia magnética ponderadas por difusión están cada vez más disponibles para la investigación de enfermedades cerebrales caninas. El coeficiente de difusión aparente (ADC) de los cerebros caninos normales se informa solo en un pequeño número de sujetos. El objetivo del estudio fue investigar el ADC de diferentes regiones anatómicas en el cerebro morfológicamente normal en una gran población de pacientes caninos en un entorno clínico. Además, se investigó la posible influencia en el valor de ADC de factores relacionados con el paciente como el sexo, la edad y el peso corporal, la diferencia entre el lado izquierdo y derecho de los hemisferios cerebrales y entre la sustancia gris y blanca.
Métodos: Se revisaron retrospectivamente los estudios de resonancia magnética cerebral que incluían imágenes ponderadas por difusión de perros presentados en la Facultad Vetsuisse de la Universidad de Zúrich entre 2015 y 2020. Solo se incluyeron los estudios de resonancia magnética cerebral morfológicamente normales de perros que presentaban signos neurológicos o no neurológicos. Se examinaron los valores del coeficiente de difusión aparente de 12 regiones de interés (ROI) en cada hemisferio y una región adicional en el vermis cerebeloso en cada perro.
Resultados: Se incluyeron un total de 321 perros (incluidos 247 perros con signos neurológicos y 62 perros con signos no neurológicos) de diversas razas, sexo y edad. El coeficiente de difusión aparente varió significativamente entre la mayoría de las regiones anatómicas del cerebro. Se midió un ADC significativamente más alto en el × gris [mediana 0,79 (rango 0,69-0,90)]−3 milímetro2/s] en comparación con la sustancia blanca [mediana 0,70 (rango 0,63-0,85) × 10−3 milímetro2/s]. No se encontraron diferencias significativas entre los hemisferios cerebrales izquierdo y derecho en la mayoría de las regiones, ni entre sexos, ni entre diferentes estados reproductivos, ni consistentemente entre los grupos de peso corporal. La edad se correlacionó primero con una disminución de los perros <1 año de edad a los perros de mediana edad (⩾3 a <8 años) y posteriormente con un aumento de los valores de ADC en perros ⩾8 años.
Discusión: Se describieron valores de coeficiente de difusión aparente de 25 ROI en 321 cerebros caninos morfológicamente normales en un entorno clínico. Existen diferencias aparentes en los coeficientes de difusión en función de la región anatómica del cerebro. Existen diferencias aparentes en los coeficientes de difusión entre las clases de edad, probablemente consistentes con la maduración y el envejecimiento del cerebro. Los datos descritos pueden ser una referencia para futuros estudios en entornos clínicos sobre el cerebro canino.
Introducción
Las imágenes ponderadas por difusión (DWI) están ganando popularidad en las imágenes avanzadas en medicina veterinaria y permiten cuantificar el movimiento de las moléculas de agua en el tejido basándose en el movimiento browniano (1). Se utilizan dos gradientes de sensibilización a la difusión, un gradiente de desfase y otro de refase, de la misma intensidad, junto a un pulso de radiofrecuencia de 180°. La falta de retorno de la señal es el resultado de que las moléculas de agua en movimiento no se refasen, lo que provoca una reducción cuantificable de la señal de resonancia magnética (RM). El movimiento de las moléculas de agua es antiproporcional a la celularidad de los tejidos, por lo que la pérdida de señal se puede utilizar para evaluar el grado de difusión restringida de la molécula de agua (2). La intensidad del gradiente de sensibilización a la difusión se define por su valor b (s/mm2).
Por lo tanto, el DWI proporciona información sobre la integridad y, hasta cierto punto, la funcionalidad del tejido y, en consecuencia, la patología potencial (3-5). Sobre la base de las secuencias DWI, se pueden generar mapas de coeficiente de difusión aparente (ADC) y cuantificar el ADC (en mm2/s) en regiones específicas de interés (ROI). Las variaciones en la ADC se pueden utilizar para detectar y caracterizar procesos patológicos (6).
En medicina humana, el DWI se usa ampliamente no solo con fines diagnósticos para evaluar el infarto (7-10), el trauma (11) y la infección (12), sino también para evaluar diferentes neoplasias y la respuesta individual al tratamiento (13-16). Otros estudios investigan el mapeo de las regiones cerebrales para la identificación de zonas epileptógenas (17, 18). Además, el DWI se ha utilizado para describir la maduración y el envejecimiento del cerebro humano (19-23) y se sabe que el ADC varía en diferentes regiones del cerebro humano (24). En medicina veterinaria, estudios anteriores describen principalmente el uso de DWI investigando incidentes cerebrovasculares en perros (25, 26), gatos (27), ratas (28) y edema cerebral en gatos (29). El uso potencial de DWI también incluye la evaluación de trastornos neoplásicos, inflamatorios y epilépticos (30-36). Los estudios que evalúan los valores de ADC en el cerebro canino morfológicamente normal son raros (4, 5, 37) con diferencias reportadas dependiendo de la región anatómica y del lado del hemisferio cerebral (4, 5) en un pequeño número de perros.
El presente estudio tuvo como objetivo investigar el ADC regional en regiones cerebrales seleccionadas en el cerebro morfológicamente normal del perro en un entorno clínico. No se ha planteado la hipótesis de la influencia del sexo, el estado reproductivo y el peso corporal (PC) en la ADC. Se ha planteado la hipótesis de la diferencia en el ADC dependiendo del lado del hemisferio cerebral, de la edad de los pacientes, de la sustancia gris y blanca, y de las regiones anatómicas.
Materiales y métodos
Animales
Se revisaron retrospectivamente los registros clínicos de la clínica de pequeños animales de la Facultad Vetsuisse de la Universidad de Zúrich. Se revisaron los perros que se sometieron a un examen de imágenes de resonancia magnética (IRM) del cerebro, incluidas las secuencias de DWI (ver técnica de resonancia magnética), entre enero de 2015 y febrero de 2020. Solo se incluyeron en el estudio perros con un examen de RM cerebral morfológicamente normal (ausencia de anomalías en la morfología y la intensidad de la señal en todas las secuencias proporcionadas). El diagnóstico de un estudio cerebral morfológicamente normal había sido declarado por un radiólogo certificado por la junta, y las imágenes fueron revisadas por otro radiólogo certificado por la junta (FDC) en el momento de la inclusión en el estudio. Si se realizó una punción con líquido cefalorraquídeo (LCR), solo se incluyeron los perros con punción con LCR normal. También se incluyeron muestras levemente contaminadas con sangre que fueron marcadas por nuestro laboratorio, pero consideradas diagnósticas. El análisis consistió en: recuento de células (valor de referencia: <5 células/μL), concentración de proteínas (valor de referencia: ≤30 mg/dL) y análisis citológico del tipo celular, así como análisis serológico si estaba indicado. Se excluyeron los perros con registros de laboratorio de anomalías en el grifo del LCR. Debido a la naturaleza retrospectiva de este estudio, no hubo necesidad de indagar el consentimiento ético. Sin embargo, los propietarios de todos los perros incluidos firmaron un formulario de consentimiento para el uso de los datos de los perros con fines académicos.
Técnica de resonancia magnética
Los exámenes de resonancia magnética de todos los perros se realizaron en la Facultad Vetsuisse de la Universidad de Zúrich. Un escáner de resonancia magnética de 3 T (escáner Philips Ingenia 3.0 T, Philips AG Healthcare, Zúrich, Suiza) y una bobina de 32 canales (dStream HeadNeck, bobina de resonancia magnética de 32 canales; Philips AG Healthcare) o bobina de 16 canales (dStream HandWrist, bobina MR de 16 canales; Philips AG Healthcare) para perros pequeños. Los perros fueron colocados en decúbito dorsal bajo anestesia general, utilizando protocolos anestésicos caso por caso. Se adquirieron imágenes del cerebro, incluyendo los lóbulos olfatorios hasta al menos las segundas vértebras cervicales. El protocolo cerebral estándar incluyó las secuencias con los parámetros enumerados en la Tabla Suplementaria S1. Las imágenes ponderadas por difusión (DW) se adquirieron en un plano transversal, estableciendo los dos valores b en 0 s/mm2 y 1.000 s/mm2, respectivamente, y utilizando la técnica de codificación de sensibilidad (SENSE) y gradientes de difusión en los tres planos (plano x, y y z). Se inyectó medio de contraste después de la secuencia DW (DOTAREM 0,2 mL/kg IV [Ácido gadoterico; Guerbet Gmbh, Sulzbach, Alemania]) seguido de solución salina (NaCl 0,9% 5 mL IV).
Análisis de datos
La señalización, incluida la raza, el sexo, el estado reproductivo, la edad, el peso corporal y la sintomatología en el momento de la presentación, se registró en las historias clínicas de todos los perros. Además, se registró la temperatura corporal y la duración del examen de resonancia magnética. Todas las imágenes de RM adquiridas se evaluaron utilizando un software dedicado (Philips IntelliSpace Portal versión 10.1.1; Philips AG, Ámsterdam, Países Bajos). Después de la adquisición de las imágenes DW, utilizando el paquete de difusión del software IntelliSpace, si es necesario, se ha realizado la corrección de movimiento. A partir de la secuencia DWI, se ajustó la intrusión B0 para excluir los píxeles de fondo de los cálculos del mapa funcional. Se seleccionaron los valores b utilizados y se generó una nueva serie de imágenes (mapa ISO ADC). Se realizó un co-registro anatómico (registro alineado) con la secuencia T2W y se controló visualmente para garantizar la calidad del registro antes de la colocación del ROI.
Un total de 13 regiones anatómicas del cerebro se definieron como ROI y se dibujaron manualmente en el plano transversal en el mapa ADC de la siguiente manera: núcleo caudado, cápsula interna (dos ubicaciones, una rostral y otra caudal), lóbulo piriforme, tálamo, hipocampo, lóbulo occipital (sustancia blanca y gris combinadas y separadas), lóbulo cerebeloso (sustancia blanca y gris combinadas y separadas), vermis cerebeloso (Figura 1). Con la excepción del vermis cerebeloso, cada ROI se dibujó tanto en el hemisferio izquierdo como en el derecho del cerebro, lo que llevó a un total de 25 ROI dibujados en cada perro. Cada ROI se dibujó en el sector que representa la estructura con mayor precisión. Siempre que una estructura era visible en más de un corte (por ejemplo, tálamo), se elegía el corte que representaba la región con la extensión subjetivamente más grande. Las imágenes de todas las demás secuencias y planos y el corregistro se utilizaron como referencia para identificar mejor la anatomía mientras se dibujaba el ROI. Típicamente, los ROI se dibujaban de la siguiente manera: en la cabeza del núcleo caudado; en la cápsula interna rostral y caudal (rostral a nivel de la cabeza del núcleo caudado o una rebanada caudal; y caudal, una o dos rebanadas separadas de la localización rostral); en el hemisferio del tálamo, tal como se publicó en CATS (38). Los otros ROI se trazaron al nivel de la mejor definición y la mayor extensión de la estructura anatómica correspondiente. Los ROI se extrajeron excluyendo las regiones cerebrales adyacentes o LCR. Los ROI no se obtuvieron en presencia de ningún tipo de artefactos. Teniendo en cuenta las diferentes estructuras anatómicas y tamaños de los perros, la posición y el tamaño del ROI se adaptaron a cada animal. Por lo tanto, el tamaño del ROI varió fuertemente entre las diferentes regiones del cerebro y entre los perros. Las regiones de interés dibujadas se sometieron a un control de alineación interna: en los primeros 20 casos, todos los ROI se trazaron por consenso de dos de los autores (BL, un veterinario específicamente capacitado y FDC, un radiólogo certificado por la junta con experiencia). Los ROI de los casos restantes fueron obtenidos por solo uno de los autores (BL). En caso de incertidumbre, los ROI se colocaron por consenso de los dos autores. Los valores de ROI ADC se expresaron en 10−3 milímetro2/s y tamaño en mm2.
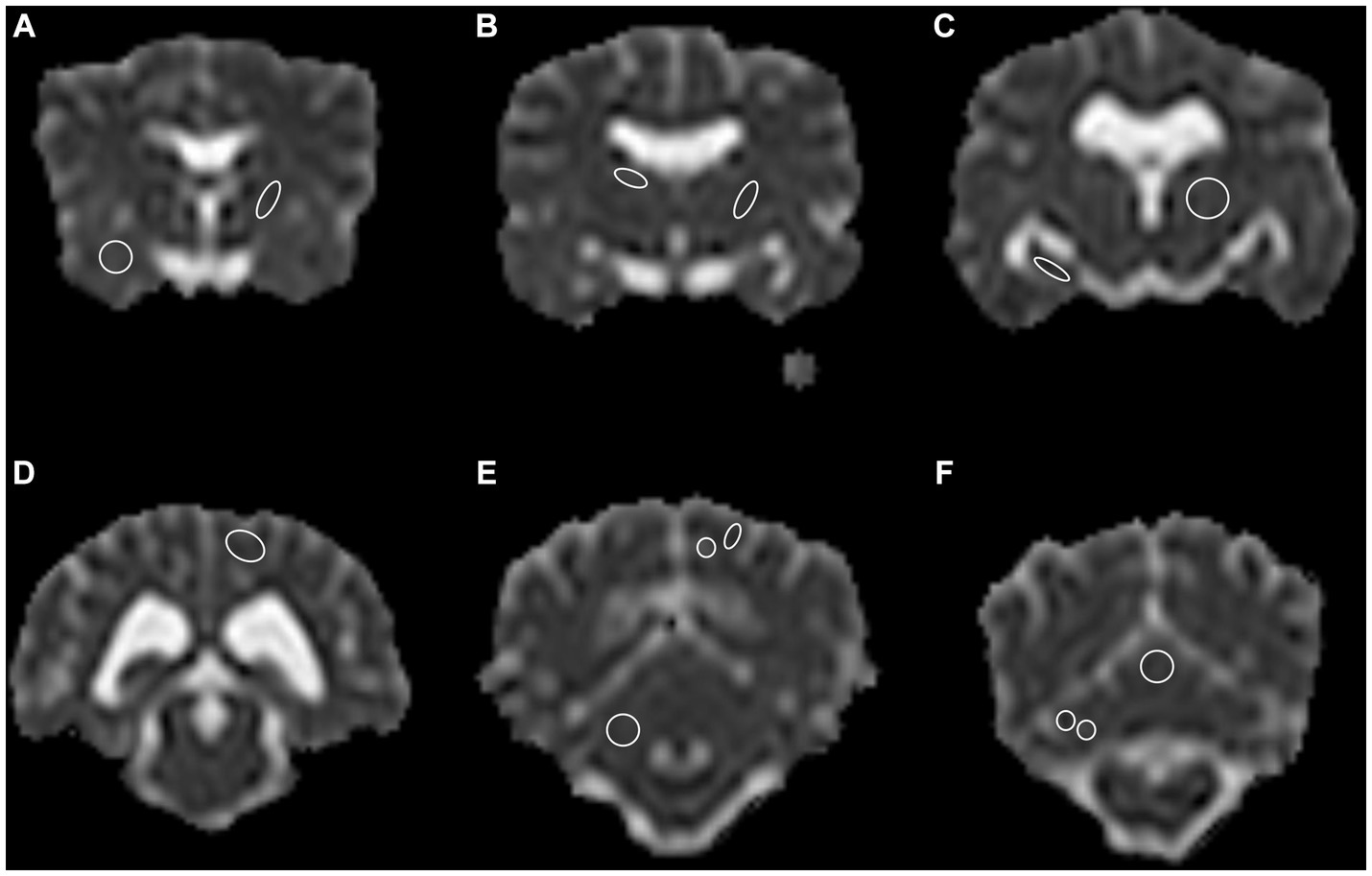
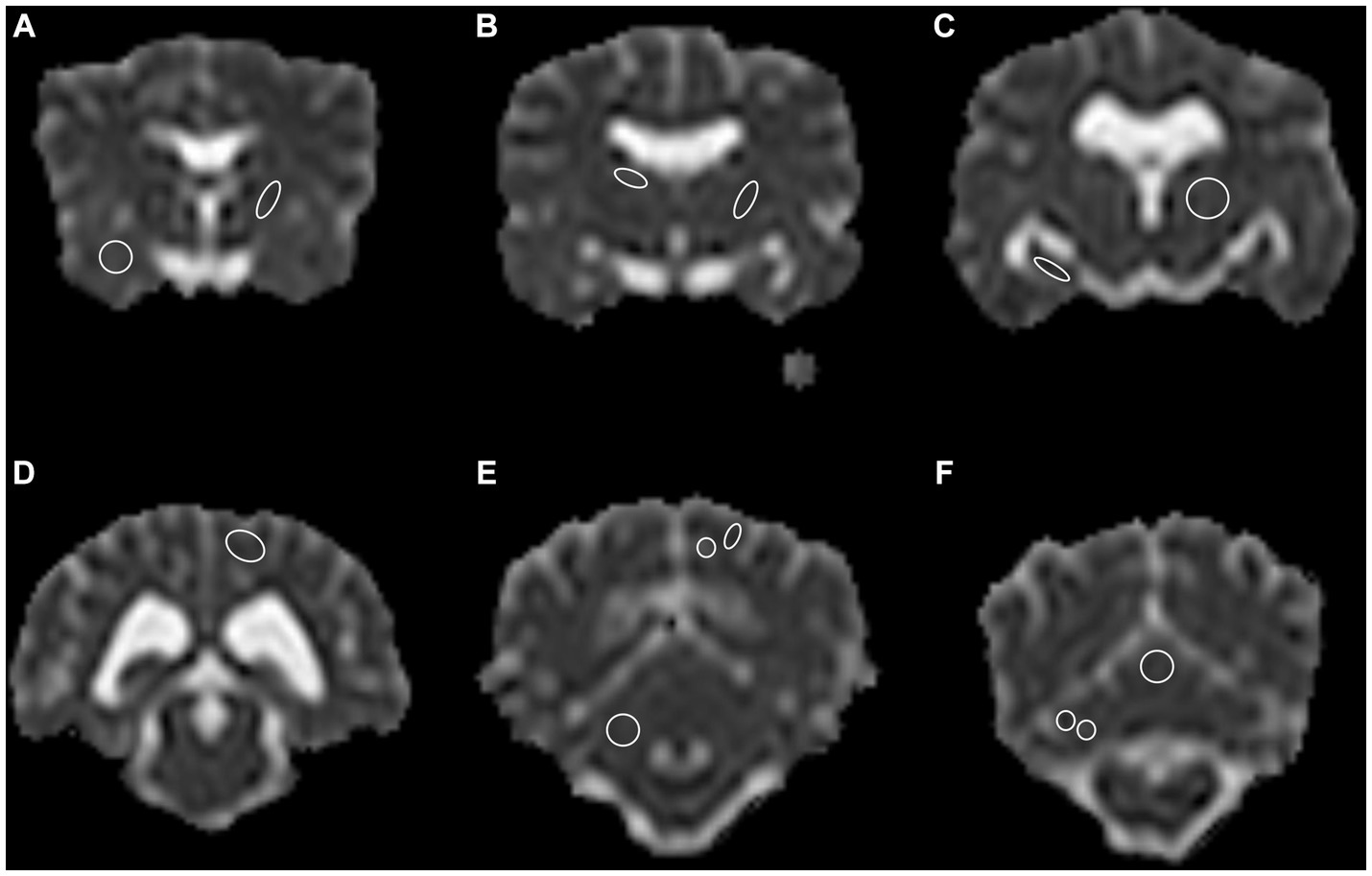 Figura 1. Un total de 13 regiones anatómicas se definieron como regiones de interés (ROI) y se dibujaron en ambos hemisferios cerebrales en el plano transversal, a excepción del vermis cerebeloso, solo dibujado en el centro. (A) Lóbulo piriforme derecho; cápsula interna rostral izquierda, (B) núcleo caudado derecho; cápsula interna caudal izquierda, (C) hipocampo derecho; tálamo izquierdo, (D) Lóbulo occipital izquierdo, sustancia gris y blanca combinadas, (E) Cerebelo derecho sustancia gris y blanca combinadas; lóbulo occipital izquierdo, sustancia gris y blanca separadas, (F) hemisferio cerebeloso derecho sustancia gris y blanca separadas; vermis central, sustancia gris y blanca combinadas. Obsérvese la limitada resolución espacial del mapa de coeficiente de difusión aparente (ADC). El lado izquierdo está en el lado derecho de la imagen. El grosor del ROI de los bordes se ha incrementado con fines representativos. Solo se muestra un lado por ROI para fines representativos.
Figura 1. Un total de 13 regiones anatómicas se definieron como regiones de interés (ROI) y se dibujaron en ambos hemisferios cerebrales en el plano transversal, a excepción del vermis cerebeloso, solo dibujado en el centro. (A) Lóbulo piriforme derecho; cápsula interna rostral izquierda, (B) núcleo caudado derecho; cápsula interna caudal izquierda, (C) hipocampo derecho; tálamo izquierdo, (D) Lóbulo occipital izquierdo, sustancia gris y blanca combinadas, (E) Cerebelo derecho sustancia gris y blanca combinadas; lóbulo occipital izquierdo, sustancia gris y blanca separadas, (F) hemisferio cerebeloso derecho sustancia gris y blanca separadas; vermis central, sustancia gris y blanca combinadas. Obsérvese la limitada resolución espacial del mapa de coeficiente de difusión aparente (ADC). El lado izquierdo está en el lado derecho de la imagen. El grosor del ROI de los bordes se ha incrementado con fines representativos. Solo se muestra un lado por ROI para fines representativos.
Para evaluar la posible influencia de la edad en los valores de ADC, la población de estudio se agrupó en cuatro clases de edad seleccionadas para adaptarse a las diferentes etapas de la vida del perro: <1 año – cachorro temprano y tardío; ⩾1 a <3 años – adultos jóvenes; ⩾3 a <8 años – adultos maduros; y ⩾8 años – perros mayores. Dependiendo del peso corporal, los animales se agruparon en tres grupos de peso corporal: ⩽10 kg, >10 – ⩽25 kg, >25 kg. Los perros se agruparon en función del motivo de la RM en el momento de la presentación. Los perros con signos neurológicos se compararon con los perros con los que se presentaron con signos no neurológicos. Los perros con estado neurológico poco claro fueron excluidos para este análisis. Las clasificaciones se basaron en los registros médicos.
Análisis estadístico
Los datos fueron recolectados en un software de hoja de cálculo (Microsoft Excel versión 16.45; Microsoft, Redmond, WA, Estados Unidos) y se analizaron con software estadístico (IBM SPSS Statistics versión 27.0; SPSS, IBM Corp, Armonk, NY, Estados Unidos). Los datos de los valores de ADC no se distribuyeron normalmente y se analizaron como no paramétricos. Se realizó estadística descriptiva, se reportaron los datos como mediana (rango) y se agregó la media ± DE cuando correspondió. Los valores de ADC se evaluaron para determinar la diferencia estadística según sexo y estado reproductivo, grupo de peso corporal y clases de edad; así como las diferencias entre el hemisferio cerebral derecho e izquierdo y entre las regiones de la sustancia blanca y gris. El ADC entre ROI se analizó mediante la prueba de Friedman para variables dependientes, seguida de la corrección post-hoc de Bonferroni para múltiples pruebas por pares. Las variables independientes se analizaron con la prueba de Kruskal-Wallis (para comparaciones múltiples) o la prueba de Mann-Whitney (para comparaciones por pares), seguida de la corrección post-hoc de Bonferroni para pruebas por pares múltiples. En general, el nivel de significación se fijó en p < 0,05.
Resultados
Un total de 321 perros cumplieron con los criterios de inclusión y fueron incluidos en el estudio (Tabla 1). Ochenta y ocho razas puras diferentes estuvieron representadas, incluyendo: Bulldog Francés (n = 22), Labrador Retriever (n = 16), Chihuahua (n = 13), Pug (n = 9), Pastor Australiano (n = 8), Border Collie (n = 7), Pastor Alemán (n = 7), Perro Salchicha (n = 6), Maltés (n = 6), Spitz Miniatura (n = 6), Yorkshire Terrier (n = 6), Boyero de Berna (n = 5), Golden Retriever (n = 5), Jack Russel Terrier (n = 5), Beagle (n = 4), Cocker Spaniel (n = 4), Papillon (n = 4), Rhodesian Ridgeback (n = 4). Otras razas puras estaban representadas por menos de 3 perros por raza. Sesenta y cuatro perros eran de raza mixta y 7 de raza desconocida (la información de la raza no se revela en la historia clínica del paciente). De las razas puras, 63 eran braquicéfalas, 145 mesocefálicas y 42 dolicocéfalas (39, 40). Ciento noventa y siete perros eran machos (61,4%) y 122 (38,0%) hembras. Ochenta y dos (25,6%) eran machos intactos, 115 (35,8%) eran machos castrados. Treinta y cinco (10,9%) eran hembras intactas y 87 (27,1%) hembras esterilizadas. Dos perros eran de sexo desconocido (0,6%). La mediana de edad fue de 71,8 meses (rango 4,1-194,4 meses). Los perros se agruparon según la edad de la siguiente manera: <1 año (n = 21); ⩾1 a <3 años (n = 41); ⩾3 a <8 años (n = 142); y ⩾8 años (n = 117). Se registró el peso corporal de 320 perros (mediana de 16,7 kg y rango de 1,4 a 72 kg) y se agruparon de la siguiente manera: ⩽10 kg (n = 104), >10 – ⩽25 kg (n = 109), >25 kg (n = 107). En un perro se desconocía el peso corporal.
La población de estudio incluyó pacientes clínicos y consistió en perros con signos neurológicos (n = 247) y con signos clínicos distintos de los signos neurológicos (n = 62). Los perros fueron sometidos a un examen de resonancia magnética con signos neurológicos (n = 247), incluyendo convulsiones (epiléptico n = 114, no epiléptico n = 15), disfunción de los nervios craneales (n = 25), disfunción vestibular (n periférica = 33, indistinguible n = 6, central n = 1), deterioro del equilibrio y alteraciones de la marcha distintas de la disfunción vestibular (n = 39) y alteración de la conciencia ( n = 14). Sesenta y dos perros se sometieron a un examen de resonancia magnética por razones distintas a los signos neurológicos, incluidos cambios de comportamiento (n = 27), enfermedad oftalmológica (n = 13), dolor de cabeza/cuello (n = 11), enfermedad del oído sin déficits neurológicos (n = 6), trastorno musculoesquelético (n = 2), enfermedad endocrina (n = 2) y un perro con secreción nasal. En 12 perros, el estado neurológico permaneció poco claro, y se excluyeron para el análisis de comparación entre los perros con signos neurológicos y los que se presentaron para signos no neurológicos. En 225 perros, se extrajo LCR del sitio atlanto-occipital (n = 224) o lumbar (n = 1). Se registró la temperatura corporal en 253/321 perros en el momento de la inducción de la anestesia general (mediana 38,2 °C; rango 34,5-39,8 °C) y al final del examen de RM (mediana 37,0 °C; rango 33,5-40,5 °C). La mediana del tiempo de examen fue de 48 min (rango 23-121 min). Típicamente, la secuencia DW se realizó en la segunda mitad del examen. Se obtuvieron un total de 7.921 ROI. En la Tabla 2 se indican los valores de ADC (media ± DE, mediana y rango) y el tamaño del ROI. Los artefactos impidieron el dibujo de uno o más ROI en 11 perros (para un total de 100 ROI).
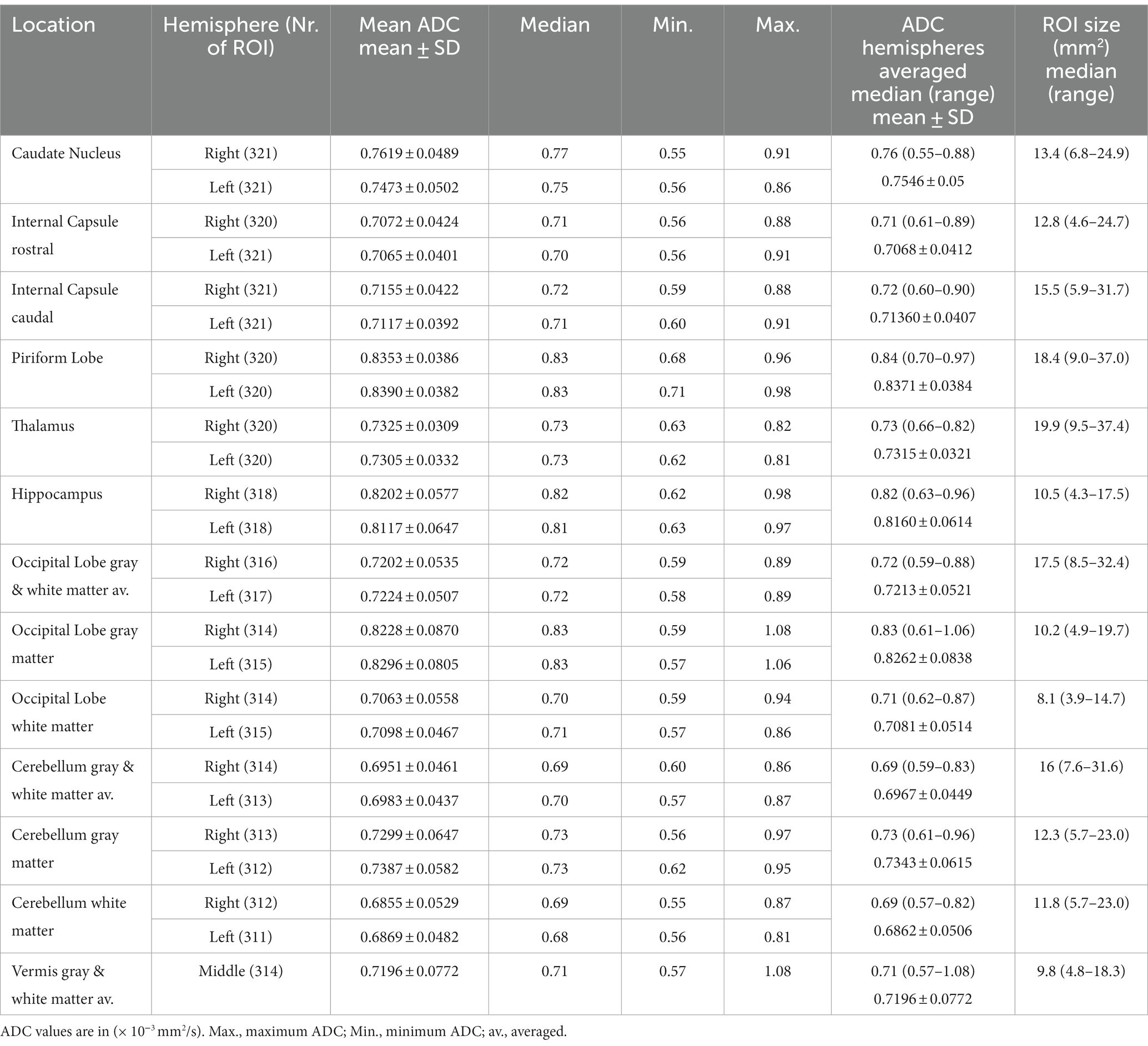 Tabla 2. El coeficiente de difusión aparente (ADC) y el tamaño de la región de interés (ROI) en 321 perros de los hemisferios derecho e izquierdo por separado y promediados.
Tabla 2. El coeficiente de difusión aparente (ADC) y el tamaño de la región de interés (ROI) en 321 perros de los hemisferios derecho e izquierdo por separado y promediados.
Los valores más altos de ADC (detalles en la Tabla 2 y descripción general en la Figura 2) se registraron en el lóbulo piriforme [0,84 (0,70–0,97) × 10−3 milímetro2/s], seguido de la sustancia gris del lóbulo occipital [0,83 (0,61–1,06) × 10−3 milímetro2/s] y el hipocampo [0,82 (0,63–0,96) × 10−3 milímetro2/s]. El valor más bajo de ADC se registró en la región cerebelosa de la sustancia blanca [0,69 (0,57–0,82) × 10−3 milímetro2/s]. El mayor tamaño de ROI se dibujó en el tálamo [19,9 (9,5–37,4) mm2] y el más pequeño en la sustancia blanca del lóbulo occipital [8,1 (3,9–14,7) mm2; Tabla 2]. Para la mayoría de los ROI analizados, la diferencia en ADC fue estadísticamente significativa (Tabla 3). Se midieron ADC significativamente más altos (p < 0,001) en el × gris [0,79 (0,69-0,90)]−3 milímetro2/s] en comparación con la sustancia blanca [0,70 (0,63–0,85) × 10−3 milímetro2/s]. Se observaron diferencias estadísticamente significativas entre el hemisferio derecho y el izquierdo en 5 ROI (p < 0,001–p = 0,047]: el núcleo caudado [izquierda 0,75 (0,56-0,86)× 10−3 milímetro2/s, derecha 0,77 (0,55–0,91) × 10−3 milímetro2/s], cápsula caudal interna [izquierda 0,71 (0,60–0,91) × 10−3 milímetro2/s, derecha 0,72 (0,59–0,88) × 10−3 milímetro2/s], lóbulo piriforme [izquierda 0,83 (0,71–0,98) × 10−3 milímetro2/s, derecha 0,83 (0,68–0,96) × 10−3 milímetro2/s], hipocampo [izquierda 0,81 (0,63–0,97) × 10−3 milímetro2/s, derecha 0,82 (0,62–0,98) × 10−3 milímetro2/s] y la sustancia gris del cerebelo [izquierda 0,73 (0,62–0,95) × 10−3 milímetro2/s, derecha 0,73 (0,56–0,91) × 10−3 milímetro2/s]. Ningún lado del hemisferio tuvo valores de ADC consistentemente más altos. No se observaron diferencias estadísticamente significativas en los valores de ADC entre perros machos y hembras ni en función del estado reproductivo.
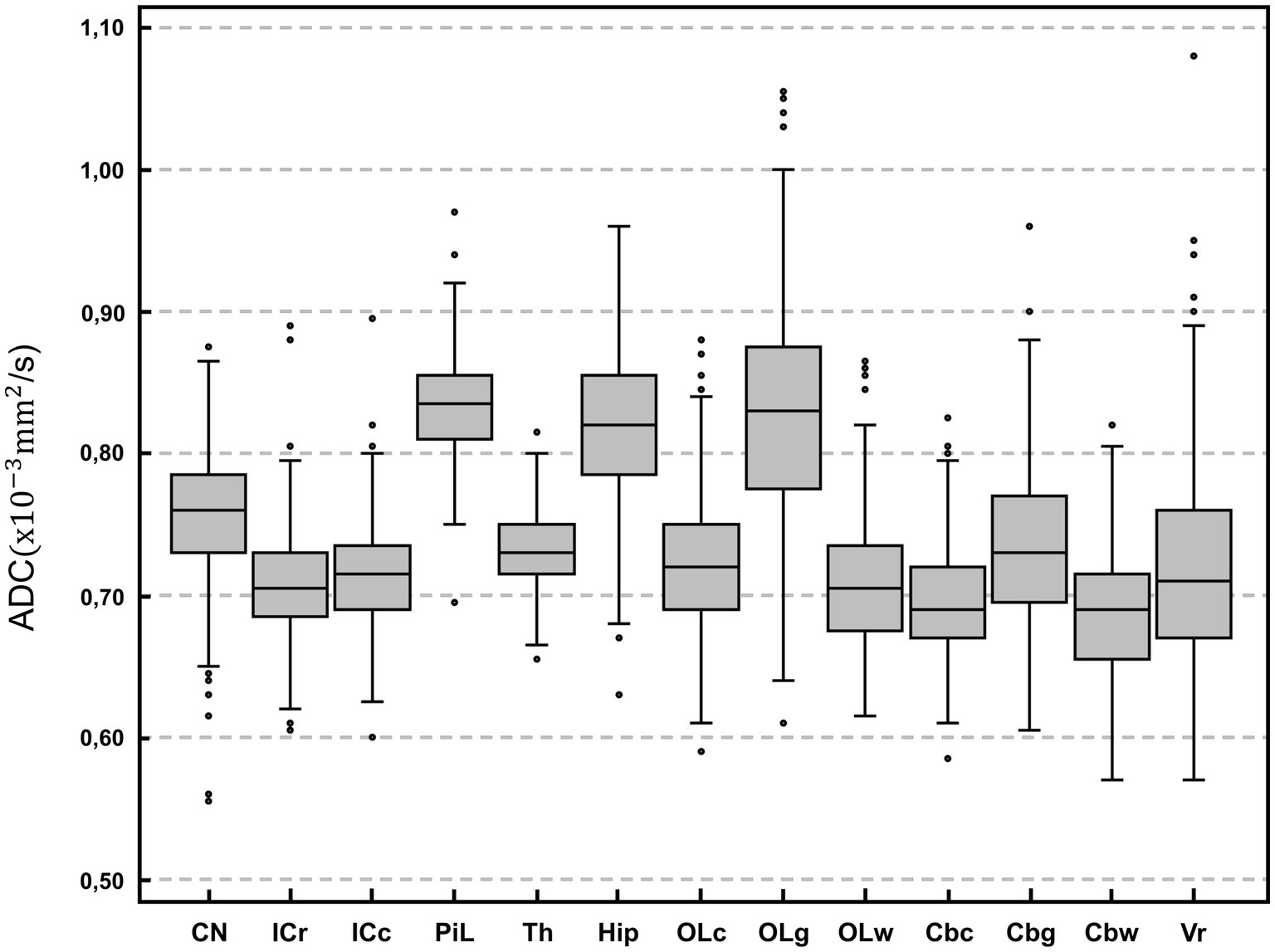 Figura 2. Comparación de diagramas de caja del coeficiente de difusión aparente (ADC; × 10−3 milímetro2/s) entre las regiones anatómicas de interés. Para cada gráfico, el cuadro representa los percentiles 25 a 75, la línea horizontal representa la mediana. Los bigotes indican el valor más alto dentro de 1,5 veces el rango intercuartílico (RIC) y el valor más bajo dentro de 1,5 veces el RIC. Los puntos representan los valores atípicos. CN: núcleo caudado; ICr: rostral interno de la cápsula; ICc: cápsula caudal interna; PiL: lóbulo piriforme; Th, tálamo; Cadera, hipocampo; OLc: lóbulo occipital combinado; OLg: sustancia gris del lóbulo occipital; OLw: sustancia blanca del lóbulo occipital; Cbc: cerebelo combinado; Cbg: Materia gris del cerebelo; Cbw: sustancia blanca del cerebelo; Vr, vermis. A excepción de vermis, se promedian los valores de los hemisferios derecho e izquierdo.
Figura 2. Comparación de diagramas de caja del coeficiente de difusión aparente (ADC; × 10−3 milímetro2/s) entre las regiones anatómicas de interés. Para cada gráfico, el cuadro representa los percentiles 25 a 75, la línea horizontal representa la mediana. Los bigotes indican el valor más alto dentro de 1,5 veces el rango intercuartílico (RIC) y el valor más bajo dentro de 1,5 veces el RIC. Los puntos representan los valores atípicos. CN: núcleo caudado; ICr: rostral interno de la cápsula; ICc: cápsula caudal interna; PiL: lóbulo piriforme; Th, tálamo; Cadera, hipocampo; OLc: lóbulo occipital combinado; OLg: sustancia gris del lóbulo occipital; OLw: sustancia blanca del lóbulo occipital; Cbc: cerebelo combinado; Cbg: Materia gris del cerebelo; Cbw: sustancia blanca del cerebelo; Vr, vermis. A excepción de vermis, se promedian los valores de los hemisferios derecho e izquierdo.
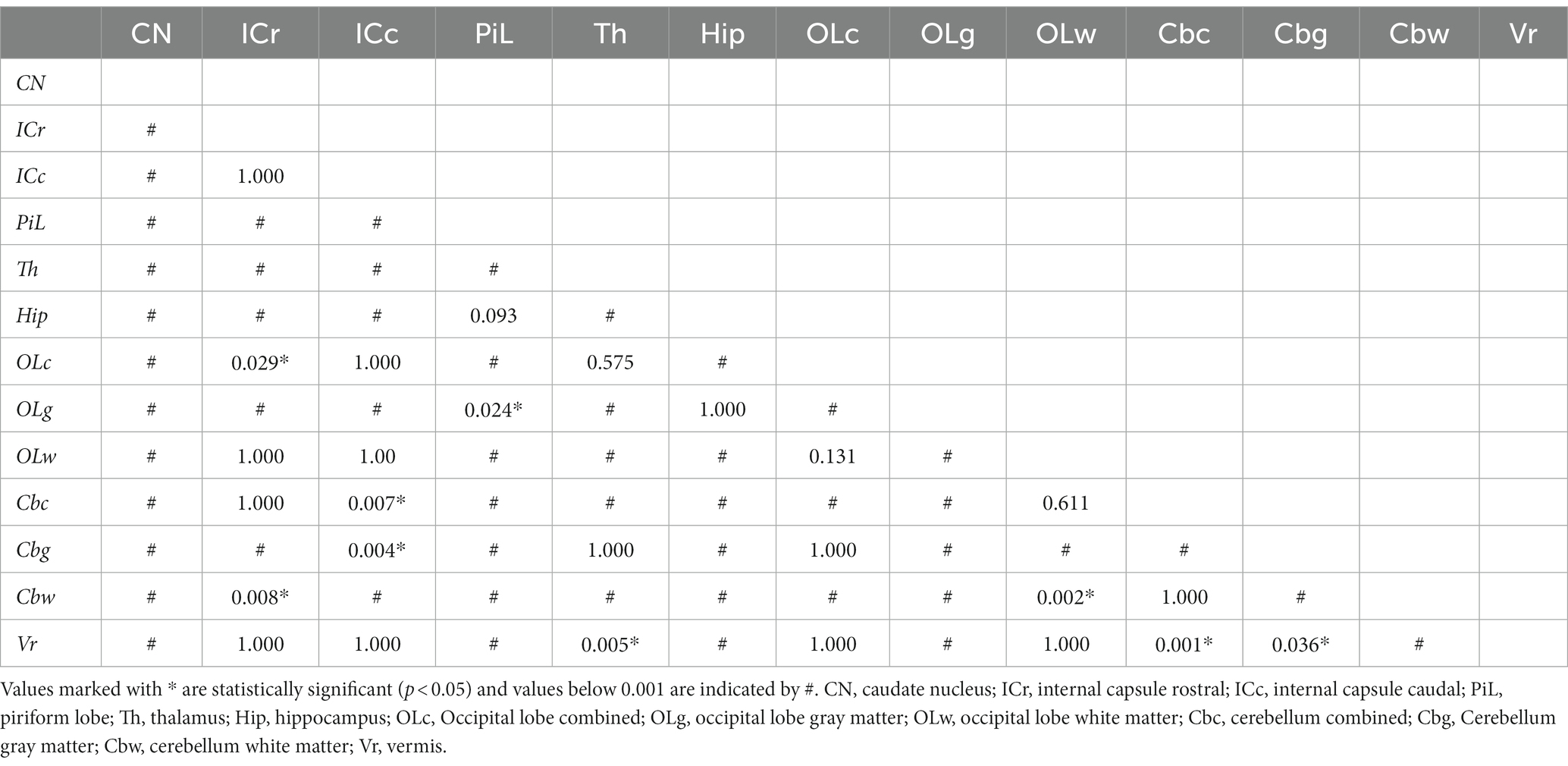 Tabla 3. Comparación estadística (test de Friedman con test post-hoc, corrección de Bonferroni para test múltiples) de los valores de ADC entre regiones anatómicas de interés.
Tabla 3. Comparación estadística (test de Friedman con test post-hoc, corrección de Bonferroni para test múltiples) de los valores de ADC entre regiones anatómicas de interés.
Dependiendo de las clases de peso corporal, se encontraron diferencias en 3 ROIs (materia combinada del lóbulo occipital, materia gris del cerebelo, vermis cerebeloso; p < 0,001–p = 0,011). En 1 ROI (materia combinada del lóbulo occipital) los valores medianos fueron más altos dentro del grupo ⩽10 kg, mientras que en 2 ROI (vermis, cerebelo, materia gris) los valores medianos fueron más altos dentro del grupo >25 kg. Ningún grupo de BW tuvo un ADC consistentemente más alto. Se encontraron diferencias estadísticamente significativas entre la clase de edad <1 año y la clase de mediana edad (⩾3 a <8 años) con los valores medios más altos dentro de los perros <1 año de edad (Figura 3). En general, los valores medios de ADC dentro de la materia gris y blanca disminuyeron de los perros menores de 1 año a los perros de mediana edad (⩾3 a <8 años) y aumentaron nuevamente en los perros mayores de 8 años.
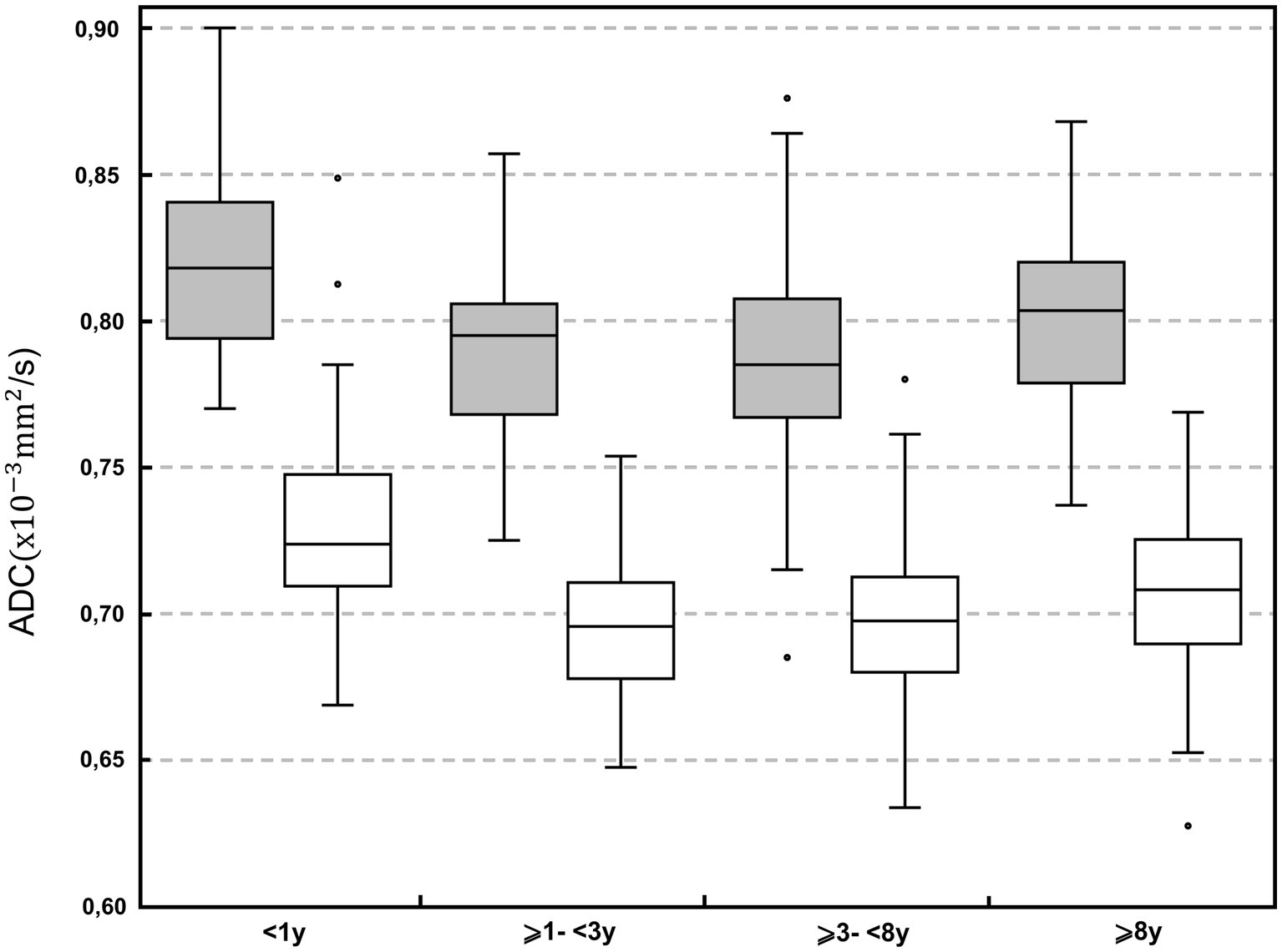 Figura 3. Diagrama de caja del coeficiente de difusión aparente (ADC; × 10−3 milímetro2/s) en las diferentes clases de edad: <1; ⩾1 a <3 años; ⩾3 a <8 años; y ⩾8 años. Los recuadros grises representan la materia gris; Las cajas blancas representan la materia blanca. Para cada gráfico, el cuadro representa los percentiles 25 a 75, la línea horizontal representa la mediana. Los bigotes representan el valor más alto dentro de 1,5 veces el rango intercuartílico (RIC) y el valor más bajo dentro de 1,5 veces el RIC. Los puntos representan los valores atípicos.
Figura 3. Diagrama de caja del coeficiente de difusión aparente (ADC; × 10−3 milímetro2/s) en las diferentes clases de edad: <1; ⩾1 a <3 años; ⩾3 a <8 años; y ⩾8 años. Los recuadros grises representan la materia gris; Las cajas blancas representan la materia blanca. Para cada gráfico, el cuadro representa los percentiles 25 a 75, la línea horizontal representa la mediana. Los bigotes representan el valor más alto dentro de 1,5 veces el rango intercuartílico (RIC) y el valor más bajo dentro de 1,5 veces el RIC. Los puntos representan los valores atípicos.
Se encontraron diferencias estadísticamente significativas en la cápsula interna (rostral y caudal) en los perros que presentaban signos neurológicos en comparación con los perros que presentaban signos no neurológicos. En ambos ROI, los valores de ADC fueron mayores en el grupo con signos neurológicos. No se encontraron diferencias entre el ADC elaborado por consenso y los valores del observador único.
Discusión
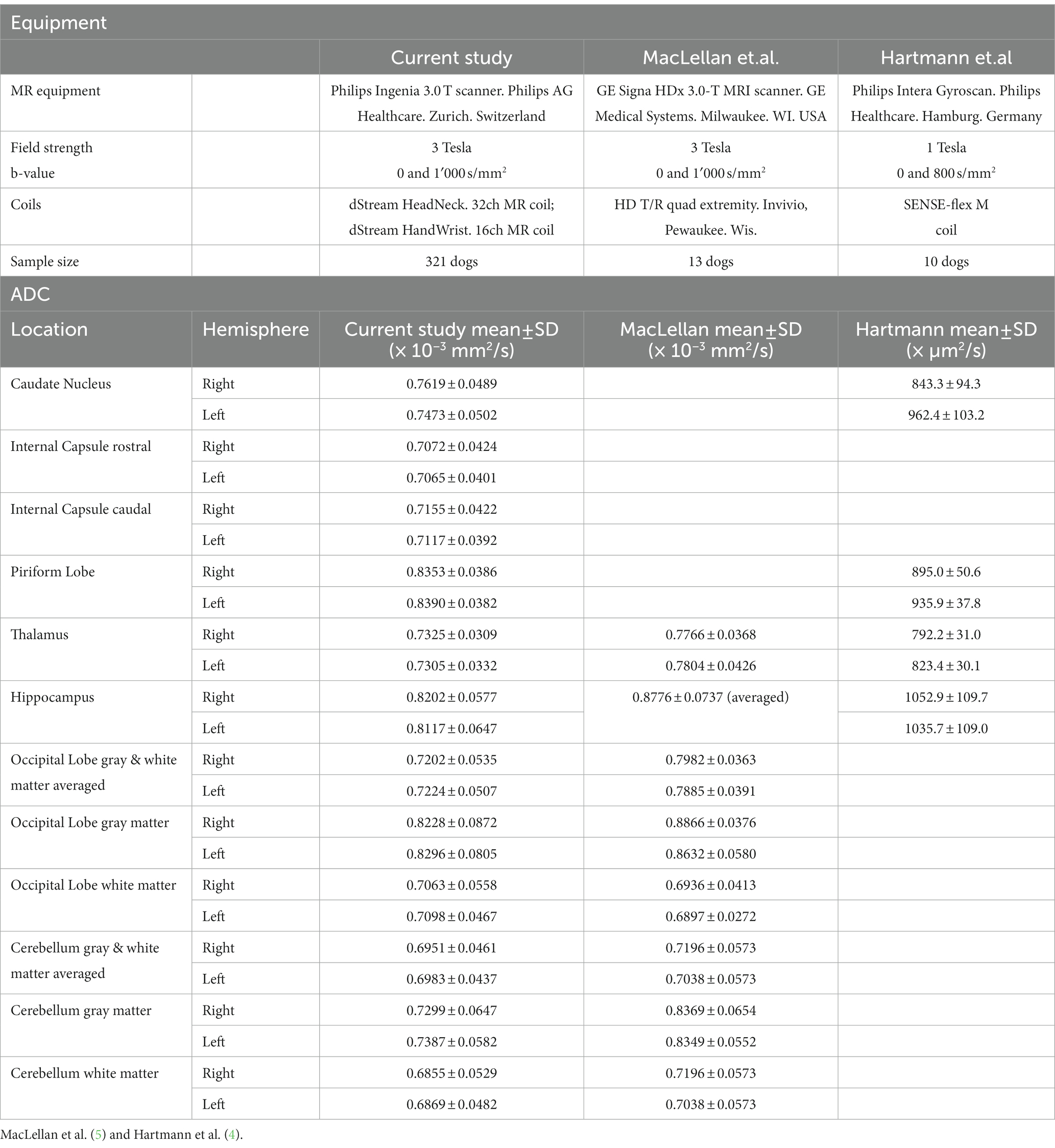
El estudio describe los valores regionales de ADC en cerebros morfológicamente normales en una gran población de pacientes caninos en entornos clínicos. Los valores más altos de ADC se midieron en el lóbulo piriforme, seguido del lóbulo occipital y el hipocampo. Otros estudios reportan los valores más altos de ADC en el hipocampo, seguido del lóbulo piriforme (4); en la corteza de los lóbulos frontal y parietal, seguidos del lóbulo occipital y el hipocampo (5). El valor más bajo de ADC se encontró en la sustancia blanca cerebelosa, similar a los hallazgos en gatos (3). Como se muestra en la Tabla 4, los valores de ADC del presente estudio fueron sustancialmente similares a los reportados (5), excepto para la sustancia gris del cerebelo. También se han reportado valores más altos de ADC regional (4). Sin embargo, los diferentes valores de ADC de diferentes estudios deben compararse con cautela porque están fuertemente influenciados por las diferencias en el equipo y la tecnología utilizada. Esto incluye el tipo de sistema, la fuerza del imán y el protocolo de escaneo aplicado. Incluso usando la misma bobina, se reportan variaciones en los valores de ADC (41). Para minimizar estas variaciones, en el presente estudio se utilizaron el mismo imán, bobinas y protocolo. Se informaron valores de ADC similares con idéntica fuerza magnética y valores b (5).
Los valores del coeficiente de difusión aparente de las regiones de materia blanca fueron significativamente más bajos en comparación con la materia gris. Esto es de esperar ya que la sustancia blanca, a diferencia de la materia gris, consiste principalmente en axones mielinizados, que actúan como barreras de difusión y conducen a valores más bajos de ADC (5). Además, los axones mielinizados son responsables de un patrón de difusión direccional, paralelo a las vías axonales, llamado anisotropía (5, 42). Este hallazgo es reproducible en perros y humanos (4, 5, 23, 43) y se ha descrito recientemente también en gatos (3).
La mediana de ADC difirió significativamente en 5 ROI entre el hemisferio cerebral derecho e izquierdo. El coeficiente de difusión aparente no fue consistentemente mayor en un lado del hemisferio: se encontró un ADC significativamente más alto en el núcleo caudado derecho, la cápsula interna y el hipocampo, y en el lóbulo piriforme izquierdo y la sustancia gris del cerebelo. Se han reportado valores estadísticamente más altos de ADC en el hemisferio cerebral izquierdo (4), así como valores más altos, pero no significativamente diferentes en el hemisferio derecho (5) en un número menor de perros. Se ha descrito asimetría en los valores de ADC en varias regiones en humanos, con cierta correlación con la edad y el sexo (44). Una de las explicaciones más acreditadas es que la asimetría en las estructuras cerebrales o en la densidad neuronal podría influir en la densidad celular y, por tanto, en la difusividad, provocando diferencias en la ADC en función del lado. Una mayor densidad neuronal conduce a una menor difusión y se ha informado que el hemisferio cerebral canino derecho es más pesado que el izquierdo (45). La lateralidad es una explicación discutida de la lateralidad en el cerebro humano (46) que influye en la densidad celular y, por lo tanto, en la difusividad, causando diferencias en el ADC según el lado (47). También se describe la pata en perros y la asimetría cerebral asociada. Sin embargo, en los estudios en perros que sí muestran patas, no se encontró una sobrerrepresentación de la pata izquierda o derecha (48-50) Esto podría apoyar la falta de consistencia para los valores más altos de ADC en un lado de los hemisferios en nuestro estudio.
Del mismo modo, en nuestros resultados, no se han encontrado diferencias en los valores de ADC en función del sexo en gatos (3). Los estudios en caninos y humanos mostraron un efecto de la edad sobre la difusividad en el cerebro. En humanos, los valores de ADC disminuyen hasta la edad adulta y aumentan durante el período de senescencia. La mielinización durante la adolescencia y, a la inversa, la pérdida de volumen extracelular y la desmielinización durante la senescencia se han discutido como causas subyacentes. (5, 44, 51, 52) En nuestro estudio, los valores medios de ADC disminuyeron de los perros menores de 1 año a los perros de mediana edad (⩾3 a <8 años) y aumentaron nuevamente en la clase de edad de los perros mayores de 8 años. Los cambios en la mielinización respaldarían nuestros resultados, teniendo en cuenta la diferente duración de la vida entre humanos y perros, y probablemente de acuerdo con el diferente ritmo de los cambios cerebrales relacionados con la edad.
Del mismo modo, como se informó (5), en nuestro estudio no se encontraron diferencias consistentes entre los grupos de peso corporal y la mediana de los valores de ADC. No hay una explicación convincente para la diferencia descrita en tres ROI dependiendo del BW. Dos de estos ROI (cápsula interna caudal y materia gris del cerebelo) se encontraban entre los ROI de menor tamaño. Se puede especular que a través de la resolución espacial limitada en los mapas ADC, que disminuye aún más en los animales más pequeños, la ubicación del ROI en los perros más pequeños puede ser más inexacta que en los animales más grandes. En perros más pequeños, los píxeles pueden representar una mayor proporción de la anatomía del paciente resuelta ópticamente y un desajuste entre las secuencias morfológicas, con una resolución espacial más alta, podría conducir a una colocación inexacta del ROI. Por lo tanto, las diferencias con los perros de menor tamaño pueden ser simplemente un efecto de inexactitud.
La mayoría de los perros presentaron, como era de esperar, signos neurológicos (n = 247), menos de la mitad de ellos con crisis epilépticas. En perros diagnosticados de epilepsia idiopática, se describe que los valores de ADC durante la fase interictal son más altos en el lóbulo piriforme y en el centro semiovalado, en comparación con los valores de perros sanos. Este hecho podría explicarse por la pérdida celular y el aumento del espacio intercelular (35). Durante el ictus se encuentra lo contrario, y el ADC regional disminuye en pacientes humanos y en el modelo experimental canino de estado epiléptico (53, 54). Nuestros datos no confirmaron esta variación en el ADC del lóbulo piriforme en perros en función de los signos clínicos. No se encontraron diferencias en el ADC entre los perros con signos neurológicos frente a los perros con signos no neurológicos en todo el ROI, excepto en la cápsula interna. En nuestra población de pacientes, los perros que presentaban signos neurológicos incluían una etiología muy heterogénea y la diferencia de ADC en la cápsula interna no puede interpretarse claramente. Solo se puede especular si los diferentes ADC podrían sugerir un posible vínculo entre los signos neurológicos y la integridad de la región o si esta variación podría representar una causa o la secuela de los signos neurológicos. Dado que no se disponía de un diagnóstico histológico definitivo en estos perros, se debe tener precaución en la interpretación de estos resultados.
Muchos otros factores relacionados con el paciente pueden influir en el ADC. En ratas y ratones, se ha descrito que el ADC se correlaciona positivamente con la temperatura corporal (55, 56). La temperatura del paciente se registró cuando estaba disponible y se mantuvo en el rango fisiológico. Sin embargo, no se registró la temperatura exacta en el momento de la adquisición de las imágenes DW, y su influencia en el ADC sigue siendo desconocida. La anestesia y su efecto sobre la actividad neuronal también pueden influir en la difusividad del agua. Este fenómeno puede causar un aumento de la ADC en regiones específicas del cerebro, lo que refleja una disminución de la actividad neuronal (57). En nuestro estudio, la anestesia no estaba estandarizada y el protocolo anestésico fue elegido en la evaluación caso por caso por el anestesista responsable. Por lo tanto, no se investigó la posible influencia de la anestesia.
La principal limitación de este estudio es la población examinada, constituida por pacientes clínicos. A pesar de que solo se incluyeron perros con estudios cerebrales de RM morfológicamente normales, no se pueden descartar procesos patológicos no visibles o microestructurales, ya que la mayoría de los perros presentaron signos neurológicos y, obviamente, no fue posible realizar un examen histopatológico. Patologías de diferente naturaleza más allá de la resolución óptica de las imágenes morfológicas estándar de RM pueden pasar desapercibidas (58, 59) pero podrían afectar potencialmente al ADC. Además, la población analizada sufre el sesgo de selección de una población clínica. Los grupos de edad son desiguales en tamaño, siendo los perros de mayor edad los que se presentan con mayor frecuencia para el examen de resonancia magnética. Esta distribución desproporcionada del tamaño de los grupos de edad podría haber tenido un impacto en los resultados.
Otra limitación consiste en el carácter retrospectivo del estudio. El manejo de casos individuales y el tiempo transcurrido entre el examen de RM y la presencia de signos clínicos no se investigó ni estandarizó y podrían influir en los valores de ADC en relación con la aparición de los signos clínicos. Los valores del coeficiente de difusión aparente se analizaron en el contexto del estudio clínico del paciente. No se investigó la influencia de los factores técnicos relacionados que podrían afectar al ADC, los valores de referencia fantasma o la relación señal-ruido en cada uno de los exámenes, así como la influencia de los artefactos no visibles ópticamente. El ADC reportado basado en las imágenes adquiridas con la técnica descrita no permite cuantificar la anisotropía, particularmente marcada en la sustancia blanca del cerebro. La colocación del ROI de ADC fue realizada en gran medida por un solo observador y no se realizó ninguna repetición de las mediciones. Por lo tanto, las posibles variabilidades entre observadores deben considerarse una limitación.
Conclusión
El presente estudio investiga el ADC en diferentes regiones del cerebro canino con un examen de resonancia magnética morfológicamente normal. Trescientos veintiún perros de diferentes razas, sexo, estado reproductivo y edad fueron incluidos en el estudio. El coeficiente de difusión aparente varía significativamente entre la mayoría de las regiones anatómicas del cerebro. El coeficiente de difusión aparente fue significativamente menor en la sustancia blanca que en la gris. Los hemisferios cerebrales izquierdo y derecho presentaron valores similares de ADC en la mayoría de las regiones, y no se observaron diferencias en función del sexo o estado reproductivo. No se encontró una correlación consistente entre los grupos de peso corporal y los valores de ADC. La edad se correlacionó primero con una disminución y luego con un aumento de los valores de ADC, probablemente consistente con la maduración y el envejecimiento del cerebro. Los datos descritos pueden servir de referencia para futuros estudios en entornos clínicos sobre el cerebro canino.
Declaración de disponibilidad de datos
Las contribuciones originales presentadas en el estudio están incluidas en el artículo/Material complementario, las consultas posteriores pueden dirigirse al autor correspondiente.
Declaración ética
Se firmó un formulario de consentimiento para el uso de los datos de los perros con fines académicos por parte de los propietarios de todos los perros incluidos.
Contribuciones de los autores
Concepción y diseño realizado por FC y LC. Adquisición de datos realizada por BL. Análisis estadístico realizado por RRHH. Redacción del artículo realizada por LC. Todos los autores contribuyeron al artículo y aprobaron la versión enviada.
Reconocimientos
Parte del estudio se presentó en la reunión anual de ECVDI (Edimburgo en 2022) como una presentación oral.
Conflicto de intereses
Los autores declaran que la investigación se llevó a cabo en ausencia de relaciones comerciales o financieras que pudieran interpretarse como un posible conflicto de intereses.
Nota del editor
Todas las afirmaciones expresadas en este artículo son únicamente las de los autores y no representan necesariamente las de sus organizaciones afiliadas, ni las del editor, los editores y los revisores. Cualquier producto que pueda ser evaluado en este artículo, o afirmación que pueda ser hecha por su fabricante, no está garantizado ni respaldado por el editor.
Material complementario
El material complementario para este artículo se puede encontrar en línea en: https://www.frontiersin.org/articles/10.3389/fvets.2023.1219943/full#supplementary-material
Referencias
1. Feynman, R. El movimiento browniano En: R. Feynman, R. Leighton y M. Sands, editores. Las conferencias de Feynman sobre física. Boston, MA: Addison-Wesley (1963). 41.
2. Guo, A, Cummings, T, Dash, R y Provenzale, J. Linfomas y astrocitomas de alto grado: comparación de la difusibilidad del agua y las características histológicas. Radiología. (2002) 224:177–83. doi: 10.1148/radiol.2241010637
Resumen de PubMed | Texto completo de CrossRef | Google Académico
3. Lindt, B, Richter, H y Del Chicca, F. Investigaron los valores del coeficiente de difusión aparente regional del cerebro felino morfológicamente normal. J Feline Med Surg. (2022) 24:E214–22. doi: 10.1177/1098612X221101535
4. Hartmann, A, Söffler, C, Failing, K, Schaubmar, A, Kramer, M y Schmidt, M. Imágenes de resonancia magnética ponderadas por difusión del cerebro canino normal. Ecografía Radiol Veterinaria. (2014) 55:592–8. doi: 10.1111/vru.12170
Resumen de PubMed | Texto completo de CrossRef | Google Académico
5. McLellan, M, Ober, C, Feeney, D y Jessen, C. Imágenes de resonancia magnética ponderadas por difusión del cerebro de perros neurológicamente normales. Am J Vet Res. (2017) 78:601–8. doi: 10.2460/ajvr.78.5.601
Resumen de PubMed | Texto completo de CrossRef | Google Académico
6. Le Bihan, D, y Breton, E. Imágenes de resonancia magnética de movimientos incoherentes intravóxeles: aplicación a la difusión y perfusión en trastornos neurológicos. RSNA. (1986) 161:401–7. doi: 10.1148/radiology.161.2.3763909
Resumen de PubMed | Texto completo de CrossRef | Google Académico
7. Olivot, J y Marks, M. Resonancia magnética en la evaluación del accidente cerebrovascular agudo. Top Magn Reson Imaging. (2008) 19:225–30. doi: 10.1097/RMR.0b013e3181aaf37c
8. Fiebach, J, Schellinger, P, Jansen, O, Meyer, M, Wilde, P, Bender, J, et al. CT e imágenes de RM ponderadas por difusión en orden aleatorio: las imágenes ponderadas por difusión dan como resultado una mayor precisión y una menor variabilidad entre evaluadores en el diagnóstico de accidente cerebrovascular isquémico hiperagudo. Accidente cerebrovascular. (2002) 33:2206–10. doi: 10.1161/01.STR.0000026864.20339.CB
Resumen de PubMed | Texto completo de CrossRef | Google Académico
9. Kucinski, T, Väterlein, O, Glauche, V, Fiehler, J, Klotz, E, Eckert, B, et al. Correlación del coeficiente de difusión aparente y la densidad de la tomografía computarizada en el accidente cerebrovascular isquémico agudo. Accidente cerebrovascular. (2002) 33:1786–91. doi: 10.1161/01.STR.0000019125.80118.99
Resumen de PubMed | Texto completo de CrossRef | Google Académico
10. Mullins, M, Schaefer, P, Sorensen, A, Halpern, E, Ay, H, He, J, et al. TC e imágenes de RM convencionales y ponderadas por difusión en accidentes cerebrovasculares agudos: estudio en 691 pacientes en el momento de la presentación al servicio de urgencias. Radiología. (2002) 224:353–60. doi: 10.1148/radiol.2242010873
Resumen de PubMed | Texto completo de CrossRef | Google Académico
11. Liu, A, Maldjian, J, Bagley, L, Sinson, G y Grossman, R. Lesión cerebral traumática: hallazgos de imágenes de RM ponderadas por difusión. AJNR Am J Neuroradiol. (1999) 20:1636–41.
12. Dmytriw, A, Sawlani, V y Shankar, J. Imágenes ponderadas por difusión del cerebro: más allá del accidente cerebrovascular. Can Assoc Radiol J. (2017) 68:131–46. doi: 10.1016/j.carj.2016.10.001
13. Provenzale, J, Mukundan, S y Barboriak, D. Imágenes de RM ponderadas por difusión y perfusión para la caracterización de tumores cerebrales y la evaluación de la respuesta al tratamiento. Radiología. (2006) 239:632–49. doi: 10.1148/radiol.2393042031
14. Barboriak, DP. Imágenes de tumores cerebrales con imágenes de RM ponderadas por difusión y con tensor de difusión. Magn Reson Imaging Clin N Am. (2003) 11:379–401. doi: 10.1016/S1064-9689(03)00065-5
15. Guzmán, R, Altrichter, S, El-Koussy, M, Gralla, J, Weis, J, Barth, A, et al. Contribución del coeficiente de difusión aparente en el edema perilesional para la evaluación de tumores cerebrales. J Neurorradiol. (2008) 35:224–9. doi: 10.1016/j.neurad.2008.02.003
Resumen de PubMed | Texto completo de CrossRef | Google Académico
16. Perrone, A, Guerrisi, P, Izzo, L, D’Angeli, I, Sassi, S, Mele, L, et al. Resonancia magnética ponderada por difusión en ganglios linfáticos cervicales: diferenciación entre lesiones benignas y malignas. Eur J Radiol. (2011) 77:281–6. doi: 10.1016/j.ejrad.2009.07.039
Resumen de PubMed | Texto completo de CrossRef | Google Académico
17. Diehl, B, Najm, I, Ruggieri, P, Tkach, J, Mohamed, A, Morris, H, et al. Imágenes ponderadas por difusión postictal para la localización de áreas epilépticas focales en la epilepsia del lóbulo temporal. Epilepsia. (2001) 42:21–8. doi: 10.1046/j.1528-1157.2001.19500.x
Resumen de PubMed | Texto completo de CrossRef | Google Académico
18. Engel, J, McDermott, M, Wiebe, S, Langfitt, J, Stern, J, Dewar, S, et al. Tratamiento quirúrgico temprano para la epilepsia del lóbulo temporal resistente a los medicamentos: un ensayo aleatorizado. JAMA. (2012) 307:922–30. doi: 10.1001/jama.2012.220
Resumen de PubMed | Texto completo de CrossRef | Google Académico
19. Nusbaum, A, Tang, C, Buchsbaum, M, Wei, C y Atlas, S. Cambios regionales y globales en la difusión cerebral con el envejecimiento normal. Am J Neuroradiol. (2001) 22:136–42.
20. Engelter, S, Provenzale, J, Petrella, J, DeLong, D, y MacFall, J. El efecto del envejecimiento en el coeficiente de difusión aparente de la sustancia blanca de apariencia normal. Am J Roentgenol. (2000) 175:425–30. doi: 10.2214/ajr.175.2.1750425
Resumen de PubMed | Texto completo de CrossRef | Google Académico
21. Sotardi, S, Gollub, R, Bates, S, Weiss, R, Murphy, S, Grant, P, et al. Cambios en el coeficiente de difusión aparente cerebral de Voxel y regional en la RM desde el nacimiento hasta los 6 años de edad. Radiología. (2021) 298:415–24. doi: 10.1148/RADIOL.2020202279
Resumen de PubMed | Texto completo de CrossRef | Google Académico
22. Neil, J, Miller, J, Mukherjee, P y Hüppi, P. Imágenes de tensor de difusión del cerebro humano en desarrollo normal y lesionado: una revisión técnica. RMN Biomed. (2002) 15:543–52. doi: 10.1002/nbm.784
23. Helenius, J, Soinne, L, Perkiö, J, Salonen, O, Kangasmäki, A, Kaste, M, et al. Imágenes de RM ponderadas por difusión en cerebros humanos normales en varios grupos de edad. AJNR. (2002) 23:194–9.
24. Ahlhelm, F, Hagen, T, Schneider, G, Dorenbeck, U, Nabhan, A y Reith, W. Mapeo ADC del cerebro humano normal. Med Sci Monit. (2004) 10:MT121–5.
25. Garosi, L, McConnell, J, Platt, S, Barone, G, Baron, J, Lahunta, A, et al. Características clínicas y topográficas de la resonancia magnética de sospecha de infarto cerebral en 40 perros. J Veterinario Pasante Med. (2006) 20:311–21. doi: 10.1111/j.1939-1676.2006.tb02862.x
Resumen de PubMed | Texto completo de CrossRef | Google Académico
26. McConnell, J, Garosi, L, y Platt, S. Hallazgos de imágenes de resonancia magnética de presunto accidente cerebrovascular cerebeloso en doce perros. Ecografía Radiol Veterinaria. (2005) 46:1–10. doi: 10.1111/j.1740-8261.2005.00001.x
27. Moseley, M, Kucharczyk, J, Mintorovitch, J, Cohen, Y, Kurhanewicz, J, Derugin, N, et al. Imágenes de RM ponderadas por difusión del accidente cerebrovascular agudo: correlación con imágenes de RM ponderadas en T2 y mejoradas por susceptibilidad magnética en gatos. AJNR. (1990) 11:423–9.
28. Liu, K, Li, F, Tatlisumak, T, García, J, Sotak, C, Fisher, M, et al. Variaciones regionales en el coeficiente de difusión aparente y la distribución intracelular del agua en el cerebro de rata durante la isquemia focal aguda. Accidente cerebrovascular. (2001) 32:1897–905. doi: 10.1161/01.str.32.8.1897
Resumen de PubMed | Texto completo de CrossRef | Google Académico
29. Kuroiwa, T, Nagaoka, T, Ueki, M, Yamada, I, Miyasaka, N, Akimoto, H, et al. Correlaciones entre el coeficiente de difusión aparente, el contenido de agua y la ultraestructura después de la inducción de edema cerebral vasogénico en gatos. J Neurosurg. (1999) 90:499–503. doi: 10.3171/jns.1999.90.3.0499
Resumen de PubMed | Texto completo de CrossRef | Google Académico
30. McLellan, M, Ober, C, Feeney, D y Jessen, C. Evaluación de imágenes de resonancia magnética ponderada por difusión a 3,0 tesla para la diferenciación entre lesiones neoplásicas intracraneales e inflamatorias no infecciosas en perros. JAVMA. (2019) 255:71–7. doi: 10.2460/javma.255.1.71
Resumen de PubMed | Texto completo de CrossRef | Google Académico
31. Wada, M, Hasegawa, D, Hamamoto, Y, Yu, Y, Asada, R, Fujiwara-Igarashi, A, et al. Comparación de meningiomas caninos y felinos mediante el coeficiente de difusión aparente y la anisotropía fraccional. Front Vet Sci. (2021) 7:614026. doi: 10.3389/fvets.2020.614026
Resumen de PubMed | Texto completo de CrossRef | Google Académico
32. Fages, J, Oura, T, Sutherland-Smith, J y Jennings, S. Los meningiomas intracraneales caninos atípicos y malignos pueden tener valores de coeficiente de difusión aparente más bajos que los tumores benignos. Ecografía Radiol Veterinaria. (2020) 61:40–7. doi: 10.1111/vru.12814
Resumen de PubMed | Texto completo de CrossRef | Google Académico
33. Scherf, G, Sutherland-Smith, J y Uriarte, A. Los perros y gatos con absceso intracraneal presunto o confirmado tienen valores bajos de coeficiente de difusión aparente. Ecografía Radiol Veterinaria. (2022) 63:197–200. doi: 10.1111/vru.13064
Resumen de PubMed | Texto completo de CrossRef | Google Académico
34. Carloni, A, Bernardini, M, Mattei, C, De Magistris, A, Llabres-Díaz, F, Williams, J, et al. ¿Puede la RMN diferenciar entre los gliomas con realce de anillo y los abscesos intraaxiales? Ecografía Radiol Veterinaria. (2022) 63:563–72. doi: 10.1111/vru.13098
Resumen de PubMed | Texto completo de CrossRef | Google Académico
35. Hartmann, A, Sager, S, Failing, K, Sparenberg, M y Schmidt, M. Imágenes ponderadas por difusión de los cerebros de perros con epilepsia idiopática. BMC Vet Res. (2017) 13:338. doi: 10.1186/s12917-017-1268-0
Resumen de PubMed | Texto completo de CrossRef | Google Académico
36. Sutherland-Smith, J, King, R, Faissler, D, Ruthazer, R y Sato, A. Coeficientes de difusión aparente de imágenes de resonancia magnética para lesiones intracraneales confirmadas histológicamente en perros. Ecografía Radiol Veterinaria. (2011) 52:142–8. doi: 10.1111/j.1740-8261.2010.01764.x
37. Anaya García, M, Hernández Anaya, J, Marrufo Meléndez, O, Velázquez Ramírez, J, y Palacios, AR. Estudio in vivo de la sustancia blanca cerebral en el perro mediante tractografía con tensor de difusión. Ecografía Radiol Veterinaria. (2015) 56:188–95. doi: 10.1111/vru.12211
38. Vite, C, Magnitsky, S, Alemán, D, O’Donnell, P, Cullen, K, Ding, W, et al. El coeficiente de difusión aparente revela la enfermedad de la sustancia gris y blanca, y el mapeo T2 detecta la enfermedad de la sustancia blanca en el cerebro en la alfa-manosidosis felina. Am J Neuroradiol. (2008) 29:308–13. DOI: 10.3174/ajnr. A0791
Resumen de PubMed | Texto completo de CrossRef | Google Académico
39. Reich, L, Hartnack, S, Fitzi-Rathgen, J, y Reichler, IM. Esperanza de vida de las razas de perros mesocéfalos, dolicocéfalos y braquicéfalos en Suiza. Schweiz Arch Tierheilkd. (2023) 165:235–11. doi: 10.17236/sat00390
Resumen de PubMed | Texto completo de CrossRef | Google Académico
40. O’Neill, DG, Pegram, C, Crocker, P, Brodbelt, DC, Church, DB y Packer, RMA. Desentrañar el estado de salud de los perros braquicéfalos en el Reino Unido mediante análisis multivariante. Sci Rep. (2020) 10:17251. doi: 10.1038/s41598-020-73088-y
Resumen de PubMed | Texto completo de CrossRef | Google Académico
41. Sasaki, M, Yamada, K, Watanabe, Y, Matsui, M, Ida, M, Fujiwara, S, et al. La variabilidad en los valores absolutos aparentes del coeficiente de difusión en diferentes plataformas puede ser sustancial: un estudio comparativo multiproveedor y multiinstitucional. Radiología. (2008) 249:624–30. doi: 10.1148/radiol.2492071681
42. Sen, P, y Basser, P. Un modelo para la difusión en la materia blanca en el cerebro. Biophys J. (2005) 89:2927–38. doi: 10.1529/biophysj.105.063016
Resumen de PubMed | Texto completo de CrossRef | Google Académico
43. Moraru, L, y Dimitrievici, L. Coeficiente de difusión aparente del cerebro humano normal para diversas condiciones experimentales. Actas de la conferencia AIP. Instituto Americano de Física Inc. (2017).
44. Naganawa, S, Sato, K, Katagiri, T, Mimura, T e Ishigaki, T. Valores regionales de ADC del cerebro normal: diferencias debidas a la edad, el sexo y la lateralidad. Eur Radiol. (2003) 13:6–11. doi: 10.1007/s00330-002-1549-1
Resumen de PubMed | Texto completo de CrossRef | Google Académico
45. Tan, Ü, y Caliskan, S. Alometría y asimetría en el cerebro del perro: el hemisferio derecho es más pesado sin preferencia de pata. Int J Neurosci. (1987) 35:189–94. doi: 10.3109/00207458708987127
Resumen de PubMed | Texto completo de CrossRef | Google Académico
46. Good, C, Johnsrude, I, Ashburner, J, Henson, R, Friston, K y Frackowiak, R. Asimetría cerebral y los efectos del sexo y la lateralidad en la estructura cerebral: un análisis morfométrico basado en vóxeles de 465 cerebros humanos adultos normales. Neuroimagen. (2001) 14:685–700. doi: 10.1006/nimg.2001.0857
Resumen de PubMed | Texto completo de CrossRef | Google Académico
47. Powell, J, Parkes, L, Kemp, G, Sluming, V, Barrick, T, y García-Fiñana, M. El efecto del sexo y la lateralidad en la anisotropía de la sustancia blanca: un estudio de imágenes de resonancia magnética con tensor de difusión. Neurociencia. (2012) 207:227–42. doi: 10.1016/j.neuroscience.2012.01.016
Resumen de PubMed | Texto completo de CrossRef | Google Académico
48. Aydinlioǧlu, A, Arslan, K, Cengiz, N, Raǧbetli, M, y Erdoǧan, E. Las relaciones del hipocampo canino con el sexo y la preferencia de las patas. Int J Neurosci. (2006) 116:77–88. doi: 10.1080/00207450690962433
Resumen de PubMed | Texto completo de CrossRef | Google Académico
49. Aydinlioǧlu, A, Arslan, K, Erdogan, A, Ragbetli, M, Keleh, P, y Diyarbakırlı, S. La relación de la anatomía de los calosos con la preferencia de las patas en los perros. Eur J Morphol. (2000) 38:128–33. doi: 10.1076/0924-3860(200004)38:2; 1-F; FT128
50. Hackert, R, Maes, L, Herbin, M, Libourel, P, y Abourachid, A. Preferencia de extremidades en el galope de los perros y la mitad atada de pikas en terreno plano. Lateralidad. (2008) 13:310–9. doi: 10.1080/13576500801948692
51. Watanabe, M, Sakai, O, Ozonoff, A, Kussman, S y Jara, H. Cambios aparentes en el coeficiente de difusión relacionados con la edad en el cerebro normal. Radiología. (2013) 266:575–82. doi: 10.1148/radiol.12112420
Resumen de PubMed | Texto completo de CrossRef | Google Académico
52. Gross, B, García-Tapia, D, Riedesel, E, Ellinwood, N y Jens, J. Maduración normal del cerebro canino en imágenes de resonancia magnética. Ecografía Radiol Veterinaria. (2010) 51:361–73. doi: 10.1111/j.1740-8261.2010.01681.x
Resumen de PubMed | Texto completo de CrossRef | Google Académico
53. Chatzikonstantinou, A, Gass, A, Förster, A, Hennerici, M y Szabo, K. Características de las anomalías agudas de DWI relacionadas con el estado epiléptico. Epilepsia Res. (2011) 97:45–51. doi: 10.1016/j.eplepsyres.2011.07.002
Resumen de PubMed | Texto completo de CrossRef | Google Académico
54. Hasegawa, D, Orima, H, Fujita, M, Nakamura, S, Takahashi, K, Ohkubo, S, et al. Imágenes ponderadas por difusión en el estado epiléptico parcial complejo inducido por ácido kaínico en perros. Res. Cerebral (2003) 983:115–27. doi: 10.1016/S0006-8993(03)03041-5
Resumen de PubMed | Texto completo de CrossRef | Google Académico
55. Hasegawa, Y, Latour, L, Sotak, H, Dardzinski, B, y Fisher, M. Cambio dependiente de la temperatura del coeficiente de difusión aparente del agua en el cerebro normal e isquémico de ratas. J Cereb Flujo sanguíneo Metab. (1994) 14:383–90. doi: 10.1038/jcbfm.1994.49
56. Bertalan, G, Boehm-Sturm, P, Schreyer, S, Morr, A, Steiner, B, Tzschätzsch, H, et al. La influencia de la temperatura corporal en la rigidez de los tejidos, la perfusión sanguínea y la difusión de agua en el cerebro del ratón. Acta Biomater. (2019) 96:412–20. doi: 10.1016/j.actbio.2019.06.034
57. Abe, Y, Tsurugizawa, T, y Le Bihan, D. La difusión del agua revela de cerca el estado de la actividad neuronal en loci cerebrales de ratas afectados por la anestesia. PLoS Biol. (2017) 15:e2001494. doi: 10.1371/journal.pbio.2001494
Resumen de PubMed | Texto completo de CrossRef | Google Académico
58. Smith, E, Schneider, J, Wardlaw, J y Greenberg, S. Microinfartos cerebrales: las lesiones invisibles. Lancet Neurol. (2012) 11:272–82. doi: 10.1016/S1474-4422(11)70307-6
Resumen de PubMed | Texto completo de CrossRef | Google Académico
59. Shenton, M, Hamoda, H, Schneiderman, J, Bouix, S, Pasternak, O, Rathi, Y, et al. Una revisión de los hallazgos de las imágenes por resonancia magnética y las imágenes de tensor de difusión en lesiones cerebrales traumáticas leves. Las imágenes cerebrales se comportan. (2012) 6:137–92. doi: 10.1007/s11682-012-9156-5
Resumen de PubMed | Texto completo de CrossRef | Google Académico
Palabras clave: resonancia magnética, canino, resonancia magnética, coeficiente de difusión aparente, ADC, DWI, neuroimagen
Cita: Carisch L, Lindt B, Richter H y Del Chicca F (2023) Valores regionales de ADC del cerebro canino morfológicamente normal. Frente. Vet. Sci. 10:1219943. doi: 10.3389/fvets.2023.1219943
Recibido: 09 de mayo de 2023; Aceptado: 16 de octubre de 2023;
Publicado: 08 Noviembre 2023.
Editado por:
Philippa Johnson, Universidad de Cornell, Estados Unidos
Revisado por:
Erica Andrews, Universidad de Cornell, Estados
Unidos Yoshihiko Yu, Investigadora independiente, Mitaka, Japón
Derechos de autor © 2023 Carisch, Lindt, Richter y Del Chicca. Este es un artículo de acceso abierto distribuido bajo los términos de la Licencia Creative Commons Attribution License (CC BY).
*Correspondencia: Lea Carisch, lea.carisch@uzh.ch
Renuncia: Todas las afirmaciones expresadas en este artículo son únicamente las de los autores y no representan necesariamente las de sus organizaciones afiliadas, ni las del editor, los editores y los revisores. Cualquier producto que pueda ser evaluado en este artículo o afirmación que pueda hacer su fabricante no está garantizado ni respaldado por el editor.
Date de alta y recibe nuestro 👉🏼 Diario Digital AXÓN INFORMAVET ONE HEALTH
Date de alta y recibe nuestro 👉🏼 Boletín Digital de Foro Agro Ganadero
Noticias animales de compañía
Noticias animales de producción
Trabajos técnicos animales de producción
Trabajos técnicos animales de compañía