La patogenicidad de Salmonella isla-14 es un factor crítico de virulencia responsable de la infección sistémica en pollos
La patogenicidad de Salmonella isla-14 es un factor crítico de virulencia responsable de la infección sistémica en pollos causada por Salmonella gallinarum
 Zuo Hu1†
Zuo Hu1†  Shinjiro Ojima1,2†
Shinjiro Ojima1,2†  Zhihao Zhu1
Zhihao Zhu1  Xiaoying Yu1,3
Xiaoying Yu1,3  Makoto Sugiyama4
Makoto Sugiyama4  Takeshi Haneda5
Takeshi Haneda5  Masashi Okamura6
Masashi Okamura6  Hisaya K. Ono1
Hisaya K. Ono1  Dong-Liang Hu1*
Dong-Liang Hu1*- 1Departamento de Zoonosis, Facultad de Medicina Veterinaria de la Universidad de Kitasato, Towada, Japón
- 2Centro de Investigación para el Desarrollo de Medicamentos y Vacunas, Instituto Nacional de Enfermedades Infecciosas, Tokio, Japón
- 3Facultad de Medicina Veterinaria, Universidad del Suroeste, Chongqing, China
- 4Laboratorio de Anatomía Veterinaria, Facultad de Medicina Veterinaria de la Universidad de Kitasato, Towada, Japón
- 5Laboratorio de Microbiología, Facultad de Farmacia de la Universidad de Kitasato, Tokio, Japón
- 6Sección de Ciencias Veterinarias Aplicadas, División de Ciencias Veterinarias, Departamento de Medicina Veterinaria, Universidad de Agricultura y Medicina Veterinaria de Obihiro, Obihiro, Japón
Salmonella enterica serovar Gallinarum (S. gallinarum) es un importante patógeno específico del huésped que causa la fiebre tifoidea aviar, una infección sistémica, septicémica y mortal grave, en los pollos. S. gallinarum causa una alta morbilidad y mortalidad en los pollos y representa una carga significativa y pérdidas económicas para la industria avícola en muchos países en desarrollo. Sin embargo, los factores de virulencia y los mecanismos de la infección sistémica inducida por S. gallinarum en pollos siguen siendo poco conocidos. En este estudio, construimos una cepa mutante de Salmonella isla-14 (SPI-14) (mSPI-14) de S. gallinarum y evaluamos la patogenicidad de mSPI-14 en el modelo de infección sistémica de pollo. El mSPI-14 exhibió el mismo nivel de crecimiento bacteriano y características morfológicas, pero redujo significativamente la resistencia a los ácidos biliares en comparación con la cepa de tipo salvaje (WT) in vitro. La virulencia de mSPI-14 se atenuó significativamente en el modelo de infección oral de pollo in vivo. Los pollos infectados con WT mostraron síntomas clínicos típicos de fiebre tifoidea aviar, y todas las aves sucumbieron a la infección dentro de los 6 a 9 días posteriores a la inoculación, y se observaron aumentos sustanciales en los recuentos bacterianos y cambios patológicos significativos en el hígado y el bazo. Por el contrario, todos los pollos infectados con mSPI-14 sobrevivieron, los recuentos bacterianos en los órganos fueron significativamente más bajos y no se observaron cambios patológicos significativos en el hígado y el bazo. La expresión de interleucina (IL)-1β, IL-12, CXCLi1, factor de necrosis tumoral (TNF)-α e interferón (IFN)-γ en el hígado de los pollos infectados con mSPI-14 fue significativamente menor que la de los pollos infectados con WT. Estos resultados indican que SPI-14 es un factor de virulencia crucial en la infección sistémica de pollos, y la mSPI-14 avirulenta podría usarse para desarrollar una nueva vacuna viva atenuada para prevenir la infección por S. gallinarum en pollos.
1 Introducción
Salmonella enterica abarca un grupo diverso de serovares, cada uno con adaptaciones amplias o específicas a diferentes huéspedes. Entre ellos, S. enteritidis y S. typhimurium, que han sido ampliamente estudiados en infecciones humanas y animales, son patógenos importantes con una amplia gama de huéspedes que causan diarrea autolimitada en mamíferos. S. gallinarum es un serovar específico del huésped que causa enfermedades infecciosas sistémicas graves llamadas fiebre tifoidea aviar en pollos (1, 2). S. gallinarum puede invadir el hígado, el bazo y otros órganos, causando infecciones sistémicas con síntomas como letargo y alta mortalidad y causando enormes pérdidas económicas a la industria avícola, especialmente en muchos países en desarrollo (3-5). Sin embargo, se sabe poco sobre los factores de virulencia y los mecanismos de S. gallinarum que inducen infecciones sistémicas en pollos (6, 7). Es crucial y necesario investigar los factores de virulencia de S. gallinarum y el mecanismo de las interacciones patógeno-huésped para desarrollar medidas de control efectivas y prevenir la aparición y propagación de la fiebre tifoidea aviar en pollos.
Las islas de patogenicidad de Salmonella (SPI) son regiones genéticas específicas que se encuentran en el genoma de bacterias pertenecientes al género Salmonella. Estudios previos han demostrado que existen múltiples SPIs identificados en diferentes serotipos de Salmonella, y cada SPI está asociado con funciones específicas relacionadas con el proceso patogénico, desempeñando especialmente un papel crucial en la capacidad de causar enfermedades infecciosas gastrointestinales (8, 9). SPI contiene grupos de genes que típicamente codifican factores de virulencia, como sistemas de secreción invasores y elementos que contribuyen a la capacidad de las bacterias para evadir el sistema inmunológico del huésped y sobrevivir dentro de las células del huésped (7, 9). Diferentes serovares de Salmonella pueden poseer distintos SPI que reflejan su adaptación a huéspedes específicos o nichos ambientales. S. enteritidis y S. typhimurium tienen una amplia gama de huéspedes y pueden sobrevivir en el ambiente ácido del estómago (6, 7, 10). Una vez que las bacterias llegan al tracto intestinal, ingresan a las células intestinales a través del sistema de secreción tipo III (T3SS) codificado por SPI-1 y posteriormente invaden las células intestinales, causando inflamación intestinal y promoviendo el crecimiento de bacterias en el intestino (11-13). Estudios recientes han informado que SPI-14 codifica un nuevo factor regulador llamado factor A bajo inducido por oxígeno (LoiA). Cuando S. typhimurium se expone a un ambiente hipóxico en el tracto intestinal, LoiA se une directamente al promotor y activa la transcripción de hilD, lo que conduce a la activación del activador maestro hilA, lo que sugiere que SPI-14 podría ser un regulador de SPI-1 que es un importante factor regulador de la virulencia en las infecciones gastrointestinales causadas por S. typhimurium y S. enteritidis (7, 14-16).
Aunque las funciones de los SPI en una amplia gama de Enterobacteriaceae del huésped y su papel en la gastroenteritis de los mamíferos han sido bien estudiadas, la patogenicidad de los SPI en S. El Gallimarum, que causa infecciones sistémicas en los pollos, sigue sin estar claro. S. gallinarum no causa inflamación significativa en el tracto intestinal de los pollos, pero es más probable que cause enfermedades infecciosas sistémicas graves que otros serotipos de Salmonella con rangos de huéspedes más amplios (2, 17). Recientemente, los análisis epidemiológicos moleculares y genéticos demostraron que los genes de SPI-13, SPI-14 y el gen inducible por macrófagos mig-14 estaban específicamente regulados al alza en el serovar específico de aves, S. gallinarum, y los estudios adicionales sobre el papel de estos genes en la infección específica del huésped están altamente indicados (6, 7). Para arrojar algo de luz sobre el mecanismo patogénico y dilucidar los factores de virulencia de la infección sistémica inducida por S. gallinarum en pollos, en este estudio, creamos una cepa mutante, mSPI-14, con genes SG0835 y SG0836 delecionados que están codificados en el SPI-14 de S. gallinarum, y estudiamos la función biológica y los roles patogénicos de SPI-14 en la infección sistémica de pollos utilizando nuestro modelo de inoculación oral de pollos recientemente establecido (5). Nuestros resultados demuestran por primera vez que el mutante mSPI-14 ha reducido la resistencia a las sales biliares in vitro, y la virulencia se atenuó significativamente en pollos infectados oralmente in vivo, lo que indica que SPI-14 es un factor de virulencia importante en la infección sistémica de pollos, y el mSPI-14 resultante puede usarse como una cepa de vacuna viva atenuada para prevenir la fiebre tifoidea aviar causada por S. gallinarum.
2 Materiales y métodos
2.1 Cepas bacterianas, plásmidos y condiciones de cultivo
Se utilizó Salmonella enterica serovar Gallinarum biovar Gallinarum (S. gallinarum) NCTC13346 cepa (SG287/91) como cepa parental (WT) de la cepa con deficiencia genética. Se utilizaron pCP20, pKD3 y pKD46 para crear una cepa que carecía de los genes SPI-14 (SG0835-0836). pCP20 es un plásmido sensible a la temperatura, y la enzima de recombinación genética codificada por pCP20 reconoce las secuencias de diana de reconocimiento de flippasa (FRT) localizadas en ambos extremos del casete de resistencia al cloranfenicol de pKD3 y elimina el casete de resistencia al cloranfenicol que ha sustituido al gen diana (13). El WT y el mSPI-14 se colocaron en placas de agar Luria-Bertani (LB) (Eiken Chemical, Tokio, Japón) utilizando un bucle de platino, se cultivaron durante la noche a 37 °C, y la colonia única resultante se inoculó en caldo LB (Eiken Chemical) y se cultivó a 37 °C con agitación a 150 rpm para preparar una suspensión bacteriana para los próximos experimentos.
2.2 Construcción de la cepa mutante SPI-14 (mSPI-14) de Salmonella gallinarum
SPI-14 contiene los genes de SG0834-0839, entre los cuales 0835 y 0836-0838 son genes con funciones distintas (Figura 1A). Por lo tanto, los genes SG0835 y SG0836 contenidos en SPI-14 se eliminaron de la cepa WT parental de acuerdo con los métodos descritos anteriormente (18, 19). En resumen, se utilizaron los cebadores de PCR, SG0835-0836F-1 (TATTGAATTATCAGATGCTCCATTCAAATGAGAGACGA GAGTAGGCTGGAGCTGCTCTCTTCTT) y SG0835-0836R-1 (GTTATGTTCAGCAATAACTAAA GAAGCCATATTTTCCTCCCATCATGAATATCCTCCTTAG), para amplificar el casete de resistencia al cloranfenicol, y la región SG0835-0836 se reemplazó por recombinación homóloga. Para eliminar el casete de resistencia al cloranfenicol (Cm) que reemplazó a SG0835-0836 en el genoma, pCP20 se transformó en las células competentes de la cepa SG0835-0836::Cm en cubeta perforada (0.1 cm de espacio) utilizando Gene Pulser® II y electroporación (1.8 kV, 25 μF, 200 Ω). Las colonias transformadas se esparcieron en placas de agar LB y se cultivaron a 42°C durante la noche para eliminar Cm y desprender pCP20 para obtener SGΔ0835-0836. La remoción de CM se confirmó mediante PCR de colonias utilizando los cebadores SG0835-0836F-2 (TAGCATCGGTCATCAGGCACAAG) y SG0835-0836R-2 (TTTTCACCA TGGGCAAATAT), que recocieron las regiones flanqueantes a 500 pb de distancia de SG0835-0836. La cepa SGΔ0835-0836 construida se denominó mutante mSPI-14.
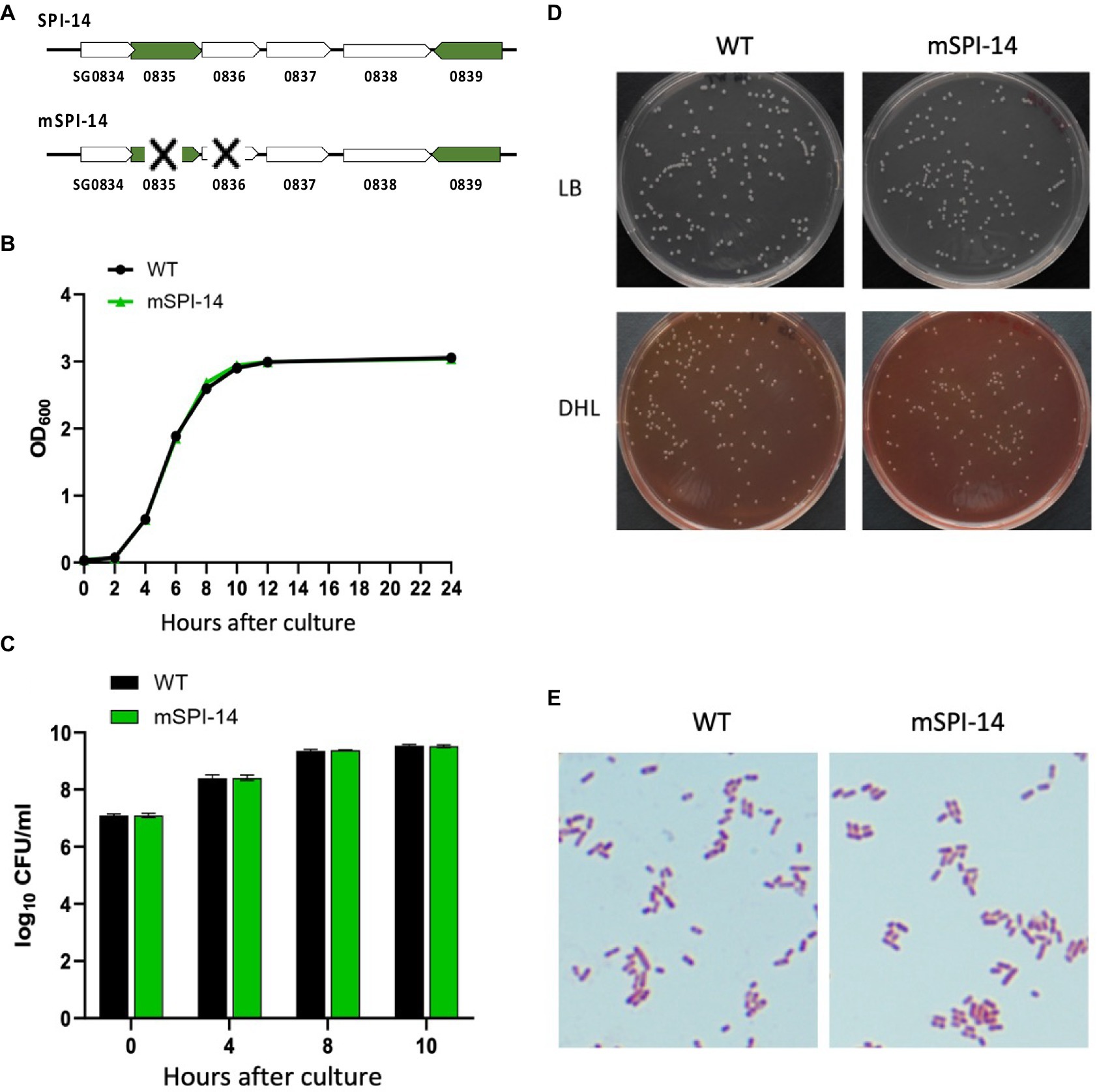 Figura 1. Características de Salmonella gallinarum (WT) y mSPI-14. (A) Estructura génica de SPI-14 y mSPI-14. (B) Curvas de crecimiento de WT y mSPI-14 en caldo LB. Las bacterias cultivadas en caldo LB durante 14 h se diluyeron a OD600 = 1,5, inoculado 1/100 en el caldo LB y cultivado a 37°C con agitación (150 rpm). La densidad óptica (OD600 nm) se midió a las 0, 2, 4, 6, 8, 10, 12 y 24 h después de la inoculación. (C) Recuentos bacterianos de WT y mSPI-14 en caldo LB. Las bacterias se cultivaron como se describió anteriormente, y 100 μL de cada cultivo en los puntos de tiempo indicados se diluyeron en serie en caldo LB y se esparcieron en una placa de agar LB. Después de incubar durante la noche a 37 °C, las colonias en la placa se contaron como unidades formadoras de colonias (UFC). (D) Morfología de las colonias generadas en medio de placa de agar LB y DHL. (E) Características morfológicas y de tinción de las bacterias teñidas con Gram.
Figura 1. Características de Salmonella gallinarum (WT) y mSPI-14. (A) Estructura génica de SPI-14 y mSPI-14. (B) Curvas de crecimiento de WT y mSPI-14 en caldo LB. Las bacterias cultivadas en caldo LB durante 14 h se diluyeron a OD600 = 1,5, inoculado 1/100 en el caldo LB y cultivado a 37°C con agitación (150 rpm). La densidad óptica (OD600 nm) se midió a las 0, 2, 4, 6, 8, 10, 12 y 24 h después de la inoculación. (C) Recuentos bacterianos de WT y mSPI-14 en caldo LB. Las bacterias se cultivaron como se describió anteriormente, y 100 μL de cada cultivo en los puntos de tiempo indicados se diluyeron en serie en caldo LB y se esparcieron en una placa de agar LB. Después de incubar durante la noche a 37 °C, las colonias en la placa se contaron como unidades formadoras de colonias (UFC). (D) Morfología de las colonias generadas en medio de placa de agar LB y DHL. (E) Características morfológicas y de tinción de las bacterias teñidas con Gram.
2.3 Comparación de las propiedades de crecimiento de WT y mSPI-14 in vitro
Para comparar las características de crecimiento de WT y mSPI-14 in vitro, cada cepa se cultivó en caldo LB a 37°C con agitación a 150 rpm durante 14 h. El cultivo bacteriano cultivado se diluyó con caldo LB a una densidad óptica (OD600 nm) = 1,5, y se inocularon 100 μL de la suspensión diluida en 10 mL de caldo LB, cultivado a 37 °C con agitación a 150 rpm, y la absorbancia (OD600 nm) de las suspensiones de cultivo se midieron a las 2, 4, 6, 8, 10, 12 y 24 h después de la incubación. Por otro lado, el número de bacterias en las suspensiones de cultivo se contó aplicando cultivo bacteriano en agar LB y placa de agar DHL, que se incubaron a 37°C durante la noche. Las colonias en las placas se contaron como unidades formadoras de colonias (UFC). Para comparar la morfología de la colonia y la forma celular de la WT y mSPI-14, esparcimos líquidos bacterianos WT y mSPI-14 en placas de agar LB, incubamos a 37°C durante 18 a 24 h, y observamos la morfología de la colonia. La tinción de Gram se realizó en frotis frescos de una sola colonia de cada cepa, y se observó la forma de las células bajo un microscopio. Para investigar si la capacidad de crecimiento cambia entre WT y mSPI-14 en diferentes condiciones de cultivo, observamos crecimiento bacteriano en caldo LB que contenía ácidos biliares (la concentración final fue de 0,01 o 0,02 mM, Sigma-Aldrich), peróxido de hidrógeno (concentración final de 0,5 o 1,0 mM, Wako, Osaka, Japón) o ácido nalidíxico (concentración final de 1,25 o 2,5 μg/mL, Wako) en placas de fondo plano de 96 pocillos (Greiner BioOne, Kremsmünster, Austria), respectivamente (19). Las placas se incubaron a 37°C sin agitar, y el crecimiento bacteriano en los momentos indicados se determinó mediante el monitoreo de la densidad óptica (OD600 nm) utilizando un lector de placas de 96 pocillos (Bio-Rad, lector de microplacas modelo 680, Hercules, CA, Estados Unidos).
2.4 Pollos y experimento oral con infección
Los experimentos de infección de pollos se llevaron a cabo de acuerdo con las regulaciones para experimentos con animales especificadas en la Ley de Bienestar Animal y la Guía para el Cuidado y Uso de Animales de Laboratorio. El protocolo de experimentación animal fue revisado y aprobado por el Comité de Cuidado de Animales de la Universidad de Kitasato (números de aprobación: 20-055 y 21-039). Se alojaron gallinas marrones Boris (de 20 días de edad) a las que se les proporcionó agua y comida ad libitum. Para confirmar la ausencia de Salmonella en el lote, se recolectaron hisopos fecales de jaulas de cría y se realizó la detección bacteriológica de Salmonella antes de la infección experimental (5, 20). Cada pollo fue inoculado por vía oral con 108 Cepa CFU WT o mSPI-14 en un volumen de 1,0 mL por sonda nasogástrica oral (el número de pollos en cada grupo es 5). Los pollos fueron alojados y mantenidos durante 14 días, y cualquier signo clínico se observó y registró dos veces al día para su monitoreo. El experimento anterior se repitió dos veces. Se hizo todo lo posible para reducir el sufrimiento de los animales durante los experimentos. Estos experimentos de infección se realizaron al mismo tiempo utilizando las cepas WT y mSPI-14, así como otras dos cepas mutantes (wecB::Cm y trxB::Cm) que no se mostraron en este artículo.
2.5 Aislamiento y enumeración de Salmonella en órganos de pollo después de la infección
Los pollos fueron inoculados por vía oral con 108 UFC de WT o mSPI-14 o con 1,0 mL de PBS como control no infectado utilizando el método descrito anteriormente. Los pollos fueron sacrificados en los días 1, 3, 5 y 7 después de la infección. Se recolectaron muestras de hígado y bazo de forma aséptica de 3 a 5 pollos de cada grupo en cada momento. Luego, las muestras de órganos se diluyeron 10 veces con PBS para hacer homogeneizados, se diluyeron en serie 10 veces con PBS y se colocaron en placas de agar LB. Después de la incubación a 37°C durante 24 h, se determinó el número de colonias en las placas y se calculó como UFC/g de órgano.
2.6 Cambios clínicos y examen histopatológico
Se observaron, registraron y evaluaron los cambios clínicos, incluido el enrojecimiento y la decoloración de la cresta y las plumas erizadas, de los pollos inoculados con WT, mSPI-14 o PBS para detectar la aparición de infección sistémica. Se investigó el grado de inflamación del hígado y el bazo de 3 a 4 pollos de cada grupo a los 1, 3, 5 y 7 días después de la inoculación mediante la observación de hinchazón, congestión, sangrado, enrojecimiento y decoloración de los tejidos. Para evaluar los cambios histológicos y los niveles de inflamación, los hígados y bazos de cada grupo se fijaron en paraformaldehído al 4% (pH 7,4) a 4 °C durante 24 h y se incluyeron en parafina. Las secciones se cortaron en tres niveles con un espesor de 4 μm y se tiñeron con tinción con hematoxilina-eosina (HE). Los cambios histológicos, como la infiltración de células inflamatorias y el daño tisular, fueron registrados y fotografiados.
2.7 Expresión de citoquinas y quimiocinas
Se extrajo ARN de los hígados de pollos infectados con la cepa WT o mSPI-14 y el control de PBS en los días 3 y 5 después de la infección, y los niveles de expresión de citoquinas inflamatorias y quimiocinas se midieron mediante PCR en tiempo real de acuerdo con nuestros métodos informados anteriormente (17, 19). Se utilizó GAPDH como control endógeno y se utilizaron IL-1β, IL-6, TNF-α, IL-12, IFN-γ y CXCLi1 como genes diana. La expresión de los genes se determinó utilizando el valor del ciclo umbral (ct) en relación con el del gen de mantenimiento GAPDH, y los resultados se expresaron como cambios en el pliegue del gen diana corregido en los pollos infectados en relación con los controles no infectados.
2.8 Análisis estadístico
Los recuentos bacterianos se expresaron en logaritmos, y las diferencias significativas en los recuentos bacterianos o los valores de OD entre el valor promedio de WT y mSPI-14 en cada punto de tiempo se probaron mediante la prueba t de Student. En el análisis de los niveles de expresión de citocinas, se probaron diferencias significativas entre los tres grupos en los niveles de expresión del grupo inoculado con WT, el grupo inoculado con mSPI-14 y el grupo control no infectado (PBS) en cada día de muestreo después de la inoculación mediante un análisis de ANOVA de una vía seguido de la prueba de comparación múltiple de Tukey. El análisis estadístico se realizó con el programa GraphPad Prism 9.3.0 (GraphPad Software, San Diego, CA, Estados Unidos) y se determinó una diferencia significativa cuando los valores de p fueron < 0,05.
3 Resultados
3.1 Características de la Salmonella gallinarum deficiente en SPI-14 (mSPI-14)
En primer lugar, comparamos las características de crecimiento bacteriano de las cepas WT y mSPI-14. El cultivo bacteriano con el OD600 el valor de la cepa WT o mSPI-14 se inoculó en medio líquido LB y se cultivó con agitación a 37°C durante 24 h; no se observaron diferencias significativas en el DO600 y el número de bacterias viables entre las cepas WT y mSPI-14 (Figuras 1B, C). No hubo diferencias significativas en el tamaño y la morfología de las colonias entre las cepas WT y mSPI-14 al observar las colonias generadas en el medio de placa de agar LB y agar DHL (Figura 1D). También comparamos las formas de los cuerpos bacterianos teñidos con Gram; no se observó ninguna anomalía en la forma de la cepa mSPI-14, y no se observaron diferencias significativas en la morfología entre las cepas WT y mSPI-14 (Figura 1E).
3.2 Resistencia de WT y mSPI-14 a ácidos biliares y peróxido de hidrógeno
Dado que se sabe que el tipo silvestre de S. gallinarum es resistente a los ácidos biliares y sensible al peróxido de hidrógeno (H2O2) y ácido nalidíxico, evaluamos los efectos de la deleción del gen SPI-14 sobre la resistencia a los ácidos biliares y la sensibilidad a H2O2 y ácido nalidíxico. En el caldo LB con diferentes concentraciones de ácido biliar, el mutante mSPI-14 mostró valores de OD significativamente reducidos a partir de 4 h después de la exposición a las concentraciones de 0,01 o 0,02 mM de ácido biliar, lo que indica que mSPI-1 es más sensible al ácido biliar que la cepa WT (p < 0,01, Figura 2A). Para examinar si el SPI-14 también es relevante para la resistencia a los antibióticos, se analizó el crecimiento de las cepas mSPI-14 y WT en caldo LB suplementado con diferentes concentraciones de ácido nalidíxico. Hubo valores similares de DO a 1,25 μg/mL de ácido nalidíxico y no hubo diferencias significativas en el crecimiento entre las cepas mSPI-14 y WT. Además, tanto las cepas mSPI-14 como WT anularon el crecimiento cuando se añadió la concentración de 2,5 μg/mL al medio (Figura 2B). Además, la mSPI-14 mostró un crecimiento comparable al de la cepa WT después de la exposición al caldo LB con 0,5 y 1,0 mM H2O2 (Figura 2C).
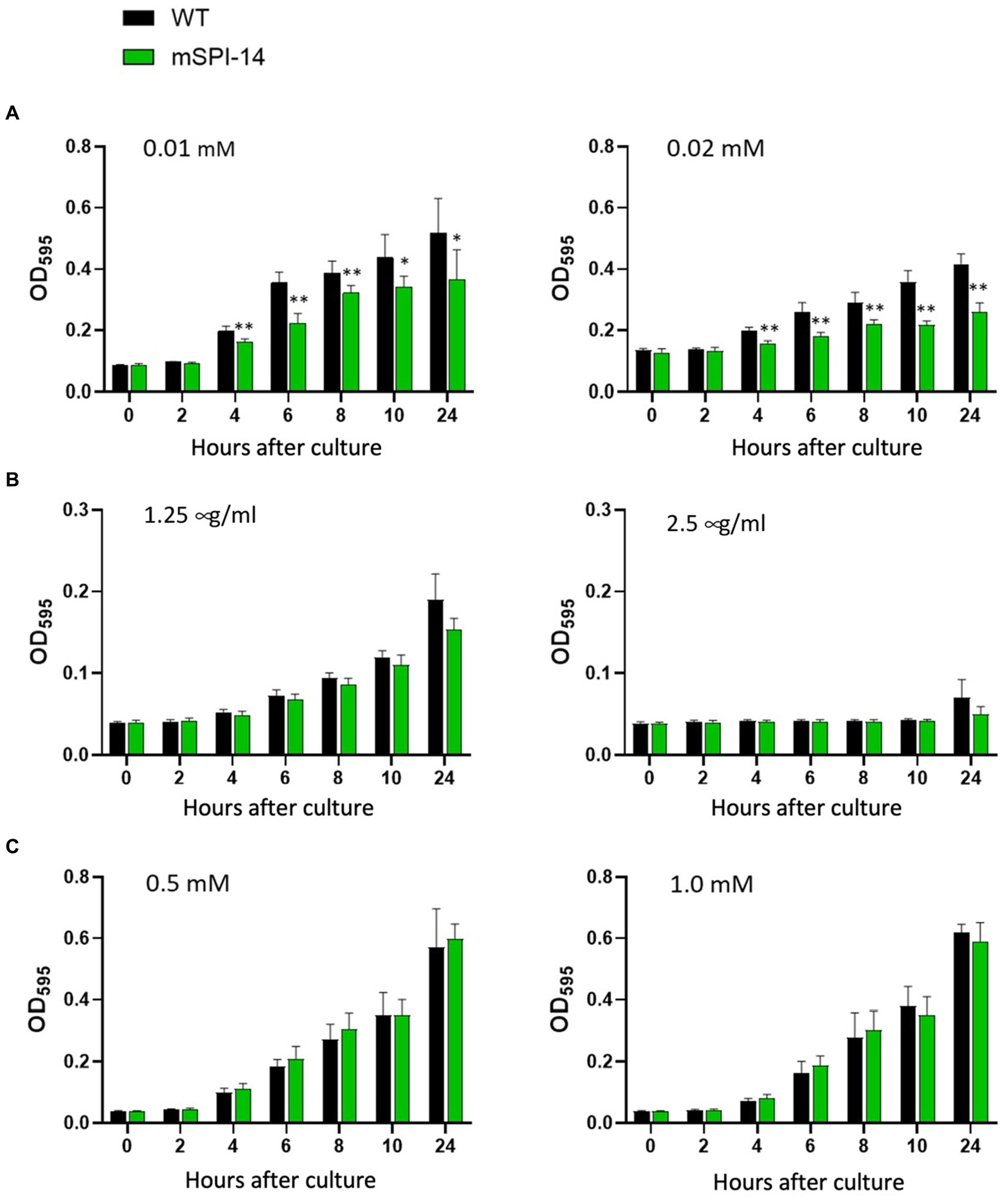 Figura 2. Comparación de las características de crecimiento bacteriano entre mSPI-14 y WT en caldo LB que contiene ácido biliar (A), ácido nalidíxico (B) o peróxido de hidrógeno (C). Las bacterias se cultivaron en caldo LB durante 14 h y luego se diluyeron a 2.0 × 107 UFC/ml. El cultivo bacteriano diluido se mezcló con cada reactivo (50:50) en placas de fondo plano de 96 pocillos y se incubó a 37 °C sin agitar. La densidad óptica (OD600 nm) se midió a las 0, 2, 4, 6, 8, 10 y 24 h después de la inoculación. Los datos son medias ± desviaciones estándar basadas en cinco pocillos por grupo en cada punto de tiempo. La diferencia significativa se mostró como *p < 0,05, **p < 0,01.
Figura 2. Comparación de las características de crecimiento bacteriano entre mSPI-14 y WT en caldo LB que contiene ácido biliar (A), ácido nalidíxico (B) o peróxido de hidrógeno (C). Las bacterias se cultivaron en caldo LB durante 14 h y luego se diluyeron a 2.0 × 107 UFC/ml. El cultivo bacteriano diluido se mezcló con cada reactivo (50:50) en placas de fondo plano de 96 pocillos y se incubó a 37 °C sin agitar. La densidad óptica (OD600 nm) se midió a las 0, 2, 4, 6, 8, 10 y 24 h después de la inoculación. Los datos son medias ± desviaciones estándar basadas en cinco pocillos por grupo en cada punto de tiempo. La diferencia significativa se mostró como *p < 0,05, **p < 0,01.
3.3 Papel patogénico de SPI-14 en un pollo infectado in vivo
Para investigar el papel patogénico de SPI-14 en la infección sistémica de pollos inducida por S. gallinarum in vivo, analizamos los cambios clínicos y la mortalidad en pollos infectados oralmente con la cepa mSPI-14 o WT. Los pollos infectados con 108 Las UFC de WT mostraron una alteración significativa o depresión, que son los síntomas clínicos típicos de la fiebre tifoidea aviar, y todos los pollos infectados con WT murieron a los 9 días después de la infección (Figura 3A). Por el contrario, los pollos infectados con mSPI-14 a la misma dosis que la cepa WT no mostraron cambios clínicos significativos, y todos los pollos sobrevivieron hasta el final del período de observación.
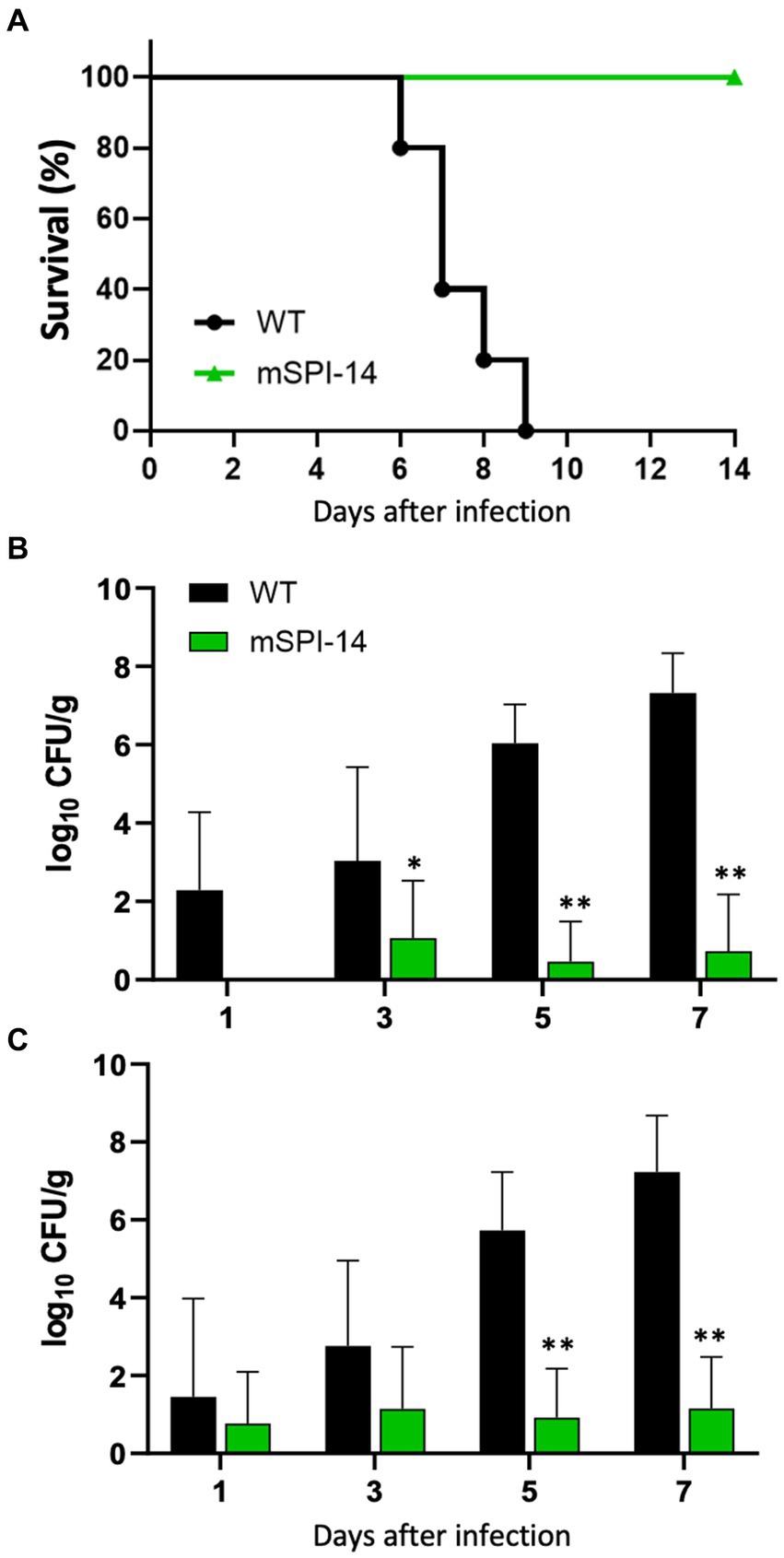 Figura 3. Hallazgos patológicos en pollos infectados oralmente con WT y mSPI-14. (A) Curva de supervivencia de pollos inoculados oralmente con WT o mSPI-14. Los pollos fueron inoculados por vía oral con 108 UFC de WT o mSPI-14, y la supervivencia de los pollos se registró durante 14 días después de la infección. (B,C) Recuentos bacterianos viables en los órganos de pollos inoculados oralmente con WT o mSPI-14. Los pollos fueron inoculados por vía oral con 108 UFC de WT o mSPI-14. Las bacterias en el hígado (B) y el bazo (C) se determinaron a los 1, 3, 5 y 7 días posteriores a la infección. Los datos son medias ± desviaciones estándar basadas en tres a cinco pollos por grupo en cada punto de tiempo. Las diferencias significativas se mostraron como *p < 0,05, **p < 0,01.
Figura 3. Hallazgos patológicos en pollos infectados oralmente con WT y mSPI-14. (A) Curva de supervivencia de pollos inoculados oralmente con WT o mSPI-14. Los pollos fueron inoculados por vía oral con 108 UFC de WT o mSPI-14, y la supervivencia de los pollos se registró durante 14 días después de la infección. (B,C) Recuentos bacterianos viables en los órganos de pollos inoculados oralmente con WT o mSPI-14. Los pollos fueron inoculados por vía oral con 108 UFC de WT o mSPI-14. Las bacterias en el hígado (B) y el bazo (C) se determinaron a los 1, 3, 5 y 7 días posteriores a la infección. Los datos son medias ± desviaciones estándar basadas en tres a cinco pollos por grupo en cada punto de tiempo. Las diferencias significativas se mostraron como *p < 0,05, **p < 0,01.
3.4 Colonización bacteriana en los pollos infectados
Para analizar la propagación y colonización de WT y mSPI-14 en los pollos infectados, contamos y comparamos el número de bacterias viables en los órganos de los pollos infectados. Las cargas bacterianas en el hígado y el bazo de los pollos infectados con WT se detectaron de 1 a 7 días después de la infección oral. El número de bacterias viables en el hígado de los pollos inoculados con WT continuó aumentando, y los números de 1,96 × 102, 1.08 × 103, 1.09 × 106y 2.09 × 107 Las UFC/g se detectaron en los días 1, 3, 5 y 7 después de la inoculación, respectivamente (Figura 3B). Por otro lado, el número de bacterias en los hígados de los pollos infectados con mSPI-14 fue de 1,15 × 10 UFC/g, de 0,29 × 10 UFC/g y de 0,53 × 10 en los días 3, 5 y 7 después de la inoculación, que fue significativamente menor que el de los pollos infectados con WT. Al igual que en el hígado, el número de bacterias en el bazo de los pollos inoculados con WT aumentó significativamente y se detectaron como 2,85 × 10, 5,75 × 102, 5.41 × 105, 1,7 × 107 UFC/g del día 1 al 7 después de la inoculación (Figura 3C). Los recuentos de bacterias en el bazo de los pollos infectados con mSPI-14 también fueron significativamente más bajos que los de los pollos infectados con WT (p < 0,01).
3.5 Hallazgos macroscópicos y cambios patológicos en los pollos infectados
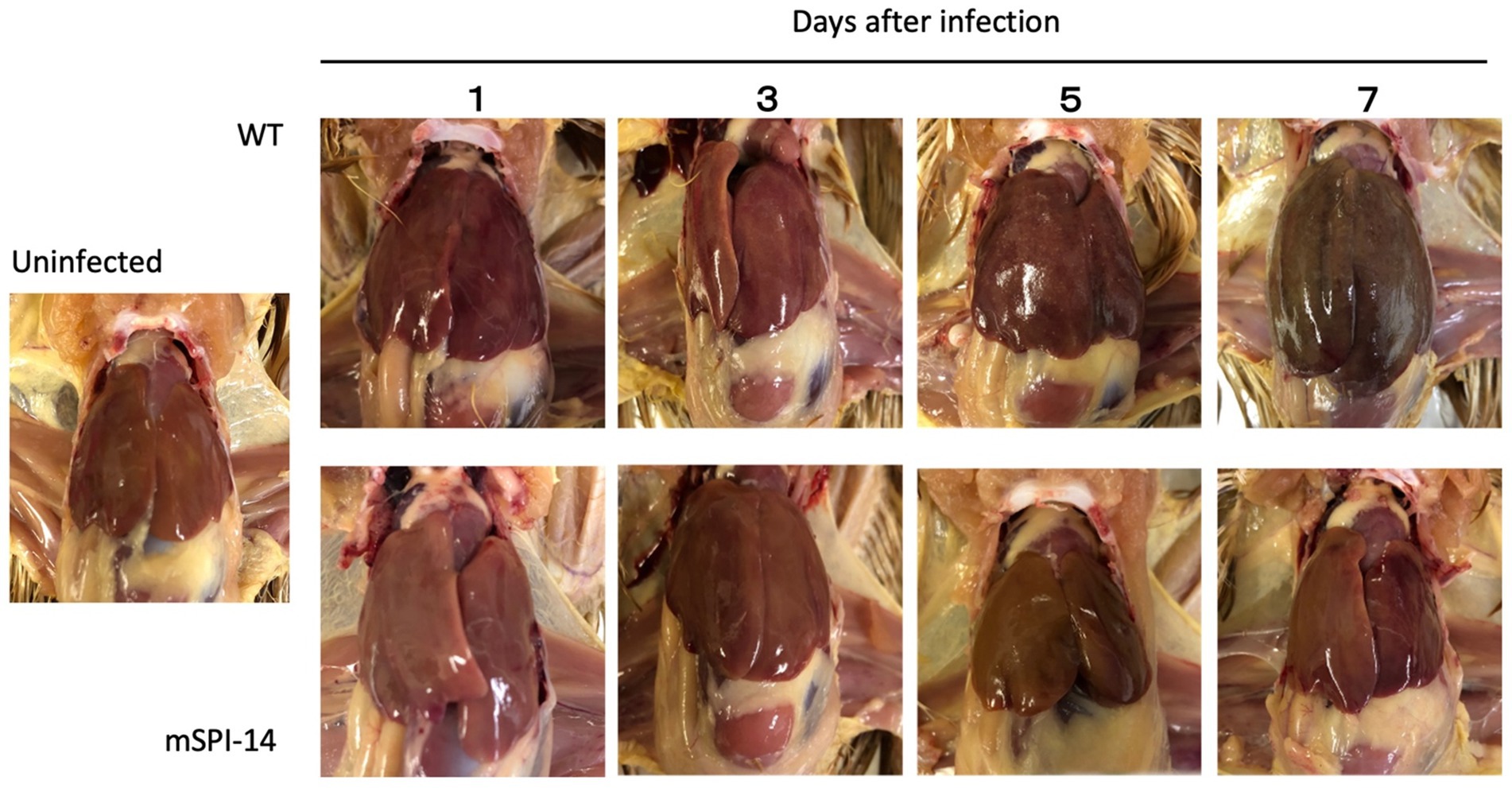
Se sabe que los hallazgos patológicos más característicos de la fiebre tifoidea aviar son la hipertrofia, las lesiones blancas y los pequeños focos necróticos, que se observaron en el hígado de pollos infectados (5). A continuación, comparamos los cambios patológicos en el hígado de pollos infectados con las cepas WT y mSPI-14. La observación macroscópica del hígado de los pollos inoculados con WT mostró que aparecieron lesiones en forma de puntos blancos y pequeñas lesiones necróticas 5 días después de la inoculación, y 7 días después de la inoculación, aparecieron más lesiones blancas, congestión, turbidez e hinchazón. Por el contrario, no se observaron lesiones evidentes en pollos infectados con mSPI-14 (Figura 4).
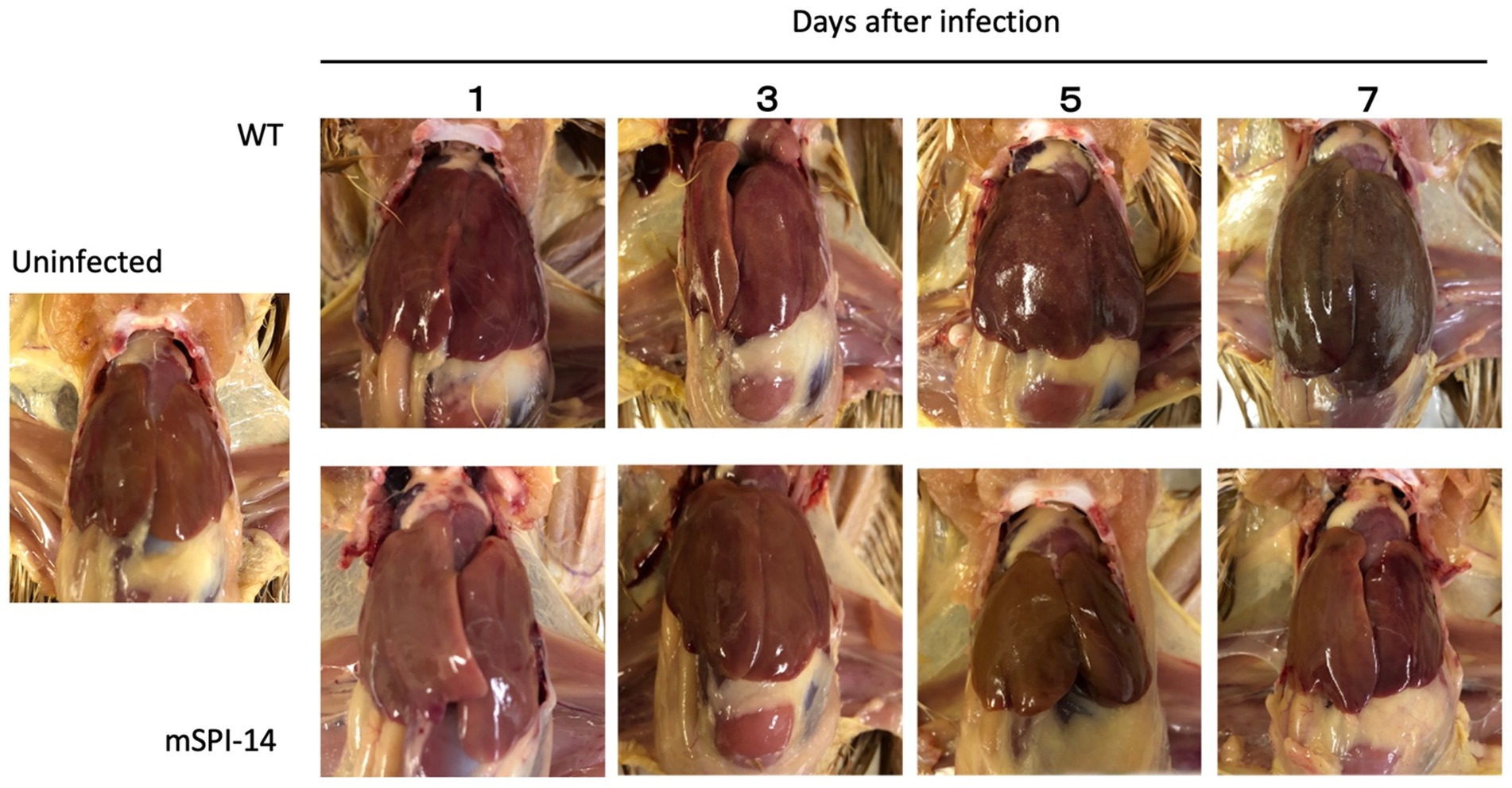 Figura 4. Lesiones macroscópicas en el hígado de pollos inoculados por vía oral con WT y mSPI-14. Los hígados de cambios patológicos se observaron a los 1, 3, 5 y 7 días después de la infección. Se observaron lesiones blancas y pequeños focos necróticos en pollos infectados con WT 3 días después de la infección, y se observó hipertrofia y congestión hepática 7 días después de la infección. Aunque se observaron ligeras lesiones blancas y pequeños focos necróticos en los pollos infectados con mSPI-14 5 días después de la infección, no se observó hipertrofia ni hinchazón.
Figura 4. Lesiones macroscópicas en el hígado de pollos inoculados por vía oral con WT y mSPI-14. Los hígados de cambios patológicos se observaron a los 1, 3, 5 y 7 días después de la infección. Se observaron lesiones blancas y pequeños focos necróticos en pollos infectados con WT 3 días después de la infección, y se observó hipertrofia y congestión hepática 7 días después de la infección. Aunque se observaron ligeras lesiones blancas y pequeños focos necróticos en los pollos infectados con mSPI-14 5 días después de la infección, no se observó hipertrofia ni hinchazón.
3.6 Cambios histológicos en los pollos infectados
A continuación, se realizó el examen histopatológico del hígado y el bazo de pollos infectados para determinar si SPI-14 está relacionado con la inflamación tisular causada por S. gallinarum. En los tejidos hepáticos de pollos inoculados con WT, se observaron características inflamatorias, como necrosis focal de hepatocitos, pseudoeosinófilos y grupos de linfocitos, de los días 3 a 5 después de la inoculación. La extensión de la inflamación y la destrucción del tejido aumentaron y se expandieron (Figura 5A). Además, se observó una extensa necrosis de la coagulación en los tejidos del bazo de los pollos inoculados con WT 5 días después de la inoculación. Por el contrario, no se observaron cambios histopatológicos notables en el hígado de los pollos inoculados con mSPI-14. Además, se observó una extensa necrosis de la coagulación en los tejidos del bazo de los pollos inoculados con WT 5 días después de la inoculación. No hubo cambios histopatológicos significativos en el bazo de los pollos inoculados con mSPI-14 (Figura 5B).
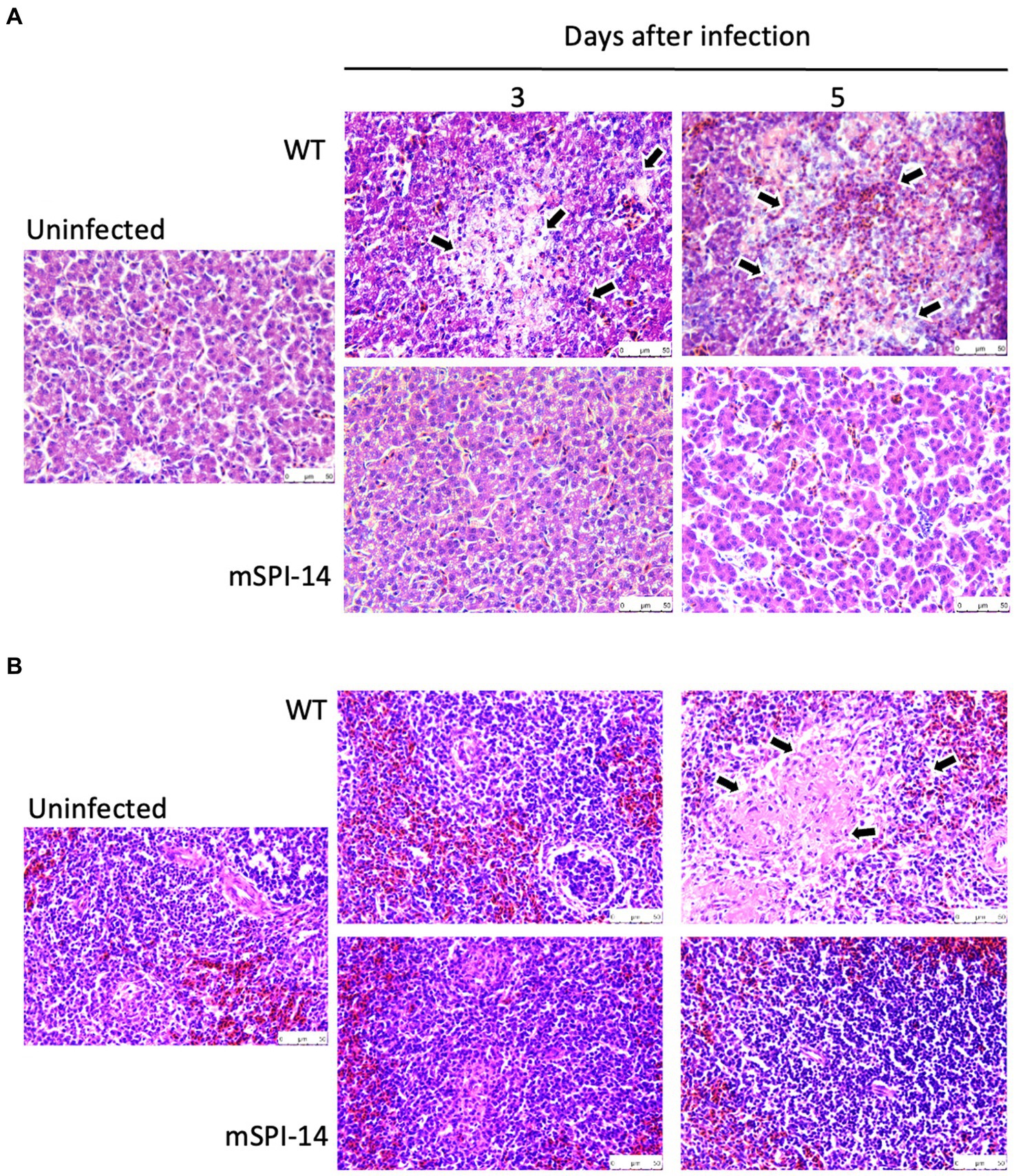 Figura 5. Cambios histopatológicos y lesiones microscópicas en el hígado y el bazo de pollos infectados oralmente con WT y mSPI-14. Los pollos fueron inoculados por vía oral con 108 UFC de WT, mSPI-14 o PBS como controles no infectados, y los órganos se recolectaron a los 3 y 5 días después de la infección. Se prepararon secciones de parafina de los órganos y se tiñeron con hematoxilina-eosina, aumento×400. (A) Hígado, las flechas muestran lesiones que se caracterizaron por una marcada infiltración de heterófilos y linfocitos con degeneración y necrosis. (B) Bazo, las flechas muestran degeneración y necrosis en la pulpa blanca.
Figura 5. Cambios histopatológicos y lesiones microscópicas en el hígado y el bazo de pollos infectados oralmente con WT y mSPI-14. Los pollos fueron inoculados por vía oral con 108 UFC de WT, mSPI-14 o PBS como controles no infectados, y los órganos se recolectaron a los 3 y 5 días después de la infección. Se prepararon secciones de parafina de los órganos y se tiñeron con hematoxilina-eosina, aumento×400. (A) Hígado, las flechas muestran lesiones que se caracterizaron por una marcada infiltración de heterófilos y linfocitos con degeneración y necrosis. (B) Bazo, las flechas muestran degeneración y necrosis en la pulpa blanca.
3.7 Expresión de citoquinas y quimiocinas en los pollos infectados
Además, analizamos y comparamos las respuestas inmunitarias de pollos infectados con WT y mSPI-14. La expresión de los genes de citocinas y quimiocinas, IL-1β, IL-6, TNF-α, IFN-γ, IL-12 y CXCLi1 en el hígado de los pollos se detectó de 3 a 5 días después de la infección. En los hígados del grupo inoculado con WT, el nivel de expresión de ARNm de TNF-α aumentó 3 días después de la inoculación en comparación con el grupo control no infectado (p < 0,05, Figura 6). A los 5 días después de la inoculación, los niveles de expresión de ARNm de TNF-α, IL-12 y CXCLi1 aumentaron de manera más significativa (p < 0,01), y el aumento de la expresión de IL-1β e IFN-γ también se observó a los 5 días después de la infección (p < 0,05). Por el contrario, no se observaron cambios significativos en la expresión de citocinas en el hígado del grupo inoculado con mSPI-14 en comparación con el grupo control no infectado (Figura 6). Es importante destacar que los niveles de expresión de IL-1β, TNF-α, IFN-γ, IL-12 y CXCLi1 en los hígados del grupo infectado con mSPI-14 fueron significativamente más bajos en comparación con los del grupo infectado con WT (Figura 6).
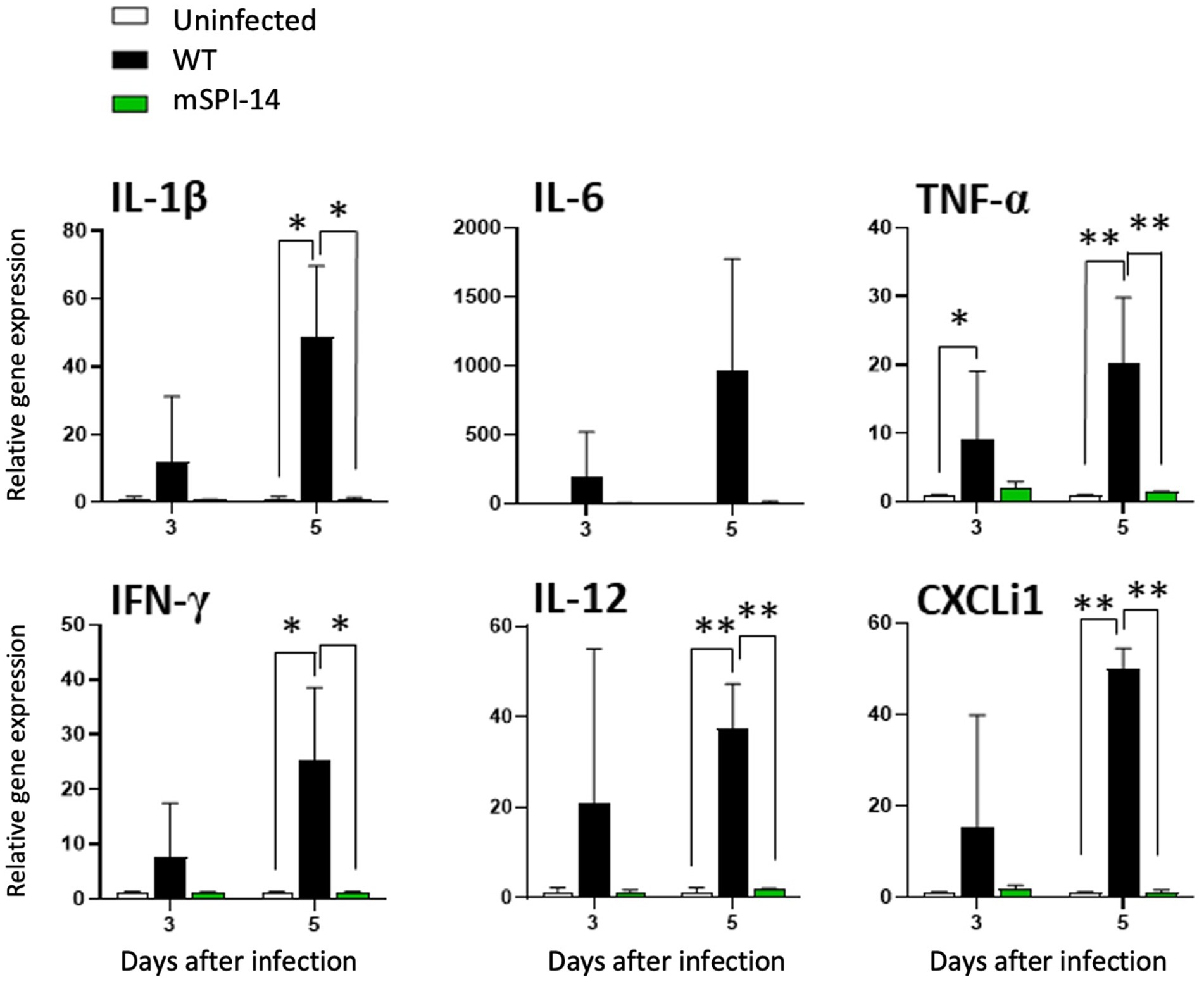 Figura 6. Expresión de citoquinas y quimiocinas en el hígado de pollos infectados con WT y mSPI-14. Los pollos fueron inoculados por vía oral con 108 UFC de WT o mSPI-14. El hígado de los pollos se colectó a los 3 y 5 días post-infección, y se determinó la expresión de IL-1β, IL-6, TNF-α, IFN-γ, IL-12 y CXCLi1 mediante RT-PCR cuantitativa. Los datos se expresaron como medias ± desviaciones estándar de los cambios en el pliegue en la expresión génica de los órganos de los grupos infectados en relación con los del grupo de control no infectado. El análisis estadístico se realizó mediante un análisis de ANOVA de un factor seguido de la prueba de comparación múltiple de Tukey para comparar pollos infectados con controles no infectados. Las diferencias significativas se mostraron como *p < 0,05, **p < 0,01.
Figura 6. Expresión de citoquinas y quimiocinas en el hígado de pollos infectados con WT y mSPI-14. Los pollos fueron inoculados por vía oral con 108 UFC de WT o mSPI-14. El hígado de los pollos se colectó a los 3 y 5 días post-infección, y se determinó la expresión de IL-1β, IL-6, TNF-α, IFN-γ, IL-12 y CXCLi1 mediante RT-PCR cuantitativa. Los datos se expresaron como medias ± desviaciones estándar de los cambios en el pliegue en la expresión génica de los órganos de los grupos infectados en relación con los del grupo de control no infectado. El análisis estadístico se realizó mediante un análisis de ANOVA de un factor seguido de la prueba de comparación múltiple de Tukey para comparar pollos infectados con controles no infectados. Las diferencias significativas se mostraron como *p < 0,05, **p < 0,01.
4 Discusión
Salmonella gallinarum es el agente causal de la fiebre tifoidea aviar que causa una alta morbilidad y mortalidad en las aves de corral y es extremadamente perjudicial para la industria avícola con brotes frecuentes, especialmente en los países en desarrollo (21-24). Aunque se ha recopilado cierta información de estudios epidemiológicos y clínicos, aún no está claro por qué S. gallinarum causa una infección sistémica mortal en los pollos, así como sus factores de virulencia y los mecanismos especiales detrás de la adaptación a las aves. En el presente estudio, construimos un mutante deficiente en SPI-14 de S. gallinarum y evaluamos los efectos patogénicos en un modelo de infección oral de pollo. Nuestros resultados mostraron por primera vez que los mutantes de deleción de SPI-14 han reducido significativamente la resistencia a las sales biliares in vitro y que las cepas de mSPI-14 resultantes se atenuaron significativamente en pollos infectados por vía oral in vivo, lo que indica que SPI-14 desempeña un papel patogénico crítico en el proceso de infección sistémica de pollos causada por S. gallinarum.
Las funciones de los SPIs se han estudiado principalmente en bacterias patógenas gastrointestinales, como S. typhimurium y S. enteritidis, que tienen una amplia gama de huéspedes y causan diarrea autolimitada en humanos y animales (7, 9, 25). Los SPI tienen efectos importantes sobre la fisiología bacteriana y las interacciones con el medio ambiente y el tracto gastrointestinal de los mamíferos (7, 26). De ellos, SPI-14 puede activar la transcripción del regulador de invasión hilD en S. typhimurium (7). Estudios recientes han reportado que SPI-14 (STM14-1008) codifica LoiA, que es un nuevo regulador de SPI-1. LoiA se une directamente al promotor y activa la transcripción de hilD, lo que posteriormente conduce a la activación de hilA, un activador maestro de SPI-1 (7, 8, 27). La deleción de loiA redujo significativamente la transcripción de hilA, hilD y otros genes representativos de SPI-1 bajo bajo O bajo2 condiciones (7, 28). SPI-14 promueve la virulencia de S. typhimurium al afectar la invasión, y la loiA es un determinante de virulencia de SPI-14. La deleción de un solo gen loiA o de toda la región SPI-14 atenuó severamente la virulencia de S. typhimurium en experimentos de infección oral con ratones (6, 7). Además, LoiA también puede regular múltiples genes relacionados con la virulencia en S. typhimurium a través de la regulación negativa de la proteasa Lon (29). Estudios recientes han demostrado que S. enteritidis y S. typhimurium pueden compartir los mismos mecanismos de virulencia para la invasión de células epiteliales y la supervivencia dentro de los macrófagos (9, 25, 30).
Sin embargo, en comparación con los estudios funcionales de SPI-14 en S. typhimurium, S. enteritidis y otras bacterias gramnegativas, se sabe poco sobre la función y el efecto patogénico de SPI-14 en la bacteria específica de aves, S. gallinarum, que causa una infección sistémica grave en lugar de diarrea autolimitada en pollos. El presente estudio mostró que la cepa mSPI-14 de S. gallinarum no mostró cambios significativos en la cinética de crecimiento y la morfología de la colonia, pero la resistencia a los ácidos biliares se redujo significativamente en comparación con las de la cepa WT in vitro (Figura 2). Es importante destacar que la patogenicidad del mutante mSPI-14 también se atenuó significativamente durante los experimentos de infección oral de pollos in vivo. mSPI-14 no causó infección sistémica grave en los pollos, y el número de bacterias viables en los órganos fue significativamente menor que el de los pollos infectados con WT (Figura 3). Los genes SG0835 y SG0836 delecionados por mSPI-14 mostraron una disminución de la tolerancia a los ácidos biliares y una patogenicidad significativamente atenuada en los pollos. La relación entre la resistencia a los ácidos biliares y la virulencia bacteriana en las infecciones sistémicas debe investigarse con más detalle en estudios posteriores. Un estudio previo informó que los ácidos biliares pueden suprimir la expresión de genes relacionados con la invasión de Salmonella mediante la inactivación de HilD (26). Un estudio reciente también demostró que los genes SG0835-G0839 (excepto SG0836) de SPI-14 están regulados de manera única en el S. gallinarum específico de aves, lo que sugiere que SPI-14 puede desempeñar diferentes funciones patogénicas entre S. gallinarum serovar y otros serovar como S. enteritidis y S. Dublín en el que los genes no estaban regulados (6). Nuestros resultados y estos informes indican fuertemente que los genes dentro de SPI-14, incluido el gen SG0836, son genes de virulencia críticos para las infecciones sistémicas de pollo (6, 26).
Hasta la fecha, los estudios sobre los efectos de Salmonella enterica SPI-14 sobre la infección sistémica de pollos in vivo son muy limitados. En nuestros estudios recientes, los pollos infectados con S. gallinarum WT murieron después de mostrar síntomas clínicos como depresión y plumas erizadas, y el examen macroscópico del hígado mostró lesiones punteadas blancas y hepatomegalia (5, 19). Además, en el análisis histopatológico, se observaron reacciones inflamatorias notables y generalizadas en los órganos, como necrosis focal, heterófilos, grupos de linfocitos en el hígado y necrosis coagulativa en el bazo (19). En este estudio, por el contrario, los pollos infectados con el mutante mSPI-14 no mostraron síntomas clínicos significativos, tuvieron una tasa de supervivencia del 100% y no mostraron diferencias en los hallazgos macroscópicos y/o cambios patológicos en comparación con el grupo no infectado. Además, la producción de citoquinas y quimiocinas proinflamatorias en los pollos infectados con mSPI-14 también fue significativamente menor que en los pollos infectados con WT. Estos resultados indicaron además que la deleción de SPI-14 está involucrada en la reducción de la virulencia de S. gallinarum en la infección sistémica de pollos. El grupo de genes SPI-14 ha sido identificado como crucial para la expresión de SPI-1. SPI-1 y SPI-2 tanto en S. enteritidis como en S. typhimurium codifican el Sistema de Secreción Tipo III (T3SS), desempeñando un papel fundamental en la invasión celular y la supervivencia intracelular dentro del tracto intestinal del huésped (29, 31, 32). Algunos SPI son ubicuos y se distribuyen entre todas las especies de Salmonella, mientras que otros SPI pueden estar asociados con serotipos específicos, lo que revela ventajas adaptativas y especificidad del huésped (10, 24). De hecho, algunas cepas de S. gallinarum de pollos clínicamente infectados carecen de SPI-1, mientras que las cepas mutantes SPI-1 de S. gallinarum aún muestran su capacidad para persistir dentro de los macrófagos de pollo (29, 33). Estos estudios indican que SPI-1 puede no ser necesario para la patogenicidad de S. gallinarum en la infección sistémica de pollos. SPI-14 desempeña un papel clave en la infección sistémica de pollos causada por S. gallinarum, posiblemente debido a sus diferentes funciones y/o vías de S. typhimurium y S. enteritidis, que son principalmente causantes de diarrea autolimitada en animales. Dado el potencial de las cepas atenuadas como vacunas para el control de S. gallinarum (34, 35), nuestro estudio demostró que los mutantes mSPI-14 construidos que sirven como cepas vacunales atenuadas viables pueden tener grandes perspectivas de desarrollo.
Declaración de disponibilidad de datos
Los conjuntos de datos presentados en este estudio se pueden encontrar en repositorios en línea. Los nombres de los repositorios y los números de acceso se pueden encontrar en el artículo/material complementario.
Declaración ética
El estudio en animales fue aprobado por el Comité de Cuidado de Animales de la Universidad de Kitasato. El estudio se llevó a cabo de acuerdo con la legislación local y los requisitos institucionales. Los experimentos de infección de pollos se llevaron a cabo de acuerdo con las regulaciones para experimentos con animales especificadas en la Ley de Bienestar Animal y la Guía para el Cuidado y Uso de Animales de Laboratorio. Se hizo todo lo posible para reducir el sufrimiento de los animales durante los experimentos. El protocolo de experimentación animal fue revisado por el Comité de Cuidado de Animales de la Universidad de Kitasato y aprobado por el Presidente de la Universidad de Kitasato (números de aprobación: 20-055 y 21-039).
Contribuciones de los autores
ZH: Curación de datos, Investigación, Metodología, Visualización, Redacción – borrador original. SO: Curación de datos, Investigación, Metodología, Visualización, Redacción – revisión y edición. ZZ: Investigación, Escritura – borrador original. XY: Curación de datos, investigación, visualización, redacción, revisión y edición. MS: Investigación, Metodología, Redacción – revisión y edición. TH: Escritura – revisión y edición. MO: Metodología, Redacción – revisión y edición. HO: Conceptualización, Investigación, Metodología, Redacción – revisión y edición. D-LH: Conceptualización, Obtención de Financiamiento, Metodología, Administración de Proyectos, Supervisión, Visualización, Redacción, Revisión y Edición.
Financiación
El/los autor/es declara(n) haber recibido apoyo financiero para la investigación, autoría y/o publicación de este artículo. Esta investigación fue financiada por el Fondo de Investigación de la Universidad de Kitasato, números de subvención R2104, R2204 y R2304.
Reconocimientos
Los autores desean expresar su sincero agradecimiento a Tomoki Yasuda, Tatsuya Nakabayashi, Ryo Okimoto y a todos los miembros del Laboratorio de Zoonosis por los experimentos con pollos, la recolección de muestras y la asistencia técnica durante la preparación de esta investigación.
Conflicto de intereses
Los autores declaran que la investigación se llevó a cabo en ausencia de relaciones comerciales o financieras que pudieran interpretarse como un posible conflicto de intereses.
Nota del editor
Todas las afirmaciones expresadas en este artículo son únicamente las de los autores y no representan necesariamente las de sus organizaciones afiliadas, ni las del editor, los editores y los revisores. Cualquier producto que pueda ser evaluado en este artículo, o afirmación que pueda ser hecha por su fabricante, no está garantizado ni respaldado por el editor.
Referencias
1. Mdegela, R, Msoffe, P, Waihenya, R, Kasanga, J, Mtambo, M, Minga, U, et al. Patogenia comparativa de infecciones experimentales por Salmonella gallinarum en pollos locales y comerciales. Trop Anim Salud Prod. (2002) 34:195–204. doi: 10.1023/a:1015226507721
Resumen de PubMed | Texto completo de Crossref | Google Académico
2. Shivaprasad, H. Fiebre tifoidea aviar y enfermedad del pullorum. Rev Sci Tech. (2000) 19:405–24. doi: 10.20506/rst.19.2.1222
3. Barrow, P, y Neto, OF. La enfermedad del pullorum y la fiebre tifoidea aviar: nuevas reflexiones sobre las viejas enfermedades: una revisión. Pathol aviar. (2011) 40:1–13. doi: 10.1080/03079457.2010.542575
Resumen de PubMed | Texto completo de Crossref | Google Académico
4. Kim, NH, Ha, EJ, Ko, DS, Lee, CY, Kim, JH y Kwon, HJ. Evolución molecular de Salmonella enterica subsp. enterica serovar Gallinarum biovar Gallinarum en campo. Microbiol veterinario. (2019) 235:63–70. doi: 10.1016/j.vetmic.2019.05.019
Resumen de PubMed | Texto completo de Crossref | Google Académico
5. Ojima, S, Okamura, M, Osawa, N, Tamura, A, Yoshioka, K, Kashimoto, T, et al. Características de la infección sistémica y respuestas del huésped en pollos infectados experimentalmente con Salmonella enterica serovar Gallinarum biovar Gallinarum. J Vet Med Sci. (2021) 83:1147–54. doi: 10.1292/jvms.21-0227
Resumen de PubMed | Texto completo de Crossref | Google Académico
6. Fei, X, Schroll, C, Huang, K, Christensen, JP, Christensen, H, Lemire, S, et al. Los transcriptomas globales de los serovares de Salmonella enterica Gallinarum, Dublin y Enteritidis en el huésped aviar. Microb Pathog. (2023) 182:106236. doi: 10.1016/j.micpath.2023.106236
Resumen de PubMed | Texto completo de Crossref | Google Académico
7. Jiang, L, Feng, L, Yang, B, Zhang, W, Wang, P, Jiang, X, et al. La vía de transducción de señales mediada por el nuevo regulador LoiA para la invasión de Salmonella Typhimurium inducida por baja tensión de oxígeno. PLoS Pathog. (2017) 13:e1006429. doi: 10.1371/journal.ppat.1006429
Resumen de PubMed | Texto completo de Crossref | Google Académico
8. Shah, DH, Lee, MJ, Park, JH, Lee, JH, Eo, SK, Kwon, JT, et al. Identificación de genes de virulencia de Salmonella gallinarum en un modelo de infección de pollo mediante utagénesis marcada con firma basada en PCR. Microbiología. (2005) 151:3957–68. doi: 10.1099/mic.0.28126-0
9. Shah, DH, Zhou, X, Kim, HY, Call, DR y Guard, J. La mutagénesis del transposón de Salmonella enterica serovar Enteritidis identifica genes que contribuyen a la invasividad en células humanas y de pollo y a la supervivencia en la albúmina de huevo. Infectar a Immun. (2012) 80:4203–15. doi: 10.1128/IAI.00790-12
Resumen de PubMed | Texto completo de Crossref | Google Académico
10. Marcus, S.L., Brumell, J.H., Pfeifer, C.G., y Finlay, B.B. Islas de patogenicidad de Salmonella: gran virulencia en paquetes pequeños. Los microbios infectan. (2000) 2:145–56. doi: 10.1016/s1286-4579(00)00273-2
Resumen de PubMed | Texto completo de Crossref | Google Académico
11. Foster, N, Tang, Y, Berchieri, A, Geng, S, Jiao, X y Barrow, P. Revisión de la infección persistente por Salmonella y el estado de portador: ¿qué sabemos? Patógenos. (2021) 10:1299. doi: 10.3390/pathogens10101299
Resumen de PubMed | Texto completo de Crossref | Google Académico
12. Lawhon, SD, Maurer, R, Suyemoto, M y Altier, C. Los ácidos grasos intestinales de cadena corta alteran la expresión génica y la virulencia de la invasión de Salmonella Typhimurium a través de BarA/SirA. Mol Microbiol. (2002) 46:1451–64. doi: 10.1046/j.1365-2958.2002.03268.x
Resumen de PubMed | Texto completo de Crossref | Google Académico
13. Chadfield, MS, Brown, DJ, Aabo, S, Christensen, JP, y Olsen, JE. Comparación de la invasión intestinal y la respuesta de macrófagos de Salmonella gallinarum y otros serovares de Salmonella enterica adaptados al huésped en el huésped aviar. Microbiol veterinario. (2003) 92:49–64. doi: 10.1016/s0378-1135(02)00290-0
Resumen de PubMed | Texto completo de Crossref | Google Académico
14. Saini, S, Ellermeier, JR, Slauch, JM, y Rao, CV. El papel de la retroalimentación positiva acoplada en la expresión del sistema de secreción SPI1 tipo tres en Salmonella. PLoS Pathog. (2010) 6:e1001025. doi: 10.1371/journal.ppat.1001025
Resumen de PubMed | Texto completo de Crossref | Google Académico
15. Chubiz, JEC, Golubeva, YA, Lin, D, Miller, LD, y Slauch, JM. Fliz regula la expresión del locus de invasión de la isla 1 de patogenicidad de Salmonella mediante el control de la actividad de la proteína HilD en Salmonella enterica serovar typhimurium. J Bacteriol. (2010) 192:6261–70. doi: 10.1128/JB.00635-10
Resumen de PubMed | Texto completo de Crossref | Google Académico
16. Ellermeier, JR, y Slauch, JM. El pelaje regula la expresión del sistema de secreción de la isla de patogenicidad de salmonela 1 tipo III a través de la hild. J Bacteriol. (2008) 190:476–86. doi: 10.1128/JB.00926-07
Resumen de PubMed | Texto completo de Crossref | Google Académico
17. Soria, MA, Bonnet, MA, y Bueno, DJ. Relación de la infección por Salmonella y la respuesta inflamatoria intestinal con los valores hematológicos y bioquímicos séricos en gallinas ponedoras. Veterinario Inmunol Inmunopatíaco. (2015) 165:145–53. doi: 10.1016/j.vetimm.2015.03.008
Resumen de PubMed | Texto completo de Crossref | Google Académico
18. Datsenko, KA y Wanner, BL. Inactivación en un solo paso de genes cromosómicos en escherichia coli K-12 mediante productos de PCR. Proc Natl Acad Sci USA. (2000) 97:6640–5. doi: 10.1073/pnas.120163297
Resumen de PubMed | Texto completo de Crossref | Google Académico
19. Ojima, S, Ono, HK, Okimoto, R, Yu, X, Sugiyama, M, Yoshioka, K, et al. El gen wecB de Salmonella gallinarum desempeña un papel fundamental en la infección sistémica de la fiebre tifoidea aviar. Microbiol frontal. (2022) 13:880932. doi: 10.3389/fmicb.2022.880932
Resumen de PubMed | Texto completo de Crossref | Google Académico
20. Smith, HW. La susceptibilidad de diferentes razas de pollos a la infección experimental por Salmonella gallinarum. Poult Sci. (1956) 35:701–5. doi: 10.3382/ps.0350701
21. Shivaprasad, H, y Barrow, P. Enfermedad de Pullorum y fiebre tifoidea aviar. En: Dis Poult. Oxford: Wiley-Blackwell Press (2013). págs. 678-93.
22. Foley, SL, Johnson, TJ, Ricke, SC, Nayak, R, y Danzeisen, J. Patogenicidad de la salmonela y adaptación del huésped en serovares asociados al pollo. Microbiol Mol Biol Rev. (2013) 77:582–607. doi: 10.1128/MMBR.00015-13
Resumen de PubMed | Texto completo de Crossref | Google Académico
23. Huang, K, Fresno, AH, Skov, S, y Olsen, JE. Dinámica y resultado de la interacción de macrófagos entre Salmonella gallinarum, Salmonella typhimurium y Salmonella Dublin y macrófagos de pollos y bovinos. Las células frontales infectan el microbiol. (2020) 9:420. doi: 10.3389/fcimb.2019.00420
Resumen de PubMed | Texto completo de Crossref | Google Académico
24. Chacón, RD, Ramírez, M, Rodríguez-Cueva, CL, Sánchez, C, Quispe-Rojas, WU, Astolfi-Ferreira, CS, et al. Caracterización genómica y perfiles genéticos de cepas de Salmonella gallinarum aisladas de ponedoras con fiebre tifoidea aviar en Colombia. Genes. (2023) 14:823. doi: 10.3390/genes14040823
Resumen de PubMed | Texto completo de Crossref | Google Académico
25. Pławińska-Czarnak, J, Wódz, K, Guzowska, M, Rosiak, E, Nowak, T, Strzałkowska, Z, et al. Comparación de la virulencia fenotípica y genotípica y los factores antimicrobianos de Salmonella Typhimurium aislada de leche humana. Int J Mol Sci. (2023) 24:5135. doi: 10.3390/ijms24065135
Resumen de PubMed | Texto completo de Crossref | Google Académico
26. Eade, CR, Hung, C-C, Bullard, B, González-Escobedo, G, Gunn, JS y Altier, C. Los ácidos biliares funcionan sinérgicamente para reprimir la expresión génica de invasión en Salmonella al desestabilizar el regulador de invasión HilD. Infectar a Immun. (2016) 84:2198–208. doi: 10.1128/IAI.00177-16
Resumen de PubMed | Texto completo de Crossref | Google Académico
27. Thomson, NR, Clayton, DJ, Windhorst, D, Vernikos, G, Davidson, S, Churcher, C, et al. El análisis comparativo del genoma de Salmonella enteritidis PT4 y Salmonella gallinarum 287/91 proporciona información sobre las vías evolutivas y de adaptación del huésped. Genoma Res. (2008) 18:1624–37. doi: 10.1101/gr.077404.108
Resumen de PubMed | Texto completo de Crossref | Google Académico
28. Fei, X, Li, Q, Olsen, JE y Jiao, X. Un enfoque bioinformático para identificar la diferencia del genoma central entre Salmonella Pullorum y Salmonella Enteritidis. Infectar Genet Evol. (2020) 85:104446. doi: 10.1016/j.meegid.2020.104446
Resumen de PubMed | Texto completo de Crossref | Google Académico
29. Jones, MA, Wigley, P, Page, KL, Hulme, SD, y Barrow, PA. Salmonella enterica serovar Gallinarum requiere el sistema de secreción de la isla de patogenicidad de Salmonella 2 tipo III, pero no el sistema de secreción de la isla de patogenicidad de Salmonella 1 tipo III para la virulencia en pollos. Infectar a Immun. (2001) 69:5471–6. doi: 10.1128/IAI.69.9.5471-5476.2001
Resumen de PubMed | Texto completo de Crossref | Google Académico
30. Li, H, Li, X, Lv, R, Jiang, X, Cao, H, Du, Y, et al. Función reguladora global del regulador transcripcional LoiA bajo inducido por oxígeno en Salmonella Typhimurium revelada por secuenciación de ARN. Biochem Biophys Res Commun. (2018) 503:2022–7. doi: 10.1016/j.bbrc.2018.07.151
Resumen de PubMed | Texto completo de Crossref | Google Académico
31. Lawrence, ALE, Abuaita, BH, Berger, RP, Hill, DR, Huang, S, Yadagiri, VK, et al. Salmonella enterica serovar typhimurium SPI-1 y SPI-2 dan forma al panorama transcripcional global en un sistema modelo de organoide intestinal humano. MBio. (2021) 12:1110–28. doi: 10.1128/mBio.00399-21
32. Saleh, DO, Horstmann, JA, Giralt-Zúñiga, M, Weber, W, Kaganovitch, E, Durairaj, AC, et al. La expresión génica de la virulencia de Spi-1 modula la motilidad de Salmonella Typhimurium de una manera dependiente de la fuerza motriz del protón y de las adhesinas. PLoS Pathog. (2023) 19:e1011451. doi: 10.1371/journal.ppat.1011451
Resumen de PubMed | Texto completo de Crossref | Google Académico
33. Boyen, F, Pasmans, F, Donné, E, Van Immerseel, F, Adriaensen, C, Hernalsteens, J-P, et al. Papel de SPI-1 en las interacciones de Salmonella Typhimurium con macrófagos porcinos. Microbiol veterinario. (2006) 113:35–44. doi: 10.1016/j.vetmic.2005.10.018
34. Łaniewski, P, Mitra, A, Karaca, K, Khan, A, Prasad, R, Curtiss, R III, et al. Evaluación de la eficacia protectora de cepas vivas atenuadas de la vacuna Salmonella enterica serovar Gallinarum contra la fiebre tifoidea aviar en pollos. Clin Vacuna Immunol. (2014) 21:1267–76. doi: 10.1128/CVI.00310-14
Resumen de PubMed | Texto completo de Crossref | Google Académico
35. Mitra, A, Loh, A, Gonzales, A, Łaniewski, P, Willingham, C, Curtiss, R III, et al. Seguridad y eficacia protectora de mutantes vivos atenuados de Salmonella gallinarum en pollos rojos de Rhode Island. Vacuna. (2013) 31:1094–9. doi: 10.1016/j.vaccine.2012.12.021
Resumen de PubMed | Texto completo de Crossref | Google Académico
Palabras clave: Salmonella gallinarum, fiebre tifoidea aviar, pollo, SPI-14, infección sistémica
Cita: Hu Z, Ojima S, Zhu Z, Yu X, Sugiyama M, Haneda T, Okamura M, Ono HK y Hu D-L (2024) La patogenicidad de la salmonela isla-14 es un factor crítico de virulencia responsable de la infección sistémica en pollos causada por Salmonella gallinarum. Frente. Vet. Sci. 11:1401392. doi: 10.3389/fvets.2024.1401392
Recibido: 15 de marzo de 2024; Aceptado: 30 de abril de 2024;
Publicado: 23 de mayo de 2024.
Editado por:
Hyuk-Joon Kwon, Universidad Nacional de Seúl, República de Corea
Revisado por:
Christi L. Swaggerty, Servicio de Investigación Agrícola (USDA), Estados
Unidos Young Min Kwon, Universidad de Arkansas, Estados Unidos
Derechos de autor © 2024 Hu, Ojima, Zhu, Yu, Sugiyama, Haneda, Okamura, Ono y Hu. Este es un artículo de acceso abierto distribuido bajo los términos de la Licencia Creative Commons Attribution License (CC BY).
*Correspondencia: Dong-Liang Hu, hudl@vmas.kitasato-u.ac.jp
†Estos autores han contribuido igualmente a este trabajo
Renuncia: Todas las afirmaciones expresadas en este artículo son únicamente las de los autores y no representan necesariamente las de sus organizaciones afiliadas, ni las del editor, los editores y los revisores. Cualquier producto que pueda ser evaluado en este artículo o afirmación que pueda hacer su fabricante no está garantizado ni respaldado por el editor.
Date de alta y recibe nuestro 👉🏼 Diario Digital AXÓN INFORMAVET ONE HEALTH
Date de alta y recibe nuestro 👉🏼 Boletín Digital de Foro Agro Ganadero
Noticias animales de compañía
Noticias animales de producción
Trabajos técnicos animales de producción
Trabajos técnicos animales de compañía