Colágeno y microvascularización en placentas de yeguas jóvenes y mayores
Colágeno y microvascularización en placentas de yeguas jóvenes y mayores
- 1Faculda de Medicina Veterinária, CIISA – Centro de Investigação Interdisciplinar em Sanidade Animal, Universidade de Lisboa, Lisboa, Portugal
- 2Embriovet, Muge, Portugal
- 3Pole Reprodución Haras de La Gesse, Boulogne-sur-Gesse, Francia
- 4Coimbra Colegio de Agricultura, Instituto Politécnico de Coimbra, Coimbra, Portugal
En las yeguas mayores, el aumento de las fibras de colágeno (fibrosis) en el endometrio y el oviducto predispone a la subfertilidad y la infertilidad. En este estudio, (i) la transcripción génica del colágeno (qPCR: COL1A1, COL1A2, COL3A1, COL5A1); (ii) proteína de colágeno total (hidroxiprolina); (iii) distribución del colágeno (mantenimiento rojo de Picrosirius; microscopía de luz polarizada); y (iv) densidad micro Se recogieron muestras del cuerno de grava, el cuerno no gravid y el cuerpo de la placenta de yeguas más jóvenes (n = 7) y mayores (n = 9) de diferentes razas. Las transcripciones de COL1A1, COL3A1 y COL5A1, la proteína de colágeno total, el grosor del tejido conectivo de la placa coriónica y la microvascularización aumentaron en el cuerno grave de las placentas de las yeguas más viejas, en comparación con la más joven (P < 0,05). Aunque en otras especies la fibrosis placentaria puede indicar insuficiencia placentaria y reducción del peso del recién nacido, esto no se observó aquí. Parece que las yeguas fértiles más viejas, con más paridades, pueden desarrollar una placenta funcional más pesada y vascularizada con más colágeno, a lo largo de una gestación más larga, lo que permite la entrega de potros más pesados. Por lo tanto, estas características podrían representar adaptaciones morfológicas y fisiológicas de las placentas fértiles de las yeguas más viejas para proporcionar la nutrición adecuada al feto equino.
Introducción
La placenta es un órgano demasiado complejo de vital importancia en el embarazo equino. La placenta de Mare como tipo epitelicorial, permite el contacto directo del epitelio endometrial con la superficie coriónica, a través de seis capas de tejido que separan la circulación materna de la circulación fetal, durante todo el embarazo (1–3). Este órgano permite nutrir al feto a través del intercambio metabólico de nutrientes, el suministro de oxígeno y la eliminación de desechos, proporcionando protección contra las agresiones internas y externas (4). Como placenta microcotyledonaria y difusa, también presenta una distribución uniforme de vellosidades coriónicas en la superficie materna, que se unen al epitelio materno formando microcotiledóneones bien distinguidos (2, 3).
En la práctica clínica equina, el examen meticuloso de la placenta, principalmente mediante una inspección anatomía grossosa, es un procedimiento de rutina (5). En la yegua, las alteraciones de la placenta pueden ser un signo de mal funcionamiento. A pesar de los marcadores de diagnóstico de sangre propuestos, el valor de un clínico experimentado que examina a la yegua es esencial (6). Es bien sabido que la nutrición fetal intrauterina influye tanto en la salud del foal (7, 8) como en su rendimiento atlético (9, 10). Sin embargo, independientemente de la especie animal, el examen macroscópico de la placenta no revela lesiones microscópicas que solo se detectan mediante examen histológico o observación de microscopía electrónica, y que podrían estar relacionadas con la muerte fetal, el bajo peso corporal neonatal o la enfermedad (11-14).
El envejecimiento de las yeguas se ha relacionado con el aumento de la fibrosis en el endometrio (15, 16) y el oviducto (17), y varias alteraciones patológicas en la placenta (13, 18). De hecho, durante la gestación de la yegua, además de las alteraciones morfológicas y los cambios degenerativos en los microplacentomas en la superficie de la placenta de la yegua, también el desarrollo de los lechos capilares fetales y maternos dentro de cada microplacentoma disminuye, perturbando el contacto físico y hematológico en la interfaz fetomater En otras especies, la vascularización de la placenta también es extremadamente importante, como en la cerda (11), la perra (14) y en la mujer (19). De hecho, en los seres humanos, la reducción de la vasculatura de la placenta se relaciona con frecuencia con la restricción del crecimiento fetal intrauterino (19).
El tejido fibrótico se caracteriza por la deposición excesiva de componentes de la matriz extracelular, como el colágeno, la fibronectina y el ácido hialurónico, debido a la activación, proliferación y acumulación de fibroblastos y miofibroblastos (20). De esta manera, el tejido fibrótico puede desregular el funcionamiento normal y la arquitectura de un órgano (21). La fibrosis se desarrolla a partir de un proceso inflamatorio crónico, en el que tanto los mecanismos de inmunidad innata como la adquirida desempeñan un papel importante (22), y donde la inflamación y la remodelación tisular ocurren simultáneamente (23). Los fibroblastos, una vez activados, se diferencian en miofibroblastos que inician la deposición de componentes del tejido conectivo, remodelando y destruyendo progresivamente la arquitectura del tejido (24). Aunque el colágeno existente en la placenta humana está relacionado con el desarrollo normal de la placenta, también se ha asociado a complicaciones metabólicas de la función placentaria (25). Los tipos de colágeno I, III, IV y V participan activamente en la formación del proceso fibrótico de las vellosidades coriónicas de la placenta humana (26).
Un cuerpo de evidencia muestra que en varias especies, las deficiencias en la estructura y función placentaria pueden reflejarse en el deterioro del desarrollo y el crecimiento fetal con la disminución del peso al nacer de los recién nacidos (13, 14, 18, 27). Por lo tanto, hemos planteado la hipótesis de que a medida que envejecen las yedas, la fibrosis en la placenta aumenta y la microvascularización disminuye, lo que conduce a una reducción en el peso del foal. Por lo tanto, el objetivo de este estudio fue evaluar en tres porciones (cina de gravedad, cuerno no de gravedad y cuerpo) de la placenta de las yedas (i) la transcripción del gen del colágeno (COL1A1A1, COL1A2, COL3A1, COL5A1); (ii) la proteína de colágeno total (hidroxiprolina);
Materiales y métodos
Identificación de la yegua
Dieciséis yeguas embarazadas de diferentes razas (Lusitano, Trotter francés, anglo-a Arabian, Hannover y KWPN) de la misma granja de sementales fueron seleccionadas al azar y agrupadas en dos categorías, según su edad. Las yeguas más jóvenes, con edades de entre 5 y 9 años, se asignaron al grupo de «ote yeguas jóvenes» (n = 7; 6,4 ± 0,6 años, media ± SEM), mientras que las yeguas más antiguas, de 10 a 15 años, se incluyeron en el grupo de «odas mayores» (n = 9; Se enredaron entre abril y mayo.
Las yeguas se mantuvieron en pasto y las dietas se ajustaron de acuerdo con las diferentes necesidades. Todas las yeguas fueron desparasitadas y vacunadas de forma rutinaria de acuerdo con el protocolo de granja de sementales. En el último mes de gestación, las yeguas se estabilizaron individualmente de la noche a la mañana, para la supervisión de los partos. En el foaling, las placentas de esas yeguas se recogieron inmediatamente después de la expulsión, se pesaron y se utilizaron para el muestreo. Los potros recién nacidos se pesaron dentro de las 24 horas posteriores al parto.
Colección de muestras
Se identificaron diferentes regiones de la placenta como cuerno gravid (A), cuerno no grave (B) y cuerpo placentario (C) (Figura 1). De cada una de estas áreas, se recogieron muestras de tejido de aproximadamente 5 mm3, de la siguiente manera: (i) cada una de las dos piezas se sumergió en 1 ml de ARN Later® (AM7020, Ambion, Applied Biosystems, Waltham, Massachusetts, EE. UU.) para estudios de PCR en tiempo real (qPCR) y para la determinación Las muestras de placenta en RNA Later® se mantuvieron a 4 °C durante 24 horas y luego se almacenaron a -80 °C hasta que se realizaron pruebas de laboratorio.
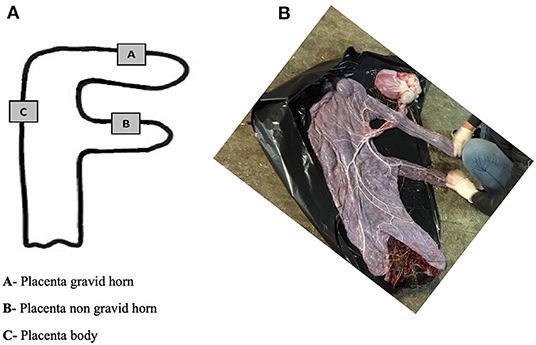 FIGURA 1. Representación diagramática de los sitios de la placenta para la recogida de muestras (A). Foto de la superficie alantoica de la placenta de una yegua después del parto (B).
FIGURA 1. Representación diagramática de los sitios de la placenta para la recogida de muestras (A). Foto de la superficie alantoica de la placenta de una yegua después del parto (B).
Reacción cuantitativa en cadena de la polimerasa en tiempo real
La determinación de la transcripción génica de los genes de colágeno, como el tipo I (COL1A1, COL1A2), el tipo III (COL3A1) y V (COL5A1) se realizó mediante PCR en tiempo real (qPCR) en el cuerno grave, el cuerno no grave y el cuerpo de la placenta obtenidos de yeguas más jóvenes (n = 7 Se diseñaron cebadores específicos, así como el gen de referencia, utilizando el programa basado en Internet Primer-3 y el software Primer Premier (Premier Biosoft Interpairs, Palo Alto, CA, EE. UU.). Los cebadores utilizados se enumeran en la Tabla 1. La extracción de ARN de muestras de placenta se llevó a cabo con el método del alcohol. En resumen, los tejidos placentarios (50 mg) se maceraron con una hoja de bisturí. Luego, se agregaron 500 μL (10 veces el peso de la muestra, en mg) de reactivo TRI® (T9424; Sigma Life Science, Burlington, MA, Estados Unidos), y se realizó una interrupción de la muestra con el TissueLyser II (Qiagen, Hilden, Alemania) durante cinco ciclos de 30 s cada uno, a 25 Hz, y Para la separación de ARN, se añadieron 100 μL (0,2 del volumen de sobrenadante) de cloroformo (C2432-1L – Sigma-Aldrich, Saint Louis, Missouri, EE. UU.) al sobrenadante recogido. La solución se mezcló, se incucursó en hielo durante 5 minutos y luego se centrifugaron a 12.000 g durante 20 minutos a 4 °C. Se recogió el sobrenadante. Posteriormente, 250 μL de isopropanol (alcohol isopropílico – 0918 – 500 ML – Biotecnología – VWR Life Science; Radnor, Pensilvania, EE. UU.), se añadieron a 500 μL del sobrenadante, se incubaron durante 10 minutos y se centrifugaron a 12.000 g durante 20 minutos a 4 ° El pellet recuperado se lavó con 75 % de etanol (K43342083215, índice -No: 603-002-00-5, Merck KGaA, Darmstadt, Alemania; volumen igual al volumen de sobrenadante), centrifugado a 7.500 g durante 5 minutos, a 4 °C, y secado al aire a temperatura ambiente durante 30 minutos. El ARN se disolvió en agua tratada con DEPC de 20-30 μL (AM9915G; Thermo Fisher Scientific, Waltham, Massachusetts, EE. UU.) y se almacenó a -80 °C. La concentración y la calidad del ARN se evaluaron utilizando Nanodrop® (ND200C; Thermo Fisher Scientific, Waltham, Massachusetts, EE. UU.), y mediante la visualización de bandas de ARNr después de la electroforesis en un gel de agarosa al 1,5% y una tinción roja (41003; Biotium, Hayward, CA, EE. UU. El ARN extraído se utilizó para la síntesis de ADNc, a través de la transcripción inversa. Este último se realizó utilizando la transcriptasa inversa M-MLV (M170B, Promega®, Madison, Wisconsin, EE. UU.) a partir de 1 μg de ARN total en un volumen de reacción de 20 μL utilizando oligonucleótidos (C1101, Promega®, Madison, Wisconsin, EE. UU.) y un inhibidor
El ADNc obtenido se combinó con Power SYBER Green PCR Master Mix (Ref. 4368706; Applied Biosystems, Waltham, Massachusetts, EE. UU.) y con los genes objetivo o de referencia, y los ensayos qPCR de ambos se realizaron simultáneamente en un sistema de PCR en tiempo real StepOne-Plus TM (Applied Biosystems, Waltham, Massachusetts, EE. UU.), utilizando los ciclos de temperatura universal descritos anteriormente (28).
Antes de ejecutar el ensayo, se optimizó la concentración de los cebadores (80 nM para los genes objetivo y de referencia), y se validó el gen de referencia. Para determinar el gen de control interno más estable, se consideraron inicialmente cuatro genes de referencia potenciales, de la siguiente manera: gliceraldehído 3-fosfato deshidrogenasa (GAPDH), complejo de succinato deshidrogenasa A, subunidad A, flavoproteína (SDHA), beta-2-microglobulina (β2M) y proteína ribosó GAPDH fue el gen de control interno más estable (29) y, por lo tanto, se consideró nuestro gen de referencia.
La confirmación de la especificidad de los productos de PCR se obtuvo mediante el funcionamiento de un gel de agarosa al 2,5% (BIO-41025; Bioline, Luckenwalde, Alemania) y mediante el análisis de la curva de fusión. El análisis cuantitativo del ARNm se determinó mediante el algoritmo PCR Miner en tiempo real (30), como se describió anteriormente (31). Los niveles de ARNm de los genes diana se normalizaron con respecto a los del gen de referencia.
Determinación de la concentración total de colágeno
Como la transcripción de los genes no siempre corresponde a la cantidad de proteína sintetizada (32), era necesario cuantificar el colágeno total presente en las muestras de placenta. Dado que la hidroxiprolina es un componente importante del colágeno que estabiliza su estructura helicoidal, la determinación de la concentración de hidroxiprolina se puede utilizar como indicador de la presencia de colágeno (33). Por lo tanto, la concentración total de hidroxiprolina en las diversas porciones de todas las placentas equinas se evaluó utilizando un método de inmunoensayo enzimático (Ref. ABIN593448; kit de ensayo colorimétrico de hidroxiprolina, Antibodies-online GmbH, Aquisgrán, Alemania). Se obtuvo un producto colorimétrico proporcional a la hidroxiprolina presente en la muestra y posteriormente se leyó en un espectrofotómetro a la longitud de onda de 560 nm, de acuerdo con las instrucciones del fabricante. Los resultados se expresaron como microgramos de hidroxiprolina por miligramo de placenta.
Evaluación histológica cualitativa del colágeno
Las muestras de placenta conservadas en el 4 % de formaldehído se deshidrataron en concentraciones crecientes de etanol (70, 80, 95 y 100 %) y en xilol, y luego se procesaron para obtener bloques de parafina. Las secciones histológicas (4 μm de grosor) de cada sitio elegido de la placenta (cuerno de gravedad, cuerno no de gravedad, cuerpo) se tiñeron con Picrosirius Red (PSR). La evaluación de las muestras manchadas de PSR se realizó utilizando una cámara (TIS 2MP RGB) acoplada a un microscopio vertical de campo ancho (Olympus BX51, Olympus Corporation, Tokio, Japón) en un aumento de 100x, bajo un haz de luz polarizado. De cada diapositiva teñida con PSR, se obtuvieron al azar 10 imágenes de cada porción (A, B y C) observadas en un campo oscuro. Además, para identificar las estructuras fotografiadas, también se tomaron duplicados de esas fotografías tomadas bajo luz polarizada en campo brillante. Dado que la mancha de PSR es particularmente útil para representar la organización y/o la orientación de la fibra de colágeno en varios tejidos conectivos en condiciones normales o patológicas (34), este método se utilizó para evaluar el colágeno en la placenta de la yegua.
Medición del grosor del tejido conectivo de la placa coriónica
El grosor del tejido conectivo de la placa coriónica en el cuerno gravid de las placentas de las yeguas se evaluó en secciones histológicas de 4 μm, teñidas con hematoxilina-eosina (05-06014E; Bio-Optica; eosina HT1103128; Sigma-Aldrich, Saint Louis, Missouri Se seleccionaron al azar dos fotografías de la placa coriónica de los cuernos gravid de cada placenta. Más tarde, se realizaron 10 mediciones de cada fotografía utilizando el programa ImageJ (Instituto Nacional de Salud, EE. UU.), que es un software de código abierto para procesar y analizar imágenes científicas. Una vez que se recogieron las 20 mediciones de cada placenta, se sometieron a un análisis estadístico.
Densidad microvascular
De cada porción de la placenta (cuerno de gravedad, cuerno no gravitado y cuerpo) conservada en bloques de parafina, se recuperaron 4 secciones de tejido histológico de μ de grosor y se tiñeron con reactivo de Shiff ácido periódico (PAS; VWR Chemicals, ref. 20593.151, Lovaina, Bélgica). Esta mancha se ha utilizado en gran medida como marcador de las células endoteliales, ya que reacciona fuertemente con los carbohidratos presentes en la membrana basal microvascular (35). En este estudio, las paredes de los vasos sanguíneos se consideraron por igual, independientemente de su naturaleza (arteriollos, venules o capilares) (28). Las diapositivas histológicas se observaron bajo microscopía de luz y se fotografiaron con una ampliación total de 100x, para un mayor análisis del programa imageJ. Se determinó el número de vasos y áreas microvasculares en 10 campos de microscopio elegidos al azar de cada porción de las placentas. El porcentaje del área ocupada por los vasos sanguíneos, con respecto a toda el área de la micrografía, se consideró como el área vascular y se calculó para los 10 campos microscópicos, a partir de cada porción de cada placenta. En las mismas áreas de micrografía, también se contó el número de recipientes presentes. Los valores medios del área vascular total y el número total de vasos sanguíneos para cada región de la placenta se consideraron más para el análisis estadístico (28, 36).
Análisis estadístico
El análisis estadístico se realizó utilizando los programas GraphPad Prism (versión 8.4.3), Statistica 7 y SAS (SAS 9.4 Institute Inc., Cary, NC, EE. UU.). En un primer enfoque y después de comprobar la distribución normal de las variables con la prueba Shapiro-Wilk, la transcripción de ARNm COL1, COL1A2, COL3A1 y COL5A1, la cuantificación de la hidroxiprolina y el grosor de la placa coriónica se analizaron mediante ANOVA unidireccional, seguida de la prueba de la diferencia Para evaluar la relación entre el peso del foal recién nacido y el peso de la placenta o la edad de la yegua, se calcularon los coeficientes de correlación de Pearson, seguidos de un análisis de regresión lineal. Para evaluar los efectos de la edad (grupos de yeguas jóvenes frente a mayores), la ubicación del muestreo placentario (A, B y C) y su interacción en las variables, se utilizó un modelo mixto (procedimiento MIXTO de SAS). La duración de la gestación y la paridad se utilizaron en este análisis como covariable, y también se probó el sexo del potro. Cuando se detectaron diferencias significativas, las diferencias entre las medias se evaluaron utilizando la prueba Tukey-Kramer. El nivel de significación se definió como p < 0,05. Los datos se muestran como media ± SEM.
Resultados
Datos de animales
La duración de los embarazos que resultaron en los foalings de los que se recuperaron las placentas fue de 324 días (mínimo) hasta 352 días (337,2 ± 2,3 días). Los pesos de la placenta variaron entre 3 y 7,5 kg (5,5 ± 0,3 kg), y aumentaron con el envejecimiento de las yeguas (p < 0,001). El peso del potro a las 24 horas después del potro oscilaba entre 35 y 59,5 kg (50,8 ± 1,8 kg). Los potros más pesados nacieron de yeguas mayores (p < 0,0001), que también tenían más paridades (p < 0,0001), y gestaciones más largas (p < 0,01). Al considerar las yeguas, según su grupo de edad, los datos se presentan en la Tabla 2. Hubo una correlación positiva entre el peso de la placenta y el peso del potro (r = 0,728; p = 0,001; Figura 2A); entre la edad de la yegua y el peso de la placenta (r = 0,760; p = 0,0006; Figura 2B); y la edad de la yegua y el peso del potro (r = 0,659 La evaluación de la relación entre el peso de la placenta y el peso de la sefo, mostró una proporción más alta en las yeguas mayores en comparación con las yeguas más jóvenes (0,114 ± 0,003 frente a 0,099 ± 0,003; p < 0,001).
 TABLA 2. Edad, paridad, duración de la gestación, peso de la placenta (kg) y peso del foal (kg) a las 24 horas después de la gestación, en los dos grupos de yeguas (media ± SEM).
TABLA 2. Edad, paridad, duración de la gestación, peso de la placenta (kg) y peso del foal (kg) a las 24 horas después de la gestación, en los dos grupos de yeguas (media ± SEM).
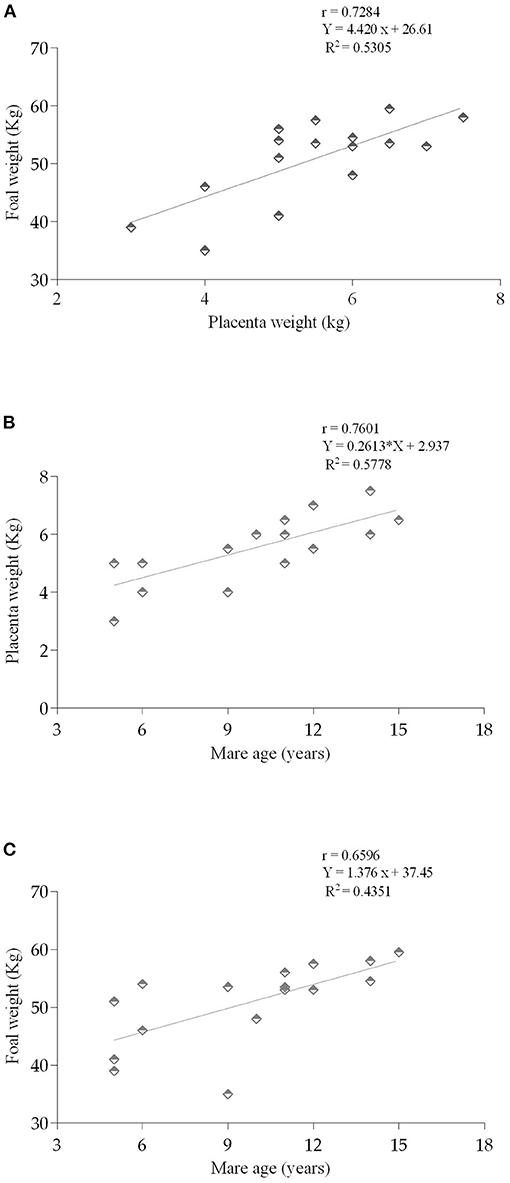 FIGURA 2. Relación entre el peso (A) de la placenta (kg) y el peso del foal a 24h (kg) (p = 0,0014); (B) edad de las yeguas (años) y el peso de la placenta (p = 0,0006); y (C) la edad de las yedas y el peso del potro (kg) (p = 0,0054) correlación de Pearson (r). Radura lineal (R2).
FIGURA 2. Relación entre el peso (A) de la placenta (kg) y el peso del foal a 24h (kg) (p = 0,0014); (B) edad de las yeguas (años) y el peso de la placenta (p = 0,0006); y (C) la edad de las yedas y el peso del potro (kg) (p = 0,0054) correlación de Pearson (r). Radura lineal (R2).
Reacción cuantitativa en cadena de la polimerasa en tiempo real
En la placenta de las yeguas mayores, cuando se hizo una comparación con las mismas regiones placentaria de las yeguas más jóvenes, los niveles de transcripción de ARNm COL1A1 eran más altos en el cuerno de la sarroda (porción A) (p = 0,01), y entre el cuerno no grave (porción B), o entre el cuerpo de la placenta Además, la transcripción de COL1A1 en el cuerno grave de las yeguas más viejas también se aumentó, en comparación con el cuerno no grave y el cuerpo de las mismas placentas (p < 0,05; Figura 3A). Cuando se utilizaron la duración y la paridad de la gestación como covariables, no se observaron efectos significativos.
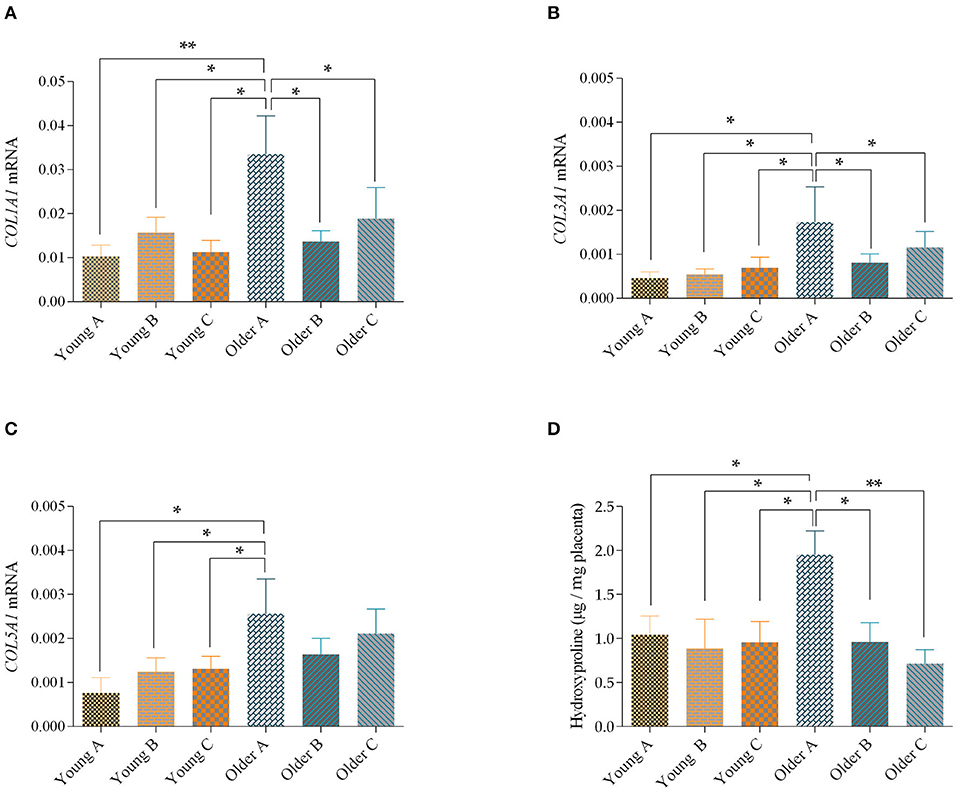 FIGURA 3. Niveles de transcripción de COL1A1 (A), COL3A1(B) y COL5A1 (C) y niveles de hidroxiprolina(D) en el cuerno grave (A), cuerno no grave (B) y el cuerpo (C) de placentas de yeguas jóvenes y mayores. Las barras representan la media ± SEM. Los asteriscos indican diferencias significativas entre las porciones placentares (*p < 0,05; **p < 0,01). Los datos se analizaron mediante ANOVA unidireccional, seguido de la prueba de LSD de Fisher.
FIGURA 3. Niveles de transcripción de COL1A1 (A), COL3A1(B) y COL5A1 (C) y niveles de hidroxiprolina(D) en el cuerno grave (A), cuerno no grave (B) y el cuerpo (C) de placentas de yeguas jóvenes y mayores. Las barras representan la media ± SEM. Los asteriscos indican diferencias significativas entre las porciones placentares (*p < 0,05; **p < 0,01). Los datos se analizaron mediante ANOVA unidireccional, seguido de la prueba de LSD de Fisher.
Aunque no se encontraron diferencias en los niveles de ARNm de COL1A2 para comparaciones directas entre las porciones placentales de yeguas jóvenes y mayores, se observó un efecto significativo de la edad, con niveles más altos de transcripciones de COL1A2 en yeguas mayores (p < 0,05). Cuando usamos la duración y la paridad de la gestación como covariables, no se observaron efectos significativos.
En cuanto a los niveles de ARNm de COL3A1, que eran similares a los de COLA1, aumentaron en el cuerno grave de las placentas de las yeguas mayores, en comparación con la misma porción en las yeguas más jóvenes (p < 0,05). Además, el cuerno grave de las placentas de las yeguas mayores tenía el nivel más alto de transcripción de COL3A1, en comparación con las porciones B y C de la misma placenta (p < 0,05; Figura 3B). Cuando se utilizó la duración de la gestación como covariable, hubo un efecto significativo de la edad, con yedas mayores mostrando niveles más altos de ARNm de COL3A1 en sus placentas que las yeguas más jóvenes (p < 0,01).
Además, cuando se evaluaron los niveles de transcripciones de COL5A1 en las diferentes porciones de la placenta, se observó un aumento en los niveles de ARNm en el cuerno de la grava de las yeguas mayores, en comparación con cualquier porción de la placenta de las yeguas más jóvenes, (p < 0,05; Figura 3C). Hubo un efecto significativo de la edad (odas jóvenes vs. Yeguas más antiguas) sobre este parámetro (p < 0,05). Además, para este parámetro, no se observaron efectos significativos cuando se utilizaron la duración de la gestación y la paridad como covariables.
El sexo con un deligo no tuvo efectos en los niveles de transcripción de COL1A1, COL1A2, COL3A1 o COL5A1.
Concentración de hidroxiprolina
De acuerdo con el aumento de las transcripciones de COL1A1, COL3A1 y COL5A1 obtenidas por qPCR, hubo un aumento en el aminoácido hidroxiprolina en el cuerno embarazada de las yeguas mayores, en relación con el cuerno no gravitativo (p < 0,05), y en el cuerpo placentario (p < 0,01) de las mismas placenta Además, los niveles de hidroxiprolina en la placenta no se vieron influenciados por la duración de la gestación ni por el sexo del potro.
Evaluación histológica cualitativa del colágeno en la placenta de Mare
La observación histológica de la placenta de la yegua, bajo un campo brillante y bajo un rayo de luz polarizado, mostró la presencia de colágeno principalmente en la placa de corola y el tejido conectivo alantoico. La evaluación cualitativa sugiere que una mayor abundancia de fibras podría estar presente en el tejido conectivo de la placa coriónica del cuerno de la grava en todas las yeguas (Figuras 4A, B). En cuanto al tejido conectivo alantoico, las fibras de colágeno también parecen predominar en grandes cantidades (Figuras 4A,B). Siempre que el espacio exocelomico estaba presente, las fibras de colágeno lo rodeaban, dentro de la fina capa interna de tejido conectivo adherido al epitelio de la superficie alantoica, más internamente (Figuras 4C,D), y en el tejido conectivo alantoico asociado a la placa coriónica, externamente (Figuras 4C,D). Muy pocas fibras de colágeno estaban presentes en el tejido conectivo del eje de las vellosidades, aunque en el cuerno grave parecían ser más abundantes (Figuras 4E, F). La observación histológica cualitativa de las placentas de las yeguas sugirió que había más colágeno presente en el cuerno de la grava, con respecto al cuerno no grave y el cuerpo de la placenta, independientemente de la edad de las yeguas.
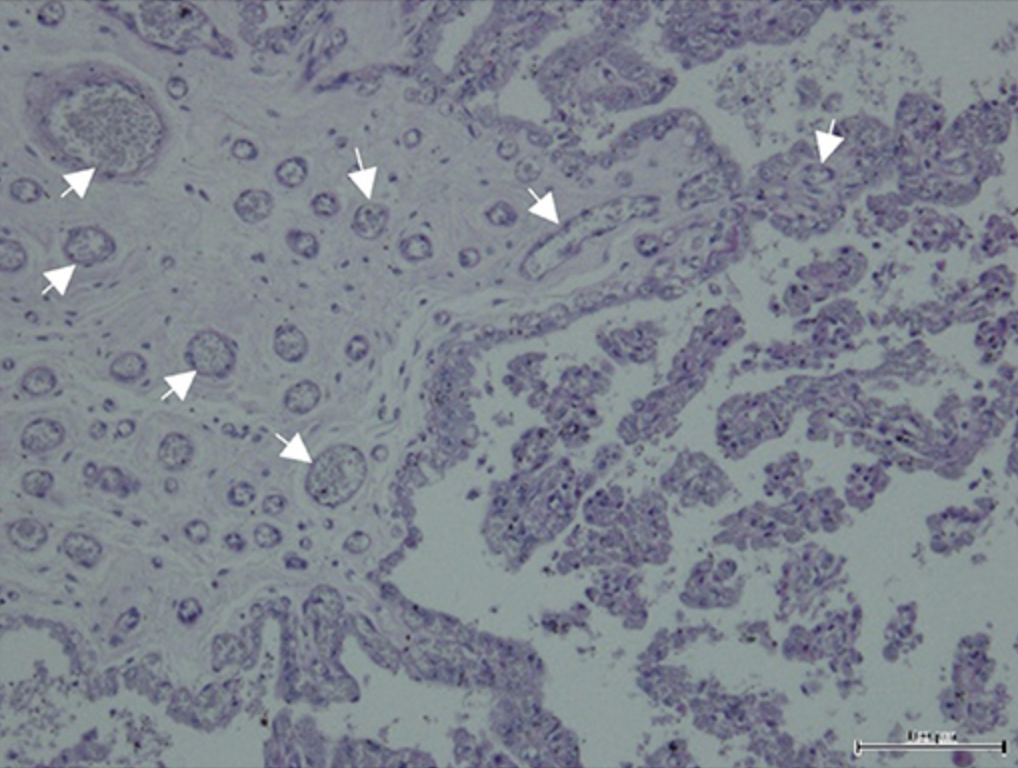
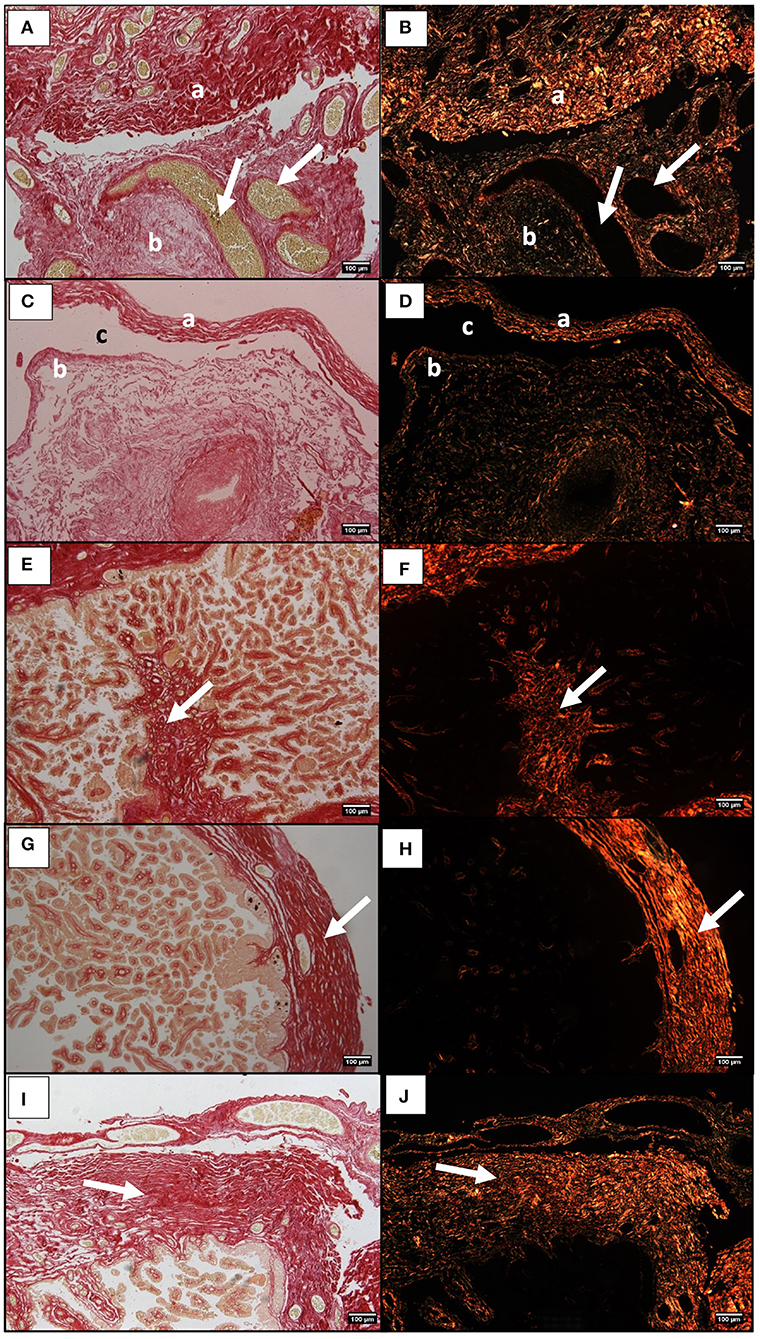 FIGURA 4. Secciones histológicas del cuerno embarazada de la placenta equina teñidas con Picrosirius Red y visualizadas en campo brillante (A,C,E) y bajo luz polarizada (B,D,F). Los colores rojo y verde reflejan la orientación de los paquetes de colágeno. (A,B) Tejido conectivo de placa coriónica (a) y tejido conectivo de membrana alantoica (b). Las flechas blancas indican los vasos sanguíneos. (C,D) Tejido conectivo adherente al epitelio alantoico (a), y en la parte externa de la membrana coriónica (b), junto al espacio extracelomico (c). (E,F) fibras de colágeno en el tejido conectivo de las vellosidades (flecha blanca). (G, H) Tejido conectivo de placa coriónica en el cuerno embarazada, de una placenta de una yegua joven (flecha blanca). (I,J) Tejido conectivo de placa coriónica en el cuerno embarazada, de una placenta de una yegua mayor (flecha blanca).
FIGURA 4. Secciones histológicas del cuerno embarazada de la placenta equina teñidas con Picrosirius Red y visualizadas en campo brillante (A,C,E) y bajo luz polarizada (B,D,F). Los colores rojo y verde reflejan la orientación de los paquetes de colágeno. (A,B) Tejido conectivo de placa coriónica (a) y tejido conectivo de membrana alantoica (b). Las flechas blancas indican los vasos sanguíneos. (C,D) Tejido conectivo adherente al epitelio alantoico (a), y en la parte externa de la membrana coriónica (b), junto al espacio extracelomico (c). (E,F) fibras de colágeno en el tejido conectivo de las vellosidades (flecha blanca). (G, H) Tejido conectivo de placa coriónica en el cuerno embarazada, de una placenta de una yegua joven (flecha blanca). (I,J) Tejido conectivo de placa coriónica en el cuerno embarazada, de una placenta de una yegua mayor (flecha blanca).
Espesor del tejido conectivo de la placa coriónica
La observación cualitativa de las fibras de colágeno teñidas por PSR en las placentas de las yeguas no reveló ningún cambio evidente entre las placentas de las yeguas jóvenes y mayores que pudiera explicar el aumento observado en el ARNm COL1 y COL3A1, evidenciado por qPCR, y por la hidroxiprolina en el cuerno grave de las yeguas mayores Por lo tanto, era necesario medir el grosor del tejido conectivo de la placa coriónica en el cuerno grave de todas las placentas. Nuestros resultados indican un aumento significativo en el grosor del tejido conectivo de la placa coriónica en el cuerno grave de las yeguas más antiguas (14,1 ± 42,1 μm), en comparación con la misma estructura en las placentas de las yeguas más jóvenes (401 ± 47,7 μm; p < 0,05),
Además, la duración de la gestación se correlacionó positivamente con el grosor de la placa coriónica (r = 0,525; p < 0,05), lo que significa que las gestaciones más largas aumentaron el grosor de la placa coriónica. Las yeguas que foalaba a un potro macho tendían a tener una placa coriónica más gruesa (p = 0,08).
Evaluación cuantitativa de la densidad microvascular
Las paredes de los vasos sanguíneos se mancharon mediante un desplazamiento periódico del ácido, como se muestra en la Figura 5A. El área microvascular en el cuerno grave de la placenta era más grande en las yeguas más antiguas que en las yeguas más jóvenes (p < 0,05; Figura 5B). Además, en las yeguas más viejas, el área vascular del cuerno gravid se incrementó con respecto al cuerno no gravid (p < 0,01) y al cuerpo de la placenta (p < 0,05; Figura 5B). Sin embargo, el área vascular de la placenta de las yeguas jóvenes era idéntica en todas las partes evaluadas de este órgano (Figura 5B). Además del aumento observado en el área vascular en el cuerno grave de las placentas de las yeguas más antiguas, el número de vasos por campo microscópico también fue mayor en esa región, en comparación con las otras porciones de la placenta (p < 0,001; Figura 5C). Las placentas de las yeguas mayores presentaban áreas vasculares más grandes que las placentas de las yeguas más jóvenes (p < 0,05). La longitud de la gestación y el sexo del potro no influyeon en el área vascular. Sin embargo, hubo un efecto de paridad en el área vascular del cuerno de la gravedad (p < 0,05) con yeguas que tenían un mayor número de partos que presentaban un mayor área vascular.
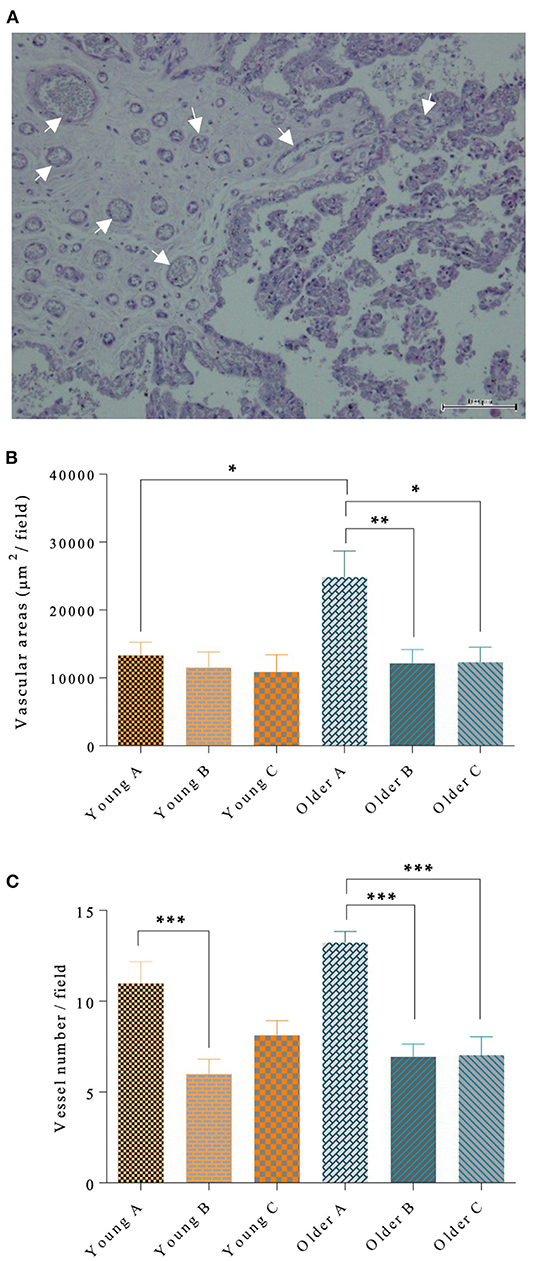 FIGURA 5. Paredes de los vasos sanguíneos teñidas por PAS (algunas marcadas con flechas), en la placenta de la yegua (A). En (A), barra = 100 μm. En la mitad izquierda de la imagen, se muestra el corion, con la placa coriónica que encierra los vasos, y el tropoblasto (epitelio cuboidal simple cuyas células poseen un citoplasma basófilo) alinea la placa coriónica. En la mitad derecha, se pueden ver las víboras coriónicas, cubiertas externamente por trofoblastos y con el eje compuesto por tejido conectivo. En víboras de mayor diámetro, se observan vasos finos. El área vascular por μm2 (B) y el número de vasos por campo (C) se muestran en las diferentes porciones de la placenta en el cuerno embarazada (A), el cuerno no embarazada (B) y el cuerpo (C) de las placentas de las yeguas jóvenes y mayores. En (B) y (C), las barras representan la media ± SEM. Los datos se analizaron mediante ANOVA unidireccional, seguido de la prueba de LSD de Fisher. Los asteriscos indican diferencias significativas entre las porciones placentales (*p < 0,05; **p < 0,01; ***p < 0,001).
FIGURA 5. Paredes de los vasos sanguíneos teñidas por PAS (algunas marcadas con flechas), en la placenta de la yegua (A). En (A), barra = 100 μm. En la mitad izquierda de la imagen, se muestra el corion, con la placa coriónica que encierra los vasos, y el tropoblasto (epitelio cuboidal simple cuyas células poseen un citoplasma basófilo) alinea la placa coriónica. En la mitad derecha, se pueden ver las víboras coriónicas, cubiertas externamente por trofoblastos y con el eje compuesto por tejido conectivo. En víboras de mayor diámetro, se observan vasos finos. El área vascular por μm2 (B) y el número de vasos por campo (C) se muestran en las diferentes porciones de la placenta en el cuerno embarazada (A), el cuerno no embarazada (B) y el cuerpo (C) de las placentas de las yeguas jóvenes y mayores. En (B) y (C), las barras representan la media ± SEM. Los datos se analizaron mediante ANOVA unidireccional, seguido de la prueba de LSD de Fisher. Los asteriscos indican diferencias significativas entre las porciones placentales (*p < 0,05; **p < 0,01; ***p < 0,001).
En las yeguas más jóvenes hubo un aumento en el recuento de vasos en la trompa embarazada, en comparación con la trompa no embarazada (p < 0,001; Figura 5C). La longitud de la gestación y el sexo del potro no influyeran en el recuento de vasos. Pero, de manera similar a los resultados obtenidos para el área vascular, la paridad tuvo un efecto en el número de vasos sanguíneos del cuerno grave (p < 0,0001), independientemente de la edad de la yegua.
Discusión
Estudios anteriores han tratado principalmente la histología de la placenta de la yegua y los patrones de proliferación celular durante el desarrollo (37-39). A pesar de que se han descrito los aspectos estructurales y hemovasculares del crecimiento placentario durante toda la gestación en yeguas jóvenes y envejecidas (13), no se ha evaluado el contenido de colágeno a nivel histológico y molecular. Por lo tanto, a nuestro leal saber y entender, este es el primer estudio que cuantifica las fibras de colágeno y la microvascularización en la placenta equina, relacionándolas con las diferentes partes de la placenta, la edad de la yegua, la placenta y el peso de los potros.
En el presente estudio, los potros más pesados al nacieron al nacer de yeguas más viejas, con más paridades, que también dieron placentas más pesadas y tenían longitudes de gestación más largas. Hubo una correlación positiva entre el peso del potro y el peso de la placenta, así como entre el peso del potro y la edad de la yegua. La correlación positiva entre el peso total de las membranas fetales y el peso del potro al nacer observado en el presente trabajo, se ha demostrado anteriormente para los pura sangre (40) y las yeguas Lusitano (41). De hecho, en Thoroughbreds, por cada kg de aumento en el peso placentario, hubo un aumento de 4,5 kg en el peso del potro (40). En la yegua, el peso de la placenta aumenta progresivamente con la paridad, el tamaño materno y afecta directamente al área de la superficie y la función del transporte de la placenta, así como a las glándulas endocrinas fetales que median el desarrollo fetal hacia el término (42-45). Además, el peso placentario equino aumenta en los meses de partos de abril y mayo, en comparación con los partos anteriores del año (46). Dado que todos los partos de las yeguas en el presente estudio se produjeron en abril y mayo, los cambios en el peso de la placenta pueden estar relacionados con la edad de las yeguas, las paridades, la duración de la gestación o el peso de los potros, pero no con ningún efecto estacional.
Los niveles de transcripción de ARNm mostraron un aumento en COL1A1, COL3A1 y COL5A1 en el cuerno embarazada de la placenta de las yeguas mayores. Este aumento en la transcripción del colágeno se confirmó por el contenido de hidroxiprolina (al colágeno total) en los tejidos de la placenta. De hecho, la regulación posttranscripcional, post-traduccional y de degradación contribuye a la concentración de proteínas en el tejido (32). En la placenta humana, el colágeno cambia su composición durante el desarrollo de la placenta y el envejecimiento, a medida que avanza el embarazo, para proporcionar nutrientes al feto y mantener el embarazo (47).
La observación histológica del colágeno en secciones de la placenta equina teñidas con PSR y observadas bajo luz polarizada permitió la visualización de esas fibras en las diferentes estructuras. En el tejido conectivo, las fibras de colágeno tipo I se agrupan densamente en haces, desempeñando un papel estructural y promoviendo la conexión entre las estructuras. Las fibras reticulares, formadas predominantemente por el colágeno tipo III, se distribuyen finamente en forma de red, desempeñando un papel de apoyo (33). En el endometrio de la yegua teñido de rojo picrosirio observado bajo un haz de luz polarizado, las fibras teñidas en rojo se identificaron como COL1, mientras que las fibras teñidas de verde se consideraron COL3 (48). Sin embargo, como han revisado otros autores, se ha demostrado que este método no es capaz de distinguir los tipos de colágeno, ya que las diferencias de color bajo la luz polarizada están simplemente relacionadas con la orientación de los paquetes de colágeno y no con el tipo de colágeno, lo que hace que dicha interpretación sea obsoleta (34). Los colores polarizados no se deben a ninguna reacción química de los componentes de la mancha roja de Picrosirius que permitiría diferenciar los tipos de colágeno por el tinte, sino que solo representan el grosor y el embalaje de la fibra (49, 50). Por lo tanto, dado que este es un método particularmente útil para revelar la organización y/o heterogeneidad de la orientación de la fibra de colágeno en diferentes tejidos conectivos en tejidos normales o patológicos (34), esta mancha se utilizó para evaluar el colágeno en la placenta de la yegua. En el presente estudio, las fibras de colágeno se representaron en diferentes lugares dependiendo de la estructura histológica del corioallantoico equino. De hecho, en todas las placentas de las yeguas predominaron las fibras de colágeno en la placa coriónica y en la membrana alantoica, mientras que muy pocas se observaron en las viles coriónicas. La presencia de colágeno en el tejido conectivo de las víboras coriónicas se describió previamente en las secciones histológicas de la placenta humana (26). El aumento en el grosor del tejido conectivo de la placa coriónica, observado en el cuerno embarazada de las yeguas mayores, que también tenían gestaciones más largas, puede explicar el aumento de los niveles de ARNm de COL1A1, COL3A1 y COL5A1 y en la hidroxiprolina. Sin embargo, se necesitan más estudios para apoyar esta hipótesis.
Hemos demostrado que la deposición de colágeno y la microvascularización (área vascular y recuento de vasos), aumentaron en el cuerno grave de las placentas de las yeguas más viejas. Aunque en otras especies la fibrosis placentaria puede indicar insuficiencia placentaria y reducción del peso corporal del recién nacido, esto no se observó en el presente estudio. El aumento de la vascularización en el cuerno gravid podría haber sido una característica compensatoria para proporcionar la nutrición adecuada al feto equino. En la perra, la proporción más baja de peso de la placenta y peso del cachorro ocurre en camadas más grandes y cuando las placentas representan la densidad capilar más alta, con respecto a las camadas más pequeñas (14). En las yeguas mayores, la mayor proporción de peso de la placenta y peso del foal se asoció con más partos, y placentas que presentaban la mayor densidad vascular, lo que podría mostrar una adaptación de la placenta y una mayor eficiencia con la paridad, como se hace referencia (51). Sin embargo, en el envejecimiento de las yeguas subfértiles con cambios degenerativos en el endometrio, la eficiencia placentaria disminuye, debido al área más pequeña del intercambio placentario (18). De hecho, en las yeguas viejas con endómetrosis, las viles coriónicas fetales son más cortas y más irregulares en comparación con las yeguas jóvenes sanas de la misma edad gestacional (13). Sin embargo, nuestros datos sugieren que las yeguas fértiles mayores fueron capaces de desarrollar una placenta funcional y continuar con un embarazo exitoso a término.
En los seres humanos, cualquier cambio en el área de la superficie, la vascularización, la composición celular o el grosor de la barrera placentaria influye en su capacidad de transporte (52). Se sabe que la fibrosis puede afectar la función de un órgano al interrumpir el transporte de fluidos y electrolitos (53). Aunque los datos obtenidos en este estudio no apoyan esta hipótesis, es posible que el grado de fibrosis placentaria de las yeguas viejas influya en el peso del foal al nacer. Varios autores han documentado la aparición de cambios degenerativos en el endometrio equino con el envejecimiento (54-56) que conducen a un menor desarrollo de microcotiledóneales placentarios (18). Un estudio realizado en nuestro laboratorio mostró la aparición de fibrosis en el oviducto asociada con la endometrosis en yeguas viejas (17). Por lo tanto, surge la hipótesis de que lo mismo podría ocurrir en la estructura histológica de la placenta equina. Teniendo en cuenta el presente estudio, a medida que las yeguas envejecieron y la duración de la gestación se prolongó, las fibras de colágeno parecían aumentar en una cantidad significativa en el tejido conectivo de la placa coriónica. Se sabe que el peso del potro al nacer refleja el equilibrio entre el contacto fetal y la eficiencia placentaria (51). Sin embargo, en el presente trabajo, la deposición de colágeno en el cuerno de grava de las yeguas mayores tuvo un efecto positivo en el desarrollo de la placenta y el peso de los potros, lo que sugiere una adaptación fisiológica de la placenta para el desarrollo intrauterino del foal. Esto podría explicarse por el hecho de que las yeguas mayores utilizadas en este estudio, de 10 a 15 años, todavía no estaban en el rango de yeguas con más problemas reproductivos asociados a la endomesis (más de 15 años) y la disfunción placentaria, como se refiere otros (51, 54). Además, dado que el presente estudio solo se centra en las placentas que se han obtenido de nacimientos exitosos, no se consideraron las placentas con lesiones histológicas y/o placentas disfuncionales que posiblemente originaron abortos. Esto puede explicar por qué no hay un impacto negativo evidente del envejecimiento de la yegua en el peso del potro. Finalmente, desafortunadamente, no fue posible recoger las biopsias endometriales de las yeguas de las que se recogieron las placentas, lo que hizo imposible correlacionar el grado de endometriosis y la fibrosis presente en la placenta.
En conclusión, nuestros datos sugieren que las yeguas fértiles más viejas, con más paridades y períodos de gestación más largos, pudieron desarrollar una placenta funcional, que era más pesada, más vascularizada y con un aumento del colágeno y el grosor de la placa coriónica, lo que permitió la entrega de potros más pesados. Por lo tanto, estas características podrían representar adaptaciones morfológicas y fisiológicas de las placentas fértiles de las yeguas más antiguas. Sin embargo, se debe continuar la investigación sobre una muestra más grande de placentas equinas (incluyendo foalings y abortos exitosos), para obtener un grupo de yeguas jóvenes y otro de yeguas viejas, que envejecidas bastante separadas entre sí. También será extremadamente importante obtener las biopsias endometriales correspondientes, para entender si la fibrosis en el endometrio va acompañada de fibrosis en la placenta y su patología.
Declaración de disponibilidad de datos
Las contribuciones originales presentadas en el estudio se incluyen en el artículo/materiales complementarios, se pueden dirigir más consultas al autor/s correspondiente(s).
Contribuciones del autor
GF-D, MR y GA-P: conceptualización. ANS, AC, AT, JA-M, CF, MF, JF, MB y ES: metodología. GF-D, MR, JF, MF y GA-P: análisis formal. ANS, AC, AT, JA-M, CF, MF y MB: investigación. ANS: redacción: preparación del borrador original. GF-D y ANS: supervisión de la administración del proyecto y la adquisición de fondos. MF, MR, JF, ES, GA-P y GF-D: redacción, revisión y edición. Todos los autores han leído y aceptado la versión publicada del manuscrito.
Financiación
Esta investigación fue financiada por los proyectos UIDB/00276/2020 y F-04 -CIISA MSC Internal Project.
Conflicto de intereses
Los autores declaran que la investigación se llevó a cabo en ausencia de cualquier relación comercial o financiera que pudiera interpretarse como un posible conflicto de intereses.
Nota del editor
Todas las afirmaciones expresadas en este artículo son únicamente las de los autores y no representan necesariamente las de sus organizaciones afiliadas, o las del editor, los editores y los revisores. Cualquier producto que pueda ser evaluado en este artículo, o reclamación que pueda ser hecha por su fabricante, no está garantizado ni respaldado por el editor.
Agradecimientos
Los autores están muy agradecidos a la granja de sementales Haras de La Gesse, 31350 Boulogne-sur-Gesse, Francia, por proporcionar amablemente todas las muestras de placenta y la recopilación de datos sobre los potros y placentas recién nacidos. También queremos dar las gracias a la Sra. María do Rosário Luís, para los preparativos histológicos.
Referencias
1. Enders AC, Blankenship TN. Estructura placentaria comparativa. Adv Drug Deliv Rev. (1999) 38:3–15. doi: 10.1016/S0169-409X(99)00003-4
Resumen de PubMed | Texto completo de CrossRef | Google Scholar
2. Caixeta ES, Fagundes NS, Caixeta MS, Pyles ESS. Desenvolvimento embrionário inicial eqüino – revisão. Rev Port Ciências Veterinárias. (2008). 103:25-34.
3. McKinnon AO, Squires EL, Vaala WE, Varner DD. Reproducción Equina. Segunda edición. (2011). Ames, EE. UU.: Wiley-Blackwell.
4. Pozor M. placenta equina: perspectiva del clínico. Parte 1: placenta normal – Fisiología y evaluación.Educe de veterinarios equinos. (2016) 28:327-34. doi: 10.1111/eve.12499
5. Morresey P. (2004). Cómo realizar una evaluación de campo de la placenta equina en Resumen recuperado de los resúmenes de la 50a Convención Anual de la Asociación Americana de Practicantes Equinos. Lexington, EE. UU.: Asociación Americana de Practicantes Equinos (AAEP) (2004) p. 4−8
6. Canisso IF, Loux SC, Lima FS. Biomarcadores para la enfermedad placentaria en las yeguas.Theriogenología. (2020) 150:302–7. doi: 10.1016/j.theriogenology.2020.01.073
Resumen de PubMed | Texto completo de CrossRef | Google Scholar
7. Pirrone A, Antonelli C, Mariella J, Castagnetti C. La morfología placentaria gruesa y la bioquímica del suero del foal como predictores de la salud del foal. Theriogenología. (2014) 81:1293–9. doi: 10.1016/j.theriogenology.2014.02.011
Resumen de PubMed | Texto completo de CrossRef | Google Scholar
8. Bianco C, Pirrone A, Boldini S, Sarli G, Castagnetti C. Parámetros histomorfométricos y complejidad fractal de la placenta equina de potros sanos y enfermos. Theriogenología. (2014) 82:1106–12. doi: 10.1016/j.theriogenology.2014.07.036
Resumen de PubMed | Texto completo de CrossRef | Google Scholar
9. Barron JK. El efecto de la edad materna y la paridad en el rendimiento de las carreras de los caballos de pura sangre. Equine Vet J. (1995) 27:73–5. doi: 10.1111/j.2042-3306.1995.tb03036.x
Resumen de PubMed | Texto completo de CrossRef | Google Scholar
10. Foote AK, Ricketts SW, Whitwell KE. ¿Un comienzo de carrera en la vida? Los obstáculos de la patología feto-placental equina. Veterinario Equino J. (2012) 44:120–9. doi: 10.1111/j.2042-3306.2011.00507.x
Resumen de PubMed | Texto completo de CrossRef | Google Scholar
11. Leiser R, Dantzer V. Aspectos estructurales y funcionales de la microvasculatura placentaria porcina.Anat Embryol (Berl). (1988) 177:409-19. doi: 10.1007/BF00304738
Resumen de PubMed | Texto completo de CrossRef | Google Scholar
12. Cottrill C, Jeffers-Lo J, Ousey J, McGladdery A, Ricketts S, Silver M, et al. La placenta como determinante del bienestar fetal en embarazos equinos normales y anormales. J Reprod Suplemento Fértil. (1991) 44:591–601.
13. Abd-Elnaeim MM, Leiser R, Wilsher S, Allen WR. Aspectos estructurales y hemovasculares del crecimiento placentario durante toda la gestación en yeguas jóvenes y envejecidas. Placenta. (2006) 27:1103–13. doi: 10.1016/j.placenta.2005.11.005
Resumen de PubMed | Texto completo de CrossRef | Google Scholar
14. Sarli G, Castagnetti C, Bianco C, Ballotta G, Tura G, Caporaletti M, et al. Hallazgos histológicos de la placenta canina y densidad microvascular: ¿La base histológica de un resultado neonatal negativo?Animales (Basilea). (2021) 11:1418. doi: 10.3390/ani11051418
Resumen de PubMed | Texto completo de CrossRef | Google Scholar
15. Kenney RM, Doig PA. Biopsia endometrial equina. Terapia actual en teriogenología. Filadelfia: DA Morrow y WB Saunders Company. (1986).
16. Rebordão MR, Amaral A, Lukasik K, Szóstek-Mioduchowska A, Pinto-Bravo P, Galvão A, et al. El deterioro de la vía antifibrotica de la prostaglandina E2 puede influir en la fibrosis inducida por las trampas extracelulares de los neutrófilos en el endometrio de la yegua. Domest Anim Endocrinol.(2019) 67:1–10. doi: 10.1016/j.domaniend.2018.10.004
Resumen de PubMed | Texto completo de CrossRef | Google Scholar
17. Pinto-Bravo P, Rebordão MR, Amaral A, Fernandes C, Cuello C, Parrilla I, et al. ¿Está la endómetrosis de la yegua relacionada con la fibrosis oviducto? Pferdeheilkunde-Equine Medicine. (2018) 34:43–6. doi: 10.21836/PEM20180107
18. Bracher V, Mathias S, Allen WR. Influencia de la endometritis degenerativa crónica (endometrosis) en el desarrollo placentario en la yegua. Veterinario Equino J. (1996) 28:180–8. doi: 10.1111/j.2042-3306.1996.tb03771.x
Resumen de PubMed | Texto completo de CrossRef | Google Scholar
19. Ahmed A, Perkins J. Angiogénesis y restricción del crecimiento intrauterino. Baillieres Best Pract Res Clin Obstet Gynaecol. (2000) 14:981–98. doi: 10.1053/beog.2000.0139
Resumen de PubMed | Texto completo de CrossRef | Google Scholar
20. Hinz B, Phan SH, Thannickal VJ, Galli A, Bochaton-Piallat ML, Gabbiani G. El miofibroblasto: una función, múltiples orígenes. Soy J Pathol. (2007) 170:1807–16. doi: 10.2353/ajpath.2007.070112
Resumen de PubMed | Texto completo de CrossRef | Google Scholar
21. Weber KT. Fibrosis y cardiopatía hipertensiva. Curr Opin Cardiol. (2000) 15:264-72. doi: 10.1097/00001573-200007000-00010
Resumen de PubMed | Texto completo de CrossRef | Google Scholar
22. Van Linthout S, Miteva K, Tschöpe C. Charla cruzada entre fibroblastos y células inflamatorias. Cardiovasc Res. (2014) 102:258–69. doi: 10.1093/cvr/cvu062
Resumen de PubMed | Texto completo de CrossRef | Google Scholar
23. Wynn TA. Los mecanismos comunes y únicos regulan la fibrosis en varias enfermedades fibroproliferativas. J Clin Invest. (2007) 117:524–9. doi: 10.1172/JCI31487
Resumen de PubMed | Texto completo de CrossRef | Google Scholar
24. Wynn TA. Mecanismos celulares y moleculares de la fibrosis. J Pathol. (2008) 214:199–210. doi: 10.1002/path.2277
Resumen de PubMed | Texto completo de CrossRef | Google Scholar
25. Hirayama H. Estudios bioquímicos sobre el colágeno en la placenta humana: relación del colágeno con la construcción y función de la placenta humana. Nihon Sanka Fujinka Gakkai Zasshi. (1983) 35:2395–403.
26. Rukosuev VS, Nanaev AK, Milovanov AP. Participación de los tipos de colágeno I, III, IV, V y fibronectina en la formación de fibrosis de vellosidades en la placenta del término humano. Acta Histochem. (1990) 89:11–6. doi: 10.1016/S0065-1281(11)80308-9
Resumen de PubMed | Texto completo de CrossRef | Google Scholar
27. Pollack RN, Divon MY. Retraso intrauterino del crecimiento: definición, clasificación y etiología. Clin Obstet Gynecol. (1992) 35:99–107. doi: 10.1097/00003081-199203000-00015
Resumen de PubMed | Texto completo de CrossRef | Google Scholar
28. Pinto-Bravo P, Rebordão MR, Amaral A, Fernandes C, Galvão A, Silva E, et al. Microvascularización y expresión del factor de crecimiento de fibroblastos y del factor de crecimiento endotelial vascular y sus receptores en el oviducto de la yegua. Animales (Basilea). (2021). 11:1099. doi: 10.3390/ani11041099
Resumen de PubMed | Texto completo de CrossRef | Google Scholar
29. Dheda K, Huggett JF, Bustin SA, Johnson MA, Rook G, Zumla A. Validación de genes de limpieza para normalizar la expresión de ARN en PCR en tiempo real. Biotécnicas. (2004) 37:112–9. doi: 10.2144/04371RR03
Resumen de PubMed | Texto completo de CrossRef | Google Scholar
30. Zhao S, Fernald RD. Algoritmo integral para la reacción en cadena de la polimerasa cuantitativa en tiempo real. J Comput Biol. (2005) 12:1047-64. doi: 10.1089/cmb.2005.12.1047
Resumen de PubMed | Texto completo de CrossRef | Google Scholar
31. Rebordão MR, Amaral A, Lukasik K, Szóstek-Mioduchowska A, Pinto-Bravo P, Galvão A, et al. Los componentes de las trampas extracelulares de neutrófilos inducen la formación de colágeno in vitro en el endometrio de la madre. Theriogenología. (2018) 113:8–18. doi: 10.1016/j.theriogenology.2018.02.001
Resumen de PubMed | Texto completo de CrossRef | Google Scholar
32. Vogel C, Marcotte EM. Información sobre la regulación de la abundancia de proteínas a partir de los análisis proteómicos y transcriptómicos. Nat Rev Genet. (2012) 13:227-32. doi: 10.1038/nrg3185
Resumen de PubMed | Texto completo de CrossRef | Google Scholar
34. Lattouf R, Younes R, Lutomski D, Naaman N, Godeau G, Senni K, et al. Mancha roja de Picrosirius: una herramienta útil para evaluar las redes de colágeno en tejidos normales y patológicos. J Histochem Cytochem. (2014) 62:751–8. doi: 10.1369/0022155414545787
Resumen de PubMed | Texto completo de CrossRef | Google Scholar
35. Luna LG. Polisacáridos y mucopolisacáridos. Métodos histopatológicos y atlas de color de manchas especiales y artefactos tisulares. Gaithersburg, MD: American Histolabs Inc. (1992) p. 364–98.
36. Ferreira-Dias G, Bravo PP, Mateus L, Redmer DA, Medeiros JA. Microvascularización y actividad angiogénica del cuerpo equino lutea a lo largo del ciclo estro. Domest Anim Endocrinol. (2006) 30:247–59. doi: 10.1016/j.domaniend.2005.07.007
Resumen de PubMed | Texto completo de CrossRef | Google Scholar
37. Steven DH, Samuel CA. Anatomía de la barrera placentaria en la yegua. J Reprod Fertil. (1975) 23:579–82.
38. Samuel CA, Allen WR, Steven DH. Desarrollo ultraestructural de la placenta equina. J Reprod Fertil.(1975) 23:575–8.
39. Gerstenberg C, Allen WR, Stewart F. Patrones de proliferación celular durante el desarrollo de la placenta equina. J Reprod Fertil. (1999) 117:143–52. doi: 10.1530/jrf.0.1170143
Resumen de PubMed | Texto completo de CrossRef | Google Scholar
40. Elliott C, Morton J, Chopin J. Factores que afectan el peso al nacer del potro en caballos de pura sangre. Theriogenología. (2009) 71:683–9. doi: 10.1016/j.theriogenology.2008.09.041
Resumen de PubMed | Texto completo de CrossRef | Google Scholar
41. Teixeira AR, Leão MT, Costa AL, Maerten C, Abreu P, Bliebernicht M, et al. Evaluación biométrica y ponderada de los potros neonatales: influencia de los factores maternos Resumen recuperado del Libro de Resúmenes de la 71a Reunión Anual de la Reunión Virtual de la Federación Europea de Ciencias Animales, del 1 al 4 de diciembre. Wageningen: Wageningen Academic Publishers (2020) p. 469.
42. Allen WR, Wilsher S, Turnbull C, Stewart F, Ousey J, Rossdal PD, et al. Influencia del tamaño materno en el crecimiento placentario, fetal y postnatal en el caballo: I Desarrollo en el útero. Reproducción.(2002) 123:445–53. doi: 10.1530/rep.0.1230445
Resumen de PubMed | Texto completo de CrossRef | Google Scholar
43. Wilsher S, Allen WR. Factores que influyen en el desarrollo y la función placentaria en la yegua.Veterinario Equino J Suppl. (2012) 41:113–9. doi: 10.1111/j.2042-3306.2011.00452.x
Resumen de PubMed | Texto completo de CrossRef | Google Scholar
44. Fowden AL, Ward JW, Wooding FPB, Forhead AJ, Constancia M. Programación de la capacidad de transporte de nutrientes placentarios. J Physiol. (2006) 572:5–15. doi: 10.1113/jphysiol.2005.104141
Resumen de PubMed | Texto completo de CrossRef | Google Scholar
45. Fowden AL, Giussani DA, Forhead AJ. Desarrollo fisiológico del feto equino durante el final de la gestación. Veterinario Equino J. (2020) 52:165–73. doi: 10.1111/evj.13206
Resumen de PubMed | Texto completo de CrossRef | Google Scholar
46. Beythien E, Aurich C, Wulf M, Aurich J. Efectos de la temporada en el desarrollo placentario, fetal y neonatal en caballos. Theriogenología. (2017) 15:98–103. doi: 10.1016/j.theriogenology.2017.04.027
Resumen de PubMed | Texto completo de CrossRef | Google Scholar
47. Iwahashi M, Ooshima A, Nakano R. Aumento del nivel relativo de colágeno tipo V durante el desarrollo y el envejecimiento de la placenta. J Clin Pathol. (1996) 49:916–9. doi: 10.1136/jcp.49.11.916
Resumen de PubMed | Texto completo de CrossRef | Google Scholar
48. Lunelli D, Cirio SM, Leite SC, Camargo CE, Kozicki LE. Tipos de colágeno en relación con la expresión de los receptores de estradiol y progesterona en la fibrosis endometrial equina. Adv Biosci Biotechnol. (2013) 4:599–605. doi: 10.4236/abb.2013.44078
49. Dayan D, Hiss Y, Hirshberg A, Bubis JJ, Wolman M. ¿Los colores de polarización del colágeno teñido de rojo picrosirius están determinados solo por el diámetro de las fibras? Histoquímica. (1989) 93:27–9. doi: 10.1007/BF00266843
Resumen de PubMed | Texto completo de CrossRef | Google Scholar
50. Coleman R. Mancha roja de Picrosirius revisada. Acta Histochem. (2011) 113:231–3. doi: 10.1016/j.acthis.2010.02.002
Resumen de PubMed | Texto completo de CrossRef | Google Scholar
51. Wilsher S, Allen WR. Los efectos de la edad materna y la paridad en el desarrollo placentario y fetal en la yegua. Veterinario Equino J. (2003) 35:476–83. doi: 10.2746/042516403775600550
Resumen de PubMed | Texto completo de CrossRef | Google Scholar
52. Sibley C, Glazier J, D’Souza S. Actividad y expresión del transportador placental en relación con el crecimiento fetal. Exp Physiol. (1997) 82:389–402. doi: 10.1113/expphysiol.1997.sp004034
Resumen de PubMed | Texto completo de CrossRef | Google Scholar
53. Jellis C, Martin J, Narula J, Marwick TH. Evaluación de la fibrosis miocárdica no ischmica. J Am Coll Cardiol. (2010) 56:89–97. doi: 10.1016/j.jacc.2010.02.047
Resumen de PubMed | Texto completo de CrossRef | Google Scholar
54. Ricketts SW, Alonso S. El efecto de la edad y la paridad en el desarrollo de la enfermedad endometrial crónica equina. Veterinario Equino J. (1991) 23:189–92. doi: 10.1111/j.2042-3306.1991.tb02752.x
Resumen de PubMed | Texto completo de CrossRef | Google Scholar
55. Carnevale EM, Ginther OJ. Relaciones entre la edad y la función uterina y la eficacia reproductiva en las yeguas. Theriogenología 37(5. (1992) 1101–15. doi: 10.1016/0093-691X(92)90108-4
Resumen de PubMed | Texto completo de CrossRef | Google Scholar
Palabras clave: colágeno, fibrosis, placenta, edad, yegua, potro, microvascularización, gestación
Cita: Neto da Silva AC, Costa AL, Teixeira A, Alpoim-Moreira J, Fernandes C, Fradinho MJ, Rebordão MR, Silva E, Ferreira da Silva J, Bliebernicht M, Alexandre-Pires G y Ferreira-Dias G (2022) Colágeno y microvascularización en placentas de yguas jóvenes y mayores. Delante. Veterinario. Ciencia. 8:772658. doi: 10.3389/fvets.2021.772658
Recibido: 08 de septiembre de 2021; Aceptado: 02 de diciembre de 2021;
Publicado: 04 de enero de 2022.
Editado por:
Khalid El Allali, Instituto Agronómico y Veterinario Hassan II, Marruecos
Revisado por:
Fuller Bazer, Universidad de Texas A&M, Estados Unidos
Martin Eduardo Argañaraz, CCT CONICET Tucuman, Argentina
Hossam El-Sheikh Ali, Universidad de Mansoura, Egipto
Copyright © 2022 Neto da Silva, Costa, Teixeira, Alpoim-Moreira, Fernandes, Fradinho, Rebordão, Silva, Ferreira da Silva, Bliebernicht, Alexandre-Pires y Ferreira-Dias.
*Correspondencia: Graça Ferreira-Dias, gmlfdias@fmv.ulisboa.pt
†Estos autores han contribuido por igual a este trabajo
Descargo de responsabilidad: Todas las afirmaciones expresadas en este artículo son únicamente las de los autores y no representan necesariamente las de sus organizaciones afiliadas, o las del editor, los editores y los revisores. Cualquier producto que pueda ser evaluado en este artículo o reclamación que pueda ser hecha por su fabricante no está garantizado o respaldado por el editor.
Date de alta y recibe nuestro 👉🏼 Diario Digital AXÓN INFORMAVET ONE HEALTH
Date de alta y recibe nuestro 👉🏼 Boletín Digital de Foro Agro Ganadero
Noticias animales de compañía
Noticias animales de producción
Trabajos técnicos animales de producción
Trabajos técnicos animales de compañía