Variación del secretoma olfativo de oveja durante un efecto ram
Variación del secretoma olfativo de oveja durante un efecto ram
 Paul Cann1†
Paul Cann1†  Chrystelle Le Danvic1,2†
Chrystelle Le Danvic1,2†  Chantal Porte3
Chantal Porte3  Didier Chesneau3
Didier Chesneau3  Matthieu Keller3
Matthieu Keller3  Patricia Nagnan-Le Meillour1*
Patricia Nagnan-Le Meillour1*- 1Université de Lille, CNRS, INRAE, Glycobiologie Structurale et Fonctionnelle, UMR8576, INRAE USC 1409, Lille, Francia
- 2ELIANCE, París, Francia
- 3INRAE/CNRS/Université de Tours/IFCE, Physiologie de la Reproduction & des Comportements, UMR 7247, INRAE 0085, Nouzilly, Francia
Introducción: Bajo latitudes templadas, la reproducción en Ovis aries muestra una marcada estacionalidad, gobernada por el fotoperíodo. En condiciones naturales, la transición entre el descanso sexual y la actividad sexual en ambos sexos es inducida por la disminución de la luz del día. Mientras tanto, los olores específicos emitidos por un macho sexualmente activo son capaces de reactivar el eje gonadotrópico de las ovejas anovulatorias. Este efecto fisiológico se llama «efecto masculino», precisamente efecto de ariete en las especies ovinas. Hemos demostrado previamente que las proteínas secretadas, a saber, las proteínas de unión olfativa (OBP), contenidas en el moco nasal constituyen el secretoma olfativo (SG), cuya composición está determinada por el estado del ciclo estral de las hembras y difiere entre los períodos de descanso sexual y actividad sexual. El objetivo de este estudio fue probar la hipótesis de que la exposición al macho sexualmente activo también puede modificar la composición del secretoma olfativo de las ovejas durante un efecto masculino, así como las hormonas producidas por la reactivación del ciclo estral en el período de actividad sexual en condiciones naturales.
Métodos: Hemos establecido un nuevo protocolo no invasivo de muestreo de moco nasal y lo hemos recogido de 12 ovejas en diferentes momentos durante un efecto carnero. Se analizó la composición de su secretoma olfativo mediante proteómica, principalmente espectrometría de masas SDS-PAGE y MALDI-TOF. Como las modificaciones postraduccionales de los OBP eran un sello distintivo del período de actividad sexual de las ovejas, estábamos buscando glicosilación por Western blot y espectrometría de masas.
Resultados: La eficiencia del efecto masculino fue baja en las ovejas estimuladas, ya que solo 3 hembras mostraron niveles elevados de progesterona en la sangre. Además, la mitad de las ovejas de control (no estimuladas) fueron cicladas. Notamos un perfil de SG común en ovejas en anocelo, versus SG de las cíclicas. Un resultado muy claro e importante fue la aparición de O-GlcNAcylation, previamente detectada solo en la actividad sexual, después de solo 30 minutos de introducción del macho en el rebaño.
Discusión: Este estudio exploratorio allana el camino para nuevos experimentos con bandadas más grandes para confirmar y reforzar estos resultados, y para eventualmente explotar el moco nasal como un indicador de la receptividad de las hembras a los olores masculinos.
1. Introducción
Debido al control fotoperiódico de la reproducción, las ovejas hembras no ovulan durante el anoestro o el período de descanso sexual en latitudes templadas. Por el contrario, cuando el fotoperíodo es favorable, puede ocurrir el ciclo ovárico (1). En condiciones naturales, una reactivación del eje gonadotrópico durante la temporada de descanso sexual puede ser inducida por la presencia de un carnero sexualmente activo en un rebaño de ovejas, este efecto se conoce como efecto macho, o efecto carnero en las especies ovinas, como se describe en 1944 por Underwood et al. (2). La mayor eficiencia del efecto masculino se observa durante las etapas tempranas o tardías de la temporada de descanso sexual cuando el estado de anoestro no es demasiado profundo. Las ovejas pueden responder al efecto macho de dos maneras diferentes, caracterizadas por las mismas modalidades pero con diferentes retrasos en la reactivación del ciclo (3-5). En ambos casos, la introducción de un macho sexualmente activo en un rebaño de ovejas anoestro reactiva la pulsatilidad de la hormona luteinizante (LH) (6, 7) que aumenta con el tiempo hasta un pico de preovulación que conduce a una ovulación silenciosa (no asociada con el comportamiento del calor) dentro de los 3 días. En un primer caso, los cuerpos lúteos formados por la ovulación están secretando progesterona (P4) durante alrededor de 17 días (duración normal del ciclo) hasta que se produce una segunda ovulación, asociada esta vez con el comportamiento del calor. En el segundo caso, la luteólisis ocurre después de 4-5 días de contacto (8) y una segunda ovulación silenciosa aparece 6 días después de la primera ovulación (ciclo corto), seguida de una tercera ovulación 17 días después (23 días después de la primera ovulación), que se asocia con el comportamiento del calor. Estos dos casos conducen a dos oleadas de partos con un intervalo de 6 días (2). La aparición de cada caso depende de la profundidad del anoestro que se estima indirectamente por el número de hembras con ovulación espontánea antes de la introducción masculina. La efectividad del efecto masculino depende de muchos factores como la experiencia de la hembra (9), su edad, su estado metabólico o el nivel de comportamiento sexual del carnero (10). Las señales vocales y visuales del macho solo pueden inducir una baja pulsatilidad de LH, incapaz de conducir a una reactivación completa del eje gonadotrópico en las hembras (11, 12). Por el contrario, el olor del ariete es el factor clave. De hecho, la exposición a la lana, que es la principal fuente de olor masculino, estimula fuertemente la pulsatilidad de la LH (13, 14) que conduce a su reactivación y ovulación. Tal mezcla de moléculas capaces de modificar profundamente la fisiología femenina puede clasificarse como una feromona cebadora, según la definición de Karlson y Lüscher (15). Aunque se han identificado algunos compuestos de la supuesta mezcla feromonal involucrada en el efecto carnero (16), la identificación de todos los componentes químicos sigue siendo un desafío.
Al moverse a nivel neurobiológico, se ha explorado el circuito involucrado en el procesamiento del olor masculino. Por ejemplo, la bulbectomía olfativa (lesión tanto del sistema olfativo principal como del accesorio) así como la lesión del sistema olfativo principal induce una pérdida importante en la respuesta de las hembras al olor masculino, al contrario de la lesión del órgano vomeronasal (11, 14, 16). En cuanto a los pasos más centrales, los resultados derivados del uso de c-Fos como marcador de activación celular han dado un mapa de las vías neuronales implicadas en el efecto del vellón de carnero sobre la secreción de LH en ovejas anoestrales, confirmando el papel crítico del sistema olfativo principal. De hecho, el bulbo olfatorio principal y el núcleo cortical de la amígdala están específicamente más activados por el olor masculino que por el femenino y, por lo tanto, parecen estar involucrados principalmente en la detección y la integración del olor a carnero del vellón (14). Así, las feromonas masculinas pueden ser detectadas por el sistema olfativo principal y/o las accesorias, como se ha demostrado para varias especies [revisado en Lévy y Keller (17)]. Además del procesamiento central, se sabe muy poco sobre el papel del paso periférico del sistema olfativo en el efecto masculino.
En un trabajo anterior, hemos explorado la posibilidad de que los eventos perirreceptores del sistema olfativo, en particular las proteínas de unión olfativa (OBP) que componen el secretoma olfativo (SG) del moco nasal, también podrían estar sujetos a plasticidad entre el descanso sexual y el período de actividad sexual (18). De hecho, la variación de la SG porcina según el sexo y el estado hormonal (antes y después de la pubertad) ha sugerido un posible control hormonal de la secreción de OBP a lo largo de la vida (19). Además, se ha propuesto que el SG podría ser un fenotipo que refleje la capacidad de detección de olores y podría estar bajo control de factores endógenos como las hormonas (19). El SG está compuesto por alrededor de 30 isoformas en cerdo (19, 20), 50 en cabra y entre 20 y 30 en ovejas (18) generadas por modificaciones postraduccionales (PTM) a partir de un número reducido de secuencias primarias de OBP. Hemos demostrado que los cambios hormonales relacionados con la alternancia de los períodos de descanso sexual y actividad sexual tienen un alto impacto en la composición de la SG de ovejas y cabras (18). En la oveja, existe una complejidad creciente del secretoma en el período de actividad sexual (AS), en términos de secuencias primarias expresadas y/o en su PTM, generando más isoformas. Planteamos la hipótesis de que este mayor número de isoformas podría corresponder a una adaptación del nivel periférico del sistema olfativo para mejorar la capacidad de detección del olor masculino, ya que PTM, como la fosforilación (21) y O-GlcNAcylation, una glicosilación particular, impulsan las propiedades de unión de OBP en cerdo (22, 23). En particular, el período de actividad sexual de la oveja se caracteriza por la expresión de lipocalina salival (SAL) y O-GlcNAcilación de OBP, totalmente ausente en el período de descanso sexual (SR). Esta marcada diferencia cuestiona la influencia del olor del carnero en la composición de la EVE OS durante un efecto masculino, que induce la reactivación del eje gonadotrópico y su liberación de hormonas. Formulamos dos hipótesis para el impacto de la detección del olor masculino, que podría conducir a una SG de transición, luego a la SG de actividad sexual o a una SG específica, típica de la respuesta a la estimulación masculina. Presentamos aquí la variación del secretoma olfativo de oveja durante un efecto masculino, con especial atención a la expresión de nuevas proteínas y sus modificaciones postraduccionales.
2. Resultados y discusión
2.1. Estado fisiológico de las hembras mediante monitorización del nivel de progesterona
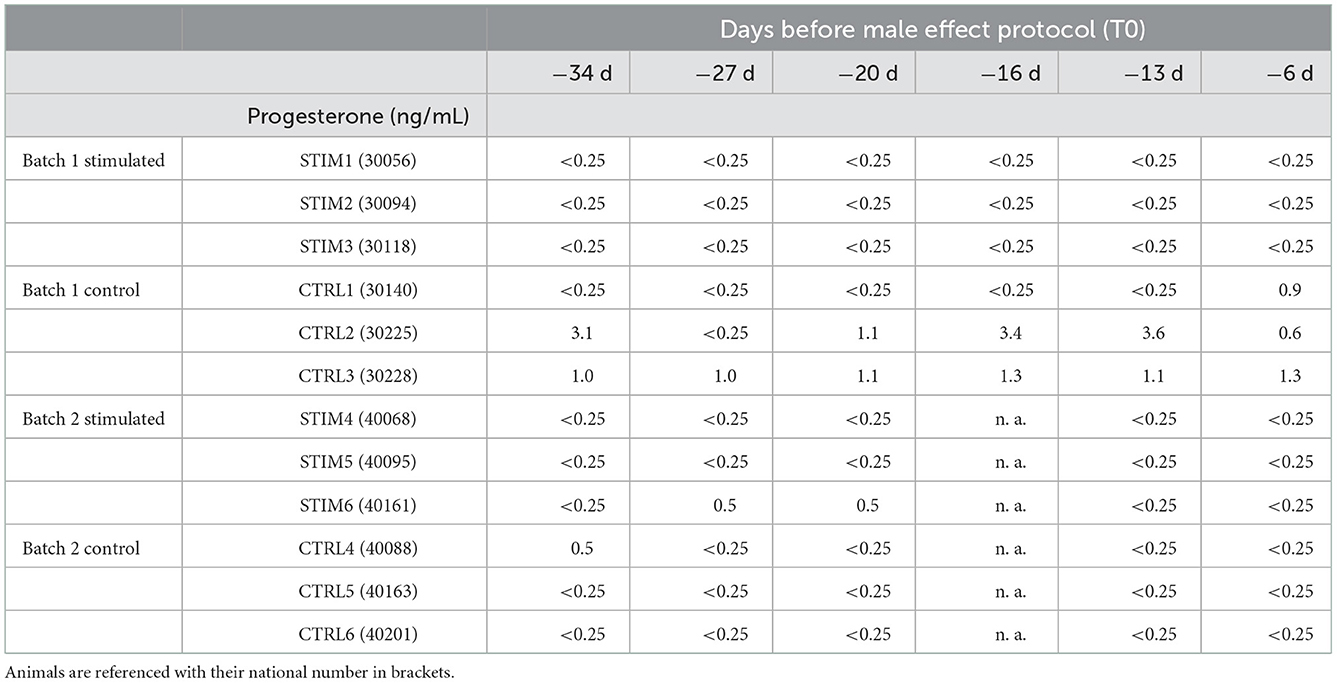
En los sistemas de cría, el efecto masculino se realiza con el fin de alargar el periodo de reproducción y una reactivación del ciclo ovárico supone que este ciclo se bloquea en el anoestro estacional. Excepto para las ovejas CTRL2 y CTRL3 que pertenecen al grupo control, se evaluó el estado del anoestro al inicio del protocolo de efecto masculino para todas las demás ovejas (Tabla 1). De hecho, su concentración de P4 estaba por debajo del umbral de detección (0,25 ng / ml) al menos 1 mes antes de la exposición al macho.
Tabla 1. Monitoreo de la concentración de progesterona en la sangre de la oveja cada semana antes de la exposición al macho.
El monitoreo de P4 durante el protocolo de efectos masculinos trajo información muy interesante sobre el estado hormonal de las mujeres. Los resultados (mostrados en la Tabla Suplementaria 1) revelaron que la mitad de las ovejas estimuladas respondieron al macho (STIM1, STIM2, STIM3 que se agruparon en el mismo lote), mientras que las ovejas STIM4, STIM5 y STIM6 del segundo lote mostraron un aumento menor del nivel de P4, lo que indica que la exposición al macho no pudo reactivar su ciclo. Curiosamente, estas 3 ovejas eran 1 año mayores que las ovejas «respondientes» del primer lote. Además, las ovejas más viejas del segundo lote control estaban en anoestro, junto con la oveja CTRL1 más joven del primer lote control (Tabla suplementaria 2). Las ovejas que no estaban en anoestro antes del protocolo (CTRL2 y CTRL3) se detectaron como cicladas. De hecho, se ha informado que, dependiendo de la raza, algunas ovejas pueden mostrar calor e incluso ovulación silenciosa durante el anoestro en abril / mayo, junto con niveles superiores a los esperados de P4 (24). Estos resultados se han enfrentado a los datos bioquímicos de la composición de SG a continuación. Como ninguna de las ovejas más viejas respondió a la exposición a los machos, hemos centrado nuestros análisis de SG por proteómica en ovejas más jóvenes (STIM1, STIM2, STIM3, CTRL1, CTRL2 y CTRL3).
2.2. Variación del perfil del secretoma olfativo según el contacto hombre-mujer
La separación de las proteínas solubles totales del moco nasal se realizó primero mediante electroforesis bidimensional (Figura suplementaria 2) para comparar los perfiles con los de los períodos de reposo sexual (RS) y actividad sexual (AS) descritos previamente en Cann et al. (1). De hecho, las ovejas STIM18, STIM1 y STIM2 del lote estimulado ya se analizaron en SA y SR. Para estas 3 hembras y las 3 ovejas control, la distribución de proteínas siguió el mismo patrón en dos cadenas de manchas proteicas a 3 y 20 kDa de masa aparente, pero la tercera cadena típica de SA (17) no apareció en ninguna de las ovejas expuestas o no al macho. Como no se destacaron diferencias por 18D-E entre hembras estimuladas y controles, o entre tiempos de muestreo para una misma hembra, realizamos el análisis de la OS de ovejas mediante SDS-PAGE (2D) unidimensional.
2.2.1. ¿Existe una expresión de nueva proteína o proteínas en respuesta a la percepción del olor masculino?
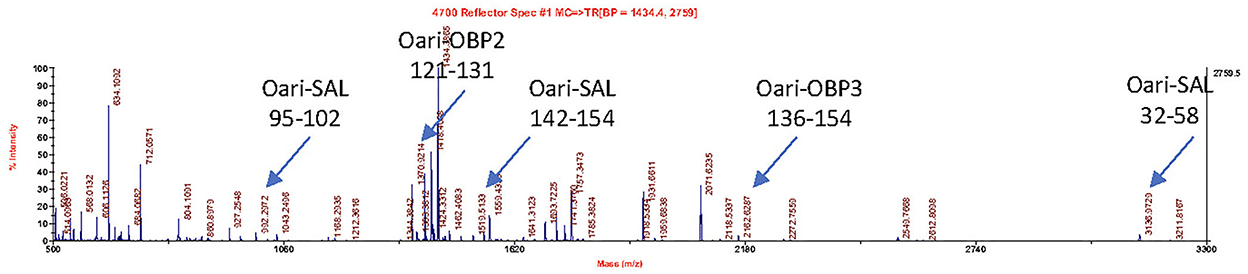
Las figuras 1, 2 resumen los resultados obtenidos para las ovejas más jóvenes, expuestas o no al macho, respectivamente. La identificación de proteínas se realizó en puntos extirpados de cada banda de geles SDS-PAGE mediante espectrometría de masas MALDI-TOF después de la digestión de tripsina (espectrometría de masas ascendente). Los resultados de MALDI-TOF MS se procesaron manualmente a partir de los cromatogramas de los espectros obtenidos, ya que esta manera es más precisa que la identificación de péptidos de la lista de picos, que no proporciona ninguna información sobre la cantidad y, por lo tanto, podría llevar a una mala interpretación de la presencia / ausencia de una proteína. La figura 3 da un ejemplo de un cromatograma de este tipo obtenido de la oveja CTRL2 en el momento del muestreo del día 7. Las masas medidas de los péptidos resultantes se compararon con las de los mapas teóricos (https://web.expasy.org/peptide_mass/) provenientes de la digestión con tripsina de los componentes principales de la SG de oveja, que son Oari-OBPs, -SAL y -VEG (Tablas suplementarias 3-14). En todas las ovejas, el sistema operativo está compuesto por secuencias Oari-OBP1 (Uniprot# W5PHM2), Oari-OBP2 (QEY02201.1), Oari-OBP3 (W5PGW3) y Oari-OBP4 (QEY02202.1), recuperadas en las bandas de 17 y 20 kDa. La cobertura de las secuencias estuvo entre 4,48 y 36,70%.
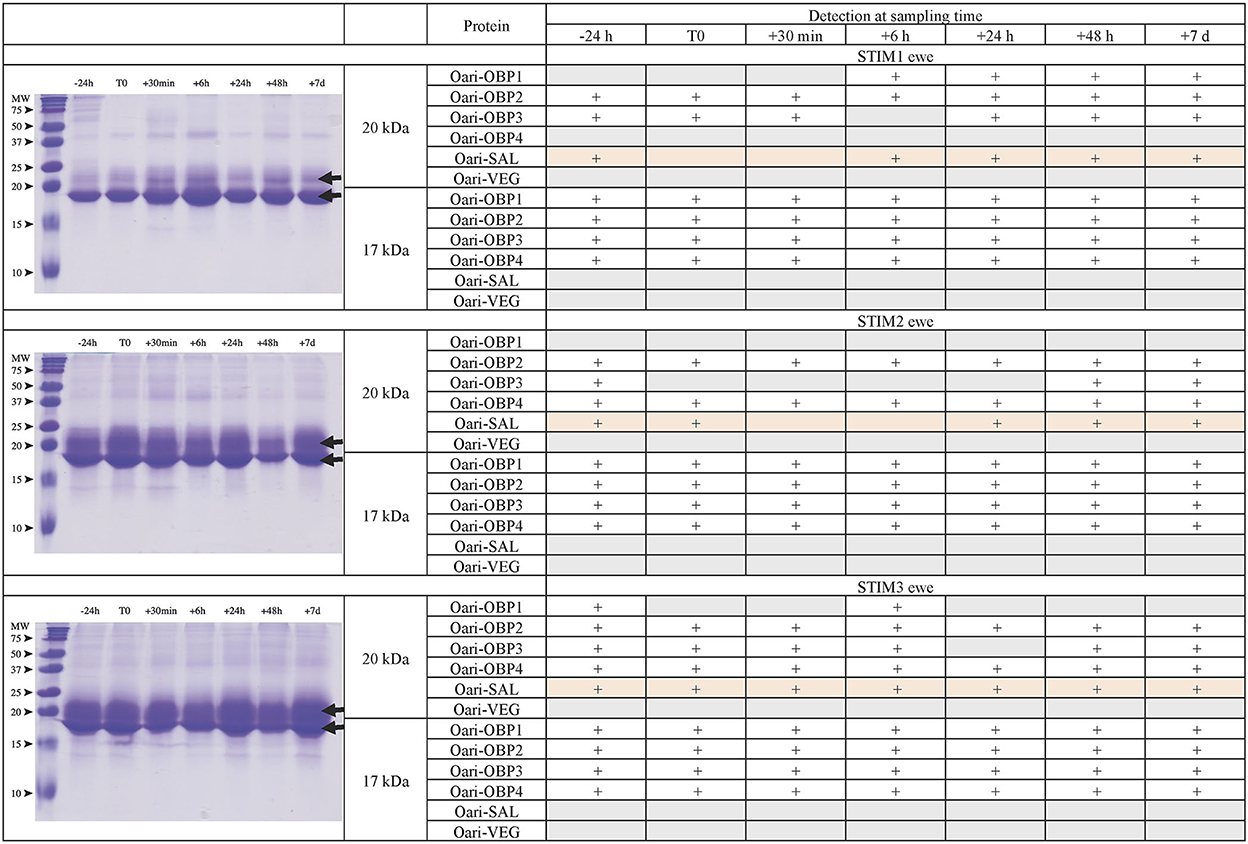 Figura 1. Análisis del secretoma olfativo de ovejas expuestas al macho. (Izquierda) Separación unidimensional (SDS-PAGE) de proteínas solubles totales extraídas del moco nasal en diferentes momentos de muestreo. Tinción azul Coomassie. Marcador de peso molecular, Precision Plus Protein Standard Dual Color (Bio-Rad). Las flechas indican las bandas migratorias de 17 y 20 kDa, cuya composición proteica fue determinada por MALDI-TOF MS y se da en tablas a la derecha.
Figura 1. Análisis del secretoma olfativo de ovejas expuestas al macho. (Izquierda) Separación unidimensional (SDS-PAGE) de proteínas solubles totales extraídas del moco nasal en diferentes momentos de muestreo. Tinción azul Coomassie. Marcador de peso molecular, Precision Plus Protein Standard Dual Color (Bio-Rad). Las flechas indican las bandas migratorias de 17 y 20 kDa, cuya composición proteica fue determinada por MALDI-TOF MS y se da en tablas a la derecha.
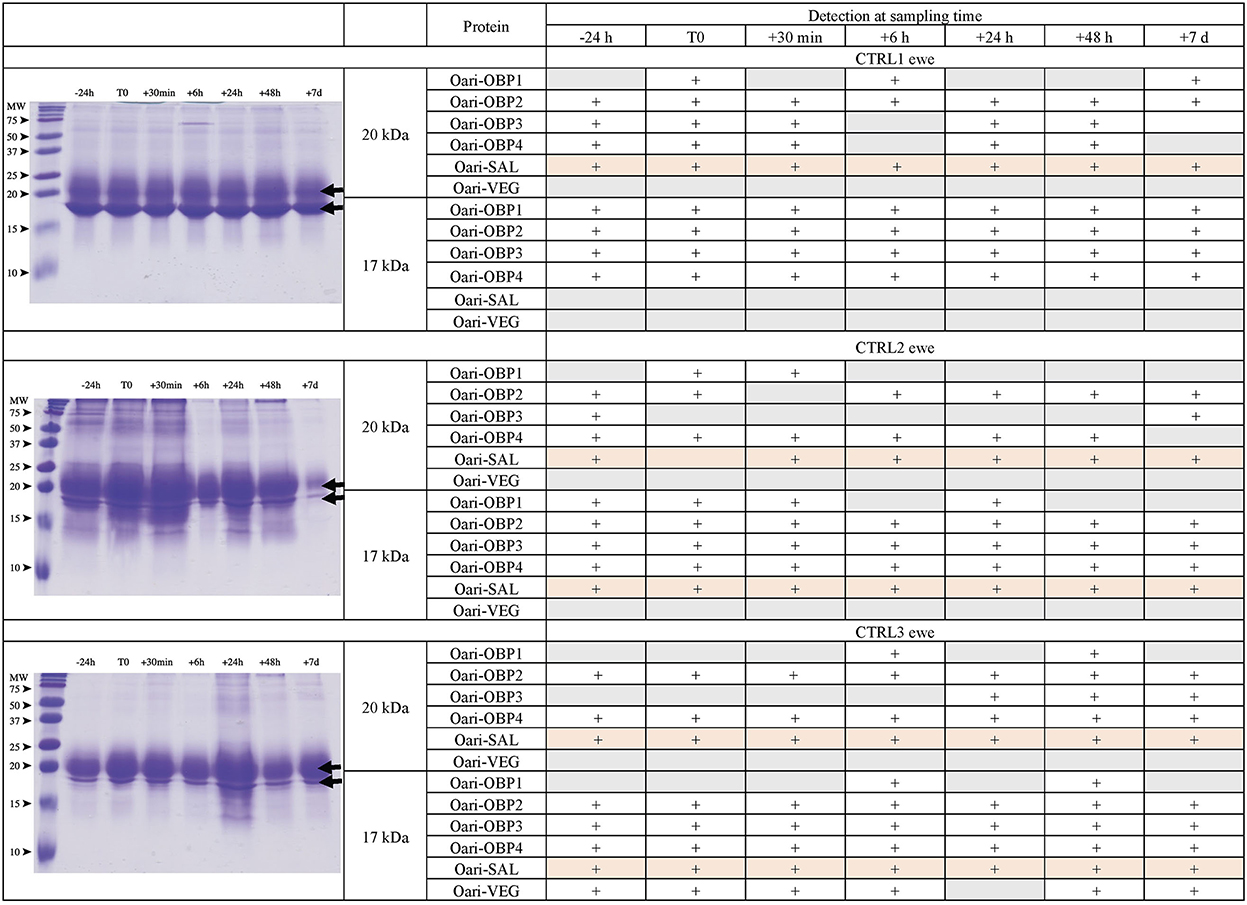 Figura 2. Análisis del secretoma olfativo de ovejas control. (Izquierda) Separación unidimensional (SDS-PAGE) de proteínas solubles totales extraídas del moco nasal en diferentes momentos de muestreo. Tinción azul Coomassie. Marcador de peso molecular, Precision Plus Protein Standard Dual Color (Bio-Rad). Las flechas indican las bandas migratorias de 17 y 20 kDa, cuya composición proteica fue determinada por MALDI-TOF MS y se da en tablas a la derecha.
Figura 2. Análisis del secretoma olfativo de ovejas control. (Izquierda) Separación unidimensional (SDS-PAGE) de proteínas solubles totales extraídas del moco nasal en diferentes momentos de muestreo. Tinción azul Coomassie. Marcador de peso molecular, Precision Plus Protein Standard Dual Color (Bio-Rad). Las flechas indican las bandas migratorias de 17 y 20 kDa, cuya composición proteica fue determinada por MALDI-TOF MS y se da en tablas a la derecha.
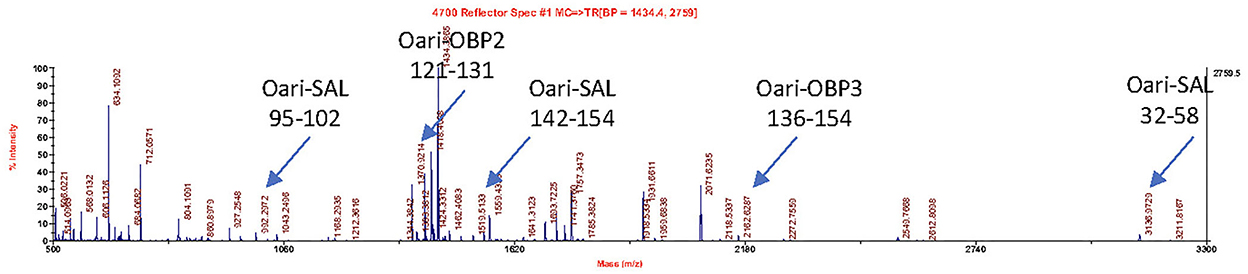 Figura 3. Espectro MALDI-TOF de péptidos resultantes de la acción de la tripsina sobre la banda de 20 kDa del secretoma olfativo de la oveja CTRL2 (tiempo de muestreo + 7 d). Las flechas indican m/z correspondientes a los péptidos Oari-OBP2, Oari-OBP3 y Oari-SAL (enumerados en la Tabla Suplementaria 12). La posición en la secuencia se indica a continuación.
Figura 3. Espectro MALDI-TOF de péptidos resultantes de la acción de la tripsina sobre la banda de 20 kDa del secretoma olfativo de la oveja CTRL2 (tiempo de muestreo + 7 d). Las flechas indican m/z correspondientes a los péptidos Oari-OBP2, Oari-OBP3 y Oari-SAL (enumerados en la Tabla Suplementaria 12). La posición en la secuencia se indica a continuación.
Curiosamente, las ovejas CTRL2 y CTRL3, que parecían cíclicas, mostraban el mismo perfil con una banda más intensa a 20 kDa que a 17 kDa. Por el contrario, las ovejas estimuladas, y la oveja CTRL1 en anocelo, mostraron una banda más intensa de 17 kDa que las de 20 kDa. Este perfil posterior parece ser típico de las ovejas anoestro, independientemente de lo que hayan estado expuestas o no al macho. De hecho, la composición de las dos bandas de proteínas también es similar en estas 4 ovejas. En particular, hay más péptidos Oari-OBP2 en la banda de 17 kDa de estas ovejas, y más Oari-OBP4 en esta banda en ovejas cicladas CTRL2 y CTRL3. El SG de ovejas estimuladas y ovejas CTRL1 también se caracteriza por la falta de péptidos Oari-SAL en la banda de 17 kDa, aunque dichos péptidos se recuperaron en la banda de 17 kDa en las ovejas CTRL2 y CTRL3 cíclicas. La presencia de SAL en ovejas anoestrus no está totalmente de acuerdo con nuestro trabajo anterior (18). De hecho, las ovejas expuestas a los machos en este trabajo fueron previamente incluidas en la comparación de SG entre SR y SA en un trabajo anterior (18). En las ovejas STIM2 y STIM3, Oari-SAL no se identificó en puntos 2D del secretoma olfativo de reposo sexual, por lo que hemos sugerido que la expresión de Oari-SAL podría ser desencadenada por hormonas en el período de actividad sexual. Para comprender mejor esta discrepancia, amplificamos secuencias similares a SAL del tejido nasal de la oveja CTRL1 en temporada para determinar los datos proteómicos y la presencia de secuencias SAL en el secretoma de la oveja. Se esperaban dos secuencias diferentes de Oari-SAL de la base de datos Ensembl del genoma de ovejas, Oari-SAL1 (W5P8W4) y Oari-SAL2 (W5P8Y1), y sus péptidos se identificaron por espectrometría de masas en el período de actividad sexual (18). Diez clones que contenían amplicones resultantes de PCR de toma de contacto revelaron 6 secuencias diferentes similares a SAL (Blastp) con mutaciones en 18 posiciones en la secuencia de proteína traducida (Figura complementaria 2). Se obtuvieron mapas teóricos de los digerros de tripsina de las seis secuencias SAL (https://web.expasy.org/peptide_mass/) para buscar péptidos discriminantes en los análisis MALDI-TOF de la SG de las ovejas. Esta diversidad, aunque interesante, complejizó la interpretación de la presencia/ausencia de SAL durante el efecto masculino. Frente a esta multiplicidad de secuencias, se planteó una pregunta sobre la precisión de la ausencia de Oari-SAL en análisis previos de RS (18). De hecho, en el momento de este trabajo previo, aún no habíamos amplificado las 6 secuencias diferentes de Oari-SAL y no las incluimos en la consulta a la búsqueda de software utilizada con datos Nano-LC-MS / MS (Mascota, Matrix Science, Londres). En el presente trabajo, se identificaron Oari-SALs con 10 péptidos de diferentes m/z, y para cada análisis, al menos uno formaba parte de la base de datos Oari-SAL1 y/o OariSAL2 de Ensebl, lo que significa que incluso sin las nuevas secuencias, se identificaría SAL. Las nuevas secuencias se depositaron en la base de datos Genbank con los números de acceso MT921827 y MT921828.
Estos datos evidenciaron diferencias entre ovejas cicladas (CTRL2 y CTRL3) y ovejas en anoestro al inicio del protocolo del efecto carnero (ovejas estimuladas y oveja CTRL1), y confirmaron el impacto del estado hormonal en el secretoma olfativo de las ovejas. Pero ningún evento particular desencadenado por la percepción del olor masculino apareció a nivel de la expresión de proteínas olfativas.
2.2.2. ¿Hay algún cambio en las modificaciones postraduccionales durante el efecto masculino?
La detección de péptidos de la misma proteína en bandas a 17 y 20 kDa denota la presencia de isoformas de estas proteínas, que podrían provenir de múltiples eventos de fosforilación (incrementos de masa de 79 Da), y/o GlcNAcylation (incrementos de masa de 203 Da), y/o N-glicosilación (múltiplo de 204 Da), explicando (1) diferencias en masas moleculares aparentes para la misma secuencia de proteínas, y (2) la ausencia de detección de péptidos potencialmente modificados, reflejada en los bajos porcentajes de cobertura de secuencia (entre 4 y 37%, Tablas suplementarias 3-14). De hecho, muchos sitios potenciales de fosforilación, O-GlcNAcilación y N-glicosilación fueron predichos por análisis in silico para OBPs del secretoma olfativo ovino (Tabla 2, detallada en la Figura Suplementaria 3), y podrían ser ocupados de manera diferente durante la vida del animal. Aunque se predijeron numerosos sitios de fosforilación para todos los Oari-OBPs, -VEG y -SAL (Tabla 2), no informamos aquí la búsqueda de fosforilación, ya que no se han detectado diferencias entre los períodos SA y SR previamente (18).
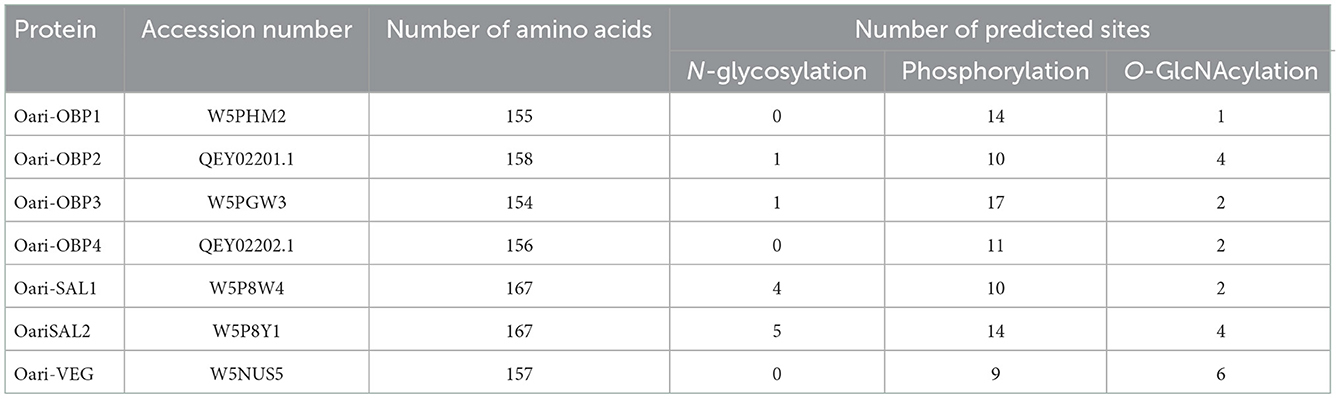 Tabla 2. Número de sitios de modificaciones postraduccionales predichas para las OBPs del secretoma olfativo de oveja.
Tabla 2. Número de sitios de modificaciones postraduccionales predichas para las OBPs del secretoma olfativo de oveja.
2.2.2.1. Análisis de la N-glicosilación de Oari-OBP y -SAL(s)
En contraste, la N-glicosilación fue descrita como una de las características distintivas de la SG de las ovejas sexualmente activas (18). Por lo tanto, el perfil de N-glicosilación de las ovejas OS incluido en este estudio se analizó mediante espectrometría de masas MALDI-TOF en modo de iones positivos de reflectrón. Después de su liberación por digestión enzimática, los N-glicanos se derivatizaron, permitiendo la metilación de los grupos hidroxilo y acetilo. La búsqueda de N-glicanos se realizó en muestras procedentes de 5 ovejas diferentes y esta elección se determinó por la cantidad de muestras restantes para cada oveja. Para la oveja de control «verdadera» CTRL1, y las ovejas STIM4 y STIM6, que no han respondido a la estimulación masculina, no se pudo detectar ninguna señal en su muestra de SG como se esperaba (datos no mostrados). Para el análisis de ovejas estimuladas STIM1 y STIM3, las muestras de SG se agruparon en cada momento de la muestra para aumentar la sensibilidad (por ejemplo, STIM1 + STIM3 a −24 h, STIM1 + STIM3 a T0, y así sucesivamente). Se detectaron algunos picos, pero sus valores m/z no coincidían con ninguna estructura de N-glicano (Figura complementaria 5). Podríamos concluir que no se indujo ninguna N-glicosilación de las proteínas OS por la exposición al olor masculino.
Mientras tanto, como los resultados de este análisis fueron cruciales para comprender el efecto de la exposición al macho en la SG de las ovejas, tuvieron que ser confirmados. Para ello, se analizaron los perfiles MALDI-TOF MS de SG de oveja CTRL2, recolectados durante el período de actividad sexual en 2017 y 2018 (año del protocolo de efecto masculino descrito aquí) en exactamente las mismas condiciones. Las estructuras mostradas en la Figura 4 fueron asignadas a partir de información composicional inferida por sus valores m/z. No se puede excluir la presencia de isómeros estructurales, ya que no se pudo realizar ningún análisis MS/MS, debido a la baja cantidad de muestra. Los espectros obtenidos demostraron ser informativos para la detección repetible de 9 y 11 glicanos durante el período de actividad sexual (SA) para el año 2018 y 2017, respectivamente (Figura 4). Excepto una estructura híbrida (m/z 1825, HexNAc3Maleficio5), se encontró que todos los N-glicanos observados eran estructuras complejas. Una serie distintiva de clúster de señales, que está relacionada por un incremento único de 204 amu, correspondiente a una diferencia hexadecimal (hexosa), se caracterizó en m/z 1907 (HexNAc5Maleficio3), 2111 (HexNAc5Maleficio4), 2315 (HexNAc5Maleficio5), 2519 (HexNAc5Maleficio6), 2723 (HexNAc5Maleficio7) y 2927 (HexNAc5Maleficio8). Otros dos complejos N-glicanos en m/z 1999 (FucHexNAc5Maleficio5) y 2285 (FucHexNAc5Maleficio4) completó el perfil. Para el año 2017, se pudieron observar dos glicanos fucosilados adicionales a m/z 2326 (FucHexNAc6Hex3) y m/z 2459 (Fuc2HexNAc5Maleficio4). La diferencia entre los 2 años podría explicarse fácilmente por un muestreo en diferentes momentos del ciclo durante el período SA, ya que no hemos seguido con precisión el ciclo estral durante este período. Por lo tanto, el muestreo podría haberse realizado en pro-celo, o estro, o di-celo. Durante los 2 años, se observaron perfiles de N-glicanos muy similares, lo que confirma que los N-glicanos parecen ser específicos del período de actividad sexual. Su presencia durante el período de SA contribuiría a la complejización del OS destacado durante este período en nuestro trabajo anterior (18).
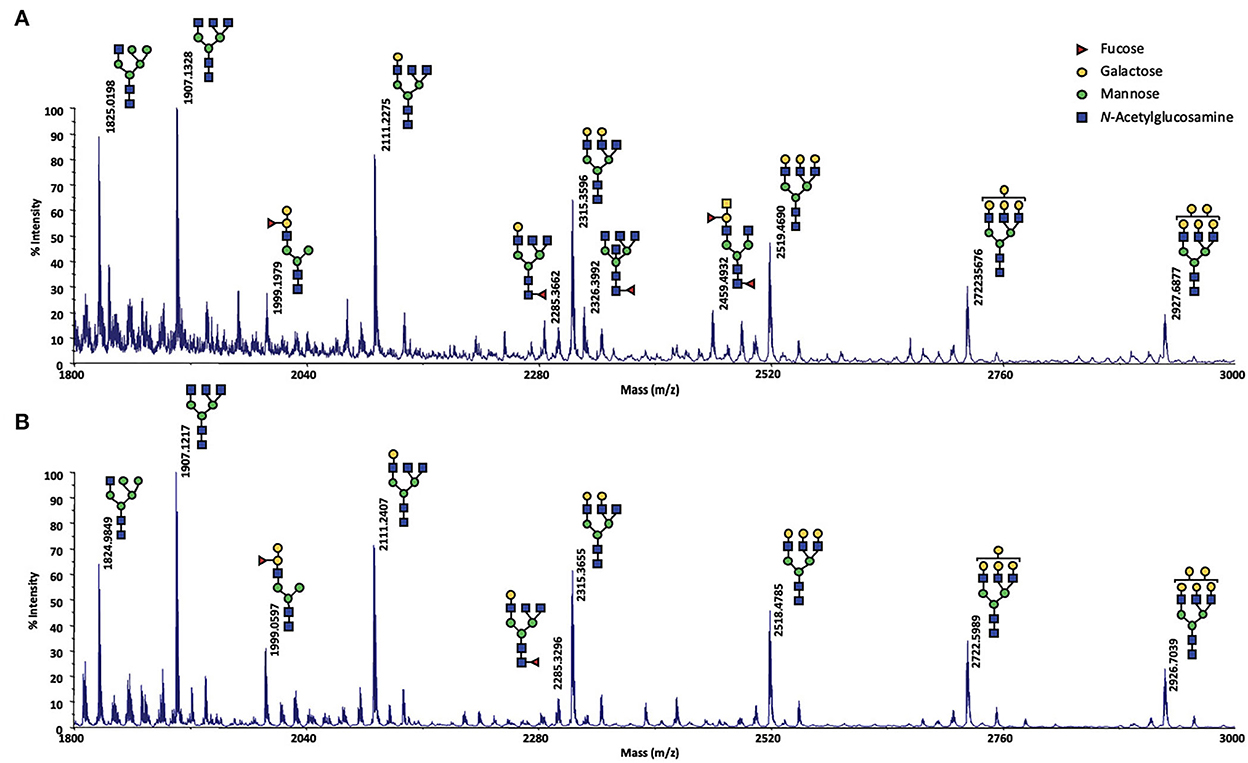 Figura 4. espectro MALDI-TOF de N-glicanos permetilados extraídos del secretoma olfativo de la oveja CTRL2 durante el período de actividad sexual (A) en 2017; (B) en 2018. Se detectaron N-glicanos como iones de aducción de sodio [M + Na] en un rango de masa de m / z 1,800-3,000. No se puede excluir la presencia de isómeros estructurales. Los esquemas estructurales de los glicanos se representan siguiendo la notación CFG: N-acetilglucosamina (cuadrado azul), fucosa (triángulo rojo), manosa (círculo verde), galactosa (círculo amarillo).+
Figura 4. espectro MALDI-TOF de N-glicanos permetilados extraídos del secretoma olfativo de la oveja CTRL2 durante el período de actividad sexual (A) en 2017; (B) en 2018. Se detectaron N-glicanos como iones de aducción de sodio [M + Na] en un rango de masa de m / z 1,800-3,000. No se puede excluir la presencia de isómeros estructurales. Los esquemas estructurales de los glicanos se representan siguiendo la notación CFG: N-acetilglucosamina (cuadrado azul), fucosa (triángulo rojo), manosa (círculo verde), galactosa (círculo amarillo).+
Debido a una cantidad limitada de proteínas, se perfiló todo el SG por su contenido en N-glicanos, pero no fue posible estudiar cada proteína por separado. Por lo tanto, las estructuras detectadas no pudieron asignarse a una u otra secuencia de proteínas del SG. De hecho, se predijo la N-glicosilación de los residuos de Asn para Oari-OBP2 (1 sitio), Oari-OBP3 (1 sitio), Oari-SAL1 (4 sitios) y Oari-SAL2 (5 sitios) (Tabla 2). Se han descrito estructuras similares para el SAL porcino (25), pero nunca para los OBP stricto sensu. Este tipo de glicosilación es la más antigua reportada y es típica de la vía de secreción (26). Por lo tanto, es intrigante que los OBP porcinos, aunque secretados y provenientes de la vía de secreción, no sean N-glicosilados, sino modificados por una glicosilación atípica, O-GlcNAcilación, así como OBP ovinos (18).
2.2.2.2. O-GlcNAcilación de Oari-OBP(s)
De hecho, uno de los marcadores de actividad sexual previamente identificados fue la presencia de O-GlcNAcilación en el secretoma de las ovejas (18), que estaba totalmente ausente en el descanso sexual. Esto fue confirmado por experimentos adicionales en animales adicionales (datos no mostrados). Así, hemos realizado la inmunodetección de O-GlcNAc por western-blot con el anticuerpo CTD110.6, específico para las proteínas secretadas O-GlcNAcylation (27). Esta especificidad se verificó compitiendo con los anticuerpos / antígenos de enlace (aquí GlcNAc unido a OBPs) por incubación entre GlcNAc libre y el anticuerpo CTD110.6, antes de la incubación con la membrana después de la electrotransferencia (Figura suplementaria 4A). Además, para superar la posibilidad de que CTD110.6 pudiera marcar cadenas de N-glicanos (aunque no se detectó en este estudio), las muestras de oveja STIM1 se trataron primero con PNGaseF para eliminar eventuales cadenas de N-glicano, y luego se incubaron con CTD110.6 (Figura complementaria 4B). Ambos controles demostraron que CTD110.6 marcó específicamente proteínas O-GlcNAciladas, y no N-glicanos. Curiosamente, la señal O-GlcNAc apareció tan pronto como 30 minutos de contacto con el macho para las tres ovejas estimuladas (Figura 5). Esta breve respuesta sugiere que la acción de los olores masculinos en el cerebro de las ovejas es muy rápida, desencadenando la reactivación de la OBP O-GlcNAcilación y, por lo tanto, la expresión de nuevas isoformas. Como el número de alícuotas de muestras estaba restringido, realizamos Western blot con CTD110.6 en dos muestras recogidas a −24 h y +24 h, que enmarcan la aparición de GlcNAc para tres ovejas estimuladas, que se incluyeron para la comparación (Figura 6). Los resultados se confirmaron para las tres ovejas que respondieron, y no se detectó ninguna señal para la verdadera oveja CTRL1 de control. La oveja CTRL3 ciclada mostró una señal de GlcNAc de acuerdo con su estado hormonal. Por el contrario, las ovejas STIM6, CTRL5 y CTRL6 mostraron señal O-GlcNAc en cualquier momento. Fue sorprendente y contradictorio con sus bajos valores de P4 que indican un anoestro. Se esperaba una ausencia de O-GlcNAcylation.
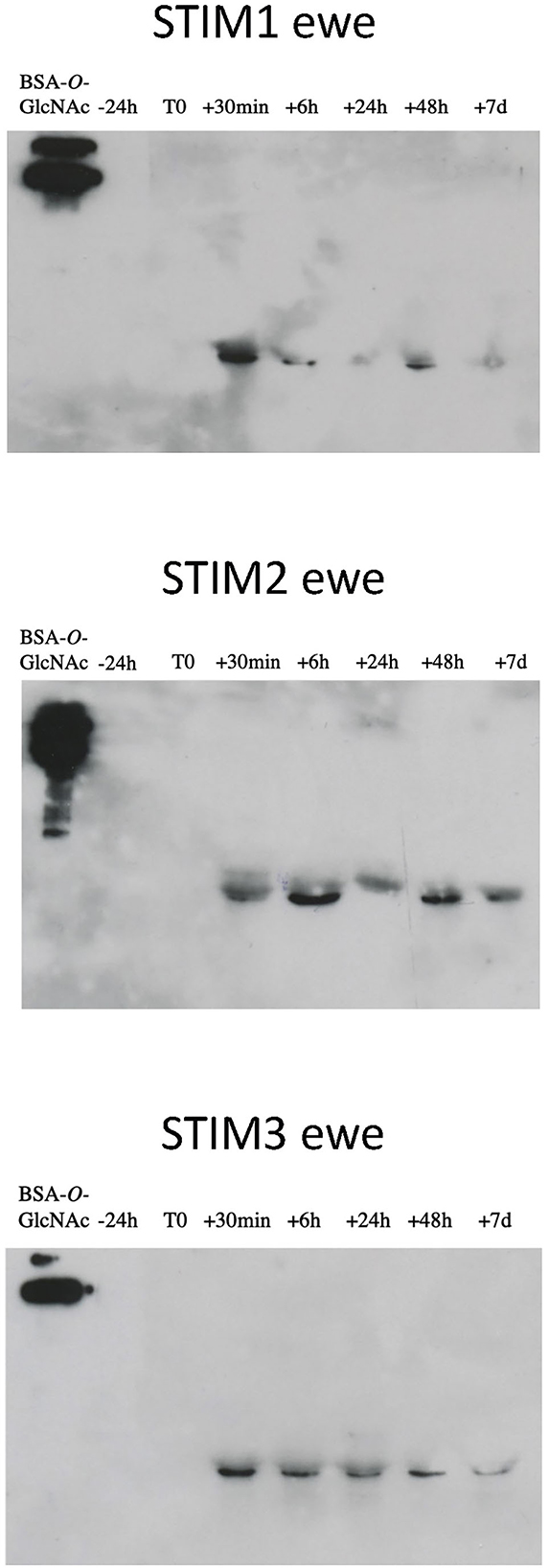 Figura 5. Inmunodetección de proteínas O-GlcNAciladas en ovejas expuestas al macho. Western blot con anticuerpo CTD110.6 (1/5.000) en proteínas de moco nasal (15 microgramos por pocillo) muestreadas durante un efecto carnero. Detección ECL, exposición a 10 min.
Figura 5. Inmunodetección de proteínas O-GlcNAciladas en ovejas expuestas al macho. Western blot con anticuerpo CTD110.6 (1/5.000) en proteínas de moco nasal (15 microgramos por pocillo) muestreadas durante un efecto carnero. Detección ECL, exposición a 10 min.
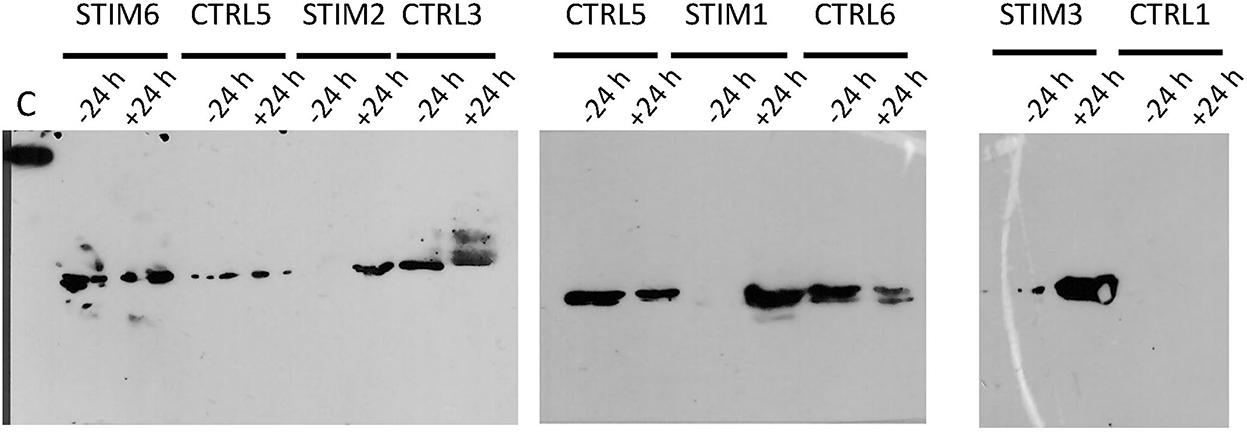 Figura 6. Inmunodetección de proteínas O-GlcNAciladas por western-blot con anticuerpo CTD110.6 en el secretoma olfativo de ovejas, estimulado o no por macho. Los tiempos de muestreo (−24 h y +24 h) enmarcan el tiempo de introducción masculina (T0). C, control; 5 ng de BSA-GlcNAc.
Figura 6. Inmunodetección de proteínas O-GlcNAciladas por western-blot con anticuerpo CTD110.6 en el secretoma olfativo de ovejas, estimulado o no por macho. Los tiempos de muestreo (−24 h y +24 h) enmarcan el tiempo de introducción masculina (T0). C, control; 5 ng de BSA-GlcNAc.
La aparición de la señal de GlcNAc después de 30 min de exposición al macho está de acuerdo con los eventos fisiológicos que ocurren después de la estimulación masculina. La respuesta a corto plazo, en pocos minutos, se caracteriza por la secreción de GnRH, que induce el aumento de los pulsos de LH en intensidad y frecuencia (7, 28) hasta el pico preovulatorio después de 24-48 h de contacto. En respuesta, los ovarios desencadenan la ovulación (respuesta a largo plazo). A nivel del sistema olfativo, parece que la reactivación del eje gonadotrópico conduce a la reactivación de la vía de ciclación O-GlcNA en los OBP secretores de tejido olfativo, tan pronto como 30 min después de la exposición masculina.
3. ¿Qué significa la expresión de isoformas específicas en respuesta a la exposición masculina?
Para volver a nuestras hipótesis de partida, y para discutir nuestros datos con la precaución vinculada a un pequeño número de animales relevantes para el estudio, no observamos ninguna transición gradual entre los fenotipos SR y SA, sino más probablemente un fenotipo de «efecto masculino» caracterizado por la reactivación de OBP O-GlcNAcylation, bajo control endocrino, probablemente estimulación de LH. Nuestros estudios previos han demostrado la fina regulación de las propiedades de unión de OBPs a los componentes feromonales mediante modificaciones postraduccionales, especialmente fosforilación y O-GlcNAcilación en cerdos (23). Después de la exposición al macho y su olor, el sistema olfativo de oveja parece expresar isoformas específicas O-GlcNAciladas, posiblemente adaptadas a la unión con moléculas específicamente secretadas por el macho sexualmente activo, que aún no se han identificado.
Este es el primer estudio que trata sobre el impacto de la exposición masculina sexualmente activa en el equipo olfativo de las ovejas, especialmente a este nivel molecular. El monitoreo de la composición del moco nasal fue posible gracias a la configuración de un protocolo de muestreo no invasivo que podría adaptarse fácilmente a otros eventos cruciales en la vida de los animales en relación con la percepción del olor. La baja eficiencia del macho para estimular a las hembras refleja la realidad de esta práctica, pero redujo el tamaño del rebaño y debilitó nuestros resultados. Sin embargo, el análisis del secretoma olfativo se vio reforzado por métodos de alta resolución. Se necesitan más experimentos para confirmar los datos, en particular ampliando el número de animales. Finalmente, esto no es seguro de que un alto número de hembras cambie el resultado principal, que es OBP O-GlcNAcylation. Además, estos resultados han establecido un vínculo entre el estado hormonal y la composición de la SG, lo que indica que la SG podría eventualmente usarse como un marcador de la receptividad de las mujeres al olor del carnero.
4. Métodos
4.1. Animales y declaraciones éticas
Los animales (Ovis aries, Ile de France, 3-5 años) fueron criados en la «Unité Expérimentale de l’Orfrasière» (UEPAO, INRAE, Francia; doi.org/10.15454/1.5573896321728955E12). El protocolo de efecto masculino descrito en este trabajo se realizó en abril de 2018, al comienzo del anoestro estacional. La medición de las concentraciones de progesterona (P4) se realizó en muestras de sangre antes y durante la exposición masculina para determinar el anoestro de las hembras y la respuesta al macho. Mientras tanto, para evitar cualquier sesgo en la interpretación de los resultados, trabajamos de manera ciega, lo que significa que los niveles de P4 en las muestras de sangre de ovejas no se conocían cuando se realizaron los análisis bioquímicos de la SG. Durante todo el período experimental, las ovejas se mantuvieron en interiores en corrales grandes (6 m × 4 m para 6 animales) en condiciones naturales de fotoperíodo. Ambos grupos (estimulados y control) fueron alojados en diferentes graneros espaciados por más de 100 m. Los animales fueron alimentados diariamente con alfalfa deshidratada, maíz, paja y un suplemento de vitaminas y minerales, y tuvieron libre acceso al agua, de acuerdo con las normas del INRAE para mantener el peso adulto y proporcionar una nutrición adecuada. El protocolo del efecto carnero, el muestreo no invasivo de moco nasal y el muestreo de sangre para la determinación de la concentración de progesterona fueron validados por el comité ético n° 019 del francés «Ministère de l’Enseignement Supérieur, de la Recherche et de l’Innovation» (APAFIS#13067–2018011616242285 v2).
4.2. Protocolo de efectos masculinos y muestreo de moco nasal
Los carneros fueron sometidos a un tratamiento fotoperiódico de largas jornadas (16 h de luz y 8 h de oscuridad) de noviembre al 15 de enero. Este tratamiento se proporcionó en un edificio a prueba de luz y la intensidad de la luz artificial proporcionada fue de al menos 300 lux a nivel de los ojos de los animales. Desde el 16 de enero hasta el final del estudio, se detuvo el tratamiento con luz y los dólares se trasladaron al interior de graneros expuestos a la luz natural, por lo tanto, a condiciones fotoperiódicas naturales. Recibieron implantes subcutáneos adicionales de melatonina (Melovine, CEVA, Francia; 18 mg). Este tratamiento estimula la actividad reproductiva masculina durante la temporada no reproductiva después de 45-60 días.
Doce ovejas anovulatorias se mantuvieron en dos edificios separados, cada grupo de 6 ovejas se separó en dos lotes. Para cada uno de los dos lotes «estimulados», un hombre sexualmente activo fue introducido en el día 0 y reemplazado por otro macho todos los días hasta el día 7 (5). Anteriormente, los carneros se activaban sexualmente mediante tratamientos fotoperiódicos e implantes de melatonina (1). Durante el protocolo, no se podía reproducir gracias a un delantal de cuero en carneros que impedía la penetración. Las ovejas de control permanecieron aisladas de los carneros durante todo el protocolo de efecto masculino en un edificio separado lejos de las ovejas y carneros estimulados.
La muestra no invasiva de moco nasal se realizó limpiando suavemente la mucosa nasal con una gasa estéril (5 cm × 5 cm, Laboratoires Mercurochrome) torcida 5 veces en cada fosa nasal. Cada gasa se colocó en un vial de vidrio de 20 ml y se almacenó a -80 ° C hasta la extracción de proteínas. El muestreo nasal de moco se realizó 24 h y pocos minutos (T0) antes de la exposición al macho, luego el muestreo se realizó después del contacto macho-hembra a los 30 min, 6 h, 24 h, 48 h y en el día 7 después de la introducción del macho en el rebaño. El estado fisiológico de las mujeres se verificó mediante el monitoreo de la progesterona en sangre cada semana comenzando 1 mes antes de la exposición masculina (Tabla 1) y luego todos los días de J-1 a J + 9 (Tablas suplementarias 1, 2). En los lotes no estimulados (grupos control) se recolectó moco nasal y sangre en estos mismos puntos de tiempo. Todas las muestras de sangre se recogieron por venopunción yugular en tubos de 5 ml que contenían 30 ml de heparina. El plasma se obtuvo después de la centrifugación 30 min a 3.000 g y 4 ° C, luego se almacenó a -20 ° C hasta la dosis hormonal. La concentración de progesterona se determinó mediante el uso de un método RIA directo (29). La sensibilidad del ensayo fue de 0,25 ng/ml. Se consideró que las hembras con concentraciones de progesterona >1,0 ng/ml habían ovulado y, por lo tanto, no estaban en anoestro (4).
4.3. Clonación molecular de secuencias similares a SAL
La oveja CTRL1 fue sacrificada en el período de actividad sexual con prácticas de acuerdo con la directiva de la UE 2010/63 / UE. La mucosa nasal se resecó inmediatamente después de la muerte en el matadero certificado por ISO9001 de la granja experimental INRAE UEPAO (Nouzilly, Francia) según el acuerdo E37-175-2. El ARN total se extrajo de 30 mg de tejido con el kit RNeasy Mini (Qiagen). Se utilizó ARN (5 mg) para amplificar los extremos 5′ y 3′ mediante RACE PCR (18) seguido de transcripción inversa con el kit SuperScript™ IV (Invitrogen) según el protocolo del proveedor. La plantilla RT se utilizó en PCR de toma de contacto (protocolo Invitrogen, 18) para amplificar OariSAL con los cebadores: 5OariSAL 5′-ACCCACATGAAGCTGCTGCTGCTGTGTCT-3′, y 3OariSAL 5′-AAGACAACTAGG CCACTCCATTCCCTCGC-3′. El producto de PCR se clonó en plásmido pCR4-TOPO (TOPO®™−Kit de clonación™ TA, Invitrogen). Después de la amplificación en células químicamente competentes de Escherichia coli One-Shot Top 10 (Invitrogen), los plásmidos recombinantes se purificaron (QIAprep Spin Miniprep kit, Qiagen) y se secuenciaron en ambos sentidos (genómica Eurofins).
4.4. Extracción de proteínas
Los productos químicos fueron comprados en Sigma-Aldrich, a menos que se especifique. Las proteínas se extrajeron de las gasas como se describe en Cann et al. (18) por partición de fase con solución fría de cloroformo/metanol (2/1, v/v). Se realizaron dos extracciones sucesivas de las gasas, primero con una incubación con 4 mL de cloroformo/metanol a 4°C durante 1 h 30, luego se añadió 1 mL de agua MilliQ y se exprimieron gasas con una jeringa estéril. La segunda extracción se realizó agregando a la misma gasa 2 mL de cloroformo/metanol a 4°C y 0.5 mL de agua MilliQ, luego la gasa se exprimió con otra jeringa estéril. Los líquidos recuperados de las dos extracciones se agruparon y centrifugaron a 3.234 rcf durante 20 min a 4°C. La fase de metanol se recogió (c. a. 4 mL) y luego se lavó una vez con el mismo volumen de cloroformo antes de otra centrifugación como se describió anteriormente. Las fases de metanol se recogieron y secaron en un concentrador de vacío [Eppendorf Vacufuge Plus Concentrator (RRID:SCR_019876)]. Las proteínas fueron alicitadas por 30 y 15 μg después de la estimación de la cantidad por SDS-PAGE.
4.5. Electroforesis bidimensional
Para 2-DE, las proteínas secas se resuspendieron en 10 μL de agua, luego en 120 μL de tampón de rehidratación como ya se ha descrito. Las tiras secas inmovilizadas (tiras IPG: pH 3–5.6, 7 cm, GE Healthcare o pH 4–7, 7 cm, Bio-Rad) se sometieron a rehidratación pasiva con muestras durante 16 h a temperatura ambiente (RT). La primera dimensión (isoelectrofocalización) se realizó en el sistema PROTEAN i12™ IEF (BioRad), con el programa estándar «7-cm Gradual S-1» (250 V rápido durante 30 min, 1.000 V gradual durante 1 h, 5.000 V gradual durante 2 h y una retención de 5.000 V), con una corriente limitada a 50 μA/gel. Cuando se completó IEF (9.000 VH final), las tiras de IPG se incubaron sucesivamente durante 15 min en el tampón de equilibrio (375 mM Tris-HCl pH 8,8, 6 M de urea, 2% (p/v) de SDS y 30% (v/v) de glicerol) conteniendo primero 1,5% (p/v) de DTT y luego 2% (p/v) de yodoacetamida. La segunda dimensión se realizó utilizando acrilamida SDS-PAGE al 16,8% en células Tetra Mini-PROTEAN (Bio-Rad) con Precision Plus Protein Standard Dual Color (Bio-Rad) como marcadores de masa molecular.®
4.6. Análisis de proteínas por espectrometría de masas
Las proteínas (30 μg) se separaron mediante SDS-PAGE, luego se tiñeron con una solución coloidal de azul de Coomassie R (19). Las manchas se extirparon de las bandas principales, luego se no teñieron durante la noche a 4 ° C en bicarbonato de amonio (v / v / v al 50% ACN / 50 mM). Los puentes de disulfuro se redujeron con 10 mM de TDT a 56°C durante 1 h, luego se alquilaron con 50 mM de yodoacetamida en 50 mM de bicarbonato de amonio a temperatura ambiente (RT) durante 45 min en la oscuridad. Antes de la digestión de la tripsina, las manchas se lavaban con bicarbonato de amonio de 50 mM y se deshidrataban con 100% de ACN. Las manchas se incubaron durante la noche con 100 ng de tripsina oro (Promega) en bicarbonato de amonio de 50 mM a 37 ° C. Los péptidos se extrajeron del gel mediante dos incubaciones en ácido fórmico al 10% / 45% ACN a 30 ° C durante 15 min, luego con ácido fórmico al 5% / 95% ACN a RT durante 10 min. Los péptidos se desalizaron por centrifugación en la columna de centrifugación Pierce C18 (Fisher Scientific) de acuerdo con las instrucciones del fabricante. Los péptidos se solubilizaron en ácido trifluoroacético al 0,1% y se mezclaron con una matriz de ácido α-ciano-10-hidroxicinámico de 4 mg/ml (Sigma-Aldrich). El análisis de ionización por desorción láser asistida por matriz: espectrometría de masas de tiempo de vuelo (MALDI-TOF MS) se realizó en un espectrómetro de masas Voyager DE Pro [ABI Voyager DE Pro MALDI-Mass Spectrometer (RRID: SCR_019340)]. El instrumento se utilizó en modo reflector positivo, midiendo masas peptídicas en un rango de 500-4.000 Da. Los espectros se analizaron con Data Explorer V4.6 (Applied Biosystems). Los datos sin procesar (archivos .t2d) se procesaron utilizando el software DataExplorer (ABSCIEX).®®
4.7. Inmunodetección de PTM por Western blot
Las alícuotas de 15 μg de proteína total se separaron mediante SDS-PAGE (19), luego se electroblot con Trans-Blot Turbo Transfer System (Bio-Rad) en la membrana de PVDF (Trans-Blot Turbo Transfer Pack PVDF Mini, Bio-Rad). Para la detección de proteínas O-GlcNAciladas, la membrana se incubó 1 h en RT en tampón de bloqueo (BSA al 3% en PBS-T, solución salina tamponada con fosfato, fosfato de fosfato fosfato fosfato, fosfato de sodio 0,1 M, NaCl 0,15%, Tween 0 v/v, pH 05,20), luego con el anticuerpo primario CTD7.2 (Sigma-Aldrich Cat# O110, RRID:AB_6) a 7764:1079524.1 en BSA/PBS-T al 5% en RT durante 000 h. La membrana se lavó 3 veces en PBS-T antes de la incubación secundaria de anticuerpos 1 h en RT (Sigma-Aldrich Cat# A6, RRID:AB_1) a 8786:258413.1 dilución. La señal fue revelada por quimioluminiscencia con el sustrato de duración extendida SuperSignal™ West Dura (Pierce, Fisher Scientific). La especificidad del anticuerpo CTD30.000 se evaluó mediante un ensayo de competencia. Para ello, las muestras se procesaron como se describió anteriormente y se incubaron en una solución de tampón de bloqueo que contenía 110 mM de GlcNAc libre previamente incubada con el anticuerpo CTD6.500. Para evaluar que CTD110.6 solo marcaba N-acetilglucosamina ligada a O-beta (110), las muestras se trataron con PNGaseF (New England Biolabs) para eliminar las cadenas de N-glicano: una muestra de 6 mg de proteína total de oveja estimulada 27 se desnaturalizó 15 min a 30056 °C, se digirió con PNGasa F durante la noche a 10 ° C, luego se inactivó 94 min a 37 ° C. Se realizó un Western blot con CTD10.75 como se describió anteriormente.
4.8. Predicción in silico de sitios PTM en OBPs de ewe OS
Estos análisis se realizaron utilizando el software libre en http://www.cbs.dtu.dk/services/NetPhos/, http://www.cbs.dtu.dk/services/YinOYang/ y http://www.cbs.dtu.dk/services/NetNGlyc/, para fosforilación, O-GlcNAcilación y N-glicosilación, respectivamente.
4.9. Identificación de cadenas de N-glicanos
Las proteínas secas extraídas (300 mg) se resuspendieron en 500 μl de bicarbonato de amonio 50 mM pH 8.0, se redujeron agregando 50 μl de 0.1 M TDT durante 1 h a 37°C, luego se alquilaron agregando 55 μl de yodoacetamida 0.5 M durante 1 h a 37°C en la oscuridad. Las proteínas se precipitaron con ácido tricloroacético (67 μl para alcanzar una concentración final del 10%) 30 min a -20 °C. Después de la centrifugación a 13 000 rpm (MiniSpin Eppendorf) durante 15 min a 4°C y 3 lavados con acetona, el pellet se resuspendió con 500 μl de bicarbonato de amonio de 50 mM, pH 8.0. Las proteínas fueron digeridas por tripsina (50 μg) a 37°C durante la noche. Después de la desactivación de tripsina a 100 ° C durante 5 min, se liberaron N-glicanos mediante una digestión nocturna con 5 U de PNGaseF (BioLabs Inc.) a 37 ° C. Para recuperar N-glicanos, la mezcla se pasó a través de columnas de espín C18 (Pierce™) y los N-glicanos se eluyeron con ácido acético al 5% y se liofilizaron.®
Antes de los análisis de espectrometría de masas, los N-glicanos nativos se metilaron mediante un procedimiento de permetilación de hidróxido de sodio. Se mezclaron vigorosamente 100 μl de solución de NaOH al 50% tomada en un tubo de vidrio con tapón limpio con 200 μl de metanol. Se agregaron aproximadamente 4 ml de DMSO anhidro a esta mezcla y se mezclaron vigorosamente agitando. Este proceso precipita los carbonatos presentes en la solución de mezcla como un sólido blanco esponjoso. El tubo se centrifugó a 13 000 rpm (MiniSpin Eppendorf) durante 5 min; Esto conduce a la precipitación de carbonatos en la parte superior de la mezcla. El sólido blanco precipitado en la parte superior y el DMSO en exceso se eliminaron cuidadosamente mientras se conservaba el gel incoloro en la parte inferior del tubo. Este procedimiento se repitió cuatro veces más hasta que cesó la precipitación sólida blanca. Además, el gel NaOH-DMSO resultante formado en la parte inferior del tubo se mezcló con 1 ml de DMSO anhidro y se utilizó directamente para la reacción de permetilación. Se añadió DMSO (100 μl) a la muestra seca, se sonicó brevemente (2 min) en un baño ultrasónico y se dejó reposar a temperatura ambiente durante 15 min. Las metilaciones se llevaron a cabo mediante la adición de 350 μl de la suspensión de NaOH-DMSO y 50 μl de yoduro de metilo. Después de 20 min de incubación, la reacción se detuvo agregando 2 ml de ácido acético frío al 5% (v / v), y los N-glicanos permetilados se recuperaron mediante extracción con cloroformo. La capa de cloroformo se lavó varias veces con agua para eliminar cualquier impureza y finalmente se secó bajo una corriente de nitrógeno.
Los glicanos permetilados se disolvieron en 10 μl de acetonitrilo y 1 μl de esta solución se mezcló con 1 μl de matriz de ácido 2,5-dihidroxibenzoico (DHB) [10 mg/ml en acetonitrilo al 50% (v/v)], detectados en una placa MALDI y analizados en un instrumento MALDI-TOF/TOF MS (Axima Resonance, Shimadu Biotech) en modo reflectrón positivo por extracción retardada utilizando un modo de aceleración de 20 kV, un retardo de pulso de 200 ns y una tensión de red del 60%. Se promediaron entre 100 y 150 exploraciones para cada espectro.
Declaración de disponibilidad de datos
Los conjuntos de datos presentados en este estudio se pueden encontrar en repositorios en línea. Los nombres del repositorio o repositorios y los números de acceso se pueden encontrar a continuación: https://www.ncbi.nlm.nih.gov/genbank/, MT921827 y MT921828.
Declaración ética
El estudio en animales fue revisado y aprobado por el Comité de Ética n° 019 del «Ministère de l’Enseignement Supérieur, de la Recherche et de l’Innovation» (APAFIS#13067–2018011616242285 v2).
Contribuciones del autor
PNLM, MK y CLD diseñaron los experimentos. MK, CP y DC establecieron los protocolos de efectos masculinos. CP realizó ensayos de progesterona. CLD realizó el muestreo de moco nasal, con la ayuda de PC, CP, DC y MK. PC realizó electroforesis, Western Blots, y MALDI-TOF MS. PC, CLD y PNLM analizaron datos de espectrometría de masas. El PNLM clonó las secuencias SAL. CLD realizó el análisis de glicanos. Todos los autores contribuyeron a la redacción del manuscrito y aceptan ser responsables del contenido del trabajo.
Financiación
Este trabajo fue financiado por ANR PHEROMALE (ANR-15-CE21-0012) a PC, por INRAE a PNLM, CP y DC, por CNRS a MK, y por ELIANCE a CLD.
Reconocimientos
Los autores agradecen a los colegas de UEPAO por el cuidado de los animales y al laboratorio PRC de ensayo hormonal para la cuantificación de la progesterona.
Conflicto de intereses
Los autores declaran que la investigación se llevó a cabo en ausencia de cualquier relación comercial o financiera que pudiera interpretarse como un posible conflicto de intereses.
Nota del editor
Todas las afirmaciones expresadas en este artículo son únicamente las de los autores y no representan necesariamente las de sus organizaciones afiliadas, o las del editor, los editores y los revisores. Cualquier producto que pueda ser evaluado en este artículo, o reclamo que pueda ser hecho por su fabricante, no está garantizado ni respaldado por el editor.
Material complementario
El material complementario para este artículo se puede encontrar en línea en: https://www.frontiersin.org/articles/10.3389/fvets.2022.1033412/full#supplementary-material
Referencias
1. Chemineau P, Pelletier J, Guérin Y, Colas G, Ravault JP, Touré G, et al. Tratamientos fotoperiódicos y melatonina para el control de la reproducción estacional en ovejas y cabras. Reprod Nutr Dev. (1988) 28:409–22. doi: 10.1051/rnd:19880307
Resumen de PubMed | Texto completo de CrossRef | Google Académico
2. Underwood EJ, Shier FL, Davenport N. Estudios en cría de ovejas en Australia Occidental. V. La época de cría de ovejas mestizadas merinas y de raza británica en los distritos agrícolas. J Dep Agric West Aust. (1944) 11:135–43.
3. Thimonier J, Cognié Y, Lassoued N, Khaldi G. L’effet mâle chez les ovins : une technique actuelle de maîtrise de la reproduction. INRA Prod Anim. (2000) 13:223–31. doi: 10.20870/productions-animales.2000.13.4.3782
4. Chemineau P, Pellicer-Rubio MT, Lassoued N, Khaldi G, Monniaux D. Male induced short oestrous and ovarian cycles in sheep and goats: a working hypothesis. Reprod Nutr Dev. (2006) 46:417–29. doi: 10.1051/rnd:2006022
Resumen de PubMed | Texto completo de CrossRef | Google Académico
5. Fabre-Nys C, Kendrick KM, Scaramuzzi RJ. El «efecto carnero»: nuevos conocimientos sobre la modulación neuronal del eje gonadotrópico por olores masculinos e interacciones sociosexuales. Neurosci frontal. (2015) 9:111. doi: 10.3389/fnins.2015.00111
Resumen de PubMed | Texto completo de CrossRef | Google Académico
6. Oldham CM, Martin GB, Knight TW.1978/1979. Estimulación de ovejas merinas estacionalmente anovulares por carneros. I. Tiempo desde la introducción de los carneros hasta el aumento preovulatorio de LH y la ovulación. Anim Reprod Sci. (1979) 1:283–90. doi: 10.1016/0378-4320(79)90013-7
7. Delgadillo JA, Gelez H, Ungerfeld R, Hawken PAR, Martin GB. El «efecto masculino» en ovejas y cabras: revisar los dogmas. Behav Brain Res. (2009) 200:304–14. doi: 10.1016/j.bbr.2009.02.004
Resumen de PubMed | Texto completo de CrossRef | Google Académico
8. Oldham CM, Martin GB. Estimulación de las ovejas merinas estacionalmente anovulares por carneros. II. Regresión prematura de cuerpos lúteos inducidos por carnero. Anim Reprod Sci. (1979) 1:291–5. doi: 10.1016/0378-4320(79)90014-9
9. Gelez H, Archer E, Chesneau D, Campan R, Fabre-Nys C. Importancia del aprendizaje en la respuesta de las ovejas al olor masculino. Sentidos químicos. (2004) 29:555–63. doi: 10.1093/chemse/bjh054
Resumen de PubMed | Texto completo de CrossRef | Google Académico
10. Perkins A, Fitzgerald JA. El componente conductual del efecto carnero: la influencia del comportamiento sexual del carnero en la inducción del estro en ovejas anovulatorias. J Anim Sci. (1994) 72:51–5. doi: 10.2527/1994.72151x
Resumen de PubMed | Texto completo de CrossRef | Google Académico
11. Cohen-Tannoudji J, Locatelli A, Signoret JP. Estimulación no feromonal por parte del macho de la liberación de LH en la oveja anoestrosa. Horm Behav. (1986) 36:921–4. doi: 10.1016/0031-9384(86)90453-1
Resumen de PubMed | Texto completo de CrossRef | Google Académico
12. Hawken PAR, Esmaili T, Scanlan V, Blache D, Martin GB. ¿Pueden los estímulos audiovisuales o visuales de una posible pareja estimular una respuesta neuroendocrina reproductiva en las ovejas? Animal. (2009) 3:690–6. doi: 10.1017/S1751731109003954
Resumen de PubMed | Texto completo de CrossRef | Google Académico
13. Knight TW, Lynch PR. Fuente de feromonas de carnero que estimulan la ovulación en la oveja. Anim Reprod Sci. (1980) 3:133–6. doi: 10.1016/0378-4320(80)90040-8
14. Gelez H, Fabre-Nys C. El «efecto masculino» en ovejas y cabras: una revisión de los respectivos roles de los dos sistemas olfativos. Horm Behav. (2004) 46:257–71. doi: 10.1016/j.yhbeh.2004.05.002
Resumen de PubMed | Texto completo de CrossRef | Google Académico
15. Karlson P, Lüscher M. «Pheromones»: a new term for a class of biological active substances. Naturaleza. (1959) 183:55–6. DOI: 10.1038/183055A0
Resumen de PubMed | Texto completo de CrossRef | Google Académico
16. Cohen-Tannoudji J, Einhorn J, Signoret JP. Feromona sexual Ram: primer enfoque de identificación química. Comportamiento fisiológico. (1994) 56:955–61. doi: 10.1016/0031-9384(94)90329-8
Resumen de PubMed | Texto completo de CrossRef | Google Académico
17. Lévy F, Keller M. Mediación olfativa del comportamiento materno en especies seleccionadas de mamíferos. Behav Brain Res. (2009) 200:336–45. doi: 10.1016/j.bbr.2008.12.017
Resumen de PubMed | Texto completo de CrossRef | Google Académico
18. Cann P, Chabi M, Delsart A, Le Danvic C, Saliou J-M, Chasles M, et al. El secretoma olfativo varía según la estación en ovejas y cabras hembras. BMC Genómica. (2019) 20:794. DOI: 10.1186/S12864-019-6194-Z
Resumen de PubMed | Texto completo de CrossRef | Google Académico
19. Nagnan-Le Meillour P, Vercoutter-Edouart A-S, Hilliou F, Le Danvic C, Lévy F. Proteomic analysis of pig (Sus scrofa) olfactory soluble proteome reveals O-linked-N-acetylglucosaminylation of secreted odorant-binding proteins. Frente Endocrinol. (2014) 5:202. doi: 10.3389/fendo.2014.00202
Resumen de PubMed | Texto completo de CrossRef | Google Académico
20. Bouclon J, Le Danvic C, Guettier E, Bray F, Tokarski C, Rolando C, et al. Identificación de modificaciones post-traduccionales en isoformas de proteínas de unión a olores del secretoma olfativo porcino mediante espectrometría de masas de alta resolución: O-β-N-acetilglucosaminilación y fosforilación. Delantero Ecol Evol. (2017) 5:142. doi: 10.3389/fevo.2017.00142
21. Nagnan-Le Meillour P, Le Danvic C, Brimau F, Chemineau P, Michalski JC. Fosforilación de proteínas nativas de unión olfativa porcina. J Chem Ecol. (2009) 35:752–60. DOI: 10.1007/S10886-009-9663-Z
Resumen de PubMed | Texto completo de CrossRef | Google Académico
22. Brimau F, Cornard J-P, Le Danvic C, Lagant P, Vergoten G, Grebert D, et al. La especificidad de unión de las isoformas de proteínas de unión a odorantes recombinantes es impulsada por la fosforilación. J Chem Ecol. (2010) 36:801–13. DOI: 10.1007/S10886-010-9820-4
Resumen de PubMed | Texto completo de CrossRef | Google Académico
23. Nagnan-Le Meillour P, Joly A, Le Danvic C, Marie A, Zirah S, Cornard J-P. La especificidad de unión de las isoformas nativas de proteínas de unión a olores es impulsada por la fosforilación y la O-N-acetilglucosaminilación en el cerdo Sus scrofa. Frente Endocrinol. (2019) 9:816. DOI: 10.3389/FENDO.2018.00816
Resumen de PubMed | Texto completo de CrossRef | Google Académico
24. Chanvallon A, Sagot L, Pottier E, Debus N, François D, Fassier T, et al. Nuevos conocimientos sobre la influencia de la raza y la época del año en la respuesta de las ovejas al efecto carnero. Animal. (2011) 5:1594–604. doi: 10.1017/S1751731111000668
Resumen de PubMed | Texto completo de CrossRef | Google Académico
25. Löebel D, Scaloni A, Paolini S, Fini C, Ferrara L, Breer H, et al. Clonación, modificaciones post-traduccionales, expresión heteróloga y unión al ligando de la lipocalina salival del jabalí. Bioquímica J. (2000) 350:369–79. DOI: 10.1042/BJ3500369
Resumen de PubMed | Texto completo de CrossRef | Google Académico
26. Aebi M. N-linked protein glycosylation in the ER. Biochim Biophys Acta. (2013) 1833:2430–7. doi: 10.1016/j.bbamcr.2013.04.001
Resumen de PubMed | Texto completo de CrossRef | Google Académico
27. Tashima Y, Stanley P. Anticuerpos que detectan O-GlcNAc en el dominio extracelular de glicoproteínas de la superficie celular. J Biol Chem. (2014) 289:11132–42. DOI: 10.1074/JBC. M113.492512
Resumen de PubMed | Texto completo de CrossRef | Google Académico
28. Poindron P, Cognie Y, Gayerie F, Orgeur P, Oldham CM, Ravault J-P. Cambios en los niveles de gonadotropinas y prolactina en ovejas anovulares aisladas (estacional o estacionalmente) asociadas con la ovulación causadas por la introducción de carneros. Comportamiento fisiológico. (1980) 25:227–36. doi: 10.1016/0031-9384(80)90210-3
Resumen de PubMed | Texto completo de CrossRef | Google Académico
29. Delgadillo JA, Sifuentes PI, Flores MJ, Espinoza-Flores LA, Andrade-Esparza JD, Hernandez H, et al. La suplementación nutricional mejora la respuesta sexual de los machos expuestos a largas jornadas en manejo semiextensivo y su capacidad para estimular la reproducción en cabras. Animal. (2021) 15:100114. doi: 10.1016/j.animal.2020.100114
Resumen de PubMed | Texto completo de CrossRef | Google Académico
Palabras clave: efecto masculino, secretoma olfativo, proteína de unión olfativa (OBP), lipocalina salival, glicosilación O-GlcNAc, ovarios, proteómica
Cita: Cann P, Le Danvic C, Porte C, Chesneau D, Keller M y Nagnan-Le Meillour P (2023) Variación del secretoma olfativo de oveja durante un efecto carnero. Frente. Vet. Sci. 9:1033412. doi: 10.3389/fvets.2022.1033412
Recibido: 31 de agosto de 2022; Aprobado: 19 de diciembre de 2022;
Publicado: 09 enero 2023.
Editado por:
Michał Dziecioł, Universidad de Ciencias Ambientales y de la Vida de Wroclaw, Polonia
Revisado por:
Rajesh Durairaj, Institut de Recherche en Sémiochimie et Ethologie Appliquée (IRSEA), Francia Cécile Bienboire-Frosini, Institut de Recherche en Sémiochimie et Ethologie Appliquée (IRSEA), Francia
Copyright © 2023 Cann, Le Danvic, Porte, Chesneau, Keller y Nagnan-Le Meillour. Este es un artículo de acceso abierto distribuido bajo los términos de la Licencia de Atribución Creative Commons (CC BY).
*Correspondencia: Patricia Nagnan-Le Meillour,  patricia.nagnan@univ-lille.fr
patricia.nagnan@univ-lille.fr
†Estos autores han contribuido igualmente a este trabajo y comparten la primera autoría
Renuncia: Todas las afirmaciones expresadas en este artículo son únicamente las de los autores y no representan necesariamente las de sus organizaciones afiliadas, o las del editor, los editores y los revisores. Cualquier producto que pueda ser evaluado en este artículo o reclamo que pueda ser hecho por su fabricante no está garantizado ni respaldado por el editor.
Date de alta y recibe nuestro 👉🏼 Diario Digital AXÓN INFORMAVET ONE HEALTH
Date de alta y recibe nuestro 👉🏼 Boletín Digital de Foro Agro Ganadero
Noticias animales de compañía
Noticias animales de producción
Trabajos técnicos animales de producción
Trabajos técnicos animales de compañía