La versatilidad, la vigilancia y el microbioma intestinal respaldan la prioridad de las gallinas de alto rango
La versatilidad, la vigilancia y el microbioma intestinal respaldan la prioridad de las gallinas de alto rango
 Zhijiang Xie1
Zhijiang Xie1  Limin Xing1
Limin Xing1  Mengqiao Zhao1
Mengqiao Zhao1  Lei Zhao1
Lei Zhao1  Jinling Liu1
Jinling Liu1  Yushan Li1
Yushan Li1  Jiankang Gan2
Jiankang Gan2  Siyu Chen1*
Siyu Chen1*  Hua Li1*
Hua Li1*- 1Laboratorio Clave Provincial de Guangdong de Diseño Molecular Animal y Cría Precisa, Laboratorio Clave de Diseño Molecular Animal y Cría Precisa de los Institutos de Educación Superior de Guangdong, Escuela de Ciencias de la Vida e Ingeniería, Universidad de Foshan, Foshan, China
- 2Guangdong Tinoo’s Foods Group Co., Ltd., Qingyuan, China
La jerarquía de dominancia existe en los animales sociales y muestra profundos impactos en la supervivencia, la salud física y mental y el éxito reproductivo de los animales. Sin embargo, la interacción agresiva, como principal indicador utilizado para calcular la jerarquía social, no se encuentra en algunas hembras. En este estudio, nuestro objetivo fue averiguar el establecimiento de la jerarquía social en gallinas que casi realizan comportamientos agresivos e investigamos las interacciones de la jerarquía social con el rendimiento de la producción y el microbioma intestinal. Cuarenta gallinas Qingyuan de 49 días de edad se dividieron aleatoriamente en cuatro grupos. La jerarquía social de las gallinas se calculaba por la posición relativa alrededor del comedero. Las aves de rango 1 (R1), R2, R3, R4, R5, R6, R7, R8, R9 y R10 se determinaron en orden ascendente. Luego, las aves R1 y R2 (cuatro duplicados, n = 8) fueron nombradas como el grupo de gallinas de alto rango (HR), mientras que los individuos R9 y R10 fueron nombrados como el grupo de gallinas de bajo rango (LR) (cuatro duplicados, n = 8). El índice cardíaco (p = 0,01), el número de visitas por día, la ingesta diaria de alimento y el tiempo de ocupación por día fueron mayores en el grupo de FC que en el grupo de LR, pero el grupo de LR tuvo una mayor ingesta de alimento por visita que el grupo de HR. La diversidad alfa fue significativamente menor en el grupo HR que en el grupo LR (p = 0,05). La abundancia relativa del filo Firmicutes fue mayor, mientras que la del filo Deferribacterota fue menor en el grupo HR que en el grupo LR (p < 0,05). A nivel de género, la abundancia relativa de Succinatimonas, Eubacterium hallii y Anaerostipes fue mayor en el grupo HR que en el grupo LR. La abundancia relativa de Bacteroides, Mucispirillum, Subdoligranulum y Barnesiellaceae sin clasificar fue mayor en el grupo LR que en el grupo HR (p < 0,05). En conclusión, el rango de las gallinas podría calcularse por la posición relativa alrededor del comedero cuando compiten por el alimento. Las gallinas dominantes tienen un carácter versátil. Además, están más atentos y tienen prioridad a la hora de buscar alimento. Las gallinas de bajo rango adoptan estrategias para obtener suficiente comida para mantenerse. Las gallinas de alto rango poseen bacterias beneficiosas que utilizan sustancias favorables para mantener el equilibrio del entorno intestinal.
Introducción
La dominancia social es un fenómeno ubicuo, que se da entre las criaturas sociales, desde insectos hasta primates (1, 2). El rango social afecta la distribución de los recursos dominantes entre los individuos, y los individuos con alto rango tienden a seleccionar áreas donde los recursos dominantes están densamente distribuidos, obteniendo así más recursos relativos. Por ejemplo, el ganado con rango alto pasa más tiempo comiendo granos mientras pasta, y el ganado con rango bajo pasa más tiempo dando vueltas a lo largo del pasto (3). El establecimiento de una jerarquía social es propicio para evitar conflictos innecesarios, peleas y competencia por los recursos dentro de los grupos. Los monos rhesus de bajo rango evitan los ataques y amenazas de los monos dominantes «haciéndose los tontos» (4). Los individuos dominantes se reproducen preferentemente (5), lo cual es esencial para el desarrollo de la población, así como para la mejora de la competitividad interespecífica (6).
Hasta la fecha, también se ha informado de un aumento de los estudios realizados sobre la jerarquía social en pollos. Ya se sabía que el gallo de mayor rango tenía prioridad para la alimentación (7) y el canto (8). Además, los gallos de alto rango tenían concentraciones plasmáticas de testosterona más altas y testosterona eyaculatoria más baja en comparación con los individuos de bajo rango, lo que sugiere que el orden social en los pollos tiene un impacto significativo en su regulación hormonal (9). Las gallinas dominantes obligan a las gallinas subdominantes a producir un comportamiento sumiso a través de la amenaza o la fuerza (10), y las gallinas de rango superior tenían huevos más pesados que las gallinas de rango inferior (11). Esto se debió a que las gallinas de bajo rango eran picoteadas por las gallinas dominantes, lo que hacía que permanecieran en el nido por un período más corto y, por lo tanto, tendían a retrasar la puesta de huevos (12). Cabe destacar que, en los estudios mencionados, la interacción agresiva fue el único indicador utilizado para calcular la jerarquía social. Sin embargo, hubo comportamientos agresivos raros en el grupo de algunas hembras. Así, la forma de calcular la jerarquía social de estos animales nos llama mucho la atención.
En los últimos años, la microbiota intestinal se ha convertido en uno de los temas principales debido a su asociación con la salud y la enfermedad del huésped. En los pollos, se mantiene un equilibrio saludable de microorganismos dentro del intestino (13), y las interacciones funcionales complejas entre los microbios intestinales y la inmunidad del huésped son importantes para la salud intestinal (14). Nuestro estudio anterior ha encontrado que la salud de los gallos dominantes parece beneficiarse de la actividad de los ácidos grasos de cadena corta, mientras que la de los gallos subdominantes puede beneficiarse de la función microbiana (15). Sin embargo, se sabe poco sobre la interacción entre la jerarquía social de los individuos con el rendimiento productivo y la microbiota intestinal en las gallinas.
Por lo tanto, implementaremos un sistema de alimentación de precisión para monitorear el rendimiento productivo de los individuos. En consecuencia, en este estudio, nuestro objetivo fue averiguar el establecimiento de la jerarquía social en gallinas que casi realizan comportamientos agresivos, e investigar las interacciones de la jerarquía social con el rendimiento de la producción y el microbioma intestinal. La comprensión de estas interacciones proporcionaría nuevos conocimientos sobre las estrategias para mejorar la salud y el bienestar de las gallinas, así como la mejora de las estrategias de manejo de los animales.
Materiales y métodos
Animales y alimentación
Cuarenta gallinas Qingyuan proporcionadas por Guangdong Tiannong Food Co., Ltd., a la edad de 49 días con un peso corporal promedio de 652,5 g (DE = 50,12) fueron seleccionadas aleatoriamente para el estudio. Luego, 40 gallinas se dividieron aleatoriamente en cuatro grupos, con diez gallinas en cada grupo. Se alojaron en un establo separado (1,5 m × 1,5 m × 2,5 m) con suelo de hormigón sin material de cama. Todos los animales de experimentación fueron marcados con anillos de colores en las patas y se les dio acceso gratuito a agua y una dieta comercial que se les proporcionaba diariamente a las 8:00 a.m.
Establecimiento del rango social
Se realizaron pruebas de competencia de alimentación de diez minutos para las gallinas de cada grupo a los 57-59 días y a los 76-78 días de edad, un total de 6 veces. A las aves se les privó de comida, pero no de agua, a partir de las 18:00 horas del día anterior a cada prueba. Cada establo separado contenía un comedero, que solo permitía que se alimentaran de dos a cuatro aves a la vez. Dado que los comportamientos agresivos eran raros entre estos animales, se utilizó un sistema de evaluación de cuatro grados para la posición relativa del comportamiento de búsqueda de alimento a intervalos de 30 s para cada ave. Una puntuación de 3 significa que las gallinas estaban consumiendo el alimento; La puntuación 2 significa que las gallinas no se estaban alimentando, pero estaban a una distancia de 2 a 6 cm del comedero o tenían una gran motivación para acercarse al comedero; Una puntuación de 1 significa que las gallinas fueron exprimidas por las gallinas con una puntuación de 2, o deambulando y buscando oportunidades para acercarse al comedero; y una puntuación de 0 significa que las gallinas eran independientes y no luchaban por la comida, o estaban a más de 20 cm de distancia del comedero, o no mostraban ningún deseo de acercarse al comedero ya que estaban buscando alimento en la dirección opuesta al comedero. Cuanto mayor sea la puntuación, mayor será el rango social. El rango social de cada gallina se calculó para cada prueba, y la clasificación final se basó en la suma ordenada de las seis evaluaciones. Cuanto mayor sea la «suma ordenada», menor será el rango social. Posteriormente, se determinaron las aves de rango 1 (R1), R2, R3, R4, R5, R6, R7, R8, R9 y R10 en orden ascendente según el rango social. Luego, las aves R1 y R2 (cuatro duplicados, n = 8) fueron nombradas como el grupo HR, mientras que los individuos R9 y R10 fueron nombrados como el grupo LR (cuatro duplicados, n = 8).
Comportamiento alimentario, rendimiento productivo e índice de órganos
A partir de los 67 días de edad, se introdujo en el experimento un sistema de alimentación preciso (9WJJ-20 producido por Guangdong Guangxing Animal Husbandry Equipment Co.), que permite que solo se alimente un ave a la vez. Cada ave llevaba un brazalete en el tobillo en las patas para la identificación del sistema. Al utilizar el sistema, se registraron automáticamente datos como el peso corporal, la duración del tiempo de alimentación, el número de visitas por día, el tiempo de ocupación por visita, la ingesta de alimento por visita, el tiempo de ocupación por día y la ingesta diaria de alimento. En consecuencia, se calculó el peso corporal inicial, el peso corporal final y la ganancia de peso diaria promedio durante todo el período experimental. A la edad de 91 días, todas las gallinas fueron sacrificadas humanamente, y la bolsa del fabricio, el corazón, el hígado y el bazo de cada ave se recogieron para pesarlas inmediatamente. Para determinar el índice de estos órganos se utilizó el índice (%) = (peso del órgano/peso corporal) x 100%.
Prueba de vigilancia
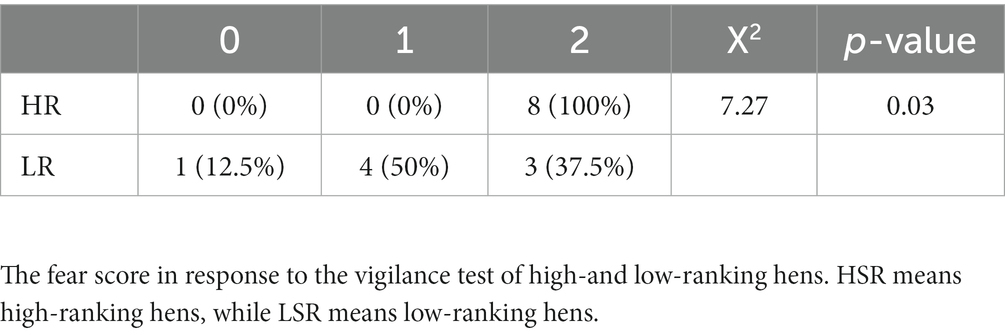
A los 61, 75, 79, 82 y 87 días de edad, se utilizó la misma arena para medir la atención de las aves de cada grupo en respuesta a un depredador. Las aves estaban acostumbradas a los gusanos vivos (200 g/d) como una fuente de alimento muy apreciada antes de la prueba, y los recibieron junto con las comidas regulares de los días 49 a 55. A las gallinas no se les proporcionó comida ni agua a las 18.00 horas del día anterior a la prueba. Se proporcionó alimento regular en una esquina del área de prueba, y se colocó alimento regular que contenía lombrices vivas en la otra esquina, 50 cm verticalmente por encima del alimento, junto con un modelo de halcón (largo: 30 cm; ancho: 30 cm). Además, durante la prueba de 12 minutos, las vocalizaciones de los halcones se reprodujeron tres veces (a los 4, 8 y 12 minutos), y la respuesta de las gallinas se calificó en una escala de 0 a 2, donde 0 denota el nivel más bajo de miedo. Brevemente, la puntuación 0 significaba que no había ningún cambio perceptible en el comportamiento de la gallina; La puntuación 1 significaba que la gallina levantaba la cabeza una vez e inmediatamente volvía a explorar o comer; La puntuación 2 significaba que la gallina levantó la cabeza una vez e hizo una llamada de alarma o caminó rápidamente durante más de 3 segundos o dejó de moverse durante 3 a 10 segundos.
Microbioma intestinal
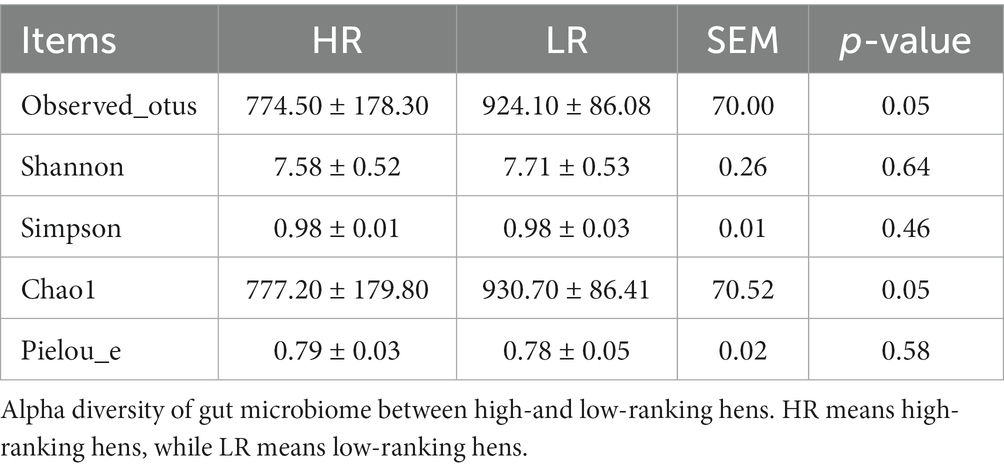
El día del sacrificio se colectó el contenido de ciego de las aves HR y LR. Antes de ser procesados, se mantuvieron en hielo seco y luego a -80 ° C. Con el fin de crear una biblioteca para la secuenciación, el ADN cecal se extrajo utilizando el microkit de heces QIAamp DNA (Tiangen Biotech, Beijing, China) de acuerdo con las instrucciones del fabricante. A continuación, se evaluó la calidad del ADN mediante electroforesis en gel de agarosa y se determinó la cantidad de ADN mediante un espectrofotómetro UV. Los fragmentos del gen 16S rRNA que contenían las regiones hipervariables V3 y V4 se amplificaron utilizando cebadores 5′-CCTACGGGNBGCASCAG-3′ y 5′-GACTACNVGGGTATCTAATCC-3′ (16). La plataforma Illumina NovaSeq se utilizó para secuenciar un total de amplicones de ARNr 16S. QIIME2 (versión 2022-2) (17) se utilizó para preprocesar, filtrar la calidad, recortar, eliminar el ruido, fusionar, modelar y analizar secuencias a través de DADA2. Se utilizó la base de datos SILVA para anotar secuencias de características para cada secuencia típica, y el paquete R (v3.5.2) se utilizó para graficar los resultados. El concepto de ASVs (Amplicon Sequence Variants) se utilizó para construir clases de OTUs (Unidades Taxonómicas Operativas). El análisis bioinformático se realizó utilizando los datos del ASV para determinar la abundancia relativa de rangos taxonómicos y la diversidad alfa. Se utilizó la diversidad alfa en términos de los índices observed_otus, Shannon, Simpson, chao1 y Pielou_e para explorar la diversidad de la muestra dentro del grupo. Los números índice más altos representan una mayor diversidad alfa. Utilizando las herramientas de OmicStudio que se encuentran en https://www.omicstudio.cn, se creó un mapa de calor de correlación de clustering con indicaciones.
Análisis estadístico
Todos los datos se analizaron mediante el programa SPSS 25 y se mostraron como media ± error estándar (EE). Se comprobó la normalidad y homogeneidad de la varianza de los datos de rendimiento de la producción, se transformaron cuando fue necesario y se analizaron mediante la prueba t. Se utilizó la prueba de Wilcoxon para analizar la puntuación obtenida en la prueba de vigilancia. Todos los valores con p < 0,05 se consideraron estadísticamente significativos (Tabla 1).
Declaración ética
Este estudio fue aprobado por el Comité de Cuidado de Animales de la Universidad de Foshan (ID de aprobación: FOSU#121).
Resultados
Rango social
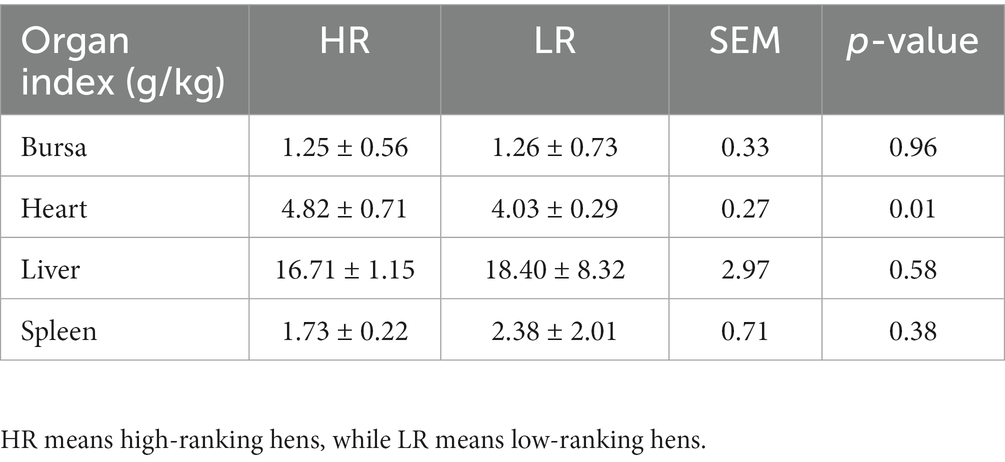
Como se muestra en la Figura 1, las gallinas numeradas 5 (suma ordenada: 14), 9 (18), 15 (9), 18 (13), 26 (17), 29 (18), 31 (10) y 39 (17) estaban en el grupo HR y las gallinas numeradas 3 (suma ordenada: 44), 6 (55), 14 (55), 20 (47), 22 (51), 25 (60), 32 (46) y 38 (51) estaban en el grupo LR.
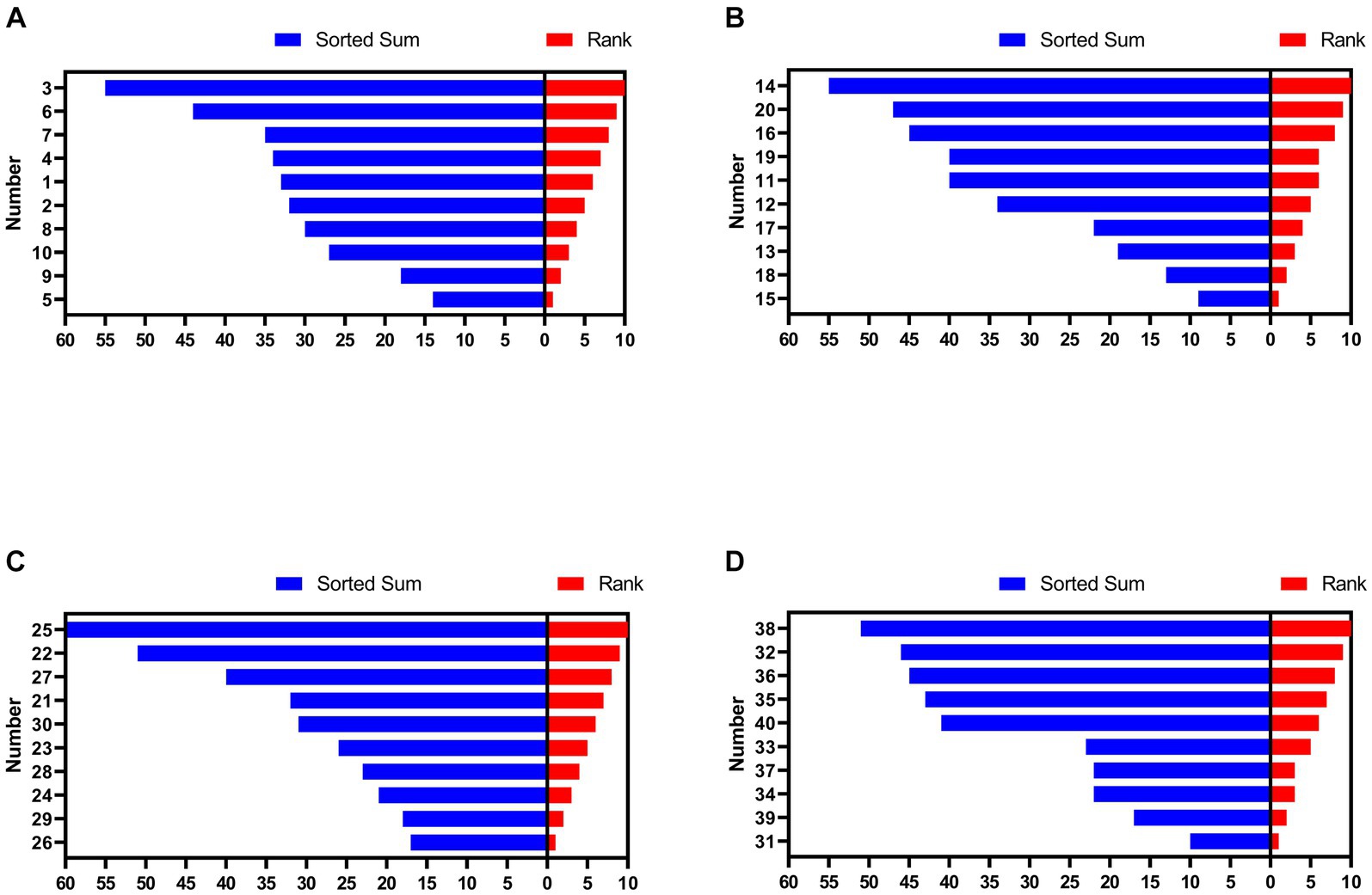 Figura 1. Rango social de las gallinas de cada grupo. A) Grupo 1. B) Grupo 2. c) Grupo 3. d) Grupo 4. Los números en el eje Y representan a cada gallina. HR significa gallinas de alto rango, mientras que LR significa gallinas de bajo rango.
Figura 1. Rango social de las gallinas de cada grupo. A) Grupo 1. B) Grupo 2. c) Grupo 3. d) Grupo 4. Los números en el eje Y representan a cada gallina. HR significa gallinas de alto rango, mientras que LR significa gallinas de bajo rango.
Comportamiento alimentario, rendimiento productivo e índice de órganos
El peso corporal de todos los animales aumentó gradualmente de los 67 a los 90 días de edad, pero el del grupo HR fue consistentemente mayor que el del grupo LR (Figura 2A). El peso corporal inicial (Figura 2B), el peso corporal final (Figura 2C), la ganancia diaria promedio (Figura 2D), el tiempo de ocupación por visita (Figura 2G) y la tasa de conversión alimenticia (Figura 2J) no fueron significativamente diferentes entre las gallinas HR y LR. Número de visitas por día (Figura 2E; p < 0,05), ingesta diaria de alimento (Figura 2H; p < 0,05) y el tiempo de ocupación por día (Figura 2F; p < 0,01) fueron significativamente mayores, mientras que el consumo de alimento por visita (Figura 2I; p < 0,05) fue significativamente menor en la FC que en la LR. El índice cardíaco fue significativamente mayor en el grupo HR que en el grupo LR (Tabla 2; p = 0,01), pero no hubo diferencias significativas entre los dos grupos en los índices de bursa, hígado y bazo.
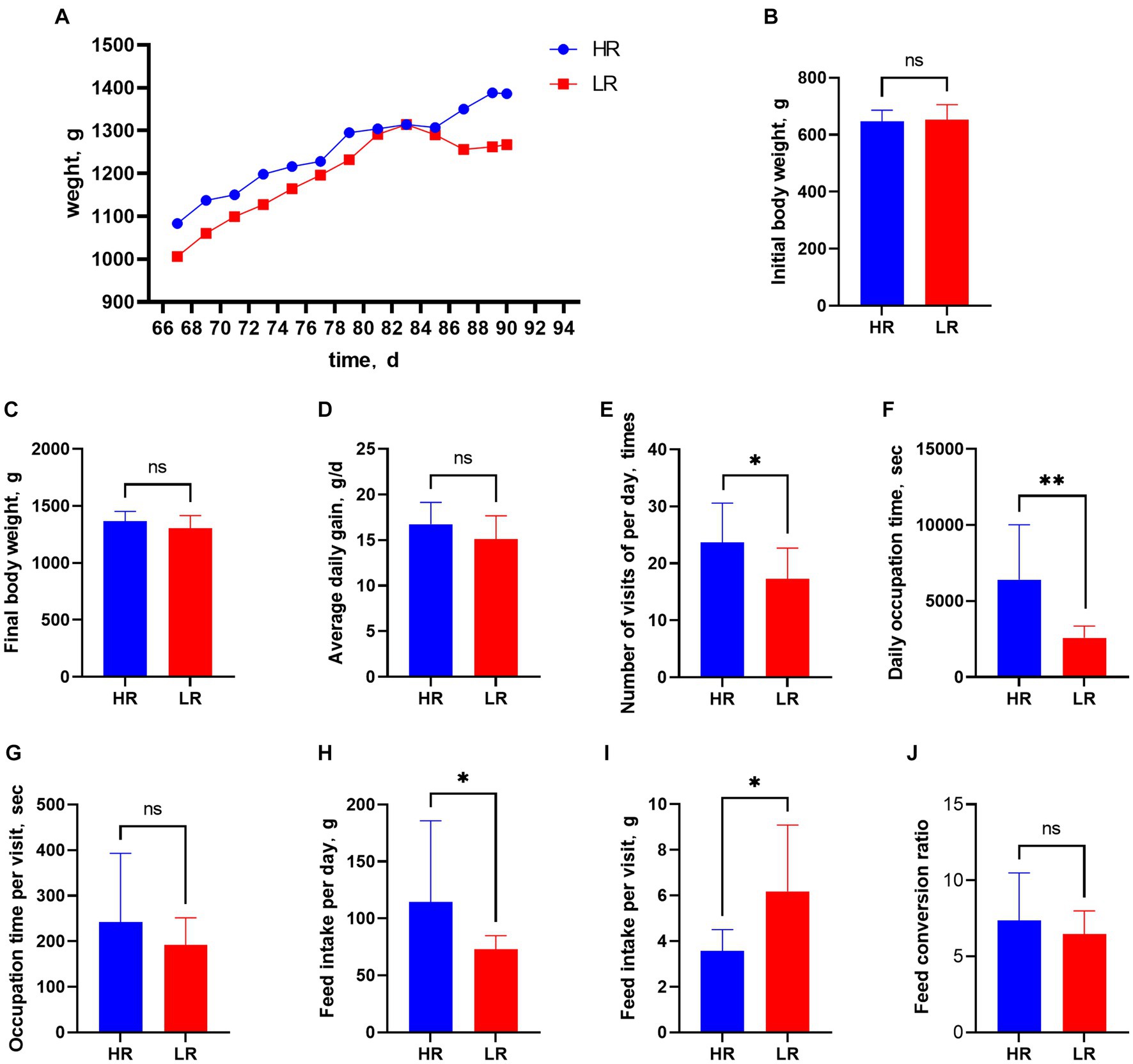 Figura 2. Comportamiento alimentario y rendimiento productivo. Figura 2 Comportamiento alimentario y rendimiento productivo. (A) Peso corporal de 67 a 90 días de edad. (B) Peso corporal inicial. (C) Peso corporal final. (D) Ganancia media diaria. (E) Número de visitas por día. (F) Tiempo de ocupación por día. (G) Tiempo de ocupación por visita. (H) Ingesta diaria de alimento. (I) Ingesta de alimento por visita. (J) Índice de conversión alimenticia. HR significa gallinas de alto rango, mientras que LR significa gallinas de bajo rango. «ns» significa no significativo. Los asteriscos denotan desviaciones significativas (*p < 0,05, **p < 0,01).
Figura 2. Comportamiento alimentario y rendimiento productivo. Figura 2 Comportamiento alimentario y rendimiento productivo. (A) Peso corporal de 67 a 90 días de edad. (B) Peso corporal inicial. (C) Peso corporal final. (D) Ganancia media diaria. (E) Número de visitas por día. (F) Tiempo de ocupación por día. (G) Tiempo de ocupación por visita. (H) Ingesta diaria de alimento. (I) Ingesta de alimento por visita. (J) Índice de conversión alimenticia. HR significa gallinas de alto rango, mientras que LR significa gallinas de bajo rango. «ns» significa no significativo. Los asteriscos denotan desviaciones significativas (*p < 0,05, **p < 0,01).
Pruebas de vigilancia
En respuesta a la prueba de vigilancia (Tabla 2), la puntuación 2 del grupo HR fue (100%) significativamente mayor que la del grupo LR (50%).
Microbioma intestinal
En nuestro análisis, se observaron un total de 5.144 ASV tanto en los grupos de HR como en los de bajo riesgo. De ellos, 1.528 ASV estaban presentes exclusivamente en el grupo HR, mientras que 2.170 ASV eran exclusivos del grupo LR (Figura 3A). A nivel de filo, los tres filos principales en el ciego de pollo fueron Bacteroidetes, Firmicutes y Proteobacteria (Figura 3C). La abundancia relativa de Firmicutes (p < 0.05) fue mayor en las gallinas de alto rango que en las de bajo rango, mientras que la abundancia relativa de Deferribacterota (p < 0.05) fue menor en las gallinas de alto rango que en las de bajo rango (Figura 3E). A nivel de género, los tres microbios principales fueron Bacteroides, Rikenellaceae del grupo intestinal RC9 y Clostridia UCG-014 sin clasificar (Figura 3D). La abundancia relativa de Succinatimonas (p < 0.05), del grupo Eubacterium hallii (p < 0.05) y Anaerostipes (p < 0.05) en las gallinas de alto rango fue mayor que la de las gallinas de bajo rango. Al mismo tiempo, la abundancia relativa de Bacteroides (p < 0.01), Mucispirillum (p < 0.05), Subdoligranulum (p < 0.05) y Barnesiellaceae no clasificadas (p < 0.05) fue menor en las gallinas de alto rango que en las de bajo rango (Figura 3F).
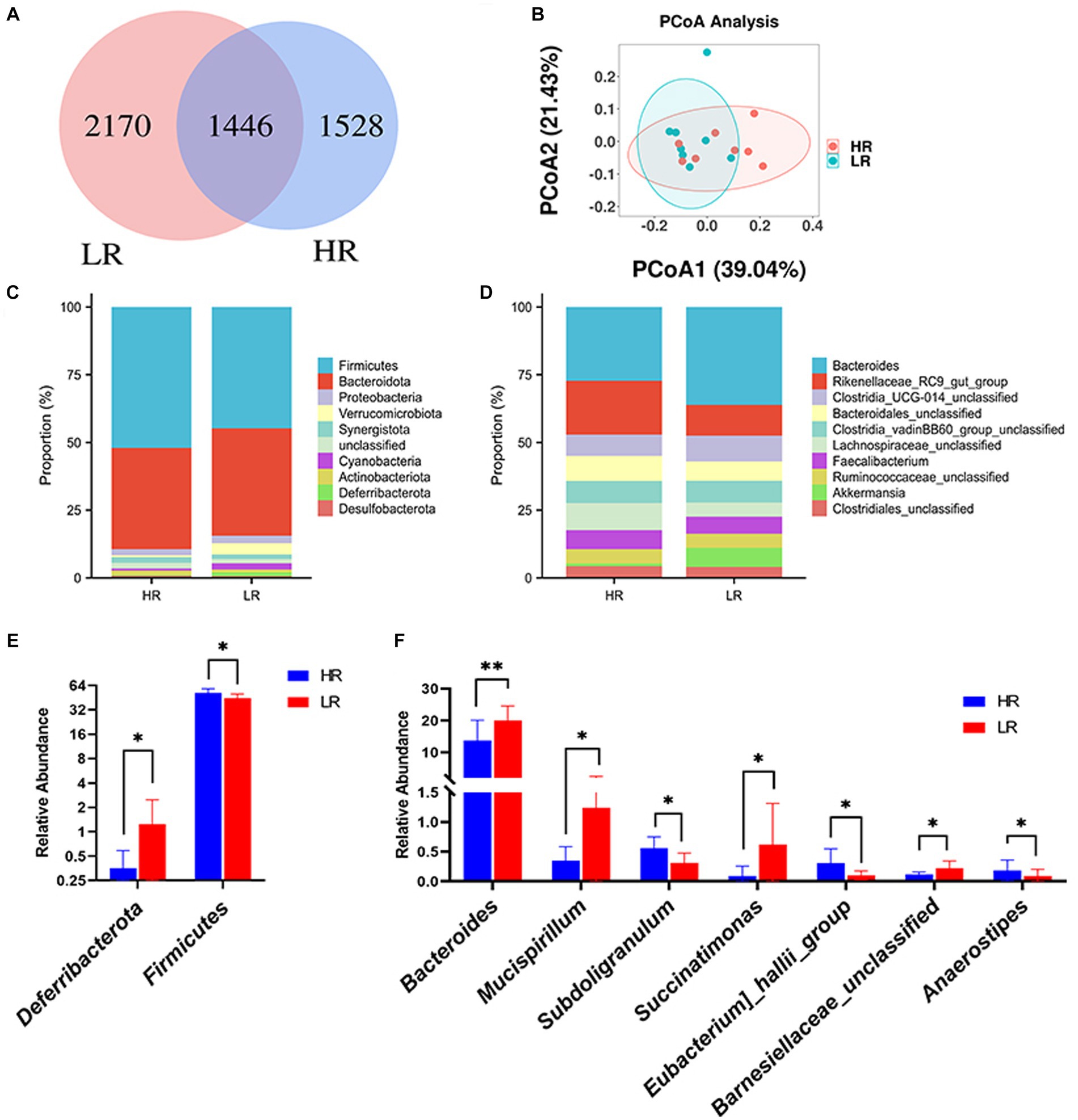 Figura 3. Microbioma intestinal. (A) Diagrama de Venn de distribución del ASV. (B) Análisis de coordenadas principales (PCOA) de la microbiota cecal. (C) Abundancia relativa de microbios intestinales a nivel de filo. (D) Abundancia relativa de microbios intestinales a nivel de género. (E) Análisis diferencial de microbios intestinales a nivel de filo. (F) Análisis diferencial de microbios intestinales a nivel de género. HR significa gallinas de alto rango, mientras que LR significa gallinas de bajo rango. Los asteriscos denotan desviaciones significativas (*p < 0,05, **p < 0,01).
Figura 3. Microbioma intestinal. (A) Diagrama de Venn de distribución del ASV. (B) Análisis de coordenadas principales (PCOA) de la microbiota cecal. (C) Abundancia relativa de microbios intestinales a nivel de filo. (D) Abundancia relativa de microbios intestinales a nivel de género. (E) Análisis diferencial de microbios intestinales a nivel de filo. (F) Análisis diferencial de microbios intestinales a nivel de género. HR significa gallinas de alto rango, mientras que LR significa gallinas de bajo rango. Los asteriscos denotan desviaciones significativas (*p < 0,05, **p < 0,01).
La diversidad beta del microbioma intestinal entre las gallinas HR y LR fue significativamente diferente mediante el análisis de PCoA basado en la matriz de distancia unifrac ponderada (Figura 3B). La diversidad alfa fue significativamente menor en el grupo HR que en el grupo LR en términos de índice observed_otus y chao1 (Tabla 3; p = 0,05), sin diferencias en cuanto a los índices de Shannon, Simpson y Pielou.
La abundancia relativa de phylum_Firmicutes se correlacionó significativa y positivamente con el tiempo de ocupación por día (p < 0.01), y la del filo Deferribacterota se correlacionó significativa y negativamente con el tiempo de ocupación por día (p < 0.05) (Figura 4A). A nivel de género (Figura 4B), la abundancia relativa de Anaerostipes se correlacionó significativa y positivamente con el tiempo de ocupación por día (p < 0.01). La abundancia relativa del grupo Eubacterium hallii se correlacionó significativa y positivamente con la ingesta de alimento por visita (p < 0.05) y negativamente con el tiempo de ocupación por día (p < 0.05). El subdoligranulum se correlacionó significativa y positivamente con la ingesta diaria de alimento (p < 0.05). La abundancia relativa de Bacteroides se correlacionó significativa y positivamente con la ingesta de alimento por visita (p < 0.05), y se correlacionó negativamente con la ganancia diaria promedio (p < 0.05). La abundancia relativa de Barnesiellaceae no clasificada se correlacionó significativa y negativamente con el peso corporal final (p < 0,05). La abundancia relativa de Mucispirillum y Succinatimonas se correlacionó significativamente negativamente con el tiempo de ocupación por día (p < 0,05).
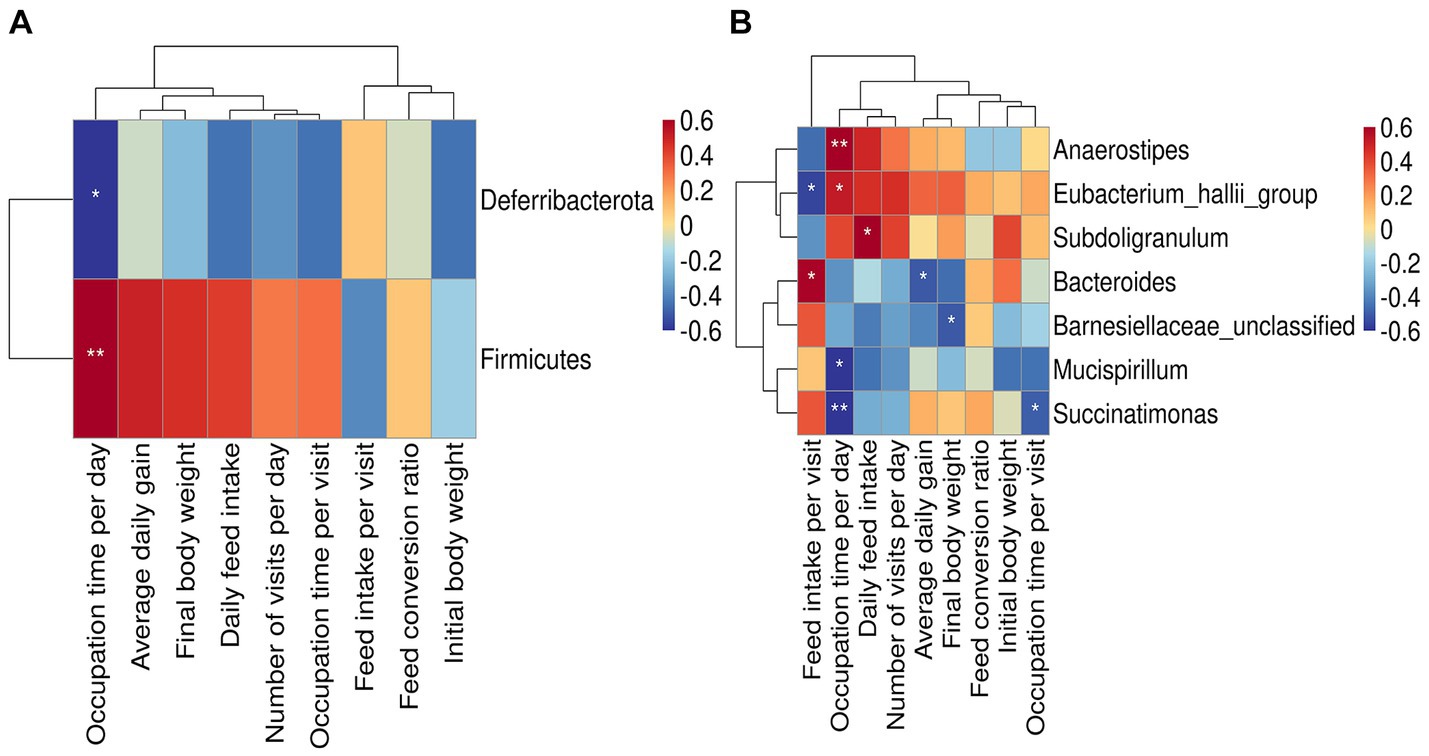 Figura 4. Relación entre las bacterias y el comportamiento alimentario o el rendimiento productivo. (A) Mapa de calor de la correlación entre los microbios intestinales a nivel de filo y el comportamiento alimentario o el rendimiento productivo. (B) Mapa de calor de la correlación entre los microbios intestinales a nivel de género y el comportamiento alimentario o el rendimiento productivo. Los asteriscos denotan desviaciones significativas (*p < 0,05, **p < 0,01).
Figura 4. Relación entre las bacterias y el comportamiento alimentario o el rendimiento productivo. (A) Mapa de calor de la correlación entre los microbios intestinales a nivel de filo y el comportamiento alimentario o el rendimiento productivo. (B) Mapa de calor de la correlación entre los microbios intestinales a nivel de género y el comportamiento alimentario o el rendimiento productivo. Los asteriscos denotan desviaciones significativas (*p < 0,05, **p < 0,01).
Discusiones
La jerarquía social suele establecerse en términos de interacciones agresivas tanto en los animales machos como en las hembras, como se mencionó anteriormente (7, 10). Sin embargo, en algunos casos el comportamiento agresivo es raro en las hembras, lo que dificulta el establecimiento de una jerarquía social. En este estudio, establecimos una competencia alimentaria y encontramos un orden claro de acceso a los recursos alimenticios entre las gallinas perdiz Qingyuan. Las aves de mayor rango tenían prioridad para buscar alimento, las aves subdominantes siempre observaban y luego buscaban oportunidades para alimentarse, y las aves de menor rango no participaban en la competencia por el alimento ni se entregaban a las aves de mayor rango. En consecuencia, utilizamos la posición relativa alrededor del alimentador para calcular el rango social. El principio del beneficio de rango ventajoso sugiere que el rango social afecta la distribución de los recursos ventajosos entre los individuos, y los individuos de mayor rango son propensos a tener recursos más ventajosos (18). Por ejemplo, Shimmura et al. (19) encontraron que los resultados de la competencia por los recursos alimenticios se correlacionaban positivamente con el rango social de las gallinas, y las gallinas de alto rango tenían prioridad para usar instalaciones de bienestar como perchas y cajas de puesta (20). En este estudio, el número de visitas por día, así como el tiempo de ocupación por día en el grupo HR fue significativamente mayor que en el grupo LR, lo que indica que las gallinas de mayor rango social tenían más oportunidades de alimentarse. Sin embargo, el peso corporal inicial, el peso corporal final y la ganancia diaria promedio no fueron diferentes entre las gallinas de alto y bajo rango. Esto es coherente con un estudio con cerdos (21) y puede explicarse por el hecho de que los animales en el mismo entorno asegurarán su propia ingesta requerida mediante la selección de múltiples estrategias de alimentación igualmente efectivas (22). Los cerdos adoptarán diferentes patrones dietéticos de carnívoros (pocas comidas largas todos los días) o mordisqueadores (muchas comidas cortas todos los días). Descubrimos que los pollos de alto rango tenían prioridad de alimentación (7), mientras que los pollos de bajo rango también tenían acceso a alimentos para satisfacer sus necesidades después de que las aves de rango superior terminaron de alimentarse. La ingesta de alimento por visita fue significativamente mayor en el grupo LR que en el grupo HR, lo cual fue inesperado y puede sugerir que las gallinas con bajo rango social necesitan satisfacer sus necesidades energéticas y nutricionales dentro de un período de tiempo limitado. Esta es probablemente la razón principal por la que no hay diferencia en el peso corporal entre las gallinas de alto y bajo rango, independientemente del peso corporal consistentemente mayor de la FC que de la LR. Nuestros resultados muestran que las gallinas de alto rango social tienen una tremenda ventaja en términos de acceso a los recursos. Mientras tanto, las gallinas de rango inferior utilizan una estrategia de aumento de la ingesta de alimento por visita para garantizar la ingesta diaria de alimentos.
En un estudio anterior, se encontraron mejores funciones inmunes en monos rhesus de rango superior que en individuos de menor rango (23). Calculamos los índices de órganos relacionados con la función inmune y no encontramos la diferencia en los índices de hígado, bazo y bursa entre las aves de alto y bajo rango. Además, el índice cardíaco de las gallinas en el grupo HR fue significativamente más alto que el del grupo LR, lo que puede sugerir una mejor capacidad aeróbica en las aves HR que en las aves LR (24). En particular, una mayor capacidad de ejercicio significa un mayor consumo de energía, es decir, las gallinas de alto rango pueden obtener más comida pero también consumir más energía, lo que puede ser una de las causas de que no haya diferencias en el peso corporal entre las gallinas de alto y bajo rango.
El comportamiento antidepredador se refiere a una variedad de comportamientos exhibidos por las especies de presa en respuesta a los depredadores, incluido el estado de alerta, la agresión y la vocalización (25). Se ha informado que las aves de bajo rango están más atentas cuando adoptan la forma de exploración visual (26). El estrés es una manifestación de la hipervigilancia y se considera una respuesta a la incertidumbre (27). Por lo tanto, se considera que los animales de bajo rango son más temerosos y sufren más estrés en comparación con los animales de alto rango (28). Sin embargo, las gallinas de alto rango mostraron más vigilancia frente al peligro que las gallinas de bajo rango en este estudio. Como se sabe, un nivel adecuado de estrés se considera un mecanismo de afrontamiento adaptativo porque permite a los animales evitar amenazas potenciales y aprovechar las oportunidades para mejorar la clasificación o acceder a los recursos (29). Especulamos que la mayor vigilancia de las gallinas de alto rango puede deberse a las amenazas percibidas desde el exterior.
La diversidad alfa se utiliza principalmente para reflejar la riqueza de especies y como un indicador de estrés reportado en estudios de pollo (30), ratones (31) y lácteos (32). En el presente estudio, la diversidad alfa de las gallinas de bajo rango fue mayor que la de las gallinas de alto rango. Este hallazgo puede sugerir un mayor estrés de las aves de mayor rango que de las aves de menor rango, lo que de alguna manera está respaldado por la respuesta de miedo entre las gallinas HR y LR. A nivel de filo, Bacteroidetes, Firmicutes y Proteobacteria fueron los más abundantes en la microbiota cecal, lo que fue consistente con estudios previos (33, 34). Los firmicutes desempeñan un papel fundamental en la fermentación de polisacáridos complejos (35) y contribuyen significativamente a la digestión de las fibras vegetales (36). Su mayor abundancia en el tracto gastrointestinal ayuda a proporcionar a los animales en crecimiento nutrientes esenciales y recursos energéticos (37). Además, los Firmicutes abarcan un número sustancial de bacterias grampositivas, algunas de las cuales son beneficiosas y contribuyen a la defensa patógena mientras mantienen un equilibrio en la microflora intestinal (38). Los Deferribacteres, otro grupo bacteriano, obtienen energía a través del metabolismo anaeróbico exclusivo o partenogenético, influyendo en el metabolismo del hierro y estando asociados con la homeostasis intestinal del hierro (39). Los microorganismos necesitan hierro para el crecimiento y el metabolismo (40), por lo que la menor abundancia de Deferribacteres puede ser una de las razones de la menor diversidad alfa en las gallinas de alto rango que en las de bajo rango. El género Succinatimonas puede utilizar pequeñas cantidades de azúcar y producir ácidos succínico y acético a partir de la glucosa como productos finales primarios de la fermentación (41). Una abundancia más próspera del género intestinal Eubacterium hallii representa un mejor nivel de función social (42), que puede utilizar glucosa, intermedios de fermentación acetato y lactato para crear el butirato beneficioso para la salud intestinal (43, 44). Los anaerostipes son conocidos por su capacidad para producir butirato a partir de azúcares, así como lactato y acetato (45), lo que tiene un papel potencialmente beneficioso en la promoción de la salud del huésped (46). Los bacteroides son bacilos grampositivos anaeróbicos, resistentes a la bilis y no formadores de esporas que son patógenos clínicamente importantes que se observan en la mayoría de las infecciones anaeróbicas (47). En las muestras de ciego de cerdos, Bacteroides se asoció negativamente con los rasgos de gordura (48). Además, se sabía que la reducción de la abundancia de Mucispirillum en la microbiota intestinal estaba relacionada con la disminución de los triglicéridos sanguíneos y de los ácidos grasos libres en ratones (44). Existe evidencia de que el subdoligranulum se asocia con inflamación crónica y control metabólico ineficiente (45). Barnesiellaceae no clasificada se correlacionó significativa y positivamente con el ácido propiónico en ratones (46). Estos resultados pueden sugerir más bacterias beneficiosas y un mejor ambiente intestinal en gallinas de alto rango que en gallinas de bajo rango.
La abundancia relativa de Firmicutes, Deferribacterota, Anaerostipes, Eubacterium hallii group, Mucispirillum y Succinatimonas se correlacionó con el tiempo de ocupación por día. La magnitud del tiempo de ocupación por día representa el apetito de los individuos. El apetito es un impulso inherente requerido para sostener la existencia orgánica (49). La ingesta de alimento por visita y el tiempo de ocupación por visita dependen del grado de saciedad estomacal y de la capacidad gástrica de cada gallina. En nuestro estudio, la ingesta de alimento por visita se relacionó con la abundancia relativa del grupo Eubacterium hallii y Bacteroides, mientras que el tiempo de ocupación por visita se relacionó con la abundancia relativa de Succinatimonas. En el ganado bovino, la ingesta de alimento depende principalmente del apetito y de la capacidad ruminal (50). Todavía no se sabe si estas bacterias tienen algún efecto sobre el apetito, y se necesita más investigación para descubrir esta interacción entre el apetito y los microbios intestinales, a fin de comprender mejor la función microbiana en el rendimiento de la producción.
Conclusión
La jerarquía social de las gallinas que rara vez expresan una interacción agresiva podría calcularse por la posición relativa alrededor del comedero cuando compiten por la comida. Las gallinas dominantes tienen una capacidad versátil, están más vigilantes y tienen acceso prioritario a los recursos alimenticios, mientras que las gallinas de bajo rango adoptan estrategias para obtener suficiente alimento para mantenerse y, por lo tanto, no muestran diferencias en el peso corporal con las gallinas de alto rango. Las gallinas de alto rango poseen bacterias beneficiosas que utilizan sustancias favorables para mantener la salud intestinal. Se ha encontrado que la abundancia relativa de algunas bacterias está asociada con el apetito; sin embargo, su mecanismo subyacente debe clasificarse con más detalle.
Declaración de disponibilidad de datos
Los conjuntos de datos presentados en este estudio se pueden encontrar en repositorios en línea. Los nombres de los repositorios y los números de acceso se pueden encontrar en: https://www.ncbi.nlm.nih.gov/, PRJNA1029363.
Declaración ética
Los estudios en animales fueron aprobados por el Comité Institucional de Cuidado y Uso de Animales de la Universidad de Foshan. Los estudios se llevaron a cabo de acuerdo con la legislación local y los requisitos institucionales. Se obtuvo el consentimiento informado por escrito de los propietarios para la participación de sus animales en este estudio.
Contribuciones de los autores
ZX: Curación de datos, Análisis formal, Investigación, Metodología, Redacción – borrador original, Redacción – revisión y edición. LX: Curación de datos, Análisis formal, Investigación, Metodología, Redacción – revisión y edición. MZ: Curación de datos, investigación, metodología, redacción, revisión y edición. LZ: Curación de datos, Investigación, Metodología, Redacción, revisión y edición. JL: Metodología, Redacción – revisión y edición. YL: Metodología, Redacción – revisión y edición. JG: Curación de datos, Recursos, Redacción, revisión y edición. SC: Conceptualización, Metodología, Administración de proyectos, Redacción – borrador original, Redacción – revisión y edición. NS: Conceptualización, Redacción – revisión y edición.
Financiación
El/los autor/es declara(n) haber recibido apoyo financiero para la investigación, autoría y/o publicación de este artículo. Esta investigación fue financiada por la Fundación Nacional de Ciencias Naturales (32102596), Principales proyectos en mejoramiento genético de biología agrícola (2023ZD0406401), el Laboratorio Clave Provincial de Guangdong de Diseño Molecular Animal y Cría Precisa (2019B030301010, 2019KSYS011) y el proyecto de investigación de innovación Característica para profesores de colegios y universidades (BKS209111).
Conflicto de intereses
JG fue empleado de Guangdong Tinoo’s Foods Group Co., Ltd.
El resto de los autores declaran que la investigación se llevó a cabo en ausencia de relaciones comerciales o financieras que pudieran interpretarse como un potencial conflicto de intereses.
Nota del editor
Todas las afirmaciones expresadas en este artículo son únicamente las de los autores y no representan necesariamente las de sus organizaciones afiliadas, ni las del editor, los editores y los revisores. Cualquier producto que pueda ser evaluado en este artículo, o afirmación que pueda ser hecha por su fabricante, no está garantizado ni respaldado por el editor.
Material complementario
El material complementario para este artículo se puede encontrar en línea en: https://www.frontiersin.org/articles/10.3389/fvets.2023.1324937/full#supplementary-material
Referencias
1. Pandey, A, y Bloch, G. El homólogo de Kruppel 1 media el rango de dominancia regulado hormonalmente en una abeja social. Biología-Basilea. (2021) 10:1188. doi: 10.3390/biology10111188
Resumen de PubMed | Texto completo de CrossRef | Google Académico
2. Vargas-Pérez, H, Sellings, L, Grieder, T, y Díaz, JL. El rango de dominancia social influye en el comportamiento de correr de la rueda en ratones. Neurosci Lett. (2009) 457:137–40. doi: 10.1016/j.neulet.2009.03.098
Resumen de PubMed | Texto completo de CrossRef | Google Académico
3. Bica, GS, Filho, LCPM, Teixeira, DL, Sousa, KTD y Htzel, MJ. El tiempo de suplementación de grano y la dominancia social modifican el comportamiento alimentario de las vaquillas en sistemas de pastoreo rotacional. Fronteras de la Ciencia Veterinaria. (2020) 7:61. doi: 10.3389/fvets.2020.00061
4. Ma, M, Xiong, W, Hu, F, Deng, MF y Zhu, LQ. Una nueva vía regula la jerarquía social a través del lncRNA AtLAS y la sinapsina postsináptica IIb. Cell Res. (2020) 30:105–18. doi: 10.1038/s41422-020-0273-1
Resumen de PubMed | Texto completo de CrossRef | Google Académico
5. Giavazzi, F, Saino, N, y Vailati, A. El alto rango alivia la competencia local masculina en los sistemas de apareamiento de lek. Sci Rep. (2018) 8:15189. doi: 10.1038/s41598-018-33292-3
6. Rárová Pinka, M, y Ceacero, F. Una posición de dominancia más alta no resulta en un mayor éxito reproductivo en el ganado vacuno hembra. J Anim Sci. (2017) 95:3301–9. doi: 10.2527/jas.2017.1415
7. Rohwer, S. La importancia social de la variabilidad del plumaje invernal de las aves. Evolución. (1975) 29:593–610. doi: 10.1111/j.1558-5646.1975.tb00853.x
Resumen de PubMed | Texto completo de CrossRef | Google Académico
8. Shimmura, T, Ohashi, S, y Yoshimura, T. El gallo de mayor rango tiene prioridad para anunciar el amanecer. Sci Rep. (2015) 5:5. doi: 10.1038/srep11683
Resumen de PubMed | Texto completo de CrossRef | Google Académico
9. Lelono, A, Riedstra, B, y Groothuis, T. Los niveles de testosterona de la eyaculación afectan la inversión materna en el gallo selvático rojo (Gallus gallus gallus). Sci Rep. (2019) 9:1–10. DOI: 10.1038/s41598-019-48563-w
Resumen de PubMed | Texto completo de CrossRef | Google Académico
10. Appleby, MC, Walker, AW, Nicol, CJ, Lindberg, AC y Elson, HA. Desarrollo de jaulas amuebladas para gallinas ponedoras. Hno. Poult Sci. (2002) 43:489–500. doi: 10.1080/0007166022000004390
11. Cunningham, DL y Tienhoven, AV. Relación entre los factores de producción y la dominancia en gallinas Leghorn blancas en un estudio sobre el rango social y el diseño de jaulas. Appl Anim Ethol. (1983) 11:33–44. doi: 10.1016/0304-3762(83)90077-9
12. Lundberg, A, y Keeling, LJ. Impacto de los factores sociales en la anidación en gallinas ponedoras (Gallus gallus domesticus). Appl Anim Behav Sci. (1999) 64:57–69. doi: 10.1016/s0168-1591(99)00020-9
13. Cox, CM, y Dalloul, RA. Papel inmunomodulador de los probióticos en aves de corral y potencial en ovo aplicación. Microbios benéficos. (2015) 6:45–52. doi: 10.3920/bm2014.0062
14. Broom, LJ, y Kogut, MH. El papel del microbioma intestinal en la configuración del sistema inmunitario de los pollos. Veterinario Inmunol Inmunopatíaco. (2018) 204:44–51. doi: 10.1016/j.vetimm.2018.10.002
Resumen de PubMed | Texto completo de CrossRef | Google Académico
15. Chen, SY, Yan, C, Liu, W, Chen, KC, Xing, LM, Li, H, et al. Nota de investigación: el microbioma intestinal integrado y los ácidos grasos de cadena corta responden a la jerarquía de dominancia en los gallos. Poult Sci. (2022) 101:101670. doi: 10.1016/j.psj.2021.101670
Resumen de PubMed | Texto completo de CrossRef | Google Académico
16. Logue, JB, Stedmon, CA, Kellerman, AM, Nielsen, NJ, Andersson, AF, Laudon, H, et al. Conocimientos experimentales sobre la importancia de la composición de la comunidad bacteriana acuática para la degradación de la materia orgánica disuelta. ISME J. (2016) 10:533–45. doi: 10.1038/ismej.2015.131
Resumen de PubMed | Texto completo de CrossRef | Google Académico
17. Bolyen, E, Rideout, JR, Dillon, MR, Bokulich, NA, Abnet, CC, Al-Ghalith, GA, et al. Ciencia de datos de microbioma reproducible, interactiva, escalable y extensible utilizando QIIME 2. Nat Biotechnol. (2019) 37:1091–1. doi: 10.1038/s41587-019-0252-6
Resumen de PubMed | Texto completo de CrossRef | Google Académico
18. Leinfelder, I, De Vries, H, Deleu, R, y Nelissen, M. Rango y reciprocidad de acicalamiento entre hembras en un grupo mixto de babuinos hamadryas cautivos. Am J Primatol. (2001) 55:25–42. doi: 10.1002/ajp.1036
19. Shimmura, T, Nakamura, T, Azuma, T, Eguchi, Y y Tanaka, T. Efectos del rango social y la familiaridad en los baños de polvo en aves domésticas. Anim Welfare (South Mimms, Inglaterra). (2010) 19:67–73. doi: 10.1016/j.anbehav.2009.11.016
20. Freire, R, Appleby, MC y Hughes, BO. Efectos de las interacciones sociales en el comportamiento previo a la puesta en gallinas. Appl Anim Behav Sci. (1998) 56:47–57. doi: 10.1016/s0168-1591(96)01196-3
21. Hoy, S, Schamun, S, y Weirich, C. Investigaciones sobre la ingesta de alimento y el comportamiento social de los cerdos de engorde alimentados en una estación de alimentación electrónica. Appl Anim Behav Sci. (2012) 139:58–64. doi: 10.1016/j.applanim.2012.03.010
22. Fernández, J, Fábrega, E, Soler, J, Tibau, J, Ruiz, J.L., Puigvert, X, et al. Estrategia de alimentación en cerdos en crecimiento alojados en grupo de cuatro razas diferentes. Appl Anim Behav Sci. (2011) 134:109–20. doi: 10.1016/j.applanim.2011.06.018
23. Snyder-Mackler, N, Sanz, J, Kohn, JN, Brinkworth, JF, Morrow, S, Shaver, AO, et al. El estatus social altera la regulación inmune y la respuesta a la infección en los macacos. Ciencia. (2016) 354:1041–5. doi: 10.1126/science.aah3580
Resumen de PubMed | Texto completo de CrossRef | Google Académico
24. Stoyell-Conti, FF, Irigoyen, MC, Sartori, M, Ribeiro, AA, y Angelis, KD. El entrenamiento aeróbico es mejor que el entrenamiento de resistencia sobre la función cardíaca y la modulación autonómica en ratones hembra Ob/Ob. Fisiola delantera. (2019) 10:10. doi: 10.3389/fphys.2019.01464
Resumen de PubMed | Texto completo de CrossRef | Google Académico
25. Fichtel, C. Evitar a los depredadores por la noche: estrategias antidepredadoras en lémures deportivos de cola roja (Lepilemur ruficaudatus). Am J Primatol. (2007) 69:611–24. doi: 10.1002/ajp.20363
Resumen de PubMed | Texto completo de CrossRef | Google Académico
26. Ekman, J. Exposición y uso del tiempo en bandadas de herrerillos de sauce: el costo de la subordinación. Anim Behave. (1987) 35:445–52. doi: 10.1016/S0003-3472(87)80269-5
27. Clauss, JA, Avery, SN, Benningfield, MM, y Blackford, JU. La ansiedad social se asocia con la respuesta de BNST a la imprevisibilidad. Deprime la ansiedad. (2019) 36:666–75. doi: 10.1002/da.22891
Resumen de PubMed | Texto completo de CrossRef | Google Académico
28. Otten, W, Puppe, B, Kanitz, E, Schön, PC y Stabenow, B. Efectos fisiológicos y conductuales de diferentes éxitos durante la confrontación social en cerdos con experiencia previa de dominancia. Physiol Behave. (2002) 75:127–33. doi: 10.1016/S0031-9384(01)00630-8
Resumen de PubMed | Texto completo de CrossRef | Google Académico
29. Wright, EC, Hostinar, CE, y Trainor, BC. Ansioso por verte: mecanismos neuroendocrinos de vigilancia social y ansiedad durante la adolescencia. Eur J Neurosci. (2020) 52:2516–29. doi: 10.1111/ejn.14628
Resumen de PubMed | Texto completo de CrossRef | Google Académico
30. Chen, SY, Xiang, H, Zhang, H, Zhu, X, Wang, D, Wang, JK, et al. El sistema de cría provoca cambios en el comportamiento, el microbioma y la expresión génica de los pollos. Poult Sci. (2019) 98:3365–76. doi: 10.3382/ps/pez140
Resumen de PubMed | Texto completo de CrossRef | Google Académico
31. Bailey, MT, Dowd, SE, Parry, NMA, Galley, JD, Schauer, DB y Lyte, M. La exposición a factores estresantes altera las poblaciones microbianas comensales en los intestinos y conduce a un aumento de la colonización por Citrobacter rodentium. Infectar a Immun. (2010) 78:1509–19. doi: 10.1128/IAI.00862-09
Resumen de PubMed | Texto completo de CrossRef | Google Académico
32. Chen, SY, Wang, J, Peng, DD, Li, G, Chen, J y Gu, XH. La exposición al ambiente de estrés por calor afecta la fisiología, los niveles de circulación de citocinas y el microbioma en las vacas lecheras. Sci Rep. (2018) 8:14606. doi: 10.1038/s41598-018-32886-1
Resumen de PubMed | Texto completo de CrossRef | Google Académico
33. Lee, KC, Kil, DY y Sul, WJ. Divergencia del microbioma cecal de pollos de engorde según sexo y peso corporal. J Microbiol. (2017) 55:939–45. doi: 10.1007/s12275-017-7202-0
Resumen de PubMed | Texto completo de CrossRef | Google Académico
34. Dong, XX, Hu, B, Wan, WL, Gong, YZ y Feng, YP. Efectos de los sistemas de cría y la cepa de pollos autóctonos chinos sobre la diversidad microbiana del ciego. Australas Asiáticas J Anim Sci. (2020) 33:1610–6. doi: 10.5713/ajas.19.0157
Resumen de PubMed | Texto completo de CrossRef | Google Académico
35. Campos, P, Guivernau, M, Prenafeta-Boldu, FX y Cardona, L. Adquisición rápida de un microbioma intestinal de fermentación de polisacáridos por tortugas verdes juveniles Chelonia mydas después del asentamiento en hábitats costeros. Microbioma. (2018) 6:69. doi: 10.1186/s40168-018-0454-z
Resumen de PubMed | Texto completo de CrossRef | Google Académico
36. Thoetkiattikul, H, Mhuantong, W, Laothanachareon, T, Tangphatsornruang, S, Pattarajinda, V, Eurwilaichitr, L, et al. Análisis comparativo de los perfiles microbianos en el rumen de vacas alimentadas con diferentes fibras dietéticas mediante pirosecuenciación del gen 16S rRNA marcado. Curr Microbiol. (2013) 67:130–7. doi: 10.1007/s00284-013-0336-3
Resumen de PubMed | Texto completo de CrossRef | Google Académico
37. Sun, BH, Wang, X, Bernstein, S, Huffman, MA, Xia, DP, Gu, ZY, et al. Marcada variación entre la microbiota intestinal de invierno y primavera en macacos tibetanos (Macaca thibetana) en libertad. Sci Rep. (2016) 6:26035. doi: 10.1038/srep26035
Resumen de PubMed | Texto completo de CrossRef | Google Académico
38. Garneau, JE, Tremblay, DM, y Moineau, S. Caracterización de 1706, un fago virulento de Lactococcus lactis con similitudes a los profagos de otros Firmicutes. Virología. (2008) 373:298–309. doi: 10.1016/j.virol.2007.12.002
Resumen de PubMed | Texto completo de CrossRef | Google Académico
39. Luan, Y, Li, Y, Yue, X, Fei, X y Zhi, X. Efectos de Codonopis bulleynana Forest ex Diels sobre Deferribacteres en el estreñimiento predominante del tumor intestinal: análisis diferencial. Saudi J Biol Sci. (2018) 26:395–401. doi: 10.1016/j.sjbs.2018.11.008
Resumen de PubMed | Texto completo de CrossRef | Google Académico
40. Hasmik, H, Roland, S, Tjakko, A, y Masja, NG. Genómica comparativa de los sistemas transportadores de hierro en cepas de Bacillus cereus e impacto de las fuentes de hierro en el crecimiento y la formación de biopelículas. Microbiol frontal. (2016) 7:842. doi: 10.3389/fmicb.2016.00842
Resumen de PubMed | Texto completo de CrossRef | Google Académico
41. Morotomi, M, Nagai, F, Watanabe, Y, y Tanaka, R. Succinatimonas hippei gen. Nov., sp. nov., aislado de heces humanas. Int J Syst Evol Microbiol. (2010) 60:1788–93. doi: 10.1099/ijs.0.015958-0
Resumen de PubMed | Texto completo de CrossRef | Google Académico
42. Kong, XJ, Liu, J, Liu, K, Koh, M, Sherman, H, Liu, SY, et al. Terapia combinada con probióticos y oxitocina en pacientes con trastorno del espectro autista: un ensayo piloto aleatorizado, doble ciego y controlado con placebo. Nutrientes. (2021) 13:1552. doi: 10.3390/nu13051552
Resumen de PubMed | Texto completo de CrossRef | Google Académico
43. Cao, X, Liu, K, Liu, J, Liu, YW y Kong, XJ. Microbiota intestinal disbiótica y desregulación del perfil de citoquinas en niños y adolescentes con trastorno del espectro autista. Neurosci frontal. (2021) 15:635925. doi: 10.3389/fnins.2021.635925
Resumen de PubMed | Texto completo de CrossRef | Google Académico
44. Udayappan, S, Manneras-Holm, L, Chaplin-Scott, A, Belzer, C, Herrema, H, Dallinga-Thie, GM, et al. El tratamiento oral con Eubacterium hallii mejora la sensibilidad a la insulina en ratones db/db. Microbiomas de NPJ Biofilms. (2016) 2:16009. doi: 10.1038/npjbiofilms.2016.9
Resumen de PubMed | Texto completo de CrossRef | Google Académico
45. Louis, P, y Flint, HJ. Diversidad, metabolismo y ecología microbiana de bacterias productoras de butirato del intestino grueso humano. FEMS Microbiol Lett. (2009) 294:1–8. doi: 10.1111/j.1574-6968.2009.01514.x
Resumen de PubMed | Texto completo de CrossRef | Google Académico
46. Bui, T, Manners-Holm, L, Puschmann, R, Wu, H y Devos, WM. La conversión del inositol dietético en propionato y acetato por Anaerostipes comensal se asocia con la salud del huésped. Nat Commun. (2021) 12:4798. DOI: 10.1038/s41467-021-25081-w
Resumen de PubMed | Texto completo de CrossRef | Google Académico
47. Wexler, HM. Bacteroides: lo bueno, lo malo y lo esencial. Clin Microbiol Rev. (2007) 20:593–621. doi: 10.1128/CMR.00008-07
Resumen de PubMed | Texto completo de CrossRef | Google Académico
48. He, M, Fang, S, Huang, X, Zhao, Y, Ke, S, Yang, H, et al. Evaluar la contribución de la microbiota intestinal a la variación de la grasa porcina con las muestras de ciego y heces. Microbiol frontal. (2016) 7:2108. doi: 10.3389/fmicb.2016.02108
Resumen de PubMed | Texto completo de CrossRef | Google Académico
49. Chen, X, Nie, X, Wang, H, Yan, S y Zhang, Y. El ácido esteárico induce la regulación positiva de CCK y GLP-1 a través de GPR120 / PLC-β, lo que lleva a una reducción del apetito en ovejas Hu alimentadas con paja de arroz. Front Vet Sci. (2022) 9:948074. doi: 10.3389/fvets.2022.948074
Resumen de PubMed | Texto completo de CrossRef | Google Académico
Palabras clave: jerarquía social, gallinas, rendimiento productivo, vigilancia, microbioma intestinal
Cita: Xie Z, Xing L, Zhao M, Zhao L, Liu J, Li Y, Gan J, Chen S y Li H (2023) La versatilidad, la vigilancia y el microbioma intestinal respaldan la prioridad de las gallinas de alto rango. Frente. Vet. Sci. 10:1324937. doi: 10.3389/fvets.2023.1324937
Recibido: 20 de octubre de 2023; Aceptado: 07 de diciembre de 2023;
Publicado: 21 diciembre 2023.
Editado por:
Sabine G. Gebhardt-Henrich, Universidad de Berna, Suiza
Revisado por:
R. X. Zhang, Universidad Agrícola del Noreste, China
Ivan Rychlik, Instituto de Investigación Veterinaria (VRI), Chequia
Derechos de autor © 2023 Xie, Xing, Zhao, Zhao, Liu, Li, Gan, Chen y Li. Este es un artículo de acceso abierto distribuido bajo los términos de la Licencia Creative Commons Attribution License (CC BY). S
*Correspondencia: Siyu Chen, chensiyu@fosu.edu.cn; Hua Li, okhuali@fosu.edu.cn
Renuncia: Todas las afirmaciones expresadas en este artículo son únicamente las de los autores y no representan necesariamente las de sus organizaciones afiliadas, ni las del editor, los editores y los revisores. Cualquier producto que pueda ser evaluado en este artículo o afirmación que pueda hacer su fabricante no está garantizado ni respaldado por el editor.
Date de alta y recibe nuestro 👉🏼 Diario Digital AXÓN INFORMAVET ONE HEALTH
Date de alta y recibe nuestro 👉🏼 Boletín Digital de Foro Agro Ganadero
Noticias animales de compañía
Noticias animales de producción
Trabajos técnicos animales de producción
Trabajos técnicos animales de compañía