A reporte de un caso: Linfoma cardíaco de células nulas en un bulldog inglés
A reporte de un caso: Linfoma cardíaco de células nulas en un bulldog inglés
 Liza S. Köster1*
Liza S. Köster1*  Kim Newkirk2
Kim Newkirk2  Philip Krawec1†
Philip Krawec1†- 1Departamento de Ciencias Clínicas de Pequeños Animales, Centro Médico Veterinario C247, Facultad de Medicina Veterinaria de la Universidad de Tennessee, Knoxville, TN, Estados Unidos
- 2Departamento de Ciencias Biomédicas y Ciencias Diagnósticas, Facultad de Medicina Veterinaria de la Universidad de Tennessee, Knoxville, TN, Estados Unidos
Este informe de caso describe un ejemplo novedoso de un linfoma extraganglionar de tipo nulo en el miocardio de un bulldog inglés de mediana edad que presentó signos de insuficiencia cardíaca derecha. El ecocardiograma encontró, además del derrame pericárdico, engrosamiento de las paredes libres de los ventrículos derecho e izquierdo y del tabique interventricular. El miocardio de pared libre del ventrículo derecho presentaba lesiones multinodulares, sospechosas de enfermedad infiltrativa. El propietario optó por la eutanasia humanitaria y se obtuvo el permiso para la necropsia. Se detectaron nódulos multifocales en los ventriculares izquierdo y derecho y una masa radicular aórtica incidental, la última de las cuales se confirmó posteriormente como quimiodectoma. Microscópicamente, los nódulos miocárdicos eran láminas de células redondas compatibles con un linfoma de alto grado. Las células neoplásicas no fueron inmunorreactivas a CD3 (células T) o CD20 y CD79a (células B), Mum-1 (células plasmáticas), CD117 (mastocitos) o CD18 (histiocitos). Estos hallazgos concuerdan con un linfoma de células nulas de grado alto.
Introducción
El linfoma primario del miocardio y del tejido contiguo (endocardio y epicardio) es poco frecuente en los perros, y representa del 2 al 3% de las neoplasias cardíacas primarias (1-3). Es una de las pocas neoplasias cardíacas que es susceptible de diagnóstico citológico y potencialmente sensible a la quimioterapia multifarmacológica, lo que enfatiza la importancia del reconocimiento ecocardiográfico del fenotipo (2). Los desafíos diagnósticos de la confirmación de la neoplasia cardíaca incluyen la baja sensibilidad de la ecocardiografía, que es aún menor en ausencia de derrame pericárdico. La biopsia con aguja y la biopsia endomiocárdica de masas cardíacas son invasivas y el rendimiento citológico es muy variable. La exactitud de la prueba para predecir todos los tipos de neoplasia cardíaca a partir de la citología del derrame pericárdico es (1) generalmente considerada deficiente (2%), con frecuentes falsos positivos y negativos; (2) depende del tipo de tumor; y (3) mejor cuando el volumen de células empaquetadas del derrame es inferior al 10% (4). Por el contrario, la utilidad diagnóstica de examinar el derrame pericárdico en el linfoma cardíaco tiene mérito. En el mayor reporte de linfoma cardíaco canino, el 92% (11 de 12) de los perros fueron diagnosticados en el examen citológico de derrame pericárdico (2).
El linfoma en estadio Vb, según el esquema de clasificación de la OMS, se refiere a un sitio extraganglionar distinto del bazo o el hígado, y el paciente es diagnosticado clínicamente con la enfermedad (1). La definición de linfoma cardíaco en la literatura humana es que el paciente debe presentar síntomas de enfermedad cardíaca, generalmente insuficiencia cardíaca derecha (RHF), con la mayor parte del linfoma intrapericárdico en localización, generalmente la aurícula derecha, en el momento del diagnóstico clínico (5). Este reporte de caso describe la presentación y los hallazgos imagenológicos de un caso de linfoma cardíaco extraganglionar de células nulas, una forma rara de linfoma confirmada en la necropsia en un perro de mediana edad. Los ecocardiogramas detectaron cambios consistentes con casos de linfoma cardíaco previamente descritos en perros. Los diagnósticos diferenciales incluyeron anomalías neoplásicas, infiltrativas, inflamatorias, infecciosas y de coagulación. Es probable que el diagnóstico se hubiera confirmado en la citología si se hubiera realizado una pericardiocentesis, pero el propietario optó por la eutanasia, lo que resultó en la necropsia y la confirmación histopatológica.
Descripción del caso
Una hembra de bulldog inglés esterilizada de 7 años fue remitida al Servicio de Emergencia del Centro Médico Veterinario de la Universidad de Tennessee para la evaluación del aumento de la frecuencia respiratoria y el esfuerzo. Seis días antes de la presentación, el paciente experimentó un inicio agudo de hiporexia, junto con taquipnea y aumento del esfuerzo respiratorio. Las radiografías torácicas obtenidas en otro centro eran preocupantes para la neumonía por aspiración. Se instituyó amoxicilina-clavulanato a dosis de 21 mg/kg por vía oral cada 12 h. Al día siguiente, los propietarios informaron que el paciente no había cambiado clínicamente, lo que provocó una evaluación por parte del veterinario principal. Al paciente se le administraron inyecciones de citrato maropitant (Cerenia-Zoetis Inc., EE.UU.) y cefovecina sódica (Convenia-Zoetis Inc., EE.UU.). El paciente continuó sin mostrar mejoría 2 días después, momento en el que se le dispensó un inhalador de albuterol (90 mcg, 1 acción cada 6-8 h según sea necesario), una dieta recetada (a/d enlatada-Hill’s Pet Nutrition, EE. UU.) y furosemida (2,3 mg/kg por vía oral cada 12 h). Los síntomas respiratorios persistieron durante 2 días; por lo tanto, el veterinario de cabecera recetó metronidazol. El apetito del paciente seguía siendo escaso, por lo que requirió la alimentación con jeringas de la dieta previamente prescrita. La frecuencia respiratoria y el esfuerzo seguían siendo anormales. Esto dio lugar a una evaluación final en el centro del veterinario de atención primaria, donde una sola radiografía torácica lateral mostró evidencia de derrame pleural, lo que provocó la derivación para más diagnósticos y terapia.
Al momento de la presentación en la institución de los autores, el paciente estaba tranquilo y alerta. La presión arterial sistólica no invasiva medida por ecografía Doppler fue de 90 mmHg (normal, 90-159 mmHg). La frecuencia cardíaca del paciente se consideró inapropiadamente alta (174 latidos por minuto, normal de 70 a 120 lpm) con taquipnea (60 respiraciones por minuto [brpm], normal de 17 a 34 brpm) y un leve aumento del esfuerzo respiratorio, parcialmente atribuido al estrés. La auscultación cardiopulmonar reveló ruidos cardíacos y pulmonares ligeramente amortiguados. Se anotó Stertor, de acuerdo con la confirmación del paciente. La palpación abdominal estaba limitada debido al habitus corporal. El resto del examen físico no tuvo nada de especial.
La saturación de oxígeno fue apropiada con una SpO2 del 100% (referencia >96%) (oxímetro de pulso Radical-7-Masimo Corp., EE. UU.). El lactato en sangre venosa (Lactate Plus-Nova Biomedical, EE. UU.) estaba mínimamente elevado (2,9 mmol/L, referencia 0,5-2,0 mmol/L), lo que se atribuye a una leve depleción de volumen, a un gasto cardíaco deficiente o a una hiperlactatemia tipo B. La gasometría venosa (Nova Stat Profile Prime Plus-Nova Biomedical, EE. UU.) reveló una alcalosis metabólica leve y compensada. Se observó azotemia leve (BUN 49 mg/dL, referencia 8-30; creatinina 1,9 mg/dL, referencia 0,6-1,6), junto con hiponatremia leve (136 mmol/L, referencia 142-149,3) e hipocloremia (98 mmol/L, referencia 113-118). Estas variaciones se atribuyeron a azotemia prerrenal secundaria a la administración de furosemida; Alternativamente, se consideró la disminución del flujo sanguíneo renal y la activación del sistema renina-angiotensina-aldosterona. No se detectaron otras alteraciones electrolíticas o ácido-base.
El paciente se sometió a una ecografía rutinaria en el punto de atención de forma estandarizada (6). No se visualizó líquido libre en el abdomen. La evaluación del tórax reveló cantidades moderadas de derrame pleural, así como una cantidad leve de derrame pericárdico.
Tras el consentimiento del propietario, el paciente se sometió a un ecocardiograma completo (sonda X5-1 y máquina EPIQ 7, Philips, EE.UU.), que incluyó un examen bidimensional, modo M y Doppler como se describe en el canino (7). Se aplicó gel de acoplamiento ultrasónico sobre el precordio izquierdo y derecho para permitir una ventana acústica; El pelaje no estaba cortado. Se utilizó una derivación de una sola extremidad (derivación II) para la monitorización continua del electrocardiograma durante el ecocardiograma, que detectó complejos prematuros ventriculares monomórficos intermitentes y monomórficos. En la vista del eje largo paraesternal derecho, se observó derrame pericárdico anecoico leve a moderado (< 1 cm de ancho) sin evidencia de taponamiento. La pared libre del ventrículo izquierdo (1,9 cm, referencia 0,6-1,2) y el tabique (1,5 cm, referencia 6-1,2) se engrosaron cuando se midieron en diástole en comparación con los intervalos de referencia predichos alométricamente en función del peso corporal del perro (8). Masa hipoecogénica focal, de forma más o menos esférica, que mide al menos 1 por 1,08 cm de dimensión, visible en el eje largo paraesternal derecho (vista de cuatro cámaras), situada dentro del miocardio del ventrículo derecho basilar anterior. Se observó un engrosamiento difusamente irregular de las paredes anterior y septal del ventrículo derecho, hiperecogénicas y de aspecto moteado debido a la ecogenicidad heterogénea (Figura 1), compatible con infiltración. Se consideró que la vena cava caudal y las venas hepáticas estaban dilatadas con ausencia de distensibilidad durante el ciclo respiratorio. Las etiologías que se consideraron fueron las siguientes: tumores cardíacos, incluyendo linfoma, mixosarcoma, hemangiosarcoma, sarcoma y quimiodecoma; enfermedad infiltrativa, incluyendo miocarditis eosinofílica y amiloidosis; miocarditis bacteriana o micótica; y la organización del hematoma o trombo miocárdico. Las recomendaciones para la investigación adicional después de los resultados del ecocardiograma que podrían considerarse útiles para dilucidar la etiología incluyeron la pericardiocentesis y el análisis del derrame, incluida la citología, un hemograma periférico completo para investigar si había un leucograma inflamatorio o eosinofilia, la bioquímica sérica y el calcio ionizado en ayunas, y la estadificación de una posible neoplasia cardíaca primaria o metastásica. incluyendo imágenes del tórax y el abdomen. No se hicieron recomendaciones para el manejo de la ectopia ventricular, ya que se consideraron de baja complejidad y es poco probable que hayan tenido un impacto hemodinámico en el paciente.
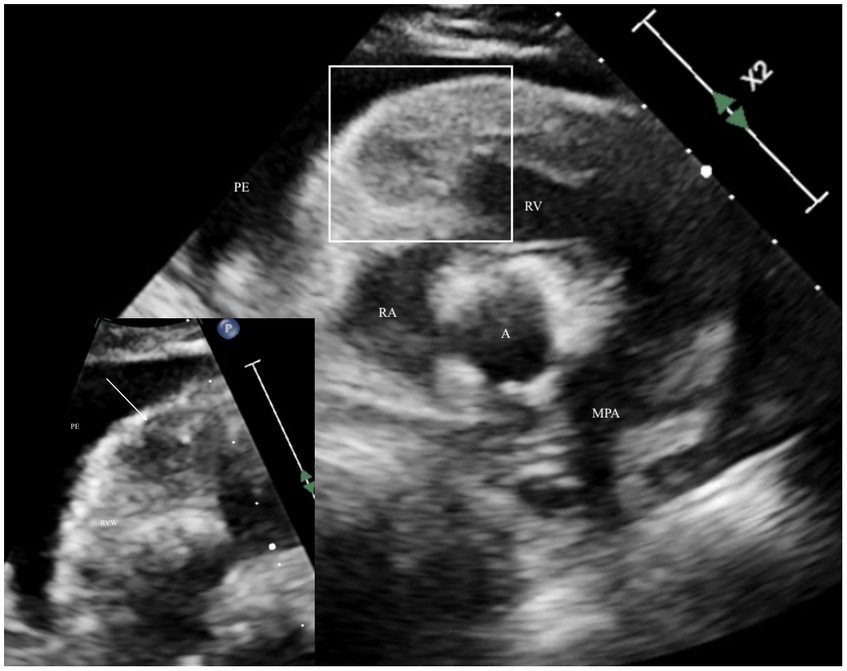
 Figura 1. Ecocardiograma que optimiza el ventrículo derecho con la vista del eje corto paraesternal derecho del tracto de salida del ventrículo derecho que muestra un engrosamiento irregular y una ecodensidad heterogénea rodeada de derrame pericárdico anecoico. El área de contorno blanco es la ubicación representada en el inserto ampliado en la esquina inferior izquierda, un área enfocada de la base de la pared libre del ventrículo derecho, que representa la ecodensidad heterogénea del miocardio con una masa hipoecogénica, aproximadamente esférica (flecha). A: aorta; MPA: arteria pulmonar principal; EP: derrame pericárdico; AR: aurícula derecha; VD: ventrículo derecho; RVW: pared ventricular derecha.
Figura 1. Ecocardiograma que optimiza el ventrículo derecho con la vista del eje corto paraesternal derecho del tracto de salida del ventrículo derecho que muestra un engrosamiento irregular y una ecodensidad heterogénea rodeada de derrame pericárdico anecoico. El área de contorno blanco es la ubicación representada en el inserto ampliado en la esquina inferior izquierda, un área enfocada de la base de la pared libre del ventrículo derecho, que representa la ecodensidad heterogénea del miocardio con una masa hipoecogénica, aproximadamente esférica (flecha). A: aorta; MPA: arteria pulmonar principal; EP: derrame pericárdico; AR: aurícula derecha; VD: ventrículo derecho; RVW: pared ventricular derecha.
Dada la naturaleza infiltrativa de la lesión miocárdica y la preocupación general por la calidad de vida, los propietarios optaron por la eutanasia humanitaria. El paciente fue sedado con propofol (PropoFlo 28-Zoetis, EE.UU.) por vía intravenosa, seguido de una inyección intravenosa de una solución de pentobarbital (Fatal-Plus Solution-Vortech Pharmaceuticals Ltd., EE.UU.). El paciente fue sometido a una necropsia completa.
La necropsia confirmó que, además de derrames en los espacios pericárdico y pleural, había derrame peritoneal (1.000 mL en la cavidad torácica, 100-150 mL en la cavidad abdominal y 100 mL en el espacio pericárdico); El líquido era transparente y variaba desde rojo claro en la cavidad torácica y el espacio pericárdico hasta rojo oscuro en la cavidad abdominal. A lo largo de la cavidad torácica, había múltiples hebras de fibrina delgadas, friables, de color rosa pálido a tostado. El mediastino se expandió por un material transparente, acuoso y gelatinoso considerado edema. La tráquea contenía material mucoide rojo claro. Los lóbulos pulmonares eran difusamente de color rojo oscuro a púrpura y colapsaron, pero todos los lóbulos pulmonares flotarían en formalina al 10%. El corazón pesaba 0,22 kg, que es el 0,9% del peso corporal (lo normal en adultos es del 0,7 al 1,2%). El miocardio de las paredes libres de los ventrículos derecho e izquierdo estaba irregularmente engrosado por numerosos nódulos blandos multifocales a coalescentes, de color blanco a tostado, que variaban de 1 mm de diámetro a 10x5x3 mm (Figura 2). El hígado pesaba 0,72 kg, lo que representaba el 3,03% del peso corporal (lo normal en adultos es del 3 al 3,5%). El bazo y los ganglios linfáticos eran muy normales. Por cierto, se detectó una hidrocefalia leve.
 Figura 2. Sección macroscópica del tracto de salida del ventrículo izquierdo. Los nódulos blandos, de color blanco a bronceado, multifocales a coalescentes, expanden el miocardio; Microscópicamente, estas masas estaban compuestas por células redondas neoplásicas. Junto a la raíz de la aorta hay un nódulo ovalado, rojo, bien circunscrito (rodeado por una línea discontinua azul), que es histológicamente congruente con un quimiodectoma.
Figura 2. Sección macroscópica del tracto de salida del ventrículo izquierdo. Los nódulos blandos, de color blanco a bronceado, multifocales a coalescentes, expanden el miocardio; Microscópicamente, estas masas estaban compuestas por células redondas neoplásicas. Junto a la raíz de la aorta hay un nódulo ovalado, rojo, bien circunscrito (rodeado por una línea discontinua azul), que es histológicamente congruente con un quimiodectoma.
En la necropsia, se recolectaron muestras de corazón, pulmón, cerebro, ganglios linfáticos, hígado y riñón y se fijaron en formol tamponado neutro al 10% y se procesaron de forma rutinaria para su examen microscópico. Las secciones de tejido se tiñeron con hematoxilina y eosina y se examinaron microscópicamente. No hubo hallazgos significativos en el pulmón, el cerebro, los ganglios linfáticos, el hígado o el riñón. En las secciones cardíacas, el miocardio de las paredes libres de los ventriculares izquierdo y derecho y el tracto de salida aórtico se expandieron multifocalmente mediante células redondas dispuestas en láminas. Las células redondas tenían bordes celulares distintos, pequeñas cantidades de citoplasma eosinófilo y núcleos redondos. Los núcleos eran aproximadamente del tamaño de un eritrocito, y había 108 figuras mitóticas en diez 400x (2,37 mm)2), con ocasionales mitosis extrañas. La anisokariosis fue leve. Había áreas multifocales donde las células neoplásicas estaban necróticas. Los miocitos cardíacos estaban ocasionalmente atrapados dentro de las células neoplásicas y eran pequeños (atrofia) o fragmentados. Dada la ausencia de cambios similares en otros órganos, los infiltrados cardíacos fueron consistentes con un linfoma cardíaco primario, que además se caracterizó como de células pequeñas y de alto grado.
Adyacente a la aorta, había otra población distinta de células neoplásicas. Estas células neoplásicas eran poligonales, dispuestas en nidos y paquetes, y sostenidas por un delgado estroma fibrovascular. Las células tenían cantidades moderadas de citoplasma granular basófilo y núcleos redondos. La anisokariosis fue leve y las mitosis estuvieron ausentes. Una tinción de Churukian-Schenk resaltó los gránulos citoplasmáticos de células neoplásicas poligonales de color marrón a negro. La tinción no resaltó ningún gránulo en la población neoplásica de células redondas descrita anteriormente. Estos hallazgos fueron consistentes con un quimiodectoma del cuerpo aórtico.
Las células redondas neoplásicas miocárdicas no contenían gránulos metacromáticos cuando se tiñeron con azul de toluidina. Además, estas células no eran inmunorreactivas a CD3 (células T), CD79 (células B) o CD20 (células B), sino que estaban rodeadas por un número moderado de células inmunorreactivas CD3. Ni las células redondas neoplásicas miocárdicas ni las células de quimiodectoma fueron inmunorreactivas a Mum-1 (célula plasmática), CD117 (c-kit; mastocitos) o CD18 (histiocito). Había células inmunorreactivas CD18 dispersas alrededor de ambas poblaciones de células neoplásicas. Las células del quimiodoxoma, pero no las células redondas neoplásicas, fueron inmunorreactivas a la enolasa neuronal específica (NSE). Las figuras 3 y 4 ponen de manifiesto la inmunorreactividad de los dos tumores.
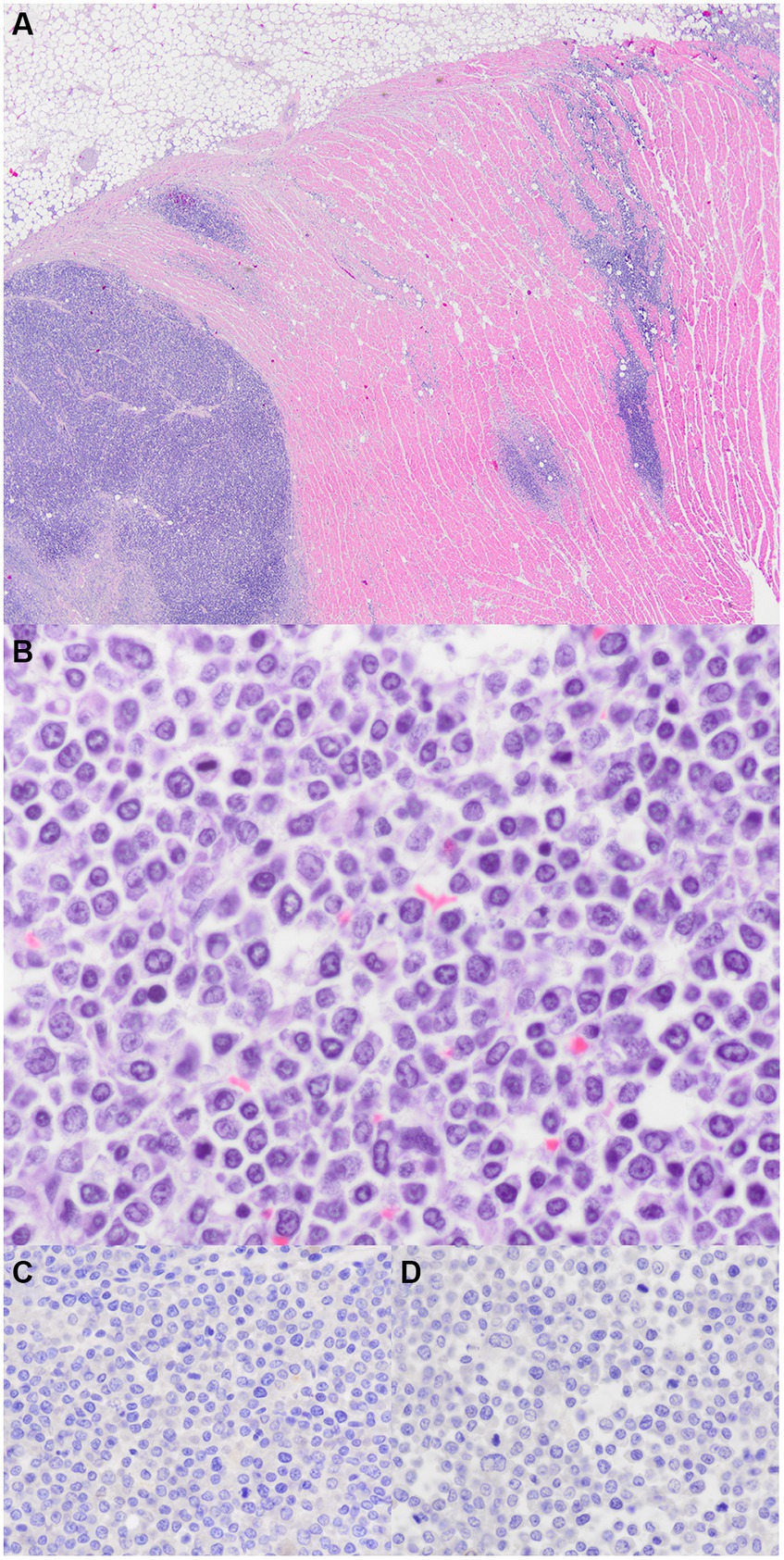 Figura 3. Linfoma de miocardio. (A) Tracto de salida del ventrículo derecho. El miocardio se expande multifocalmente mediante láminas de células redondas neoplásicas (tinción H&E, 20x). (B) Las células redondas neoplásicas tienen mitosis dispersas (tinción H&E, 600x). (C) Inmunohistoquímica para CD3; sin inmunorreactividad (600x). d) Inmunohistoquímica para CD8; sin inmunorreactividad (600x).
Figura 3. Linfoma de miocardio. (A) Tracto de salida del ventrículo derecho. El miocardio se expande multifocalmente mediante láminas de células redondas neoplásicas (tinción H&E, 20x). (B) Las células redondas neoplásicas tienen mitosis dispersas (tinción H&E, 600x). (C) Inmunohistoquímica para CD3; sin inmunorreactividad (600x). d) Inmunohistoquímica para CD8; sin inmunorreactividad (600x).
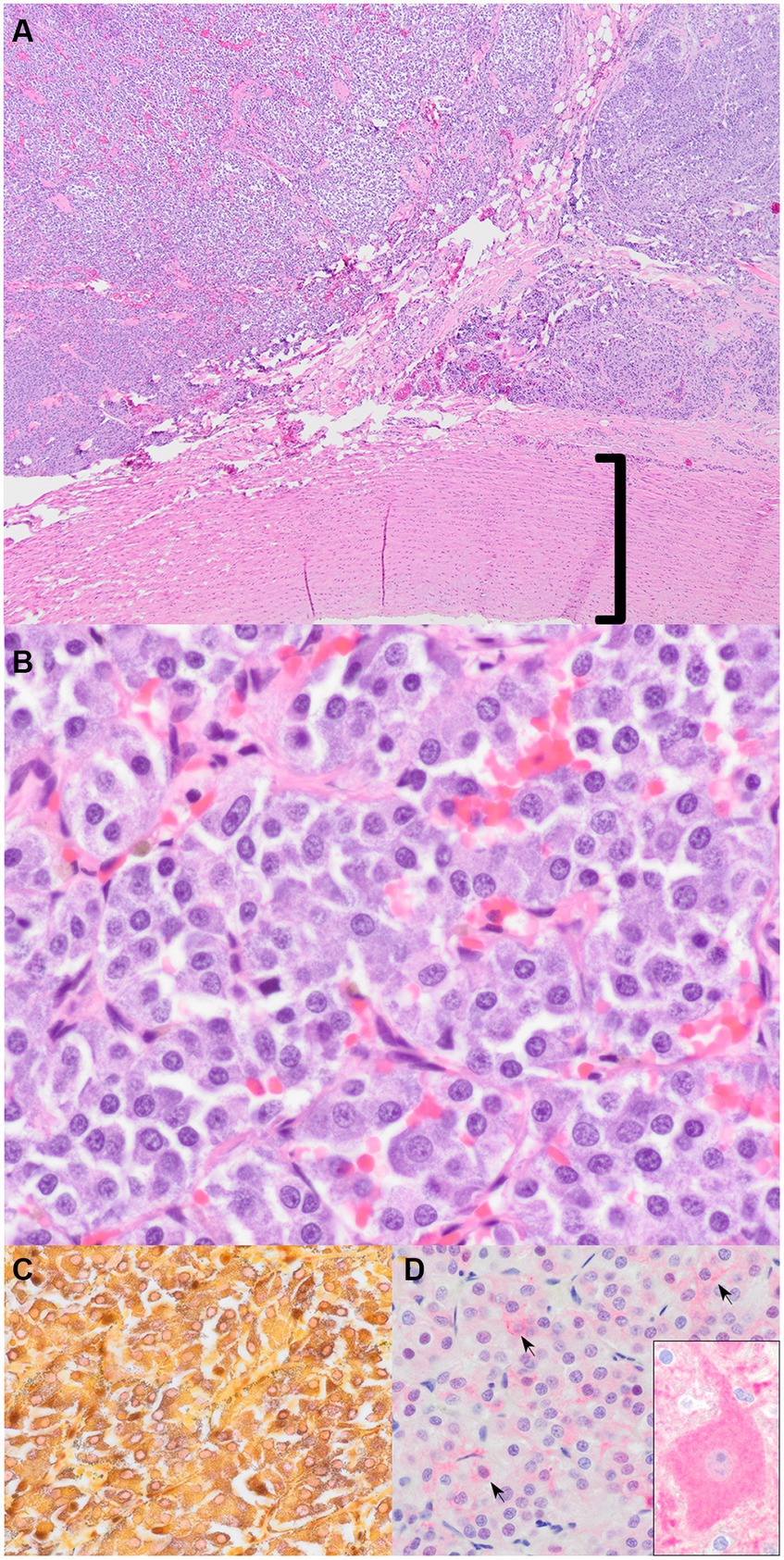 Figura 4. Quimiodectoma aórtico. (A) Masa adyacente a la aorta (bracket) (tinción H&E, 40x). (B) Nidos y paquetes de células neoplásicas poligonales con citoplasma basófilo granular (tinción H&E, 400x). (C) La tinción de Churukian-Schenk resalta los gránulos neurosecretores argirófilos (negros) en las células neoplásicas (tinción H&E, 600x). (D) Inmunohistoquímica para la enolasa neuronal específica (NSE). Hay una tenue inmunorreactividad citoplasmática y membranosa de color rosa (las flechas negras indican algunas de las células inmunorreactivas) (600x). El recuadro es tejido cerebral de control positivo con un gran cuerpo de células neuronales piramidales inmunorreactivas (600x).
Figura 4. Quimiodectoma aórtico. (A) Masa adyacente a la aorta (bracket) (tinción H&E, 40x). (B) Nidos y paquetes de células neoplásicas poligonales con citoplasma basófilo granular (tinción H&E, 400x). (C) La tinción de Churukian-Schenk resalta los gránulos neurosecretores argirófilos (negros) en las células neoplásicas (tinción H&E, 600x). (D) Inmunohistoquímica para la enolasa neuronal específica (NSE). Hay una tenue inmunorreactividad citoplasmática y membranosa de color rosa (las flechas negras indican algunas de las células inmunorreactivas) (600x). El recuadro es tejido cerebral de control positivo con un gran cuerpo de células neuronales piramidales inmunorreactivas (600x).
Discusión
Este caso describe el caso de un perro de mediana edad con un fenotipo raro de tumor cardíaco del miocardio del ventrículo derecho que presentó signos de RHF. El caso sirve para enfatizar la importancia de considerar el linfoma cardíaco como un diagnóstico diferencial, aunque poco frecuente en esta especie. En una serie de casos de 12 perros diagnosticados con linfoma cardíaco, todos menos uno eran de raza grande con un amplio rango de edad (2 a 16 años). Se ha descrito un caso raro de agrupamiento de linfoma cardíaco en una familia de Otterhounds, con el padre y dos hijos hermanos afectados entre los 5 y 6 años de edad; Se ha propuesto un factor genético o viral (9). No había información disponible sobre animales relacionados con el perro en nuestro informe de caso. Los signos de RHF probablemente fueron secundarios al derrame crónico en el espacio pericárdico y a los infiltrados miocárdicos, lo que puede haber contribuido a la reducción de la distensibilidad del ventrículo derecho. En la serie de casos, los signos clínicos desarrollaron una mediana de 3 días antes de la presentación y, con mayor frecuencia, fueron letargo y disnea. La insuficiencia cardíaca derecha se describe como el hallazgo clínico de presentación más común en el linfoma cardíaco canino, como se desprende de las siguientes descripciones: 8 de 12 perros en una serie de casos presentaron ascitis; un cocker spaniel de 9 años de edad con una gran masa intraauricular derecha que presentaba ascitis, hepatomegalia y distensión de la vena cava caudal; y un cachorro de 10 semanas de edad que presentó derrame pleural y peritoneal (2, 10, 11). La insuficiencia cardíaca derecha es también el hallazgo clínico de presentación más frecuente en el linfoma cardíaco humano (5).
El único hallazgo ecocardiográfico estructural anormal en 9 de los 12 perros en los que se realizó ecocardiografía fue un derrame pericárdico sin masas visibles en el miocardio. Otros informes de casos han descrito engrosamiento irregular y ecodensidades heterogéneas en el miocardio ventricular (11-13). Específicamente, las características ecocardiográficas, si están presentes, incluyen masa heterogéneamente ecodensa (13), tabique interventricular engrosado (12) y engrosamiento e irregularidades de la pared y el tabique del ventrículo izquierdo en tres perros de nutria relacionados (9), y en un cachorro de 10 semanas de edad, un ventrículo moderadamente dilatado e hipocinético (11). El diagnóstico antemortem de engrosamiento de la pared del ventrículo izquierdo se confirmó posteriormente en la necropsia como consecuencia de un linfoma de miocardio que también se había infiltrado en el ventrículo izquierdo. En el ecocardiograma no se reconoció una ecotextura anormal del ventrículo izquierdo y se pasó por alto la infiltración con neoplasia en esta cámara. Esto pone de manifiesto la baja sensibilidad de la ecocardiografía en el cribado de tumores miocárdicos.
El conocimiento del fenotipo del tumor cardíaco canino hace que la ecocardiografía sea la prueba diagnóstica de elección para investigar la etiología del derrame pericárdico; sin embargo, se considera moderadamente precisa, con un 86% de acuerdo con la localización y solo un 65% de acuerdo con el diagnóstico de tipo de tejido en comparación con la necropsia (14). La presencia de derrame pericárdico mejora la precisión de la ecocardiografía, ya que el líquido pericárdico anecoico es capaz de proporcionar contraste a los tumores cardíacos, con una sensibilidad reportada del 82% y una especificidad del 100% (3). A pesar de que la resonancia magnética cardíaca (RMc) se considera el estándar de oro para el diagnóstico de la neoplasia cardíaca en humanos, en un pequeño estudio en el que la RMCh examinó a perros con derrame pericárdico, esta modalidad no demostró una ventaja diagnóstica. En muchos casos, los resultados fueron discordantes y los resultados fueron influenciados por la experiencia del radiólogo (15). Potencialmente, la ecocardiografía transesofágica o el uso de agentes de contraste para el ecocardiograma pueden ofrecer una mayor utilidad diagnóstica que la ecocardiografía transtorácica estándar, pero esta comparación no se ha realizado en perros. Sorprendentemente, el derrame pericárdico no es una complicación común de los tumores cardíacos, presente en solo el 16% de todos los perros diagnosticados con tumores cardíacos en la necropsia. Esto contrasta con la mayor prevalencia de derrame pericárdico concurrente en el 42% de los perros con detección ecocardiográfica y diagnóstico confirmado posteriormente (en la necropsia) (14, 16). El beneficio de esta modalidad de imagen es la información proporcionada sobre la movilidad, la naturaleza infiltrativa, la ubicación de la inserción y las consecuencias hemodinámicas de una masa cardíaca. A pesar de la alta especificidad citada, el diagnóstico diferencial debe incluir vegetación infecciosa, trombos estériles y hematomas miocárdicos. La sensibilidad referenciada pone de manifiesto que existe un riesgo inherente de falsos negativos en los diagnósticos ecocardiográficos, especialmente en ausencia de derrame pericárdico, como pone de manifiesto el estudio del linfoma canino que no fue capaz de detectar una masa cardíaca en todos los perros que se sometieron a ecocardiografía (2).
En raras ocasiones, la detección de arritmias es el motivo de un ecocardiograma y la detección de una masa miocárdica. Se registró el ritmo sinusal en los 12 perros de la serie de casos, además de un perro con un bloqueo auriculoventricular (AV) intermitente (2). En varios informes de casos individuales se ha descrito un bloqueo AV completo y una ectopia ventricular asociada con linfoma cardíaco extraganglionar (11–13). Otras arritmias incluyeron taquicardia ventricular en el cachorro de 10 semanas de edad (11), uno de los 12 perros con linfoma de miocardio que tenía ritmo idioventricular acelerado y complejos ventriculares prematuros (2), uno de los 3 perros relacionados diagnosticados con linfoma cardíaco había informado ectopia ventricular (9), y un perro con ritmo sinusal y ritmo idioventricular acelerado intermitente y complejos ventriculares prematuros en el momento de la presentación. que posteriormente falleció 2 h después de la pericardiocentesis por fibrilación ventricular (12).
De los 12 perros descritos en la serie de casos más grande, 5 fueron tratados con varias combinaciones de quimioterapia multifarmacológica, ya sea después de la pericardiocentesis terapéutica o de la pericardiectomía. La mediana del tiempo de supervivencia fue de 157 días, que fue significativamente más larga que la de los perros que no recibieron quimioterapia, que fue de 7 días (2). No se encontraron otros factores que fueran pronósticos de un resultado desfavorable en este estudio. En un informe de caso se describió una respuesta favorable de un linfoma miocárdico a la prednisolona con una recaída 1 año después (9). El perro de nuestro caso fue sacrificado después de que los resultados de la ecocardiografía fueran discutidos con el dueño. Se desconoce si la presencia de derrames y arritmias o el tipo de células nulas de alto grado habrían contribuido al resultado general si los propietarios hubieran elegido el tratamiento.
La inmunohistoquímica del linfoma cardíaco canino ha sido descrita en la literatura veterinaria. Se confirmó linfoma cardíaco inmunorreactivo a CD3, CD79a y CD18 en el perro con bloqueo AV (13); coexpresión de CD3 y CD20 y clonalidad molecular consistente con el reordenamiento gamma del receptor clonal de células T en un pug de 8 años con vaina nerviosa periférica y linfoma cardíaco (17); un linfoma de células T (inmunorreactivo a CD3 pero no a CD79) en un labrador de 9 años con engrosamiento miocárdico difuso y derrame pericárdico; y 3 de los 12 perros de la serie de casos de linfoma canino a los que se les realizó una tinción, se encontró que 2 eran compatibles con linfoma de células T y uno con linfoma de células B (2). Los hallazgos del examen microscópico y de la inmunohistoquímica en este informe de caso confirmaron la presencia de un quimiodectoma localizado cerca de la raíz aórtica y una población neoplásica separada de células redondas. Las características histológicas de las células redondas eran compatibles con un linfoma de células pequeñas de alto grado; La designación del grado se basó en el recuento mitótico (18). El tamaño de las células neoplásicas se enumeró de acuerdo con la descripción de Valli et al. (19). La inmunohistoquímica reveló que las células redondas neoplásicas no eran inmunorreactivas a los marcadores leucocitarios de células B, células T, células plasmáticas, histiocitos o mastocitos, por lo que se realizó el diagnóstico de linfoma de células nulas. Menos del 1 % de los linfomas caninos son de células nulas (sin inmunorreactividad a CD3, CD79a, CD4 y CD8), y estos pueden representar neoplasias de células NK; sin embargo, aún no se han determinado los marcadores inmunohistoquímicos ni las definiciones de caso para los linfomas de células asesinas naturales (NK) en medicina veterinaria (20). Un estudio morfológico de 608 casos de linfoma canino describió el linfoma de células nulas como CD3 y CD79a negativo, y estos representaron el 0,8% de todos los casos de linfoma (5 de 608) (21). La descripción incluyó linfomas mixtos pleomórficos en cuatro perros y un linfoma de células grandes en otro. El linfoma de células nulas está mal caracterizado en perros debido a la falta de un anticuerpo canino CD56, que es un marcador del linfoma NK (21, 22). El linfoma extraganglionar humano de células NK/T es una proliferación sistémica agresiva de células T NK o similares a NK, predilección por el tejido nasal, nasofaríngeo, gastrointestinal y testicular (22). El cáncer se caracteriza por afectación rápida, múltiple, extraganglionar, con síndrome hemofagocítico frecuente y disfunción multiorgánica. Se sospechó en dos perros con linfoma granular grande y síndrome hemofagocítico.
Conclusión
El linfoma de células nulas es un tumor cardíaco poco frecuente que se manifiesta en el inicio agudo de la ICR en un perro de mediana edad y debe considerarse un diagnóstico diferencial cuando la ecocardiografía detecta engrosamiento de la pared y nódulos miocárdicos. Se desconoce el pronóstico de este tipo de célula en el perro, pero la contraparte humana se considera agresiva.
Declaración de disponibilidad de datos
Las contribuciones originales presentadas en el estudio se incluyen en el artículo/material complementario, las consultas posteriores pueden dirigirse al autor correspondiente.
Declaración ética
No se requirió la aprobación ética para los estudios con animales de acuerdo con la legislación local y los requisitos institucionales porque no se necesita la aprobación de la IACUC si se recolecta una muestra de un caso de necropsia y se da la aprobación del cliente. Se obtuvo el consentimiento informado por escrito de los propietarios para la participación de sus animales en este estudio.
Contribuciones de los autores
LK: Conceptualización, Investigación, Escritura – borrador original. KN: Conceptualización, Investigación, Escritura – Revisión y Edición. PK: Conceptualización, Investigación, Escritura – Revisión y Edición.
Financiación
El/los autor/es declaran/n que no se recibió apoyo financiero para la investigación, autoría y/o publicación de este artículo.
Reconocimientos
Los autores agradecen al personal y a los estudiantes, y un agradecimiento especial a Kimberly Crane, de la Facultad de Medicina Veterinaria de la Universidad de Tennessee, por ayudar en el manejo del paciente mientras estaba hospitalizado en la Unidad de Cuidados Intensivos. Además, los autores reconocen el trabajo del equipo en el laboratorio de histología de la Universidad de Tennessee.
Conflicto de intereses
Los autores declaran que la investigación se llevó a cabo en ausencia de relaciones comerciales o financieras que pudieran interpretarse como un posible conflicto de intereses.
Nota del editor
Todas las afirmaciones expresadas en este artículo son únicamente las de los autores y no representan necesariamente las de sus organizaciones afiliadas, ni las del editor, los editores y los revisores. Cualquier producto que pueda ser evaluado en este artículo, o afirmación que pueda ser hecha por su fabricante, no está garantizado ni respaldado por el editor.
Referencias
1. Treggiari, E, Pedro, B, Dukes-McEwan, J, Gelzer, AR, y Blackwood, L. Revisión descriptiva de los tumores cardíacos en perros y gatos. Veterinario Comp Oncol. (2017) 15:273–88. doi: 10.1111/vco.12167
Resumen de PubMed | Texto completo de Crossref | Google Académico
2. MacGregor, JM, Faria, ML, Moore, AS, Tobias, AH, Brown, DJ y de Morais, HS. Linfoma cardíaco y derrame pericárdico en perros: 12 casos (1994-2004). J Am Vet Med Assoc. (2005) 227:1449–53. doi: 10.2460/javma.2005.227.1449
Resumen de PubMed | Texto completo de Crossref | Google Académico
3. MacDonald, KA, Cagney, O, y Magne, ML. Caracterización ecocardiográfica y clinicopatológica del derrame pericárdico en perros: 107 casos (1985-2006). J Am Vet Med Assoc. (2009) 235:1456–61. doi: 10.2460/javma.235.12.1456
Resumen de PubMed | Texto completo de Crossref | Google Académico
4. Cagle, LA, Epstein, SE, Owens, SD, Mellema, MS, Hopper, K, y Burton, AG. Rendimiento diagnóstico del análisis citológico del derrame pericárdico en perros. J Veterinario Pasante Med. (2014) 28:66–71. doi: 10.1111/jvim.12253
Resumen de PubMed | Texto completo de Crossref | Google Académico
5. Burke, A, y Tavora, F. Clasificación de la OMS de 2015 de tumores de corazón y pericardio. J Oncol torácico. (2016) 11:441–52. doi: 10.1016/j.jtho.2015.11.009
6. Lisciandro, GR. Evaluación abdominal y torácica focalizada con ecografía para traumatismo, triaje y monitoreo en pequeños animales. J Vet Emerg Crit Care. (2011) 21:104–22. doi: 10.1111/j.1476-4431.2011.00626.x
Resumen de PubMed | Texto completo de Crossref | Google Académico
7. Thomas, WP, Gaber, CE, Jacobs, GJ, Kaplan, PM, Lombard, CW, Moise, NS, et al. Recomendaciones para los estándares en ecocardiografía transtorácica bidimensional en perro y gato. Comité de Ecocardiografía de la Especialidad de Cardiología, Colegio Americano de Medicina Interna Veterinaria. J Veterinario Pasante Med. (1993) 7:247–52. doi: 10.1111/j.1939-1676.1993.tb01015.x
Resumen de PubMed | Texto completo de Crossref | Google Académico
8. Cornell, CC, Kittleson, MD, Della Torre, P, Häggström, J, Lombard, CW, Pedersen, HD, et al. Escalamiento alométrico de las mediciones cardíacas en modo M en perros adultos normales. J Veterinario Pasante Med. (2004) 18:311–21.
9. Teske, E, de Vos, JP, Egberink, HF, y Vos, JH. Agrupamiento en linfoma maligno canino. Veterinario Q. (1994) 16:134–6. doi: 10.1080/01652176.1994.9694435
10. Tong, LJ, Bennett, SL, Thompson, DJ, Adsett, SL, y Shiel, RE. Insuficiencia cardíaca congestiva del lado derecho en un perro debido a un linfoma miocárdico intracavitario primario. Aust Vet J. (2015) 93:67–71. doi: 10.1111/avj.12289
Resumen de PubMed | Texto completo de Crossref | Google Académico
11. Kimura, Y, Harada, T, Sasaki, T, Imai, T y Machida, N. Linfoma cardíaco primario en un perro de 10 semanas de edad. J Vet Med Sci. (2018) 80:1716–9. doi: 10.1292/jvms.18-0272
Resumen de PubMed | Texto completo de Crossref | Google Académico
12. Sims, CS, Tobias, AH, Hayden, DW, Fine, DM, Borjesson, DL y Aird, B. Derrame pericárdico debido a linfosarcoma cardíaco primario en un perro. J Veterinario Pasante Med. (2003) 17:923–7. doi: 10.1111/j.1939-1676.2003.tb02534.x
Resumen de PubMed | Texto completo de Crossref | Google Académico
13. Stern, JA, Tobias, JR y Keene, BW. Bloqueo auriculoventricular completo secundario a linfoma cardíaco en un perro. J Vet Cardiol. (2012) 14:537–9. doi: 10.1016/j.jvc.2012.04.007
Resumen de PubMed | Texto completo de Crossref | Google Académico
14. Rajagopalan, V, Jesty, SA, Craig, LE, y Gompf, R. Comparación de diagnósticos ecocardiográficos presuntos y definitivos de tumores cardíacos en perros. J Veterinario Pasante Med. (2013) 27:1092–6. doi: 10.1111/jvim.12134
Resumen de PubMed | Texto completo de Crossref | Google Académico
15. Boddy, KN, Sleeper, MM, Sammarco, CD, Weisse, C, Ghods, S y Litt, HI. Resonancia magnética cardíaca en la diferenciación del derrame pericárdico neoplásico y no neoplásico. J Veterinario Pasante Med. (2011) 25:1003–9. doi: 10.1111/j.1939-1676.2011.0762.x
Resumen de PubMed | Texto completo de Crossref | Google Académico
16. Ware, WA, y Hopper, DL. Tumores cardíacos en perros: 1982-1995. J Veterinario Pasante Med. (1999) 13:95–103. doi: 10.1111/j.1939-1676.1999.tb01136.x
Resumen de PubMed | Texto completo de Crossref | Google Académico
17. Nakagun, S, Horiuchi, N, Watanabe, K, Matsumoto, K, Tagawa, M, Shimbo, G, et al. Coexpresión de CD3 y CD20 en un caso de linfoma de células T periféricas caninas con afectación cardíaca y nerviosa periférica prominente. J Vet Diagn Invest. (2018) 30:779–83. doi: 10.1177/1040638718794765
Resumen de PubMed | Texto completo de Crossref | Google Académico
18. Valli, VE, Kass, PH, San Myint, M, y Scott, F. Linfomas caninos: asociación del tipo de clasificación, estadio de la enfermedad, subtipo tumoral, tasa mitótica y tratamiento con la supervivencia. Veterinario Pathol. (2013) 50:738–48. doi: 10.1177/0300985813478210
19. Valli, VE, San Myint, M, Barthel, A, Bienzle, D, Caswell, J, Colbatzky, F, et al. Clasificación de los linfomas malignos caninos según los criterios de la Organización Mundial de la Salud. Veterinario Pathol. (2011) 48:198–211. doi: 10.1177/0300985810379428
Resumen de PubMed | Texto completo de Crossref | Google Académico
20. Meuten, DJ. Tumores en animales domésticos. 5ª ed. Hoboken, NJ: John Wiley e hijos (2017). 1 pág.
21. Ponce, F, Marchal, T, Magnol, JP, Turinelli, V, Ledieu, D, Bonnefont, C, et al. Estudio morfológico de 608 casos de linfoma maligno canino en Francia, centrado en las similitudes comparativas entre la morfología del linfoma canino y humano. Veterinario Pathol. (2010) 47:414–33. doi: 10.1177/0300985810363902
Resumen de PubMed | Texto completo de Crossref | Google Académico
22. Turinelli, V, Marchal, T, Ponce, F, Bonnefont-Rebeix, C, y Fournel-Fleury, C. Linfomas linfocitos granulares grandes agresivos asociados a un síndrome hemofagocítico en 5 perros: un estudio clínico citohistológico e inmunológico. Comp Clin Path. (2005) 13:109–18. doi: 10.1007/s00580-004-0531-5
Palabras clave: tumor cardíaco, ecocardiograma, linfoma de células nulas, derrame pericárdico, reporte de caso, insuficiencia cardíaca derecha, perro
Cita: Köster LS, Newkirk K y Krawec P (2024) Un informe de caso: linfoma cardíaco de células nulas en un bulldog inglés. Frente. Vet. Sci. 11:1256442. doi: 10.3389/fvets.2024.1256442
Recibido: 10 de julio de 2023; Aceptado: 18 de enero de 2024;
Publicado: 07 Febrero 2024.
Editado por:
Ricardo Marcos, Universidad de Oporto, Portugal
Revisado por:
Kyoung Won Seo, Universidad Nacional de Seúl, República de Corea
Francisco Ruben Carvallo Chaigneau, Virginia Tech, Estados Unidos
Derechos de autor © 2024 Köster, Newkirk y Krawec. Este es un artículo de acceso abierto distribuido bajo los términos de la Licencia Creative Commons Attribution License (CC BY).
*Correspondencia: Liza S. Köster, lkoster@utk.edu
†ORCID: Philip Krawec, https://orcid.org/0000-0001-5934-8309
Renuncia: Todas las afirmaciones expresadas en este artículo son únicamente las de los autores y no representan necesariamente las de sus organizaciones afiliadas, ni las del editor, los editores y los revisores. Cualquier producto que pueda ser evaluado en este artículo o afirmación que pueda hacer su fabricante no está garantizado ni respaldado por el editor.
Date de alta y recibe nuestro 👉🏼 Diario Digital AXÓN INFORMAVET ONE HEALTH
Date de alta y recibe nuestro 👉🏼 Boletín Digital de Foro Agro Ganadero
Noticias animales de compañía
Noticias animales de producción
Trabajos técnicos animales de producción
Trabajos técnicos animales de compañía