Efecto de una prueba intradérmica reciente sobre la especificidad del ELISA P22 para el diagnóstico de tuberculosis caprina
 Efecto de una prueba intradérmica reciente sobre la especificidad del ELISA P22 para el diagnóstico de tuberculosis caprina
Efecto de una prueba intradérmica reciente sobre la especificidad del ELISA P22 para el diagnóstico de tuberculosis caprina
 Carlos Velasco1†
Carlos Velasco1†  Javier Ortega1,2†
Javier Ortega1,2†  Jaime Ricón1
Jaime Ricón1  Beatriz Romero1,2*
Beatriz Romero1,2*  Lucía de Juan1,2
Lucía de Juan1,2  Lucas Domínguez1,2
Lucas Domínguez1,2  Mercedes Domínguez3
Mercedes Domínguez3  Inmaculada Moreno3
Inmaculada Moreno3  Julio Álvarez1,2
Julio Álvarez1,2  Javier Bezos1,2
Javier Bezos1,2- 1Centro de Vigilancia Sanitaria VISAVET, Universidad Complutense de Madrid, Madrid, España
- 2Facultad de Veterinaria, Departamento de Sanidad Animal, Universidad Complutense de Madrid, Madrid, España
- 3Unidad de Inmunología Microbiana, Centro Nacional de Microbiología, Instituto de Salud Carlos III, Madrid, España
La tuberculosis caprina (TB) es una enfermedad zoonótica causada por miembros del complejo Mycobacterium tuberculosis. Los programas de erradicación de la tuberculosis en cabras se basan en las pruebas de tuberculina intradérmica única y comparativa (SITT y CITT, respectivamente). Las técnicas diagnósticas basadas en anticuerpos han surgido como posibles herramientas diagnósticas para la tuberculosis. El ELISA P22 se ha evaluado previamente utilizando muestras recogidas después de las pruebas de tuberculina intradérmica para maximizar la sensibilidad, un fenómeno conocido como efecto booster. Sin embargo, no hay información disponible sobre si el uso de esta estrategia diagnóstica podría conducir a una disminución de su especificidad (Sp). El objetivo del presente estudio fue dilucidar el efecto de interferencia de un CITT reciente sobre el Sp del ELISA P22 en muestras de suero y leche recolectadas en diferentes momentos después del CITT de un hato libre de TB (n = 113). El número de reactores a ELISA P22 fue significativamente mayor (p < 0,01) en las muestras de suero recolectadas 15 días después de la CITT en comparación con el día 0, mostrando una disminución en Sp del 99,1% (IC 95%; 95,2-99,8%) al 88,5% (IC 95%; 81,3-93,2%). El número de reactores y los valores cuantitativos de P22 ELISA fueron significativamente mayores (p < 0,01) en las muestras de suero en comparación con la leche. No se observaron cambios significativos (p > 0,05) en el Sp del ELISA P22 a lo largo de los diferentes muestreos de tiempo con leche No se observaron cambios significativos (p > 0,05) en los días 30 y 60 post-CITT. En conclusión, la estrategia de efecto de refuerzo puede disminuir significativamente la Sp de ELISA P22 en rebaños libres de TB cuando se utilizan muestras de suero, pero no cuando se analiza la leche.
Introducción
La tuberculosis (TB) en cabras, causada principalmente por Mycobacterium bovis y M. caprae, es una enfermedad infecciosa crónica que afecta a los rebaños caprinos de todo el mundo (1, 2). Representa una amenaza para la salud animal, causando pérdidas económicas a la industria ganadera, y tiene implicaciones para la salud pública debido a su potencial zoonótico (3-5). A diferencia de la tuberculosis bovina, las cabras no están sujetas a programas de erradicación obligatoria dentro de la Unión Europea (UE), aunque el alcance del programa de erradicación de la tuberculosis bovina también incluye a los rebaños caprinos que están epidemiológicamente vinculados a los rebaños bovinos (6). Además, algunas regiones de España han implementado programas regionales de erradicación de la tuberculosis caprina (7). Estos programas se basan en estrategias de prueba y sacrificio mediante las pruebas de tuberculina intradérmica única y comparativa (SITT y CITT, respectivamente) y, en casos muy concretos, el ensayo de liberación de interferón gamma (IGRA), todas ellas basadas en la detección de la respuesta inmune celular (8). Sin embargo, estas herramientas diagnósticas tienen limitaciones en términos de sensibilidad (Se) y especificidad (Sp), principalmente cuando los animales no desarrollan una respuesta inmune celular adecuada, por ejemplo, en etapas avanzadas de infección (3, 9). Por este motivo, en los últimos años han surgido técnicas basadas en la detección de anticuerpos (Ab) como herramientas diagnósticas auxiliares para detectar animales infectados por tuberculosis, especialmente aquellos que no reaccionan a las pruebas celulares (10). Además, los ensayos humorales tienen ciertas ventajas, como su alta Sp y la variedad de tipos de muestras admitidas, incluyendo muestras de suero (10, 11), leche (12) e incluso fluidos orales (13) y orina (14). Además, dado que no tienen altas exigencias logísticas y no requieren estimulación inmunológica con antígenos antes de realizar el ensayo, existe interés en su evaluación y desarrollo (11). Sin embargo, es bien sabido que el Se de estas técnicas es inferior al reportado cuando se utiliza la prueba de tuberculina intradérmica e IGRA, especialmente en animales recientemente infectados por TB, lo que dificulta la detección de la enfermedad en determinadas situaciones epidemiológicas (8). Varios estudios han reportado un aumento de los títulos de Ab en suero (10, 15-17) y leche (18, 19) después de una prueba reciente de tuberculina intradérmica (efecto booster) en rumiantes, lo que lleva a una mejora de la Se de las técnicas basadas en su detección (15, 20, 21). En este contexto, P22 ELISA es un inmunoensayo que detecta Ab específico frente a un antígeno multiproteico, que se purifica por afinidad a partir de un derivado proteico purificado (PPD) bovino (21). Esta herramienta ha sido evaluada previamente en bovinos (10) y caprinos (12, 19) sometidos a una prueba intradérmica previa, lo que ha llevado a un aumento en el número de reactores a ELISA P22 cuando se utilizan muestras de suero y leche. Esto sugiere el potencial del efecto de refuerzo para maximizar el Se en rebaños infectados por tuberculosis (19). Sin embargo, hasta donde sabemos, no se han llevado a cabo estudios en rebaños libres de tuberculosis caprina para evaluar el efecto de esta estrategia diagnóstica sobre la Sp de ELISA P22 u otra prueba diagnóstica humoral. Por lo tanto, con el fin de obtener un mejor conocimiento de esta estrategia diagnóstica, el objetivo del presente estudio fue evaluar la Sp del ELISA P22 utilizando muestras de suero y leche recolectadas en diferentes momentos (0, 15, 30 y 60 días) después de un CITT en un hato caprino libre de TB.
Método
Diseño del estudio
El estudio se llevó a cabo en un rebaño lechero de cabras de raza Murciano-Granadina situado en la región central de España. El rebaño (n = 113) fue negativo en las pruebas anuales realizadas en el marco de un programa regional de erradicación en los últimos 7 años y no tenía antecedentes de TB. Los animales del rebaño fueron sometidos a SITT, CITT e IGRA al inicio del estudio (día 0). Todos los animales también se analizaron con ELISA P22 en muestras de suero y leche a los días 0, 15, 30 y 60 después de la prueba intradérmica. Las muestras de leche y sangre del día 0 se obtuvieron previamente a la inoculación de las PPD (Figura 1).
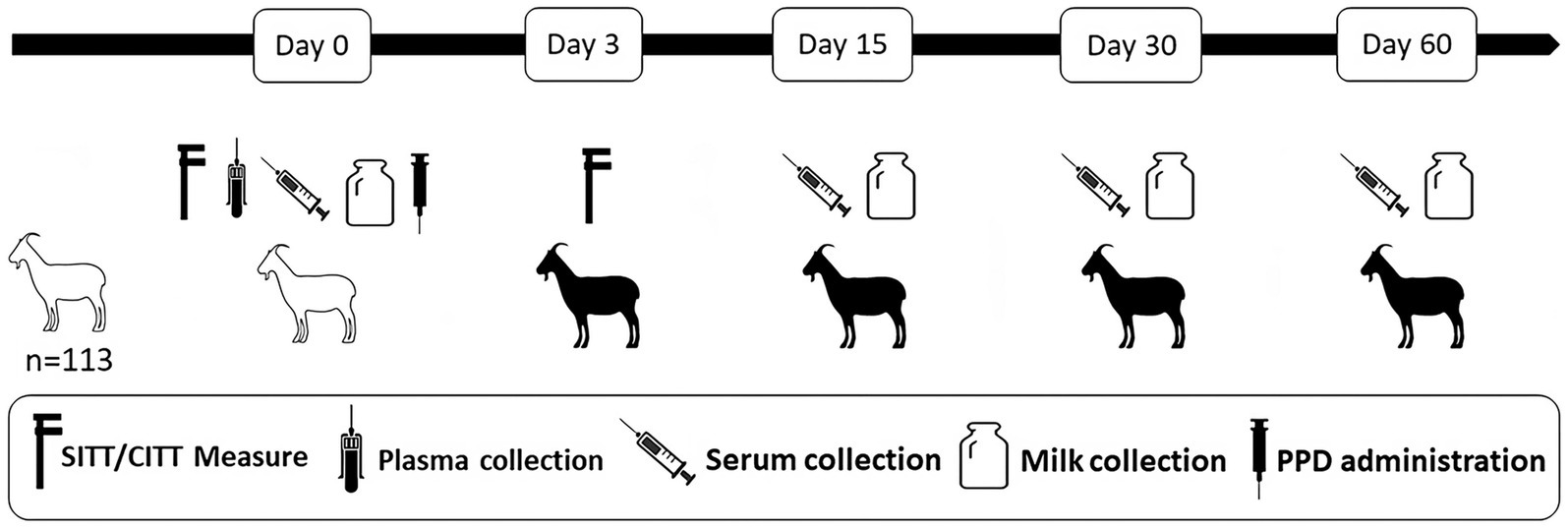 Figura 1. Resumen del diseño experimental. Las cabras se sometieron a una prueba de tuberculina intradérmica única (SITT), a una prueba comparativa de tuberculina intradérmica (CITT) y a un ensayo de liberación de interferón-gamma (IGRA) en el día 0 del estudio y se probaron con ELISA P22 en muestras de suero y leche en los días 0, 15, 30 y 60 después de la prueba intradérmica. Las siluetas blancas y negras representan a las cabras antes y después de la administración del PPD, respectivamente.
Figura 1. Resumen del diseño experimental. Las cabras se sometieron a una prueba de tuberculina intradérmica única (SITT), a una prueba comparativa de tuberculina intradérmica (CITT) y a un ensayo de liberación de interferón-gamma (IGRA) en el día 0 del estudio y se probaron con ELISA P22 en muestras de suero y leche en los días 0, 15, 30 y 60 después de la prueba intradérmica. Las siluetas blancas y negras representan a las cabras antes y después de la administración del PPD, respectivamente.
ELISA indirecto
Se recogieron muestras individuales de leche (40 mL) y sangre (10 mL) en tubos de plástico durante la sesión de ordeño de la glándula mamaria y la vena yugular, respectivamente. En el laboratorio, ambos tipos de muestras se procesaron como se describió anteriormente (19). Brevemente, se centrifugó una alícuota de 1 mL de cada muestra de leche a 13.000 g durante 5 min, tras lo cual se desecharon la nata superficial y el pellet. Las muestras de sangre se centrifugaron a 1.500 g durante 10 min para obtener el suero. Las muestras de leche y suero se almacenaron a -20 °C hasta la realización del ensayo ELISA. A continuación, se analizaron muestras de suero y leche mediante el empleo de un ELISA indirecto interno para la detección de Ab específico frente al complejo proteico P22 (ELISA P22) (22). El ELISA P22 se realizó como se describió anteriormente utilizando la dilución óptima de muestras de suero (1/100) y leche (1/8) en solución de leche desnatada/PBS al 5% (12, 19). Finalmente, se midió la densidad óptica (DO) a 492 nm con un lector ELISA. Los resultados de las muestras de suero y leche se expresaron como un porcentaje de ELISA (E%), calculado con base en la siguiente fórmula: muestra E% = [media de la muestra DO / (2 x media de DO de control negativo)] x 100. Las muestras de suero y leche con valores de E% superiores a 100E% o 150E% se consideraron reactor a ELISA P22 al aplicar los criterios estándar y severo, respectivamente, como se describió anteriormente (23, 24).
Pruebas de tuberculina intradérmica
La ITCT y la CITT se realizaron según el protocolo publicado por el Laboratorio de Referencia de la Unión Europea (EU-RL) para la tuberculosis bovina (SOP/002/EURL), el Reglamento UE 2016/429, el Reglamento Delegado UE 2020/688 de la Comisión y el Real Decreto 2611/1996. Brevemente, el SITT consistió en la inoculación intradérmica de 0,1 mL de PPD bovino (CZ Vaccines, Porriño España) en el lado izquierdo del cuello mediante el uso de una jeringa Dermojet (Akra Dermojet, Francia). Para el CITT también se realizó una inoculación intradérmica de 0,1 mL de PPD aviares en el lado derecho del cuello. Los resultados se interpretaron como se describió anteriormente (24). En este estudio se aplicaron dos puntos de corte (Tabla 1): para leer los resultados del ITST de acuerdo con la interpretación estándar, un aumento en el grosor del pliegue cutáneo ≥ 4 mm y/o la presencia de signos clínicos (edema, dolor, exudación o necrosis) se consideraron una reacción positiva al ITS. Cuando se utilizó la interpretación severa, se consideró positivo un aumento del grosor de los pliegues cutáneos de >2 mm y/o la presencia de signos clínicos. Para la interpretación estándar del CITT, se consideró que un animal era positivo si la reacción bovina era >4 mm mayor que la reacción aviar y/o se observaban signos clínicos en el sitio de inoculación de PPD bovino. Cuando se utilizó la interpretación severa, los reactores fueron aquellos con una reacción bovina >2 mm mayor que la reacción aviar y/o con signos clínicos en el sitio de inoculación de PPD bovino.
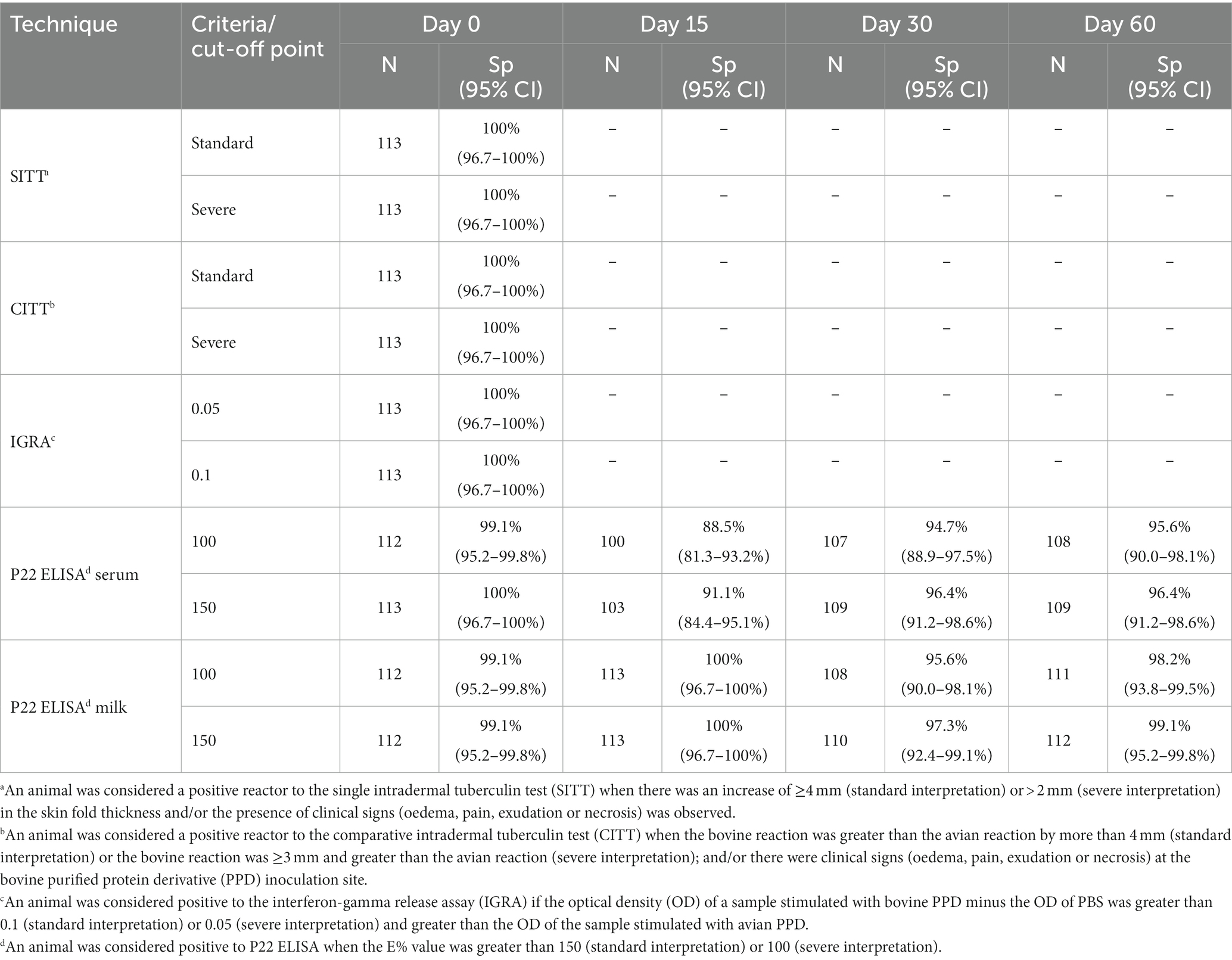 Tabla 1. Número de animales negativos (N) y porcentaje de especificidad (Sp, incluyendo IC 95% de Wilson) a las diferentes pruebas diagnósticas utilizadas en el presente estudio.
Tabla 1. Número de animales negativos (N) y porcentaje de especificidad (Sp, incluyendo IC 95% de Wilson) a las diferentes pruebas diagnósticas utilizadas en el presente estudio.
Ensayo de liberación de interferón gamma (IGRA)
Se recogieron muestras de sangre de la vena yugular antes de la prueba cutánea (día 0 del estudio) mediante venopunción utilizando tubos de vacío (BD Vacutainer Becton, Dickinson and Company, Franklin Lakes, Estados Unidos) con heparina de litio (Figura 1). En el laboratorio, las muestras de sangre se estimularon con PPDs bovinos y aviares (CZ Vaccines, Porriño, España) a una concentración final de 20 μg/mL con el fin de evaluar la producción de IFN-γ. Posteriormente, las muestras de sangre se procesaron como se describe en otra parte (25). La producción de IFN-γ en plasma se midió utilizando un IGRA comercial (Bovigam TB kit, Thermo Fisher Scientific, Waltham, Estados Unidos) de acuerdo con las instrucciones del fabricante. Se consideró que un animal era positivo para el IGRA si la densidad óptica (DO) de una muestra estimulada con PPD bovina menos la OD de PBS era mayor que 0,1 (interpretación estándar) o 0,05 (interpretación severa) y mayor que la DO de la muestra estimulada con PPD aviar (26).
Análisis estadístico
Los datos fueron analizados con el software estadístico comercial SPSS Statistics 25 (IBM, Nueva York, NY, Estados Unidos) e interpretados considerando un valor de p de 0,05 para determinar la significación estadística. Se calcularon los intervalos de confianza del 95% de Wilson (IC del 95%) para el porcentaje de animales que fueron positivos a las diferentes pruebas utilizando WinPepi versión 11.6 (27). La comparación de las proporciones de los reactores ELISA P22 utilizando muestras de leche y suero en los diferentes eventos de muestreo se realizó mediante la prueba Q de Cochran. Las diferencias cuantitativas en el E% durante el estudio en relación con el efecto booster se analizaron mediante la prueba de Friedman.
Resultados
El número y porcentaje de animales que dieron negativo a las diferentes pruebas diagnósticas se resumen en la Tabla 1. No se detectaron reactores para el SITT, CITT o IGRA en el día 0 del estudio, independientemente de la interpretación de la prueba (estándar o grave) utilizada (Tabla 1). Con respecto a los resultados de ELISA P22 en muestras de suero en el día inicial del estudio (día 0), no se observaron reactores cuando se utilizó la interpretación estándar [100% Sp (IC 95%; 96,7-100%)] (Tabla 1; Figura 2) y solo una cabra fue positiva para el ELISA P22 cuando se utilizó la interpretación severa [99,1% Sp (IC 95%; 95,2-99,8%)]. Posteriormente, tanto la respuesta cuantitativa (E%) como el número de reactores en el ELISA P22 utilizando muestras de suero recogidas en el día 15 aumentaron significativamente (p < 0,01) en comparación con el día 0 cuando se utilizó la interpretación estándar [91,1% Sp (IC 95%; 84,4-95,1%)] y severa [88,5% Sp (IC 95%; 81,3-93,2%)]. Sin embargo, solo se observaron diferencias significativas (p < 0,05) en la respuesta cuantitativa el día 30 cuando se utilizaron muestras de suero (Figura 3).
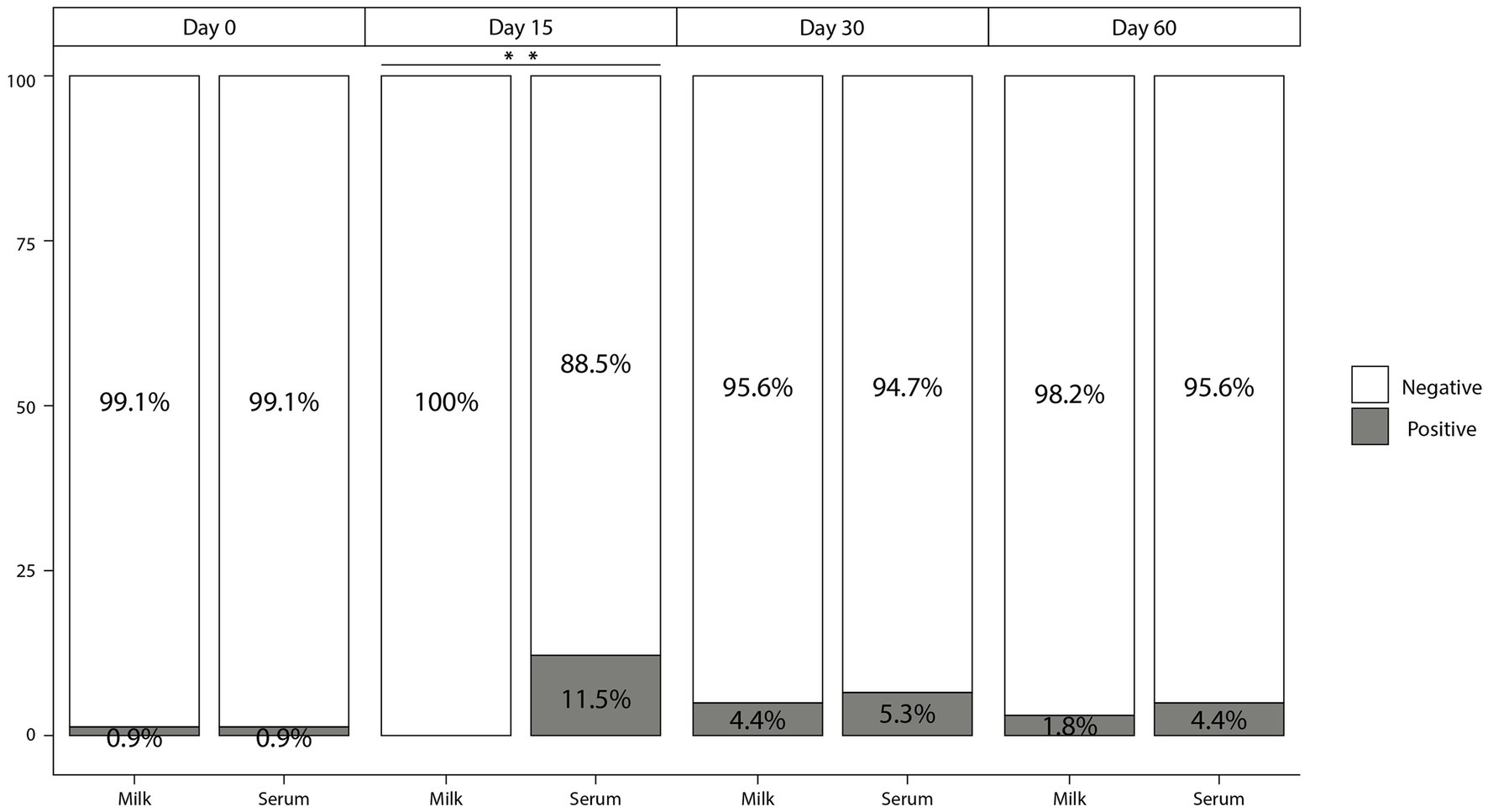 Figura 2. Porcentaje de animales que dieron positivo (gris) y negativo (blanco) al ELISA P22 en muestras de leche y suero con un punto de corte del 100 % de los 113 animales analizados durante los diferentes eventos de ensayo del período evaluado. **p < 0,01.
Figura 2. Porcentaje de animales que dieron positivo (gris) y negativo (blanco) al ELISA P22 en muestras de leche y suero con un punto de corte del 100 % de los 113 animales analizados durante los diferentes eventos de ensayo del período evaluado. **p < 0,01.
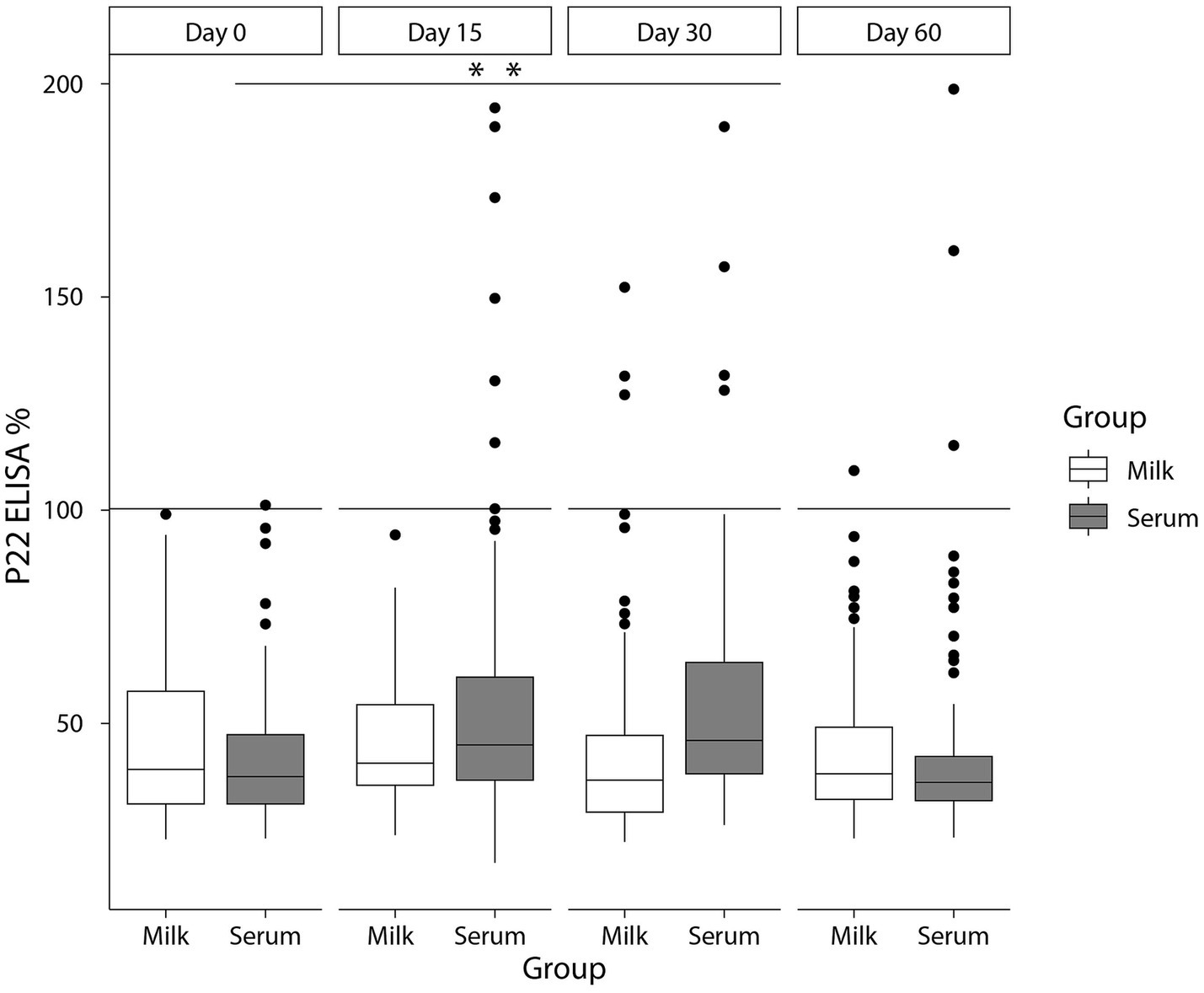 Figura 3. Valores de E% en leche (blanca) y suero (gris) a los días 0, 15, 30 y 60 del estudio del efecto de refuerzo en cabras infectadas por TB con un punto de corte del 100 %. **p < 0,01.
Figura 3. Valores de E% en leche (blanca) y suero (gris) a los días 0, 15, 30 y 60 del estudio del efecto de refuerzo en cabras infectadas por TB con un punto de corte del 100 %. **p < 0,01.
Con respecto a las muestras de leche, solo un animal fue reactorizado a ELISA P22 [99,1% Sp (IC 95%; 95,2-99,8%)] cuando se utilizaron muestras de leche recolectadas en el día 0 e independientemente de los criterios aplicados. No se observaron diferencias significativas (p > 0,05) en los valores de E% y el porcentaje de reactores en el ELISA P22 cuando se utilizaron muestras recolectadas 15 días después de la inoculación de PPD, lo que arrojó un Sp del 100% (IC 95%; 96,7-100%) del ELISA P22 en este momento. Se observaron diferencias significativas (p < 0,01) tanto en los valores de E% como en el número de reactores (independientemente de los criterios aplicados) en las muestras de suero en comparación con la leche en el día 15 (Figuras 2, 3). En los siguientes eventos de muestreo se observó una disminución en los valores de E% cuando se utilizaron muestras de leche (o suero) hasta el día 60 del estudio, con niveles similares a los reportados en el día 0 del estudio (Figura 3). La Sp de ELISA P22 en los días 30 y 60 del estudio fue mayor, cuando se utilizó leche en comparación con las muestras de suero, aunque las diferencias no fueron significativas (Tabla 1; Figura 2).
Discusión
En el presente estudio, nuestro objetivo fue dilucidar el impacto de un CITT reciente en la Sp de ELISA P22 en muestras de suero y leche recolectadas en varios momentos de un rebaño caprino libre de TB. En este estudio, demostramos una Sp significativamente menor de P22 cuando se recolectaron muestras de suero 15 días después de la administración de PPD en comparación con el día 0. Sin embargo, no se observaron cambios significativos en la Sp de la prueba después de la prueba cutánea cuando se utilizaron muestras de leche, independientemente del momento de la toma de muestras.
El aumento de la producción específica de Ab frente a los miembros de MTBC después de una prueba intradérmica reciente (efecto de refuerzo) ha sido ampliamente caracterizado y sugerido como una metodología adecuada para aumentar el Se diagnóstico en una variedad de especies animales, incluyendo bovinos infectados por tuberculosis (10, 16), cabras (11, 19, 21), camélidos del nuevo mundo (20) y ciervos rojos (28). Sin embargo, el aumento de reactores como consecuencia de una prueba intradérmica previa también podría conducir potencialmente a una reducción significativa en la Sp de las pruebas diagnósticas basadas en Ab, como se observa en los resultados del presente estudio.
De acuerdo con la cronología seguida en un estudio reciente que utilizó el efecto de refuerzo en cabras infectadas por tuberculosis (19), el presente estudio evaluó el rendimiento del ELISA P22 en muestras de suero y leche tomadas de un rebaño caprino libre de tuberculosis en los 15, 30 y 60 días posteriores a un CITT. Nuestros resultados mostraron un aumento significativo de los valores cuantitativos (E%) del ELISA P22 en muestras de suero recogidas 15 días después de la administración de PPD, lo que condujo a un número significativamente mayor de reactores (independientemente de los criterios aplicados) al ELISA P22 en el día 15 en comparación con el día 0. Se informaron resultados similares en estudios previos que utilizaron el efecto de refuerzo para aumentar la Se de la prueba humoral en rebaños de bovinos y caprinos infectados con tuberculosis cuando se utilizaron muestras de suero (15, 21) o leche (18, 19). De hecho, un estudio previo en bovinos infectados con tuberculosis también informó de un aumento de la respuesta inmunitaria basada en Ab cuando se recogieron muestras de leche tras la realización de la prueba de tuberculina intradérmica (18). En cabras infectadas con tuberculosis, dos estudios previos informaron resultados similares utilizando muestras de suero recogidas 15 días después de la realización de la prueba de tuberculina intradérmica (11, 21). Gutiérrez y colaboradores (21) observaron un aumento de la Se de una técnica humoral de detección de Ab del 54,9% al 88,6% al comparar los resultados obtenidos antes y 15 días después de la inoculación de PPD. Del mismo modo, Bezos y colaboradores (11) observaron un aumento en el Se de un ELISA experimental P22 antes/15 días después de una prueba cutánea del 83,2% al 100%. Además, los resultados de un estudio reciente sugirieron que el efecto de refuerzo observado en las muestras de leche o suero recogidas después de la prueba cutánea podría maximizar la detección de cabras infectadas por tuberculosis en los rebaños lecheros (19). En este estudio, los valores de E% de los animales de un rebaño infectado fueron significativamente más altos 15 días después de la prueba intradérmica que los observados en los días 30 y 60 del estudio, lo que sugiere un mejor desempeño del ELISA P22 cuando se utilizan muestras de suero o leche recolectadas en este evento de muestreo y se detecta el 100% de cabras infectadas por TB (19). El efecto potenciador también se ha evaluado para el diagnóstico humoral de la paratuberculosis (PTB), otra enfermedad micobacteriana que afecta a los rumiantes domésticos causada por Mycobacterium avium subsp. paratuberculosis (MAP) (29, 30). En este sentido, un CITT reciente puede maximizar el Se de las técnicas humorales de PTB en rebaños infectados con PTB (30), aunque también se ha descrito un impacto en los rebaños libres de PTB observados en Sp (29).
Dado que la totalidad de los estudios realizados en rumiantes (bovinos o caprinos) para evaluar el efecto del refuerzo en la respuesta humoral de la TB se han llevado a cabo en rebaños infectados por TB (11, 15, 18, 19, 21), es esencial evaluar el efecto en rebaños libres de TB para evaluar la idoneidad de esta estrategia diagnóstica cuando la enfermedad no está presente. En este contexto, el presente estudio es el primero en evaluar el efecto de un CITT reciente sobre la Sp del ELISA P22 en muestras de suero y leche recogidas de un rebaño caprino libre de TB.
En conclusión, el aumento de los niveles de E% después de una inoculación de PPD condujo a un aumento significativo en el número de animales (falsos) positivos al ELISA P22 cuando se utilizaron muestras de suero recogidas 15 días después de la administración de PPD, lo que sugiere que la Sp de la prueba podría verse comprometida en estas circunstancias. Sin embargo, los CITT no interfieren significativamente en el Sp del ELISA P22 en muestras de suero recogidas a partir de los 30 días posteriores a la TIMT. Por el contrario, la recolección de muestras de leche 15 días después de un CITT podría ser una valiosa estrategia diagnóstica de TB en rebaños caprinos en combinación con pruebas ELISA, ya que los resultados previos demostraron una Sp alta y un aumento significativo de la Se, aunque siendo esta última menor que la reportada con muestras de suero. Los resultados del presente estudio serán valiosos para el uso estratégico de plataformas basadas en Ab para el diagnóstico de la TB caprina como herramienta diagnóstica auxiliar en el marco de los diferentes programas de erradicación de la TB caprina.
Declaración de disponibilidad de datos
Las contribuciones originales presentadas en el estudio se incluyen en el artículo, las consultas posteriores pueden dirigirse al autor correspondiente.
Declaración ética
Los animales incluidos en este estudio no eran animales de experimentación. Todos los muestreos y demás procedimientos se realizaron de acuerdo con la legislación española (Real Decreto 2611/1996).
Contribuciones de los autores
CV: Redacción – revisión y edición, Análisis formal, Redacción – borrador original. JO: Análisis formal, Redacción – borrador original, Redacción – revisión y edición. JR: Curación de datos, redacción, revisión y edición. BR: Redacción – revisión y edición, Recursos, Curación de datos. LJ: Redacción – revisión y edición, Investigación, Supervisión. LD: Escritura – revisión y edición, conceptualización, recursos. MD: Escritura – revisión y edición. JÁ: Escritura – revisión y edición. JB: Redacción – revisión y edición, análisis formal, curación de datos.
Financiación
El/los autor/es declara(n) haber recibido apoyo financiero para la investigación, autoría y/o publicación de este artículo. Esta investigación ha sido posible gracias a la financiación del ICRAD, una red ERA-NET cofinanciada por el programa de investigación e innovación Horizonte 2020 (https://ec.europa.eu/programmes/horizon2020/en) de la Unión Europea en virtud del Acuerdo de Subvención n°862605, el Ministerio de Ciencia e Innovación (PCI2023-143368) y el Ministerio de Agricultura, Pesca y Alimentación (ref. 21.06.412D.640.08). JO ha contado con el apoyo de una beca de FPU (Formación de Profesorado Universitario) concedida por el Ministerio de Ciencia, Innovación y Universidades (FPU18/05197).
Reconocimientos
Los autores agradecen a Ana Belén Martín (ISCIII), a las Unidades de Asistencia Ganadera Veterinaria y Micobacterias (VISAVET-UCM) y a los Servicios Veterinarios Oficiales de Castilla y León su asistencia técnica.
Conflicto de intereses
Los autores declaran que la investigación se llevó a cabo en ausencia de relaciones comerciales o financieras que pudieran interpretarse como un posible conflicto de intereses.
El/los autor/es declararon, en el momento de la presentación, ser miembro del consejo editorial de Frontiers. Esto no tuvo ningún impacto en el proceso de revisión por pares ni en la decisión final.
Nota del editor
Todas las afirmaciones expresadas en este artículo son únicamente las de los autores y no representan necesariamente las de sus organizaciones afiliadas, ni las del editor, los editores y los revisores. Cualquier producto que pueda ser evaluado en este artículo, o afirmación que pueda ser hecha por su fabricante, no está garantizado ni respaldado por el editor.
Referencias
1. Aranaz, A, Cousins, D, Mateos, A, y Domínguez, L. Elevación de Mycobacterium tuberculosis 293 subsp. caprae Aranaz et al. 1999 a la especie clasificada como Mycobacterium caprae comb. nov., sp. nov. Int J Syst Evol Microbiol. (2003) 53:1785–9. doi: 10.1099/ijs.0.02532-0
Resumen de PubMed | Texto completo de Crossref | Google Académico
2. Rodríguez, S, Bezos, J, Romero, B, de Juan, L, Álvarez, J, Castellanos, E, et al. Infección por Mycobacterium caprae en ganado y vida silvestre. España Emerg Infect Dis. (2011) 17:532–5. doi: 10.3201/eid1703.100618
Resumen de PubMed | Texto completo de Crossref | Google Académico
3. Bezos, J, Alvarez, J, Romero, B, Aranaz, A, y Juan, L. Tuberculosis en cabras: evaluación de los ensayos diagnósticos actuales in vivo mediados por células y basados en anticuerpos. Veterinario J. (2012) 191:161–5. doi: 10.1016/j.tvjl.2011.02.010
Resumen de PubMed | Texto completo de Crossref | Google Académico
4. Napp, S, Allepuz, A, Mercader, I, Nofrarias, M, López-Soria, S, Domingo, M, et al. Evidencia de que las cabras actúan como reservorios domésticos de tuberculosis bovina. Rec. Veterinario (2013) 172:663. doi: 10.1136/vr.101347
Resumen de PubMed | Texto completo de Crossref | Google Académico
5. Schiller, I, Oesch, B, Vordermeier, HM, Palmer, MV, Harris, BN, Orloski, KA, et al. Tuberculosis bovina: una revisión de las técnicas diagnósticas actuales y emergentes en vista de su relevancia para el control y la erradicación de enfermedades. Transbound Emerg Dis. (2010) 57:205–20. doi: 10.1111/j.1865-1682.2010.01148.x
Resumen de PubMed | Texto completo de Crossref | Google Académico
6. Ministerio de Agricultura, Pesca y Alimentación. Programa Nacional de Erradicación de Tuberculosis bovina 2023 (Infección por el complejo Mycobacterium tuberculosis). (2023). Disponible en: https://www.mapa.gob.es/es/ganaderia/temas/sanidad-animal-higiene-ganadera/programatb2023_tcm30-640045.pdf
7. Roy, A, Infantes-Lorenzo, JA, de la Cruz, ML, Domínguez, L, Álvarez, J y Bezos, J. Precisión de las pruebas diagnósticas de tuberculosis en pequeños rumiantes: una revisión sistemática y metaanálisis. Prev Vet Med. (2020) 182:105102. doi: 10.1016/j.prevetmed.2020.105102
Resumen de PubMed | Texto completo de Crossref | Google Académico
8. Bezos, J, Casal, C, Romero, B, Schroeder, B, Hardegger, R, Raeber, AJ, et al. Técnicas actuales ante mortem para el diagnóstico de la tuberculosis bovina. Res Vet Sci. (2014) 97 (Supl.): S44–S52) 97:S44–52. doi: 10.1016/j.rvsc.2014.04.002
Resumen de PubMed | Texto completo de Crossref | Google Académico
9. Pollock, JM y Neill, SD. Infección por Mycobacterium bovis y tuberculosis en bovinos. Veterinario J. (2002) 163:115–27. doi: 10.1053/tvjl.2001.0655
Resumen de PubMed | Texto completo de Crossref | Google Académico
10. Casal, C, Infantes, JA, Risalde, MA, Díez-Guerrier, A, Domínguez, M, Moreno, I, et al. Las pruebas de detección de anticuerpos mejoran la sensibilidad del diagnóstico de tuberculosis en el ganado. Res Vet Sci. (2017) 112:214–21. doi: 10.1016/j.rvsc.2017.05.012
Resumen de PubMed | Texto completo de Crossref | Google Académico
11. Bezos, J, Roy, A, Infantes-Lorenzo, JA, González, I, Venteo, A, Romero, B, et al. El uso de pruebas serológicas en combinación con la prueba de tuberculina intradérmica maximiza la detección de cabras infectadas con tuberculosis. Veterinario Inmunol Inmunopatíaco. (2018) 199:43–52. doi: 10.1016/j.vetimm.2018.03
Resumen de PubMed | Texto completo de Crossref | Google Académico
12. Roy, A, Infantes-Lorenzo, JA, Domínguez, M, Moreno, I, Pérez, M, García, N, et al. Evaluación de un nuevo ensayo inmunoenzimático para el diagnóstico de tuberculosis en leche de cabra. Res Vet Sci. (2020) 128:217–23. doi: 10.1016/j.rvsc.2019.12.009
Resumen de PubMed | Texto completo de Crossref | Google Académico
13. Ortega, J, Infantes-Lorenzo, JA, Bezos, J, Roy, Á, de Juan, L, Romero, B, et al. Evaluación del ELISA P 22 para la detección del anticuerpo específico contra Mycobacterium bovis en el fluido oral de cabras. Front Vet Sci. (2021) 8:674636. doi: 10.3389/fvets.2021.674636
Resumen de PubMed | Texto completo de Crossref | Google Académico
14. Lyashchenko, KP, Sikar-Gang, A, Sridhara, AA, Johnathan-Lee, A, Elahi, R, Greenwald, R, et al. Uso de matrices sanguíneas y fluidos biológicos alternativos para la detección de anticuerpos en tuberculosis animal. Veterinario Inmunol Inmunopatíaco. (2021) 239:110303. doi: 10.1016/j.vetimm.2021.110303
Resumen de PubMed | Texto completo de Crossref | Google Académico
15. Casal, C, Diez-Guerrier, A, Alvarez, J, Rodriguez-Campos, S, Mateos, A, Linscott, R, et al. Uso estratégico de la serología para el diagnóstico de tuberculosis bovina tras pruebas cutáneas intradérmicas. Microbiol veterinario. (2014) 170:342–51. doi: 10.1016/j.vetmic.2014.02.036
Resumen de PubMed | Texto completo de Crossref | Google Académico
16. Waters, WR, Palmer, MV, Stafne, MR, Bass, KE, Maggioli, MF, Thacker, TC, et al. Efectos de las pruebas cutáneas seriadas con derivados proteicos purificados sobre el nivel y la calidad de los anticuerpos frente a antígenos complejos y definidos en bovinos infectados por Mycobacterium bovis. Clin Vacuna Immunol. (2015) 22:641–9. doi: 10.1128/CVI.00119-15
Resumen de PubMed | Texto completo de Crossref | Google Académico
17. Buendía, AJ, Sánchez, J, Salinas, J, Ortega, N, Del Río, L, y Navarro, JA. Evaluación de un ELISA comercial de doble reconocimiento para el diagnóstico de tuberculosis caprina: sensibilidad, especificidad y correlación con lesiones macroscópicas y microscópicas. Res Vet Sci. (2022) 152:618–23. doi: 10.1016/j.rvsc.2022.09.034
Resumen de PubMed | Texto completo de Crossref | Google Académico
18. Buddle, BM, Wilson, T, Luo, D, Voges, H, Linscott, R, Martel, E, et al. Evaluación de un ensayo comercial de inmunoadsorción enzimática para el diagnóstico de tuberculosis bovina a partir de muestras de leche de vacas lecheras. Clin Vacuna Immunol. (2013) 20:1812–6. doi: 10.1128/CVI.00538-13
Resumen de PubMed | Texto completo de Crossref | Google Académico
19. Ortega, J, Infantes-Lorenzo, JA, Roy, A, de Juan, L, Romero, B, Moreno, I, et al. Factores que afectan el desempeño del ELISA P 22 para el diagnóstico de tuberculosis caprina en muestras de leche. Res Vet Sci. (2022) 145:40–5. doi: 10.1016/j.rvsc.2022.02.008
Resumen de PubMed | Texto completo de Crossref | Google Académico
20. Bezos, J, Casal, C, Álvarez, J, Díez-Guerrier, A, Rodríguez-Bertos, A, Romero, B, et al. Evaluación de la realización de pruebas diagnósticas celulares y serológicas para el diagnóstico de tuberculosis en un hato de alpaca (Vicugna pacos) infectado naturalmente con Mycobacterium bovis. Prev Vet Med. (2013) 111:304–13. doi: 10.1016/j.prevetmed.2013.05.013
Resumen de PubMed | Texto completo de Crossref | Google Académico
21. Gutiérrez, M, Tellechea, J, y García Marín, JF. Evaluación de pruebas diagnósticas celulares y serológicas para la detección de cabras infectadas por Mycobacterium bovis. Microbiol veterinario. (1998) 62:281–90. doi: 10.1016/S0378-1135(98)00217-X
Resumen de PubMed | Texto completo de Crossref | Google Académico
22. Infantes-Lorenzo, JA, Moreno, I, Risalde, MA, Roy, A, Villar, M, Romero, B, et al. Caracterización proteómica de derivados proteicos purificados bovinos y aviares e identificación de antígenos específicos para el serodiagnóstico de tuberculosis bovina. Proteómica de Clin. (2017) 14:36. doi: 10.1186/s12014-017-9171-z
Resumen de PubMed | Texto completo de Crossref | Google Académico
23. Infantes-Lorenzo, JA, Moreno, I, Roy, A, Risalde, MA, Balseiro, A, de Juan, L, et al. Especificidad de la prueba serológica para la detección de tuberculosis en bovinos, caprinos, ovinos y porcinos en diferentes situaciones epidemiológicas. BMC Vet Res. (2019) 15:70. doi: 10.1186/s12917-019-1814-z
Resumen de PubMed | Texto completo de Crossref | Google Académico
24. Ortega, J, Roy, Á, Álvarez, J, Sánchez-Cesteros, J, Romero, B, Infantes-Lorenzo, JA, et al. Efecto del sitio de inoculación de derivados proteicos purificados (PPD) bovinos y aviares sobre el rendimiento de la prueba de tuberculina intradérmica en cabras de rebaños infectados y libres de tuberculosis. Front Vet Sci. (2021) 8:722825. doi: 10.3389/fvets.2021.722825
Resumen de PubMed | Texto completo de Crossref | Google Académico
25. Bezos, J, Álvarez, J, de Juan, L, Romero, B, Rodríguez, S, Castellanos, E, et al. Factores que influyen en la realización de un ensayo de interferón gamma para el diagnóstico de tuberculosis en cabras. Veterinario J. (2011) 190:131–5. doi: 10.1016/j.tvjl.2010.09.026
Resumen de PubMed | Texto completo de Crossref | Google Académico
26. Roy, A, Tome, I, Romero, B, Lorente-Leal, V, Infantes-Lorenzo, JA, Domínguez, M, et al. Evaluación de la inmunogenicidad y eficacia de las vacunas BCG y MTBVAC utilizando un modelo de transmisión natural de la tuberculosis. Res. Veterinaria. (2019) 50:82. doi: 10.1186/s13567-019-0702-7
Resumen de PubMed | Texto completo de Crossref | Google Académico
27. Abramson, JH. WINPEPI (PEPI-for-windows): programas informáticos para epidemiólogos. Epidemiol Perspect Innov. (2004) 1:6. doi: 10.1186/1742-5573-1-6
Resumen de PubMed | Texto completo de Crossref | Google Académico
28. Che-Amat, A, Risalde, MA, González-Barrio, D, Ortíz, JA, y Gortázar, C. Efectos de las pruebas comparativas repetidas de tuberculina intradérmica en los resultados de las pruebas: un estudio longitudinal en ciervos rojos libres de tuberculosis. BMC Vet Res. (2016) 12:184. doi: 10.1186/s12917-016-0825-2
Resumen de PubMed | Texto completo de Crossref | Google Académico
29. Varges, R, Marassi, CD, Oelemann, W, y Lilenbaum, W. Interferencia de las pruebas de tuberculina intradérmica en el serodiagnóstico de la paratuberculosis en el ganado. Res Vet Sci. (2009) 86:371–2. doi: 10.1016/j.rvsc.2008.08.006
Resumen de PubMed | Texto completo de Crossref | Google Académico
30. Nunney, E, Crotta, M, van Winden, S, Bond, K, Green, M y Guitian, J. Efecto de las pruebas cutáneas de tuberculina en los resultados serológicos contra Mycobacterium avium ssp. paratuberculosis (MAP): evidencia de efectos distintos en vacas infectadas y no infectadas con MAP. J Lácteos Sci. (2022) 105:8354–63. doi: 10.3168/jds.2021-21753
Resumen de PubMed | Texto completo de Crossref | Google Académico
Palabras clave: tuberculosis caprina, prueba de tuberculina intradérmica, ELISA P22, efecto booster, especificidad
Cita: Velasco C, Ortega J, Ricón J, Romero B, de Juan L, Domínguez L, Domínguez M, Moreno I, Álvarez J y Bezos J (2024) Efecto de una prueba intradérmica reciente sobre la especificidad del ELISA P22 para el diagnóstico de tuberculosis caprina. Frente. Vet. Sci. 11:1358413. doi: 10.3389/fvets.2024.1358413
Recibido: 19 de diciembre de 2023; Aceptado: 24 de enero de 2024;
Publicado: 08 Febrero 2024.
Editado por:
Waithaka Mwangi, Universidad Estatal de Kansas, Estados Unidos
Revisado por:
Gobena Ameni, Universidad de los Emiratos Árabes Unidos, Emiratos Árabes
Unidos Siti Zubaidah Ramanoon, Universiti Putra Malaysia, Malasia
Copyright © 2024 Velasco, Ortega, Ricón, Romero, de Juan, Domínguez, Domínguez, Moreno, Álvarez y Bezos. Este es un artículo de acceso abierto distribuido bajo los términos de la Licencia Creative Commons Attribution License (CC BY).
*Correspondencia: Beatriz Romero Martínez, bromerom@ucm.es
†Estos autores han contribuido igualmente a este trabajo
Renuncia: Todas las afirmaciones expresadas en este artículo son únicamente las de los autores y no representan necesariamente las de sus organizaciones afiliadas, ni las del editor, los editores y los revisores. Cualquier producto que pueda ser evaluado en este artículo o afirmación que pueda hacer su fabricante no está garantizado ni respaldado por el editor.
Date de alta y recibe nuestro 👉🏼 Diario Digital AXÓN INFORMAVET ONE HEALTH
Date de alta y recibe nuestro 👉🏼 Boletín Digital de Foro Agro Ganadero
Noticias animales de compañía
Noticias animales de producción
Trabajos técnicos animales de producción
Trabajos técnicos animales de compañía

