Actividad antimicrobiana del sobrenadante libre de células derivado de Ligilactobacillus animalis SWLA-1
 Actividad antimicrobiana del sobrenadante libre de células derivado de Ligilactobacillus animalis SWLA-1 en un nuevo modelo ex vivo de infección corneal canina
Actividad antimicrobiana del sobrenadante libre de células derivado de Ligilactobacillus animalis SWLA-1 en un nuevo modelo ex vivo de infección corneal canina
 Je-Hwan Jang1†
Je-Hwan Jang1†  Hong-Jae Lee2†
Hong-Jae Lee2†  Dong-Hwi Kim2
Dong-Hwi Kim2  Sang-Won Lee2
Sang-Won Lee2  Joon-Yong Kim1*
Joon-Yong Kim1*- 1Departamento de Oftalmología Veterinaria, Facultad de Medicina Veterinaria, Universidad de Konkuk, Seúl (República de Corea)
- 2Laboratorio de Enfermedades Infecciosas y Microbiología Veterinaria, Facultad de Medicina Veterinaria, Universidad de Konkuk, Seúl (República de Corea)
Introducción: La queratitis bacteriana canina es una infección de la córnea que causa varios síntomas, incluida la discapacidad visual, y requiere la extirpación del ojo en casos graves. Staphylococcus pseudintermedius es un patógeno que causa queratitis bacteriana significativa en pacientes caninos. Además, se han notificado casos de Staphylococcus pseudintermedius multirresistente (MDRSP) tanto en humanos como en animales. Con respecto al fracaso del tratamiento contra patógenos multirresistentes (MDR) con antibióticos clásicos, se han sugerido compuestos antimicrobianos derivados de probióticos como un enfoque alternativo.
Métodos: La cepa SWLA-1 de Ligilactobacillus animalis y su sobrenadante libre de células (SFC) han demostrado previamente una potente actividad antimicrobiana contra varias bacterias patógenas MDR. Sobre la base de este hallazgo, evaluamos la actividad antiestafilocócica del SFC derivado de Ligilactobacillus animalis SWLA-1 contra MDRSP en un modelo de infección corneal canina ex vivo recientemente establecido utilizando bordes corneoesclerales caninos frescos. Además, se realizó una prueba de citotoxicidad in vitro con queratocitos humanos.
Resultados y Discusión: El SFC inhibió significativamente el crecimiento de MDRSP en el nuevo modelo ex vivo y no mostró ninguna toxicidad significativa contra los queratocitos in vitro. Sobre la base de estos resultados, los compuestos antimicrobianos del SFC muestran potencial como un enfoque novedoso para el tratamiento de la queratitis estafilocócica MDR.
1 Introducción
La queratitis bacteriana es uno de los tipos más comunes de queratitis infecciosa en perros (1), y se han aislado e identificado las principales bacterias patógenas implicadas en las úlceras corneales caninas. Los géneros bacterianos más prevalentes son Staphylococcus spp., Streptococcus y Pseudomonas. El estafilococo pseudintermedius es la especie predominante responsable de la queratitis infecciosa canina en numerosas regiones geográficas (2-7). La aparición de bacterias multirresistentes, atribuida al uso indebido y al abuso de agentes antimicrobianos, supone una importante amenaza mundial para los seres humanos y los animales (8). En el caso de los patógenos bacterianos caninos, el estafilococo MDR pseudintermedius (MDRSP) es un patógeno principal dominante con resistencia a los antibióticos (9). Como se sabe que esta bacteria es un patógeno importante de queratitis bacteriana y úlceras corneales en perros, se han notificado casos de infección por MDRSP, incluidas cepas pertenecientes a Staphylococo pseudintermedius resistente a la meticilina (MRSP) (10-12). Además, muchas cepas de MDRSP presentan resistencia a los agentes antimicrobianos utilizados en oftalmología veterinaria, como las fluoroquinolonas y las tetraciclinas (13, 14).
Desde finales del siglo XX se han puesto en marcha planes de acción para combatir las bacterias MDR y salvaguardar importantes antibióticos en las comunidades internacionales. La Organización Mundial de la Salud, la Organización de las Naciones Unidas para la Alimentación y la Agricultura y la Organización Mundial de Sanidad Animal (anteriormente conocida como Oficina Internacional de Epizootias) han recomendado directrices para el uso responsable de agentes antimicrobianos y han enumerado los antibióticos de importancia crítica en la medicina humana y veterinaria (15-17). Además, reconociendo la necesidad de alternativas a los antibióticos clásicos contra las bacterias MDR, varios estudios proactivos han sugerido descubrir y desarrollar nuevos enfoques alternativos que salvaguarden los antibióticos clásicos (18-20). Entre ellos, las moléculas antimicrobianas producidas por los probióticos, incluidas las bacteriocinas y los ácidos orgánicos, se han considerado alternativas prometedoras a los antibióticos clásicos y un arsenal para luchar contra las bacterias MDR. Se han descubierto y reportado varios tipos de estas moléculas por su efecto antimicrobiano (21-23).
Ligilactobacillus animalis La cepa SWLA-1 y su sobrenadante libre de células (SFC), que tiene una actividad antimicrobiana versátil contra las bacterias MDR Gram-positivas y Gram-negativas, tienen un efecto inhibidor contra el MDR Staphylococcus spp. in vitro (24). Sobre la base de los hallazgos, nos propusimos evaluar la actividad antimicrobiana del SFC derivado de L. animalis SWLA-1 frente a la cepa MDR Staph. pseudintermedius KUVM1701GC como una alternativa potencial a los agentes antibióticos oftálmicos comerciales (Figura 1). Para simular el entorno ocular resultante de una infección estafilocócica, se estableció un nuevo modelo de infección ex vivo utilizando bordes corneoesclerales caninos frescos (CSR). Además, se realizó un ensayo de citotoxicidad in vitro para determinar los efectos citotóxicos inducidos por el SFC derivado de L. animalis SWLA-1 sobre queratocitos vivos.
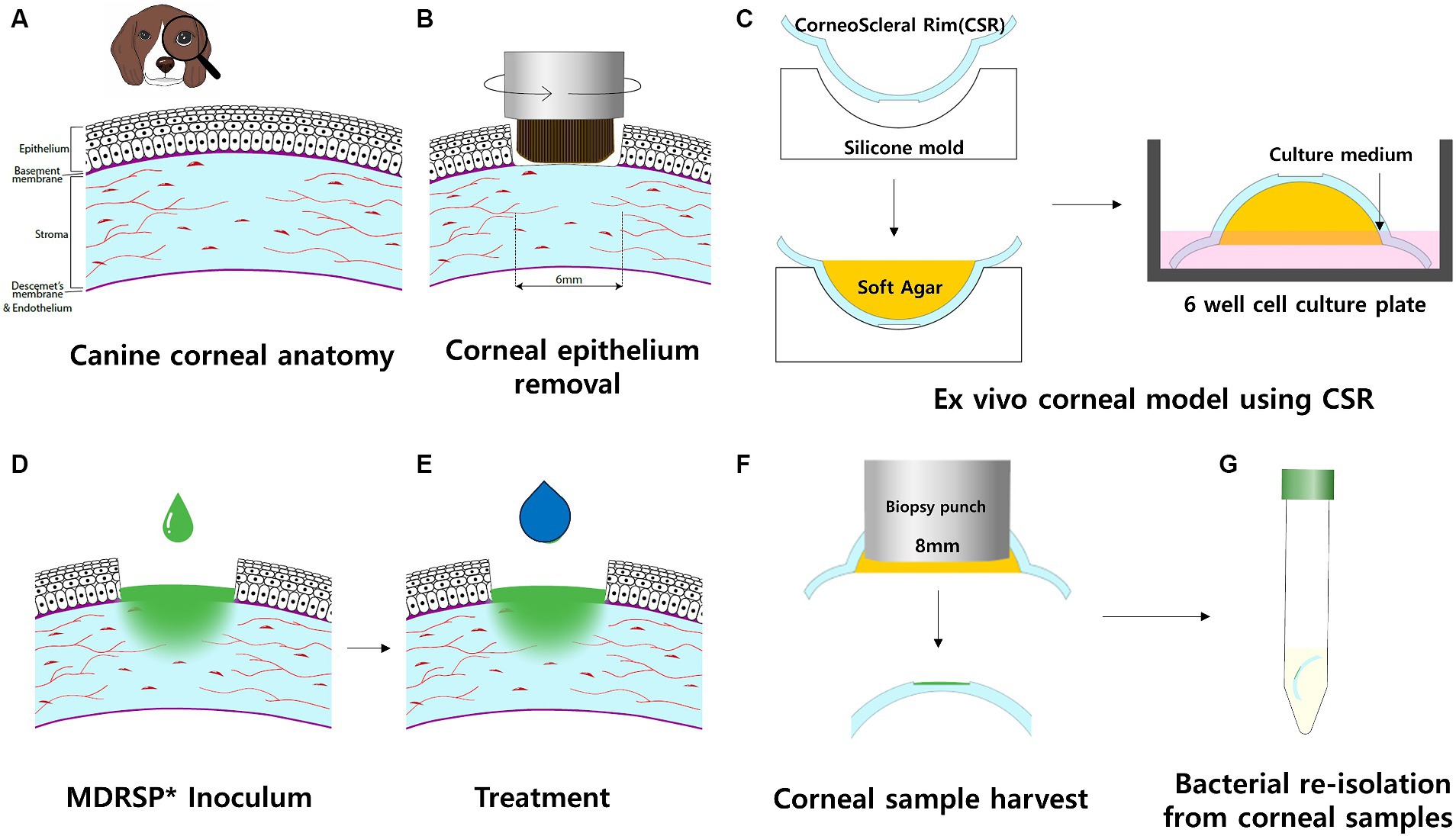 Figura 1. Flujo de trabajo esquemático del modelo de infección corneal canina ex vivo. Cada procedimiento se realizó en un ambiente estéril en una campana de flujo laminar biosegura. (A) Vista transversal de la córnea canina, incluyendo cuatro capas: epitelio, estroma, membrana de Descemet y endotelio. (B) Se utilizaron cepillos corneales giratorios para estimular la extirpación del epitelio corneal. (C) Se obtuvo el borde corneoescleral (CSR) y se colocó en un molde de silicona estéril con el lado epitelial hacia abajo. A continuación, el agar se llenaba con agar blando y se dejaba reposar hasta que se solidificaba. Las CSR con agar solidificado se colocaron en una placa de cultivo de 6 pocillos con el lado epitelial hacia arriba. El pozo de cultivo se llenó con medio de cultivo hasta el nivel del limbo de las RSE, los cuales se incubaron en una plataforma oscilante. (D) Se aplicó inóculo de MDRSP a los sitios de defectos de CSR. (E) A partir de entonces, se aplicó la misma cantidad de tratamiento tópico según el diseño experimental dentro de una campana biosegura. (F) Después de 48 h de incubación, se recolectaron muestras de córnea y se eliminó agar blando de cada CSR. (G) Para el análisis microbiológico, las muestras de córnea se transfirieron a tubos estériles individuales que contenían 10 ml de succinato de polibutileno (PBS). *MDRSP: Staphylococcus pseudintermedius multirresistente.
Figura 1. Flujo de trabajo esquemático del modelo de infección corneal canina ex vivo. Cada procedimiento se realizó en un ambiente estéril en una campana de flujo laminar biosegura. (A) Vista transversal de la córnea canina, incluyendo cuatro capas: epitelio, estroma, membrana de Descemet y endotelio. (B) Se utilizaron cepillos corneales giratorios para estimular la extirpación del epitelio corneal. (C) Se obtuvo el borde corneoescleral (CSR) y se colocó en un molde de silicona estéril con el lado epitelial hacia abajo. A continuación, el agar se llenaba con agar blando y se dejaba reposar hasta que se solidificaba. Las CSR con agar solidificado se colocaron en una placa de cultivo de 6 pocillos con el lado epitelial hacia arriba. El pozo de cultivo se llenó con medio de cultivo hasta el nivel del limbo de las RSE, los cuales se incubaron en una plataforma oscilante. (D) Se aplicó inóculo de MDRSP a los sitios de defectos de CSR. (E) A partir de entonces, se aplicó la misma cantidad de tratamiento tópico según el diseño experimental dentro de una campana biosegura. (F) Después de 48 h de incubación, se recolectaron muestras de córnea y se eliminó agar blando de cada CSR. (G) Para el análisis microbiológico, las muestras de córnea se transfirieron a tubos estériles individuales que contenían 10 ml de succinato de polibutileno (PBS). *MDRSP: Staphylococcus pseudintermedius multirresistente.
2 Materiales y métodos
2.1 Preparación de la córnea canina para el modelo de infección ex vivo
Las CSR caninas se cultivaron como se describió previamente en modelos caninos ex vivo (12). Se obtuvieron CSR caninos frescos de 15 perros sacrificados por razones no relacionadas con este estudio. Se extrajeron un total de 30 ojos de 15 sujetos caninos. Sin embargo, seis ojos fueron excluidos del grupo experimental debido a la pigmentación y degeneración corneal observada, lo que los hizo inadecuados para el estudio. Brevemente, la enucleación de los globos oculares fue realizada por un veterinario y no se confirmó ninguna enfermedad oftálmica mediante evaluación macroscópica. Los globos enucleados se sumergieron en povidona yodada al 10% durante 30 min a temperatura ambiente. Posteriormente, la povidona yodada fue sustituida por solución salina estéril tamponada con fosfato hasta eliminar todas las trazas visibles de povidona yodada (25). A continuación, todos los globos se transfirieron al medio Eagles’ modificado de Dulbecco que contenía 100 μg/mL de estreptomicina, 100 unidades/mL de penicilina y 0,25 μg/mL de anfotericina. Utilizando biomicroscopía con lámpara de hendidura, se excluyeron muestras inadecuadas para este estudio de todos los globos oculares enucleados. El medio de cultivo corneal consistió en el medio Eagle modificado de Dulbecco y la mezcla de nutrientes F-12c de Ham en una proporción de 1:1, suplementada con suero fetal bovino al 10%, tampón HEPES y sulfato de condroitina al 0,025%; además, el medio se fortificó con solución antimicrobiana al 10% (100 μg/mL de estreptomicina, 100 unidades/mL de penicilina y 0,25 μg/mL de anfotericina), glutatión y solución de L-glutamina al 1% (12).
2.2 Preparación del SFC y de las bacterias indicadoras
Se descongeló un cultivo puro congelado de L. animalis SWLA-1 y se colocó en agar Difco de Man Rogosa Sharp (MRS) (BD Biosciences, Sparks, MD, EE. UU.). La placa se incubó a 37°C durante 24 h. Se seleccionaron cinco colonias individuales de L. animalis SWLA-1 de la placa, se inocularon en el caldo MRS y se incubaron durante la noche. Este cultivo bacteriano (1,2 × 109 unidad formadora de colonias [UFC]/mL) y se centrifugó a 10.000 × g y 4 °C durante 30 min (Legend X1R; Thermo Fisher Scientific, Waltham, MA, EE.UU.) para obtener el crudo CFS. Como la actividad antimicrobiana de este SFC era similar a la de la bacteriocina, según un estudio previo (24), se concentró utilizando el método de precipitación de proteínas de ácido tricloroacético (TCA). Brevemente, se añadieron 10 ml de solución de TCA (Sigma-Aldrich, St. Louis, MO, EE. UU.) a 40 ml de SFC crudo derivado de L. animalis SWLA-1. Las muestras se incubaron durante 1 h a 4°C para la precipitación. La muestra se centrifugó a 14.000 × g y 4°C durante 10 min. A continuación, se retiró el sobrenadante, dejando intacta la bolita de proteína. Este pellet se lavó con 2 mL de acetona fría y se centrifugó a 14.000 × g y 4°C durante 10 min. Se repitió el paso de lavado y el pellet se secó en un bloque térmico a 95 °C para evaporar cualquier acetona residual. El gránulo de proteína pura se volvió a disolver en 50 μL de dimetilsulfóxido (Sigma-Aldrich, St. Louis, MO, EE. UU.) y se diluyó con 950 μL de agua Milli-Q. La concentración proteica del CFS concentrado se cuantificó mediante el ensayo proteico del ácido bicinconínico (BCA) (Pierce™ BCA Protein Assay Kits, Thermo Fisher, EE. UU.) y se comparó con la del CFS crudo. Los patrones de proteína de albúmina se prepararon siguiendo las recomendaciones del fabricante. Estos patrones proteicos y CFS concentrados se diluyeron en el reactivo de trabajo. Se mezclaron 25 μL de cada muestra con 200 μL del reactivo de trabajo en una placa de microlitros de 96 pocillos y se incubaron a 37 °C durante 30 min. Cada mezcla se enfrió a temperatura ambiente y se midió la absorbancia en OD562 Lector de placas. Finalmente, la concentración de SFC se determinó mediante la curva estándar, que se generó mediante la representación gráfica del testigo en blanco y de cada patrón de proteína. También se evaluaron las muestras concentradas de SFC (5×, 10×, 20× y 40×) para determinar la concentración mínima inhibitoria frente a las bacterias indicadoras.
La cepa MDRSP aislada de una muestra clínica proporcionada por el Hospital Docente de Medicina Veterinaria de la Universidad de Konkuk (KUVMTH) y designada como Staph. pseudintermedius KUVM1701GC se utilizó como bacteria indicadora de MDR en este estudio. Esta bacteria fue colectada del paciente canino con endoftalmitis crónica y dermatitis alrededor de la cara. El cultivo bacteriano puro se aisló de una muestra de hisopo ocular y cutáneo y se mantuvo a -80 °C. Los cultivos congelados de Staph. pseudintermedius KUVM1701GC se descongelaron y se colocaron en agar sangre de oveja. Las placas de agar se incubaron a 37°C durante 24 h. Cinco colonias individuales de esta bacteria fueron inoculadas en caldo de soja tríptico (TSB; BD, Francia) y se incuba durante la noche. Estos cultivos bacterianos se utilizaron en un modelo ex vivo de infección corneal. Utilizando el método de microdilución, se evaluaron los perfiles de susceptibilidad antimicrobiana de las bacterias indicadoras utilizando 15 agentes antimicrobianos, de acuerdo con las directrices del Clinical Laboratory Standard Institute (CLSI VET01, 2019) y el Comité Europeo de Pruebas de Susceptibilidad Antimicrobiana (EUCAST ver.11.0, 2021).
2.3 Evaluación de la actividad antimicrobiana en un nuevo modelo de infección corneal ex vivo
Para imitar la queratitis bacteriana in vivo, las defensas anatómicas corneales deben estar comprometidas. Utilizando una biopsia estéril con sacabocados de 6 mm (BIOPSY PUNCH, KAI medical, Japón), se creó un defecto del mismo diámetro en el centro de cada córnea. A continuación, un cepillo epitelial (Occubrush, Occutech, Corea del Sur) y un cepillo giratorio (Amoils epitelial scrubber; Innovative Excimer Solutions, Inc., Toronto, Canadá) para eliminar de manera consistente el epitelio corneal. El epitelio corneal se extirpó durante aproximadamente 10 segundos hasta que no se encontraron inserciones restantes en los márgenes de marcado. A continuación, se extirparon la córnea y el borde escleral (a 5 mm del limbo) con un bisturí desechable estéril (15 T, Paragon®, Inglaterra).
Antes de preparar la CSR para ser colocada sobre la base de agar y el medio de cultivo, se aplicó soporte estructural a cada CSR para mantener intacta la curvatura de la córnea. Cada córnea se colocó en un molde de silicona de cúpula hemisférica con una superficie de moldeo de forma cóncava y se rellenó con gel de agarosa de bajo punto de fusión (UltraPure LMP Agarose, Thermo Fisher Scientific, Waltham, MA, EE. UU.) para evitar daños por calor excesivo en la córnea. Las CSR se llenaron con un gel de agarosa blando estéril y se incubaron a temperatura ambiente durante 30 min hasta que el agar se solidificó. Tras la solidificación de la solución de agarosa, las CSR preparadas se colocaron con el lado epitelial hacia arriba en placas de cultivo celular Falcon® de 6 pocillos (Corning, NY, EE. UU.).
Se colocaron seis CSR preparadas en cada placa de cultivo celular de 6 pocillos y se dividieron en seis grupos; (1) Grupo 1: 20 μL de PBS inoculado sobre el defecto corneal; (2) Grupo 2: 20 μL de Estafilococo pseudintermedius KUVM1701GC cultivo inoculado sobre defecto corneal y tratado con 20 μL de PBS; (3) Grupo 3: 20 μL de Estafilococo pseudintermedius KUVM1701GC cultivo inoculado sobre defecto corneal y tratado con 20 μL de vancomicina (20 μg/mL); (4) Grupo 4: 20 μL de Estafilococo pseudintermedius KUVM1701GC cultivo inoculado sobre defecto corneal y tratado con 20 μL de ofloxacino (3 mg/mL); (5) Grupo 5: 20 μL de cultivo de KUVM1701GC de estafilococos pseudintermedius inoculado sobre el defecto corneal y tratado con 20 μL de CFS concentrado (20 ×× ) derivado de L. animalis SWLA-1 y (6) Grupo 6: 20 μL de Staph. pseudintermedius KUVM1701GC cultivo inoculado sobre defecto corneal y tratado con 10 μL de CFS concentrado (20 ×× ) derivado de L. animalis SWLA-1 y 10 μL de ofloxacino (3 mg/mL). Las CSR pertenecían al grupo 1 y el grupo 2 no fue tratado con ningún antibiótico en este experimento. Además, las CSR inoculadas con bacterias indicadoras fueron preincubadas durante 1 h antes de ser tratadas con PBS, antibióticos o CFS concentrado. Un cultivo bacteriano de Staph. pseudintermedius KUVM1701GC (OD600 = 0,210, 5 × 106 UFC/mL) de acuerdo con el rango de UFC descrito por Ubani-Ukoma et al. (25). Dado que la concentración más baja de SFC concentrado derivado de L. animalis SWLA-1 que podía inhibir las bacterias indicadoras fue de 10 veces (118,82 ± 3,27 mg/mL), en este experimento se utilizó CFS concentrado de 20 veces (232,96 ± 5,23 mg/mL), con volúmenes iguales de SFC e inóculo aplicados al defecto corneal. Como las bacterias indicadoras eran sensibles a la vancomicina y resistentes a la ofloxacina, estos antibióticos se utilizaron como antibióticos de referencia. El tratamiento con PBS, antibióticos o SFC concentrado se administró dos veces al día a intervalos de 12 h durante 48 h. En el Grupo 6, se utilizó una combinación de CFS concentrado y ofloxacino para tratar las bacterias indicadoras con el fin de determinar cualquier efecto sinérgico entre estos compuestos.
A cada RSE preparada se le adicionó medio de cultivo en el pocillo de las placas de cultivo hasta llegar al limbo. Las placas de cultivo se colocaron en un agitador de plataforma oscilante, girando en el sentido de las agujas del reloj en ejes tridimensionales (20 rotaciones/min) en una incubadora humidificada a 37°C con 5% de CO2 durante 48 h.
Después de 48 h, se recogieron asépticamente 8 mm de tejido corneal, incluido el centro del defecto corneal, de cada CSR mediante una biopsia estéril con sacabocados de 8 mm (BIOPSY PUNCH, KAI Medical, Japón). Los tejidos corneales recolectados se suspendieron en 10 mL de PBS estéril y se diluyeron en serie 10 veces para el recuento de colonias viables de Staph. pseudintermedius KUVM1701GC. Utilizando el método de Miles y Misra, cada 20 μL de muestra diluida se colocó en placas medianas de Staphylococcus No. 110 (Oxoid, Reino Unido). Las placas se incubaron a 37°C durante 24 h. Después de la incubación, se contaron las colonias bacterianas y se transformó logarítmicamente el valor medido de UFC de cada muestra (log10 UFC/ml) para comparar las diferencias medias en los recuentos entre los grupos experimentales. Los experimentos se realizaron de forma independiente utilizando cuatro copias de las placas de cultivo.
2.4 Análisis de la opacidad corneal
El cambio en la opacidad corneal después de la infección bacteriana con RSE en el modelo de infección corneal ex vivo fue evaluado en cada grupo experimental por tres oftalmólogos veterinarios. Los veterinarios puntuaron aleatoriamente las imágenes de CSR de Staphylococcus negativos o Staphylococcus positivos para cada grupo experimental sin ninguna información relacionada con los tratamientos. La puntuación de cada opacidad corneal en el examen macroscópico se evaluó mediante el sistema semicuantitativo de puntuación de toxicología ocular preclínica (SPOTS) (26) y se registró. Brevemente, con base en este sistema, la severidad de la opacidad corneal se puntuó 24 h y 48 h después de la infección utilizando el sistema SPOTS (0-córnea normal, 1-pérdida mínima de transparencia corneal, 2-pérdida leve de transparencia corneal, 3-pérdida moderada de transparencia corneal).
2.5 Ensayo de citotoxicidad in vitro
Se obtuvieron queratocitos humanos (ScienCell, Catálogo #6520) y se cultivaron en un medio fibroblástico (ScienCell, Catálogo #2301). Los cultivos se mantuvieron a 37°C en una atmósfera con 5% de CO2.
La citotoxicidad del CFS concentrado derivado de L. animalis SWLA-1 (10 ×× , 118,82 ± 3,27 mg/mL) en queratocitos humanos se evaluó mediante el ensayo Cell Counting Kit-8. Los queratocitos humanos se sembraron a una densidad de 1 × 104 células por pocillo en una placa de 96 pocillos. Después de 24 h, las células fueron tratadas con concentraciones seriadas de SFC durante 72 h. Tras la eliminación del sobrenadante, se añadió a las células el reactivo CCK-8 al 10% (Sigma-Aldrich, 96.992) en medios frescos sin suero. Las células se incubaron en un CO al 5%2 temperatura ambiente a 37°C. Después de 3 h, se utilizó un espectrofotómetro (lector de microplacas Sunrise, Tecan, Austria) para medir la absorbancia de las células viables a 450 nm. La citotoxicidad se analizó comparando la viabilidad de las células tratadas simuladamente, que se consideraron controles 100% viables. Este experimento se realizó de forma independiente por triplicado.
2.6 Análisis estadístico
Los datos cuantitativos de este estudio se evaluaron para determinar su normalidad mediante la prueba de Shapiro-Wilk. Como los valores medios de las puntuaciones de opacidad corneal y los datos de UFC de las muestras corneales no se distribuyeron normalmente, se utilizó la prueba de Kruskal-Wallis para comparar de forma no paramétrica las múltiples medias de los datos experimentales de cada grupo. Esta prueba se utilizó para analizar las diferencias en la puntuación media observada o en los datos de UFC entre los grupos. Posteriormente, se utilizó la prueba de Dunn post-hoc para comparar las puntuaciones medias y los datos de las UFC de cada grupo. Dado que los datos observados estaban distribuidos de forma no paramétrica, también se utilizó la prueba de Scheirer-Ray-Hare para analizar las relaciones entre los recuentos viables medios de las bacterias indicadoras y las dos variables (grupos experimentales y puntuaciones de opacidad corneal). Se utilizó la prueba de Dunn post-hoc para comparar los datos experimentales de cada grupo. Todas las pruebas se realizaron utilizando el paquete «rstatix» [versión 0.6.0; R Foundation for Statistical Computing, Viena, Austria; (27)] y el paquete «rcompanion» [versión 2.4.3; Rutgers Cooperative Extension, New Brunswick, Nueva Jersey, EE.UU.; (28)] en R (versión 4.3.1; R Foundation for Statistical Computing, Viena, Austria; R equipo central 2023). La significación se fijó en un nivel de α de 0,05.
3 Resultados
3.1 Perfiles de susceptibilidad antimicrobiana de las bacterias indicadoras
El perfil de susceptibilidad antimicrobiana de Staph. pseudintermedius KUVM1701GC se determinó mediante el método de microdilución (Tabla 1). Entre los 15 agentes antimicrobianos utilizados en este estudio, las bacterias indicadoras fueron resistentes a 12 antibióticos (ciprofloxacino, ofloxacino, oxacilina, ampicilina, tetraciclina, ceftriaxona, cloranfenicol, gentamicina, azitromicina, trimetoprima/sulfametoxazol, ceftazidima y cefotaxima). Solo tres agentes (vancomicina, clindamicina y amikacina) demostraron susceptibilidad a esta bacteria. Staph. pseudintermedius KUVM1701GC se identificó como resistente a la meticilina y MDRSP.
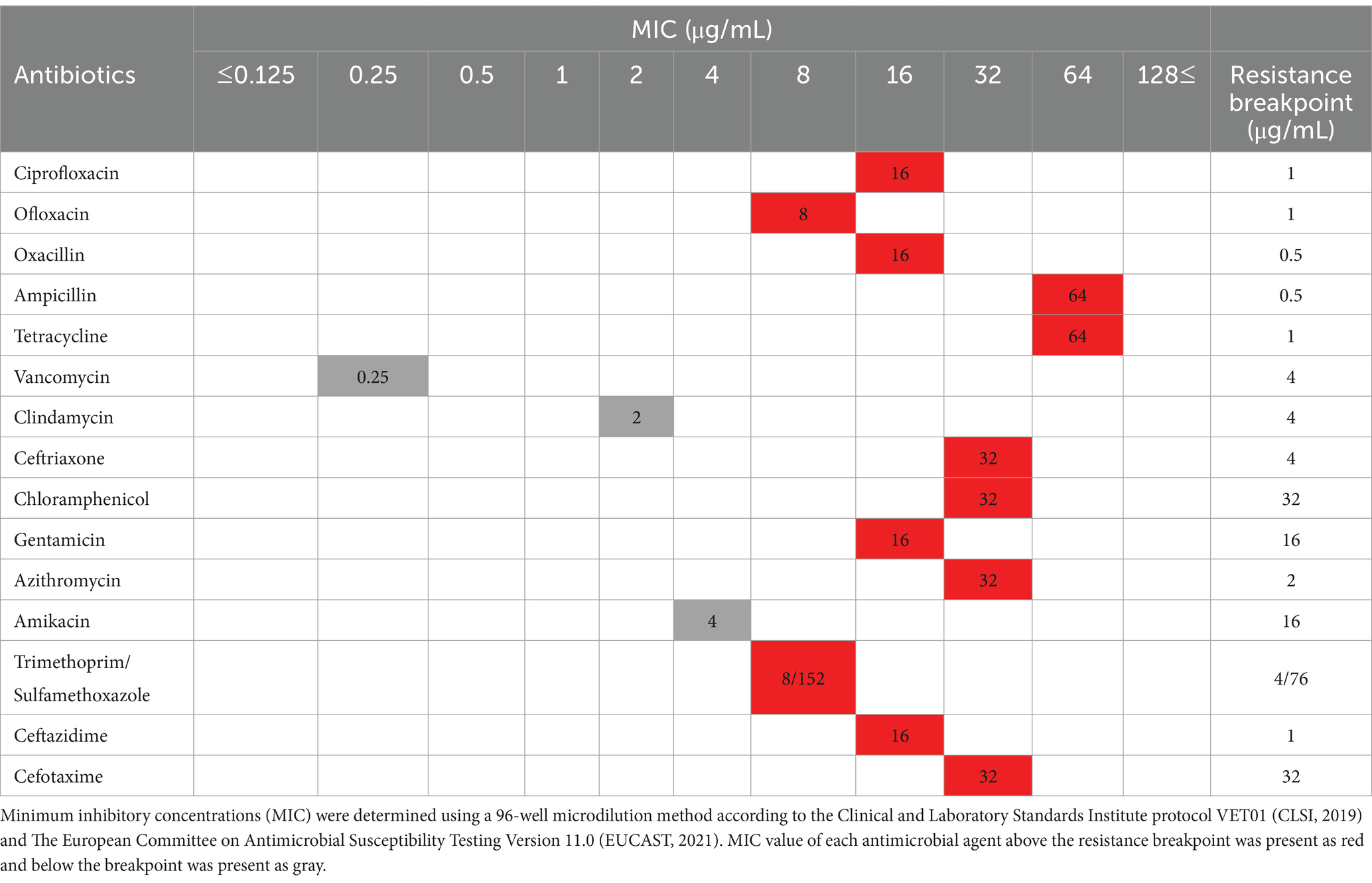 Tabla 1. Perfil de susceptibilidad antimicrobiana de la cepa de Staphylococcus pseudintermedius KUVM1701GC con la concentración inhibitoria mínima.
Tabla 1. Perfil de susceptibilidad antimicrobiana de la cepa de Staphylococcus pseudintermedius KUVM1701GC con la concentración inhibitoria mínima.
También se determinó la susceptibilidad del SFC concentrado derivado de L. L. animalis SWLA-1 frente a bacterias indicadoras mediante el método de microdilución. La concentración inhibitoria mínima del SFC fue de 10 veces la concentración de uno (118,82 ± 3,27 mg/mL), mientras que el efecto inhibidor contra el estafilococo pseudintermedius KUVM1791GC no se observó en el concentrado de SFC 5 veces (55,74 ± 6,54 mg/ml).
3.2 Puntuación de la opacidad corneal y evaluación microbiológica en modelo ex vivo
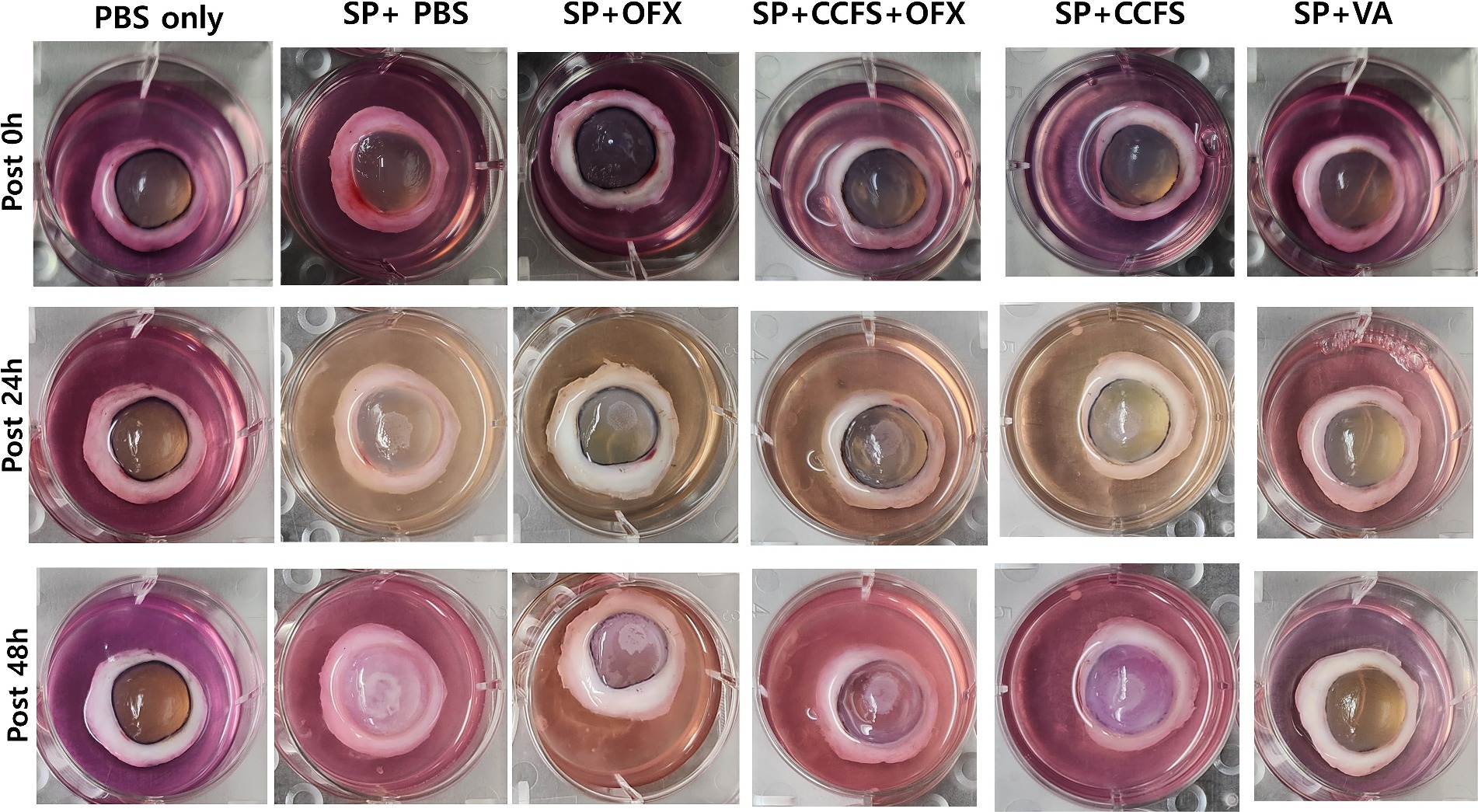
Los cambios en la opacidad corneal después de la inoculación de bacterias indicadoras en cada punto de tiempo (0, 24 y 48 h) se muestran en la Figura 2. Los hallazgos macroscópicos mostraron que la opacidad corneal aumentó con el tiempo en todos los grupos experimentales, excepto en los grupos tratados con PBS solo y vancomicina. Como se muestra en la Figura 3, las puntuaciones medias de opacidad corneal de los grupos tratados con vancomicina y ofloxacino fueron significativamente inferiores a las del grupo control Staphylococcus positivo (p < 0,01). Por el contrario, el grupo tratado con SFC concentrado o una combinación de SFC concentrado y ofloxacino tuvo puntuaciones significativamente más altas que el grupo control negativo para Staphylococcus o el grupo tratado con vancomicina (p < 0,01). Cabe destacar que no se observaron diferencias significativas entre el grupo tratado con ofloxacino y el SFC o la combinación de grupos tratados con SFC y ofloxacino (p > 0,05).
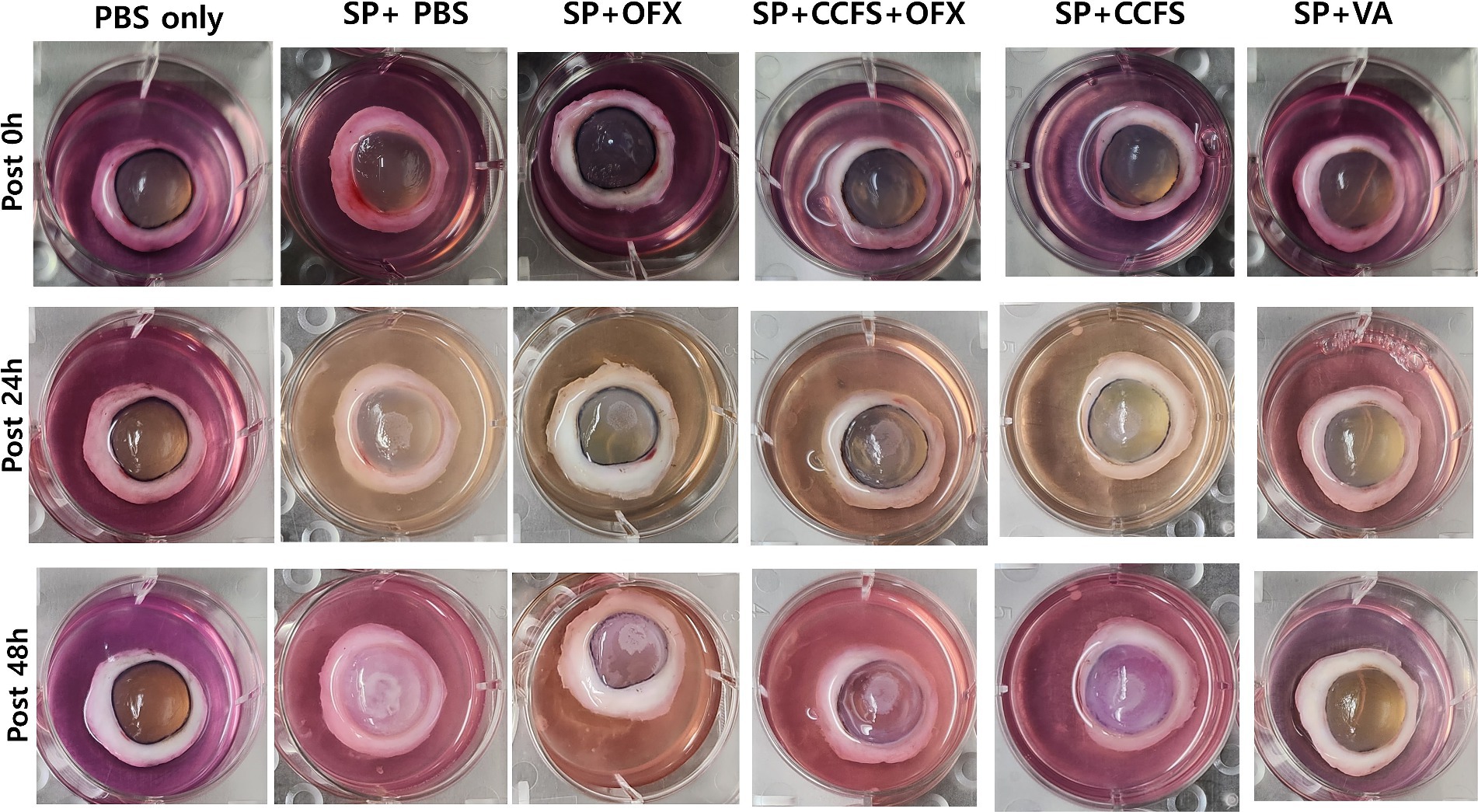 Figura 2. Observación de los cambios en la opacidad corneal a lo largo de los puntos temporales. Los grupos experimentales son los siguientes: PBS solamente, Staphylococcus negativo e inoculado con PBS estéril solamente; SP + PBS, Staphylococcus positivo y tratado con PBS; SP + OFX, Staphylococcus positivo y tratado con ofloxacino (3 mg/mL); SP + CCFS, Staphylococcus positivo y tratado con CFS concentrado derivado de L. animalis SWLA-1 (20×, 232,96 ± 5,23 mg/mL); CCFS+OFX, Staphylococcus positivo y tratado con una combinación de CFS concentrado (20×, 232,96 ± 5,23 mg/mL) y ofloxacino (3 mg/mL); SP + VA, Staphylococcus positivo y tratado con vancomicina (20 μg/mL). PBS: succinato de polibutileno.
Figura 2. Observación de los cambios en la opacidad corneal a lo largo de los puntos temporales. Los grupos experimentales son los siguientes: PBS solamente, Staphylococcus negativo e inoculado con PBS estéril solamente; SP + PBS, Staphylococcus positivo y tratado con PBS; SP + OFX, Staphylococcus positivo y tratado con ofloxacino (3 mg/mL); SP + CCFS, Staphylococcus positivo y tratado con CFS concentrado derivado de L. animalis SWLA-1 (20×, 232,96 ± 5,23 mg/mL); CCFS+OFX, Staphylococcus positivo y tratado con una combinación de CFS concentrado (20×, 232,96 ± 5,23 mg/mL) y ofloxacino (3 mg/mL); SP + VA, Staphylococcus positivo y tratado con vancomicina (20 μg/mL). PBS: succinato de polibutileno.
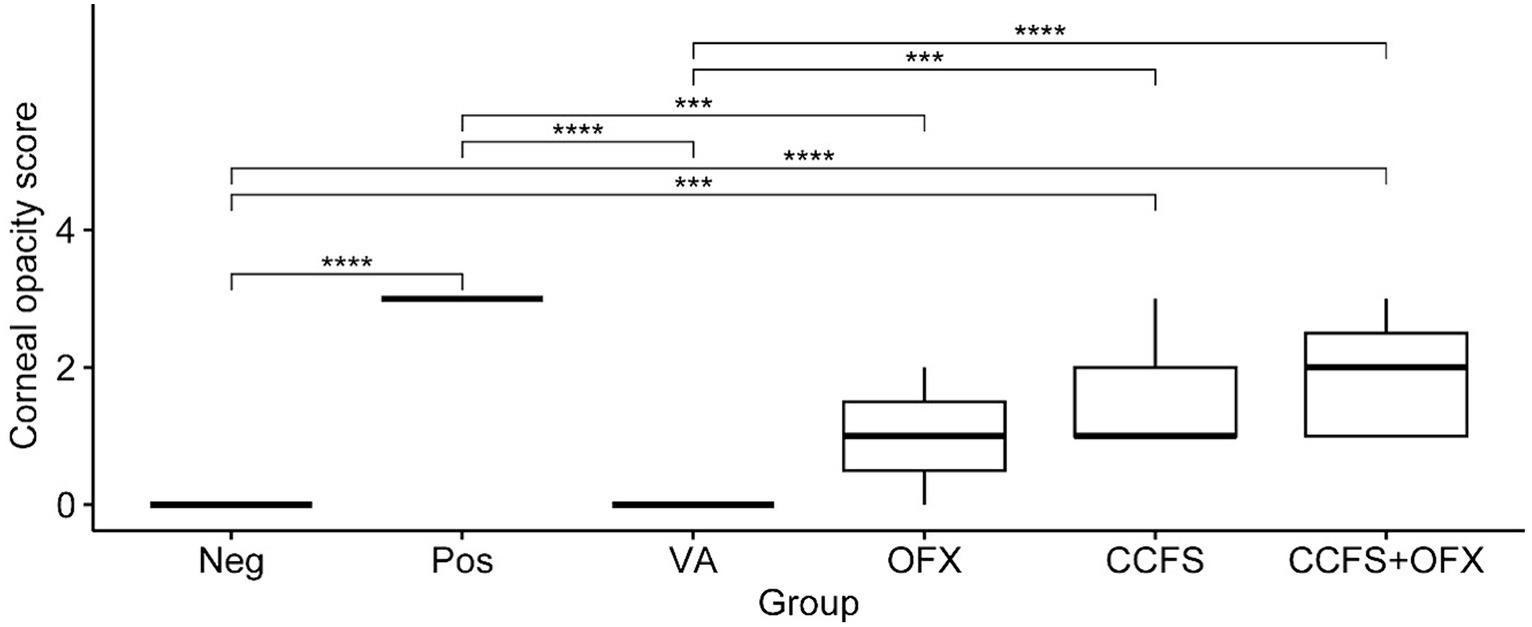 Figura 3. Diferencias en la puntuación media de opacidad corneal entre grupos experimentales. Los valores de todos los grupos se analizaron mediante la prueba de Kruskal-Wallis, seguida de la prueba de Dunn para la prueba post-hoc. Los grupos experimentales son los siguientes: Neg, Staphylococcus negativo e inoculado únicamente con PBS estéril; Pos, Staphylococcus positivo y tratado con PBS; VA, Staphylococcus positivo y tratado con vancomicina (20 μg/mL); OFX, Staphylococcus positivo y tratado con ofloxacino (3 mg/mL); CCFS: Staphylococcus positivo y tratado con CFS concentrado derivado de L. animalis SWLA-1 (20×, 232,96 ± 5,23 mg/mL); CCFS+OFX, Staphylococcus positivo y tratado con una combinación de CFS concentrado (20×, 232,96 ± 5,23 mg/mL) y ofloxacino (3 mg/mL). La media de los datos observados en cada grupo experimental se presenta como la línea horizontal en negrita en la figura. Las diferencias significativas se indican con asteriscos (***p < 0,001, ****p < 0,0001).
Figura 3. Diferencias en la puntuación media de opacidad corneal entre grupos experimentales. Los valores de todos los grupos se analizaron mediante la prueba de Kruskal-Wallis, seguida de la prueba de Dunn para la prueba post-hoc. Los grupos experimentales son los siguientes: Neg, Staphylococcus negativo e inoculado únicamente con PBS estéril; Pos, Staphylococcus positivo y tratado con PBS; VA, Staphylococcus positivo y tratado con vancomicina (20 μg/mL); OFX, Staphylococcus positivo y tratado con ofloxacino (3 mg/mL); CCFS: Staphylococcus positivo y tratado con CFS concentrado derivado de L. animalis SWLA-1 (20×, 232,96 ± 5,23 mg/mL); CCFS+OFX, Staphylococcus positivo y tratado con una combinación de CFS concentrado (20×, 232,96 ± 5,23 mg/mL) y ofloxacino (3 mg/mL). La media de los datos observados en cada grupo experimental se presenta como la línea horizontal en negrita en la figura. Las diferencias significativas se indican con asteriscos (***p < 0,001, ****p < 0,0001).
Comparando con los resultados de la puntuación de opacidad corneal, se observaron diferentes resultados en la evaluación microbiológica (Figura 4). Los valores medios de UFC del grupo tratado con SFC concentrado derivado de L. animalis SWLA-1 o una combinación de SFC concentrado y ofloxacino fueron significativamente más bajos que los del grupo control positivo para Staphylococcus (p < 0,05). Por el contrario, el valor medio de UFC del grupo tratado con ofloxacina sola fue significativamente mayor que el del grupo de control con Staphylococcus negativo. En particular, el crecimiento de Staphylococcus pseudintermedius KUVM1701GC se inhibió significativamente en el grupo tratado con vancomicina o SFC concentrado en comparación con el de los otros grupos, según las diferencias medias de UFC (p < 0,05). En cuanto al resultado de este experimento, los valores medios de UFC fueron el único resultado cuantitativo que mostró diferencia significativa entre el grupo Staphylococcus positivo y otros grupos, ya que los resultados de la prueba de Scheirer-Ray-Hare no mostraron interacción significativa entre las variables categóricas (grupos experimentales, puntuación corneal) y cuantitativas (resultado de UFC) (p > 0,05).
 Figura 4. Diferencias en los valores medios de UFC entre grupos experimentales. Los valores de todos los grupos se analizaron mediante la prueba de Kruskal-Wallis, seguida de la prueba de Dunn para la prueba post-hoc. Los grupos experimentales son los siguientes: Neg, Staphylococcus negativo e inoculado únicamente con PBS estéril; Pos, Staphylococcus positivo y tratado con PBS; VA, Staphylococcus positivo y tratado con vancomicina (20 μg/mL); OFX, Staphylococcus positivo y tratado con ofloxacino (3 mg/mL); CCFS: Staphylococcus positivo y tratado con CFS concentrado derivado de L. animalis SWLA-1 (20×, 232,96 ± 5,23 mg/mL); CCFS+OFX, Staphylococcus positivo y tratado con combinación de CFS concentrado (20×, 232,96 ± 5,23 mg/mL) y ofloxacino (3 mg/mL). Los valores atípicos se representan con viñetas, y la media de los datos observados en cada grupo experimental se representa mediante la línea horizontal en negrita de la figura. Las diferencias significativas se indican con asteriscos (*p < 0,05, **p < 0,01, ****p < 0,0001).
Figura 4. Diferencias en los valores medios de UFC entre grupos experimentales. Los valores de todos los grupos se analizaron mediante la prueba de Kruskal-Wallis, seguida de la prueba de Dunn para la prueba post-hoc. Los grupos experimentales son los siguientes: Neg, Staphylococcus negativo e inoculado únicamente con PBS estéril; Pos, Staphylococcus positivo y tratado con PBS; VA, Staphylococcus positivo y tratado con vancomicina (20 μg/mL); OFX, Staphylococcus positivo y tratado con ofloxacino (3 mg/mL); CCFS: Staphylococcus positivo y tratado con CFS concentrado derivado de L. animalis SWLA-1 (20×, 232,96 ± 5,23 mg/mL); CCFS+OFX, Staphylococcus positivo y tratado con combinación de CFS concentrado (20×, 232,96 ± 5,23 mg/mL) y ofloxacino (3 mg/mL). Los valores atípicos se representan con viñetas, y la media de los datos observados en cada grupo experimental se representa mediante la línea horizontal en negrita de la figura. Las diferencias significativas se indican con asteriscos (*p < 0,05, **p < 0,01, ****p < 0,0001).
3.3 Evaluación in vitro de la citotoxicidad
El ensayo CCK-8 demostró un efecto citotóxico leve en los queratocitos humanos cuando se expusieron al SFC derivado de L. animalis SWLA-1 en comparación con el grupo tratado con simulacro. Sin embargo, después de una dilución de 2 veces, no se observaron efectos citotóxicos significativos sobre la viabilidad de los queratocitos humanos (Figura 5). Esto demostró que la dilución de 2 veces del SFC no afectó negativamente a la viabilidad celular.
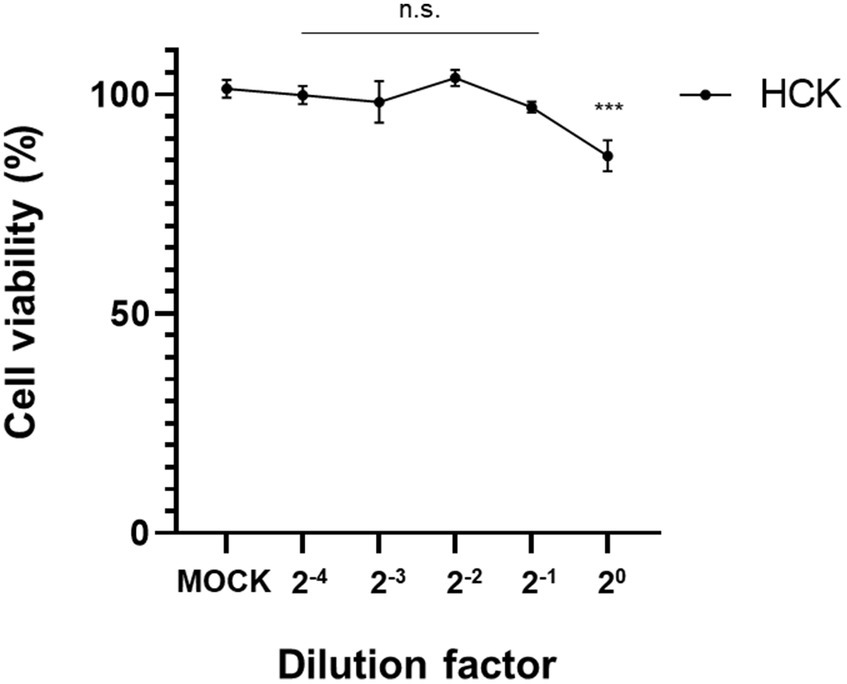 Figura 5. Confirmación de la viabilidad celular de los queratocitos humanos mediante el ensayo CCK-8. Los resultados se obtuvieron 72 h después del tratamiento con SFC derivado de L. animalis SWLA-1, en comparación con las células tratadas simuladamente en las diluciones indicadas. Los datos se presentan como media ± desviación estándar para tres experimentos independientes. Los datos se analizaron mediante análisis de varianza de una vía (n.d.: no significativo, ***p<0,001).
Figura 5. Confirmación de la viabilidad celular de los queratocitos humanos mediante el ensayo CCK-8. Los resultados se obtuvieron 72 h después del tratamiento con SFC derivado de L. animalis SWLA-1, en comparación con las células tratadas simuladamente en las diluciones indicadas. Los datos se presentan como media ± desviación estándar para tres experimentos independientes. Los datos se analizaron mediante análisis de varianza de una vía (n.d.: no significativo, ***p<0,001).
4 Discusión
La queratitis ulcerosa es una de las enfermedades oculares más comunes que afectan a los perros. Debido a diversos factores que interactúan con la superficie ocular y la afectan negativamente, el epitelio corneal puede alterarse, lo que lleva a la exposición del estroma corneal subyacente. Cuando la barrera anatómica de la córnea se ve comprometida o alterada, puede conducir a la invasión de bacterias patógenas a través de este espacio debilitado. Una infección bacteriana secundaria en el estroma corneal puede destruir la estructura corneal organizada, lo que puede causar deterioro de la visión y requerir la extirpación de todo el globo ocular en casos graves. Para el diagnóstico y tratamiento de la queratitis bacteriana se recomienda el examen citológico, el cultivo microbiológico de muestras de córnea y las pruebas de sensibilidad a los antibióticos (1).
Staphylococcus pseudintermedius es el patógeno oportunista más común responsable de causar queratitis infecciosa en regiones como América (7, 29, 30), Europa (31) y Asia (10, 32). Se ha informado que Staphylococcus pseudintermedius puede causar la destrucción del tejido corneal al expresar un análogo de la proteína A, que es producida por Staphylococcus aureus y juega un papel importante en la queratitis estafilocócica (33, 34). La destrucción y lisis de las estructuras corneales inducidas por infección bacteriana aumentan la opacidad corneal con la presencia de un área opaca o turbia en la córnea (35). En este estudio se determinó el cambio en la opacidad corneal y la medición del crecimiento bacteriano mediante UFC.
La aparición de resistencia a los antimicrobianos plantea un reto importante en la oftalmología veterinaria (36). En un estudio reciente sobre la queratitis bacteriana canina, casi la mitad de los aislamientos de infecciones clínicas por Staphylococcus spp. con úlceras del estroma corneal se identificaron como MRSP. En el mismo estudio, uno de los aislados de un paciente infectado por MRSP mostró resistencia a múltiples fármacos a los antibióticos y presentó síntomas clínicos altamente agresivos (30). Aunque la queratitis bacteriana inducida por MDRSP es un desafío serio emergente en medicina veterinaria, se han realizado estudios limitados que utilizan modelos de infección corneal de MDRSP. Hasta donde sabemos, este es el primer estudio que desarrolla un modelo de infección corneal utilizando MDRSP.
En el presente estudio, se estableció un nuevo modelo de infección corneal ex vivo para evaluar la actividad antimicrobiana del SFC derivado de L. animalis SWLA-1. Este modelo puede sugerir un enfoque alternativo para evaluar el efecto inhibidor de las sustancias antimicrobianas CFS derivadas de bacterias probióticas contra MDRSP en condiciones simuladas similares a la queratitis bacteriana en animales vivos. Además, debido a la ausencia de un sistema inmune del huésped en este modelo ex vivo, evaluamos con éxito las propiedades antibacterianas intrínsecas del SFC derivado de L. animalis SWLA-1 frente a la cepa MDRSP KUVM1701GC. Además, los modelos de infección corneal ex vivo son más fáciles de establecer y permiten la progresión visible de las lesiones en menos de 24 h en comparación con los modelos de infección in vivo (37).
En este estudio evaluamos la opacidad corneal mediante la puntuación de la opacidad corneal 48 h después de la infección. Las características clínicas de la queratitis bacteriana canina incluyen la opacidad corneal (1, 38). Nuestros resultados no mostraron una correlación significativa entre la opacidad corneal y el valor de UFC entre los grupos. Por ejemplo, el grupo experimental tratado con ofloxacino contra bacterias indicadoras mostró una puntuación de opacidad corneal significativamente más baja en comparación con el grupo infectado con bacterias indicadoras y tratado solo con PBS. Sin embargo, no se observaron diferencias significativas entre estos dos grupos en función del resultado de la medición de los recuentos de células bacterianas viables. Por el contrario, el grupo tratado con SFC concentrado mostró un aumento significativo de la puntuación de opacidad corneal en comparación con el grupo de Staphylococcus negativo. Curiosamente, este grupo fue el único que inhibió significativamente el crecimiento de bacterias indicadoras, así como el grupo tratado con vancomicina, que no tiene cambios en la opacidad corneal y tiene un efecto inhibidor significativo contra las bacterias indicadoras en función de los recuentos de células viables. Estos hallazgos sugieren que la evaluación clínica de la progresión de la inflamación corneal puede diferir del grado real de infección microbiana. Otros estudios deben incluir el análisis histopatológico de un modelo in vivo de infección por MDRSP.
Obviamente, los modelos corneales in vivo ofrecen una excelente plataforma para investigar la defensa inmunitaria del huésped, la inflamación y los mecanismos de curación de la córnea. Sin embargo, estos modelos no son adecuados para examinar las etapas iniciales de la infección debido al desafío de infectar córneas sanas e intactas. Además, el proceso de inicio y progresión de la infección dura varios días y carece de certeza (39). Además, el uso práctico de los estudios in vivo se ve obstaculizado por el alto costo asociado con los costos de compra y mantenimiento de animales, así como por las preocupaciones éticas con respecto al uso de perros como animales de experimentación.
Recientemente, ha habido un interés considerable en la utilización de modelos corneales ex vivo para estudiar la queratitis. Los modelos de tejidos ex vivo que imitan fielmente los aspectos bioquímicos y biofísicos son más valiosos en términos de eficiencia y rentabilidad. Se han reportado varias técnicas en la literatura para inducir infecciones bacterianas en modelos corneales ex vivo, incluyendo el uso de lentes de contacto infectadas (40), la escarificación corneal (41) y la inyección intraestromal (37). En este estudio, utilizamos un cepillo epitelial giratorio para eliminar el epitelio corneal y establecer las defensas anatómicas comprometidas (42). Este dispositivo ha sido desarrollado para la extirpación precisa del epitelio corneal durante la cirugía refractiva en medicina humana, incluida la queratectomía fotorrefractiva y la queratectomía subepitelial asistida por láser. Su aplicación asegura el mantenimiento de un tamaño y profundidad constantes de los defectos corneales. Dado que el modelo corneal ex vivo también se puede utilizar para investigar los sistemas de administración de fármacos relacionados con las infecciones oculares (25), puede utilizarse en la evaluación de otros compuestos antimicrobianos en estudios posteriores.
Los probióticos y sus sustancias antimicrobianas se han utilizado con éxito para prevenir y tratar diversas infecciones bacterianas tanto en humanos como en animales (43-46). Recientemente, se han investigado compuestos antimicrobianos eficaces o metabolitos derivados de bacterias probióticas como alternativas a los antibióticos clásicos para el tratamiento de las infecciones bacterianas MDR. Estos compuestos antimicrobianos, también conocidos como postbióticos o farmacéuticos, pueden contribuir a la preservación de los antibióticos clásicos y al tratamiento de las bacterias patógenas MDR (47). Además, los compuestos antimicrobianos derivados de los probióticos, como las bacteriocinas, tienen ventajas significativas sobre los antibióticos clásicos, incluida la reducción de la probabilidad de inducir resistencia a los antibióticos en las bacterias y la relativa facilidad de modificación y bioingeniería debido a su tamaño molecular y estructuras (21, 48).
Con base en los resultados de la evaluación microbiológica, el SFC concentrado derivado de L. animalis SWLA-1 inhibió significativamente el crecimiento de MDRSP, comparable al grupo tratado con vancomicina (p < 0.05). Como este compuesto exhibe una mayor actividad antimicrobiana contra patógenos cuando se concentra mediante precipitación de proteínas TCA, parece funcionar de manera dependiente de la concentración, de manera similar a las bacteriocinas (49, 50). Los estudios posteriores deben incluir la identificación y el aislamiento de los compuestos antimicrobianos activos en este SFC mediante el análisis completo del genoma de L. animalis SWLA-1 o péptidos y el análisis químico mediante espectrometría de masas.
De acuerdo con estos resultados, la actividad antimicrobiana del SFC concentrado derivado de L. animalis SWLA-1 inhibió eficazmente el crecimiento de MDRSP en un modelo de infección corneal ex vivo. Teniendo en cuenta que los compuestos antimicrobianos derivados de los probióticos tienen una menor propensión a desarrollar resistencia a los antibióticos en los patógenos y generalmente se reconocen como seguros para humanos y animales, este compuesto tiene potencial como alternativa a los agentes antibióticos tópicos para tratar la queratitis bacteriana.
Aunque nuestro modelo de infección ex vivo resulta útil para evaluar la eficacia, tiene limitaciones. El objetivo principal de este estudio fue establecer un modelo de infección corneal ex vivo por MDRSP y evaluar la eficacia del SFC concentrado derivado de L. animalis SWLA-1, sirviendo como un experimento puente preliminar antes de avanzar a un modelo de infección in vivo. A diferencia del modelo in vivo, el modelo ex vivo de este estudio permitió evaluar los resultados experimentales con claras diferencias macroscópicas en un corto período de tiempo. Sin embargo, para futuros experimentos que utilicen el modelo in vivo, se estudiarán aspectos no abordados en este estudio, como la interacción entre el sistema inmunitario completo, incluidas las películas lagrimales, y la infección bacteriana durante un período prolongado. Esto implicará una investigación más profunda a través de estudios histopatológicos.
Otra limitación de este estudio es la utilización del método de puntuación de la opacidad corneal del sistema SPOTS en un entorno ex vivo. El sistema SPOTS fue desarrollado para puntuar clínicamente las lesiones in vivo. Para replicar mejor las condiciones clínicas de infección in vivo, personalizamos un entorno de cultivo «aire-líquido» con una plataforma oscilante que estimula el parpadeo del ojo. Además, se utilizó un medio que contenía suero para suministrar factores de crecimiento y nutrientes que se replican en condiciones in vivo siguiendo la metodología utilizada en estudios previos (51, 52). Por lo tanto, teniendo en cuenta que el entorno de cultivo ex vivo en este estudio se asemeja mucho al entorno in vivo, y con el factor adicional de un tiempo de cultivo relativamente corto de 48 h, determinamos que el sistema SPOTS es adecuado para medir la opacidad corneal inducida por la ulceración corneal inducida por una infección bacteriana, que fue el foco de nuestro experimento. En futuros estudios, será necesario un análisis exhaustivo mediante tomografía de coherencia óptica del segmento anterior y estudios histopatológicos.
Este es el primer estudio que describe el establecimiento de un modelo de cultivo de córnea de infección por MDRSP ex vivo utilizando córneas caninas. Además, confirmamos la eficacia del SFC concentrado derivado de L. animalis SWLA-1 como un potencial agente antibiótico alternativo contra MDRSP. En estudios futuros, el modelo de infección corneal ex vivo puede surgir como una plataforma sólida para la evaluación integral de diversos microorganismos infecciosos e intervenciones terapéuticas tópicas aplicables tanto a la queratitis ulcerosa canina como humana.
Declaración de disponibilidad de datos
Las contribuciones originales presentadas en el estudio se incluyen en el artículo/Material complementario, las consultas posteriores pueden dirigirse al autor correspondiente.
Declaración ética
El Comité Institucional de Cuidado y Uso de Animales (IACUC) de la Universidad de Konkuk eximió del requisito de aprobación ética para los estudios con animales porque los tejidos se adquirieron en condiciones post mortem; No involucrar el sufrimiento o la manipulación de los animales. Los estudios se llevaron a cabo de acuerdo con la legislación local y los requisitos institucionales. Se obtuvo el consentimiento informado por escrito de los propietarios para la participación de sus animales en este estudio.
Contribuciones de los autores
J-HJ: Conceptualización, Investigación, Escritura – borrador original. H-JL: Análisis formal, Investigación, Escritura – borrador original. D-HK: Investigación, Escritura – borrador original. S-WL: Administración de proyectos, redacción, revisión y edición. J-YK: Adquisición de fondos, administración de proyectos, supervisión, redacción, revisión y edición.
Financiación
El/los autor/es declara(n) haber recibido apoyo financiero para la investigación, autoría y/o publicación de este artículo. Este trabajo fue apoyado por la Universidad de Konkuk en 2023 (número de subvención 2023-A019-0041).
Conflicto de intereses
Los autores declaran que la investigación se llevó a cabo en ausencia de relaciones comerciales o financieras que pudieran interpretarse como un posible conflicto de intereses.
Nota del editor
Todas las afirmaciones expresadas en este artículo son únicamente las de los autores y no representan necesariamente las de sus organizaciones afiliadas, ni las del editor, los editores y los revisores. Cualquier producto que pueda ser evaluado en este artículo, o afirmación que pueda ser hecha por su fabricante, no está garantizado ni respaldado por el editor.
Material complementario
El material complementario para este artículo se puede encontrar en línea en: https://www.frontiersin.org/articles/10.3389/fvets.2024.1346313/full#supplementary-material
Referencias
1. Ledbetter, E, y Gilger, Columbia Británica. Enfermedades y cirugía de la córnea y esclerótica canina. Oxford: Wiley-Blackwell (2013).
2. McKeever, JM, Ward, DA, y Hendrix, DV. Comparación de los patrones de resistencia a los antimicrobianos en perros con queratitis bacteriana presentados en un hospital universitario veterinario durante dos períodos de varios años (1993-2003 y 2013-2019) en el sureste de los Estados Unidos. Veterinario Oftalmológico. (2021) 24:653–8. doi: 10.1111/vop.12897
Resumen de PubMed | Texto completo de Crossref | Google Académico
3. Hindley, KE, Groth, AD, King, M, Graham, K y Billson, FM. Aislados bacterianos, susceptibilidad antimicrobiana y características clínicas de la queratitis bacteriana en perros que se presentan a la práctica de referencia en Australia. Veterinario Oftalmológico. (2016) 19:418–26. doi: 10.1111/vop.12325
Resumen de PubMed | Texto completo de Crossref | Google Académico
4. Wang, L, Pan, Q, Zhang, L, Xue, Q, Cui, J y Qi, C. Investigación de microorganismos bacterianos en el saco conjuntival de perros clínicamente normales y perros con queratitis ulcerosa en Beijing, China. Veterinario Oftalmológico. (2008) 11:145–9. doi: 10.1111/j.1463-5224.2008.00579.x
Resumen de PubMed | Texto completo de Crossref | Google Académico
5. Jinks, MR, Miller, EJ, Díaz-Campos, D, Mollenkopf, DF, Newbold, G, Gemensky-Metzler, A, et al. Uso de valores mínimos de concentración inhibitoria de antibióticos tópicos comunes para investigar la resistencia emergente a los antibióticos: un estudio retrospectivo de 134 perros y 20 caballos con queratitis ulcerosa. Veterinario Oftalmológico. (2020) 23:806–13. doi: 10.1111/vop.12801
Resumen de PubMed | Texto completo de Crossref | Google Académico
6. LoPinto, AJ, Mohammed, HO y Ledbetter, EC. Prevalencia y factores de riesgo para el aislamiento de Staphylococcus resistente a la meticilina en perros con queratitis. Veterinario Oftalmológico. (2015) 18:297–303. doi: 10.1111/vop.12200
Resumen de PubMed | Texto completo de Crossref | Google Académico
7. Hewitt, JS, Allbaugh, RA, Kenne, DE, y Sebbag, L. Prevalencia y susceptibilidad a los antibióticos de aislados bacterianos de perros con queratitis ulcerosa en el medio oeste de los Estados Unidos. Front Vet Sci. (2020) 7:583965. doi: 10.3389/fvets.2020.583965
Resumen de PubMed | Texto completo de Crossref | Google Académico
8. Aslam, B, Wang, W, Arshad, MI, Khurshid, M, Muzammil, S, Rasool, MH, et al. Resistencia a los antibióticos: un resumen de una crisis global. Infectar la resistencia a los medicamentos. (2018) 11:1645–58. doi: 10.2147/IDR. S173867
Resumen de PubMed | Texto completo de Crossref | Google Académico
9. Lord, J, Millis, N, Jones, RD, Johnson, B, Kania, SA y Odoi, A. Patrones de resistencia a antimicrobianos, multifármacos y meticilina entre Staphylococcus spp. aislados de especímenes caninos enviados a un laboratorio de diagnóstico en Tennessee, EE. UU.: un estudio descriptivo. BMC Vet Res. (2022) 18:91. doi: 10.1186/s12917-022-03185-9
10. Ekapopphan, D, Srisutthakarn, A, Moonarmart, W, Buddhirongawatr, R, y Bangphoomi, N. Identificación y susceptibilidad antimicrobiana de microorganismos aislados de úlceras corneales graves de perros en Tailandia. J Vet Med Sci. (2018) 80:1259–65. doi: 10.1292/jvms.18-0045
Resumen de PubMed | Texto completo de Crossref | Google Académico
11. Viegas, FM, Santana, JA, Silva, BA, Xavier, RGC, Bonisson, CT, Câmara, JLS, et al. Ocurrencia y caracterización de Staphylococcus spp. resistente a meticilina en perros enfermos en Brasil. PLoS Uno. (2022) 17:e0269422. doi: 10.1371/journal.pone.0269422
Resumen de PubMed | Texto completo de Crossref | Google Académico
12. Proietto, LR, Whitley, RD, Brooks, DE, Schultz, GE, Gibson, DJ, Berkowski, WM Jr, et al. Desarrollo y evaluación de un nuevo modelo corneal canino ex vivo. Curr Eye Res. (2017) 42:813–21. doi: 10.1080/02713683.2016.1262428
13. Kang, M-H, Chae, M-J, Yoon, J-W, Lee, S-Y, Yoo, J-H y Park, H-M. Resistencia a fluoroquinolonas y meticilina en aislamientos oftálmicos de Staphylococcus pseudintermedius de animales de compañía. ¿Puede Vet J. (2014) 55:678–82.
14. Wang, Z, Guo, L, Li, J, Li, J, Cui, L, Dong, J, et al. Resistencia a antibióticos, formación de biopelículas y factores de virulencia de aislados de Staphylococcus pseudintermedius de perros sanos y perros con queratitis. Front Vet Sci. (2022) 9:903633. doi: 10.3389/fvets.2022.903633
15. FAO, PNUMA, OMS y OMSA. Plan de acción conjunto de una sola unidad de salud (2022-2026). Trabajando juntos por la salud de los seres humanos, los animales, las plantas y el medio ambiente. Roma: OMS (2022).
16. Organización Mundial de Sanidad Animal. OIE: Lista de agentes antimicrobianos de importancia veterinaria de la OIE. (2015). Disponible en:. (https://www.woah.org/app/uploads/2021/03/oie-list-antimicrobials.pdf)
17. Organización Mundial de la Salud. Antimicrobianos de importancia crítica para la medicina humana, 6ª revisión. (2019). Disponible en:. (https://www.who.int/publications/i/item/9789241515528)
18. Chen, B, Li, F, Zhu, XK, Xie, W, Hu, X, Zan, MH, et al. Nanopartículas biomiméticas altamente biocompatibles y reciclables para la infección por bacterias resistentes a antibióticos. Biomater Sci. (2021) 9:826–34. doi: 10.1039/D0BM01397H
Resumen de PubMed | Texto completo de Crossref | Google Académico
19. Kortright, KE, Chan, BK, Koff, JL y Turner, PE. Terapia con fagos: un enfoque renovado para combatir las bacterias resistentes a los antibióticos. Microbio huésped celular. (2019) 25:219–32. doi: 10.1016/j.chom.2019.01.014
Resumen de PubMed | Texto completo de Crossref | Google Académico
20. Soltani, S, Hammami, R, Cotter, PD, Rebuffat, S, Said, LB, Gaudreau, H, et al. Las bacteriocinas como nueva generación de antimicrobianos: aspectos de toxicidad y regulaciones. FEMS Microbiol Rev. (2021) 45:39. doi: 10.1093/femsre/fuaa039
21. Hols, P, Ledesma-García, L, Gabant, P, y Mignolet, J. Movilización de comensales de microbiota y sus bacteriocinas para la terapéutica. Tendencias Microbiol. (2019) 27:690–702. doi: 10.1016/j.tim.2019.03.007
Resumen de PubMed | Texto completo de Crossref | Google Académico
22. Pérez, RH, Zendo, T, y Sonomoto, K. Nuevas bacteriocinas de bacterias lácticas (BAL): diversas estructuras y aplicaciones. Fábricas de células microb. (2014) 13:1–13. doi: 10.1186/1475-2859-13-S1-S3
23. Zhou, Q, Gu, R, Li, P, Lu, Y, Chen, L y Gu, Q. Modo de acción anti-Salmonella del ácido láctico L-fenil natural purificado de Lactobacillus plantarum ZJ316. Aplicación Microbiol Biotechnol. (2020) 104:5283–92. doi: 10.1007/s00253-020-10503-4
Resumen de PubMed | Texto completo de Crossref | Google Académico
24. Lee, H-J, Lee, J-B, Park, S-Y, Choi, I-S, y Lee, S-W. Actividad antimicrobiana de Ligilactobacillus animalis SWLA-1 y su sobrenadante libre de células contra bacterias multirresistentes y su uso potencial como alternativa a los agentes antimicrobianos. Microorganismos. (2023) 11:182. doi: 10.3390/microorganismos11010182
Resumen de PubMed | Texto completo de Crossref | Google Académico
25. Ubani-Ukoma, U, Chauhan, A, Schultz, G y Gibson, DJ. Un modelo de infección corneal ex vivo. MétodosX. (2020) 7:100876. doi: 10.1016/j.mex.2020.100876
26. Eaton, JS, Miller, PE, Bentley, E, Thomasy, SM y Murphy, CJ. El sistema SPOTS: un sistema de puntuación ocular optimizado para su uso en el desarrollo preclínico moderno de fármacos y toxicología. J Ocul Pharmacol Ther. (2017) 33:718–34. doi: 10.1089/jop.2017.0108
27. Kassambara, A. paquete rstatix, versión 0.6.0; R Foundation for Statistical Computing. (2020). Viena, Austria.
28. Kassambara, A. rcompanion package, versión 2.4.3; Extensión Cooperativa de Rutgers. (2023). Nuevo Brunswick, Nueva Jersey, Estados Unidos.
29. Prado, MR, Rocha, MF, Brito, ÉH, Girão, MD, Monteiro, AJ, Teixeira, MF, et al. Estudio de microorganismos bacterianos en el saco conjuntival de perros clínicamente normales y perros con queratitis ulcerosa en Fortaleza, Ceará. Veterinario Oftalmológico. (2005) 8:33–7. doi: 10.1111/j.1463-5224.2005.04061.x
Resumen de PubMed | Texto completo de Crossref | Google Académico
30. Joksimovic, M, Ford, BA, Lazic, T, Soldatovic, I, Luzetsky, S, y Grozdanic, S. Recomendaciones de antibióticos para el tratamiento de las úlceras corneales del estroma canino. Veterinaria Sci. (2023) 10:66. doi: 10.3390/vetsci10020066
31. Suter, A, Voelter, K, Hartnack, S, Spiess, BM y Pot, S.A. Queratitis séptica en perros, gatos y caballos en Suiza: bacterias asociadas y susceptibilidad a los antibióticos. Veterinario Oftalmológico. (2018) 21:66–75. doi: 10.1111/vop.12480
Resumen de PubMed | Texto completo de Crossref | Google Académico
32. Lin, CT y Petersen-Jones, S. Susceptibilidad a los antibióticos de aislados bacterianos de úlceras corneales de perros en Taiwán. J Pequeña Anim Pract. (2007) 48:271–4. doi: 10.1111/j.1748-5827.2007.00348.x
Resumen de PubMed | Texto completo de Crossref | Google Académico
33. Lakhundi, S, Siddiqui, R, y Khan, NA. Patogenia de la queratitis microbiana. Microb Pathog. (2017) 104:97–109. doi: 10.1016/j.micpath.2016.12.013
34. Balachandran, M, Bemis, DA, y Kania, SA. Expresión y función de la proteína a en Staphylococcus pseudintermedius. Virulencia. (2018) 9:390–401. doi: 10.1080/21505594.2017.1403710
Resumen de PubMed | Texto completo de Crossref | Google Académico
35. Jadi, PK, Sharma, P, Bhogapurapu, B y Roy, S. Intervenciones terapéuticas alternativas: péptidos antimicrobianos y moléculas pequeñas para tratar la queratitis microbiana. Frente Chem. (2021) 9:694998. doi: 10.3389/fchem.2021.694998
Resumen de PubMed | Texto completo de Crossref | Google Académico
36. Soimala, T, Lübke-Becker, A, Hanke, D, Eichhorn, I, Feßler, AT, Schwarz, S, et al. Caracterización molecular y fenotípica de Staphylococcus pseudintermedius resistente a meticilina a partir de superficies oculares de perros y gatos que padecen enfermedades oftalmológicas. Microbiol veterinario. (2020) 244:108687. doi: 10.1016/j.vetmic.2020.108687
Resumen de PubMed | Texto completo de Crossref | Google Académico
37. Pinnock, A, Shivshetty, N, Roy, S, Rimmer, S, Douglas, I, Mac Neil, S, et al. Córneas ex vivo de conejo y humanos como modelos de queratitis bacteriana y fúngica. Graefes Arch Clin Exp Ophthalmol. (2017) 255:333–42. doi: 10.1007/s00417-016-3546-0
Resumen de PubMed | Texto completo de Crossref | Google Académico
38. Meekins, JM, Rankin, AJ y Samuelson, DA. Anatomía oftálmica. Veterinario Oftalmológico. (2021) 1:41–123.
39. Mun, JJ, Tam, C, Kowbel, D, Hawgood, S, Barnett, MJ, Evans, DJ, et al. La eliminación de Pseudomonas aeruginosa de una superficie ocular sana involucra la proteína D del surfactante y está comprometida por la elastasa bacteriana en un modelo murino de infección nula. Infectar a Immun. (2009) 77:2392–8. doi: 10.1128/IAI.00173-09
Resumen de PubMed | Texto completo de Crossref | Google Académico
40. Vermeltfoort, PB, van Kooten, TG, Bruinsma, GM, Hooymans, AM, van der Mei, HC, y Busscher, HJ. Transmisión bacteriana de lentes de contacto a córneas porcinas: un estudio ex vivo. Invertir Ophthalmol Vis Sci. (2005) 46:2042–6. doi: 10.1167/iovs.04-1401
41. Okurowska, K, Roy, S, Thokala, P, Partridge, L, Garg, P, Mac Neil, S, et al. Establecimiento de un modelo de córnea porcina ex vivo para el estudio de tratamientos farmacológicos contra la queratitis bacteriana. J Vis Exp. (2020) 159:E61156. DOI: 10.3791/61156-V
42. Chung, HS, Moon, SH, Kang, S-S, Kim, M, Lee, H, Tchah, H, et al. Extirpación del epitelio corneal con un cepillo epitelial de nuevo diseño. J Ophthalmol. (2021) 2021:4668056. doi: 10.1155/2021/4668056
43. Fayol-Messaoudi, D, Berger, CN, Coconnier-Polter, M-H, Lievin-Le Moal, V, y Servin, AL. Actividades dependientes del pH, ácido láctico y no ácido láctico de lactobacilos probióticos contra Salmonella enterica Serovar typhimurium. Appl Environ Microbiol. (2005) 71:6008–13. doi: 10.1128/AEM.71.10.6008-6013.2005
Resumen de PubMed | Texto completo de Crossref | Google Académico
44. Tejero-Sariñena, S, Barlow, J, Costabile, A, Gibson, GR, y Rowland, I. Evaluación in vitro de la actividad antimicrobiana de una serie de probióticos frente a patógenos: evidencia de los efectos de los ácidos orgánicos. Anaerobio. (2012) 18:530–8. doi: 10.1016/j.anaerobe.2012.08.004
Resumen de PubMed | Texto completo de Crossref | Google Académico
45. Fernández-Fernández, R, Lozano, C, Eguizábal, P, Ruiz-Ripa, L, Martínez-Álvarez, S, Abdullahi, IN, et al. Sustancias inhibidoras similares a las bacteriocinas en estafilococos de diferentes orígenes y especies con actividad frente a patógenos relevantes. Microbiol frontal. (2022) 13:870510. doi: 10.3389/fmicb.2022.870510
Resumen de PubMed | Texto completo de Crossref | Google Académico
46. Jiang, Y-H, Xin, W-G, Yang, L-Y, Ying, J-P, Zhao, Z-S, Lin, L-B, et al. Una nueva bacteriocina contra Staphylococcus aureus de Lactobacillus paracasei aislada de yogur fermentado tradicional de Yunnan: purificación, caracterización antibacteriana y actividad antibiofilm. J Dairy Sci. (2022) 105:2094–107. doi: 10.3168/jds.2021-21126
Resumen de PubMed | Texto completo de Crossref | Google Académico
47. Hill, C. Probióticos y farmabióticos: ¿medicina alternativa o una alternativa basada en la evidencia? Bichos Bioeng. (2010) 1:79–84. doi: 10.4161/bbug.1.2.10796
Resumen de PubMed | Texto completo de Crossref | Google Académico
48. Hernández-González, JC, Martínez-Tapia, A, Lazcano-Hernández, G, García-Pérez, BE, y Castrejón-Jiménez, NS. Bacteriocinas de bacterias lácticas. Una poderosa alternativa como antimicrobianos, probióticos e inmunomoduladores en medicina veterinaria. Animales. (2021) 11:979. doi: 10.3390/ani11040979
49. Bruno, ME, y Montville, TJ. Acción mecanicista común de las bacteriocinas de las bacterias lácticas. Appl Environ Microbiol. (1993) 59:3003–10. doi: 10.1128/aem.59.9.3003-3010.1993
Resumen de PubMed | Texto completo de Crossref | Google Académico
50. Wang, Y, Haqmal, MA, Liang, YD, Muhammad, I, Zhao, XO, Elken, EM, et al. Actividad antibacteriana y citotoxicidad de una nueva bacteriocina aislada de la cepa 166 de Pseudomonas sp. Microb Biotechnol. (2022) 15:2337–50. doi: 10.1111/1751-7915.14096
51. Castro-Combs, J, Noguera, G, Cano, M, Yew, M, Gehlbach, PL, Palmer, J, et al. La cicatrización de heridas corneales se modula mediante la aplicación tópica de líquido amniótico en un modelo de cultivo de órganos ex vivo. Exp Eye Res. (2008) 87:56–63. doi: 10.1016/j.exer.2008.04.010
Resumen de PubMed | Texto completo de Crossref | Google Académico
52. Harman, RM, Bussche, L, Ledbetter, EC, y Van de Walle, GR. Establecimiento y caracterización de un modelo de cultivo de órganos corneales caninos aire-líquido para estudiar la queratitis aguda por herpes. J Virol. (2014) 88:13669–77. doi: 10.1128/JVI.02135-14
Resumen de PubMed | Texto completo de Crossref | Google Académico
Palabras clave: queratitis bacteriana, estafilococos multirresistentes, infección corneal ex vivo, alternativas antimicrobianas, ulceración corneal
Cita: Jang J-H, Lee H-J, Kim D-H, Lee S-W y Kim J-Y (2024) Actividad antimicrobiana del sobrenadante libre de células derivado de Ligilactobacillus animalis SWLA-1 en un nuevo modelo de infección corneal canina ex vivo. Frente. Vet. Sci. 11:1346313. doi: 10.3389/fvets.2024.1346313
Recibido: 29 de noviembre de 2023; Aceptado: 04 de abril de 2024;
Publicado: 23 de abril de 2024.
Editado por:
Piera Anna Martino, Universidad de Milán, Italia
Revisado por:
Cristin Coman, Instituto Nacional de Investigación y Desarrollo Médico-Militar, Rumanía
Kumaragurubaran Karthik, Universidad de Ciencias Veterinarias y Animales de Tamil Nadu, India
Derechos de autor © 2024 Jang, Lee, Kim, Lee y Kim. Este es un artículo de acceso abierto distribuido bajo los términos de la Licencia Creative Commons Attribution License (CC BY).
*Correspondencia: Joon-Young Kim, de canvet@konkuk.ac.kr años; canvet@hanafos.com
†Estos autores han contribuido igualmente a este trabajo
Renuncia: Todas las afirmaciones expresadas en este artículo son únicamente las de los autores y no representan necesariamente las de sus organizaciones afiliadas, ni las del editor, los editores y los revisores. Cualquier producto que pueda ser evaluado en este artículo o afirmación que pueda hacer su fabricante no está garantizado ni respaldado por el editor.
Date de alta y recibe nuestro 👉🏼 Diario Digital AXÓN INFORMAVET ONE HEALTH
Date de alta y recibe nuestro 👉🏼 Boletín Digital de Foro Agro Ganadero
Noticias animales de compañía
Noticias animales de producción
Trabajos técnicos animales de producción
Trabajos técnicos animales de compañía

