Actualizaciones sobre endoparásitos bovinos
Actualizaciones sobre endoparásitos bovinos
Hany Elsheikha revisa los protocolos de prevalencia y tratamiento actuales y esperados en rebaños, incluidas las consideraciones de resistencia.
- Este artículo fue publicado originalmente en Vet Times 51.24 (15 de junio de 2021).
La producción comercial de ganado ha aumentado en las últimas décadas, y se prevé un mayor crecimiento para mantener la seguridad alimentaria de la creciente población mundial.
Los endoparásitos, incluidos los gusanos/helmintos y los protozoos, son la principal causa de infecciones gastrointestinales graves relacionadas con parásitos en el ganado en todo el mundo. Por lo tanto, el control eficiente de los endoparásitos es importante para mantener la salud y el bienestar del ganado, apoyar los esfuerzos mundiales de seguridad alimentaria y, potencialmente, la salud pública.
A pesar de las muchas opciones quimioterapéuticas y el considerable esfuerzo que se ha dedicado al desarrollo de programas de control de parásitos, el control de endoparásitos sigue siendo un desafío en casi todas partes del mundo. La situación se agrava aún más por la creciente prevalencia de resistencia a los antihelmínticos entre muchos helmintos. El desarrollo de nuevos antihelmínticos es caro y puede llevar décadas.
Además, no existen vacunas autorizadas para el control de parásitos en el ganado, excepto la vacuna utilizada en la prevención de gusanos pulmonares y la vacuna recientemente desarrollada contra los gusanos polares del barbero. Estos desafíos ponen en peligro a la industria ganadera. Por lo tanto, la eficacia de los antihelmínticos existentes debe mantenerse diseñando enfoques integrados de control de parásitos, combinando el uso sensato de los antihelmínticos y las buenas prácticas de pastoreo.
Si bien los veterinarios de animales de granja desempeñan un papel clave en la implementación de programas de control de parásitos, los parasitólogos pueden aportar información significativa y novedosa sobre la formulación y el éxito de estos programas.
El ganado puede estar infectado por un gran número de gusanos/helmintos parásitos, incluidas muchas especies de nematodos (gusanos redondos), trematodos (gripos) y cestodos (gusanos de cinta).
El ganado también puede estar infectado por una serie de protozoos, como las especies de Eimeria, las especies de Giardia y las especies de Cryptosporidium. Todos estos parásitos se transmiten a través de la vía fecal-oral y se asocian con manifestaciones gastrointestinales.
El potencial zoonótico y el riesgo para la salud pública de algunos de estos parásitos, como las especies de Fasciola, las especies de Giardia y las especies de Cryptosporidium, hacen que la mejor comprensión de los endoparásitos bovinos sea un foco clave de los programas de control de parásitos veterinarios y humanos.
El objetivo de este artículo es discutir aspectos clave de las infecciones causadas por endoparásitos en el ganado.
Nematodos (gusanos redondos)
Nematodos gastrointestinales
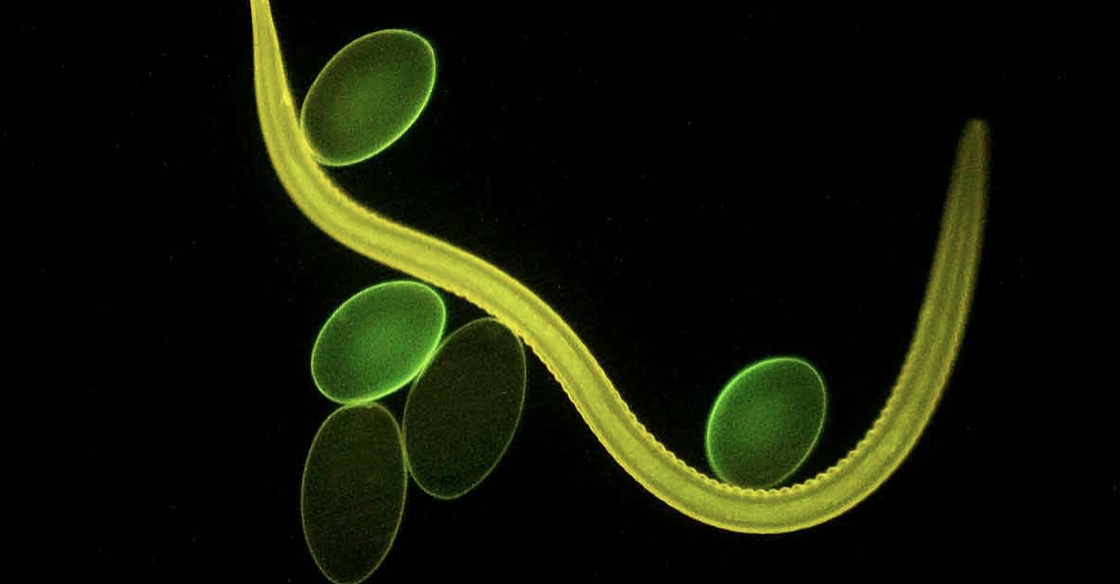
Los nematodos gastrointestinales del ganado incluyen especies que viven en el abomaso. Estos son Haemonchus placei, Ostertagia ostertagi y Trichostrongylus axei.Haemonchus contortus (Figura 1) infecta principalmente a las ovejas, pero también se puede encontrar en el ganado vacuno.
Los nematodos intestinales que habitan en el intestino delgado del ganado incluyen Cooperia oncophora, Cooperia punctata, Cooperia pectinata, Trichostrongylus colubriformis, Trichostrongylus vitrinus, Nematodirus helvetianus, Bunostomum phlebotomum y Capillaria bovis.
Los gusanos redondos intestinales grandes incluyen Oesophagostomum radiatum y Trichuris discolor.
Los ciclos de vida de estos nematodos son directos y siguen un patrón similar (Elsheikha y Khan, 2011).
El ganado adquiere infección por vía oral por ingestión de pastos contaminados que contienen larvas infecciosas de tercera etapa. Los nematodos gastrointestinales cuestan a la industria ganadera en América del Norte más de 2.000 millones de dólares (1,41 mil millones de libras esterlinas) al año (Stromberg y Gasbarre, 2006).
Los medicamentos antihelmínticos que están disponibles para el tratamiento de infecciones por nematodos gastrointestinales pertenecen a cinco clases químicas diferentes e incluyen benzimidazoles, levamisol, lactonas macrocíclicas, derivados de aminoacetonitrilo (monepantel) y espiroindoliles (derquantel). Estos antihelmínticos son efectivos contra muchas especies de nematodos gastrointestinales y gusanos pulmonares. Algunos de estos productos también tienen actividad contra los trematodos hepáticos.
Las lactonas macrocíclicas a menudo se conocen como endectocidas debido a su actividad adicional contra parásitos externos. Otros productos antihelmínticos tienen un espectro estrecho y solo son efectivos contra especies parasitarias particulares.
Los medicamentos antihelmínticos deben elegirse para dirigirse a la etapa de desarrollo del gusano (ya sea en forma adulta o juvenil) muy probable que esté involucrado en la infección, o que ya se haya identificado utilizando métodos de diagnóstico de laboratorio, como el recuento de óvulos de gusano fecal.
En un esfuerzo por sobrevivir durante condiciones climáticas adversas, muchos nematodos se someten a un proceso conocido como hipobiosis, donde las larvas ingeridas de la tercera etapa detienen su desarrollo en la cuarta etapa inicial. Estas larvas latentes reanudan su crecimiento la próxima temporada de pastoreo, lo que resulta en enfermedades clínicas en bovinos mayores (por ejemplo, ostertagiosis tipo dos). Este fenómeno de hipobiosis permite al ganado mantener la carga del parásito bajo control.
El desarrollo de parásitos arrestados también reduce el nivel de contaminación de pastos a un nivel que no pone al ganado pastoreo en riesgo de desarrollar enfermedad clínica.
No todos los productos antihelmínticos tienen potencia contra las larvas hipobióticas.
Gusanos de pulmón
Dictyocaulus viviparus es un importante nematodo que infecta el pulmón del ganado en regiones templadas. Causa una enfermedad conocida como bronquitis parasitaria, cáscara o dictiocaulosis, que comúnmente afecta a los terneros pastoreo de primera temporada; sin embargo, también se ha informado de infección en vacas adultas.
La dictocaulosis puede causar una reducción en el aumento de peso y la producción de leche, y una mortalidad que puede alcanzar el 20 por ciento (Holzhauer et al, 2011).
Se deben evitar los siguientes factores porque aumentan la exposición del ganado a D viviparus:
- introducción de nuevos animales en el rebaño
- uso intensivo de antihelmínticos
- presencia de masas de agua en los pastos
El diagnóstico de la infección por D viviparus se basa en la recuperación de larvas de las heces utilizando el método Baermann o mediante el uso de ensayos inmunes, como ELISA.
La dictocaulosis se puede tratar con levamisol, benzimidazoles o lactonas macrocíclicas; todos son efectivos contra la infección por gusanos pulmonares. La intervención temprana y oportuna antes del inicio de los signos clínicos puede prevenir la enfermedad y permitir el establecimiento de inmunidad protectora.
Existe una vacuna eficaz para el gusano pulmonar y está compuesta por larvas irradiadas de tercera etapa (infecciosas). La vacunación contra la cáscara puede ser un componente vital de cualquier programa de control de gusanos pulmonares. Sin embargo, esta vacuna no produce protección persistente sin infecciones naturales posteriores o vacunación anual de refuerzo.
Trematodos (gripos)
Flukes hepáticos (especies de Fasciola)
La fasciolosis, una infección parasitaria generalizada de rumiantes, es causada por trematodos hepáticos del género Fasciola. Esta enfermedad causa un impacto significativo en la productividad de los animales productores de alimentos, incluido el ganado.
La creciente prevalencia de trematodos hepáticos se ha atribuido al aumento de los movimientos de animales, los cambios en las prácticas agrícolas y el cambio climático.
Las pruebas diagnósticas actuales incluyen un examen fecal para la detección de óvulos de trematodos y ensayos serológicos para la detección de la presencia de anticuerpos contra Fasciola.
Las especies de Fasciola también infectan a una amplia gama de huéspedes mamíferos y pueden propagarse a la esfera humana; millones de personas están en riesgo de infección (Sabourin et al, 2018). Por lo tanto, se necesitan estrategias efectivas de manejo de parásitos para controlar esta enfermedad, para proteger la salud animal y humana.
El ganado a menudo sufre de fasciolosis crónica; por lo tanto, el tratamiento debe dirigirse a los trematodos adultos para ahorrar productividad animal y reducir la contaminación de los pastos.
El control de la infección por Fasciola depende del uso de medicamentos fluquicidas. Hay una amplia selección de tales productos en el mercado, incluyendo oxiclozánido, clorsulón, closantel, nitroxinil y rafoxanida. El triclabendazol se usa ampliamente porque es eficaz contra los estadios adultos y juveniles de los trematodos hepáticos; sin embargo, se ha informado de resistencia al triclabendazol (Fairweather et al, 2020).
Algunos productos disponibles para tratar los trematodos adultos están autorizados para su uso en ganado lechero lactante, como los que contienen albendazol (tiempo de extracción de leche de 60 horas) y oxiclozanida (tiempo de extracción de leche de 72 horas).
El manejo de pastos, incluida la cerca o el drenaje de áreas de alto riesgo, puede reducir la exposición del ganado al riesgo de trematodo hepático.
Flujos ruminales (parafistomas)
Aunque las infecciones por paranfórmidos se han limitado tradicionalmente a regiones tropicales y subtropicales, la prevalencia de estos trematodos ruminales en rumiantes en Europa ha ido aumentando progresivamente en los últimos 10 a 15 años en el Reino Unido y varios países europeos (Taylor, 2012; Gordon et al, 2013).
Esto se puede atribuir al cambio climático, la importación de animales infectados, la mejora de las capacidades de diagnóstico, el uso de antihelmínticos con una eficacia limitada contra los trematodos ruminales y la adaptación de los trematodos ruminales a su huésped intermedio, el caracol truncatula Galba.
La principal especie de paramphistómido detectada en Europa es Calicophoron daubneyi. Paramphistomum leydeni se ha detectado con poca frecuencia en Inglaterra, Irlanda y los Países Bajos.
El ganado infectado por trematodos ruminales tiene más probabilidades de infectarse por F hepatica, lo que se puede atribuir al hecho de que ambos parásitos comparten el mismo huésped intermedio y requieren condiciones ambientales similares para completar su desarrollo. Sin embargo, se desconoce si la presencia de parafistóma en una granja influye en el riesgo de infección y las consiguientes pérdidas debidas a F hepatica.
Las infecciones por paranfósmides pueden comprometer la productividad animal y la tasa de crecimiento. Los trematodos inmaduros que se desarrollan en el intestino delgado son la causa de la enfermedad clínica.
El diagnóstico de la infección por parafistoma depende de la detección de los huevos de paranfórmidos en las heces de rumiantes. En el examen post mortem, se pueden ver trematodos adultos unidos a la mucosa de los dos primeros compartimentos del estómago del ganado.
Actualmente no se ha aprobado ningún producto antihelmíntico para el tratamiento de trematodos ruminales en el Reino Unido. Los antihelmínticos tradicionales son ineficaces contra los trematodos ruminales.
Una dosis única de 15 mg/kg de oxiclozanida o 10 mg/kg de closantel tiene una buena eficacia contra los trematodos ruminales en el ganado (García-Dios et al, 2020). La oxiclozánida, que se utiliza para el tratamiento de la infección F hepatica en adultos, también es efectiva contra las etapas inmaduras y maduras de los trematodos ruminales (Paraud et al, 2009).
La mayor prevalencia de trematodos ruminales en las regiones occidentales de Gran Bretaña se ha atribuido a las altas precipitaciones o al acceso del ganado a los cursos de agua (Fenemore et al, 2021). Por lo tanto, los tratamientos estratégicos de los trematodos ruminales que utilizan fluquicidas deben estar respaldados por medidas de control complementarias, como evitar o reducir el acceso del ganado a los cursos de agua y el drenaje de los hábitats de caracoles, para reducir la contaminación de los pastos con huevos con trematodos.
Cestodios (gusanos de cinta)
Las tenias de Moniezia, Avitellina y Thysanosoma habitan el intestino delgado de los rumiantes y tienen una distribución mundial. Una infección grave puede conducir a obstrucción intestinal, particularmente en rumiantes jóvenes. Varios productos antihelmínticos de benzimidazol son efectivos contra las tenias (www.cattleparasites.org.uk).
¿Qué es la resistencia antihelmíntica y cómo sucede?
El desarrollo de resistencia a los antihelmínticos por muchos nematodos parásitos es un problema creciente en todo el mundo.
Aunque la resistencia antihelmíntica (RA) está generalizada en parásitos de ovejas, hay informes de varios países que indican que la RA también ocurre en nematodos gastrointestinales de ganado, incluidos H contortus, H placei, C punctata, C oncophora, Cooperia spatulata y O ostertagi.
La RA se desarrolla cuando un fármaco pierde su actividad contra una o más especies de parásitos que antes eran susceptibles. En general, la RA se desarrolla debido a muchos factores, especialmente la subdosis, los tratamientos frecuentes y la baja refugia (Elsheikha y Khan, 2011; Sutherland y Leathwick, 2011). Por lo tanto, la frecuencia del tratamiento es una potente fuente de presión de selección que ocurre cada vez que se usa un medicamento a menudo.
Los gusanos resistentes transmiten sus atributos genéticos a la próxima generación, amplificando así la frecuencia de sus genes resistentes en la población de parásitos.
El problema de la resistencia a los antihelmínticos es multifacético. La base genética, los modos de herencia de resistencia y el ritmo al que evoluciona la RA a un desparasitado en particular son en gran medida indefinidos y varían significativamente entre las diversas clases químicas de antihelmínticos.
Dados estos desafíos y las limitadas opciones alternativas al control de gusanos, la evaluación periódica del alcance y el impacto de la RA a nivel de granja, utilizando una prueba de reducción del recuento de huevos de gusano fecal, es una medida necesaria para lograr regímenes efectivos de control de parásitos.
¿Cómo se puede gestionar la RA?
Se deben tomar medidas estrictas para hacer frente a la creciente amenaza de la RA porque amenaza la sostenibilidad de prácticas agrícolas eficientes (McKellar y Jackson, 2004; Kaplan, 2020). Esto debería lograrse adoptando un enfoque integrado de manejo de parásitos y reduciendo la dependencia exclusiva de medicamentos antihelmínticos.
Si bien el uso estratégico de medicamentos antiparasitarios es valioso para manejar los impactos adversos del parasitismo en los animales, las herramientas de manejo del pastoreo, como el suministro de pastos limpios, el pastoreo alternativo por diferentes especies animales, el pastoreo alternativo por huéspedes inmunológicamente resistentes de la misma especie, el mantenimiento de refugios y el monitoreo de la carga de parásitos, también pueden apoyar la efectividad de los medicamentos antihelmínticos.
El manejo racional de los pastos reduce la necesidad de antihelmínticos y minimiza la reinfección al prevenir la contaminación de los pastos y la acumulación de huevos de gusano infecciosos o larvas en los pastos.
Los agricultores deben estar bien informados sobre el uso más apropiado de los gusanos y asegurarse de que puedan seguir directrices basadas en evidencia sobre el uso efectivo de los desparasparas de ganado (www.cattleparasites.org.uk). Las personas que administran antihelmínticos deben leer el prospecto del producto y el resumen de las características del producto, y asegurarse de la dosis prescrita pesando a los animales o usando una banda de peso.
Es importante basar el programa de tratamiento en la evidencia de la infección existente. Los recuentos de óvulos fecales, junto con el monitoreo del peso y la condición de los animales, pueden dar una idea general de si se necesita tratamiento.
Otra solución al problema de la resistencia a un solo tratamiento antihelmíntico es la administración combinada de antihelmínticos con mecanismos de acción no superpuestos/diferímiles. Este concepto empírico de tratamiento combinado se ha buscado como estrategia alternativa para manejar los nematodos gastrointestinales resistentes (Geary et al, 2012).
Un estudio reciente encontró que la administración conjunta a cuatro años de moxidectina y levamisol en corderos con nematodos gastrointestinales multirresistentes resultó en una eficacia significativamente mejor (87%) que la de moxidectina (42%) o levamisol (69%) administradas por separado (Luque et al, 2021). Sin embargo, este enfoque de tratamiento combinado todavía requiere muchos estudios de validación y optimización, y puede aumentar la complejidad de los regímenes de control de parásitos.
La refugia (aquellos en refugio) se refiere a la subpoblación del parásito que no está expuesta al tratamiento antihelmíntico. La refutación incluye:
- etapas de desarrollo fuera del huésped en pastos
- parásitos en animales no tratados
- etapas parasitarias dentro de los animales, pero no están expuestas al tratamiento (por ejemplo, larvas hipobióticas)
Los parásitos en refugia proporcionan una fuente de gusanos sensibles a las drogas con alelos genéticos susceptibles para aparearse con gusanos resistentes a las drogas, lo que resultará en más crías con genes no seleccionados. Cualquier aumento en los refugiados conducirá a una reducción en la tasa de desarrollo de la RA y viceversa.
La vacunación ha sido una gran herramienta en el control de muchas enfermedades infecciosas, pero este no es el caso cuando se trata de enfermedades parasitarias. A pesar de los avances significativos en la comprensión de la inmunobiología de las infecciones por helmintos, este mejor conocimiento no ha hecho que la perspectiva de vacunas contra el helminto sea más alcanzable.
Afortunadamente, hay una vacuna disponible para el control del gusano pulmonar. Además, existe una vacuna para el gusano polar del barbero, H contortus, que se comercializa en Australia y Sudáfrica. Se puede usar para controlar la hemonchosis en ovejas y puede funcionar contra H placei en terneros (Bassetto et al, 2014), pero esta vacuna no está autorizada para su uso en bovinos. Puede ser particularmente útil en situaciones en las que la RA está muy extendida.
Los productos naturales han proporcionado un recurso considerable para el descubrimiento de nuevas sustancias con altas actividades antihelmínticas. Un estudio previo mostró que las proteinasas de cisteína derivadas del látex de papaya tienen una actividad antihelmíntica significativa contra el nematodo abomasal H contortus (Buttle et al, 2011). Otro estudio reciente mostró que las combinaciones de aceite de cilantro y linalool (Figura 2) confieren un efecto antihelmíntico sinérgico sobre la motilidad de las larvas infecciosas de cinco nematodos gastrointestinales principales de rumiantes (Helal et al, 2020).

Protozoos gastrointestinales
El ganado es susceptible a la infección por una serie de protozoos, que pueden tener una carga importante para la salud y el bienestar de los animales infectados, en particular los terneros jóvenes.
Varias especies de Eimeria se encuentran en el tracto gastrointestinal del ganado, que se infectan al ingerir ooquistes esporulados por vía fecal-oral mientras pastan pastos contaminados. Varias especies de Eimeria pueden infectar al ganado; sin embargo, Eimeria bovis y Eimeria zuernii son la principal causa de enfermedad entérica, e incluso pueden matar terneros jóvenes.
Los organismos de eimeria se multiplican rápidamente y causan destrucción masiva en la mucosa intestinal, lo que conduce a la mala absorción de nutrientes y diarrea acuosa o sanguinolenta, particularmente en animales jóvenes. La cría intensiva de terneros, la mala higiene y las situaciones estresantes (como el transporte, el hacinamiento y el destete) favorecen la multiplicación de estos protozoos.
La enfermedad causada por la infección por Eimeria, conocida como coccidiosis, se asocia con pérdidas significativas de producción porque los animales afectados exhiben pérdida de apetito, depresión, deshidratación, pérdida de peso y retraso en el crecimiento. Los bovinos mayores, a menos que estén seriamente estresados o inmunodeprimidos, son portadores asintomáticos y eliminan ooquistes, causando más contaminación ambiental y propagan la infección a otros animales.
Los ooquistes de eimeria se pueden detectar mediante una prueba de flotación fecal. Los productos anticoccidiales (por ejemplo, diclazuril, toltrazuril) se utilizan a menudo para controlar la coccidiosis en terneros y pueden tener una alta eficacia contra la infección preexistente por Eimeria.
La infección por Giardia duodenalis en rumiantes es generalmente asintomática, pero se ha notificado diarrea en animales jóvenes infectados con este protozoario. Los quistes de Giardia se pueden detectar en las heces mediante una prueba de flotación de doble centrifugación con sulfato de zinc.
Además de causar pérdidas de producción en los animales afectados, G duodenalis tiene un impacto en la salud pública debido a su potencial zoonótico.
Aunque no hay medicamentos autorizados para la infección por Giardia en rumiantes, los medicamentos antihelmínticos como el albendazol y el fenbendazol han sido efectivos.
Se informa de varias especies de Cryptosporidium en el ganado; sin embargo, Cryptosporidium parvum es la especie de Cryptosporidium más frecuente y patógena que infecta a terneros. Comúnmente se asocia con diarrea, pérdida de apetito, deshidratación, reducción del peso corporal e incluso la muerte en terneros predestetados.
La criptosporidiosis clínica puede costar potencialmente 130 libras esterlinas por ternero infectado debido a la reducción del aumento de peso (Shaw et al, 2020). C parvum también es zoonótico y puede infectar a los humanos.
El diagnóstico se logra utilizando el método Wisconsin de doble centrifugación con solución de sacarosa donde los ooquistes parecen refringentes a la luz con un color rosa característico.
El lactato de halofuginona oral se utiliza para prevenir o reducir la diarrea debida al parvum C en terneros.
Conclusión
Mantener una producción ganadera eficiente mediante la prevención y el tratamiento de infecciones endoparasitarias es esencial para satisfacer la creciente demanda de alimentos de la creciente población mundial.
El control del gusano en el ganado se basa en el uso de antihelmínticos, que seguirán siendo las herramientas más valiosas en el tratamiento y control de la infección por gusanos. Sin embargo, los problemas de resistencia pueden aumentar con el uso excesivo de antihelmínticos, lo que comprometerá el éxito general del control de gusanos del ganado.
El ganado también es susceptible a la infección por una serie de protozoos, algunos de los cuales pueden tener una importancia médica considerable además de su impacto veterinario.
Se debe diseñar un programa eficaz de control de endoparásitos para minimizar la carga de parásitos en el ganado, prevenir la contaminación del medio ambiente e interrumpir el ciclo de transmisión del parásito, manteniendo al mismo tiempo la eficacia de los medicamentos antiparasitarios existentes.
Se deben intensificar los esfuerzos en el desarrollo de programas de control de endoparásitos más innovadores que combinen el uso sensato de los endoparasiticidas y prácticas sólidas de manejo del pastoreo.
Conflicto de intereses
El autor declara que el artículo fue escrito en ausencia de relaciones comerciales o financieras que puedan interpretarse como un posible conflicto de intereses. Las referencias a cualquier droga no implican su aprobación por parte del autor o editor.
Es importante leer las hojas de datos de productos más actualizadas, ya que algunas restricciones a los productos, incluidos los períodos de extracción de carne y leche, son propensas a cambiar a medida que cambien los límites máximos de residuos para productos individuales.
- Algunos medicamentos se usan debajo de la cascada.
Referencias
- Bassetto CC, Silva MRL, Newlands GFJ et al (2014). Vacunación de terneros pastando con antígenos de las membranas intestinales de Haemonchus contortus: efectos contra el desafío natural con Haemonchus placei y Haemonchus similis, International Journal for Parasitology 44(10): 697-702.
- Buttle DJ, Behnke JM, Bartley Y et al (2011). La dosificación oral con látex de papaya es un tratamiento antihelmíntico eficaz para ovejas infectadas con Haemonchus contortus, Parásitos y Vectores 4: 36.
- Elsheikha HM y Khan NA (2011). Essentials of Veterinary Parasitology (1a edición), Caister Academic Press, Norfolk.
- Fairweather I, Brennan GP, Hanna REB y otros (2020). Resistencia a los medicamentos en los trematodos hepáticos, International Journal for Parasitology: Drugs and Drug Resistance 12: 39-59.
- Fenemore C, Floyd T y Mitchell S (2021). Rumen fluke en Gran Bretaña, Journal of Comparative Pathology 184: 31-36.
- García-Dios D, Díaz P, Viña M et al (2020). Eficacia de la oxiclozanida y el closantel contra los trematodos rumanos (paramphistomidae) en ovejas infectadas naturalmente, Animals10(11): 1943.
- Geary T, Hosking B, Skuce P y otros (2012). Directriz de la Asociación Mundial para el Avance de la Parasitología Veterinaria (W.A.A.V.P.): productos combinados antihelmínticos dirigidos a infecciones por nematodos de rumiantes y caballos, Parasitología Veterinaria 190(1-2): 306-316.
- Gordon DK, Roberts LCP, Lean N y otros (2013). Identificación del trematodo ruminal,Calicophoron daubneyi, en ganado GB: posibles implicaciones para el diagnóstico de trematodo hepático, Parasitología Veterinaria 195(1-2): 65-71.
- Helal MA, Abdel-Gawad AM, Kandil OM et al (2020). Efectos nematocidas de un aceite esencial de cilantro y cinco principios puros sobre las larvas infecciosas de los principales nematodos gastrointestinales ovinos in vitro, Patógenos 9(9): 740.
- Holzhauer M, van Schaik G, Saatkamp HW y Ploeger HW (2011). Brotes de gusanos pulmonares en vacas lecheras adultas: estimación de las pérdidas económicas y lecciones que se deben aprender, Vet Rec 169(19): 494.
- Kaplan RM (2020). Biología, epidemiología, diagnóstico y manejo de la resistencia antihelmíntica en nematodos gastrointestinales del ganado, Clínicas Veterinarias de América del Norte: Alimentación Animal Practice 36(1): 17-30.
- Luque S, Lloberas M, Cardozo P y otros (2021). Tratamiento combinado de moxidectina-levamisol contra nematodos gastrointestinales multirresistentes: un monitoreo de la eficacia a cuatro años en corderos, Parasitología Veterinaria 290: 109362.
- McKellar QA y Jackson F (2004). Anhelmínticos veterinarios: antiguos y nuevos, Tendencias en Parasitología 20(10): 456-461.
- Paraud C, Gaudin C, Pors I y Chartier C (2009). Eficacia de la oxiclozanida contra el trematodo ruminal Calicophoron daubneyi en cabras infectadas experimentalmente, The Veterinary Journal 180(2): 265-267.
- Sabourin E, Alda P, Vázquez A y otros (2018). Impacto de las actividades humanas en la transmisión de la fasciolosis, Tendencias en Parasitología 34(10): 891-903.
- Shaw HJ, Innes EA, Morrison LJ y otros (2020). Efectos de producción a largo plazo de la criptosporidiosis clínica en terneros neonatales, International Journal for Parasitology 50(5): 371-376.
- Stromberg BE y Gasbarre LC (2006). Programas de control de nematodos gastrointestinales con énfasis en el ganado, Clínicas Veterinarias de América del Norte: Práctica Alimentaria de Animales 22(3): 543-565.
- Sutherland IA y Leathwick DM (2011). Resistencia anhelmíntica en parásitos nematodos del ganado: ¿un problema global?, Tendencias en Parasitología 27(4): 176-181.
- Taylor MA (2012). Enfermedades parasitarias emergentes de ovejas, Parasitología Veterinaria189(1): 2-7.
Fuente Vet Times
Date de alta y recibe nuestro 👉🏼 Diario Digital AXÓN INFORMAVET ONE HEALTH
Date de alta y recibe nuestro 👉🏼 Boletín Digital de Foro Agro Ganadero
Noticias animales de compañía
Noticias animales de producción
Trabajos técnicos animales de producción
Trabajos técnicos animales de compañía

