Adrenalectomía laparoscópica vs. abierta: perros con tumor suprarrenal
Adrenalectomía laparoscópica vs. abierta: datos perioperatorios y análisis de supervivencia en 70 perros con tumor suprarrenal
 Kirsten L. van Bokhorst1,2
Kirsten L. van Bokhorst1,2  Sara Galac1
Sara Galac1  Hans S. Kooistra1
Hans S. Kooistra1  Janny C. de Grauw1,3
Janny C. de Grauw1,3  Erik Teske1
Erik Teske1  Guy C. M. Grinwis4
Guy C. M. Grinwis4  Sebastiaan A. van Nimwegen1*
Sebastiaan A. van Nimwegen1*- 1Departamento de Ciencias Clínicas, Facultad de Medicina Veterinaria, Universidad de Utrecht, Utrecht, Países Bajos
- 2IVC Evidensia, Vleuten, Países Bajos
- 3Ciencias y Servicios Clínicos, Royal Veterinary College, Universidad de Londres, Londres, Reino Unido
- 4Departamento de Ciencias de la Salud Biomolecular, Facultad de Medicina Veterinaria, Universidad de Utrecht, Utrecht, Países Bajos
La adrenalectomía es el tratamiento de elección en caso de tumores suprarrenales funcionales e incidentalomas suprarrenales malignos. La adrenalectomía laparoscópica (LA) en perros ha ganado popularidad en los últimos años, sin embargo, los estudios clínicos en grandes poblaciones de pacientes son escasos. Este estudio retrospectivo describe los datos perioperatorios y de recurrencia, la supervivencia y los factores pronósticos en 70 perros que se sometieron a AL o adrenalectomía abierta (OA) en nuestro hospital entre 2008 y 2022. El diagnóstico se basó en la anamnesis, los signos clínicos, las pruebas de función endocrina y el diagnóstico por imágenes avanzadas. La adrenalectomía laparoscópica se realizó en 42 perros (n = 27 hipercortisolismo natural, n = 4 feocromocitoma, n = 1 feocromocitoma con hipercortisolismo concurrente, n = 10 incidentaloma) y OA en 28 perros (n = 22 hipercortisolismo, n = 3 feocromocitoma, n = 3 incidentaloma). La adrenalectomía bilateral se realizó en 8/70 perros. La duración quirúrgica de la AL y la OA no difirió significativamente en los procedimientos unilaterales y bilaterales (P = 0,108 y P = 0,101, respectivamente). La hipertensión sistémica ocurrió en 7/41 y 1/28 perros durante LA y OA, respectivamente (P = 0,130). La hipotensión ocurrió en 2/41 y 4/28 perros durante LA y OA, respectivamente (P = 0,214). Un total de 40/42 perros en el grupo LA y 27/28 en el grupo OA sobrevivieron hasta el alta (P = 0,810). La estancia hospitalaria media fue significativamente más corta (P = 0,006) después de LA (1,5 días, rango 1-3) que después de OA (2,2 días, rango 1-4). No se demostraron diferencias significativas entre los grupos de AL y OA en la recurrencia de la enfermedad endocrina dependiente de las glándulas suprarrenales (P = 0,332), el período libre de enfermedad (P = 0,733) y el tiempo de supervivencia (P = 0,353). Las tasas de supervivencia a 1, 2 y 3 años específicas de la enfermedad fueron de 95, 89 y 89 % después de LA y 92, 88 y 81 % después de OA. El tamaño del tumor se asoció significativamente con la aparición de una recurrencia. Además, el tamaño del tumor tuvo un efecto negativo en el período libre de enfermedad y el tiempo de supervivencia. Este estudio muestra un resultado favorable tanto de LA como de OA en perros. Sobre la base de la baja tasa de complicaciones perioperatorias, el corto tiempo de hospitalización y los resultados a largo plazo comparables a la OA en casos seleccionados, el enfoque laparoscópico menos invasivo se considera la técnica preferida.
1. Introducción
Los tumores suprarrenales (AT) pueden ser secretores de hormonas, es decir, funcionales u hormonalmente silenciosos. Los tumores adrenocorticales funcionales (TCA) más comunes en perros son secretores de cortisol y conducen a hipercortisolismo natural (HC), es decir, síndrome de Cushing, mientras que los tumores corticales menos comunes pueden secretar aldosterona, hormonas sexuales u hormonas precursoras (1). Los TA funcionales que surgen de la médula, es decir, feocromocitomas (PCC), conducen a un exceso de catecolaminas. Además, se han reportado múltiples proliferaciones neoplásicas dentro de una glándula suprarrenal, y las masas suprarrenales también pueden representar metástasis, granulomas o quistes (2). Los TA hormonalmente silenciosos se describen con frecuencia como «incidentalomas», ya que estos tumores se diagnostican con mayor frecuencia como un hallazgo incidental durante las imágenes abdominales para otras indicaciones (1). Debido a la mayor disponibilidad y calidad de las imágenes avanzadas, estos incidentalomas suprarrenales (IA) se diagnostican con mayor frecuencia (2, 3).
La adrenalectomía es el tratamiento de elección cuando una TA funcional causa signos clínicos o cuando se sospecha que una IA es maligna, y no se han detectado metástasis (4-10). La diferenciación del TCA benigno de maligno en perros es un desafío, pero la invasión extensa en el tejido adyacente o la vasculatura y el tamaño del tumor >2 cm se consideran consistentes con el carcinoma de corteza suprarrenal (ACC) (2, 11, 12). El exceso hormonal de los TA funcionales puede predisponer a complicaciones perioperatorias, como tromboembolismo en caso de HC e hipertensión arterial en caso de HC, hiperaldosteronismo y CCP. Por lo tanto, es importante realizar un diagnóstico exhaustivo antes de la adrenalectomía (2, 9, 11).
La adrenalectomía laparoscópica (LA) se ha descrito en perros (13-15). En informes anteriores, el LA fue exitoso como tratamiento de los TA y se asoció con una baja tasa de mortalidad perioperatoria (10, 16, 17). Si bien la laparoscopia es una técnica menos invasiva, existen preocupaciones en la medicina humana sobre el aumento de la recurrencia y la reducción del intervalo libre de enfermedad después de la extirpación laparoscópica del ACC debido a la extirpación incompleta o al derrame tumoral (18, 19). Sin embargo, en un análisis más reciente, no se demostraron diferencias significativas en las tasas de recurrencia o mortalidad asociada al cáncer después de la extirpación laparoscópica vs. laparotómica del ACC en humanos (20). En pacientes caninos, los factores de riesgo para la recurrencia de la enfermedad endocrina después de la adrenalectomía no están bien establecidos. En el estudio de Taylor et al. (10) no se demostró ninguna diferencia en la recurrencia y la supervivencia a largo plazo entre 14 casos de AL y 26 casos de OA. En ese estudio, la hipotensión intraoperatoria ocurrió con menos frecuencia, y la duración quirúrgica se redujo en los perros en los que se realizó AL. Como es el único estudio que compara el resultado a largo plazo entre LA y OA en perros y realizado en una clínica universitaria, se necesitan más estudios para ampliar los conocimientos sobre la tasa de éxito y la recurrencia después de diferentes técnicas de adrenalectomía y los posibles factores relacionados con el resultado. Por lo tanto, el presente estudio compara las complicaciones perioperatorias, las tasas de éxito y recurrencia, la supervivencia a largo plazo y los factores pronósticos relacionados en una gran cohorte de perros tratados por LA o OA para varios AT.
2. Materiales y métodos
2.1. Selección de pacientes
En este estudio retrospectivo, se revisaron los registros clínicos de perros que se sometieron a LA o OA en el Departamento de Ciencias Clínicas de la Facultad de Medicina Veterinaria de la Universidad de Utrecht, Países Bajos, entre 2008 y 2022. Cuando la laparoscopia se convirtió en laparotomía, los datos asociados se analizaron como un caso de OA.
2.2. Diagnóstico
Los perros se presentaron debido a signos clínicos de exceso hormonal, o debido a una masa suprarrenal descubierta incidentalmente en el diagnóstico por imágenes por razones no relacionadas específicamente con la enfermedad endocrina. Todos los perros incluidos en el estudio se sometieron a una evaluación diagnóstica exhaustiva. El diagnóstico preoperatorio se basó en la anamnesis, los signos clínicos, la hematología, la bioquímica y el análisis de orina, combinados con el análisis hormonal para evaluar la funcionalidad de la TA. En perros con antecedentes, examen físico y hallazgos de laboratorio consistentes con HC, el diagnóstico se confirmó mediante pruebas de función endocrina, es decir, prueba de supresión de dexametasona en dosis bajas (LDDST) o cocientes corticoide-creatinina urinaria (UCCR) combinadas con una prueba oral de supresión de dexametasona en dosis altas (HDDST) y medición endógena de ACTH plasmática. Las pruebas de función endocrina y los análisis hormonales para HC se realizaron e interpretaron como se describió anteriormente (21, 22). La concentración plasmática de aldosterona y las metanefrinas plasmáticas u urinarias se midieron para detectar hiperaldosteronismo y PCC, respectivamente, como se describió anteriormente (23, 24).
2.3. Imagen suprarrenal
La imagen diagnóstica de la hipófisis, el tórax y el abdomen se realizó en todos los perros incluidos en este estudio. La tomografía computarizada (TC) se realizó bajo anestesia general con un escáner de TC helicoidal de uno o varios cortes (Secura CT Scanner; Phillips, Best, Países Bajos), utilizando un protocolo descrito anteriormente (25). La estructura, forma y simetría de las glándulas suprarrenales y la invasión tumoral en los vasos sanguíneos fue evaluada por un radiólogo certificado. Los tumores suprarrenales se midieron en tres dimensiones, es decir, longitud, altura y anchura en centímetros, utilizando el programa informático Agfa Impax (Impax Agility 8.1.2; Agfa-Gevaert, Mortsel, Bélgica) o Radiant DICOM viewer (Medixant; versión 2021.2, Poznan, Polonia). Se determinó la dimensión máxima de AT y el volumen de AT se estimó utilizando la fórmula para el cálculo del volumen de un elipsoide: 4/3 × Pi × A × B × C, donde A, B y C son las longitudes de los tres semiejes del elipsoide, es decir, 0,5 veces los diámetros medidos de la glándula suprarrenal en cada dimensión. Las imágenes de TC se evaluaron para detectar la presencia de masas compatibles con metástasis. Dependiendo de la ubicación específica de la(s) masa(s), se tomaron biopsias de aspiración con aguja fina guiadas por ultrasonido para la evaluación citológica preoperatoria, o biopsias de tejido durante la cirugía para la evaluación histológica.
A partir de la integración de los hallazgos clínicos, de laboratorio y de diagnóstico por imagen, se realizó un diagnóstico endocrino preoperatorio de HC, hiperaldosteronismo, CCP o combinaciones de los mismos. Si los signos clínicos y los resultados de las pruebas de función endocrina no eran consistentes con uno de estos diagnósticos, el TA se definió como IA. Se registró tratamiento médico preoperatorio para HC o CCP.
2.4. Adrenalectomía
La anestesia fue supervisada por un anestesiólogo certificado. El protocolo anestésico no fue estandarizado, sin embargo, generalmente consistió en premedicación IV o IM con un mu-opioide y un agente antimuscarínico, inducción IV con propofol y mantenimiento con isoflurano en oxígeno (FiO2 ~50%) titulado para mantener una profundidad anestésica adecuada, con una infusión de velocidad constante de fentanilo (Fentadon, Dechra, Bladel, Países Bajos) 5–20 mcg/kg/h o sufentanilo (Sufentanil-hameln, Hameln pharma GMBH, Hameln, Alemania) 0.5–2 mcg/kg/h a discreción del anestesista. Las decisiones para ajustar el plan anestésico se basaron en el juicio del médico tratante sobre los parámetros clínicos del perro. Los parámetros de la función respiratoria y cardiovascular se documentaron cada 5-10 min, al igual que cualquier comentario sobre anestesia o cirugía. Los perros diagnosticados con HC o AI recibieron hidrocortisona intravenosa (Solu-Cortef, Pfizer, Capelle a/d IJssel, Países Bajos) 1 mg/kg durante 6 h después de la inducción. Si se realizó adrenalectomía bilateral, se añadió acetato de desoxicortina (Facultad de Farmacia de Medicina Veterinaria, Universidad de Utrecht, Países Bajos) 0,10 mg/kg cada 24 h SC al protocolo de suplementación. La duración quirúrgica se calculó desde la primera incisión hasta la finalización del cierre abdominal.
Durante la anestesia, la presión arterial se midió de forma invasiva a través de un catéter arterial conectado a un transductor de presión electrónico o, si la colocación del catéter no tuvo éxito, mediante medición oscilométrica no invasiva (Pettrust, condado de Taoyuan, Taiwán). La hipertensión sistémica se definió como una presión arterial sistólica (PAE) >160 mm Hg sostenida durante un mínimo de 10 min (10, 26). Además, la SAP se calificó como elevada en el límite cuando la presión arterial estaba por encima de 140 mm Hg durante un mínimo de 10 minutos, pero no superaba persistentemente los 160 mm Hg. La hipotensión se definió como una presión arterial media (PAM) <60 mm Hg sostenida durante un mínimo de 10 min. La hipertensión o hipotensión sistémica fue tratada según lo considerado necesario por el anestesista tratante, mediante el ajuste de la concentración del agente inhalante, la provisión de analgesia adicional, bolos de líquidos intravenosos y/o la administración de fármacos vasoactivos [antagonistas alfa o beta-adrenérgicos (esmolol, fentolamina) o agonistas (dobutamina, fenilefrina, norepinefrina)].
La adrenalectomía fue realizada por el mismo cirujano (SN) para cada perro basado en los métodos descritos anteriormente (9, 13, 27). En principio, no hubo límite de tamaño tumoral al considerar LA u OA, siempre y cuando la forma del tumor estuviera relativamente claramente marginada sin afectación manifiesta de vasos sanguíneos importantes que impidieran la escisión completa del tumor. Por lo tanto, se excluyeron los tumores irregulares con invasión irregular extensa en o alrededor de los tejidos circundantes o que recubren la aorta, la vena cava o la arteria mesentérica craneal. Además, la extensión del trombo tumoral en la vena cava más allá del hilio hepático se consideró un criterio de exclusión. La decisión de realizar AL se basó en los hallazgos de imágenes, incluyendo un TA relativamente bien definido y suavemente marginado, sin invasión vascular visible más allá de la vena frenicoabdominal (es decir, sin trombo tumoral entrando en la vena cava o vena renal), sin infiltración tumoral en el riñón o hilio renal, y evaluación subjetiva del tamaño de AT en relación con el espacio quirúrgico esperado que está influenciado por el tamaño y la conformación del perro. Si se considera posible, LA fue la técnica preferida.
Para AL, la pared lateral del cuerpo se recortó ampliamente y se preparó asépticamente desde la mitad del tórax hasta las coxas tuberculosas en orientación craneocaudal y desde la línea media dorsal hasta la línea media ventral en orientación dorsoventral, lo que permitió la conversión a un enfoque de laparotomía paracostal en caso de que fuera necesario. Los perros fueron colocados en reclinación esternal, hasta 30o oblicuo contralateral, fuertemente apoyado por cojines de vacío moldeables colocados debajo del esternón y entre las patas traseras para levantar el esternón y el hueso púbico para permitir que el abdomen cuelgue en el medio, promoviendo que los órganos abdominales se muevan de manera dependiente (28). Una mesa motorizada permitió una mayor inclinación del paciente en cualquier dirección si era necesario durante la adrenalectomía. En la mayoría de los casos, se utilizó una técnica de Hasson modificada utilizando cánula roscada de 6 mm de diámetro (Ternamian Endotip, Karl Storz, Tuttlingen, Alemania) para la inserción del 1er puerto de cámara de 3-5 cm caudal hasta la última costilla y 2-3 cm ventral a las apófisis espinosas transversales (lateral al riñón). En algunos casos tempranos, se insertó una aguja de Veress justo caudal a la costilla 13 en la fosa paralumbar. Después de la insuflación abdominal con CO2 (presión intraabdominal de 8 mmHg), se colocaron dos cánulas adicionales de 6 mm craneales y caudales al portal de la cámara, con base en los hallazgos intraabdominales, con el objetivo de triangulación de los instrumentos. Se utilizó un laparoscopio de 5° de 30 mm de diámetro (Karl Storz, Tuttlingen, Alemania) y se realizó manipulación y disección de tejidos utilizando pinzas laparoscópicas de 5 mm de diámetro tipo punta roma, Babcock o Kelly (Clickline(R), Karl Storz, Tuttlingen, Alemania). LigaSureTM Sellador/divisor de tejidos de Maryland con ForceTriadTM generador (Medtronic, Eindhoven, Países Bajos) se utilizó para la disección, sellado y transección de tejidos en la mayoría de los casos; LigaSure-V se utilizó en algunos casos tempranos. Para lograr el acceso a la glándula suprarrenal derecha, se hizo una incisión en el ligamento hepatorrenal derecho y se retrajo cranealmente el lóbulo hepático lateral. Para obtener una exposición adecuada de la glándula suprarrenal izquierda y derecha, el riñón se retrajo caudalmente y el peritoneo entre la glándula suprarrenal y el riñón se diseccionó cerca de la cápsula suprarrenal, teniendo cuidado de no dañar la vena frenicoabdominal. Si es necesario, la exposición de la glándula suprarrenal podría mejorarse aún más mediante una mayor retracción del riñón después de diseccionar las uniones peritoneales craneodorsales del riñón. La disección adicional de la glándula suprarrenal de sus inserciones peritoneales se realizó con una manipulación mínima de la AT de caudodorsal a craneodorsal, diseccionando y transectando la rama dorsal (y con AT izquierda también la rama ventral) de la vena frenicoabdominal con LigaSure. Si había un trombo tumoral (pequeño) en la vena frenicoabdominal, se tuvo cuidado de incluir el trombo completo con la porción de la vena que se extirpó en bloque con el AT. La disección circunferencial de la glándula suprarrenal se continuó con una disección cuidadosa de sus inserciones fibrosas y nerviosas y vasos sanguíneos medial y caudalmente, teniendo cuidado de no dañar la vena renal que puede estar situada cerca o adherida al tumor. En el lado derecho, la parte ventral de la glándula suprarrenal se diseccionó cuidadosamente de la pared de la vena cava mientras levantaba o empujaba suavemente la glándula dorsalmente. La rama ventral de la vena frenicoabdominal derecha se diseccionó libre y, mientras se levantaba suavemente la AT dorsalmente, la vena frenicoabdominal se selló y transectó a nivel de la vena cava, asegurando que, si estaba presente, el pequeño trombo tumoral estuviera contenido en la vena frenicoabdominal extirpada. La penetración capsular se registró si esto ocurrió a pesar de la disección meticulosa. La glándula suprarrenal extirpada se extrajo del abdomen a través de un portal agrandado utilizando una bolsa de recuperación o un dedo de guante para evitar una posible contaminación con células tumorales. En la AL bilateral, los pacientes fueron recortados y preparados asépticamente circunferenciales y colocados en decúbito esternal como se describió anteriormente, asegurando la accesibilidad de ambos flancos laterales sin reposicionar al paciente entre procedimientos (Figura 1). LA se inició en el lado izquierdo y el procedimiento se repitió para el lado contralateral como se describió anteriormente. El abdomen se descomprimió después de la inspección de hemorragia, y los sitios portuarios laparoscópicos se cerraron rutinariamente en tres capas.
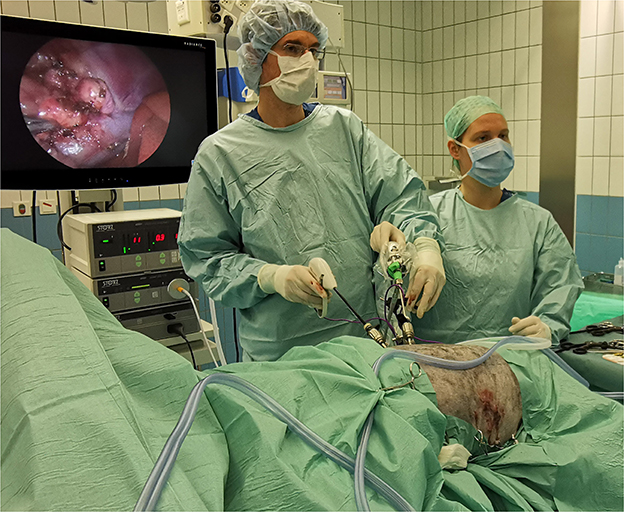
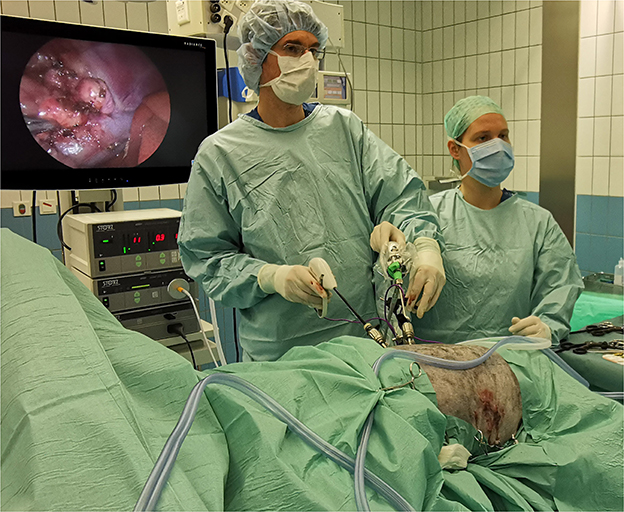 Figura 1. Ajuste de la sala de operaciones durante la adrenalectomía laparoscópica bilateral a través del enfoque de flanco en la decúbito esternal en un perro pastor australiano con HC. En la imagen, LA derecha está en progreso y LA izquierda se ha completado (con 3 portales suturados). Ambos procedimientos se realizan consecutivamente sin reposicionar o volver a cubrir al paciente.
Figura 1. Ajuste de la sala de operaciones durante la adrenalectomía laparoscópica bilateral a través del enfoque de flanco en la decúbito esternal en un perro pastor australiano con HC. En la imagen, LA derecha está en progreso y LA izquierda se ha completado (con 3 portales suturados). Ambos procedimientos se realizan consecutivamente sin reposicionar o volver a cubrir al paciente.
La adrenalectomía abierta se realizó mediante celiotomía paracostal o ventral de la línea media, dependiendo de la anatomía individual relacionada con el tumor y la afectación vascular. Los tumores sin afectación aparente de órganos o vasos sanguíneos mediales al tumor o tumores del lado derecho con invasión cava limitada a la vena cava abdominal generalmente se abordaron mediante celiotomía paracostal del flanco. Los tumores más grandes que crecían en el hilio renal, con sospecha de afectación de la vena renal, los tumores del lado izquierdo con sospecha de invasión cava y las adrenalectomías bilaterales se abordaron a través de la celiotomía ventral de la línea media. Los perros se colocaron en reclinación dorsal o lateral dependiendo del enfoque de celiotomía elegido. Después de la celiotomía estándar y la exposición de la glándula suprarrenal, la extirpación se inició mediante la disección de todas las inserciones peritumorales con una combinación de disección aguda, roma y electroquirúrgica utilizando una combinación de electrocirugía monopolar y bipolar estándar y LigaSureTM Sellador/divisor abierto de mandíbula pequeña. La vena frenicoabdominal, incluido el trombo tumoral si estaba presente, se aisló, selló y dividió en la cara lateral de la glándula con LigaSureTM, sutura o clips vasculares. La glándula suprarrenal se diseccionó aún más de las uniones fasciales circundantes y otras estructuras, incluidos los vasos sanguíneos adheridos y la vena cava si estaba indicado. Antes de la escisión, la vena frenicoabdominal se ligaba o sellaba y se dividía cerca de su entrada en la vena cava. Los trombos tumorales de Caval se extirparon en bloque con el TA a través de una venotomía cava a nivel de la vena frenicoabdominal. Los torniquetes de ruptura siempre se colocaron en la vena cava antes y después del trombo y en cualquier vena renal conectada a la parte cava afectada. Si el tamaño del trombo tumoral lo permitía, se colocaba previamente una pinza vascular Satinsky antes de la venotomía y no se apretaban los torniquetes de Rummel. Para trombos tumorales más grandes, se realizó una oclusión temporal completa del flujo cava apretando los torniquetes de Rummel para la cavotomía y la extirpación del trombo tumoral. Después de la extracción del trombo, siempre se colocó una pinza vascular Satinsky sobre el sitio de la cavotomía y se realizó una sutura de cavotomía con polipropileno 5-0 o 6-0 bajo oclusión parcial de cava. Después de la adrenalectomía, la incisión de la celiotomía se cerró rutinariamente en tres capas.
Después de la operación, los perros fueron monitoreados cuidadosamente y tratados para detectar signos de incomodidad y cualquier trastorno hemodinámico o electrolítico en la Unidad de Cuidados Intensivos (UCI). La analgesia opioide se continuó y se redujo gradualmente a discreción del intensivista asistente, según los hallazgos del examen clínico, incluida la evaluación del dolor. En perros diagnosticados con HC o IA, la suplementación con glucocorticoides se continuó mediante acetato de cortisona oral (Teva, Harlem, Países Bajos) 1 mg/kg cada 12h PO una vez que el perro comenzó a comer. El acetato de cortisona se redujo gradualmente en 7-8 semanas y se suspendió después de procedimientos unilaterales, mientras que después de la adrenalectomía bilateral, glucocorticoides y mineralocorticoides (fludrocortisona; Fendigo, Bruselas, Bélgica/Florinef, Aspen, Países Bajos) 6,25 mcg/kg cada 12h La suplementación con PO se continuó de por vida como se hace en perros con hipoadrenocorticismo primario. Los perros fueron dados de alta del hospital cuando se consideraron cómodos con analgésicos orales y demostraron una ingesta voluntaria suficiente de alimentos.
2.5. Histopatología
El examen histopatológico de las muestras teñidas con hematoxilina y eosina fue realizado por un patólogo certificado por la junta para identificar y diferenciar la neoplasia adrenocortical de la medular. Las neoplasias se evaluaron utilizando un conjunto de hasta veinte características morfológicas que incluyen morfología celular y nuclear, necrosis, invasión vascular e índice mitótico (29, 30). Si el patólogo tratante lo consideró posible, se llegó a una conclusión morfológica de adenoma adrenocortical (ACA) frente a ACC. La presencia de un CCP se confirmó mediante la realización de inmunohistoquímica para la cromogranina A y la sinaptofisina (31).
2.6. Seguimiento
La información de seguimiento se recogió de los expedientes médicos y poniéndose en contacto con los propietarios y los veterinarios remitentes. La recurrencia se definió como la reaparición de los signos clínicos de la enfermedad suprarrenal original y las pruebas de función endocrina positivas y, cuando los clientes dieron su consentimiento, las imágenes descritas para el estudio inicial.
2.7. Estadísticas
El análisis estadístico se realizó utilizando software estadístico comercial (SPSS 27.0.1.0 para Windows, SPSS). Se utilizó la prueba de Kolmogorov-Smirnov para evaluar la normalidad de los datos y la prueba de Levene para la igualdad de varianzas. Las variables perioperatorias comparadas entre LA y OA incluyeron edad, peso corporal, tamaño de TA, invasión vascular, duración quirúrgica, aparición de hiper o hipotensión, penetración capsular intraoperatoria, supervivencia al alta y tiempo de hospitalización. Normalmente, los datos distribuidos se compararon mediante pruebas T. Si los datos no se distribuían normalmente o las varianzas no eran iguales, se utilizó la prueba U de Mann-Whitney para comparar los grupos. La comparación continua de variables entre múltiples grupos se realizó mediante un análisis unidireccional de la varianza seguido de pruebas post-hoc. Las variables nominales se compararon entre los grupos mediante tabulación cruzada y pruebas de Chi-cuadrado, o pruebas exactas de Fisher si el número de animales en un grupo particular era menor que 10.
Las curvas de supervivencia se dibujaron por el método de Kaplan-Meier. Las pruebas univariadas para la comparación de los datos de supervivencia de LA y OA se realizaron mediante pruebas de rango logarítmico y modelos de regresión logística de riesgo proporcional. Las variables univariadas con p < 0,20 se introdujeron en un análisis de regresión del modelo de riesgos proporcionales de Cox multivariado del período libre de enfermedad (DFP) y el tiempo de supervivencia con selección paso a paso hacia adelante. El período libre de enfermedad se calculó desde el momento de la cirugía hasta la aparición de recurrencia. Para el análisis DFP, los perros fueron censurados si se perdieron durante el seguimiento, murieron antes de la recurrencia o la recurrencia no había ocurrido antes del final del período de estudio. Los tiempos de supervivencia se calcularon desde el momento de la cirugía hasta la muerte asociada al tumor. Si un perro moría por una causa no relacionada, se perdía en el seguimiento o todavía estaba vivo al final del estudio, se censuraba y la última fecha conocida en que el perro aún estaba vivo se usaba como fecha de censura. Se realizó un análisis de regresión logística binomial para determinar los efectos de la edad, el peso corporal, el tipo de cirugía, la invasión vascular, el lado de la lesión, la dimensión máxima de AT, el volumen de TA, la duración de la cirugía, la penetración capsular intraoperatoria, el diagnóstico histopatológico, la hipertensión sistémica y la hipotensión sobre la recurrencia.
3. Resultados
3.1. Animales y diagnóstico
Se realizó adrenalectomía laparoscópica en 45 perros; en 3 perros, LA se convirtió a laparotomía, lo que resultó en un total de 42 perros en el grupo de LA (n = 19 del lado izquierdo, n = 18 del lado derecho, n = 5 bilateral). En 25 perros se utilizó un abordaje de laparotomía primaria, resultando un total de 28 perros en el grupo OA (n = 13 del lado izquierdo, n = 12 del lado derecho, n = 3 bilateral). La proporción de adrenalectomías izquierdas, derechas y bilaterales no fue significativamente diferente entre AL y OA (P = 0,987).
El peso corporal medio de los perros en el grupo LA (15,2 kg, rango 6,5-50,3 kg) no difirió significativamente de los perros en los que se realizó OA (14,0 kg, rango 5,1-43,6 kg; P = 0,278). La mayoría de los perros en el grupo de LA fueron castrados (n = 32; 16 machos, 16 hembras), 10 estaban intactos (8 machos, 2 hembras) y las razas más comunes fueron de raza mixta (n = 9), Labrador retriever (n = 5) y Shih tzu (n = 3). El grupo OA consistió en 23 perros castrados (9 machos, 14 hembras) y 5 perros intactos (4 machos, 1 hembra) y las razas más comunes fueron mestizos (n = 7) y Shih tzu (n = 3). La edad media en LA fue de 9,9 años (DE 1,8) y no difirió significativamente de los casos de OA [9,6 años (DE 1,2); P = 0,415].
Los diagnósticos endocrinos preoperatorios en el grupo LA fueron HC (n = 27), CCP (n = 4), CCP con HC concurrente (n = 1) e IA (n = 10). En el grupo de OA, los diagnósticos endocrinos preoperatorios fueron HC (n = 22), CCP (n = 3) e IA (n = 3). Se descubrieron incidentalomas durante la ecografía realizada por diversas razones, incluidos vómitos, diarrea o elevación leve de las enzimas hepáticas en el examen preanestésico. Cuando se les preguntó específicamente, los dueños de perros 9/13 con IA informaron un aumento en la ingesta de agua. En al menos 3/9 perros, esto se diagnosticó como polidipsia primaria basada en la gravedad específica urinaria ≥1.035 sin glucosuria. En un perro diagnosticado con IA no se midieron metanefrinas plasmáticas debido a limitaciones técnicas. En dos perros con IA, se suprimieron las concentraciones plasmáticas de ACTH (<5 pg/mL) y la glándula suprarrenal contralateral de tamaño pequeño. En uno de estos perros, la masa suprarrenal fue un hallazgo incidental durante el diagnóstico de diarrea, mientras que el otro perro presentó poliuria, polidipsia y polifagia intermitente. En este último perro, LDDST reveló bajas concentraciones plasmáticas de cortisol (24, 3 y 2 nmol/L antes y 4 y 8 h después de la dexametasona intravenosa, respectivamente); por lo tanto, este perro no cumplía con los criterios de HC y, por lo tanto, fue diagnosticado con IA. Las razones para la adrenalectomía bilateral fueron HC con neoplasia suprarrenal bilateral en 6 perros y TA unilateral con HC hipofisaria concomitante en 2 perros. En los dos perros con HC hipofisaria dependiente concurrente, la hipofisectomía no se consideró una opción preferible además de la adrenalectomía unilateral, ya que estos comprendían tumores hipofisarios de pequeño tamaño en perros de 11 y 12 años de edad.
Seis de 28 y 3/22 perros con HC fueron tratados con trilostano (Vetoryl, Dechra, Bladel, Países Bajos) 0,5-1,5 mg/kg cada 12h PO antes de LA y OA, respectivamente. El tratamiento con trilostano se suspendió durante un mínimo de 3 días antes de los procedimientos bajo anestesia. Todos los perros con PCC confirmado, incluido el Cocker spaniel con HC concurrente, fueron tratados con fenoxibenzamina (Dibenzyran, Aristo pharma GmbH, Berlín) 0,25-0,5 mg / kg cada 12 h PO en las 2 semanas anteriores a la cirugía. Además, un perro Shih Tzu diagnosticado con IA pero alta concentración plasmática normal de normetanefrina (3,24 nmol/L, rango de referencia 0,90-3,56) (24) fue tratado con fenoxibenzamina antes de la operación.
3.2. Imagen suprarrenal
Según las imágenes preoperatorias, mediana de la dimensión máxima de AT (2,7 cm, rango 1,5–5,2) y volumen de AT (3,06 cm)3, rango 0,77–41,4) en el grupo LA fueron más pequeños que en el grupo OA [3,2 cm (rango 1,7–9,9) y 6,03 cm3 (rango 1,6–374,3); P = 0,037 y P < 0,001, respectivamente]. Los resultados de las tomografías computarizadas preoperatorias fueron sospechosos de invasión de la vena cava caudal o de la vena frenicoabdominal en 11 perros con HC, 2 perros con PCC y 1 perro con IA. La invasión vascular no se asoció significativamente con la dimensión máxima de AT (P = 0,639) o el volumen de AT (P = 0,097). En 2/14 perros, ambos con invasión de la vena frenicoabdominal, se realizó AL, mientras que la OA se realizó en los 12/14 perros restantes.
3.3. Adrenalectomía
La duración quirúrgica media de la AL fue de 138 min (DE 52) en procedimientos unilaterales y de 230 min (DE 24) en procedimientos bilaterales, lo que no fue significativamente diferente de la OA [unilateral 153 min (DE 36), bilateral 197 min (DE 22); P = 0,108 y P = 0,101, respectivamente]. El tiempo quirúrgico no difirió significativamente entre AL y OA para los procedimientos del lado izquierdo (P = 0,891), del lado derecho (P = 0,149) y bilaterales (P = 0,102). Sin embargo, para ambas técnicas combinadas, la duración de la adrenalectomía del lado izquierdo (media 132 min, DE 42) fue más corta que la derecha (157 min, DE 48; P = 0,033).
La evaluación de la presión arterial sistémica durante la anestesia estuvo disponible en 69/70 perros; 41/42 perros que se sometieron a LA y los 28 perros en los que se realizó OA. En el perro salchicha miniatura restante con HC, la canulación arterial no tuvo éxito y la monitorización oscilométrica falló. La presión arterial se midió de forma invasiva en 49/69 perros (n = 28 LA y n = 21 OA) y de forma no invasiva en 20/69 perros (n = 13 LA y n = 7 OA). Las categorías de presión arterial sistémica por diagnóstico endocrino y técnica quirúrgica se resumen en la Tabla 1. La hipertensión sistémica ocurrió en 7/41 y 1/28 perros durante LA y OA, respectivamente (P = 0,130). Se observó presión arterial sistémica elevada en el límite en 9/41 y 6/28 perros durante LA y OA, respectivamente (P = 0,999). La hipotensión ocurrió en 2/41 y 4/28 perros durante LA y OA, respectivamente (P = 0,214). Se utilizaron agonistas alfa o beta-adrenérgicos en otros dos perros que no desarrollaron hipotensión sistémica. Un perro diagnosticado con CCP (OA) y un perro con PCC del lado izquierdo y HC hipofisaria dependiente concurrente (LA bilateral), inicialmente desarrollaron hipertensión y episodios cortos de SAP >160 mm Hg, respectivamente, hasta la eliminación del AT; posteriormente se produjo hipotensión que requirió un vasopresor para aumentar la PAM > 60 mm Hg.
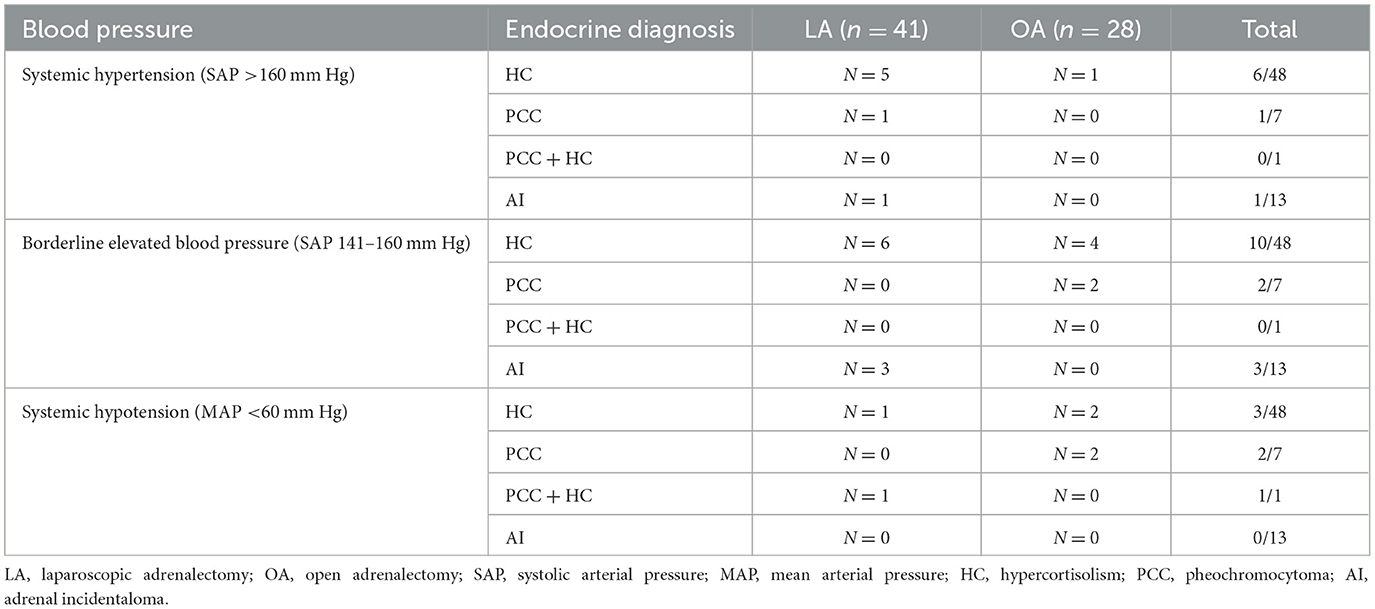 Tabla 1. Categorías de presión arterial sistémica por diagnóstico endocrino en 41 perros que se sometieron a adrenalectomía laparoscópica y 28 perros que se sometieron a adrenalectomía abierta.
Tabla 1. Categorías de presión arterial sistémica por diagnóstico endocrino en 41 perros que se sometieron a adrenalectomía laparoscópica y 28 perros que se sometieron a adrenalectomía abierta.
La extensión del trombo tumoral Caval en la OA fue prehepática o simplemente entró en el hilio hepático, con trombos más grandes que no se extendieron cranealmente más allá de las primeras ramas hepáticas de la vena lobar. Se notificó penetración capsular intraoperatoria en 19 perros (n = 13 LA, n = 6 OA). No se encontró asociación entre la penetración capsular y el abordaje quirúrgico (P = 0,418), la dimensión máxima de AT (P = 0,516) o el volumen de AT (P = 0,342).
La adrenalectomía se realizó con éxito sin complicaciones intraoperatorias importantes en todos menos un perro. En este Jack Russell terrier, no hubo hipertensión sistémica antes de la operación y las pruebas de función endocrina excluyeron HC e hiperaldosteronismo. Fue este perro en el que no se pudieron determinar metanefrinas plasmáticas antes de la operación debido a limitaciones técnicas y el perro no fue pretratado con fenoxibenzamina. El perro se sometió a LA por una sospecha de IA del lado derecho que medía 1.2 × 1.1 × 2.1 cm y murió después de desarrollar hipertensión sistémica incontrolable (SAP >300 mm Hg) durante la cirugía que condujo a un paro cardíaco. Durante la anestesia para la tomografía computarizada 7 semanas antes de la cirugía, no ocurrieron complicaciones anestésicas. La histopatología postmortem fue rechazada por el propietario y, por lo tanto, no fue posible hacer un diagnóstico definitivo en este perro.
En dos perros en los que se inició LA unilateral, la cirugía se convirtió en OA. Las razones para la conversión fueron hemorragia moderada debido a laceración de la cápsula tumoral medial al tumor en un perro y hemorragia difusa de la cápsula renal en otro perro pequeño (5,1 kg) con espacio quirúrgico limitado, que no se pudo controlar laparoscópicamente. En un perro que se sometió a adrenalectomía por HC bilateral dependiente de glándulas suprarrenales, la cirugía tuvo que convertirse en una técnica abierta para la segunda suprarrenal (derecha) debido al neumotórax inadvertido durante la colocación de la cánula, lo que llevó a una visibilidad oscurecida por el diafragma desplazado caudalmente. Además, se produjo un neumotórax accidental en un perro de 7,9 kg debido a la punción inadvertida de la cavidad torácica durante la colocación de la aguja Veress. En este caso, el neumotórax se manejó intraoperatoriamente con drenaje torácico y el procedimiento de LA se completó sin más eventos.
3.4. Histopatología
La histopatología suprarrenal estuvo disponible en todos los perros 69/70 en los que la adrenalectomía fue exitosa. El feocromocitoma se confirmó en los 8 perros con este diagnóstico preoperatorio. En los 61 perros restantes, se diagnosticaron tumores corticales, como se resume en la Tabla 2.
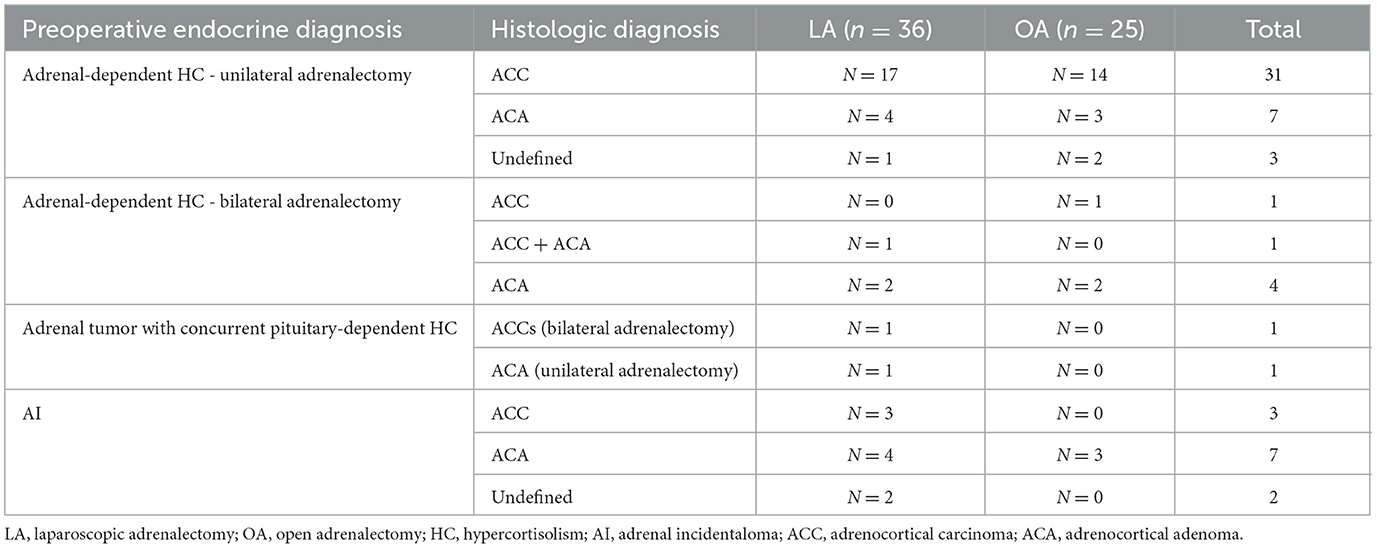 Tabla 2. Diagnósticos histopatológicos de neoplasia cortical en 36 perros sometidos a adrenalectomía laparoscópica y 25 perros sometidos a adrenalectomía abierta.
Tabla 2. Diagnósticos histopatológicos de neoplasia cortical en 36 perros sometidos a adrenalectomía laparoscópica y 25 perros sometidos a adrenalectomía abierta.
En un perro con PCC confirmado y pruebas negativas de función endocrina para HC, se encontró un tumor cortical concurrente en la misma glándula suprarrenal. En otro perro con HC dependiente suprarrenal confirmada y metanefrinas plasmáticas dentro del rango de referencia, se demostró un tumor medular concurrente consistente con CCP dentro de la misma glándula suprarrenal.
De los 14 perros en los que las imágenes de TC preoperatorias sugirieron invasión vascular, la histopatología suprarrenal fue consistente con PCC en 2 perros, ACC en 9 perros y ACA en 3 perros, incluido el perro con un diagnóstico endocrino preoperatorio de IA. En perros con TCA, la invasión vascular no fue más frecuente en los carcinomas histológicos que en los adenomas (P = 0,732).
3.5. Seguimiento
Un total de 40/42 perros en el grupo LA y 27/28 en el grupo OA sobrevivieron hasta el alta (P = 0,810). Además del perro que murió durante la cirugía, dos perros murieron poco después de la recuperación. Un perro desarrolló vómitos, diarrea y disnea después de la recuperación de LA en la UCI y sufrió un paro cardíaco dentro de las 12 h después de la operación. Este perro se sometió a una cirugía por HC debido a una TA del lado izquierdo y no se encontró una causa inmediata de muerte, incluido tromboembolismo pulmonar, en la necropsia. Otro perro sometido a OA por HC dependiente suprarrenal bilateral se recuperó sin incidentes inicialmente, pero sufrió un paro cardíaco a partir de entonces, mientras que el recuento de trombocitos y los tiempos de coagulación estaban dentro de sus respectivos rangos de referencia y no se encontró líquido libre en la ecografía abdominal. La reanimación no tuvo éxito y el examen postmortem se rechazó en este perro.
En los perros que sobrevivieron al alta, la estancia hospitalaria media después de la adrenalectomía fue significativamente más corta en el LA (1,5 días, rango 1-3) en comparación con el grupo de OA (2,2 días, rango 1-4; P = 0,006). Un perro con HC dependiente suprarrenal y diabetes mellitus fue excluido de este análisis ya que desarrolló una infección en el sitio del catéter y fue hospitalizado durante un período prolongado de 11 días no relacionado con LA.
La recurrencia ocurrió en 13 perros con HC dependiente de las glándulas suprarrenales; 7 después de LA (n = 3 derecha, n = 3 izquierda, n = 1 bilateral) y 6 después de OA (n = 1 derecha, n = 5 izquierda; P = 0,332) después de una media de 533 días (DE 438). Además de los signos clínicos compatibles con HC y las pruebas positivas de la función endocrina, se realizó diagnóstico por imagen en 4/13 perros (n = 3 radiografías torácicas y ecografía abdominal, n = 1 tomografía computarizada del cráneo, tórax y abdomen) confirmando metástasis a distancia (n = 3) o anomalías locales sugestivas de rebrote tumoral (n = 1). En dos perros (n = 1 LA, n = 1 OA) se realizó una biopsia hepática durante la cirugía para la evaluación histopatológica de pequeños nódulos visibles durante la laparoscopia y la laparotomía, respectivamente. Se confirmaron metástasis de adenocarcinoma y los signos clínicos de HC volvieron a aparecer después de 3 meses. Los períodos libres de enfermedad no difirieron significativamente entre AL y OA (Figura 2; P = 0,733).
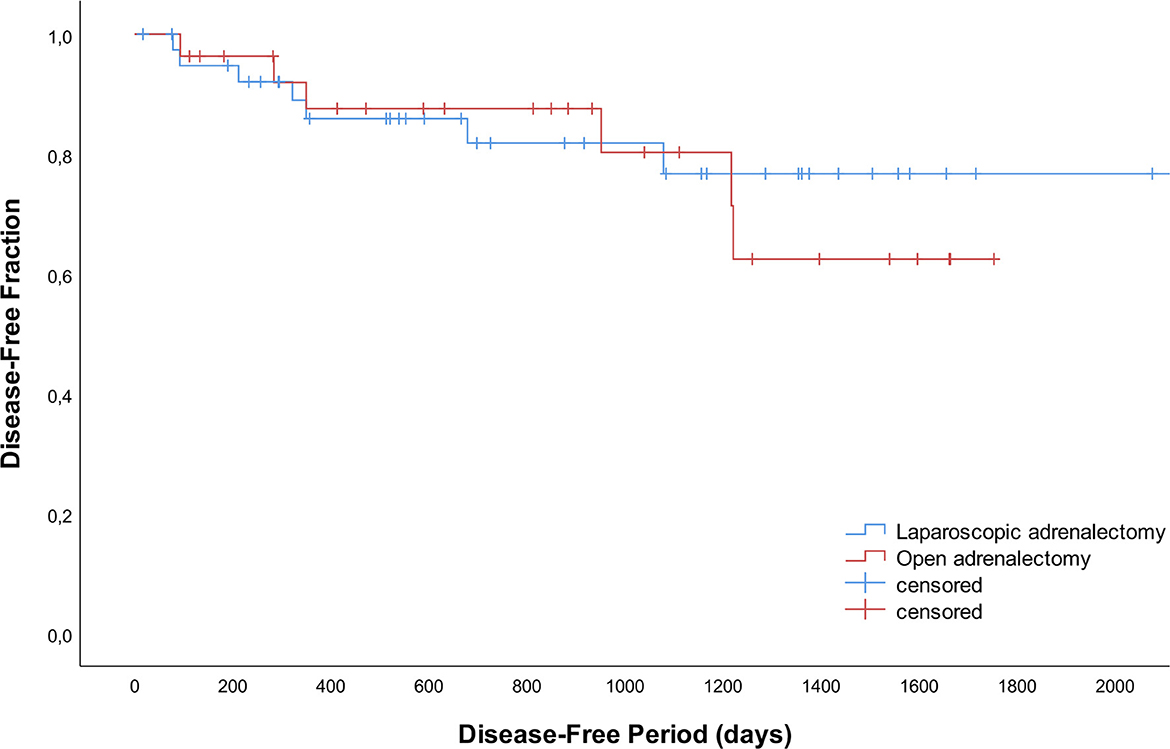 Figura 2. Curvas libres de enfermedad para 42 perros que se sometieron a adrenalectomía laparoscópica y 28 perros que se sometieron a adrenalectomía abierta.
Figura 2. Curvas libres de enfermedad para 42 perros que se sometieron a adrenalectomía laparoscópica y 28 perros que se sometieron a adrenalectomía abierta.
Del grupo total, 42 perros murieron durante el período de estudio, 5 perros se perdieron durante el seguimiento y 23 todavía estaban vivos en el momento de la preparación del manuscrito. Los tiempos de supervivencia no difirieron significativamente entre los grupos AL y OA (P = 0,353). No se alcanzaron los tiempos medios de supervivencia. Las tasas de supervivencia a 1, 2 y 3 años específicas de la enfermedad fueron de 95, 89 y 89 % después de LA y 92, 88 y 81 % después de OA (Figura 3)
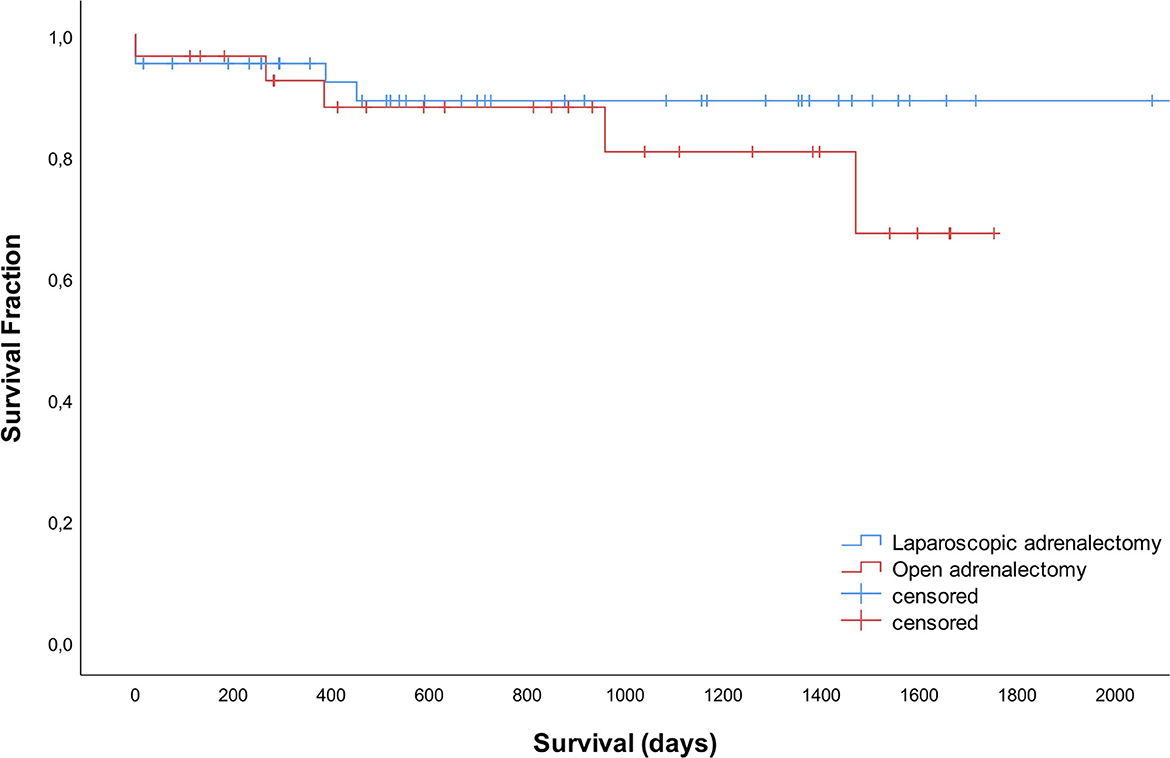 Figura 3. Curvas de supervivencia para 42 perros que se sometieron a adrenalectomía laparoscópica y 28 perros que se sometieron a adrenalectomía abierta.
Figura 3. Curvas de supervivencia para 42 perros que se sometieron a adrenalectomía laparoscópica y 28 perros que se sometieron a adrenalectomía abierta.
Con base en el análisis de regresión univariada, los parámetros peso corporal, dimensión máxima de AT, volumen de AT y duración de la cirugía se introdujeron en un modelo multivariado de regresión de riesgo proporcional de Cox para predecir DFP y el tiempo de supervivencia general. La dimensión AT máxima pareció ser el único predictor negativo significativo (P = 0,001) para DFP y el volumen de AT (P = 0,003) para la supervivencia general.
La invasión vascular fue relativamente rara en los 13 perros en los que se diagnosticó recurrencia, con invasión de la vena cava caudal visible en la tomografía computarizada preoperatoria en dos perros e invasión de la vena frenicoabdominal en un perro. La invasión vascular (P = 0,829) y la penetración capsular perioperatoria (P = 0,725) no fueron más frecuentes en perros con recurrencia. La recurrencia se asoció con mayores volúmenes de TA tanto en LA (P = 0,008) como en OA (P = 0,021), y para todas las adrenalectomías consideradas juntas (P = 0,001). En los 13 perros con recurrencia, la histopatología de la(s) glándula(s) suprarrenal(es) fue consistente con ACC.
En el análisis binomial de regresión logística para predecir las recidivas, se construyó un modelo que incluye los parámetros de dimensión máxima del tumor y diagnóstico histopatológico. El modelo de regresión logística fue estadísticamente significativo, χ2(2) = 26,804; P < 0,001. El modelo explicó 55.6% (Nagelkerke R2) de la varianza en las recurrencias y correctamente clasificado 85,0% de los casos. El aumento de la dimensión máxima del tumor se asoció con una mayor probabilidad de recurrencia, con probabilidades de recurrencia 3,9 más altas por cada cm de aumento en el tamaño máximo de la dimensión tumoral en comparación con el más pequeño.
Dos perros se perdieron durante el seguimiento después del diagnóstico de recurrencia, 2 todavía estaban vivos y 9 murieron. De los perros que murieron, la muerte se relacionó con la recurrencia de HC dependiente de las glándulas suprarrenales en 6/9 perros. Uno de los perros con recurrencia mostró supresión del UCCR después de la dexametasona oral en el momento del diagnóstico inicial, sugestivo de HC hipofisaria-dependiente. Sin embargo, se suprimió la ACTH endógena y los hallazgos de diagnóstico por imágenes fueron consistentes con los AT. En este perro específico, las células ACC metastásicas se demostraron en biopsias de aspiración con aguja fina del hígado 2 años después de la LA bilateral. Además de la recurrencia definida por la reaparición de la endocrinopatía inicial dependiente de las glándulas suprarrenales, se diagnosticó HC dependiente de alimentos en un perro que desarrolló signos clínicos de HC después de la mejoría inicial después de la adrenalectomía unilateral. Otro perro con HC dependiente suprarrenal y ACTH endógena suprimida en el momento del diagnóstico fue diagnosticado con un microtumor hipofisario 1 año después, cuando se presentó nuevamente por signos clínicos de HC. Un perro diagnosticado con un PCC del lado derecho desarrolló un segundo PCC 6 años más tarde en la glándula suprarrenal izquierda que luego se eliminó con éxito por vía laparoscópica. Este perro desarrolló hipertensión sistémica durante la primera cirugía e hipotensión en la segunda a pesar de que se utilizó un protocolo anestésico comparable. Por último, otro perro desarrolló una segunda IA en la glándula suprarrenal contralateral 1,5 años después de la adrenalectomía, que no se extirpó quirúrgicamente.
4. Discusión
Nuestra gran serie de casos retrospectivos revela altas tasas de éxito de LA y OA en perros con TA funcionales u hormonalmente silenciosos. Además, la AL bilateral demostró ser una opción de tratamiento exitosa en perros con HC debido a neoplasia suprarrenal bilateral y en perros con TA unilateral con HC hipofisaria dependiente concurrente. En línea con los datos anteriores, la recurrencia de endocrinopatías dependientes de las glándulas suprarrenales se produjo en una minoría de perros. En los perros con TA más grandes, la recurrencia fue más común, y tanto la DFP como el tiempo de supervivencia disminuyeron; una correlación que no se ha descrito anteriormente.
La adrenalectomía laparoscópica a través de un enfoque de flanco en la decúbito esternal se asoció en nuestra serie de casos con una tasa de conversión baja (6,6%) a OA y una tasa de complicaciones muy baja. La baja tasa de conversión puede estar relacionada en parte con la mejora del acceso quirúrgico a las glándulas suprarrenales debido a los portales de flanco relativamente posicionados dorsalmente y la posición esternal del paciente con abdomen colgante, moviendo los otros órganos abdominales fuera del campo quirúrgico. Además, este enfoque facilitó el éxito de la AL bilateral sin reposicionar o volver a cubrir al paciente.
Contrariamente a los datos previamente reportados (10, 16), el presente estudio no reveló diferencias significativas en la duración quirúrgica entre AL y OA en nuestra institución. La duración quirúrgica depende en gran medida de las habilidades técnicas y la experiencia con la técnica; Es beneficioso que este procedimiento laparoscópico complejo no haya dado lugar a una mayor duración quirúrgica. Se demostró un sesgo de selección por el tamaño significativamente mayor de AT en OA y perros con invasión vascular, que podría llevar más tiempo eliminar. Sin embargo, fue posible eliminar con éxito los TA por vía laparoscópica en perros de tamaño comparable al del grupo de OA, con el perro más pequeño tratado laparoscópicamente pesando solo 6,5 kg. En ambas técnicas, la duración de la adrenalectomía del lado derecho fue significativamente más larga que para la adrenalectomía del lado izquierdo, lo que puede explicarse por la anatomía más compleja de la glándula suprarrenal derecha, incluida su ubicación más oculta entre el hígado y el riñón y su adherencia a la vena cava (9, 11). La proporción de AL del lado derecho en nuestro estudio (49% de los procedimientos unilaterales) es relativamente alta en comparación con los informes anteriores (29-39% de LA del lado derecho) que podrían haber prolongado la duración quirúrgica media que resulta en una duración comparable a la OA. Si bien la diferencia real en los días de hospitalización fue pequeña, fue significativamente más corta después de LA en nuestra cohorte de perros.
Este estudio no reveló diferencias en la ocurrencia de hipertensión sistémica o hipotensión durante AL y OA, lo que contrasta con el estudio de Taylor et al. (10). En ese estudio, se encontró una diferencia con respecto a la hipotensión intraoperatoria, ocurriendo en 14.3 y 61.5% de los perros durante LA y OA, respectivamente, mientras que en el presente estudio la hipotensión ocurrió en respectivamente 4.9 y 14% de los perros. Esto podría estar relacionado con la duración quirúrgica similar en ambos grupos en nuestro estudio, lo que implica una duración comparable de la exposición a agentes anestésicos inhalantes con posibles efectos reductores de la presión arterial (32, 33). En general, CO2 La insuflación durante la cirugía abdominal laparoscópica se ha asociado con presión arterial elevada (34, 35). Sin embargo, con CO intraabdominal2 presión establecida en 8 mm Hg, no se encontraron diferencias en la hipertensión sistémica persistente o hipertensión limítrofe durante LA o OA en nuestro estudio. Se han reportado complicaciones anestésicas que incluyen hipertensión sistémica severa específicamente durante la extirpación del CCP (36). En nuestro estudio, la hipertensión sistémica y la hipertensión limítrofe se documentaron en solo 1/8 y 2/8 perros con PCC, respectivamente. En nuestro hospital, todos los perros con PCC confirmado o altamente sospechoso son tratados con fenoxibenzamina antes de la operación. Con base en los resultados de un estudio reciente, se podría debatir si el pretratamiento con este medicamento es beneficioso, ya que los episodios hipertensivos ocurrieron en 46/53 perros con PCC, de los cuales 37 fueron tratados con un alfabloqueante antes de la cirugía (37). Sin embargo, los números de ese estudio podrían estar influenciados por la definición utilizada de hipertensión sistémica, ya que se definió como una presión arterial sistólica >160 mm Hg sin especificación de duración de elevación y / o métodos de medición. La presión arterial durante la cirugía puede verse afectada por factores intrínsecos y extrínsecos, incluidos los efectos de la manipulación quirúrgica y los fármacos anestésicos sobre el retorno venoso, el gasto cardíaco y la resistencia vascular sistémica, dependiendo también de la profundidad anestésica y la nocicepción intraoperatoria. Desafortunadamente, no existe consenso para los valores de corte que definen la hipertensión sistémica durante la anestesia en perros. Se ha sugerido que la hipertensión aguda podría ser preocupante cuando la PAM excede los 140 mm Hg o la PAE excede los 180 mm Hg, o en la hipertensión crónica cuando la PAM excede los 120 y/o la PAE excede los 160 mm Hg (38). La opinión de los expertos sostiene que estos valores son solo sugerencias, y que las decisiones sobre el tratamiento deben basarse en la confiabilidad y repetibilidad de la medición, la etapa del procedimiento quirúrgico, la naturaleza persistente y la magnitud de los trastornos de la presión arterial y las posibles consecuencias adversas del tratamiento propuesto (38). Los cursos individuales de presión arterial documentados en el estudio actual, incluidos episodios cortos de hipertensión, hipertensión inicial con hipotensión posterior y la aparición de hipertensión en la primera, pero hipotensión en la segunda cirugía en el mismo paciente, subrayan la importancia de la monitorización y el manejo de la presión arterial por un anestesista bien entrenado, en cada perro durante la adrenalectomía.
La recurrencia de la enfermedad endocrina dependiente de las glándulas suprarrenales fue más común después de la extirpación de tumores más grandes. Las posibles explicaciones de esta correlación son un procedimiento más complejo y la posible extirpación incompleta o derrame tumoral, pero también un desarrollo tumoral más avanzado que resulta en metástasis que no se descubrieron durante el cribado preoperatorio. No se demostró ningún efecto significativo sobre la DFP o la recidiva de otros parámetros perioperatorios, incluido el abordaje quirúrgico, la invasión tumoral vascular, el lado de la lesión y la penetración capsular perioperatoria. El perro con recidiva y HC supresor de dexametasona presente en el momento del diagnóstico subraya la importancia de incluir imágenes hipofisarias y medición de ACTH endógena en plasma para evitar el diagnóstico erróneo de HC hipofisaria dependiente en perros con adrenomegalia bilateral.
La invasión en la vasculatura u otros tejidos se considera consistente con malignidad. Sin embargo, en el presente estudio la invasión vascular poblacional no fue más frecuente en tumores con un diagnóstico histopatológico morfológico de carcinoma vs. adenoma. Además, el tamaño del tumor >2 cm se informa como una característica específica para ACC, sin embargo, en este estudio la dimensión tumoral máxima excedió los 2 cm en 14/18 perros diagnosticados con ACA en histopatología. En los seres humanos, la extirpación quirúrgica de un ACA resultó en un mejor pronóstico que después de la extirpación quirúrgica de un ACC (39). Por el contrario, los parámetros histopatológicos morfológicos en perros no se han relacionado con la supervivencia después de la eliminación de los TA funcionales (5, 6, 40). En el presente estudio, todos los perros con recurrencia tenían un diagnóstico histopatológico de ACC; Sin embargo, en otros 23 perros diagnosticados con carcinoma, no se informó recurrencia. En este contexto, es importante señalar que con la histopatología, la diferenciación definitiva entre ACC y ACA es difícil en esta especie y esto puede haber influido en las discrepancias en las correlaciones con la invasión vascular y el tamaño del tumor. La misma discrepancia podría haber estado presente en el perro con HC concurrente dependiente de la hipófisis y la hipófisis, en la que la histopatología de la presunta suprarrenal hiperplásica fue consistente con el ACC. Los parámetros reportados para diferenciar el ACC de la ACA en perros son algo controvertidos e incluyen fibrosis periférica, invasión capsular, patrón de crecimiento trabecular, hemorragia, necrosis, necrosis unicelular, hematopoyesis, trombos de fibrina, vacuolación citoplasmática y aumento del índice de proliferación evaluado por inmunohistoquímica para el antígeno Ki67 (2, 11, 12, 30). Más recientemente, se demostró que la puntuación de Utrecht es útil para distinguir perros con TCA secretoras de cortisol con una supervivencia más corta después de la adrenalectomía (29). Parece válido incluir tales marcadores de malignidad en la evaluación de los TA después de la extirpación quirúrgica, lo que indica la necesidad de estudios adicionales para investigar la correlación exacta con la recurrencia en grupos más grandes de perros.
Además de la recurrencia de la endocrinopatía dependiente suprarrenal, en este estudio se descubrió HC natural dependiente de alimentos y hipófisis. Por lo tanto, es importante seguir la vía diagnóstica como para la enfermedad primaria, para evitar el diagnóstico incorrecto de la enfermedad metastásica en lugar de estos escenarios fisiopatológicos alternativos. Dos perros desarrollaron un segundo PCC y AI en la glándula suprarrenal contralateral, respectivamente. Estos se interpretan como nuevas ocurrencias de tumores; sin embargo, no se puede excluir la posibilidad teórica de enfermedad metastásica. Como los IA pueden ser un hallazgo incidental durante las imágenes abdominales para otras indicaciones que no sean la enfermedad endocrina, se necesitan imágenes postoperatorias repetidas para diagnosticar adecuadamente la recurrencia en estos perros; Por lo tanto, los casos individuales de recurrencia podrían haberse pasado por alto en perros sin signos clínicos.
El estudio actual proporciona información sobre la recurrencia de la enfermedad endocrina tanto en ACT como en PCC. Se informa que los feocromocitomas son más propensos a la invasión de la vena cava y menos susceptibles de extirpación laparoscópica (10, 41). Sin embargo, en el presente estudio 5/8 PCC se eliminaron con éxito mediante un enfoque laparoscópico. Además, no se diagnosticó enfermedad metastásica después de la adrenalectomía en ninguno de los perros con PCC. Por el contrario, los TCA se describen como menos malignos que el CCP, con metástasis a distancia reportadas en solo el 5-14% de los casos (4, 5, 16, 40), mientras que en el estudio actual se demostró recurrencia en el 22% de los perros dados de alta con neoplasia cortical.
En el presente estudio, los propietarios de varios perros diagnosticados con IA informaron polidipsia en la presentación. La polidipsia puede ser primaria o secundaria a mecanismos desconocidos inducidos por la IA que conducen a la poliuria. En varios perros, la polidipsia se resolvió después de la adrenalectomía, sin embargo, debido a la naturaleza retrospectiva de este estudio, no se sabe si esto se aplicó a todos los perros con IA. En nuestro estudio, los perros fueron diagnosticados con IA si no cumplían con los criterios descritos para PCC, HC o hiperaldosteronismo. Sin embargo, esto no implica que estos TA fueran verdaderos tumores silenciosos, es decir, no secretores de hormonas. Los dos perros con ACTH endógena suprimida y glándulas suprarrenales contralaterales de menor tamaño podrían haber sido ejemplos de secretores de precursores corticoides distintos del cortisol, que no se midieron en los ensayos de laboratorio disponibles. Por lo tanto, se necesitan más estudios para investigar el origen exacto y los efectos endocrinos de la IA en perros. En nuestra institución, todos los perros diagnosticados con IA son tratados con glucocorticoides perioperatoriamente, mientras que estos perros no muestran un exceso manifiesto de cortisol durante el estudio preoperatorio como se define para HC. Con esta estrategia se evita cualquier riesgo de deficiencia de corticoides, lo que podría ser relevante en casos de secreción de precursores corticoides, sin embargo, podría ser innecesario en otros perros. La prueba postoperatoria de estimulación con ACTH podría ser útil para diferenciar entre estos escenarios, pero requiere más estudio.
La supervivencia a largo plazo de los perros en el estudio actual no difirió entre los perros después de LA o OA, lo que está en línea con una publicación anterior (10). La mayoría de los estudios disponibles no compararon el seguimiento a largo plazo entre AL y OA. Para ambas técnicas de adrenalectomía combinadas, se informan tasas de supervivencia a 1 y 2 años de 77-83% y 60-76% (10, 15, 17). En el estudio actual se demostraron porcentajes aún más altos de 95% y 89% después de LA y 92% y 88% después de OA, lo que respalda la conclusión de una alta tasa de éxito general de adrenalectomía en perros.
La principal limitación de este estudio fue su naturaleza retrospectiva con discrepancias asociadas en el diagnóstico preoperatorio. En los 14 años cubiertos en este estudio, la disponibilidad de pruebas de función endocrina y análisis hormonales varió, lo que llevó a la falta de parámetros en un pequeño número de perros. Además, debido a las preferencias del propietario, no se realizaron imágenes diagnósticas en todos los perros diagnosticados con recurrencia en función de los signos clínicos y las pruebas de función endocrina.
En conclusión, la AL se puede realizar con éxito en perros de varios tamaños si se considera la selección adecuada de casos y no se asocia con una disminución de la supervivencia o recurrencia perioperatoria y a largo plazo. Sobre la base de la baja tasa de complicaciones perioperatorias, el corto tiempo de hospitalización y el resultado comparable a largo plazo en comparación con los perros tratados con OA, el enfoque laparoscópico menos invasivo se considera la técnica preferida siempre que sea posible. Se debe considerar un mayor riesgo de recurrencia en TA más grandes para ambas técnicas.
Declaración de disponibilidad de datos
Los datos brutos que apoyan las conclusiones de este artículo serán puestos a disposición por los autores, sin reservas indebidas.
Declaración ética
No se requirió revisión ética y aprobación para el estudio en animales porque todos los datos reportados en este manuscrito se basaron en perros propiedad del cliente que fueron tratados en nuestro hospital por su(s) tumor(es) suprarrenal(es); No se realizaron procedimientos adicionales ni pruebas diagnósticas. Se obtuvo el consentimiento informado por escrito de los propietarios para la participación de sus animales en este estudio. Se obtuvo el consentimiento informado por escrito de la(s) persona(s) para la publicación de cualquier imagen o dato potencialmente identificable incluido en este artículo.
Contribuciones del autor
KB, SG, HK y SN contribuyeron a la concepción y diseño del estudio. KB, SG y SN organizaron la base de datos. ET y KB realizaron el análisis estadístico. KB escribió el primer borrador del manuscrito. JG, GG, ET y SN escribieron secciones del manuscrito. Todos los autores contribuyeron a la revisión del manuscrito, leyeron y aprobaron la versión presentada.
Conflicto de intereses
KB es empleado de IVC Evidensia.
Los autores restantes declaran que la investigación se realizó en ausencia de cualquier relación comercial o financiera que pudiera interpretarse como un posible conflicto de intereses.
Nota del editor
Todas las afirmaciones expresadas en este artículo son únicamente las de los autores y no representan necesariamente las de sus organizaciones afiliadas, o las del editor, los editores y los revisores. Cualquier producto que pueda ser evaluado en este artículo, o reclamo que pueda ser hecho por su fabricante, no está garantizado ni respaldado por el editor.
Referencias
1. Behrend EN. «Non-Cortisol-Secreting Adrenocortical Tumors and Incidentalomas». En:Ettinger S, Feldman E, Cote E, , editors Textbook of Veterinary Internal Medicine, 8th Edn. St. Louis, MO: Elsevier (2017), p. 1819–24.
2. Cook AK, Spaulding KA, Edwards JF. Hallazgos clínicos en perros con lesiones incidentales de la glándula suprarrenal determinadas por ecografía: 151 casos (2007-2010). J Am Vet Med Assoc. (2014) 244:1181–5. doi: 10.2460/javma.244.10.1181
Resumen de PubMed | Texto completo de CrossRef | Google Académico
3. Baum JI, Boston SE, Case JB. Prevalencia de masas de glándulas suprarrenales como hallazgos incidentales durante la tomografía computarizada abdominal en perros: 270 casos (2013-2014). J Am Vet Med Assoc. (2016) 249:1165–9. doi: 10.2460/javma.249.10.1165
Resumen de PubMed | Texto completo de CrossRef | Google Académico
4. Kyles AE, Feldman EC, De Cock HEV, Kass PH, Mathews KG, Hardie EM, et al. Manejo quirúrgico de tumores de glándulas suprarrenales con y sin trombos tumorales asociados en perros: 40 casos (1994-2001). J Am Vet Med Assoc. (2003) 223:654–62. doi: 10.2460/javma.2003.223.654
Resumen de PubMed | Texto completo de CrossRef | Google Académico
5. Schwartz P, Kovak JR, Koprowski A, Ludwig LL, Monette S, Bergman PJ. Evaluación de los factores pronósticos en el tratamiento quirúrgico de los tumores de la glándula suprarrenal en perros: 41 casos (1999-2005). J Am Vet Med Assoc. (2008) 232:77–84. doi: 10.2460/javma.232.1.77
Resumen de PubMed | Texto completo de CrossRef | Google Académico
6. Lang JM, Schertel E, Kennedy S, Wilson D, Barnhart M, Danielson B. Elective and emergency surgical management of adrenal gland tumors: 60 cases (1999-2006). J Am Anim Hosp Assoc. (2011) 47:428–35. doi: 10.5326/JAAHA-MS-5669
Resumen de PubMed | Texto completo de CrossRef | Google Académico
7. Massari F, Nicoli S, Romanelli G, Buracco P, Zini E. Adrenalectomía en perros con tumores de la glándula suprarrenal: 52 casos (2002–2008). J Am Vet Med Assoc. (2011) 239:216–21. doi: 10.2460/javma.239.2.216
Resumen de PubMed | Texto completo de CrossRef | Google Académico
8. Barrera JS, Bernard F, Ehrhart EJ, Withrow SJ, Monnet E. Evaluación de los factores de riesgo para el resultado asociado con tumores de la glándula suprarrenal con o sin invasión de la vena cava caudal y tratados mediante adrenalectomía en perros: 86 casos (1993-2009). J Am Vet Med Assoc. (2013) 242:1715–21. doi: 10.2460/javma.242.12.1715
Resumen de PubMed | Texto completo de CrossRef | Google Académico
9. Adin CA, Nelson RW. «Glándulas suprarrenales». En:Johnston SA, Tobias KM, , editores. Cirugía Veterinaria: Animal Pequeño, 2ª ed. St. Louis, MO: Elsevier (2018), p. 2281–91
10. Taylor CJ, Monnet E. Una comparación de los resultados entre las adrenalectomías laparoscópicas y abiertas en perros. Veterinario Surg. (2021) 50:99–107. DOI: 10.1111/VSU.13565
Resumen de PubMed | Texto completo de CrossRef | Google Académico
11. Hayes G. Actualización sobre la adrenalectomía. Veterinario Clin North am Small Anim Pract. (2022) 52:473–87. doi: 10.1016/j.cvsm.2021.12.005
Resumen de PubMed | Texto completo de CrossRef | Google Académico
12. Pagani E, Tursi M, Lorenzi C, Tarducci A, Bruno B, Borgogno Mondino EC, et al. Las características ultrasonográficas de las lesiones de la glándula suprarrenal en perros pueden ayudar en el diagnóstico. BMC Vet Res. (2016) 12:267. DOI: 10.1186/S12917-016-0895-1
Resumen de PubMed | Texto completo de CrossRef | Google Académico
13. Naan EC, Kirpensteijn J, Dupré GP, Galac S, Radlinsky MG. Enfoque innovador para la adrenalectomía laparoscópica para el tratamiento de tumores unilaterales de la glándula suprarrenal en perros. Veterinario Surg. (2013) 42:710–5. doi: 10.1111/j.1532-950X.2013.12029.x
Resumen de PubMed | Texto completo de CrossRef | Google Académico
14. Jiménez Peláez M, Bouvy BM, Dupré GP. Adrenalectomía laparoscópica para el tratamiento de carcinomas adrenocorticales unilaterales: técnica, complicaciones y resultados en siete perros. Veterinario Surg. (2008) 37:444–53. doi: 10.1111/j.1532-950X.2008.00410.x
15. Pitt KA, Mayhew PD, Steffey MA, Culp WTN, Fuller MC, Della Maggiore A, et al. Laparoscopic adrenalectomy for removal of unilateral noninvasive pheochromocytomas in 10 dogs. Vet Surg. (2016) 45:O70–6. doi: 10.1111/vsu.12552
16. Mayhew PD, Culp WTN, Hunt GB, Steffey MA, Mayhe KN, Fulle M, et al. Comparación de las tasas de morbilidad y mortalidad perioperatorias en perros con masas adrenocorticales no invasivas sometidas a adrenalectomía laparoscópica versus abierta. J Am Vet Med Assoc. (2014) 245:1028–35. doi: 10.2460/javma.245.9.1028
Resumen de PubMed | Texto completo de CrossRef | Google Académico
17. Cavalcanti JVJ, Skinner OT, Mayhew PD, Colee JC, Boston SE. Resultado en perros sometidos a adrenalectomía para pequeños tumores de la glándula suprarrenal sin invasión vascular. Veterinario Comp Oncol. (2020) 18:599–606. DOI: 10.1111/vco.12587
Resumen de PubMed | Texto completo de CrossRef | Google Académico
18. Miller BS, Ammori JB, Gauger PG, Broome JT, Hammer GD, Doherty GM. La resección laparoscópica es inadecuada en pacientes con carcinoma adrenocortical conocido o presunto. Mundo J Surg. (2010) 34:1380–5. DOI: 10.1007/S00268-010-0532-2
Resumen de PubMed | Texto completo de CrossRef | Google Académico
19. Miller BS, Gauger PG, Hammer GD, Doherty GM. La resección del carcinoma de corteza suprarrenal es menos completa y la recidiva local ocurre antes y con más frecuencia después de la adrenalectomía laparoscópica que después de la adrenalectomía abierta. Cirugía. (2012) 152:1150–7. doi: 10.1016/j.surg.2012.08.024
Resumen de PubMed | Texto completo de CrossRef | Google Académico
20. Autorino R, Bove P, De Sio M, Miano R, Micali S, Cindolo L, et al. Adrenalectomía abierta versus laparoscópica para el carcinoma de corteza suprarrenalina: un metanálisis de los resultados quirúrgicos y oncológicos. Ann Surg Oncol. (2016) 23:1195–202. DOI: 10.1245/S10434-015-4900-X
Resumen de PubMed | Texto completo de CrossRef | Google Académico
21. Behrend EN, Kooistra HS, Nelson R, Reusch CE, Scott-Moncrieff JC. Diagnóstico de hiperadrenocorticismo canino espontáneo: declaración de consenso ACVIM 2012 (animal pequeño). J Vet Pasante Med. (2013) 27:1292–304. DOI: 10.1111/JVIM.12192
Resumen de PubMed | Texto completo de CrossRef | Google Académico
22. van Bokhorst KL, Kooistra HS, Boroffka SAEB, Galac S. Concurrent pituitaria and adrenocortical lesions on computed tomography imaging in dogs with spontaneous hypercortisolism. J Vet Pasante Med. (2019) 33:72–8. DOI: 10.1111/JVIM.15378
Resumen de PubMed | Texto completo de CrossRef | Google Académico
23. Javadi S, Galac S, Boer P, Robben JH, Teske E, Kooistra HS. Proporciones de aldosterona a renina y cortisol a hormona adrenocorticotrópica en perros sanos y perros con hipoadrenocorticismo primario. J Vet Pasante Med. (2006) 20:556–61. doi: 10.1111/j.1939-1676.2006.tb02896.x
Resumen de PubMed | Texto completo de CrossRef | Google Académico
24. van den Berg MF, Kooistra HS, Grinwis GCM, van Nimwegen SA, van Faassen M, Kema IP, et al. Intervalos de referencia para concentraciones plasmáticas, urinarias y salivales de metanefrinas libres en perros: relevancia para el diagnóstico de feocromocitoma. J Vet Pasante Med. (2023) 37:173–86. DOI: 10.1111/JVIM.16624
Resumen de PubMed | Texto completo de CrossRef | Google Académico
25. Del Magno S, Grinwis GCM, Voorhout G, Meij BP. Tomografía computarizada dinámica de la glándula pituitaria utilizando un escáner de corte único en perros con hipercortisolismo dependiente de la hipófisis. Res Vet Sci. (2016) 107:42–9. doi: 10.1016/j.rvsc.2016.04.005
Resumen de PubMed | Texto completo de CrossRef | Google Académico
26. Acierno MJ, Brown S, Coleman AE, Jepson RE, Papich M, Stepien RL, et al. ACVIM consensus statement: Guidelines for the identification, evaluation, and management of systemic hypertension in dogs and cats. J Vet Pasante Med. (2018) 32:1803–22. DOI: 10.1111/JVIM.15331
Resumen de PubMed | Texto completo de CrossRef | Google Académico
27. Mayhew PD, Araya FJL, Kirpensteijn J. «Laparoscopic adrenalectomy». En:Fransson BA, Mayhew PD, , editores. Laparoscopia y toracoscopia de animales pequeños, 2nd edn. Hoboken, NJ: John Wiley & Sons (2022), p. 199–213.
28. van Nimwegen SA, Buishand FO, Kirpensteijn J. «Laparoscopic Surgery of the Pancreas». En:En Fransson BA, Mayhew PD, , editores. Laparoscopia y toracoscopia de animales pequeños, 2nd edn. Hoboken, NJ: John Wiley & Sons (2022), p. 156–66
29. Sanders K, Cirkel K, Grinwis GCM, Teske E, van Nimwegen SA, Mol JA, et al. La puntuación de Utrecht: un novedoso sistema de puntuación histopatológica para evaluar el pronóstico de perros con tumores adrenocorticales secretores de cortisol. Veterinario Comp Oncol. (2019) 17:329–37. DOI: 10.1111/vco.12474
Resumen de PubMed | Texto completo de CrossRef | Google Académico
30. Labelle P, Kyles AE, Farver TB, De Cock HE V. Indicadores de malignidad de tumores adrenocorticales caninos: histopatología e índice de proliferación. Veterinario Pathol. (2004) 41:490–7. DOI: 10.1354/VP.41-5-490
Resumen de PubMed | Texto completo de CrossRef | Google Académico
31. Galac S, Korpershoek E. Feocromocitomas y paragangliomas en humanos y perros. Veterinario Comp Oncol. (2017) 15:1158–70. DOI: 10.1111/vco.12291
Resumen de PubMed | Texto completo de CrossRef | Google Académico
32. Gaynor J, Dunlop C, Wagner A, Wertz E, Golden A, Demme W. Complications and mortality associated with anesthesia in dogs and cats. J Am Anim Hosp Assoc. (1999) 35:13–7. doi: 10.5326/15473317-35-1-13
Resumen de PubMed | Texto completo de CrossRef | Google Académico
33. Iizuka T, Kamata M, Yanagawa M, Nishimura R. Incidence of intraoperative hypotension during isoflurane-fentanyl and propofol-fentanyl anaesthesia in dogs. Veterinario J. (2013) 198:289–91. doi: 10.1016/j.tvjl.2013.06.021
Resumen de PubMed | Texto completo de CrossRef | Google Académico
34. Gerges FJ, Kanazi GE, Jabbour-Khoury SI. Anestesia para laparoscopia: una revisión. J Clin Anesth. (2006) 18:67–78. doi: 10.1016/j.jclinane.2005.01.013
Resumen de PubMed | Texto completo de CrossRef | Google Académico
35. Kim H. Pneumoperitoneum in laparoscopy and preoperative antihypertensive agents: A retrospective study. Exp Ther Med. (2019) 18:4517–22. doi: 10.3892/etm.2019.8076
Resumen de PubMed | Texto completo de CrossRef | Google Académico
36. Herrera MA, Mehl ML, Kass PH, Pascoe PJ, Feldman EC, Nelson RW. Factores predictivos y el efecto de la fenoxibenzamina sobre el resultado en perros sometidos a adrenalectomía por feocromocitoma. J Vet Pasante Med. (2008) 22:1333–9. doi: 10.1111/j.1939-1676.2008.0182.x
Resumen de PubMed | Texto completo de CrossRef | Google Académico
37. Enright D, Dickerson VM, Grimes JA, Townsend S, Thieman Mankin KM. Supervivencia a corto y largo plazo después de la adrenalectomía en 53 perros con feocromocitomas con o sin terapia con alfabloqueantes. Veterinario Surg. (2022) 51:438–46. DOI: 10.1111/VSU.13771
Resumen de PubMed | Texto completo de CrossRef | Google Académico
38. Haskins S. «Monitoring Anesthetized Patients». En:Grimm KA, Lamont LA, Tranquilli WJ, Greene SA, Robertson SA, , editores. Lumb and Jones Veterinary Anesthesia and Analgesia, 5th Edn. Hoboken, NJ: Wiley-Blackwell (2015), p 86–113.
39. Bilimoria KY, Shen WT, Elaraj D, Bentrem DJ, Winchester DJ, Kebebew E, et al. Carcinoma de corteza suprarrenal en los Estados Unidos: utilización del tratamiento y factores pronósticos. Cáncer. (2008) 113:3130–6. DOI: 10.1002/CNCR.23886
Resumen de PubMed | Texto completo de CrossRef | Google Académico
40. Anderson CR, Birchard SJ, Powers BE, Belandria GA, Kuntz CA, Withrow SJ, et al. Tratamiento quirúrgico de tumores adrenocorticales: 21 casos (1990-1996). J Am Anim Hosp Assoc. (2001) 37:93–7. doi: 10.5326/15473317-37-1-93
Resumen de PubMed | Texto completo de CrossRef | Google Académico
41. Mayhew PD, Boston SE, Zwingenberger AL, Giuffrida MA, Runge JJ, Holt DE, et al. Morbilidad y mortalidad perioperatoria en perros con neoplasias suprarrenales invasivas tratadas mediante adrenalectomía y cavotomía. Veterinario Surg. (2019) 48:742–50. DOI: 10.1111/VSU.13221
Resumen de PubMed | Texto completo de CrossRef | Google Académico
Palabras clave: hiperadrenocorticismo, hipercortisolismo, feocromocitoma, incidentaloma, recurrencia, hipertensión, hipotensión
Cita: van Bokhorst KL, Galac S, Kooistra HS, de Grauw JC, Teske E, Grinwis GCM y van Nimwegen SA (2023) Adrenalectomía laparoscópica vs. abierta: datos perioperatorios y análisis de supervivencia en 70 perros con un tumor suprarrenal. Frente. Vet. Sci. 10:1156801. doi: 10.3389/fvets.2023.1156801
Recibido: 01 Febrero 2023; Aprobado: 25 de julio de 2023;
Publicado: 16 agosto 2023.
Editado por:
Paolo Emidio Crisi, Universidad de Teramo, Italia
Revisado por:
Sara Del Magno, Universidad de Bolonia, Italia
Julianna Thuroczy, Gamma-Vet Ltd., Hungría
Álan Pöppl, Universidad Federal de Rio Grande do Sul, Brasil
Copyright © 2023 van Bokhorst, Galac, Kooistra, de Grauw, Teske, Grinwis y van Nimwegen. Este es un artículo de acceso abierto distribuido bajo los términos de la Licencia de Atribución Creative Commons (CC BY).
*Correspondencia: Sebastiaan A. van Nimwegen, s.a.vannimwegen@uu.nl
Renuncia: Todas las afirmaciones expresadas en este artículo son únicamente las de los autores y no representan necesariamente las de sus organizaciones afiliadas, o las del editor, los editores y los revisores. Cualquier producto que pueda ser evaluado en este artículo o reclamo que pueda ser hecho por su fabricante no está garantizado ni respaldado por el editor.
Date de alta y recibe nuestro 👉🏼 Diario Digital AXÓN INFORMAVET ONE HEALTH
Date de alta y recibe nuestro 👉🏼 Boletín Digital de Foro Agro Ganadero
Noticias animales de compañía
Noticias animales de producción
Trabajos técnicos animales de producción
Trabajos técnicos animales de compañía

