Alivio del dolor en caballos maduros con osteoartritis después de la administración de aceite de cannabidiol
Mejora de la calidad de vida y alivio del dolor en caballos maduros con osteoartritis después de la administración de aceite de cannabidiol transmucoso oral como parte de un régimen analgésico
 Claudia Interlandi1
Claudia Interlandi1  Marco Tabbì1
Marco Tabbì1  Simona Di Pietro1
Simona Di Pietro1  Fabiola D’Angelo2
Fabiola D’Angelo2  Giovanna L. Costa1*
Giovanna L. Costa1*  Francesca Arfuso1
Francesca Arfuso1  Elisabetta Giudice1
Elisabetta Giudice1  Patrizia Licata1
Patrizia Licata1  Daniele Macrì3
Daniele Macrì3  Rosalía Crupi1
Rosalía Crupi1  Enrico Gugliandolo1
Enrico Gugliandolo1- 1Departamento de Ciencias Veterinarias, Universidad de Messina, Messina, Italia
- 2Freelancer, Varese, Italia
- 3Instituto Zooprofiláctico, Palermo, Italia
El objetivo de este estudio fue evaluar el efecto de la administración oral de cannabidiol (CBD) además de un protocolo analgésico convencional sobre los signos clínicos de 20 caballos con artrosis articular leve. Los caballos fueron asignados aleatoriamente al grupo de control (grupo C) o al grupo de cannabidiol (grupo CBD). Ambos grupos fueron tratados con fenilbutazona durante 5 días. El grupo de CBD recibió 0,03 mg/kg de cannabidiol en aceite de cáñamo por vía oral una vez al día durante 14 días, además del tratamiento con fenilbutazona. A todos los sujetos se les monitorizaron los parámetros clínicos, el estado oxidativo y los hemogramas. El dolor y la calidad de vida también se evaluaron mediante la Escala de Dolor Crónico del Caballo (HCPS). El grupo de CBD mostró una reducción significativa de la frecuencia cardíaca, la frecuencia respiratoria, el recuento de glóbulos blancos y el estrés oxidativo (peroxidación lipídica de malondialdehído). Se observó una reducción significativa en las puntuaciones de HCPS en ambos grupos. Se registraron puntuaciones más bajas en el grupo CBD (3 med; rango: 2/4) que en el grupo C (7 med; rango: 4/10). La adición de un producto a base de cannabidiol a un protocolo analgésico fue bien tolerada y mostró efectos positivos en los sujetos tratados, mejorando su calidad de vida y aliviando el dolor.
1 Introducción
El uso terapéutico del cannabidiol (CBD) es cada vez más popular, probablemente debido a su percepción como un tratamiento natural entre los dueños de mascotas (1). Varios estudios han demostrado que el CBD reduce la producción de citoquinas inflamatorias, lo que ayuda a reducir la inflamación en varios tejidos del cuerpo y puede tener un efecto calmante en los caballos (2, 3). La osteoartritis (OA) es una afección progresiva también conocida como enfermedad degenerativa de las articulaciones. Es un trastorno musculoesquelético importante, que causa reducción de la movilidad y reticencia a moverse, afecta a muchas especies y es particularmente frecuente en caballos (4-6). Estos trastornos (artritis degenerativa, artrosis de la articulación metacarpiano/metatarsofalángica, articulaciones interfalángicas, trastornos de las pezuñas, lesiones vertebrales, espinas besadoras, osteofitos periarticulares, sinovitis) pueden dar lugar a complicaciones reales con disminución del bienestar. Los caballos tienden a ser reacios a ser manipulados, no están dispuestos a moverse y muestran signos de dolor (cojera). Estos trastornos resultan en pérdidas económicas para los propietarios de caballos. El manejo terapéutico incluye tratamientos tópicos, inyecciones intraarticulares y analgésicos sistémicos y terapias antiinflamatorias (7). Los medicamentos antiinflamatorios no esteroideos (AINE), como la fenilbutazona, se usan comúnmente para tratar el dolor artrítico, pero no se recomienda su uso a largo plazo debido a los posibles efectos secundarios de estos medicamentos, como anorexia, irritación gástrica, úlcera péptica, nefrotoxicidad, hepatotoxicidad y enfermedades hematológicas (8-10). Como resultado, se buscan constantemente terapias alternativas y a menudo se proponen nuevos tratamientos. El sistema endocannabinoide (SEC) es un sistema de comunicación intercelular encargado de regular los procesos fisiológicos en el organismo y promover la homeostasis. El uso médico de los cannabinoides, en particular de los fitocannabinoides, ha sido uno de los enfoques farmacoterapéuticos más interesantes de los últimos años (11). La planta de cannabis (Cannabis sativa L.), miembro de la familia Cannabaceae, produce numerosos compuestos, incluidos terpenos, flavonoides, ácidos fenólicos y fitocannabinoides (12, 13). Entre estos últimos, predominan el ácido cannabidiólico (CBDA) y el ácido tetrahidrocannabinólico (THCA). Durante la extracción por calor, se descarboxilan a cannabidiol (CBD) y 19-tetrahidrocannabinol (THC), que son los más utilizados hoy en día por sus posibles aplicaciones medicinales (14-17). El cannabidiol (CBD) es el segundo cannabinoide más importante, después del ∆9-tetrahidrocannabinol (THC). Aunque el THC y el CBD comparten la misma fórmula química, sus características farmacológicas no son equivalentes (18). Cuando se administran por vía oral, estas sustancias entran rápidamente en el torrente sanguíneo, donde se unen a las lipoproteínas, la albúmina y los glóbulos rojos. Tienden a acumularse en el tejido adiposo, el hígado, los pulmones, el bazo, el cerebro y los músculos, desde donde se liberan continuamente a medida que disminuyen los niveles plasmáticos. Esto sugiere una larga fase de eliminación del CBD asociada a un alto volumen de distribución a varios tejidos. Los derivados naturales sufren hidroxilación, descarboxilación y conjugación hepáticas, y también pueden metabolizarse en tejidos extrahepáticos como el intestino delgado, los pulmones y el cerebro (15-17). Las propiedades analgésicas de los cannabinoides (CBD; THC) parecen estar relacionados con sus propiedades lipofílicas, que todasEs posible que la analgesia atraviese fácilmente la barrera hematoencefálica e induzca la analgesia. Sin embargo, el mecanismo de control del dolor por parte de los cannabinoides aún no está claro si se debe al agonismo de los receptores CB1 y CB2 o a los efectos causados por la interacción con neuromoduladores o la inhibición de neurotransmisores como el glutamato, la dopamina, las prostaglandinas, la acetilcolina, el GABA, la histamina, la noradrenalina y los péptidos opioides endógenos implicados en la modulación del dolor (15-19). El estudio del estrés oxidativo juega un papel esencial en muchas enfermedades, y el malondialdehído (MDA) es uno de los productos secundarios más conocidos de la peroxidación lipídica, utilizado como indicador de daño en la membrana celular. El grado de peroxidación lipídica sérica se cuantificó midiendo la concentración de malondialdehído (MDA). El malondialdehído reacciona con el ácido tiobarbitúrico para formar un producto de color rojo-rosa, que se puede medir espectrofotométricamente a 535 nm como se describió anteriormente (19, 20). Los cannabinoides tienen efectos inmunomoduladores, antihiperalgésicos, antinociceptivos, anticancerígenos y antiinflamatorios. También favorecen la regeneración de los tejidos y tienen propiedades neuroprotectoras (3, 21-24). Los fitocannabinoides interactúan con los receptores cannabinoides y producen efectos antioxidantes y antiinflamatorios en el cuerpo (11, 24). En comparación con la administración oral, intramuscular e intravenosa, la vía transmucosa oral (OTM) se utiliza cada vez más para la administración sistémica de fármacos, ya que es fácil de realizar, rápida e indolora, y el elevado riego sanguíneo a la mucosa oral evita el efecto hepático de primer paso o la degradación gastrointestinal (2, 3, 25). El uso de cannabidiol (CBD) en varias especies está ganando popularidad como un suplemento potencial a los tratamientos farmacéuticos convencionales para una variedad de afecciones (2, 26, 27). El objetivo del presente estudio fue evaluar la eficacia del CBD 15%, incluido en un régimen farmacológico clásico, en el alivio del dolor en caballos con artrosis mediante la monitorización de parámetros clínicos y hematológicos, estrés oxidativo y calidad de vida. Los autores plantearon la hipótesis de que dosis bajas de CBD al 15% administradas en la mucosa bucal podrían mejorar la eficacia de un protocolo analgésico utilizado para tratar el dolor relacionado con la artrosis en caballos, sin causar efectos secundarios.
2 Materiales y métodos
2.1 Animales
El estudio fue aprobado por el Comité Ético Institucional para el Cuidado de los Animales de la Universidad de Messina. Los protocolos de cría y experimentación de animales fueron revisados y aprobados de acuerdo con los estándares de la Guía para el Cuidado y Uso de Animales de Laboratorio y la Directiva 2010/63/UE sobre experimentación animal (aprobación n.º: 089/2022). Todos los propietarios fueron plenamente informados del estudio y dieron su consentimiento por escrito para que sus caballos participaran. Veinticuatro caballos propiedad de clientes de diferentes razas, edades, pesos y sexos, estabulados en el Club Hípico «La Palma», fueron evaluados y tratados por dolor relacionado con la artrosis. Se realizó un tamizaje basal (T0), consistente en un examen físico y perfil hematoquímico para descartar comorbilidades, y los animales estaban libres de parásitos internos y externos. Los caballos eran elegibles para su inclusión en el estudio si estaban sanos, tenían signos clínicos de cojera debido a la osteoartritis (articulación metacarpofalángica o metatarsofalángica) localizados en una o más articulaciones diagnosticadas por «bloqueo articular» y confirmadas por técnicas de imagen, como radiografía o ecografía. Los hallazgos radiográficos y la localización de la artrosis fueron anotados y registrados por un radiólogo internado. Las condiciones dolorosas crónicas, incluida la artrosis, fueron consideradas leves por el veterinario tratante, utilizando la Escala de Dolor Crónico del Caballo (HCPS). Los sujetos de los grupos permanecieron bajo estrecha supervisión veterinaria y los exámenes se realizaron en los establos durante el día y no duraron más de 30 minutos en total. Los caballos fueron alimentados con una dieta a base de fibra. No se administraron concentrados para evitar la ingesta excesiva de proteínas en los animales en reposo, lo que podría afectar negativamente a su bienestar (28, 29). Dos semanas antes del inicio del estudio, los caballos fueron manipulados por dos de los observadores que realizaban el estudio, con el fin de acostumbrar a los animales a su presencia y manipulaciones. Los criterios de exclusión incluyeron caballos que padecían otras enfermedades concomitantes, que recibían otras terapias analgésicas o que habían sido sometidos a cirugía ortopédica en las 3 semanas previas a la primera evaluación.
2.2 Diseño del estudio
Los caballos fueron inscritos durante 12 meses y tratados por el dolor relacionado con la artrosis. Todos los sujetos inscritos fueron aleatorizados utilizando software comercial (Microsoft Office Excel 2013; Microsoft Corp, Redmond, WA, Estados Unidos) en dos grupos: un grupo control (grupo C) tratado con fenilbutazona sola y el grupo tratado con fenilbutazona y CBD al 15% (grupo CBD). Se incluyeron en el estudio un total de 24 caballos, de los cuales 10 caballos afectados por artrosis de las articulaciones metacarpofalángicas (derecha e izquierda), 6 caballos afectados por artrosis de las articulaciones metatarsofalángicas (derecha o izquierda o ambas) y 8 caballos afectados por artrosis de las articulaciones metacarpofalángicas (derecha o izquierda). La señalización y las condiciones clínicas se reportan en la Tabla 1 (30). Se desaconsejó el uso de otros fármacos y suplementos durante al menos 2 semanas antes del inicio del estudio. Se informó a los propietarios y al personal estable que cualquier introducción de nuevos fármacos o cambios en la dosis durante el período del estudio daría lugar a la exclusión del estudio. Entre los sujetos que completaron el estudio, había 8 castrados y 16 hembras, de tres razas (16 caballos de silla italianos, 6 caballos de silla alemanes y 2 caballos hannoverianos). La mediana de edad de los pacientes del grupo C fue de 19,5 años (rango: 15/22, media: 18,8 ± 2,4) y del grupo CBD fue de 20 años (rango: 16/22, media: 20,1 ± 1,7), la mediana de peso del grupo C fue de 462 kg (rango: 400/567, media: 467 ± 52,7) y del grupo CBD fue de 442 kg (rango: 389/540, media: 453 ± 46,5), la mediana de la puntuación de la condición corporal, en una escala de 1 a 9, del grupo C fue de 6 (rango: 4/6, media: 5,4 ± 0,8) y del grupo CBD fue de 5 (rango: 4/6, media: 5,1 ± 0,8). Los dos grupos no difirieron significativamente. La Tabla 1 muestra los datos de los caballos en términos de raza, edad, peso, sexo y dosis de AINE y CBD utilizados. Independientemente del grupo, todos los caballos recibieron fenilbutazona (Bute 200 mg/mL, ACME, Italia) por vía endógena (IV) a una dosis de 2,2 mg/kg al día durante 5 días (8), con fenilbutazona administrada por el veterinario del establo por la noche. En el grupo de CBD, los pacientes también recibieron un producto cannabinoide (CBD 15%), emulsionado en aceite de cáñamo (GREEN CBD Oil 15%, Green Ladybug; Udine; Italia). Se administró aceite de cannabidiol al 15% por vía OTM a una dosis de 0,03 mg/kg cada 24 h durante 2 semanas (2, 31). La suspensión de aceite se utilizó para preparar gotas que contenían un 15% de CBD, lo que corresponde a aproximadamente 7,5 mg de CBD por gota. Se obtuvo un certificado de análisis del lote de producto utilizado en este estudio en el Laboratorio de Toxicología Forense, Sección de Medicina Legal, Hospital Universitario, Hospital General Umberto I. El análisis mostró un contenido de CBD de aproximadamente el 15,5% y un contenido de THC del 0,38%, lo que confirma el cumplimiento del producto con las medidas de control de calidad, incluida la evaluación de la contaminación por microbios, micotoxinas, pesticidas, metales pesados y disolventes. Las gotas orales (CBD 15% y THC < 0,5%) estaban disponibles comercialmente de acuerdo con las especificaciones del fabricante.1 Todos los caballos se pesaron utilizando una báscula de plataforma para determinar la dosis adecuada de CBD en función del peso corporal individual. Las puntuaciones de condición corporal (BCS) fueron asignadas de forma independiente por tres observadores (32). Todos los sujetos estaban acostumbrados a ser manipulados y tomaban la droga con facilidad. El acceso a los alimentos se denegó 3 h antes de la administración del fármaco y se restableció 2 h después. El acceso al agua no estaba restringido. Durante 14 días consecutivos, los caballos de cada grupo fueron evaluados en su entorno natural por tres observadores. Se midieron parámetros clínicos como frecuencia cardíaca (FC), frecuencia respiratoria (FR), presión arterial [presión arterial sistólica (PAS), presión arterial diastólica (PAD), presión arterial media (PAM)] y temperatura rectal (T°). Todos los caballos proceden del mismo centro de adiestramiento de caballos, y durante todo el periodo experimental fueron alojados individualmente en sus boxes (3,20 × 3,20 m). Todos los animales fueron alimentados con heno de 11 kg/caballo (se disponía de agua ad libitum). Una dieta basada en fibra es ventajosa desde el punto de vista del bienestar del animal, ya que permite a los caballos expresar un equilibrio de tiempo más natural, lo que resulta en más tiempo dedicado a la alimentación y menos producción de energía, lo que conduce a una reducción en el comportamiento excitable (28, 29). Los conjuntos de datos (FC, RR, SAP, DAP, MAP, T°) se recogieron a la misma hora del día (10.00-12.00) (33) en los siguientes momentos: día uno (T1; línea de base), día dos (T2), día tres (T3), día cuatro (T4), día cinco (T5), día seis (T6), día siete (T7), día ocho (T8), día nueve (T9), día diez (T10), día once (T11), día doce (T12), día trece (T13) y día catorce (14). La recolección de datos se realizó durante las temporadas de primavera y otoño, en aproximadamente 4 caballos por mes se inscribió. Las evaluaciones clínicas se realizaron mediante un monitor multiparamétrico (Datex-Ohmeda S/5; Finlandia), que mostró FC (latidos/min) y (SAP, DAP y MAP (mmHg)). La frecuencia del pulso (FC) se midió con un oxímetro de pulso colocado en el labio superior, mientras que la presión arterial no invasiva (PAS, DAP y PAM) se midió mediante un manguito ocluyente (tamaño 7,2/13 cm) colocado en la cola mediante el método oscilométrico. La frecuencia respiratoria (RR, respiraciones/min) se obtuvo mediante la observación directa de las excursiones de la pared torácica. La temperatura corporal (T, °C) se controló mediante un termómetro calibrado insertado en el recto. Para evaluar la presencia de dolor y la calidad de vida de los caballos, se pidió a tres observadores entrenados e independientes, desconocedores del tratamiento administrado, que completaran la Escala de Dolor Crónico del Caballo (HCPS). El HCPS es un cuestionario validado que consta de 15 preguntas que evalúan varios aspectos del comportamiento del caballo en una escala de calificación numérica (34, 35). Las puntuaciones totales de dolor oscilan entre cero (sin signos de dolor) y 45 (puntuación máxima de dolor). Siete preguntas evalúan la interferencia del dolor con la actividad general y el disfrute de la vida. Las siete preguntas de interferencia del dolor se puntuaron en una escala numérica que osciló entre 0 (sin interferencia) y 3 (interferencia total) (Figura 1) (34, 35). Cinco preguntas evaluaron la gravedad del dolor a través de la postura corporal, la distribución del peso, el cambio de peso de las extremidades delanteras y traseras, la respuesta al dolor a la flexión y el movimiento estandarizado de las extremidades anteriores y posteriores. Además, tres preguntas evaluaron la puntuación de la condición corporal, los músculos y los puntos de presión sobre la piel. Todas las preguntas se calificaron en una escala numérica de 0 (sin respuesta) a 3 (respuesta máxima) (5, 34, 35). Se pidió a los observadores que calificaran a los caballos utilizando el sistema de puntuación de la Escala de Dolor Crónico del Caballo antes del inicio del tratamiento el día 1 (T1) y todos los días durante 14 días (T14) a la misma hora (10.00-12.00). Si las puntuaciones de la escala aumentaban, el protocolo de tratamiento se modificaba en consulta con el veterinario de equitación y el sujeto era excluido del estudio. Además, se pidió a los observadores y al personal estable que registraran la ocurrencia de cualquier evento adverso leve, moderado o grave. Después de registrar todos los parámetros evaluados, se administraron los fármacos.
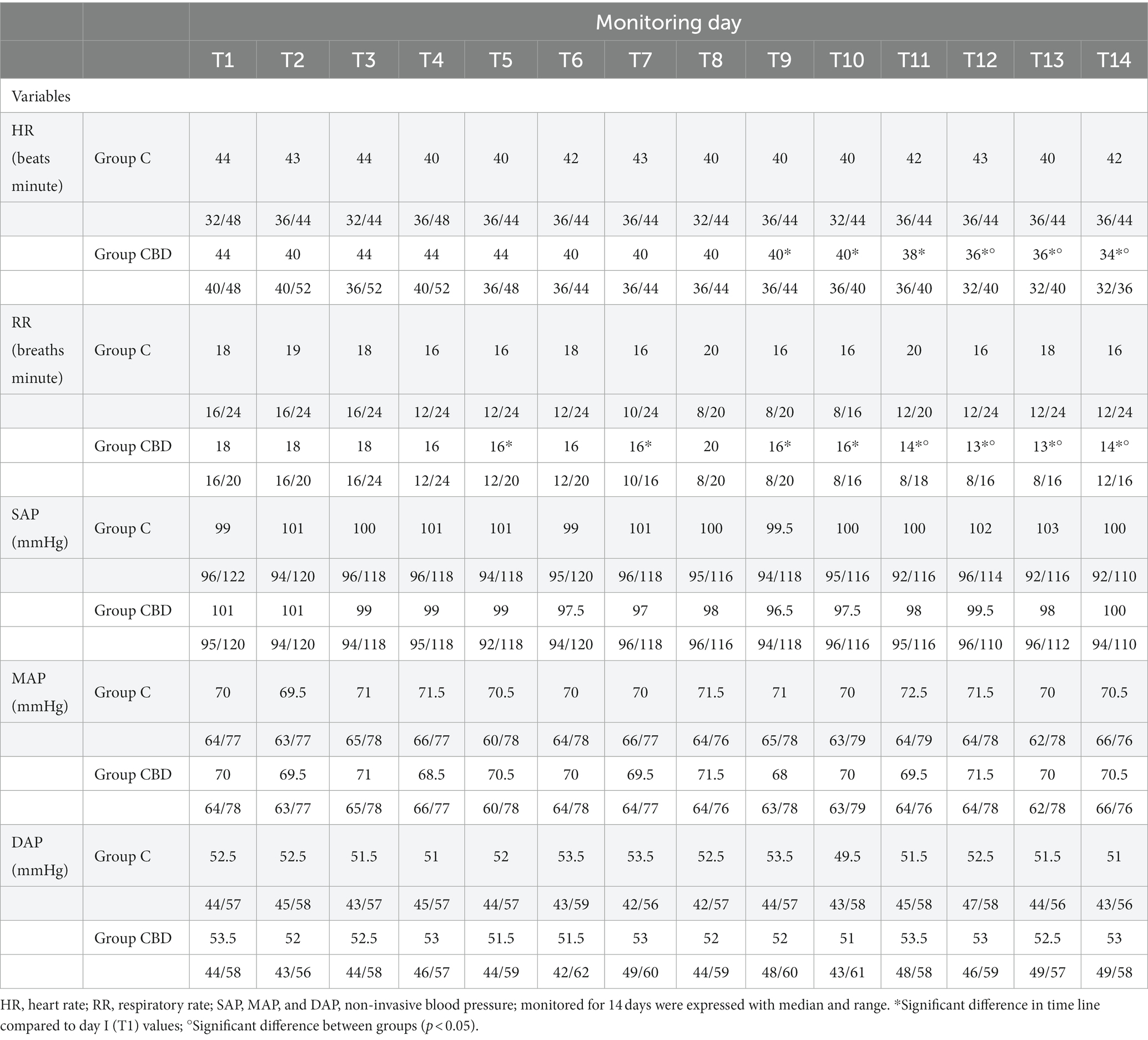
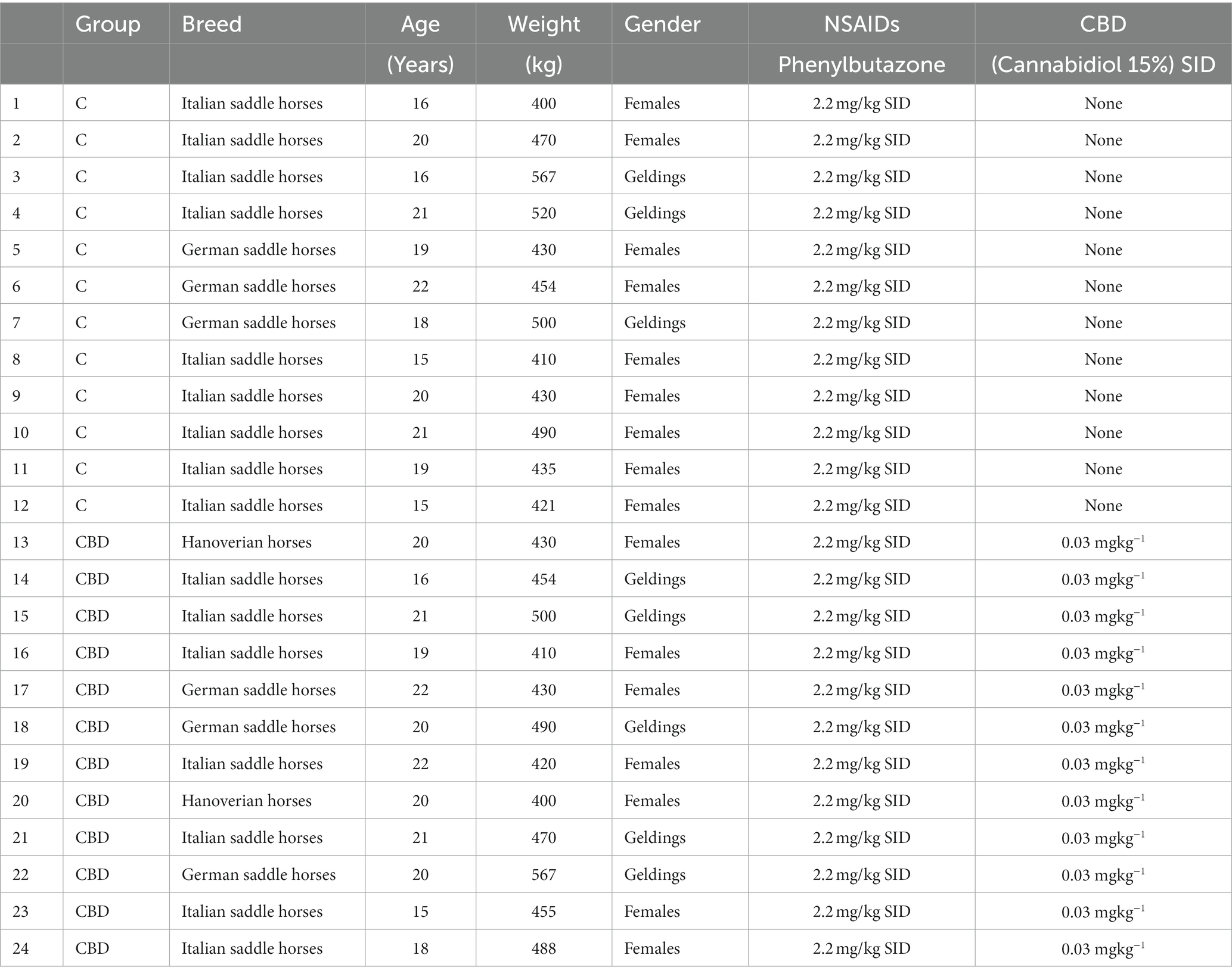 Tabla 1. Caballos reclutados en los grupos C (n = 12) y CBD (n = 12), raza, edad, peso, sexo y terapia administrada al SID, una vez al día.
Tabla 1. Caballos reclutados en los grupos C (n = 12) y CBD (n = 12), raza, edad, peso, sexo y terapia administrada al SID, una vez al día.
2.3 Estrés oxidativo hematológico e inflamatorio
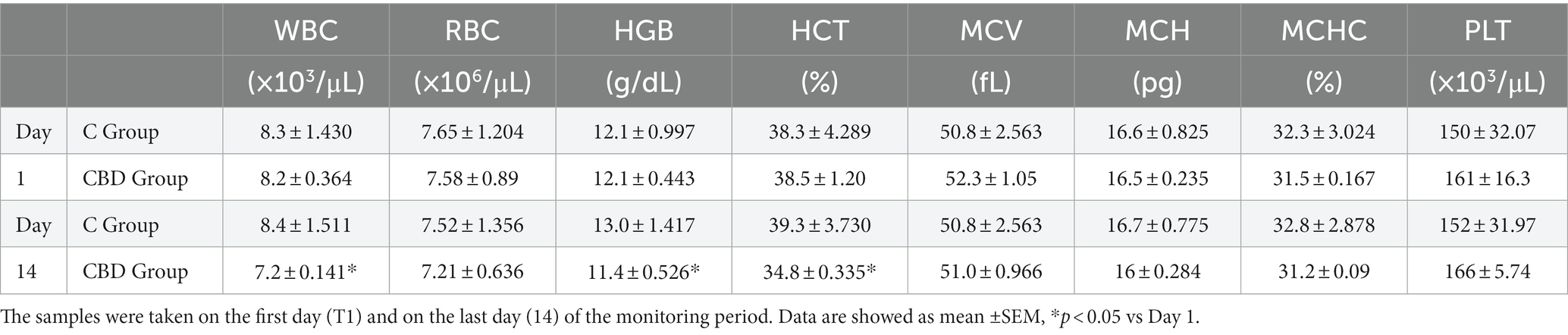
Se recogieron muestras de sangre de todos los caballos inmediatamente después de la evaluación de los parámetros fisiológicos y de la puntuación HCPS, antes de la administración de fenilbutazona/CBD o CBD solo en los puntos de datos T1, T7 y T14 por parte de un operador ciego al tratamiento, con el consentimiento informado de los propietarios. Las muestras de sangre (6 mL) se recolectaron de todos los animales por venopunción yugular y se dividieron en dos alícuotas, una de las cuales se colocó en tubos Vacutainer que contenían ácido etilendiaminotetraacético (EDTA) (Terumo Corporation, Tokio, Japón) como anticoagulante, que se utilizó para evaluar el estrés oxidativo mediante la evaluación de la peroxidación lipídica malondialdehído (MDA). Otra alícuota de sangre se colocó en un tubo de vacío que contenía EDTA (K3-EDTA, Vacuette, Greiner Bio-One, Kremsmünster, Austria) y se utilizó para la evaluación del hemograma. Después de la recolección, el suero se separó de las muestras de sangre en 15 minutos y el suero se almacenó inmediatamente a -80 ° C. Las otras alícuotas de sangre se refrigeraron inmediatamente a 4 °C y luego se evaluó el hemograma (dentro de las 3-4 h). Se realizaron pruebas de estrés oxidativo hematológico e inflamatorio y fueron evaluadas por un veterinario calificado para garantizar que los valores estuvieran dentro de los límites fisiológicos normales antes de inscribir a los caballos en el estudio.®
2.4 Análisis estadístico
Se realizó un cálculo a priori del tamaño de la muestra para determinar el número de caballos necesarios para este estudio. El tamaño de la muestra se calculó con el software G*Power 3.1 (Heinrich-Heine-Universität Dusseldorf, Düsseldorf, Alemania). Aceptando un tamaño del efecto (f) de 0,6, un nivel de significancia (α) de 0,05, una potencia (1-β) de 0,80 con efectos fijos de Anova, ómnibus, prueba de una vía, fueron necesarios 12 caballos en cada grupo para reconocer una diferencia estadísticamente significativa. El análisis estadístico se realizó con el programa SPSS 21.0 (IBM Company, Italia). La hipótesis de normalidad de los datos clínicos se examinó mediante una prueba de Shapiro-Wilk. Las puntuaciones fueron asignadas por tres observadores, desconocedores del tratamiento administrado, y se calculó el coeficiente de concordancia W de Kendall. Los datos clínicos (FC, RR, SAP, MAP y DAP), las puntuaciones de la Escala de Dolor Crónico del Caballo y el nivel de MDA se informaron como mediana y rango. Las diferencias a lo largo de la línea de tiempo se realizaron mediante la prueba de Wilcoxon. Los parámetros hematológicos se reportan como media ± error estándar de la media (SEM) de cada observación. Para el análisis se utilizó el ANOVA de un factor, seguido de la prueba de Bonferroni para comparaciones múltiples. Se consideró significativa una p < 0,05.
3 Resultados
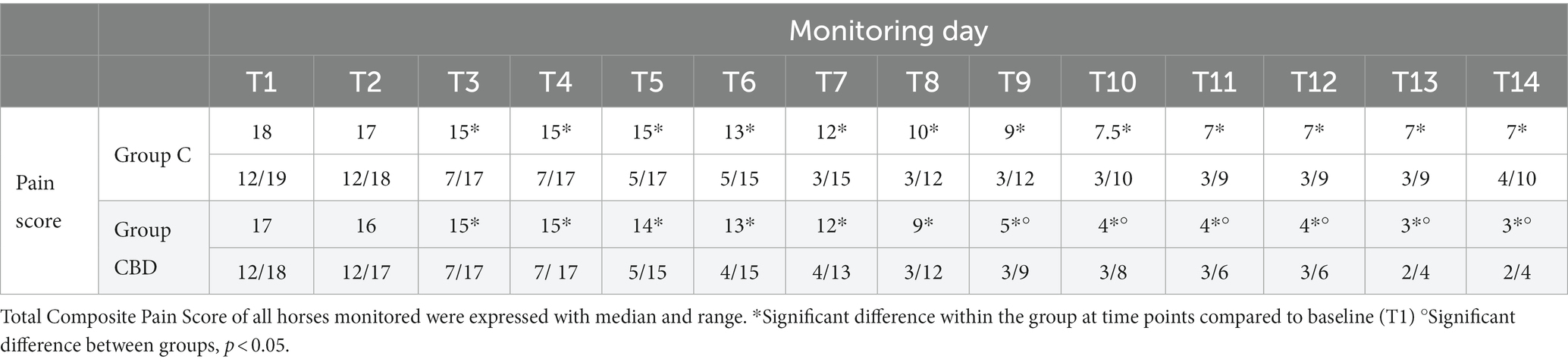
El número total de sujetos involucrados en el estudio de investigación fue de 24, con un poder efectivo de 0,80. Normalmente, los datos no se distribuyeron. El nivel de concordancia interobservador fue alto (W = 1). No se observaron reacciones adversas durante o después de la administración de CBD. Se prestó atención a signos como estornudos, sacudidas de cabeza, lamerse, náuseas, salivación y signos de sedación, letargo, ataxia, falta de coordinación, aumento o disminución del apetito, hiperestesia, incontinencia urinaria, diarrea, midriasis, hipotermia, blefaroespasmo, fotofobia o nistagmo. En cuanto a los parámetros clínicos recogidos, se observó una disminución significativa de la frecuencia cardíaca (FC) en el grupo CBD desde el día 9 (T9) hasta el final del periodo de observación (T14) en comparación con los valores basales del día 1 (T1, p = 0,000), mientras que la frecuencia cardíaca en el grupo C se mantuvo constante durante todo el periodo de observación. La comparación de los dos grupos muestra que en el grupo CBD la FC es significativamente menor que en el grupo C en T12, T13 y T14 (p < 0,05) (Tabla 2). La frecuencia respiratoria (RR) en el grupo C no mostró cambios significativos durante el período de dos semanas, mientras que en el grupo CBD, la RR disminuyó significativamente en varios días de seguimiento (T5, T7, T9, T10, T11, T12, T13, T14, T15) en comparación con T1 (p = 0,000). La comparación del grupo C con el grupo CBD mostró valores de RR significativamente diferentes, con valores de RR más altos en el grupo C que en el grupo CBD en T11, T 12, T 13 y T14 (p < 0,05). Presión arterial no invasiva: La presión arterial sistólica (SAP), diastólica (DAP) y media (PAM) no difirieron significativamente entre los dos grupos en ningún momento (Tabla 2). No se encontraron alteraciones significativas de la temperatura corporal (T, °C) durante el período de monitoreo. Aunque se observaron algunos resultados estadísticamente significativos, en todos los sujetos los parámetros clínicos monitorizados se encontraban dentro de los rangos fisiológicos. En la Tabla 3 se muestran las puntuaciones totales de dolor de las 15 preguntas de la Escala de Dolor Crónico de Caballos (HCPS) para los sujetos de cada grupo. Los resultados reportados muestran que no hubo diferencia en las puntuaciones entre los dos grupos al inicio (T1), mientras que hubo una reducción significativa en las puntuaciones de HCPS de T3 a T14 en ambos grupos (p = 0,000). La comparación entre los dos grupos muestra una reducción significativa en varios momentos en el grupo CBD en comparación con el grupo C T9, T10, T11, T12, T13, T14 (p = 0,000). El recuento de leucocitos se mantuvo dentro de los rangos de referencia, pero hubo un ligero aumento en el recuento de leucocitos en el grupo C y una ligera disminución en el grupo CBD.
4 Discusión
Se dispone de información limitada sobre el uso de productos de cáñamo ricos en cannabinoides para el tratamiento del dolor en caballos con osteoartritis. La terapia clásica implica el uso de medicamentos antiinflamatorios, de los cuales la fenilbutazona es uno de los más utilizados. Los efectos a corto plazo de la fenilbutazona son bien conocidos. Sin embargo, el uso prolongado del antiinflamatorio de forma continuada puede provocar problemas en muchos casos (8). El primer objetivo de este estudio fue determinar si la adición de un 15% de CBD a un protocolo analgésico básico conduciría a una mejora adicional en la condición clínica de los caballos con artrosis. En este estudio, el tratamiento con CBD al 15% en aceite de cáñamo en combinación con fenilbutazona durante 14 días en el grupo de CBD mostró una disminución significativa de la frecuencia cardíaca (FC) y la frecuencia respiratoria (RR), presión arterial estable, puntuaciones de dolor reducidas y niveles séricos de MDA (un marcador de peroxidación lipídica) y mostró resultados positivos, lo que llevó a una mejora en la condición clínica de los pacientes. Parámetros como la frecuencia cardíaca y la frecuencia respiratoria pueden verse afectados por el dolor y son fáciles de medir y cuantificar; Sin embargo, estos parámetros por sí solos no son específicos de la presencia y la gravedad del dolor, ya que pueden estar influenciados por otros factores. A menudo, varios estudios no han logrado establecer una relación directa entre los cambios en los parámetros fisiológicos y la presencia o gravedad del dolor. Por lo tanto, estos parámetros se evalúan en conjunto con otros métodos para confirmar su validez (16, 17, 36-38). En este estudio, observamos que ciertos marcadores de inflamación y estrés oxidativo cambiaron en comparación con el grupo tratado. En concreto, como se muestra en la Tabla 4, observamos que el tratamiento con CBD durante 14 días redujo el número de leucocitólogos, lo que podría correlacionarse con una reducción del proceso inflamatorio en curso. Además, los datos muestran una reducción significativa del nivel de MDA en el grupo de CBD, probablemente debido a la reducción de la inflamación y el estrés oxidativo, efecto que no se observó en el grupo control (Figura 2). En medicina veterinaria, hay pocas fuentes fiables sobre el uso clínico de los cannabinoides. Aunque algunos artículos científicos han discutido el uso terapéutico potencial del CBD en medicina veterinaria, pocos estudios han investigado específicamente los efectos del aceite de cáñamo y el CBD en las enfermedades ortopédicas crónicas en caballos (39). La analgesia CB2 es interesante porque se asocia a un mecanismo periférico sin efecto sobre el SNC, además de la falta de tolerancia rápida en comparación con la encontrada en los receptores CB1 (40). Entre las ventajas de los cannabinoides en caballos, los receptores CB2 parecen tener propiedades inmunomoduladoras, ya que al inhibir la síntesis o liberación de moléculas proinflamatorias modifican la respuesta inflamatoria e infiltrativa en afecciones articulares degenerativas crónicas o progresivas. Además, sus agonistas proporcionan una mejora en el tratamiento de los pacientes veterinarios equinos con enfermedades osteoarticulares al mejorar el nivel de protección contra el proceso degenerativo y reducir la sintomatología principal, lo que conduce a ralentizar la progresión y el desenlace de la enfermedad degenerativa (40, 41). Los autores encontraron que los receptores cannabinoides también se distribuyen en las neuronas sensoriales, las células gliales satélite (SGC), los macrófagos, el ganglio de la raíz dorsal (DRG) e interneuronass y elementos sinoviales de la articulación metacarpofalángica en caballos. Existe una estrecha relación funcional entre las neuronas sensoriales y el DRG en el procesamiento periférico de la información nociceptiva. Los resultados de diversos estudios han favorecido el desarrollo de nuevos estudios que apoyan el uso de moléculas que actúan sobre estos receptores para reducir la inflamación articular en caballos. Esta investigación ha proporcionado una base anatómica para futuros estudios que exploren el uso terapéutico de cannabinoides no psicotrópicos para el tratamiento del dolor en caballos (2, 42-44). La investigación en humanos ha demostrado que el CBD reduce las señales relacionadas con el estrés que pueden conducir a la inflamación crónica y las respuestas al dolor (45). Resultados similares podrían obtenerse en caballos, que también son sensibles al estrés. Los estudios en ratones, perros y caballos han demostrado que el CBD reduce la producción de citoquinas inflamatorias como el factor de necrosis tumoral alfa (TNFα), que puede ayudar a reducir la inflamación en varios tejidos y promover un efecto calmante y reducir la ansiedad en los caballos (24, 46, 47). La vía OTM ha demostrado una buena absorción y eficacia del CBD al 15% y por tanto representa una alternativa interesante a otras vías de administración ya que es una técnica no invasiva e indolora que permite el uso de concentraciones y dosis estandarizadas, requiere una constricción mínima y no causa molestias al paciente (3, 25, 48, 49). Los estudios anteriores se han centrado principalmente en determinar los niveles adecuados de suplementación con aceite de CBD dietético en animales de compañía, como perros y gatos, mientras que la información disponible para caballos maduros es limitada. Está claro que pequeñas cantidades de aceite de CBD pueden pasar más lentamente del esófago al estómago, prolongando su absorción. Por el contrario, cuando el CBD se administra directamente en la boca, la digestión y la absorción pueden ser más rápidas. En un estudio de caballos de raza pura sometidos a entrenamiento, se administró una dosis oral única de CBD suspendido en aceite de sésamo a 0,5, 1 o 2 mg/kg para evaluar sus posibles efectos antiinflamatorios. Los caballos toleraron bien el CBD y no se observaron anomalías significativas en el comportamiento o gastrointestinales (2, 31). El CBD en una suspensión oleosa formulada para la administración oral y transmucosa oral es actualmente el preferido y parece ser el método de administración óptimo para una absorción eficiente (2, 5). En investigaciones anteriores en caballos, la suplementación con 100 mg de CBD durante un período de 6 semanas resultó en una reducción de la reactividad (50). Otro estudio administró una dosis única de 50, 100 y 250 mg de CBD en un suplemento granulado y observó un aumento del nitrógeno ureico en sangre (BUN), lo que sugiere un posible estrés renal (51). Dada la sensibilidad del CBD a la temperatura y a la luz, los suplementos se almacenaron en la oscuridad a una temperatura de 4°C hasta su administración (52). Los estudios farmacocinéticos han demostrado que el CBD tiene un amplio volumen de distribución y se puede encontrar en muchos tejidos y órganos (18). Estudios recientes han demostrado que los receptores cannabinoides CB1 están más ampliamente distribuidos en el sistema nervioso central, mientras que los receptores CB2 se encuentran principalmente en la periferia. Esta diferencia en la distribución implica que el perfil farmacológico de los agonistas del receptor CB2 es diferente, con la ventaja de que los receptores CB2 tienenLa actividad antinociceptiva de las hormigas con menos efectos secundarios psicoactivos, y las diferencias anatómicas y estructurales entre los dos receptores pueden conducir a una diana terapéutica más apropiada para los pacientes veterinarios equinos. Se han encontrado receptores CB1 y CB2 en la membrana celular de los sinoviocitos de la íntima y en los pequeños vasos sanguíneos de la subíntima del tejido sinovial. Algunos autores han reportado cambios en el sistema endocannabinoide (SEC) dependiendo del grado de inflamación sinovial, confirmando que ambos receptores cannabinoides aumentan con la sinovitis. Sin embargo, también se ha observado que con el aumento de la gravedad del daño articular macroscópico, la expresión de CB1 de las células sinoviales tiende a disminuir, pero el mecanismo exacto sigue siendo desconocido (41). Estas características explicarían el efecto del CBD sobre el dolor artrítico. El interés por los derivados del cannabis en animales de compañía está creciendo debido a sus beneficios potenciales, como el alivio de problemas de comportamiento (53), el tratamiento de trastornos dermatológicos (54) y el manejo de trastornos convulsivos, mejorando así la calidad de vida de los perros (55). Los resultados del presente estudio muestran que el CBD es bien tolerado por los caballos en las dosis utilizadas. Además, se ha demostrado que el grado de absorción de CBD está influenciado por la formulación utilizada, en nuestro estudio se utilizó aceite de cáñamo como vehículo. Aunque el aceite de sésamo ha demostrado una mejor absorción en algunas especies, la eficacia de los vehículos alternativos aún no se ha probado en caballos. Por lo tanto, no puede excluirse la posibilidad de una mejor absorción con una elección diferente de vehículo (31). La vida media de eliminación del CBD en caballos es ligeramente prolongada en comparación con otras especies, pero los metabolitos primarios son los mismos que los reportados en humanos y perros (31). Sin embargo, otro estudio informó de hipocalcemia leve y aumento de las enzimas hepáticas en todos los caballos que recibieron suplementos de 0,5 mg/kg o 1,5 mg/kg durante 6 semanas (2, 56). No se observaron anomalías conductuales o gastrointestinales significativas en caballos pura sangre en entrenamiento que recibieron una dosis oral única de CBD suspendido en aceite de sésamo a 0,5, 1 o 2 mg/kg para evaluar sus posibles efectos antiinflamatorios (2, 31). En los seres humanos, se ha demostrado que los alimentos influyen en el grado de absorción de CBD (57). Como el CBD es un producto altamente lipofílico con baja solubilidad acuosa, la administración con alimentos aumenta su biodisponibilidad y reduce la fluctuación diaria de los niveles sanguíneos del medicamento. En el presente estudio, se negó el acceso a los alimentos 3 h antes y 2 h después de la administración de CBD. Como los caballos son menos tolerantes a los altos niveles de grasa en su dieta que los humanos, la influencia de los alimentos en la absorción de CBD puede ser un factor menor. Además, otros autores especulan que incluso si la biodisponibilidad oral fuera extremadamente baja, como en otras especies, es probable que el aclaramiento de CBD en caballos supere la circulación hepática (31, 58). El cannabidiol es un compuesto que ha llamado la atención de los veterinarios. Aunque aún no se ha alcanzado todo su potencial farmacéutico y nutracéutico, la importante presencia de este compuesto en las variedades de cáñamo de grado alimentario pone de manifiesto la necesidad de investigar más a fondo sus propiedades químicas y biológicas y aprovechar plenamente sus beneficios. En un estudio realizado por Leise et al. (2) se administró a caballos suplementos de cannabidiol a dosis de 0,12 y 0,13 mg/kg. Sin submarinoEn las muestras de sangre tomadas en el día 0 y 28 días después se detectaron sustancias clasificadas como drogas de abuso, como el CBD, el 7-arboxy-cannabidiol, el 7-Nor-7-carboxi-cannabidiol y el tetrahidrocannabinol (THC). Este resultado es significativo teniendo en cuenta que muchas exposiciones ecuestres prohíben el uso de CBD y cannabidiol. Por lo tanto, el uso de CBD en estas dosis no supone un riesgo de descalificación. Varios factores influyen en el bienestar de los caballos, como el suelo adecuado (por ejemplo, arena o hierba) y el recorte continuo de los cascos (no más de 6 semanas), el acceso a los pastos, el tiempo suficiente en el potrero, etc. Los caballos siempre se alojan en los mismos boxes (uno para el día y otro para la noche), separados para que puedan verse entre sí, para crear un grupo estable de sujetos y fomentar la formación de una sola manada. Además, los caballos son llevados a pastar durante unas horas cada día para mantener sus vínculos sociales (59-61). Además, ciertas actividades ecuestres se han asociado con un mayor riesgo de problemas en las extremidades. Además, ciertas actividades ecuestres, como el salto de obstáculos, la equitación y las combinaciones de diferentes disciplinas, se asocian con un mayor riesgo de problemas en las extremidades que la doma. En nuestro estudio, todos los caballos se mantuvieron en las mismas condiciones de establo y nos aseguramos de que se tuvieran en cuenta los factores anteriores. El presente estudio se realizó en caballos con condiciones de dolor crónico leve que requirieron tratamiento analgésico. Esto también refleja la visión de gestión y cuidado de la residencia de ancianos donde se realizó el estudio, ya que apoya el principio de que los caballos deben poder vivir y prosperar en el cuidado diario sin un tratamiento analgésico excesivo, pero que el uso de productos naturales puede mejorar la calidad de vida de los sujetos tratados. Una de las principales ventajas de utilizar CBD al 15% en caballos es su disponibilidad para la venta sin restricciones. La difusión a través de las nuevas tecnologías sociales, de una innovadora terapia de base natural, en particular el CBD, podría favorecer su aplicación por parte de un mayor número de profesionales y estudiantes de veterinaria (62, 63). Este estudio tiene algunas limitaciones, incluido el pequeño número de animales y la falta de análisis de la concentración plasmática de CBD durante el período de observación debido a limitaciones técnicas. Además, se debe evaluar la medición de los parámetros bioquímicos séricos (transaminasas hepáticas) y el examen de orina, además de considerar otros biomarcadores de inflamación como la proteína C reactiva. Para identificar el equilibrio analgesia-nocicepción, la evaluación del índice PTA proporcionaría datos fiables sobre la verdadera interpretación de la variabilidad de la frecuencia cardíaca (16, 17). Además, deben investigarse las posibles diferencias sexuales en respuesta a los cannabinoides. Investigaciones adicionales permitirían estudiar la reducción de las dosis de AINE en el tratamiento de la osteoartritis. No se puede excluir el efecto de la habituación, ya que los caballos fueron monitoreados de cerca y las mediciones se tomaron una vez al día. Sin embargo, dado que ambos grupos fueron sometidos al mismo protocolo de monitoreo, la habituación habría ocurrido de manera similar y, por lo tanto, puede considerarse insignificante. Por lo tanto, los resultados deben interpretarse con precaución y se necesita más investigación para obtener datos confiables. Según los datos recopilados en este estudio, la adición de un 15% de CBD a un régimen rutinario de AINE en caballos dio como resultado una reducción de la frecuencia cardíaca y respiratoria, el recuento de glóbulos blancos y el nivel de MDAs y puntuaciones de la escala de dolor; todo lo cual podría correlacionarse con una reducción del proceso inflamatorio en curso y una mejora en la calidad de vida de los sujetos tratados.
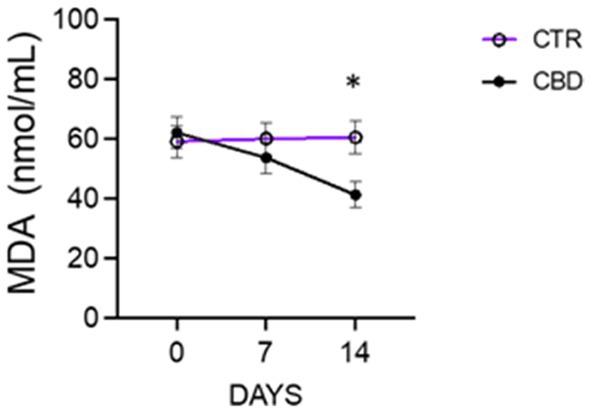 Figura 2. Niveles séricos de MDA en el grupo C y en el grupo CBD; los datos se muestran como media ± SEM de n = 6, *p < 0,05 vs. T1.
Figura 2. Niveles séricos de MDA en el grupo C y en el grupo CBD; los datos se muestran como media ± SEM de n = 6, *p < 0,05 vs. T1.
5 Conclusión
El objetivo del presente estudio fue fomentar una mayor investigación sobre los múltiples efectos del CBD, incluidas sus propiedades analgésicas y antiinflamatorias. Según nuestros resultados, la administración transmucosa oral de aceite de CBD al 15% (0,03 mg kg−1 cada 24 h), además de la fenilbutazona intravenosa, proporcionó un mejor manejo del dolor y una calidad de vida más satisfactoria que el tratamiento con AINE único en caballos con artrosis. Sin embargo, se necesita más investigación para comprender completamente la farmacodinámica y la farmacocinética de los cannabinoides, establecer un rango de dosis y determinar las posibles aplicaciones en esta especie. Los productos de CBD podrían desempeñar un papel importante en la medicina alternativa o complementaria, ya sea como complemento de los enfoques terapéuticos convencionales o como tratamiento de sustitución independiente.
Declaración de disponibilidad de datos
Los datos brutos que respaldan las conclusiones de este artículo serán puestos a disposición por los autores, sin reservas indebidas.
Declaración ética
Los estudios en animales fueron aprobados por el Comité Ético Institucional para el Cuidado de los Animales de la Universidad de Messina. Los estudios se llevaron a cabo de acuerdo con la legislación local y los requisitos institucionales. Se obtuvo el consentimiento informado por escrito de los propietarios para la participación de sus animales en este estudio.
Contribuciones de los autores
CI: Conceptualización, Investigación, Escritura – borrador original, Escritura – revisión y edición. MT: Investigación, Escritura – borrador original. SP: Curación de datos, Investigación, Redacción – borrador original. FD’A: Curación de datos, Redacción – borrador original. GC: Curación de datos, redacción, revisión y edición. FA: Curación de datos, redacción, revisión y edición. EGi: Investigación, Escritura – borrador original. PL: Escritura – revisión y edición. DM: Investigación, Escritura – Revisión y Edición. RC: Investigación, Escritura – Revisión y Edición. EGu: Conceptualización, Redacción – revisión y edición.
Financiación
El/los autor/es declaran/n que no se recibió apoyo financiero para la investigación, autoría y/o publicación de este artículo.
Reconocimientos
Los autores agradecen el apoyo de la Universidad de Messina a través de la iniciativa APC.
Conflicto de intereses
Los autores declaran que la investigación se llevó a cabo en ausencia de relaciones comerciales o financieras que pudieran interpretarse como un posible conflicto de intereses.
El/los autor/es declararon, en el momento de la presentación, ser miembro del consejo editorial de Frontiers. Esto no tuvo ningún impacto en el proceso de revisión por pares ni en la decisión final.
Nota del editor
Todas las afirmaciones expresadas en este artículo son únicamente las de los autores y no representan necesariamente las de sus organizaciones afiliadas, ni las del editor, los editores y los revisores. Cualquier producto que pueda ser evaluado en este artículo, o afirmación que pueda ser hecha por su fabricante, no está garantizado ni respaldado por el editor.
Notas
1. ^www.greenladybug.it
Referencias
1. Kogan, LR , Hellyer, PW , Silcox, S y Schoenfeld-Tacher, R . Uso y percepciones de los productos de cannabis por parte de los dueños de perros canadienses. ¿Puede Vet J. (2019) 60:749–55.
2. Leise, JM , Leatherwood, JL , París, BL , Walter, KW , George, JM , Martínez, RE, et al. Evaluación de un producto suplementario oral de cannabidiol para determinar su aceptabilidad y rendimiento en caballos maduros. Animales. (2023) 13:245. 401. doi: 10.3390/ani13020245
Resumen de PubMed | Texto completo de Crossref | Google Académico
3. Brioschi, FA , Di Cesare, F , Gioeni, D , Rabbogliatti, V , Ferrari, F , D’Urso, ES, et al. Formulación de aceite de cannabidiol transmucoso oral como parte de un régimen analgésico multimodal: efectos sobre el alivio del dolor y la mejora de la calidad de vida en perros afectados por artrosis espontánea. Animales. (2020) 10:1505. doi: 10.3390/ani10091505
Resumen de PubMed | Texto completo de Crossref | Google Académico
4. Alves, ALG , Fonseca, BPA , Thomassian, A , Nicoletti, JLM , Hussni, CA y Silveira, CA . Lombalgia em equinos. Braz J Vet Res Anim Sci. (2007) 44:191–9. doi: 10.11606/issn.1678-4456.bjvras.2007.26638
5. Holzhauer, M , Bremer, R , Santman-Berends, I , Smink, O , Janssens, I y Atrás, W . Estudio transversal de la prevalencia y los factores de riesgo de las enfermedades de los cascos en caballos de los Países Bajos. Veterinario Med. (2017) 140:53–9. doi: 10.1016/j.prevetmed.2017.02.013
Resumen de PubMed | Texto completo de Crossref | Google Académico
6. Souza, MV . Artrosis en caballos – parte 1: relación entre el examen clínico y radiográfico para el diagnóstico. Braz Arch Biol Technol. (2016) 59:1–9. doi: 10.1590/1678-4324-2016150024
7. Isola, M , Piccinotti, C , Magro, M , Fasolato, L , Vianello, F , Menandro, ML, et al. Formulación de óxido de hierro coloidal para la desinfección de cascos equinos. Animales. (2021) 11:766. doi: 10.3390/ani11030766
Resumen de PubMed | Texto completo de Crossref | Google Académico
8. Soma, LR , Uboh, CE y Maylin, gerente general . El uso de fenilbutazona en el caballo. J Vet Pharmacol Ther. (2012) 35:1–12. doi: 10.1111/j.1365-2885.2011.01299.x
9. Mercer, MA , Davis, JL y McKenzie, HC . Farmacología clínica y evaluación terapéutica de antiinflamatorios no esteroideos en caballos adultos. Animales. (2023) 13:1597. doi: 10.3390/ani13101597
Resumen de PubMed | Texto completo de Crossref | Google Académico
10. Inundación, J y Stewart, AJ . Antiinflamatorios no esteroideos y toxicidades asociadas en caballos. Animales. (2022) 12:2939. doi: 10.3390/ani12212939
Resumen de PubMed | Texto completo de Crossref | Google Académico
11. Atalay, S , Jarocka-Karpowicz, I y Skrzydlewska, E . Propiedades antioxidantes y antiinflamatorias de los antioxidantes Cannabidiol. Antioxidantes. (2020) 9:21. doi: 10.3390/antiox9010021
Resumen de PubMed | Texto completo de Crossref | Google Académico
12. Andrés, CM , Hausman, JF y Guerriero, G . Cannabis sativa: la planta de las mil y una moléculas. Planta Frontal Sci. (2016) 7:19. doi: 10.3389/fpls.2016.00019
Resumen de PubMed | Texto completo de Crossref | Google Académico
13. De Briyne, N , Holmes, D , Sandler, I , Stiles, E , Szymanski, D , Moody, S, et al. Cannabis, aceites de cannabidiol y tetrahidrocannabinol: ¿qué deben saber los veterinarios? Animales. (2021) 11:892. doi: 10.3390/ani11030892
Resumen de PubMed | Texto completo de Crossref | Google Académico
14. Klatzkow, S , Davis, G , Shmalberg, J , Gallastegui, A , Miscioscia, E , Tarricone, J, et al. Evaluación de la eficacia de un extracto de cáñamo rico en cannabidiol y ácido cannabidiólico para el dolor en perros después de una osteotomía de nivelación de la meseta tibial. Front Vet Sci. (2023) 9:1036056. doi: 10.3389/fvets.2022.1036056
Resumen de PubMed | Texto completo de Crossref | Google Académico
15. Miranda-Cortés, A , Mota-Rojas, D , Crosignani-Outeda, N , Casas-Alvarado, A , Martínez-Burnes, J , Olmos-Hernández, A, et al. El papel de los cannabinoides en la modulación del dolor en animales de compañía. Front Vet Sci. (2023) 9:1050884. doi: 10.3389/fvets.2022.1050884
Resumen de PubMed | Texto completo de Crossref | Google Académico
16. Eichler, F , Poźniak, B , Machnik, M , Schenk, I , Wingender, A , Baudisch, N, et al. Modelización farmacocinética del cannabidiol administrado por vía oral e implicaciones para el control de la medicación en caballos. Front Vet Sci. (2023) 10:1234551. doi: 10.3389/fvets.2023.1234551
Resumen de PubMed | Texto completo de Crossref | Google Académico
17. Eichler, F , Ehrle, A , Jensen, KC , Baudisch, N , Petersen, H , Bäumer, W, et al. Observaciones conductuales, frecuencia cardíaca y variabilidad de la frecuencia cardíaca en caballos después de la administración oral de una pasta que contiene cannabidiol en tres dosis crecientes (parte 1/2). Front Vet Sci. (2023) 10:1305868. doi: 10.3389/fvets.2023.1305868
Resumen de PubMed | Texto completo de Crossref | Google Académico
18. Mannucci, C , Navarra, M , Calapai, F , Spagnolo, EV , Busardò, FP , Cas, RD, et al. Aspectos neurológicos del uso médico del Cannabidiol. Dianas farmacológicas de disord neurol del SNC. (2017) 16:541–53. doi: 10.2174/1871527316666170413114210
Resumen de PubMed | Texto completo de Crossref | Google Académico
19. Gastón, TE y Friedman, D . Farmacología de los cannabinoides en el tratamiento de la epilepsia. Comportamiento de la epilepsia. (2017) 70:313–8. doi: 10.1016/j.yebeh.2016.11.016
20. Tsikas, D . Evaluación de la peroxidación lipídica mediante la medición de malondialdehído (MDA) y sus parientes en muestras biológicas: desafíos analíticos y biológicos. Bioquímica anal. (2017) 524:13–30. doi: 10.1016/j.ab.2016.10.021
Resumen de PubMed | Texto completo de Crossref | Google Académico
21. Russo, EB y Marcu, J . Farmacología cannábica: los sospechosos habituales y algunas pistas prometedoras. Adv Pharmacol. (2017) 80:67–134. doi: 10.1016/bs.apha.2017.03.004
22. Genovese, T , Cordaro, M , Siracusa, R , Impellizzeri, D , Caudullo, S , Raffone, E, et al. Mecanismo molecular y bioquímico del cannabidiol en el manejo de los procesos inflamatorios y oxidativos asociados a la endometriosis. Int J Mol Sci. (2022) 23:5427. doi: 10.3390/ijms23105427
Resumen de PubMed | Texto completo de Crossref | Google Académico
23. Mlost, J , Bryk, M y Starowicz, K . Cannabidiol para el tratamiento del dolor: enfoque en farmacología y mecanismo de acción. Int J Mol Sci. (2020) 21:8870. doi: 10.3390/ijms21228870
Resumen de PubMed | Texto completo de Crossref | Google Académico
24. Gugliandolo, E , Licata, P , Peritore, AF , Siracusa, R , D’Amico, R , Cordaro, M, et al. Efecto del Cannabidiol (CBD) sobre la respuesta inflamatoria canina: un estudio ex vivo sobre sangre total estimulada por LPS. Veterinaria Sci. (2021) 8:185. doi: 10.3390/vetsci8090185
Resumen de PubMed | Texto completo de Crossref | Google Académico
25. Polidoro, D , Temmerman, R , Devreese, M , Charalambous, M , Jamón, LV , Cornelis, I, et al. Farmacocinética del cannabidiol después de la administración intranasal, intrarrectal y oral en perros sanos. Front Vet Sci. (2022) 9:899940. doi: 10.3389/fvets.2022.899940
Resumen de PubMed | Texto completo de Crossref | Google Académico
26. Ortiz, F. , Castillo, M. , Hernández, Q. y Flores, C. Evaluación preliminar del uso de cannabidiol en un elefante asiático: breve informe. Preprints (2021), 2021060442.
27. Carpintero, Testigo de Jehová , Tully, TN Jr, Rockwell, K y KuKanich, B . Farmacocinética del cannabidiol en la cotorra amazónica de La Española (Amazona ventralis). J Avian Med Surg. (2022) 36:121–7. doi: 10.1647/20-00076
Resumen de PubMed | Texto completo de Crossref | Google Académico
28. Raspa, F , Tarántala, M , Muca, E , Bergero, D , Soglia, D , Cavallini, D, et al. ¿El manejo de la alimentación hace una diferencia en las actividades conductuales y el bienestar de los caballos criados para la producción de carne? Animales. (2022) 12:1740. doi: 10.3390/ani12141740
Resumen de PubMed | Texto completo de Crossref | Google Académico
29. Raspa, F , Vervuert, I , Capucchio, MT , Colombino, E , Bergero, D , Forte, C, et al. Una dieta alta en almidón vs. alta en fibra: efectos en el entorno intestinal de los diferentes compartimentos intestinales del tracto digestivo del caballo. BMC Vet Res. (2022) 18:187. doi: 10.1186/s12917-022-03289-2
Resumen de PubMed | Texto completo de Crossref | Google Académico
30. Spadari, A , Gialletti, R , Gandini, M , Valle, E , Cerullo, A , Cavallini, D, et al. Supervivencia a corto plazo y tasas de complicaciones postoperatorias en caballos sometidos a cirugía de cólicos: un estudio multicéntrico. Animales. (2023) 13:1107. doi: 10.3390/ani13061107
Resumen de PubMed | Texto completo de Crossref | Google Académico
31. Ryan, D , McKemie, DS , Kass, PH , Puschner, B y Knych, HK . Farmacocinética y efectos sobre el metabolismo del ácido araquidónico de dosis bajas de cannabidiol tras la administración oral a caballos. Prueba de drogas anal. (2021) 13:1305–17. doi: 10.1002/dta.3028
32. Henneke, República Dominicana , Alfarero, GD , Kreider, JL y Yeates, BF . Relación entre el puntaje de condición, las medidas físicas y el porcentaje de grasa corporal en yeguas. Veterinario Equino J. (1983) 4:371–2.
33. Piccione, G , Caola, G y Refinetti, R . Relaciones temporales de 21 variables fisiológicas en equinos y ovinos. Comp Biochem Physiol A Mol Integr Physiol. (2005) 142:389–96. doi: 10.1016/j.cbpa.2005.07.019
Resumen de PubMed | Texto completo de Crossref | Google Académico
34. van Loon, JPAM y Macri, L . Evaluación objetiva del dolor crónico en caballos mediante la escala de dolor crónico equino (HCPS): un estudio de construcción de escalas. Animales. (1826) 11:11. doi: 10.3390/ani11061826
Resumen de PubMed | Texto completo de Crossref | Google Académico
35. van Loon, JP , Jonckheer-Sheehy, VS , Espalda, W , van Weeren, Relaciones Públicas y Hellebrekers, LJ . Monitorización del dolor visceral equino con una puntuación de escala de dolor compuesta y correlación con la supervivencia después de la cirugía gastrointestinal de emergencia. Veterinario J. (2014) 200:109–15. doi: 10.1016/j.tvjl.2014.01.003
Resumen de PubMed | Texto completo de Crossref | Google Académico
36. Bussières, G , Jacques, C , Lainay, O , Beauchamp, G , Leblond, A , Cadore, JL, et al. Desarrollo de una escala de dolor ortopédico compuesta en caballos. Res Vet Sci. (2008) 85:294–306. doi: 10.1016/j.rvsc.2007.10.011
Resumen de PubMed | Texto completo de Crossref | Google Académico
37. de Grauw, JC y van Loon, JP . Evaluación sistemática del dolor en caballos. Veterinario J. (2016) 209:14–22. doi: 10.1016/j.tvjl.2015.07.030
Resumen de PubMed | Texto completo de Crossref | Google Académico
38. von Lewinski, M , Biau, S , Erber, R , Ille, N , Aurich, J , Faure, JM, et al. Liberación de cortisol, frecuencia cardíaca y variabilidad de la frecuencia cardíaca en el caballo y su jinete: diferentes respuestas al entrenamiento y al rendimiento. Veterinario J. (2013) 197:229–32. doi: 10.1016/j.tvjl.2012.12.025
Resumen de PubMed | Texto completo de Crossref | Google Académico
39. Landa, L , Troyano, V , Demlova, R , Jurica, J y Hrib, R . El cannabidiol y las posibilidades de su uso en medicina veterinaria de perros y caballos: una breve revisión. Veterinario Med. (2022) 67:455–62. doi: 10.17221/127/2021-VETMED
40. Sánchez-Aparicio, P , Florán, B , Rodríguez Velázquez, D , Ibancovichi, J.A. , Varela Guerrero, J.A. y Recillas, S . Receptores cannabinoides CB2, una nueva diana farmacológica prometedora para las condiciones de dolor crónico y degenerativo en pacientes veterinarios equinos. J Veterinario Equino. (2020) 85:102880. doi: 10.1016/j.jevs.2019.102880
Resumen de PubMed | Texto completo de Crossref | Google Académico
41. Miagkoff, L , Girard, CA , San Juan, G , Richard, H , Beauchamp, G y Laverty, S . Los receptores cannabinoides se expresan en la membrana sinovial equina y se regulan al alza con la sinovitis. Veterinario Equino J. (2023) 55:681–95. doi: 10.1111/evj.13860
Resumen de PubMed | Texto completo de Crossref | Google Académico
42. Galiazzo, G , De Silva, M , Giancola, F , Rinnovati, R , Peli, A y Chiocchetti, R . Distribución celular de los receptores relacionados con cannabinoides TRPV1, PPAR-gamma, GPR55 y GPR3 en los ganglios de la raíz dorsal cervical equina. Veterinario Equino J. (2021) 54:788–98. doi: 10.1111/evj.13499
Resumen de PubMed | Texto completo de Crossref | Google Académico
43. Zamith Cunha, R , Zannoni, A , Salamanca, G , De Silva, M , Rinnovati, R , Gramenzi, A, et al. Expresión de cannabinoides (CB1 y CB2) y receptores relacionados con cannabinoides (TRPV1, GPR55 y PPARα) en la membrana sinovial de la articulación metacarpofalángica del caballo. Front Vet Sci. (2023) 10:1045030. doi: 10.3389/fvets.2023.1045030
Resumen de PubMed | Texto completo de Crossref | Google Académico
44. Chiocchetti, R , Rinnovati, R , Tagliavia, C , Stanzani, A , Galiazzo, G , Giancola, F, et al. Localización de cannabinoides y receptores relacionados con cannabinoides en los ganglios de la raíz dorsal equina. Veterinario Equino J. (2021) 53:549–57. doi: 10.1111/evj.13305
Resumen de PubMed | Texto completo de Crossref | Google Académico
45. Guindon, J y Hohmann, AG . El sistema endocannabinoide y el dolor. Dianas farmacológicas de disord neurol del SNC. (2009) 8:403–21. doi: 10.2174/187152709789824660
Resumen de PubMed | Texto completo de Crossref | Google Académico
46. Ribeiro, A , Ferraz-De-Paula, V , Pinheiro, ML , Vitoretti, LB , Mariano-Souza, DP , Quinteiro-Filho, WM, et al. El cannabidiol, un cannabinoide no psicotrópico derivado de plantas, disminuye la inflamación en un modelo murino de lesión pulmonar aguda: papel del receptor 2A de adenosina a. Eur J Pharmacol. (2012) 678:78–85. doi: 10.1016/j.ejphar.2011.12.043
Resumen de PubMed | Texto completo de Crossref | Google Académico
47. Turner, S , Ladrador, VD y Adams, AA . Efectos del Cannabidiol sobre la producción de citoquinas proinflamatorias de linfocitos in vitro de caballos senior. J Veterinario Equino. (2021) 103:103668. doi: 10.1016/j.jevs.2021.103668
Resumen de PubMed | Texto completo de Crossref | Google Académico
48. Bruni, N , Della Pepa, C , Oliaro-Bosso, S , Pessione, E , Gastaldi, D y Dosio, F . Sistemas de administración de cannabinoides para el tratamiento del dolor y la inflamación. Moléculas. (2018) 23:2478. doi: 10.3390/moléculas23102478
Resumen de PubMed | Texto completo de Crossref | Google Académico
49. Bartner, LR , McGrath, S , Rao, S , Hyatt, LK y Wittenburg, LA . Farmacocinética del cannabidiol administrado por 3 métodos de administración en 2 dosis diferentes a perros sanos. Can J Vet Res. (2018) 82:178–83.
50. Draeger, AL , Thomas, EP , Jones, KA , Davis, AJ y Porr, CAS . Los efectos de la suplementación con cannabidiol granulado sobre la frecuencia cardíaca y las puntuaciones de reacción en caballos. J Vet se comporta. (2021) 46:97–100. doi: 10.1016/j.jveb.2021.09.003
51. Draeger, AL , Hoffman, LK , Godwin, Relaciones Públicas y Davis, AJ . Farmacocinética de una sola alimentación de Cannabidiol peletizado en caballos. Carrera de obstáculos ORCA Stud J. (2021) 4:1.
52. Mazzetti, C , Ferri, E , Pozzi, M y Labra, M . Cuantificación del contenido de cannabidiol en e-líquidos disponibles comercialmente y estudios sobre su estabilidad térmica y foto-estabilidad. Sci Rep. (2020) 10:3697. doi: 10.1038/s41598-020-60477-6
Resumen de PubMed | Texto completo de Crossref | Google Académico
53. Deabold, KA , Schwark, WS , Lobo, L y Wakshlag, JJ . Farmacocinética de dosis única y evaluación preliminar de la seguridad con el uso de nutracéuticos de cáñamo ricos en CBD en perros y gatos sanos. Animales. (2019) 9:832. doi: 10.3390/ani9100832
Resumen de PubMed | Texto completo de Crossref | Google Académico
54. Wang, T , Zakharov, A , Gómez, B , Lyubimov, A , Trottier, Países Bajos , Schwark, WS, et al. Evaluación farmacocinética en estado estacionario de cannabinoides séricos de 24 h y 1 semana en gatos utilizando una pasta de cáñamo rica en CBD/CBDA. Front Vet Sci. (2022) 9:895368. doi: 10.3389/fvets.2022.895368
Resumen de PubMed | Texto completo de Crossref | Google Académico
55. McGrath, S , Bartner, LR , Rao, S , Packer, RA y Gustafson, DL . Ensayo clínico aleatorizado, ciego, controlado para evaluar el efecto de la administración oral de cannabidiol además del tratamiento antiepiléptico convencional sobre la frecuencia de las convulsiones en perros con epilepsia idiopática intratable. JAVMA. (2019) 254:1301–8. doi: 10.2460/javma.254.11.1301
Resumen de PubMed | Texto completo de Crossref | Google Académico
56. Yocom, AF , O’Fallon, ES , Gustafson, D y Contino, EK . Farmacocinética, seguridad y concentraciones en el líquido sinovial de la administración oral de dosis única y múltiple de 1 y 3 mg/kg de Cannabidiol en caballos. J Veterinario Equino. (2022) 113:103933. doi: 10.1016/j.jevs.2022.103933
Resumen de PubMed | Texto completo de Crossref | Google Académico
57. Taylor, L , Gidal, B , Blakey, G , Tayo, B y Morrison, G . Un ensayo de fase I, aleatorizado, doble ciego, controlado con placebo, dosis única ascendente, dosis múltiple y efecto alimentario de la seguridad, tolerabilidad y farmacocinética del cannabidiol altamente purificado en sujetos sanos. Fármacos para el SNC. (2018) 32:1053–67. doi: 10.1007/s40263-018-0578-5
Resumen de PubMed | Texto completo de Crossref | Google Académico
58. Dique, T , Hubbell, J , Sams, R y Hinchcliff, K . Flujo sanguíneo hepático en caballos durante el período de recuperación del ejercicio máximo. Am J Vet Res. (1998) 59:1476–80. doi: 10.2460/ajvr.1998.59.11.1476
Resumen de PubMed | Texto completo de Crossref | Google Académico
59. Placci, M , Marliani, G , Sabioni, S , Gabai, G , Mondo, E , Borghetti, P, et al. Alojamiento natural de caballos vs establo tradicional: comparación de parámetros hormonales, hematológicos e inmunológicos. J Appl Anim Welf Sci. (2020) 23:366–77. doi: 10.1080/10888705.2019.1663737
Resumen de PubMed | Texto completo de Crossref | Google Académico
60. Arena, I , Marliani, G , Sabioni, S , Gabai, G , Bucci, D y Accorsi, PA . Evaluación del bienestar de los caballos: aspectos conductuales, hormonales y de cría. J Vet se comporta. (2021) 41:82–90. doi: 10.1016/j.jveb.2021.01.006
61. Marliani, G , Sprocatti, I , Schiavoni, G , Bellodi, A y Accorsi, PA . Evaluación del presupuesto de actividad diurna de los caballos en un modelo de establo etológico: un estudio de caso en Italia. J Appl Anim Welf Sci. (2021) 24:200–13. doi: 10.1080/10888705.2020.1857252
Resumen de PubMed | Texto completo de Crossref | Google Académico
62. Muca, E , Cavallini, D , Odore, R , Baratta, M , Bergero, D y Valle, E . ¿Los estudiantes de veterinaria utilizan tecnologías y recursos de aprendizaje en línea para la formación didáctica? Un mini-meta-análisis. Educ Sci. (2022) 12:573. doi: 10.3390/educsci12080573
63. Muca, E , Buonaiuto, G , Lamanna, M , Silvestrelli, S , Ghiaccio, F , Federiconi, A, et al. Llegar a un público más amplio: el papel de Instagram en la educación y el compromiso con la nutrición de las vacas lecheras. Animales. (2023) 13:3503. doi: 10.3390/ani13223503
Resumen de PubMed | Texto completo de Crossref | Google Académico
Palabras clave: equinos, cannabidiol, transmucosa oral, artrosis, calidad de vida, dolor, aceite de cáñamo
Cita: Interlandi C, Tabbì M, Di Pietro S, D’Angelo F, Costa GL, Arfuso F, Giudice E, Licata P, Macrì D, Crupi R y Gugliandolo E (2024) Mejora de la calidad de vida y el alivio del dolor en caballos maduros con osteoartritis después de la administración de aceite de cannabidiol transmucoso oral como parte de un régimen analgésico. Frente. Vet. Sci. 11:1341396. doi: 10.3389/fvets.2024.1341396
Recibido: 20 de noviembre de 2023; Aceptado: 02 de enero de 2024;
Publicado: 06 Febrero 2024.
Editado por:
Daniel Mota-Rojas, Universidad Autónoma Metropolitana, México
Revisado por:
Marco Tassinari, Universidad de Bolonia, Italia
Ismael Hernández Ávalos, Universidad Nacional Autónoma de México, México
Copyright © 2024 Interlandi, Tabbì, Di Pietro, D’Angelo, Costa, Arfuso, Giudice, Licata, Macrì, Crupi y Gugliandolo. Este es un artículo de acceso abierto distribuido bajo los términos de la Licencia Creative Commons Attribution License (CC BY).
*Correspondencia: Giovanna L. Costa, glcosta@unime.it
Renuncia: Todas las afirmaciones expresadas en este artículo son únicamente las de los autores y no representan necesariamente las de sus organizaciones afiliadas, ni las del editor, los editores y los revisores. Cualquier producto que pueda ser evaluado en este artículo o afirmación que pueda hacer su fabricante no está garantizado ni respaldado por el editor.
Date de alta y recibe nuestro 👉🏼 Diario Digital AXÓN INFORMAVET ONE HEALTH
Date de alta y recibe nuestro 👉🏼 Boletín Digital de Foro Agro Ganadero
Noticias animales de compañía
Noticias animales de producción
Trabajos técnicos animales de producción
Trabajos técnicos animales de compañía