Análisis comparativo del inmunofenotipo en perros con linfoma
Análisis comparativo del inmunofenotipo aberrante y características clínicas en perros con linfoma: estudio de 27 casos
 Hyeona Bae1†
Hyeona Bae1†  Sang-Ki Kim2†
Sang-Ki Kim2†  DoHyeon Yu1*†
DoHyeon Yu1*†- 1Facultad de Medicina Veterinaria, Universidad Nacional de Gyeongsang, Jinju (República de Corea)
- 2Facultad de Ciencias Industriales, Universidad Nacional de Kongju, Yesan (República de Corea)
Introducción: Los fenotipos de linfoma aberrante se encuentran con frecuencia en perros, pero las implicaciones clínicas son escasas.
Métodos: Se analizaron veintisiete perros con linfoma aberrante diagnosticado mediante citometría de flujo entre 2017 y 2023. Los síndromes paraneoplásicos mayores, los factores pronósticos y las características clínicas del linfoma se compararon con sus inmunofenotipos.
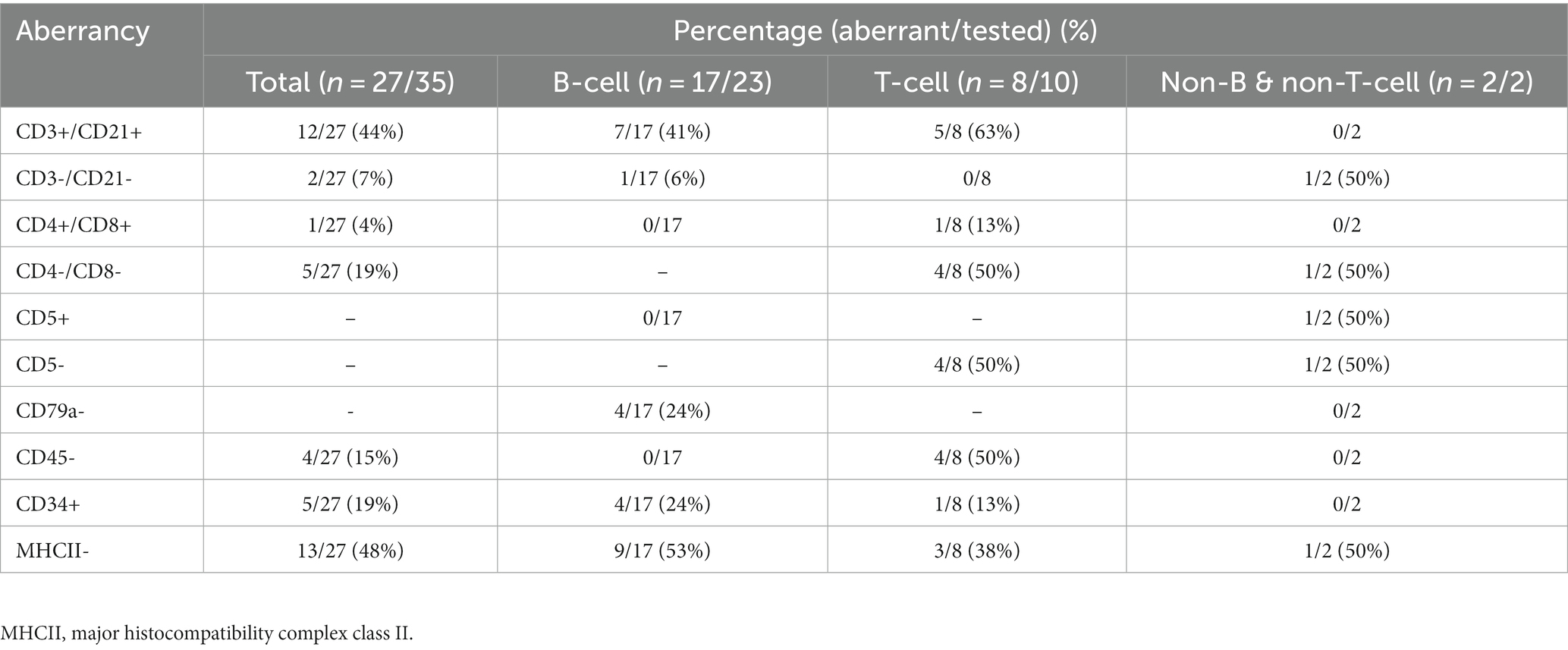
Resultados: Veintisiete perros tenían inmunofenotipos aberrantes, siendo MHCII- (48%) y CD3+/CD21+ (44%) las aberrancias más comúnmente identificadas. En el linfoma de células B, las aberraciones más frecuentes fueron MHC II- (53%), CD3+/CD21+ (41%), CD34+ (24%) y CD79a- (24%). Mientras tanto, en el linfoma de células T, los CD3+/CD21+ (63%), CD4-/CD8- (50%), CD5- (50%) y CD45- (50%) fueron los más comunes. El cociente plaquetas-neutrófilos fue significativamente mayor en el grupo CD3+/CD21+ que en los otros grupos, donde no se expresaron uno o ambos marcadores (55,23 ± 39,64; 18,72 ± 14,95, respectivamente; p = 0,001). La concentración sérica de albúmina fue significativamente menor en el grupo MHCII (2,59 g/dl, IC 95%: 2,31-2,87) que en el grupo MHCII+ (3,06 g/dl, IC 95%: 2,88-3,23; p = 0,009). La expresión de CD34 mostró correlaciones significativas con la masa mediastínica craneal, el subestadio clínico de la OMS y la fiebre (p = 0,028 , p = 0,041 y p = 0,047, respectivamente). La expresión de MHCII se correlacionó con reacciones adversas a la quimioterapia, masas mediastínicas craneales y fiebre (p = 0,009 , p = 0,023 y p < 0,001, respectivamente). No se observaron diferencias estadísticamente significativas en el período de supervivencia para ninguna de las aberrancias fenotípicas.
Conclusión: Los linfomas aberrantes son comunes en los perros. Se han identificado algunos factores pronósticos clínicos que se correlacionan significativamente con inmunofenotipos aberrantes y que pueden aplicarse clínicamente.
1. Introducción
En comparación con los animales de experimentación, las enfermedades naturales de los perros podrían reflejar enfermedades humanas como el cáncer. El estudio de estas similitudes puede proporcionar información valiosa sobre los mecanismos de la enfermedad, los tratamientos y los posibles objetivos terapéuticos tanto para los perros como para los humanos.
El inmunofenotipado desempeña un papel crucial en el diagnóstico y la clasificación precisos del linfoma canino, similar al linfoma humano. A pesar de la limitada disponibilidad de anticuerpos caninos comercialmente específicos, se ha establecido un factor pronóstico significativo basado en el inmunofenotipado en el linfoma canino (1-3). Los inmunofenotipos de linfoma en perros se clasifican según el origen de las células B y T, con marcadores representativos de CD21/CD79a y CD3/CD4/CD8 comúnmente utilizados en perros. Además, se han identificado varios fenotipos en detalle, como CD45 en todos los leucocitos, CD34 en células hematopoyéticas precursoras y complejo mayor de histocompatibilidad clase II (MHCII) en células presentadoras de antígenos. Entre estos, los fenotipos aberrantes caracterizados por un aumento o disminución de la expresión de antígenos específicos están bien establecidos tanto en medicina humana como veterinaria (4-7). Se están llevando a cabo varios estudios para explorar la posibilidad de utilizar inmunofenotipos, incluidas diversas aberrancias, con fines clínicos y predicción de pronóstico en humanos (8-13).
En el linfoma canino se han estudiado factores pronósticos clínicos como el subestadio de la Organización Mundial de la Salud (OMS), la linfadenopatía mediastínica (14) y el síndrome paraneoplásico (SNP) (15), pero aún no se han estudiado las implicaciones clínicas de los fenotipos aberrantes en perros.
Por lo tanto, los objetivos de este estudio fueron [1] la identificación de fenotipos aberrantes en perros con varios tipos de linfoma y [2] la investigación de los tipos asociados con la gravedad de los signos clínicos, el SNP y el pronóstico de los fenotipos aberrantes.
2. Materiales y métodos
Se realizó un análisis retrospectivo in vitro de los parámetros clinicopatológicos e inmunofenotipos de perros con linfoma utilizando aspirados ganglionares y muestras de sangre total periférica recogidas en el momento del diagnóstico. Este estudio fue aprobado por el Comité Institucional de Cuidado y Cuidado de Animales (IACUC) GNU-230425-D0087.
Entre los perros diagnosticados con linfoma que visitaron el Hospital Docente Veterinario de la Universidad Nacional de Gyeongsang entre 2017 y 2023, se incluyeron en este estudio 35 perros inmunofenotipados por citometría de flujo. Los criterios de inclusión fueron los siguientes: [1] perros diagnosticados de linfoma mediante los siguientes procedimientos diagnósticos: citología, histopatología, inmunofenotipado y prueba de clonalidad (mediante aspiración con aguja fina (por aspiración con aguja fina o una muestra de biopsia de ganglios linfáticos agrandados o lesiones diana); [2] perros sin enfermedades subyacentes distintas del linfoma que puedan afectar cambios hematológicos; y [3] perros con linfoma previo que no habían recibido quimioterapia antes del ingreso o perros con linfoma recidivante seis meses después de la última quimioterapia. Se incluyeron tanto las formas ganglionares como las extraganglionares, y todos los perros se estadificaron de acuerdo con el sistema de estadificación de la OMS (16). La graduación citológica se evaluó de acuerdo con la clasificación actualizada de Kiel (17, 18). La histopatología y la reacción en cadena de la polimerasa para el reordenamiento del receptor de antígeno se solicitaron a un laboratorio externo (IDEXX, Westbrook, ME, Estados Unidos), mientras que la citología y el inmunofenotipado mediante citometría de flujo.
Los criterios de clasificación para cada linaje de linfocitos en el inmunofenotipado fueron los siguientes: [1] Linfoma de células B, si las células tumorales eran CD21+ (>70 % de las células principales) y el marcador de células T era negativo; [2] Linfoma de células T, si las células tumorales eran CD3+ (>70 % de las células principales) y el marcador de células B era negativo; y [3] linfomas no B y no T, si las células tumorales eran negativas para los marcadores de células B y T.
Las aberraciones fenotípicas se definieron de la siguiente manera: [1] expresión reducida o ausente de marcadores panleucocitarios o linfocitarios (CD45 y MHCII), [2] expresión simultánea de marcadores linfocitarios de diferentes linajes (CD3 y CD21) o diferentes estadios de diferenciación (marcadores de estadio maduro y CD34), [3] en células T, los marcadores CD4 y CD8 se expresaron simultáneamente, o ninguno se expresó, [4] en los linfocitos B, pérdida de CD79a, que se expresa en todas las etapas de maduración de los linfocitos B (7, 19, 20).
En el momento del diagnóstico, se evaluó la presencia de SNP en todos los perros para determinar el curso clínico y el pronóstico. Se analizó la correlación entre el subestadio ‘b’ (clínicamente enfermo) de la OMS, la anemia, la hipercalcemia, la trombocitopenia y el inmunofenotipo. El tiempo de supervivencia se definió como el período comprendido entre la fecha del diagnóstico en nuestro hospital y el día de la muerte por linfoma. Los perros que murieron por causas no relacionadas con el tumor o cuyo seguimiento se interrumpió se consideraron «censurados». La respuesta al tratamiento se evaluó en perros que habían recibido quimioterapia o medicación equivalente y se dividió en remisión completa (RC), remisión parcial (RP), enfermedad progresiva (DP) y enfermedad estable (DE) según la literatura previa (21).
Al ingreso, se realizaron exámenes de laboratorio para evaluar el estado clínico general de los perros y detectar cualquier enfermedad subyacente, incluido el SNP. Se realizó un hemograma completo (analizador hematológico Procyte Dx, IDEXX, Westbrook, ME, Estados Unidos) y un análisis de frotis sanguíneo, que incluyó la relación plaquetas/linfocitos (PLR), la relación plaquetas/neutrófilos (PNR), la relación linfocitos/monocitos (LMR) y la relación neutrófilos/linfocitos (NLR). También se realizaron análisis de equilibrio ácido-base y concentraciones de electrolitos (analizador Nova pHOX, Nova Biochemical, Waltham, MA, Estados Unidos), análisis bioquímico sérico (Catalyst Dx Chemistry Analyzer, IDEXX, Westbrook, ME, Estados Unidos), pruebas de coagulación (analizador Coag Dx®™ con cartuchos de citrato PT y citrato aPTT, IDEXX) y análisis de orina completo (VetLab UA Analyzer, IDEXX). Los niveles de fibrinógeno se evaluaron mediante el método de Millar (22).
Se recolectaron aspirados de PAAF de los ganglios linfáticos prescapulares o inguinales de perros con linfadenopatía generalizada y se recolectó sangre periférica para evaluar la estadificación de la OMS. Para los casos de linfoma extraganglionar, se recolectaron aspirados de PAAF de ganglios linfáticos regionales con sospecha de compromiso cerca de las lesiones diana (estómago, segmentos intestinales, hígado, bazo y lesiones cutáneas) y también se recolectaron líquidos libres pleurales o abdominales. Todos los aspirados se suspendieron en 0,3-0,5 ml de solución salina dextrosa al 5% y la sangre periférica se recolectó en tubos de ácido etileno-diamina-tetraacético. Todas las muestras fueron analizadas dentro de las 24 h posteriores a la recolección por el mismo operador, y se excluyeron aquellas con diagnósticos ambiguos, baja celularidad o baja viabilidad.
Los anticuerpos utilizados en este estudio se basaron en estudios previos (23). Se realizó un análisis citométrico de flujo multicolor para evaluar la expresión contemporánea de diferentes antígenos dentro de la misma población celular. El método de preparación y análisis de la muestra fue similar al de estudios previos (6), con la excepción de que se clasificaron las células CD14 negativas (CD14 se expresa en monocitos y macrófagos), y solo se seleccionaron los linfocitos utilizando la diferencia en granularidad y marcadores específicos de linfocitos. Las células principales se identificaron primero a través de la citología, y el análisis citométrico de flujo se realizó principalmente en los linfocitos, que constituían la población más grande (>60%). También se analizaron los linfocitos que presentaban un fenotipo tumorigénico, incluso en un pequeño porcentaje. Las muestras se adquirieron utilizando el MACSQuant Analyzer 10 (Miltenyi Biotech, Bergisch Gladbach, Alemania) y se analizaron utilizando el software FlowJo versión 10.8.0 (Ashland, OR, Estados Unidos).
Todos los análisis estadísticos (prueba t de Student, prueba U de Mann-Whitney, prueba exacta de Fisher y curva de Kaplan-Meier) se realizaron con el programa SPSS Statistics versión 27.0, para Windows (SPSS Inc., Chicago, IL, Estados Unidos). Los datos clínicos de ingreso, incluyendo la señalización, la temperatura, el peso corporal, la presencia de anomalías en los parámetros hematológicos y los subestadios clínicos, se evaluaron para determinar su impacto en el tiempo de supervivencia mediante estimadores de Kaplan-Meier y pruebas de rango logarítmico. Para la prueba exacta de Fisher, se dicotomizaron y evaluaron los datos clínicos, clinicopatológicos e inmunofenotípicos. Los valores de p fueron bilaterales y se consideraron significativos a p < 0,05.
3. Resultados
3.1. Población de estudio y prevalencia de aberraciones inmunofenotípicas
Las características de los perros incluidos en este estudio se resumen en la Tabla Suplementaria S1. Entre los perros reclutados inicialmente para el estudio, se incluyeron 27, todos los cuales presentaban aberraciones inmunofenotípicas con inmunofenotipado por citometría de flujo en el momento del diagnóstico. La edad media (± desviación estándar) de 27 perros fue de 9 ± 3,5 años (rango, 3-15 años). Las razas incluían Maltés (n = 7), Mixto (n = 5), Shih-Tzu (n = 4), Golden Retriever (n = 3), Caniche Miniatura (n = 2), Yorkshire Terrier (n = 1), Dogo Canario (n = 1), Dachshund (n = 1), Chihuahua (n = 1), Cocker Spaniel (n = 1) y Shiba (n = 1). El linfoma multicéntrico fue el más frecuente (n = 24), seguido del linfoma extraganglionar, se identificaron las formas alimentaria (n = 1), lengua (n = 1) e hígado (n = 1). Cuando se clasificaron por estadio clínico de la OMS, uno fue el estadio I de la OMS, dos el estadio III, 13 el estadio IV y 11 el estadio V. De los 27 perros, 11 pertenecían al subestadio «a» de la OMS (asintomáticos) y 16 al subestadio «b» (clínicamente enfermos).
Un total de 21 perros recibieron quimioterapia después de ser diagnosticados con linfoma. De estos, 14 perros se sometieron al protocolo L-CHOP, a tres perros se les administró clorambucilo y a un perro se les aplicó los protocolos CHOP, COP y doxorrubicina sola a un perro cada uno. Dos de los perros que recibieron el protocolo L-CHOP, murieron por progresión tumoral y se perdieron en el seguimiento inmediatamente después de la quimioterapia en la primera semana (L-asparaginasa y vincristina). Un perro que fue tratado con clorambucilo mostró una respuesta deficiente y fue tratado con una combinación de prednisolona, imatinib y ciclofosfamida. Tras la evaluación de la respuesta después de la quimioterapia, se identificaron cinco perros con RC, seis perros con RP, cuatro perros con SD y 8 con DP.
En el examen citológico, 12 perros tenían células grandes, 7 perros tenían células intermedias y cinco perros tenían células pequeñas. En tres perros, las células intermedias y grandes se identificaron como heterogéneas. Entre los 22 perros que pudieron ser analizados por la clasificación actualizada de Kiel, se encontró que cinco perros (23%) tenían linfoma de bajo grado y 17 perros (77%) tenían linfoma de alto grado (Tablas suplementarias S2, S3). En el grupo de linfoma de bajo grado, había tres células claras, una célula de tipo prolinfocítico y un tipo de célula de tipo centrocítico. En el grupo de linfoma de grado alto, había siete células polimórficas centroblásticas (predominantemente células grandes), tres tipo Burkitt, tres plasmocitoides, dos pleomórficas, una célula polimórfica centroblástica (predominantemente células pequeñas) y un linfoma anaplásico. De los ocho perros que pudieron ser diagnosticados a través de métodos histopatológicos e inmunohistoquímicos, se identificó linfoma difuso de células B grandes (DLBCL) en cinco, TZL en dos y linfoma difuso de células B pequeñas en uno.
Se identificaron un total de 27 perros con un inmunofenotipo aberrante (Tabla 1). Entre las aberrancias totales, MHCII- (13/27, 48%) y CD3+/CD21+ (12/27, 44%) fueron las más frecuentemente identificadas, mientras que el 19% de estos perros (5/27) no expresaron CD3 o CD21. Los 22 perros que pudieron ser analizados por la clasificación actualizada de Kiel mostraron aberrancias inmunofenotípicas. Entre los perros que mostraron aberrancia, se encontró que cinco tenían linfoma de bajo grado y 17 tenían linfoma de alto grado, y el grupo de linfoma de alto grado mostró más aberrancias inmunofenotípicas. Los CD3+/CD21+ (4/5, 80%) y MHCII- (7/17, 41%) fueron los más frecuentemente identificados en linfomas de bajo y alto grado, respectivamente. Las aberraciones más representadas en el linfoma de células B fueron MHCII- (9/17, 53%), CD3+/CD21+ (7/17, 41%), CD34+ (4/17, 24%), CD79a- (4/17, 24%), mientras que en el linfoma de células T se expresaron CD3+/CD21+ (5/8, 63%), CD4-/CD8- (4/8, 50%), CD45- (4/8, 50%), CD5- (4/8, 50%). En los dos casos que mostraron el fenotipo no B/no T, se confirmó la expresión de CD3-/CD21-, CD4-/CD8-, CD5 y MHCII- en una tasa del 50%. En ambos casos, el marcador de células asesinas naturales caninas (células NK), NKp46, estaba altamente expresado, lo que sugiere un linfoma derivado de células NK.
3.2. Correlación con el inmunofenotipo aberrante y las mediciones clinicopatológicas del síndrome paraneoplásico
Como resultado del análisis de la medición clínica en el grupo CD3+/CD21+, que se identificó como el más frecuente entre los fenotipos aberrantes, el PNR fue significativamente mayor en el grupo identificado como CD3+/CD21+ que en los otros grupos (no se expresaron uno o ambos) (55,23 ± 38,52; 18,13 ± 17,12, respectivamente; p = 0,003), grupo CD45 que en el grupo CD45+ (90,01 ± 43,30; 26,85 ± 22,66, respectivamente; p = 0,007). La NLR fue significativamente menor en el grupo CD45 (7,45 ± 10,58; 0,47 ± 0,22; p = 0,041). La concentración de calcio ionizado también fue significativamente mayor en el grupo identificado como CD3+/CD21+ que en los otros grupos (1,32 mmol/L, IC del 95%: 1,29-1,35; 1,24 mmol/L, IC del 95%: 1,19-1,29, respectivamente; p = 0,01). La concentración sérica de albúmina fue significativamente menor en el grupo de MHCII- (2,59 g/dl, IC del 95%: 2,31-2,87) que en el grupo de MHCII+ (3,10 g/dl, IC del 95%: 2,94-3,26; p = 0,005) (Figura 1).
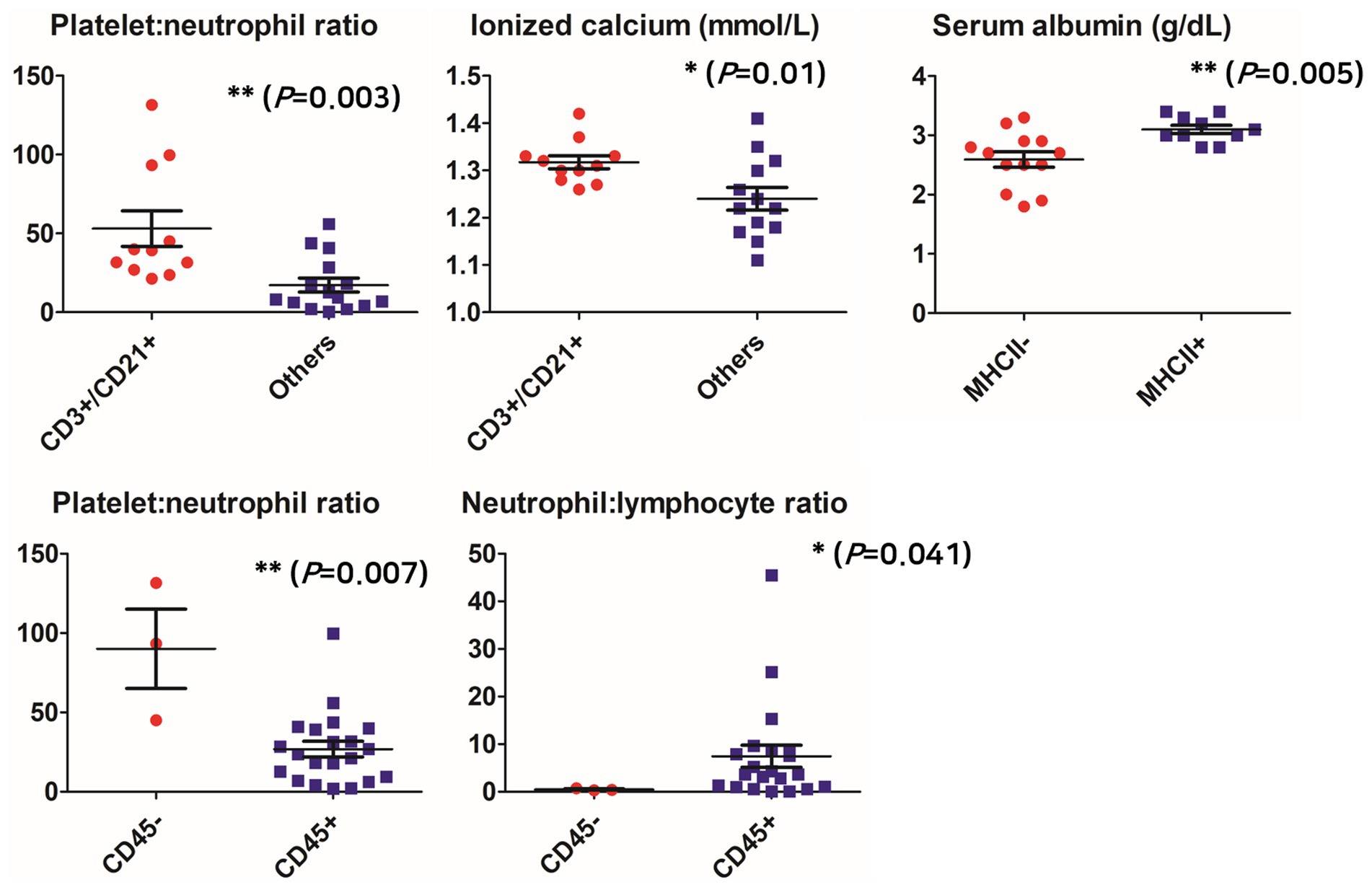 Figura 1. Comparación de parámetros clinicopatológicos según fenotipos aberrantes. *p < 0,05, **p < 0,01, ***p < 0,001.
Figura 1. Comparación de parámetros clinicopatológicos según fenotipos aberrantes. *p < 0,05, **p < 0,01, ***p < 0,001.
Al analizar la asociación entre las aberraciones fenotípicas y las medidas clínicas, la expresión de CD34 mostró correlaciones significativas con la adenopatía mediastínica craneal, el subestadio clínico de la OMS y la fiebre (p = 0,017, p = 0,037 y p = 0,033, respectivamente). La linfadenopatía mediastínica craneal estuvo presente en cuatro de los cinco perros (80%) que expresaron CD34, mientras que solo tres de los 18 perros (16,7%) que no expresaron CD34 tenían linfadenopatía mediastínica craneal. Cinco (41,7%) de los 12 perros con subestadio «b» expresaron CD34, mientras que ninguno de los 11 perros con subestadio «a» expresó CD34; cuatro de cada cinco perros (80%) con CD34+ tenían fiebre, mientras que solo cuatro de 18 perros (22,2%) con CD34 tenían fiebre. Las probabilidades de linfadenopatía mediastínica craneal fueron 20 veces mayores en los perros CD34+ que en los perros CD34. Los perros CD34+ tenían 2,6 veces más probabilidades de ser evaluados como subestadio clínico «b» de la OMS que los perros CD34, y sus probabilidades de tener fiebre eran 14 veces mayores.
Se observó una correlación significativa entre la presencia de expresión de MHCII y fiebre (p < 0,001) y la presencia de reacciones adversas a la quimioterapia (p = 0,022). La fiebre estuvo presente en siete de los 10 perros MHCII+ (70%), mientras que ninguno mostró fiebre en el grupo de 13 MHCII. Los efectos adversos de la quimioterapia estuvieron presentes en siete de los nueve perros MHCII+ (77,8%), mientras que solo dos de los 11 perros con MHCII mostraron reacciones adversas a la quimioterapia. Las probabilidades de reacciones adversas a la quimioterapia fueron 16 veces mayores en el grupo MHCII+ que en el grupo MHCII, y las probabilidades de expresar MHCII fueron 5,3 veces mayores cuando había fiebre que cuando no había fiebre (Tabla 2).
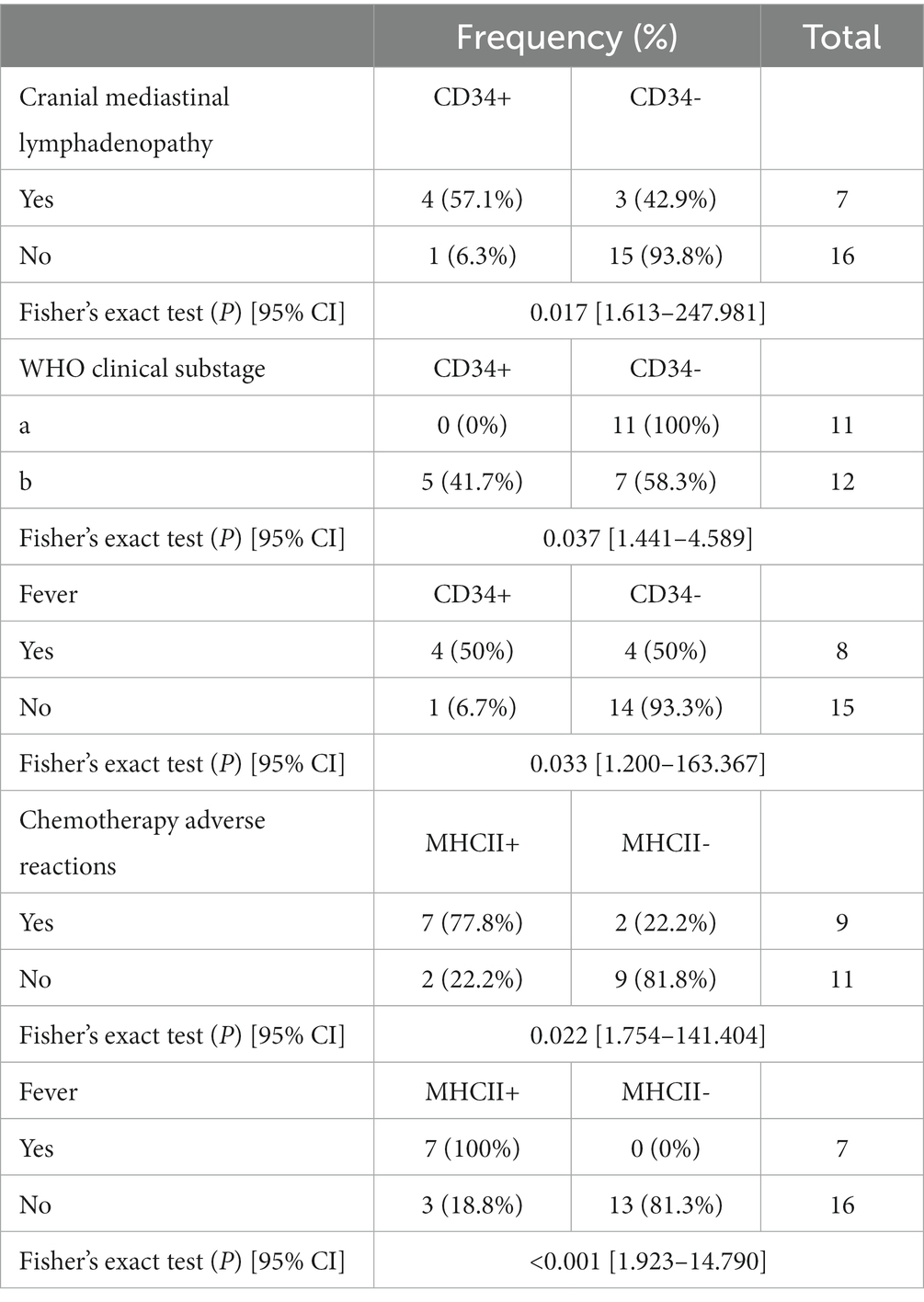 Tabla 2. Análisis de asociación entre factores pronósticos de linfoma e inmunofenotipos aberrantes mediante la prueba exacta de Fisher.
Tabla 2. Análisis de asociación entre factores pronósticos de linfoma e inmunofenotipos aberrantes mediante la prueba exacta de Fisher.
3.3. Análisis de supervivencia
La mediana general de supervivencia fue de 365 días (intervalo de 1 a 1.138 días). Diez perros murieron debido a un linfoma, mientras que dos perros murieron debido a otras razones no relacionadas con el tumor. Doce perros sobrevivieron durante toda la duración del estudio, y se suspendió el seguimiento de tres perros.
No se observaron diferencias estadísticamente significativas en el período de supervivencia para ninguna de las aberrancias fenotípicas. El tiempo de supervivencia fue significativamente menor en el grupo del subestadio «b» (p = 0,006) y en el grupo con anemia y monocitosis entre los pacientes con SNP (p = 0,028 y p = 0,024, respectivamente) (Tabla suplementaria S4).
4. Discusión
Los animales de compañía sirven como excelentes modelos para las enfermedades humanas, en particular los cánceres que ocurren espontáneamente, que reflejan patobicías y comorbilidades similares. Los perros y los humanos comparten características citogenéticas y clínicas, patología, biología tumoral, comportamiento tumoral y aberraciones genéticas comunes en el caso del linfoma (24, 25). En este estudio, se utilizó la citometría de flujo para analizar los inmunofenotipos, un factor pronóstico importante en los perros diagnosticados de linfoma, y se identificaron aberraciones en el 77% de los perros (27/35 perros). Los perros con linfoma de alto grado clasificados según la clasificación actualizada de Kiel mostraron muchas más aberraciones inmunofenotípicas que los que tenían linfoma de bajo grado. Además, se identificaron correlaciones entre los hallazgos clínicos, hematológicos y serológicos en perros con fenotipos aberrantes. Según la hipótesis, se identificaron aberraciones asociadas con marcadores pronósticos de linfoma y SNP, pero no se observaron diferencias significativas en el tiempo de supervivencia según el fenotipo aberrante.
Estudios previos han reportado una ligera diferencia en la incidencia de fenotipos aberrantes dependiendo de la definición utilizada. En concreto, Celant et al. encontraron que el 12% (310/2.612) de los perros tenían aberraciones de antígenos específicos (20), mientras que Wilkerson et al. informaron de una incidencia del 22% (5). La incidencia de pérdida de expresión o baja expresión de MHCII, que fue la aberración identificada con mayor frecuencia en nuestro estudio, se ha reportado de aproximadamente 14-72% en estudios previos (2, 11). Además, se ha informado que la coexpresión de CD3 y CD21 oscila entre un 0,7% (20) y un 31-50% (5, 19), mientras que un estudio no informó casos de coexpresión de CD3/CD21 (26).
Las proteínas MHCII se expresan específicamente en células presentadoras de antígenos profesionales, como linfocitos B, monocitos y células dendríticas (27). La firma de expresión génica MHCII sugiere que la presentación de antígenos al sistema inmune juega un papel importante en las respuestas terapéuticas (27). La expresión reducida de MHCII puede dificultar una inmunovigilancia tumoral suficiente, lo que podría haber contribuido al resultado desfavorable (27). En este estudio, se identificó la pérdida de expresión de MHCII en los siete perros con morfotipos de alto grado (7/17, 41%). Aunque este estudio no encontró una diferencia significativa en el tiempo de supervivencia en función de la expresión de MHCII, varios estudios previos en humanos y perros han establecido su uso potencial como factor pronóstico.
CD3 es una molécula compleja asociada al receptor de células T y se expresa durante la maduración en timocitos tempranos (5). Es un marcador representativo expresado en los linfocitos T y está presente en todas las etapas de las células T, desde las células T precursoras tempranas hasta las células T maduras que entran en la circulación y los ganglios linfáticos. Por otro lado, CD21 es un marcador de células B maduras, y cuando las células B inmaduras que no han estado expuestas al antígeno se liberan de la médula ósea, el antígeno CD21 se expresa en la superficie (28).
En este estudio, las aberraciones identificadas con mayor frecuencia en todos los linajes fueron doble positivo para CD3 y CD21. La coexpresión de diferentes marcadores de linaje es un rasgo característico de los tumores que no se pueden identificar en los ganglios linfáticos reactivos (19). Cuatro de los cinco perros con linfoma de bajo grado mostraron CD3+/CD21+, y tres de ellos mostraron tipos de células claras y fueron diagnosticados con TZL en histopatología. Ocho perros coexpresaron CD21 entre las células T, de las cuales se presumía que cuatro perros tenían TZL y un perro tenía linfoma multicéntrico de células T clínicamente agresivo (no hay biopsia disponible). Estos eran los resultados esperados, ya que el TZL es un linfoma indolente de bajo grado y expresa CD21, como se informó anteriormente (29). Sin embargo, en el caso del otro perro, no era clínicamente indolente. Seis de los diecisiete perros con linfoma de alto grado mostraron expresión de CD3+/CD21+, que se supone que es una expresión aberrante.
La positividad para CD21 ya se ha descrito en neoplasias caninas de células T en el pasado (5, 19). Al tratarse de una célula tumoral, es posible que se altere el fenotipo del antígeno expresado durante la etapa de maduración de los linfocitos. También es posible que estos dos tipos de tumores ocurrieran al mismo tiempo. Un perro con linfoma de células B que expresa CD3 fue diagnosticado histopatológicamente con DLBCL. Sin embargo, en la prueba de clonalidad, se confirmó que tanto las células T como las B eran clonales, lo que sugiere que ambos linajes tumorales ocurrieron al mismo tiempo.
La pérdida de la doble negatividad CD45, CD5 y CD4/CD8 fue la segunda anomalía más común en las células T. CD45 es una proteína tirosina fosfatasa transmembrana que sirve como marcador leucocitario común debido a su expresión en todos los leucocitos independientemente de su linaje (30). La pérdida de CD45 también se ha considerado como un sello distintivo del tumor en estudios previos (19, 31). Entre los subtipos histológicos de linfoma, el CD45 es un hallazgo característico de la TZL y, como se mencionó anteriormente, es clínicamente indolente. En nuestro estudio, dos perros con CD45 fueron diagnosticados histopatológicamente de TZL. Uno de los dos perros sin histopatología tenía una masa en la lengua como queja principal y exhibía un inmunofenotipo de CD3+/CD4-/CD8+/CD21+/CD45- en los ganglios linfáticos regionales. Aunque no se analizó el fenotipo de la masa de la lengua, la citología confirmó que la población principal eran los linfocitos pequeños (datos no mostrados). La posibilidad de que el TZL se origine en la lengua también es alta en este perro, considerando un caso previo de TZL en la lengua (32). Sin embargo, en otro estudio, el 5,3% de los perros con células T no especificadas se identificaron como CD45- (20). Aunque en este estudio no se encontró ningún linfoma agresivo con CD45-, se espera que la frecuencia de este tipo aberrante aumente a medida que aumente el tamaño de la población.
Los linfocitos T se diferencian de los timocitos dobles negativos (CD4-/CD8-) a células doblemente positivas (CD4+/CD8+) antes de abandonar el timo y evolucionar a células CD4+ y CD8+ (7). Dado que CD4 y CD8 no se expresan en las células T maduras, que están marcadas por CD3+, el fenotipo observado en este estudio se consideró aberrante. El fenotipo CD4/CD8 se ha presentado en varias formas anatómicas de linfoma de células T. Por ejemplo, el fenotipo de linfocitos neoplásicos en el linfoma epiteliotrópico cutáneo fue CD4-/CD8+ o CD4-/CD8- (33), y también se identificaron patrones CD4-/CD8+ o CD4-/CD8 en el linfoma hepatoesplénico y hepatocitotrópico (34). En cuanto al periodo de supervivencia, un estudio reciente encontró que los perros con fenotipo CD4-/CD8-/MHCII+ tenían un intervalo libre de progresión relativamente largo (2), mientras que otro estudio reportó una progresión más agresiva (35). Entre los linfomas en perros, se ha demostrado que el linfoma linfoblástico, que tiene la progresión más agresiva, expresa CD4-/CD8-o CD4+/CD8+ (36). En este estudio, no hubo diferencias significativas en el tiempo de supervivencia y no se confirmó una asociación significativa con factores pronósticos. Los cuatro perros con el fenotipo CD4/CD8 doble negativo no mostraron ninguna región tumoral anatómica común.
En las células B, se identificó MHCII- en aproximadamente el 53% de los casos, seguido de CD3+/CD21+ en el 41%, CD34+ en el 24% y CD79-en el 24%. Como se mencionó anteriormente, la baja expresión de MHCII es bien conocida como uno de los indicadores más confiables de malos resultados en el linfoma de células B humanas (27, 37). Los estudios en perros con linfoma de células B también han demostrado una asociación entre la baja expresión de MHCII y las altas tasas de mortalidad y recaída (11). Existe evidencia que sugiere que la expresión de MHCII se correlaciona con una inmunovigilancia más robusta en los linfomas de células B, así como con una supervivencia más prolongada en los linfomas de células T (12). Sin embargo, en los estudios que investigan la expresión de MHCII en el linfoma de células T, no está claro si se puede utilizar como factor pronóstico, ya que se ha demostrado que los perros con una fuerte expresión de MHCII tienen tiempos de supervivencia más cortos (2). Además, no se encontraron diferencias en el tiempo de supervivencia en función de la expresión de MHCII en una cohorte de DLBCL en un estudio posterior (38). Sin embargo, en este estudio, hubo una fuerte correlación entre la expresión de MHCII y los signos clínicos y el SNP causado por linfoma, como fiebre y linfadenopatía mediastínica craneal, lo que sugiere que la expresión de MHCII puede influir en la gravedad o el pronóstico de la enfermedad.
CD34 es un marcador de células precursoras hematopoyéticas bien conocido que se ha utilizado clínicamente para distinguir entre la leucemia linfoblástica aguda, la leucemia linfocítica crónica y el estadio leucémico (estadio V) del linfoma (28). Aunque se ha observado una expresión aberrante de CD34 en linfomas sin afectación de la médula ósea, su significado biológico sigue sin estar claro (5, 6, 39). En el caso del linfoma precursor, también se pueden identificar antígenos expresados en linfocitos en una etapa relativamente temprana de diferenciación, incluido el CD34. En este estudio, el 19% (5/27) de los perros mostraron expresión de CD34, y todos mostraron morfotipos de alto grado en la clasificación actualizada de Kiel. Cuatro de ellos fueron positivos para CD21, un marcador de células B maduras, lo que sugiere una expresión aberrante en el linfoma de células B maduras. Entre las células T, un perro fue identificado como CD34+ y CD4-/CD8-, lo que sugiere la posibilidad de linfoma precursor. En estudios previos, la tasa de expresión de CD34 fue del 10 al 29%. Cuando CD34 se coexpresa con CD21, un marcador de células B maduras, como en este estudio, se considera un fenotipo aberrante (5, 11). Desafortunadamente, debido a la falta de histopatología y análisis de médula ósea, se desconocía la clasificación de la OMS y la infiltración de médula ósea. Sin embargo, en el caso del linfoma de células B CD34+, teniendo en cuenta diversas características clínicas e inmunofenotípicas, y la evolución del tumor, se estimó que la posibilidad de leucemia aguda o linfoma precursor era baja. La respuesta a la quimioterapia de los perros con linfoma de células B CD34+ fue deficiente, ya que recidivó durante el protocolo de inducción (L-CHOP). A pesar de realizar un protocolo de rescate, la enfermedad se consideró progresiva con un tiempo de supervivencia de 99 días.
A continuación, se analizó la relación entre las aberraciones fenotípicas y las mediciones clínicas. La importancia clínica de las proporciones de células sanguíneas como biomarcador ya ha sido aceptada para varias enfermedades en humanos, y se están llevando a cabo investigaciones en tumores de diversos orígenes en perros. La inflamación juega un papel fundamental en la linfogénesis y la progresión tumoral, y viceversa, y puede provocar cambios en la composición de los leucocitos en sangre periférica (neutrófilos, monocitos y linfocitos, especialmente), dependiendo de la gravedad y extensión de la inflamación (40, 41). El PNR se confirmó como un factor pronóstico independiente en perros diagnosticados de DLBCL, con un valor de corte de 0,032; Un valor más alto aumenta el riesgo de progresión tumoral antes de los 180 días (42). Las interacciones plaqueta-neutrófilos en condiciones malignas están directamente relacionadas con el PNR, especialmente en humanos y perros con linfomas que presentan hipercoagulabilidad maligna como un SNP frecuente (42-45). En nuestro estudio, el PNR fue significativamente mayor en el grupo CD3+/CD21+ y CD45 que en el grupo sin este fenotipo. Aunque no hubo diferencias estadísticamente significativas en el tiempo de supervivencia entre los fenotipos PNR, CD45 y CD3+/CD21+, los perros con un PNR bajo generalmente tendían a estar «clínicamente enfermos» al ingreso. Sin embargo, esto no se relacionó con la progresión tumoral y no se pudo confirmar la relación con las aberrancias fenotípicas. Además, la NLR fue mayor en el grupo CD45+ que en el grupo CD45+. En el linfoma no Hodgkin humano, se identificó un NLR de 3,5 o más como factor pronóstico negativo (46, 47). En este estudio, dos de cada cuatro perros con CD45- fueron diagnosticados con TZL, y ambos tenían linfocitosis en el momento del diagnóstico, con neutrófilos dentro del rango de referencia. Se especula que la diferencia en NLR se debe en gran medida a la influencia de la linfocitosis. Sin embargo, el NLR bajo en comparación con los linfomas que muestran características clínicas agresivas (por ejemplo, DLBCL, linfoma de células T periféricas no especificado de otra manera) probablemente se deba al grado leve de respuesta inflamatoria inducida por el tumor (cambio de neutrófilos) y al cambio de la inmunidad del huésped (cambio de linfocitos) en comparación con el linfoma agresivo. Se presume que esto está en línea con el tipo clínicamente indolente y los signos clínicos similares a los de los linfomas agresivos, como la linfadenopatía generalizada y la linfocitosis, pero se cree que la progresión diferente está relacionada con los cambios en la proporción de células sanguíneas. La población de TZL era demasiado pequeña para detectar diferencias entre TZL y otros linfomas o entre TZL y perros sanos.
En comparación con los datos de química sérica, la concentración de calcio ionizado fue significativamente mayor en el grupo CD3+/CD21+. Sin embargo, su relevancia clínica sigue siendo desconocida. Entre los perros estudiados, dos tenían hipercalcemia, que se evaluó como SNP debido a la hormona relacionada con la hormona paratiroidea, mientras que uno se encontró con hipocalcemia. Se encontraron varios resultados significativos en la prueba exacta de Fisher, la mayoría de los cuales estaban relacionados con el SNP. Se cree que la fiebre neoplásica se debe a la respuesta inmunitaria innata a un antígeno tumoral o al desarrollo de células necróticas dentro del tumor, y es particularmente común en cánceres hematopoyéticos como el linfoma (14). En este estudio, se identificó una diferencia significativa en la presencia o ausencia de fiebre de acuerdo con la expresión de MHCII (p < 0,001). Se cree que esto está relacionado con la función de MHCII y el mecanismo de su regulación positiva en perros con tumores. Las citocinas como el TNF-α, el IFN-γ y la IL-1 regulan al alza la expresión de MHCII (48), y estas citocinas también activan la cascada del ácido araquidónico para producir prostaglandina E2, que actúa sobre el centro termorregulador del hipotálamo para regular el desarrollo de la fiebre (49). Aunque se desconoce la relación causal directa entre la expresión de MHCII y la fiebre, se necesita más investigación para determinar la relevancia clínica de MHCII como factor de pronóstico negativo y de la fiebre como SNP. También hubo una correlación entre la expresión de MHCII y las reacciones adversas a la quimioterapia. Cuando se expresó MHCII, el riesgo de reacciones adversas a la quimioterapia fue mayor que cuando no se expresó. La mayoría de las reacciones adversas fueron mielosupresión, principalmente neutropenia. La neutropenia inducida por quimioterapia de grado III o IV se conoce como un factor pronóstico favorable del linfoma en perros (50, 51). Asimismo, aunque no se pudo identificar la relación directa entre la expresión de MHCII y las reacciones adversas a la quimioterapia, se presume que existe un mecanismo desconocido entre ellas.
En el caso del linfoma CD34+, se puede suponer que se trata de una aberrancia derivada de precursores o remanente en el estadio de diferenciación de las células tumorales o de afectación leucémica en el linfoma de alto grado (52). El subestadio clínico «b» de la OMS se refiere a un estado con signos clínicos como letargo, inapetencia, pérdida de peso, poliuria/polidipsia o fiebre debido a linfoma, y es un factor pronóstico negativo para el linfoma (1, 53). En este estudio, los 11 perros en la subetapa «a» de la OMS no expresaron CD34, mientras que cinco de los 12 perros (41,7%) en la subetapa «b» expresaron CD34. Uno de los cinco perros que expresaban CD34 era de origen de células T, y el otro era de origen de células B. No hubo diferencias estadísticamente significativas en el tiempo de supervivencia, probablemente debido al pequeño tamaño de la muestra, pero cuatro de los perros CD34+ mostraron una rápida progresión tumoral después o durante el protocolo de inducción (L-CHOP). La respuesta a la quimioterapia en los cuatro perros se evaluó como DP y se realizó la eutanasia, o los perros murieron debido a la progresión del tumor. Cuando se analizó la correlación con las masas mediastínicas craneales, otro factor pronóstico negativo, se expresó CD34 en cuatro de siete perros (57,1%) con masas y solo en uno (6,3%) de 16 perros sin masas. Una vez más, no se pudo confirmar una relación causal entre estos factores, pero se presume que existe una posible asociación clínica entre la expresión de CD34, la respuesta a la quimioterapia y el intervalo libre de progresión.
Cuando se utilizó la curva de Kaplan-Meier para analizar el tiempo de supervivencia basado en el fenotipo aberrante, no se observaron diferencias estadísticamente significativas en la mediana del tiempo de supervivencia para ningún fenotipo. Estudios previos han demostrado que el pronóstico de las células T es peor que el de las células B, pero este estudio no identificó diferencias en el tiempo de supervivencia según el inmunofenotipo. Aunque los perros con linfoma de alto grado en la clasificación actualizada de Kiel mostraron más aberrancias inmunofenotípicas, no se confirmó si está relacionado con el pronóstico. Existen estudios previos que demuestran que el pronóstico está relacionado con morfotipos específicos con la clasificación de Kiel actualizada (54). Sin embargo, este estudio no confirmó la asociación con morfotipos detallados, aberraciones inmunofenotípicas y pronóstico debido a la pequeña población. El período de supervivencia fue significativamente más corto en el grupo de SNP, particularmente en perros con anemia y monocitosis. Estos resultados se alinean con los factores pronósticos negativos del linfoma previamente conocidos. El pequeño tamaño de la muestra y los casos en los que no se confirmó la progresión tumoral debido a la pérdida durante el seguimiento pueden haber contribuido a estos hallazgos.
Este estudio tuvo algunas limitaciones asociadas a su carácter retrospectivo. En primer lugar, debido al pequeño número de individuos, hubo limitaciones en el análisis de varios aspectos de las aberraciones fenotípicas, que se sabe que tienen una frecuencia particularmente baja. En este estudio, se identificó que dos de los 19 perros tenían un origen no B ni de células T, y se confirmó que ambos eran positivos para el marcador de células NK NKp46. Por lo tanto, se podría diagnosticar un linfoma de células NK. Sin embargo, fue difícil comparar las características clínicas porque solo había dos perros. En segundo lugar, todavía se producen algunos anticuerpos que se dirigen a los perros para la citometría de flujo, y la mayoría de los utilizados en este estudio son anticuerpos que reaccionan de forma cruzada con células humanas, de rata o de ratón. En este caso, se podría observar una expresión falsa debido al riesgo de enlace inespecífico. Sin embargo, en este estudio, esto era poco probable porque las células de fondo, incluidos los neutrófilos, los monocitos y los linfocitos reactivos, no mostraron una unión inespecífica a cada anticuerpo. Además, hay pocos anticuerpos disponibles para subdividir aún más los fenotipos dentro del mismo linaje. Al identificar los cambios fenotípicos según la etapa de maduración de los linfocitos y compararlos con las mediciones clínicas, se pueden identificar subtipos que aún no son ampliamente conocidos en medicina veterinaria, como el linfoma precursor. En tercer lugar, la clasificación de la OMS basada en la histopatología y el análisis de la médula ósea sigue siendo una herramienta clave para el diagnóstico y la clasificación del linfoma y para distinguirlo de las enfermedades originadas en la médula ósea, como la leucemia. En particular, es necesario realizar un análisis de médula ósea para determinar si la expresión de CD34 identificada en este estudio es un inmunofenotipo aberrante, un linfoma precursor o una leucemia linfoblástica aguda, y los análisis de sangre periférica son insuficientes. Aunque no es posible evaluar la respuesta al tratamiento o el pronóstico utilizando estos métodos solos, es importante una evaluación clara, ya que la clasificación histológica y la clasificación son un factor pronóstico importante. En la práctica clínica, la resección quirúrgica no se intenta con frecuencia, ya que el diagnóstico puede lograrse hasta cierto punto con una citología e inmunofenotipado menos invasivos. Estudios futuros en poblaciones con resultados patológicos seguros pueden permitir un análisis preciso entre los factores pronósticos y las mediciones clínicas. Se espera que estos estudios ayuden a nuestra comprensión de varios subtipos de linfoma en perros mediante el análisis de cómo las funciones que se ven alteradas por la expresión aberrante de antígenos se expresan clínicamente a nivel de expresión génica.
Declaración de disponibilidad de datos
Las contribuciones originales presentadas en el estudio están incluidas en el artículo/Material complementario, las consultas posteriores pueden dirigirse al autor correspondiente.
Declaración ética
Los estudios en animales fueron aprobados por la Universidad Nacional de Gyengsang, IACUC no. GNU-230425-D0087. Los estudios se llevaron a cabo de acuerdo con la legislación local y los requisitos institucionales. Se obtuvo el consentimiento informado por escrito de los propietarios para la participación de sus animales en este estudio.
Contribuciones de los autores
HB: Conceptualización, Recursos, Software, Escritura – revisión y edición, Curación de datos, Análisis formal, Investigación, Metodología, Visualización, Escritura – borrador original. S-KK: Curación de datos, Análisis formal, Recursos, Redacción, revisión y edición, Adquisición de fondos, Validación. DY: Obtención de fondos, Recursos, Validación, Redacción, revisión y edición, Conceptualización, Administración de proyectos, Software, Supervisión.
Financiación
El/los autor/es declara(n) haber recibido apoyo financiero para la investigación, autoría y/o publicación de este artículo. Esta investigación contó con el apoyo del Instituto Coreano de Planificación y Evaluación de la Tecnología en la Alimentación, la Agricultura y la Silvicultura (IPET) a través del Programa de Desarrollo Tecnológico de la Industria del Ciclo de Vida de los Animales de Compañía, financiado por el Ministerio de Agricultura, Alimentación y Asuntos Rurales (MAFRA) (322092-04-1-HD030).
Conflicto de intereses
Los autores declaran que la investigación se llevó a cabo en ausencia de relaciones comerciales o financieras que pudieran interpretarse como un posible conflicto de intereses.
Nota del editor
Todas las afirmaciones expresadas en este artículo son únicamente las de los autores y no representan necesariamente las de sus organizaciones afiliadas, ni las del editor, los editores y los revisores. Cualquier producto que pueda ser evaluado en este artículo, o afirmación que pueda ser hecha por su fabricante, no está garantizado ni respaldado por el editor.
Material complementario
El material complementario para este artículo se puede encontrar en línea en: https://www.frontiersin.org/articles/10.3389/fvets.2023.1254458/full#supplementary-material
Referencias
1. Teske, E, van Heerde, P, Rutteman, GR, Kurzman, ID, Moore, PF y MacEwen, EG. Factores pronósticos para el tratamiento del linfoma maligno en perros. J Am Vet Med Assoc. (1994) 205:1722–8.
2. Deravi, N, Berke, O, Woods, JP y Bienzle, D. Los inmunotipos específicos de linfoma de células T caninas se asocian con diferentes resultados. Veterinario Inmunol Inmunopatíaco. (2017) 191:5–13. doi: 10.1016/j.vetimm.2017.07.008
Resumen de PubMed | Texto completo de CrossRef | Google Académico
3. Ruslander, DA, Gebhard, DH, Tompkins, MB, Grindem, CB y Page, RL. Caracterización inmunofenotípica de los trastornos linfoproliferativos caninos. En vivo. (1997) 11:169–72.
4. Schmidt, CJ, Domenico, L, Ward, P, Barcos, MP y Stewart, CC. Expresión aberrante del antígeno detectada por citometría de flujo multiparamétrica de tres colores en linfomas de células B de grado intermedio y alto. Linfoma leuk. (1999) 34:539–44. doi: 10.3109/10428199909058481
Resumen de PubMed | Texto completo de CrossRef | Google Académico
5. Wilkerson, MJ, Dolce, K, Koopman, T, Shuman, W, Chun, R, Garrett, L, et al. Diferenciación de linaje de linfoma/leucemias caninas y expresión aberrante de moléculas de EC. Veterinario Inmunol Inmunopatíaco. (2005) 106:179–96. doi: 10.1016/j.vetimm.2005.02.020
Resumen de PubMed | Texto completo de CrossRef | Google Académico
6. Gelain, ME, Mazzilli, M, Riondato, F, Marconato, L, y Comazzi, S. Fenotipos aberrantes y expresión cuantitativa de antígenos en diferentes subtipos de linfoma canino por citometría de flujo. Veterinario Inmunol Inmunopatíaco. (2008) 121:179–88. doi: 10.1016/j.vetimm.2007.09.018
7. Comazzi, S, y Gelain, ME. Uso del inmunofenotipado por citometría de flujo para refinar el diagnóstico citológico del linfoma canino. Veterinario J. (2011) 188:149–55. doi: 10.1016/j.tvjl.2010.03.011
8. Sehn, LH. Uso óptimo de los factores pronósticos en el linfoma no Hodgkin. Programa Hematología Am Soc Hematol Educ. (2006) 2006:295–302. doi: 10.1182/asheducation-2006.1.295
9. Berglund, M, Thunberg, U, Amini, RM, Book, M, Roos, G, Erlanson, M, et al. Evaluación del inmunofenotipo en el linfoma difuso de células B grandes y su impacto en el pronóstico. Mod Pathol. (2005) 18:1113–20. doi: 10.1038/modpathol.3800396
10. Rahemtullah, A, Longtine, JA, Harris, NL, Dorn, M, Zembowicz, A, Quintanilla-Fend, L, et al. Linfoma de células T CD20+: análisis clinicopatológico de 9 casos y una revisión de la literatura. Am J Surg Pathol. (2008) 32:1593–607. doi: 10.1097/PAS.0b013e31817d7452
11. Rao, S, Lana, S, Eickhoff, J, Marcus, E, Avery, PR, Morley, PS, et al. La expresión del complejo mayor de histocompatibilidad de clase II y el tamaño celular predicen de forma independiente la supervivencia en el linfoma canino de células B. J Veterinario Pasante Med. (2011) 25:1097–105. doi: 10.1111/j.1939-1676.2011.0767.x
12. Avery, PR, Burton, J, Bromberek, JL, Seelig, DM, Elmslie, R, Correa, S, et al. Caracterización citométrica de flujo y evolución clínica del linfoma de células T CD4+ en perros: 67 casos. J Veterinario Pasante Med. (2014) 28:538–46. doi: 10.1111/jvim.12304
Resumen de PubMed | Texto completo de CrossRef | Google Académico
13. Williams, MJ, Avery, AC, Lana, SE, Hillers, KR, Bachand, AM y Avery, PR. Enfermedad linfoproliferativa canina caracterizada por linfocitosis: marcadores inmunofenotípicos de pronóstico. J Veterinario Pasante Med. (2008) 22:596–601. doi: 10.1111/j.1939-1676.2008.0041.x
Resumen de PubMed | Texto completo de CrossRef | Google Académico
14. Vail, DM, Thamm, DH y Liptak, JM. Libro electrónico de oncología clínica de pequeños animales de Withrow y MacEwen, 6ª ed. Edimburgo, Reino Unido: Elsevier Health Sciences (2019).
15. Huang, W-H, Lee, J-J, Liao, AT y Wang, S-L. El síndrome paraneoplásico como factor pronóstico en perros con linfoma multicéntrico. Pasante J Appl Res Vet Med. (2020):18.
16. Valli, VE, San Myint, M, Barthel, A, Bienzle, D, Caswell, J, Colbatzky, F, et al. Clasificación de los linfomas malignos caninos según los criterios de la Organización Mundial de la Salud. Veterinario Pathol. (2011) 48:198–211. doi: 10.1177/0300985810379428
Resumen de PubMed | Texto completo de CrossRef | Google Académico
17. Ponce, F, Marchal, T, Magnol, JP, Turinelli, V, Ledieu, D, Bonnefont, C, et al. Estudio morfológico de 608 casos de linfoma maligno canino en Francia, centrado en las similitudes comparativas entre la morfología del linfoma canino y humano. Veterinario Pathol. (2010) 47:414–33. doi: 10.1177/0300985810363902
Resumen de PubMed | Texto completo de CrossRef | Google Académico
18. Fournel-Fleury, C, Magnol, JP, Bricaire, P, Marchal, T, Chabanne, L, Delverdier, A, et al. Clasificación citohistológica e inmunológica de los linfomas malignos caninos: comparación con linfomas no Hodgkin humanos. J Comp Pathol. (1997) 117:35–59. doi: 10.1016/S0021-9975(97)80065-5
Resumen de PubMed | Texto completo de CrossRef | Google Académico
19. Martini, V, Poggi, A, Riondato, F, Gelain, ME, Aresu, L, y Comazzi, S. Detección citométrica de flujo de aberrancias fenotípicas en el linfoma canino de células pequeñas claras. Veterinario Comp Oncol. (2015) 13:281–7. doi: 10.1111/vco.12043
Resumen de PubMed | Texto completo de CrossRef | Google Académico
20. Celant, E, Marconato, L, Stefanello, D, Moretti, P, Aresu, L, Comazzi, S, et al. Presentación clínica y clínico patológica de 310 perros afectados por linfoma con expresión antigénica aberrante identificada mediante citometría de flujo. Veterinaria Sci. (2022) 9:9. doi: 10.3390/vetsci9040184
21. Vail, DM, Michels, GM, Khanna, C, Selting, KA, Londres, CA, y Veterinary Cooperative Oncology, G. Criterios de evaluación de la respuesta para el linfoma ganglionar periférico en perros (v1.0): un documento de consenso del grupo de oncología cooperativa veterinaria (VCOG). Veterinario Comp Oncol. (2010) 8:28–37. doi: 10.1111/j.1476-5829.2009.00200.x
22. Millar, HR, Simpson, JG y Stalker, AL. Una evaluación del método de precipitación térmica para la estimación del fibrinógeno plasmático. J Clin Pathol. (1971) 24:827–30. doi: 10.1136/jcp.24.9.827
Resumen de PubMed | Texto completo de CrossRef | Google Académico
23. Shin, SW, Jin Lim, Y, Bae, H, Kim, J, Cho, A, Park, J, et al. CD3+/CD4+/CD5+/CD8+/CD21+/CD34-/CD45-/CD79a-/TCRαβ+/TCRγδ-/MHCII+ Linfoma de la zona T en un perro con linfadenopatía generalizada: informe de un caso. Revista Coreana de Investigación Veterinaria. (2021) 61:E21. doi: 10.14405/kjvr.2021.61.e21
24. Seelig, DM, Avery, AC, Ehrhart, EJ, y Linden, MA. Las características diagnósticas comparativas del linfoma canino y humano. Veterinaria Sci. (2016) 3:3. doi: 10.3390/vetsci3020011
25. Ito, D, Frantz, AM, y Modiano, JF. El linfoma canino como modelo comparativo para el linfoma no Hodgkin humano: avances recientes y aplicaciones. Veterinario Inmunol Inmunopatíaco. (2014) 159:192–201. doi: 10.1016/j.vetimm.2014.02.016
Resumen de PubMed | Texto completo de CrossRef | Google Académico
26. Pawlak, A, Rapak, A, Drynda, A, Poradowski, D, Zbyryt, I, Dzimira, S, et al. Caracterización inmunofenotípica del linfoma maligno canino: un estudio retrospectivo de los casos diagnosticados en Polonia Baja Silesia, durante el período 2011-2013. Veterinario Comp Oncol. (2016) 14:52–60. doi: 10.1111/vco.12112
27. Rimsza, LM, Roberts, RA, Miller, TP, Unger, JM, LeBlanc, M, Braziel, RM, et al. La pérdida de la expresión del gen MHC de clase II y de la proteína en el linfoma difuso de células B grandes se relaciona con una disminución de la inmunovigilancia tumoral y una mala supervivencia de los pacientes, independientemente de otros factores pronósticos: un estudio de seguimiento del proyecto de perfiles moleculares de leucemia y linfoma. Sangre. (2004) 103:4251–8. doi: 10.1182/blood-2003-07-2365
Resumen de PubMed | Texto completo de CrossRef | Google Académico
28. Moore, P, y Vernau, W. Linfocitos: moléculas de diferenciación en el diagnóstico y el pronóstico. Hematología veterinaria de Schalm, 5ª ed. (2000):247–55.
29. Seelig, DM, Avery, P, Webb, T, Yoshimoto, J, Bromberek, J, Ehrhart, EJ, et al. Linfoma canino de la zona T: características inmunofenotípicas únicas, resultado y características de la población. J Veterinario Pasante Med. (2014) 28:878–86. doi: 10.1111/jvim.12343
Resumen de PubMed | Texto completo de CrossRef | Google Académico
30. Dahlke, MH, Larsen, SR, Rasko, JE, y Schlitt, HJ. La biología de CD45 y su uso como diana terapéutica. Linfoma leuk. (2004) 45:229–36. doi: 10.1080/1042819031000151932
31. Martini, V, Cozzi, M, Arico, A, Dalla Rovere, G, Poggi, A, Albonico, F, et al. La pérdida de la expresión de la superficie de las células CD45 en el linfoma canino de la zona T es el resultado de la reducción de la expresión génica. Veterinario Inmunol Inmunopatíaco. (2017) 187:14–9. doi: 10.1016/j.vetimm.2017.03.006
Resumen de PubMed | Texto completo de CrossRef | Google Académico
32. Borin-Crivellenti, S, De Nardi, AB, Varallo, GR, Tinucci-Costa, M, Raposo-Ferreira, TMM, Laufer-Amorim, R, et al. Linfoma de células T en la lengua de un perro con afectación cutánea y estriada de los músculos de las extremidades anteriores. Acta Sci Vet. (2014) 42:1–6.
33. Moore, PF, Affolter, VK, Graham, PS y Hirt, B. Linfoma cutáneo de células T epiteliotrópico canino: una investigación del inmunofenotipo del receptor de células T, la topografía de la lesión y la clonalidad molecular. Veterinario Dermatol. (2009) 20:569–76. doi: 10.1111/j.1365-3164.2009.00814.x
Resumen de PubMed | Texto completo de CrossRef | Google Académico
34. Keller, SM, Vernau, W, Hodges, J, Kass, PH, Vilches-Moure, JG, McElliot, V, et al. Linfoma hepatoesplénico y hepatocitotrópico de células T: dos tipos distintos de linfoma de células T en perros. Veterinario Pathol. (2013) 50:281–90. doi: 10.1177/0300985812451625
35. Lurie, DM, Milner, RJ, Suter, SE y Vernau, W. Subclasificación inmunofenotípica y citomorfológica del linfoma de células T en la raza bóxer. Veterinario Inmunol Inmunopatíaco. (2008) 125:102–10. doi: 10.1016/j.vetimm.2008.05.009
Resumen de PubMed | Texto completo de CrossRef | Google Académico
36. Ponce, F, Magnol, J, Blavier, A, Bonnefont, C, Ghernati, I, Felman, P, et al. Estudio clínico, morfológico e inmunológico de 13 casos de linfoma linfoblástico canino: comparación con la entidad humana. Comp Clin Pathol. (2003) 12:75–83. doi: 10.1007/s00580-003-0480-4
37. Veelken, H, Dannheim, SV, Moenting, JS, Martens, U, Finke, J y Schmitt-Graeff, A. Inmunofenotipo como factor pronóstico del linfoma difuso de células B grandes en pacientes sometidos a terapia clínica adaptada al riesgo. Ann Oncol. (2007) 18:931–9. doi: 10.1093/annonc/mdm012
Resumen de PubMed | Texto completo de CrossRef | Google Académico
38. Wolf-Ringwall, A, López, L, Elmslie, R, Fowler, B, Lori, J, Sfiligoi, G, et al. Evaluación prospectiva de las características citométricas de flujo, el diagnóstico histopatológico y el resultado clínico en perros con linfoma de células B vírgenes tratados con un protocolo CHOP de 19 semanas. Veterinario Comp Oncol. (2020) 18:342–52. doi: 10.1111/vco.12553
39. Marconato, L, Gelain, ME, y Comazzi, S. El perro como posible modelo animal para el linfoma no Hodgkin humano: una revisión. Hematol Oncol. (2013) 31:1–9. doi: 10.1002/hon.2017
40. Hjelmström, P. Neogénesis linfoide: formación de novo de tejido linfoide en la inflamación crónica a través de la expresión de quimiocinas homing. J Leukoc Biol. (2001) 69:331–9. doi: 10.1189/jlb.69.3.331
41. Carbone, A, Tripodo, C, Carlo-Stella, C, Santoro, A, y Gloghini, A. El papel de la inflamación en el linfoma. Adv Exp Med Biol. (2014) 816:315–33. doi: 10.1007/978-3-0348-0837-8_12
42. Henriques, J, Felisberto, R, Constantino-Casas, F, Cabeçadas, J y Dobson, J. Proporciones de células sanguíneas periféricas como factores pronósticos en el linfoma difuso canino de células B grandes tratado con el protocolo CHOP. Veterinario Comp Oncol. (2021) 19:242–52. doi: 10.1111/vco.12668
Resumen de PubMed | Texto completo de CrossRef | Google Académico
43. Kol, A, Marks, SL, Skorupski, KA, Kass, PH, Guerrero, T, Gosselin, RC, et al. Monitorización hemostática seriada de perros con linfoma multicéntrico. Veterinario Comp Oncol. (2015) 13:255–66. doi: 10.1111/vco.12041
44. Caruso, V, Di Castelnuovo, A, Meschengieser, S, Lazzari, MA, De Gaetano, G, Storti, S, et al. Complicaciones trombóticas en pacientes adultos con linfoma: un meta-análisis de 29 cohortes independientes que incluyen 18 018 pacientes y 1149 eventos Sangre. J Am Soc Hematol. (2010) 115:5322–8. doi: 10.1182/blood-2010-01-258624
45. Caine, GJ, Stonelake, PS, Lip, GY y Kehoe, ST. El estado de hipercoagulabilidad de la neoplasia maligna: patogenia y debate actual. Neoplasia. (2002) 4:465–73. doi: 10.1038/sj.neo.7900263
Resumen de PubMed | Texto completo de CrossRef | Google Académico
46. Mutz, M, Boudreaux, B, Kearney, M, Stroda, K, Gaunt, S y Shiomitsu, K. Valor pronóstico de la concentración absoluta basal de linfocitos y la relación neutrófilos/linfocitos en perros con linfoma multicéntrico recién diagnosticado. Veterinario Comp Oncol. (2015) 13:337–47. doi: 10.1111/vco.12045
Resumen de PubMed | Texto completo de CrossRef | Google Académico
47. Porrata, LF, Ristow, K, Habermann, T, Inwards, DJ, Micallef, IN, y Markovic, SN. Predicción de la supervivencia de los pacientes con linfoma difuso de células B grandes mediante la relación inicial de neutrófilos/linfocitos. Am J Hematol. (2010) 85:896–9. doi: 10.1002/ajh.21849
Resumen de PubMed | Texto completo de CrossRef | Google Académico
48. Guardiola, J y Maffei, A. Control de la expresión génica MHC clase II en enfermedades autoinmunes, infecciosas y neoplásicas. Crit Rev Immunol. (1993) 13:247–68.
49. Ettinger, SJ, Feldman, EC, y Cote, E. Texbook of Veterinary internal medicine, 8ª ed. Missouri, Estados Unidos: Elsevier ciencias de la salud (2016).
50. Wang, SL, Lee, JJ y Liao, AT. La neutropenia inducida por quimioterapia se relaciona con una duración prolongada de la remisión y un tiempo de supervivencia en el linfoma canino. Veterinario J. (2015) 205:69–73. doi: 10.1016/j.tvjl.2015.04.032
Resumen de PubMed | Texto completo de CrossRef | Google Académico
51. Vaughan, A, Johnson, JL, y Williams, LE. Impacto de la intensidad de la dosis quimioterapéutica y la toxicidad hematológica en la duración de la primera remisión en perros con linfoma tratados con un protocolo de quimiorradioterapia. J Veterinario Pasante Med. (2007) 21:1332–9. doi: 10.1111/j.1939-1676.2007.tb01956.x
Resumen de PubMed | Texto completo de CrossRef | Google Académico
52. Tasca, S, Carli, E, Caldin, M, Menegazzo, L, Furlanello, T, y Gallego, LS. Anomalías hematológicas y resultados del inmunofenotipado por citometría de flujo en perros con neoplasia hematopoyética: 210 casos (2002-2006). Veterinario Clin Pathol. (2009) 38:2–12. doi: 10.1111/j.1939-165X.2008.00099.x
Resumen de PubMed | Texto completo de CrossRef | Google Académico
53. Jagielski, D, Lechowski, R, Hoffmann-Jagielska, M, y Winiarczyk, S. Estudio retrospectivo de la incidencia y factores pronósticos del linfoma multicéntrico en perros (1998-2000). J Vet Med A Physiol Pathol Clin Med. (2002) 49:419–24. doi: 10.1046/j.1439-0442.2002.00458.x
Resumen de PubMed | Texto completo de CrossRef | Google Académico
54. Sayag, D, Fournel-Fleury, C y Ponce, F. Significado pronóstico de los morfotipos en los linfomas caninos: una revisión sistemática de la literatura. Veterinario Comp Oncol. (2018) 16:12–9. doi: 10.1111/vco.12320
Resumen de PubMed | Texto completo de CrossRef | Google Académico
Palabras clave: linfoma, inmunofenotipado, citometría de flujo, aberrancias, perro
Cita: Bae H, Kim S-K y Yu D (2023) Análisis comparativo del inmunofenotipo aberrante y las características clínicas en perros con linfoma: un estudio de 27 casos. Frente. Vet. Sci. 10:1254458. doi: 10.3389/fvets.2023.1254458
Recibido: 07 de julio de 2023; Aceptado: 03 de octubre de 2023;
Publicado: 16 octubre 2023.
Editado por:
Carlos Eduardo Fonseca-Alves, Universidad Paulista, Brasil
Revisado por:
Joy Archer, Universidad de Cambridge, Reino
Unido Maria Elena Gelain, Universidad de Padua, Italia
Derechos de autor © 2023 Bae, Kim y Yu. Este es un artículo de acceso abierto distribuido bajo los términos de la Licencia Creative Commons Attribution License (CC BY).
*Correspondencia: DoHyeon Yu, yudh@gnu.ac.kr
†ORCID: Hyeona Bae orcid.org/0000-0002-2888-5782
Sang-Ki Kim orcid.org/0000-0003-0292-8200
DoHyeon Yu orcid.org/0000-0001-7645-6926
Renuncia: Todas las afirmaciones expresadas en este artículo son únicamente las de los autores y no representan necesariamente las de sus organizaciones afiliadas, ni las del editor, los editores y los revisores. Cualquier producto que pueda ser evaluado en este artículo o afirmación que pueda hacer su fabricante no está garantizado ni respaldado por el editor.
Date de alta y recibe nuestro 👉🏼 Diario Digital AXÓN INFORMAVET ONE HEALTH
Date de alta y recibe nuestro 👉🏼 Boletín Digital de Foro Agro Ganadero
Noticias animales de compañía
Noticias animales de producción
Trabajos técnicos animales de producción
Trabajos técnicos animales de compañía