Conectar la dinámica de las enfermedades del ganado con el aprendizaje humano y las decisiones de bioseguridad
Conectar la dinámica de las enfermedades del ganado con el aprendizaje humano y las decisiones de bioseguridad
 Gabriela Bucini1,2*
Gabriela Bucini1,2*  Eric M. Clark1,2
Eric M. Clark1,2  Scott C. Merrill1,2
Scott C. Merrill1,2  Ollin Langle-Chimal3
Ollin Langle-Chimal3  Asim Zia2,3,4
Asim Zia2,3,4  Cristóbal Koliba2,4
Cristóbal Koliba2,4  Nick Cheney3
Nick Cheney3  Serge Wiltshire2,5
Serge Wiltshire2,5  Lucas Trinidad2,6
Lucas Trinidad2,6  Julia M. Smith7
Julia M. Smith7- 1Departamento de Ciencias de las Plantas y del Suelo, Universidad de Vermont, Burlington, VT, Estados Unidos
- 2Laboratorio de Simulación y Juegos Socio-Ecológicos, Universidad de Vermont, Burlington, VT, Estados Unidos
- 3Departamento de Ciencias de la Computación, Universidad de Vermont, Burlington, VT, Estados Unidos
- 4Departamento de Desarrollo Comunitario y Economía Aplicada, Universidad de Vermont, Burlington, VT, Estados Unidos
- 5Centro de Investigación de Sistemas Alimentarios, Universidad de Vermont, Burlington, VT, Estados Unidos
- 6Laboratorio de Investigación y Análisis de Biología Computacional, Universidad de Victoria, Victoria, BC, Canadá
- 7Departamento de Ciencias Animales y Veterinarias, Universidad de Vermont, Burlington, VT, Estados Unidos
La aceleración de la propagación de enfermedades animales en todo el mundo debido al aumento del movimiento de animales, piensos y humanos ha impulsado un creciente cuerpo de investigación epidemiológica, así como un interés más profundo en los estudios del comportamiento humano destinados a comprender su interconexión. Las medidas de bioseguridad pueden reducir el riesgo de infección, pero la tolerancia al riesgo humano puede obstaculizar las inversiones y el cumplimiento de la bioseguridad. Los seres humanos pueden aprender de las dificultades y volverse más reacios al riesgo, pero a veces se vuelven más tolerantes al riesgo porque olvidan las experiencias negativas que ocurrieron en el pasado o porque llegan a creer que son inmunes. Representamos la complejidad del sistema de producción porcina con las amenazas de enfermedades, la toma de decisiones humanas y la actitud de riesgo humano utilizando un modelo basado en agentes. Nuestro objetivo es explorar el papel de los comportamientos tolerantes al riesgo y las consecuencias de las inversiones tardías en bioseguridad. Realizamos experimentos con simulaciones Monte Carlo de escenarios diseñados con diferente tolerancia al riesgo entre los productores porcinos y derivamos distribuciones y tendencias de bioseguridad e incidencia del virus de la diarrea epidémica porcina (PEDv) que emergen en el sistema. Los datos de salida nos permitieron examinar las interacciones entre los modos de tolerancia al riesgo y los tiempos de respuesta de bioseguridad, discutiendo las consecuencias para la protección contra enfermedades en el sistema de producción. Los resultados muestran que las respuestas de bioseguridad apresuradas y tardías o los cambios lentos hacia un cultivo bioseguro no garantizan el control de la contaminación cuando la enfermedad ya se ha propagado en el sistema. En un esfuerzo por apoyar la prevención eficaz de enfermedades, los resultados de nuestro modelo pueden informar la formulación de políticas para avanzar hacia sistemas de producción más resilientes y saludables. La dinámica modelada de la actitud de riesgo también tiene el potencial de mejorar las estrategias de comunicación para empujar y establecer comportamientos de aversión al riesgo, equipando así el sistema de producción en caso de incursiones de enfermedades extrañas.
Introducción
En todo el mundo, millones de animales de granja están expuestos a enfermedades infecciosas de forma regular. Los seres humanos tienen un papel fundamental que desempeñar para proteger a los animales y reducir el riesgo de infección. La incursión de una enfermedad animal foránea (DCP) en un país previamente libre de la enfermedad puede tener consecuencias devastadoras, que incluyen no solo la muerte directa de los animales, sino también acciones de respuesta a la enfermedad, como la despoblación de animales o las zonas de control de movimientos, las restricciones al mercado y las amenazas para la salud humana. Por ejemplo, la propagación de la peste porcina africana (PPA) a países cercanos a los Estados Unidos ha suscitado serias preocupaciones en la industria porcina de los Estados Unidos debido a la alta tasa de contagio del virus y a la mortalidad porcina de hasta el 100% (1–3). La incursión de la PPA en los Estados Unidos provocaría pérdidas económicas desastrosas y desestabilización, y efectos indirectos incluso en el sector de la salud humana (4). El conocimiento y la conciencia de la patología de la enfermedad y la propagación geográfica han motivado a la industria porcina de los Estados Unidos, así como a las agencias gubernamentales, a diseñar planes estratégicos y capacitaciones para la prevención y respuesta a enfermedades (3, 5). De hecho, se entiende que los seres humanos pueden controlar el riesgo de propagación de la enfermedad, pero, dada la variabilidad existente en la percepción y el comportamiento del riesgo humano, ¿qué se necesita para controlar la enfermedad?
Los protocolos de bioseguridad dirigidos a la bioexclusión están diseñados específicamente para guiar las decisiones humanas sobre las prácticas agrícolas y proteger el sistema de producción de las incursiones de enfermedades animales. Razones importantes para el apoyo y la promoción continuos de las prácticas de bioseguridad son que las habilidades técnicas deben mantenerse actualizadas y también que las dimensiones humanas, como la personalidad y las actitudes de riesgo, influyen en las decisiones sobre si invertir en bioseguridad y cumplir con ella (6–12). A pesar de todos los éxitos en la prevención de enfermedades del ganado, persisten muchos problemas relacionados con las inversiones en bioseguridad y el cumplimiento (7, 13–15). Algunos de estos problemas pueden ser difíciles de explorar en el mundo real debido a los obstáculos prácticos inherentes al riesgo de propagación de enfermedades. Por lo tanto, la modelación es una herramienta clave para explorar escenarios e investigar mecanismos que actúan en un sistema de producción y que pueden obstaculizar o respaldar los esfuerzos de control de enfermedades. El objetivo de este artículo es aplicar el modelado basado en agentes a la ciencia de la prevención de enfermedades con un enfoque de investigación en la dinámica social que conecta las actitudes humanas de riesgo con las decisiones sobre bioseguridad. El papel humano es particularmente interesante porque puede alterar los resultados esperados de la implementación de bioseguridad probada en laboratorio.
La ciencia computacional en forma de modelos basados en agentes (ABM, por sus siglas en inglés) es fundamental para explorar los patrones de propagación de enfermedades que surgen en sistemas complejos caracterizados por muchas decisiones individuales, interacciones dinámicas, estocasticidad y entornos variables. Los modelos epidemiológicos continúan evolucionando gracias tanto a las herramientas analíticas emergentes como a la recopilación de datos casi en tiempo real (16-22). Sin embargo, hasta donde sabemos, la mayoría de los modelos epidemiológicos actuales rara vez incluyen la dinámica de la actitud de riesgo, sus efectos sobre las respuestas individuales a la presencia de la enfermedad y los comportamientos adaptativos. Un ejemplo de la importancia del comportamiento humano lo dan Nicolas et al. (23), donde los patrones de transmisión de enfermedades infecciosas estaban claramente conectados con eventos culturales, así como con movimientos estacionales humanos y animales. Los estudios de sistemas socioecológicos ofrecen información sobre la comprensión de la actitud humana hacia el riesgo, el cambio de las percepciones de riesgo y las acciones consecuentes para la prevención o respuesta a las enfermedades. A lo largo de varios años, hemos estado abordando estas cuestiones con un conjunto complementario de herramientas de investigación (24) aplicadas a la comprensión de los impactos de las actitudes de riesgo en la propagación del virus de la diarrea epidémica porcina (PEDv). En este trabajo, investigamos a través de una serie de escenarios simulados el efecto de la tolerancia al riesgo en los comportamientos que influyen en el control de la enfermedad. Prestamos especial atención al papel que desempeña el momento de las intervenciones de bioseguridad a medida que los agentes productores aprenden comportamientos más reacios al riesgo mientras la enfermedad se propaga en el sistema.
Diagnosticado por primera vez en los Estados Unidos en la primavera de 2013, el PEDv se propagó rápidamente a 13 estados en < 2 meses (25). El virus causante es altamente infeccioso y patógeno, con un breve período de incubación de aproximadamente 2 días y que oscila entre 1 y 8 días (26). El virus causa vómitos, diarrea acuosa severa y deshidratación, y afecta a cerdos de todas las edades (27, 28). El PEDv es un coronavirus (familia: coronoaviridae) con infectividad resultante de una pequeña dosis infecciosa (28, 29). Entre los lechones lactantes, la infección se propaga rápidamente con casi un 100% de pérdida mortal. Se ha observado poca mortalidad en cerdos destetados y mayores, pero hay morbilidad, sufrimiento y pérdida de peso visible. Los adultos se vuelven inmunes, temporalmente, después de la recuperación. El PEDv puede sobrevivir en el estiércol y en la alimentación animal (30, 31) con temperaturas frías que aumentan su supervivencia (32). Puede transmitirse tanto por contacto directo como indirecto, especialmente por vía fecal-oral. La transmisión indirecta puede ocurrir a través de fómites contaminados, incluida la ropa de granja (32), los piensos (31, 33-35) y los remolques de transporte (36, 37). El PEDv en el aire es otro mecanismo de transmisión que ocurre a través de la ruta fecal-nasal de cerdo a cerdo o a través de partículas en aerosol que se mueven de una granja a otra (28, 38). Las múltiples rutas de transmisión, incluso con la alimentación, hicieron que fuera particularmente difícil controlar la PED con las prácticas tradicionales de bioseguridad.
La PED es una de las enfermedades virales más devastadoras de los cerdos en los Estados Unidos y el mundo, lo que genera importantes preocupaciones financieras para la industria porcina (39-43). Las grandes pérdidas causadas por la DEP pueden reducirse significativamente con estrategias de bioseguridad que controlen el virus en los diferentes nodos de la cadena productiva (sitios de producción porcina, fábricas de piensos, plantas procesadoras de carne) así como durante el movimiento de animales y productos (42). Los productores pueden invertir e implementar medidas de bioseguridad con el objetivo de controlar o erradicar la infección por el virus PED. Algunos ejemplos de bioseguridad utilizados en una instalación de producción son el establecimiento de una línea de separación, la limpieza con agua caliente con detergente, la desinfección, la cuarentena de animales y productos, la calefacción y el secado de vehículos, la eliminación completa del estiércol, la eliminación de animales muertos, la desinfección del personal y el equipo, y el mantenimiento de registros de visitantes (44–46). Cuando reflexionamos sobre quiénes participan en estos procedimientos, entendemos que, si bien el contagio de la enfermedad está claramente ligado al carácter epidemiológico de una enfermedad, los seres humanos controlan la transmisión con sus comportamientos y actividades.
Este estudio es parte de un programa más amplio que se centra en el desarrollo de métodos para comprender los procesos subyacentes del comportamiento humano que influyen en la eficacia de la bioseguridad durante un brote de enfermedad en un sistema de producción animal. En este trabajo se presenta un modelo basado en agentes (ABM) que representa un sistema de producción porcina, diseñado para capturar aspectos conductuales asociados con la toma de decisiones en un contexto de riesgo de enfermedad animal. Las métricas de toma de decisiones se parametrizaron utilizando información derivada de juegos experimentales. Ilustramos el potencial del enfoque que combina ABM y juegos experimentales con la propagación de PEDv dentro de un sistema de producción porcina. Tenemos en cuenta los factores de riesgo epidemiológicos y humanos que afectan a las prácticas de bioseguridad y a la consiguiente incidencia de enfermedades. Sobre la base de investigaciones y esfuerzos de modelado publicados anteriormente (47, 48), presentamos mejoras en varios aspectos del ABM que, creemos, lo hacen más realista y capaz de proporcionar nuevos conocimientos. Estas mejoras están guiadas por el desarrollo de juegos experimentales que proporcionan observaciones sobre cómo la toma de decisiones humanas afecta las inversiones y el cumplimiento de la bioseguridad, así como sobre los cambios en la percepción del riesgo en los participantes (8, 10-12, 24, 49, 50). En general, una mayor percepción del riesgo de enfermedad cambia el comportamiento hacia más inversiones en bioseguridad y un mayor cumplimiento de la bioseguridad (49, 51). Aunque puede parecer evidente que la incidencia de la enfermedad debería aumentar a medida que la población está compuesta por individuos más tolerantes al riesgo, este argumento ignora las posibles dinámicas complejas que surgen de los cambios en el comportamiento de riesgo durante un brote de enfermedad.
Los objetivos generales de este trabajo son: (1) explorar el papel de los comportamientos tolerantes al riesgo en la bioseguridad y la incidencia de enfermedades a nivel de sistema, y (2) realizar una evaluación de las consecuencias de las inversiones tardías en bioseguridad en el control de enfermedades. Nos interesa responder a tres preguntas:
• Si inicializamos el ABM con una población de productores porcinos tolerante al riesgo en lugar de una población sin riesgo (configuración de modelo calibrado), ¿cómo evoluciona la incidencia de la enfermedad después de un brote?
• Si modelamos la inversión en bioseguridad a niveles cada vez más altos de tolerancia (inversiones retrasadas), ¿observamos un escenario de tolerancia en el que las filtraciones de enfermedades en el sistema (pandemias) se convierten en la mayoría de los resultados de la simulación?
• ¿Qué importancia tiene el aprendizaje de la aversión al riesgo para contrarrestar las condiciones iniciales de tolerancia al riesgo?
La idea de estas preguntas surgió de conversaciones con veterinarios de nuestro equipo asesor que recordaron el brote de PEDv de 2013 en los Estados Unidos y observaron de primera mano que el tiempo que tardó el sistema en actualizar su bioseguridad causó altas tasas de transmisión de enfermedades y pérdidas de producción durante aproximadamente 2 años. Simulamos esta situación de baja preparación y respuesta tardía de bioseguridad mediante la codificación de conductas tolerantes al riesgo. Los resultados contribuirán a reflexionar sobre la importancia de cronometrar la respuesta de bioseguridad y pueden servir de base para el diseño de políticas de bioseguridad.
Métodos
Nuestro modelo vincula la bioseguridad (inversión y cumplimiento) con la dinámica de infección a dos escalas diferentes, dentro de las redes de instalaciones de producción y en las instalaciones individuales (Figura 1). Obsérvese que en el documento utilizamos indistintamente los términos agente productor de cerdos, productor de cerdos y locales de producción. La voluntad de un agente productor de invertir en bioseguridad se basa en la dinámica de la red. Cada productor forma parte de una red de locales supervisados por un veterinario que comunica el nivel de infección en la red. Un productor decide si invertir o no en bioseguridad en función del riesgo percibido de infección cuando el veterinario envía información. En cambio, el cumplimiento de la bioseguridad se basa en lo que sucede a escala de un local y se establece que disminuirá con el tiempo mientras el local esté libre de enfermedades, pero se establece en la capacidad máxima de bioseguridad del local tan pronto como el local se convierte en síntoma de enfermedad.
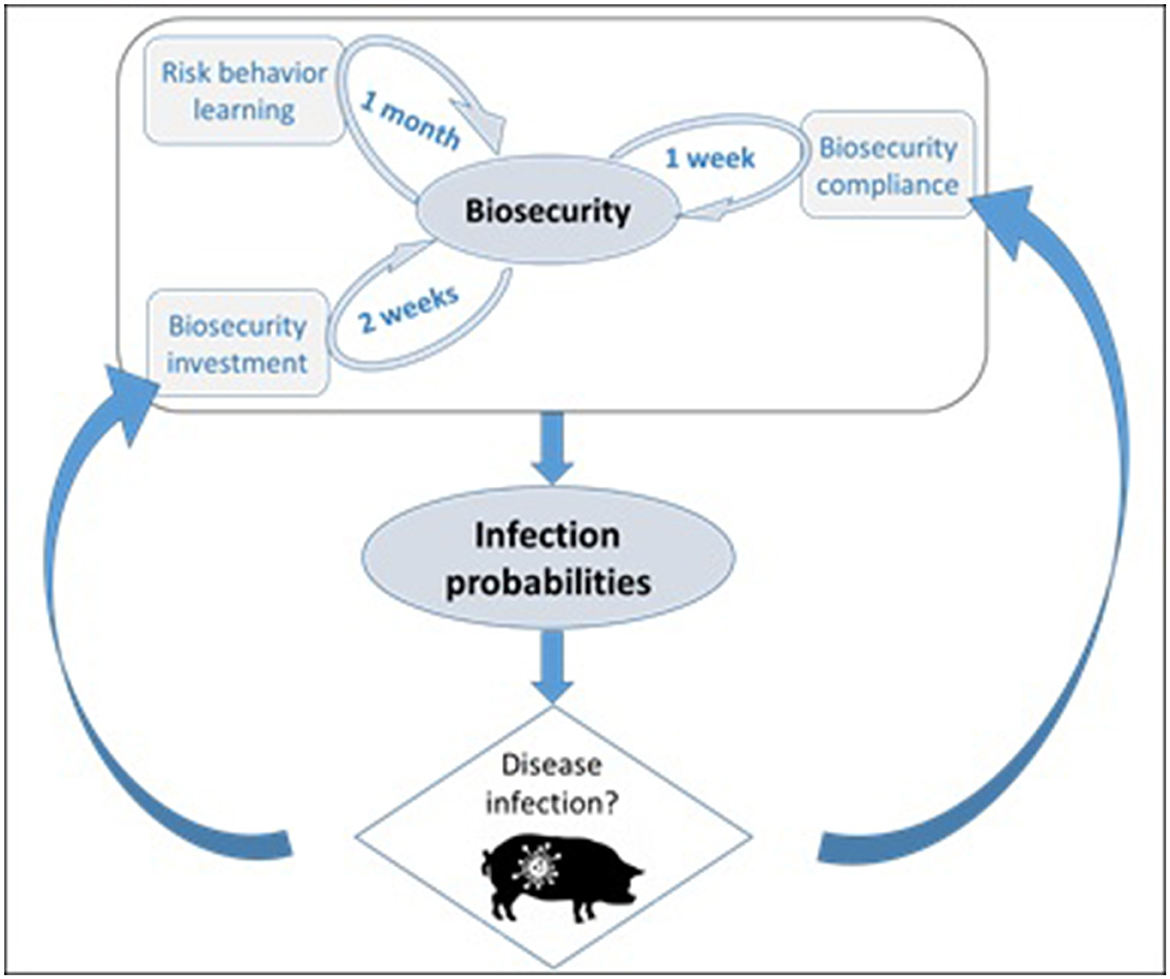
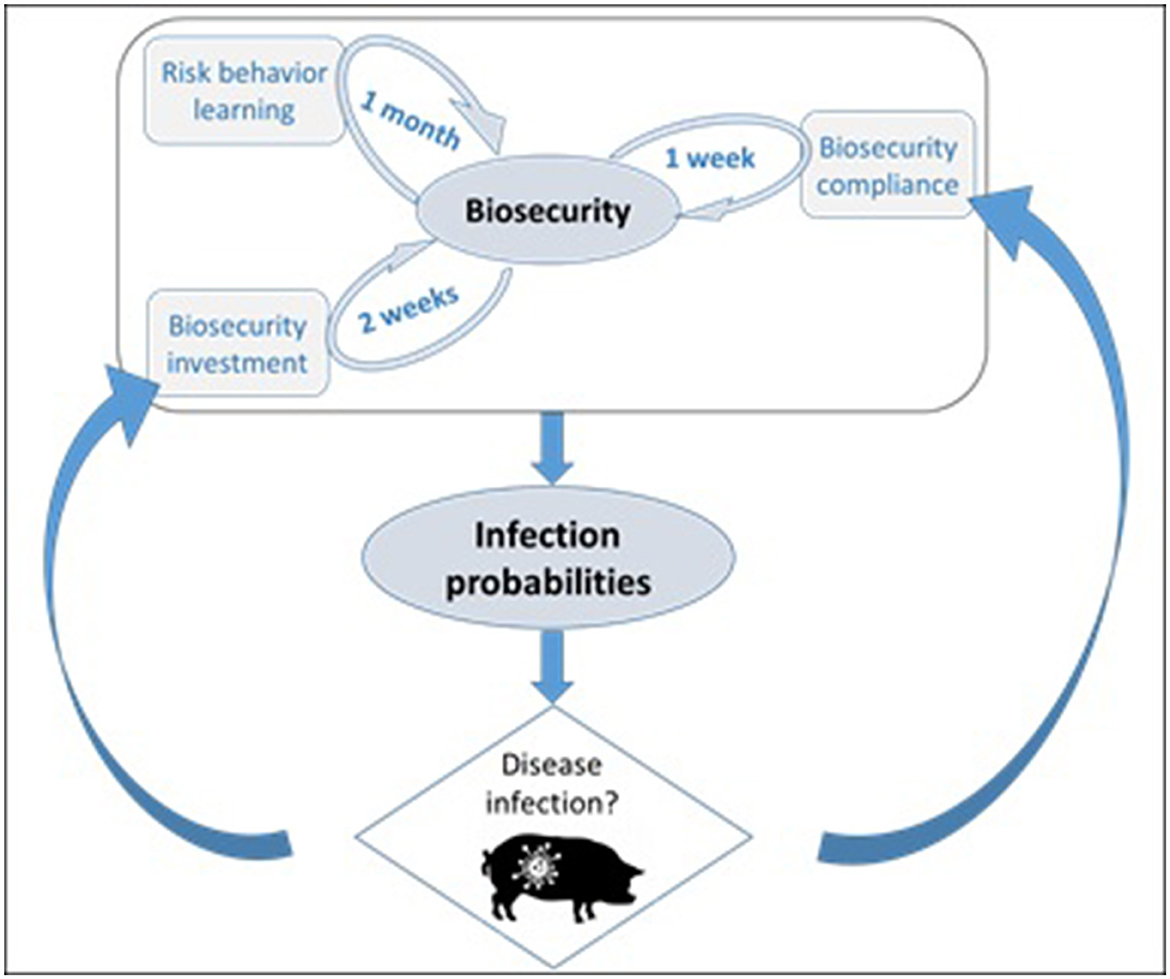 Figura 1. La probabilidad de infección está directamente relacionada con la bioseguridad en el ABM. El nivel de bioseguridad de un agente productor porcino en el modelo depende de su cumplimiento, de su disposición a realizar inversiones en bioseguridad y de su actitud hacia el riesgo, que puede cambiar con el tiempo (aprendizaje). La infección por enfermedades se retroalimenta en la bioseguridad de dos maneras: inversiones en bioseguridad en respuesta a la vecindad de la enfermedad y cumplimiento total cuando un local se vuelve sintomático. El mecanismo de aprendizaje implementado es agnóstico y, por lo tanto, independiente de las condiciones de enfermedad simuladas.
Figura 1. La probabilidad de infección está directamente relacionada con la bioseguridad en el ABM. El nivel de bioseguridad de un agente productor porcino en el modelo depende de su cumplimiento, de su disposición a realizar inversiones en bioseguridad y de su actitud hacia el riesgo, que puede cambiar con el tiempo (aprendizaje). La infección por enfermedades se retroalimenta en la bioseguridad de dos maneras: inversiones en bioseguridad en respuesta a la vecindad de la enfermedad y cumplimiento total cuando un local se vuelve sintomático. El mecanismo de aprendizaje implementado es agnóstico y, por lo tanto, independiente de las condiciones de enfermedad simuladas.
Arquitectura del modelo
En esta sección, proporcionamos una descripción general de la arquitectura y el funcionamiento del modelo. Se pueden encontrar más detalles en el documento ODD + D en el material complementario. El ABM fue desarrollado en el software AnyLogic (https://www.anylogic.com) con el código escrito en Java (https://www.oracle.com/technetwork/java/index.html). La arquitectura del modelo simula un sistema de producción porcina con agentes que representan instalaciones de producción, fábricas de piensos y plantas de sacrificio. El sistema simulado para este estudio refleja la densidad, los tipos de operación y los tamaños de las unidades de producción encontradas en Carolina del Norte con datos proporcionados por la herramienta Farm Location and Agricultural Production Simulator (FLAPS), que se basa en el Censo de Agricultura de 2012 y la fotografía aérea (52). Esta es una región en la que se crían cerdos de forma intensiva. El sistema de producción ABM tiene los seis tipos de agentes productores que se encuentran en la cadena de producción porcina de los Estados Unidos: de parto a destete, de destete a engorde, de alimentador a engorde, de parto a engorde, de destete a engorde y de engorde a engorde. Las redes se construyen con agentes productores y agentes de área de servicio (fábricas de piensos y plantas de sacrificio) que comercian de acuerdo con su rol en la industria, y sus vínculos tienen una estructura vecina más cercana. Estas redes subyacen al movimiento del ganado y los piensos y codifican los patrones de contacto entre los agentes que siguen los patógenos a medida que se propaga la epidemia.
Epidemiología
El componente epidemiológico ABM simula la transmisión de enfermedades a través de mecanismos directos e indirectos relacionados con el movimiento de animales y piensos a través de redes de agentes. El modelo no modela explícitamente la transmisión aérea de PEDv (28). Cada agente (productor porcino, planta de sacrificio y fábrica de piensos) tiene un modelo de transición de estado estocástico que incluye estados limpios (susceptibles), subclínicos infectados (asintomáticos) e infectados sintomáticos (Figura 2). La transmisión de enfermedades puede ocurrir durante cualquier interacción de agentes con funciones de probabilidad que dependen de tres variables: la bioseguridad del agente, el tipo de interacción de la red y la estacionalidad. Los coeficientes se estimaron mediante la opinión de expertos. La inclusión de un tiempo de incubación de la enfermedad que regule la transición del estado subclínico al sintomático ha sido una adición importante al componente epidemiológico actual de ABM en comparación con las versiones anteriores (47, 48). El período de incubación de las enfermedades infecciosas es el tiempo que transcurre desde la infección hasta la aparición de los síntomas. El huésped infectado puede ser infeccioso durante el período de incubación y, por lo tanto, la presencia de este parámetro es directamente relevante para la dinámica epidemiológica, así como para la prevención y el control. El período de incubación de la enfermedad nos permite modelar distintos comportamientos durante los estados asintomáticos y sintomáticos de la infección. Durante el tiempo de incubación, se modela un local para que funcione de forma rutinaria con intercambios de entrada y salida de cerdos y partos in situ, por lo que se puede propagar la enfermedad. Después del período de incubación, los síntomas de la enfermedad desencadenan protocolos de seguridad y bioseguridad más altos, como la interrupción de los movimientos de los animales y, por lo tanto, una disminución en la posibilidad de propagación de la enfermedad.
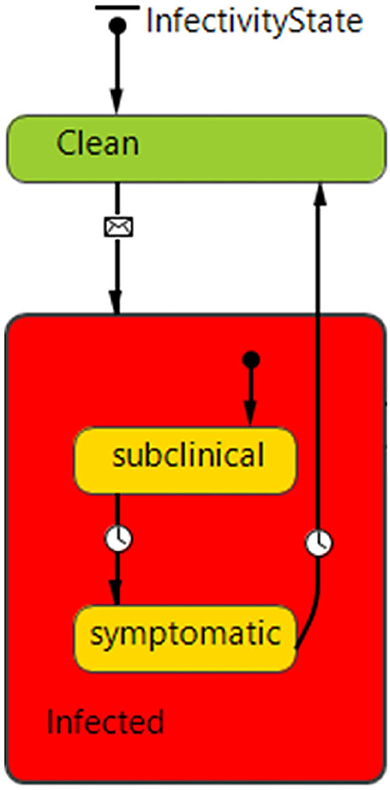 Figura 2. InfectividadGráfico de estado que define los estados de enfermedad y las transiciones para los agentes productores de cerdos. Cada agente comienza en el estado «Limpio» (sin enfermedad) y puede pasar al estado infectado, que es un estado compuesto que consta de subestados subclínicos (asintomáticos) y sintomáticos. Las transiciones están reguladas por mensajes y condiciones de tiempo de espera (2 días entre subclínico y sintomático, 50 días de infectado sintomático a limpio-susceptible). Los agentes de la fábrica de piensos y de la planta de sacrificio solo pueden estar limpios o infectados.
Figura 2. InfectividadGráfico de estado que define los estados de enfermedad y las transiciones para los agentes productores de cerdos. Cada agente comienza en el estado «Limpio» (sin enfermedad) y puede pasar al estado infectado, que es un estado compuesto que consta de subestados subclínicos (asintomáticos) y sintomáticos. Las transiciones están reguladas por mensajes y condiciones de tiempo de espera (2 días entre subclínico y sintomático, 50 días de infectado sintomático a limpio-susceptible). Los agentes de la fábrica de piensos y de la planta de sacrificio solo pueden estar limpios o infectados.
Comportamiento humano
Los datos experimentales de juegos recopilados por el Laboratorio de Juegos y Simulación Socio-Ecológica (SEGS) han demostrado que el bajo cumplimiento de los protocolos de bioseguridad por parte de los trabajadores, la mala planificación de la bioseguridad por parte de los gerentes o los débiles mensajes de bioseguridad por parte de los líderes, crean vulnerabilidades en el sistema de producción dejándolo más expuesto a brechas de bioseguridad y enfermedades (8-12, 49-51, 53, 54). Los juegos experimentales también nos permitieron identificar tendencias de comportamiento dentro de los datos del juego, encontrando tres grupos distintos que difieren según la actitud de riesgo (8). La actitud hacia el riesgo puede entenderse como la evaluación positiva (favorable) o negativa (desfavorable) de un individuo de asumir riesgos cuando hay un brote de enfermedad. Las personas con aversión al riesgo tienden a invertir en bioseguridad incluso cuando no hay o hay pocas infecciones en la red (el riesgo de infección es casi inexistente). Los «oportunistas» están dispuestos a invertir en bioseguridad a medida que surge el riesgo, lo que significa que no invierten en bioseguridad cuando el riesgo percibido es bajo, sino que comienzan a invertir más cuando el riesgo es alto. Por último, las personas tolerantes al riesgo difícilmente están dispuestas a invertir en bioseguridad a menos que el entorno epidémico se perciba como extremadamente peligroso. De acuerdo con estos resultados, nuestro ABM se basó en la suposición de que el cumplimiento de la bioseguridad y las inversiones pueden conducir a mejoras tanto en la salud como en la producción animal. Desarrollamos tres mecanismos principales en el modelo que modulan cómo las actitudes de riesgo y la heurística de decisión de los agentes influyen en la bioseguridad: inversiones en bioseguridad, cumplimiento de la bioseguridad y aprendizaje de actitudes al riesgo.
Los agentes productores pueden elegir si invertir o no en bioseguridad en función de las actualizaciones del estado de la enfermedad (número de establecimientos infectados en la red) enviadas por su agente veterinario. En concreto, la probabilidad de que cada agente invierta en bioseguridad adicional se rige por una función logística y depende tanto del número de granjas infectadas dentro de su red veterinaria como de la actitud de riesgo del agente. Estas heurísticas se basan en datos recopilados por SEGS que muestran que a medida que aumentan las infecciones en las granjas cercanas, es más probable que los gerentes inviertan en bioseguridad, incluso si eso significa recibir un golpe financiero por adelantado (8, 51).
El cumplimiento de la bioseguridad se basa en el fenómeno del distanciamiento psicológico, según el cual cuanto más tiempo haya ocurrido un evento en el pasado, menos probable es que sea un factor de decisión destacado (55-57). Los juegos experimentales mostraron que el cumplimiento de los protocolos de bioseguridad por parte de los empleados de la granja tiende a disminuir cuanto más tiempo ha pasado desde que la granja experimentó un evento de infección (9, 49). En la ABM, codificamos este fenómeno con una disminución lineal de la bioseguridad a lo largo del tiempo mientras un productor no sea sintomático, y cuando un productor entra en el estado sintomático se suspende la disminución de la bioseguridad.
Los agentes productores pueden cambiar su actitud de riesgo inicial en el transcurso de una simulación en el ABM actual, mientras que en versiones anteriores, los productores de cerdos tenían actitudes de riesgo fijas. Los cambios de actitud al riesgo se codifican con un proceso de aprendizaje agnóstico, lo que significa que los cambios de actitud al riesgo se derivaron estadísticamente de juegos experimentales y se asignaron a cada agente ABM al inicio del modelo. El aprendizaje no se genera contextualmente en la simulación como respuesta a las interacciones con el entorno del modelo. La decisión de añadir este mecanismo de comportamiento humano como un aprendizaje agnóstico refleja nuestra conciencia de la complejidad de los posibles impulsores de los cambios de actitud ante el riesgo. Sabemos por la literatura y los resultados de nuestros juegos experimentales que los humanos pueden cambiar su respuesta al riesgo, adaptándola a lo que experimentan y a la información que reciben (58, 59). La actitud hacia el riesgo puede cambiar dependiendo, por ejemplo, de los efectos combinados de las experiencias previas con la enfermedad, la frecuencia de aparición de la enfermedad, el rol laboral, la inversión personal y la responsabilidad con el manejo de la enfermedad. Por ejemplo, un productor que ha lidiado con éxito con la enfermedad en el pasado podría aprender que la enfermedad no es un riesgo y volverse más tolerante al riesgo en el futuro. Nuestro juego experimental emuló el proceso de toma de decisiones de inversión en bioseguridad, lo que permitió a los participantes reaccionar ante varios escenarios de brotes eligiendo si invertir o no en bioseguridad para mitigar la probabilidad de infección (8, 51). Utilizando una gran muestra de participantes en línea, cuantificamos las distribuciones del riesgo conductual con respecto a la información sobre la incidencia de enfermedades y la protección de la bioseguridad a lo largo de una cadena de suministro simulada. Esto también nos permitió evaluar cómo nuestros participantes hacen la transición a comportamientos más o menos riesgosos a lo largo de sus experiencias simuladas. Estas distribuciones de las actitudes de riesgo observadas y sus trayectorias conductuales se integraron en el diseño de nuestros agentes modelo.
Simulaciones de modelos individuales
Se diseña un experimento de simulación para examinar los agentes a lo largo del tiempo con el fin de explorar el efecto del movimiento de animales y alimentos y las actitudes de riesgo individuales en la propagación de la enfermedad. Tras la inicialización, a cada agente individual se le asigna un papel en la cadena de producción (instalaciones de producción de cerdos, fábrica de piensos o planta de sacrificio) y, en el caso del agente de las instalaciones del productor de cerdos, una actitud de riesgo única (reacio, oportunista o tolerante) y una regla de aprendizaje de actitud de riesgo de permanecer en el mismo grupo de riesgo o pasar a uno diferente. Las simulaciones de modelos se ejecutan en un paso diario. Una simulación comienza con una fase de inicialización de 1.610 días (232 semanas), después de la cual se inicia un brote de enfermedad y la simulación continúa durante un total de 2.982 días (196 semanas), produciendo datos para los análisis. Por lo tanto, los resultados de la simulación coinciden con el número de semanas del conjunto de datos observado (del 1 de junio de 2014 al 25 de febrero de 2018), que fue publicado por el Departamento de Agricultura de los Estados Unidos (Informe sobre la situación de la enfermedad por coronavirus entérico porcino, marzo de 2018 de http://www.aphis.usda.gov/animal-health/secd). Las variables de salida fueron medidas de enfermedad y bioseguridad.
Análisis de modelos
Nuestro análisis siguió tres pasos: primero la calibración del ABM, luego un análisis de sensibilidad y finalmente experimentos con escenarios de tolerancia al riesgo relacionados con nuestras preguntas de investigación. Las simulaciones para estos análisis de modelos se llevaron a cabo en AnyLogic. Los escenarios experimentales tanto para el análisis de sensibilidad como para el análisis de riesgo-tolerancia consistieron en simulaciones de Monte Carlo (MC) con 500 réplicas con diferentes semillas aleatorias. Los experimentos de MC generan series temporales semanales de tres variables de interés: incidencia de enfermedades, número de inversiones en bioseguridad y bioseguridad media a nivel de sistema. Los datos simulados se recopilaron y exportaron a archivos para su análisis estadístico y visualización.
Los datos de salida se procesaron con R (60) y R Studio (61). Se analizaron las series temporales de las variables, así como las variables de resumen como la incidencia total, las inversiones totales en bioseguridad y la bioseguridad media durante el tiempo de simulación. Las variables de resumen se calcularon como la suma de una serie temporal en el caso de la incidencia de enfermedades y las inversiones en bioseguridad y como el promedio de una serie temporal en el caso de la bioseguridad media. Se compararon las distribuciones de las variables entre escenarios mediante pruebas no paramétricas porque los datos no cumplían ni con el supuesto de normalidad (prueba de Shapiro-Wilk) ni con varianzas iguales (prueba de Brown-Forsythe y prueba de Fligner-Killeen). Una comparación por pares con la prueba de Kolmogorov-Smirnov de dos muestras evaluó las diferencias entre escenarios para estas variables de salida y se utilizaron diagramas de caja para mostrar los resultados. Para el análisis de riesgo-tolerancia, también se calcularon modelos de regresión lineal en las series temporales de incidencia que se ajustan por separado a cada MC replicado para cada escenario. Comparamos las distribuciones de las pendientes de regresión de la misma manera que comparamos las otras variables de salida para comprobar si la enfermedad disminuyó (pendiente de regresión negativa) o no en el sistema durante el tiempo simulado.
Calibración
Calibramos el ABM haciendo coincidir la incidencia semanal del sistema modelado y la realidad observada, de modo que la simulación pueda estar más cerca del caso real. El análisis se realizó en el entorno de software AnyLogic utilizando un algoritmo genético OptQuest incorporado para minimizar el error cuadrático medio (RMSE) entre la incidencia modelada y observada durante el período histórico del 05/31/2014 al 02/25/2018. Por calibración, determinamos cuatro parámetros del modelo que controlan el comportamiento humano y sobre los cuales carecemos de datos: el aumento de la bioseguridad para cada inversión, la tasa de disminución de la bioseguridad debido a la falta de cumplimiento (distanciamiento psicológico), la diferencia relativa en el número de agentes infectados necesarios para desencadenar una inversión en bioseguridad para los tres grupos de actitud de riesgo, y el lapso de tiempo mínimo permitido entre las inversiones en bioseguridad. Procedimos a una primera calibración con rangos de búsqueda más grandes y luego redujimos esos rangos alrededor de los valores de los parámetros optimizados para una calibración más refinada. Cada escenario de calibración se ejecutó con 100 réplicas.
Análisis de sensibilidad
Con el análisis de sensibilidad, se buscó comprender el comportamiento del modelo en respuesta a la variación de cuatro parámetros del modelo directamente relacionados con la incidencia de la enfermedad (Tabla 1). Utilizamos el modelo calibrado como referencia y probamos la variabilidad condicional en la incidencia variando un parámetro a la vez, manteniendo los demás en valores basales. No se probaron interacciones entre parámetros.
Experimentos de escenarios de tolerancia al riesgo
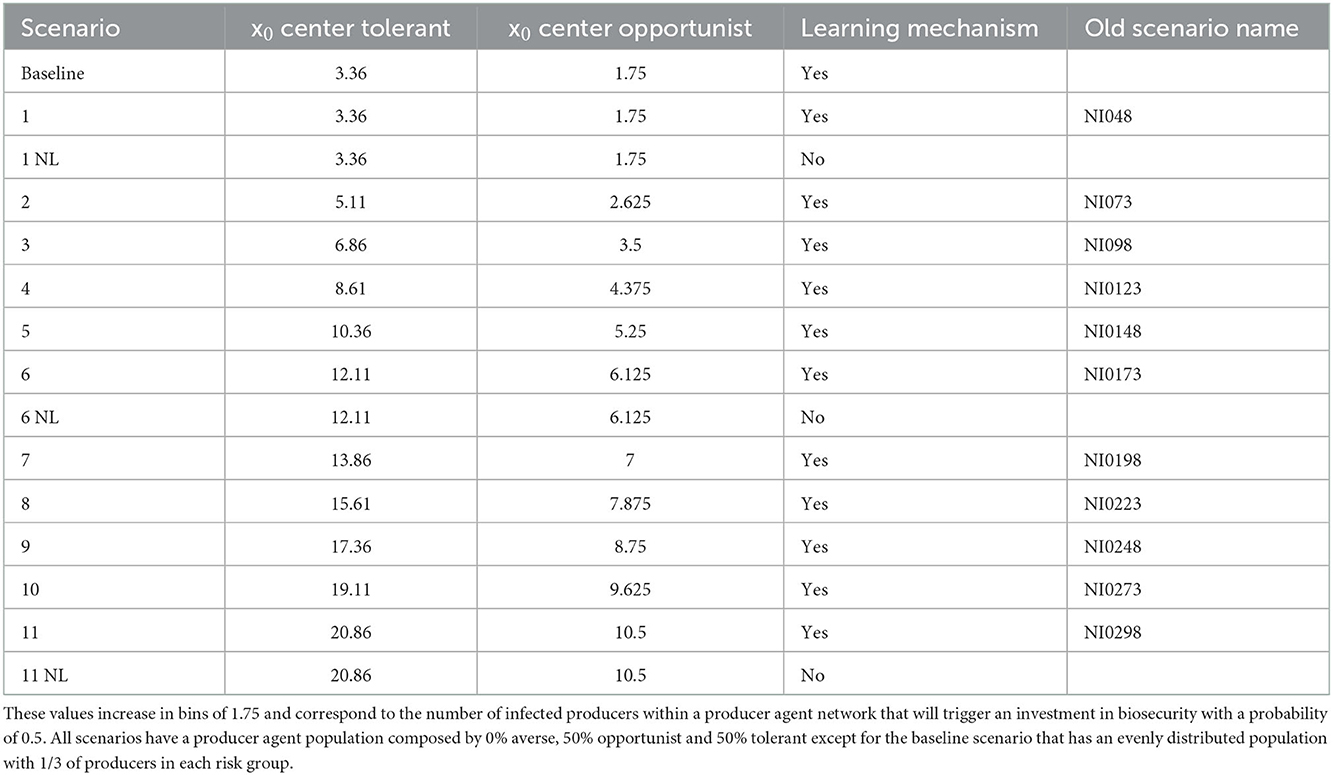
A través de una serie de experimentos de simulación se exploraron el potencial de epidemias generalizadas, el retraso en la protección de la bioseguridad y la imprevisibilidad de la propagación de enfermedades que acompañan a la tolerancia al riesgo. Estábamos interesados en examinar una población de productores simulada que reflejara condiciones de tolerancia al riesgo relativamente alta en el sistema. La decisión surgió de conversaciones con veterinarios que presenciaron el brote de PED y se dieron cuenta de que los productores no estaban preparados con la bioseguridad adecuada para enfrentar la inesperada y virulenta enfermedad. Establecimos tres experimentos para analizar la incidencia y la bioseguridad en sistemas simulados e implementamos tres ABMs donde variamos diferentes parámetros del modelo y/o mecanismos que controlan el comportamiento de riesgo (Tablas 2, 3):
1. Experimento 1: Comparamos el sistema de referencia con una población inicial (ingenua) de agentes productores de cerdos de 33% de aversión, 33% de oportunistas, 33% de tolerantes a un sistema más tolerante al riesgo con una población inicial de 0% de aversión, 50% de oportunista de riesgo y 50% de tolerancia al riesgo. Todas las simulaciones se ejecutaron con el mecanismo de aprendizaje de riesgo-actitud activado. Se espera que el ABM proporcione una estimación del cambio en la incidencia de la enfermedad relacionada con diferentes condiciones iniciales.
2. Experimento 2: Inicializando el modelo con una población más tolerante (escenario 2 del experimento 1), variamos el parámetro x0, que representa el número de agentes productores infectados (instalaciones porcinas infectadas) necesarios para desencadenar una inversión en bioseguridad con una probabilidad de 0,5. En un conjunto de 11 escenarios, el parámetro x0 varía de 3,36 a 20,86 en incrementos de 1,75 tanto para los tolerantes como para los oportunistas y se fija en 0,14 para los agentes adversos (Tabla 3). A pesar de su significado, la x0 los valores no son números enteros porque se reescalan para el modelo donde se establecen a través de un parámetro auxiliar vinculado a la función de probabilidad de la inversión en bioseguridad (ver ODD + D). Todas las simulaciones se ejecutaron con el mecanismo de aprendizaje de riesgo-actitud activado. Se espera que este ABM estime los efectos de retrasar las inversiones en bioseguridad debido a la tolerancia al riesgo.
3. Experimento 3: Sobre la base de los experimentos 1 y 2, comparamos los efectos de la presencia y la ausencia del mecanismo de aprendizaje de riesgo-actitud. Se seleccionaron los escenarios 1, 6 y 11 del experimento 2 (Tabla 3) con x: bajo, intermedio y alto.0 respectivamente, e inicializó el modelo con una población de agentes productores de 50% tolerantes y 50% oportunistas. En cada uno de los experimentos anteriores, el ABM con el mecanismo de aprendizaje riesgo-actitud se configuró para conducir a una población final con un 47% de aversión al riesgo, un 30% de oportunista y un 23% de tolerante (Tabla 4). Cuando el mecanismo de aprendizaje está desactivado, la población mantiene la distribución inicial de la actitud ante el riesgo durante todo el tiempo de simulación. Se espera que este ABM proporcione información sobre el efecto de la fuerza opuesta proporcionada por el aprendizaje de riesgo-actitud frente a la dinámica desencadenada por las conductas tolerantes.
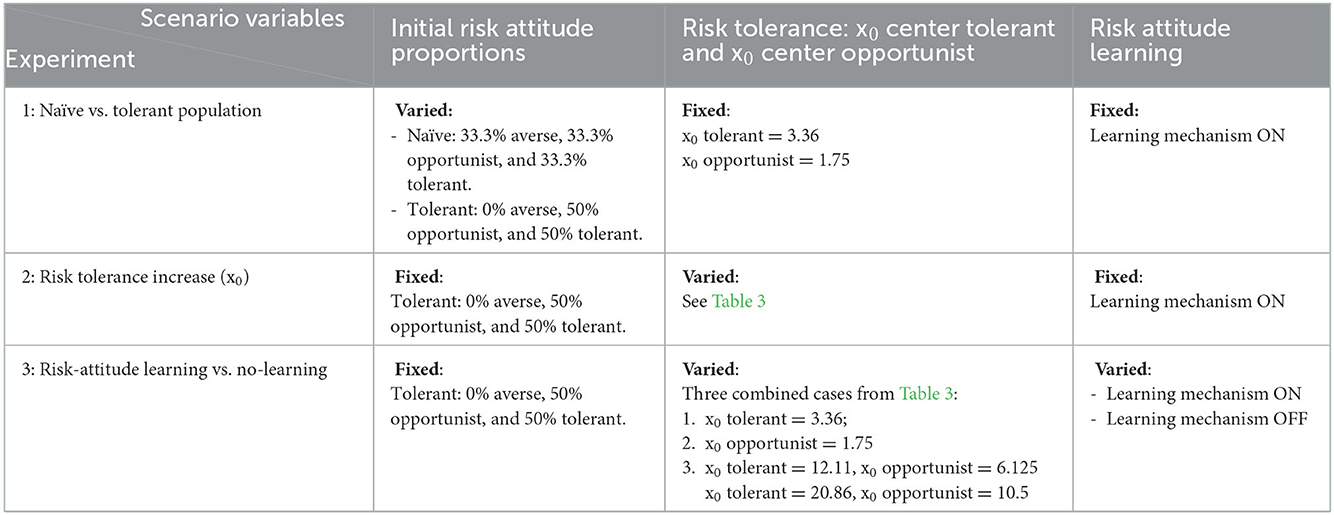 Tabla 2. Tabla resumen de los tres experimentos realizados para probar los efectos del aumento de la tolerancia al riesgo en la propagación simulada de enfermedades en un sistema de producción porcina.
Tabla 2. Tabla resumen de los tres experimentos realizados para probar los efectos del aumento de la tolerancia al riesgo en la propagación simulada de enfermedades en un sistema de producción porcina.
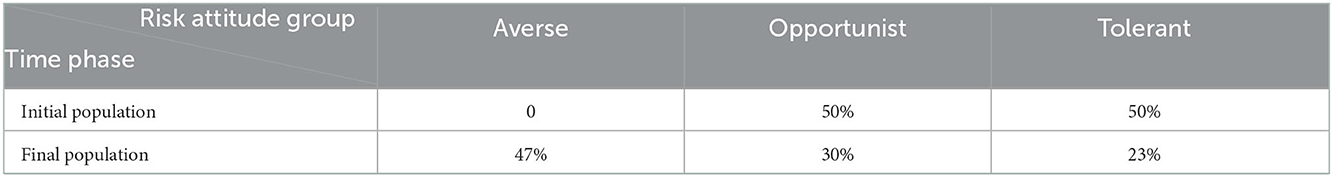 Tabla 4. Proporción inicial y final de productores en cada grupo de actitud al riesgo cuando se activa el mecanismo de aprendizaje de actitud al riesgo.
Tabla 4. Proporción inicial y final de productores en cada grupo de actitud al riesgo cuando se activa el mecanismo de aprendizaje de actitud al riesgo.
Resultados
Calibración
La calibración del ABM optimizó los cuatro parámetros con un RMSE mínimo de 3,275 en unidades de incidencia (Tabla 5). Esto significa que la incidencia modelada coincidió con ≤ error del 14% de la incidencia observada, que oscila entre 0 y 23 nuevos casos semanales de infección. La combinación de parámetros se comprobó cuidadosamente mediante la ejecución de varios experimentos de calibración con diferentes valores y rangos de parámetros iniciales. El proceso de búsqueda arrojó otras posibles asignaciones de parámetros con valores cercanos a los seleccionados pero de mayor RMSE. El modelo calibrado reproduce la variabilidad estacional y la tendencia negativa de los datos observados, pero en promedio, pasa por alto los picos altos de incidencia invernal (Figura 3).
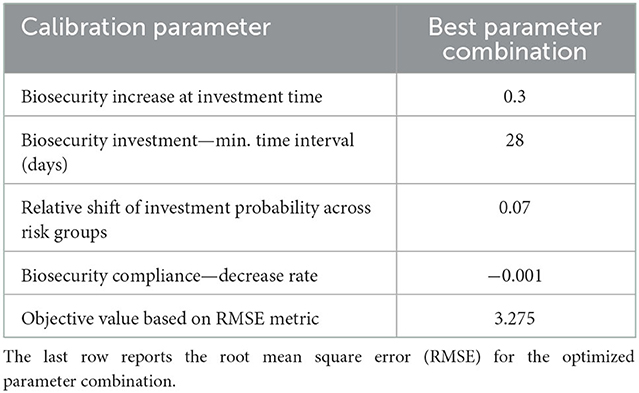 Tabla 5. Resultados de la calibración del modelo: Valores optimizados para cuatro valores de parámetros vinculados al comportamiento humano.
Tabla 5. Resultados de la calibración del modelo: Valores optimizados para cuatro valores de parámetros vinculados al comportamiento humano.
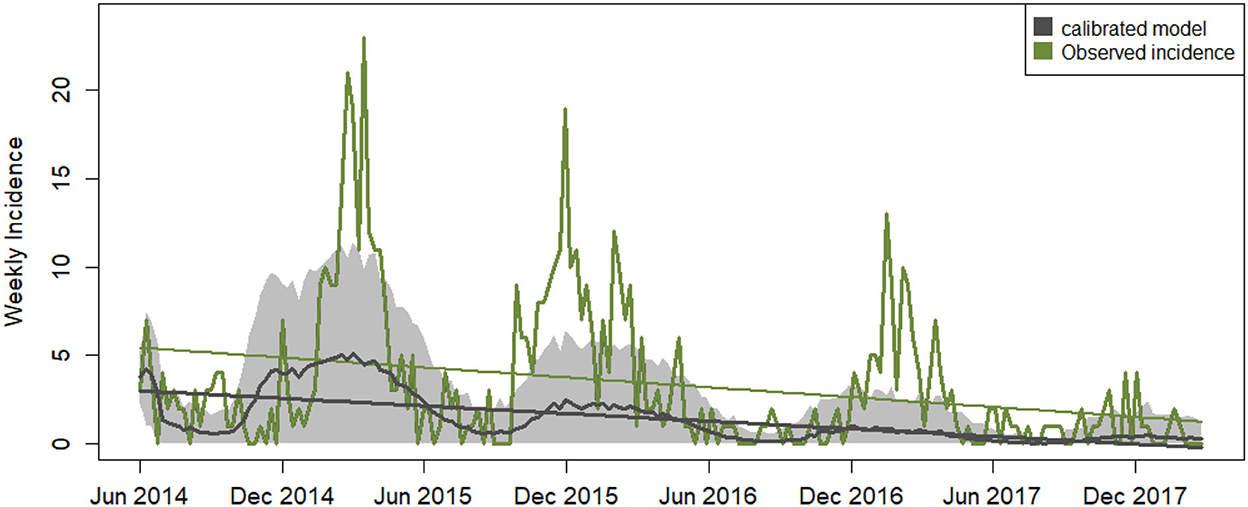 Figura 3. Series temporales semanales de incidencia de la enfermedad. Los datos relacionados con los resultados del modelo calibrado se muestran en negro: incidencia media de la enfermedad modelada (línea negra no lineal), su desviación estándar generada a lo largo de 100 iteraciones (tonos grises) y la tendencia lineal con una pendiente media de −0,017 ± 0,017. La línea verde representa los datos de incidencia observados para Carolina del Norte con una tendencia lineal superpuesta de pendiente −0,021.
Figura 3. Series temporales semanales de incidencia de la enfermedad. Los datos relacionados con los resultados del modelo calibrado se muestran en negro: incidencia media de la enfermedad modelada (línea negra no lineal), su desviación estándar generada a lo largo de 100 iteraciones (tonos grises) y la tendencia lineal con una pendiente media de −0,017 ± 0,017. La línea verde representa los datos de incidencia observados para Carolina del Norte con una tendencia lineal superpuesta de pendiente −0,021.
Análisis de sensibilidad
La Figura 4 muestra los resultados del análisis de sensibilidad y se puede leer de la siguiente manera. La distribución de incidencia para la parametrización del modelo de referencia puede considerarse como referencia y las demás distribuciones de incidencia como resultados de diferentes escenarios de parametrización. Observamos que los cambios en la incidencia son significativos y siguen las direcciones esperadas en las observaciones del mundo real. Solo en dos casos (Figuras 4B, C)
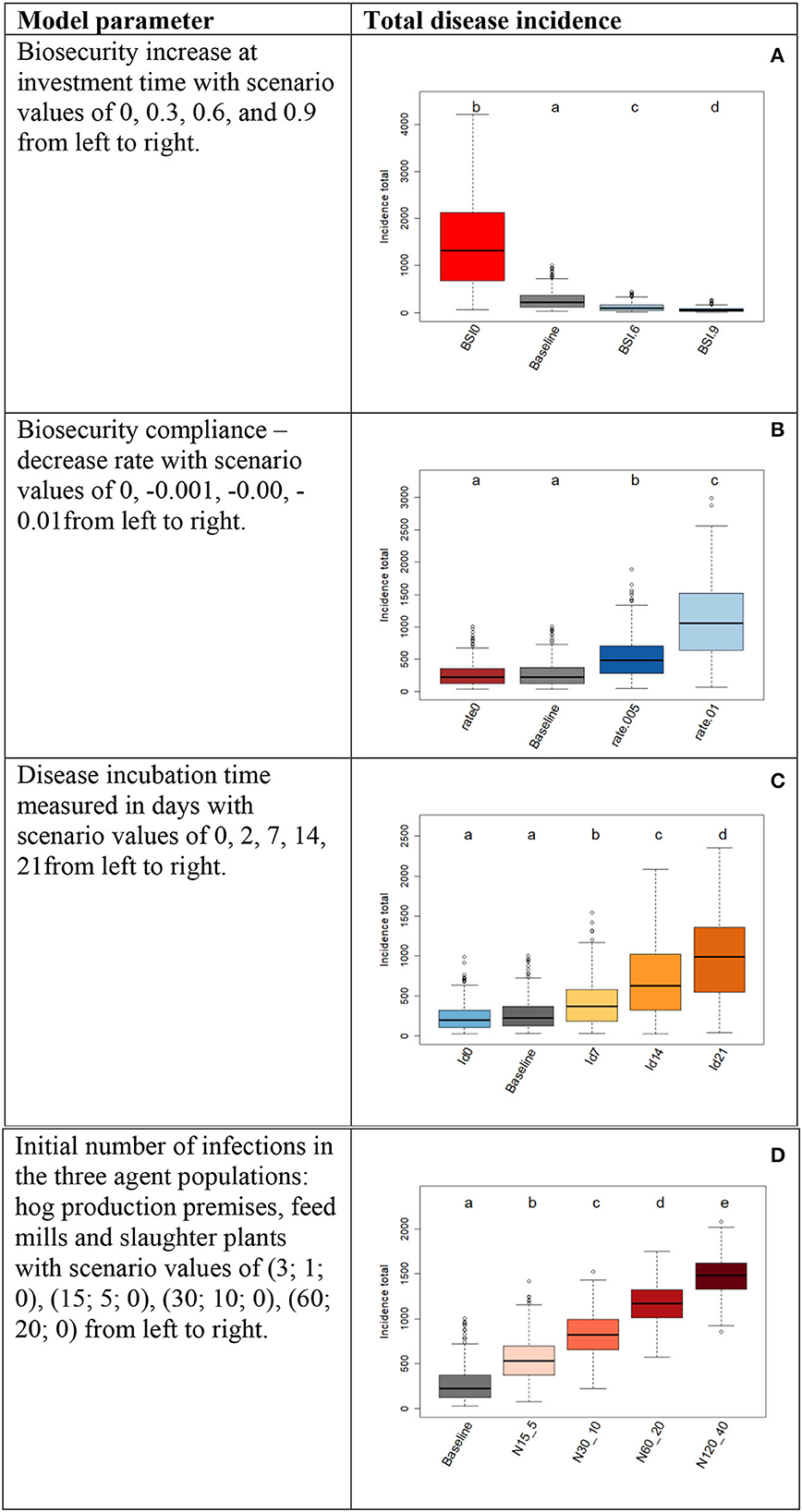 Figura 4. Resultados del análisis de sensibilidad. Cada fila de la tabla representa un experimento de sensibilidad en el que se varió un parámetro del modelo en un intervalo de valores (escenarios), como se indica en la columna de la izquierda. Las letras mayúsculas distinguen los experimentos: (A) para el parámetro «Aumento de la bioseguridad en el momento de la inversión»; (B) para «Cumplimiento de la bioseguridad»; (C) para «Tiempo de incubación subclínica de la enfermedad» y; D) para «Número inicial de infecciones». Los diagramas de caja muestran las distribuciones de los totales de incidencia de enfermedades con letras que indican la importancia de las comparaciones de distribución por pares de los escenarios. Se utilizó la línea de base como escenario de referencia. Las distribuciones que no comparten ninguna letra son diferentes por la prueba de Kolmogorov-Smirnov de dos muestras en el nivel de significación del 5%.
Figura 4. Resultados del análisis de sensibilidad. Cada fila de la tabla representa un experimento de sensibilidad en el que se varió un parámetro del modelo en un intervalo de valores (escenarios), como se indica en la columna de la izquierda. Las letras mayúsculas distinguen los experimentos: (A) para el parámetro «Aumento de la bioseguridad en el momento de la inversión»; (B) para «Cumplimiento de la bioseguridad»; (C) para «Tiempo de incubación subclínica de la enfermedad» y; D) para «Número inicial de infecciones». Los diagramas de caja muestran las distribuciones de los totales de incidencia de enfermedades con letras que indican la importancia de las comparaciones de distribución por pares de los escenarios. Se utilizó la línea de base como escenario de referencia. Las distribuciones que no comparten ninguna letra son diferentes por la prueba de Kolmogorov-Smirnov de dos muestras en el nivel de significación del 5%.
Un cambio desde la línea de base a valores de parámetros más bajos conduce a la dirección correcta del cambio de incidencia, pero este cambio no es significativo. En el caso del cumplimiento de la bioseguridad (Figura 4B), esto significa que la eliminación del mecanismo de distanciamiento psicológico (tasa de disminución del cumplimiento = 0) no cambiará significativamente los totales de incidencia en comparación con los obtenidos a partir del modelo de referencia con una tasa de disminución del cumplimiento = −0,001. Sin embargo, una disminución más negativa de las tasas de cumplimiento tiene efectos crecientes significativos en la incidencia. En el caso del tiempo de incubación subclínica de la enfermedad, 2 vs. 0 días no influye significativamente en la incidencia total cuando el modelo se inicializa con la parametrización basal (Figura 4C). Sin embargo, los tiempos de incubación ≥ 7 días conducen a un aumento significativo de la incidencia. En resumen, confirmamos que los mecanismos de la enfermedad construidos en el modelo y controlados por estos cuatro parámetros siguen comportamientos realistas, y podemos confiar en los mecanismos subyacentes del modelo controlados por estos parámetros.
Análisis de escenarios de tolerancia al riesgo
Utilizando el ABM, se llevaron a cabo tres experimentos, que abarcaron sistemáticamente a través de los tratamientos variando tres parámetros que controlan la tolerancia al riesgo: la proporción relativa de agentes productores entre los grupos de actitud al riesgo, el número de casos de enfermedad necesarios para que un productor realice una inversión en bioseguridad y la capacidad de los productores para cambiar su actitud hacia el riesgo (aprendizaje de la actitud hacia el riesgo). Resumimos los resultados en los gráficos que se muestran en las figuras 5 a 7. Las series temporales de estas figuras (paneles E, G y H) informan de las líneas de los promedios a través de las 500 réplicas de Monte Carlo y las áreas sombreadas muestran las desviaciones estándar. Nuestros datos simulados muestran que la resiliencia epidemiológica del sistema puede verse afectada significativamente por los cambios en estos parámetros.
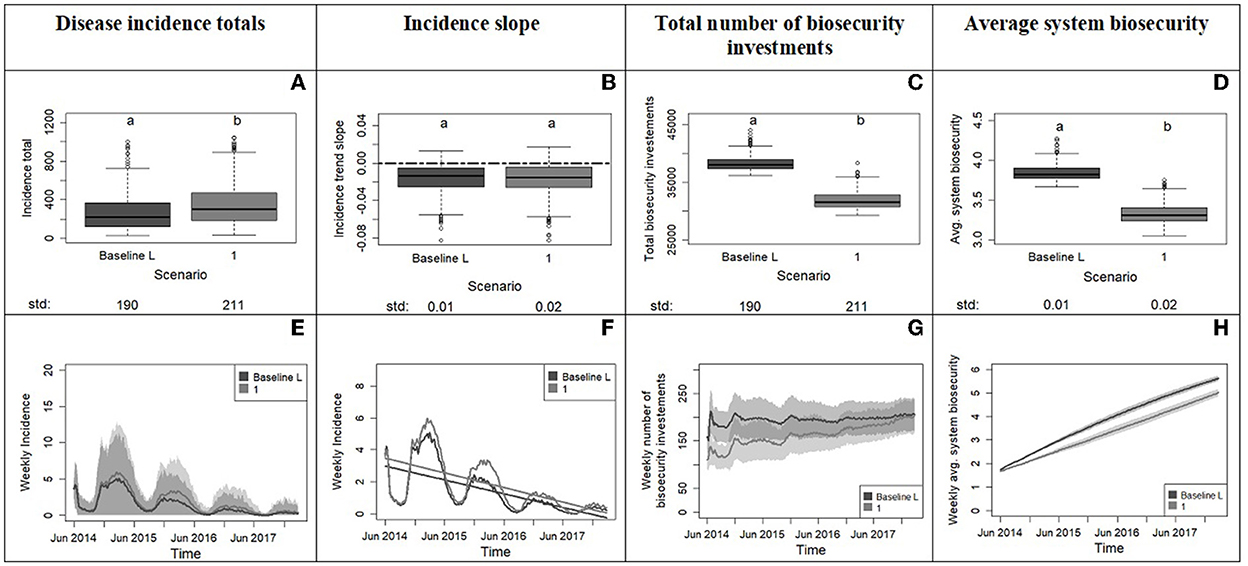 Figura 5. Resultados del experimento 1 en el que se compara el sistema con la población de referencia (33% de aversión, 33% de oportunistas, 33% de tolerancia) con un sistema con una población más tolerante al riesgo (0% de aversión, 50% de oportunista, 50% de tolerancia). La fila superior muestra los diagramas de caja de las variables del sistema, con el eje x que muestra los escenarios y el eje y que informa los valores para los totales de incidencia de enfermedades (A), la pendiente de incidencia de las series temporales (B), el número total de inversiones en bioseguridad (C) y la bioseguridad media del sistema (D). Las letras en la parte superior de los diagramas de caja informan los resultados de las comparaciones de distribución por pares de la línea de base con el escenario tolerante. La distribución que no comparte ninguna letra es diferente por la prueba de Kolmogorov-Smirnov de dos muestras en el nivel de significación del 5%. El valor de la desviación estándar de cada distribución se imprime debajo del eje x del diagrama de caja. La fila inferior de la figura (E-H) muestra las series temporales con frecuencia semanal para las variables; los tonos coloreados muestran la variabilidad proporcionada por las réplicas de Monte Carlo. El panel (F) se acerca a las líneas de incidencia semanal promedio del panel (E) e incluye las tendencias lineales.
Figura 5. Resultados del experimento 1 en el que se compara el sistema con la población de referencia (33% de aversión, 33% de oportunistas, 33% de tolerancia) con un sistema con una población más tolerante al riesgo (0% de aversión, 50% de oportunista, 50% de tolerancia). La fila superior muestra los diagramas de caja de las variables del sistema, con el eje x que muestra los escenarios y el eje y que informa los valores para los totales de incidencia de enfermedades (A), la pendiente de incidencia de las series temporales (B), el número total de inversiones en bioseguridad (C) y la bioseguridad media del sistema (D). Las letras en la parte superior de los diagramas de caja informan los resultados de las comparaciones de distribución por pares de la línea de base con el escenario tolerante. La distribución que no comparte ninguna letra es diferente por la prueba de Kolmogorov-Smirnov de dos muestras en el nivel de significación del 5%. El valor de la desviación estándar de cada distribución se imprime debajo del eje x del diagrama de caja. La fila inferior de la figura (E-H) muestra las series temporales con frecuencia semanal para las variables; los tonos coloreados muestran la variabilidad proporcionada por las réplicas de Monte Carlo. El panel (F) se acerca a las líneas de incidencia semanal promedio del panel (E) e incluye las tendencias lineales.
Del Experimento 1, aprendemos que una ausencia inicial de productores adversos junto con un mayor número de productores tolerantes y oportunistas en el escenario 1 provocan un aumento significativo en la incidencia total en comparación con el escenario base (Figuras 5A, E). En los dos escenarios, la incidencia disminuye con la misma pendiente, pero esta disminución tarda más en el sistema más tolerante. Este resultado puede estar relacionado con el menor nivel promedio de bioseguridad en el escenario más tolerante debido en parte a menores inversiones en bioseguridad (Figuras 5C, D). Aunque el número de inversiones en bioseguridad hacia el final del tiempo de simulación en los dos escenarios tiende a converger, el efecto de la bioseguridad sobre la enfermedad se retrasa en el escenario tolerante (Figuras 5G, H). En resumen, un cambio de un modelo iniciado con una población de productores de cerdos distribuidos uniformemente entre los grupos de actitud de riesgo (33% de aversión, 33% oportunista y 33% tolerante) a un modelo iniciado con una población de productores de cerdos más tolerante y poco preparada a una nueva enfermedad (50% oportunista y 50% tolerante) significa bajar la bioseguridad inicial en el sistema y eso conlleva tiempos más largos para aumentar las defensas de bioseguridad y controlar la infección.
El Experimento 2 comienza con la distribución de actitud de riesgo más tolerante del Experimento 1 y varía el punto de activación x0 para la inversión en bioseguridad. Los resultados (Figura 6) indican que el aumento de la tolerancia al número de infecciones necesarias para desencadenar las inversiones en bioseguridad conduce a dos resultados principales: un aumento significativo de la incidencia de la enfermedad y un aumento general de la variabilidad de la incidencia. Una mayor variabilidad significa que el sistema se vuelve más impredecible y susceptible de experimentar epidemias generalizadas con la introducción de una nueva enfermedad (Figuras 6A, E). Este experimento revela un cambio en los patrones epidémicos alrededor de los escenarios 5 y 6, como lo demuestran las pendientes de regresión de la mediana (Figuras 6B, F) que pasan de valores negativos a positivos:
• En los escenarios números ≤ 6, la mediana de la pendiente de regresión de incidencia es < 0, lo que significa una reducción de la incidencia de la enfermedad durante el tiempo de simulación. Aprendemos que los valores del parámetro x0 Establecido en ≤ 12 infecciones vecinas para agentes tolerantes al riesgo y ≤ 6 infecciones para agentes oportunistas son necesarias para pendientes negativas (valores medianos). De acuerdo con las medianas, mayor x0 Los valores retrasan, pero no impiden, el control de la enfermedad en este conjunto de escenarios. Estos valores umbral de x0 sin embargo, no son suficientes para garantizar siempre el control de la enfermedad y los casos de pandemias (pendientes positivas) aún pueden ocurrir, como lo muestra la variabilidad entre las réplicas de Monte Carlo (Figuras 6A, B, E).
• En los escenarios números > 6, la mediana de la pendiente de regresión es ≥0, lo que significa que no hay disminución de la incidencia durante el tiempo de simulación. Las pendientes positivas indican que la incidencia de la enfermedad no se puede controlar y puede aumentar durante el tiempo de simulación. Las pendientes cercanas a cero siguen siendo un indicio de que la enfermedad no cede, manteniéndose en niveles iniciales, con variaciones estacionales, a pesar de las inversiones en bioseguridad realizadas por los agentes. En estos escenarios, los valores más altos del parámetro x0 hacer que los productores de cerdos reaccionen con relativa lentitud a la presencia de la enfermedad y restrinjan significativamente la posibilidad de controlar un brote. Los gráficos destacan un aumento apresurado de las inversiones en bioseguridad hacia el final del tiempo de simulación (Figura 6G), pero no tiene éxito en elevar la bioseguridad a niveles que contengan enfermedades (Figuras 6A, H). La contradicción del aprendizaje de la actitud hacia el riesgo en el aumento de la aversión al riesgo en el sistema no es lo suficientemente fuerte como para prevenir grandes filtraciones de enfermedades, como lo demuestra el experimento 3.
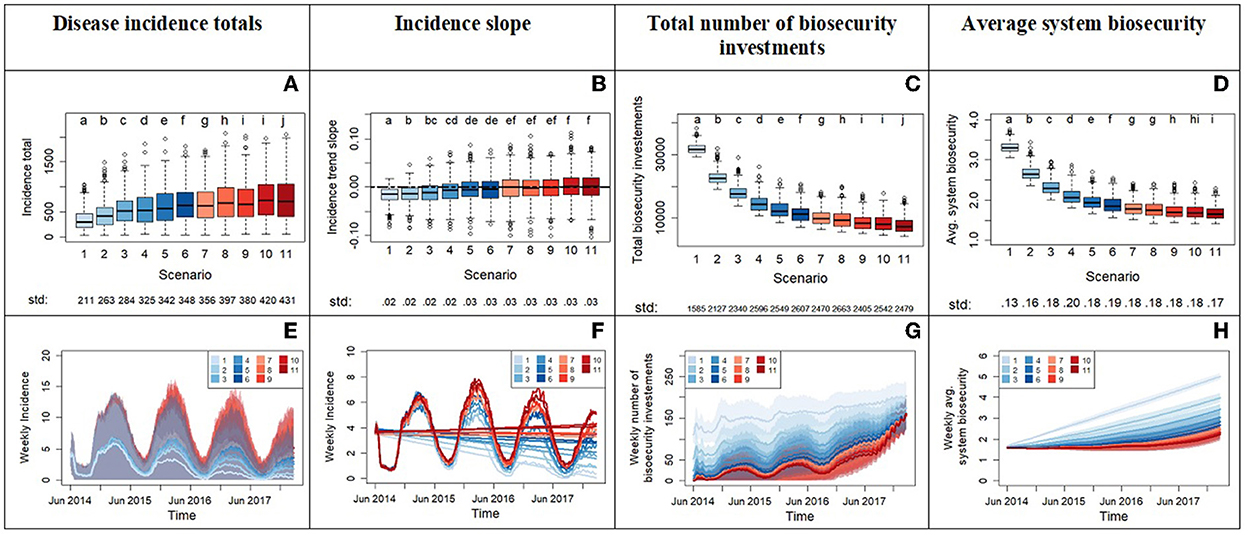 Figura 6. Los resultados del experimento 2 comparan el sistema a través de un gradiente de tolerancia creciente, con el escenario 1 con la tolerancia más baja y el escenario 11 con la más alta. Esto se hace aumentando el parámetro x0, que representa el umbral en número de locales infectados en la vecindad de un productor antes de activar la inversión del productor en bioseguridad. La fila superior muestra los diagramas de caja de las variables del sistema (eje Y): totales de incidencia de enfermedades (A), pendiente de incidencia de series temporales (B), número total de inversiones en bioseguridad (C) y bioseguridad media del sistema (D). El eje x informa de los diferentes escenarios. Se aplicó un ajuste de Bonferroni y se probó cada hipótesis a nivel alfa = 0,0045. Las letras en la parte superior de los diagramas de caja informan de los resultados de las comparaciones de distribución por pares en todos los escenarios. La distribución que no comparte ninguna letra es diferente por la prueba de Kolmogorov-Smirnov de dos muestras en el nivel alfa de significación. El valor de la desviación estándar de cada distribución se imprime debajo del eje x del diagrama de caja. La fila inferior de la figura (E-H) muestra las series temporales con la frecuencia semanal de las variables. Los tonos de color muestran la variabilidad proporcionada por las réplicas de Monte Carlo. El panel (F) se acerca a las líneas de incidencia semanal promedio del panel (E) e incluye las tendencias lineales.
Figura 6. Los resultados del experimento 2 comparan el sistema a través de un gradiente de tolerancia creciente, con el escenario 1 con la tolerancia más baja y el escenario 11 con la más alta. Esto se hace aumentando el parámetro x0, que representa el umbral en número de locales infectados en la vecindad de un productor antes de activar la inversión del productor en bioseguridad. La fila superior muestra los diagramas de caja de las variables del sistema (eje Y): totales de incidencia de enfermedades (A), pendiente de incidencia de series temporales (B), número total de inversiones en bioseguridad (C) y bioseguridad media del sistema (D). El eje x informa de los diferentes escenarios. Se aplicó un ajuste de Bonferroni y se probó cada hipótesis a nivel alfa = 0,0045. Las letras en la parte superior de los diagramas de caja informan de los resultados de las comparaciones de distribución por pares en todos los escenarios. La distribución que no comparte ninguna letra es diferente por la prueba de Kolmogorov-Smirnov de dos muestras en el nivel alfa de significación. El valor de la desviación estándar de cada distribución se imprime debajo del eje x del diagrama de caja. La fila inferior de la figura (E-H) muestra las series temporales con la frecuencia semanal de las variables. Los tonos de color muestran la variabilidad proporcionada por las réplicas de Monte Carlo. El panel (F) se acerca a las líneas de incidencia semanal promedio del panel (E) e incluye las tendencias lineales.
El Experimento 3 muestra que la eliminación del aprendizaje de la actitud hacia el riesgo no cambia significativamente la incidencia total para ningún par de escenarios, a pesar de las diferencias significativas en las inversiones totales en bioseguridad y la bioseguridad promedio entre los escenarios (Figuras 7A, C y D). Tampoco afecta significativamente a las pendientes, excepto en los escenarios pareados 11 y 11NL, donde el aprendizaje produce tendencias planas de incidencia mediana, mientras que su ausencia es positiva (Figuras 7B, F). Esto significa que la actitud de riesgo parametrizada en el ABM generalmente no es capaz de revertir las tendencias establecidas por las condiciones iniciales (Figuras 7A, B, E). Un resultado notable de este experimento es que la incidencia total, la pendiente y la bioseguridad media del sistema para los escenarios 6NL y 11 no son significativamente diferentes a pesar de las mayores inversiones en bioseguridad en el escenario 11. Esto significa que el aprendizaje de la aversión al riesgo en un sistema con alta tolerancia al riesgo a la vecindad de la enfermedad (escenario 11) reduce el impacto de la enfermedad al nivel de un sistema que no aprende la aversión al riesgo, sino que comienza con una menor tolerancia intrínseca al riesgo de la enfermedad (menor x0, escenario 6NL). Sin embargo, no ocurre lo mismo entre los escenarios 6 y 1NL: los valores bajos de x0 en el escenario 1 protege al sistema de las enfermedades gracias a inversiones relativamente rápidas en bioseguridad y esto es significativamente más eficaz que el aprendizaje, que lleva tiempo y, por lo tanto, retrasa sus beneficios para el avance de la bioseguridad (Figuras 7B, F). Estos resultados ponen de manifiesto la fuerte no linealidad de este sistema modelado.
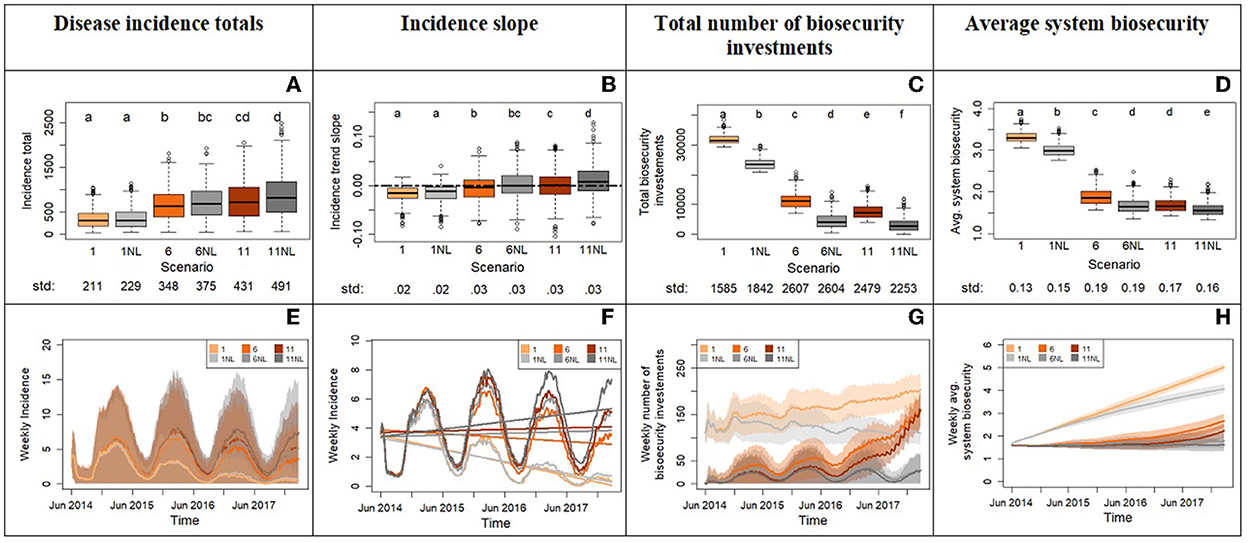 Figura 7. Resultados del experimento 3 comparando el sistema con y sin mecanismo de aprendizaje de riesgo-actitud para tres escenarios diferentes del experimento 2 (1, 6 y 11). La fila superior muestra los diagramas de caja de las variables del sistema (eje Y): totales de incidencia de enfermedades (A), pendiente de incidencia de series temporales (B), número total de inversiones en bioseguridad (C) y bioseguridad media del sistema (D). El eje x informa de los diferentes escenarios. Se aplicó un ajuste de Bonferroni y se probó cada hipótesis a nivel alfa = 0,0083. Las letras en la parte superior de los diagramas de caja informan de los resultados de las comparaciones de distribución por pares en todos los escenarios. La distribución que no comparte ninguna letra es diferente por la prueba de Kolmogorov-Smirnov de dos muestras en el nivel alfa de significación. El valor de la desviación estándar de cada distribución se imprime debajo del eje x del diagrama de caja. La fila inferior de la figura (E-H) muestra las series temporales con frecuencia semanal para las variables. Los tonos de color muestran la variabilidad proporcionada por las réplicas de Monte Carlo. El panel (F) se acerca a las líneas de incidencia semanal promedio del panel (E) e incluye las tendencias lineales.
Figura 7. Resultados del experimento 3 comparando el sistema con y sin mecanismo de aprendizaje de riesgo-actitud para tres escenarios diferentes del experimento 2 (1, 6 y 11). La fila superior muestra los diagramas de caja de las variables del sistema (eje Y): totales de incidencia de enfermedades (A), pendiente de incidencia de series temporales (B), número total de inversiones en bioseguridad (C) y bioseguridad media del sistema (D). El eje x informa de los diferentes escenarios. Se aplicó un ajuste de Bonferroni y se probó cada hipótesis a nivel alfa = 0,0083. Las letras en la parte superior de los diagramas de caja informan de los resultados de las comparaciones de distribución por pares en todos los escenarios. La distribución que no comparte ninguna letra es diferente por la prueba de Kolmogorov-Smirnov de dos muestras en el nivel alfa de significación. El valor de la desviación estándar de cada distribución se imprime debajo del eje x del diagrama de caja. La fila inferior de la figura (E-H) muestra las series temporales con frecuencia semanal para las variables. Los tonos de color muestran la variabilidad proporcionada por las réplicas de Monte Carlo. El panel (F) se acerca a las líneas de incidencia semanal promedio del panel (E) e incluye las tendencias lineales.
Discusión
La epidemia de PEDv que comenzó en 2013 proporciona un ejemplo histórico de exposición a enfermedades de varios años y una oportunidad para aprender de la experiencia a medida que las industrias de animales destinados a la producción de alimentos se preparan para posibles nuevos DCP en el futuro. Los DCP son preocupantes porque pueden generar inestabilidad en los empleos de las personas, pérdidas de ingresos y un uso insostenible de los recursos económicos tanto de los actores de la producción como de las entidades gubernamentales encargadas de estabilizar las funciones socioeconómicas. El reconocimiento de las consecuencias negativas y de largo alcance de los DCP ha impulsado nuestro trabajo de investigación y modelización sobre bioseguridad y comportamiento humano.
Koliba et al. (24) analizan cómo los comportamientos a nivel micro se amplían a patrones más amplios a nivel macro que influyen en la propagación de la enfermedad a través de los niveles operativo, táctico y estratégico. Nuestro modelo basado en agentes (ABM, por sus siglas en inglés) integra conocimientos de los niveles de análisis operacional y táctico para informar una perspectiva a nivel de sistemas que tenga en cuenta la toma de decisiones sobre bioseguridad. El nivel operativo es el nivel de los empleados de la granja, que se refiere en gran medida a las decisiones de los empleados de poner en práctica los protocolos de bioseguridad prescritos. El nivel táctico involucra a los gerentes de una granja o una empresa agrícola con su red de producción y se centra en las inversiones en bioseguridad y la implementación de medidas de bioseguridad. Por último, el nivel estratégico involucra a los tomadores de decisiones que tienen poder para influir en las políticas a largo plazo a escala macro y se preocupan por los complejos patrones de interacción entre los agentes a lo largo de la cadena de producción. Los tres niveles están interconectados e influyen mutuamente en las decisiones.
Construimos nuestro ABM para explorar las interacciones entre los mecanismos epidemiológicos y de comportamiento humano. Como modelo descriptivo y demostrativo, lo utilizamos para ilustrar que los patrones de interés se pueden producir a través de reglas e interacciones a nivel de agente. En particular, se ha demostrado que el componente de comportamiento humano que controla las decisiones sobre bioseguridad desempeña un papel fundamental en la determinación de los resultados de un brote de enfermedad, que de otro modo seguiría estando sujeto únicamente a las normas epidemiológicas relacionadas con la variabilidad estacional de la infección. Encontramos que las intervenciones de bioseguridad activadas por la aversión al riesgo al comienzo de un brote simulado son cruciales para prevenir la presencia a largo plazo de enfermedades o epidemias generalizadas en el sistema. De manera divergente, los cambios lentos hacia posiciones más reacias al riesgo están en su mayoría rezagados para controlar la enfermedad y reducir la imprevisibilidad intrínseca de un sistema que se queda con una baja protección de bioseguridad.
Los resultados de los experimentos modelo ayudan a responder a nuestras tres preguntas de investigación y demuestran que las decisiones de bioseguridad a nivel de las instalaciones tienen ramificaciones para la protección de todo el sistema de producción:
• Pregunta 1: Si comenzamos el modelo con una población de productores tolerante al riesgo en lugar de una población de productores que no lo conoce, ¿cómo evoluciona la incidencia de la enfermedad después de un brote? Las implicaciones del experimento 1 son que la distribución inicial de riesgo-actitud en el sistema afecta a la evolución de la enfermedad. En nuestro caso, la eliminación de los productores con aversión al riesgo (en comparación con el 33% de la población ingenua) refleja la suposición de una población productora bastante desprevenida y desconocedora del riesgo de una nueva enfermedad. La consecuencia fue una mayor incidencia, pero no grandes pandemias, ya que la población elevó la bioseguridad con la suficiente rapidez. Este requisito sobre el tiempo de respuesta de bioseguridad es crucial para el control de la enfermedad, como se muestra en el experimento 2 dirigido por nuestra segunda pregunta.
• Pregunta 2: Si modelamos la inversión en bioseguridad a niveles cada vez más altos de tolerancia (inversiones retrasadas), ¿observamos un escenario de tolerancia en el que las filtraciones de enfermedades en el sistema (pandemias) se convierten en la mayoría de los resultados de la simulación? En las comparaciones de escenarios (Figura 6), identificamos un rango de x0 valores (10-12 infecciones vecinas para tolerantes al riesgo y 5-6 para oportunistas) que marcan una transición de un sistema capaz de controlar la enfermedad a uno más propenso a las filtraciones mayores de la enfermedad. En situaciones del mundo real, estos x específicos0 Es posible que los valores no se apliquen, pero este hallazgo nos advierte que el retraso en la implementación de la bioseguridad puede alcanzar un umbral más allá del cual el control de enfermedades se vuelve severamente más difícil y las pandemias más probables. Los resultados del modelo también señalan un incremento en la variabilidad de la incidencia asociado con una mayor tolerancia. Las implicaciones son que la dinámica de la enfermedad en el sistema se vuelve más impredecible y, por lo tanto, más difícil de controlar con bioseguridad. Queremos seguir reflexionando sobre este último punto centrando la atención en el aumento apresurado de las inversiones en bioseguridad hacia el final del tiempo de simulación (Figura 6G), que no logró alcanzar niveles de bioseguridad adecuados para contener enfermedades y prevenir pandemias (véanse las tendencias medianas en las Figuras 6E, F y H). Podemos comparar este comportamiento de inversión con una respuesta de emergencia apresurada adoptada en un momento en que la enfermedad se ha vuelto tan prevalente que muchos productores toman conciencia del riesgo de infección o se les imponen protocolos obligatorios de bioseguridad por parte de las políticas. En cualquier caso, las inversiones urgentes y apresuradas no garantizan el control inmediato de la enfermedad.
• Pregunta 3: ¿Qué importancia tiene el aprendizaje de la aversión al riesgo para contrarrestar las condiciones iniciales de tolerancia al riesgo? Los datos proporcionaron un efecto débil e inesperado del mecanismo de aprendizaje sobre la dinámica de la enfermedad. Para dar una respuesta eficaz e inmediata a un brote de enfermedad, el mecanismo de aprendizaje no es el que se debe contar. Tal como se modela en el ABM, el aprendizaje de actitudes hacia el riesgo es un proceso relativamente lento que muestra sus resultados a lo largo de los años. Podemos pensar en el aprendizaje como un mecanismo que modifica la cultura del riesgo y necesita más tiempo que los mecanismos que imponen cambios rápidos de comportamiento como las políticas. Sin embargo, es un mecanismo crítico necesario en el mundo real, ya que una transición cultural basada en comportamientos aprendidos preparará a los productores para generar respuestas de aversión al riesgo y bioseguras.
De las simulaciones de ABM surgieron fenómenos que corroboraron la importancia de las decisiones humanas y demostraron interacciones complejas entre los mecanismos epidemiológicos y de comportamiento humano. El presente trabajo destacó comportamientos complejos impulsados por dependencias de trayectorias y dinámicas no lineales. La dependencia de la trayectoria ocurre cuando los eventos y decisiones presentes condicionan la trayectoria de eventos o decisiones posteriores (62). En otras palabras, la evolución de un sistema dependiente de la trayectoria está ligada a su propia historia. En el Experimento 1, por ejemplo, las dos distribuciones iniciales diferentes de las actitudes de riesgo determinan las decisiones iniciales sobre las inversiones en bioseguridad (Figura 5G), que gobiernan la bioseguridad del sistema y las infecciones de la enfermedad, lo que en última instancia conduce a trayectorias significativamente diferentes en la evolución y el resultado de la enfermedad. El experimento 2 demostró una respuesta no lineal de la enfermedad a un aumento lineal de la tolerancia al riesgo. Un aumento de la tolerancia a la enfermedad en poblaciones relativamente menos tolerantes al riesgo desencadenó una mayor respuesta de bioseguridad, un mayor aumento de la incidencia de la enfermedad y una mayor pérdida de la capacidad de control de la enfermedad (Figura 6, escenarios 1-6) que el mismo aumento de la tolerancia a la enfermedad aplicado en una población caracterizada inicialmente por una mayor tolerancia (Figura 6, escenarios 6-11). La Figura 6 muestra este efecto de saturación no lineal que refleja una capacidad cada vez más reducida de la enfermedad para propagarse en el sistema y desencadenar más inversiones en bioseguridad. El sistema se aproxima a su capacidad de inversión en bioseguridad. Este estado cercano a la saturación no significa que casi todos los agentes estén infectados, sino que los nodos clave de transferencia de enfermedades en las redes están infectados y ya han realizado las inversiones en bioseguridad permitidas por las reglas modelo (48).
En comparación con las versiones anteriores de ABM que avanzaban en estudios sobre la dinámica de la red y los efectos de las configuraciones de riesgo-actitud (47, 48, 63), la ABM actual, orientada al mecanismo de aprendizaje de riesgo-actitud, nos permitió explorar cuestiones más profundas y complejas sobre cómo las acciones locales diversas, conectadas e interdependientes tienen impactos globales. El aprendizaje se lleva a cabo a lo largo de los 4 años de simulación de forma escalonada y, como tal, puede interpretarse como un proceso que conduce a una nueva cultura de riesgo-actitud en el sistema. Nuestros resultados indicaron que el aprendizaje lento de la aversión al riesgo no es eficaz para contrarrestar las conductas tolerantes al riesgo que se establecen en un sistema donde la enfermedad ya se está propagando. Sin embargo, creemos que este aspecto cultural de la bioseguridad es importante debido a su poder para cambiar la cultura del riesgo a largo plazo. Una cultura biosegura, es decir, un respaldo colectivo a las medidas preventivas, puede contribuir a un sentido más amplio de lo que es posible en caso de una incursión de la enfermedad y, por lo tanto, de lo que se podría invertir ahora para estar listo en el futuro. En este contexto, reconocemos que la cultura y la actitud hacia el riesgo son etiquetas descriptivas de mecanismos complejos que subyacen a los comportamientos de las personas. Por lo tanto, es probable que los comportamientos de actitud de riesgo y el aprendizaje que codificamos en nuestro ABM abarquen un espectro más amplio de impulsores humanos de la toma de decisiones. Por ejemplo, los productores de cerdos que apenas responden a la vecindad de enfermedades con bioseguridad pueden comportarse así debido a la incapacidad de acceder a los recursos de bioseguridad o a la ausencia de medios económicos para realizar inversiones en bioseguridad.
Siguiendo los puntos planteados por An (64), queremos reflexionar sobre las limitaciones de nuestro modelo. Al mismo tiempo que desarrollábamos versiones más holísticas del ABM al incluir el comportamiento humano, hemos ido incorporando reglas basadas en datos de juegos experimentales, pero también reglas hipotéticas basadas en la opinión de expertos en lugares donde no existían datos adecuados. Por ejemplo, los agentes se infectan de manera estocástica con probabilidades que dependen del tipo de contactos realizados entre los agentes y se estimaron en base a la opinión de expertos. Para parametrizar el modelo se han utilizado estimaciones basadas en calibración. Por ejemplo, se estimaron tres parámetros de la función de probabilidad que controla la decisión sobre las inversiones en bioseguridad mediante la calibración del modelo. Es evidente que existen limitaciones y desventajas asociadas a la parametrización del modelo con supuestos y/o valores basados en la calibración, ya que pueden no ser adecuados. Los modelos basados en agentes se ocupan del estudio de los sistemas socio-ecológicos que pueden ser conceptualizados a través de un conjunto de micro y macro relaciones y reglas que conducen a una compleja arquitectura interna de ABM. En un entorno de calibración, es difícil estimar los parámetros microscópicos (relacionados con el agente) directamente desde el nivel macroscópico (incidencia del sistema) porque el gran número de parámetros del modelo puede dar lugar a una «maldición de dimensionalidad» que conduce a una multiplicidad de posibles combinaciones de parámetros. Minimizamos este problema limitando el número de parámetros basados en la calibración y utilizamos la opinión de expertos para estimar un subconjunto de parámetros. Por lo tanto, somos conscientes de que la parametrización de las reglas de comportamiento en el ABM que establecemos con estos enfoques debe usarse con precaución.
La estructura de las redes de animales, piensos y veterinarios se basó en las métricas del vecino más cercano. Por ejemplo, un agente productor de parto a destete moverá sus cerdos destetados dentro de una red vecina más cercana de productores de destete a engorde o de destete a engorde en el modelo, pero en el mundo real, una empresa de producción podría tener sus instalaciones distribuidas en grandes áreas geográficas y más allá de las instalaciones vecinas. La suposición de la red modelada puede dar lugar a propiedades emergentes del sistema que no son totalmente representativas de la dinámica real, lo que podría incluir la propagación de enfermedades a distancias más grandes. Como posible consecuencia, la transmisión de la enfermedad en nuestros resultados es más localizada y no tiene en cuenta las infecciones traídas dentro y fuera del estado. No obstante, confiamos en los patrones del modelo basados en el razonamiento de que la calibración del modelo proporcionaba una parametrización que realizaba valores de incidencia y una tendencia comparable con las observaciones, y la validación del modelo confirmaba patrones realistas.
En resumen, nuestro trabajo corroboró la visión de que la epidemiología y la psicología se necesitan mutuamente y destacamos tres puntos principales aprendidos de estos experimentos de modelización:
– La configuración inicial de bioseguridad en el sistema juega un papel clave en la determinación de la evolución de la propagación de la enfermedad. Una población inicialmente tolerante al riesgo con baja preparación para la bioseguridad conducirá a un tiempo prolongado necesario para el control de la enfermedad.
– El retraso en las intervenciones de bioseguridad debido a la tolerancia a las enfermedades hace que el sistema sea vulnerable a la propagación impredecible de enfermedades y a una mayor probabilidad de epidemias generalizadas.
– Un cambio lento hacia comportamientos más reacios (cambio cultural) no ayuda significativamente al control de la enfermedad una vez que la enfermedad se ha propagado en el sistema. Sin embargo, los esfuerzos dirigidos a crear una cultura de aversión al riesgo son esenciales para preparar a los productores de cerdos (y otras partes interesadas) con el nivel de bioseguridad necesario para contrarrestar rápidamente la incursión de una nueva enfermedad potencial.
Conclusiones e investigaciones futuras
Controlar la aparición, propagación y persistencia de las enfermedades infecciosas de los animales es un desafío importante en nuestro mundo interconectado. La gestión de las enfermedades animales requiere que las partes interesadas de la cadena de producción, así como los responsables de la formulación de políticas, adopten una perspectiva que represente adecuadamente las complejas relaciones causales entre la transmisión de enfermedades y el comportamiento humano. El modelado basado en agentes es un método poderoso para estudiar sistemas complejos como la cadena de producción animal y simular interacciones epidemiológicas y humanas. Este artículo exploró preguntas sobre los aspectos epidemiológicos y conductuales humanos acoplados que influyen en el control de la enfermedad. Los resultados muestran que una respuesta inicial fuerte con inversiones en bioseguridad asociadas con baja tolerancia al riesgo es más efectiva que un cambio constante hacia una cultura más reacia al riesgo frente a una nueva enfermedad infecciosa como la PEDv. Un peligro claro para un sistema con bajos niveles de bioseguridad es que la dinámica de la enfermedad se vuelva muy variable e impredecible. Esto significa que las intervenciones de bioseguridad tardías, incluso si se implementan rápidamente, podrían no prevenir la aparición de epidemias generalizadas.
Nuestro ABM aún está en desarrollo activo y, como tal, hay una serie de características que tenemos la intención de implementar. Estamos trabajando para vincular la toma de decisiones de bioseguridad de los agentes a un submodelo presupuestario/económico, ya que, en el mundo real, un productor porcino no podría implementar un nuevo protocolo de bioseguridad sin suficiente efectivo o capital disponible para un préstamo bancario. También ampliaremos el modelo para incluir la dinámica del sistema en todo Estados Unidos. Es vital que tanto la comunidad científica como la industria adopten métodos de investigación innovadores y avanzados para identificar las mejores direcciones para la investigación, la práctica y la política para apoyar la resiliencia de la producción de animales destinados a la producción de alimentos frente a las amenazas de enfermedades emergentes y exóticas. La transmisión de enfermedades tiene lugar dentro de los sistemas socio-ecológicos y, por lo tanto, los aspectos del comportamiento humano son un constructo esencial en el trabajo de modelización para comprender la dinámica de las enfermedades. Su incorporación en nuestro modelo basado en agentes condujo a una visión sólida de cómo la personalidad y la variabilidad en el comportamiento pueden conducir a firmas de brotes muy diferentes que requieren intervenciones atentas y planes de preparación.
Declaración de disponibilidad de datos
Los datos brutos que respaldan las conclusiones de este artículo serán puestos a disposición por los autores, sin reservas indebidas.
Contribuciones de los autores
GB, EC, SM y JS contribuyeron a la conceptualización y redacción del borrador original. GB, SM, EC, SW, AZ, CK y JS contribuyeron a la conceptualización, investigación, metodología, administración del proyecto, supervisión y redacción, revisión y edición. GB, SM, EC, SW y LT contribuyeron a la conceptualización, el software y la redacción, revisión y edición. GB, SM, OL-C y NC contribuyeron a la parametrización y revisión del software. JS, AZ y CK contribuyeron a la investigación, la obtención de fondos, la administración del proyecto y la redacción, revisión y edición. Todos los autores contribuyeron al artículo y aprobaron la versión enviada.
Financiación
Este trabajo contó con el apoyo de la Subvención Competitiva de la Iniciativa de Investigación Agrícola y Alimentaria (Nos. 2015-69004-23273, 2021-67015-35236 y 2022-69014-37041) del Instituto Nacional de Alimentos y Agricultura del USDA.
Conflicto de intereses
Los autores declaran que la investigación se llevó a cabo en ausencia de relaciones comerciales o financieras que pudieran interpretarse como un posible conflicto de intereses.
Nota del editor
Todas las afirmaciones expresadas en este artículo son únicamente las de los autores y no representan necesariamente las de sus organizaciones afiliadas, ni las del editor, los editores y los revisores. Cualquier producto que pueda ser evaluado en este artículo, o afirmación que pueda ser hecha por su fabricante, no está garantizado ni respaldado por el editor.
Descargo de responsabilidad del autor
Los contenidos son responsabilidad exclusiva de los autores y no representan necesariamente los puntos de vista oficiales del USDA o NIFA.
Material complementario
El material complementario para este artículo se puede encontrar en línea en: https://www.frontiersin.org/articles/10.3389/fvets.2022.1067364/full#supplementary-material
Referencias
1. Galindo I, Alonso C. Virus de la peste porcina africana: una revisión. Virus. (2017) 9:103. doi: 10.3390/v9050103
Resumen de PubMed | Texto completo de CrossRef | Google Académico
2. Normile D. La llegada de una enfermedad mortal de los cerdos podría significar un desastre para China. Ciencia. (2018) 361:741. doi: 10.1126/science.361.6404.741
Resumen de PubMed | Texto completo de CrossRef | Google Académico
3. Jurado C, Mur L, Pérez Aguirreburualde MS, Cadenas-Fernández E, Martínez-López B, Sánchez-Vizcaíno JM, et al. Riesgo de introducción del virus de la peste porcina africana en los Estados Unidos a través del contrabando de carne de cerdo en el equipaje de los pasajeros aéreos. Sci Rep. (2019) 9:14423. DOI: 10.1038/s41598-019-50403-w
Resumen de PubMed | Texto completo de CrossRef | Google Académico
4. Vilanova E, Tovar AMF, Mourão PAS. Riesgo inminente de escasez mundial de heparina causada por la peste porcina africana que afecta a la cabaña porcina china. J Trombo hemostático. (2019) 17:254–6. doi: 10.1111/jth.14372
Resumen de PubMed | Texto completo de CrossRef | Google Académico
5. Linskens EJ, Neu AE, Walz EJ, St Charles KM, Culhane MR, Ssematimba A, et al. Preparación para un brote de una enfermedad animal foránea mediante un novedoso ejercicio de mesa. Prehosp Disaster Med. (2018) 33:640–6. doi: 10.1017/S1049023X18000717
Resumen de PubMed | Texto completo de CrossRef | Google Académico
6. Racicot M, Venne D, Durivage A, Vaillancourt J-P. Evaluación de la relación entre los rasgos de personalidad, la experiencia, la educación y el cumplimiento de la bioseguridad en granjas avícolas de Quebec, Canadá. Prev Vet Med. (2012) 103:201–7. doi: 10.1016/j.prevetmed.2011.08.011
Resumen de PubMed | Texto completo de CrossRef | Google Académico
7. Ritter C, Jansen J, Roche S, Kelton DF, Adams CL, Orsel K, et al. Revisión invitada: Determinantes de la adopción por parte de los agricultores de estrategias basadas en el manejo para la prevención y el control de enfermedades infecciosas. J Lácteos Sci. (2017) 100:3329–47. doi: 10.3168/jds.2016-11977
Resumen de PubMed | Texto completo de CrossRef | Google Académico
8. Clark EM, Merrill SC, Trinity L, Bucini G, Cheney N, Langle-Chimal O, et al. Uso de simulaciones de juegos experimentales para obtener estrategias conductuales de mitigación de riesgos para el manejo de enfermedades agrícolas. PLoS UNO. (2020) 15:e0228983. doi: 10.1371/journal.pone.0228983
Resumen de PubMed | Texto completo de CrossRef | Google Académico
9. Trinity L, Merrill SC, Clark EM, Koliba CJ, Zia A, Bucini G, et al. Efectos de las señales sociales en el cumplimiento de la bioseguridad en instalaciones ganaderas: evidencia de simulaciones experimentales. Front Vet Sci. (2020) 7:130. doi: 10.3389/fvets.2020.00130
Resumen de PubMed | Texto completo de CrossRef | Google Académico
10. Clark EM, Merrill SC, Trinity L, Bucini G, Cheney N, Langle-Chimal O, et al. Emulando el manejo de enfermedades agrícolas: comparando las preferencias de riesgo entre los profesionales de la industria y los participantes en línea utilizando simulaciones de juegos experimentales y encuestas de elección de lotería emparejadas. Front Vet Sci. (2021) 7:556668. doi: 10.3389/fvets.2020.556668
Resumen de PubMed | Texto completo de CrossRef | Google Académico
11. Merrill SC, Trinity L, Clark EM, Shrum TR, Koliba CJ, Zia A, et al. La estrategia de entrega de mensajes influye en la voluntad de cumplir con la bioseguridad. Front Vet Sci. (2021) 8:667265. doi: 10.3389/fvets.2021.667265
Resumen de PubMed | Texto completo de CrossRef | Google Académico
12. Clark EM, Merrill SC, Trinity L, Liu T-L, O’Keefe A, Shrum T, et al. Comparación de estrategias de evaluación de riesgos conductuales para cuantificar el cumplimiento de la bioseguridad con el fin de mitigar la propagación de enfermedades animales. Front Vet Sci. (2022) 9:962989. doi: 10.3389/fvets.2022.962989
Resumen de PubMed | Texto completo de CrossRef | Google Académico
13. Elbakidze L, McCarl BA. Preparación previa a las enfermedades animales frente a la respuesta posterior a los eventos: ¿cuándo es rentable proteger? J Agric Appl Econ. (2016) 38:327–36. doi: 10.1017/S1074070800022367
14. Hennessy DA, Wolf CA. Información asimétrica, externalidades e incentivos en la prevención y el control de enfermedades animales. J Agric Econ. (2018) 69:226–42. doi: 10.1111/1477-9552.12113
15. Racicot M, Cardenal A-M, Tremblay D, Vaillancourt J-P. Tecnologías que monitorean y mejoran el cumplimiento de la bioseguridad en las antesalas de los establos. Front Vet Sci. (2022) 9:1005144. doi: 10.3389/fvets.2022.1005144
Resumen de PubMed | Texto completo de CrossRef | Google Académico
16. VanderWaal K, Morrison RB, Neuhauser C, Vilalta C, Pérez AM. Traducir big data en smart data para la epidemiología veterinaria. Front Vet Sci. (2017) 4:110. doi: 10.3389/fvets.2017.00110
Resumen de PubMed | Texto completo de CrossRef | Google Académico
17. Liakos KG, Busato P, Moshou D, Pearson S, Bochtis D. Aprendizaje automático en la agricultura: una revisión. Sensores. (2018) 18:2674. doi: 10.3390/s18082674
Resumen de PubMed | Texto completo de CrossRef | Google Académico
18. VanderWaal K, Pérez A, Torremorrell M, Morrison RM, Craft M. Papel del movimiento de animales y el contacto indirecto entre granjas en la transmisión del virus de la diarrea epidémica porcina. Epidemias. (2018) 24:67–75. doi: 10.1016/j.epidem.2018.04.001
Resumen de PubMed | Texto completo de CrossRef | Google Académico
19. Neethirajan S. El papel de los sensores, el big data y el aprendizaje automático en la ganadería moderna. Sens Biosens Res. (2020) 29:100367. doi: 10.1016/j.sbsr.2020.100367
20. VanderWaal K, Paploski IAD, Makau DN, Corzo CA. Contraste entre el movimiento animal y las redes de conectividad espacial en la configuración de las vías de transmisión de un virus genéticamente diverso. Prev Vet Med. (2020) 178:104977. doi: 10.1016/j.prevetmed.2020.104977
Resumen de PubMed | Texto completo de CrossRef | Google Académico
21. Paploski IAD, Bhojwani RK, Sanhueza JM, Corzo CA, VanderWaal K. Pronóstico de brotes de enfermedades virales a nivel de granja para granjas de cerdas comerciales en los EE. UU. Prev Vet Med. (2021) 196:105449. doi: 10.1016/j.prevetmed.2021.105449
Resumen de PubMed | Texto completo de CrossRef | Google Académico
22. Cárdenas NC, Sykes AL, Lopes FPN, Machado G. Movimientos de animales de múltiples especies: propiedades de la red, dinámica de la enfermedad y el impacto de las acciones de control dirigidas. Res. Veterinaria. (2022) 53:14. doi: 10.1186/s13567-022-01031-2
Resumen de PubMed | Texto completo de CrossRef | Google Académico
23. Nicolas G, Apolloni A, Coste C, Wint GRW, Lancelot R, Gilbert M. Modelos gravitacionales predictivos de la movilidad del ganado en Mauritania: los efectos de la oferta, la demanda y los factores culturales. PLoS UNO. (2018) 13:e0199547. doi: 10.1371/journal.pone.0199547
Resumen de PubMed | Texto completo de CrossRef | Google Académico
24. Koliba C, Merrill SC, Zia A, Bucini G, Clark E, Shrum TR, et al. Evaluar la toma de decisiones estratégicas, tácticas y operativas y el riesgo en una cadena de producción ganadera a través de plataformas experimentales de simulación. Front Vet Sci. (2022) 9:962788. doi: 10.3389/fvets.2022.962788
Resumen de PubMed | Texto completo de CrossRef | Google Académico
25. Scott A, McCluskey B, Brown-Reid M, Grear D, Pitcher P, Ramos G, et al. Introducción del virus de la diarrea epidémica porcina en los Estados Unidos: investigación de la causa raíz. Prevenir Vet Med. (2016) 123:192–201. doi: 10.1016/j.prevetmed.2015.11.013
Resumen de PubMed | Texto completo de CrossRef | Google Académico
26. Lee C. Virus de la diarrea epidémica porcina: un virus porcino epizoótico emergente y reemergente. Virol J. (2015) 12:193. doi: 10.1186/s12985-015-0421-2
Resumen de PubMed | Texto completo de CrossRef | Google Académico
27. Stevenson GW, Hoang H, Schwartz KJ, Burrough ER, Sun D, Madson D, et al. Aparición del virus de la diarrea epidémica porcina en los Estados Unidos: signos clínicos, lesiones y secuencias genómicas virales. J Vet Diagn Invest. (2013) 25:649–54. doi: 10.1177/1040638713501675
Resumen de PubMed | Texto completo de CrossRef | Google Académico
28. Jung K, Saif LJ, Wang Q. Virus de la diarrea epidémica porcina (PEDV): una actualización sobre etiología, transmisión, patogénesis y prevención y control. Virus Res. (2020) 286:198045. doi: 10.1016/j.virusres.2020.198045
Resumen de PubMed | Texto completo de CrossRef | Google Académico
29. Liu X, Lin C-M, Annamalai T, Gao X, Lu Z, Esseili MA, et al. Determinación del título infeccioso y la virulencia de una cepa PC22A original del virus de la diarrea epidémica porcina de los Estados Unidos. Res. Veterinaria. (2015) 46:109. doi: 10.1186/s13567-015-0249-1
Resumen de PubMed | Texto completo de CrossRef | Google Académico
30. Tun HM, Cai Z, Khafipour E. Monitoreo de la capacidad de supervivencia y la infectividad del virus de la diarrea epidémica porcina (PEDv) en los almacenes de estiércol de tierra (EMS) infectados en las granjas. Microbiol frontal. (2016) 7:265. doi: 10.3389/fmicb.2016.00265
Resumen de PubMed | Texto completo de CrossRef | Google Académico
31. Trudeau MP, Verma H, Urriola PE, Sampedro F, Shurson GC, Goyal SM. Supervivencia del virus de la diarrea epidémica porcina (PEDV) en ingredientes de piensos tratados térmicamente y en superficies. Gestión de la Salud Porcina. (2017) 3:17. doi: 10.1186/s40813-017-0064-3
Resumen de PubMed | Texto completo de CrossRef | Google Académico
32. Kim Y, Krishna V, Torremorell M, Goyal S, Cheeran M. Estabilidad del virus de la diarrea epidémica porcina en materiales de fómites a diferentes temperaturas. Veterinaria Sci. (2018) 5:21. doi: 10.3390/vetsci5010021
Resumen de PubMed | Texto completo de CrossRef | Google Académico
33. Dee S, Clement T, Schelkopf A, Nerem J, Knudsen D, Christopher-Hennings J, et al. Una evaluación de los piensos completos contaminados como vehículo para la infección por el virus de la diarrea epidémica porcina en cerdos ingenuos tras el consumo a través de un comportamiento alimentario natural: prueba de concepto. BMC Vet Res. (2014) 10:176. doi: 10.1186/s12917-014-0176-9
Resumen de PubMed | Texto completo de CrossRef | Google Académico
34. Bowman AS, Krogwold RA, Price T, Davis M, Moeller SJ. Investigación de la introducción del virus de la diarrea epidémica porcina en una explotación porcina de Ohio. BMC Vet Res. (2015) 11:38. doi: 10.1186/s12917-015-0348-2
Resumen de PubMed | Texto completo de CrossRef | Google Académico
35. Schumacher LL, Huss AR, Cochrane RA, Stark CR, Woodworth JC, Bai J, et al. Caracterización de la rápida propagación del virus de la diarrea epidémica porcina (PEDV) a través de una instalación de fabricación de alimentos para animales. PLoS UNO. (2017) 12:e0187309. doi: 10.1371/journal.pone.0187309
Resumen de PubMed | Texto completo de CrossRef | Google Académico
36. Lowe J, Gauger P, Harmon K, Zhang J, Connor J, Yeske P, et al. Papel del transporte en la propagación de la infección por el virus de la diarrea epidémica porcina, Estados Unidos. Emerg Infect Dis. (2014) 20:872–4. doi: 10.3201/eid2005.131628
Resumen de PubMed | Texto completo de CrossRef | Google Académico
37. Sasaki Y, Álvarez J, Sekiguchi S, Sueyoshi M, Otake S, Pérez A. Factores epidemiológicos asociados a la propagación de la diarrea epidémica porcina en Japón. Prev Vet Med. (2016) 123:161–7. doi: 10.1016/j.prevetmed.2015.11.002
Resumen de PubMed | Texto completo de CrossRef | Google Académico
38. Alonso C, Goede DP, Morrison RB, Davies PR, Rovira A, Marthaler DG, et al. Evidencia de infectividad del virus de la diarrea epidémica porcina transmitido por el aire y detección de ARN viral en el aire a largas distancias de los rebaños infectados. Res. Veterinaria. (2014) 45:73. DOI: 10.1186/s13567-014-0073-z
Resumen de PubMed | Texto completo de CrossRef | Google Académico
39. Mole B. El virus mortal del cerdo se desliza a través de las fronteras de EE. UU. Naturaleza. (2013) 499:788. doi: 10.1038/499388a
Resumen de PubMed | Texto completo de CrossRef | Google Académico
40. Paarlberg PL. Impactos estimados actualizados del virus de la diarrea epidémica porcina (PEDV, por sus siglas en inglés). West Lafayette, IN: Universidad de Purdue, Facultad de Agricultura, Departamento de Economía Agrícola (2014).
41. Schulz LL, Tonsor GT. Evaluación de los impactos económicos del virus de la diarrea epidémica porcina en los Estados Unidos. J Anim Sci. (2015) 93:5111–8. doi: 10.2527/jas.2015-9136
Resumen de PubMed | Texto completo de CrossRef | Google Académico
42. Weng L, Weersink A, Poljak Z, de Lange K, von Massow M. Una evaluación económica de las estrategias de intervención para la Diarrea Epidémica Porcina (PED). Prev Vet Med. (2016) 134:58–68. doi: 10.1016/j.prevetmed.2016.09.018
Resumen de PubMed | Texto completo de CrossRef | Google Académico
43. Niederwerder MC, Hesse RA. Enfermedad por coronavirus entérico porcino: una revisión de 4 años con el virus de la diarrea epidémica porcina y el deltacoronavirus porcino en los Estados Unidos y Canadá. Transbound Emerg Dis. (2018) 65:660–75. doi: 10.1111/tbed.12823
Resumen de PubMed | Texto completo de CrossRef | Google Académico
44. Marque P. Recursos de PEDV. En la Junta NP, editores. Des Moines, IA: Los productores de carne de cerdo de Estados Unidos y el cheque de la carne de cerdo. Disponible en línea en: https://www.in.gov/boah/files/PEDVbookJan2016FINAL.pdf
45. Kim Y, Yang M, Goyal SM, Cheeran MC-J, Torremorell M. Evaluación de medidas de bioseguridad para prevenir la transmisión indirecta del virus de la diarrea epidémica porcina. BMC Vet Res. (2017) 13:89. doi: 10.1186/s12917-017-1017-4
Resumen de PubMed | Texto completo de CrossRef | Google Académico
46. Baker KL, Mowrer CL, Zhang J, Chen Q, Ramírez A, Wang C, et al. Evaluación de un desinfectante a base de peroxígeno para la inactivación del virus de la diarrea epidémica porcina a bajas temperaturas sobre superficies metálicas. Microbiol veterinario. (2018) 214:99–107. doi: 10.1016/j.vetmic.2017.12.019
Resumen de PubMed | Texto completo de CrossRef | Google Académico
47. Bucini G, Merrill SC, Clark E, Moegenburg SM, Zia A, Koliba CJ, et al. Las actitudes de riesgo afectan las decisiones de bioseguridad del ganado con ramificaciones para el control de enfermedades en un sistema de producción simulado. Front Vet Sci. (2019) 6:196. doi: 10.3389/fvets.2019.00196
Resumen de PubMed | Texto completo de CrossRef | Google Académico
48. Wiltshire S, Zia A, Koliba C, Bucini G, Clark E, Merrill S, et al. Metamétricas de redes: uso de la computación evolutiva para identificar indicadores efectivos de vulnerabilidad epidemiológica en un modelo de sistema de producción ganadera. J Artif Soc Soc Simul. (2019) 22:8. doi: 10.18564/jasss.3991
49. Merrill SC, Moegenburg S, Koliba CJ, Zia A, Trinity L, Clark E, et al. Disposición a cumplir con la bioseguridad en instalaciones ganaderas: Evidencia de simulaciones experimentales. Front Vet Sci. (2019) 6:156. doi: 10.3389/fvets.2019.00156
Resumen de PubMed | Texto completo de CrossRef | Google Académico
50. Merrill S, Koliba C, Moegenburg S, Clark E, Bucini G, Zia A, et al. Juegos serios: recopilación de datos, análisis de sistemas complejos y empujones. En: Conferencia del Noreste sobre Administración Pública (NECOPA). Burlington, VT (2017).
51. Merrill SC, Koliba CJ, Moegenburg SM, Zia A, Parker J, Sellnow T, et al. Toma de decisiones en prácticas de bioseguridad ganadera en medio de la incertidumbre ambiental y social: evidencia de un juego experimental. PLoS UNO. (2019) 14:e0214500. doi: 10.1371/journal.pone.0214500
Resumen de PubMed | Texto completo de CrossRef | Google Académico
52. Burdett CL, Kraus BR, Garza SJ, Miller RS, Björk KE. Simulación de la distribución de granjas ganaderas individuales y sus poblaciones en los Estados Unidos: un ejemplo utilizando granjas de cerdos domésticos (Sus scrofa domesticus). PLoS UNO. (2015) 10:e0140338. doi: 10.1371/journal.pone.0140338
Resumen de PubMed | Texto completo de CrossRef | Google Académico
53. Merrill SC, Koliba C, Bucini G, Clark E, Trinity L, Zia A, et al. 307 Un enfoque sistémico para comprender la toma de decisiones de bioseguridad. J Anim Sci. (2020) 98(Suppl_4):43. doi: 10.1093/jas/skaa278.078
54. Liu T-L, Merrill SC, O’Keefe A, Clark EM, Langle-Chimal OD, Trinity L, et al. Efectos de la entrega de mensajes en el cumplimiento de la bioseguridad intercultural: perspectivas de simulaciones experimentales. Front Vet Sci. (2022) 9:984945. doi: 10.3389/fvets.2022.984945
Resumen de PubMed | Texto completo de CrossRef | Google Académico
55. Thomas M, Tsai CI. Distancia psicológica y experiencia subjetiva: cómo el distanciamiento reduce la sensación de dificultad. J Consum Res. (2011) 39:324–40. doi: 10.1086/663772
56. Denny BT, Ochsner KN. Efectos conductuales del entrenamiento longitudinal en la reevaluación cognitiva. Emoción. (2014) 14:425–33. doi: 10.1037/a0035276
Resumen de PubMed | Texto completo de CrossRef | Google Académico
57. Poderes JP, LaBar KS. Regulación de la emoción a través del distanciamiento: una taxonomía, un modelo neurocognitivo y un metaanálisis de apoyo. Neurosci Biobehav Rev. (2019) 96:155–73. doi: 10.1016/j.neubiorev.2018.04.023
Resumen de PubMed | Texto completo de CrossRef | Google Académico
58. Hidano A, Enticott G, Christley RM, Gates MC. Modelado de cambios dinámicos en el comportamiento humano en modelos de enfermedades animales: desafíos y oportunidades para abordar el sesgo. Front Vet Sci. (2018) 5:137. doi: 10.3389/fvets.2018.00137
Resumen de PubMed | Texto completo de CrossRef | Google Académico
59. Sellnow DD, Sellnow TL, Martin JM. Convergencia estratégica de mensajes en la comunicación de la bioseguridad: el caso del Virus de la Diarrea Epidémica Porcina 2013. Commun Rep. (2019) 32:125-36. doi: 10.1080/08934215.2019.1634747
60. Equipo central de R. R: Un lenguaje y un entorno para la computación estadística. Viena: R Foundation for Statistical Computing (2020).
62. David PA. Dependencia del camino: un concepto fundamental para la ciencia social histórica. Cliométrica. (2007) 1:91–114. doi: 10.1007/s11698-006-0005-x
63. Wiltshire SW. Uso de un modelo basado en agentes para evaluar el efecto de la especialización de los productores en la resiliencia epidemiológica de las redes de producción ganadera. PLoS UNO. (2018) 13:e0194013. doi: 10.1371/journal.pone.0194013
Resumen de PubMed | Texto completo de CrossRef | Google Académico
Palabras clave: bioseguridad, comportamiento humano (actividades), actitud de riesgo, sistemas de producción porcina, modelación basada en agentes, virus de la diarrea epidémica porcina (PEDv)
Cita: Bucini G, Clark EM, Merrill SC, Langle-Chimal O, Zia A, Koliba C, Cheney N, Wiltshire S, Trinity L y Smith JM (2023) Conexión de la dinámica de las enfermedades del ganado con el aprendizaje humano y las decisiones de bioseguridad. Frente. Vet. Sci. 9:1067364. doi: 10.3389/fvets.2022.1067364
Recibido: 11 de octubre de 2022; Aceptado: 20 de diciembre de 2022;
Publicado: 20 enero 2023.
Editado por:
Enric M. Mateu, Universitat Autònoma de Barcelona, España
Revisado por:
Rosemary Marusak, Universidad de Minnesota Twin Cities, Estados Unidos Diane DeWitte, Extensión de la Universidad de Minnesota, Estados
Unidos
Derechos de autor © 2023 Bucini, Clark, Merrill, Langle-Chimal, Zia, Koliba, Cheney, Wiltshire, Trinity y Smith. Este es un artículo de acceso abierto distribuido bajo los términos de la Licencia Creative Commons Attribution License (CC BY).
*Correspondencia: Gabriela Bucini, 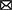 gbucini@uvm.edu
gbucini@uvm.edu
Renuncia: Todas las afirmaciones expresadas en este artículo son únicamente las de los autores y no representan necesariamente las de sus organizaciones afiliadas, ni las del editor, los editores y los revisores. Cualquier producto que pueda ser evaluado en este artículo o afirmación que pueda hacer su fabricante no está garantizado ni respaldado por el editor.
Date de alta y recibe nuestro 👉🏼 Diario Digital AXÓN INFORMAVET ONE HEALTH
Date de alta y recibe nuestro 👉🏼 Boletín Digital de Foro Agro Ganadero
Noticias animales de compañía
Noticias animales de producción
Trabajos técnicos animales de producción
Trabajos técnicos animales de compañía