Análisis inmunológico y de expresión de proteínas inmunorreactivas de Ehrlichia canis
 Jignesh G. Patel1
Jignesh G. Patel1 Tian Luo1
Tian Luo1 Xiaofeng Zhang1
Xiaofeng Zhang1 Jere W. McBride1,2,3,4,5*
Jere W. McBride1,2,3,4,5*- 1Departamento de Patología, Rama Médica de la Universidad de Texas, Galveston, TX, Estados Unidos
- número arábigoDepartamento de Microbiología e Inmunología, Rama Médica de la Universidad de Texas, Galveston, TX, Estados Unidos
- 3Centro de Biodefensa y Enfermedades Infecciosas Emergentes, Rama Médica de la Universidad de Texas, Galveston, TX, Estados Unidos
- 4Instituto Sealy de Ciencias de las Vacunas, Rama Médica de la Universidad de Texas, Galveston, TX, Estados Unidos
- 5Instituto de Infecciones e Inmunidad Humana, Rama Médica de la Universidad de Texas, Galveston, TX, Estados Unidos
La Ehrlichia canis es el principal agente etiológico de la ehrlichiosis monocítica canina, una enfermedad hemorrágica grave y a veces mortal de los perros. El diagnóstico de la infección por E. canis a menudo se confirma retrospectivamente mediante la detección serológica de anticuerpos mediante microscopía inmunofluorescente. Nuestro laboratorio identificó previamente numerosas proteínas inmunorreactivas importantes con epítopos de anticuerpos lineales específicos de cada especie que son útiles para el inmunodiagnóstico de CME. Más recientemente, hemos definido todo el inmunoma reactivo de anticuerpos de E. canis, aumentando sustancialmente el número de las principales proteínas inmunorreactivas que se sabe que existen. En este estudio, analizamos y comparamos siete proteínas reactivas de anticuerpos E. canis identificadas recientemente con antígenos de diagnóstico establecidos, incluidas las proteínas repetidas en tándem TRP19, TRP36 y TRP140, y observamos una inmunorreactividad comparable. Muchas de estas proteínas se conservaron en diferentes cepas de E. canis. Se mapearon múltiples epítopos lineales de anticuerpos en un TRP (Ecaj_0126) altamente conservado, incluso dentro del dominio de repetición en tándem. Se examinaron las respuestas temporales de los anticuerpos, y múltiples proteínas reaccionaron con los anticuerpos en los sueros tan pronto como 21 días después de la infección experimental. Se examinó la expresión específica del huésped de las proteínas, lo que reveló que algunas proteínas exhibían una mayor expresión en las células de mamíferos, mientras que otras en las células de garrapatas. Este estudio ha identificado nuevos candidatos a inmunodiagnóstico que exhiben diferentes patrones de expresión del huésped, información que puede ser útil para desarrollar inmunodiagnósticos ultrasensibles y vacunas efectivas para CME.
Introducción
La ehrlichiosis monocítica canina (CME), causada principalmente por Ehrlichia canis, es una enfermedad transmitida por garrapatas en perros de importancia mundial. E. canis es transmitida por la garrapata marrón del perro, Rhipicephalus sanguineus (1) y la EMC se manifiesta como una enfermedad multisistémica, que puede manifestarse en múltiples formas que incluyen fases agudas, subclínicas o crónicas (2). La fase aguda se caracteriza por signos clínicos y anomalías hematológicas, como depresión, anorexia, pérdida de peso, fiebre, hemorragia, trombocitopenia y anemia. En la fase subclínica, los perros pueden eliminar espontáneamente la infección o permanecer infectados y parecer clínicamente sanos durante meses o años. Por último, algunos perros pueden desarrollar una infección crónica grave caracterizada por médula ósea hipoplásica, hemorragia y muerte (3).
El diagnóstico de EMC se puede determinar presuntivamente mediante la visualización de E. canis-morulae intracitoplasmática dentro de los monocitos de sangre periférica; sin embargo, este método es el menos sensible y específico (4). En la mayoría de los casos, el diagnóstico se confirma mediante métodos serológicos o moleculares, como un ensayo de anticuerpos inmunofluorescentes o una PCR (5, 6). Los diagnósticos moleculares como la PCR pueden ser útiles, pero los resultados falsos negativos y positivos son comunes debido a los bajos niveles de ehrlichiae circulantes en la sangre, combinados con una baja sensibilidad a la PCR, contaminantes que inhiben la PCR y potencial de amplificación inespecífica (6). El diagnóstico de la EMC mediante un ensayo de anticuerpos fluorescentes indirectos (IFA) se considera el «estándar de oro» serológico, pero los anticuerpos reactivos cruzados pueden dificultar el diagnóstico definitivo mediante IFA (5). Además, el IFA también requiere un costoso equipo de microscopía y una interpretación subjetiva por parte de un microscopista experimentado. Más recientemente, el inmunodiagnóstico molecular de la infección por E. canis utilizando péptidos que contienen epítopos lineales de anticuerpos como marcadores diagnósticos se ha utilizado en pruebas diagnósticas veterinarias de referencia y en el punto de atención (6-8).
En las últimas dos décadas, se han identificado y caracterizado molecularmente numerosas proteínas inmunorreactivas de E. canis que reaccionan fuertemente con los anticuerpos de sueros de perros infectados (9-13). La caracterización inmunomolecular de estas principales proteínas inmunorreactivas ha revelado varias proteínas de repetición en tándem (TRPs) que contienen epítopos de anticuerpos lineales específicos de la especie ubicados dentro de las repeticiones en tándem (TRs) (10, 12, 14). Tres de estas TRPs (TRP19, TRP36 y TRP140) han sido identificadas como proteínas inmunorreactivas importantes que son particularmente útiles para el diagnóstico de la infección por E. canis (15, 16). Sin embargo, la variabilidad genética (es decir, TRP36) puede limitar la fiabilidad de dichos antígenos dependiendo de la ubicación geográfica (17, 18). Por lo tanto, las proteínas más conservadas (es decir, TRP19) son más confiables y preferidas para el inmunodiagnóstico de la infección por E. canis (18, 19).
El inmunoma de E. canis, recientemente finalizado, ha revelado un grupo de nuevas proteínas inmunorreactivas (20-22). La mayoría de estas proteínas son pequeños efectores secretados con funciones desconocidas. En este estudio, evaluamos y comparamos siete proteínas recientemente identificadas con TRPs establecidas para el inmunodiagnóstico de CME. Para comprender las diferencias en la reactividad temporal de los anticuerpos y la sensibilidad diagnóstica, también examinamos la reactividad con sueros de perro infectados experimentalmente y determinamos los niveles de expresión de estas proteínas inmunorreactivas en células de garrapata infectadas por E. canis (ISE6) y de mamíferos (DH82).
Materiales y métodos
Síntesis génica y expresión libre de células
Las secuencias genéticas de Ehrlichia canis (Jake Strain) utilizadas en el estudio están disponibles en los Genomas Microbianos Integrados (IMG). Se realizó la síntesis génica de 1 E. canis (GenScript, Piscataway, NJ, USA) y los genes se clonaron en un vector pIVEX-2.3d o pET-14b que contenía un promotor/terminador T7 y una secuencia de etiquetas His 6×. Los plásmidos con genes clonados se liofilizaron y almacenaron a -20 °C antes de su uso.
La expresión libre de células de las proteínas inmunorreactivas de E. canis se realizó utilizando el Sistema de Expresión de Proteínas de Alto Rendimiento S30 T7 (Promega, Madison, WI, USA). Los plásmidos se transformaron en células competentes para Stellar (Takara, Mountain View, CA, EE. UU.) y el plásmido se extrajo y purificó utilizando QIAprep Spin Miniprep Kit (Qiagen, Germantown, MD, EE. UU.) como se describió anteriormente (21). El plásmido recombinante se mezcló con extracto de E. coli, una mezcla de premezcla y reacción y se incubó a 37°C con agitación a 750 rpm durante 3 h. La proteína expresada sin células se almacenó a 20 °C hasta su uso.
Sueros para perros
En este estudio se utilizó un panel de 15 sueros de perros infectados naturalmente procedentes de Estados Unidos, Colombia y Brasil que fueron confirmados como positivos para el anticuerpo contra E. canis por IFA. Se utilizaron sueros recolectados de un perro infectado experimentalmente con E. canis (inoculación con aguja) en los días 0, 7, 14, 21, 28, 35, 42 y 56 después de la infección para evaluar las respuestas temporales de anticuerpos a las proteínas (16).
ELISA
La inmunorreactividad y la sensibilidad diagnóstica de las proteínas de E. canis expresadas en células libres se evaluaron mediante ELISA como se describió anteriormente (21, 22). Brevemente, las placas ELISA recubiertas de anti-HIS (GenScript) se bloquearon con tampón de bloqueo de bloque de arranque (Thermo Fisher) a temperatura ambiente durante 20 min con agitación (300 rpm). Después de lavar dos veces con PBS-Tween 20 (0,05%) (PBST), las placas se recubrieron con lisado de expresión libre de células que contenía proteínas recombinantes marcadas con His (50 μL), diluidas (1:50) en tampón de bloqueo (TBST, leche en polvo descremada al 2%) y se incubaron durante la noche a 4 °C. Las placas se lavaron cinco veces y se añadieron sueros de perro diluidos (1:200, 50 μL) a cada pocillo y se incubaron a temperatura ambiente durante 1 h con agitación. Las placas se lavaron cinco veces y se incubaron con anticuerpo secundario IgG (H + L) de cabra marcado con fosfatasa alcalina (100 μL; 1:5000, KPL, Gaithersburg, MD), y se incubaron durante 1 h a temperatura ambiente con agitación. Las placas fueron lavadas y se utilizó sustrato BluePhos (100 μL; KPL) y se incubó durante 30 min en la oscuridad con agitación. El desarrollo del color se midió a A650 en un lector de microplacas VersaMax (Molecular Devices) y los datos se analizaron con el software Softmax Pro 7 (Molecular Devices). La densidad óptica final (OD650) se determinó después de restar el valor de OD650 del control negativo (lisado libre de células del vector vacío). Se incluyeron sueros caninos positivos y negativos como controles.
Mapeo de epítopos
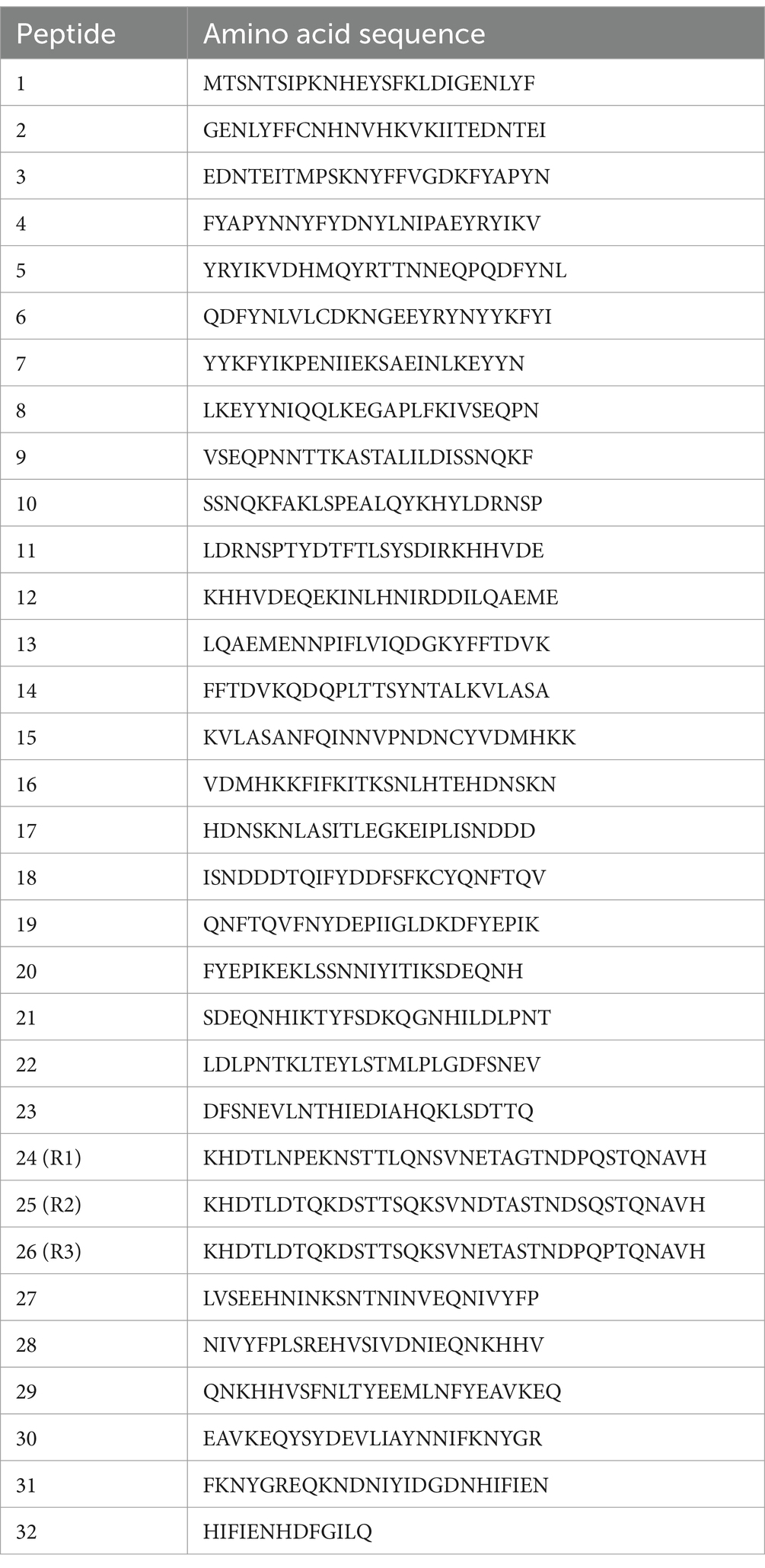
Los epítopos lineales en el TRP de E. canis (Ecaj_0126) se mapearon con péptidos superpuestos de 25 aminoácidos (GenScript, Piscataway, NJ, EE. UU.) que representan todo el marco de lectura abierto, excepto tres TR de 35 aminoácidos que se sintetizaron por separado. Los péptidos liofilizados se resuspendieron en agua de grado molecular (1 mg/mL) y placas ELISA (MaxiSorp; NUNC, Roskilde, Dinamarca) se recubrieron (1 μg/mL) durante la noche a 4 °C. Las placas se lavaron tres veces con TBST y se bloquearon con suero de caballo al 10% en TBST durante 1 h a temperatura ambiente con agitación. El ELISA se realizó como se describió anteriormente (14).
Cultivo celular
Ehrlichia canis (cepa Jake) se propagó en células DH82 (células caninas similares a los macrófagos) con un medio esencial mínimo (Gibco, Grand Island, NY, EE. UU.) suplementadas con 10% de suero fetal bovino (HyClone, Logan, UT, EE. UU.), 1% de HEPES (Sigma Chemical Co., St. Louis, MO, EE. UU.), 1% de piruvato de sodio (Sigma) y 1% de aminoácidos no esenciales (Sigma) a 37 °C en una atmósfera humidificada con 5% de CO2. Ulrike Munderloh (Universidad de Minnesota) (23) y se mantuvo en medio L15B300 suplementado con un 10% de suero fetal bovino (GeminiBio, Sacramento, CA, EE.UU.), un 10% de caldo de fosfato de triptosa (BD, Sparks, MD, EE.UU.) y un 1% de concentrado de colesterol de lipoproteínas bovinas (MP Biomedicals, Irvine, CA, EE.UU.) como se ha descrito anteriormente (24). Las células ISE6 se infectaron [multiplicidad de infección (MOI) = 10] con E. canis libre de células huésped derivadas de células DH82 infectadas.
Antígeno de Ehrlichia canis
El antígeno de Ehrlichia canis para el análisis de Western blot se preparó como se describió anteriormente (17). Brevemente, se recolectaron células infectadas (DH82 e ISE6) cuando se observaron mórulas en todas las células después de la tinción con Diff-Quik. A continuación, las células se centrifugaron a (5.000 × g durante 15 min) y se resuspendieron en solución salina tamponada con fosfato (PBS). Las células se rompieron por sonicación, dos veces (40 Hz) durante 10 s, y los restos de células grandes se peletizaron por centrifugación (1.500 × g durante 10 min) a 4°C. El sobrenadante se centrifugó (10.000 × g durante 15 min) a 4 °C para recoger ehrlichiae libres de células. El pellet se lavó en PBS, se centrifugó (10.000 × g durante 15 min) a 4 °C y se resuspendió en PBS. Se realizó un ensayo de proteína BCA (Pierce Biotechnology, Rockford, IL, EE. UU.) para determinar la concentración de proteína. El lisado celular preparado a partir de las células no infectadas se utilizó como control negativo.
Anticuerpos
Los anticuerpos policlonales de conejo se generaron comercialmente inmunizando conejos con péptidos derivados de las respectivas proteínas inmunorreactivas de E. canis (GenScript). Los antisueros se utilizaron para el análisis de Western blot y la microscopía de inmunofluorescencia.
Electroforesis en gel y Western blot
El antígeno de E. canis purificado se solubilizó en tampón de muestra LDS que contenía el agente reductor ditiotreitol (Invitrogen), se calentó a 70 °C durante 10 min y se separó mediante electroforesis en gel de poliacrilamida de dodecil-sulfato de sodio (SDS-PAGE) en tampón de funcionamiento de ácido 3-N-morfolinopropanosulfónico (MOPS) en condiciones reductoras con geles de acrilamida Bis-Tris con un gradiente del 4 al 20% (NuPAGE; Invitrogen). Las proteínas se transfirieron a una membrana de nitrocelulosa (Protran BA85, tamaño de poro de 0,45 μm; Whatman, Florham Park, NJ, EE.UU.) utilizando un aparato de transferencia semiseco (Bio-Rad, Hercules, CA, EE.UU.). Las membranas se bloquearon durante 1 h con tampón bloqueante TBST (leche descremada al 5%). E. canis antisueros se diluyó (1:100) en el tampón de bloqueo y se incubó durante 1 h a temperatura ambiente con agitación. Las membranas se lavaron 3 veces con TBST, 5 min cada una y se aplicó e incubó durante 1 h un anticuerpo secundario anti-conejo anti-conejo (1:5000) en tampón de bloqueo Después del lavado, se aplicó 5-bromo-4-cloro-3-indolil-fosfato y sustrato de tetrazolio nitroazul (BCIP-NBT) (KPL) para visualizar el anticuerpo unido. Se realizó densitometría para las bandas de Western blot de cada proteína utilizando el software ImageJ y se determinaron los cambios de plegamiento de las proteínas de E. canis en relación con la actina celular.
Microscopía de inmunofluorescencia
Se prepararon portaobjetos de antígenos a partir de células DH82 o ISE6 infectadas con E. canis. Las células infectadas se aplicaron a portaobjetos recubiertos de teflón de 12 pocillos, se secaron al aire y se fijaron con paraformaldehído (PFA) al 4% durante 20 min a temperatura ambiente y se lavaron dos veces en PBS. Las células se permeabilizaron con Triton X-100 al 0,2% en PBS (BSA) durante 15 min y se lavaron. Se aplicó Image-It Signal Enhancer (Invitrogen) a las células durante 30 min, seguido de BlockAid (Invitrogen) durante 30 min. A continuación, las células se incubaron con antisueros específicos de antígeno (1:100) en tampón de bloqueo durante 1,5 h, se lavaron tres veces con PBST y se incubaron con anticuerpo secundario Alexa Fluorophore Plus 488 (1:200) durante 30 min en la oscuridad. Los portaobjetos se lavaron tres veces y se montaron con el reactivo antidecoloración ProLong Glass (Invitrogen). Las imágenes de inmunofluorescencia se capturaron con un microscopio de epifluorescencia Olympus BX61 y se analizaron utilizando el software Slidebook (v.5.0; Intelligent Imaging Innovations, Denver, CO, EE. UU.).
PCR cuantitativa en tiempo real (qPCR)
Las células DH82 e ISE6 se cultivaron en matraces T-25 (Cellstar) con una confluencia del 90-95% y se incubaron con E. canis libre de células a una multiplicidad de infección (MOI) de 10. Se recolectaron muestras diariamente para las células DH82 (5 días) e ISE6 (8 días), y el número absoluto de copias de E. canis dsb se determinó mediante qPCR en tiempo real y se trazó contra la curva estándar, como se describió anteriormente (25). Brevemente, las células se lavaron con PBS y se lisaron en SideStep Lysis and Stabilization Buffer (Agilent Technologies, Santa Clara, CA, EE. UU.), y se realizó una amplificación de PCR cuantitativa (qPCR) en tiempo real utilizando Brilliant II SYBR Green Mastermix (Agilent), cebador directo (5-GCTGCTCCACCAATAAATGTATCCCT-3) y cebador inverso (5-GTTTCATTAGCCAAGAATTCCGACACT-3), utilizando un sistema de PCR en tiempo real CFX96 Touch (BioRad).
Resultados
Comparación de la inmunorreactividad y la sensibilidad de las proteínas
Nuestro laboratorio identificó recientemente proteínas inmunodominantes de E. canis (n = 18), además de aquellas (es decir, TRPs, Anks, OMP-1) que se han reportado previamente (9, 11-13). En este estudio, seleccionamos siete proteínas que exhibieron la inmunorreactividad más fuerte para una evaluación adicional y las comparamos con proteínas inmunorreactivas bien definidas, incluidas TRP19, TRP36 y TRP140. De acuerdo con nuestros hallazgos anteriores, TRP19, TRP36 y TRP140 reaccionaron con 15 sueros de perros CME infectados de forma natural. Con ELISA, TRP36 y dos proteínas recientemente identificadas (Ecaj_0919 y Ecaj_0126) reaccionaron fuertemente con los sueros de perro (ODmedia de 650 > 2,0), y otras 5 (Ecaj_0717, Ecaj_0920, Ecaj_0636, Ecaj_0073 y Ecaj_0151) fueron ligeramente inferiores y similares a TRP140 y TRP19 (media OD650 > 1,7). Los sueros de perros infectados de forma natural no reaccionaron con la proteína de control negativo expresada en células libres (OD650 < 0,1) y las proteínas de E. canis expresadas en células libres (incluidas las TRP) no reaccionaron con sueros de perros no infectados. La inmunorreactividad de estas proteínas se determinó mediante ELISA y se clasificó según la media de OD650 (Figura 1A).
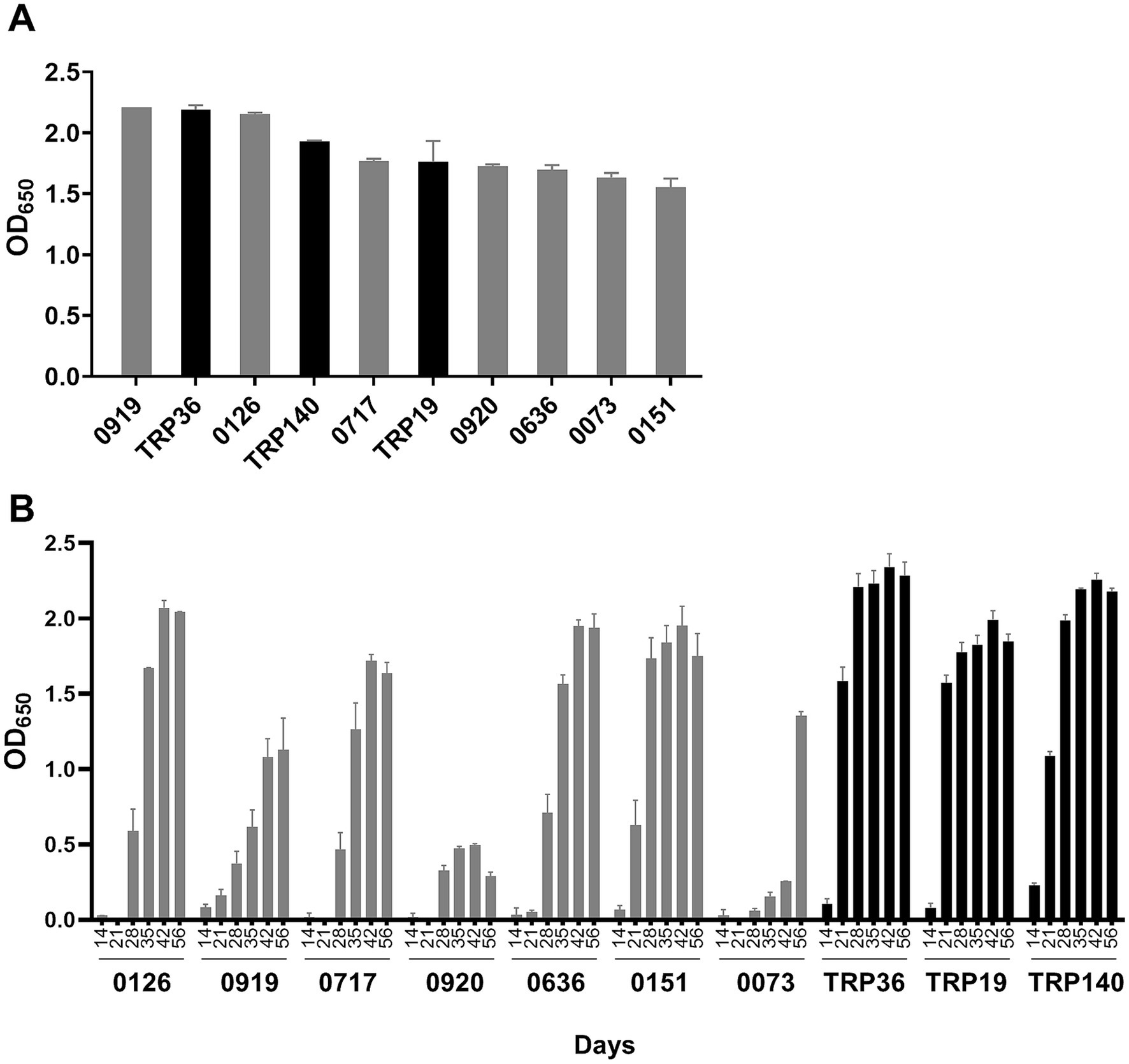
Para comprender las posibles diferencias en la sensibilidad diagnóstica para la detección de anticuerpos generados en las primeras etapas de la infección, se examinaron las proteínas de E. canis utilizando sueros de perros convalecientes de E. canis recogidos de un perro infectado experimentalmente en los días 0, 7, 14, 21, 28, 35, 42 y 56. Los sueros de perro obtenidos antes de la infección (día 0) se utilizaron como control negativo. Como se informó anteriormente (15), TRP36 y TRP140 fueron las más sensibles, ya que ambas proteínas reaccionaron con anticuerpos en sueros de perro ya en el día 14 (Figura 1B). TRP19 y Ecaj_0919 y Ecaj_0151 reaccionaron con anticuerpos el día 21. Todas las demás proteínas inmunodominantes reaccionaron con anticuerpos en el día 28, excepto Ecaj_0073, que reaccionó con anticuerpos en el día 35.
Diversidad genética de las proteínas de Ehrlichia canis
Investigamos la diversidad genética de E. canis. Proteínas (incluidas las TRP) mediante un análisis de secuencia BLAST. En la Tabla 1 se muestran las secuencias de proteínas derivadas de la cepa de E. canis Jake (EE. UU.) y E. canis YZ-1 (China), y las secuencias ortóloga de E. minasensis. E. minasensis es una especie de Ehrlichia relativamente nueva que es el pariente más cercano a E. canis (26). Cuatro de las 7 proteínas recién identificadas en la cepa de E. canis Jake eran idénticas a las homólogas de la cepa YZ-1 de E. canis, mientras que tres proteínas tenían diferencias menores en la longitud de la secuencia de aminoácidos y el porcentaje de identidad. TRP19 estaba muy conservado y TRP36 y TRP140 estaban menos conservados como se había informado anteriormente (18). En comparación con los ortólogos de E. minasensis, los TRP de E. canis variaron significativamente en la identidad de aminoácidos (53-70%). Sin embargo, los ortólogos de E. minasensis de dos proteínas recién descubiertas (Ecaj_0073 y Ecaj_0151) eran idénticos en longitud y tenían una identidad de secuencia del 88 y 94%, respectivamente, con E. canis. Los ortólogos de las cinco proteínas restantes de E. canis recientemente identificadas tuvieron variaciones en la longitud de la secuencia y su identidad de aminoácidos fue menor (entre 37 y 80%) entre las cepas. Estos datos indican que muchas de las proteínas reactivas de anticuerpos recientemente descubiertas están altamente conservadas entre las cepas de E. canis, pero diversas en el pariente más cercano de E. canis, E. minasensis.
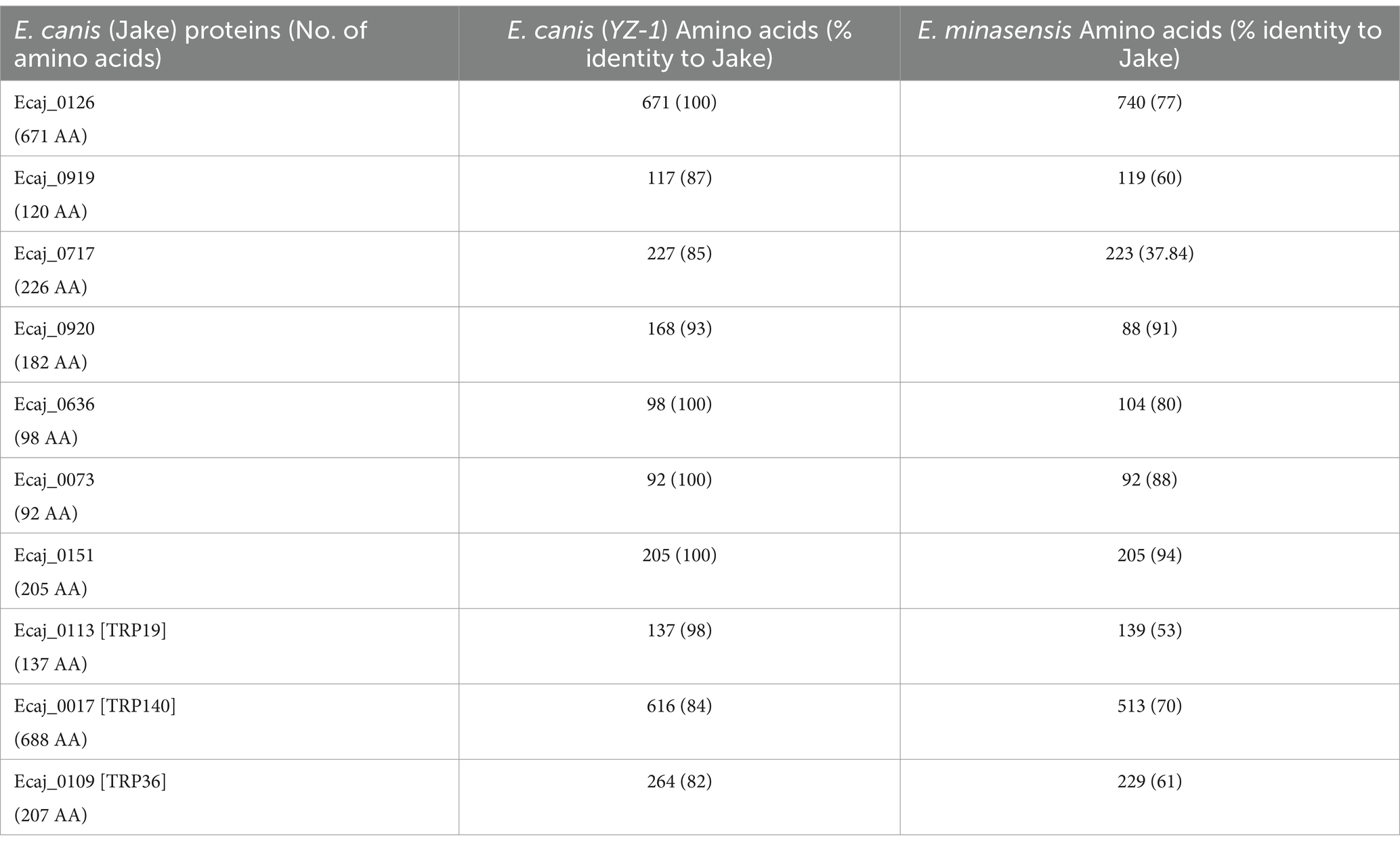
Tabla 1. Aminoácidos y porcentaje de identificación de las proteínas inmunorreactivas de Ehrlichia canis.
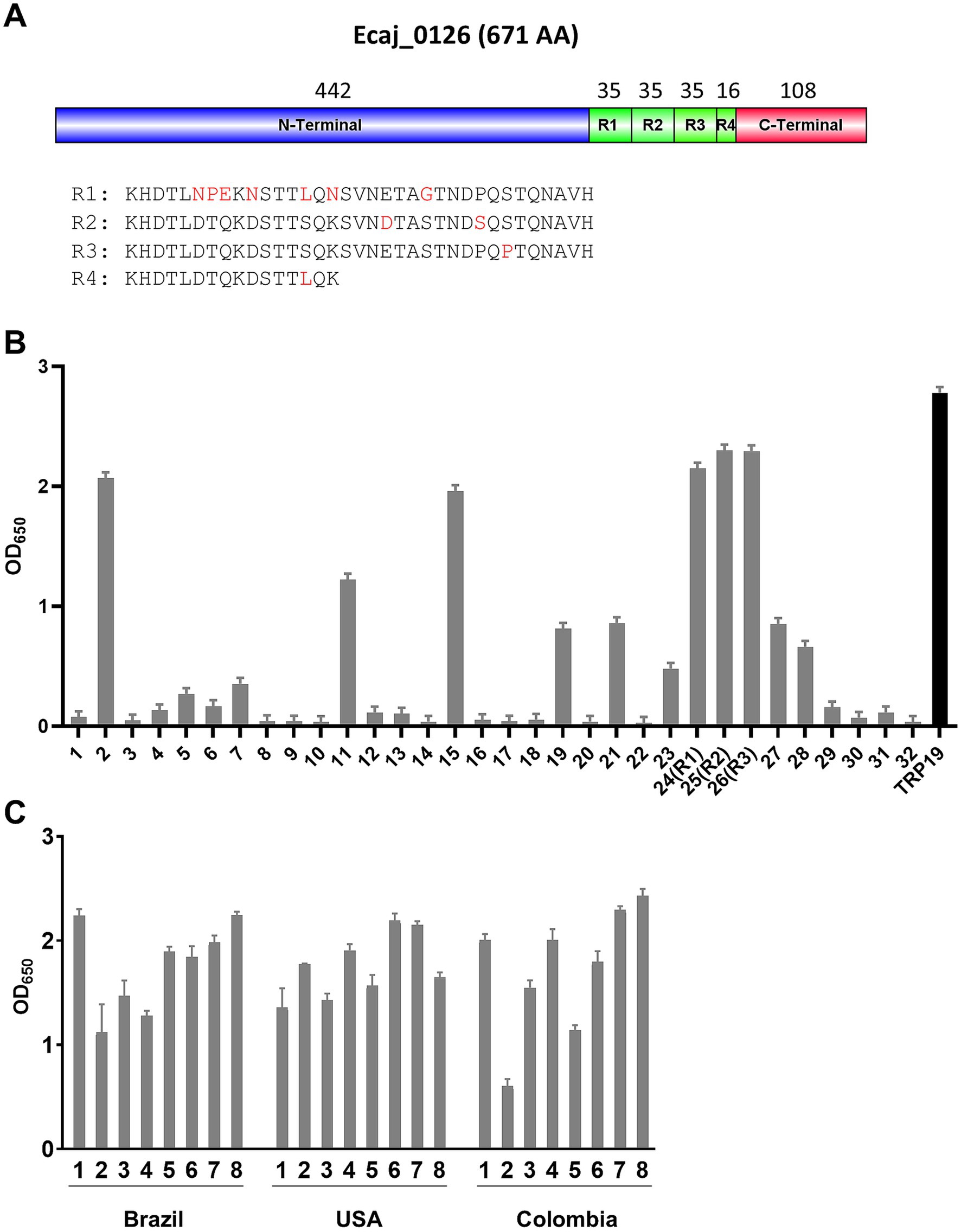
Mapeo lineal de epítopos de proteínas repetidas en tándem (Ecaj_0126)
Nuestro reciente estudio definiendo el inmunoma de E. canis reveló una proteína E. canis altamente inmunorreactiva (Ecaj_0126) (22). En esta investigación, determinamos que Ecaj_0126 contenía un dominio TR C-terminal (Figura 2A). Ecaj_0126 tiene una masa prevista de ~70 KDa (671 aminoácidos) y contiene tres repeticiones casi idénticas de 35 aminoácidos y una cuarta repetición parcial (16 aminoácidos). Para identificar los epítopos lineales de anticuerpos en Ecaj_0126, seleccionamos los péptidos superpuestos (25 aminoácidos; 6 aminoácidos superpuestos) y las 3 repeticiones de longitud completa (35 aminoácidos) de la región TR (Tabla 2). Se identificaron múltiples péptidos fuertemente inmunorreactivos con Ecaj_0126 que indican la presencia de epítopos lineales de anticuerpos (Figura 2B). Investigaciones posteriores de estos epítopos inmunorreactivos con sueros caninos adicionales de CME (n = 10) encontraron consistentemente una fuerte reactividad de anticuerpos con los péptidos TR. A continuación, analizamos el péptido Ecaj_0126 R2 con 8 sueros de perros CME recogidos en diferentes países de América del Norte y del Sur (EE. UU., Colombia y Brasil). Observamos una reactividad consistente de anticuerpos con todos los sueros de perros, lo que indica que el epítopo TR se conserva entre las cepas de E. canis dispersas geográficamente (Figura 2C).
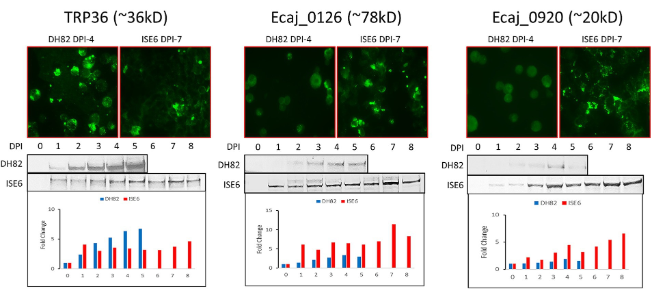
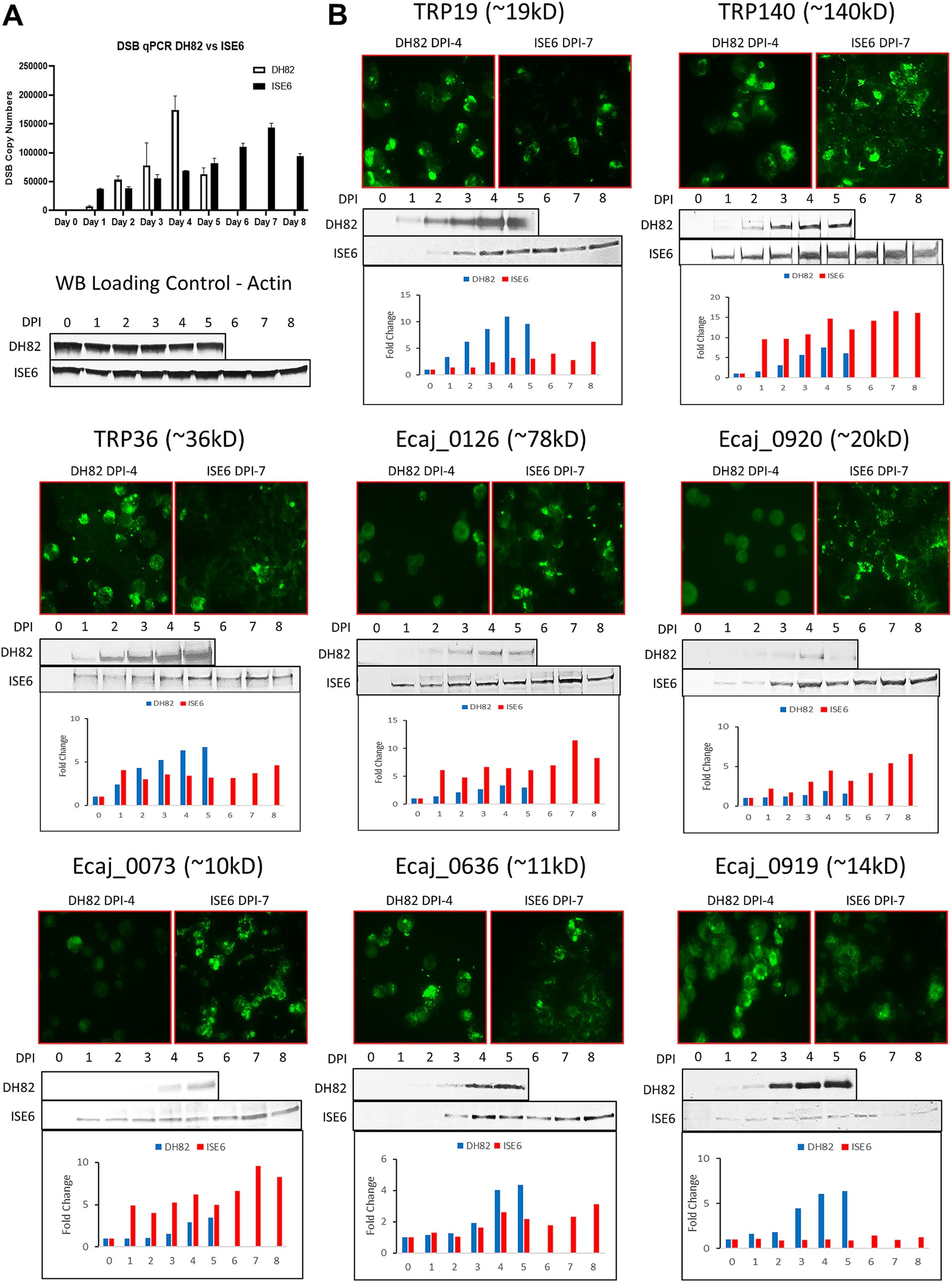
Expresión temporal de proteínas de Ehrlichia canis en células de mamíferos y garrapatas
Por qPCR en tiempo real, la replicación de E. canis aumentó más rápidamente en las células DH82, alcanzando su punto máximo en el día 4 en comparación con las células ISE6, que exhibieron una curva de crecimiento más lenta (pico en el día 7) más lineal (Figura 3A). Para examinar las diferencias en los niveles de expresión proteica de los TRPs de E. canis y las proteínas inmunorreactivas recientemente identificadas, se realizaron análisis de IFA y Western blot utilizando células DH82 infectadas por E. canis y células ISE6 (Figura 3B). Después de determinar la curva de crecimiento en ambas líneas celulares, preparamos portaobjetos de antígeno de E. canis utilizando células DH82 (día 4) e ISE6 (día 7). Por inmunotransferencia, cuatro proteínas (TRP140, Ecaj_0126, 0920 y 0073) mostraron niveles de expresión general más altos en las células ISE6 en comparación con DH82. Por el contrario, TRP19, TRP36, Ecaj_0636 y 0919 mostraron una mayor expresión general en las células DH82. Las imágenes de IFA fueron consistentes con la densitometría de inmunotransferencia occidental en los días 4 (DH82) y 7 (ISE6) después de la infección.
Discusión
La definición de los antígenos reactivos a los anticuerpos de Ehrlichia spp. y sus características moleculares es importante para desarrollar las vacunas inmunodiagnósticas más sensibles y específicas y, quizás lo que es más importante, las vacunas protectoras. La definición de proteínas inmunorreactivas de Ehrlichia ha progresado en los últimos 25 años, culminando con la caracterización completa de los inmunomas reactivos a anticuerpos de E. chaffeensis y E. canis (20-22). Se identificaron un total de 18 nuevas proteínas en E. canis que eran desconocidas hasta ahora (22). Antes de completar el inmunoma, se definió un pequeño subconjunto de proteínas de E. canis que reaccionan fuertemente con los anticuerpos en sueros de perros infectados y se consideraron proteínas inmunorreactivas importantes, incluidas tres TRP de E. canis (TRP140, TRP36 y TRP19) y los ortólogos correspondientes en E. chaffeensis (TRP120, TRP47 y TRP32). Un análisis inmunomolecular más detallado reveló importantes epítopos lineales específicos de la especie dentro de las unidades TR de estas proteínas. En particular, los péptidos que representan estos epítopos son sensibles y específicos para la detección de anticuerpos, algunos de los cuales se utilizan actualmente como marcadores de diagnóstico en pruebas veterinarias de referencia y en el punto de atención (7, 8).
E. canis es una enfermedad distribuida a nivel mundial y muchos estudios han identificado variación genética en las principales proteínas inmunorreactivas como TRP36 (18, 19). Por el contrario, TRP19 parece estar relativamente conservado, lo que es beneficioso para el desarrollo de pruebas diagnósticas fiables en todo el mundo (19). En particular, muchas de las nuevas proteínas inmunorreactivas principales (Ecaj_0126, 0636, 0073, 0151) examinadas en este estudio parecen estar altamente conservadas, mientras que otras exhiben cierta diversidad genética. Esto sugiere que muchas de estas proteínas conservadas serían particularmente útiles para el diagnóstico confiable de EMC, independientemente de la ubicación geográfica.
Anteriormente informamos que TRP36 y TRP19 provocaron respuestas tempranas de anticuerpos en perros infectados experimentalmente con E. canis (15, 16). Del mismo modo, descubrimos que varias de las nuevas proteínas inmunorreactivas principales provocan anticuerpos 3 semanas después de la infección. Utilizando sueros de un perro infectado experimentalmente, observamos respuestas de anticuerpos más bajas a algunas proteínas (Ecaj_0073 y Ecaj_0920) que las observadas con sueros de perro infectados de forma natural (Figura 1). La diferencia en la respuesta que observamos con sueros de perros infectados naturalmente puede estar relacionada con factores asociados con la transmisión de garrapatas en comparación con la inoculación experimental con aguja, la ruta utilizada para infectar experimentalmente a los perros. Es notable que estas dos proteínas exhibieron niveles de expresión más altos en las células de garrapata en comparación con las células de mamíferos en este estudio, lo que apoya esta posibilidad. Sin embargo, todas las nuevas proteínas inmunorreactivas principales provocan una respuesta robusta de anticuerpos en perros infectados naturalmente y sugieren que estas proteínas podrían ser valiosas candidatas diagnósticas y/o vacunales.
Dado que los cambios en el fenotipo de Ehrlichia en diferentes huéspedes no se conocen bien, examinamos la expresión de estas proteínas inmunorreactivas en células huésped de garrapatas y mamíferos. En un estudio anterior, informamos sobre los perfiles de transcripción del gen Ehrlichia en células de garrapatas y mamíferos y descubrimos que la expresión del transcriptoma de E. chaffeensis es mayor en las células de garrapatas en comparación con las células de mamíferos (24). Sin embargo, se descubrió que los TRP son algunos de los genes más expresados en las células de mamíferos, lo que fue consistente con los datos de expresión que observamos en el estudio actual. En particular, la mitad de las proteínas examinadas en este estudio demostraron niveles de expresión más altos en las células de garrapata, lo que sugiere que pueden ser importantes para la infección y transmisión de garrapatas. Estas diferencias en la expresión del huésped también ilustran cómo los estudios que utilizan solo ehrlichiae producidos en células de mamíferos podrían estar sesgados. Muchas proteínas fuertemente inmunorreactivas se expresan más en las garrapatas y es probable que sean objetivos importantes para las vacunas que bloquean la transmisión o provoquen respuestas de anticuerpos más tempranas que serían útiles para mejorar la sensibilidad diagnóstica.
Las TRP de E. chaffeensis y E. canis se identificaron hace más de una década sobre la base de una fuerte reactividad de anticuerpos mediante inmunotransferencia occidental (16). Posteriormente, el análisis inmunomolecular y el mapeo de epítopos identificaron epítopos de anticuerpos lineales específicos de cada especie en TRPs que definieron la base molecular de la reactividad de los anticuerpos (12, 14, 27). En particular, ahora se sabe que las TRP son proteínas efectoras secretadas que tienen múltiples funciones e interacciones con la célula huésped, incluidas las que actúan como nucleomodulinas, ubiquitina ligasa e imitadores de ligandos de la vía de señalización eucariota (28). Del mismo modo, se identificó un nuevo TRP (Ecaj_0126) que tiene una longitud de 671 aminoácidos y tres TR (35 aminoácidos). Al igual que otros TRPs conocidos, Ecaj_0126 mostraron una fuerte inmunorreactividad, y en este estudio, identificamos un epítopo de anticuerpo lineal en el TR de Ecaj_0126. Además, también identificamos al menos 3 epítopos lineales principales fuera del dominio TR que exhibían una inmunorreactividad similar al epítopo TR. En particular, Ecaj_0126 está altamente conservado (100%) entre las cepas dispersas de E. canis, lo que sugiere que podría ser un antígeno diagnóstico muy confiable independientemente de la variación genética y fenotípica entre las cepas. Esto se ve respaldado por la reactividad fuerte y consistente de los péptidos de Ecaj_0126 con sueros de perros de América del Norte y del Sur.
Declaración de disponibilidad de datos
Las contribuciones originales presentadas en el estudio están incluidas en el artículo/Material complementario, las consultas posteriores pueden dirigirse al autor correspondiente.
Declaración ética
No se requirió la aprobación ética para el estudio con animales de acuerdo con la legislación local y los requisitos institucionales porque todas las cepas celulares y sueros animales se compraron a empresas comerciales, se regalaron a otros grupos de investigación o se aislaron como parte de nuestro estudio aprobado anteriormente.
Contribuciones de los autores
JP: Curación de datos, Análisis formal, Investigación, Metodología, Software, Validación, Redacción – borrador original. TL: Curación de datos, Análisis formal, Investigación, Software, Validación, Redacción – revisión y edición. XZ: Curación de datos, Análisis formal, Metodología, Redacción – revisión y edición. JM: Conceptualización, Curación de datos, Análisis formal, Obtención de fondos, Investigación, Metodología, Administración de proyectos, Recursos, Supervisión, Validación, Redacción – borrador original, Redacción – revisión y edición.
Financiación
El/los autor/es declara(n) haber recibido apoyo financiero para la investigación, autoría y/o publicación de este artículo. Este estudio fue apoyado por la Fundación Clayton para la Investigación.
Conflicto de intereses
Los autores declaran que la investigación se llevó a cabo en ausencia de relaciones comerciales o financieras que pudieran interpretarse como un posible conflicto de intereses.
Nota del editor
Todas las afirmaciones expresadas en este artículo son únicamente las de los autores y no representan necesariamente las de sus organizaciones afiliadas, ni las del editor, los editores y los revisores. Cualquier producto que pueda ser evaluado en este artículo, o afirmación que pueda hacer su fabricante, no está garantizado ni respaldado por el editor.
Material complementario
El material complementario para este artículo se puede encontrar en línea en: https://www.frontiersin.org/articles/10.3389/fvets.2024.1481934/full#supplementary-material
Notas
1. ^http://img.jgi.doe.gov/
Referencias
1. Groves, MG, Dennis, GL, Amyx, HL, y Huxsoll, DL. Transmisión de Ehrlichia canis a perros por garrapatas (Rhipicephalus sanguineus). Am J Vet Res. (1975) 36:937–40.
2. Mylonakis, ME, Harrus, S, y Breitschwerdt, EB. Actualización sobre el tratamiento de la ehrlichiosis monocítica canina (Ehrlichia canis). Veterinario J. (2019) 246:45–53. doi: 10.1016/j.tvjl.2019.01.015
Resumen de PubMed | Texto completo de Crossref | Google Académico
3. Mylonakis, ME, Koutinas, AF, Breitschwerdt, EB, Hegarty, BC, Billinis, CD, Leontides, LS, et al. Ehrlichiosis crónica canina (Ehrlichia canis): estudio retrospectivo de 19 casos naturales. J am anim hosp assoc. (2004) 40:174–84. doi: 10.5326/0400174
Resumen de PubMed | Texto completo de Crossref | Google Académico
4. Mylonakis, ME, Koutinas, AF, Billinis, C, Leontides, LS, Kontos, V, Papadopoulos, O, et al. Evaluación de la citología en el diagnóstico de la ehrlichiosis monocítica canina aguda (Ehrlichia canis): comparación entre cinco métodos. Microbiol veterinario. (2003) 91:197–204. doi: 10.1016/S0378-1135(02)00298-5
Resumen de PubMed | Texto completo de Crossref | Google Académico
5. Waner, T, Harrus, S, Jongejan, F, Bark, H, Keysary, A, y Cornelissen, AW. Importancia de las pruebas serológicas para las enfermedades ehrlichiales en perros, con especial énfasis en el diagnóstico de la ehrlichiosis monocítica canina causada por Ehrlichia canis. Parasitol veterinario. (2001) 95:1–15. doi: 10.1016/S0304-4017(00)00407-6
Resumen de PubMed | Texto completo de Crossref | Google Académico
6. Harrus, S, y Waner, T. Diagnóstico de la ehrlichiosis monocitotrópica canina (Ehrlichia canis): una visión general. Veterinario J. (2011) 187:292–6. doi: 10.1016/j.tvjl.2010.02.001
Resumen de PubMed | Texto completo de Crossref | Google Académico
7. Beall, MJ, Mainville, CA, Argüello-Marín, A, Clark, G, Lemieux, C, Saucier, J, et al. Un ELISA mejorado en el punto de atención para el diagnóstico de anaplasmosis y ehrlichiosis durante la fase aguda de las infecciones transmitidas por garrapatas en perros. Mejor compañero Anim Med. (2022) 51:100735. doi: 10.1016/j.tcam.2022.100735
Resumen de PubMed | Texto completo de Crossref | Google Académico
8. Qurollo, BA, Stillman, BA, Beall, MJ, Foster, P, Hegarty, BC, Breitschwerdt, EB, et al. Comparación de ELISA de péptidos específicos de la especie Anaplasma y Ehrlichia con ensayos inmunofluorescentes basados en organismos completos para el diagnóstico serológico de anaplasmosis y ehrlichiosis en perros. Am J Vet Res. (2021) 82:71–80. doi: 10.2460/ajvr.82.1.71
9. Yu, XJ, McBride, JW, Díaz, CM y Walker, DH. Clonación molecular y caracterización del gen de la proteína de 120 kilodalton de Ehrlichia canis y aplicación de la proteína recombinante de 120 kilodalton para el serodiagnóstico de la ehrlichiosis canina. J Clin Microbiol. (2000) 38:369–74. doi: 10.1128/JCM.38.1.369-374.2000
Resumen de PubMed | Texto completo de Crossref | Google Académico
10. Doyle, CK, Cárdenas, AM, Aguiar, DM, Labruna, MB, Ndip, LM, Yu, XJ, et al. Caracterización molecular de repeticiones en tándem de E. canis gp36 y E. chaffeensis gp47 entre aislados de diferentes localidades geográficas. Ann N y Acad Sci. (2005) 1063:433–5. doi: 10.1196/anales.1355.079
11. Nethery, KA, Doyle, CK, Zhang, X y McBride, JW. Ehrlichia canis gp200 contiene epítopos de anticuerpos específicos de especies dominantes en dominios ácidos terminales. Infectar a Immun. (2007) 75:4900–8. doi: 10.1128/IAI.00041-07
Resumen de PubMed | Texto completo de Crossref | Google Académico
12. McBride, JW, Doyle, CK, Zhang, X, Cárdenas, AM, Popov, VL, Nethery, KA, et al. Identificación de una proteína inmunorreactiva principal glicosilada de Ehrlichia canis de 19 kilodalton con un epítopo de glicopéptido rico en serina específico de la especie. Infectar a Immun. (2007) 75:74–82. doi: 10.1128/IAI.01494-06
Resumen de PubMed | Texto completo de Crossref | Google Académico
13. McBride, JW, Yu, X y Walker, DH. Clonación molecular del gen de una proteína inmunorreactiva conservada de 28 kilodalton de Ehrlichia canis: un potencial antígeno serodiagnóstico. Clin Diagn Lab Immunol. (1999) 6:392–9. doi: 10.1128/CDLI.6.3.392-399.1999
Resumen de PubMed | Texto completo de Crossref | Google Académico
14. Luo, T, Zhang, X y McBride, JW. Epítopos de anticuerpos específicos de las especies principales de los ortólogos Ehrlichia chaffeensis p120 y E. canis p140 en regiones repetidas en tándem expuestas a la superficie. Clin Vacc Immunol. (2009) 16:982–90. doi: 10.1128/CVI.00048-09
Resumen de PubMed | Texto completo de Crossref | Google Académico
15. Cárdenas, AM, Doyle, CK, Zhang, X, Nethery, K, Corstvet, RE, Walker, DH, et al. El ensayo de inmunoadsorción enzimática con glicoproteínas inmunorreactivas conservadas gp36 y gp19 ha mejorado la sensibilidad y proporciona un inmunodiagnóstico específico de la especie de la infección por Ehrlichia canis. Clin Vacc Immunol. (2007) 14:123–8. doi: 10.1128/CVI.00361-06
Resumen de PubMed | Texto completo de Crossref | Google Académico
16. McBride, JW, Corstvet, RE, Gaunt, SD, Boudreaux, C, Guedry, T, y Walker, DH. Cinética de la respuesta de anticuerpos a las proteínas inmunorreactivas de Ehrlichia canis. Infectar a Immun. (2003) 71:2516–24. doi: 10.1128/IAI.71.5.2516-2524.2003
Resumen de PubMed | Texto completo de Crossref | Google Académico
17. Zhang, X, Luo, T, Keysary, A, Baneth, G, Miyashiro, S, Strenger, C, et al. Diversidades genéticas y antigénicas de las principales proteínas inmunorreactivas en cepas de Ehrlichia canis distribuidas globalmente. Clin Vacc Immunol. (2008) 15:1080–8. doi: 10.1128/CVI.00482-07
Resumen de PubMed | Texto completo de Crossref | Google Académico
18. Aguiar, DM, Zhang, X, Melo, AL, Pacheco, TA, Meneses, AM, Zanutto, MS, et al. Diversidad genética de Ehrlichia canis en Brasil. Microbiol veterinario. (2013) 164:315–21. doi: 10.1016/j.vetmic.2013.02.015
Resumen de PubMed | Texto completo de Crossref | Google Académico
19. Nambooppha, B, Rittipornlertrak, A, Tattiyapong, M, Tangtrongsup, S, Tiwananthagorn, S, Chung, YT, et al. Dos genogrupos diferentes de Ehrlichia canis de perros en Tailandia que utilizan genes de proteínas inmunodominantes. Infección Genet Evol. (2018) 63:116–25. doi: 10.1016/j.meegid.2018.05.027
Resumen de PubMed | Texto completo de Crossref | Google Académico
20. Luo, T, Patel, JG, Zhang, X, Walker, DH y McBride, JW. El hipotético análisis de proteínas de Ehrlichia chaffeensis y E. canis revela pequeñas proteínas inmunodominantes secretadas y epítopos de anticuerpos dependientes de la conformación. NPJ Vacc. (2020) 5:85. doi: 10.1038/s41541-020-00231-1
Resumen de PubMed | Texto completo de Crossref | Google Académico
21. Luo, T, Patel, JG, Zhang, X, Walker, DH y McBride, JW. Los repertorios de proteínas inmunorreactivas de Ehrlichia chaffeensis y E. canis revelan el dominio de proteínas hipotéticas y epítopos de anticuerpos dependientes de la conformación. Infectar a Immun. (2021) 89:E0022421. doi: 10.1128/IAI.00224-21
Resumen de PubMed | Texto completo de Crossref | Google Académico
22. Luo, T, Patel, JG, Zhang, X y McBride, JW. Los inmunomas reactivos de anticuerpos de Ehrlichia chaffeensis y E. canis son diversos y se definen por determinantes antigénicos conformacionales. La célula frontal infecta el microbiol. (2023) 13:1321291. doi: 10.3389/fcimb.2023.1321291
23. Munderloh, UG, Liu, Y, Wang, M, Chen, C y Kurtti, TJ. Establecimiento, mantenimiento y descripción de líneas celulares de la garrapata Ixodes scapularis. J Parasitol. (1994) 80:533–43. doi: 10.2307/3283188
Resumen de PubMed | Texto completo de Crossref | Google Académico
24. Kuriakose, JA, Miyashiro, S, Luo, T, Zhu, B y McBride, JW. El transcriptoma de Ehrlichia chaffeensis en huéspedes mamíferos y artrópodos revela la expresión génica diferencial y la regulación postranscripcional. PLoS Uno. (2011) 6:E24136. doi: 10.1371/journal.pone.0024136
Resumen de PubMed | Texto completo de Crossref | Google Académico
25. Dunphy, PS, Luo, T y McBride, JW. La Ehrlichia chaffeensis explota las vías de SUMOilación del huésped para mediar las interacciones efector-huésped y promover la supervivencia intracelular. Infectar a Immun. (2014) 82:4154–68. doi: 10.1128/IAI.01984-14
Resumen de PubMed | Texto completo de Crossref | Google Académico
26. Cabezas-Cruz, A, Valdés, JJ, y de la Fuente, J. La glicoproteína TRP36 de Ehrlichia sp. UFMG-EV y el patógeno bovino relacionado Ehrlichia sp. UFMT-BV evolucionaron a partir de un clado altamente variable de E. canis bajo selección diversificadora adaptativa. Vectores parásitos. (2014) 7:584. doi: 10.1186/s13071-014-0584-5
Resumen de PubMed | Texto completo de Crossref | Google Académico
27. Doyle, CK, Nethery, KA, Popov, VL, y McBride, JW. Los ortólogos de las principales proteínas inmunorreactivas expresadas y secretadas diferencialmente de Ehrlichia canis y E. chaffeensis provocan respuestas tempranas de anticuerpos a los epítopos en las repeticiones en tándem glicosiladas. Infectar a Immun. (2006) 74:711–20. doi: 10.1128/IAI.74.1.711-720.2006
Resumen de PubMed | Texto completo de Crossref | Google Académico
28. Byerly, CD, Patterson, LL, y McBride, JW. Ehrlichia Efectores TRP: pluriempleo, mimetismo e infección. Patógenos Dis. (2021) 79:ftab026. doi: 10.1093/femspd/ftab026
Resumen de PubMed | Texto completo de Crossref | Google Académico
Palabras clave: Ehrlichia, E. canis, proteína inmunorreactiva, ehrlichiosis monocítica canina (EMC), inmunodiagnóstico, vacuna, proteínas repetidas en tándem (TRPs)
Cita: Patel JG, Luo T, Zhang X y McBride JW (2024) Análisis inmunológico y de expresión de proteínas inmunorreactivas de Ehrlichia canis. Frente. Vet. Sci. 11:1481934. doi: 10.3389/fvets.2024.1481934
Recibido: 16 de agosto de 2024; Aceptado: 10 de octubre de 2024;
Publicado: 21 de octubre de 2024.
Editado por:
Eric M. Nicholson, Servicio de Investigación Agrícola (USDA), Estados Unidos
Revisado por:
Jifeng Bian, Servicio de Investigación Agrícola (USDA), Estados
Unidos Benjamin Cull, Universidad de Minnesota Twin Cities, Estados Unidos
Derechos de autor © 2024 Patel, Luo, Zhang y McBride. Este es un artículo de acceso abierto distribuido bajo los términos de la Licencia Creative Commons Atribución (CC BY).
*Correspondencia: Jere W. McBride, jemcbrid@utmb.edu
Renuncia: Todas las afirmaciones expresadas en este artículo son únicamente las de los autores y no representan necesariamente a las de sus organizaciones afiliadas, o las del editor, de los editores y de los revisores. Cualquier producto que puede ser evaluada en este artículo o afirmación que puede ser hecha por su El fabricante no está garantizado ni respaldado por el editor.
Date de alta y recibe nuestro 👉🏼 Diario Digital AXÓN INFORMAVET ONE HEALTH
Date de alta y recibe nuestro 👉🏼 Boletín Digital de Foro Agro Ganadero
Noticias animales de compañía
Noticias animales de producción
Trabajos técnicos animales de producción
Trabajos técnicos animales de compañía