Aplicación de la ecografía Doppler color para la evaluación de las consolidaciones pulmonares en un perro
Caso clínico: Aplicación de la ecografía Doppler color para la evaluación de las consolidaciones pulmonares en un perro
 Katarzyna Kraszewska1*
Katarzyna Kraszewska1*  Michał Gajewski1
Michał Gajewski1  Søren R. Boysen2
Søren R. Boysen2- 1Clínica Veterinaria Vetcardia, Varsovia, Polonia
- 2Facultad de Medicina Veterinaria, Universidad de Calgary, Calgary, AB, Canadá
Un macho Maltipoo de 1,5 años fue presentado al servicio de urgencias por disnea, debilidad y tos. Un examen ecocardiográfico mostró evidencia de hipertensión pulmonar con un signo de McConnell. Se realizó ecografía pulmonar, incluyendo Doppler color, e identificó dos poblaciones distintas de consolidación pulmonar. El análisis Doppler color del primer tipo de consolidación mostró la ausencia de flujo sanguíneo dentro de las regiones de la consolidación y la amputación del flujo. Estos hallazgos fueron consistentes con el «signo vascular» reportado en medicina humana y motivaron la consideración del tromboembolismo pulmonar como diagnóstico diferencial. En el segundo tipo de consolidación, el Doppler color identificó el flujo sanguíneo dentro de los vasos pulmonares del pulmón consolidado, formando un patrón «ramificado en forma de árbol» que seguía el curso anatómico de la vasculatura pulmonar. Estos hallazgos sugirieron que el flujo sanguíneo se conservaba dentro de la vasculatura pulmonar del pulmón consolidado e impulsaron la consideración de las causas inflamatorias de la patología pulmonar. Al volver a verificarla 6 días después, se identificó la recanalización del primer tipo de consolidación con Doppler color. El caso fue seguido en serie una vez al mes durante 5 meses con LUS, que mostró una mejoría continua. Sobre la base de una prueba de Baermann fecal positiva, se realizó un diagnóstico final de Angiostrongylus vasorum. Se proporciona información nueva o única: este es el primer informe de LUS Doppler color que se utiliza para caracterizar y ayudar a diferenciar la causa de la consolidación pulmonar en perros.
Introducción
En medicina humana, el análisis Doppler color es un componente de la ecografía pulmonar (LUS) que puede ayudar a diferenciar las lesiones pulmonares tromboembólicas de las inflamatorias (1-4). La ausencia de flujo sanguíneo dentro de las regiones de consolidación pulmonar y el llamado «signo vascular» son consistentes con la enfermedad pulmonar tromboembólica y se cree que son el resultado de la oclusión de un vaso por material embólico (4). Por el contrario, la identificación del flujo sanguíneo y un patrón vascular «en forma de árbol» dentro de las regiones de consolidación pulmonar son más consistentes con las causas inflamatorias de la enfermedad pulmonar (2, 4-6). El tromboembolismo pulmonar (TEP) es difícil de diagnosticar en pacientes veterinarios, ya que los signos clínicos son inespecíficos y los diagnósticos fácilmente disponibles, incluidas las radiografías torácicas, no son ni sensibles ni específicos. El estándar de referencia, la angiografía pulmonar por tomografía computarizada selectiva (ATP), requiere equipos especializados que no están fácilmente disponibles y están restringidos por la necesidad de transportar pacientes y el requerimiento de anestesia general, sedación y/o restricción física (7). Por el contrario, la ecografía se ha convertido en algo habitual en muchas clínicas veterinarias y, a menudo, se utiliza para evaluar los pulmones de pacientes de pequeños animales con dificultad respiratoria (8). La ecografía pulmonar es mínimamente invasiva, bien tolerada y puede realizarse sin necesidad de sedación, analgesia o posicionamiento específico del paciente, lo que minimiza el riesgo de deterioro del paciente al evaluar a los pacientes con dificultad respiratoria. Además, la LUS se ha utilizado para apoyar el diagnóstico de TEP en perros mediante la identificación de «signos de cuña» (9). Desafortunadamente, los «signos de cuña», identificados de forma aislada o localizados ventralmente, no se consideran sensibles o específicos para la TEP (4, 10). Hasta donde saben los autores, la ecografía Doppler color del pulmón no se ha utilizado clínicamente en pacientes con pequeños animales. Este caso clínico describe cómo se puede utilizar el análisis Doppler color del parénquima pulmonar consolidado para caracterizar y ayudar a diferenciar la patología pulmonar en función de la preservación o falta de flujo sanguíneo.
Descripción del caso
Un macho Maltipoo de 1,5 años fue remitido al servicio de urgencias por disnea, debilidad, tos y anorexia de 3 días de evolución. A la exploración física, el perro presentaba taquipneico (40 respiraciones/min) con marcado esfuerzo respiratorio, tenía crepitantes cráneo-dorsales locales auscultados bilateralmente y temperatura corporal rectal de 36,6 °C. En la auscultación cardíaca se observó un soplo cardíaco sistólico apical derecho (grado 1/6). La ecografía torácica en el punto de atención realizada por el médico de urgencias que lo atendió identificó caudodorsalmente las vías B difusas. Las radiografías torácicas (TXR) de tres proyecciones (ventrodorsal, dorsoventral y lateral derecho), tomadas sin sedación, revelaron un patrón bronquial bilateral en las regiones pulmonares caudales y un patrón alveolar craneal, que era más prominente en la derecha (Figura suplementaria S1). La puntuación del corazón vertebral fue de 9,5 y se consideró normal para el tórax de forma estándar del perro (11). Un hemograma completo (CBC) interno y un panel químico sérico mostraron neutrofilia (20,63 G/L, valores de referencia 6-12 G/L) con todos los demás parámetros sanguíneos medidos dentro de los límites de referencia. Después de las pruebas diagnósticas iniciales, el paciente recibió oxígeno suplementario a través de una caja de oxígeno, furosemida (2 mg/kg), terapia antibiótica (enrofloxacina 5 mg/kg SID) y teofilina (10 mg/kg dos veces al día) para la sospecha de neumonía por aspiración y la posible enfermedad de las vías respiratorias pequeñas según los patrones alveolares y bronquiales ventrales craneales observados en la TXR, respectivamente.
Debido a la presencia de un soplo cardíaco y a la detección de un aumento de las líneas B, se realizó un ecocardiograma al día siguiente por un médico experimentado con >10 años de experiencia en cardiología (KK) utilizando un ecógrafo GE VIVID IQ con dos sondas de matriz fraseada de frecuencia de 12 y 6 MHz. La ecocardiografía se realizó con el paciente de pie debido a la persistencia de la dificultad respiratoria, que había empeorado en relación con el momento de la presentación. La sonda de mayor frecuencia se utilizó para evaluar las estructuras cardíacas en detalle de alta resolución con un preajuste de «neonato» listo para usar con una profundidad de 6 cm y una posición de enfoque de 3 cm. La sonda de baja frecuencia, debido a que tiene un Doppler de onda continua de mejor calidad, se utilizó para medir la velocidad de cualquier insuficiencia valvular tricúspide y pulmonar. La velocidad se calculó automáticamente de m/s a mmHg utilizando la ecuación de Bernoulli (p = 4 × V2). La evaluación ecocardiográfica reveló escasa cantidad de derrame pericárdico (EP) en el ápice cardíaco del ventrículo derecho, hipertrofia excéntrica y concéntrica severa del ventrículo derecho en diástole (RVDd) y sístole (RVD) (Figura suplementaria S2), movimiento paradójico del tabique interventricular e insuficiencia de la válvula tricúspide (TVR) con chorro regurgitante de alta velocidad. El diagnóstico de hipertensión pulmonar se realizó a partir de mediciones cardíacas objetivas (Tabla 1) junto con las guías recientes de hipertensión pulmonar (12, 14-17). En la vista apical izquierda, se observó acinesia del ventrículo derecho con preservación apical, también conocida como signo de McConnell, que se ha reportado como secundaria a tromboembolismo pulmonar agudo (TEP) (18, 19). Un estudio de contraste salino agitado no reveló evidencia de derivación intracardíaca o extracardíaca de derecha a izquierda.
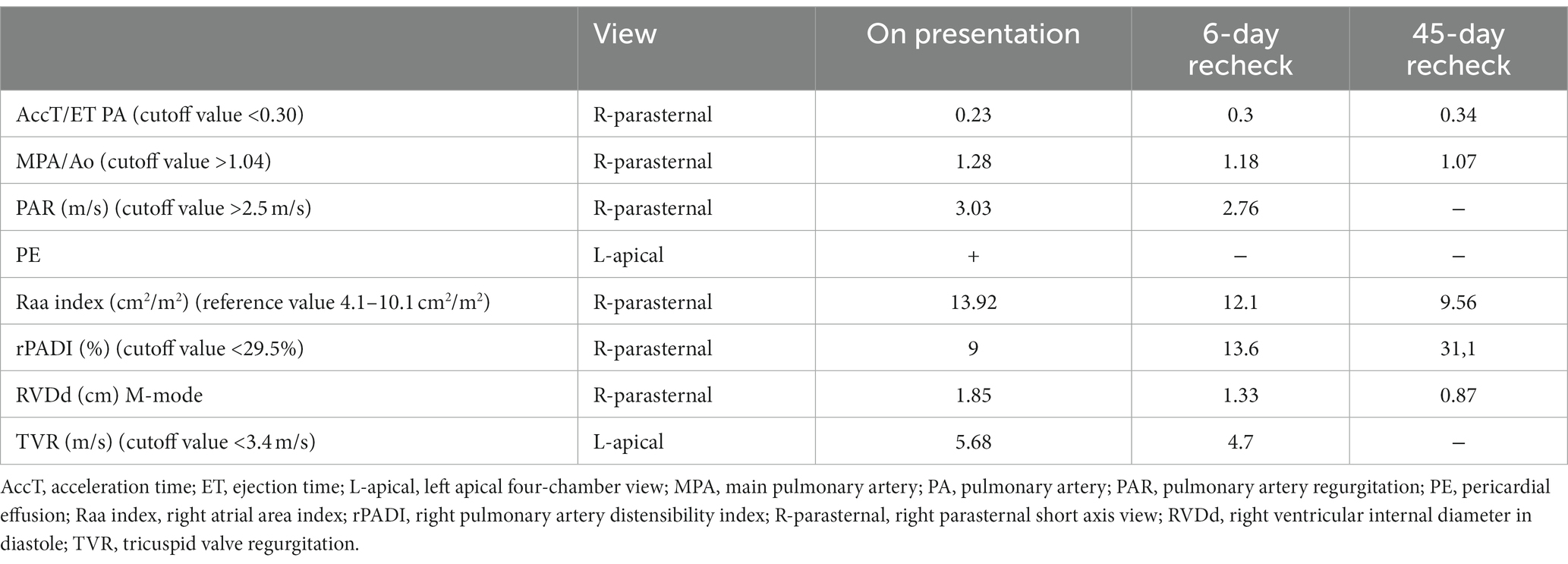 Tabla 1. Valores de corte y referencia para los parámetros ecocardiográficos seleccionados de la HTP para la predicción del gradiente máximo de presión sistólica regurgitante tricúspide >50 mmHg al ingreso, a los 6 días y a los 45 días (12, 13).
Tabla 1. Valores de corte y referencia para los parámetros ecocardiográficos seleccionados de la HTP para la predicción del gradiente máximo de presión sistólica regurgitante tricúspide >50 mmHg al ingreso, a los 6 días y a los 45 días (12, 13).
Dado que no había una causa cardiogénica obvia para la hipertensión pulmonar y que los TXR sugerían enfermedad pulmonar, el mismo operador (KK, con más de 5 años de experiencia en la realización de LUS con formación avanzada de expertos en ecografía pulmonar humana) realizó un examen de ultrasonido pulmonar pulmonar (KK, con más de 5 años de experiencia en LUS con formación avanzada de expertos en ecografía pulmonar humana) utilizando un GE VIVID IQ y una sonda lineal multifrecuencia (6-12 MHz). Durante el examen se utilizaron dos preajustes. Para la identificación y caracterización de los artefactos de la superficie pulmonar, la línea pleural y el deslizamiento pulmonar, se utilizó un «preajuste pulmonar» especial. Este preajuste tiene los armónicos desactivados, utiliza la frecuencia más baja de la sonda (6 MHz) con la persistencia puesta a cero, tiene una posición focal establecida al nivel de la línea pleural y utiliza una compensación de ganancia de tiempo (TGC) aumentada en el campo distal (lejano) de la pantalla. Tales ajustes crean una imagen «más tosca» (20, 21). En este preset se realizó un análisis Doppler color de las consolidaciones, con el límite de Nyquist establecido en el nivel de 0,7 m/s. Para una mejor visualización de las consolidaciones, el ajuste preestablecido se cambió a un ajuste preestablecido predeterminado de «tiroides». El preajuste «Tiroides» tiene los armónicos activados, utiliza un rango dinámico más alto y tiene activadas las imágenes espaciales compuestas, lo que da como resultado una imagen «más suave» para una mejor representación de la consolidación; El foco se puso en el centro de la consolidación.
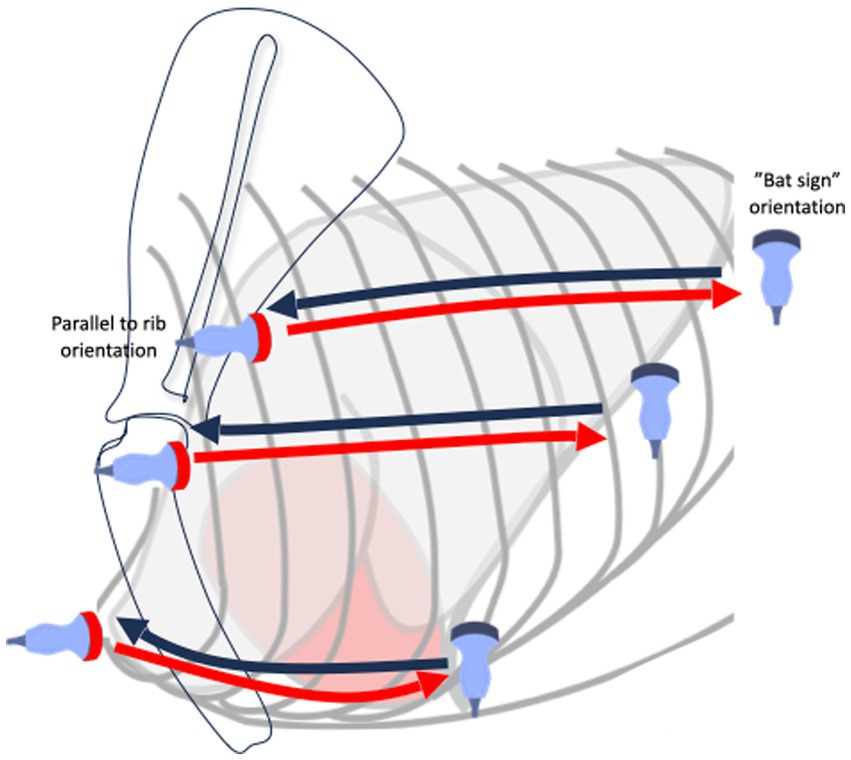
El perro fue examinado de pie. Se utilizaron alcohol y gel como agentes de acoplamiento. La ecografía pulmonar siguió el protocolo VetLus Figura 1 (22), elaborado por los autores (K.K. y M.G.). Utiliza una técnica de deslizamiento horizontal con el transductor colocado en tres ubicaciones verticales diferentes a cada lado del tórax a un nivel en línea con: (1) el centro de la escápula debajo de las cabezas de las costillas y los músculos epaxiales (línea dorsal); (2) la articulación del hombro (a nivel de la base del corazón, línea media); y (3) solo dorsal a esternera (línea ventral). La orientación inicial de la sonda está en el plano longitudinal con respecto al eje longitudinal del cuerpo (plano frontal, perpendicular a las costillas). En primer lugar, el transductor se deslizó a lo largo de la línea dorsal desde el cráneo hasta la caudal para identificar el signo del murciélago y evaluar la mayor parte posible de la superficie pulmonar. Después de este escaneo inicial, la sonda se giró 90 grados en un plano transversal; Por lo tanto, la orientación de la sonda es longitudinal en relación con las costillas, y los espacios intercostales se evalúan moviendo la sonda de una dirección caudal a una craneal a lo largo de la misma línea dorsal. Esto da una imagen de una línea pleural continua sin sombras de costillas, que eran visibles en el plano frontal. Se repitió la misma técnica de escaneo con deslizamiento de la sonda en el plano frontal seguido del plano transversal en las ubicaciones de segunda y tercera línea (es decir, el hombro y la línea paraesternal). A continuación, se repitió la técnica en el hemitórax opuesto.
Cada vez que el operador encontraba artefactos verticales o consolidaciones en el examen de LUS, se registraba un cineloop para su posterior caracterización. Las características de cada consolidación pulmonar incluyeron su tamaño, forma, márgenes, ecogenicidad y características adicionales, que se pueden dividir en criterios parenquimatosos (presencia de broncogramas), vasculares (mediante ecografía Doppler color) y pleurales (presencia o ausencia de deslizamiento pulmonar, derrame e irregularidades en la línea pleural), según lo definido por las recientes guías de ecografía pulmonar humana (4, 23). Posteriormente, se identificaron dos poblaciones de consolidación en función de su forma y características vasculares: (1) consolidaciones de forma irregular tipo «trituración» con flujo sanguíneo vascular visible y (2) consolidaciones triangulares o en forma de canasta sin flujo sanguíneo y/o con un «signo vascular» (4, 9, 10, 24, 25). Las características de estos dos tipos de consolidaciones se resumen en la Tabla 2.
 Tabla 2. Características de dos tipos de consolidaciones identificadas en la ecografía pulmonar junto con su posible etiología.
Tabla 2. Características de dos tipos de consolidaciones identificadas en la ecografía pulmonar junto con su posible etiología.
Las consolidaciones de forma irregular se restringieron predominantemente a los lóbulos pulmonares caudodorsales y tenían broncogramas aéreos estáticos y dinámicos visibles (4, 10, 24) (Figura suplementaria S3). En la periferia de algunas regiones consolidadas se observó un broncograma líquido. También se observaron artefactos de cola de cometa, que se extienden desde el borde más lejano de estas consolidaciones, también conocidas como líneas C (24, 26). Las imágenes Doppler color identificaron vasos perfundidos dentro de estas consolidaciones, lo que indica que el sistema vascular estaba intacto y seguía el curso anatómico de los vasos sanguíneos, tomando así la forma de un árbol (Figura suplementaria S3) (3, 27). El deslizamiento pulmonar estuvo localmente ausente en la interfase pared torácica-consolidación (superficie proximal de la consolidación).
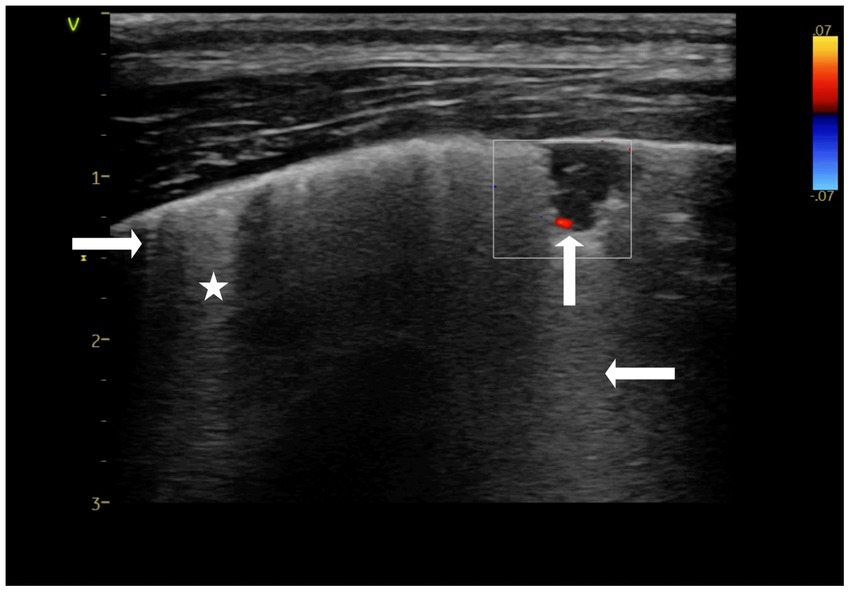
Se observaron lesiones de forma triangular, con la base del triángulo orientada hacia la línea pleural, en los lóbulos craneales del pulmón. Además de las lesiones en forma de triángulo, se identificó una lesión ocasional en forma de canasta, que aparece como un triángulo con la «punta» cortada (cuña roma). Tanto las lesiones de forma triangular como las de cesta se clasificaron como «signos de cuña» debido a las características compartidas de LUS y Doppler color y su semejanza con la forma anatómica de un lóbulo pulmonar (Figura 2) (9). La longitud de las consolidaciones desde el ápice hasta la base del «signo de cuña» (diagonal del triángulo) varió entre 3 y 20 mm, con artefactos de cola de cometa (líneas C) que se extendían desde el borde más alejado de la consolidación. Junto a los «signos de cuña», se observaron las líneas B. Se identificaron áreas pulmonares preservadas (pulmón aireado normal) además de regiones pulmonares consolidadas y líneas B, así como artefactos verticales cortos en forma de aguja, denominados líneas I (Figura 2) (28). Las características parenquimatosas de estas lesiones incluyeron consolidación hipoecogénica con ausencia de broncogramas. En muchos casos se puede observar una pequeña cantidad de líquido pleural entre el «signo de cuña» y la pared torácica, con una disminución o ausencia local de deslizamiento pulmonar a lo largo de la superficie proximal del «signo de cuña» (4). Las características vasculares identificadas en las imágenes Doppler color incluyeron un «signo vascular« descrito en la literatura humana (4) que se encontró en el lóbulo pulmonar craneal derecho (Figura 2) dentro de dos consolidaciones en forma de canasta. Se cree que el «signo vascular» es el resultado de la oclusión de un vaso por material embólico (4, 24, 25). El cese brusco del flujo sanguíneo en la «punta» de la consolidación se puede ver utilizando Doppler color. Las guías de ecografía pulmonar humana sugieren que encontrar incluso una consolidación con un signo vascular es sugestivo de TEP (4). Los hallazgos de un «signo de cuña» y un «signo vascular» en este reporte de caso llevaron a considerar el TEP como un diagnóstico diferencial (4, 9) (Figura 2).
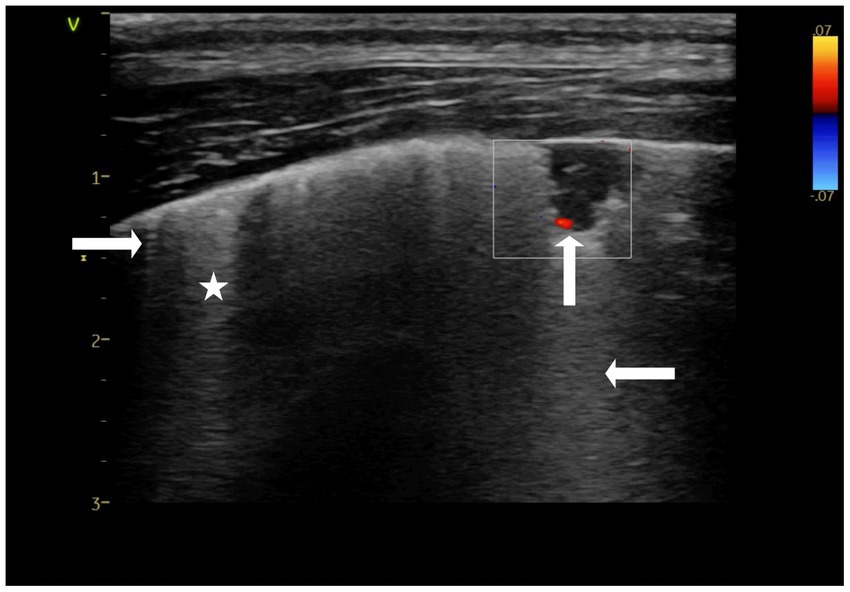 Figura 2. Imagen fija Doppler color de una consolidación de forma triangular dentro del pulmón conocida como «signo de cuña». Es visible la ausencia de flujo sanguíneo dentro de la región consolidada, lo que da la impresión de que el flujo sanguíneo está «amputado» (↑), lo que se conoce como el «signo vascular». Un artefacto de cola de cometa (línea C) se extiende desde el borde inferior de la consolidación (←). También son visibles artefactos cortos que se originan en la línea pleural (→), denominados líneas I. Por último, también son visibles artefactos verticales hiperecogénicos, que se cree que son líneas B (*). Para confirmar que se trata de líneas B, la profundidad debe ampliarse (10-15 cm) para garantizar que estos artefactos blancos verticales continúen llegando al campo lejano. Realizado en la presentación. Ajustes preestablecidos de tiroides.
Figura 2. Imagen fija Doppler color de una consolidación de forma triangular dentro del pulmón conocida como «signo de cuña». Es visible la ausencia de flujo sanguíneo dentro de la región consolidada, lo que da la impresión de que el flujo sanguíneo está «amputado» (↑), lo que se conoce como el «signo vascular». Un artefacto de cola de cometa (línea C) se extiende desde el borde inferior de la consolidación (←). También son visibles artefactos cortos que se originan en la línea pleural (→), denominados líneas I. Por último, también son visibles artefactos verticales hiperecogénicos, que se cree que son líneas B (*). Para confirmar que se trata de líneas B, la profundidad debe ampliarse (10-15 cm) para garantizar que estos artefactos blancos verticales continúen llegando al campo lejano. Realizado en la presentación. Ajustes preestablecidos de tiroides.
Se realizó un diagnóstico preliminar de TEP agudo basado en los hallazgos ecocardiográficos de HTP grave y los hallazgos de LUS de «signos de cuña» que contenían un «signo vascular». Se realizaron pruebas de biomarcadores a través de ensayos de dímero D y proteína C reactiva (PCR) para respaldar o refutar aún más un estado procoagulante y/o inflamatorio. El ensayo del dímero D midió 0,6 μg/mL (valores de referencia <0,3 μg/mL), mientras que la PCR fue de 32,8 mg/L (valores de referencia <20 mg/mL), lo que sugestivo de un estado de hipercoagulabilidad y neumonía, respectivamente. La prueba rápida de antígenos para el gusano del corazón fue negativa.
El perro fue tratado con enoxaparina (0,8 mg/kg de TID durante 3 días, disminuyendo gradualmente a SID durante 6 días), rivaroxabán (2,5 mg/kg de SID) (29), sildenafil (2 mg/kg de TID), pimobendán (0,25 mg/kg de IDT dos veces al día) (12), torasemida (0,1 mg/kg de SID) y enrofloxacino (5 mg de SID). Después de 3 días, se observó una respuesta al tratamiento, el estado general del paciente mejoró y el perro fue dado de alta al dueño. Los diuréticos fueron iniciados por el veterinario de admisión el primer día y continuaron hasta un nuevo examen de control en el día 6 debido a la presencia de líneas B y la sospecha de HTP (30-32). Se continuó con teofilina y antibióticos porque no se pudo descartar neumonía por aspiración asociada a bacterias en función de la presencia de leucocitosis, un patrón alveolar ventral en la TXR, consolidaciones y líneas B en el LU, y niveles elevados de PCR.
La ecocardiografía, el examen de LUS, el hemograma, el panel bioquímico, el dímero D y los ensayos de PCR se repitieron después de 6 días de tratamiento. El ensayo del dímero D fue de <0,3 μg/mL, la PCR fue de <20 mg/L y el recuento de leucocitos fue de 17,3 G/L. En el examen ecocardiográfico realizado por el mismo operador, se observó una reducción de la DFV y de la velocidad de la insuficiencia tricuspídea. No se apreciaba líquido pericárdico. En el examen de LUS se observó recanalización (retorno del flujo sanguíneo basado en Doppler color) de las consolidaciones en signo de cuña, así como un número reducido de líneas B (Figura 3; Figuras 4A y B). Las consolidaciones de los signos de trituración, que apoyan la enfermedad pulmonar inflamatoria y se localizan en los lóbulos caudodorsales, disminuyeron de tamaño, y algunos cambiaron de aspecto para adoptar una forma hipoecoica más redonda y pequeña, similar a la señal de un nódulo (Figura complementaria S4). Se continuó el tratamiento con enrofloxacino durante 10 días más. Se continuó con sildenafilo, rivaroxabán y teofilina (10 mg/kg dos veces al día). Se realizó un examen fecal de Baermann 10 días después de la presentación en una muestra fecal combinada recolectada en tres días consecutivos, que confirmó la infección por Angiostrongylus vasorum (33, 34). El perro fue tratado con imidacloprid (10 mg/kg) y moxidectina (2,5 mg/kg) readministrados a las 4 semanas.
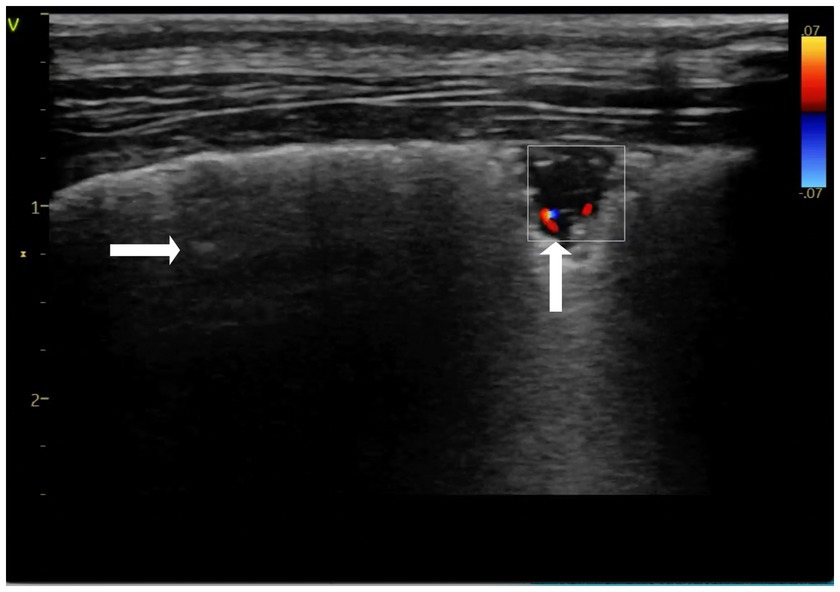 Figura 3. Imagen Doppler color del «signo de cuña» de consolidación pulmonar triangular, que demuestra la recanalización de la consolidación a lo largo del tiempo (↑), (→) áreas preservadas. Se realiza el día 6-recheck. Ajustes preestablecidos de tiroides.
Figura 3. Imagen Doppler color del «signo de cuña» de consolidación pulmonar triangular, que demuestra la recanalización de la consolidación a lo largo del tiempo (↑), (→) áreas preservadas. Se realiza el día 6-recheck. Ajustes preestablecidos de tiroides.
 Figura 4. Imagen fija Doppler color de un «signo de cuña» de consolidaciones de forma triangular con una consolidación hipoecogénica larga sin flujo (A). La recanalización precoz de la consolidación mediante doppler color se observó 6 días después del inicio del tratamiento (→) (B). Ajustes preestablecidos de pulmón.
Figura 4. Imagen fija Doppler color de un «signo de cuña» de consolidaciones de forma triangular con una consolidación hipoecogénica larga sin flujo (A). La recanalización precoz de la consolidación mediante doppler color se observó 6 días después del inicio del tratamiento (→) (B). Ajustes preestablecidos de pulmón.
Un segundo examen de revisión a los 45 días del ingreso, realizado por el mismo operador, reveló que el diámetro luminal de la aurícula derecha y el ventrículo estaban dentro de los límites de referencia y que la regurgitación de las válvulas tricúspide y de la arteria pulmonar se había resuelto. Sobre la base de las imágenes Doppler de ondas pulsadas (PW), el perfil de la arteria pulmonar se consideró normal. Se suspendió el tratamiento con sildenafilo, teofilina y rivaroxabán. La repetición de los exámenes de LUS reveló ocasionalmente líneas B aisladas bilateralmente sin consolidaciones pulmonares visibles.
Discusión
Los hallazgos de este caso clínico sugieren que la ecografía Doppler color, además de la forma de las consolidaciones pulmonares, puede ayudar a caracterizar y diferenciar las lesiones pulmonares en perros, lo que lleva a considerar el TEP y otras causas inflamatorias de patología pulmonar como diagnósticos diferenciales. En el presente caso se presentaron dos tipos de consolidación pulmonar: «signos en cuña» sin flujo sanguíneo sugestivo de TEP (el «signo vascular») y consolidaciones de forma irregular no descriptivas con broncogramas visibles y flujo sanguíneo preservado, compatibles con una lesión inflamatoria inespecífica.
La interpretación de LUS se basa en la evaluación de artefactos y consolidaciones. En un pulmón normalmente aireado, el signo del murciélago, el deslizamiento del pulmón y las líneas A deben ser visibles. Las líneas A son artefactos de reverberación que surgen como un fenómeno acústico resultante de la reflexión de los haces de ultrasonidos de una superficie altamente reflectante (interfaz tejido blando-aire, como la superficie pleural) y sus múltiples reflexiones entre esta superficie y la huella del transductor (35). En este caso, se observaron varios artefactos de la superficie pulmonar, incluidas las líneas B, C y I. Los artefactos patológicos más comunes del LUS son las líneas B. Se pueden encontrar líneas B ocasionales en perros sanos, pero su presencia se asocia con patología pulmonar cuando aumenta en número. Las líneas B se mueven con el deslizamiento pulmonar, se originan en la línea pleural y se extienden hasta el campo lejano de la imagen ecográfica (25, 35). Como el transductor lineal se utilizó para diferenciar las líneas B de otros artefactos de la cola del cometa en este informe de caso, la profundidad de la imagen se incrementó a 15 cm para confirmar que las líneas B no terminaban antes de alcanzar el campo lejano de la imagen de ultrasonido (25). A diferencia de las líneas B, que ocasionalmente pueden ser normales, la detección de las líneas C debido a su asociación con la consolidación pulmonar, siempre se considera un hallazgo anormal. Líneas C, que se originan y se extienden desde el borde distal (profundo) de las consolidaciones pulmonares en lugar de la línea pleural (23). Las líneas I se describen en la literatura como artefactos verticales cortos «en forma de aguja» que se originan en la línea pleural y terminan en unos pocos centímetros; su significado no está claro (Figura 2) (35).
Aunque la «forma de cuña» triangular es la consolidación ecográfica clásica identificada con el TEP, identificándose en aproximadamente el 85% de los pacientes humanos, el TEP también puede dar lugar a consolidaciones ovaladas, redondeadas y poligonales (4, 10, 23, 36). Se sospechó que varias consolidaciones de LUS localizadas ventralmente en el caso actual eran el resultado de PTE en función de su forma triangular o en forma de sol consistente con un «signo de cuña». En una pequeña serie de casos que involucró a dos perros, se consideró que un «signo de cuña» apoyaba el TEP, aunque no se confirmó un diagnóstico definitivo debido a la falta de un estándar de referencia (9). Los autores plantearon la hipótesis de que la localización de la lesión influía en la probabilidad de que un «signo de cuña» fuera diagnóstico de TEP, con «signos de cuña» localizados caudodorsalmente que apoyaban el diagnóstico, mientras que los «signos de cuña» localizados ventralmente no lo hacían. La preocupación con los «signos de cuña» localizados ventralmente es que los signos de trituración, que comúnmente se localizan ventralmente debido a patologías como la neumonía por aspiración, también pueden parecer triangulares, lo que hace que sea un desafío diferenciar los dos. Esto llevó a Lisciandro et al. a concluir que el «signo de cuña» es indistinguible de los signos de trituración y tejido cuando se localiza en regiones pulmonares dependientes de la gravedad (9). Para diferenciar aún más los signos de cuña de los signos de trituración, utilizamos una ecografía Doppler color del pulmón e identificamos hallazgos similares a los que se han reportado en la literatura humana. La evaluación de las características vasculares de las consolidaciones mediante ecografía Doppler color del pulmón se ha utilizado para proporcionar información diagnóstica adicional en pacientes cuando se sospecha que las lesiones pulmonares son causadas por TEP, pero se desea una confirmación adicional. En el caso del infarto pulmonar, el flujo sanguíneo arterial pulmonar no puede ser detectado por la ecografía Doppler color, lo que se denomina consolidación sin perfusión, similar a lo que se encontró en el presente caso (Figura 3) (1, 2, 23, 37). Además, en ocasiones se puede identificar un vaso tromboembólico congestionado dentro de la consolidación, lo que se denomina «signo vascular», que también se encontró en nuestro caso actual (Figura 2) (2, 3, 5).
La identificación de estos hallazgos de LUS Doppler color apoya el diagnóstico de TEP en las personas. Por el contrario, las consolidaciones no «en forma de cuña» en el caso actual preservaron el flujo vascular, lo que hace que el TEP sea menos probable. Estas consolidaciones de forma irregular con flujo sanguíneo preservado y broncogramas aéreos se consideran sugestivas de lesiones inflamatorias en las personas (4). Los hallazgos del presente informe de caso sugieren que la aplicación de la ecografía Doppler color del pulmón puede ayudar a diferenciar la TEP de otras causas de consolidación, incluso cuando las lesiones se localizan en las regiones pulmonares ventrales y/o tienen un aspecto atípico de forma no triangular. Si se conserva el flujo sanguíneo dentro de una región pulmonar consolidada, se argumenta en contra de la TEP, mientras que el hallazgo de un «signo vascular» y la interrupción o ausencia del flujo sanguíneo dentro de una región de consolidaciones debería impulsar la consideración de la TEP.
En el presente caso, se sospechó de TEP con base en ecocardiografía, la presencia de un signo de McConnell y dímeros D elevados. Se identificó un apoyo adicional para la presencia de TEP a través de la detección de «signos de cuña», particularmente cuando contenían «signos vasculares». Estos hallazgos, junto con la ausencia de sangrado activo, fueron la justificación para proporcionar tratamiento antitrombótico. Por el contrario, el perro también tenía consolidaciones con flujo sanguíneo preservado en forma de un patrón de vasculatura en forma de árbol en Doppler color, así como niveles elevados de PCR. Se ha reportado que las elevaciones de la PCR se asocian con la neumonía por aspiración canina (38), aunque no existen estudios sobre el valor diagnóstico de la PCR en otras formas de neumonía, incluida la neumonía parasitaria, en perros. Sin embargo, este informe de caso sugiere que el uso adicional del Doppler color durante el examen de LUS para caracterizar los hallazgos vasculares de las consolidaciones junto con la forma de la consolidación pulmonar puede ser útil para diferenciar la causa de la consolidación pulmonar. Cabe recordar que la ausencia de hallazgos sobre LUS no descarta el TEP.
El diagnóstico final en el presente caso fue Angiostrongylus vasorum basado en una prueba de Baermann fecal positiva y una respuesta positiva al tratamiento antiparasitario. Los hallazgos de LUS en casos con Angiostrongylus vasorum han sido descritos en la literatura, consistentes en múltiples nódulos pulmonares subpleurales con o sin líneas B concomitantes (34). Cuando se identificaron, los nódulos siempre se localizaron bilateralmente, afectando principalmente a las áreas caudodorsales, con una forma más o menos redonda, ecogenicidad ligeramente hipoecoica y márgenes claros. Del mismo modo, en el presente caso se identificaron consolidaciones predominantemente en las regiones caudodorsales. Sin embargo, a diferencia del informe anterior, las consolidaciones en el presente caso tenían múltiples hallazgos bronquiales presentes, incluidos broncogramas aéreos estáticos y dinámicos, así como broncogramas líquidos, que no fueron informados por Venco et al., aunque al evaluar retrospectivamente las imágenes publicadas en el estudio Venco, parece que algunas consolidaciones sí contienen broncogramas aéreos (34). Una diferencia significativa en las consolidaciones entre los dos estudios es la forma de las lesiones: irregulares vs. redondas. Dado que la clasificación de las consolidaciones no está estandarizada en medicina veterinaria, es posible que las diferencias subjetivas en lo que se considera redondo, irregular o en forma de cesta sean diferentes entre los operadores que clasifican las lesiones en los dos artículos. También es posible que algunas de las lesiones de forma redonda descritas por Venco tuvieran de hecho forma de canasta y, por lo tanto, pudieran haber sido causadas por PTE, particularmente si los broncogramas estaban ausentes. También es posible que el momento de la evaluación entre los dos estudios haya sido diferente y que las imágenes agudas de Angiostrongylus vasorum puedan revelar consolidaciones de forma irregular en las regiones caudodorsales, que se vuelven más pequeñas, más redondas y más parecidas a un «nódulo» en apariencia a medida que se resuelven con la cicatrización pulmonar. Por lo tanto, es posible que los casos analizados por Venco et al. se encontraran en las etapas más avanzadas y se asemejaran a la consolidación en el caso actual durante la segunda evaluación de revisión en comparación con la evaluación más aguda en el momento de la derivación. Las consolidaciones redondas se denominan «signo de nódulo» en la literatura y pueden corresponder a granulomas encontrados en el examen macroscópico e histopatológico en casos de invasión de Angiostrongylus vasorum (39). Los signos de los nódulos también pueden estar relacionados con la presencia de lesiones neoplásicas (tanto primarias como metastásicas), y la neoplasia debe incluirse en el diagnóstico diferencial de estos pacientes. Sin embargo, en el caso presentado, el «signo del nódulo» evolucionó a partir de un «signo de trituración», por lo que no se consideró neoplásico. Además, la neoplasia se consideró poco probable dada la corta edad del perro y la ausencia de lesiones intersticiales en la TXR realizada antes de la LUS.
La evaluación de los pulmones en el presente caso se realizó con una sonda lineal en contraste con una sonda microconvexa. En el presente informe se optó por una sonda lineal, ya que se prefirió una frecuencia más alta para la caracterización de las consolidaciones identificadas. Con base en las recomendaciones de la medicina humana, se puede preferir la sonda lineal para la evaluación de la consolidación pleural y subpleural (25, 40). Sin embargo, debe tenerse en cuenta que la sonda microconvexa a menudo se recomienda para el análisis vertical de artefactos de la superficie pulmonar. Sin embargo, al aumentar la profundidad de la imagen a 15 cm con la sonda lineal, la capacidad del operador para diferenciar los artefactos verticales que surgen de la línea pleural (por ejemplo, líneas B, Z o I) y confirmar que las líneas B son verdaderas líneas B se puede lograr evaluando si el artefacto vertical alcanza el campo lejano y se mueve o no con las fases de la respiración.
Una desventaja general de la LUS es que las lesiones que no llegan a la periferia pulmonar no se detectan porque la patología pulmonar separada de la superficie pulmonar por el aire se oscurece y solo se ven artefactos de reverberación. Por lo tanto, la LUS no puede descartar el TEP y, en medicina humana, el hallazgo de una consolidación en forma de cuña con hallazgos clínicos de apoyo siempre se considera una indicación para realizar pruebas adicionales para confirmar o excluir aún más el TEP (4, 10). Otras pruebas pueden incluir ecocardiografía para buscar evidencia de hipertensión pulmonar, diagnósticos no imagenológicos como tromboelastografía o dímeros D, búsqueda de un estado de hipercoagulabilidad y el uso de la ecografía Doppler color cuando no se dispone de diagnósticos estándar de referencia.
Hay varias limitaciones en este informe de caso. En primer lugar, no podemos confirmar que este paciente tuviera TEP. En segundo lugar, se identificaron dos tipos de consolidación ecográfica con diferentes criterios vasculares, por lo que es posible que la HTP se haya producido como consecuencia de TEP y/o neumonía, ya que tanto los niveles de dímero D como de PCR estaban elevados. Además, el perro recibió tratamiento multimodal, lo que hizo imposible determinar qué causa subyacente era responsable de la HTF. En este caso, no fue posible realizar un diagnóstico estándar de referencia debido a la falta de disponibilidad de equipos y a las limitaciones financieras del propietario. Sin embargo, al igual que en otros estudios, se utilizó un diagnóstico clínico estándar que consistió en hallazgos clínicos de apoyo, hallazgos ecocardiográficos, resultados del dímero D, la presencia de una enfermedad potencialmente hipercoagulable y una ecografía Doppler color de los pulmones. Aunque el LUS puede ser beneficioso como método de cribado, debe considerarse con el contexto clínico del paciente y alinearse con el examen clínico y otras pruebas diagnósticas de imagen y no de imagen.
Un inconveniente general de la ecografía Doppler color para LUS es que los artefactos de movimiento como resultado de las respiraciones pueden interferir con la calidad de la ecografía Doppler color. Es importante que la ecografía y los ajustes de la escala de velocidad Doppler sean buenos para visualizar los vasos pequeños dentro de las consolidaciones pulmonares. Para los operadores menos experimentados, el análisis Doppler puede ser difícil de realizar. Dependiendo de la disponibilidad de equipos en un entorno de emergencia, las máquinas de ultrasonido en el punto de atención pueden tener una funcionalidad Doppler limitada y una calidad de imagen más baja, lo que puede limitar su capacidad para detectar PTE. Sin embargo, la consolidación pulmonar debe evaluarse para la vascularización siempre que sea posible. Si el paciente experimenta disnea severa o jadeo, se puede realizar LUS después de la estabilización del paciente y se administra sedación. Los sedantes no deben influir directamente en los resultados de la exploración, pero la LUS debe realizarse tan pronto como sea posible después de lograr la sedación para evitar la atelectasia, que puede ocurrir debido a la decúbito lateral prolongado.
Conclusión
Además de utilizar el LUS en modo B para caracterizar la forma y el aspecto parenquimatoso de las consolidaciones, la adición de la ecografía Doppler color para evaluar sus características vasculares puede proporcionar información de apoyo sobre posibles etiologías. El Doppler color también puede ayudar a guiar el manejo del paciente al respaldar un diagnóstico de TEP cuando se identifica una afección hipercoagulable y el paciente presenta hallazgos clínicos adicionales que respaldan aún más el diagnóstico.
Declaración de disponibilidad de datos
Los datos brutos que respaldan las conclusiones de este artículo serán puestos a disposición por los autores, sin reservas indebidas.
Declaración ética
No se requirió aprobación ética para los estudios con animales de acuerdo con la legislación local y los requisitos institucionales porque se trata de un informe de caso, no de un ensayo clínico. Se obtuvo el consentimiento informado por escrito de los propietarios para la participación de su animal en este estudio.
Contribuciones de los autores
KK: Conceptualización, Escritura – borrador original, Investigación, Visualización. MG: Supervisión, redacción, revisión y edición. SB: Supervisión, Redacción – revisión y edición.
Financiación
El/los autor/es declaran/n que no se recibió apoyo financiero para la investigación, autoría y/o publicación de este artículo.
Conflicto de intereses
Los autores declaran que la investigación se llevó a cabo en ausencia de relaciones comerciales o financieras que pudieran interpretarse como un posible conflicto de intereses.
El/los autor/es declararon, en el momento de la presentación, ser miembro del consejo editorial de Frontiers. Esto no tuvo ningún impacto en el proceso de revisión por pares ni en la decisión final.
Nota del editor
Todas las afirmaciones expresadas en este artículo son únicamente las de los autores y no representan necesariamente las de sus organizaciones afiliadas, ni las del editor, los editores y los revisores. Cualquier producto que pueda ser evaluado en este artículo, o afirmación que pueda ser hecha por su fabricante, no está garantizado ni respaldado por el editor.
Material complementario
El material complementario para este artículo se puede encontrar en línea en: https://www.frontiersin.org/articles/10.3389/fvets.2023.1275929/full#supplementary-material
Figura complementaria S1 | Radiografías torácicas tomadas en el momento de la presentación. (A) Dorsoventral, (B) lateral derecho. Se puede observar un patrón bronquial bilateral en las regiones pulmonares caudales y un patrón alveolar craneal, que era más prominente a la derecha.
Figura complementaria S2 | Imagen fija del eje corto paraesternal derecho. El ventrículo derecho (↓) está agrandado, con el aplanamiento del tabique interventricular (→), lo que sugiere hipertensión pulmonar. Se realiza en la presentación.
Figura complementaria S3 | Imagen fija Doppler en color de una consolidación de forma irregular donde se pueden visualizar las estructuras vasculares ramificadas (que parecen arbóreas), lo que confirma la preservación del flujo sanguíneo dentro de la consolidación. Ajustes preestablecidos de pulmón. Se realiza en la presentación.
Figura complementaria S4 | Imagen de ultrasonido pulmonar fija de una consolidación de forma redonda denominada «signo del nódulo». Se realiza en la revisión del día 6. Ajustes preestablecidos de tiroides.
Abreviaturas
Ao: diámetro aórtico; AccT: tiempo de aceleración; Hemograma: hemograma completo; CD: Doppler color; PCR: proteína C reactiva; ET: tiempo de eyección; LUS: ecografía pulmonar; MPA: arteria pulmonar principal; EP: derrame pericárdico; HTP: hipertensión pulmonar; TEP: tromboembolismo pulmonar; AR: aurícula derecha; Índice Raa, índice del área auricular derecha; rPADI: índice de distensibilidad de la arteria pulmonar derecha; RVDd: diámetro interno del ventrículo derecho en diástole; TVR: regurgitación de la válvula tricúspide.
Referencias
1. Yuan, A, Yang, PC y Chang, DB. Infarto pulmonar: uso de la ecografía Doppler color para el diagnóstico y valoración de la reperfusión pulmonar. AJR Am J Roentgenol. (1993) 160:419–20. doi: 10.2214/ajr.160.2.8424369
Resumen de PubMed | Texto completo de CrossRef | Google Académico
2. Reissig, A, y Kroegel, C. Ecografía transtorácica de pulmón y pleura en el diagnóstico de la embolia pulmonar: un nuevo enfoque no invasivo a pie de cama. Respiración. (2003) 70:441–52. doi: 10.1159/000074195
Resumen de PubMed | Texto completo de CrossRef | Google Académico
3. Gorg, C, Seifart, U, Gorg, K y Zugmaier, G. Mapeo ecográfico Doppler color de lesiones pulmonares: evidencia de suministro arterial dual mediante análisis espectral. J Ultrasonido Med. (2003) 22:1033–9. doi: 10.7863/jum.2003.22.10.1033
4. Buda, N, Kosiak, W, Radzikowska, E, Olszewski, R, Jassem, E, Grabczak, EM, et al. Recomendaciones polacas para la ecografía pulmonar en medicina interna (POLLUS-IM). J Ultrason. (2018) 18:198–206. doi: 10.15557/JoU.2018.0030
Resumen de PubMed | Texto completo de CrossRef | Google Académico
5. Mathis, G, Metzler, J, Fussenegger, D, Sutterlutti, G, Feurstein, M, y Fritzsche, H. Observación ecográfica del infarto pulmonar y los infartos tempranos por embolia pulmonar. Eur Corazón J. (1993) 14:804–8. doi: 10.1093/eurheartj/14.6.804
Resumen de PubMed | Texto completo de CrossRef | Google Académico
6. Yang, P. Aplicaciones de la ecografía Doppler color en el diagnóstico de enfermedades torácicas. Respirología. (1997) 2:231–8. doi: 10.1111/j.1440-1843.1997.tb00083.x
Resumen de PubMed | Texto completo de CrossRef | Google Académico
7. Mitchell, CW. El diagnóstico por imágenes de la tromboembolia pulmonar. ¿Puede Vet J. (2009) 50:199–202.
8. Pelchat, J, Chalhoub, S, y Boysen, SR. El uso de ultrasonido veterinario en el punto de atención por parte de los veterinarios: una encuesta canadiense a nivel nacional. ¿Puede Vet J. (2020) 61:1278–82.
9. Lisciandro, GR, Puchot, ML, Gambino, JM, y Lisciandro, SC. El signo de cuña: un posible signo ecográfico pulmonar para tromboembolismo pulmonar. J Vet Emerg Crit Care. (2022) 32:663–9. doi: 10.1111/vec.13208
10. Buda, N, Kosiak, W, Wełnicki, M, Skoczylas, A, Olszewski, R, Piotrkowski, J, et al. Recomendaciones para la ecografía pulmonar en medicina interna. Diagnóstico. (2020) 10:597. doi: 10.3390/diagnostics10080597
11. Buchanan, JW, y Bucheler, J. Sistema de escala vertebral para medir el tamaño del corazón canino en radiografías. J Am Vet Med Assoc. (1995) 206:194–9.
12. Reinero, C, Visser, LC, Kellihan, HB, Masseau, I, Rozanski, E, Clercx, C, et al. Directrices de declaración de consenso de ACVIM para el diagnóstico, clasificación, tratamiento y seguimiento de la hipertensión pulmonar en perros. J Veterinario Pasante Med. (2020) 34:549–73. doi: 10.1111/jvim.15725
Resumen de PubMed | Texto completo de CrossRef | Google Académico
13. Visser, LC, Im, MK, Johnson, LR y Stern, JA. Valor diagnóstico del índice de distensibilidad de la arteria pulmonar derecha en perros con hipertensión pulmonar: comparación con estimaciones ecocardiográficas Doppler de la presión arterial pulmonar. J Veterinario Pasante Med. (2016) 30:543–52. doi: 10.1111/jvim.13911
Resumen de PubMed | Texto completo de CrossRef | Google Académico
14. Vezzosi, T, Domenech, O, Iacona, M, Marchesotti, F, Zini, E, Venco, L, et al. Evaluación ecocardiográfica del índice del área auricular derecha en perros con hipertensión pulmonar. J Veterinario Pasante Med. (2018) 32:42–7. doi: 10.1111/jvim.15035
Resumen de PubMed | Texto completo de CrossRef | Google Académico
15. Vezzosi, T, Domenech, O, Costa, G, Marchesotti, F, Venco, L, Zini, E, et al. Evaluación ecocardiográfica de la dimensión del ventrículo derecho y de la función sistólica en perros con hipertensión pulmonar. J Veterinario Pasante Med. (2018) 32:1541–8. doi: 10.1111/jvim.15253
Resumen de PubMed | Texto completo de CrossRef | Google Académico
16. Feldhütter, EK, Domenech, O, Vezzosi, T, Tognetti, R, Eberhard, J, Friederich, J, et al. Tamaño y función del ventrículo derecho evaluados por diversos índices ecocardiográficos en perros con hipertensión pulmonar. J Veterinario Pasante Med. (2022) 36:1882–91. doi: 10.1111/jvim.16496
Resumen de PubMed | Texto completo de CrossRef | Google Académico
17. Schober, KE, y Baade, H. Predicción ecocardiográfica Doppler de la hipertensión pulmonar en terriers blancos de West Highland con enfermedad pulmonar crónica. J Veterinario Pasante Med. (2006) 20:912–20. doi: 10.1111/j.1939-1676.2006.tb01805.x
Resumen de PubMed | Texto completo de CrossRef | Google Académico
18. Mazur, ES, Mazur, VV, Rabinovich, RM, y Myasnikov, KS. Distensión longitudinal del ventrículo derecho en embolia pulmonar aguda e infarto de miocardio del ventrículo derecho en pacientes con signo de McConnell. Kardiologiia. (2020) 60:20–7. doi: 10.18087/cardio.2020.7.n1151
Resumen de PubMed | Texto completo de CrossRef | Google Académico
19. McConnell, MV, Solomon, SD, Rayan, ME, Come, PC, Goldhaber, SZ y Lee, RT. Disfunción ventricular derecha regional detectada por ecocardiografía en embolia pulmonar aguda. Am J Cardiol. (1996) 78:469–73. doi: 10.1016/S0002-9149(96)00339-6
Resumen de PubMed | Texto completo de CrossRef | Google Académico
20. Kameda, T, Kamiyama, N, y Taniguchi, N. Los mecanismos subyacentes a los artefactos verticales en la ecografía pulmonar y su utilización adecuada para la evaluación del edema pulmonar cardiogénico. Diagnóstico. (2022) 12:252. doi: 10.3390/diagnostics12020252
21. Schmickl, CN, Menon, AA, Dhokarh, R, Seth, B y Schembri, F. Optimización de las líneas B en la ecografía pulmonar: un estudio piloto in vitro a in vivo con implicaciones clínicas. J Clin Monit Comput. (2020) 34:277–84. doi: 10.1007/s10877-019-00321-z
Resumen de PubMed | Texto completo de CrossRef | Google Académico
22. KGM, K. USG płuc małych zwierzat w praktyce: atlas przypadków. 1ª ed. West Palm Beach, Florida: EDRA Urban & Partner (2023).
23. Demi, L, Wolfram, F, Klersy, C, de Silvestri, A, Ferretti, VV, Muller, M, et al. Nuevas guías internacionales y consenso sobre el uso de la ecografía pulmonar. J Ultrasonido Med. (2023) 42:309–44. doi: 10.1002/jum.16088
Resumen de PubMed | Texto completo de CrossRef | Google Académico
24. Dietrich, CF, Buda, N, Ciuca, IM, Dong, Y, Fang, C, Feldkamp, A, et al. Ultrasonido pulmonar en niños, artículo de revisión de WFUMB (parte 2). Ultrasonido médico. (2021) 23:443–52. doi: 10.11152/mu-3059
Resumen de PubMed | Texto completo de CrossRef | Google Académico
25. Buda, N, y Kosiak, W. ¿Es útil una sonda lineal en el diagnóstico de enfermedades de los espacios intersticiales pulmonares? J Ultrason. (2017) 17:136–41. doi: 10.15557/JoU.2017.0021
Resumen de PubMed | Texto completo de CrossRef | Google Académico
26. Demi, M, Buda, N y Soldati, G. Artefactos verticales en la ecografía pulmonar: algunas preguntas comunes de los médicos y las respuestas relacionadas con el ingeniero. Diagnóstico. (2022) 12:245. doi: 10.3390/diagnostics12010215
27. Linta, N, Barón Toaldo, M, Bettini, G, Cordella, A, Quinci, M, Pey, P, et al. Viabilidad de la ecografía con contraste (CEUS) en el diagnóstico de trastornos torácicos no cardíacos de perros y gatos. BMC Vet Res. (2017) 13:141. doi: 10.1186/s12917-017-1061-0
28. Copetti, R, Soldati, G, y Copetti, P. Ecografía de tórax: una herramienta útil para diferenciar el edema pulmonar cardiogénico agudo del síndrome de dificultad respiratoria aguda. Ecografía cardiovasca. (2008) 6:16. doi: 10.1186/1476-7120-6-16
Resumen de PubMed | Texto completo de CrossRef | Google Académico
29. Yang, VK, Cunningham, SM, Rush, JE, y de Laforcade, A. El uso de rivaroxabán para el tratamiento de complicaciones trombóticas en cuatro perros. J Vet Emerg Crit Care. (2016) 26:729–36. doi: 10.1111/vec.12466
Resumen de PubMed | Texto completo de CrossRef | Google Académico
30. Suzuki, R, Yuchi, Y, Saito, T, Yasumura, Y, Teshima, T, Matsumoto, H, et al. Beraprost sódico para la hipertensión pulmonar en perros: efecto sobre la hemodinámica y la función cardíaca. Animales. (2022) 12:2078. doi: 10.3390/ani12162078
31. Murphy, LA, Russell, N, Bianco, D, y Nakamura, RK. Evaluación retrospectiva del tratamiento con pimobendan y sildenafil para la hipertensión pulmonar grave debida a enfermedad pulmonar e hipoxia en 28 perros (2007-2013). Vet Med Sci. (2017) 3:99–106. doi: 10.1002/vms3.60
Resumen de PubMed | Texto completo de CrossRef | Google Académico
32. Fuso, L, Baldi, F, y Di Perna, A. Estrategias terapéuticas en la hipertensión pulmonar. Frente Pharmacol. (2011) 2:21. doi: 10.3389/fphar.2011.00021
33. Corda, A, Carta, S, Varcasia, A, Tamponi, C, Evangelisti, MA, Scala, A, et al. Respuesta arterial pulmonar a angiostrongylus vasorum en perros infectados de forma natural: hallazgos ecocardiográficos en dos casos. Vectores parásitos. (2019) 12:286. doi: 10.1186/s13071-019-3544-2
Resumen de PubMed | Texto completo de CrossRef | Google Académico
34. Venco, L, Colaneri, G, Formaggini, L, De Franco, M, y Rishniw, M. Utilidad de la ecografía torácica en un diagnóstico rápido de angiostrongilosis en perros jóvenes que presentan dificultad respiratoria. Veterinario J. (2021) 271:105649. doi: 10.1016/j.tvjl.2021.105649
Resumen de PubMed | Texto completo de CrossRef | Google Académico
36. Squizzato, A, Rancan, E, Dentali, F, Bonzini, M, Guasti, L, Steidl, L, et al. Precisión diagnóstica de la ecografía pulmonar para la embolia pulmonar: una revisión sistemática y metanálisis. J Trombo hemostático. (2013) 11:1269–78. doi: 10.1111/jth.12232
Resumen de PubMed | Texto completo de CrossRef | Google Académico
37. Yang, PC. Ecografía Doppler color de consolidación pulmonar. Eur J Ecografía. (1996) 3:169–78. doi: 10.1016/0929-8266(96)00146-2
38. Fernandes Rodrigues, N, Giraud, L, Bolen, G, Fastrès, A, Clercx, C, Boysen, S, et al. Comparación de la ecografía pulmonar, las radiografías de tórax, la proteína C reactiva y los hallazgos clínicos en perros tratados por neumonía por aspiración. J Veterinario Pasante Med. (2022) 36:743–52. doi: 10.1111/jvim.16379
Resumen de PubMed | Texto completo de CrossRef | Google Académico
39. Bourque, AC, Conboy, G, Miller, LM y Whitney, H. Hallazgos patológicos en perros naturalmente infectados con Angiostrongylus vasorum en Terranova y Labrador, Canadá. J Vet Diagn Invest. (2008) 20:11–20. doi: 10.1177/104063870802000103
Resumen de PubMed | Texto completo de CrossRef | Google Académico
40. Corsini, I, Parri, N, Ficial, B, y Dani, C. Ecografía pulmonar en la unidad de cuidados intensivos neonatales: revisión de la literatura y perspectivas futuras. Pediatr Pulmonol. (2020) 55:1550–62. doi: 10.1002/ppul.24792
Resumen de PubMed | Texto completo de CrossRef | Google Académico
Palabras clave: perro, ecografía pulmonar (LUS), enfermedad tromboembólica, consolidación, Doppler color
Cita: Kraszewska K, Gajewski M y Boysen SR (2023) Caso clínico: Aplicación de la ecografía Doppler color para la evaluación de las consolidaciones pulmonares en un perro. Frente. Vet. Sci. 10:1275929. doi: 10.3389/fvets.2023.1275929
Recibido: 29 de agosto de 2023; Aceptado: 09 de noviembre de 2023;
Publicado: 08 Diciembre 2023.
Editado por:
Sibylle Maria Kneissl, Universidad de Medicina Veterinaria de Viena, Austria
Revisado por:
Laura Cole, Royal Veterinary College (RVC), Reino Unido
Jessica Ward, Universidad Estatal de Iowa, Estados Unidos
Derechos de autor © 2023 Kraszewska, Gajewski y Boysen. Este es un artículo de acceso abierto distribuido bajo los términos de la Licencia Creative Commons Attribution License (CC BY).
*Correspondencia: Katarzyna Kraszewska, pavc.info@gmail.com
Renuncia: Todas las afirmaciones expresadas en este artículo son únicamente las de los autores y no representan necesariamente las de sus organizaciones afiliadas, ni las del editor, los editores y los revisores. Cualquier producto que pueda ser evaluado en este artículo o afirmación que pueda hacer su fabricante no está garantizado ni respaldado por el editor.
Date de alta y recibe nuestro 👉🏼 Diario Digital AXÓN INFORMAVET ONE HEALTH
Date de alta y recibe nuestro 👉🏼 Boletín Digital de Foro Agro Ganadero
Noticias animales de compañía
Noticias animales de producción
Trabajos técnicos animales de producción
Trabajos técnicos animales de compañía