Avances en la tecnología de organoides para el modelado de enfermedades veterinarias
Avances en la tecnología de organoides para el modelado de enfermedades veterinarias
 Bo Chen
Bo Chen  Ronald Francis Slocombe
Ronald Francis Slocombe  Smitha Rose Georgy*
Smitha Rose Georgy*- Sección de Anatomía Patológica, Facultad de Veterinaria de Melbourne, Facultad de Ciencias, Universidad de Melbourne, Werribee, VIC, Australia
Los organoides son estructuras similares a órganos in vitro que recapitulan fielmente muchas características de un órgano específico. Durante las últimas décadas, se han logrado importantes avances en el establecimiento de sistemas de cultivo tridimensionales (3D) para obtener organoides derivados de células madre. Como un avance tecnológico significativo, estas asombrosas construcciones de organoides en 3D unen los modelos in vitro 2D convencionales y los modelos animales in vivo y brindan una oportunidad sin precedentes para investigar las complejidades de las enfermedades veterinarias que van desde su patogénesis hasta la prevención, la terapia o incluso las futuras estrategias de reemplazo de órganos. En esta revisión, discutimos brevemente varias definiciones utilizadas en la investigación de organoides y destacamos los logros actualmente conocidos en el modelado de enfermedades veterinarias, incluidas las enfermedades infecciosas e inflamatorias, los cánceres y las enfermedades metabólicas. Las aplicaciones de la tecnología de organoides en el modelado de enfermedades veterinarias aún se encuentran en su etapa inicial, pero el futuro es prometedor.
1. Introducción
La transición de los modelos in vitro del cultivo celular monocapa tradicional a un sistema tridimensional (3D) representa sin duda la innovación más crítica de la última década para los estudios in vitro. Uno de los avances más significativos en los modelos 3D es la generación de organoides o ‘mini órganos en un plato’ como tecnología de vanguardia (1). En los últimos años, hay un número creciente de publicaciones de investigación en las que se aplica el modelo organoide para estudiar enfermedades de importancia veterinaria, pero en comparación con la investigación médica, su potencial aún no está completamente explorado para la medicina veterinaria.
El primer uso del término «organoide», que significa «parecido a un órgano», fue en 1946 cuando los autores describieron un teratoma quístico (2). Los teratomas se desarrollan a partir de células madre pluripotentes (PSC) de la línea germinal y organizan una variedad de estructuras organotípicas específicas, como la piel, el nervio, el intestino, el hueso y el diente, debido a los procesos de recapitulación de la segregación celular y la especificación del destino. Ahora bien, el término «organoide» es generalmente aceptado para significar una agregación 3D de tipos celulares específicos de órganos. Al igual que los teratomas, los organoides se desarrollan a partir de células madre o progenitores de órganos (por ejemplo, criptas intestinales) y se autoorganizan a través de dos procesos de recapitulación de la segregación celular y la especificación del destino, como el desarrollo y el crecimiento in vivo (1). La autoorganización es esencial en los organoides para distinguirlo de las culturas bidimensionales.
Los pasos significativos para generar un organoide son la proliferación inicial de células madre y precursoras en un ambiente adecuado. La derivación a partir de células madre es una característica crítica en la definición de un organoide y diferencia los organoides de los explantes de tejidos, que se derivan de un cultivo organotípico de células o pequeños segmentos de tejido (3). Las células madre incluían células madre embrionarias (ESC), células madre pluripotentes inducidas (iPSC) o células madre adultas (ASC) específicas de órganos (4). Las ESC se derivan de embriones en etapa temprana. Las células madre pluripotentes inducidas (iPSC) son un tipo de células madre que se reprograman genéticamente a partir de células somáticas adultas y exhiben muchas similitudes con las ESC en muchas propiedades (4). En principio, las ASC se obtienen a partir de tejidos «maduros» o adultos, pero no proceden necesariamente de animales adultos, sino que pueden proceder de juveniles o incluso de embriones avanzados (1, 5). Las células madre cancerosas (CSC) también pueden considerarse un tipo de ASC y son capaces de producir tumores 3D en entornos apropiados (6). Los organoides derivados de ASC están intrínsecamente programados con sus funciones específicas de ubicación (7), lo que los hace más «parecidos a los adultos» que los organoides derivados de ESC, que retienen células mesenquimales asociadas a tejidos (Figura 1).
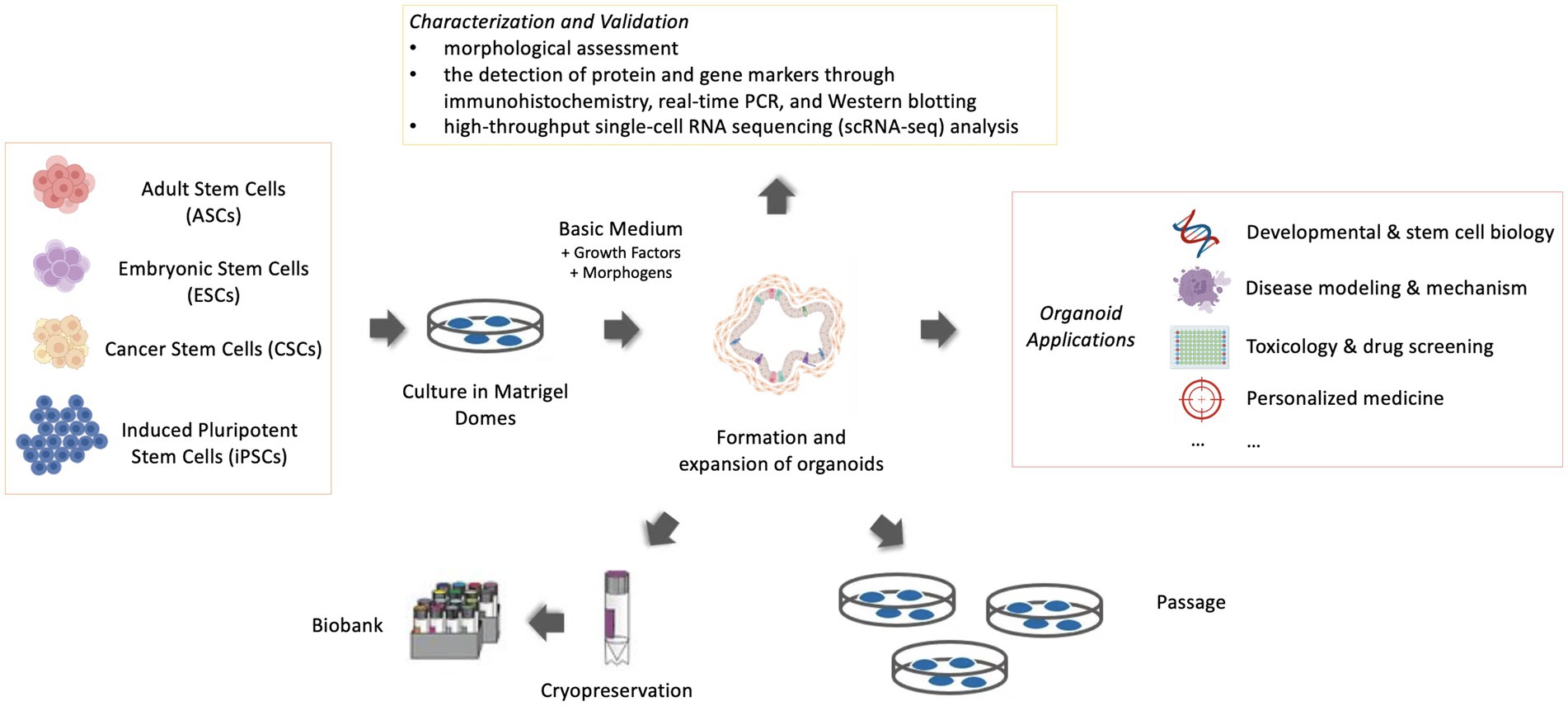 Figura 1. Representación esquemática del cultivo, mantenimiento y aplicación de organoides (Creado con BioRender.com).
Figura 1. Representación esquemática del cultivo, mantenimiento y aplicación de organoides (Creado con BioRender.com).
Los métodos de cultivo celular tridimensional (3D) representan cualquier cultivo de células que recapitula su organización 3D y/o las interacciones célula-célula y célula-matriz in vitro (8). Los cultivos celulares 3D de más tipos celulares a menudo se denominan cocultivo (9). Cuando a las células madre se les suministran las condiciones de cultivo adecuadas y el andamiaje para promover su crecimiento y supervivencia, pueden generar modelos de órganos en miniatura conocidos como organoides o esferoides que imitan los tipos, la estructura y las funciones de las células (10, 11). El uso de los términos «organoide» y «esferoide» puede variar o superponerse en diferentes trabajos publicados. Algunos trabajos, especialmente en la etapa inicial de la investigación de organoides, prefieren usar el término «organoides» para indicar ambos, o consideran «esferoide» como un tipo simple, primitivo o intermedio de «organoide» (11). Otras opiniones tienen una definición más rígida de que los esferoides a menudo se denominan agregados de células simples sin andamios con un origen de una sola célula (12, 13). En este caso, se propuso una definición más explícita de «organoide» basada en tres requisitos esenciales que deben cumplirse: primero, un organoide debe contener más de un tipo de célula del órgano que modela; en segundo lugar, debe recapitular algunas de las funciones específicas de ese órgano; y tercero, las células deben tener una organización espacial similar a la del órgano (1). Dado que los organoides representan un orden superior de complejidad y recapitulan su órgano progenitor más estrechamente que los esferoides, los investigadores se inclinan más por la tecnología de organoides para el modelado de enfermedades y la optimización del descubrimiento de fármacos y la medicina personalizada (14). Alternativamente, en la investigación del cáncer, se prefieren los esferoides que se pueden generar a partir de líneas celulares cancerosas o fragmentos tumorales, porque aún imitan de cerca las características principales de las estructuras y funciones de los tumores sólidos como grupos simples de agregados de células madre cancerosas que flotan libremente (15).
También han surgido ambigüedades en la nomenclatura de organoides gastrointestinales, al mencionar «enteroides», «colonoides» y «organoides intestinales». Generalmente, los «enteroides» son un tipo de organoide que se obtiene de criptas intestinales aisladas o células madre del intestino (16). Las contrapartes colónicas se denominan «colonoides». Los organoides intestinales deben incluir enteroides y colonoides literalmente y algunos autores también usan el término «organoides intestinales» y «enteroides» como sinónimos sin la subdivisión de «colonoides». En algunos grupos de investigación, los «organoides» se refieren a los cultivos que contienen componentes epiteliales y mesenquimales, mientras que el término «enteroides» se ha sugerido para estructuras 3D que contienen solo células epiteliales (17). Además, a veces los «organoides intestinales» se denominan especialmente estructuras 3D que se originan a partir de células madre pluripotentes inducibles (16). En esta revisión, el término «organoides» significa cualquiera de estos sistemas 3D complejos y multicelulares, los grupos o agregados iniciados por células madre o células tumorales. Hay varios otros términos que se utilizan exclusivamente en la investigación de organoides, algunos de los cuales también se utilizan en esta revisión. Los «ensambladores» son organoides generados a partir de la fusión espacial y la integración funcional de múltiples tipos de células (18). «Tumoroides» significa «organoides similares a tumores» (19). Las «mamósferas» se refieren a los agregados de células madre epiteliales mamarias, pero también son aceptables para indicar los agregados derivados de nichos de células de cáncer de mama o líneas celulares de cáncer de mama (20). Por lo tanto, sugerimos que las definiciones de los términos ambiguos utilizados en los trabajos de organoides deben definirse en contexto para evitar malentendidos.
Una vez que las estructuras 3D se ensamblan in vitro con una arquitectura altamente ordenada, pueden funcionar como modelos poderosos para la investigación de enfermedades. Las aplicaciones generalizadas de los modelos de organoides murinos y humanos han acelerado el desarrollo de diversas áreas de la medicina humana, como la biología del desarrollo y de las células madre, el modelado de enfermedades y la exploración de mecanismos, la toxicología y el cribado de fármacos, y la medicina personalizada (21-23) (Figura 1). En los últimos años, un mayor número de modelos de organoides se diseñaron específicamente para ser investigados en medicina veterinaria. Tras el establecimiento de los organoides, los investigadores veterinarios se beneficiaron enormemente de las aplicaciones existentes y emergentes de los sistemas organoides, ya que los sistemas organoides tenían un mayor valor experimental y sus características 3D contribuían a una comprensión más profunda de la organogénesis y la morfogénesis que los cultivos 2D convencionales. En comparación con los modelos in vivo, es más barato y fácil de mantener y manipular, y una alternativa más ética (24). En contraste con el énfasis predominante en los modelos de enfermedad de cáncer y enfermedades crónicas en la medicina humana, la investigación veterinaria pone mayor énfasis en las enfermedades infecciosas y los trastornos nutricionales. Por lo tanto, los organoides demuestran su eficacia única porque se pueden adaptar a partir de especies y tejidos específicos para investigar enfermedades de importancia veterinaria, dada la gran diversidad de especies animales. Cierta información crítica es necesaria antes de iniciar cualquier cultivo de organoides. Las consideraciones esenciales son elegir el órgano o las células apropiadas (trozos de tejido, iPSC o ESC) y el protocolo de cultivo adecuado, la matriz extracelular, los factores de crecimiento y los morfógenos [moléculas de señalización que actúan en el patrón de las células durante el desarrollo embrionario] (25)]. La adquisición de un conocimiento profundo de estas consideraciones, junto con un avance en los protocolos de cultivo de organoides, debería crear una mayor aplicabilidad de estos modelos 3D en diversos campos. Sin embargo, en esta revisión, debido a las limitaciones de espacio, el contexto hace hincapié principalmente en las aplicaciones para las enfermedades veterinarias y proporciona un marco para las aplicaciones emergentes de los modelos de organoides, en particular para las enfermedades veterinarias (Tabla 1). En esta revisión, destacamos los logros y proyectos actualmente conocidos de modelización de enfermedades llevados a cabo en la búsqueda del bienestar del ganado y los animales de compañía.
2. Modelos de organoides para enfermedades infecciosas veterinarias
Las enfermedades infecciosas veterinarias son un mundo intrincado en el que los patógenos de los animales domésticos pueden provocar sufrimiento o la muerte, pérdidas económicas masivas, uso excesivo o abuso de antibióticos en el control de enfermedades, o causar enfermedades zoonóticas en los seres humanos (53). Las enfermedades infecciosas son el resultado de una interacción bidireccional que ocurre entre los huéspedes y los microorganismos. La invasión de microbios se lleva a cabo mediante una serie de pasos cronológicos, que suelen incluir el acceso a un portal de entrada a sus huéspedes, el reconocimiento de las células diana en el sistema de barrera, la colonización o ruptura del sistema de barrera, la colonización de nuevas poblaciones de células diana (como los leucocitos y las células endoteliales), la invasión, la diseminación sistémica o la invasión de un sistema de órganos específico. y, finalmente, conduce a una disfunción sistémica que se manifiesta como enfermedad (54). La capacidad de los microbios para causar enfermedades (su patogenicidad) está dominada por sus «factores de virulencia» transportados por sus genes, que son las consecuencias de las adaptaciones evolutivas a los factores de resistencia expresados por los huéspedes y crea una diversidad espectacular de interacciones potenciales. Por lo general, los brotes de enfermedades infecciosas en los rebaños ocurren solo cuando varios elementos están presentes juntos. De acuerdo con el modelo de «cadena de infección», toda infección se origina a partir de la interacción entre el huésped, el patógeno y el medio ambiente, depende del reservorio, el portal de entrada y salida, los medios de transmisión y termina con la infección de un nuevo huésped (55). La complejidad de cada enfermedad infecciosa plantea una plétora de desafíos específicos de patógenos y especies para comprender la patogénesis y desarrollar estrategias de prevención y control.
En el pasado, los modelos animales in vivo o el cultivo celular monocapa in vitro se aplicaban ampliamente para los estudios de biología de patógenos y desarrollo de fármacos (24). Como era de esperar, ambos métodos tienen limitaciones obvias. Los modelos animales in vivo tienen la diversidad estructural que mantiene las actividades fisiológicas de los animales, pero son caros y pueden plantear dilemas éticos. Por el contrario, el cultivo celular monocapa in vitro es fácil de manipular, pero carece de la estructura espacial o microambiente del tejido. En comparación con los cultivos celulares 2D convencionales y los modelos animales, la tecnología de organoides es una herramienta más flexible y duradera para modelar infecciones para estudiar las interacciones entre microbios y huéspedes, lo que se explica por las características de proporcionar una mejor diferenciación y diversidad celular con la presencia de microambientes intercelulares. Por ejemplo, los enteroides de diferentes segmentos intestinales aún conservan características específicas y muestran diferentes grados de adaptación a las infecciones (28), a pesar de que todas las células están expuestas al mismo ambiente extracelular. Los avances en la técnica de organoides han impulsado el progreso en la comprensión de las enfermedades infecciosas o las interacciones entre el huésped y el microbioma y presentan nuevas oportunidades para el descubrimiento o desarrollo de nuevos fármacos para prevenir y controlar las enfermedades infecciosas.
Hasta la fecha y hasta donde sabemos, la tecnología de organoides ha modelado 12 enfermedades infecciosas veterinarias, incluidas las infecciones causadas por virus [virus de la encefalitis de la artritis caprina (26), coronavirus pulmonar y entérico porcino (27-30), coronavirus felino (56) y calicivirus de conejo (36)], rotavirus bovino (rotavirus del grupo A) (32), bacterias (Lawsonia intracellularis (33), Salmonella typhimurium (34) y E. coli enterotoxigénica (35)), y un parásito [Toxoplasma gondii (34)]. En la Tabla 1 se presenta información detallada sobre modelos de organoides para enfermedades infecciosas específicas.
El primer modelo de organoide para enfermedades infecciosas se reportó ya en 2005 (26). Los organoides mamarios de cabra se establecieron a partir de células individuales de la glándula mamaria y se trataron con suspensión viral en sobrenadante cultural como un enfoque para la infección por el virus de la encefalitis de la artritis caprina (CAEV) modelo. El CAEV es un lentivirus de la familia Retroviridae y causa artritis, encefalitis y/o neumonía en cabras adultas (57). El modelo 3D de la glándula mamaria de cabra era una estructura lobulada similar a la mamósfera o acinus que consistía en células epiteliales luminales y células mioepiteliales periféricas limitadas por una capa externa de membrana basal, con respuestas a hormonas y factores de crecimiento, que imitaban así la estructura y función de la glándula mamaria. El autor complicó el modelo importando leucocitos de sangre periférica porque el sistema monocitos-macrófagos desempeña un papel fundamental en la propagación sistémica de CAEV. Sin embargo, la ubicación y la cantidad del antígeno no se identificaron específicamente, ya que podría haber diferentes niveles de infección entre el epitelio y los leucocitos. Es un diseño inteligente para los estudios de enfermedades infecciosas veterinarias al enriquecer la complejidad de los organoides del ganado a través del cocultivo de organoides epiteliales y células inmunitarias (26).
La pandemia de la enfermedad por coronavirus 2019 (COVID-19) ha tenido un impacto social generalizado y desastroso en la humanidad. Del mismo modo, los coronavirus en medicina veterinaria también causan graves pérdidas económicas en los animales de granja y morbilidad en los animales de compañía. El coronavirus respiratorio porcino (PRCoV), un mutante natural de deleción de espícula del virus de la gastroenteritis transmisible altamente enteropatógeno (TGEV), podría ser un sustituto para estudiar la patogénesis de los coronavirus respiratorios humanos. Se generaron organoides (AO) de las vías respiratorias porcinas porcinas a largo plazo derivados de células epiteliales basales y cultivos monocapa derivados de AO que proporcionaron información sobre la patogénesis y la inmunidad innata de PRCoV (3). En estos modelos, las AO 27D consisten en cuatro tipos principales de células epiteliales de las vías respiratorias identificadas mediante inmunotinción, incluidas las células ciliadas, las células caliciformes, las células basales y las células club. Especialmente, las células ciliadas, las células caliciformes y las células club se distribuyeron principalmente en la superficie de las «esferas de tráqueas». Las células ciliadas también tenían dos orientaciones hacia el lumen o invertidas desde él. Los cultivos monocapa derivados de AO a partir de AO 3D compensan las limitaciones de los AO 3D para acceder a la superficie apical en busca de patógenos. Los cultivos monocapa derivados de AO también expresaron marcadores de células ciliadas, células caliciformes y células basales, incluso con más diferenciación. Ambos sistemas de AOs recapitularon la celularidad epitelial del complejo de la vía aérea in vivo. Los AO 3D y los cultivos monocapa derivados de AO son susceptibles tanto a PRCoV como a TGEV a pesar del grado variable de permisividad y pueden producir una respuesta inflamatoria y de IFN pronunciada a la infección viral, lo que refleja bien los eventos asociados con la infección por PRCoV in vivo.
Publicaciones recientes sobre aplicaciones de organoides en enfermedades infecciosas veterinarias han mostrado un enfoque en las enfermedades gastrointestinales desde 2019. Desde la primera generación de organoides intestinales de ratones en 2009, los organoides intestinales de las criptas intestinales de los seres humanos y de casi todas las categorías de animales de granja y de compañía (incluidos el cerdo, el buey, la oveja, el caballo, el pollo, el perro, el gato y el conejo) han sido desarrollados por grupos de investigación en crecimiento (10, 58). La diversidad celular de las superficies intestinales ofrece los objetivos principales de muchos patógenos enteropatógenos, y el intestino puede ser un sitio objetivo de adhesión, invasión y replicación de muchos patógenos veterinarios que median cambios patológicos entéricos significativos y signos clínicos (59). Los organoides intestinales que contienen estos linajes diferenciados de tipos celulares, incluidos los enterocitos, las células caliciformes, las células de Paneth, las células enteroendocrinas y/o las células madre/progenitoras, y la recapitulación de la extrema heterogeneidad celular y los microambientes intercelulares, permiten una mejor comprensión de varios aspectos de los procesos infecciosos, como la adhesión, la colonización, la toxigénesis, la invasividad y los mecanismos de defensa locales.
Además de la especificidad de la especie debido al tropismo de los diferentes patógenos, las muestras para generar el modelo organoide se obtuvieron en su mayoría también de animales de las edades más susceptibles y de los segmentos intestinales más susceptibles para capturar las características clásicas de la enfermedad. Por ejemplo, los modelos infecciosos de diarrea epidémica porcina (PED) o enfermedad por rotavirus bovino se informan principalmente en animales recién nacidos, por lo que los científicos utilizaron lechones libres de patógenos específicos (SPF) de 2 a 10 días de edad y terneros neonatos privados de calostro, respectivamente. El íleon se utilizó para generar organoides en el modelado de la infección por Lawsonia intracellularis debido a que L. intracellularis se distribuye principalmente en esa localización anatómica (33). Todos los enteroides se derivan de las criptas intestinales, que incluyen un grupo de células madre adultas multipotentes llamadas células columnares de la base de la cripta. Una de las distinciones interesantes es el paso inicial para los tratamientos de las criptas. La mayoría de los métodos de estudio aislarían el tejido de la cripta o las fracciones con la mayor proporción de criptas a vellosidades para iniciar cultivos enteroides tridimensionales en lugar de una sola suspensión de células madre. Los enteroides derivados de tejidos también podrían contener células de Paneth entremezcladas y estructuras de soporte como una matriz extracelular. Una limitación en la mayoría de estos estudios es que no se indicó el número de animales utilizados para obtener organoides y, por lo tanto, no se tiene en cuenta la variación del donante individual en el desarrollo del modelo. Además, en el modelado de la infección por L. intracellularis, solo se utilizó un segmento de íleon de un cerdo de 90 kg para el cultivo de organoides. Las derivaciones de un solo animal muestran la ventaja de los organoides en la reducción del uso de animales, pero es relevante citar el tamaño de la muestra, o la derivación de tejidos de múltiples animales para saber más sobre cómo las variaciones individuales afectan a las generaciones de organoides y la repetibilidad de cada protocolo.
La célula epitelial intestinal está altamente organizada con la polaridad de distintos dominios de la membrana plasmática apical y basolateral, lo cual es crítico para la formación de barreras y el transporte de nutrientes (60). Generalmente, los organoides intestinales están enterrados en un andamio que contiene matriz extracelular, lo que generalmente resulta en un epitelio polarizado con un lado apical hacia el interior de los organoides (modelo basal-out). A diferencia de algunos patógenos, la mayoría de los patógenos entéricos se adhieren e invaden a través del lado apical de las células mucosas, aunque hay excepciones, por ejemplo, Listeria monocytogenes, que invade exclusivamente al huésped a través de receptores en el lado basal de las células epiteliales intestinales, incluso cuando las bacterias están en la superficie de la mucosa intestinal (61). El sistema de organoides basales limita el acceso que inicia el reconocimiento y ataque de los patógenos. Por ejemplo, se registra que los organoides basales no fueron susceptibles a la infección por TGEV (30). Para resolver este problema, existen varios enfoques. En primer lugar, los patógenos pueden importarse a la luz del modelo enteroide basal-out mediante microinyección (55). Sin embargo, la microinyección plantea umbrales técnicos y de equipo, también es laboriosa y tiene el potencial de dañar la estructura del enteroide. Probablemente es por eso que este método rara vez se adoptó en el modelado de enfermedades infecciosas veterinarias. Para exponer la superficie apical, los organoides pueden romperse (enzimática o mecánicamente) en trozos más pequeños y co-incubarse con patógenos, como en el caso del modelado organoide de la infección por coronavirus felino, rotavirus bovino, Toxoplasma gondii y Salmonella typhimurium (32, 34, 56). Este enfoque provoca la pérdida de polaridad del epitelio y la devaluación de los modelos organoides in vitro. Aun así, los enteroides interrumpidos se volverán a ensamblar posteriormente en estructuras basales 3D nuevamente. Otro enfoque popular es disociar organoides y generar un sistema de cultivo monocapa derivado de organoides con el lado apical hacia arriba (62). Este enfoque se adoptó en los modelos organoides de coronavirus porcinos, calicivirus de conejo e infecciones por L. intracellularis (28-30, 33, 36). Entre ellos, los enteroides se sembraron en membranas transpocillas después de ser interrumpidos mecánicamente y expuestos apicalmente a L. intracellularis (33). En esta situación, las células forman una barrera que imita la superficie mucosa de los intestinos. La polaridad de los organoides intestinales también se puede invertir en el cultivo en suspensión para que la membrana apical se mantenga hacia afuera. Este modelo permite un acceso más fácil a la superficie apical para los patógenos y aumenta la superficie expuesta disponible sin impedir los estados proliferativos de los enteroides. Se desarrolló con éxito un modelo pionero de un modelo de organoide apical que se asemeja mejor a las características fisiológicas normales, caracterizadas por una membrana apical en la superficie, para la infección por TGEV. Este abordaje de la infección facilita el estudio de la infección por virus entérico porcino y el organoide se considera un enteroide porcino de nueva generación (30).
Los modelos organoides pueden dilucidar la respuesta celular a la infección, previamente limitada por la ausencia de modelos intestinales in vitro robustos. Los CoV enteropatógenos porcinos (28-30), el virus de la peritonitis infecciosa felina (FIPV) (31), el virus de la enfermedad hemorrágica del conejo (RHDV) (36, 37) y L. intracellularis (33) tienen problemas similares de propagación viral deficiente o infecciones bacterianas en modelos 2D convencionales. Antes de los organoides, las células epiteliales transformadas y no transformadas específicas de la especie disponibles tenían inconvenientes obvios, como una propagación viral deficiente, la falta de heterogeneidad celular o la presencia de anomalías genómicas (28, 63). Los explantes intestinales o cultivos celulares primarios de células epiteliales intestinales recapitulan las características críticas del órgano in vivo, pero no son adecuados para el cultivo a largo plazo debido a su limitada viabilidad (24-48 h) (63, 64). Afortunadamente, los modelos infecciosos basados en organoides específicos de la especie han mejorado estas situaciones. Se han generado enteroides porcinos para CoV enteropatógenos porcinos, incluido el virus de la diarrea epidémica porcina (PEDV) (28), el deltacoronavirus porcino (PDCoV) (29) y el virus de la gastroenteritis transmisible (TGEV) (30), y se han demostrado mejores modelos in vitro para estudios más profundos. La peritonitis infecciosa felina (PIF) está causada por la mutación de FeCoV, virus de la peritonitis infecciosa felina (FIPV) (31), con dos serotipos de FCoV (basados en la antigenicidad), tipos I y II. Si bien ambos tipos pueden causar peritonitis infecciosa felina (PIF), el tipo I es más común en las poblaciones felinas domésticas. Los serotipos difieren principalmente en las características de crecimiento en cultivos celulares y en el uso de receptores, y la mayor parte del trabajo experimental hasta ahora se ha realizado en las cepas de Tipo II porque las cepas de Tipo I son difíciles de cultivar bien en cultivo celular. En 2020 se publicó una comunicación basada en el modelo de organoide intestinal felino, FECV de serotipo I recombinante que expresa GFP, que no crece en cultivo celular monocapa disponible, puede adaptarse a organoides de colon felino y se propaga de forma persistente. Aunque este patógeno no puede adaptarse a los enteroides del íleon felino, este resultado representa una nueva vía in vitro que tiene el potencial de estudiar el mecanismo de la infección por FECV del serotipo I, la transición de la FIPV y el desarrollo de la enfermedad in vitro (56). El virus de la enfermedad hemorrágica del conejo (VHDH) es un calicivirus hepatotrópico y se ha planteado la hipótesis de que evolucionó a partir de un calicivirus enterotrópico benigno (65). Calicivirus de conejo Australia-1, un lagovirus enterotrópico que no crece en cultivos celulares convencionales, pero que puede adaptarse al cultivo de monocapas derivado de organoides hepatobiliares lepóridos (37). Sin embargo, este lagovirus tampoco crece en monocapas celulares derivadas de organoides intestinales de conejo (36). Las razones se deben supuestamente a la falta de condiciones adecuadas o de cualquier cofactor que se requiera para la diafonía huésped-calicivirus. Por ejemplo, la bilis desempeña un papel importante en la generación del modelo enteroide humano de calicivirus (norovirus) (66), y también podría ser crítico para la contraparte de conejo.
En otros estudios, los enteroides se utilizan como nuevos modelos in vitro para identificar la respuesta epitelial intestinal similar con procesos in vivo después de la infección, incluidos los tropismos infecciosos de segmentos intestinales y tipos celulares específicos, citocinas y respuestas inflamatorias en las transcripciones génicas. Toxoplasma gondii es uno de los parásitos más ubicuos y puede infectar a casi todas las especies homeotérmicas, incluidos los seres humanos y el ganado, estando presente en todos los países (67). Se detectaron focos infecciosos de T. gondii en los organoides ileales porcinos y bovinos generados (34). En el mismo artículo, organoides ileales porcinos y bovinos fueron infectados con Salmonella typhimurium, que es un importante patógeno transmitido por los alimentos (68). La infección por S. typhimurium 4/74 en enteroides bovinos resultó en la presencia de bacterias luminales, mientras que las bacterias estaban presentes en la periferia de los enteroides porcinos. La E. coli enterotoxigénica (ETEC) es una de las causas importantes de diarrea post-destete en lechones, lo que resulta en un aumento de la mortalidad, una reducción de las tasas de crecimiento y graves pérdidas económicas en la cría de cerdos (35). Tanto las monocapas de enteroides, jeyunales como las ileales, apoyaron la adhesión mediada por F4 de las bacterias ETEC (35). Todos ellos son estudios piloto exitosos para generar modelos enteroides para la investigación veterinaria de protozoos y bacterias.
En un estudio de rotavirus del grupo A, importantes patógenos zoonóticos que causan diarrea severa en niños y animales jóvenes, incluido el ganado vacuno (32), los autores revelaron que se requerían dos ligandos para que el rotavirus ingresara a las células epiteliales del intestino delgado en el ganado. Sin embargo, la entrada viral en las células también se detectó a partir de enteroides humanos sin los dos ligandos identificados, aunque de manera menos eficiente que los enteroides bovinos. En este estudio, los modelos enteroides expusieron la diafonía molecular ligando-receptor potencialmente no detectada que no se identificó en otros métodos y ensayos experimentales. El estudio demuestra el papel fundamental que pueden desempeñar los organoides en la investigación básica.
Hasta el momento, no se ha incluido ninguna enfermedad fúngica en la lista de artículos de investigación publicados que utilizan organoides para enfermedades animales. Las aplicaciones de la generación de organoides epidérmicos humanos proporcionan un modelo in vitro de infecciones por dermatofitos, que tiene potencial para estudiar la patogénesis de las infecciones fúngicas y probar la eficacia de los fármacos antifúngicos (69). Las infecciones por dermatofitos en humanos y animales son similares, lo que facilita la aplicación de los principios de diseño del modelo para investigar las infecciones fúngicas en una población animal. Hubo y se produjeron fallos en la generación de modelos organoides adecuados para el estudio de las enfermedades veterinarias. Aun así, todos los resultados demostraron que el establecimiento de este nuevo sistema de cultivo en 3D facilitará las aplicaciones en muchos ámbitos diferentes de las enfermedades infecciosas veterinarias. A medida que se sigan acumulando conocimientos, se prevé el desarrollo exitoso de técnicas de fabricación de organoides que puedan ser más flexibles y confiables para adaptarse a diversas infecciones veterinarias y superar los desafíos actuales.
3. Modelo organoide para enfermedad inflamatoria crónica
La enfermedad inflamatoria intestinal (EII) identifica un grupo de enteropatías idiopáticas crónicas que ocurren espontáneamente y conducen a una inflamación debilitante grave del tracto gastrointestinal (70). Al igual que la EII en humanos, la EII canina (EIIc) es una enfermedad multifactorial resultante de una combinación de predisposiciones genéticas, alteraciones de la microbiota intestinal y aberraciones inmunológicas en la mucosa intestinal (70).
Entre los modelos animales grandes utilizados en el estudio de múltiples trastornos crónicos humanos, incluida la EII, el modelo canino es particularmente relevante en función de las similitudes ambientales y genéticas, los análogos de la anatomía, la fisiología y la patología intestinales, y la semejanza de la composición de la microbiota intestinal (71-73). Los organoides intestinales caninos son un modelo bien desarrollado y caracterizado para la investigación veterinaria y traslacional (38, 39, 70, 74-77). Además de su capacidad de diferenciación epitelial, la monocapa derivada de organoides intestinales caninos ofrece una interfaz tisular accesible, exhibiendo características como la polarización, la diferenciación dependiente del linaje, la formación de barreras de unión estrecha, la permeabilidad y la expresión de bombas de eflujo cruciales (74). La utilización de tejidos/biopsias intestinales portadores de EII para generar organoides ofrece la oportunidad de estudiar la patogénesis, las características y las posibles terapias sin sacrificar animales vivos. Dos estudios generaron organoides intestinales caninos de perros con EII (38, 39). Sin embargo, la histología y la microscopía electrónica de transmisión revelaron similitud entre los organoides intestinales derivados de la EII y los perros sanos (38). Además, la expresión del receptor de prostaglandinas EP4 (EP4R), un receptor que está implicado en la patogénesis de la EII y funciona como diana de tratamiento, no mostró diferencias significativas al utilizar la sonda de hibridación in situ de ARN (ISH) (38). Esto podría deberse al linaje epitelial único de organoides intestinales construidos. Se cree que los organoides recapitularon bien las características genéticas del tejido, incluso después de los pasajes, lo que facilita el estudio de los perfiles transcriptómicos de organoides intestinales de perros con enfermedad inflamatoria intestinal después de la estimulación con lipopolisacáridos (LPS) (39). El tratamiento con LPS reveló una disminución de la expresión de varios genes asociados con el cáncer y patrones de expresión opuestos de transporte, transcripción y traducción de aniones, procesos apoptóticos y regulación de las respuestas inmunitarias adaptativas entre los enteroides de EII y los colonoides. El modelo de esteroideo cIBD proporciona nuevos datos que describen los perfiles de expresión génica. Junto con un sistema de cocultivo diversificado en el que participen otros linajes celulares (por ejemplo, células inmunitarias) y la microbiota intestinal, el modelo organoide de la EII podría estar bien desarrollado y tener un impacto significativo en el cribado de opciones farmacológicas y en el descubrimiento de métodos terapéuticos eficaces para la enfermedad de naturaleza multifactorial, tanto para humanos como para animales.
4. Organoides en el modelado del cáncer veterinario
En la investigación del cáncer, los organoides han representado modelos prometedores y casi fisiológicos de cánceres humanos. Hasta ahora, se pueden lograr numerosos organoides humanos robustos y eficientes a partir de varios tipos de neoplasias que surgen de pulmón, mama, estómago, hígado, páncreas, riñones, vejiga urinaria y próstata (19). Por el contrario, en oncología veterinaria está surgiendo un número limitado pero creciente de investigaciones sobre organoides cancerosos.
Los modelos organoides de cáncer animal, que podrían derivarse de un pequeño número de células madre, permitieron una mejor comprensión de las características moleculares y el comportamiento neoplásico de la enfermedad en animales y actuaron como modelos preliminares para el cribado de fármacos (78-81). Por ejemplo, el carcinoma medular de tiroides canino, los estudios sobre su comportamiento biológico son escasos, pero los resultados del tratamiento siempre son decepcionantes, por lo que el desarrollo de un modelo de organoide canino debería ayudar a dilucidar los mejores enfoques terapéuticos (46). Los organoides podrían formarse a partir de un número limitado de células, como las células madre derivadas de la orina, que se utilizan con éxito en el estudio de organoides del cáncer de próstata y del tracto urinario canino (40-43). La disponibilidad de muestras primarias difícilmente podría ser un problema después de adoptar sistemas de cultivo de organoides para la investigación del cáncer.
Debido a la mejor preservación del microambiente tumoral que los modelos convencionales de líneas celulares 2D, los organoides del cáncer de próstata canino (40), el cáncer de vejiga canina (41–43), el carcinoma de tiroides medular y de células foliculares caninas (45, 46), el adenocarcinoma de pulmón canino (48) y el tumor mamario canino (47), conservan con precisión las características morfológicas, las estructuras genómicas y/o los perfiles mutacionales originales y recapitulan la heterogeneidad genética y fenotípica de las células tumorales. Los organoides del cáncer de próstata canino (40) expresaron marcadores epiteliales (E-cadherina, CK5 y CK8), un marcador de miofibroblastos (a-SMA) y un marcador de células madre cancerosas (CD44). Los organoides establecidos para el cáncer de vejiga canina (41–43) tenían una estructura esferoidal y un tipo histológico similar al del cáncer de vejiga natural en perros. Se caracterizaron por la expresión de marcadores de células uroteliales y se asemejaron a la arquitectura celular de un tipo invasivo de cáncer de vejiga canina. Los organoides derivados del carcinoma tiroideo de células foliculares caninas expresan altamente el receptor de tirotropina, el simportador de yoduro de sodio, la pendrina y la peroxidasa tiroidea, cuyas expresiones son similares o mayores en comparación con los tumores primarios (45). Los organoides derivados del carcinoma medular tiroideo canino (46) mostraron características histológicas similares con el tumor primario después de un cultivo a largo plazo. Los organoides del cáncer de pulmón canino recapitularon la arquitectura tisular del adenocarcinoma de pulmón canino y expresaron TTF1, un marcador de adenocarcinoma de pulmón (48). Los organoides tumorales mamarios caninos recapitularon las estructuras tisulares primarias y las características tumorales, como la atipia celular, el pleomorfismo y la vacuolización, y a veces la diferenciación escamosa (47). También se conservaron las características inmunohistológicas del tejido primario del que se derivaron, incluyendo la clasificación molecular de sus tumores primarios con alta fidelidad en el 82% de los casos (47). Además, también se formaron tumores después de la inyección de los organoides en ratones inmunodeficientes para el cáncer de próstata canino, lo que indica un comportamiento neoplásico similar (40). También se conservaron las características genéticas y genómicas, como las mutaciones de los genes conductores, las variaciones en el número de copias del ADN y las variantes de un solo nucleótido, incluso después de un paso prolongado en los tumores mamarios caninos (47).
Los organoides son un modelo adecuado para ensayos de fármacos in vitro con dosis-respuesta reproducible y tolerancia dependiente de la dosis esperada. Por ejemplo, después de la caracterización molecular inicial de organoides establecidos, se pudo encontrar que varios genes están específicamente regulados al alza, que también podrían ser objetivos potenciales para nuevas terapias, como se llevó a cabo en el estudio del cáncer de vejiga canina y el cáncer de pulmón canino (41, 43, 48). Varios genes, incluida la señalización del receptor del factor de crecimiento epidérmico (EGFR)/ERK, se regularon al alza en el cáncer de vejiga (41, 43). El trametinib, un inhibidor de la activación de ERK, mostró una inhibición extrema en la viabilidad celular de los organoides del cáncer de vejiga canina junto con el inhibidor de YAP (43). El trametinib también disminuyó el crecimiento xenoinjertado de organoides de cáncer de vejiga canina en ratones y mejoró la sensibilidad de los organoides derivados del xenoinjerto al carboplatino (43). Del mismo modo, las expresiones de moléculas relacionadas con la vía MEK también se regularon al alza en organoides de cáncer de pulmón canino (48). Sin embargo, la sensibilidad de los organoides del cáncer de pulmón canino o sus xenoinjertos al trametinib fue diferente entre las cepas de organoides, lo que indicó que cada organoide de diferentes animales pacientes podría mostrar diferentes respuestas específicas de cada individuo al tratamiento con una variedad de medicamentos contra el cáncer, y que podrían usarse para seleccionar protocolos de tratamiento personalizados individualmente. En el biobanco vivo de organoides de tumores mamarios caninos (47), las líneas de organoides mutadas en PIK3CA fueron más sensibles a un inhibidor de la vía PI3K/AKT, alpelisib, y tolerantes a un inhibidor de la interacción MDM2-TP53, nutlin-3a, que tiene efectos sobre otras líneas de organoides, lo que sugiere una herramienta práctica para investigar si mutaciones específicas predicen los resultados de la terapia. Además, los organoides de tumores mamarios caninos también pudieron modificarse genéticamente con un vector lentiviral o una subbiblioteca canina CRISPR/Cas9 personalizada y luego se utilizaron para realizar un cribado combinado de CRISPR/Cas9, donde la representación de la biblioteca se mantuvo con precisión. Las similitudes en la respuesta a los fármacos entre los modelos in vitro 3D y los modelos in vivo (por ejemplo, xenoinjertos derivados del paciente) podrían deberse en gran medida a sus similitudes en las interacciones celulares mejoradas a través de la adhesión y la secreción de factores solubles de los tumores (30, 32).
También se realizaron cultivos monocapa derivados de organoides, sin perder sus características diferenciadas, para estudiar tumores veterinarios (42, 44). En el estudio del cáncer de vejiga canina (42), los cultivos monocapa derivados de organoides proliferaron rápidamente y tuvieron una sensibilidad similar a los medicamentos contra el cáncer. La inyección de células organoides monocapa en ratones inmunodeficientes también generó tumores con características histopatológicas similares a las del carcinoma urotelial (42). Más recientemente, el mismo grupo de investigación veterinaria también generó modelos de organoides de cáncer monocapa directos utilizando tejidos animales de perros y gatos (44). Los tejidos, incluidas muestras de orina de perros enfermos de cáncer de vejiga, muestras de tejido de tumores mamarios de perros, melanoma, adenocarcinoma de pulmón, tumor de piel de gato y tumores mamarios, se utilizaron directamente para generar organoides monocapa por medios organoides monocapa especiales sin formación de estructura organoide 3D. El cultivo de organoides monocapa directos mostró pasajes constantes y mayor velocidad de proliferación en los medios monocapa. Los organoides monocapa directos mantuvieron el patrón de expresión de marcadores específicos y demostraron tumorigénesis in vivo. Además, los organoides monocapa directos mostraron una sensibilidad dependiente de la concentración y diferente a los fármacos anticancerígenos entre las diferentes cepas. Estos hallazgos sugieren que los métodos directos de cultivo de organoides monocapa se pueden utilizar como modelos de investigación más baratos, más fáciles y que consumen menos tiempo en lugar de organoides 3D para estudiar la biología del cáncer y acelerar la medicina veterinaria de precisión.
Los enfoques de cultivo de células organoides tienen un gran potencial y ofrecen sistemas complejos para diversos fines en el campo de la investigación del cáncer, como la tumorigénesis y la progresión específicas de la especie, y la investigación de candidatos prometedores a fármacos contra el cáncer y combinaciones de terapias. En inoides dotados de la capacidad de modelar microambientes tumorales. En el futuro, los medicamentos contra el cáncer pueden probarse mediante sistemas similares a tejidos más complejos, en lugar de utilizar cultivos 2D convencionales que no manifiestan completamente las características de los tumores in vivo. Los modelos organoides pueden ser una plataforma intermedia entre los cultivos 2D convencionales y los modelos in vivo. Sin embargo, la generación de tumoroides sigue siendo más costosa y requiere más tiempo para establecer, mantener y pasar a los cultivos 2D convencionales, lo que limita el desarrollo actual de modelos de organoides para la investigación veterinaria del cáncer (30, 32).
5. Modelos organoides para enfermedades metabólicas
Las publicaciones disponibles sobre modelos organoides para enfermedades metabólicas se limitan a modelos caninos y felinos. Más precisamente, aquí discutimos la relevancia y las limitaciones de los cultivos veterinarios en 3D para modelar y estudiar las disfunciones metabólicas asociadas con trastornos hepáticos en animales de compañía (enfermedad congénita de almacenamiento de cobre canino y esteatosis hepática felina) y discutimos la viabilidad de modelar las enfermedades humanas correspondientes.
En perros, las mutaciones en el gen del dominio 1 del metabolismo del cobre (COMMD1) conducen a una toxicosis autosómica recesiva por cobre asociada con una excreción biliar defectuosa de cobre, lo que resulta en una acumulación hepática masiva de cobre y muestra muchas características de la enfermedad de Wilson. El potencial de la tecnología de organoides hepáticos para tratar la enfermedad por almacenamiento de cobre en el hígado se ha investigado recientemente en el modelo canino deficiente en COMMD1 (49). Organoides hepáticos diferenciados de 14 días cultivados a partir de COMMD1−/− Los perros tuvieron una mayor acumulación intracelular de cobre después de ser sometidos a altos niveles de cobre durante 3 h. Este hallazgo demostró que los organoides hepáticos establecidos a partir de los perros con una deficiencia autosómica recesiva de COMMD1 mantienen el defecto de excreción de cobre, similar a la situación en la situación in vivo, y apoyó la viabilidad de utilizar organoides hepáticos caninos enfermos para modelar la enfermedad de almacenamiento de cobre. La corrección génica se realizó en organoides COMMD1 mediante el uso de vectores lentivirales portadores del gen COMMD1. Después de la transducción, la suplementación con el gen COMMD1 normalizó el contenido de cobre celular en los organoides a niveles de tipo salvaje dentro de las 24 h, evidenciado por la comparación del nivel de cobre después de 3 o 24 h de tratamiento con cobre con COMMD1 diferenciado−/− y organoides silvestres. Los autores indicaron que estos resultados confirman que los organoides de las enfermedades hepáticas caninas sirven como un modelo traslacional robusto para enfermedades hepáticas como la enfermedad de Wilson e ilustran el asombroso potencial terapéutico para corregir errores genéticos cuando se combinan con la tecnología de edición del genoma. En un estudio de seguimiento (50), el mismo grupo proporcionó una prueba de concepto preclínica para el trasplante de células basado en organoides in vivo con la esperanza de que los organoides hepáticos corregidos genéticamente pudieran ser una fuente celular terapéuticamente relevante para el trasplante autólogo en pacientes con enfermedades hepáticas metabólicas. Han documentado el uso de células de organoides hepáticos autólogos corregidos genéticamente para trasplante en modelos caninos deficientes en COMMD1 de enfermedad por almacenamiento de cobre. Los resultados revelaron que las células derivadas de organoides podían infundirse de forma segura y repetida de forma no invasiva a través de la vena porta, con una supervivencia de hasta dos años después del trasplante como células individuales, aunque las células derivadas de organoides traducidas no estaban completamente maduras y mantenían la integración funcional in vivo. Este estudio preclínico confirma la supervivencia in vivo de células similares a hepatocitos derivadas de organoides autólogos corregidos genéticamente y garantiza una mayor optimización del injerto de organoides y la recuperación funcional en un modelo animal grande de enfermedad hepática humana. Los organoides hepáticos caninos proporcionan plataformas para el modelado preclínico de enfermedades hepáticas. La perspectiva del uso de organoides hepáticos en la terapia celular es alentadora, pero requiere validación en el entorno clínico. El desarrollo a partir de cultivos de células madre hepáticas del perro como modelo animal es un paso importante para superar los desafíos de pasar de la investigación traslacional básica a la aplicación en pacientes humanos.
La esteatosis hepática felina (FHS), una de las enfermedades hepatobiliares más comunes en gatos, se caracteriza por la acumulación de triglicéridos (TG) en la mayoría de los hepatocitos, lo que conduce a una hepatomegalia significativa, deterioro de la función hepática y colestasis intrahepática. La fisiopatología de la ESF es compleja. Varias similitudes entre la esteatosis felina y humana y la sensibilidad única de esta enfermedad en los gatos alentaron a los científicos a establecer un modelo felino a largo plazo que pudiera imitar la enfermedad del hígado graso no alcohólico (NAFLD) y evaluar la eficacia de los medicamentos potenciales para el tratamiento de la FHS (51, 52). Se generó una estructura esférica del modelo organoide hepático felino con plegamientos epiteliales ocasionales y proyecciones intraluminales y exhibió firmas transcriptómicas o expresivas altamente comparables con células madre adultas hepáticas o características progenitoras/biliares y potencial diferenciado hacia células similares a hepatocitos. En circunstancias de exceso de ácidos grasos libres (AGL), se observó acumulación de lípidos en organoides y, curiosamente, los organoides derivados del hígado felino acumularon significativamente más gotas de lípidos que los organoides derivados de los humanos, lo que indica una diferencia de especies. Además, se encontraron diferencias en la activación transcripcional entre los organoides humanos y felinos tratados con FFA, lo que también revela diferencias de especies en los procesos celulares de metabolización de lípidos. En un estudio de seguimiento (52), los mismos autores utilizaron modelos de organoides hepáticos felinos para probar el potencial de los fármacos para reducir la acumulación de lípidos e identificaron T863 y AICAR (inhibidor de la O-aciltransferasa 1 del diacilglicerol y activador de la proteína quinasa activada por monofosfato de adenosina, respectivamente) como dos candidatos prometedores para una evaluación clínica adicional utilizada en el tratamiento de la FHS. Todos estos estudios destacan el potencial de los organoides para modelar enfermedades metabólicas hepáticas y ofrecen nuevas perspectivas en el descubrimiento de fármacos para tratar enfermedades metabólicas (82).
6. Discusión
Los modelos de organoides se están integrando rápidamente en diversos aspectos de la investigación veterinaria y actualmente se generan para diversas especies veterinarias y una diversidad de órganos debido a la mejora de los protocolos de derivación y las condiciones culturales (58) (Figura 2). Estos modelos, derivados de tejidos primarios o células inmortalizadas, allanarán el camino para aplicaciones in vitro avanzadas en enfermedades veterinarias. En comparación con el número de modelos de organoides veterinarios generados a partir de tejidos normales, las aplicaciones de estos organoides para modelar enfermedades son actualmente relativamente escasas. Por ejemplo, la generación de organoides para órganos reproductivos (ovarios, testículos, oviductos, endometrio y placenta) y embrioides avanzó mucho en las especies de animales de granja (83). Pero los modelos patológicos de organoides para órganos reproductivos son todavía escasos (83). El desarrollo de organoides reproductivos en condiciones patológicas tiene el potencial de ofrecer nuevos enfoques terapéuticos y mejorar las intervenciones para abordar la infertilidad en animales de granja.
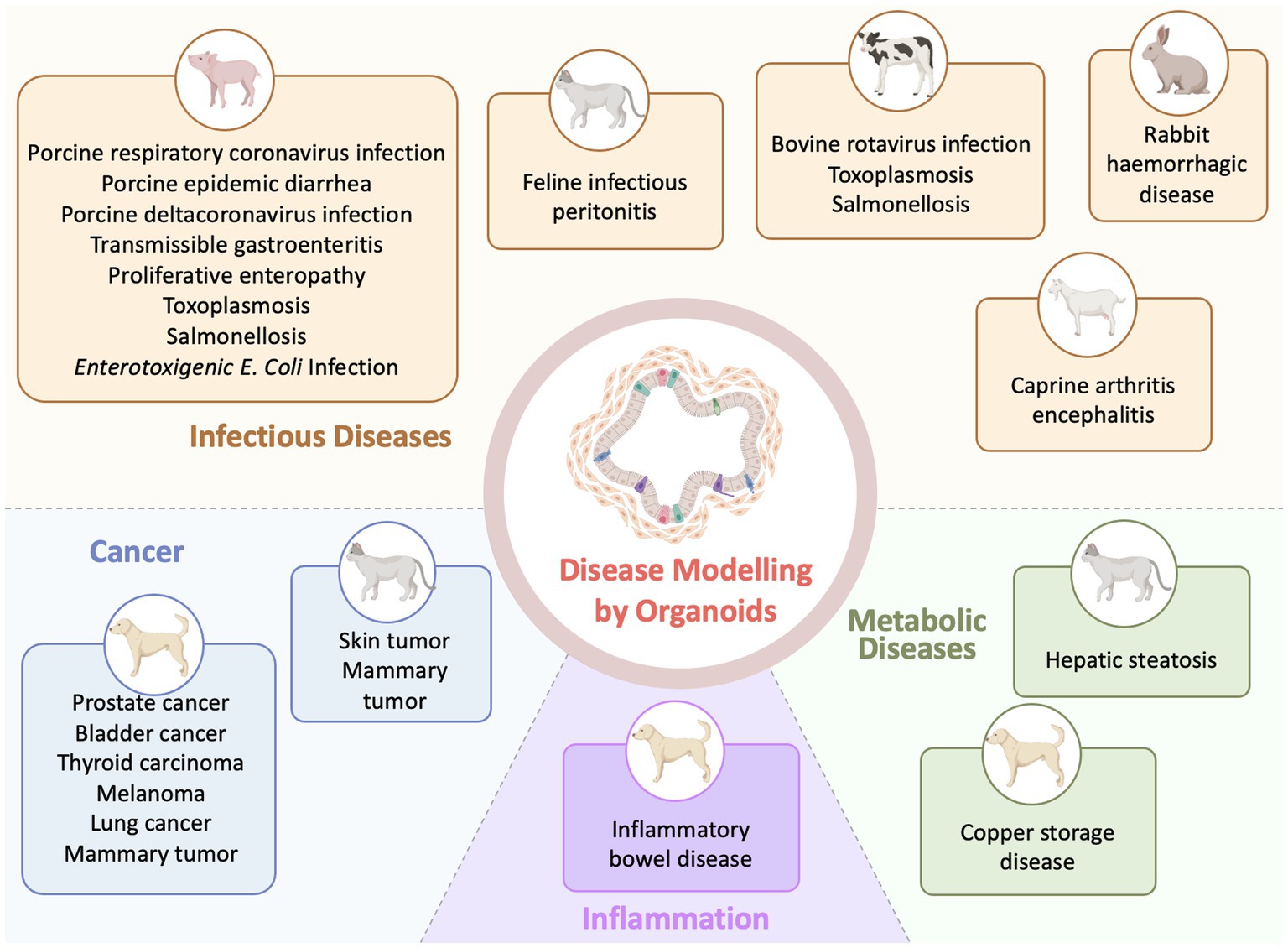 Figura 2. Aplicaciones de la tecnología de organoides en la investigación de enfermedades veterinarias (Creado con BioRender.com).
Figura 2. Aplicaciones de la tecnología de organoides en la investigación de enfermedades veterinarias (Creado con BioRender.com).
El futuro del modelo de enfermedad organoide en el campo veterinario es prometedor no solo por los diferentes organoides veterinarios existentes que pueden ser manipulados, sino también por la disponibilidad de poderosos métodos de bioingeniería, como los enfoques de edición del genoma. Debido a que los organoides se derivan de células madre, las estrategias de edición del genoma proporcionan enfoques ideales para producir células transgénicas que poseen genotipos clave, que luego pueden expandirse y diferenciarse clonalmente. Los organoides veterinarios con modificaciones genómicas pueden contribuir fundamentalmente a modelar enfermedades con anomalías genéticas (como la fibrosis quística), estudiando las intrincadas interacciones receptor-ligando para la enfermedad infecciosa y la transformación maligna (84). Como se mencionó anteriormente, la corrección génica se realizó en células COMMD1 con lentivirus, lo que normalizó la capacidad de almacenamiento de cobre de los organoides e intentó lograr la remisión sintomática para los perros pacientes trasplantados (49). Los organoides también son susceptibles a las estrategias génicas mediante la eliminación de genes por siRNA, shRNA e interferencia CRISPR. Como resultado, las estructuras organoides pueden ser aplicaciones de la investigación de genotipo a fenotipo, el tratamiento de defectos congénitos y la medicina de precisión después de las manipulaciones del genoma.
Los organoides asumen un papel fundamental en el ámbito de la medicina de precisión. Algunas enfermedades, como el cáncer y la EII, son heterogéneas e incluyen interacciones complejas de diversos componentes celulares o no celulares. Los organoides se cultivan utilizando tejidos patológicos obtenidos de pacientes afectados con características de microambientes. Los organoides derivados del paciente (PDO) funcionan como una herramienta para determinaciones médicas personalizadas informadas, con la capacidad de anticipar las reacciones de los pacientes a los protocolos terapéuticos y, a su vez, fomentar la perspectiva de mejorar la eficacia del tratamiento. Además de las terapias personalizadas, el establecimiento de un «biobanco de organoides vivos» bien definido para las enfermedades multifactoriales está ganando cada vez más atención. La ventaja fundamental es proporcionar información más precisa de las complejidades inherentes a estas enfermedades después de la secuenciación a gran escala y el cribado de fármacos, y reflejar más fielmente la receptividad de los pacientes a los agentes farmacéuticos y su capacidad para soportar las toxicidades inducidas por los fármacos (85). Como sugiere el concepto de «Una sola medicina», los métodos terapéuticos y técnicos pueden compartirse entre humanos y animales para su beneficio mutuo, pero la medicina de precisión en enfermedades veterinarias aún está inmadura y su aplicación puede variar según la especie (86). Varios modelos de organoides veterinarios también demostraron el poderoso potencial de la medicina regenerativa (86). Por ejemplo, los organoides epiteliales corneales en perros y gatos se han cultivado y mantenido con éxito con expresiones de marcadores progenitores epiteliales y de células madre específicos de la córnea, lo que podría ser una nueva herramienta para modelar la enfermedad oftalmológica veterinaria y probar el fármaco corneal e incluso tratar las enfermedades corneales mediante el trasplante de organoides corneales o el aprovechamiento de las capacidades regenerativas de las células madre limbales en la concepción de la medicina regenerativa (87). Las ventajas de adoptar un sistema de organoides veterinarios para modelar enfermedades y luego aplicarlo en medicina de precisión y regenerativa avanzan continuamente, con beneficios potenciales tanto para animales como para humanos.
Existe evidencia convincente que sugiere que los estudios preclínicos o la evaluación de la toxicidad obtienen ventajas significativas de la adopción de modelos de organoides (11, 88). No obstante, hay una cantidad limitada de investigaciones sobre toxicidad realizadas utilizando sistemas de organoides veterinarios, como la evaluación del efecto de los productos químicos en los enteroides de criptas y vellosidades aviares generados (89). El perro es el modelo animal de mamífero no roedor preferido en la investigación farmacéutica, según lo avalado por la FDA para recopilar datos iniciales de seguridad sobre medicamentos destinados al uso humano (90). Se proporcionó un protocolo completo para la creación de organoides caninos en un sistema de doble cámara para formar una monocapa epitelial cilíndrica con microvellosidades en la parte apical de las células en el soporte permeable, lo que permitió a otros investigadores determinar la permeabilidad aparente de los candidatos a fármacos terapéuticos (75). Los hallazgos preliminares señalaron un potencial prometedor en la utilización de monocapas de organoides derivados de caninos para realizar evaluaciones específicas de la permeabilidad pasiva de las especies en relación con los medicamentos terapéuticos (77). Además, se ha propuesto la utilización de unidades de organoides gastrointestinales porcinos como una herramienta prospectiva in vitro con relevancia para el descubrimiento y desarrollo de fármacos (91). Los organoides gastrointestinales animales pueden surgir para llenar el vacío entre otros modelos in vitro actuales y los modelos animales para evaluar la eficacia de los fármacos y la toxicidad potencial durante las investigaciones preclínicas (38, 84). Además, una vez que se ha logrado establecer el modelado de la enfermedad mediante el uso de sistemas organoides, la integración con los estudios ADME (adsorción, distribución, metabolismo y excreción) también puede ser un paso crucial en el desarrollo de fármacos, ya que la integración contribuirá a la evaluación de la eficacia y la seguridad de los posibles candidatos a fármacos en el contexto de las enfermedades humanas y veterinarias objetivo.
Los modelos recientes de organoides para enfermedades veterinarias eran todavía imperfectos y una de las razones era la falta de componentes multicelulares de todos los linajes. Todos los modelos de organoides generados para enfermedades veterinarias ahora se derivan de células madre adultas (ASC). Los organoides derivados de ASC tienen mayores características de diferenciación, pero consisten únicamente en células de un solo linaje y no tienen atributos dinámicos ni funcionalidades avanzadas de órganos auténticos, a pesar de que esta disposición ofrece la ventaja de manifestar directamente el impacto de los tratamientos experimentales en células diana específicas. Sin embargo, la complejidad de los órganos multicelulares y dinámicos siempre oculta mecanismos más intrincados de las enfermedades, y los microambientes tumorales también juegan un papel crucial en la mediación de algunos de los efectos de la quimioterapia y la radioterapia (92), por lo que se restablece la complejidad y se abarcan varios componentes, incluidas las células inmunes, neuronales, estromales y vasculares, junto con los microambientes físicos y químicos, así como la microbiota. todo ello en el contexto de las características dinámicas de un sistema vivo, presenta retos considerables en el campo de la modelización de enfermedades veterinarias. Este inconveniente podría superarse parcialmente mediante el establecimiento de modelos de organoides de cocultivo más complejos o el uso de sistemas de cultivo de organoides derivados de iPSC/ESC, que también contienen componentes mesenquimales. Otros métodos, como la bioimpresión 3D y los modelos de órganos en un chip, podrían imitar más características de las actividades biológicas de los órganos vivos completos, las propiedades mecánicas dinámicas y las funcionalidades bioquímicas que se utilizan en la medicina básica, y su desarrollo es muy alentador. Los modelos Organ-on-a-chip o OrganoidChips son los enfoques innovadores de ingeniería para crear dispositivos de cultivo celular microfluídicos para la producción, el control preciso y el análisis de alto rendimiento de organoides y su microambiente biomecánico dinámico (84, 93). Además, se pueden vincular fluidamente diferentes modelos de chips de órganos para construir sistemas de «cuerpo en un chip» capaces de simular interacciones multiorgánicas y respuestas funcionales a nivel sistémico (94). Al adoptar modelos de organoides de órgano en un chip, se lograrán más avances en los campos veterinarios, especialmente para el modelado de enfermedades, después de controlar mejor el microambiente e imitar las interacciones tejido-tejido y multiorgánicas (93). Una vez que la heterogeneidad celular en los organoides se aborde en modelos más sofisticados, estos modelos deberían ayudar a comprender mejor la fisiopatología de las enfermedades y apoyar el desarrollo de nuevas terapias, lo que también tiene el potencial de reducir en gran medida el número de modelos animales utilizados para fines equivalentes.
Es cierto que, además de la reducción de la complejidad de los modelos organoides actuales y su naturaleza estática, también se observan otras limitaciones significativas (95). En primer lugar, los organoides no alcanzan la madurez completa de los órganos in vivo. Por ejemplo, el organoide hepático exhibe la expresión de marcadores asociados con células progenitoras hepáticas y células biliares, pero sin el marcador de hepatocitos maduros HepPar-1 (51). Los organoides suelen modelar las primeras etapas de desarrollo o subconjuntos específicos de tipos celulares, y lograr la funcionalidad completa de los órganos sigue siendo un desafío formidable. Como resultado, la tarea de determinar la diferenciación de los organoides debe abordarse en cada investigación evaluando si las células dentro de los organoides se han convertido en los tipos de células especializadas deseados o imitan de cerca el estado de diferenciación del órgano de interés. Para lograr esto, los principales métodos empleados para examinar la composición de los organoides incluyen la evaluación de la morfología de los organoides a través de técnicas como las imágenes de campo claro y la microscopía óptica y electrónica. Además, la inmunofluorescencia y las imágenes inmunohistoquímicas, que pueden ayudar a proporcionar información sobre la proporción de diferentes tipos de células con la ayuda de la tinción de anticuerpos marcadores celulares específicos, se utilizan popularmente en medicina veterinaria. Por ejemplo, los tipos celulares de organoides intestinales pueden distinguirse por marcadores específicos de diferenciación, como la villina y la villina1 para los enterocitos maduros, la mucina 2 y la mucina 5 ac para las células caliciformes, la cromogranina A y la sinaptofisina para las células enteroendocrinas, la lisozima para las células de Paneth, Ki67 para las células proliferantes, Lgr5, SOX9 y SMOC2 para las células madre intestinales, además de ZO-1 para las proteínas apicales y β-catenina para las proteínas basales (28-30, 32-36 y 56). Además, en la investigación de modelado de organoides veterinarios, a menudo comienza con la PCR en tiempo real para una evaluación rápida y cuantitativa de los genes marcadores que indican la identidad celular, incluidos los factores de transcripción y los marcadores de diferenciación. Para profundizar, la transferencia occidental también puede ofrecer información sobre la abundancia, la degradación, las interacciones y las modificaciones postraduccionales de las proteínas, revelando actividades específicas de la vía de señalización en tipos celulares comprometidos (96). Para obtener una visión más completa, el análisis scRNA-seq de alto rendimiento perfila todos los tipos de células organoides, tanto indiferenciadas como comprometidas, a nivel del transcriptoma del genoma completo (96). A continuación, estos perfiles se comparan con células recién aisladas de los tejidos u órganos correspondientes para evaluar la similitud de cada población celular. Este enfoque es particularmente útil para comprender la diversidad de estados de diferenciación celular dentro de organoides cultivados, que a menudo contienen varios tipos de células inmaduras. En segundo lugar, no existen criterios estandarizados de protocolos para el establecimiento de organoides y el control de calidad. Debido a la diversidad entre individuos y protocolos, los resultados varían de un grupo a otro. Las unidades organoides, incluso en el mismo sistema de cultivo, son heterogéneas en términos de viabilidad, tamaño y forma, lo que impide las cribas fenotípicas. En algunos casos, la heterogeneidad de los organoides podría imitar la situación real in vivo mejor que una respuesta limitada altamente estereotipada. La estandarización es un paso importante para garantizar que los resultados obtenidos de los modelos de organoides sean consistentes, reproducibles y comparables. Si bien se ha prestado poca atención a la normalización dentro de los ámbitos veterinarios, una publicación ha abordado esta brecha mediante el establecimiento de protocolos estandarizados para el mantenimiento de cultivos de organoides hepáticos e intestinales caninos en 3D (76). Este esfuerzo tiene como objetivo proporcionar una base confiable para los procedimientos de cultivo de organoides caninos en la investigación biomédica, promoviendo el intercambio intradisciplinario de conocimientos. En tercer lugar, los organoides suelen crecer en una estructura 3D con una sustancia llamada Matrigel como microambiente. La influencia precisa de Matrigel en el comportamiento de estos organoides sigue siendo incierta. Es importante darse cuenta de que Matrigel podría afectar la forma en que usamos los organoides para la medicina personalizada o el trasplante de células basadas en órganos. Las investigaciones futuras deben centrarse en comprender y abordar este problema. Por último, los organoides son relativamente costosos en comparación con los cultivos celulares tradicionales.
Aunque los modelos de organoides son relativamente caros y no pueden modelar todo el organismo como lo hace un modelo animal, siguen siendo más baratos y fáciles de manejar que los modelos animales y permiten a los científicos recopilar datos rápidamente, evitando al mismo tiempo las cuestiones éticas relacionadas con el uso de animales para la investigación (24). La modelización de diferentes enfermedades mediante el uso de sistemas de organoides ayuda a reemplazar la experimentación animal de acuerdo con el principio de las 3R, es decir, el reemplazo, la reducción y el refinamiento, y también el principio de las 4R con la responsabilidad de la experimentación animal (97, 98). El concepto de «Una Salud» representa un avance o evolución del paradigma anterior de «Una Medicina» con la incorporación de la salud del ecosistema (99). La versatilidad de los modelos de organoides para dar cabida a diversas especies los hace especialmente importantes en el marco de «Una sola salud» para gestionar las zoonosis emergentes y reemergentes y dilucidar la dinámica fisiopatológica interconectada entre la salud humana, animal y ambiental (97). Por otro lado, la mayoría de los cultivos son genéticamente estables, se pueden propagar indefinidamente y se pueden congelar para su almacenamiento de la misma manera que las células inmortalizadas, lo que facilita su uso, almacenamiento y transferencia. En un estudio a largo plazo, los enteroides podrían vivir normalmente de 4 meses a más de 1 año sin anomalías o con muy pocas anomalías en su crecimiento, morfología y perfiles genéticos (29). Por el contrario, otros modelos in vitro no transformados, como las células primarias o los explantes de tejidos, tienen una capacidad de replicación finita y una rápida senescencia (100).
En conclusión, el cultivo de organoides ofrece más que los sistemas convencionales de cultivo celular 2D en la investigación básica y aplicada. La aplicación actual de organoides en enfermedades veterinarias está en pañales, pero se está desarrollando rápidamente. Los modelos organoides tienen un enorme potencial para ser modelos in vitro duraderos para estudiar la patogénesis de enfermedades y el desarrollo de fármacos. El futuro de la tecnología de organoides en el modelado de enfermedades veterinarias es prometedor.
Contribuciones de los autores
BC escribió el primer borrador del manuscrito. RS y SG contribuyeron a la revisión del manuscrito, editaron y aprobaron la versión presentada. Todos los autores contribuyeron al artículo y aprobaron la versión enviada.
Financiación
El trabajo fue apoyado por la Beca de Doctorado del Consejo de Becas de China (CSC) – Universidad de Melbourne (Unimelb) organizada por CSC (Archivo No. 202008320396) y la Universidad de Melbourne.
Conflicto de intereses
Los autores declaran que la investigación se llevó a cabo en ausencia de relaciones comerciales o financieras que pudieran interpretarse como un posible conflicto de intereses.
Nota del editor
Todas las afirmaciones expresadas en este artículo son únicamente las de los autores y no representan necesariamente las de sus organizaciones afiliadas, ni las del editor, los editores y los revisores. Cualquier producto que pueda ser evaluado en este artículo, o afirmación que pueda ser hecha por su fabricante, no está garantizado ni respaldado por el editor.
Referencias
1. Lancaster, MA y Knoblich, J.A. . Organogénesis en un plato: Modelización del desarrollo y la enfermedad mediante tecnologías de organoides. Ciencia. (2014) 345:1247125. doi: 10.1126/science.1247125
2. Smith, E y Cochrane, WJ . Teratoma organoide quístico; informe de un caso. Can Med Assoc J. (1946) 55:151.
3. Resau, JH , Sakamoto, K , Cottrell, JR , Hudson, EA y Meltzer, SJ . Explante de órganos: una revisión. Citotecnología. (1991) 7:137–49. doi: 10.1007/BF00365924
4. Dolor, B . Organoides en animales domésticos: ¿con qué células madre? Res. Veterinaria. (2021) 52:38. doi: 10.1186/s13567-021-00911-3
5. Fatehullah, A , Bronceado, SH y Barker, N . Los organoides como modelo in vitro del desarrollo humano y la enfermedad. Nat Cell Biol. (2016) 18:246–54. doi: 10.1038/ncb3312
6. Tatullo, M , Marrelli, B , Benincasa, C , Aiello, E , Makeeva, yo , Zavan, B, et al. Organoides en oncología traslacional. J Clin Med. (2020) 9:2774. doi: 10.3390/jcm9092774
7. Kar, SK , Pozos, JM , Ellen, ED , Te Pas, MFW , Madsen, O , Groenen, MAM, et al. Organoides: una nueva y prometedora plataforma in vitro en la investigación ganadera y veterinaria. Res. Veterinaria. (2021) 52:43. doi: 10.1186/s13567-021-00904-2
8. Koledova, Z . Cultivo celular en 3D: una introducción. Métodos Mol Biol. (2017) 1612:1–11. doi: 10.1007/978-1-4939-7021-6_1
9. Sumbal, J , Budkova, Z , Traustadóttir, G y Koledova, Z . Organoides mamarios y cultivos celulares 3D: perros viejos con nuevos trucos. J Neoplasia Biol de la glándula mamaria. (2020) 25:273–88. doi: 10.1007/s10911-020-09468-x
10. Sato, T , Vries, RG , Snippert, HJ , Van de Wetering, M , Barker, N , Stange, DE, et al. Las células madre Lgr5 individuales construyen estructuras de cripta-vellosidades in vitro sin un nicho mesenquimatoso. Naturaleza. (2009) 459:262–5. doi: 10.1038/nature07935
11. Augustyniak, J , Bertero, A , Coccini, T , Baderna, D , Buzanska, L y Caloni, F . Los organoides son herramientas prometedoras para estudios toxicológicos in vitro específicos de especies. J Appl Toxicol. (2019) 39:1610–22. doi: 10.1002/jat.3815
12. Sato, K , Zhang, W , Safarikia, S , Isidán, A , Chen, AM , Li, P, et al. Organoides y esferoides como modelos para el estudio de la lesión hepática colestásica y el colangiocarcinoma. Hepatología. (2021) 74:491–502. doi: 10.1002/hep.31653
13. Nath, S y Devi, GR . Sistemas de cultivo tridimensional en la investigación del cáncer: enfoque en el modelo de esferoide tumoral. Pharmacol Ther. (2016) 163:94–108. doi: 10.1016/j.pharmthera.2016.03.013
14. Colmillo, Y y Eglen, RM . Cultivos celulares tridimensionales en el descubrimiento y desarrollo de fármacos. SLAS Discov. (2017) 22:456–72. doi: 10.1177/1087057117696795
15. Nunes, AS , Barros, AS , Costa, CE , Moreira, AF y Correia, IJ . Esferoides tumorales 3D como modelos in vitro para imitar in vivo la resistencia de los tumores sólidos humanos a los fármacos terapéuticos. Biotechnol Bioeng. (2019) 116:206–26. doi: 10.1002/bit.26845
16. Zachos, Carolina del Norte , Kovbasnjuk, O , Foulke-Abel, J , En, J , Blutt, SE , de Jonge, HR, et al. Human Enteroids/Colonoids and intestinal organoids functionally recapitulan Normal intestinal physiology and pathophysiology (Fisiología y fisiopatología intestinales normales). J Biol Chem. (2016) 291:3759–66. doi: 10.1074/jbc. R114.635995
17. Kratochvil, MJ , Seymour, AJ , Li, TL , Pasca, SP , Kuo, CJ y Heilshorn, Carolina del Sur . Materiales de ingeniería para sistemas organoides. Nat Rev Mater. (2019) 4:606–22. doi: 10.1038/s41578-019-0129-9
19. Xu, H , Jiao, D , Liu, A y Wu, K . Organoides tumorales: aplicaciones en cáncer Modelización y potenciales en medicina de precisión. J Hematol Oncol. (2022) 15:58. doi: 10.1186/s13045-022-01278-4
20. Grimshaw, MJ , Cooper, L , Papazisis, K , Coleman, Ja , Bohnenkamp, RRHH , Chiapero-Stanke, L, et al. El cultivo de la mamosfera de células de cáncer de mama metastásico enriquece las células de cáncer de mama tumorigénicas. Cáncer de Mama Res. (2008) 10:R52. doi: 10.1186/bcr2106
21. Cavallero, S , Neves Granito, R , Estocolmo, D , Azzolin, P , Martín, MT y Fortunel, NO . La exposición de organoides de piel humana a bajo estrés genotóxico puede promover la transición epitelial a mesenquimal en la regeneración de células precursoras de queratinocitos. Células. (2020) 9:1912. doi: 10.3390/cells9081912
22. Lee, J , Bscke, R , Tang, PC , Hartman, BH , Heller, S y Koehler, KR . Desarrollo del folículo piloso en organoides cutáneos derivados de células madre pluripotentes de ratón. Rep. de Célula (2018) 22:242–54. doi: 10.1016/j.celrep.2017.12.007
23. Lei, M , Schumacher, LJ , Lai, YC , Juan, WT , Yeh, CY , Wu, P, et al. El proceso de autoorganización en la formación de organoides de la piel del recién nacido inspira la estrategia para restaurar la regeneración capilar de las células adultas. Proc Natl Acad Sci U S A. (2017) 114:E7101–10. doi: 10.1073/pnas.1700475114
24. Shpichka, A , Bikmulina, P , Peshkova, M , Heydari, Z , Kosheleva, N , Vosough, M, et al. Organoides en la modelización de enfermedades infecciosas. Droga Discov hoy. (2022) 27:223–33. doi: 10.1016/j.drudis.2021.08.005
25. Wolpert, L . Morfógenos: Historia. Módulo de referencia en neurociencia y psicología bioconductual. Ámsterdam: Elsevier (2017).
26. Le Jan, C , Bellaton, C , Groenlandia, T y Mornex, JF . Transmisión mamaria del virus de la encefalitis de la artritis caprina: un modelo 3D para estudio in vitro. Reprod Nutr Dev. (2005) 45:513–23. doi: 10.1051/rnd:2005035
27. Jiang, C , Li, L , Xue, M , Zhao, L , Liu, X , Wang, W, et al. La expansión a largo plazo de los organoides de las vías respiratorias porcinas proporciona información sobre la patogénesis y la inmunidad innata de la infección por coronavirus respiratorio porcino. J Virol. (2022) 96:e0073822. doi: 10.1128/jvi.00738-22
28. Li, L , Fu, F , Guo, S , Wang, H , Él, X , Xue, M, et al. Enteroides intestinales porcinos: un nuevo modelo para estudiar la infección por el virus de la diarrea epidémica porcina por coronavirus entérico y la respuesta innata del huésped. J Virol. (2019) 93:e01682-18. doi: 10.1128/jvi.01682-18
29. Luo, H , Zheng, J , Chen, Y , Wang, T , Zhang, Z , Shan, Y, et al. Evaluación de la utilidad de enteroides porcinos como modelo de infección por Pdcov in vitro. Microbiol frontal. (2020):11. doi: 10.3389/fmicb.2020.00821
30. Li, Y , Yang, N , Chen, J , Huang, X , Zhang, N , Yang, S, et al. Organoides intestinales porcinos de próxima generación: un modelo de organoide apical para investigaciones de infección por virus entéricos porcinos e investigaciones de respuesta inmune. J Virol. (2020) 94:E01006–20. doi: 10.1128/JVI.01006-20
31. Tekes, G y Thiel, HJ . Capítulo seis – Coronavirus felinos: patogénesis de la peritonitis infecciosa felina En: J Ziebuhr editor. Avances en la investigación de virus. 96. Cambridge, MA: Academic Press (2016). 193–218.
32. Alfajaro, MM , Kim, JY , Barbé, L , Cho, EH , Parque, JG , Soliman, M, et al. Reconocimiento dual de los epítopos de ácido siálico y Αgal por los dominios Vp8* del rotavirus bovino G6p[5] Wc3 y de sus cepas de la vacuna mono-Reassortant G4p[5] Rotateq. J Virol. (2019) 93:e00941-19. doi: 10.1128/jvi.00941-19
33. Resende, TP , Medida, RL , Vannucci, FA , Saqui-Salces, M y Gebhart, C . Evaluación de enteroides porcinos como modelos in vitro para la infección por Lawsonia intracellularis. J Anim Sci. (2020) 98:skaa011. doi: 10.1093/jas/skaa011
34. Derricott, H , Luu, L , Fong, WY , Hartley, CS , Johnston, LJ , Armstrong, SD, et al. Desarrollo de un modelo de epitelio intestinal en 3D para especies ganaderas. Res. de Tejido Celular. (2019) 375:409–24. doi: 10.1007/s00441-018-2924-9
35. Vermeire, B , González, LM , Jansens, RJJ , Cox, E y Devriendt, B . Organoides porcinos del intestino delgado como modelo para explorar las interacciones Etec-huésped en el intestino. Res. Veterinaria. (2021) 52:94. doi: 10.1186/s13567-021-00961-7
36. Kardia, E , Frese, M , Smertina, E , Esforzarse, T , Zeng, X-L , Estes, M, et al. Cultivo y diferenciación de organoides intestinales de conejo y monocapas celulares derivadas de organoides. Sci Rep. (2021) 11:5401. doi: 10.1038/s41598-021-84774-w
37. Kardia, E , Fakhri, O , Pavy, M , Albañil, H , Huang, N , Smertina, E, et al. Los organoides hepatobiliares derivados de los lepóridos apoyan la replicación de los lagovirus hepatotrópicos. J Gen Virol. (2023) 104:8. doi: 10.1099/jgv.0.001874
38. Chandra, L , Borcherding, DC , Kingsbury, D , Atherly, T , Ambrosini, YM , Bourgois-Mochel, A, et al. Derivación de organoides intestinales caninos adultos para investigación traslacional en gastroenterología. BMC Biol. (2019) 17:33. doi: 10.1186/s12915-019-0652-6
39. Sahoo, DK , Borcherding, DC , Chandra, L , Jergens, AE , Atherly, T , Bourgois-Mochel, A, et al. Perfiles transcriptómicos diferenciales tras la estimulación con lipopolisacáridos en organoides intestinales de perros con enfermedad inflamatoria intestinal y tumor intestinal de mastocitos. Cánceres (Basilea). (2022) 14:3525. doi: 10.3390/cancers14143525
40. Usui, T , Sakurai, M , Nishikawa, S , Umata, K , Nemoto, Y , Haraguchi, T, et al. Establecimiento de un organoide primario de cáncer de próstata en perros utilizando las células madre del cáncer de orina. Cáncer Sci. (2017) 108:2383. doi: 10.1111/cas.13418
41. Elbadawy, M , Usui, T , Mori, T , Tsunedomi, R , Hazama, S , Nabeta, R, et al. Establecimiento de un nuevo modelo experimental para el cáncer de vejiga invasivo muscular utilizando un cultivo de organoides de cáncer de vejiga de perro. Cáncer Sci. (2019) 110:2806–21. doi: 10.1111/cas.14118
42. Abugomaa, A , Elbadawy, M , Yamanaka, M , Ir a, Y , Hayashi, K , Mori, T, et al. Establecimiento de un modelo de cultivo de organoides 2.5d utilizando cultivo de organoides de cáncer de vejiga 3d. Sci Rep. (2020) 10:9393. doi: 10.1038/s41598-020-66229-w
43. Elbadawy, M , Sato, Y , Mori, T , Ir a, Y , Hayashi, K , Yamanaka, M, et al. Efecto antitumoral de trametinib en el organoide del cáncer de vejiga y el mecanismo subyacente. Cáncer Biol Ther. (2021) 22:357–71. doi: 10.1080/15384047.2021.1919004
44. Abugomaa, A , Elbadawy, M , Yamamoto, H , Ayame, H , Ishihara, Y , Sato, Y, et al. Establecimiento de un modelo directo de cultivo de organoides 2.5d utilizando tejidos cancerígenos de animales de compañía. Farmacia Biomédica. (2022) 154:113597. doi: 10.1016/j.biopha.2022.113597
45. Jankovic, J , Dettwiler, M , Fernández, MG , Tièche, E , Hahn, K , April-Monn, S, et al. Validación de la inmunohistoquímica de las proteínas caninas implicadas en la captación de yodo tiroideo y su expresión en carcinomas tiroideos de células foliculares caninas (Ftc) y organoides derivados de Ftc. Veterinario Pathol. (2021) 58:1172–80. doi: 10.1177/03009858211018813
46. Scheemaeker, S , Inglebert, M , Daminet, S , Dettwiler, M , Letko, A , Drögemüller, C, et al. Organoides del carcinoma medular de tiroides derivado del paciente: el primer hito hacia un nuevo modelo in vitro en perros. Veterinario Comp Oncol. (2023) 21:111–22. doi: 10.1111/vco.12872
47. Inglebert, M , Dettwiler, M , Hahn, K , Letko, A , Drogemuller, C , Doench, J, et al. Un biobanco vivo de organoides de tumores mamarios caninos como modelo comparativo para el cáncer de mama humano. Sci Rep. (2022) 12:18051. doi: 10.1038/s41598-022-21706-2
48. Shiota Sato, Y , Elbadawy, M , Suzuki, K , Tsunedomi, R , Nagano, H , Ishihara, Y, et al. Derivación de un nuevo modelo de adenocarcinoma de pulmón utilizando organoides de cáncer de pulmón canino para la investigación traslacional en medicina pulmonar. Farmacia Biomédica. (2023) 165:115079. doi: 10.1016/j.biopha.2023.115079
49. Nantasanti, S , Spee, B , Kruitwagen, HS , Chen, C , Geijsen, N , Oosterhoff, LA, et al. Modelado de enfermedades y terapia génica de la enfermedad por almacenamiento de cobre en organoides hepáticos caninos. Informes de células madre. (2015) 5:895–907. doi: 10.1016/j.stemcr.2015.09.002
50. Kruitwagen, HS , Oosterhoff, LA , van Wolferen, ME , Chen, C , Nantasanti Assawarachan, S , Schneeberger, K, et al. Supervivencia a largo plazo de organoides hepáticos caninos autólogos trasplantados en un modelo canino de enfermedad hepática metabólica deficiente en Commd1. Células. (2020) 9:410. doi: 10.3390/cells9020410
51. Hedwig, SK , Loes, AO , Ingrid, GWHV , Ingrid, MS , EvW, M , Farah, B, et al. Cultivos de organoides hepáticos felinos adultos a largo plazo para la enfermedad Modelado de la esteatosis hepática. Informes de células madre. (2017) 8:822–30. doi: 10.1016/j.stemcr.2017.02.015
52. Maya, WH , Hedwig, SK , Arie, BV , Martín, H , Louis, CP , Martijn, RM, et al. Identificación de posibles fármacos para el tratamiento de la lipidosis hepática en gatos utilizando un sistema organoide hepático felino in vitro. J Veterinario Pasante Med. (2020) 34:132–8. doi: 10.1111/jvim.15670
53. Caswell, JL y Callanan, JJ . La intrigante patología de las enfermedades infecciosas. Veterinario Pathol. (2014) 51:313–4. doi: 10.1177/0300985814521822
54. Zacarías, JF . Capítulo 4 – Mecanismos de las infecciones microbianas1 En: JF Zachary editor. Bases patológicas de las enfermedades veterinarias. 6ª ed. Maryland Heights, MO: Mosby (2017)
55. Dutta, D y Clevers, H . Sistemas de cultivo de organoides para el estudio de las interacciones huésped-patógeno. Curr Opin Immunol. (2017) 48:15–22. doi: 10.1016/j.coi.2017.07.012
56. Tekes, G , Ehmann, R , Boulant, S y Stanifer, ML . Desarrollo de organoides derivados del íleon y el colon felino y su uso potencial para apoyar la infección felina por coronavirus. Células. (2020) 9:2085. doi: 10.3390/cells9092085
57. Larruskain, A y Jugo, BM . Infecciones retrovirales en ovinos y caprinos: lentivirus de pequeños rumiantes e interacción del huésped. Virus. (2013) 5:2043–61. doi: 10.3390/v5082043
58. Kawasaki, M , Goyama, T , Tachibana, Y , Nagao, I y Ambrosini, YM . Modelos de organoides de animales de granja y de compañía en la investigación traslacional: una poderosa herramienta para cerrar la brecha entre ratones y humanos. Front Med Technol. (2022) 4:895379. doi: 10.3389/fmedt.2022.895379
59. Peterson, LW y Artis, D . Células epiteliales intestinales: reguladoras de la función barrera y de la homeostasis inmunitaria. Nat Rev Immunol. (2014) 14:141–53. doi: 10.1038/NRI3608
60. Schneeberger, K , Roth, S , Nieuwenhuis, EES y Middendorp, S . Defectos de polaridad de las células epiteliales intestinales en la enfermedad: lecciones de la enfermedad por inclusión de microvellosidades. Dis Model Mech. (2018) 11:DMM031088. doi: 10.1242/dmm.031088
61. Hamon, M , Bierne, H y Cossart, P . Listeria Monocytogenes: un modelo multifacético. Nat Rev Microbiol. (2006) 4:423–34. doi: 10.1038/nrmicro1413
62. van der Hee, B , Loonen, LMP , Taverne, N , Taverne-Thiele, JJ , Smidt, H y Wells, JM . Procedimientos optimizados para generar un sistema de cultivo 2D mejorado, casi fisiológico, a partir de organoides intestinales porcinos. Células Madre Res. (2018) 28:165–71. doi: 10.1016/j.scr.2018.02.013
63. Beaumont, M , Blanc, F , Cherbuy, C , Egidy, G , Giuffra, E , Lacroix-Lamandé, S, et al. Organoides intestinales en animales de granja. Res. Veterinaria. (2021) 52:33. doi: 10.1186/s13567-021-00909-x
64. Randall, KJ , Turton, J y Foster, JR . Cultivo de explantes de tejido gastrointestinal: una revisión de métodos y aplicaciones. Cell Biol Toxicol. (2011) 27:267–84. doi: 10.1007/s10565-011-9187-5
65. Abrantes, J , van der Loo, W , Le Pendu, J y Esteves, PJ . Enfermedad hemorrágica del conejo (Rhd) y virus de la enfermedad hemorrágica del conejo (Rhdv): una revisión. Res. Veterinaria. (2012) 43:12. doi: 10.1186/1297-9716-43-12
66. Ettayebi, K , Crawford, SE , Murakami, K , Broughman, JR , Karandikar, U , Tenge, VR, et al. Replicación de norovirus humanos en enteroides humanos derivados de células madre. Ciencia. (2016) 353:1387–93. doi: 10.1126/science.aaf5211
67. Stelzer, S , Basso, W , Benavides Silván, J , Ortega-Mora, LM , Maksimov, P , Gethmann, J, et al. Infección por Toxoplasma gondii y toxoplasmosis en animales de granja: factores de riesgo e impacto económico. Parasitol a base de agua de los alimentos. (2019) 15:E00037. doi: 10.1016/j.fawpar.2019.e00037
68. Doyle, diputado y Erickson, MC . Reducir el transporte de patógenos transmitidos por los alimentos en el ganado y las aves de corral. Poult Sci. (2006) 85:960–73. doi: 10.1093/ps/85.6.960
69. Wang, X , Wang, S , Guo, B , Do, Y , Tan, Z , Chang, M, et al. Los organoides epidérmicos primarios humanos permiten modelar las infecciones por dermatofitos. Muerte celular Dis. (2021) 12:35. doi: 10.1038/s41419-020-03330-y
70. Kopper, JJ , Iennarella-Servantez, C , Jergens, AE , Sahoo, DK , Guillot, E , Bourgois-Mochel, A, et al. Aprovechar la biología de los organoides intestinales caninos para mejorar la comprensión de la patogénesis de la enfermedad inflamatoria intestinal y acelerar el descubrimiento de fármacos: un enfoque de una sola salud. Toxicol frontal. (2021):3. doi: 10.3389/ftox.2021.773953
71. Kararli, TT . Comparación de la anatomía gastrointestinal, la fisiología y la bioquímica de los seres humanos y los animales de laboratorio de uso común. Biopharm Drug Dispos. (1995) 16:351–80. doi: 10.1002/bdd.2510160502
72. Cerquetella, M , Spaterna, A , Laus, F , Tesei, B , Rossi, G , Antonelli, E, et al. Enfermedad inflamatoria intestinal en el perro: diferencias y similitudes con los humanos. Mundo J Gastroenterol. (2010) 16:1050–6. doi: 10.3748/wjg.v16.i9.1050
73. Coelho, LP , Kultima, JR , Costea, PI , Fournier, C , Pan, Y , Czarnecki-Maulden, G, et al. Similitud de los microbiomas intestinales del perro y del humano en el contenido de genes y la respuesta a la dieta. Microbioma. (2018) 6:72. doi: 10.1186/s40168-018-0450-3
74. Ambrosini, YM , Parque, Y , Jergens, AE , Shin, W , mín., s , Atherly, T, et al. Recapitulación de la interfaz accesible de organoides intestinales caninos derivados de biopsias para el estudio de las interacciones epitelio-luminales. PLoS Uno. (2020) 15:e0231423. doi: 10.1371/journal.pone.0231423
75. Gabriel, V , Zdyrski, C , Sahoo, DK , Dao, K , Bourgois-Mochel, A , Atherly, T, et al. Organoides intestinales caninos en un sistema de soporte permeable de doble cámara. JoVE. (2022) 181:E63612. doi: 10.3791/63612
76. Gabriel, V , Zdyrski, C , Sahoo, DK , Dao, K , Bourgois-Mochel, A , Kopper, J, et al. Estandarización y mantenimiento de cultivos de organoides caninos hepáticos e intestinales en 3D para su uso en investigación biomédica. J Vis Exp. (2022):31:179. doi: 10.3791/63515
77. Sahoo, DK , Martínez, MN , Dao, K , Gabriel, V , Zdyrski, C , Jergens, AE, et al. Organoides intestinales caninos como un nuevo modelo in vitro de permeabilidad intestinal a fármacos: un estudio de prueba de concepto. Células. (2023) 12:1269. doi: 10.3390/cells12091269
78. Elshafae, SM , Dirksen, WP , Alasonyalilar-Demirer, A , Breitbach, J , Yuan, S , Kantake, N, et al. Línea celular de cáncer de próstata canino (luma) con metástasis ósea osteoblástica. Próstata. (2020) 80:698–714. doi: 10.1002/pros.23983
79. Packeiser, EM , Hewicker-Trautwein, M , Thiemeyer, H , Mohr, A , Junginger, J , Schille, JT, et al. Caracterización de seis líneas celulares de adenocarcinoma de próstata canino y tres líneas celulares de carcinoma de células transicionales derivadas de tejidos tumorales primarios y metástasis. PLoS Uno. (2020) 15:e0230272. doi: 10.1371/journal.pone.0230272
80. Simmons, JK , Dirksen, WP , Hildreth, BE 3º, Dorr, C , Williams, C , Thomas, R, et al. La línea celular de cáncer de próstata canino (Probasco) produce metástasis osteoblásticas in vivo. Próstata. (2014) 74:1251–65. doi: 10.1002/pros.22838
81. Thudi, NK , Shu, ST , Martín, CK , Lanigan, LG , Nadella, MV , Van Bokhoven, A, et al. Desarrollo de una línea celular de cáncer de próstata canino metastásico cerebral. Próstata. (2011) 71:1251–63. doi: 10.1002/pros.21341
82. Richiardone, E , Van den Bossche, V y Corbet, C . Estudios metabólicos en organoides: aplicaciones actuales, oportunidades y desafíos. Organoides. (2022) 1:85–105. doi: 10.3390/organoides1010008
83. Bourdon, G , Cadoret, V , Charpigny, G , Couturier-Tarrade, A , Dalbies-Tran, R , Flores, M-J, et al. Avances y retos en el desarrollo de organoides en especies animales de granja para el estudio de la reproducción y sus aplicaciones a las biotecnologías reproductivas. Res. Veterinaria. (2021) 52:42. DOI: 10.1186/s13567-020-00891-W
84. Mochel, JP , Jergens, AE , Kingsbury, D , Kim, HJ , Martín, MG y Allenspach, K . Células madre intestinales para avanzar en el desarrollo de fármacos, la precisión y la medicina regenerativa: un cambio de paradigma en la investigación traslacional. AAPS J. (2017) 20:17. doi: 10.1208/s12248-017-0178-1
85. Zhou, Z , Cong, L y Cong, X . Organoides derivados del paciente en medicina de precisión: cribado de fármacos, organoide en un chip y biobanco de organoides vivos. Frente Oncol. (2021):11:762184. doi: 10.3389/fonc.2021.762184
86. Pluma, LC y van den Boom, R . Tecnología de organoides de animales de compañía para avanzar en la medicina regenerativa veterinaria. Front Vet Sci. (2023) 10:1032835. doi: 10.3389/fvets.2023.1032835
87. Bedos, L , Wickham, H , Gabriel, V , Zdyrski, C , Allbaugh, RA , Sahoo, DK, et al. Cultivo y caracterización de organoides epiteliales corneales caninos y felinos: una nueva herramienta para el estudio y tratamiento de las enfermedades corneales. Front Vet Sci. (2022) 9:1050467. doi: 10.3389/fvets.2022.1050467
88. Prasad, M , Kumar, R , Buragohain, L , Kumari, A y Ghosh, M . Tecnología de organoides: una herramienta fiable de biología del desarrollo para la evaluación de la nanotoxicidad específica de órganos. Front Cell Dev Biol. (2021):9:696668. doi: 10.3389/fcell.2021.696668
89. Acharya, M , Arsi, K , Donoghue, AM , Liyanage, R y Rath, Carolina del Norte . Producción y caracterización de enteroides de criptas-vellosidades aviares y el efecto de los productos químicos. BMC Vet Res. (2020) 16:179. doi: 10.1186/s12917-020-02397-1
90. Schaefer, K , Rensing, S , Hillen, H , Burkhardt, JE y Germann, PG . ¿Es la ciencia el único impulsor en la selección de especies? Un estudio interno para evaluar los requerimientos de compuestos en el minicerdo en comparación con el perro en estudios preclínicos. Toxicol Pathol. (2016) 44:474–9. doi: 10.1177/0192623315624572
91. Olayanju, A , Jones, L , Greco, K , Anillo de oro, CE y Ansari, T . Aplicación de unidades de organoides gastrointestinales porcinos como una potencial herramienta in vitro para el descubrimiento y desarrollo de fármacos. J Appl Toxicol. (2019) 39:4–15. doi: 10.1002/jat.3641
92. Hirata, E y Sahai, E . Microambiente tumoral y respuestas diferenciales al tratamiento. Cold Spring Harb Perspect Med. (2017) 7:A026781. doi: 10.1101/cshperspect.a026781
93. Parque, SE , Georgescu, A , y Huh, D . Organoides en un chip. Ciencia. (2019) 364:960–5. doi: 10.1126/science.aaw7894
94. Cantado, JH , Wang, YI , Narasimhan Sriram, N , Jackson, M , Largo, C , Hickman, JJ, et al. Avances recientes en sistemas body-on-a-chip. Química anal. (2019) 91:330–51. doi: 10.1021/acs.analchem.8b05293
95. Kim, J , Koo, BK y Knoblich, J.A. . Organoides humanos: modelos de Sistemas para la Biología y la Medicina Humana. Nat Rev Mol Cell Biol. (2020) 21:571–84. doi: 10.1038/s41580-020-0259-3
96. Zhao, Z , Chen, X , Dowbaj, AM , Sljukic, A , Bratlie, K , Lin, L, et al. Organoides. Imprimaciones de métodos Nat Rev. (2022) 2:94. doi: 10.1038/s43586-022-00174-y
97. Csukovich, G , Pratscher, B y Burgener, IA . El mundo de los organoides: modelización de enfermedades gastrointestinales a los 3 años y una salud con especial relevancia para perros y gatos. Animales. (2022) 12:2461:10.3390/ani12182461.
98. Arora, T , Mehta, A , Joshi, V , Mehta, K , Ratón, N , Mediratta, P, et al. Sustitución de animales en la investigación de fármacos: una aproximación hacia el cumplimiento de las 4r. Indian J Pharm Sci. (2011) 73:1. doi: 10.4103/0250-474X.89750
99. Destoumieux-Garzón, D , Mavingui, P , Boetsch, G , Boissier, J , Darriet, F , Duboz, P, et al. El concepto de una sola salud: 10 años y un largo camino por delante. Front Vet Sci. (2018):5:14. doi: 10.3389/fvets.2018.00014
Palabras clave: organoides, modelización de enfermedades, modelo in vitro, enfermedad veterinaria, enfermedad infecciosa, cáncer, enfermedad metabólica, enfermedad inflamatoria
Cita: Chen B, Slocombe RF y Georgy SR (2023) Avances en la tecnología de organoides para el modelado de enfermedades veterinarias. Frente. Vet. Sci. 10:1234628. doi: 10.3389/fvets.2023.1234628
Recibido: 05 de junio de 2023; Aceptado: 04 de octubre de 2023;
Publicado: 18 octubre 2023.
Editado por:
Francisco Javier Salguero, Agencia de Seguridad Sanitaria del Reino Unido (UKHSA), Reino Unido
Revisado por:
Rajesh Kumar, Universidad Lala Lajpat Rai de Ciencias Veterinarias y Animales, India
Jonathan Paul Mochel, Universidad de Georgia, Estados Unidos Dipak Kumar Sahoo, Universidad Estatal de Iowa, Estados
Unidos Ambre Chapuis, Universidad de Edimburgo, Reino Unido
Derechos de autor © 2023 Chen, Slocombe y Georgy. Este es un artículo de acceso abierto distribuido bajo los términos de la Licencia Creative Commons Attribution License (CC BY).
*Correspondencia: Smitha Rose Georgy, s.georgy@unimelb.edu.au
Renuncia: Todas las afirmaciones expresadas en este artículo son únicamente las de los autores y no representan necesariamente las de sus organizaciones afiliadas, ni las del editor, los editores y los revisores. Cualquier producto que pueda ser evaluado en este artículo o afirmación que pueda hacer su fabricante no está garantizado ni respaldado por el editor.
Date de alta y recibe nuestro 👉🏼 Diario Digital AXÓN INFORMAVET ONE HEALTH
Date de alta y recibe nuestro 👉🏼 Boletín Digital de Foro Agro Ganadero
Noticias animales de compañía
Noticias animales de producción
Trabajos técnicos animales de producción
Trabajos técnicos animales de compañía