La melatonina mejora la vitrificación de las mórdulas de oveja
La melatonina mejora la vitrificación de las mórdulas de oveja mediante la modulación del transcriptoma
 Pengyun Ji1,2†
Pengyun Ji1,2†  Yunjie Liu2†
Yunjie Liu2†  Laiqing Yan2
Laiqing Yan2  Yanquan Jia3
Yanquan Jia3  Mengmeng Zhao2
Mengmeng Zhao2  Dongying Lv2
Dongying Lv2  Yujun Yao2
Yujun Yao2  Wenkui Ma1,2
Wenkui Ma1,2  Depeng Yin2
Depeng Yin2  Fenze Liu4
Fenze Liu4  Shuai Gao2
Shuai Gao2  Abulizi Wusiman1
Abulizi Wusiman1  Kailun Yang1
Kailun Yang1  Lu Zhang2*
Lu Zhang2*  Guoshi Liu2*
Guoshi Liu2*- 1Facultad de Ciencia Animal, Universidad Agrícola de Xinjiang, Urumqi, China
- 2Laboratorio Nacional de Ingeniería para la Cría de Animales, Facultad de Ciencia y Tecnología Animal, Universidad Agrícola de China, Beijing, China
- 3Hospital Jiaen de Pekín, Pekín, China
- 4Mongolia Interior Golden Grassland Ecological Technology Group Co., Ltd., Mongolia Interior, China
La tecnología de vitrificación de embriones se utiliza ampliamente en la producción ganadera, pero las lesiones por congelación han sido un factor clave que obstaculiza la eficiencia de la producción de embriones. Existe una necesidad urgente de analizar más a fondo el mecanismo molecular del daño embrionario por el proceso de vitrificación. En el estudio, se recolectaron mórulas de cuernos uterinos de ovejas Hu después de la superovulación y la transfusión de esperma. Las mórulas fueron vitrificadas y calentadas con Cryotop. Nueve mórulas estaban en el grupo control vitrificado (congelado), y siete mórulas fueron vitrificadas y calentadas con 10−5 M melatonina (melatonina). Se utilizaron once mórulas no congeladas como controles (frescas). Después del calentamiento, cada embrión se secuenció por separado para la construcción de la biblioteca y el análisis de la expresión génica. p < 0,05 se utilizó para diferenciar los genes expresados diferencialmente (DEG). Los resultados mostraron que los genes diferenciados expresados diferencialmente (DEG) en las mórulas vitrificadas estaban principalmente enriquecidos en la actividad de la proteína quinasa, los procesos de adhesión, las vías de señalización del calcio y las vías de señalización Wnt, PI3K/AKT, Ras, ErbB y MAPK en comparación con los controles. Es importante destacar que el tratamiento con melatonina aumentó la expresión de vías clave que aumentan la resistencia de las mórulas contra el daño inducido por la vitrificación. Estas vías incluyen la vía de la actividad de la quinasa, ErbB y la vía de señalización PI3K/Akt. Vale la pena mencionar que la melatonina regula al alza la expresión de XPA, que es un factor de transcripción clave para la reparación del ADN. En conclusión, la vitrificación afectó el transcriptoma de las mórulas de oveja Hu derivadas in vivo, y la melatonina tuvo un efecto protector sobre el proceso de vitrificación. Por primera vez, se analizaron los perfiles transcriptomas causados por la vitrificación y la melatonina en mórdulas de ovejas a nivel de embrión único. Estos datos obtenidos a nivel de embrión único proporcionan un importante mecanismo molecular para optimizar aún más la criopreservación de embriones u otras células.
1. Introducción
La criopreservación se utiliza ampliamente para la preservación de embriones y se ha convertido en una rutina de la industria comercial de transferencia de embriones (1). En la actualidad, existen dos técnicas básicas que se utilizan para la criopreservación celular. es decir, la congelación controlada a baja velocidad y la vitrificación. En comparación con la congelación lenta, la criopreservación de vitrificación no requiere un costoso congelador biológico y el método es simple y eficiente. Además, la vitrificación no produce cristales de hielo, pero posiblemente reduce la formación de cristales de hielo, y tiene menos lesiones asociadas al frío al aumentar la temperatura y la velocidad de transferencia (2). Por lo tanto, las tasas de supervivencia de las mórdulas y blastocistos ovinos conservados en vitrificación derivadas tanto in vivo como in vitro fueron significativamente superiores a las de los embriones criopreservados con técnicas de congelación lenta (la tasa de supervivencia embrionaria in vivo para la congelación lenta es del 45,6% y la de la vitrificación es del 67,1%). La tasa de supervivencia embrionaria in vitro para la congelación lenta es del 7,3% y la de la vitrificación del 38,7% (3-5). Como resultado, la criopreservación por vitrificación se convierte en el método dominante para preservar los embriones de animales domésticos. Sin embargo, el proceso de vitrificación aún puede causar daño al embrión, lo que resulta en la pérdida de embriones y un desarrollo fetal anormal. Mecánicamente, el proceso de vitrificación provoca algunos cambios ultraestructurales en el embrión (6), lo que reduce la calidad del embrión al alterar la expresión génica y aumentar el nivel de apoptosis y daña la proteína quinasa activada por mitógenos (MAPK), una enzima esencial para el desarrollo embrionario (7). Se sugirió que la clave para mejorar la eficiencia de la vitrificación es reducir el volumen del crioprotector y aumentar la velocidad de enfriamiento (8, 9). Así, se colocó una cantidad muy pequeña (<0,01 mL) de solución de vitrificación en la punta de una banda delgada de polipropileno para preservar los embriones e inmediatamente sumergirlos en nitrógeno líquido (10). Este proceso de vitrificación modificado se conoce como método Cryotop. La pequeña cantidad de medio de vitrificación alrededor de los embriones les permite pasar rápidamente la zona crítica de temperatura. Diferentes procesos de vitrificación afectan la eficiencia de la criopreservación. Por ejemplo, los ovocitos bovinos conservados con el método Cryotop tuvieron tasas de blastocisto más altas en comparación con el procedimiento tradicional OPS (Open pulled straw) (11). La velocidad de enfriamiento de la vitrificación con Cryotop es similar a la de la vitrificación con OPS, pero la velocidad de calentamiento de Cryotop (aproximadamente 48.000 °C/min) es mucho mayor que la de OPS (aproximadamente 14.000 °C/min) (12). Esta diferencia puede explicar la mayor eficiencia del método Cryotop.
Durante el proceso de vitrificación, los embriones que forman un estado vítreo altamente viscoso se comportan como un sólido, evitando la cristalización que causa daño embrionario (13), pero el efecto secundario del crioprotector también puede causar lesiones embrionarias (14). Así, muchos estudios han intentado optimizar el proceso de vitrificación embrionaria ajustando la concentración de agentes crioprotectores (CPA) o los componentes de la solución de vitrificación (15, 16). Uno de los nuevos CPA es la melatonina. La melatonina (N-acetil-5-metoxitriptófano, MT) es un derivado del triptófano. Es un potente antioxidante y eliminador de radicales libres (17). La MT y sus metabolitos no solo actúan como eliminadores directos de radicales libres, sino que también pueden regular al alza la expresión génica de enzimas antioxidantes como la catalasa, la glutatión peroxidasa y la superóxido dismutasa (18). Además, la melatonina tiene una amplia gama de funciones fisiológicas, que incluyen actividades antiinflamatorias, antiapoptóticas, antienvejecimiento, mejora inmunológica, promoción del sueño y modulación reproductiva (19). En los últimos años, los efectos de la melatonina en el desarrollo embrionario han sido ampliamente estudiados (20). La suplementación con melatonina mejoró la calidad del desarrollo de ovocitos y embriones. Los efectos de la melatonina en la criopreservación también son un tema candente de investigación. Una variedad de estudios han demostrado que la melatonina añadida a los medios de vitrificación mejora la calidad de los ovocitos de vitrificación/calentamiento y su posterior desarrollo al suprimir el estrés oxidativo en humanos (21, 22), vacas (23) y ratones (24). Se han sugerido varios mecanismos protectores de la melatonina durante la criopreservación. Sin embargo, la mayoría de estos estudios están relacionados con la expresión génica en embriones vitrificados después de la suplementación con melatonina y se basan en datos de análisis de micromatrices (25-27) o ARN-Seq a granel (28, 29). Estos análisis proporcionan información limitada sobre los mecanismos protectores de la melatonina.
En el presente estudio, se utilizará un enfoque avanzado de transcriptómica de un solo embrión para analizar las alteraciones moleculares inducidas por el procedimiento de vitrificación Cryotop. Este método puede determinar las alteraciones de la expresión génica embrionaria específicas del proceso durante la vitrificación para confirmar el papel protector de la melatonina. De acuerdo con el protocolo de ovulación múltiple y transferencia de embriones (MOET) existente en el laboratorio, la melatonina se agregará al medio de cultivo de vitrificación Cryotop en congelación/tibio, y mórulas de ovejas no congeladas. Los datos obtenidos en este estudio proporcionarán nuevos conocimientos sobre las alteraciones del transcriptoma inducidas por la vitrificación y la melatonina y nos permitirán comprender mejor el desarrollo del embrión después de la vitrificación y mejorar aún más este proceso.
2. Materiales y métodos
2.1. Productos químicos
A menos que se indique lo contrario, los productos químicos se compraron a Sigma-Aldrich (St. Louis, MO, Estados Unidos). Los dispositivos Cryotop fueron adquiridos a Ingamed (Maringá, Paraná, Brasil). La hormona estimulante del folículo (FSH), la gonadotropina sérica de yegua preñada (PMSG) y la prostaglandina (PG) se compraron a Sansheng Biological Technology (Ningbo, China); EAZI-BREED-CIDR y el medio de tenencia se compraron a Zoetis (Nueva Jersey, Estados Unidos).
2.2. Diseño experimental
Se recolectaron embriones vitrificados in vivo y RNA-Seq: mórulas de los cuernos uterinos de 9 ovejas Hu y se dividieron aleatoriamente en tres grupos, es decir, 11 en el grupo fresco (sin vitrificación), nueve en el grupo congelado (vitrificación) y siete en el grupo de melatonina (melatonina, 10−5 M melatonina añadida a la solución de vitrificación y calentamiento). Las mórulas se vitrificaron y calentaron, y los embriones calentados se transfirieron a una solución de retención y se recuperaron a 38,5 °C, 5% de CO2 incubadora durante 0,5 h. Los embriones individuales se recolectaron para la amplificación del genoma y se secuenciaron para analizar los genes expresados diferencialmente.
Embrión vitrificado in vitro y qPCR: se extrajeron ovarios de oveja del matadero, se recogieron AOC, madurados in vitro, y se recogieron mórulas el día 6 después de la fecundación in vitro, divididas aleatoriamente en tres grupos, consultar el párrafo anterior para la agrupación y manipulación de embriones. Los embriones individuales recolectados se sometieron a RT-qPCR después de la amplificación genómica para verificar la expresión de genes diferenciales analizados por datos de RNA-Seq embrionario in vivo.
2.3. Sincronización de la superovulación y la recogida de embriones
Se eligieron ovejas de 2,5 a 3 años de edad como donantes, se utilizó el procedimiento CIDR + FSH + PMSG para la superovulación (30). Las ovejas fueron tratadas mediante la inserción de un CIDR (contenido de progesterona: 0,3 g/cápsula; Pharmacia & Upjohn Pty Ltd., Rydalmere, Nueva Gales del Sur, Australia) en la vagina y con inyección intramuscular de vitamina AD 3-5 mL al mismo tiempo. Diez días después de la inserción de CIDR, la FSH (Ovagen; Immuno-Chemical Products Ltd., Auckland, Nueva Zelanda) (300-500 UI por donante, según el peso corporal y los tiempos de operación para ajustar las dosis) cada 12 h. Después de la séptima inyección, se retiró el CIDR. La PMSG se inyectó 12 h después de la retirada del CIDR. La PMSG se inyectó a una dosis de 330-450 UI por donante. Se realizó inseminación artificial endoscópica en las ovejas donantes 48-54 h después de la extracción del CIDR. De 5 a 6 días después de la inseminación, los embriones se recuperaron mediante lavado quirúrgico de los cuernos uterinos. Los embriones fueron recolectados bajo un microscopio estereoscópico. Se registraron el estado, el color, el tamaño, el número, la plenitud y las etapas de desarrollo. Los embriones fueron recolectados quirúrgicamente por laparotomía bajo anestesia general al sexto día después del primer apareamiento. Cada cuerno uterino se enjuagó con 20 mL de solución salina tamponada con fosfato (PBS) precalentada que contenía 3 mg/mL de albúmina sérica bovina (BSA). Los embriones se colocaron inmediatamente en una solución de retención (Immuno-Chemical Products Ltd.). Se evaluó la morfología de los embriones y se utilizaron buenas mórulas para la congelación. Las muestras se procesaron en grupos de referencia al protocolo de la sección 3.
2.4. Recogida de embriones in vitro
Los ovarios de oveja se recogieron de un matadero local en un plazo de 3 h, se sumergieron en solución salina estéril a 25-30 °C que contenía penicilina (100 UI/ml) y estreptomicina (100 UI/ml), y se transportaron inmediatamente al laboratorio. Los AOC se recolectaron cortando los folículos ováricos con una cuchilla de afeitar en una placa de cultivo de 90 mm de diámetro. Para el estudio se seleccionaron AOC con citoplasma homogéneo y cúmulos intactos. Se utilizó como medio basal el medio de cultivo tisular 199 (TCM-199) suplementado con piruvato de sodio (2,5 mM), L-glutamina (1,0 mM), penicilina (100 UI/mL), estreptomicina (100 UI/mL), suero fetal bovino al 15% y cisteamina (0,1 mM). El medio basal adicionado 100 ng/mL de EGF, 10 μg/mL de FSH, 10 μg/mL de LH y 1 μg/mL de estradiol-17( se utilizó como solución de maduración (IVM). Los AOC se cultivaron con medio IVM a 38,5 °C con 5% de CO2 durante 24 h. El semen congelado del carnero calentado se utilizó para la FIV. A continuación, los espermatozoides y los ovocitos maduros se incubaron juntos en líquido de oviducto sintético (SOF) durante 18 h a 38,5 °C, 5% CO2. El SOF suplementado con 1 mM de glutamina, 8 mg/mL de BSA libre de ácidos grasos, 1% (v/v) de aminoácidos esenciales Basel Medium Eagle (BME) y 1% (v/v) de aminoácidos no esenciales Minimum Essential Medium (MEM) se utilizaron como solución de desarrollo embrionario. Luego, los cigotos se cultivaron en solución de desarrollo embrionario a 38,5 °C con 5% de CO2, 5% O2y 90% N2. Después de 6 días de incubación, las mórulas fueron procesadas en grupos de acuerdo con el protocolo de la sección 3. Los embriones individuales se transfirieron al tampón de lisis celular bajo un microscopio estereoscópico. Posteriormente, se realizó transcripción inversa para sintetizar el ADNc de segunda cadena, su amplificación se realizó mediante 16 ciclos de PCR con cebadores 3’P2 e IS.
2.5. Los procesos de vitrificación y calentamiento de embriones
Soluciones de vitrificación: la solución de pretratamiento contenía un 10 % de etilenglicol (EG) en medio DPBS, y la solución de vitrificación (EFS35) contenía un 35 % de EG (v/v), un 30 % de Ficoll (p/v) y 0,5 M de sacarosa en medio DPBS. Los embriones se incubaron en medio ES al 10% durante 30 s a temperatura ambiente y se transfirieron a una solución EFS35 durante 25 s. A continuación, los embriones se transfirieron a las pajuelas del sistema Cryotop (Kitazato BioPharma Co. Ltd., Shizuoka, Japón) con un volumen mínimo de líquido de congelación que solo se envolvía alrededor de los embriones. El embrión que contenía Cryotop se sumergió inmediatamente en nitrógeno líquido. Para el calentamiento de los embriones, las pajuelas criopreservadas de Cryotop se sumergieron inmediatamente en una solución de sacarosa 0,5 M a 37 °C. Al fin y al cabo, los embriones se desprendieron de las pajuelas Cryotop. Los embriones se colocaron en solución de sacarosa durante 5 min, se lavaron en solución de retención tres veces y luego se cultivaron en CO al 5%2 durante media hora para la recuperación. Para el estudio solo se utilizaron embriones de buena calidad.
2.6. Secuenciación del transcriptoma de un solo embrión
Las bibliotecas de secuenciación de ARN de una sola célula se prepararon utilizando un protocolo experimental basado en la tecnología de secuenciación de transcriptómica de una sola célula. Las muestras in vivo se trataron con una solución ácida de Tyrode para eliminar la zona pelúcida. Las mórulas se transfirieron a 2 μL de tampón lisado bajo un microscopio mediante pipeteo. La transcripción inversa se realizó mediante PCR para sintetizar ADNc de segunda cadena. Los cebadores P3 de 2′ y los cebadores IS se utilizaron para amplificar el producto con 16 ciclos de PCR. Posteriormente, los 96 productos diferentes de preamplificación de PCR de un solo embrión etiquetados con códigos de barras se agruparon y purificaron utilizando perlas magnéticas AMPure XP. A continuación, se realizó la amplificación por PCR con 40 ng de cebadores de ADN e IS. El ADNc amplificado se rompió en fragmentos de aproximadamente 300 pb utilizando Covaris S2. A continuación, los fragmentos de ADN se enriquecieron mediante incubación con perlas magnéticas de estreptavidina C1 (Thermo Fisher) durante 1 h. Por último, se construyeron bibliotecas utilizando el KAPA Hyper Pre Kit (KAPA Biosystems). Todos los datos de secuenciación de ARN de una sola célula se generaron en la plataforma Illumina HiSeq4000 para lecturas de extremos emparejados de 150 pb.
2.7. Análisis de datos de RNA-Seq de un solo embrión
Sobre la base de las etiquetas de código de barras originales para cada morula in vivo individual, se dividieron los datos de secuenciación del extremo R2. Estos datos divididos del extremo R2 se utilizaron para clasificar los datos del extremo R1. Los datos del extremo R1 se procesaron con la adición de información UMI y la eliminación de secuencias de TSO poliA, y luego las secuencias de ARNm se compararon con el genoma de la oveja (oviAri4) de la base de datos UCSC como secuencia de referencia utilizando HISAT2 (31). Los archivos bam resultantes de la comparación se analizaron para el recuento de transcripciones mediante el software HTSeq (32). Los criterios primarios de detección de control de calidad fueron la expresión de genes con un recuento superior a 500, la expresión génica total con un recuento superior a 1.000 y una tasa de alineación superior al 20 %. Los datos primarios calificados se examinaron nuevamente seleccionando los datos que tenían <0,4 genes mitocondriales expresados. Para los resultados finales de la secuenciación del control de calidad, se llevó a cabo el desescalamiento de PCA y tSNE y el agrupamiento de tipos celulares con el paquete Seurat (33) en R para identificar genes expresados diferencialmente (DEGs). p < 0,05 se consideró estadísticamente significativo. Se realizaron análisis de enriquecimiento de la ontología genética (GO) y de la Enciclopedia de Genes y Genomas de Kioto (KEGG) en función de los genes expresados diferencialmente. Para obtener información sobre las funciones biológicas de la sobrerrepresentación, la herramienta Metascape1 (34). El análisis de GSEA se realizó mediante el paquete de R clusterProfiler (35). Se utilizó la inferencia virtual de la actividad de las proteínas mediante el análisis de regulones enriquecidos (VIPER) para inferir la actividad del regulador. Se llevó a cabo el algoritmo ARACNE para construir TRNs e identificar algunos MRs con DEGs a partir de comparaciones (36, 37). Los reguladores con p < 0.05 se inferieron como factores impulsores en cada dos etapas consecutivas.
2.8. RT-qPCR
La RT-qPCR se implementó con el ChamQ Universal SYBR qPCR Master Mix (Vazyme, China) utilizando el sistema CFX96TM Real-Time (Bio-Rad, Estados Unidos). Las muestras se obtuvieron de los embriones in vitro descritos en la sección 2.4. Los pares de cebadores incluyeron HIF1A, 5′-GACCCTGCACTCAACCAAGA-3′ (adelante), 5′-TGGGACTGTTAGGCTCAGGT-3′ (reverso); PARP1, 5′-CGTGGACATCGTCAAAGGG-3′ (adelante), 5′-TGTTACTACCAATCACCGTGCC-3′ (reverso); PRKDC, 5′-TCTACACGGTCGCCACTCATT-3′ (adelante), 5′-TTTCTGACTCTTTGGACCTACGC-3′ (reverso); BTG2, 5′-CTGGAGGAGAACTGGCTGTC-3′ (adelante), 5′-AAAACAATGCCCAAGGTCTG-3′ (reverso); ACTB, 5′-GTCACCAACTGGGACGACAT-3′ (adelante), 5′-CATCTTCTCACGGTTGGCCT-3′ (reverso); y la expresión de β-actina se utilizó como un gen de mantenimiento para normalizar los datos. La expresión relativa se cuantificó mediante el 2−ΔΔCt El método y los datos se expresaron utilizando la media ± SEM.
2.9. Análisis de datos
Todos los datos se analizaron mediante ANOVA de una vía mediante comparaciones post hoc de Tukey para determinar las diferencias. Se utilizó el software de GraphPad Prism 7.0. P < 0,05 se consideró estadísticamente significativo.
3. Resultados
3.1. Perfil transcriptoma de la mórula de oveja vitrificada
A través del procesamiento y normalización de los datos, se utilizaron un total de 27 células cualificadas para su posterior análisis. Los datos normalizados de conteo de lectura de los gráficos de escalamiento multidimensional Análisis de Componentes Principales (PCA) y Aproximación y Proyección de Colectores Uniformes (UMAP), revelaron los mapeos distribuidos espacialmente de las células frescas, congeladas y congeladas más melatonina (Figuras 1A-D). PC_1 y UMAP_1 mostraron la clara separación de las células congeladas y frescas, sin embargo, estas separaciones no fueron obvias entre las células congeladas y congeladas más melatonina. El umbral de restricción de las diferencias fue un valor de p < 0,05 y los criterios de corte para los DEG se modificaron en la expresión < −1,5 y > 1,5 veces. Se identificó un total de 569 DEG en el grupo congelado en comparación con el grupo fresco, y la Figura 1E reveló la distribución de DEG en diferentes valores de cambio de plegamiento. Más específicamente, como se muestra en el mapa de calor (Figura 1F), 433 genes estaban regulados al alza (Tabla Suplementaria S1), mientras que 136 estaban regulados a la baja (Tabla Suplementaria S2).
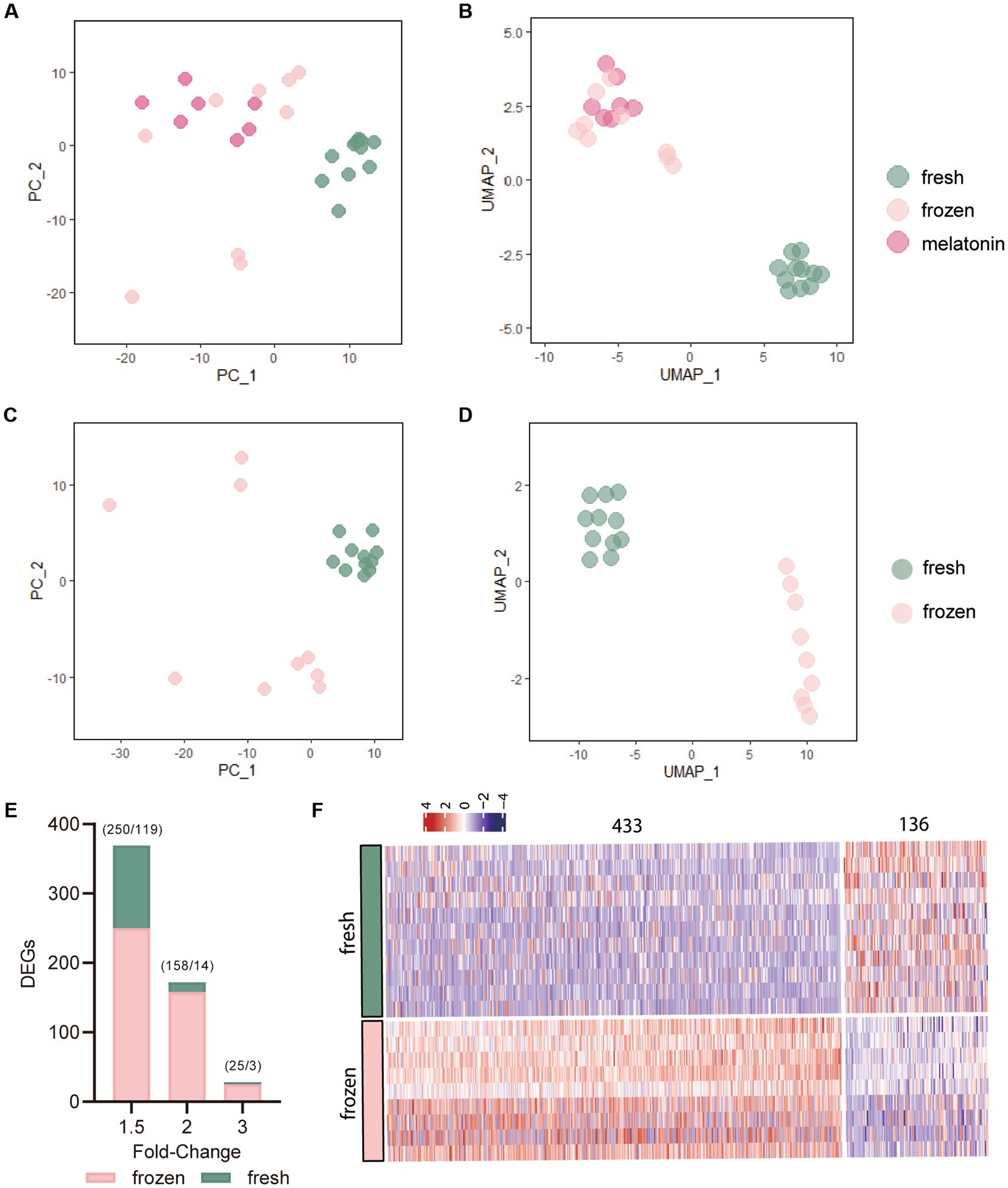 Figura 1. Los efectos de la vitrificación sobre la expresión génica de la mórula. (A,B) Gráficos de Análisis de Componentes Principales (PCA) y Aproximación y Proyección de Variedades Uniformes (UMAP) de los niveles de expresión de 800 genes significativamente diferenciados. Cada punto representa una sola muestra de mórula. Los colores denotan el grupo fresco (verde), el grupo congelado (rosa) y el grupo congelado más melatonina (fushcia). (C,D) Gráficos de PCA y UMAP de los 800 genes en muestras de mórula frescas y congeladas en función de los niveles de expresión más variables en el conjunto de datos. (E) Número de genes expresados diferencialmente (DEGs) en mórulas calentadas vitrificadas en comparación con los embriones de control frescos. Los DEG se identificaron a partir del análisis del transcriptoma utilizando diferentes valores de cambio de pliegue (1,5, 2 y 3) y un valor de p de 0,05. Los números entre paréntesis indican el número de DEG regulados al alza y a la baja. (F) Mapa de calor de todos los genes expresados diferencialmente (DEGs) en controles congelados por vitrificación frente a controles frescos. Las columnas indican DEGs (p < 0,05) y las filas indican muestras de embriones congelados o de control por vitrificación. Las claves de color de azul a rojo indican la expresión relativa de los genes de menor a mayor, respectivamente.
Figura 1. Los efectos de la vitrificación sobre la expresión génica de la mórula. (A,B) Gráficos de Análisis de Componentes Principales (PCA) y Aproximación y Proyección de Variedades Uniformes (UMAP) de los niveles de expresión de 800 genes significativamente diferenciados. Cada punto representa una sola muestra de mórula. Los colores denotan el grupo fresco (verde), el grupo congelado (rosa) y el grupo congelado más melatonina (fushcia). (C,D) Gráficos de PCA y UMAP de los 800 genes en muestras de mórula frescas y congeladas en función de los niveles de expresión más variables en el conjunto de datos. (E) Número de genes expresados diferencialmente (DEGs) en mórulas calentadas vitrificadas en comparación con los embriones de control frescos. Los DEG se identificaron a partir del análisis del transcriptoma utilizando diferentes valores de cambio de pliegue (1,5, 2 y 3) y un valor de p de 0,05. Los números entre paréntesis indican el número de DEG regulados al alza y a la baja. (F) Mapa de calor de todos los genes expresados diferencialmente (DEGs) en controles congelados por vitrificación frente a controles frescos. Las columnas indican DEGs (p < 0,05) y las filas indican muestras de embriones congelados o de control por vitrificación. Las claves de color de azul a rojo indican la expresión relativa de los genes de menor a mayor, respectivamente.
Se utilizó la R y la herramienta Metscape para identificar las alteraciones del transcriptoma embrionario causadas por la vitrificación. Los términos y vías de expresión entre la vitrificación y las comparaciones intergrupales frescas fueron analizados por GO a través de la base de datos de anotaciones funcionales de la herramienta Metascape (Tabla Suplementaria S3). La Figura 2A muestra los 20 grupos principales de los términos GO proceso biológico (BP) y función molecular (MF). Los genes alterados en el grupo de vitrificación vs. fresco se asociaron con regulaciones de la señalización típica de Wnt, la señalización de MAPK, la señalización de PI3K/AKT y las vías de la proteína quinasa. La red reguladora del proceso BP representada por Cytoscape se ilustró en la Figura 2B.
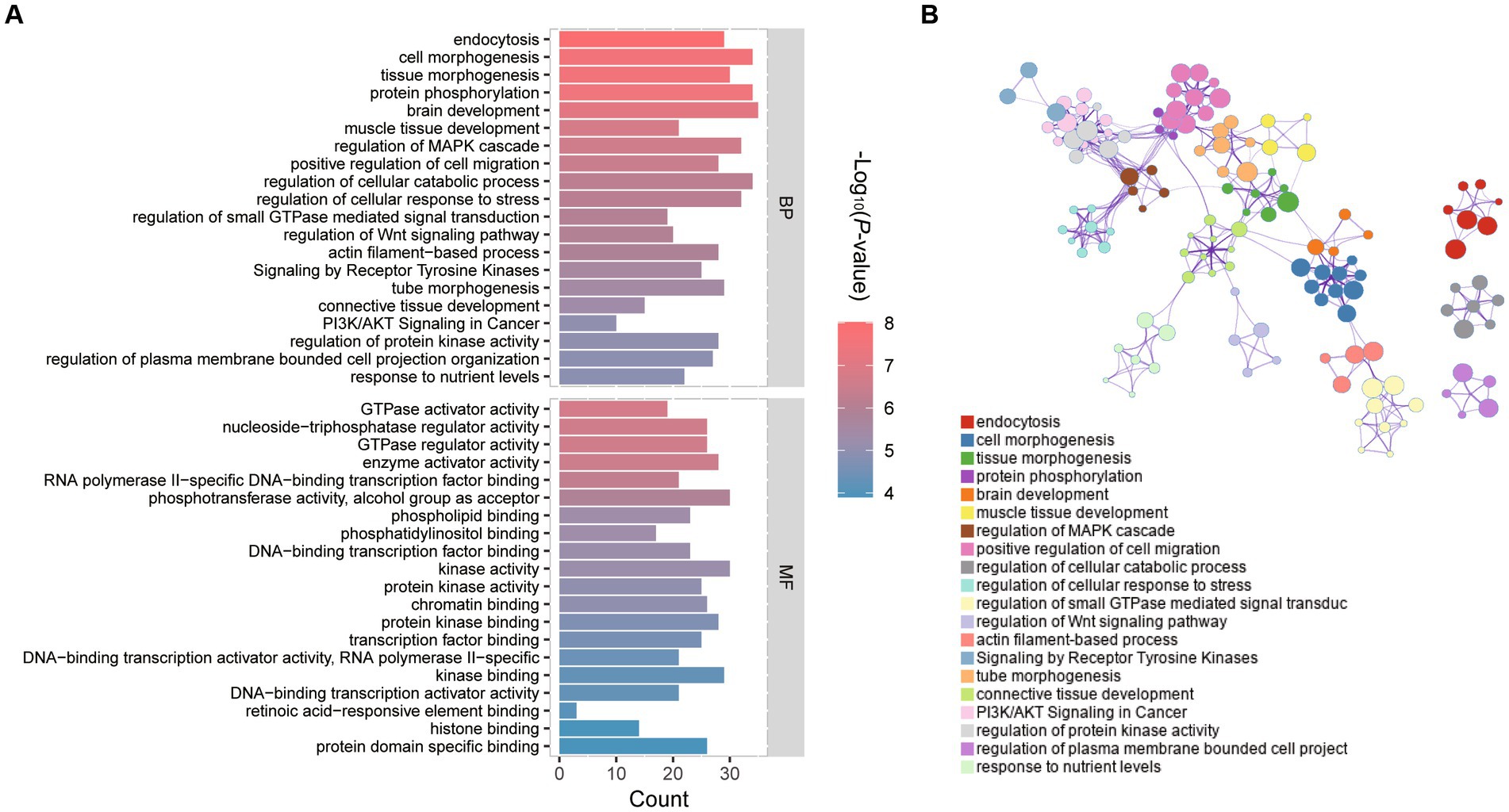 Figura 2. Análisis de enriquecimiento funcional GO de genes expresados diferencialmente (DEGs) en vitrificación vs. mórula fresca. (A) análisis GO de genes expresados diferencialmente (DEGs); Las coordenadas horizontales indican el número de DEG en cada entrada. (B) Red de términos enriquecidos coloreados por la identidad del clúster, donde los nodos que comparten la misma identidad del clúster suelen estar cerca unos de otros.
Figura 2. Análisis de enriquecimiento funcional GO de genes expresados diferencialmente (DEGs) en vitrificación vs. mórula fresca. (A) análisis GO de genes expresados diferencialmente (DEGs); Las coordenadas horizontales indican el número de DEG en cada entrada. (B) Red de términos enriquecidos coloreados por la identidad del clúster, donde los nodos que comparten la misma identidad del clúster suelen estar cerca unos de otros.
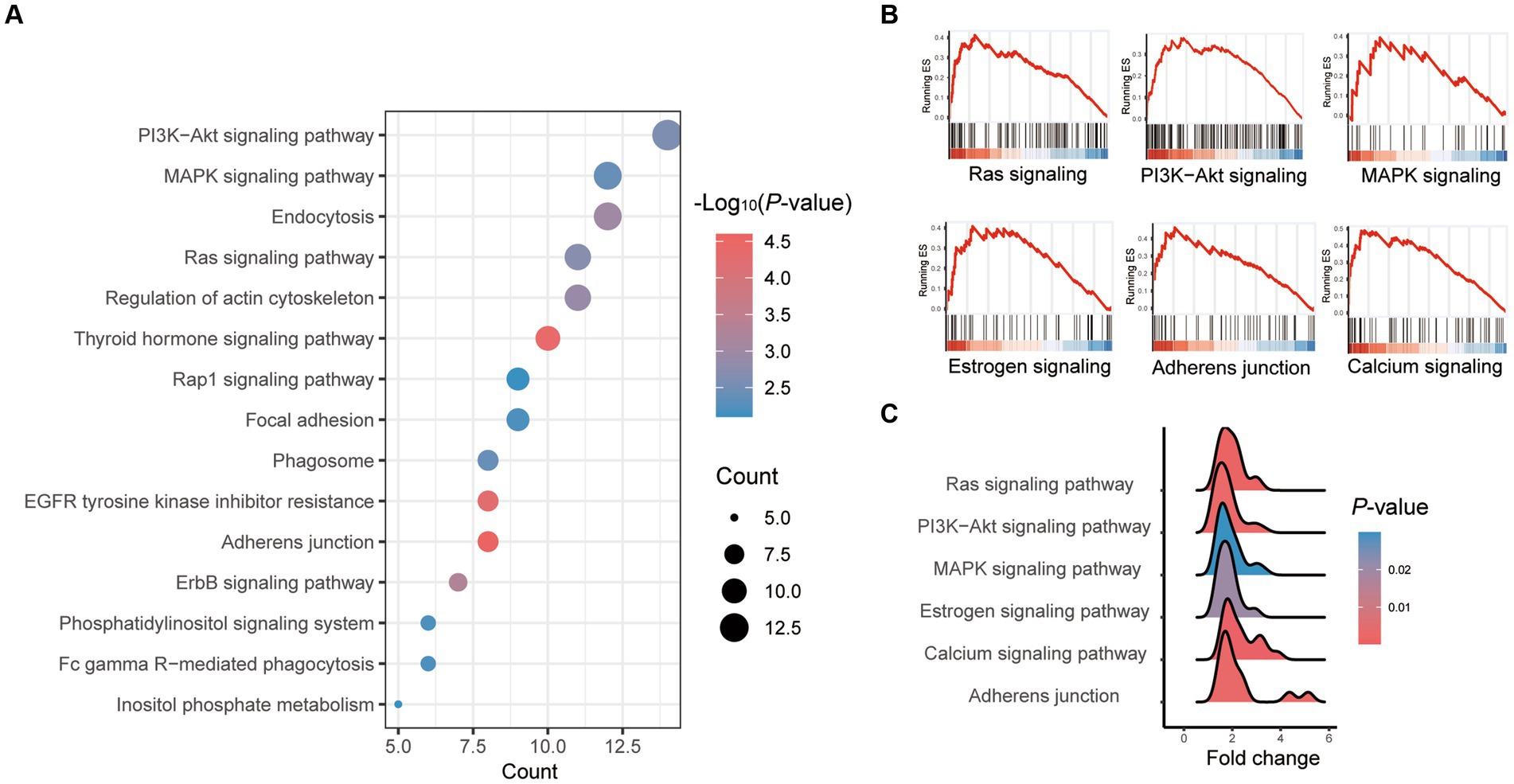
La vía KEGG más enriquecida entre todos los genes significativamente diferenciales entre la vitrificación y la mórula fresca fue el «proceso de adhesión», y la vía más enriquecida fue la «vía de señalización PI3K-Akt» (Tabla suplementaria S4; Figura 3A). Los cambios generales en el conjunto de genes durante el proceso de vitrificación analizado por GSEA se mostraron en la Figura 3B. La vitrificación promovió significativamente las vías de señalización de Ras, PI3K-Akt, MAPK, estrógeno y calcio, así como el proceso de adhesión. Los genes de estas vías se regularon significativamente al alza después de la vitrificación (Figura 3C).
Figura 3. Análisis de enriquecimiento de la vía de genes expresados diferencialmente (DEGs) en mórula congelada vitrificada frente a mórula fresca. (A) Resultados del análisis KEGG; el color de cada punto indica el valor p de los dos conjuntos de genes expresados diferencialmente (DEGs), y el tamaño del punto indica el número de DEGs en cada vía KEGG. (B) Los resultados del análisis GSEA. (C) Pliegue de todos los genes de la vía GSEA que están altamente expresados en la mórula de vitrificación.
3.2. Efectos de la melatonina sobre el transcriptoma de la vitrificación de la mórula
Se analizó el efecto de la melatonina sobre el perfil transcripcional de la mórula ovina derivada in vivo durante la vitrificación (congelada vs. congelada más melatonina). El umbral de restricción para el análisis se fijó en un valor de p de 0,05 y varios puntos de corte de cambio de ploidía. Para su posterior análisis se utilizó una lista de criterios DEG para los cambios de ploidía <−1 y > 1. Se identificaron un total de 177 DEG entre ellos (Tabla Suplementaria S5), de los cuales 121 genes estaban regulados al alza en el grupo de vitrificación, mientras que 56 estaban regulados a la baja (Figura 4A). Se realizó un análisis de GO para todos los DEG, y en la Figura 4B se mostraron los 10 principales conglomerados de PA y MF (Tabla Suplementaria S6). Los genes alterados entre los dos grupos en BP que se asociaron con la regulación del desarrollo reproductivo, la producción de gametos, la regulación de la fosforilación de proteínas, las vías de señalización apoptótica y la respuesta celular a los estímulos de daño del ADN. Las entradas se enriquecieron en las vías MF y KEGG, que incluyeron las relacionadas con el proceso de vitrificación en la vía de la actividad de la quinasa, la vía de señalización ErbB y la vía de señalización PI3K-Akt (Figuras 4B, C).
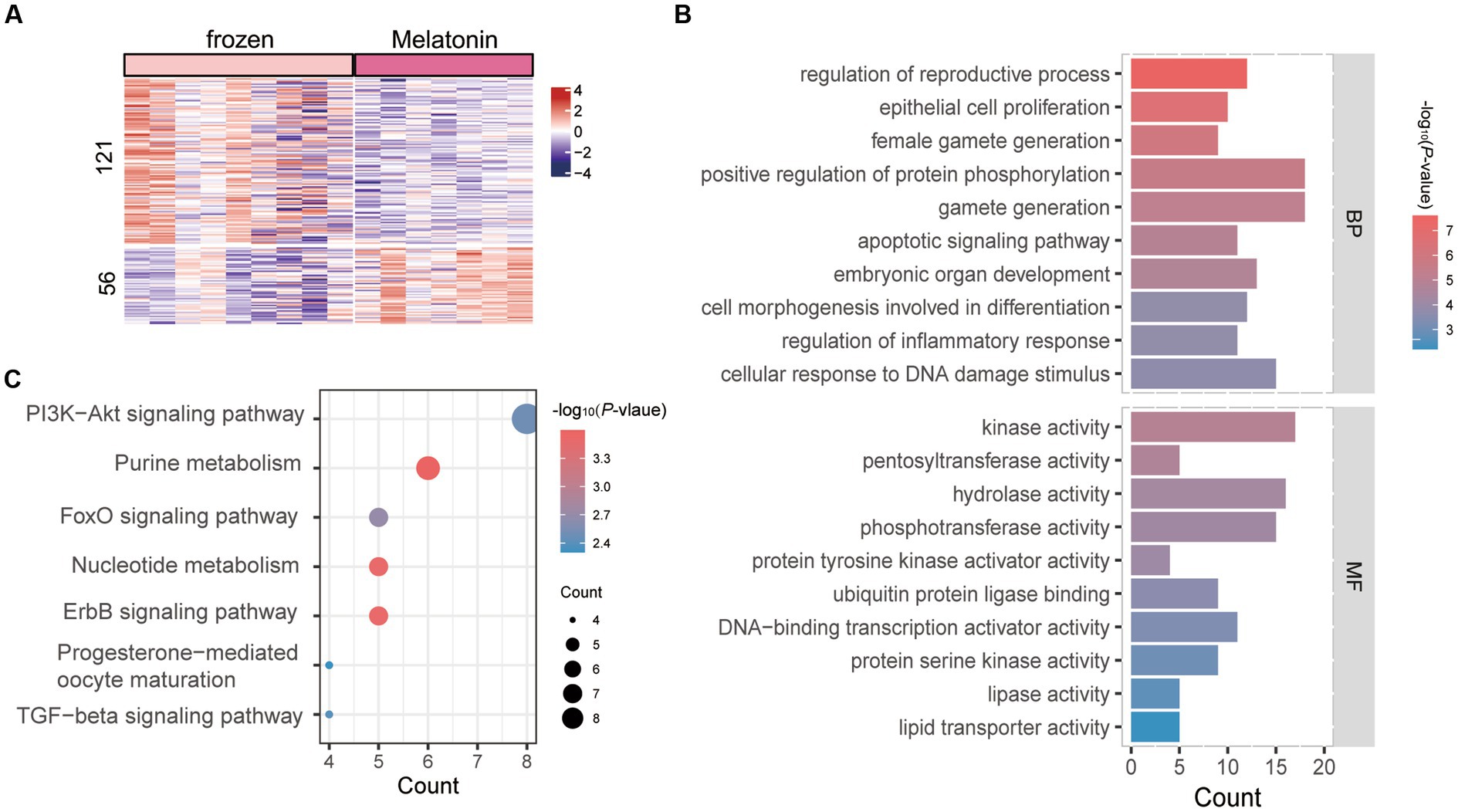 Figura 4. Análisis de enriquecimiento de genes expresados diferencialmente (DEGs) en vitrificación vs. mórula de melatonina más vitrificación. (A) Mapa de calor de todos los genes expresados diferencialmente (DEGs). Las filas indican DEG (p < 0,05) y las columnas indican muestras de embriones de vitrificación o melatonina más vitrificación. Las claves de color de azul a rojo indican la expresión relativa de los genes de menor a mayor. (B) análisis de GO; Las coordenadas horizontales indican el número de DEG en cada entrada. C) Análisis KEGG; el color de cada punto indica el valor p de los dos conjuntos de genes expresados diferencialmente (DEGs), y el tamaño del punto indica el número de DEGs en cada vía KEGG.
Figura 4. Análisis de enriquecimiento de genes expresados diferencialmente (DEGs) en vitrificación vs. mórula de melatonina más vitrificación. (A) Mapa de calor de todos los genes expresados diferencialmente (DEGs). Las filas indican DEG (p < 0,05) y las columnas indican muestras de embriones de vitrificación o melatonina más vitrificación. Las claves de color de azul a rojo indican la expresión relativa de los genes de menor a mayor. (B) análisis de GO; Las coordenadas horizontales indican el número de DEG en cada entrada. C) Análisis KEGG; el color de cada punto indica el valor p de los dos conjuntos de genes expresados diferencialmente (DEGs), y el tamaño del punto indica el número de DEGs en cada vía KEGG.
3.3. Las alteraciones de los factores de transcripción clave durante la vitrificación de la mórula y los efectos de la melatonina sobre ellos
Los algoritmos ARACNe y VIPER que se utilizaron para identificar los reguladores clave alterados durante el proceso de vitrificación. Estos gráficos de enriquecimiento de los reguladores maestros TF que se identificaron en p < 0.05 en el análisis se mostraron en la Figura 5A. Las actividades de SPIC, NME2, XPA y SMARCE1 se inhibieron en la vitrificación de embriones, y se activaron SSRP1, ZKSCAN5, MGA, SP1, ZBTB2, OVOL2, GATAD2A, FOXN3 y SOX2. Los niveles relativos de expresión de los reguladores maestros de TF en los tres grupos experimentales se mostraron en la Figura 5B.
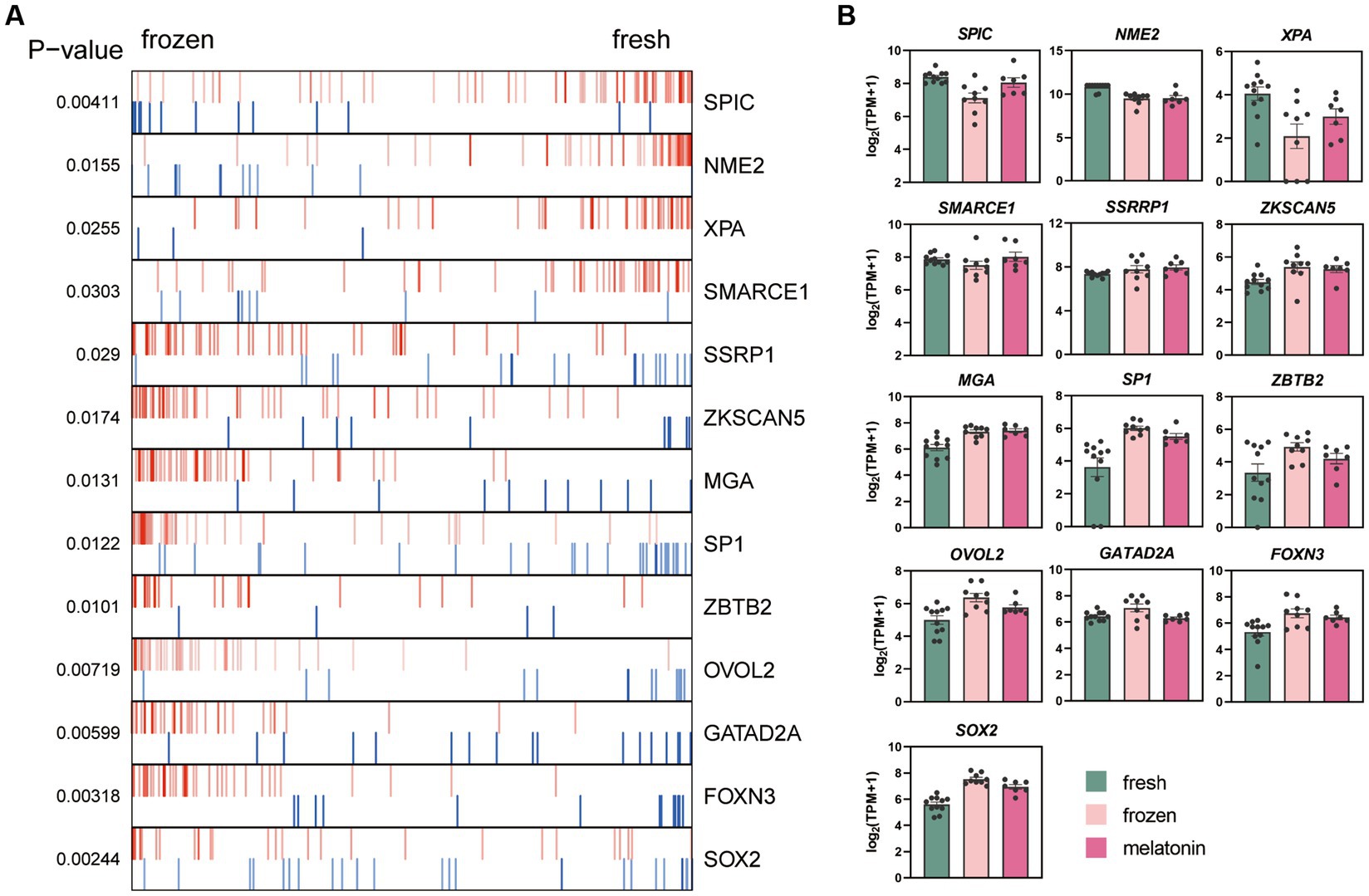 Figura 5. Efectos de la vitrificación y la melatonina más la vitrificación de la mórula sobre los reguladores de genes clave (TF) analizados con VIPER. (A) El gráfico producido por VIPER presenta los 13 principales TF regulados al alza y a la baja. (B) El gráfico de barras muestra los niveles de expresión relativa de los genes [log2 (TPM + 1)]. Los colores denotan el grupo fresco (verde), el grupo congelado (rosa) y el grupo melatonina (fushcia).
Figura 5. Efectos de la vitrificación y la melatonina más la vitrificación de la mórula sobre los reguladores de genes clave (TF) analizados con VIPER. (A) El gráfico producido por VIPER presenta los 13 principales TF regulados al alza y a la baja. (B) El gráfico de barras muestra los niveles de expresión relativa de los genes [log2 (TPM + 1)]. Los colores denotan el grupo fresco (verde), el grupo congelado (rosa) y el grupo melatonina (fushcia).
3.4. Validación de los resultados de RNA-Seq
Los embriones generados in vitro se agruparon y vitrificaron de la misma manera que los embriones in vivo. Los resultados de qPCR de embriones in vitro se compararon con los resultados de RNA-Seq de embriones in vivo. Sobre la base de los datos de RNA-Seq y el análisis de la función, se seleccionaron cuatro genes (HIF1A, PARP1, PRKDC y BTG2) de mórulas cultivadas in vitro procesadas con vitrificación para su validación mediante qRT-PCR. En la Figura 6 se resumen los datos de compresión de RNA-Seq y qRT-PCR entre la vitrificación, la melatonina más vitrificación y la mórula de control in vivo.
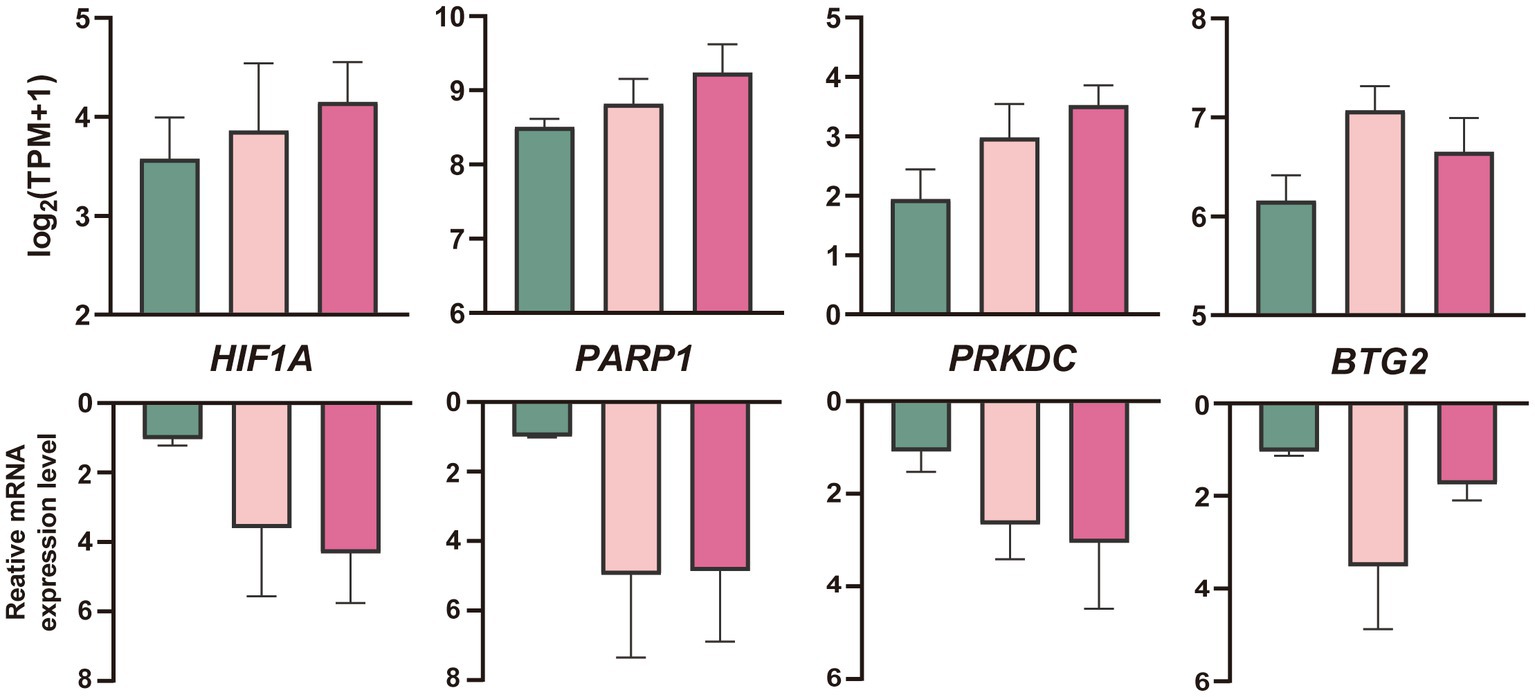 Figura 6. Cuantificación (media ± SEM) de perfiles de ARNm de cuatro genes en blastocistos de oveja producidos in vitro tras criopreservación con análisis RNA-Seq (arriba) y qRT-PCR (abajo, n = 3 réplicas por grupo de mórula). Los colores denotan lo fresco (verde), la vitrificación y la melatonina más la vitrificación (fushcia).
Figura 6. Cuantificación (media ± SEM) de perfiles de ARNm de cuatro genes en blastocistos de oveja producidos in vitro tras criopreservación con análisis RNA-Seq (arriba) y qRT-PCR (abajo, n = 3 réplicas por grupo de mórula). Los colores denotan lo fresco (verde), la vitrificación y la melatonina más la vitrificación (fushcia).
4. Discusión
En este estudio, hemos proporcionado los perfiles transcripcionales de las mórulas de ovejas tras las cuales se realizó el procedimiento de vitrificación. Los datos de la secuenciación del ARN revelaron varias alteraciones transcripcionales importantes, que pueden reflejar el daño molecular causado por la temperatura congelada e indicar el proceso de curación molecular de los embriones para superar el impacto de la vitrificación. En los últimos años, la evidencia ha demostrado que la melatonina actúa como antioxidante para mejorar la capacidad de desarrollo de los embriones criopreservados. Por lo tanto, en este estudio, también investigamos los efectos de la melatonina sobre las alteraciones del transcriptoma asociadas a la vitrificación en la mórula de oveja.
En la actualidad, los microarrays (38) y el RNA-Seq a granel son ampliamente utilizados para estudiar las influencias de la vitrificación en los embriones. En este estudio, estos métodos se utilizaron para analizar el perfil del transcriptoma de los embriones de oveja vitrificados a nivel de embrión único. Los resultados de la secuenciación de embriones individuales pueden detectar más detalles sobre los cambios en la expresión génica causados por la vitrificación y también tienen más posibilidades de identificar nuevos genes diferenciales. Nuestros resultados confirmaron un informe previo de que la mayoría de los DEG se regulan al alza durante el proceso de vitrificación (29). Sin embargo, se encontró que el efecto de la vitrificación sobre el número de DEG fue menor. En cuanto a los niveles de expresión, solo 27 DEGs en mórulas vitrificadas mostraron cambios mayores a 3 veces. La variación dentro del grupo en las mórulas vitrificadas fue mayor que en otros tratamientos, lo que puede implicar que los diferentes embriones responden de manera diferente a la congelación. Mientras tanto, los ACP de los grupos de vitrificación y melatonina más vitrificación se agruparon en un solo grupo, lo que indica que la adición de melatonina tuvo menos efecto sobre la expresión transcripcional de las mórulas vitrificadas.
La ontología génica y el análisis de enriquecimiento de KEGG de mórulas vitrificadas mostraron que los términos de GO que participan en el metabolismo de GO, el desarrollo de tejidos, los procesos biológicos de señalización celular y los DEG asociados con la actividad de la quinasa y la actividad de unión al factor de transcripción estaban significativamente enriquecidos. Los resultados indican que los procesos de vitrificación/calentamiento inducen respuestas que se relacionan principalmente con el metabolismo celular en las mórulas. Durante el proceso de vitrificación, los embriones se convierten en una fase sólida similar al vidrio para evitar la formación de hielo intracelular y daños mecánicos por cristales de hielo, mientras que, al mismo tiempo, la vitrificación causa daños irreversibles en la membrana celular del embrión (39). Esto es consistente con nuestros hallazgos, en los que los procesos biológicos importantes estrechamente relacionados con la función de la membrana celular (endocitosis y uniones adhesivas) se enriquecieron significativamente. Tanto en animales domésticos como en humanos, las interacciones adhesivas entre células adyacentes son esenciales para la embriogénesis, así como para la morfogénesis y renovación de los tejidos (40). La endocitosis es esencial en el desarrollo embrionario temprano (41). En embriones de ratones, la endocitosis mediada por clatrina desempeña un papel clave en la progresión de la embriogénesis temprana y la degradación selectiva de las proteínas de la membrana plasmática derivadas de ovocitos (42). Las alteraciones de los genes en estas dos vías funcionales podrían tener un impacto significativo en el desarrollo de las mórulas vitrificadas. Nuestros resultados mostraron que los genes de estas dos vías funcionales estaban regulados al alza, lo que indica su importancia para la supervivencia de las mórulas vitrificadas.
Entre las vías obtenidas a partir del enriquecimiento de DEGs de mórulas vitrificadas, las entradas de la vía de señalización (PI3K/AKT, MAPK y Ras) se enriquecieron significativamente por su participación reguladora en el desarrollo embrionario, estrés oxidativo. Las vías de la fosfoinositida 3-quinasa/proteína quinasa B (PI3K/AKT) y la proteína quinasa activada por mitógenos (MAPK) desempeñan un papel fundamental en la regulación de una variedad de funciones celulares, incluida la proliferación, la supervivencia, el crecimiento, la transcripción y la síntesis de proteínas (43). La vía MAPK está involucrada en las respuestas de estrés desencadenadas por muchos estímulos extracelulares e intracelulares, y también se observó un enriquecimiento significativo de la vía MAPK en blastocistos porcinos vitrificados (27). la vía PI3K/AKT es una señal importante que regula la apoptosis mediante la modulación del estrés oxidativo. Se encontró que esta vía estaba involucrada en la respuesta al estrés oxidativo durante el proceso de vitrificación/calentamiento y en el potencial de desarrollo de los ovocitos de ratón calentados (44).
La melatonina como potente antioxidante se ha utilizado ampliamente para mejorar la capacidad de desarrollo de los ovocitos animales criopreservados (24). Nuestros resultados mostraron que las vías TGFβ y FoxO se enriquecieron significativamente en las mórulas del tratamiento con melatonina más vitrificación en comparación con las de la vitrificación sola. Estas vías regulan la pluripotencia y el embarazo de las células madre implicadas en el desarrollo embrionario. También se ha informado de un enriquecimiento de la vía de señalización en AOC porcinos vitrificados (45, 46), así como en blastocistos de ratón vitrificados, indicado por un aumento del nivel de miARN que se asoció con la regulación positiva de TGFβ (47). La vía FoxO también se activa en condiciones de estrés (48); Se ha encontrado que las moléculas de FoxO en la masa celular interna de los blastocistos de ratón (49) regulan al alza los genes diana, promoviendo así los genes estancados del ciclo celular y aumentando la resistencia al estrés.
Nuestro estudio reveló que algunos genes relacionados con la apoptosis que se expresan en gran medida después de la vitrificación fueron reprimidos, mientras que los factores que promueven la reparación del daño del ADN se regularon al alza con el tratamiento con melatonina. Se identificaron varios factores de transcripción alterados durante la vitrificación mediante el método ARACNe. Se observó una disminución significativa de la actividad de XPA después de la vitrificación. y la melatonina alivia esta disminución de la expresión de XPA causada por la vitrificación. XPA es una subunidad importante del sistema de reparación por escisión de nucleótidos (NER), que reconoce de manera eficiente el daño en el ADN y luego recluta proteínas NER en la región dañada (50, 51). La NER es una vía de reparación versátil y es capaz de eliminar un amplio espectro de daños en la hélice del ADN (52). XPA es una proteína clave en la NER y es importante para la validación del daño en el ADN y el reclutamiento de otras proteínas NER (53). Muchos estudios han demostrado que la falta de XPA conduce al fracaso completo de la TNE (54).
Además, XPA es un objetivo directo del factor 1 alfa inducible por hipoxia (HIF-1α), y la unión de HIF-1α a HRE en la región promotora de XPA regula significativamente al alza la expresión de XPA (55). Descubrimos que la melatonina también regula al alza la expresión de HIF1A, y este puede ser uno de los mecanismos por los cuales la melatonina actúa indirectamente sobre el XPA para suprimir el daño de la vitrificación. XPA puede interactuar con PARP1, lo que facilita la poli-ADP-ribosilación (PARilación) de XPA. La interacción directa de XPA-PARP1 estimula aún más la actividad de PARP1 y promueve eventos adicionales de ribosilación de poli-ADP y apertura de la estructura de la cromatina (56). PARP1 también se reguló significativamente al alza en melatonina más vitrificación en comparación con el grupo de vitrificación sola. El ritmo circadiano también podría influir en la TNE modificando directamente los niveles de XPA (57). En el cerebro, el hígado y la piel de ratones, XPA y NER exhiben una fuerte ritmicidad circadiana (58). La melatonina es un potente regulador del ritmo circadiano; por lo tanto, puede regular el XPA a través del mecanismo circadiano. Sería interesante realizar más estudios sobre la relación reglamentaria entre ambos.
5. Conclusión
Nuestros hallazgos revelaron alteraciones específicas en la expresión génica embrionaria causadas por el proceso de vitrificación e identificaron las posibles vías que involucran la vitrificación y causan daño en las mórulas. Estas alteraciones provocadas por la vitrificación se enriquecieron principalmente en los procesos de adhesión, endocitosis y actividad quinasa. Además, descubrimos genes que están implicados en el papel protector de la melatonina sobre el daño de la vitrificación. Estos genes incluyen XPA y HIF1A. Hasta donde sabemos, este es el primer informe sobre las alteraciones del perfil del transcriptoma causadas por el proceso de vitrificación/calentamiento en las mórulas de ovejas derivadas in vivo a nivel de embrión único. Este estudio contribuye a la comprensión de las consecuencias de los procedimientos de vitrificación/calentamiento sobre la calidad embrionaria y la capacidad de desarrollo, no solo en ovejas, sino también en otras especies de mamíferos. Además, también se exploraron los mecanismos protectores de la melatonina en la vitrificación frente al daño de las mórulas. Estas observaciones proporcionan un importante mecanismo molecular para optimizar aún más la criopreservación de embriones y otras células.
Declaración de disponibilidad de datos
Los conjuntos de datos presentados en este estudio se pueden encontrar en repositorios en línea. A continuación se indican los nombres de los repositorios y los números de acceso: https://www.ncbi.nlm.nih.gov/; PRJNA971313.
Declaración ética
El estudio en animales fue revisado y aprobado por el Comité de Inspección Ética de Bienestar Animal y Experimentación Animal del Laboratorio de la Universidad Agrícola de China.
Contribuciones de los autores
PJ: conceptualización. GL: adquisición de fondos. PJ, LY, YJ, DL, YY, WM y DY: investigación. FL, AW y KY: administración de proyectos y recursos. LZ y GL: supervisión. YL y MZ: visualización. YL: escritura-borrador original. LZ, SG y GL: redacción, revisión y edición. Todos los autores contribuyeron al artículo y aprobaron la versión enviada.
Financiación
Esta investigación fue financiada por el Proyecto Principal de Ciencia y Tecnología de Mongolia Interior (2021ZD0023-1), el Proyecto de Mejoramiento Biológico-Tema4 (2022ZD0401404) y el Programa Nacional Clave de Investigación y Desarrollo (2021YFD1300903).
Conflicto de intereses
FL es empleado de Inner Mongolia Golden Grassland Ecological Technology Group Co., Ltd.
El resto de los autores declaran que la investigación se llevó a cabo en ausencia de relaciones comerciales o financieras que pudieran interpretarse como un potencial conflicto de intereses.
Nota del editor
Todas las afirmaciones expresadas en este artículo son únicamente las de los autores y no representan necesariamente las de sus organizaciones afiliadas, ni las del editor, los editores y los revisores. Cualquier producto que pueda ser evaluado en este artículo, o afirmación que pueda ser hecha por su fabricante, no está garantizado ni respaldado por el editor.
Material complementario
El material complementario para este artículo se puede encontrar en: https://www.frontiersin.org/articles/10.3389/fvets.2023.1212047/full#supplementary-material
Notas
1. ^http://metascape.org
Referencias
1. Loi, P , Ptak, G , Dattena, M , Ledda, S , Naitana, S y Cappai, P . Transferencia embrionaria y tecnologías relacionadas en la reproducción ovina. Reprod Nutr Dev. (1998) 38:615–28. doi: 10.1051/rnd:19980604
Resumen de PubMed | Texto completo de CrossRef | Google Académico
2. Vajta, G y Nagy, ZP . ¿Siguen siendo necesarios los congeladores programables en el laboratorio de embriones? Revisión sobre la vitrificación. Reprod Biomed. (2006) 12:779–96. doi: 10.1016/s1472-6483(10)61091-7
3. Baril, G , Traldi, AL , Cognie, Y , Leboeuf, B , Beckers, JF y Mermillod, P . Transferencia directa exitosa de embriones de oveja vitrificados. Teriogenología. (2001) 56:299–305. doi: 10.1016/S0093-691X(01)00564-7
Resumen de PubMed | Texto completo de CrossRef | Google Académico
4. Dos, SP , Cuadro, F , Barrera, N , Crispo, M y Menchaca, A . Supervivencia embrionaria y tasa de natalidad tras la vitrificación de volumen mínimo o la congelación lenta de embriones ovinos producidos in vivo e in vitro. Criobiología. (2017) 78:8–14. doi: 10.1016/j.cryobiol.2017.08.002
5. Vajta, G . Vitrificación en embriología humana y de animales domésticos: trabajo en curso. Reprod Fertil Dev. (2013) 25:719–27. doi: 10.1071/RD12118
6. Bettencourt, EM , Bettencourt, CM , Silva, JN , Ferreira, P , de Matos, CP , Oliveira, E, et al. Caracterización ultraestructural de embriones ovinos frescos y criopreservados in vivo. Teriogenología. (2009) 71:947–58. doi: 10.1016/j.theriogenology.2008.10.019
7. Bogliolo, L , Ariu, F , Fois, S , Rosati, I , Zedda, MT , Leoni, G, et al. Análisis morfológico y bioquímico de ovocitos ovinos inmaduros vitrificados con o sin células cúmulos. Teriogenología. (2007) 68:1138–49. doi: 10.1016/j.theriogenology.2007.08.013
Resumen de PubMed | Texto completo de CrossRef | Google Académico
8. Kuwayama, M , Vajta, G , Ieda, S y Kato, O . Comparación de métodos abiertos y cerrados para la vitrificación de embriones humanos y la eliminación de posibles contaminaciones. Reprod Biomed. (2005) 11:608–14. doi: 10.1016/s1472-6483(10)61169-8
9. Papis, K , Shimizu, M e Izaike, Y . Factores que afectan a la supervivencia de ovocitos bovinos vitrificados en gotitas. Teriogenología. (2000) 54:651–8. doi: 10.1016/S0093-691X(00)00380-0
Resumen de PubMed | Texto completo de CrossRef | Google Académico
10. Kuwayama, M , Vajta, G , Kato, O y Leibo, SP . Método de vitrificación altamente eficiente para la criopreservación de ovocitos humanos. Reprod Biomed. (2005) 11:300–8. doi: 10.1016/s1472-6483(10)60837-1
11. Checura, CM y Seidel, GJ . Efecto de macromoléculas en soluciones para vitrificación de ovocitos bovinos maduros. Teriogenología. (2007) 67:919–30. doi: 10.1016/j.theriogenology.2006.09.044
Resumen de PubMed | Texto completo de CrossRef | Google Académico
12. Gosden, R . Criopreservación: una mirada fría a la tecnología para la preservación de la fertilidad. Fértil estéril. (2011) 96:264–8. doi: 10.1016/j.fertnstert.2011.06.029
Resumen de PubMed | Texto completo de CrossRef | Google Académico
13. Pegg, DE . Principios de criopreservación. Métodos Mol Biol. (2007) 368: 39–57. doi: 10.1007/978-1-59745-362-2_3
14. Brair, VL , Maia, A , Correia, L , Barbosa, NO , Santos, J , Brandao, FZ, et al. Los patrones de expresión génica de los blastocistos de oveja derivados in vivo se ven más afectados por la vitrificación que por la técnica de congelación lenta. Criobiología. (2020) 95:110–5. doi: 10.1016/j.cryobiol.2020.05.009
Resumen de PubMed | Texto completo de CrossRef | Google Académico
15. Parque, MJ , Lee, SE , Yoon, Testigo de Jehová , Parque, HJ , Kim, SH , Oh, SH, et al. Efecto de la suplementación de la solución crioprotectora con hidroxipropilcelulosa para la vitrificación de ovocitos bovinos. Animales. (2022) 12:2636. doi: 10.3390/ani12192636
Resumen de PubMed | Texto completo de CrossRef | Google Académico
16. Matos, JE , Marqués, CC , Moura, TF , Baptista, MC , Horta, AE , Soveral, G, et al. El ácido linoleico conjugado mejora la criosupervivencia de los ovocitos a través de la modulación de la tasa de entrada de los crioprotectores. Reprod Biol Endocrinol. (2015) 13:60. doi: 10.1186/s12958-015-0059-3
17. Reiter, RJ , Mayo, JC , Bronceado, DX , Sainz, RM , Alatorre-Jiménez, M y Qin, L . La melatonina como antioxidante: menos promesas, pero más de lo que cumple. J Pineal Res. (2016) 61:253–78. doi: 10.1111/jpi.12360
Resumen de PubMed | Texto completo de CrossRef | Google Académico
18. Amaral, F y Cipolla-Neto, J . Una breve reseña sobre la melatonina, una hormona pineal. Arch Endocrinol Metab. (2018) 62:472–9. doi: 10.20945/2359-3997000000066
Resumen de PubMed | Texto completo de CrossRef | Google Académico
19. Tordjman, S , Chokron, S , Delorme, R , Charrier, A , Bellissant, E , Jaafari, N, et al. Melatonina: farmacología, funciones y beneficios terapéuticos. Curr Neuropharmacol. (2017) 15:434–43. doi: 10.2174/1570159X14666161228122115
Resumen de PubMed | Texto completo de CrossRef | Google Académico
20. Yong, W , Ma, H , Na, M , Gao, T , Zhang, Y , Hao, L, et al. Funciones de la melatonina en el campo de la medicina reproductiva. Farmacia Biomédica. (2021) 144:112001. doi: 10.1016/j.biopha.2021.112001
Resumen de PubMed | Texto completo de CrossRef | Google Académico
21. Zhang, Z , Mu, Y , Ding, D , Zou, W , Li, X , Chen, B, et al. La melatonina mejora el efecto de la criopreservación en los ovocitos humanos suprimiendo el estrés oxidativo y manteniendo la permeabilidad del oolema. J Pineal Res. (2021) 70:E12707. doi: 10.1111/jpi.12707
Resumen de PubMed | Texto completo de CrossRef | Google Académico
22. Zhu, Q , Ding, D , Yang, H , Zou, W , Yang, D , Wang, K, et al. La melatonina protege la función mitocondrial e inhibe el daño oxidativo contra la disminución del desarrollo de los ovocitos humanos causada por la criopreservación prolongada. Células. (2022) 11:4018. doi: 10.3390/cells11244018
Resumen de PubMed | Texto completo de CrossRef | Google Académico
23. Zhao, XM , Hao, HS , Du, WH , Zhao, SJ , Wang, HY , Wang, N, et al. La melatonina inhibe la apoptosis y mejora el potencial de desarrollo de los ovocitos bovinos vitrificados. J Pineal Res. (2016) 60:132–41. doi: 10.1111/jpi.12290
24. Zhang, Y , Li, W , Ma, Y , Wang, D , Zhao, X , Zeng, C, et al. Mejora del desarrollo mediante el tratamiento con melatonina tras la vitrificación de ovocitos de metafase II de ratón. Criobiología. (2016) 73:335–42. doi: 10.1016/j.cryobiol.2016.09.171
Resumen de PubMed | Texto completo de CrossRef | Google Académico
25. Larman, MG , Katz-Jaffe, MG , McCallie, B , Filipovits, JA y Gardner, DK . Análisis de la expresión génica global tras la criopreservación de blastocisto de ratón. Hum Reprod. (2011) 26:2672–80. doi: 10.1093/humrep/der238
Resumen de PubMed | Texto completo de CrossRef | Google Académico
26. Aksu, DA , Agca, C , Aksu, S , Bagis, H , Akkoc, T , Caputcu, AT, et al. Perfiles de expresión génica de blastocistos bovinos vitrificados in vitro e in vivo. Mol Reprod Dev. (2012) 79:613–25. doi: 10.1002/mrd.22068
Resumen de PubMed | Texto completo de CrossRef | Google Académico
27. Cuello, C , Martínez, CA , Cambra, JM , Parrilla, I , Rodríguez-Martínez, H , Gil, MA, et al. Efectos de la vitrificación sobre el perfil de expresión génica del blastocisto en un modelo porcino. Int J Mol Sci. (2021) 22:1222. doi: 10.3390/ijms22031222
Resumen de PubMed | Texto completo de CrossRef | Google Académico
28. Sudano, MJ , Caixeta, ES , Paschoal, DM , Martins, AJ , Machado, R , Buratini, J, et al. Criotolerancia y patrones globales de expresión génica de Bos taurus indicus y Bos taurus taurus en blastocistos producidos in vitro e in vivo. Reprod Fertil Dev. (2014) 26:1129–41. doi: 10.1071/RD13099
Resumen de PubMed | Texto completo de CrossRef | Google Académico
29. Alminana, C , Dubuisson, F , Bauersachs, S , Royer, E , Mermillod, P , Blesbois, E, et al. Desvelando cómo afecta la vitrificación al blastocisto porcino: pistas de un estudio transcriptómico. J Anim Sci Biotechnol. (2022) 13:46. doi: 10.1186/s40104-021-00672-1
30. Shi, JM , Yi, JY , Tian, XZ , Wang, F , Lian, ZX , Han, HB, et al. Efectos de los cambios estacionales sobre la tasa de ovulación y la calidad embrionaria en ovejas negras superovuladas de Suffolk. Neuroendocrinol Lett. (2015) 36:330–6.
31. Kim, D , Paggi, JM , Parque, C , Bennett, C y Salzberg, S.L. . Alineación y genotipado del genoma basado en grafos con HISAT2 y HISAT-genotype. Nat Biotechnol. (2019) 37:907–15. doi: 10.1038/s41587-019-0201-4
Resumen de PubMed | Texto completo de CrossRef | Google Académico
32. Putri, GH , Anders, S , Pyl, PT , Pimanda, JE y Zanini, F . Análisis de datos de secuenciación de alto rendimiento en Python con HTSeq 2.0. Bioinformática. (2022) 38:2943–5. doi: 10.1093/bioinformatics/btac166
Resumen de PubMed | Texto completo de CrossRef | Google Académico
33. Hao, Y , Hao, S , Andersen-Nissen, E , Mauck, WR , Zheng, S , Butler, A, et al. Análisis integrado de datos multimodales de una sola célula. Células. (2021) 184:3573–87. doi: 10.1016/j.cell.2021.04.048
Resumen de PubMed | Texto completo de CrossRef | Google Académico
34. Zhou, Y , Zhou, B , Pache, L , Chang, M , Khodabakhshi, AH , Tanaseichuk, O, et al. Metascape proporciona un recurso orientado a los biólogos para el análisis de conjuntos de datos a nivel de sistemas. Nat Commun. (2019) 10:1523. doi: 10.1038/s41467-019-09234-6
35. Wu, T , Hu, E , Xu, S , Chen, M , Guo, P , Dai, Z, et al. clusterProfiler 4.0: una herramienta de enriquecimiento universal para interpretar datos ómicos. Innovación. (2021) 2:100141. doi: 10.1016/j.xinn.2021.100141
Resumen de PubMed | Texto completo de CrossRef | Google Académico
36. Lachmann, A , Giorgi, FM , López, G y Califano, A . ARACNe-AP: ingeniería inversa de redes génicas a través de la inferencia de partición adaptativa de información mutua. Bioinformática. (2016) 32:2233–5. doi: 10.1093/bioinformatics/btw216
Resumen de PubMed | Texto completo de CrossRef | Google Académico
37. Álvarez, MJ , Shen, Y , Giorgi, FM , Lachmann, A , Ding, BB , Ye, BH, et al. Caracterización funcional de mutaciones somáticas en cáncer mediante inferencia basada en redes de la actividad proteica. Nat Genet. (2016) 48:838–47. doi: 10.1038/ng.3593
38. Gupta, A , Singh, J , Dufort, I , Roberto, C , Dias, F y Anzar, M . Diferencia transcriptómica en blastocistos bovinos después de la vitrificación y congelación lenta en la etapa de mórula. PLoS Uno. (2017) 12:e187268. doi: 10.1371/journal.pone.0187268
Resumen de PubMed | Texto completo de CrossRef | Google Académico
39. Kartberg, AJ , Hambiliki, F , Arvidsson, T , Stavreus-Evers, A y Svalander, P . La vitrificación con DMSO protege la integridad de la membrana embrionaria mejor que las soluciones sin DMSO. Reprod Biomed. (2008) 17:378–84. doi: 10.1016/s1472-6483(10)60221-0
40. Halbleib, JM y Nelson, WJ . Cadherinas en desarrollo: adhesión celular, clasificación y morfogénesis tisular. Genes Dev. (2006) 20:3199–214. doi: 10.1101/gad.1486806
Resumen de PubMed | Texto completo de CrossRef | Google Académico
41. Morita, A , Satouh, Y , Kosako, H , Kobayashi, H , Iwase, A y Sato, K . La endocitosis mediada por clatrina es esencial para la degradación selectiva de las proteínas de la membrana materna y el desarrollo preimplantacional. Desarrollo. (2021) 148:v199461. doi: 10.1242/dev.199461
42. Morita, A , Satouh, Y , Sato, K e Iwase, A . Importancia de la asociación entre el desarrollo embrionario temprano y la endocitosis. Med Mol Morphol. (2022) 55:167–73. doi: 10.1007/s00795-022-00331-y
Resumen de PubMed | Texto completo de CrossRef | Google Académico
43. Stefani, C , Miricescu, D , Stanescu-Spinu, II , Nica, RI , Greabu, M , Totan, AR, et al. Factores de crecimiento, vías de señalización PI3K/AKT/mTOR y MAPK en la patogénesis del cáncer colorrectal: ¿dónde estamos ahora? Int J Mol Sci. (2021) 22:10260. doi: 10.3390/ijms221910260
Resumen de PubMed | Texto completo de CrossRef | Google Académico
44. Li, J , Yang, X , Liu, F , Canción, Y y Liu, Y . La vía de señalización activada PI3K/AKT se asocia con el estrés oxidativo y el deterioro del potencial de desarrollo de los ovocitos vitrificados-descongelados. Reprod Sci. (2020) 27:404–10. doi: 10.1007/s43032-019-00036-1
Resumen de PubMed | Texto completo de CrossRef | Google Académico
45. Hsu, CC , Lin, CE , Chen, SC , Huang, SC , Liu, BH , Yu, YH, et al. Expresión génica diferencial entre la mórula porcina y el blastocisto. Reprod Domest Anim. (2012) 47:69–81. doi: 10.1111/j.1439-0531.2011.01803.x
Resumen de PubMed | Texto completo de CrossRef | Google Académico
46. Tanaka, TS y Ko, MS . Una visión global de la expresión génica en el embrión de ratón preimplantacional: mórula versus blastocisto. Eur J Obstet Gynecol Reprod Biol. (2004) 115:S85-91. doi: 10.1016/j.ejogrb.2004.01.026
47. Jia, POR , Xiang, DC , Liu, SN , Zhang, B , Shao, QY , Hong, QH, et al. Análisis proteómico cuantitativo basado en TMT de células cúmulos derivadas de ovocitos inmaduros porcinos vitrificados después de la maduración in vitro. Teriogenología. (2020) 152:8–17. doi: 10.1016/j.theriogenology.2020.04.025
48. Jaroudi, S y SenGupta, S . Reparación del ADN en embriones de mamíferos. Mutat Res Fundam Mol Mech Mutagen. (2007) 635:53–77. doi: 10.1016/j.mrrev.2006.09.002
49. Kuscu, N y Celik-Ozenci, C . FOXO1, FOXO3 Y FOXO4 se expresan de manera diferente durante la maduración de los ovocitos de ratón y el desarrollo embrionario preimplantacional. Patrones de Expansión Génica. (2015) 18:16–20. doi: 10.1016/j.gep.2015.04.003
Resumen de PubMed | Texto completo de CrossRef | Google Académico
50. Missura, M , Buterin, T , Obstáculos, R , Hubscher, U , Kasparkova, J , Brabec, V, et al. Sondeo de doble comprobación de la flexión y desenrollado del ADN mediante XPA-RPA: una función arquitectónica en la reparación del ADN. EMBO J. (2001) 20:3554–64. doi: 10.1093/emboj/20.13.3554
Resumen de PubMed | Texto completo de CrossRef | Google Académico
51. Krasikova, YS , Rechkunova, NI , Maltseva, EA y Lavrik, OI . Interacción de RPA y XPA con estructuras de ADN que imitan intermediarios de las últimas etapas en la reparación de la escisión de nucleótidos. PLoS Uno. (2018) 13:e190782. doi: 10.1371/journal.pone.0190782
Resumen de PubMed | Texto completo de CrossRef | Google Académico
52. Rey, BS , Cooper, KL , Liu, KJ y Hudson, LG . La poli(ADP-ribosa) contribuye a una asociación entre la poli(ADP-ribosa) polimerasa-1 y el grupo de complementación a del xeroderma pigmentoso en la reparación de la escisión de nucleótidos. J Biol Chem. (2012) 287:39824–33. doi: 10.1074/jbc. M112.393504
53. Pajuelo-Lozano, N , Bargiela-Iparraguirre, J , Domínguez, G , Quiroga, AG , Perona, R y Sánchez-Pérez, I . XPA, XPC y XPD modulan la sensibilidad en las células cancerosas gástricas resistentes al cisplatino. Frente Pharmacol. (2018) 9:1197. doi: 10.3389/fphar.2018.01197
54. Camenisch, U , Dip, R , Schumacher, SB , Schuler, B y Naegeli, H . El reconocimiento de torceduras helicoidales por parte de la proteína del grupo a de xeroderma pigmentosum desencadena la reparación de la escisión del ADN. Nat Struct Mol Biol. (2006) 13:278–84. doi: 10.1038/nsmb1061
Resumen de PubMed | Texto completo de CrossRef | Google Académico
55. Liu, Y , Bernauer, AM , Yingling, CM y Belinsky, S.A. . La expresión regulada por HIF1alfa de XPA contribuye a la resistencia al cisplatino en el cáncer de pulmón. Carcinogénesis. (2012) 33:1187–92. doi: 10.1093/carcin/bgs142
Resumen de PubMed | Texto completo de CrossRef | Google Académico
56. Robu, M , Shah, RG , Purohit, NK , Zhou, P , Naegeli, H y Shah, GM . La poli(ADP-ribosa) polimerasa 1 acompaña a XPC a las lesiones de ADN inducidas por UV durante la reparación de la escisión de nucleótidos. Proc Natl Acad Sci U S A. (2017) 114:E6847–56. doi: 10.1073/pnas.1706981114
Resumen de PubMed | Texto completo de CrossRef | Google Académico
57. Kang, TH , Lindsey-Boltz, LA , Reardon, JT y Sancar, A . Control circadiano de XPA y reparación por escisión del daño cisplatino-ADN por criptocromo y ubiquitina ligasa HERC2. Proc Natl Acad Sci U S A. (2010) 107:4890–5. doi: 10.1073/pnas.0915085107
Resumen de PubMed | Texto completo de CrossRef | Google Académico
58. Dakup, P y Gaddameedhi, S . Impacto del reloj circadiano en la respuesta al daño del ADN inducido por los rayos UV y la fotocarcinogénesis. Photochem Photobiol. (2017) 93:296–303. doi: 10.1111/php.12662
Resumen de PubMed | Texto completo de CrossRef | Google Académico
Palabras clave: congelación embrionaria, crioprotector, antioxidante, RNA-seq, reparación del ADN
Cita: Ji P, Liu Y, Yan L, Jia Y, Zhao M, Lv D, Yao Y, Ma W, Yin D, Liu F, Gao S, Wusiman A, Yang K, Zhang L y Liu G (2023) La melatonina mejora la vitrificación de las mórulas de oveja mediante la modulación del transcriptoma. Frente. Vet. Sci. 10:1212047. doi: 10.3389/fvets.2023.1212047
Recibido: 25 de abril de 2023; Aceptado: 03 de julio de 2023;
Publicado: 18 octubre 2023.
Editado por:
Joanna Maria Gonçalves de Souza Fabjan, Universidad Federal Fluminense, Brasil
Revisado por:
Alexsandra Fernandes Pereira, Universidad Federal Rural Semiárida, Brasil
Feng Su, Universidad Agrícola de Shandong, China
Derechos de autor © 2023 Ji, Liu, Yan, Jia, Zhao, Lv, Yao, Ma, Yin, Liu, Gao, Wusiman, Yang, Zhang y Liu. Este es un artículo de acceso abierto distribuido bajo los términos de la Licencia Creative Commons Attribution License (CC BY).
*Correspondencia: Lu Zhang, luzhang2018@cau.edu.cn; Guoshi Liu, gshliu@cau.edu.cn
†Estos autores han contribuido igualmente a este trabajo y comparten la primera autoría
Renuncia: Todas las afirmaciones expresadas en este artículo son únicamente las de los autores y no representan necesariamente las de sus organizaciones afiliadas, ni las del editor, los editores y los revisores. Cualquier producto que pueda ser evaluado en este artículo o afirmación que pueda hacer su fabricante no está garantizado ni respaldado por el editor.
Date de alta y recibe nuestro 👉🏼 Diario Digital AXÓN INFORMAVET ONE HEALTH
Date de alta y recibe nuestro 👉🏼 Boletín Digital de Foro Agro Ganadero
Noticias animales de compañía
Noticias animales de producción
Trabajos técnicos animales de producción
Trabajos técnicos animales de compañía