Características de la hemocromatosis en perros por imágenes ultrasonográficas y tomográficas computarizadas
Caso clínico: Características de la hemocromatosis en perros por imágenes ultrasonográficas y tomográficas computarizadas
- 1Centro Médico Animal BON, Suwon, República de Corea
- 2Sección de Imágenes Médicas, Centro Médico Veterinario, Universidad Nacional de Chungbuk, Cheongju, República de Corea
Un perro mestizo macho castrado de 7 kg de peso presentó enzimas hepáticas elevadas y anorexia. La radiografía abdominal reveló hepatomegalia con opacificación hepática heterogénea, y la ecografía abdominal mostró una ecotextura fina y un parénquima heterogéneo concurrente con una sospecha de derivación portosistémica adquirida. La tomografía computarizada (TC) previa al contraste mostró una marcada hepatomegalia con aumento homogéneo de la densidad hepática y múltiples ganglios linfáticos abdominales agrandados con un marcado aumento de la densidad parenquimatosa. La histopatología de la biopsia hepática y ganglionar reveló una acumulación abundante de hemosiderina, y la tinción de azul de Prusia confirmó una marcada acumulación de hierro dentro de los hepatocitos. Basándonos en nuestra revisión de la literatura, este es el primer informe de caso que describe el diagnóstico por imagen de la hemocromatosis en un perro.
Introducción
El hierro es un micronutriente esencial para la síntesis de hemoglobina, las reacciones de oxidación-reducción y la proliferación celular. El hígado es el órgano principal para el almacenamiento de hierro y tiene la mayor capacidad para almacenar el exceso de hierro (1). Se han desarrollado varios mecanismos fisiológicos para mantener la homeostasis del hierro, ya que un exceso de hierro puede causar especies reactivas de oxígeno, lo que puede causar disfunción orgánica. Esta afección se conoce como hemocromatosis (2). Las enfermedades por sobrecarga de hierro se clasifican en primarias (genéticas) o secundarias (3, 4). La hemocromatosis hereditaria es un trastorno genético autosómico recesivo y presenta la causa primaria más común de trastornos por sobrecarga de hierro en humanos (3); sin embargo, no se han descrito casos de hemocromatosis hereditaria en medicina veterinaria. La hemocromatosis secundaria incluye aumento de la absorción de hierro, anemia relacionada con eritropoyesis ineficaz, aumento exógeno por ingestión, infusión parenteral o transfusiones múltiples (4), y rara vez se informa en perros (5-8). Los signos clínicos comunes de sobrecarga de hierro en humanos incluyen pigmentación de la piel, disfunción hepática, diabetes y miocardiopatía (3, 4). En medicina veterinaria, los síntomas que se presentan incluyen irritación gastrointestinal, colapso vascular periférico, edema pulmonar e insuficiencia hepática, así como coma y muerte (1). Los métodos generales para diagnosticar la sobrecarga hepática de hierro en medicina humana incluyen la tomografía computarizada (TC), la resonancia magnética nuclear (RM) o las biopsias hepáticas (9). Sin embargo, hasta donde sabemos, no hay ningún informe previo de las características de diagnóstico por imagen de la hemocromatosis en perros.
En nuestro estudio, nuestro paciente presentó insuficiencia hepática y fue diagnosticada mediante técnicas de imagen y biopsia hepática. Este informe tiene como objetivo describir en detalle las características de imagen de la hemocromatosis en un perro.
Descripción del caso
Un perro mestizo macho castrado, con un peso de 7 kg, presentó una historia de 2 semanas de anemia, anorexia, heces blandas y enzimas hepáticas elevadas. Los cuidados de soporte hepático se administraron en el hospital veterinario de referencia. La edad del perro no estaba clara, ya que el paciente había sido rescatado 2 años antes y se había quedado en un refugio de animales. En el examen físico, el perro mostró caquexia (puntuación de condición corporal [BCS] 2/9). La temperatura corporal, la presión arterial, la frecuencia respiratoria, el tiempo de llenado capilar y el pulso no fueron notables. El hemograma completo mostró anemia microcítica y normocrómica. La bioquímica sérica reveló enzimas hepáticas severamente elevadas (Tabla 1). A través del ensayo comercial, se confirmó que el paciente tenía una infección por Giardia, mientras que otros kits arrojaron resultados negativos (SNAP 4Dx, IDEXX Laboratories Inc., Westbrook, ME; Rapid CDV, CIV, CPV, CCV y Giardia Ag, Bionote, Hwaseong-si, Corea del Sur para la detección de antígenos de moquillo canino, influenza, parvovirus, coronavirus y Giardia).
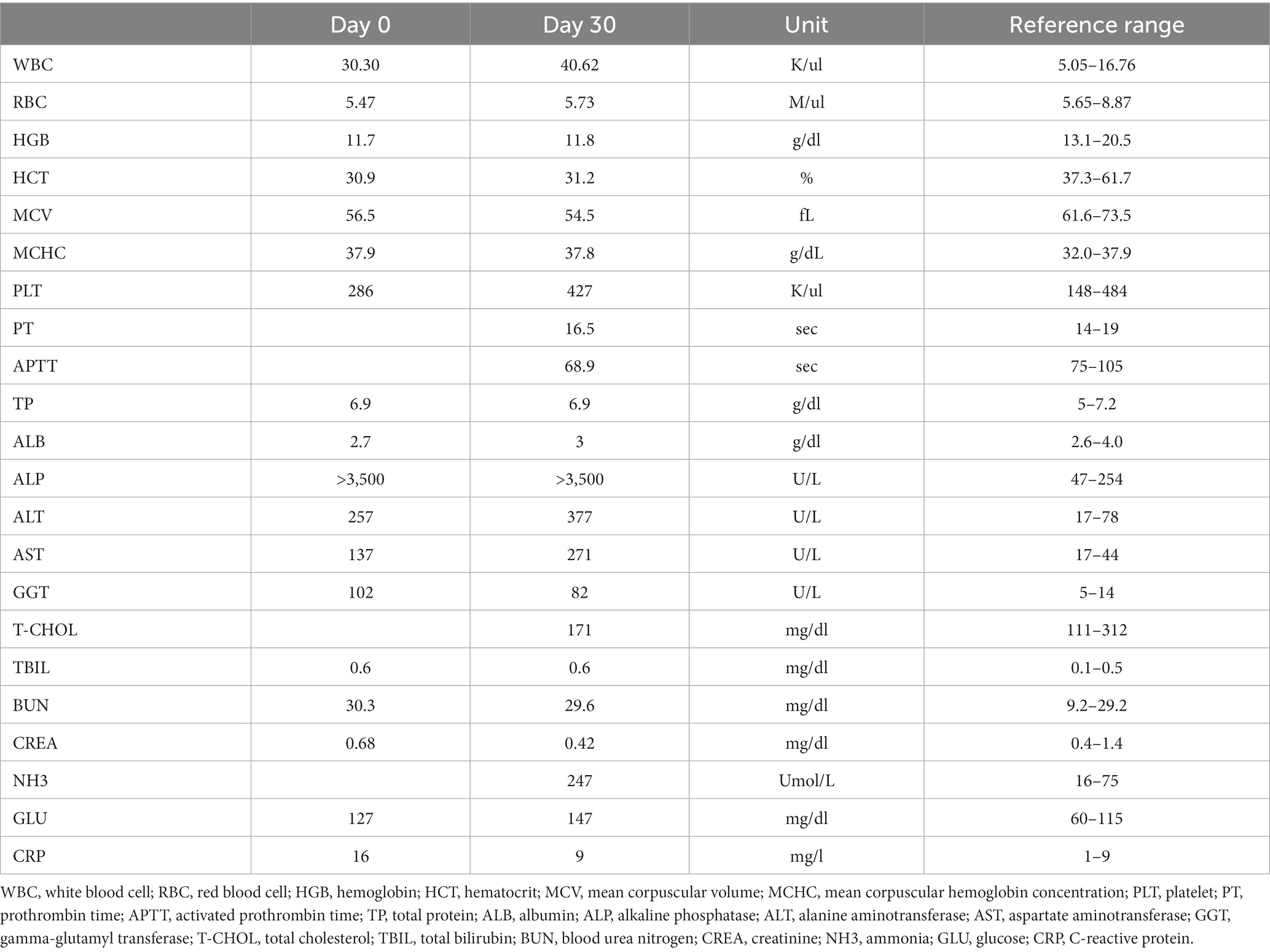
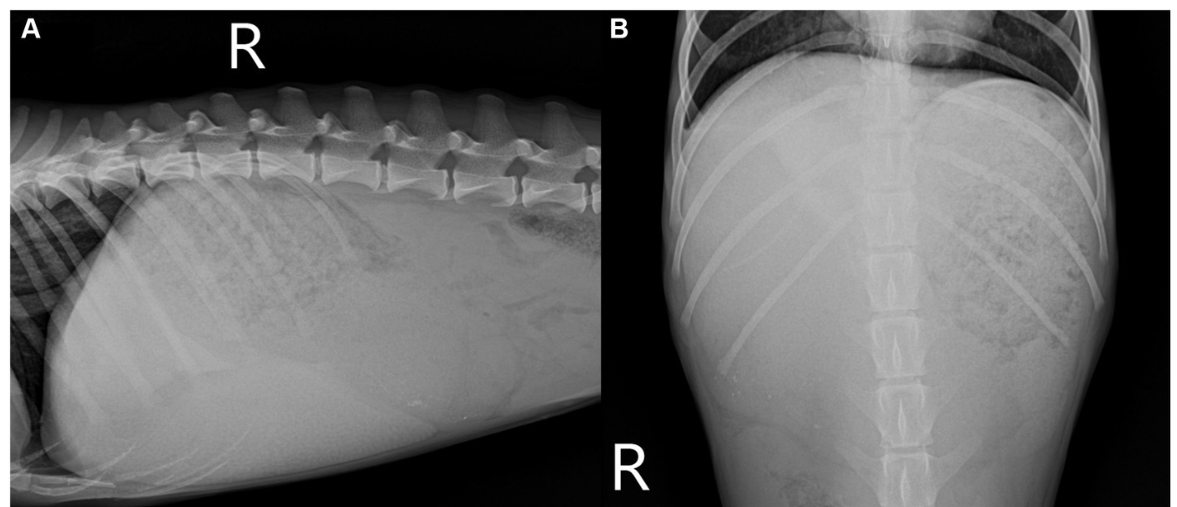
Se realizó radiografía abdominal (1417WGC, Rayence Co., Ltd., Hwaseong-si, Corea del Sur). En la vista lateral se observó hepatomegalia severa con pérdida de detalles serosales. La opacidad hepática se incrementó de forma heterogénea (Figuras 1A, B). Las radiografías torácicas no presentaban presentaciones. La ecografía abdominal se realizó con transductores lineales de 4-18 MHz (EPIQ 7 ELITE, Philips Healthcare, Amsterdam, Países Bajos). El resultado mostró un hígado agrandado con un aumento uniforme de la ecogenicidad, ecotextura fina, parénquima heterogéneo (Figura 1C), aumento de la ecogenicidad de la pared de la vesícula biliar sin sombreado acústico, múltiples vasos pequeños y tortuosos cerca de las regiones renal izquierda y esplénica con una pequeña cantidad de líquido peritoneal (Figuras 1D, E), y múltiples lesiones nodulares hipoecoicas difusas en el bazo. No se observaron otros hallazgos notables en la cavidad peritoneal en la ecografía. El diagnóstico diferencial de las lesiones hepáticas incluyó colangiohepatitis o, con menor probabilidad, un tumor maligno, que condujo a una derivación portosistémica adquirida. La lesión esplénica pudo haberse presentado secundaria a la anemia por hematopoyesis extramedular. El diagnóstico tentativo fue colangiohepatitis concurrente con anemia crónica secundaria leve por hemorragia intestinal causada por infección por Giardia. El paciente recibió soporte hepático (incluyendo ácido ursodesoxicólico (AUDCA), 10 mg/kg, dos veces al día; silimarina, 10 mg/kg, dos veces al día) y un agente antiprotozoario (metronidazol, 10 mg/kg, dos veces al día). Sin embargo, el perro no mostró signos de mejoría (Tabla 1), y la repetición de la ecografía abdominal no mostró cambios al mes de seguimiento. A continuación, se realizó una TC helicoidal multifásica después de 1 mes de tratamiento para su posterior investigación.
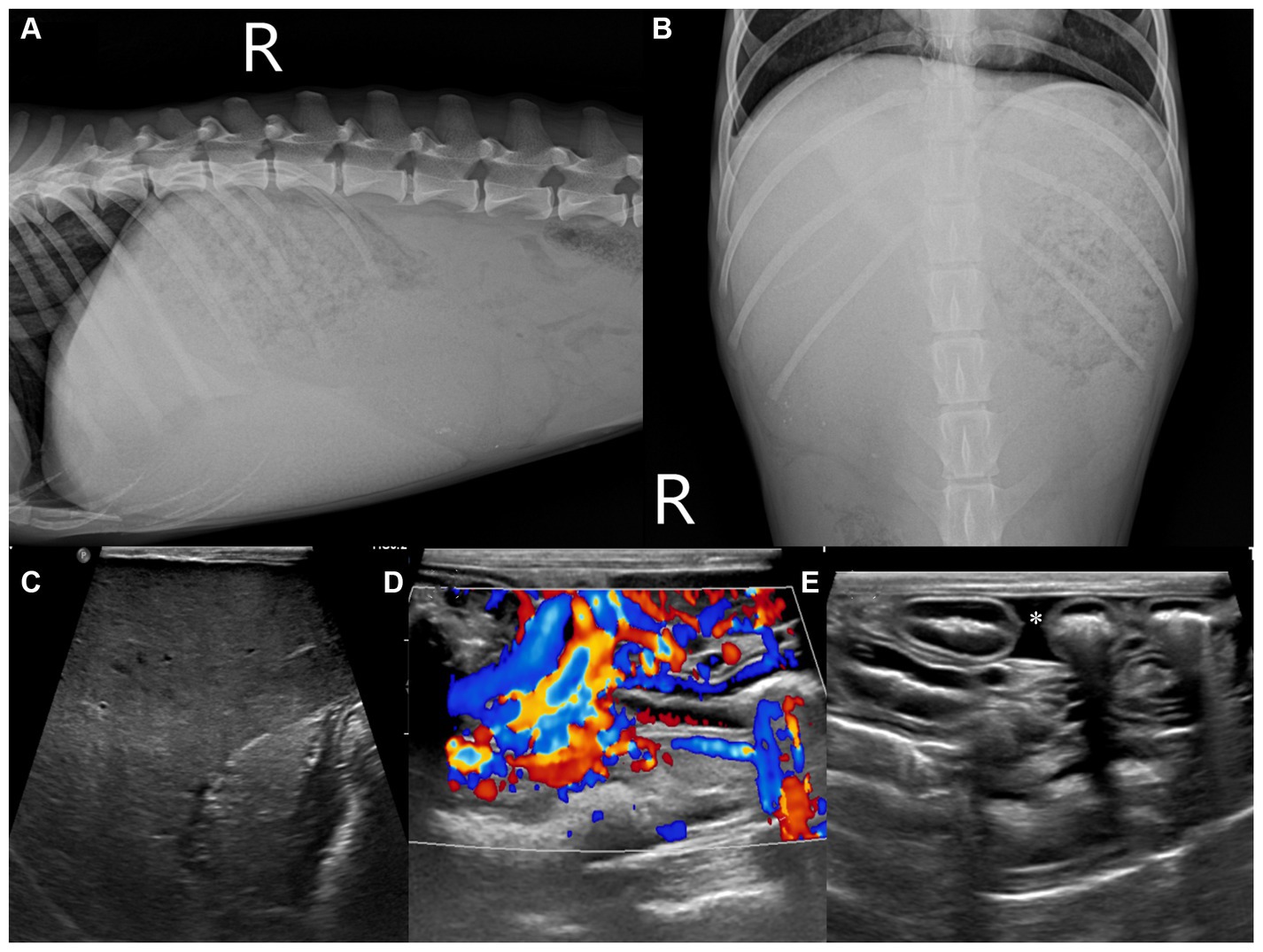 Figura 1. Examen radiográfico y ultrasonográfico abdominal (A-E). Radiografías laterales derechas (A) y ventrodorsales (B) de abdomen. Los márgenes hepáticos caudoventrales son redondeados y el eje gástrico está desviado caudalmente. El parénquima hepático muestra una opacidad irregular en forma de red, heterogéneamente aumentada. Imágenes ultrasonográficas Doppler en modo B y color del hígado (C), cerca del riñón izquierdo (D) y de la cavidad peritoneal (E). El parénquima hepático ilustra un aumento uniforme de la ecogenicidad con una visualización reducida de las estructuras portales (C). Se observaron numerosos vasos pequeños y tortuosos cerca del riñón izquierdo (D) y se acumuló una pequeña cantidad de líquido peritoneal (E), asterisco.
Figura 1. Examen radiográfico y ultrasonográfico abdominal (A-E). Radiografías laterales derechas (A) y ventrodorsales (B) de abdomen. Los márgenes hepáticos caudoventrales son redondeados y el eje gástrico está desviado caudalmente. El parénquima hepático muestra una opacidad irregular en forma de red, heterogéneamente aumentada. Imágenes ultrasonográficas Doppler en modo B y color del hígado (C), cerca del riñón izquierdo (D) y de la cavidad peritoneal (E). El parénquima hepático ilustra un aumento uniforme de la ecogenicidad con una visualización reducida de las estructuras portales (C). Se observaron numerosos vasos pequeños y tortuosos cerca del riñón izquierdo (D) y se acumuló una pequeña cantidad de líquido peritoneal (E), asterisco.
La TC se realizó con un escáner de 64 cortes (Aquillion64™, Toshiba Medical Systems, Tochigi, Japón). La anestesia fue inducida con propofol (6 mg/kg, IV) y mantenida con isoflurano. El protocolo de TC fue el siguiente: 0,5 mm de espesor de corte, 120 kVp, 150 mAs, matriz 512 × 512 y 0,75 s/rotación. Se utilizó Iohexol (Omnipaque™ 300, GE Healthcare, Chicago, IL, EE. UU.) para estudios de TC con contraste intravenoso a una dosis de 700 mgI/kg, administrada por un inyector de potencia (Dual Shot GX-7, Nemoto Kyorindo co., Ltd., Tokio, Japón) con una tasa de inyección de 2,5 m/s. Se utilizó un protocolo de seguimiento en bolo durante la adquisición arterial en dirección craneal a caudal y se activó cuando la aorta que era justo caudal a la porta hepática se alcanzó a 250 UH, demostrando la fase arterial. De acuerdo con el procedimiento estándar, la fase portal se adquirió en dirección craneal a caudal 40 s después de la administración de contraste. La fase retardada se adquirió después de 120 s, y las imágenes se reconstruyeron en secuencias transversales de 2,0 mm, con imágenes sagitales, dorsales y oblicuas reformateadas utilizando algoritmos de tejidos blandos y pulmón.
En la imagen previa al contraste se observó una marcada hepatomegalia, excepto en el lóbulo hepático izquierdo con la vesícula biliar anormalmente desviada hacia la izquierda. El parénquima hepático tenía un aspecto moteado. El aumento homogéneo de la densidad parenquimatosa se observó en todos los lóbulos hepáticos (Figuras 2A-C). El lóbulo hepático izquierdo era pequeño, con una densidad parenquimatosa homogénea aumentada más prominente (Figura 2A). Los ganglios linfáticos hepáticos, esplénicos y gástricos estaban agrandados con un marcado aumento de la densidad parenquimatosa, como se observó en el parénquima pancreático (Figuras 2B, C). Para la evaluación cuantitativa, se trazaron tres regiones circulares diferentes de interés sobre el parénquima hepático izquierdo y derecho, los ganglios linfáticos y el parénquima pancreático, evitando los vasos principales. Para cada región de interés, se registraron los valores de atenuación promedio (desviación estándar, [DE]) (HU, Unidades de Hounsfield) y se calculó un promedio de las tres mediciones. También se registraron los valores de atenuación del parénquima esplénico para compararlos con los valores hepáticos, ganglionares y pancreáticos. Los valores medios (DE) de atenuación hepática, ganglionar linfática, parenquimatosa pancreática y esplénica izquierda y derecha fueron de 254,26 HU (17,28), 129,21 HU (14,96), 264,75 HU (7,48), 71,36 HU (3,67) y 52,95 HU (3,18), respectivamente. En las imágenes posteriores al contraste, había numerosas várices en el esófago, la vena gástrica izquierda, la vena pancreaticoduodenal, las venas renal a esplénica izquierda y las regiones mesentérica y cólica (Figuras 2D-F). Había una pequeña cantidad de líquido peritoneal acumulado. No se detectaron lesiones anormales en tórax.
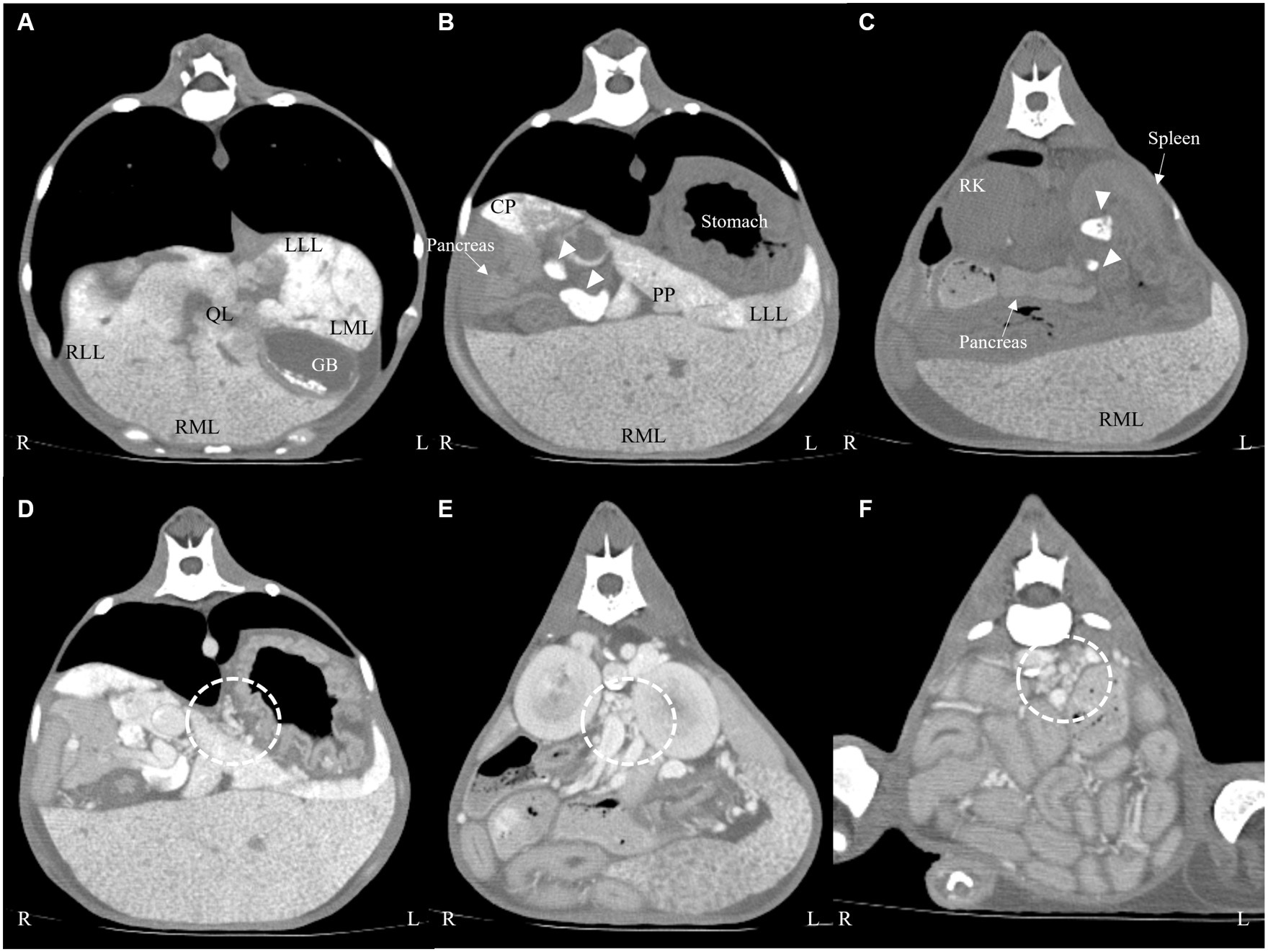 Figura 2. Imágenes de tomografía computarizada transversal: imágenes de precontraste (A-C) y post-contraste (D-F) en un algoritmo de tejidos blandos. Agrandamiento generalizado del hígado (A-C) y de los ganglios linfáticos ((B,C), puntas de flecha) con aumento de la atenuación en comparación con el parénquima esplénico. Había numerosas várices en la vena gástrica izquierda (D), renal izquierda (E) y región cólica (F) (línea punteada). LLL: lóbulo lateral izquierdo; amo mi vida, lóbulo medial izquierdo; RLL: lóbulo lateral derecho; RML: lóbulo medial derecho; QL: lóbulo cuadrado; CP: apófisis caudada del lóbulo caudado; PP: apófisis papilar del lóbulo caudado; GB: vesícula biliar; RK: riñón derecho.
Figura 2. Imágenes de tomografía computarizada transversal: imágenes de precontraste (A-C) y post-contraste (D-F) en un algoritmo de tejidos blandos. Agrandamiento generalizado del hígado (A-C) y de los ganglios linfáticos ((B,C), puntas de flecha) con aumento de la atenuación en comparación con el parénquima esplénico. Había numerosas várices en la vena gástrica izquierda (D), renal izquierda (E) y región cólica (F) (línea punteada). LLL: lóbulo lateral izquierdo; amo mi vida, lóbulo medial izquierdo; RLL: lóbulo lateral derecho; RML: lóbulo medial derecho; QL: lóbulo cuadrado; CP: apófisis caudada del lóbulo caudado; PP: apófisis papilar del lóbulo caudado; GB: vesícula biliar; RK: riñón derecho.
Sobre la base de los hallazgos clínicos y de imagen, el diagnóstico diferencial fue la infiltración atípica (p. ej., acumulación de metales pesados) del parénquima hepático y los ganglios linfáticos y, con menor probabilidad, neoplasia con hipertensión portal inducida y derivación portosistémica adquirida consecuente.
Se realizó una biopsia laparoscópica de parénquima hepático y ganglios linfáticos (Stryker 1.288 HD, Stryker, Chicago, IL, USA). Un panel de coagulación mostró un tiempo de protrombina parcial ligeramente retrasado (124,5 s; rango de referencia, 75-105 s). La anestesia fue inducida con propofol (6 mg/kg, IV) y mantenida con isoflurano con aporte de oxígeno, y el perro fue monitoreado adecuadamente. Se utilizó una técnica de dos puertos. El paciente se colocó en decúbito dorsal y se colocó un puerto de cámara subumbilical de 6 mm en la línea media ventral justo caudal al ombligo mediante la técnica de Hasson modificada. Se colocó un segundo puerto de instrumento de 6 mm a medio camino entre el puerto de la cámara y el proceso xifoides. Se insertó un laparoscopio de 5 mm y 30 grados y, antes de obtener cualquier muestra de biopsia, se evaluaron las superficies diafragmática y visceral de cada lóbulo hepático en busca de lesiones macroscópicas. Se introdujo un instrumento de biopsia en copa de 5 mm y se obtuvieron seis muestras (incluyendo 2 lóbulos hepáticos medios derechos, 1 lateral derecho, 1 medial izquierdo, 1 cuadrado y ganglios linfáticos gástricos). Los tejidos del parénquima hepático y del ganglio linfático se fijaron en formalina tamponada neutra al 10% y se enviaron a un laboratorio para su evaluación histológica (IDEXX Laboratories Inc., Westbrook, ME, EE. UU.).
En la evaluación macroscópica, el hígado estaba difusamente amarillo a tostado y agrandado con micronodulaciones multifocales a coalescentes (Figura 3A). Después de la biopsia, el paciente fue monitoreado de cerca para detectar hemorragia. Aunque se confirmó un aumento de la cantidad de líquido peritoneal 1 día después del procedimiento de biopsia, no hubo signos de inestabilidad hemodinámica ni disminución relevante del hematocrito (hematocrito antes de la biopsia; 27,7 %, hematocrito 1 día después de la biopsia; 23,6 %; y rango de referencia, 37,3–61,7 %). El análisis de líquidos confirmó que la ascitis se produce por «no» sangrado (hematocrito, 0,8%). Sobre los hallazgos macroscópicos se realizó un diagnóstico presuntivo de hepatopatía crónica y, por lo tanto, el paciente recibió cuidados de soporte hepático (AUDCA, 10 mg/kg, dos veces al día; silimarina, 10 mg/kg, dos veces al día; SAMe, 10 mg/kg, dos veces al día; doxiciclina 5 mg/kg, dos veces al día y espironolactona, y 1 mg/kg, dos veces al día) y transfusión de albúmina. Sin embargo, los síntomas progresaron a anemia e hipoalbuminemia más severas, y el paciente finalmente murió 7 días después de la biopsia laparoscópica.
 Figura 3. Fotografía laparoscópica (A) del hígado y hallazgos histopatológicos después de la tinción de HE (B) y la tinción de azul de Prusia (C) del hígado. El hígado era difusamente amarillo a tostado y mostraba micronodulación multifocal macroscópicamente (A). Se observaron abundantes grupos de células de Kupffer que contenían hemosiderina intracitoplasmática (B, ×20), y la tinción con azul de Prusia (C, ×20) confirmó una marcada acumulación de hierro dentro de los hepatocitos.
Figura 3. Fotografía laparoscópica (A) del hígado y hallazgos histopatológicos después de la tinción de HE (B) y la tinción de azul de Prusia (C) del hígado. El hígado era difusamente amarillo a tostado y mostraba micronodulación multifocal macroscópicamente (A). Se observaron abundantes grupos de células de Kupffer que contenían hemosiderina intracitoplasmática (B, ×20), y la tinción con azul de Prusia (C, ×20) confirmó una marcada acumulación de hierro dentro de los hepatocitos.
El examen histológico de las muestras de biopsia hepática confirmó una marcada mineralización del mural vascular o calcificación con reduplicación vascular portal (Figura 3B). A lo largo del intersticio portal afectado, se observaron abundantes grupos de células de Kupffer que contenían hemosiderina intracitoplasmática. La tinción con azul de Prusia mostró una marcada acumulación de hierro dentro de los hepatocitos en los nódulos regenerativos, los tabiques intersticiales y los grupos de macrófagos (Figura 3C). La tinción de rodanina no mostró acumulación patológica de cobre. Los ganglios linfáticos gástricos también mostraron cambios muy similares a los observados en el hígado. Se realizó un diagnóstico definitivo de disfunción hepática inducida por hemocromatosis y posterior hipertensión portal con base en la TC y el examen histopatológico.
Discusión
La hemocromatosis se define como un trastorno caracterizado por la deposición excesiva de hierro, que conduce a una disfunción orgánica múltiple, con un énfasis particular en la toxicidad hepática. Las concentraciones séricas de ferritina, que están asociadas con el almacenamiento de hierro en los tejidos y proporcionan una medida útil del hierro corporal total, se utilizan para diagnosticar condiciones de sobrecarga de hierro (9). Sin embargo, debido a que la ferritina es una proteína de fase aguda, los animales con inflamación coexistente, así como aquellos con otras enfermedades como enfermedades hemolíticas y hepáticas y algunos trastornos neoplásicos, pueden tener mayores cantidades de ferritina (1).
En medicina humana, la biopsia hepática y el estudio por imágenes (TC o RM) son generalmente los métodos de diagnóstico. La ecografía no es una modalidad adecuada para evaluar la sobrecarga hepática de hierro, ya que no puede detectar el depósito de hierro (10). La TC sin realce muestra un aumento homogéneo de la atenuación del parénquima hepático. En los seres humanos, los valores de atenuación de la TC no mejorada del hígado normal varían de 50 a 65 HU (frente a un rango de 60-70 HU para los perros) (11). En los casos de sobrecarga hepática de hierro humana, la TC no realzada revela un aumento de la atenuación hepática (por encima de 70 UH) (12) debido a la mayor densidad de electrones asociada con los átomos de hierro en comparación con el tejido hepático normal. Se puede observar un aumento de la atenuación hepática en los trastornos de almacenamiento, la sarcoidosis, la hepatopatía por cobre y la hepatotoxicidad inducida por fármacos (amiodarona, metotrexato y oro), por lo que se requiere precaución durante la interpretación (13-15). A la hora de diagnosticar la sobrecarga de hierro, la TC tiene una baja sensibilidad del 63% y una alta especificidad del 96% (13). En nuestro caso, la ecografía abdominal no aportó evidencia de apoyo para el diagnóstico de hemocromatosis, pero sí reveló distinciones con respecto a la enfermedad hepática general. El hígado presentaba un prominente parénquima hiperecogénico agrandado con múltiples derivaciones portosistémicas adquiridas. Sospechábamos de causas hepáticas de hipertensión portal, pero el diagnóstico inicial era desconcertante. Además, a pesar de la ausencia de un reporte relacionado con la sobrecarga de hierro en el examen de TC en medicina veterinaria, nuestro caso mostró resultados similares a los de la medicina humana.
La resonancia magnética (RM) es la herramienta no invasiva más común en medicina humana para diagnosticar la sobrecarga de hierro en el hígado, determinar la gravedad y monitorizar con alta sensibilidad, especificidad y valores predictivos positivos y negativos (16). Los iones de hierro tienen propiedades superparamagnéticas, que provocan un acortamiento de los tiempos de relajación T1, T2 y T2* y dan lugar a una señal hipointensa en los órganos afectados (16). Los ecos de gradiente son más sensibles a los efectos de susceptibilidad que los ecos de espín y, por lo tanto, los casos leves de sobrecarga de hierro pueden ser evidentes solo en las imágenes de eco de gradiente (17). Si la sobrecarga de hierro es grave, el grado de pérdida de señal puede marcarse en todas las imágenes (16). No fue posible realizar una resonancia magnética a nuestro paciente, lo que pone de manifiesto la necesidad de realizar más estudios en medicina veterinaria sobre el diagnóstico y seguimiento de la enfermedad por sobrecarga hepática de hierro.
Generalmente, el hierro se administra primero al sistema reticuloendotelial (RES), y cuando la capacidad de almacenamiento de RES se satura, el hierro se acumula en los hepatocitos y las células parenquimatosas de otros órganos (18). Por lo tanto, en medicina humana, la sobrecarga de hierro se puede clasificar como patrones de depósito reticuloendotelial, parenquimatoso o renal, lo que puede ayudar a distinguir las posibles causas de la hemocromatosis. En primer lugar, el patrón de depósito reticuloendotelial, que ocurre como consecuencia de transfusiones repetidas, generalmente ocurre en el sistema reticuloendotelial (p. ej., el hígado, el bazo y la médula ósea) y no se asocia con daño tisular (19, 20). En segundo lugar, el patrón de depósito parenquimatoso se desarrolla en casos de mayor absorción de hierro, como la hemocromatosis primaria o la anemia crónica con eritropoyesis ineficiente. El exceso de hierro se acumula, lo que provoca daño tisular inicialmente en los hepatocitos periportales y se extiende a la porción restante del hígado, el páncreas y la glándula tiroides (20, 21). En tercer lugar, solo se observa un patrón de depósito renal en el caso de hemólisis intravascular en la corteza renal (22). Nuestro paciente presentaba un patrón de depósito parenquimatoso (p. ej., hígado, ganglio linfático y páncreas), por lo que se sospechaba que la causa de la hemocromatosis era anemia primaria o crónica. A pesar de que el paciente presentaba anemia normocrómica microcítica leve, se consideró que era consecuencia de la enfermedad (enfermedad hepática crónica) y no de la causa subyacente, como el estado ferropénico de la enfermedad. Además, afecciones como la deficiencia de piruvato quinasa pueden causar anemia hemolítica crónica o intermitente grave. Sin embargo, nuestro paciente no presentaba anemia hemolítica en el momento de la presentación y no presentaba estado anémico al momento del rescate. Por lo tanto, la causa de la hemocromatosis sigue sin estar clara.
En humanos, la hepatomegalia se observa con frecuencia en las primeras etapas, pero la cirrosis ocurre cuando la hemocromatosis es progresiva (9). Histológicamente, a medida que el hierro se acumula, la fibrosis se desarrolla lentamente en una distribución periportal. Con el tiempo, se produce fibrosis y cirrosis de puente portal-portal, lo que da lugar a un patrón micronodular difuso (2), que induce un aumento de la resistencia al flujo sanguíneo de la vena porta y conduce a la hipertensión portal. En nuestro paciente, el tamaño del hígado era desigual, con el lóbulo hepático izquierdo notablemente más pequeño y los otros lóbulos agrandados. El lóbulo hepático izquierdo (254 HU) mostró un valor de HU más alto que los otros lóbulos hepáticos (129 HU). Inicialmente, sospechamos que el hígado izquierdo era el que presentaba la mayor acumulación de hierro y el cambio cirrótico, pero faltaban características histopatológicas compatibles con hepatitis crónica activa. En medicina humana, la correlación entre la atenuación de la TC y la concentración hepática de hierro es pobre (13), lo que requiere precaución para su interpretación. Además, nuestro caso se consideró hipertensión portal inductora de hemocromatosis, independientemente del estadio. Sin embargo, la causa de la variación en el tamaño hepático sigue siendo desconocida.
Para prevenir el daño irreversible a los órganos en pacientes con hemocromatosis, el diagnóstico precoz y el inicio oportuno de los tratamientos adecuados son fundamentales (9). La flebotomía es el tratamiento estándar en humanos. Sin embargo, tanto en los casos de sobrecarga de hierro como de anemia, también se puede considerar la terapia de quelación del hierro (9). Sin embargo, como la hemocromatosis rara vez se ha descrito en medicina veterinaria, no hay experiencia con la quelación del hierro en perros. Además, dado que el paciente ya había progresado a hipertensión portal, se seleccionó una terapia conservadora, pero finalmente condujo a la muerte.
Nuestro estudio tuvo algunas limitaciones. En primer lugar, no se realizó una resonancia magnética del hígado y las pruebas de nivel de ferritina sérica debido a limitaciones financieras, ya que nuestro paciente era un rescate de un refugio de animales. Sin embargo, la TC y el examen histopatológico confirmaron el diagnóstico de hemocromatosis. En segundo lugar, la causa de la hemocromatosis no está clara. Aunque el patrón de imagen sugería depósito de hierro parenquimatoso, un criterio adaptado de la medicina humana, es necesario descartar otras causas. Por último, se desconocía la historia del paciente, que incluía factores como las transfusiones de sangre repetidas y la administración excesiva de hierro, por lo que no se realizó necropsia.
En conclusión, la hemocromatosis debe incluirse en las listas de diagnóstico diferencial clínico de perros con disfunción hepática concurrente con hepatomegalia e hipertensión portal. Dado que la ecografía abdominal no es una modalidad adecuada para evaluar la sobrecarga hepática de hierro, se deben realizar exámenes de imagen multimodales para investigar la afección. Debido a un valor de HU notablemente elevado del parénquima hepático en las imágenes previas al contraste, la TC permitió el diagnóstico cualitativo y cuantitativo del estado de sobrecarga difusa de hierro y fue confirmada por histopatología para un diagnóstico definitivo.
Declaración de disponibilidad de datos
Las contribuciones originales presentadas en el estudio se incluyen en el artículo/material complementario, las consultas posteriores pueden dirigirse al autor correspondiente.
Declaración ética
No se requirió aprobación ética para el estudio con animales de acuerdo con la legislación local y los requisitos institucionales porque no se requirió aprobación ética para el estudio porque el informe de caso es una descripción de un caso clínico. No se pudo obtener el consentimiento informado por escrito porque el paciente es un perro de rescate, sin embargo, se permitió la prueba de diagnóstico del centro de protección animal en Suwon.
Contribuciones de los autores
MC: Conceptualización, Análisis formal, Redacción – borrador original. NL: Supervisión, Redacción – revisión y edición.
Financiación
El/los autor/es declaran/n que no se recibió apoyo financiero para la investigación, autoría y/o publicación de este artículo.
Reconocimientos
Los autores desean agradecer a Editage (www.editage.co.kr) por la edición en inglés y al Centro Médico Animal BON.
Conflicto de intereses
Los autores declaran que la investigación se llevó a cabo en ausencia de relaciones comerciales o financieras que pudieran interpretarse como un posible conflicto de intereses.
Nota del editor
Todas las afirmaciones expresadas en este artículo son únicamente las de los autores y no representan necesariamente las de sus organizaciones afiliadas, ni las del editor, los editores y los revisores. Cualquier producto que pueda ser evaluado en este artículo, o afirmación que pueda ser hecha por su fabricante, no está garantizado ni respaldado por el editor.
Referencias
1. Kohgo, Y, Ikuta, K, Ohtake, T, Torimoto, Y y Kato, J. Metabolismo corporal del hierro y fisiopatología de la sobrecarga de hierro. Int J Hematol. (2008) 88:7–15. doi: 10.1007/s12185-008-0120-5
Resumen de PubMed | Texto completo de Crossref | Google Académico
2. McCown, JL, y Specht, AJ. Homeostasis del hierro y trastornos en perros y gatos: una revisión. J Am Anim Hosp Assoc. (2011) 47:151–60. doi: 10.5326/JAAHA-MS-5553
Resumen de PubMed | Texto completo de Crossref | Google Académico
3. Batas, KP. Los síndromes de sobrecarga de hierro y el hígado. Mod Pathol. (2007) 20:S31–9. doi: 10.1038/modpathol.3800715
4. Siah, CW, Ombiga, J, Adams, LA, Trinder, D, y Olynyk, JK. Metabolismo normal del hierro y fisiopatología de los trastornos por sobrecarga de hierro. Clin Biochem Rev. (2006) 27:5–16.
5. Sprague, WS, Hackett, TB, Johnson, JS y Swardson-Olver, CJ. Hemocromatosis secundaria a transfusiones sanguíneas repetidas en un perro. Veterinario Pathol. (2003) 40:334–7. doi: 10.1354/vp.40-3-334
Resumen de PubMed | Texto completo de Crossref | Google Académico
7. Giger, U, y Noble, NA. Determinación de la deficiencia de piruvato quinasa eritrocitaria en basenjis con anemia hemolítica crónica. J Am Vet Med Assoc. (1991) 198:1755–61. doi: 10.2460/javma.1991.198.010.1755
Resumen de PubMed | Texto completo de Crossref | Google Académico
8. Gultekin, GI, Raj, K, Foureman, P, Lehman, S, Manhart, K, Abdulmalik, O, et al. Mutaciones de la piruvato quinasa eritrocítica que causan anemia hemolítica, osteoesclerosis y hemocromatosis secundaria en perros. J Veterinario Pasante Med. (2012) 26:935–44. doi: 10.1111/j.1939-1676.2012.00958.x
Resumen de PubMed | Texto completo de Crossref | Google Académico
9. Crawford, DHG, Ramm, GA, Bridle, KR, Nicoll, AJ, Delatycki, MB y Olynyk, JK. Guías de práctica clínica sobre hemocromatosis: Asociación Asiática del Pacífico para el Estudio del Hígado. Hepatol Int. (2023) 17:522–41. doi: 10.1007/s12072-023-10510-3
Resumen de PubMed | Texto completo de Crossref | Google Académico
10. Matheson, JS, Paul-Murphy, J, O’Brien, RT y Steinberg, H. Ultrasonido cuantitativo, imágenes de resonancia magnética y análisis de imágenes histológicas de la acumulación hepática de hierro en palomas (Columbia livia). J Zoo Wildl Med. (2007) 38:222–30. doi: 10.1638/1042-7260(2007)038[0222:QUMRIA]2.0.CO; 2
Resumen de PubMed | Texto completo de Crossref | Google Académico
11. Rossi, F, Morandi, F, y Schwarz, T. Hígado, vesícula biliar y bazo En: T Schwarz y J Saunders, editores. Tomografía computarizada veterinaria. Chichester, Reino Unido: Wiley-Blackwell (2011). 297–314.
12. Chezmar, JL, Nelson, RC, Malko, JA, y Bernardino, ME. Sobrecarga hepática de hierro: diagnóstico y cuantificación por imagen no invasiva. Gastrointest Radiol. (1990) 15:27–31. doi: 10.1007/BF01888728
13. Howard, JM, Gante, CN, Carey, LS, Flanagan, PR, y Valberg, LS. Eficacia diagnóstica de la tomografía computarizada hepática en la detección de sobrecarga de hierro corporal. Gastroenterología. (1983) 84:209–15. doi: 10.1016/S0016-5085(83)80113-9
Resumen de PubMed | Texto completo de Crossref | Google Académico
14. Goldman, IS, Winkler, ML, Raper, SE, Barker, ME, Keung, E, Goldberg, HI, et al. Aumento de la densidad hepática y fosfolípidos por amiodarona. AJR Am J Roentgenol. (1985) 144:541–6. doi: 10.2214/ajr.144.3.541
Resumen de PubMed | Texto completo de Crossref | Google Académico
15. De Maria, M, De Simone, G, Laconi, A, Mercadante, G, Pavone, P, y Rossi, P. Almacenamiento de oro en el hígado: aparición en las tomografías computarizadas. Radiología. (1986) 159:355–6. doi: 10.1148/radiology.159.2.3961168
Resumen de PubMed | Texto completo de Crossref | Google Académico
16. Queiroz-Andrade, M, Blasbalg, R, Ortega, CD, Rodstein, MAM, Baroni, RH, Rocha, MS, et al. Hallazgos de imágenes de RM de sobrecarga de hierro. Radiografías. (2009) 29:1575–89. doi: 10.1148/rg.296095511
17. Gandon, Y, Guyader, D, Heautot, JF, Reda, MI, Yaouanq, J, Buhé, T, et al. Hemocromatosis: diagnóstico y cuantificación del hierro hepático con imágenes de RM de ecocardiograma de gradiente. Radiología. (1994) 193:533–8. doi: 10.1148/radiology.193.2.7972774
Resumen de PubMed | Texto completo de Crossref | Google Académico
18. Stark, DD. Sobrecarga hepática de hierro: patología paramagnética. Radiología. (1991) 179:333–5. doi: 10.1148/radiology.179.2.2014271
Resumen de PubMed | Texto completo de Crossref | Google Académico
19. Siegelman, ES, Mitchel, DG, y Semelka, RC. Depósito abdominal de hierro: metabolismo, hallazgos de RM e importancia clínica. Radiología. (1996) 199:13–22. doi: 10.1148/radiology.199.1.8633135
Resumen de PubMed | Texto completo de Crossref | Google Académico
20. Siegelman, ES, Mitchell, DG, Rubin, R, Hann, HW, Kaplan, KR, Steiner, RM, et al. Sobrecarga de hierro parenquimatoso versus reticuloendotelial en el hígado: distinción con imágenes de RM. Radiología. (1991) 179:361–6. doi: 10.1148/radiology.179.2.2014275
Resumen de PubMed | Texto completo de Crossref | Google Académico
21. Siegelman, ES, Mitchell, RG, Outwater, E, Muñoz, SJ y Rubin, R. Hemocromatosis idiopática: hallazgos de imágenes de RM en pacientes cirróticos y precirróticos. Radiología. (1993) 188:637–41. doi: 10.1148/radiology.188.3.8351325
Resumen de PubMed | Texto completo de Crossref | Google Académico
22. Roubidoux, MA. Imágenes por resonancia magnética de hemorragia y depósito de hierro en el riñón. Radiografías. (1994) 14:1033–44. doi: 10.1148/radiographics.14.5.7991812
Resumen de PubMed | Texto completo de Crossref | Google Académico
Palabras clave: canino, trastorno por sobrecarga de hierro, hemocromatosis, hipertensión portal, TC pre-contraste
Cita: Choi M y Lee N (2024) Caso clínico: Características de las imágenes ultrasonográficas y tomográficas computarizadas de la hemocromatosis en un perro. Frente. Vet. Sci. 10:1331392. doi: 10.3389/fvets.2023.1331392
Recibido: 01 de noviembre de 2023; Aceptado: 28 de diciembre de 2023;
Publicado: 15 enero 2024.
Editado por:
Mário Ginja, Universidad de Trás-os-Montes y Alto Duero, Portugal
Revisado por:
Nan Choisunirachon, Universidad de Chulalongkorn, Tailandia
Simonetta Citi, Universidad de Pisa, Italia
Derechos de autor © 2024 Choi y Lee. Este es un artículo de acceso abierto distribuido bajo los términos de la Licencia Creative Commons Attribution License (CC BY).
*Correspondencia: Namsoon Lee, ultravet@cbnu.ac.kr
Renuncia: Todas las afirmaciones expresadas en este artículo son únicamente las de los autores y no representan necesariamente las de sus organizaciones afiliadas, ni las del editor, los editores y los revisores. Cualquier producto que pueda ser evaluado en este artículo o afirmación que pueda hacer su fabricante no está garantizado ni respaldado por el editor.
Date de alta y recibe nuestro 👉🏼 Diario Digital AXÓN INFORMAVET ONE HEALTH
Date de alta y recibe nuestro 👉🏼 Boletín Digital de Foro Agro Ganadero
Noticias animales de compañía
Noticias animales de producción
Trabajos técnicos animales de producción
Trabajos técnicos animales de compañía


 Namsoon Lee2*
Namsoon Lee2*