Caso clínico: quimiodectoma maligno con metástasis hepática en un gato
Caso clínico: quimiodectoma maligno con metástasis hepática en un gato
 Shakirat Adeola Adetunji1
Shakirat Adeola Adetunji1  Kaiwen Chen2
Kaiwen Chen2  Justin Thomason2
Justin Thomason2  Franco Matías Ferreyra1*
Franco Matías Ferreyra1*- 1Laboratorio de Diagnóstico Veterinario del Estado de Kansas, Medicina de Diagnóstico y Patobiología, Universidad Estatal de Kansas, Manhattan, KS, Estados Unidos
- 2Departamento de Ciencias Clínicas, Facultad de Medicina Veterinaria, Universidad Estatal de Kansas, Manhattan, KS, Estados Unidos
Un gato doméstico de pelo corto macho castrado de 10 años fue examinado en el Servicio de Emergencia del Centro de Salud Veterinaria de la Universidad Estatal de Kansas por una historia de disnea de un día. Antes de la toracocentesis, se administró sedación. El gato dejó de respirar después de la sedación y sufrió un paro cardíaco. La reanimación cardiopulmonar (RCP) no tuvo éxito. En la necropsia había derrame pleural severo y atelectasia pulmonar bilateral. El miocardio de las aurículas y ventrículos, y la túnica adventicia de los vasos coronarios, la arteria pulmonar y la aorta, presentaban masas multinodulares pálidas, firmes y que variaban de 0,3 a 0,5 cm de diámetro. También había múltiples nódulos en el hígado. Expandiendo multifocalmente la grasa epicárdica y comprimiendo el epicardio subyacente, infiltrando y expandiendo el miocardio, y expandiendo las paredes de los vasos principales, había una neoplasia multinodular, no encapsulada, densamente celular, compuesta de células epiteliales poligonales dispuestas en nidos y paquetes y sostenidas por un estroma fibrovascular fino. Los nódulos en el hígado tenían características histológicas similares. En este caso, las células neoplásicas en los sitios primario y metastásico fueron intensamente inmunorreactivas a la sinaptofisina, reactivas de forma variable a la cromogranina A y negativas para la enolasa específica de las neuronas, la citoqueratina, la vimentina, la tiroglobulina y la actina del músculo liso. Los hallazgos macroscópicos, histológicos e inmunohistoquímicos apoyan el diagnóstico de quimiodectoma, con metástasis hepáticas. La sinaptofisina y la cromogranina A fueron los marcadores inmunohistoquímicos más útiles para el diagnóstico de quimiodectoma maligno en este gato.
Introducción
Las neoplasias cardíacas primarias son raras en gatos domésticos y existen muy pocos informes en la literatura. Las neoplasias cardíacas notificadas con mayor frecuencia en estos animales incluyen linfoma, hemangiosarcoma, rabdomiosarcoma, ganglioneuroma, tumores metastásicos y, con menor frecuencia, tumores de la aorta y del cuerpo carotídeo (paraganglioma/quimiodecoma) (1–14). A diferencia de los gatos, los quimiodectomas son comunes en perros, especialmente en las razas braquicéfalas, y existe abundante literatura que detalla las características clínicas y patológicas, así como el manejo de esta neoplasia (2, 15-17).
El quimiodectoma es una neoplasia generalmente benigna compuesta de células quimiorreceptoras neoplásicas y, a menudo, son benignas. Las células quimiorreceptoras están presentes en varios tejidos del cuerpo, incluidos los cuerpos aórticos y carotídeos ubicados en las regiones submandibulares y craneales cervicales y adventicia de los vasos principales en la base del corazón, el páncreas, los ojos, el oído y algunos nervios craneales (18). Las células quimiorreceptoras detectan cambios en el pH, el dióxido de carbono y la tensión de oxígeno; Por lo tanto, ayudan en la regulación de parámetros fisiológicos, incluida la respiración y la circulación sanguínea (19, 20). Estas células son similares a las células medulares suprarrenales; sin embargo, son negativos para la tinción cromafín; Por lo tanto, las neoplasias de las células quimiorreceptoras se designan quimiomodectoma o paraganglioma no cromafín (17). En los animales domésticos, las neoplasias del tejido quimiorreceptor se desarrollan comúnmente en los cuerpos aórtico y carotídeo, pero las neoplasias del cuerpo aórtico ocurren con mayor frecuencia (2, 12). La patogenia del quimiodectoma aún no está establecida; Sin embargo, se han implicado varios factores, como la predisposición genética en algunas razas de perros (braquicéfalos) y, especialmente, la hipoxia crónica, dado que las células quimiorreceptoras regulan la respiración y los parámetros de circulación sanguínea (21). Además, los estudios han demostrado una mayor incidencia de quimiodectomas en humanos y animales (principalmente perros y bovinos braquicéfalos) que viven en ambientes de gran altitud que comúnmente inducen hipoxia crónica (17, 22, 23).
Se sabe que los quimiodectomas son funcionalmente inactivos, y la mayoría de los signos clínicos observados se asocian con los efectos de ocupación de espacio del tumor u otras complicaciones como taquipnea/disnea secundaria a derrame pleural o disfagia como resultado de la compresión esofágica (24). Se ha producido un caso de taquipnea/disnea por derrame pleural secundario a quimiodectoma en un gato. Por lo tanto, el diagnóstico clínico de las neoplasias de la base cardíaca de crecimiento lento es difícil hasta que alcanzan un tamaño crítico o comienzan a causar cambios patológicos secundarios. Por lo tanto, a pesar de que las células del quimiodectoma son frágiles y se exfolian bien, el diagnóstico a menudo se realiza durante la necropsia.
En los perros, el riesgo de metástasis es mínimo, pero esto es común (1, 16, 25, 26). La extirpación quirúrgica, la quimioterapia y/o la radioterapia son las opciones de tratamiento típicas en humanos y perros (22). Las opciones de tratamiento reportadas para los gatos incluyen toracocentesis, quimioterapia y citorreducción quirúrgica. El tiempo de supervivencia de los quimiodectomas de la base cardíaca varía desde la eutanasia inmediatamente después del diagnóstico hasta los 19 meses (27).
Hasta la fecha, se han descrito muy pocos casos de quimiodectoma en gatos, y se dispone de mucha menos documentación de metástasis locales o a distancia de la neoplasia (2, 22, 24, 27). Dada la escasez de bibliografía sobre la incidencia y los factores predisponentes de esta neoplasia en gatos, los avances en el diagnóstico precoz y el tratamiento del quimiodectoma en gatos aún deben caracterizarse e investigarse. En este reporte se documenta un caso de quimiodectoma metastásico con énfasis en marcadores diagnósticos inmunológicos comunes útiles para el diagnóstico de esta entidad en un gato adulto doméstico.
Métodos y resultados
Un gato doméstico de pelo corto castrado macho de 10 años fue remitido al Servicio de Emergencia del Centro de Salud Veterinaria de la Universidad Estatal de Kansas para la evaluación de un historial de disnea de un día con episodios previos reportados de sibilancias durante la temporada de otoño. Por lo demás, el gato estaba sano y los signos clínicos respiratorios se atribuyeron previamente a la exposición al humo de los incendios forestales. A su llegada, el gato respiraba con la boca abierta y fue colocado en una jaula de oxígeno para recibir cuidados de apoyo. Después de la estabilización, un examen más completo reveló una reducción de los ruidos pulmonares bilaterales, pero no se evidenció soplo en la auscultación. La evaluación focalizada en el tórax con ecografía para traumatismos, triaje y pruebas de seguimiento (TFAST) reveló un derrame pleural bilateral moderado que afectaba más marcadamente al hemitórax derecho. Al gato se le administró butorfanol (0,23 mg/kg) por vía intramuscular y furosemida (3 mg/kg) por vía intravenosa. La frecuencia respiratoria disminuyó después de la administración de medicamentos, pero el paciente seguía siendo ortopneico. Posteriormente, se administró midazolam (0,2 mg/kg) y alfaxalona (0,75 mg/kg) por vía intravenosa para facilitar la toracocentesis terapéutica. A pesar de estar sedado, la frecuencia respiratoria del paciente continuó disminuyendo y desarrolló un paro cardíaco y pulmonar poco después. Se realizó reanimación cardiopulmonar (RCP) y se recuperó la respiración espontánea. El gato volvió a desarrollar un paro cardíaco después de unos 10 minutos y se realizó RCP adicional, pero no tuvo éxito.
En el momento de la necropsia, el animal se encontraba en buenas condiciones nutricionales con suficiente grasa subcutánea e intraabdominal, así como una adecuada musculatura esquelética. La cavidad pleural contenía aproximadamente 700 mL de líquido espeso y transparente. Bilateralmente, los pulmones eran difusamente atelectáticos. El pericardio estaba firmemente adherido a las aurículas derecha e izquierda y la cavidad pericárdica contenía aproximadamente 5 mL de líquido libre, de color rojo oscuro y ligeramente viscoso. El epicardio, los tejidos adiposos epicárdicos, el tabique interauricular, la túnica adventicia de los vasos coronarios, la arteria pulmonar y la aorta, presentaban masas múltiples, adherentes, firmes, pálidas, multinodulares de 0,3 a 0,5 cm de diámetro, de color rojo a blanco y veteadas en las superficies cortadas (Figura 1A). Después de la fijación en formol, una sección longitudinal del corazón reveló múltiples masas firmes, de borde amarillo, jaspeadas, con centros rojo-blancos que borraban las válvulas aórtica, pulmonar y auriculoventricular, y ambas aurículas (Figuras 1B, C). A todos los lóbulos hepáticos se observaron masas nodulares múltiples, de color canela, firmes y de tamaño variable (el nódulo más grande medía 1,5 × 1 × 0,4 cm) que se extendían hacia el parénquima en las secciones cortadas. Otros hallazgos macroscópicos incluyeron riñón izquierdo difusamente pequeño y encogido (3,5 cm de longitud en comparación con el derecho, 5 cm) y un riñón izquierdo irregular con un infarto de 1 cm de ancho que se extendía desde la corteza hasta la médula.
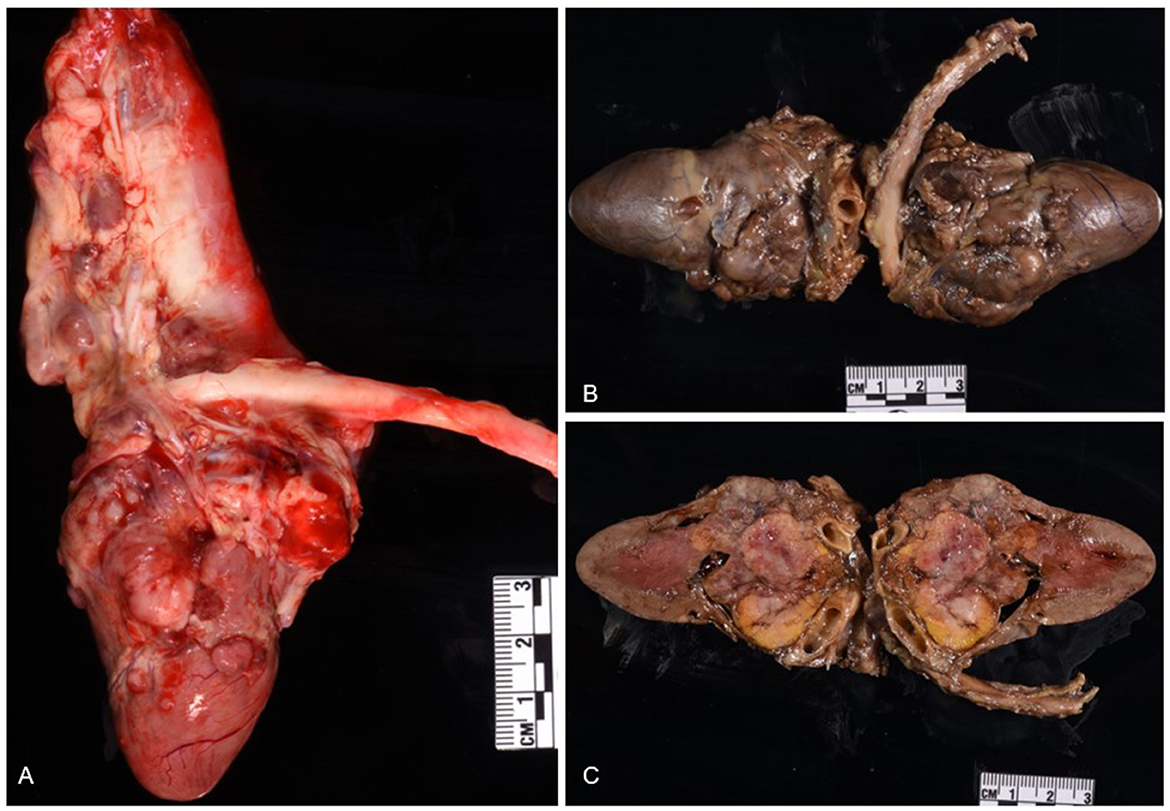 Figura 1. Chemodectoma en el corazón de un gato doméstico de pelo corto. La neoplasia borró las aurículas derecha e izquierda, las válvulas auriculoventriculares y los vasos sanguíneos principales del corazón. Corazón fresco (A); corazón fijado en formol (B, C).
Figura 1. Chemodectoma en el corazón de un gato doméstico de pelo corto. La neoplasia borró las aurículas derecha e izquierda, las válvulas auriculoventriculares y los vasos sanguíneos principales del corazón. Corazón fresco (A); corazón fijado en formol (B, C).
La evaluación histológica se realizó en secciones de tejido fijadas en formol e incluidas en parafina (5 μm) teñidas con hematoxilina y eosina (H&E) procesadas de forma rutinaria. Todos los reactivos de H&E se compraron en StatLab, McKinney, Texas, EE. UU. La evaluación microscópica de las masas en el corazón reveló una neoplasia multilobulada infiltrativa, no encapsulada, mal circunscrita, densamente celular, compuesta por células poligonales dispuestas en nidos y paquetes y sostenida por un estroma fibrovascular fino (Figura 2). Las células neoplásicas tenían bordes celulares variables y cantidades moderadas de citoplasma eosinófilo finamente granular, núcleos redondos u ovalados con cromatina finamente punteada y un nucléolo variablemente distinto. Hubo anisocitosis leve y anisocariosis moderada con cariomegalia rara. Había 22 figuras mitóticas en 2,37 mm2 (10 campos consecutivos de 400X). La neoplasia presentaba áreas multifocales de hemorragia y necrosis caracterizadas por hipereosinofilia citoplasmática y picnosis nuclear y cariorrexis; y rara vez fue infiltrado por un número moderado de linfocitos y macrófagos. La grasa epicárdica, la túnica adventicia, la media y la íntima de las grandes arterias también fueron infiltradas y borradas por nidos y paquetes de células neoplásicas. En el hígado, los nódulos fueron compatibles con la diseminación metastásica de la neoplasia cardíaca con base en características histológicas y morfológicas similares. El análisis inmunohistoquímico de secciones de la neoplasia cardíaca y hepática se realizó en el Laboratorio de Diagnóstico Veterinario del Estado de Kansas siguiendo protocolos internos validados. Todas las inmunotinciones se enumeran en la Tabla 1 y se realizaron con un tinción IHC Leica Bond Rxm (Leica Biosystems, Deer Park, Illinois, EE. UU.). Brevemente, la recuperación del antígeno se realizó utilizando citrato (pH 6,0; 10-20 min) y tampones EDTA (pH 9,0; 10-20 min). Posteriormente, se incubaron secciones durante 15 min con anticuerpos primarios contra citoqueratina (ratón anti-AE1/AE3; 1:100; Leica Biosystems, Illinois, EE.UU.), sinaptofisina (ratón anti-sy38; 1:100; Dako/Agilent, Santa Clara, CA, EE.UU.), cromogranina A/SP-1 (policlonal de conejo; 1:500; Kit de detección Refine, ImmunoStar, Hudson, Wisconsin, EE. UU.), enolasa neuronal específica (ratón, clon L1830, kit de detección Refine Red de Leica-Deer Park, IL), tiroglobulina (anti-EPR9730 conejo; 1:7.000; Abcam, Boston, EE.UU.), vimentina (anti-SRL33 para ratones; prediluido; Leica Biosystems, Deer Park, Illinois, EE.UU.) y actina-AME del músculo liso (anti-alfa sm-1 de ratón; prediluido; Leica Biosystems, Deer Park, Illinois, Estados Unidos). Posteriormente, las secciones de tejido se incubaron durante 25 minutos con IgG secundaria de Poly-HRP anti-conejo, o IgG de ratón PowerVision Poly-AP anti-ratón de los kits de tinción Refine Detection proporcionados por el fabricante (Leica Biosystems, Deer Park, Illinois, EE. UU.). Finalmente, las secciones se contratiñeron con hematoxilina de Gill (StatLab, McKinney, Texas, EE.UU.). Se utilizaron secciones de tejidos normales de otros animales para el control positivo; piel para la citoqueratina, tiroides para la tiroglobulina, glándula suprarrenal para la cromogranina y sinaptofisina, vejiga urinaria para la AME y un histiocitoma fibroso maligno dérmico para la vimentina. Aproximadamente el 100% y el 70% de las células neoplásicas fueron fuertemente positivas para sinaptofisina y cromogranina A, respectivamente (Figura 3). Las células neoplásicas fueron negativas para citoqueratina AE1/AE3, vimentina, tiroglobulina y actina del músculo liso. Se observaron observaciones similares en las células neoplásicas metastásicas del parénquima hepático.
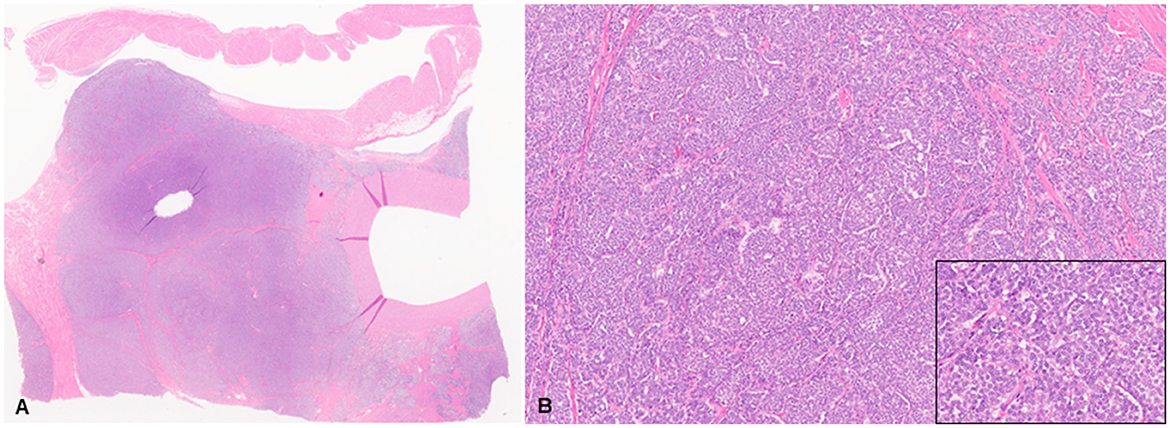 Figura 2. Chemodectoma en un gato doméstico, arteria pulmonar y aurícula derecha. Las células neoplásicas expanden y borran la túnica adventicia de la arteria pulmonar, los tejidos conectivos y adiposos adyacentes, e invaden la aurícula derecha. Tinciones de hematoxilina y eosina (H&E). Vista subgruesa (A) y aumento mayor (B). Recuadro: 400X H&E.
Figura 2. Chemodectoma en un gato doméstico, arteria pulmonar y aurícula derecha. Las células neoplásicas expanden y borran la túnica adventicia de la arteria pulmonar, los tejidos conectivos y adiposos adyacentes, e invaden la aurícula derecha. Tinciones de hematoxilina y eosina (H&E). Vista subgruesa (A) y aumento mayor (B). Recuadro: 400X H&E.
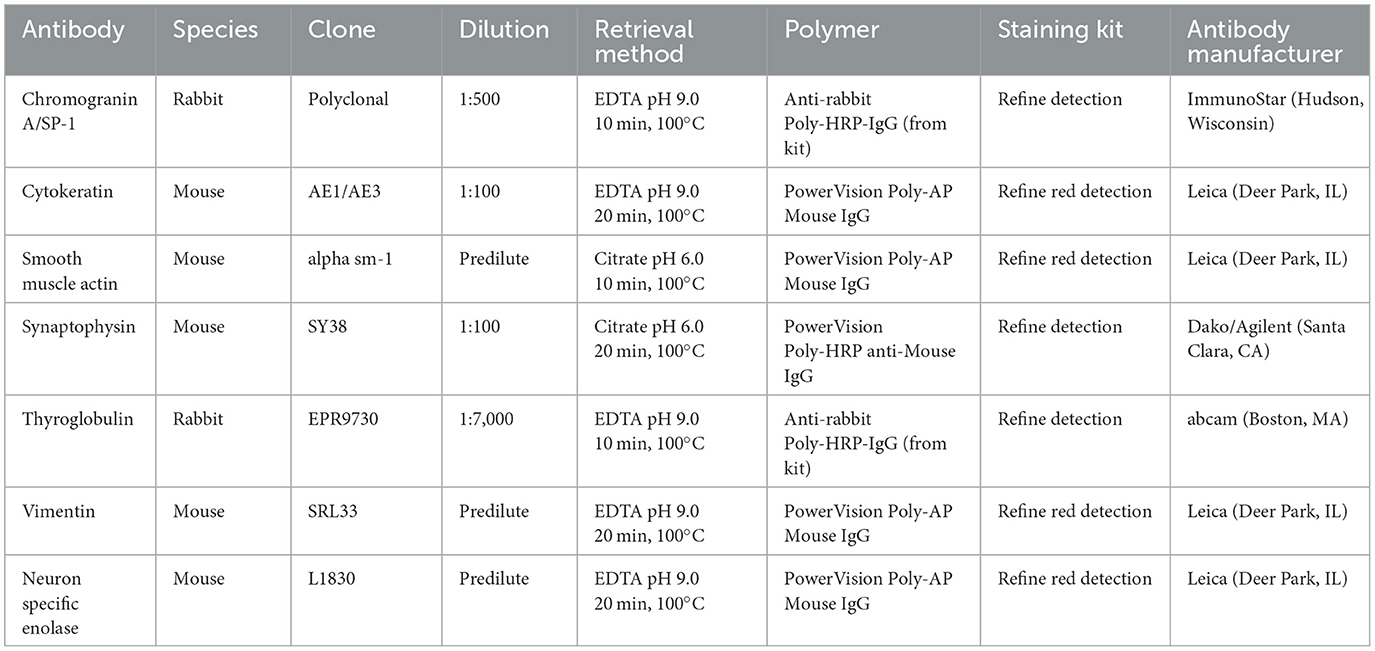 Tabla 1. Anticuerpos primarios y secundarios utilizados para el análisis inmunohistoquímico de células neoplásicas en los tejidos de un gato doméstico con quimiodectoma maligno.
Tabla 1. Anticuerpos primarios y secundarios utilizados para el análisis inmunohistoquímico de células neoplásicas en los tejidos de un gato doméstico con quimiodectoma maligno.
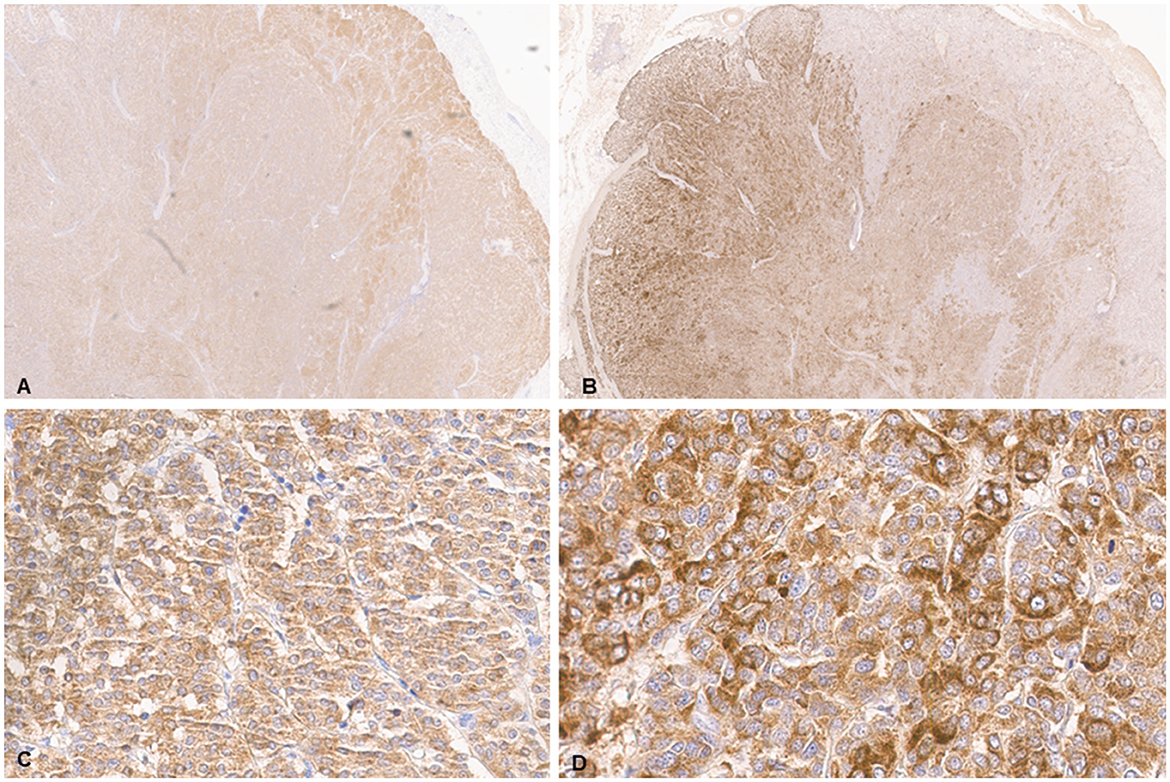 Figura 3. Chemodectoma en un gato doméstico, corazón. Análisis inmunohistoquímico (IHQ). Células neoplásicas fuertemente teñidas para sinaptofisina (A, C) y cromogranina A (B, D).
Figura 3. Chemodectoma en un gato doméstico, corazón. Análisis inmunohistoquímico (IHQ). Células neoplásicas fuertemente teñidas para sinaptofisina (A, C) y cromogranina A (B, D).
Discusión
En este reporte se describe el quimiodectoma cardíaco y vascular primario con diseminación metastásica hepática en un gato doméstico. Como se mencionó anteriormente, las neoplasias cardíacas primarias rara vez se reportan en gatos domésticos. Sin embargo, se han documentado quimiodectoma, hemangiosarcoma, carcinoma ectópico de tiroides y paratiroides (2, 8). Por lo tanto, la caracterización de las neoplasias cardíacas mediante morfología macroscópica, histología y análisis inmunohistoquímico es crucial para diferenciar las enfermedades neoplásicas que afectan al corazón. En este caso, se determinó que el diagnóstico diferencial macroscópico primario de la neoplasia era un quimiodectoma según la ubicación del tumor en la base del corazón y los vasos principales del corazón. Las pruebas adicionales incluyeron la evaluación microscópica y la inmunorreactividad positiva a la sinaptofisina y la cromogranina A, todas las cuales apoyaron el diagnóstico de quimiodectoma. Las células neoplásicas tuvieron inmunorreactividad negativa para el factor de transcripción tiroideo 1 y tiroglobulina (tumores tiroideos y pulmonares), actina muscular lisa (tumores musculares lisos), vimentina (tumores mesenquimales), citoqueratina AE1/AE3 (tumores epiteliales).
Los quimiodectomas son tumores neuroendocrinos no cromafines que surgen de la transformación neoplásica de las células quimiorreceptoras ubicadas dentro de la túnica adventicia de los vasos sanguíneos principales, con frecuencia en la bifurcación de las arterias carótidas comunes (cuerpo carotídeo) y a lo largo del arco aórtico (cuerpo aórtico) (28, 29). Las células quimiorreceptoras son células receptoras sensoriales especializadas con funciones reguladoras conocidas en el sistema cardiorrespiratorio a través de la monitorización de las concentraciones de pH, dióxido de carbono y oxígeno (19, 20).
En general, los quimiodectomas son masas no funcionales, que ocupan espacio y localmente invasivas, con un bajo potencial metastásico reportado (hasta 22% en tumores caninos) (2, 28). Del mismo modo, en felinos, cinco de los 13 casos notificados han notificado metástasis en otros tejidos de la cavidad torácica, incluidos los pulmones y el diafragma (20, 27, 30, 31). Se sabe que las neoplasias del cuerpo carotídeo son más malignas y a menudo hacen metástasis en otros órganos que las neoplasias del cuerpo aórtido. Los quimiodectomas suelen estar presentes como una sola masa en la base del corazón, y se presentan con mayor frecuencia entre la aorta y la arteria pulmonar, la aorta y la aurícula derecha, o entre la arteria pulmonar y la aurícula izquierda (2, 24), que fue la ubicación en este caso. Los sitios más comunes de quimiodectoma metastásico incluyen los ganglios linfáticos regionales, los pulmones, el hígado, las glándulas suprarrenales y el cerebro (23, 24, 28). La metástasis en este gato fue en el hígado, afectando ~20% del volumen hepático total. No se sabe nada sobre el tropismo a diferentes tejidos. Sin embargo, el hígado es un sitio común para la metástasis de varias neoplasias. Actualmente se desconocen los factores que hacen que un órgano sea más susceptible a la metástasis del quimiodoxoma.
El gato de este informe tenía 10 años de edad, que se encuentra dentro del rango de edad común en el que se han notificado quimiodectomas (10 a 15 años). En general, los animales mayores son más susceptibles a las enfermedades neoplásicas debido a la exposición crónica inherente a las agresiones ambientales, la acumulación inevitable de daños en el ADN o el deterioro de los mecanismos de reparación del ADN. En caninos, se han notificado previamente metástasis en el hígado, el pulmón, el bazo renal, la médula ósea y los ganglios linfáticos (15-17). Un estudio indicó que una mayor relación peso-cuerpo de la neoplasia se correlaciona con el potencial maligno de las neoplasias del cuerpo aórtico en perros; Sin embargo, las características distintivas de la malignidad, incluido el índice mitótico y el pleomorfismo nuclear, así como la intensidad del marcaje inmunohistoquímico de las células neoplásicas, no son determinantes sensibles de los tumores malignos del cuerpo aórtico (26).
La expresión de enolasa neuronal específica (NSE) estuvo presente en todas las células neoplásicas de la neoplasia del cuerpo aórtico canino, independientemente de la metástasis (26). Sin embargo, en el caso actual del quimiodectoma felino, las células neoplásicas fueron mayoritariamente negativas para el marcador NSE, lo que indica la no sensibilidad del quimiodectoma en gatos para NSE. Curiosamente, un informe de caso anterior de quimiodectoma felino también documentó tinción negativa para marcadores de NSE (24), mientras que otro informó de una intensidad de tinción variable que indica que NSE es solo parcialmente confiable como marcador para el diagnóstico de quimiodectoma en gatos domésticos (27). Otro hallazgo importante en el presente informe de caso es que las células neoplásicas fueron intensamente inmunorreactivas a la sinaptofisina, un hallazgo consistente en otros informes (24, 27), lo que demuestra que la sinaptofisina es un marcador diagnóstico importante para el quimiodectoma en gatos domésticos.
En este caso, se desconoce el origen tisular exacto de la neoplasia (carótida vs. cuerpo aórtico vs. aurícula). La dificultad respiratoria en el gato se atribuye al derrame pleural y a la atelectasia pulmonar bilateral, secundaria a la neoplasia. El origen neuroendocrino de la neoplasia fue confirmado por inmunorreactividad positiva a sinaptofisina y cromogranina A. Curiosamente, las células neoplásicas en el hígado también fueron fuertemente positivas para sinaptofisina y cromogranina A, y negativas para los otros marcadores inmunohistoquímicos previamente mencionados. Se descartaron tumores tiroideos, epiteliales y mesenquimales con los marcadores inmunohistoquímicos específicos descritos anteriormente (Tabla 1). En conjunto, la morfología macroscópica, las características histológicas y la reactividad inmunohistoquímica respaldaron el diagnóstico de quimiodecoma, con metástasis en el hígado. El quilotórax observado en este caso fue probablemente secundario a la rotura del conducto torácico asociada a la neoplasia (no observada durante la autopsia) o a la impedancia del flujo linfático a nivel de la anastomosis venosa linfática (32, 33). Se ha demostrado que el drenaje del quilotórax mediante un catéter de drenaje intratorácico en un perro con neoplasia de la base del corazón mejora la supervivencia en un perro (32).
En conclusión, este reporte de caso describe las características clínicas, morfológicas macroscópicas e histopatológicas, así como la inmunorreactividad de las células neoplásicas en un quimiodectoma felino metastásico. Esta neoplasia debe considerarse como un diagnóstico diferencial en casos de aparición súbita de dificultad respiratoria, derrame pleural, atelectasia pulmonar y un espacio que ocupa masa en la cavidad torácica en gatos domésticos. Los análisis inmunohistoquímicos indican que la sinaptofisina y la cromogranina A son pruebas auxiliares más útiles en el diagnóstico de los quimiotectomas felinos. Con base en este informe actual y en la revisión de la bibliografía relevante, un panel inmunohistoquímico recomendado para apoyar el diagnóstico de quimiodectoma en gatos domésticos incluye sinaptofisina y cromogranina A (Tabla 2). En este caso, la neoplasia se consideró no funcional debido a la ausencia de signos clínicos específicos del tumor. Se necesitan más estudios para investigar y predecir el potencial metastásico del quimiodectoma en gatos y los marcadores diagnósticos premortem de la enfermedad.
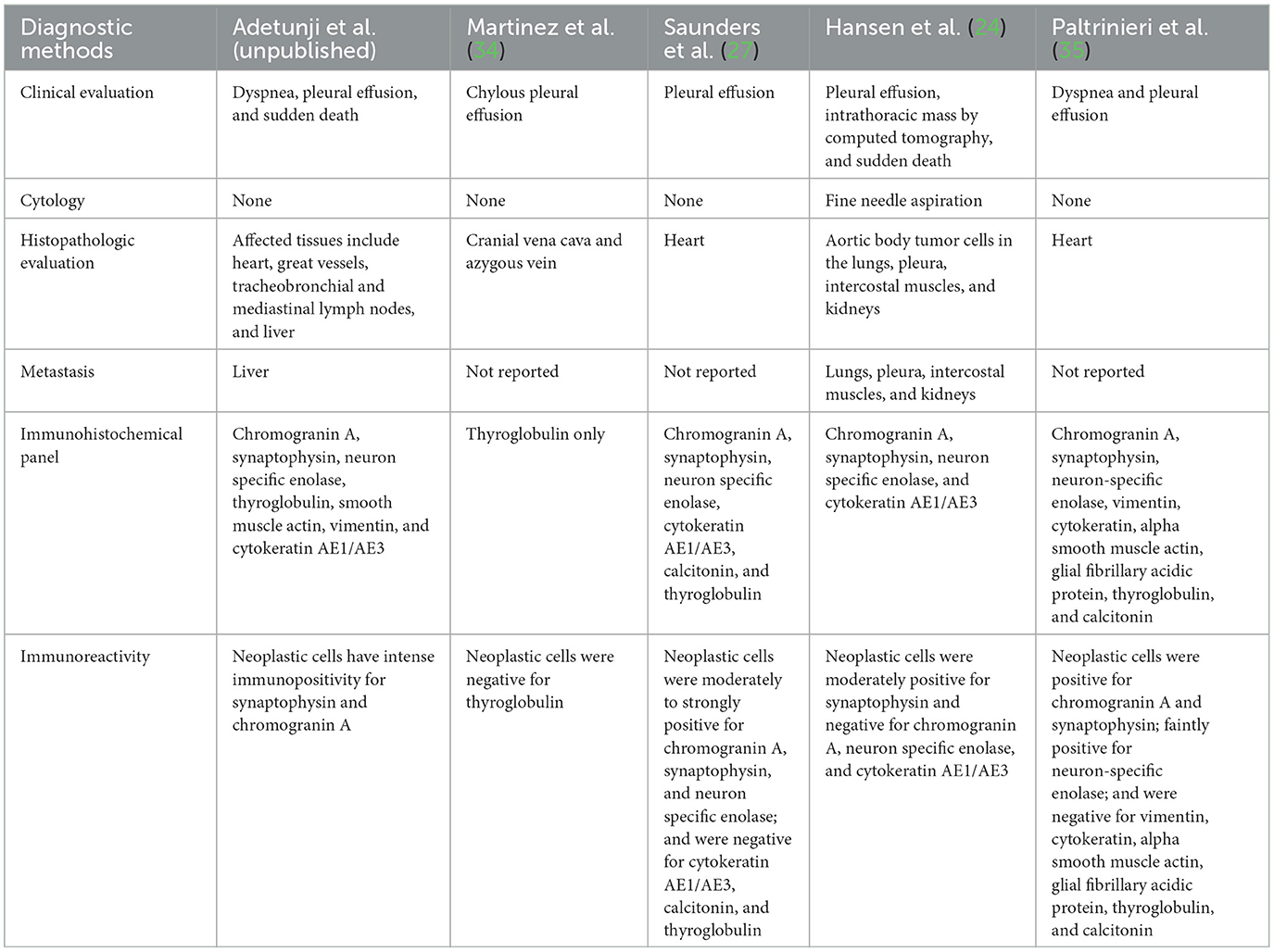 Tabla 2. Chemodectoma en gatos domésticos. Resumen de la bibliografía relevante seleccionada en los últimos 20 años.
Tabla 2. Chemodectoma en gatos domésticos. Resumen de la bibliografía relevante seleccionada en los últimos 20 años.
Declaración de disponibilidad de datos
Las contribuciones originales presentadas en el estudio se incluyen en el artículo/material complementario, las consultas adicionales pueden dirigirse al autor correspondiente.
Declaración ética
No se requirió revisión y aprobación ética para el estudio de animales de acuerdo con la legislación local y los requisitos institucionales. No se requería el consentimiento informado por escrito de los propietarios para la participación de sus animales, de conformidad con la legislación nacional y los requisitos institucionales.
Contribuciones de los autores
SA, KC y FMF escribieron, revisaron y editaron el manuscrito. JT revisó y editó el manuscrito. Todos los autores contribuyeron al artículo y aprobaron la versión enviada.
Financiación
Los autores revelaron haber recibido apoyo financiero para la autoría y/o publicación de este artículo del Laboratorio de Diagnóstico Veterinario del Estado de Kansas y del Departamento de Medicina Diagnóstica/Patobiología de la Facultad de Medicina Veterinaria de la Universidad Estatal de Kansas, Manhattan, KS 66506.
Reconocimientos
Nos gustaría expresar nuestra gratitud al personal del laboratorio de histología del Laboratorio de Diagnóstico Veterinario del Estado de Kansas (KSVDL) por su ayuda y al equipo de la clínica KSU VHC.
Conflicto de intereses
Los autores declaran que la investigación se llevó a cabo en ausencia de relaciones comerciales o financieras que pudieran interpretarse como un posible conflicto de intereses.
Nota del editor
Todas las afirmaciones expresadas en este artículo son únicamente las de los autores y no representan necesariamente las de sus organizaciones afiliadas, ni las del editor, los editores y los revisores. Cualquier producto que pueda ser evaluado en este artículo, o afirmación que pueda ser hecha por su fabricante, no está garantizado ni respaldado por el editor.
Referencias
1. Aupperle H, März I, Ellenberger C, Buschatz S, Reischauer A, Schoon HA. Tumores cardíacos primarios y secundarios en perros y gatos. J Comp Path. (2007) 136:18–26. doi: 10.1016/j.jcpa.2006.10.002
Resumen de PubMed | Texto completo de CrossRef | Google Académico
2. Treggiari E, Pedro B, Dukes-McEwan J, Gelzer AR, Blackwood L, A. Revisión descriptiva de tumores cardíacos en perros y gatos. Veterinario Comparativo Oncol. (2017) 15:273–88. doi: 10.1111/vco.12167
Resumen de PubMed | Texto completo de CrossRef | Google Académico
3. Magalhães HI, Mendonça KG, de Paula YH, Romão FB, Barcelos JB, Dobritz WR, et al. Linfoma cardíaco felino: reporte de un caso. Brazilian J Vet Med. (2019) 41:e100019. doi: 10.29374/2527-2179.bjvm100019
4. Campbell MD, Gelberg HB. Mixoma osificante endocárdico de la aurícula derecha en un gato. Camino del veterinario. (2000) 37:460–2. doi: 10.1354/vp.37-5-460
Resumen de PubMed | Texto completo de CrossRef | Google Académico
5. Kobayashi R, Ohsaki Y, Yasuno K, Ogihara K, Kasai T, Chambers JK, et al. Ganglioneuropama cardíaco felino maligno y metastásico. J Vet Diagn Invest. (2012) 24:412–7. doi: 10.1177/1040638711435113
Resumen de PubMed | Texto completo de CrossRef | Google Académico
6. Venco L, Kramer L, Sola LB, Moccia A. Rabdomiosarcoma cardíaco primario en un gato. J Am Anim Hosp Assoc. (2001) 37:159–63. doi: 10.5326/15473317-37-2-159
Resumen de PubMed | Texto completo de CrossRef | Google Académico
7. Schreeg ME, Evans BJ, Allen J, Lewis MC, Luckring E, Evola M, et al. Leiomiosarcoma cardíaco en un gato que se presenta por neoplasia renal bilateral. J Comp Path. (2019) 168:19–24. doi: 10.1016/j.jcpa.2019.02.005
Resumen de PubMed | Texto completo de CrossRef | Google Académico
8. Herrold EJ, Donovan TA, Hohenhaus AE, Fox PR. Hemangiosarcoma cardíaco primario compresivo pericárdico gigante en un gato. J Vet Cardiol. (2020) 29:54–9. doi: 10.1016/j.jvc.2020.04.004
Resumen de PubMed | Texto completo de CrossRef | Google Académico
9. Chalfon C, Romito G, Sabattini S, Rigillo A, Quinci M, Foglia A, et al. Sarcoma histiocítico periarticular con metástasis cardíaca en un gato. Vet Clin Path. (2021) 50:579–83. doi: 10.1111/vcp.13017
Resumen de PubMed | Texto completo de CrossRef | Google Académico
10. Tanaka S, Suzuki R, Hirata M, Kagawa Y, Koyama H. Diagnóstico inusual de linfoma cardíaco felino mediante biopsia cardíaca con aguja. BMC Vet Res. (2022) 18:251. doi: 10.1186/s12917-022-03357-7
Resumen de PubMed | Texto completo de CrossRef | Google Académico
11. Santos IR, Raiter J, Lamego ÉC, Bandinelli MB, Dal Pont TP, Siqueira KF, et al. Carcinoma pulmonar felino: aspectos macroscópicos, histológicos, metastásicos e inmunohistoquímicos. Camino del veterinario. (2023) 60:8–20. doi: 10.1177/03009858221122517
Resumen de PubMed | Texto completo de CrossRef | Google Académico
12. Woldemeskel M. Linfoma cardíaco primario en un gato. J Comp Path. (2020) 174:34–8. doi: 10.1016/j.jcpa.2019.10.192
Resumen de PubMed | Texto completo de CrossRef | Google Académico
13. Amati M, Venco L, Roccabianca P, Santagostino SF, Bertazzolo W. Linfoma pericárdico en siete gatos. J Feline Med Surg. (2014) 16:507–12. doi: 10.1177/1098612X13506199
Resumen de PubMed | Texto completo de CrossRef | Google Académico
14. Tillson DM, Fingland RB, Andrews GA. Chemodectoma en un gato. J Am Anim Hosp Assoc. (1994) 30:586–90.
15. Callanan JJ, McNeil PE, Anderson TJ, Laird H. Tumor metastásico del cuerpo aórtico que causa dolor de cuello en un perro. J Pequeña Anim Pract. (1991) 32:525–8. doi: 10.1111/j.1748-5827.1991.tb00873.x
16. Szczech GM, Blevins WE, Carlton WW, Cutlan GR. Quimiodectoma con metástasis ósea en un perro. Amer Vet Med Assoc J. (1973).
17. Robinson WF, Robinson NA. «Neoplasias del corazón», en Kennedy & Palmer’s pathology of domestic animals: Volume 3 p52 Sixth Edition, Jubb M. Amsterdam: Elsevier Health Sciences. (2016).
18. Adams NOSOTROS. Morfología comparada del cuerpo carotídeo y el seno carotídeo. Tomás. (1958). 44:209–211. doi: 10.1113/expphysiol.1959.sp001388
19. Acker H, Starlinger H. Contenido de trifosfato de adenosina en el cuerpo carotídeo del gato bajo diferentes condiciones arteriales de O2 y CO2. Neurosci Lett. (1984) 50:175–9. doi: 10.1016/0304-3940(84)90482-8
Resumen de PubMed | Texto completo de CrossRef | Google Académico
20. Lahiri S, DeLaney RG. Relación entre la actividad de los quimiorreceptores carotídeos y la ventilación en el gato. Respir Physiol. (1975) 24:267–86. doi: 10.1016/0034-5687(75)90018-3
Resumen de PubMed | Texto completo de CrossRef | Google Académico
21. Blain GM, Smith CA, Henderson KS, Dempsey JA. Los quimiorreceptores periféricos determinan la sensibilidad respiratoria de los quimiorreceptores centrales al CO2. J Physiol. (2010) 588:2455–71. doi: 10.1113/jphysiol.2010.187211
Resumen de PubMed | Texto completo de CrossRef | Google Académico
22. Willis R, Williams AE, Schwarz T, Paterson C, Wotton PR. Quimiodectoma del cuerpo aórtico que causa edema pulmonar en un gato. J Pequeña Anim Pract. (2001) 42:20–3. doi: 10.1111/j.1748-5827.2001.tb01978.x
Resumen de PubMed | Texto completo de CrossRef | Google Académico
23. Caruso KJ, Cowell RL, Upton ML, Dorsey KE, Meinkoth JH, Campbell GA. Masa intratorácica en un gato. Vet Clin Path. (2002) 31:193. doi: 10.1111/j.1939-165X.2002.tb00302.x
Resumen de PubMed | Texto completo de CrossRef | Google Académico
24. Hansen SC, Smith AN, Kuo KW, Fish EJ, Koehler JW, Martinez-Romero G, et al. Carcinoma neuroendocrino metastásico de origen corporal aórtico en un gato. V Vet Clin Path. (2016) 45:490–4. doi: 10.1111/vcp.12392
Resumen de PubMed | Texto completo de CrossRef | Google Académico
25. Lew FH, McQuown B, Borrego J, Cunningham S, Burgess KE. Evaluación retrospectiva de tumores caninos tratados con toceranib fosfato (Palladia): 2011-2018. Veterinario Comp Oncol. (2019) 17:465–71. doi: 10.1111/vco.12491
Resumen de PubMed | Texto completo de CrossRef | Google Académico
26. Yamamoto S, Fukushima R, Hirakawa A, Abe M, Kobayashi M, Machida N. Evaluación histopatológica e inmunohistoquímica del potencial maligno en tumores del cuerpo aórtico canino. J Comp Path. (2013) 149:182–91. doi: 10.1016/j.jcpa.2012.12.007
Resumen de PubMed | Texto completo de CrossRef | Google Académico
27. Saunders R, Kraipowich N, Marshall HC. Paraganglioma maligno no cromoafín intracardíaco (quimiodectoma) en un gato. J Vet Cardiol. (2021) 37:1–7. doi: 10.1016/j.jvc.2021.07.002
Resumen de PubMed | Texto completo de CrossRef | Google Académico
28. Yates WD, Lester SJ, Mills JH. Tumores quimiorreceptores diagnosticados en el Western College of Veterinary Medicine 1967-1979. ¿Puede Vet J. (1980) 21:124.
29. Paola JP, Hammer AS, Smeak DD, Merryman JI. Tumor del cuerpo aórtico que causa derrame pleural en un gato. J Am Anim Hosp Assoc. (1994) 41:2.
30. del Busto I, Stiborova K, Villiers E, Ferreira AJ, Bode EF. Quimiodectoma aórtico que causa un derrame rico en linfocitos en un gato. Representante de casos de Vet Rec. (2018) 6:E000620. doi: 10.1136/vetreccr-2018-000620
31. Lord S, Bavcar S, Lodzinska J, Gozalo-Marcilla M. Hipercapnia severa asociada con un quimiodectoma que causa un estrechamiento traqueal profundo en un gato. Vet Rec Case Rep. (2020) 8:e001232. doi: 10.1136/vetreccr-2020-001232
32. Gibson EA, Culp WT, Kent MS, Mayhew PD, Wisner ER, Wells A, et al. Tratamiento de un tumor de la base del corazón y quilotórax con stent endovascular, radioterapia corporal estereotáctica y un inhibidor de la tirosina cinasa en un perro. J Vet Cardiol. (2021) 33:61–8. doi: 10.1016/j.jvc.2020.11.004
Resumen de PubMed | Texto completo de CrossRef | Google Académico
33. Singh A, Brisson B, Nykamp S. Quilotórax idiopático: fisiopatología, diagnóstico e imágenes del conducto torácico. Compend Contin Educ Vet. (2012) 34:E2.
34. Martínez I, Brockman D, Purzycka K. Chemodectoma de Caval en un gato. JFMS Open Rep. (2022) 8:20551169221106990. doi: 10.1177/20551169221106990
Resumen de PubMed | Texto completo de CrossRef | Google Académico
35. Paltrinieri S, Riccaboni P, Rondena M, Giudice C. Hallazgos patológicos e inmunohistoquímicos en un tumor del cuerpo aórtico felino. Veterinario Pathol. (2004) 41:195–8. doi: 10.1354/vp.41-2-195
Resumen de PubMed | Texto completo de CrossRef | Google Académico
Palabras clave: tumor del cuerpo aórtico, quimiodectoma, felino, maligno, metástasis
Cita: Adetunji SA, Chen K, Thomason J y Matías Ferreyra F (2023) Caso clínico: Quimiodectoma maligno con metástasis hepática en un gato. Frente. Vet. Sci. 10:1216439. doi: 10.3389/fvets.2023.1216439
Recibido: 03 de mayo de 2023; Aceptado: 30 de junio de 2023;
Publicado: 18 julio 2023.
Editado por:
Massimo Castagnaro, Universidad de Padua, Italia
Revisado por:
Maja Ruetten, PathoVet, Suiza
Massimiliano Tursi, Universidad de Turín, Italia
Paola Roccabianca, Università degli Studi di Milano, Italia
Derechos de autor © 2023 Adetunji, Chen, Thomason y Matías Ferreyra. Este es un artículo de acceso abierto distribuido bajo los términos de la Licencia Creative Commons Attribution License (CC BY).
*Correspondencia: Franco Matías Ferreyra, francomf@vet.k-state.edu
Renuncia: Todas las afirmaciones expresadas en este artículo son únicamente las de los autores y no representan necesariamente las de sus organizaciones afiliadas, ni las del editor, los editores y los revisores. Cualquier producto que pueda ser evaluado en este artículo o afirmación que pueda hacer su fabricante no está garantizado ni respaldado por el editor.
Date de alta y recibe nuestro 👉🏼 Diario Digital AXÓN INFORMAVET ONE HEALTH
Date de alta y recibe nuestro 👉🏼 Boletín Digital de Foro Agro Ganadero
Noticias animales de compañía
Noticias animales de producción
Trabajos técnicos animales de producción
Trabajos técnicos animales de compañía


