Caso clínico: Resolución de la lesión renal aguda oligoanúrica con la administración de furosemida en un gato tras la toxicidad del lirio
Caso clínico: Resolución de la lesión renal aguda oligoanúrica con la administración de furosemida en un gato tras la toxicidad del lirio
 Un A1,
Un A1,  Claudia Dávila1,
Claudia Dávila1,  Sarah Stroope1 y
Sarah Stroope1 y  Rebecca Walton1,2*
Rebecca Walton1,2*- 1Departamento de Emergencias y Cuidados Críticos, Veterinary Centers of America (VCA) West Los Angeles Animal Hospital, Los Angeles, CA, Estados Unidos
- 2Departamento de Emergencias y Cuidados Críticos, Universidad Estatal de Iowa, Ames, IA, Estados Unidos
Objetivo: Describir el resultado exitoso de un caso de lesión renal aguda oligoanúrica en un gato secundario a la ingestión de lirios.
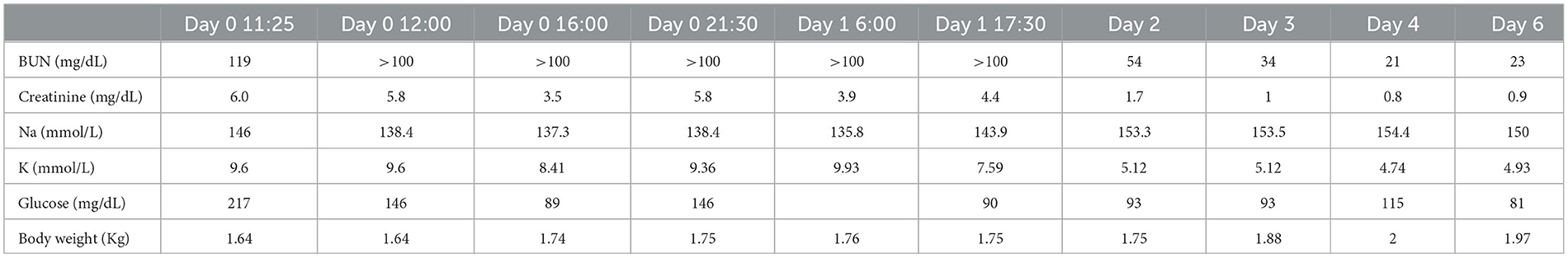
Resumen del caso: Un gato doméstico de pelo corto macho intacto de 12 semanas de edad que pesaba 1,64 kg (3,6 lb) presentó una duración de 12 horas de vómitos y letargo después de la exposición a lirios de los géneros Lilium species 24 h antes de la presentación. El día de la presentación se observó azotemia grave (creatinina 5,8 mg/dL, BUN > 100 mg/dL) e hiperpotasemia (9,36 mmol/L). El tratamiento de la hiperpotasemia se instituyó con gluconato de calcio, solución de timbres lactatos, dextrosa, insulina regular de acción corta, albuterol y bicarbonato de sodio, Oliguria a anuria fue altamente sospechada basada en una falta de producción de orina 21 h después de la hospitalización con administración de líquidos intravenosos y un tamaño estático de la vejiga. Al gato se le administraron 4 mg/kg de furosemida, y orinó a las 6 h después de la administración y continuó produciendo más de 6 ml/kg/h de orina en las siguientes 24 h. Dos días después de la administración de furosemida, la hiperpotasemia y la azotemia del gato se resolvieron. El gato fue dado de alta después de 4 días de hospitalización, y un nuevo control no reveló azotemia persistente o hiperpotasemia.
Información única: La lesión renal aguda anúrica secundaria a toxicidad por lirio se asocia con un mal pronóstico, y la única modalidad de tratamiento descrita anteriormente es la hemodiálisis. El gato en este informe fue manejado con éxito con intervención médica y administración de furosemida, con resolución completa de la lesión renal aguda.
Introducción
Se sabe que los lirios, incluidos los géneros Lilium y Hemerocallis, causan lesión renal aguda (LRA) en gatos (1). Los hallazgos clínicos asociados con toxicidad por lirio consisten en signos gastrointestinales, letargo, poliuria, polidipsia, azotemia, glucosuria, proteinuria y, en casos graves, oliguria o anuria (2). Cuando se diagnostica temprano, la toxicidad del lirio tiene un pronóstico excelente (3). Se observan tasas de supervivencia de hasta el 100% cuando la descontaminación gastrointestinal y la fluidoterapia de apoyo se inician dentro de las 48 h posteriores a la exposición (3). Sin embargo, el pronóstico es malo si los gatos desarrollan insuficiencia renal anúrica (1). Se desconoce el mecanismo exacto de acción de la toxicidad del lirio; Sin embargo, la toxicidad produce daño tubular renal grave y muerte celular con lesiones macroscópicas, incluyendo congestión renal, edema perirrenal y necrosis tubular renal (1). La LRA poliúrica ocurre de 12 a 30 h después de la ingestión, y la LRA anúrica puede desarrollarse entre 24 y 48 h (1). Históricamente, la terapia de reemplazo renal, incluida la diálisis peritoneal y la hemodiálisis, han sido las únicas formas efectivas de tratamiento para la anuria secundaria a la toxicidad del lirio, y el manejo médico no ha demostrado ser efectivo (4). Las terapias de reemplazo renal no están fácilmente disponibles en medicina veterinaria y a menudo tienen un costo prohibitivo. El tratamiento médico de la LRA anúrica incluye el uso de diuréticos, más comúnmente furosemida e históricamente manitol (5). La furosemida es transportada a la membrana luminal del túbulo proximal renal por transportadores de aniones orgánicos renales e inhibe los cotransportadores de sodio-cloruro-potasio de la extremidad ascendente del asa de Henle (6). La furosemida causa un aumento de la producción de orina, pero no se ha demostrado que aumente la tasa de filtración glomerular o mejore los resultados (7). También se ha demostrado que el manitol aumenta la producción de orina, pero tiene efectos adversos potenciales, incluida la sobrecarga de líquidos y el desarrollo de nefrosis osmótica, y actualmente no se recomienda (5, 8). Hasta donde saben los autores, no hay casos reportados de conversión espontánea de oligo-anuria a poliuria o manejo exitoso de LRA anúrica en un gato con toxicidad por lirio sin terapia de reemplazo renal. Este caso describe el resultado exitoso y la conversión de LRA oligoanúrica a LRA poliúrica en un gato con toxicidad por lirios.
Resumen del caso
Un gato doméstico de pelo corto intacto de 12 semanas de edad que pesaba 1,64 kg (3,6 lb) se presentó en el Departamento de Emergencias de un gran hospital de práctica privada para la evaluación del inicio agudo de vómitos y letargo durante 12 horas. El gato era un gato de interior con antecedentes de anemia por pulgas meses antes; sin embargo, no había otros antecedentes o medicamentos actuales en el momento de la presentación. El veterinario tratante identificó que el gato estuvo expuesto a un ramo de flores que contenía lirios de Pascua de los géneros Lilium 24 h antes de la presentación. El apetito del gato había sido normal 24 h antes de la presentación. El gato fue evaluado inicialmente por el proveedor de atención primaria, y un perfil químico realizado 12 h después del inicio del vómito reveló azotemia severa con una creatinina de 6,0 mg/dL; 530 μmol/L (rango de referencia 0,6–1,6 g/dL; 53–141 μmol/L), nitrógeno ureico en sangre (BUN) 119 mg/dL; 42,5 μmol/L (rango de referencia 16–33 mg/dL; 5,7–11,7 μmol/L), fósforo > 16,1 mg/dL; 5,1 μmol/L (rango de referencia 4,5–10,4 mg/dL; 1,4–3,4 μmol/L), Na 146 mmol/L (rango de referencia 150–165 mmol/L), K 9,6 mmol/L (rango de referencia 3,7–5,9 mmol/L) y glucosa 217 mg/dL; 12 mmol/L (rango de referencia 77–153 mg/dL; 4.3–8.5 mmol/L) (Tabla 1). No se instituyó ningún tratamiento antes de la derivación.
El paciente presentaba normotermo a 37,6 C; 99.7 F, bradicárdico a 140 latidos por minuto, y tenía una frecuencia respiratoria de 50 respiraciones por minuto en la presentación. Las membranas mucosas eran pegajosas y de color rosa claro, con un tiempo de llenado capilar de < 2 s. El examen físico en el momento de la presentación (día 0) fue consistente con una deshidratación del 5% basada en las membranas mucosas pegajosas y una leve disminución de la turgencia de la piel. La bradicardia se atribuyó a la hiperpotasemia, sin evidencia de hipovolemia observada. El paciente estaba embotado sin déficits neurológicos observados y bradicárdico sin soplo apreciado. Se observó una vejiga pequeña pero palpable en el momento de la presentación. El peso del paciente fue de 1,64 kg al ingreso. Un electrocardiograma diagnóstico reveló bradicardia sinusal con complejos QRS anchos. En la gasometría venosa, una hiponatremia a 138,4 mmol/L (rango de referencia 146,2–156,2 mmol/L), hiperpotasemia 9,36 mmol/L (rango de referencia 3,42–4,71 mmol/L), hipocalcemia ionizada 1,07 mmol/L (rango de referencia 1,16–1,35 mmol/L), nitrógeno ureico en sangre (BUN) >100 mg/dL (rango de referencia 8,0–30,0 mg/dL) y creatinina de 5,8 mg/dL; Se observaron 512,8 mmol/L (rango de referencia 0,6–1,6 g/dL; 53–141 μmol/L). La gravedad específica de la orina fue de 1,018, y no se observó evidencia de cristales de oxalato de calcio monohidrato en el examen directo de sedimentos urinarios. La terapéutica inicial consistió en gluconato de calcio1 1 mL/kg diluido 1:4 con solución salina IV al 0,9% durante 20 min, 10 mL/kg de solución de ringer lactato2 Bolo intravenoso, 1 mL/kg de dextrosa al 50%3 diluido 1:4 con solución salina IV al 0,9% durante 5 min, insulina regular, de acción corta 1 unidad IM, maropitant4 1 mg/kg IV, 1 inhalación de albuterol5 para tratar la hiperpotasemia del paciente, y 1 mL/kg de bicarbonato de sodio 8,4%6 diluido 1:5 con D5W IV durante 10 min. El gato comenzó con una solución de timbre lactato (ver nota 2 del texto) a una velocidad de 9 ml / kg / h con dextrosa al 5%, debido a la administración de insulina, durante 3 h basada en un mantenimiento de 70 ml / kg / día, además de una deshidratación del 5% que se deseaba reemplazar durante 6 h seguida de 73 ml / kg / día con dextrosa al 5% (ver nota 3 del texto). Además, ampicilina/sulbactam7 (30 mg/kg IV cada 8h) al plan terapéutico. El gato fue monitoreado durante la noche, incluyendo monitoreo de telemetría y medición del peso corporal cada 4 h. La gasometría venosa realizada 4 h después de la presentación reveló hiponatremia a 137,3 mmol/L (rango de referencia 146,2–156,2 mmol/L), mejoría de la hiperpotasemia a 8,41 mmol/L (rango de referencia 3,42–4,71 mmol/L), hipocalcemia ionizada 1,1 mmol/L (rango de referencia 1,16–1,35 mmol/L) y mejoría de la azotemia con una creatinina de 3,5 mg/dL; 344 μmol/L (rango de referencia 0.6–1.6 g/dL; 53–141 μmol/L). La ecografía abdominal realizada reveló cortezas renales bilateralmente hiperecoicas con arquitectura renal normal. En la gasometría venosa realizada 10 h después de la evaluación inicial, se observó hiponatremia a 133,0 mmol/L (rango de referencia 146,2–156,2 mmol/L), hiperpotasemia a 9,49 mmol/L (rango de referencia 3,42–4,71 mmol/L) e hipocalcemia ionizada 1,07 mmol/L (rango de referencia 1,16–1,35 mmol/L) con una creatinina de 5,8 mg/dL; 513 μmol/L (rango de referencia 0.6–1.6 g/dL; 53–141 μmol/L). El peso del paciente era de 1,74 kg en ese momento. Una dosis adicional de insulina regular de acción corta8 a 0,25 U/kg se administró por vía intravenosa junto con 2 inhalaciones de albuterol (véase la nota 5 del texto). La hospitalización continuó, y no se observó micción durante las primeras 15 h de hospitalización; En este momento, el tamaño de la vejiga se midió subjetivamente a través de ultrasonido abdominal, revelando un tamaño de 4,2 × 4,5 cm.
En el día 1 de la hospitalización, 18 h después de la presentación, el gato continuó teniendo una mente aburrida con una apreciación significativa del dolor abdominal. Cuando se le ofrecía comida, el gato comía fácilmente. La telemetría en este momento reveló bradicardia con taquicardia ventricular intermitente (Figura 1). El peso del gato era estático en 1,76 kg. En la gasometría venosa, se observó hiponatremia a 135,8 mmol/L (rango de referencia 146,2–156,2 mmol/L), hiperpotasemia 9,93 mmol/L (rango de referencia 3,42–4,71 mmol/L) e hipocalcemia ionizada 1,07 mmol/L (rango de referencia 1,16–1,35 mmol/L) con una creatinina de 3,9 mg/dL; 345 μmol/L (rango de referencia 0.6–1.6 g/dL; 53–141 mmol/L). El tratamiento en ese momento consistió en solución de timbre lactato (ver nota 2 del texto) a 75 ml/kg/día basado en una tasa de mantenimiento para un animal joven, con dextrosa al 5% (ver nota 3 del texto), maropitant (ver nota 4 del texto) 1 mg/kg IV cada 24h, pantoprazol9 1 mg/kg IV cada 12 h, y albuterol (véase la nota 5 del texto) 2 inhalaciones cada 8 h. Veintiún horas después de la presentación, el gato comenzó a tener series más largas y frecuentes de taquicardia ventricular (Figura 2) y tratamiento con terbutalina10 a 0,01 mg/kg IM cada 8 h se inició como tratamiento continuado para la hiperpotasemia. En este momento, la medición de la vejiga era estática en 4,2 × 4,5 cm. Debido al empeoramiento del estado cardíaco, la falta de producción de orina y la ausencia de cambios en el tamaño de la vejiga durante las primeras 21 h de hospitalización, se administró por vía intravenosa una dosis de furosemida (véase la nota 7 del texto) de 4 mg/kg. Seis horas después de la administración de furosemida, el gato orinó aproximadamente 4 ml/kg/h. La gasometría venosa realizada 30 min después de orinar (6,5 h después de la administración de furosemida y 28 h después de la evaluación inicial) reveló sodio de 143,9 mmol/L (rango de referencia 146,2–156,2 mmol/L), mejoría de la hiperpotasemia a 7,59 mmol/L (rango de referencia 3,42–4,71 mmol/L) e hipocalcemia ionizada 1,07 mmol/L (rango de referencia 1,16–1,35 mmol/L) con una creatinina de 4,4 mg/dL; 389 μmol/L (rango de referencia 0.6–1.6 g/dL; 53–141 μmol/L). El tratamiento continuo incluyó cristaloide isotónico (véase la nota 2 del texto) a 75 ml/kg/día, ampicilina/sulbactam11 30 mg/kg IV cada 8 h, y maropitant (véase la nota 4 del texto) 1 mg/kg IV cada 24 h.
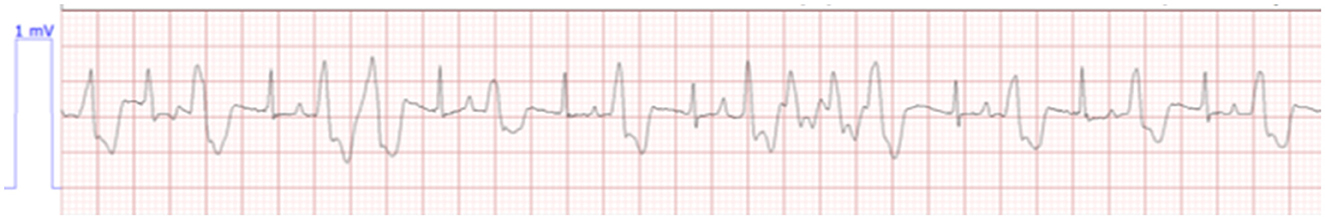 Figura 1. Bradicardia con taquicardia ventricular intermitente. Plomo II, HR 127, papel, velocidad 25,0 mm/s.
Figura 1. Bradicardia con taquicardia ventricular intermitente. Plomo II, HR 127, papel, velocidad 25,0 mm/s.
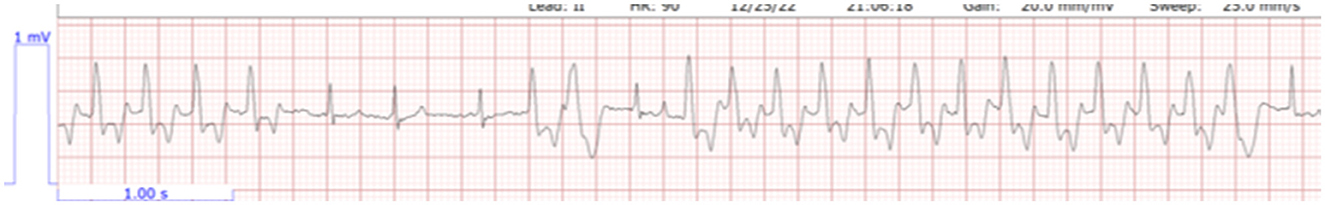 Figura 2. Bradicardia con series más frecuentes de taquicardia ventricular. Plomo II, HR 90, velocidad del papel 25,0 mm/s.
Figura 2. Bradicardia con series más frecuentes de taquicardia ventricular. Plomo II, HR 90, velocidad del papel 25,0 mm/s.
En el día 2 de hospitalización, el gato orinó más de 8 veces, totalizando más de 6 ml / kg / h. El peso varió de 1,74 a 1,96 kg, y se observó que el paciente tenía un ritmo sinusal normal y buen apetito. La ampicilina/sulbactam (véase la nota 7 del texto) se suspendió el día 2 de la hospitalización debido a resultados negativos del urocultivo. El gato continuó comiendo bien, y durante el examen físico de la mañana, el gato estaba brillante y cómodo a la palpación abdominal. La gasometría venosa reveló un sodio de 153,5 mmol/L (rango de referencia 146,2–156,2 mmol/L), mejoría de la hiperpotasemia a 5,12 mmol/L (rango de referencia 3,42–4,71 mmol/L), calcio ionizado de 1,39 mmol/L (rango de referencia 1,16–1,35 mmol/L) y mejoría de la azotemia con una creatinina de 1,7 mg/dL; 150 μmol/L (rango de referencia 0.6–1.6 g/dL; 53–141 μmol/L). Los tratamientos en el día 2 de la hospitalización incluyeron cristaloides isotónicos (ver texto nota 2) a 300 ml/kg/día para igualar la diuresis y maropitant (ver texto nota 4) 1 mg/kg IV cada 24h. El paciente permaneció clínicamente hidratado con signos vitales poco notables y hallazgos en el examen físico.
En el día 3 de hospitalización, la gasometría venosa reveló potasio de 5,12 mmol/L (rango de referencia 3,42–4,71 mmol/L) y creatinina de 1,0 mg/dL; 88 μmol/L (rango de referencia 0.6–1.6 g/dL; 53–141 μmol/L). Los líquidos intravenosos se disminuyeron en una reducción del 25% cada 6 h durante los días 3 y 4 de hospitalización, y el paciente fue dado de alta el día 4 con una creatinina de 0,8 mg/dL; 70,4 mmol/L (rango de referencia 0,6-1,6 g/dL; 53-141 μmol/L) y potasio de 4,74 mmol/L (rango de referencia 3,42-4,71 mmol/L). El paciente fue evaluado 2 días después del alta (día 6). El paciente estaba clínicamente normal en casa, comiendo y bebiendo, sin preocupaciones observadas. Los análisis de sangre durante el nuevo control revelaron una creatinina de 0,9 mg/dL; 79,5 mmol/L (rango de referencia 0,6–1,6 g/dL; 53–141 μmol/L) y potasio de 4,93 mmol/L (rango de referencia 3,42–4,71 mmol/L). Durante el momento de escribir este artículo, 3 meses después de la ingestión, el paciente está asintomático en casa y sin cambios ni preocupaciones desde el nuevo chequeo.
Discusión
La toxicidad del lirio produce necrosis tubular nefrotóxica con daño selectivo al epitelio tubular renal (1, 2, 9). Los signos clínicos son agudos, comenzando con signos gastrointestinales dentro de 1-3 h después de la exposición, poliuria dentro de 12-30 h, y la anuria puede ocurrir a partir de 24 a 48 h (1). El pilar de la terapia para la toxicidad del lirio es la administración de líquidos intravenosos para tratar la deshidratación y mantener la euvolemia para apoyar la perfusión renal. Una vez que se desarrolla la anuria, la hemodiálisis es la única modalidad de tratamiento que se ha utilizado en gatos con toxicidad por lirios. Sin embargo, el pronóstico sigue siendo malo, con una supervivencia de ~18% en gatos tratados con hemodiálisis (5, 10). Además del mal pronóstico asociado con la hemodiálisis en la toxicidad del lirio en gatos, la hemodiálisis puede estar asociada con complicaciones sistémicas, incluida la hipotensión, ya que el volumen de líneas de sangre pediátricas y dializadores se aproxima al volumen total de sangre de los gatos, lo que resulta en una carga financiera significativa (11). El gato en este informe de caso habría tenido un mayor riesgo de complicaciones debido a su tamaño, y la hemodiálisis no se describe en gatos < 2,4 kg (4, 11, 12).
Los intentos de conversión de LRA oligúrica o anúrica a poliuria incluyen el uso del diurético furosemida, un diurético de asa (7). La furosemida inhibe el transporte de cloruro resultando en natriuresis, kaliuresis, calciuresis y aumento del flujo de orina (6, 13). Además, puede proporcionar protección contra el daño isquémico al reducir la reabsorción de sodio o disminuir el consumo renal de oxígeno a través del bloqueo de la bomba dependiente de Na+-K+-ATPasa (6, 13). La combinación de natriuresis, kaliuresis y calciuresis hace que la furosemida sea útil para reducir la hiperpotasemia y la sobrecarga de líquidos (14). La respuesta a la furosemida también es un indicador de células tubulares funcionales y puede usarse como un predictor de la gravedad de la LRA (13). Los estudios en humanos demuestran que la falta de respuesta a la furosemida se asocia con un mayor riesgo de progresión de LRA y un aumento en la necesidad de terapia de reemplazo renal (13). La eficacia de la furosemida está determinada por su capacidad para alcanzar la luz tubular, y la LRA puede requerir dosis más altas para alcanzar niveles terapéuticos debido a una combinación de secreción tubular reducida de furosemida y una respuesta embotada del Na-K-Cl2 cotransportadores (6, 14). Debido a los posibles efectos secundarios, como aciduria, ototoxicidad y la precipitación de vasoconstricción, la administración de furosemida en personas fue previamente controvertida (14). Estudios previos en humanos no han demostrado una reducción en el riesgo de requerir terapia de reemplazo renal o mortalidad, y la administración de furosemida puede disminuir la reabsorción de agua y aumentar la producción de orina sin mejorar la creatinina y la función renal (14, 15). Sin embargo, estudios más recientes demuestran una mejor supervivencia a corto plazo, recuperación de la función renal en IRA y mejoría de la azotemia en pacientes oligúricos que recibieron furosemida (13, 16–19). Más recientemente, la prueba de esfuerzo de furosemida (FST), que evalúa la producción de orina en respuesta a un bolo IV de furosemida, predice la progresión de la LRA y disminuye la necesidad de terapia de reemplazo renal. En las primeras etapas, FST puede predecir la LRA progresiva mejor que los marcadores bioquímicos (16, 20). Hay pocos estudios en medicina veterinaria que analicen el efecto de la administración de furosemida en la LRA. En un estudio retrospectivo de perros con leptospirosis, dos de 14 perros con oliguria se volvieron poliúricos después de la administración de furosemida (21). Otro estudio mostró que la combinación de furosemida y dopamina había mejorado el gasto urinario y la diuresis sin cambios en el flujo sanguíneo renal en gatos sanos (19, 21). A pesar de la creciente evidencia para apoyar el papel de la furosemida en personas con LRA, no hay estudios que evalúen el efecto de la furosemida en la producción de orina en gatos con LRA (19, 21).
El gato en este informe de caso se consideró oligoanúrico basado en una falta de producción de orina 21 h después de la hospitalización con administración de líquidos intravenosos, después de corregir la deshidratación, y un tamaño estático de la vejiga de 4,2 × 4,5 cm. Seis horas después de la administración de 4 mg/kg de furosemida IV, se observó que el gato orinaba y continuó orinando posteriormente a ~6,8 ml/kg/h durante las primeras 24 h, en comparación con una producción normal de orina de 1-2 ml/kg/h. La azotemia del paciente se resolvió dentro de los 6 días de la hospitalización y 5 días después de la administración de furosemida. Aunque el momento de la administración de furosemida coincidió con la producción de diuresis, también es posible que el paciente se convirtiera de oligoanuria a no anuria sin intervención. Además, se sospechó que el gato en este informe de caso era oligo-anúrico basado en la falta de micción y un tamaño estático de la vejiga en la evaluación de ultrasonido. Sin embargo, la diuresis no se midió mediante cateterismo urinario, sino más bien pesando las almohadillas urinarias.
Este es el primer caso que describe el resultado exitoso de la LRA oligoanúrica en un gato secundario a la toxicidad del lirio. La conversión de oligoanuria a poliuria puede haber sido secundaria a la administración de furosemida o puede haber sido una progresión natural del proceso de la enfermedad subyacente y la LRA. Sin embargo, esta es la primera supervivencia descrita de LRA oligoanúrica secundaria a toxicidad por lirio en un gato sin tratamiento de reemplazo renal. En conclusión, la furosemida puede ser beneficiosa en la conversión de oligoanuria a poliuria en LRA secundaria a toxicidad por lirios y puede prevenir la necesidad de tratamiento de reemplazo renal. Además, aunque el pronóstico de la LRA anúrica secundaria a la toxicidad del lirio sigue siendo pobre, puede ser posible una resolución exitosa. Se necesitan estudios prospectivos adicionales para evaluar los beneficios de la furosemida sobre la LRA anúrica en medicina veterinaria.
Declaración de disponibilidad de datos
Las contribuciones originales presentadas en el estudio se incluyen en el artículo / material complementario, las consultas adicionales pueden dirigirse al autor correspondiente.
Declaración ética
Se obtuvo el consentimiento informado por escrito del participante/paciente (s) para la publicación de este informe de caso.
Contribuciones del autor
AT, CD, SS y RW contribuyeron a la preparación del manuscrito. Todos los autores contribuyeron al artículo y aprobaron la versión presentada.
Conflicto de intereses
Los autores declaran que la investigación se llevó a cabo en ausencia de cualquier relación comercial o financiera que pudiera interpretarse como un posible conflicto de intereses.
Nota del editor
Todas las afirmaciones expresadas en este artículo son únicamente las de los autores y no representan necesariamente las de sus organizaciones afiliadas, o las del editor, los editores y los revisores. Cualquier producto que pueda ser evaluado en este artículo, o reclamo que pueda ser hecho por su fabricante, no está garantizado ni respaldado por el editor.
Notas
1. ^Gluconato de calcio—Fresenius Kabi, Lago Zurich, IL.
2. ^Cristaloide isotónico—Dechra Veterinary Products, Overland Park, KS.
3. ^Dextrosa—International Medication Systems, El Monte, CA.
4. ^Cerenia—Zoetis Inc, Kalamazoo, MI.
5. ^Albuterol—Glaxosmithkline, Research Triangle Park, NC.
6. ^Bicarbonato de sodio—Hospira Inc, Lake Forest, IL.
7. ^Unasyn—Meitheal Pharmaceuticals, Chicago, IL.
8. ^Humulin R—Lilly USA, Indianapolis, IN.
9. ^Pantoprazol—Sun Pharmaceutical Industries Inc, Cranbury, NJ.
10. ^Terbutalina—Westward Pharmaceutical Corp, Eatontown, NJ.
11. ^Furosemida—Covetrus North America, Dublín, OH.
Referencias
1. Fitzgerald KT. Lily Toxicidad en el gato. Top Companion Anim Med. (2010) 25:213–7. doi: 10.1053/j.tcam.2010.09.006
Resumen de PubMed | Texto completo de CrossRef | Google Académico
2. Rumbeiha WK, Francis JA, Fitzgerald SD, Nair MG, Holan K, Bugyei KA, et al. Un estudio exhaustivo de la intoxicación por lirio de pascua en gatos. J Vet Diagn Investig. (2004) 16:527–41. doi: 10.1177/104063870401600607
Resumen de PubMed | Texto completo de CrossRef | Google Académico
3. Bennett AJ, Reineke EL. Resultado después de la descontaminación del tracto gastrointestinal y la diuresis de líquidos intravenosos en gatos con ingestión conocida de lirios: 25 casos (2001-2010). J Am Vet Med Assoc. (2013) 242:1110–6. doi: 10.2460/javma.242.8.1110
Resumen de PubMed | Texto completo de CrossRef | Google Académico
4. Langston CE. Insuficiencia renal aguda causada por la ingestión de lirios en seis gatos. J Am Vet Med Assoc. (2002) 220:49–52. doi: 10.2460/javma.2002.220.49
Resumen de PubMed | Texto completo de CrossRef | Google Académico
5. Langston C, Eatroff A. Lesión renal aguda. En:S. Little, Susan y J. August, , editores. Consultas de agosto en Medicina Interna Felina, Volumen 7. St Louis, MO: Elsevier (2016). págs. 483–98.
6. Abbott LM, Kovacic J. El espectro farmacológico de la furosemida. J Vet Emerg Crit Care. (2008) 18:26–39. doi: 10.1111/j.1476-4431.2007.00267.x
7. Ross L. Lesión renal aguda en perros y gatos. Veterinario Clin N Am. (2011) 41:1–14. doi: 10.1016/j.cvsm.2010.09.003
Resumen de PubMed | Texto completo de CrossRef | Google Académico
8. Sirivella S, Gielchinsky I, Parsonnet V. Manitol, furosemida e infusión de dopamina en la insuficiencia renal postoperatoria que complica la cirugía cardíaca. Ann Thorac Surg. (2000) 69:501–6. doi: 10.1016/S0003-4975(99)01298-9
Resumen de PubMed | Texto completo de CrossRef | Google Académico
9. Brady MA, Janovitz EB. Nefrotoxicosis en un gato después de la ingestión de lirio híbrido asiático (Lilium Sp.). J Vet Diagn Investig. (2000) 12, 566–8. DOI: 10.1177/104063870001200613
Resumen de PubMed | Texto completo de CrossRef | Google Académico
10. Segev G, Nivy R, Kass PH, Cowgill LD. Un estudio retrospectivo de la lesión renal aguda en gatos y el desarrollo de un nuevo sistema de puntuación clínica para predecir el resultado de los gatos tratados por hemodiálisis. J Vet Pasante Med. (2013) 27:830–9. DOI: 10.1111/JVIM.12108
Resumen de PubMed | Texto completo de CrossRef | Google Académico
11. Langston CE, Cowgill LD, Spano JA. Aplicaciones y resultado de la hemodiálisis en gatos: una revisión de 29 casos. J Vet Pasante Med. (1997) 11:348–55. doi: 10.1111/j.1939-1676.1997.tb00479.x
Resumen de PubMed | Texto completo de CrossRef | Google Académico
12. Silverstein DC, Hopper K. Small Animal Critical Care Medicine. 3ª ed. St. Louis, MO: Elsevier – OHCE (2022).
13. Dehkordi MG, Yousefichaijan P, Ghandi Y, Dorreh F, Alinejad S, Rezagholizamenjany M. Dopamina y goteo lasix en pediatría con oliguria: un estudio de ensayo clínico. Nefrourol Lun. (2021) 13:1–4. doi: 10.5812/numonthly.111895
14. Chawla LS, Davison DL, Brasha-Mitchell E, et al. Desarrollo y estandarización de una prueba de esfuerzo de furosemida para predecir la gravedad de la lesión renal aguda. Cuidado crítico. (2013) 17. DOI: 10.1186/CC13015
Resumen de PubMed | Texto completo de CrossRef | Google Académico
15. Ho KM, Power BM. Beneficios y riesgos de la furosemida en la lesión renal aguda. Anestesia. (2010) 65:283–93. doi: 10.1111/j.1365-2044.2009.06228.x
Resumen de PubMed | Texto completo de CrossRef | Google Académico
16. Chen JJ, Chang CH, Huang YT, Kuo G. Prueba de esfuerzo de furosemida como marcador predictivo de progresión de la lesión renal aguda o terapia de reemplazo renal: una revisión sistémica y metanálisis. Cuidado crítico. (2020) 24. DOI: 10.1186/S13054-020-02912-8
Resumen de PubMed | Texto completo de CrossRef | Google Académico
17. Ni J, Jiang H, Wang F, Zhang L, Sha D, Wang J. Efecto de la infusión continua de furosemida en el resultado de la lesión renal aguda. Pak J Med Sci. (2019) 35:754–7. DOI: 10.12669/PJMS.35.3.1012
Resumen de PubMed | Texto completo de CrossRef | Google Académico
18. Lindner A, Cutler RE, Goodman WG, Pansing PA, Kuester R. Sinergismo de dopamina más furosemida en la prevención de la insuficiencia renal aguda en el perro. Riñón Int. (1979) 16:158–66. doi: 10.1038/ki.1979.117
Resumen de PubMed | Texto completo de CrossRef | Google Académico
19. McClellan JM, Goldstein RE, Erb HN, Dykes NL, Cowgill LD. Efectos de la administración de líquidos y diuréticos sobre la tasa de filtración glomerular, el flujo sanguíneo renal y la producción de orina en gatos despiertos sanos. Am J Vet Res. (2006) 67:715–22. DOI: 10.2460/AJVR.67.4.715
Resumen de PubMed | Texto completo de CrossRef | Google Académico
20. Koyner JL, Davison DL, Brasha-Mitchell E, Chalikonda DM, Arthur JM, Shaw AD, et al. Prueba de esfuerzo con furosemida y biomarcadores para la predicción de la gravedad de la LRA. J Am Soc Nefrol. (2015) 26:2023–31. doi: 10.1681/ASN.2014060535
Resumen de PubMed | Texto completo de CrossRef | Google Académico
21. Adin CA, Cowgill LD. Tratamiento y resultado de perros con leptospirosis: 36 casos (1990–1998). J Am Vet Med Assoc. (2000) 216:371–5. doi: 10.2460/javma.2000.216.371
Resumen de PubMed | Texto completo de CrossRef | Google Académico
Palabras clave: anuria, lesión renal aguda, lirio (Lilium y Hemerocallis spp.), furosemida, toxicidad, oligoanuria
Cita: A A, Davila C, Stroope S y Walton R (2023) Informe de caso: Resolución de la lesión renal aguda oligoanúrica con la administración de furosemida en un gato después de la toxicidad del lirio. Frente. Vet. Sci. 10:1195743. doi: 10.3389/fvets.2023.1195743
Recibido: 28 de marzo de 2023; Aprobado: 05 Junio 2023;
Publicado: 05 julio 2023.
Editado por:
Philippe Jacques Berny, VetAgro Sup, Francia
Revisado por:
Maxime Cambournac, Centre Hospitalier Vétérinaire FREGIS, Francia
Nicola Bates, Veterinary Poisons Information Service (VPIS), Reino Unido
Derechos de autor © 2023 Para, Dávila, Stroope y Walton. Este es un artículo de acceso abierto distribuido bajo los términos de la Licencia de Atribución Creative Commons (CC BY).
*Correspondencia: Rebecca Walton, rwalton@iastate.edu
Renuncia: Todas las afirmaciones expresadas en este artículo son únicamente las de los autores y no representan necesariamente las de sus organizaciones afiliadas, o las del editor, los editores y los revisores. Cualquier producto que pueda ser evaluado en este artículo o reclamo que pueda ser hecho por su fabricante no está garantizado ni respaldado por el editor.
Date de alta y recibe nuestro 👉🏼 Diario Digital AXÓN INFORMAVET ONE HEALTH
Date de alta y recibe nuestro 👉🏼 Boletín Digital de Foro Agro Ganadero
Noticias animales de compañía
Noticias animales de producción
Trabajos técnicos animales de producción
Trabajos técnicos animales de compañía