Caso clínico: Terapia con cannabinoides para el lupus eritematoso discoide en un perro
Caso clínico: Terapia con cannabinoides para el lupus eritematoso discoide en un perro
 Maria Eduarda Schmitz da Silva1
Maria Eduarda Schmitz da Silva1  Bruna Christianetti1
Bruna Christianetti1  Erik Amazonas2,3
Erik Amazonas2,3  Marcy Lancia Pereira2*
Marcy Lancia Pereira2*- 1Estudiante de Medicina Veterinaria, Universidad Federal de Santa Catarina (UFSC), Curitibanos, Brasil
- 2Departamento de Biociencias y Una Salud, Centro de Ciencias Rurales, Universidad Federal de Santa Catarina (UFSC), Curitibanos, Brasil
- 3Centro de Desarrollo e Innovación del Cannabis (PODICAN/UFSC), Curitibanos, Brasil
El lupus eritematoso discoide (DLE) es una enfermedad autoinmune común de la piel en los perros. Los tratamientos convencionales, como los corticosteroides, pueden ser eficaces, pero a menudo tienen efectos secundarios. En este caso clínico se presenta un uso exitoso de la terapia con cannabinoides (TC) en un perro con DLE resistente al tratamiento convencional. Un perro mestizo de 2 años de edad con antecedentes de DLE presentó un empeoramiento de las lesiones a pesar del tratamiento con corticoides y otros medicamentos. Los niveles de enzimas hepáticas estaban elevados, lo que indica efectos secundarios inducidos por corticosteroides. Se inició la TC con un aceite de cannabis de espectro completo rico en CBD. La dosis se ajustó gradualmente hasta encontrar la dosis mínima efectiva. A las pocas semanas de comenzar la TC, el perro mostró una mejora significativa en las lesiones cutáneas y en los niveles de enzimas hepáticas. Después de 1 año, el perro permanece clínicamente estable con una dosis baja de aceite rico en CBD de espectro completo. No se observaron evidencias de recurrencia del DEL. Este caso sugiere que la TC puede ser una alternativa viable o una terapia complementaria para el DLE en perros, particularmente para aquellos que experimentan efectos adversos de los tratamientos convencionales. Se justifica la realización de más investigaciones para confirmar la eficacia y la seguridad de la TC para el tratamiento del DLE en perros.
1 Introducción
El lupus eritematoso discoide (DLE) es una enfermedad de la piel inmunomediada que afecta a perros de ambos sexos y razas a partir de los 2 años. Es causada por la producción de anticuerpos contra componentes celulares (autoanticuerpos) de la piel y conduce a reacciones de hipersensibilidad de tipo II o III (1). Los autoanticuerpos se dirigen a los componentes sanos de las células de la piel, en particular a las estructuras nucleares y a las proteínas ribosómicas, iniciando la cascada inflamatoria. Las citoquinas proinflamatorias, como la IL-6 y el TNF-alfa, actúan como amplificadores, reclutando células inflamatorias y potenciando sus tendencias destructivas, lo que provoca daños tisulares y lesiones visibles (2, 3). La cascada del complemento también desempeña un papel crucial en el DLE, ya que perfora las membranas celulares, lo que aumenta el daño tisular. Como resultado de la cascada inflamatoria presente en DLE, los radicales libres se acumulan, amplifican la inflamación y causan estragos al dañar las células y los tejidos.
Los signos clínicos del DLE incluyen despigmentación, pérdida de cabello y enrojecimiento, que pueden progresar a costras y ulceración. Las lesiones son más comunes en la nariz y las orejas, pero también pueden ocurrir en las extremidades, los genitales y la boca. El diagnóstico definitivo del DLE se realiza mediante el examen físico, la historia clínica y el examen histopatológico (2, 4, 5).
Los tratamientos inmunosupresores convencionales como los corticoides (6) y los inhibidores de la calcineurina (7) pueden ser eficaces, pero a menudo tienen efectos secundarios. Los cannabinoides representan una nueva clase de compuestos inmunomoduladores que se están estudiando a fondo para diversas enfermedades inflamatorias y autoinmunes (8-13). Estas moléculas derivadas del cannabis actúan sobre el sistema endocannabinoide (SEC) de los animales vertebrados y tienen como objetivo absoluto el mantenimiento de la homeostasis en todo el entorno intracelular en todos los sistemas del cuerpo (14). Si bien el mecanismo exacto de acción de los cannabinoides en el DLE en perros sigue siendo objeto de investigación, sus efectos inmunomoduladores a través del sistema endocannabinoide (SEC) ofrecen una explicación prometedora de su potencial terapéutico. El cannabidiol (CBD) y el tetrahidrocannabinol (THC) inhiben la degranulación de los mastocitos, reduciendo la liberación de mediadores inflamatorios como la histamina y las prostaglandinas (15). El CBD y el THC también regulan a la baja la producción de citoquinas proinflamatorias como la interleucina (IL)-6 y el factor de necrosis tumoral (TNF)-alfa (15), al tiempo que promueven la liberación de citoquinas antiinflamatorias como la IL-10 y promueven la actividad de las células T reguladoras (Tregs) (16), que suprimen la respuesta inmunitaria general y previenen la inflamación excesiva y eliminan los radicales libres previniendo el estrés oxidativo (17). El CBD puede inhibir la activación de la cascada del complemento, evitando el reclutamiento de más células inflamatorias. Conocido por sus efectos analgésicos y antipruriginosos, el THC parece actuar a través de la activación de los receptores CB1 en las neuronas sensoriales, lo que inhibe la transmisión de señales de picazón a la médula espinal y el cerebro, proporcionando un alivio directo de los rascados y las molestias. El THC puede suprimir la liberación de la sustancia neuropeptídica P, que contribuye a la inflamación neurogénica y a la sensación de picor, y por lo tanto reduce la inflamación neurogénica (18).
En este caso clínico se presenta el uso exitoso de la terapia con cannabinoides (TC) en un perro con DLE resistente al tratamiento convencional.
2 Descripción del caso
Una perra mestiza de 2 años de edad, con un peso de 25,5 kg y una puntuación de condición corporal de 5 (en una escala de 1 a 9), fue presentada en la Clínica de la Facultad de Veterinaria (CVE) de la Universidad Federal de Santa Catarina, con diagnóstico histopatológico previo de lupus eritematoso discoide. La principal queja fue la descamación epidérmica, la despigmentación y la formación de costras en la región del puente nasal y en el interior de las fosas nasales. Previamente, el perro había sido tratado con tacrolimus tópico (Tacroz 1 mg, pomada, BID), vitamina E (DrogaVET, 400 UI, 1 cápsula VO, BID) y un protector solar y loción hidratante (loción Hydra Reflex, aplicada antes de la exposición solar) durante 30 días, pero no se observó mejoría de las lesiones.®®®
Al examen físico, la región nasal presentaba áreas hipopigmentadas de 0,8 mm, eritema difuso con erosión y descamación. Se inició tratamiento con 1,5 mg/kg de prednisolona (40 mg de Eurofarma genérico, 1 comprimido VO, dos veces al día) durante 2 semanas. Si bien el perro mostró una ligera mejoría después de un mes de seguimiento, las lesiones persistieron (Figura 1A). El tratamiento con corticoides se prolongó durante otras 2 semanas, lo que desafortunadamente provocó un empeoramiento de las lesiones.
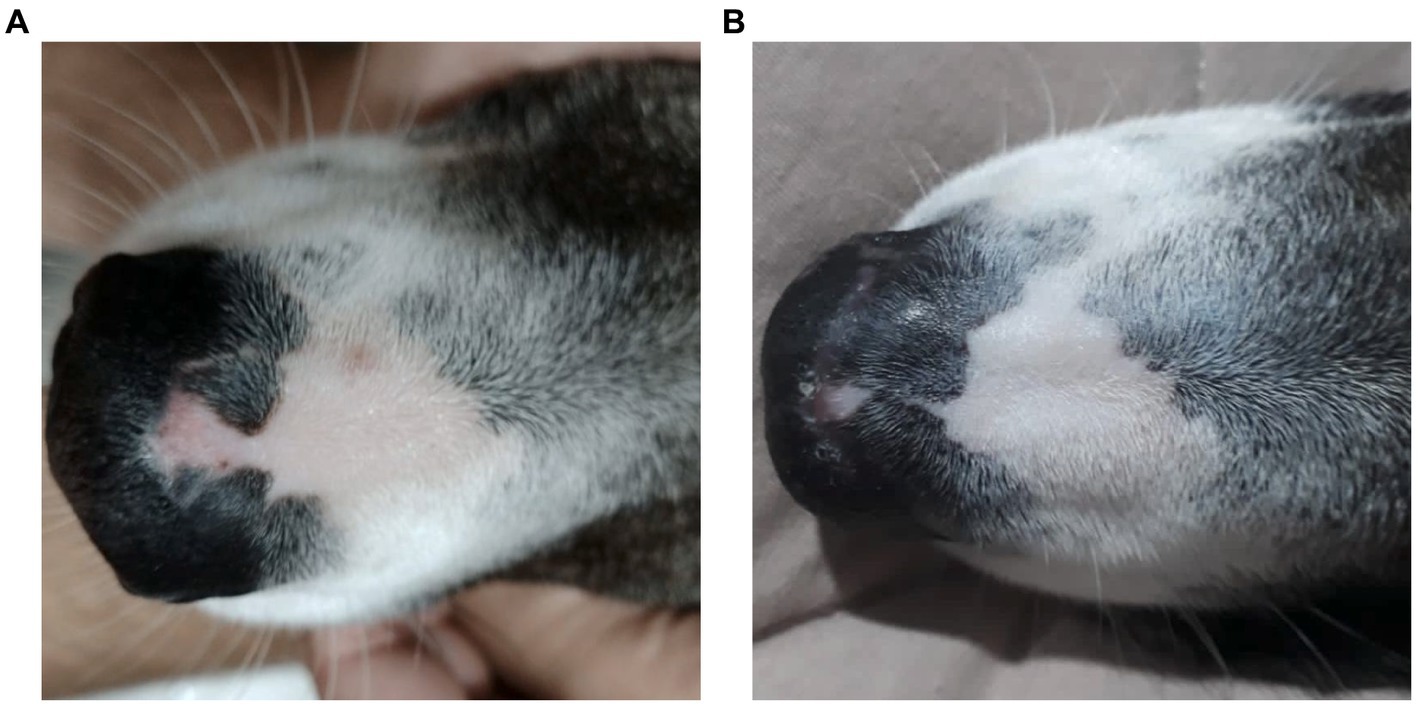
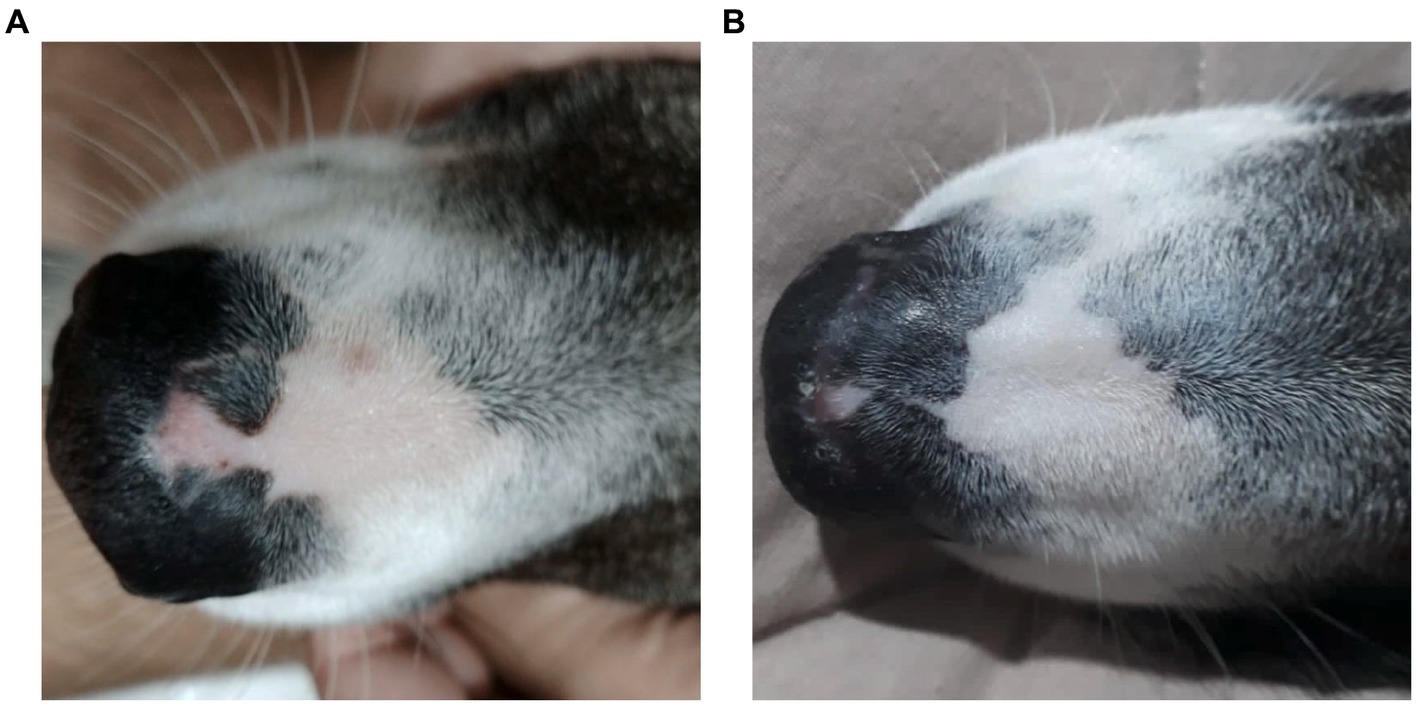 Figura 1. Una perra mestiza, de 2 años de edad, presentó despigmentación epidérmica en el puente nasal. (A) Imagen macroscópica que muestra la despigmentación en el plano nasal antes del tratamiento con aceite de Cannabis (fecha: 31/05/2022). (B) Imagen macroscópica que muestra la reducción y estabilización de la despigmentación en el plano nasal después de 1 año y 3 meses de tratamiento con aceite de Cannabis (fecha: 19/09/2023).
Figura 1. Una perra mestiza, de 2 años de edad, presentó despigmentación epidérmica en el puente nasal. (A) Imagen macroscópica que muestra la despigmentación en el plano nasal antes del tratamiento con aceite de Cannabis (fecha: 31/05/2022). (B) Imagen macroscópica que muestra la reducción y estabilización de la despigmentación en el plano nasal después de 1 año y 3 meses de tratamiento con aceite de Cannabis (fecha: 19/09/2023).
Durante 7 meses, tres intentos de reducir la dosis de corticoides resultaron infructuosos. El perro desarrolló cambios de comportamiento, incluido un aumento de la irritabilidad con sus compañeros de casa, un aumento de peso de 25,5 kg a 36,7 kg, un aumento del 44% en 7 meses e indicios de daño hepático. Las pruebas de función hepática realizadas con 1 mes de diferencia confirmaron estas preocupaciones, mostrando niveles elevados de alanina aminotransferasa (ALT) (160 U/L y 276,6 U/L respectivamente, rango de referencia: 10-88 U/L) y fosfatasa alcalina (FA) (181 U/L y 416 U/L respectivamente, rango de referencia: 20-156 U/L).
No baseline tests were performed to measure the patient’s condition before initiating corticosteroid therapy. Prior to the initial examination, no complaints beyond peeling, depigmentation, and crusting were documented. The emergence of behavioral and weight concerns only occurred following the administration of corticosteroids.
With corticosteroid therapy no longer an option, the owner, concerned about the dog’s well-being, explored alternative treatments. After discussion, it was decided to interrupt corticosteroid therapy and to try cannabinoid therapy (CT) with cannabis derivatives.
The patient was directed to a veterinarian specialist well-versed in cannabinoid therapy. The veterinarian prescribed a full-spectrum oil containing a 2:1 THC:CBD ratio (20 mg/mL THC, 10 mg/mL CBD, and a total of 40 mg/mL, considering other non-identified cannabinoid species). All Cannabis-based products used along this dog’s treatment were provided by the following non-governmental medical Cannabis associations in Brazil: Cannabis Sem Fronteiras (CSF), AMA-ME, Alternativa, and Santa Cannabis, to whom we express our gratitude for their timely delivery and generous donation of several Cannabis oils throughout the treatment.
El tratamiento con cannabinoides comenzó con una sola gota de aceite de cannabis (0,08 mg/kg/día de cannabinoides totales; AMA-ME) administrada por vía oral una vez al día durante 3 días. A continuación, la dosis se incrementó gradualmente cada 3 días, pasando de una gota oral una vez al día a una gota dos veces al día (0,16 mg/kg/día de cannabinoides totales), luego a dos gotas dos veces al día (0,32 mg/kg/día de cannabinoides totales), y así sucesivamente, hasta que se identificó la dosis óptima para el control de los síntomas. Curiosamente, el propietario informó de una mejora en el comportamiento del perro poco después de suspender la prednisolona y en el primer día de recibir el aceite de cannabis.
Cuarenta días después, el paciente regresó con molestias en el oído. Los hisopados citológicos revelaron otitis fúngica por hongos en el oído izquierdo y otitis bacteriana con cocos y bastones en el oído derecho. Un compuesto limpiador de oídos que contiene 50% de pantenol, 20% de ácido glicirrícico, 20% de ácido láctico, 3% de aceite esencial de menta y 2% de aceite esencial de manzanilla (Oto Clean Up, una pulverización por oído, una vez al día durante 3 días) y una suspensión otológica antiinflamatoria, antibiótica y antifúngica (49% de orbifloxacino, 5,14% de furoato de mometasona y 5,14% de posaconazol; Posatex®®, Se prescribieron ocho gotas por oído, una vez al día durante 6 días, a partir de la limpieza inicial). Mientras que el propietario informó que administraba ocho gotas del aceite de THC:CBD 2:1 (40 mg/ml) dos veces al día (1,28 mg/kg/día de cannabinoides totales; AMA-ME), no se observó una mejoría significativa en el estado de la piel. Para abordar esto, el protocolo se ajustó para incluir 10 gotas de un aceite rico en CBD de espectro completo (50 mg/ml) dos veces al día (1,96 mg/kg/día de cannabinoides totales; Alternativa) mientras se reduce el aceite con predominio de THC (40 mg/mL) a tres gotas una vez al día (0,24 mg/kg/día de cannabinoides totales; AMA-ME). En pocas semanas, el perro mostró una mejora significativa en los signos dermatológicos, acompañada de una mejora concurrente en la función hepática.
Diez días después de la evaluación anterior, el perro regresó para una cita de seguimiento. La lesión del plano nasal continuó reduciéndose, lo que provocó un aumento en la dosis de aceite rico en CBD de 10 a 15 gotas (2,4 mg/kg/día de cannabinoides totales; Alternativa). La dosis de aceite rico en THC se mantuvo sin cambios en tres gotas (0,24 mg/kg/día de cannabinoides totales; LCR). Si bien persistió el eritema leve, la secreción y la pérdida de cabello en el oído izquierdo, se continuó con la solución para el oído prescrita durante otros 3 días, lo que llevó a la resolución completa de la otitis externa bilateral.
Quince días después, una evaluación de seguimiento no reveló ninguna reducción adicional en el área de despigmentación del plano nasal, aunque su progresión se había estabilizado. El estado general del paciente había mejorado de forma demostrable con la pérdida de peso, y el propietario informó de un retorno a la normalidad y al comportamiento juguetón, sin signos observables de malestar. Las dosis de ambos aceites de cannabis se mantuvieron en los niveles anteriores.
Aproximadamente 1 mes y medio después de la consulta previa, un seguimiento reveló que la lesión del plano nasal era estática, sin mostrar mayor mejoría o deterioro. Sin embargo, se identificó una nueva lesión caracterizada por despigmentación y signos de conjuntivitis alérgica en la cara medial de la fosa nasal derecha. Se prescribió ungüento oftálmico Keravit (tópicamente, dos veces al día durante 5 días). La terapia con cannabis se mantuvo inalterada y se aconsejó al paciente que minimizara la exposición al sol.®
Tres meses después, el animal regresó sin signos de despigmentación en el plano nasal. Sin embargo, se observaron nuevas lesiones costrosas en la vulva. La zona afectada se limpió con clorhexidina al 1% (spray Asseptcare, BID durante 7 días), mientras se mantenían las dosis de los aceites de cannabis. Aunque se mencionó la posibilidad de una lesión relacionada con el lupus, no se realizó ninguna investigación diagnóstica adicional. Un seguimiento telefónico posterior confirmó la resolución completa de la lesión vulvar.®
Dos meses después, el animal regresó para una reevaluación clínica y una vacunación anual. Se extrajo sangre periférica para una evaluación integral, que incluyó análisis bioquímico, recuento de células sanguíneas y una prueba de anticuerpos antinucleares (ANA). A pesar del tratamiento en curso, el animal se mantuvo clínicamente estable. El hemograma reveló una eritrocitosis discreta, con recuento elevado de glóbulos rojos (8,79 × 106/μl; Referencia: 5.5–8 × 106/μl), hemoglobina (20,8 d/dL; referencia: 12-18 g/dL) y hematocrito (65,1%; referencia: 37-55%). Además, se observó anisocitosis, policromasia, macroplaquetas, lipemia y hemólisis en el suero. En particular, los niveles de ALT, aunque seguían superando el rango de referencia, habían disminuido a 123,6 U/L (10-88 U/L). Un dato alentador fue que el resultado de la prueba de ANA fue negativo.
Dada la facilidad de acceso y los resultados satisfactorios, la terapia con cannabinoides del animal pasó a un único aceite de cannabis de espectro completo con una proporción de CBD:THC de 3:1 (40 mg/ml de cannabinoides totales, Alternativa). Para determinar la dosis mínima efectiva, se instruyó al propietario para que redujera gradualmente la medicación, reduciendo el aceite de cannabis en 1 gota (0,08 mg/kg de cannabinoides totales) cada 3 días y vigilando cualquier regresión en la respuesta al tratamiento. Este programa de ajuste continuaría hasta que se estableciera la dosis óptima de mantenimiento.
Un año después del diagnóstico, el animal mantiene la estabilidad clínica (Figura 1B) con una dosis de cannabinoides dos veces al día de 0,32 mg/kg/día de Santa Cannabis con la misma proporción de CBD:THC de 3:1 a 40 mg/ml, con un peso corporal de 26,6 kg, solo 1 kilogramo por encima de la medición inicial.
3 Discusión
El lupus eritematoso discoide (DLE) sigue siendo un enemigo misterioso en los perros. Sus orígenes están envueltos en una mezcla de genética, infecciones, hormonas y exposición al sol (1). Esta enfermedad autoinmune se presenta como parches escamosos y descoloridos típicamente en la nariz, pero a veces se aventuran a las orejas, los labios y más allá (2, 19). El diagnóstico implica la combinación de los signos clínicos, las pruebas cutáneas y los análisis de sangre (19), aunque las pruebas específicas de autoanticuerpos a menudo eluden el alcance de DLE (4). El diagnóstico diferencial incluye pioderma nasal, demodicosis, dermatofitosis, pénfigo eritematoso o foliáceo, dermatomiositis, síndrome uveodermatológico, dermatitis nasal solar y despigmentación nasal (2, 5, 20). Las terapias tradicionales, como los corticosteroides y los inhibidores de la calcineurina, mantienen el fuerte inicialmente, pero a menudo requieren un compromiso a largo plazo debido a la tendencia de la DLE a regresar y conllevan posibles efectos secundarios (2, 7). El aumento de peso y los cambios de comportamiento fueron efectos secundarios observados en el presente caso. El perro mostró una mayor irritabilidad con sus compañeros de casa y el peso del animal aumentó un 44%, de 25,5 kg a 36,7 kg, durante la terapia con corticosteroides. Un mes después del tratamiento con cannabinoides, el paciente ya había reducido el peso alcanzando los 32,4 kg (un 9% menos) y terminó en 26,6 kg en la observación final realizada (Figura 2).
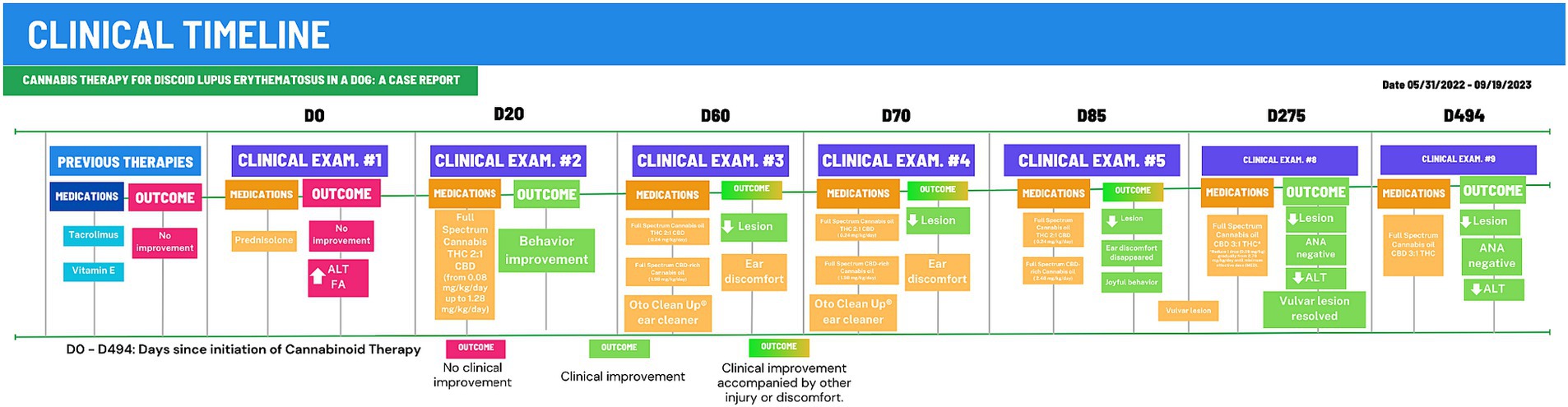 Figura 2. Cronograma clínico de 494 días de terapia con cannabinoides (TC). Después de 275 días de TC, el animal se estabilizó y la dosis total de cannabinoides se redujo gradualmente a 0,38 mg/kg/día. D0, Primer examen en CVE/UFSC; Resultados en recuadros rojos, sin mejoría o empeoramiento; Resultados mmm cajas verdes, mejoría clínica.
Figura 2. Cronograma clínico de 494 días de terapia con cannabinoides (TC). Después de 275 días de TC, el animal se estabilizó y la dosis total de cannabinoides se redujo gradualmente a 0,38 mg/kg/día. D0, Primer examen en CVE/UFSC; Resultados en recuadros rojos, sin mejoría o empeoramiento; Resultados mmm cajas verdes, mejoría clínica.
La presentación inicial de la paciente incluyó despigmentación persistente y descamación en el plano nasal, junto con lesiones costrosas en las orejas y la vulva. También se reportó un episodio de otitis externa. Se observó un aumento de las enzimas ALT y FA, relevante para el uso prolongado de corticoides. Sin embargo, no se realizaron pruebas previas antes del inicio del tratamiento con corticoides con fines comparativos. El animal fue remitido con una biopsia positiva para DLE y una prueba de anticuerpos antinucleares (ANA) negativa.
El tratamiento del DLE consiste en controlar las vías inflamatorias implicadas en la patogénesis. Por lo general, las lesiones responden bien a una variedad de medicamentos. En la mayoría de los casos, el tratamiento debe continuarse durante toda la vida del animal debido a las frecuentes recaídas tras la reducción de la dosis, como se observa en este caso. En casos leves, el tratamiento con DLE consiste en la aplicación tópica de corticosteroides como betametasona, fluocinolona o ciclosporina del 1 al 2% dos veces al día (dos veces al día) hasta la remisión completa, que puede tardar de 4 a 6 semanas (3). La frecuencia de las aplicaciones se reduce a un mínimo de cada 24 o 48 h. Además, en los casos leves se pueden utilizar tratamientos tópicos con inhibidores de la calcineurina como la pomada de tacrolimus al 0,1% dos veces al día (2, 3, 21). Nuestro paciente canino, diagnosticado de DLE, se embarcó inicialmente en un viaje de corticoides y pomada de tacrolimus, pero esto fue ineficaz para controlar las lesiones derivadas de la enfermedad. Además, el tapering resultó traicionero y el hígado mostró signos de angustia. Desafortunadamente, la vitamina E, un aliado potencial en el control de los síntomas, fue abandonada antes de que se pudiera evaluar su impacto. En los casos más graves, está indicada la terapia inmunosupresora. Esto puede incluir corticosteroides sistémicos como prednisona o prednisolona a una dosis de 2 mg/kg de DIM o 1 mg/kg dos veces al día por vía oral hasta que las lesiones se curen, lo que puede tardar hasta 4 semanas, y no puede haber mejoría alguna. Se ha recomendado la vitamina E o una combinación de niacinamida y tetraciclina como tratamientos complementarios para el control de signos como el prurito en el DLE (3). La ciclosporina se recomienda para los casos graves de DLE (20), pero es costosa y puede ser difícil mantener el tratamiento de manera constante. El mayor reto radica en la búsqueda de una terapia eficaz y segura a largo plazo.
Los derivados del cannabis, más allá de su destreza analgésica, están emergiendo como potenciales caballeros con una armadura brillante contra la inflamación y el exceso de trabajo del sistema inmunológico en el mundo veterinario (8, 15, 22-26). A diferencia de las drogas tradicionales, estos compuestos bailan con el propio sistema endocannabinoide (SEC) del cuerpo, un maestro conductor de la armonía celular, la homeostasis y diversas funciones (27). Al influir en la orquesta de la respuesta inmunitaria, pueden silenciar los tambores proinflamatorios y amplificar las melodías antiinflamatorias (15, 28-30). Este intrincado vals se alinea maravillosamente con las necesidades de DLE, como lo demuestra la mejoría observada en nuestro paciente.
Los veterinarios están interesados en el uso de compuestos cannabinoides derivados de la planta Cannabis sativa como alternativas seguras y efectivas para el tratamiento del DLE en perros. Los estudios clínicos y los informes de casos en animales han mostrado resultados positivos para el uso de estos compuestos en el tratamiento de la osteoartritis canina (22-25, 31), la epilepsia (31-34), los trastornos del comportamiento en perros (35) y caballos (36) y los efectos antiinflamatorios (37). Sin embargo, hasta el momento no se han realizado estudios o informes sobre el uso del aceite de cannabis en el tratamiento del DLE en perros.
Como se ha observado, la terapia convencional con corticoides puede ser eficaz, pero está limitada por su uso prolongado. Los cannabinoides, por otro lado, carecen de efectos secundarios significativos y son seguros para el uso a largo plazo (27, 31, 38, 39). La terapia con cannabinoides para el DLE, aún en pañales, necesita ajustes meticulosos y dosis individualizadas. Este caso ejemplifica el mantra «Empieza poco, ve despacio», donde la dosis diaria total ascendió suavemente de 0,08 mg/kg a 2,64 mg/kg, guiada por la respuesta única del paciente. Con cada aumento cuidadoso, el objetivo es restaurar el ritmo del SEC y encontrar la melodía perfecta, la dosis efectiva más pequeña, para cada animal individual, reconociendo la sinfonía diversa de cada SEC (40, 41).
Los derivados de espectro completo de Cannabis sativa contienen cientos de cannabinoides, como el THC y el CBD, que actúan sobre varios receptores acoplados a proteínas G, incluidos los receptores cannabinoides 1 y 2 (CB1 y CB2), el potencial vanloide del receptor transitorio (TRPV), la melastatina del potencial del receptor transitorio (TRPM), la anquirina del potencial del receptor transitorio (TRPA) y el receptor activado por el proliferador de peroxisomas (PPAR) (15, 27, 29). Estos receptores desencadenan innumerables efectos sobre el metabolismo celular, incluidas importantes vías de señalización intrínsecas a la respuesta inmunitaria, como AMPc, MAPK/ERK/MEK/FOS/JUN y PI3/Akt (42) y modulan el entorno celular hacia la homeostasis y, por lo tanto, resuelven los procesos inflamatorios (15, 27, 29, 42).
Los cannabinoides se han asociado con la modulación de la función inmune y la inhibición de la liberación de citoquinas proinflamatorias, como el factor de necrosis tumoral alfa (TNF-α), interferón alfa, gamma y beta (IFN-ɑ, IFN-ɣ e IFN-β), interleucinas IL-1β, IL-6, IL-12, IL-23, y regula el factor nuclear NF-κB (15, 27, 43, 44). Los cannabinoides también modulan la activación de los linfocitos T y B, promueven la secreción de IL-10 y estimulan las células T reguladoras, reduciendo así la respuesta inflamatoria (15, 29). El CBD inhibe la liberación selectiva de IFN-ɑ a través de CB2 en las células dendríticas plasmocitoides, que están presentes en altos niveles en la piel de pacientes con lupus eritematoso discoide (DLE) (30). Las reacciones de hipersensibilidad que se producen en el DLE son responsables de mecanismos proinflamatorios que conducen a la infiltración y el daño tisular. Los estudios han demostrado que los cannabinoides son capaces de inhibir estos procesos (45-47). Esto puede explicar la mejoría observada en el paciente en cuestión.
Nuestro caso de DLE de un año de duración destaca el éxito de la titulación de dosis para un enfoque de Terapia Cannabinoide Individualizada (ICT). El tratamiento comenzó con una dosis diaria de cannabinoides de 0,08 mg/kg. Se comenzaron a observar notables mejoras clínicas en el plano nasal a 0,32 mg/kg/día, lo que provocó un aumento adicional a 2,64 mg/kg/día. Tras la estabilización clínica, la dosis se redujo gradualmente, alcanzando la dosis mínima efectiva de 0,32 mg/kg/día de cannabinoides totales.
A lo largo del período de tratamiento, el perro mostró un bienestar general robusto, mantuvo una disposición activa y juguetona y experimentó una estabilización de sus signos dermatológicos. No se necesitaron corticoides durante la TIC. Esto ofrece indicios iniciales de que los cannabinoides podrían servir como una alternativa viable y saludable a los enfoques terapéuticos extendidos para el DLE en perros. Sin embargo, la búsqueda de respuestas definitivas continúa: se necesitan estudios rigurosos para solidificar la eficacia de los derivados del cannabis para la DLE; la dosis óptima y el horario de administración siguen siendo una melodía que espera ser compuesta; y los datos de seguridad y eficacia a largo plazo requieren más investigación.
Si bien la canción de la terapia con cannabis para el DLE en perros es inmensamente prometedora, debemos seguir escuchando atentamente, reuniendo más evidencia y refinando la melodía. Este informe de caso agrega su verso al coro creciente, allanando el camino para futuras investigaciones y potencialmente ofreciendo un nuevo ritmo de esperanza y un refugio del reinado a largo plazo de los corticosteroides para los perros que luchan contra esta desafiante enfermedad.
Declaración de disponibilidad de datos
Los datos brutos que respaldan las conclusiones de este artículo serán puestos a disposición por los autores, sin reservas indebidas.
Declaración ética
No se requirió aprobación ética para los estudios con animales de acuerdo con la legislación local y los requisitos institucionales porque se trata de un informe de caso. El perro estaba en tratamiento clínico en nuestra universidad y a continuación describimos el resultado positivo del tratamiento con cannabis realizado. Se obtuvo el consentimiento informado por escrito de los propietarios para la participación de sus animales en este estudio.
Contribuciones de los autores
MS: Curación de datos, Análisis formal, Investigación, Redacción – borrador original, Redacción – revisión y edición. BC: Curación de datos, Análisis formal, Investigación, Redacción – borrador original, Redacción – revisión y edición. EA: Conceptualización, Curación de datos, Investigación, Supervisión, Validación, Redacción – revisión y edición, Recursos, Redacción – borrador original. MP: Conceptualización, Investigación, Supervisión, Validación, Redacción, Revisión y Edición, Curación de datos, Análisis formal, Administración de proyectos.
Financiación
El/los autor/es declara(n) haber recibido apoyo financiero para la investigación, autoría y/o publicación de este artículo. Este trabajo fue financiado por la Asociación Brasileña de Cannabis Medicinal Alternativa para los gastos de publicación.
Reconocimientos
Nuestro grupo desea expresar nuestro sincero agradecimiento a las asociaciones brasileñas Cannabis Sem Fronteiras, AMA-ME, Alternativa y Santa Cannabis por su entrega oportuna y generosa donación de varios aceites medicinales de cannabis durante todo el tratamiento.
Conflicto de intereses
Los autores declaran que la investigación se llevó a cabo en ausencia de relaciones comerciales o financieras que pudieran interpretarse como un posible conflicto de intereses.
Nota del editor
Todas las afirmaciones expresadas en este artículo son únicamente las de los autores y no representan necesariamente las de sus organizaciones afiliadas, ni las del editor, los editores y los revisores. Cualquier producto que pueda ser evaluado en este artículo, o afirmación que pueda ser hecha por su fabricante, no está garantizado ni respaldado por el editor.
Material complementario
El material complementario para este artículo se puede encontrar en línea en: https://www.frontiersin.org/articles/10.3389/fvets.2024.1309167/full#supplementary-material
Referencias
1. Nastri Gouvêa, F, Santos Pennacchi, C, Vieira Fernandes Ferreira, A, de Almeida, P, y Luna Alves, APP. Lupus eritematoso discoide en perro. Veterinária Notícias. (2022) 28:1–4. doi: 10.14393/VTN-v28n1-2022-62645
2. Olivry, T, Linder, KE y Banovic, F. Lupus eritematoso cutáneo en perros: una revisión exhaustiva. BMC Vet Res. (2018) 14:132. doi: 10.1186/s12917-018-1446-8
Resumen de PubMed | Texto completo de Crossref | Google Académico
3. Kurtdede, A, y Alic Ural, D. Guzel Ondokuz Mayıs Üniversitesi M. Lupus eritematoso cutáneo en un perro. Disponible en: https://www.researchgate.net/publication/287763990
4. Pereira, P, Cristina Barini Nunes, A, Alves, J, Cunha, DO, Acb, N, y Medvep, PJ. Lúpus eritematoso discoide (LED)-Relato de caso em mmm canino SRD Lupus eritematoso discoide-Reporte de caso en un perro SRD. Alergologia Veterinária. (2014) 3:390–3.
5. Banovic, F, Linder, KE, Uri, M, Rossi, MA y Olivry, T. Características clínicas y microscópicas del lupus eritematoso discoide generalizado en perros (10 casos). Veterinario Dermatol. (2016) 27:488–E131. doi: 10.1111/vde.12389
Resumen de PubMed | Texto completo de Crossref | Google Académico
6. Griffin, CE, Stannard, AA, Ihrke, PJ, Ardans, AA, Cello, RM y Bjorling, DR. Lupus eritematoso discoide canino. Veterinario Inmunol Inmunopatíaco. (1979) 1:79–87. doi: 10.1016/0165-2427(79)90009-6
7. Banovic, F, Robson, D, Linek, M y Olivry, T. Eficacia terapéutica de los inhibidores de la calcineurina en el lupus eritematoso cutáneo vesicular canino. Veterinario Dermatol. (2017) 28:493-E115. doi: 10.1111/vde.12448
Resumen de PubMed | Texto completo de Crossref | Google Académico
8. Nagarkatti, P, Pandey, R, Rieder, SA, Hegde, VL y Nagarkatti, M. Cannabinoides como nuevos medicamentos antiinflamatorios. Futuro Med Chem. (2009) 1:1333–49. doi: 10.4155/fmc.09.93
Resumen de PubMed | Texto completo de Crossref | Google Académico
9. Croxford, JL, y Yamamura, T. Cannabinoides y sistema inmune: ¿potencial para el tratamiento de enfermedades inflamatorias? J Neuroinmunol. (2005) 166:3–18. doi: 10.1016/j.jneuroim.2005.04.023
10. Shao, K, Stewart, C, y Grant-Kels, JM. El cannabis y la piel. Clin Dermatol. (2021) 39:784–95. doi: 10.1016/j.clindermatol.2021.05.006
11. Banach, D, y Ferrero, P. Cannabis y patologías en perros y gatos: primera encuesta sobre el uso de fitocannabinoides en medicina veterinaria en Argentina. J Cannabis Res. (2023) 5:39. doi: 10.1186/s42238-023-00209-5
Resumen de PubMed | Texto completo de Crossref | Google Académico
12. Lima, MG, Tardelli, VS, Brietzke, E, y Fidalgo, TM. Cannabis y mediadores inflamatorios. Eur Addict Res. (2021) 27:16–24. doi: 10.1159/000508840
13. Atalay, S, Jarocka-karpowicz, I, y Skrzydlewskas, E. Propiedades antioxidantes y antiinflamatorias del cannabidiol. Antioxidantes. (2020) 9:21. doi: 10.3390/antiox9010021
Resumen de PubMed | Texto completo de Crossref | Google Académico
14. Cital, S, Kramer, K, Hughston, L, y Gaynor, JS eds. Cannabis therapy in veterinary medicine. Cham: Springer International Publishing (2021).
15. Anil, SM, Peeri, H, y Koltai, H. Actividad del cannabis medicinal contra la inflamación: compuestos activos y modos de acción. (2022) 13:908198. doi: 10.3389/fphar.2022.908198
Resumen de PubMed | Texto completo de Crossref | Google Académico
16. Holloman, BL, Nagarkatti, M y Nagarkatti, P. Regulación epigenética de la atenuación de la inflamación mediada por cannabinoides y su impacto en el uso de cannabinoides para tratar enfermedades autoinmunes. Int J Mol Sci. (2021) 22:7302. doi: 10.3390/ijms22147302
Resumen de PubMed | Texto completo de Crossref | Google Académico
17. Khaksar, S, Bigdeli, M, Samiee, A y Shirazi-zand, Z. Efectos antioxidantes y antiapoptóticos del cannabidiol en un modelo de accidente cerebrovascular isquémico en ratas. Cerebro Res Bull. (2022) 180:118–30. doi: 10.1016/j.brainresbull.2022.01.001
Resumen de PubMed | Texto completo de Crossref | Google Académico
18. Henry, RJ, Kerr, DM, Finn, DP, y Roche, M. Para quién afecta el endocannabinoide: modulación de la función inmune innata e implicaciones para los trastornos psiquiátricos. Prog Neuro-Psychopharmacol Biol Psiquiatría. (2016) 64:167–80. doi: 10.1016/j.pnpbp.2015.03.006
Resumen de PubMed | Texto completo de Crossref | Google Académico
19. Ferreira, TC, Pinheiro, ADN, Leite, AKRM, Guedes, RFM, y Pinheiro, DCSN. Patogenia, biomarcadores e inmunoterapia en enfermedades autoinmunes de la piel en perros y gatos. Una revisión. Rev Bras de Saúde e Prod Anim. (2015) 9:299–319. doi: 10.5935/1981-2965.20150030
20. Ataide, W, Silva, V, Ferraz, H, Amaral, A, y Romani, A. lúpus eritematoso discoide em cães. Encicl Biosf. (2019) 16:995–1009. doi: 10.18677/encibio_2019a81
21. Messinger, L, Strauss, T, y Jonas, L (2017). Un estudio cruzado aleatorizado, doble ciego y controlado con placebo que evaluó la monoterapia con ungüento de tacrolimus al 0,03% en el tratamiento del lupus eritematoso discoide en perros. Disponible en: www.symbiosisonline.orgwww.symbiosisonlinepublishing.com
22. Gamble, LJ, Boesch, JM, Frye, CW, Schwark, WS, Mann, S, Wolfe, L, et al. Farmacocinética, seguridad y eficacia clínica del tratamiento con Cannabidiol en perros con artrosis. Front Vet Sci. (2018) 5:165. doi: 10.3389/fvets.2018.00165
Resumen de PubMed | Texto completo de Crossref | Google Académico
23. Brioschi, FA, di Cesare, F, Gioeni, D, Rabbogliatti, V, Ferrari, F, D’Urso, ES, et al. Formulación de aceite de cannabidiol transmucoso oral como parte de un régimen analgésico multimodal: efectos sobre el alivio del dolor y la mejora de la calidad de vida en perros afectados por artrosis espontánea. Animales. (2020) 10:1–14. doi: 10.3390/ani10091505
Resumen de PubMed | Texto completo de Crossref | Google Académico
24. Verrico, CD, Wesson, S, Konduri, V, Hofferek, CJ, Vázquez-Pérez, J, Blair, E, et al. Un estudio aleatorizado, doble ciego y controlado con placebo de cannabidiol diario para el tratamiento del dolor de la osteoartritis canina. Dolor. (2020) 161:2191–202. doi: 10.1097/j.pain.000000000000001896
Resumen de PubMed | Texto completo de Crossref | Google Académico
25. Mejía, S, Duerr, FM, Griffenhagen, G y McGrath, S. Evaluación del efecto del cannabidiol en el dolor asociado a la osteoartritis que ocurre naturalmente: un estudio piloto en perros. J Am Anim Hosp Assoc. (2021) 57:81–90. doi: 10.5326/JAAHA-MS-7119
Resumen de PubMed | Texto completo de Crossref | Google Académico
26. Rieder, SA, Chauhan, A, Singh, U, Nagarkatti, M y Nagarkatti, P. Apoptosis inducida por cannabinoides en células inmunitarias como vía para la inmunosupresión. Inmunobiología. (2010) 215:598–605. doi: 10.1016/j.imbio.2009.04.001
Resumen de PubMed | Texto completo de Crossref | Google Académico
27. Copas, G, Amazonas, E, y Brandon, S. La farmacología de los cannabinoides En: S Cital, K Kramer, L Hughston y JS Gaynor, editores. Cannabis terapia en medicina veterinaria. Cham: Springer International Publishing (2021). 17–59.
28. Robaina Cabrera, CL, Keir-Rudman, S, Horniman, N, Clarkson, N, y Page, C. Los efectos antiinflamatorios del cannabidiol y el cannabigerol solos, y en combinación. Pulm Pharmacol Ther. (2021) 69:102047. doi: 10.1016/j.pupt.2021.102047
Resumen de PubMed | Texto completo de Crossref | Google Académico
29. de Lorimier, L-P, Hazzah, T, Amazonas, E y Cital, S. Cannabinoides en oncología y respuesta inmune En: S Cital, K Kramer, L Hughston y JS Gaynor, editores. Cannabis terapia en medicina veterinaria. Cham: Springer International Publishing (2021). 231–69.
30. Luz-Veiga, M, Azevedo-Silva, J, y Fernandes, JC. Más allá del alivio del dolor: una revisión sobre el potencial del cannabidiol en las terapias médicas. Productos farmacéuticos. (2023) 16:155. doi: 10.3390/ph16020155
Resumen de PubMed | Texto completo de Crossref | Google Académico
31. Alvarenga, IC, Panickar, KS, Hess, H y Mcgrath, S. Validación científica del cannabidiol para el manejo de enfermedades de perros y gatos. Annu Rev Anim Biosci. (2023) 11:227–46. doi: 10.1146/annurev-animal-081122
32. McGrath, S, Bartner, LR, Rao, S, Packer, RA, y Gustafson, DL. Ensayo clínico aleatorizado, ciego, controlado para evaluar el efecto de la administración oral de cannabidiol además del tratamiento antiepiléptico convencional sobre la frecuencia de las convulsiones en perros con epilepsia idiopática intratable. J Am Vet Med Assoc. (2019) 254:1301–8. doi: 10.2460/javma.254.11.1301
Resumen de PubMed | Texto completo de Crossref | Google Académico
33. Potschka, H, Bhatti, SFM, Tipold, A y McGrath, S. Cannabidiol en la epilepsia canina. Veterinario J. (2022) 290:105913. doi: 10.1016/j.tvjl.2022.105913
Resumen de PubMed | Texto completo de Crossref | Google Académico
34. De Risio, L, Stabile, F, São Braz, B, y Garcia, GA. Seguridad y eficacia del extracto de cáñamo rico en cannabidiol-ácido cannabidiólico en el tratamiento de las convulsiones epilépticas refractarias en perros. Disponible en: https://www.epidiolex.com/sites/default/files/pdfs/VV-MED–
35. Corsetti, S, Borruso, S, Malandrucco, L, Spallucci, V, Maragliano, L, Perino, R, et al. Cannabis sativa L. puede reducir el comportamiento agresivo hacia los humanos en perros de refugio. Sci Rep. (2021) 11:2773. doi: 10.1038/s41598-021-82439-2
Resumen de PubMed | Texto completo de Crossref | Google Académico
36. Cunha, RZ, Felisardo, LL, Salamanca, G, Marchioni, GG, Neto, OI y Chiocchetti, R. El uso del cannabidiol como tratamiento novedoso para el comportamiento estereotipado oral (morder la cuna) en un caballo. Vet Anim Sci. (2023) 19:100289. doi: 10.1016/j.vas.2023.100289
Resumen de PubMed | Texto completo de Crossref | Google Académico
37. Gugliandolo, E, Licata, P, Peritore, AF, Siracusa, R, D’amico, R, Cordaro, M, et al. Efecto del cannabidiol (Cbd) sobre la respuesta inflamatoria canina: un estudio ex vivo sobre la sangre total estimulada por lps. Veterinaria Sci. (2021) 8:185. doi: 10.3390/vetsci8090185
Resumen de PubMed | Texto completo de Crossref | Google Académico
38. de Andrade, DF, Gewehr, JLH y de Almeida, EA. Seguridad y eficacia del uso terapéutico de productos a base de cannabis en el tratamiento de perros: una revisión integrativa. Cannabinoide de Cannabis Res. (2022) 7:736–44. doi: 10.1089/can.2021.0172
Resumen de PubMed | Texto completo de Crossref | Google Académico
39. Lima, TDM, Santiago, NR, Alves, ECR, Chaves, DSDA y Visacri, MB. Uso de cannabis en el tratamiento de animales: una revisión sistemática de ensayos clínicos aleatorizados. Anim Health Res Rev. (2022) 23:25–38. doi: 10.1017/S1466252321000189
Resumen de PubMed | Texto completo de Crossref | Google Académico
40. MacCallum, CA, y Russo, EB. Consideraciones prácticas en la administración y dosificación del cannabis medicinal. Eur J Pasante Med. (2018) 49:12–9. doi: 10.1016/j.ejim.2018.01.004
Resumen de PubMed | Texto completo de Crossref | Google Académico
41. Sideris, A, Lauzadis, J, y Kaczocha, M. La ciencia básica de los cannabinoides. Anesth Analg. (2024) 138:42–53. doi: 10.1213/ANE.000000000000006472
Resumen de PubMed | Texto completo de Crossref | Google Académico
42. López-Cardona, AP, Sánchez-Calabuig, MJ, Beltrán-Breña, P, Agirregoitia, N, Rizos, D, Agirregoitia, E, et al. Efecto de los exocannabinoides en la maduración de ovocitos bovinos in vitro a través de la activación de AKT y ERK1/2. Reproducción. (2016) 152:603–12. doi: 10.1530/REP-16-0199
Resumen de PubMed | Texto completo de Crossref | Google Académico
43. Shrivastava, A, Kuzontkoski, PM, Groopman, JE, y Prasad, A. El cannabidiol induce la muerte celular programada en las células de cáncer de mama mediante la coordinación de la diafonía entre la apoptosis y la autofagia. Mol Cáncer Ther. (2011) 10:1161–72. doi: 10.1158/1535-7163.MCT-10-1100
Resumen de PubMed | Texto completo de Crossref | Google Académico
44. Preet, A, Qamri, Z, Nasser, MW, Prasad, A, Shilo, K, Zou, X, et al. Receptores cannabinoides, CB1 y CB2, como nuevas dianas para la inhibición del crecimiento y la metástasis del cáncer de pulmón de células no pequeñas. Cáncer Prev Res. (2011) 4:65–75. doi: 10.1158/1940-6207.CAPR-10-0181
Resumen de PubMed | Texto completo de Crossref | Google Académico
45. Preteroti, M, Wilson, ET, Eidelman, DH, y Baglole, CJ. Modulación de la función inmune pulmonar por productos de cannabis inhalados y consecuencias para la enfermedad pulmonar. Respir Res. (2023) 24:95. doi: 10.1186/s12931-023-02399-1
Resumen de PubMed | Texto completo de Crossref | Google Académico
46. Nagarkatti, P, Miranda, K y Nagarkatti, M. Uso de cannabinoides para tratar el síndrome de dificultad respiratoria aguda y la tormenta de citoquinas asociada con la enfermedad por coronavirus-2019. Frente Pharmacol. (2020) 11:589438. doi: 10.3389/fphar.2020.589438
Resumen de PubMed | Texto completo de Crossref | Google Académico
47. Maayah, ZH, Ferdaoussi, M, Alam, A, Takahara, S, Silver, H, Soni, S, et al. El cannabidiol suprime la tormenta de citoquinas y protege contra las lesiones cardíacas y renales asociadas con la sepsis. Cannabinoide de Cannabis Res. (2022). doi: 10.1089/can.2022.0170
Resumen de PubMed | Texto completo de Crossref | Google Académico
Palabras clave: lupus eritematoso discoide, terapia con cannabinoides, CBD, THC, enfermedad autoinmune, cannabis
Cita: da Silva MES, Christianetti B, Amazonas E y Pereira ML (2024) Caso clínico: Terapia con cannabinoides para el lupus eritematoso discoide en un perro. Frente. Vet. Sci. 11:1309167. doi: 10.3389/fvets.2024.1309167
Recibido: 07 de octubre de 2023; Aceptado: 25 de enero de 2024;
Publicado: 09 Febrero 2024.
Editado por:
Heather Knych, Universidad de California, Davis, Estados Unidos
Revisado por:
Claudia Interlandi, Universidad de Messina, Italia
Stephen White, Universidad de California, Davis, Estados Unidos
Copyright © 2024 da Silva, Christianetti, Amazonas y Pereira. Este es un artículo de acceso abierto distribuido bajo los términos de la Licencia Creative Commons Attribution License (CC BY).
*Correspondencia: Marcy Lancia Pereira, marcy.pereira@ufsc.br
Date de alta y recibe nuestro 👉🏼 Diario Digital AXÓN INFORMAVET ONE HEALTH
Date de alta y recibe nuestro 👉🏼 Boletín Digital de Foro Agro Ganadero
Noticias animales de compañía
Noticias animales de producción
Trabajos técnicos animales de producción
Trabajos técnicos animales de compañía
Renuncia: Todas las afirmaciones expresadas en este artículo son únicamente las de los autores y no representan necesariamente las de sus organizaciones afiliadas, ni las del editor, los editores y los revisores. Cualquier producto que pueda ser evaluado en este artículo o afirmación que pueda hacer su fabricante no está garantizado ni respaldado por el editor.