Cecropina A: investigación de un péptido de defensa del huésped con actividad inmunomoduladora multifacética en un cultivo de células hepáticas de pollo
Cecropina A: investigación de un péptido de defensa del huésped con actividad inmunomoduladora multifacética en un cultivo de células hepáticas de pollo
 Rege Anna Márton1,2*
Rege Anna Márton1,2*  Csilla Sebők1
Csilla Sebők1  Máté Mackei1,2
Máté Mackei1,2  Patrik Tráj1
Patrik Tráj1  Júlia Vörösházi1
Júlia Vörösházi1  Ágnes Kemény3,4
Ágnes Kemény3,4  Zsuzsanna Neogrády1
Zsuzsanna Neogrády1  Gábor Mátis1,2
Gábor Mátis1,2- 1División de Bioquímica, Departamento de Fisiología y Bioquímica, Universidad de Medicina Veterinaria, Budapest, Hungría
- 2Laboratorio Nacional de Enfermedades Infecciosas de los Animales, Resistencia a los Antimicrobianos, Salud Pública Veterinaria y Seguridad de la Cadena Alimentaria, Universidad de Medicina Veterinaria, Budapest, Hungría
- 3Departamento de Farmacología y Farmacoterapia, Facultad de Medicina, Universidad de Pécs, Pécs, Hungría
- 4Departamento de Biología Médica, Facultad de Medicina, Universidad de Pécs, Pécs, Hungría
Introducción: Los péptidos de defensa del huésped (HDP) se conocen cada vez más como candidatos prometedores para la reducción del uso de antibióticos convencionales, combatiendo así la resistencia a los antibióticos. Dado que se ha descrito que las HDP ejercen diversos efectos inmunomoduladores, la cecropina A (CecA) parece ser un potente agente que influye en la respuesta inflamatoria del huésped.
Métodos: En el presente estudio, se utilizó un cocultivo primario de hepatocitos y células no parenquimatosas de pollo para investigar los supuestos efectos inmunomoduladores de CecA sola y en condiciones inflamatorias evocadas por ácido poliinosínico-policitidílico (Poly I:C). Para examinar la viabilidad de las células, se determinó la actividad extracelular de la lactato deshidrogenasa (LDH) mediante ensayo colorimétrico. Los marcadores inflamatorios interleucina (IL)-8 y factor de crecimiento transformante-ß1 (TGF-ß1) se investigaron mediante el método ELISA, mientras que las concentraciones de IL-6, IL-10 e interferón-γ (IFN-γ) se analizaron mediante la tecnología Luminex xMAP. H extracelular2O2 y los niveles de malondialdehído se midieron por métodos fluorométricos y colorimétricos, respectivamente.
Resultados: Los resultados de las concentraciones más bajas sugirieron la aplicación segura de CecA; sin embargo, podría contribuir al daño de la membrana celular hepática en sus concentraciones más altas. También encontramos que el péptido alivió la respuesta inflamatoria, reflejada en la disminución de la producción de IL-6, IL-8 e IFN-γ proinflamatorios. Además, CecA disminuyó los niveles de IL-10 y TGF-ß1 antiinflamatorios. Los marcadores oxidativos medidos permanecieron inalterados en la mayoría de los casos de exposición a CecA.
Discusión: La CecA mostró una actividad inmunomoduladora multifacética, pero no puramente antiinflamatoria, en las células hepáticas, y podría sugerirse que mantiene la homeostasis inflamatoria hepática en la respuesta inmunitaria desencadenada por Poly I:C. En conclusión, nuestro estudio sugiere que CecA podría ser una molécula prometedora para el desarrollo de nuevos agentes inmunomoduladores sustitutivos de antibióticos en medicina avícola; Sin embargo, aún queda mucho por aclarar respecto a sus efectos celulares.
1 Introducción
El uso indiscriminado de antibióticos convencionales, tanto en medicina humana como veterinaria, ha contribuido a la propagación mundial de la resistencia a los antibióticos y, según las predicciones de la Organización Mundial de la Salud (OMS), podría cobrarse más de 10 millones de vidas humanas para 2050 (1). Por lo tanto, existe una demanda urgente de buscar alternativas que puedan proporcionar un nuevo modo de acción antimicrobiano (1, 2). Encontrar un posible sustituto también es crucial para la ganadería, donde los animales están muy expuestos a los patógenos, mientras que la eficiencia de la producción, así como la salud y el bienestar de los animales, deben mantenerse (2). Además, la resistencia a los antibióticos también puede suponer un grave riesgo para los cuidadores de animales de granja y los consumidores de productos de origen animal, lo que contribuye aún más a la necesidad de desarrollar nuevas sustancias antimicrobianas (3). En este campo, los péptidos de defensa del huésped (HDP), originalmente conocidos como péptidos antimicrobianos (AMP), han despertado recientemente un gran interés y parecen ser candidatos prometedores para el diseño de nuevos agentes antimicrobianos (1).
Los HDP son generalmente pequeños péptidos catiónicos que constan de 10 a 50 aminoácidos y son producidos por todos los organismos vivos como parte esencial de su sistema inmunológico innato, lo que ayuda al huésped a superar las infecciones originadas por varios patógenos (1, 4). Los estudios iniciales tuvieron como objetivo descubrir las características estructurales y fisiológicas comunes necesarias para su actividad microbicida directa (5). Sobre la base de estos hallazgos, ahora está bien documentado que los HDP muestran efectos antimicrobianos de amplio espectro, incluso contra bacterias, virus, hongos o protozoos multirresistentes (4). Sin embargo, además de poseer la capacidad de atacar directamente a los microbios, recientemente ha atraído más atención que los HDP son capaces de influir en la respuesta inmune del huésped, ofreciendo así mecanismos alternativos para combatir las infecciones (1, 5). Esto puede lograrse de diversas maneras, como la regulación de la producción de diversas citoquinas, la estimulación de la quimiotaxis, el apoyo a la diferenciación de las células inmunitarias, la promoción de la cicatrización de heridas, el efecto antiendotoxina, la inhibición de los receptores tipo Toll (TLR) o la configuración de la microbiota normal del intestino (6-8). Este impacto indirecto y la capacidad de actuar sobre múltiples dianas puede considerarse una de sus mayores ventajas frente a los antibióticos convencionales (1), y se puede sugerir que, en lugar de actuar directamente, su función principal es servir como importantes moléculas de señalización que afectan a las actividades celulares (8).
Debido a la presencia generalizada, los HDP de origen insecto representan uno de los grupos más grandes, entre los cuales las cecropinas son péptidos ampliamente estudiados (1, 2, 9). Además de haber demostrado ya una característica antimicrobiana de amplio espectro, especialmente contra bacterias gramnegativas (9), se ha descrito que varias cecropinas y HDP similares a la cecropina tienen efectos beneficiosos sobre el huésped, como actividad inmunomoduladora (10-13), antioxidante (14-17) o antitumoral (9), y mejora de la integridad y morfología del epitelio intestinal (2, 15, 18). Además, algunos de ellos pueden actuar incluso como promotores del crecimiento en animales de granja de diversas maneras (2, 19, 20). Se ha informado que algunos de estos resultados ventajosos también se refieren a la cecropina A (CecA) (21-24), un HDP de insecto natural que contiene 37 aminoácidos de la familia de las cecropinas (23). Actuando principalmente como agente antiinflamatorio, CecA fue capaz de mejorar la supervivencia después de la peritonitis inducida por Escherichia coli en ratones, disminuyendo las concentraciones de endotoxinas y factor de necrosis tumoral α (TNFα) en la sangre (25). Además, podría aliviar la inflamación en la enfermedad inflamatoria intestinal (EII) inducida experimentalmente en ratones al dificultar la producción de TNFα proinflamatorio, interleucina-1ß (IL-1ß) e IL-6 (21). Los estudios in vitro en diferentes líneas celulares demostraron que el efecto antiinflamatorio de CecA se exhibió por la inhibición de proteínas reguladoras clave de la inflamación, como la ciclooxigenasa-2 (COX-2) y las proteínas quinasas activadas por mitógenos (MAPK), que contribuyeron a la reducción de la producción de varias citoquinas proinflamatorias (22, 23).
A pesar de ser una molécula exhaustivamente investigada y prometedora, solo se dispone de unos pocos estudios sobre los efectos de la CecA a nivel celular y, hasta la fecha, ninguno de ellos se ha llevado a cabo en el hígado. Sin embargo, el hígado desempeña un papel clave en el mantenimiento de la homeostasis local y sistémica mediante la regulación de los procesos inflamatorios. El hígado sano está constantemente expuesto a metabolitos y componentes microbianos derivados del intestino que deben tolerarse y, al mismo tiempo, estar preparado para reaccionar cuando sea necesario. Esta exposición regular a los compuestos microbianos, junto con un microambiente en continuo cambio, da como resultado un estado inmunológico estrictamente controlado (26). Las células inmunitarias residentes, por ejemplo, las células de Kupffer, los macrófagos derivados de monocitos, las células mieloides o las células linfoides, son de gran importancia en la regulación de estos procesos inflamatorios, mediante la detección de patrones moleculares asociados a patógenos (PAMP) o patrones moleculares asociados al daño (DAMP), la interacción con otras células locales o la producción de citoquinas y quimiocinas inflamatorias (26, 27). Aparte de ellas, las células no hematopoyéticas, como los hepatocitos o las células estrelladas hepáticas (CMH), también tienen una gran importancia durante los procesos inflamatorios, ya que sus superficies son ricas en receptores de reconocimiento de patrones (PRR), y también pueden producir mediadores inflamatorios (26, 28).
Como órgano central de la desintoxicación y el metabolismo, el hígado es altamente vulnerable no solo a la inflamación, sino también al estrés oxidativo causado por los radicales libres, como las especies reactivas de oxígeno (ROS) y las especies reactivas de nitrógeno (RNS). Aparte de esto, cada vez más evidencia sugiere que la inflamación y el desequilibrio redox a menudo juegan un papel crucial en el daño hepático como procesos de interacción complejos y estrechamente regulados (29). No solo la respuesta inflamatoria, sino también la formación de radicales libres es un mecanismo importante contra los patógenos. Sin embargo, su deliberación excesiva podría tener un impacto perjudicial en la homeostasis hepática y los resultados adversos para las aves de corral, causando inmunosupresión, trastornos intestinales y deterioro de la producción. Por lo tanto, es relevante investigar no solo el estado inflamatorio sino también el oxidativo (30).
Dada la prevalencia de la resistencia a los antibióticos, la demanda urgente de buscar nuevos agentes antimicrobianos en la avicultura y la acción inmunomoduladora versátil de los HDP, la investigación del impacto de sus representantes a nivel celular es de gran importancia. Dado que se dispone de datos limitados sobre el papel inmunomodulador de la CecA en animales domésticos, y ninguno de ellos investigó los efectos en las células avícolas o hepáticas, el objetivo del presente estudio fue examinar la influencia del péptido en la respuesta inmune y la homeostasis redox, utilizando un cocultivo primario de hepatocitos y células no parenquimatosas de origen pollo. Dado que los TLR, al igual que los PRR, desempeñan un papel crucial en el reconocimiento de patógenos e inducen la señalización posterior que conduce a la inflamación (5), se utilizó el análogo sintético de ARN bicatenario (dsRNA) ácido poliinosínico-policitidílico (Poly I:C), como agonista de TLR3, para evocar la inflamación, que fue aplicado previamente con éxito por nuestro grupo de investigación para este fin (31-33).
2 Materiales y métodos
2.1 Proceso de aislamiento celular
Se utilizó un pollo de engorde macho Ross-308 de 3 semanas de edad para el aislamiento celular. El pollo se mantuvo en el animalario del Departamento de Fisiología y Bioquímica de la Universidad de Medicina Veterinaria de Budapest, Hungría. El animal fue alimentado de acuerdo con las instrucciones del criador y se le proporcionó agua ad libitum. Se hicieron todos los esfuerzos para mantener las circunstancias para el bienestar animal, y nuestros experimentos se ajustaron a las leyes de la Unión Europea, aprobadas por el Comité Local de Bienestar Animal y habilitadas por la Oficina del Gobierno (número de permiso: GK-419/2020; fecha de aprobación: 11 de mayo de 2020). A menos que se indique lo contrario, todos los productos químicos y compuestos descritos se compraron a Merck KGaA (Darmstadt, Alemania).
El proceso de aislamiento celular se realizó de acuerdo con Mackei et al., (34). El exterminio del animal se llevó a cabo por decapitación, utilizando narcosis de dióxido de carbono. Después de la extracción de las plumas abdominales y la desinfección de la piel, se abrió la cavidad corporal y se canuló el sistema portal a través de la vena duodenal gastropancreatico, utilizando una cánula venosa de 22 tamaños. A continuación, se perfundió el hígado mediante un sistema de perfusión de tres pasos a un caudal de 30 ml/min. Todas las soluciones se precalentaron a 40 °C y se oxigenaron con carbógeno (composición: 95% O2, 5% CO2; caudal 1 L/min) inmediatamente antes de su uso. Para empezar, la perfusión se realizó utilizando 150 mL de tampón de solución salina equilibrada (HBSS) de Hanks, que contenía etilenglicol-bis(2-aminoethil éter)-N,N,N′,N′-ácido tetraacético (EGTA), seguido de la aplicación de 150 mL de tampón HBSS libre de EGTA. Como último paso de perfusión, el hígado se lavó con 100 ml de solución de HBSS suplementada con 100 mg de colagenasa tipo IV, 7 mM de CaCl2, y 7 mM de MgCl2. Después de la extracción del órgano y de la cápsula de Glisson, las células se suspendieron en 50 mL de tampón HBSS suplementado con albúmina sérica bovina (BSA, 2,5%) para evitar la agregación de las células. La suspensión celular resultante se filtró a través de una lámina de gasa estéril de tres capas y luego se dejó reposar sobre hielo durante 45 minutos. En el siguiente paso, la suspensión celular se centrifugó (3 min, 100 × g) tres veces, durante las cuales se recolectó el sobrenadante resultante por separado y el sedimento se resuspendió en el medio E de Williams (suplementado con NaHCO al 0,22%3, 50 mg/mL de gentamicina, 2 mM de glutamina, 4 g/L de dexametasona, 20 UI/L de insulina, 5% de suero fetal bovino [FBS] y 0,5 g/mL de anfotericina B). Después de la centrifugación por tercera vez, el sedimento se resuspendió nuevamente para obtener una suspensión celular rica en hepatocitos. Por otro lado, los sobrenadantes no parenquimatosos que contenían previamente recolectados se mezclaron y centrifugaron (10 min, 350 × g). Finalmente, el sobrenadante restante se centrifugó (10 min, 800 × g) y el gránulo se resuspendió en Williams Medium E, obteniendo así la fracción rica en células no parenquimatosas. Los hepatocitos y macrófagos en las suspensiones primera y posterior fueron previamente caracterizados por tinción inmunofluorescente y citometría de flujo por Mackei et al., (34). En este experimento anterior de nuestro grupo de investigación, los hepatocitos aislados y cultivados se marcaron utilizando antialbúmina acoplada a isotiocianato de fluoresceína (FITC) específico de pollo, mientras que los macrófagos de la fracción rica en células no parenquimatosas se detectaron mediante anticuerpos conjugados con ficoeritrina (PE) específicos de macrófagos de pollo. El proceso estandarizado de aislamiento celular se realizó de la misma manera en el presente estudio, asegurando que los mismos tipos de células estuvieran presentes en las fracciones correspondientes. Una vez obtenidas las suspensiones celulares, se realizó la tinción de Giemsa para comprobar la morfología de las células aisladas y la de los cultivos celulares confluentes, confirmando sus características.
Para evaluar la viabilidad de las células en ambas fracciones, se realizó una prueba de exclusión de azul de tripano en las cámaras de Bürker antes de la siembra. Antes de la siembra, las dos fracciones se diluyeron de acuerdo con el recuento de células, y la suspensión que contenía hepatocitos se mezcló con la fracción rica en células no parenquimatosas en una proporción de 6 a 1, recibiendo una concentración total de 106 células/mL. Con un volumen de 400 μL de suspensión/pocillo celular, las células se sembraron en placas de cultivo de 24 pocillos (Greiner Bio-One Hungary Kft., Mosonmagyaróvár, Hungría) previamente recubiertas con colágeno de cola de rata tipo I. El recubrimiento de las placas comenzó con la disolución completa de 10 mg de colágeno en 100 mL de solución de ácido acético al 0,1%. Posteriormente, las placas de cultivo de 24 pocillos se recubrieron con 300 μL/pocillo (refiriéndose a 10 μg/cm2), seguido de la incubación nocturna a temperatura ambiente y la exposición a la luz ultravioleta para evitar la contaminación hasta el secado completo. El primer cambio del medio de cultivo celular se realizó después de 4 h de incubación a 37°C y 5% de CO2, que fue seguido por los tratamientos después de 24 h de incubación en las mismas condiciones.
2.2 Tratamientos
El tratamiento de las células se realizó mediante el uso de los medios de cultivo celular suplementados descritos anteriormente, pero sin el uso de FBS, de acuerdo con la Tabla 1. El control se creó añadiendo solo medios de cultivo celular a las células. Para evocar la inflamación, se añadió Poly I:C a una concentración de 50 μg/mL. Los efectos de CecA se examinaron únicamente y en la inflamación inducida por Poly I:C, respectivamente, a cinco concentraciones diferentes de 1, 3,125, 6,25, 12,5 y 25 μg/mL. Al administrar tratamientos combinados de Poly I:C y CecA, las dos sustancias se aplicaron a la vez. Después de 24 h de tratamiento, se tomaron muestras de medios de cultivo celular de microplacas de 24 pocillos y se centrifugaron (5 min, 4.000 × g), y las alícuotas se congelaron a -80 °C hasta las mediciones mencionadas a continuación.
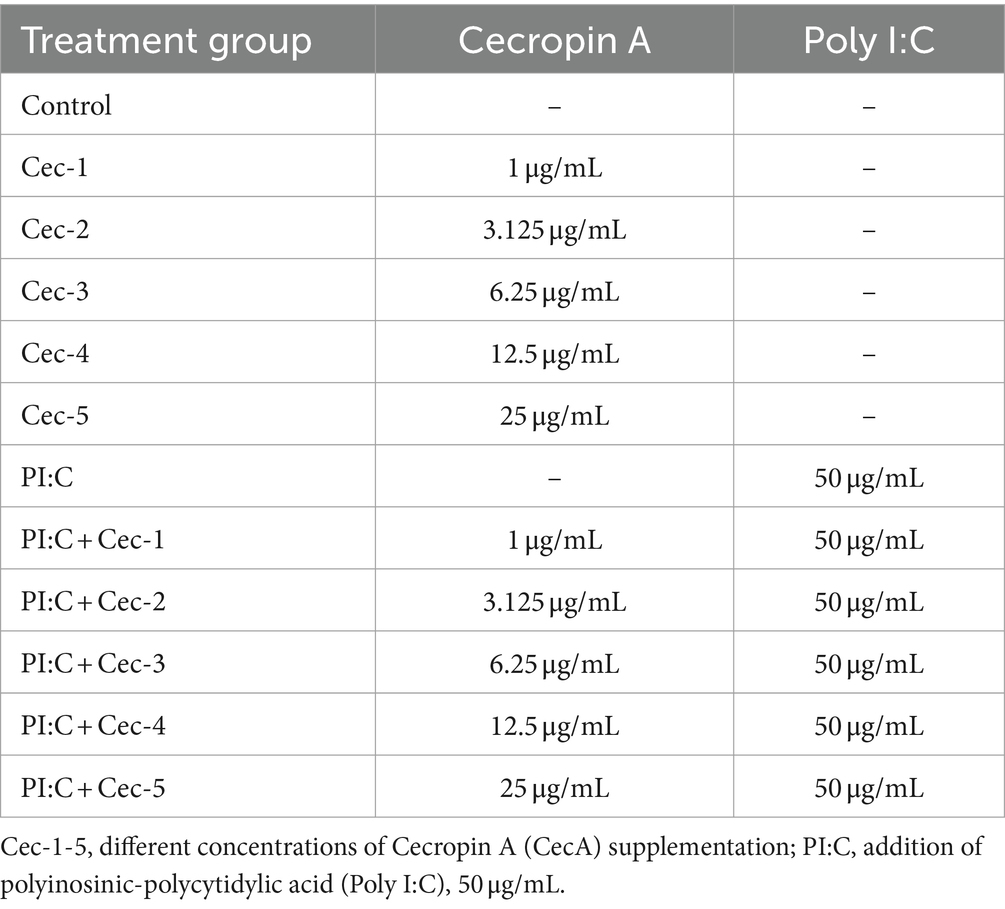 Tabla 1. Grupos de tratamiento aplicados en cocultivo primario de hepatocitos de pollo y células no parenquimatosas.
Tabla 1. Grupos de tratamiento aplicados en cocultivo primario de hepatocitos de pollo y células no parenquimatosas.
2.3 Medidas
2.3.1 Viabilidad celular
Con el fin de investigar la viabilidad de las células, se examinó la integridad de la membrana celular. Para lograr esto, se aplicó el kit de ensayo de actividad de lactato deshidrogenasa (Cat. Nr. MAK066-1KT) para detectar la lactato deshidrogenasa (LDH) liberada en el medio de cultivo desde células dañadas. La enzima reduce el NAD a NADH, que puede detectarse específicamente mediante un ensayo colorimétrico a 450 nm. Se cargó una microplaca de 96 pocillos con 50 μL de muestras de medios de cultivo diluidas con tampón de ensayo LDH y luego se complementó con 50 μL de mezcla de reacción maestra recién preparada. La primera lectura de la absorbancia se realizó después de 2 min de incubación a 37 °C, utilizando un lector Multiscan GO 3.2 (Thermo Fisher Scientific Inc., Waltham, MA, Estados Unidos) a 450 nm. Las mediciones continuaron cada 5 min hasta que el valor de la muestra más activa fue mayor que el valor del estándar más alto.++
2.3.2 Marcadores inflamatorios
Sobre la base de nuestros resultados con respecto a la viabilidad celular, los marcadores inflamatorios y redox continuaron siendo examinados solo en grupos de tratamiento que contenían CecA a concentraciones de 1, 3,125 y 6,25 μg/mL, respectivamente. La IL-8 (a menudo denominada CXCLi2 en pollo) y el factor de crecimiento transformante-ß1 (TGF-ß1) se midieron en los medios de cultivo mediante kits de ELISA específicos para pollos (MyBioSource Inc., San Diego, CA, Estados Unidos, Cat. Nr. MBS289628 y MBS261515, respectivamente), utilizando una técnica de sándwich para el primero y una técnica de sándwich de doble anticuerpo para el segundo. Los pasos se llevaron a cabo de acuerdo con las instrucciones del fabricante y los valores de absorbancia fueron leídos por un lector Multiscan GO 3.2 a 450 nm.
Los niveles de IL-6, IL-10 e interferón-γ (IFN-γ) se analizaron mediante la tecnología Luminex xMAP, utilizando el panel de citoquinas/quimiocinas de pollo Milliplex (Merck KGaA Cat. Nr.: GCYT1-16 K). De acuerdo con las instrucciones del fabricante, se cargó una microplaca de 96 pocillos adherida al kit con 25 μL de muestra/pocillo de medio de cultivo celular, utilizando duplicados. A partir de entonces, se añadieron 25 μL de tres juegos de perlas recubiertas de anticuerpos de captura de color a cada pocillo. Después de la incubación y el lavado durante la noche, se añadieron a la placa anticuerpos de detección biotinilados y ficoeritrina estreptavidina. Como siguiente paso, se añadieron 150 mL de líquido de accionamiento, seguido de la resuspensión de las perlas durante 5 min en un agitador de placas. La lectura se realizó con el instrumento Luminex MAGPIX y los datos se recogieron mediante el programa Luminex xPonent 4.2. De acuerdo con la mediana de la intensidad de fluorescencia de las perlas, las curvas estándar se generaron mediante el software Belysa Immunoassay Curve Fitting (Merck KGaA, Darmstadt, Alemania) para todos los analitos.®
2.3.3 Marcadores redox
Se midió el nivel de peróxido de hidrógeno extracelular (CE) en el medio de cultivo, utilizando el método fluorométrico Amplex Red (Thermo Fisher Scientific, Waltham, MA, Estados Unidos, Cat. Nr. A21188), de acuerdo con el protocolo proporcionado por el fabricante. Se cargó una microplaca de 96 pocillos con 50 μL de muestras de medios de cultivo, seguida de la adición de 50 μL de solución Amplex Red Working preparada antes de su uso. Después de 30 min de incubación a temperatura ambiente, los valores de fluorescencia se obtuvieron con un fluorímetro Victor X2 2030 (Perkin Elmer Inc., Waltham, MA, Estados Unidos), a longitudes de onda de 530 nm (excitación) y 590 nm (emisión).
Para determinar el grado de peroxidación lipídica, se midió la concentración de malondialdehído (MDA) de los medios de cultivo celular con el kit de ensayo de peroxidación lipídica (MDA) (Cat. Nr. MAK085-1KT). De acuerdo con el protocolo adjunto por el fabricante, se mezclaron 150 μL de solución de ácido tiobarbitúrico (TBA) y 50 μL de cada muestra y se incubaron durante 1 h a 95 °C, lo que permitió la formación de un complejo MDA-TBA. Después de enfriar a temperatura ambiente, se cargó una microplaca de 96 pocillos con 200 μL de la mezcla. Los valores de absorbancia se midieron a 532 nm, utilizando un lector Multiscan GO 3.2.
2.4 Análisis estadístico
El análisis estadístico de los datos se llevó a cabo utilizando R v. 4.0.3 (R Core Team, 2020). Se realizó la prueba de rangos con signo de Wilcoxon para las comparaciones por pares, dado que las pruebas de Shapiro-Wilk indicaron que los datos de varios grupos de tratamiento tenían distribuciones no normales. Si el valor p calculado era inferior a 0,05, la diferencia se consideraba significativa. Se compararon los grupos de tratamiento que contenían diferentes concentraciones de CecA aplicado únicamente y el control inflamatorio en el que se utilizó Poly I:C solo con el grupo control. Cuando se administró CecA junto con Poly I:C, los resultados se cotejaron con el Control y también con el grupo tratado solo con Poly I:C. Los gráficos se crearon utilizando Prism 9 (GraphPad Software Inc., San Diego, CA, V 9.2.1).
3 Resultados
3.1 Viabilidad celular
Para evaluar el daño a la membrana celular, se determinó la actividad de la LDH de la CE. Las células tratadas solo con CecA mostraron un aumento significativo de la actividad enzimática en las dos concentraciones más altas (12,5 y 25 μg/mL) del péptido (p = 0,0159 y p = 0,0381, respectivamente), mientras que las concentraciones de 1, 3,125 y 6,25 μg/mL no parecieron afectar la integridad de la membrana celular. Poly I:C ejerció un aumento significativo en la actividad de LDH en comparación con el grupo control (p = 0,0095), que no se vio afectado por ninguna de las concentraciones aplicadas de CecA. Sin embargo, se observaron valores significativamente más altos al combinar Poly I:C y cada concentración del péptido (p = 0,0095 para las cinco comparaciones), en comparación con el grupo control (Figura 1).
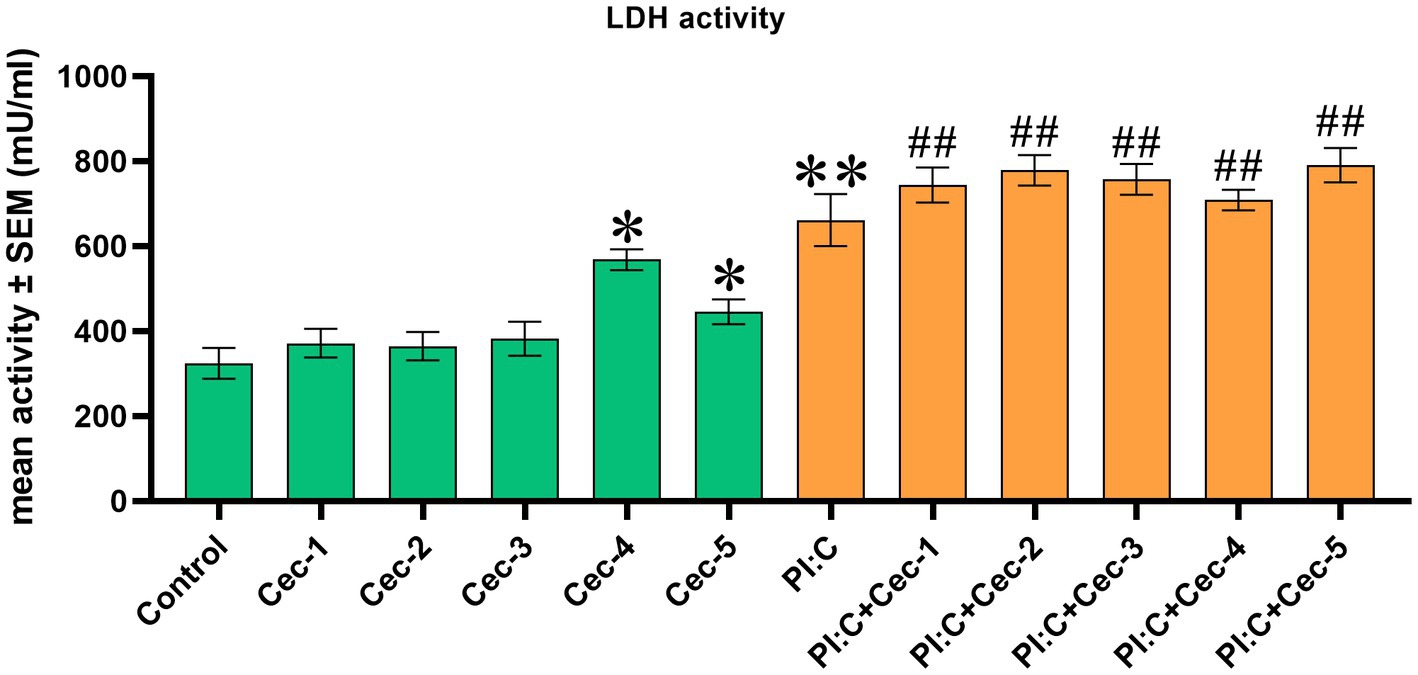 Figura 1. Gráfico de barras que muestra la actividad de la lactato deshidrogenasa (LDH) extracelular medida mediante ensayo colorimétrico. Los cocultivos de células hepatocito-no parenquimatosas de pollo se trataron con cinco concentraciones diferentes de cecropina A (CecA) sola y en combinación con ácido poliinosínico-policitidílico (Poly I:C). El color verde se refiere a los grupos de tratamiento sin la adición de Poly I:C, mientras que el color naranja se refiere al tratamiento con Poly I:C. Las columnas representan las medias ± SEM (n = 6/grupo de tratamiento). Cec-1 = 1 μg/mL de CecA, Cec-2 = 3,125 μg/mL de CecA, Cec-3 = 6,25 μg/mL de CecA, Cec-4 = 12,5 μg/mL de CecA, Cec-5 = 25 μg/mL de CecA, PI:C = 50 μg/mL de Poly I:C. Las células que no reciben ninguno de los tratamientos se consideran control. Los asteriscos indican diferencias significativas cuando se compararon los grupos de tratamiento Cec-1, Cec-2, Cec-3, Cec-4, Cec-5 y PI:C con el control, mientras que las combinaciones de Poly I:C y CecA (PI:C + Cec-1, PI:C + Cec-2, PI:C + Cec-3, PI:C + Cec-4, PI:C + Cec-5) se compararon con el grupo PI:C. Los hashtags indican diferencias significativas cuando se comparan combinaciones de Poly I: C y CecA a controlar. *p < 0,05, **p < 0,01 y p < 0,01.##
Figura 1. Gráfico de barras que muestra la actividad de la lactato deshidrogenasa (LDH) extracelular medida mediante ensayo colorimétrico. Los cocultivos de células hepatocito-no parenquimatosas de pollo se trataron con cinco concentraciones diferentes de cecropina A (CecA) sola y en combinación con ácido poliinosínico-policitidílico (Poly I:C). El color verde se refiere a los grupos de tratamiento sin la adición de Poly I:C, mientras que el color naranja se refiere al tratamiento con Poly I:C. Las columnas representan las medias ± SEM (n = 6/grupo de tratamiento). Cec-1 = 1 μg/mL de CecA, Cec-2 = 3,125 μg/mL de CecA, Cec-3 = 6,25 μg/mL de CecA, Cec-4 = 12,5 μg/mL de CecA, Cec-5 = 25 μg/mL de CecA, PI:C = 50 μg/mL de Poly I:C. Las células que no reciben ninguno de los tratamientos se consideran control. Los asteriscos indican diferencias significativas cuando se compararon los grupos de tratamiento Cec-1, Cec-2, Cec-3, Cec-4, Cec-5 y PI:C con el control, mientras que las combinaciones de Poly I:C y CecA (PI:C + Cec-1, PI:C + Cec-2, PI:C + Cec-3, PI:C + Cec-4, PI:C + Cec-5) se compararon con el grupo PI:C. Los hashtags indican diferencias significativas cuando se comparan combinaciones de Poly I: C y CecA a controlar. *p < 0,05, **p < 0,01 y p < 0,01.##
3.2 Marcadores inflamatorios
Con el fin de investigar el impacto de CecA en la respuesta inmune, se determinaron los niveles de IL-6, IL-8, IFN-γ, IL-10 y TGF-ß1. Al medir la IL-6, la CecA sola a 1 μg/mL fue capaz de disminuir el nivel de citocina (p = 0,0381). En comparación con la inflamación provocada por Poly I:C, las concentraciones de 1, 3,125 y 6,25 μg/mL de CecA atenuaron la producción de IL-6 (p = 0,0022, p = 0,0411 y p = 0,0152, respectivamente) (Figura 2A).
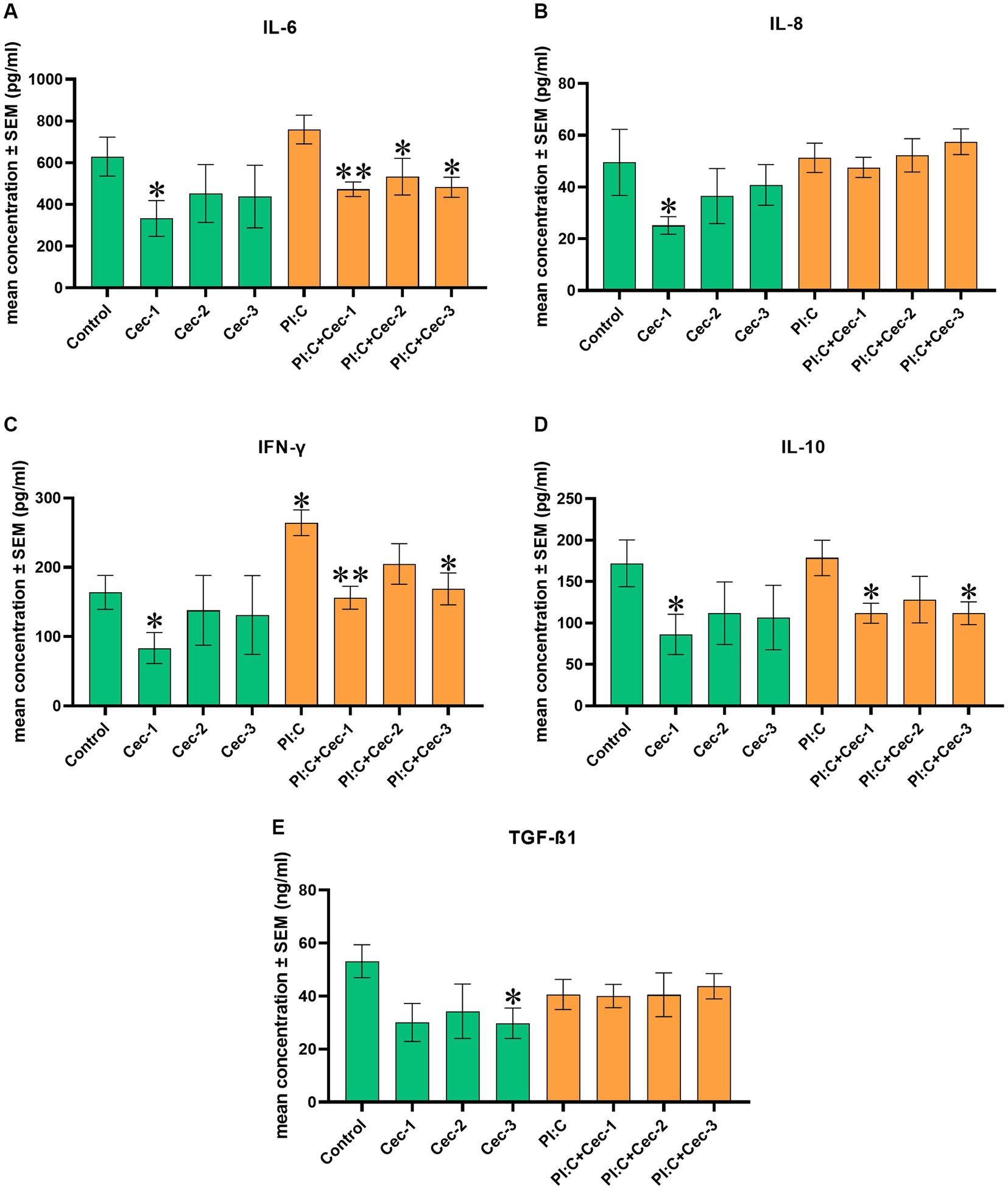 Figura 2. Gráficos de barras que muestran (A) la concentración de IL-6 medida por el panel Luminex MAGPIX específico para pollos. (B) Concentración de IL-8 medida por ELISA específico para pollos. (C) Concentración de IFN-γ medida por el panel Luminex MAGPIX específico para pollos. (D) Concentración de IL-10 medida por el panel Luminex MAGPIX específico para pollos. E) Concentración de TGF-ß1 medida mediante ELISA específico para pollos. Los cocultivos de células no parenquimatosas de hepatocitos de pollo se trataron con tres concentraciones diferentes de cecropina A (CecA) sola y en combinación con ácido poliinosínico-policitidílico (Poly I:C). El color verde se refiere a los grupos de tratamiento sin la adición de Poly I:C, mientras que el color naranja se refiere al tratamiento con Poly I:C. Las columnas representan las medias ± SEM (n = 6/grupo de tratamiento). Cec-1 = 1 μg/mL CecA, Cec-2 = 3,125 μg/mL CecA, Cec-3 = 6,25 μg/mL CecA, PI:C = 50 μg/mL Poly I:C. Las células que no reciben ninguno de los tratamientos se consideran control. Los asteriscos indican diferencias significativas entre los grupos de tratamiento. Los grupos Cec-1, Cec-2, Cec-3 y PI:C se compararon con Control, mientras que las combinaciones de Poly I:C y CecA (PI:C + Cec-1, PI:C + Cec-2, PI:C + Cec-3) se compararon con el grupo PI:C. *p < 0,05 y **p < 0,01.
Figura 2. Gráficos de barras que muestran (A) la concentración de IL-6 medida por el panel Luminex MAGPIX específico para pollos. (B) Concentración de IL-8 medida por ELISA específico para pollos. (C) Concentración de IFN-γ medida por el panel Luminex MAGPIX específico para pollos. (D) Concentración de IL-10 medida por el panel Luminex MAGPIX específico para pollos. E) Concentración de TGF-ß1 medida mediante ELISA específico para pollos. Los cocultivos de células no parenquimatosas de hepatocitos de pollo se trataron con tres concentraciones diferentes de cecropina A (CecA) sola y en combinación con ácido poliinosínico-policitidílico (Poly I:C). El color verde se refiere a los grupos de tratamiento sin la adición de Poly I:C, mientras que el color naranja se refiere al tratamiento con Poly I:C. Las columnas representan las medias ± SEM (n = 6/grupo de tratamiento). Cec-1 = 1 μg/mL CecA, Cec-2 = 3,125 μg/mL CecA, Cec-3 = 6,25 μg/mL CecA, PI:C = 50 μg/mL Poly I:C. Las células que no reciben ninguno de los tratamientos se consideran control. Los asteriscos indican diferencias significativas entre los grupos de tratamiento. Los grupos Cec-1, Cec-2, Cec-3 y PI:C se compararon con Control, mientras que las combinaciones de Poly I:C y CecA (PI:C + Cec-1, PI:C + Cec-2, PI:C + Cec-3) se compararon con el grupo PI:C. *p < 0,05 y **p < 0,01.
En el caso de la IL-8, la aplicación exclusiva de CecA en 1 μg/mL contribuyó a una disminución significativa (p = 0,0381), mientras que a concentraciones de 3,125 y 6,25 μg/mL, no se observaron cambios significativos. Ni el Poli I:C solo ni los tratamientos combinados de Poli I:C y las diferentes concentraciones de CecA afectaron a la cantidad de IL-8 (Figura 2B).
En cuanto al IFN-γ, la sola administración de CecA a 1 μg/mL disminuyó el nivel de la citocina (p = 0,0381). Por el contrario, el Poli I:C elevó significativamente el nivel de IFN-γ (p = 0,0191), que fue atenuado por CecA a 1 y 6,25 μg/mL (p = 0,0022 y p = 0,0152, respectivamente) (Figura 2C).
Se encontró que el nivel de IL-10 disminuyó solo con la dosis más baja (1 μg/mL) de CecA aplicado únicamente (p = 0,0381). Las combinaciones de Poly I:C y 1 μg/mL, así como las concentraciones de 6,25 μg/mL de CecA también contribuyeron a una reducción significativa de la cantidad de citocinas (p = 0,0260 y p = 0,0411, respectivamente) (Figura 2D).
Además, al medir el TGF-ß1, la aplicación exclusiva de CecA en 6,25 μg/mL contribuyó a una disminución significativa de su nivel (p = 0,0416), mientras que a concentraciones de 1 y 3,125 μg/mL, no se observaron cambios significativos. Ni el Poli I:C solo ni los tratamientos combinados de Poli I:C y las diferentes concentraciones de CecA afectaron a la cantidad de TGF-ß1 (Figura 2E).
3.3 Marcadores redox
Para el examen del efecto de la CecA sobre la homeostasis redox, el nivel de EC H2O2 y se midió la concentración de MDA que indica peroxidación lipídica. En el caso de la H2O2 Se observó que la dosis más baja administrada de CecA (1 μg/mL) aumentaba la cantidad del marcador oxidativo (p = 0,0381), mientras que las otras concentraciones aplicadas del péptido no parecían afectarla. Al evocar la inflamación, Poly I:C por sí solo aumentó significativamente el nivel de H2O2 ( p = 0,0381), cuya elevación se vio reforzada por la CecA a una concentración de 6,25 μg/mL (p = 0,0087); sin embargo, no se observaron cambios significativos en los grupos de tratamiento con concentraciones de 1 o 3,125 μg/mL de HDP. Además, se observaron valores significativamente más altos al combinar Poly I:C y cada concentración del péptido (p = 0,0095 para las tres comparaciones), en comparación con el grupo control (Figura 3A).
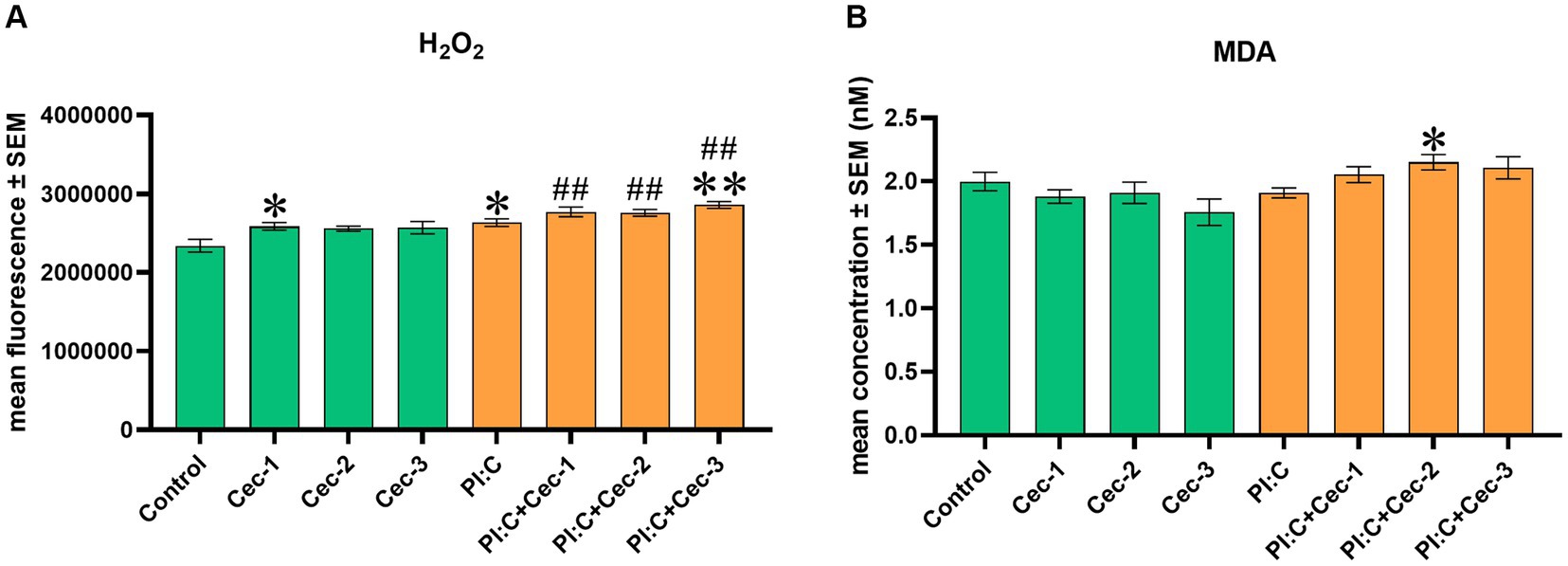 Figura 3. Gráfico de barras que muestra (A) EC H2O2 Concentración medida mediante ensayo fluorométrico. (B) Concentración de MDA medida por ensayo colorimétrico. Los cocultivos de células no parenquimatosas de hepatocitos de pollo se trataron con tres concentraciones diferentes de cecropina A (CecA) sola y en combinación con ácido poliinosínico-policitidílico (Poly I:C). El color verde se refiere a los grupos de tratamiento sin la adición de Poly I:C, mientras que el color naranja se refiere al tratamiento con Poly I:C. Las columnas representan las medias ± SEM (n = 6/grupo de tratamiento). Cec-1 = 1 μg/mL CecA, Cec-2 = 3,125 μg/mL CecA, Cec-3 = 6,25 μg/mL CecA, PI:C = 50 μg/mL Poly I:C. Las células que no reciben ninguno de los tratamientos se consideran control. Los asteriscos indican diferencias significativas cuando se compararon los grupos de tratamiento Cec-1, Cec-2, Cec-3 y PI:C con Control, mientras que las combinaciones de Poly I:C y CecA (PI:C + Cec-1, PI:C + Cec-2, PI:C + Cec-3) se compararon con el grupo PI:C. Los hashtags indican diferencias significativas cuando se comparan las combinaciones de Poly I:C y CecA con Control. *p < 0,05, **p < 0,01 y p < 0,01.##
Figura 3. Gráfico de barras que muestra (A) EC H2O2 Concentración medida mediante ensayo fluorométrico. (B) Concentración de MDA medida por ensayo colorimétrico. Los cocultivos de células no parenquimatosas de hepatocitos de pollo se trataron con tres concentraciones diferentes de cecropina A (CecA) sola y en combinación con ácido poliinosínico-policitidílico (Poly I:C). El color verde se refiere a los grupos de tratamiento sin la adición de Poly I:C, mientras que el color naranja se refiere al tratamiento con Poly I:C. Las columnas representan las medias ± SEM (n = 6/grupo de tratamiento). Cec-1 = 1 μg/mL CecA, Cec-2 = 3,125 μg/mL CecA, Cec-3 = 6,25 μg/mL CecA, PI:C = 50 μg/mL Poly I:C. Las células que no reciben ninguno de los tratamientos se consideran control. Los asteriscos indican diferencias significativas cuando se compararon los grupos de tratamiento Cec-1, Cec-2, Cec-3 y PI:C con Control, mientras que las combinaciones de Poly I:C y CecA (PI:C + Cec-1, PI:C + Cec-2, PI:C + Cec-3) se compararon con el grupo PI:C. Los hashtags indican diferencias significativas cuando se comparan las combinaciones de Poly I:C y CecA con Control. *p < 0,05, **p < 0,01 y p < 0,01.##
En cuanto al MDA, ninguna de las concentraciones de CecA aplicadas por sí solas influyó en el marcador de peroxidación lipídica. Por otro lado, en la inflamación inducida por Poly I:C, CecA contribuyó a una elevación significativa a su concentración de 3,125 μg/mL (p = 0,0123) (Figura 3B).
4 Discusión
Dado que la aparición de resistencia a los antibióticos se ha convertido en una preocupación mundial, existe una necesidad imperiosa de diseñar nuevos agentes antimicrobianos (5). Para ello, los HDP han atraído una gran atención, incluso en la avicultura (1), donde los animales se enfrentan constantemente a un gran conjunto de patógenos. Un número creciente de estudios ha demostrado que, además de su efecto antimicrobiano directo, los HDP poseen notables propiedades inmunomoduladoras (5, 7, 8). Sin embargo, en lugar de actuar sobre un único receptor o vía de señalización, las HDP ejercen un efecto pleiotrópico e influyen selectivamente en ciertos procesos inmunitarios (7). Como consecuencia, la investigación de sus efectos celulares es crucial para su uso terapéutico en el futuro, contribuyendo así a la lucha contra la resistencia a los antibióticos.
En el presente estudio, se examinaron los efectos inmunomoduladores de CecA solos y en condiciones inflamatorias inducidas por Poly I:C, en un cocultivo primario de hepatocitos y células no parenquimatosas de origen pollo. Al ser una molécula sintética de dsRNA, Poly I:C actúa como un potente agonista de TLR3 (33), cuyo papel inmunomodulador ya se ha confirmado también en pollos (35). Tras la estimulación del receptor, la señalización posterior promueve la activación de la transducción de señales del factor nuclear-κB (NF-κB) y otras señales intracelulares, lo que conduce a la producción de citoquinas proinflamatorias (por ejemplo, interferones de tipo I) y la maduración de las células dendríticas, lo que contribuye a la inflamación (33). Como la evidencia reciente sugiere que, al igual que en los mamíferos, la señalización NF-κB también juega un papel importante en el estado inflamatorio de las aves de corral (30), Poly I:C podría ser un candidato adecuado para evocar inflamación en cultivos de células de pollo. En el presente estudio, Poly I:C contribuyó al aumento de la producción de IFN-γ, lo que indica el estado inflamatorio desencadenado.
Con el fin de confirmar el posible uso seguro de las HDP en el futuro, deben investigarse a fondo sus posibles efectos citotóxicos en las células huésped (36). Sin embargo, se dispone de datos limitados sobre sus interacciones con las células eucariotas (24). Dado que las HDP catiónicas suelen describirse como de alta selectividad frente a las bacterias (36), también se ha destacado que las cecropinas poseen una baja citotoxicidad contra las células de mamíferos (9). Aun así, estos hallazgos no han sido confirmados en el caso de las aves de corral. De acuerdo con nuestros resultados, el tratamiento de las células con CecA a concentraciones más bajas no resultó en un cambio en la integridad de la membrana celular, lo que sugiere su aplicación segura. Esto está en línea con los hallazgos anteriores, ya que no se encontró que CecA tuviera efectos no deseados contra la línea celular de macrófagos murinos RAW 264.7 (23), la línea celular epitelial epitelial intestinal porcina IPEC-J2 (22) y los cultivos de células mononucleares periféricas humanas (36). Sin embargo, en nuestro estudio, las concentraciones más altas del péptido causaron un aumento significativo en la actividad de la LDH de la CE, lo que indica una fuga de la membrana celular y una disminución de la viabilidad celular. A pesar de que hay datos disponibles en los que una dosis administrada más alta de CecA o su derivado sintético mostró efectos citotóxicos (24, 37-39), el papel del daño en la membrana es controvertido. Sin embargo, se describió que la contribución de CecA a la muerte celular se produce a través de un efecto apoptótico independiente de la caspasa en lugar de causar necrosis (24, 36). Además, según los datos de la literatura, incluso las mismas concentraciones del péptido mostraron diversos efectos sobre la viabilidad de diferentes tipos de células. Por lo tanto, la citotoxicidad de CecA también podría depender del tipo de célula examinada y del origen del cultivo celular utilizado. Además, la baja penetración tisular de las HDP después de su adición podría resultar en una baja disponibilidad en los órganos (40), por lo tanto, es menos probable que se produzca una dosis citotóxica en condiciones in vivo en el hígado. Tomando nuestros datos en conjunto, la administración de CecA todavía parece ser inofensiva para las células huésped a bajas concentraciones; Sin embargo, desde el punto de vista hepático, podría ser aconsejable evitar concentraciones más altas de la misma.
Los efectos inmunomoduladores de CecA se investigaron mediante la medición de diferentes citocinas como IL-6, IL-8, IFN-γ, TGF-ß1 e IL-10. Mientras que la IL-6, la IL-8 y el IFN-γ suelen describirse como mediadores proinflamatorios, producidos por un gran conjunto de células (41), la IL-10 y el TGF-ß se consideran principalmente antiinflamatorios (28, 41, 42). La IL-6 desempeña un papel crucial en la inflamación, ya que está implicada en el reclutamiento de leucocitos, la producción de proteínas en fase aguda de los hepatocitos, la proliferación de células T y la diferenciación de las células B (41). La IL-8 también tiene un papel importante en el reclutamiento de neutrófilos, células asesinas naturales (NK) y células T en el sitio de la lesión (41). Además, el IFN-γ es un regulador clave de la activación de macrófagos, la presentación de antígenos y las respuestas celulares citotóxicas (41).
En el presente estudio, la dosis única de CecA a 1 μg/mL y la administración de HDP en la inflamación inducida por Poly I:C en las tres concentraciones dieron lugar a una disminución de la IL-6. Esto está de acuerdo con hallazgos previos, donde CecA fue capaz de inhibir la producción de la citoquina en la línea celular IPEC-J2 co-cultivada con Escherichia coli, aliviando así la inflamación (22). También se encontró que otras cecropinas naturales como SibaCec (12), Musca domestica cecropin (Mdc) (15), cecropin-TY1 (10) y Cecropinas de Aedes egypti (11) ejercen el mismo efecto en diferentes cultivos celulares. Además, en condiciones in vivo, en la EII inducida experimentalmente en ratones, se ha demostrado que CecA alivia los síntomas y reduce el nivel local de IL-6 (21). En el caso del IFN-γ, se midió una reducción significativa después de la adición única de CecA a 1 μg/mL y después de la inflamación evocada por Poly I:C a concentraciones de 1 y 6,25 μg/mL, respectivamente. Aunque hasta donde saben los autores, el efecto de CecA sobre la producción de IFN-γ no se ha investigado previamente, nuestros hallazgos están en línea con los resultados de otras cecropinas. A saber, Mdc en un modelo experimental de ratones (15) y cecropina AD en rodaballo (Scophthalmus maximus) (18) también fueron capaces de aliviar el nivel de IFN-γ en condiciones in vivo. Con respecto a la IL-8, CecA mostró un efecto reductor a la única concentración de 1 μg/mL en nuestro estudio, lo que está de acuerdo con los hallazgos de Zhai et al., donde se observó un impacto similar en la línea celular IPEC-J2 cocultivada con Escherichia coli (22). Tomando los datos mencionados anteriormente, nuestros resultados sugieren la actividad antiinflamatoria de CecA, cuyo mecanismo ya se ha demostrado que se logra mediante la inhibición de proteínas clave de la inflamación como COX-2 y MAPKs (23).
La IL-10, una citoquina antiinflamatoria, se produce en respuesta a estímulos microbianos principalmente por macrófagos y células dendríticas, y ejerce un efecto supresor directo principalmente a nivel celular (42). Sirve como un regulador clave del equilibrio inflamatorio, ya que la respuesta inmune debe proteger al organismo sin contribuir a una reacción excesiva e inmunopatología (42). En nuestro experimento, los niveles de IL-10 se redujeron con la aplicación exclusiva de CecA a 1 μg/mL y el tratamiento del péptido en la inflamación inducida por Poly I:C a 1 y 6,25 μg/mL. Aunque hasta donde saben los autores, el efecto de CecA en la producción de IL-10 no se ha investigado previamente, nuestros hallazgos están en línea con los resultados de Mdc, otra cecropína en una EII inducida experimentalmente en ratones (15). Dado que la producción de IL-10 exige, entre otras cosas, la activación de p38 MAPK y la quinasa regulada por señales extracelulares (ERK) (42), y CecA ejerce un efecto inhibidor sobre estas proteínas clave (23), la disminución del nivel de IL-10 podría lograrse debido a este mecanismo. También podría indicar que las células inmunitarias no requerían cantidades significativas de citoquinas antiinflamatorias para aliviar la respuesta inmunitaria, ya que la CecA había disminuido notablemente los niveles de citoquinas proinflamatorias (43).
El TGF-ß es una citocina menos examinada en relación con las cecropinas; sin embargo, posee impactos multifacéticos en las células, a menudo descritas como una molécula pleiotrópica (44, 45). Además de tener un efecto principalmente antiinflamatorio, que ya se ha investigado en pollos de engorde (46), el TGF-ß desempeña un papel importante en la regulación de la proliferación y diferenciación celular, la producción de citoquinas, los procesos fibróticos, los mecanismos de reparación y la formación de la matriz extracelular (28, 44, 45). Además, puede ser producida por varios tipos de células en el hígado, siendo las principales fuentes las HSC, los macrófagos y los linfocitos (28). De acuerdo con nuestros resultados, la liberación de TGF-ß1, una isoforma de TGF-ß, puede disminuirse con la adición única de CecA a 6,25 μg/mL, pero no se ve afectada por la adición del péptido en estado inflamatorio. Hasta donde saben los autores, el efecto de CecA en la producción de TGF-ß no ha sido investigado previamente; sin embargo, Han y Sheperd hicieron la misma observación recientemente, tratando una línea celular similar al epitelio de la trucha arco iris (RTgill-W1) con otra cecropina natural, la cecropina P1 (47). No obstante, se ha publicado previamente que el TGF-ß podría tener un papel especial desde el punto de vista hepático, ya que se encontró que los hepatocitos murinos y humanos podrían ser especialmente sensibles a la citoquina, y una gran cantidad de TGF-ß podría mostrar un efecto apoptótico (28, 48). Por lo tanto, su inhibición podría resultar en la preservación y protección de la función hepática, además, también podría apoyar la apoptosis de HSC con fenotipo patológico (49). De acuerdo con nuestros resultados, al reducir la cantidad de TGF-ß1 en células sanas, CecA podría ejercer los mismos efectos beneficiosos, que podrían lograrse por la capacidad mencionada anteriormente para inhibir MAPKs (22, 23), ya que la producción de TGF-ß también está regulada por esta vía de señalización (44).
Tomando nuestros resultados sobre los marcadores inflamatorios en conjunto, CecA mostró, por un lado, un efecto antiinflamatorio, ya que contribuyó a disminuir la producción de los mediadores proinflamatorios IL-6, IL-8 e IFN-γ. Por otro lado, también provocó una reducción de los niveles de los antiinflamatorios IL-10 y TGF-ß1, en base a los cuales no se puede afirmar un efecto puramente antiinflamatorio de CecA en nuestras circunstancias experimentales. A pesar de que es contrario a los hallazgos previos, donde la CecA se caracterizó claramente como una molécula antiinflamatoria (21-23), también vale la pena señalar que las HDP se describen como moléculas inmunomoduladoras con efectos pleiotrópicos, lo que les permite ejercer incluso una actividad proinflamatoria (7). Por ejemplo, la misma reducción simultánea de IL-6 e IL-10 fue observada por Hansen et al. al examinar los efectos inmunomoduladores de HDP GKY25 en una línea celular RAW 264.7 (50). Como consecuencia, su efecto no es universal y no puede predecirse para una HDP determinada (5), ya que es muy complejo y depende del contexto biológico específico, el tipo de célula y el estímulo inflamatorio (5, 8). Además, aunque la mayoría de las cecropinas se describen en la literatura como poseedoras de actividad antiinflamatoria, también se pueden encontrar ejemplos entre ellas de ejercer incluso efectos proinflamatorios, como en el caso de la cecropina P1 (47). Además, el presente estudio está sujeto a limitaciones, como el rango relativamente estrecho de parámetros inflamatorios probados y el uso de un solo tipo de agonista TLR para inducir inflamación.
A medida que más y más evidencia sugiere que la inflamación y el estado redox están estrechamente conectados entre sí (29), y se ha descrito que varias cecropinas influyen en las condiciones oxidativas de las células huésped (14-17, 51, 52), los efectos de CecA sobre la homeostasis redox también se examinaron en el presente estudio. De acuerdo con nuestros resultados, la dosis baja de CecA aplicada únicamente mejoró el nivel de EC H2O2, Y en condiciones inflamatorias, su alta dosis también contribuyó al estrés oxidativo. Dado que la formación excesiva de ROS contribuye a la peroxidación lipídica (29), también se midieron los niveles de MDA. No se encontró que ninguna de las únicas concentraciones añadidas de CecA aumentara su cantidad, lo que indica que, aunque una mayor producción de H2O2 no condujo al daño oxidativo de los fosfolípidos formadores de membrana. Sin embargo, CecA elevó el nivel de MDA a una concentración de 3,125 μg/mL en la inflamación inducida por Poly I:C, que podría ser el resultado de eventos oxidativos desconocidos diferentes de la formación de H2O2, ya que no se detectó que se elevara. Curiosamente, se realizaron observaciones similares en el caso de HDP LRR11, ya que el péptido mejoró la generación de ROS cuando se aplicó simultáneamente con un agente proinflamatorio; sin embargo, no mostró un efecto prooxidante cuando se administró solo (53). Aunque nuestros hallazgos son contrarios a la actividad antioxidante previamente probada de otras cecropinas (14-17), también se encontró que la cecropina 3 (52) y el péptido similar a la cecropina Hp (2-20) (51) contribuyeron al estrés oxidativo que inicialmente se ejerció como una respuesta de defensa del huésped contra patógenos, pero terminó mostrando un impacto perjudicial en las células huésped (51). Además, al investigar la actividad antitumoral de CecA, se observó que el péptido conducía a la acumulación de ROS en su mayor concentración en una línea celular de leucemia promielocítica humana (24). Además, se encontró que CecA también promueve la formación excesiva de ROS en Candida albicans, lo que se consideró una parte esencial de la actividad antifúngica del péptido (54, 55). Tomando nuestros resultados en conjunto, el efecto de CecA sobre la homeostasis redox es difícil de evaluar, y podría haber requerido la investigación de parámetros adicionales, cuya falta es una limitación de nuestro estudio. Por lo tanto, se necesitan más estudios in vitro e in vivo para examinar los efectos detallados de CecA sobre el estado oxidativo celular, a los que nuestro estudio puede proporcionar información útil.
En resumen, nuestro estudio confirma que las HDPs son reguladores biológicos versátiles de la respuesta inmune y de las vías inflamatorias, ya que luchan contra patógenos de forma compleja, lo que posiblemente contribuya a su futura aplicación como agentes antimicrobianos inmunomoduladores. Sin embargo, para lograr esto, las HDP deben ser examinadas ampliamente a nivel celular y en diferentes especies, especialmente en lo que respecta a su uso en la ganadería, para la que hay menos estudios disponibles.
5 Conclusión
El presente estudio tuvo como objetivo investigar los efectos de CecA sobre la respuesta inflamatoria y la homeostasis redox de un cocultivo primario de hepatocitos de pollo-células no parenquimatosas. De acuerdo con nuestros resultados, CecA no parece tener efectos nocivos sobre la viabilidad de las células hepáticas cuando se aplica en sus concentraciones más bajas; sin embargo, el uso de sus concentraciones más altas podría provocar daños en la membrana celular. También se puede afirmar que CecA posee un impacto multifacético en la respuesta inmune de las células huésped, ya que fue capaz de influir en los niveles de IL-6, IL-8, IFN-γ, IL-10 y TGF-ß1. A pesar de que, según nuestros resultados, la CecA no puede considerarse puramente antiinflamatoria, se sugiere mantener la homeostasis inflamatoria hepática en la respuesta inmunitaria desencadenada por Poly I:C. Además, el examen de los efectos de CecA sobre el estado redox celular mostró que los parámetros oxidativos no se vieron afectados en la mayoría de los casos de exposición a CecA, aun así, se requieren más estudios para comprender su acción. En conclusión, el CecA ofrece algo más que un simple efecto antibacteriano, y podría ser un candidato prometedor para el futuro diseño y desarrollo de agentes antimicrobianos, contribuyendo así a la reducción del uso de antibióticos convencionales y la resistencia a los antibióticos.
Declaración de disponibilidad de datos
Los conjuntos de datos presentados en este estudio se pueden encontrar en repositorios en línea. Los nombres de los repositorios y los números de acceso se pueden encontrar en: 10.6084/m9.figshare.23997939.
Declaración ética
El estudio en animales fue aprobado por el Comité Local de Bienestar Animal y la Oficina del Gobierno (número de permiso: GK-419/2020; fecha de aprobación: 11 de mayo de 2020). El estudio se llevó a cabo de acuerdo con la legislación local y los requisitos institucionales.
Contribuciones de los autores
RM: Conceptualización, Curación de datos, Análisis formal, Investigación, Metodología, Software, Visualización, Escritura – borrador original, Escritura – revisión y edición. CS: Investigación, Metodología, Redacción – revisión y edición. MM: Análisis formal, Investigación, Metodología, Validación, Redacción – revisión y edición. PT: Investigación, Metodología, Redacción – Revisión y Edición. JV: Investigación, Metodología, Redacción – revisión y edición. ÁK: Metodología, Software, Validación, Redacción – revisión y edición. ZN: Investigación, Metodología, Redacción – revisión y edición. GM: Conceptualización, Análisis formal, Investigación, Metodología, Validación, Redacción – revisión y edición.
Financiación
El/los autor/es declara(n) haber recibido apoyo financiero para la investigación, autoría y/o publicación de este artículo. El trabajo contó con el apoyo financiero de la Oficina Nacional de Investigación, Desarrollo e Innovación de Hungría (número de subvención: OTKA FK 134940). Además, el proyecto no. El MRR-2.3.1-21-2022-00001 se ha ejecutado con el apoyo proporcionado por el Mecanismo de Recuperación y Resiliencia (MRR), financiado con cargo a la estimación presupuestaria del Fondo Nacional de Recuperación, esquema de financiación del MRR-2.3.1-21.
Reconocimientos
Un agradecimiento especial a Mária Kósa por su ayuda durante las mediciones de laboratorio.
Conflicto de intereses
Los autores declaran que la investigación se llevó a cabo en ausencia de relaciones comerciales o financieras que pudieran interpretarse como un posible conflicto de intereses.
Nota del editor
Todas las afirmaciones expresadas en este artículo son únicamente las de los autores y no representan necesariamente las de sus organizaciones afiliadas, ni las del editor, los editores y los revisores. Cualquier producto que pueda ser evaluado en este artículo, o afirmación que pueda ser hecha por su fabricante, no está garantizado ni respaldado por el editor.
Referencias
1. Wang, S, Zeng, X, Yang, Q y Qiao, S. Péptidos antimicrobianos como posibles alternativas a los antibióticos en la industria de animales destinados a la alimentación. IJMS. (2016) 17:603. doi: 10.3390/ijms17050603
Resumen de PubMed | Texto completo de Crossref | Google Académico
2. Józefiak, A, y Engberg, R. Proteínas de insectos como fuente potencial de péptidos antimicrobianos en la producción ganadera. J Anim Feed Sci. (2017) 26:87–99. doi: 10.22358/jafs/69998/2017
3. Zehra, A, Singh, R, Kaur, S, y Gill, JPS. Caracterización molecular de Staphylococcus aureus resistente a antibióticos en ganado bovino (bovino y porcino). Mundo Veterinario. (2017) 10:598–604. doi: 10.14202/vetworld.2017.598-604
Resumen de PubMed | Texto completo de Crossref | Google Académico
4. Moretta, A, Scieuzo, C, Petrone, AM, Salvia, R, Manniello, MD, Franco, A, et al. Péptidos antimicrobianos: una nueva esperanza en los campos biomédico y farmacéutico. Las células frontales infectan el microbiol. (2021) 11:668632. doi: 10.3389/fcimb.2021.668632
Resumen de PubMed | Texto completo de Crossref | Google Académico
5. Lee, EY, Lee, MW, y Wong, GCL. Modulación de la señalización de receptores tipo toll por péptidos antimicrobianos. Semin Cell Dev Biol. (2019) 88:173–84. doi: 10.1016/j.semcdb.2018.02.002
Resumen de PubMed | Texto completo de Crossref | Google Académico
6. Mahlapuu, M, Håkansson, J, Ringstad, L, y Björn, C. Péptidos antimicrobianos: una categoría emergente de agentes terapéuticos. Las células frontales infectan el microbiol. (2016) 6:194. doi: 10.3389/fcimb.2016.00194/full
7. Hancock, REW, y Sahl, HG. Péptidos antimicrobianos y de defensa del huésped como nuevas estrategias terapéuticas antiinfecciosas. Nat Biotechnol. (2006) 24:1551–7. doi: 10.1038/nbt1267
8. Hancock, REW, Haney, EF y Gill, EE. UU. La inmunología de los péptidos de defensa del huésped: más allá de la actividad antimicrobiana. Nat Rev Immunol. (2016) 16:321–34. doi: 10.1038/nri.2016.29
Resumen de PubMed | Texto completo de Crossref | Google Académico
9. Brady, D, Grapputo, A, Romoli, O, y Sandrelli, F. Cecropinas de insectos, péptidos antimicrobianos con posibles aplicaciones terapéuticas. IJMS. (2019) 20:5862. doi: 10.3390/ijms20235862
Resumen de PubMed | Texto completo de Crossref | Google Académico
10. Wei, L, Huang, C, Yang, H, Li, M, Yang, J, Qiao, X, et al. Un potente péptido antiinflamatorio de las glándulas salivales del tábano. Parásitos vectores. (2015) 8:556. doi: 10.1186/s13071-015-1149-y
Resumen de PubMed | Texto completo de Crossref | Google Académico
11. Wei, L, Yang, Y, Zhou, Y, Li, M, Yang, H, Mu, L, et al. Actividades antiinflamatorias de las cecropinas de Aedes aegypti y su protección contra el choque con endotoxinas murinas. Parásitos vectores. (2018) 11:470. doi: 10.1186/s13071-018-3000-8
Resumen de PubMed | Texto completo de Crossref | Google Académico
12. Wu, J, Mu, L, Zhuang, L, Han, Y, Liu, T, Li, J, et al. Péptido antimicrobiano similar a la cecropina con actividad antiinflamatoria de las glándulas salivales de la mosca negra. Parásitos vectores. (2015) 8:561. doi: 10.1186/s13071-015-1176-8
Resumen de PubMed | Texto completo de Crossref | Google Académico
13. Wei, RY, Bai, J, Zhao, MF, Xu, B, Li, WJ, Wei, FX, et al. Actividad antiinflamatoria de la cecropina-A2 de Musca domestica. Microb Pathog. (2017) 110:637–44. doi: 10.1016/j.micpath.2017.07.032
Resumen de PubMed | Texto completo de Crossref | Google Académico
14. Zhang, L, Gui, S, Xu, Y, Zeng, J, Wang, J, Chen, Q, et al. Nanopartículas de carbono mesoporosas acumuladoras de tejido de colon cargadas con cecropina Musca domestica para el tratamiento de la colitis ulcerosa. Teranósticos. (2021) 11:3417–38. doi: 10.7150/thno.53105
Resumen de PubMed | Texto completo de Crossref | Google Académico
15. Zhang, L, Gui, S, Liang, Z, Liu, A, Chen, Z, Tang, Y, et al. Musca domestica Cecropin (mdc) alivia el deterioro de la barrera de la mucosa colónica inducido por Salmonella typhimurium: se asocia con la respuesta al estrés inflamatorio y oxidativo, la unión estrecha y la flora intestinal. Microbiol frontal. (2019) 10. doi: 10.3389/fmicb.2019.00522
Resumen de PubMed | Texto completo de Crossref | Google Académico
16. Lin, X, Chen, W, Lin, S y Luo, L. Efectos de la cecropina dietética sobre el crecimiento, la inmunidad inespecífica y la resistencia a enfermedades de la tilapia (Oreochromis niloticus × O. aureus). Aquac Res. (2015) 46:2999–3007. doi: 10.1111/are.12457
17. Dong, XQ, Zhang, DM, Chen, YK, Wang, QJ y Yang, YY. Efectos de los péptidos antimicrobianos (AMPs) sobre los parámetros bioquímicos sanguíneos, la actividad antioxidante y la función inmune en la carpa común (Cyprinus carpio). Pescados y mariscos Immunol. 47:429–34. doi: 10.1016/j.fsi.2015.09.030
Resumen de PubMed | Texto completo de Crossref | Google Académico
18. Dai, J, Ou, W, Yu, G, Ai, Q, Zhang, W, Mai, K, et al. El suplemento de péptido antimicrobiano Cecropin AD alivió la inflamación intestinal inducida por la harina de soja, el daño de la barrera y la disbiosis microbiana en el rodaballo juvenil, Scophthalmus maximus. Frente Mar Sci. (2020) 7:584482. doi: 10.3389/fmars.2020.584482
19. Wen, LF, y He, JG. Efectos dosis-respuesta de un péptido antimicrobiano, un híbrido de cecropina, sobre el rendimiento del crecimiento, la utilización de nutrientes, los recuentos bacterianos en la digesta y la morfología intestinal en pollos de engorde. Hno. J Nutr. (2012) 108:1756–63. doi: 10.1017/S0007114511007240
Resumen de PubMed | Texto completo de Crossref | Google Académico
20. Xiong, X, Yang, HS, Li, L, Wang, YF, Huang, RL, Li, FN, et al. Efectos de los péptidos antimicrobianos en las dietas de destete sobre el rendimiento del crecimiento de cerdos criados en cinco granjas diferentes. Livest Sci. (2014) 167:206–10. doi: 10.1016/j.livsci.2014.04.024
21. Zhai, Z, Zhang, F, Cao, R, Ni, X, Xin, Z, Deng, J, et al. La cecropina A alivia la inflamación mediante la modulación de la microbiota intestinal de ratones C57BL/6 con EII inducida por DSS. Microbiol frontal. (2019) 10:1595. doi: 10.3389/fmicb.2019.01595
Resumen de PubMed | Texto completo de Crossref | Google Académico
22. Zhai, Z, Ni, X, Jin, C, Ren, W, Li, J, Deng, J, et al. La cecropina A modula la expresión de proteínas relacionadas con la unión estrecha y mejora la función de barrera de las células epiteliales intestinales porcinas mediante la supresión de la vía MEK / ERK. IJMS. (2018) 19:1941. doi: 10.3390/ijms19071941
Resumen de PubMed | Texto completo de Crossref | Google Académico
23. Lee, E, Shin, A y Kim, Y. Actividades antiinflamatorias de la cecropina A y su mecanismo de acción. Arch Insect Biochem Physiol. (2015) 88:31–44. doi: 10.1002/arch.21193
Resumen de PubMed | Texto completo de Crossref | Google Académico
24. Cerón, JM, Contreras-Moreno, J, Puertollano, E, de Cienfuegos, GÁ, Puertollano, MA, y de Pablo, MA. El péptido antimicrobiano cecropina A induce la muerte celular independiente de la caspasa en las células de leucemia promielocítica humana. Péptidos. (2010) 31:1494–503. doi: 10.1016/j.peptides.2010.05.008
Resumen de PubMed | Texto completo de Crossref | Google Académico
25. Giacometti, A, Cirioni, O, Ghiselli, R, Viticchi, C, Mocchegiani, F, Riva, A, et al. Efecto de las cecropinas intraperitoneales monodosis en el shock séptico experimental: medicina de cuidados críticos (2001) 29:1666. doi: 10.1097/00003246-200109000-00002,
26. Robinson, MW, Harmon, C y O’Farrelly, C. Inmunología hepática y su papel en la inflamación y la homeostasis. Cell Mol Immunol. (2016) 13:267–76. doi: 10.1038/cmi.2016.3
Resumen de PubMed | Texto completo de Crossref | Google Académico
27. Shan, Z y Ju, C. Macrófagos hepáticos en la lesión hepática. Frente Immunol. (2020) 11:322. doi: 10.3389/fimmu.2020.00322
Resumen de PubMed | Texto completo de Crossref | Google Académico
28. Bissell, D. Factor de crecimiento transformante β y el hígado. Hepatología. (2001) 34:859–67. doi: 10.1053/jhep.2001.28457
29. Li, S, Hong, M, Tan, HY, Wang, N y Feng, Y. Ideas sobre el papel y la interdependencia del estrés oxidativo y la inflamación en las enfermedades hepáticas. Oxidativa Med Cell Longev. (2016) 2016:1–21. doi: 10.1155/2016/4234061
Resumen de PubMed | Texto completo de Crossref | Google Académico
30. Surai, PF, Kochish, II, y Kidd, MT. Homeostasis redox en aves de corral: funciones reguladoras de NF-κB. Antioxidantes. (2021) 10:186. doi: 10.3390/antiox10020186
Resumen de PubMed | Texto completo de Crossref | Google Académico
31. Tráj, P, Herrmann, EM, Sebők, C, Vörösházi, J, Mackei, M, Gálfi, P, et al. Efectos protectores del ácido chicórico sobre el ácido poliinosínico-policitidílico expuesto al cultivo de células hepáticas de pollo que imitan el daño viral y la inflamación. Veterinario Inmunol Inmunopatíaco. (2022) 250:110427. doi: 10.1016/j.vetimm.2022.110427
Resumen de PubMed | Texto completo de Crossref | Google Académico
32. Sebők, C, Tráj, P, Vörösházi, J, Mackei, M, Papp, M, Gálfi, P, et al. Dos lados de cada pregunta: intentos de activar la inmunidad innata de los pollos en cultivos de células hepáticas 2D y 3D. Célula. (2021) 10:1910. doi: 10.3390/cells10081910
Resumen de PubMed | Texto completo de Crossref | Google Académico
33. Matsumoto, M, y Seya, T. TLR3: inducción de interferón por ARN bicatenario incluyendo poli(I:C)☆. Adv Drug Deliv Rev. (2008) 60:805–12. doi: 10.1016/j.addr.2007.11.005
Resumen de PubMed | Texto completo de Crossref | Google Académico
34. Mackei, M, Molnár, A, Nagy, S, Pál, L, Kővágó, C, Gálfi, P, et al. Efectos del estrés térmico agudo en un modelo de cocultivo de células no parenquimatosas de hepatocitos de pollo recientemente establecido. Animales. (2020) 10:409. doi: 10.3390/ani10030409
Resumen de PubMed | Texto completo de Crossref | Google Académico
35. Barjesteh, N, Behboudi, S, Brisbin, JT, Villanueva, AI, Nagy, É y Sharif, S. Los ligandos TLR inducen respuestas antivirales en macrófagos de pollo. PLoS Uno. (2014) 9:e105713. doi: 10.1371/journal.pone.0105713
36. Bacalum, M, y Radu, M. Citotoxicidad de péptidos antimicrobianos catiónicos en células de mamíferos: un análisis utilizando el concepto integrador de índice terapéutico. Int J Pept Res ther. (2015) 21:47–55. doi: 10.1007/s10989-014-9430-z
37. Kalsy, M, Tonk, M, Hardt, M, Dobrindt, U, Zdybicka-Barabas, A, Cytrynska, M, et al. El péptido antimicrobiano de insectos cecropina A altera las biopelículas uropatógenas de Escherichia coli. npj Biofilms Microbiomas. (2020) 6:e3. doi: 10.1038/s41522-020-0116-3
38. López-Rojas, R, Docobo-Pérez, F, Pachón-Ibáñez, ME, Torre, BG, Fernández-Reyes, M, March, C, et al. Eficacia de los péptidos de cecropina A-melitina en un modelo de sepsis de infección por Acinetobacter baumannii pan-resistente. Eur J Clin Microbiol Infect Dis. (2011) 30:1391–8. doi: 10.1007/s10096-011-1233-y
Resumen de PubMed | Texto completo de Crossref | Google Académico
39. Velasco, M, Díaz-Guerra, MJ, Díaz-Achirica, P, Andreu, D, Rivas, L, y Boscá, L. La activación de macrófagos con cecropina A y péptidos derivados de melitina induce la expresión de óxido nítrico sintasa tipo II. J Immunol. (1997) 158:4437–43. doi: 10.4049/jimmunol.158.9.4437
Resumen de PubMed | Texto completo de Crossref | Google Académico
40. van Gent, ME, Ali, M, Nibbering, PH, y Kłodzińska, SN. Avances actuales en sistemas de administración de péptidos y péptidos antimicrobianos lipídicos y poliméricos y recubrimientos para la prevención y el tratamiento de infecciones bacterianas. Farmacia. (2021) 13:1840. doi: 10.3390/pharmaceutics13111840
Resumen de PubMed | Texto completo de Crossref | Google Académico
41. Akdis, M, Burgler, S, Crameri, R, Eiwegger, T, Fujita, H, Gómez, E, et al. Interleucinas, de 1 a 37, e interferón-γ: receptores, funciones y roles en las enfermedades. J Alergia Clin Immunol. (2011) 127:701–21. doi: 10.1016/j.jaci.2010.11.050
Resumen de PubMed | Texto completo de Crossref | Google Académico
42. Howes, A, Stimpson, P, Redford, P, Gabrysova, L, y O’Garra, A. Interleucina-10: citoquinas en antiinflamatoria y tolerancia. T Yoshimoto y T Yoshimoto, (Eds.) Fronteras de las citoquinas. Tokio: Springer Japón; (2020), 85:106658
43. Feng, J, Wang, L, Xie, Y, Chen, Y, Yi, H y He, D. Efectos del péptido antimicrobiano catelicidina-BF en el control de la diarrea, las respuestas inmunitarias, la inflamación intestinal y la función de barrera intestinal en lechones con diarrea posdestete. Int Immunopharmacol. (2020) 85:106658. doi: 10.1016/j.intimp.2020.106658
Resumen de PubMed | Texto completo de Crossref | Google Académico
44. Kogut, MH, y Arsenault, RJ. Un papel para las vías de señalización no canónicas Wnt-β-catenina y TGF-β en la inducción de tolerancia durante el establecimiento de una infección cecal persistente por Salmonella enterica Serovar Enteritidis en pollos. Ciencia Veterinaria Frontal. (2015) 2:2. doi: 10.3389/fvets.2015.00033
Resumen de PubMed | Texto completo de Crossref | Google Académico
45. Opal, SM, y DePalo, VA. Citoquinas antiinflamatorias. Pecho. (2000) 117:1162–72. doi: 10.1378/chest.117.4.1162
46. Leshchinsky, TV, y Klasing, KC. Divergencia de la respuesta inflamatoria en dos tipos de pollos. Dev Compar Immunol. (2001) 25:629–38. doi: 10.1016/S0145-305X(01)00023-4
Resumen de PubMed | Texto completo de Crossref | Google Académico
47. Han, YC y Shepherd, BS. El péptido antimicrobiano de cecropina P1 modula la expresión diferencial de genes inmunorrelevantes en la línea celular branquial de trucha arco iris (Oncorhynchus mykiss), RTgill-W1. Pescados y mariscos Immunol. (2023) 137:108756. doi: 10.1016/j.fsi.2023.108756
Resumen de PubMed | Texto completo de Crossref | Google Académico
48. Abnaof, K, Mallela, N, Walenda, G, Meurer, SK, Seré, K, Lin, Q, et al. La estimulación con TGF-β en células humanas y murinas revela procesos y vías biológicas comúnmente afectados a nivel de transcripción. BMC Syst Biol. (2014) 8:55. doi: 10.1186/1752-0509-8-55
Resumen de PubMed | Texto completo de Crossref | Google Académico
49. Nakamura, T, Sakata, R, Ueno, T, Sata, M y Ueno, H. La inhibición del factor de crecimiento transformante beta previene la progresión de la fibrosis hepática y mejora la regeneración de los hepatocitos en ratas tratadas con dimetilnitrosamina. Hepatología. (2000) 32:247–55. doi: 10.1053/jhep.2000.9109
Resumen de PubMed | Texto completo de Crossref | Google Académico
50. Hansen, FC, Kalle-Brune, M, van der Plas, MJA, Strömdahl, AC, Malmsten, M, Mörgelin, M, et al. El péptido de defensa del huésped GKY25 derivado de la trombina inhibe las respuestas inducidas por endotoxinas a través de interacciones con lipopolisacáridos y macrófagos/monocitos. J Immunol. (2015) 194:5397–406. doi: 10.4049/jimmunol.1403009
Resumen de PubMed | Texto completo de Crossref | Google Académico
51. Bylund, J, Christophe, T, Boulay, F, Nyström, T, Karlsson, A y Dahlgren, C. Actividad proinflamatoria de un péptido antibacteriano similar a la cecropina de Helicobacter pylori. Agentes antimicrobianos quimiotera. (2001) 45:1700–4. doi: 10.1128/AAC.45.6.1700-1704.2001
Resumen de PubMed | Texto completo de Crossref | Google Académico
52. Pavón, N, Buelna-Chontal, M, Hernández-Esquivel, L, Hernández, S, Chávez, E, Condé, R, et al. Inactivación mitocondrial por Anopheles albimanus cecropin 3: mecanismos moleculares. Péptidos. (2014) 53:202–9. doi: 10.1016/j.peptides.2013.07.010
Resumen de PubMed | Texto completo de Crossref | Google Académico
53. Viryasova, GM, Golenkina, EA, Hianik, T, Soshnikova, NV, Dolinnaya, NG, Gaponova, TV, et al. Péptido mágico: propiedades únicas del péptido LRR11 en la activación de la síntesis de leucotrienos en neutrófilos humanos. Int J Mol Sci. (2021) 22:2671. doi: 10.3390/ijms22052671
Resumen de PubMed | Texto completo de Crossref | Google Académico
54. Yun, J y Lee, DG. La apoptosis inducida por la cecropina A está regulada por el equilibrio iónico y el sistema antioxidante de glutatión en Candida albicans. IUBMB Vida. (2016) 68:652–62. DOI: 10.1002/iub.1527
Resumen de PubMed | Texto completo de Crossref | Google Académico
55. Peng, C, Liu, Y, Shui, L, Zhao, Z, Mao, X y Liu, Z. Mecanismos de acción del péptido antimicrobiano Cecropin en la muerte de Candida albicans. Vida. (2022) 12:1581. doi: 10.3390/life12101581
Resumen de PubMed | Texto completo de Crossref | Google Académico
Palabras clave: péptido antimicrobiano, péptido de defensa del huésped, cecropina A, avicultura, cultivo de células hepáticas, inmunomodulador
Cita: Márton RA, Sebők C, Mackei M, Tráj P, Vörösházi J, Kemény Á, Neogrády Z y Mátis G (2024) Cecropina A: investigación de un péptido de defensa del huésped con actividad inmunomoduladora multifacética en un cultivo de células hepáticas de pollo. Frente. Vet. Sci. 11:1337677. doi: 10.3389/fvets.2024.1337677
Recibido: 13 de noviembre de 2023; Aceptado: 20 de febrero de 2024;
Publicado: 01 Marzo 2024.
Editado por:
Kun Li, Universidad Agrícola de Nanjing, China
Revisado por:
Aoyun Li, Universidad Agrícola de Huazhong, China
Monika Jamioł, Universidad de Ciencias de la Vida de Lublin, Polonia
Derechos de autor © 2024 Márton, Sebők, Mackei, Tráj, Vörösházi, Kemény, Neogrády y Mátis. Este es un artículo de acceso abierto distribuido bajo los términos de la Licencia Creative Commons Attribution License (CC BY).
*Correspondencia: Rege Anna Márton, marton.rege.anna@univet.hu
Renuncia: Todas las afirmaciones expresadas en este artículo son únicamente las de los autores y no representan necesariamente las de sus organizaciones afiliadas, ni las del editor, los editores y los revisores. Cualquier producto que pueda ser evaluado en este artículo o afirmación que pueda hacer su fabricante no está garantizado ni respaldado por el editor.
Date de alta y recibe nuestro 👉🏼 Diario Digital AXÓN INFORMAVET ONE HEALTH
Date de alta y recibe nuestro 👉🏼 Boletín Digital de Foro Agro Ganadero
Noticias animales de compañía
Noticias animales de producción
Trabajos técnicos animales de producción
Trabajos técnicos animales de compañía


