Estudio de seguridad de los productos de cannabidiol en perros sanos
Estudio de seguridad de los productos de cannabidiol en perros sanos
 William Bookout1
William Bookout1  Margitta Dziwenka2*
Margitta Dziwenka2*  Kaiti Valm2
Kaiti Valm2  Jennifer Kovacs-Nolan2
Jennifer Kovacs-Nolan2- 1Consejo Nacional de Suplementación Animal (NASC), Sun City West, AZ, Estados Unidos
- 2Servicios farmacéuticos y nutracéuticos de Nutrasource, Guelph, ON, Canadá
La tolerabilidad de diferentes cannabinoides administrados por vía oral a perros se evaluó en un estudio aleatorizado, no ciego, controlado negativamente, con diseño paralelo de 90 días de dosis repetidas con un período de recuperación de 14 días. Los beagles sanos (16 machos y 16 hembras) fueron aleatorizados en cuatro grupos de tratamiento y tratados con aceite de triglicéridos de cadena media como control o con uno de los siguientes: cannabidiol de amplio espectro, cannabidiol de amplio espectro con cannabigerol o cannabidiol de amplio espectro con ácido cannabidiólico a 5 mg de cannabinoides totales/kg de peso corporal/día. Los animales fueron observados diariamente con exámenes clínicos detallados realizados semanalmente. Los animales fueron monitoreados durante 2 semanas adicionales después de la dosis. En el estudio se incluyeron los pesos corporales, el consumo de alimentos y las evaluaciones de patología clínica. Los cannabinoides fueron bien tolerados cuando se administraron dosis a beagles machos y hembras sanos durante 90 días consecutivos. Los datos anuales de vigilancia poscomercialización de los productos de suplementos derivados del cáñamo vendidos para su uso en perros de 2010 a 2023 (año parcial) muestran que la tasa por 1 millón de administraciones vendidas es de 2,10 para los eventos adversos y de 0,01 para los eventos adversos graves. Según los resultados de este estudio, otros estudios publicados y los datos de una amplia vigilancia posterior a la comercialización, los cannabinoides derivados del cáñamo son bien tolerados en perros sanos a una dosis de 5 mg/kg de peso corporal/día.
1 Introducción
Los productos cannabinoides derivados de Cannabis sativa L., específicamente el cáñamo (definido en el Código de Regulaciones Federales de EE. UU. Título 7 Parte 1437.3 «Cáñamo» como C. sativa que contiene <0.3% de Δ9-tetrahidrocannabinol (THC)), están aumentando su uso tanto para humanos como para sus mascotas. Las encuestas de consumidores y veterinarios indican que el uso en mascotas es notable y es probable que crezca, y la comprensión de los consumidores sobre los productos que les dan a sus mascotas es baja. Alvarenga et al. (1) recopilaron datos de 1.238 participantes de la encuesta (la mayoría en los EE. UU.) a través de un sitio web que agrupa a los participantes específicamente para la investigación en línea. Informaron que el 28,8% (n = 356) de los encuestados indicaron que actualmente le dan o le han dado a su mascota un producto de cannabidiol (CBD) o cannabis y el 51,4% (n = 882) indicaron que estarían interesados en darle a su mascota un producto de CBD o cannabis. De los encuestados que estaban dando o habían dado un suplemento, el aislado de CBD fue el producto más comúnmente identificado (100% CBD, 25,8%, n = 92). También se utilizaron comúnmente el espectro amplio (descrito como 0% de THC, 16,6%, n = 59) y el espectro completo (incluye THC, 15,2%, n = 54). Sin embargo, muchos encuestados desconocían la pureza o composición (42,4%, n = 151) (1). También hay lagunas en la información para los veterinarios y la comunidad veterinaria no está totalmente equipada para asesorar a los clientes sobre el uso del CBD para sus mascotas. En una encuesta anónima realizada a 2.130 veterinarios estadounidenses en 2018, aproximadamente un tercio (35%) dijo que «no sabía mucho» sobre los efectos terapéuticos del cáñamo/CBD, y el 43,7% de los encuestados indicó que «no sabía mucho» sobre los efectos tóxicos de los productos de cáñamo/CBD. La mayoría (86,4%) de los encuestados estuvo de acuerdo o muy de acuerdo en que se debe investigar el uso terapéutico y la toxicidad del cáñamo/CBD (2).
El conjunto de pruebas sobre la seguridad del uso de productos cannabinoides en perros, tanto de informes de consumidores como de estudios científicos, es pequeño pero creciente. Por el contrario, el riesgo de toxicosis por cannabis en las mascotas aumenta con la creciente disponibilidad de productos de consumo, por lo que se justifica una mayor investigación sobre la seguridad y eficacia de los productos de cannabis (3, 4). La información sobre la seguridad de los extractos de cáñamo y los cannabinoides aislados de cáñamo de estudios preclínicos en roedores se puede utilizar para determinar la seguridad de estos extractos, sin embargo, se requiere información adicional de los estudios realizados en perros para determinar adecuadamente las dosis seguras a utilizar (5-7). Se dispone de datos farmacocinéticos de estudios recientes en perros para el CBD de amplio espectro (8, 9), el CBD purificado (10), el CBD/ácido cannabidiólico (CBDA) (11-13) y el cannabigerol (CBG) con ácido cannabigerólico (CBGA) (14), así como para otros métodos de administración distintos de la vía oral (15-17), el CBD con THC en una proporción de THC:18 de 1:20 (18) y el Sativex® (19).
Se ha explorado la duración del uso, la forma del producto y el vehículo (por ejemplo, extractos a base de aceite) para la administración de cannabinoides. Alvarenga et al. (9) completaron un estudio a largo plazo (36 semanas) de CBD de amplio espectro (95% del perfil de cannabinoides) en un vehículo de triglicéridos de cadena media (MCT). Los autores informaron que el CBD se acumuló en los perros a lo largo del tiempo a medida que la vida media se triplicó en la marca de las 18 semanas y se mantuvo en ese nivel hasta las 36 semanas, y este efecto fue proporcional a la dosis (9). Deabold et al. (8) administraron dosis de 2 mg de mezcla de CBD/CBDA/kg de peso corporal (pc)/día a perros en ayunas (n = 6) durante un período de 12 semanas en formato masticable. Los autores observaron que la administración en un masticable resultó en un tiempo de retención y una vida media más cortos que un aceite infundido (8). Wakshlag et al. (11) determinaron la farmacocinética de tres formas diferentes de un aceite infundido que contiene cantidades iguales de CBD y CBDA y pequeñas cantidades de THC y ácido tetrahidrocannabinólico (THCA). Determinaron que un vehículo con un 25% de lecitina de girasol aumentaba la absorción de CBDA y THCA, lo que demuestra que el vehículo tiene el potencial de afectar el perfil de seguridad (11).
La administración oral de cannabinoides en perros suele ser bien tolerada. Di Salvo et al. (20) resumieron 19 estudios de tolerabilidad con CBD o CBD/CBDA. De los dos estudios que se extendieron más allá de las 12 semanas de duración, uno utilizó un destilado de CBD solo a aproximadamente 4 mg/kg de peso corporal/día y el otro utilizó un CBD altamente purificado (Epidiolex) a un máximo de 100 mg/kg de peso corporal/día. También se resumieron cinco estudios de 12 semanas de duración con CBD o productos de CBD/CBDA. Los efectos secundarios comunes observados fueron aumento de la actividad de la fosfatasa alcalina, síntomas gastrointestinales, somnolencia y ataxia. No se observaron efectos secundarios graves (20).
Este estudio en beagles machos y hembras sanos a los que se les administró una dosis diaria de tratamiento durante 90 días consecutivos evalúa el CBD de amplio espectro, el CBD de amplio espectro con CBDA, y es el primero hasta donde sabemos en incluir CBD de amplio espectro con CBG en un estudio de tolerabilidad a largo plazo. Dado el volumen de productos de consumo vendidos anualmente, los datos de estudios bien controlados con criterios de valoración de seguridad y dosis definidos en relación con el uso en la industria son imprescindibles para comprender el riesgo asociado con el uso de cannabinoides en perros. Se espera que dosis de 5 mg/kg de peso corporal/día no tengan efectos adversos en beagles sanos. El presente estudio se suma a la literatura disponible que evalúa la tolerabilidad de los productos cannabinoides de amplio espectro en perros sanos en un estado alimentado.
2 Materiales y métodos
2.1 Realización del estudio
Este estudio fue realizado por ClinVet USA LLC, un centro acreditado por la Asociación para la Evaluación y Acreditación del Cuidado de Animales de Laboratorio que cumple con las pautas establecidas en la Guía del Consejo Nacional de Investigación para el Cuidado y Uso de Animales de Laboratorio (8ª edición, 2011). Todos los procedimientos se diseñaron de acuerdo con los principios de la Ley de Bienestar Animal del USDA (7 USC § 2,131-2,159), así como con el Código de Regulaciones Federales de EE. UU., Título 9, Parte 3. El protocolo del estudio fue aprobado por el Comité Institucional de Cuidado y Uso de Animales.
2.2 Animales
Se incluyeron en este estudio treinta y dos perros beagle sanos intactos (16 machos y 16 hembras), con una edad promedio de 18,4 meses ± 6,7 (rango de 11 a 32 meses) y un peso promedio de 9,9 kg ± 1,2 (rango de 8,2 a 12,8 kg) al inicio del estudio. Las perras fueron sometidas a pruebas de preñez antes de su inclusión en el estudio. Consulte la sección 3.4 Evaluación para obtener más información sobre las evaluaciones de salud. Todos los perros fueron alojados individualmente en jaulas de acero inoxidable, que se limpiaron diariamente y se desinfectaron al menos dos veces por semana. Se proporcionó un período de aclimatación de 14 días en la habitación de alojamiento. Todos los animales tuvieron acceso al contacto visual, auditivo y olfativo durante el estudio. Los perros se ejercitaron con sus respectivos grupos de tratamiento y sexos fuera de sus jaulas durante las tareas diarias de cría. Se mantuvo un ciclo de luz/oscuridad de 12 h durante todo el estudio. Todos los perros fueron alimentados con Parable Agriculture Custom 30-22 Dog Food, de Pro-Pet, LLC (alimento seco) en una ración diaria con agua ad libitum. A los animales se les administró una dosis diaria durante 90 días y luego se les observó durante 14 días adicionales sin dosis. Al final del estudio, los animales fueron devueltos a la colonia del centro de pruebas.
2.3 Diseño del estudio
Este estudio fue un diseño de grupos paralelos, aleatorizado, no cegado, controlado negativamente. Los perros fueron aleatorizados por diseño de bloques en 4 grupos. Se crearon cuatro grupos equilibrados por sexo clasificando a las hembras (n = 16) disminuyendo el peso, a los machos (n = 16) aumentando el peso y bloqueando a los animales en 8 grupos de 4 perros. Dentro de los bloques, los perros fueron asignados aleatoriamente a los grupos de tratamiento. A cada grupo de tratamiento se le administró una dosis oral diaria de: CBD de amplio espectro (artículo de prueba (TA) 1; grupo 2), combinación de CBD + CBG (TA2; grupo 3), combinación de CBD + CBDA (TA3; grupo 4) o aceite MCT (control; grupo 1) durante 90 días. Los perros fueron ayunados durante la noche después de retirar cualquier ración diaria restante y recibieron una ración normal por la mañana antes de la dosis. A los perros se les administró la dosis cuando estaban en estado de alimentación y las dosis se administraron por vía oral a través de una jeringa.
La dosis diaria de los materiales de prueba fue de 5 mg de cannabinoides totales/kg de peso corporal y el volumen del aceite MCT de control se correlacionó con el volumen dosificado en los grupos de tratamiento. TA1 era CBD de 80-90% de pureza, fabricado por Open Book Extracts, Roxboro, Carolina del Norte. TA2 era CBD + CBG en una proporción de 1:2, fabricado por Open Book Extracts. TA3 fue CBD + CBDA en una proporción de 1:1, fabricado por KND Labs, Lakewood, CO (Tabla 1). El artículo de control fue aceite MCT procedente de coco o palmiste, fabricado por Jedwards International, Inc., Braintree, MA.
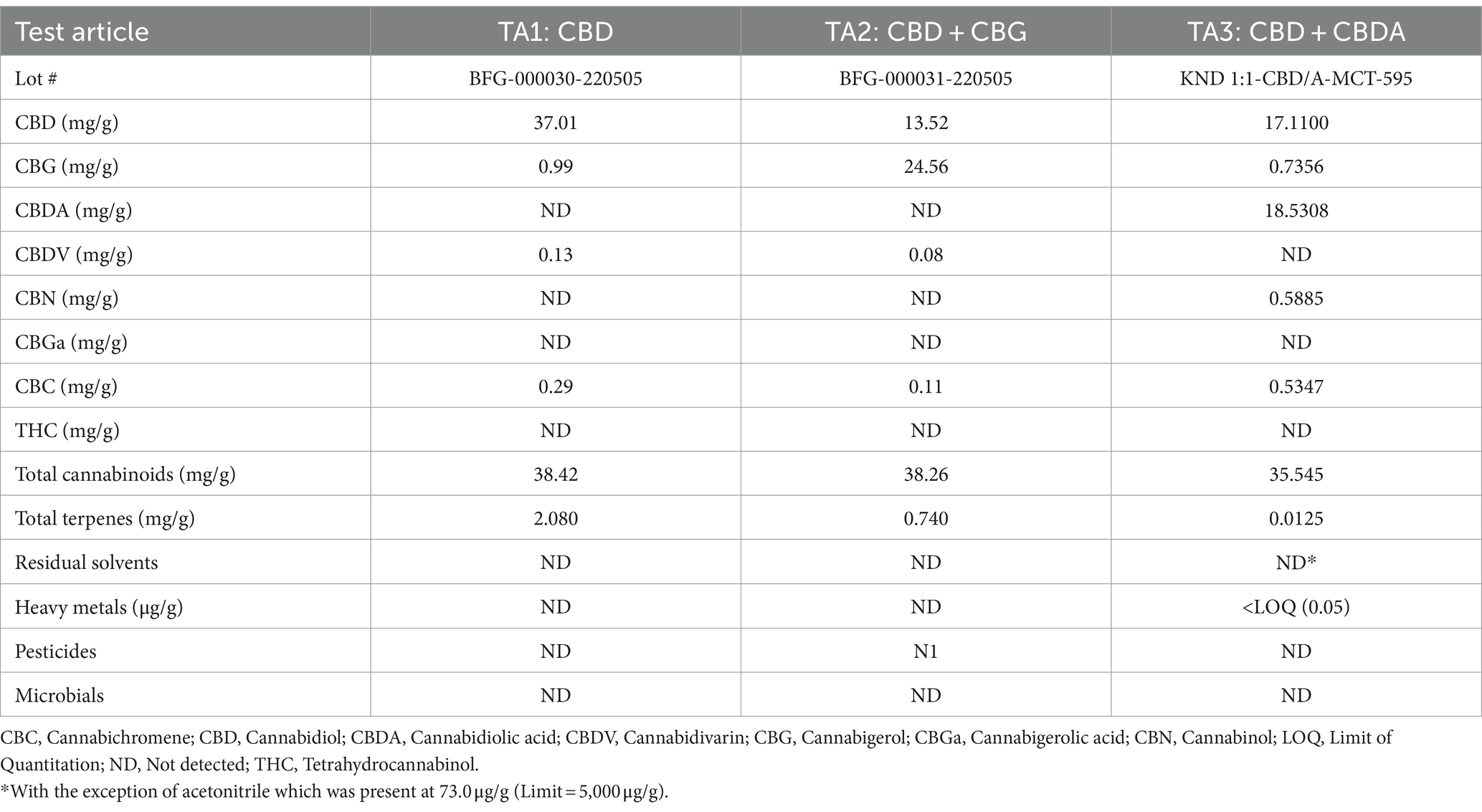 Tabla 1. Composición de los artículos de prueba de cannabinoides (AT) utilizados en el estudio de dosis repetidas de 90 días.
Tabla 1. Composición de los artículos de prueba de cannabinoides (AT) utilizados en el estudio de dosis repetidas de 90 días.
2.4 Evaluaciones
Se realizaron exámenes clínicos a todos los animales durante la aclimatación (entre el día −14 y −1), y los días 14, 28, 56, 90 y 104. El examen clínico incluyó, entre otros, signos vitales, membranas mucosas, ojos, motilidad, ganglios linfáticos, palpaciones abdominales, auscultación torácica, afección de la piel, comportamiento, sistema reproductivo, sistemas respiratorio, cardíaco, gastrointestinal y urinario. También se observó a todos los animales dos veces al día para detectar hábitos, color de la orina, color y consistencia de las heces, salivación, vómitos, lesiones cutáneas y cambios evidentes en el estado general. Los pesos corporales se midieron en los días -8, -1 y semanalmente durante todo el estudio. Se consideró que los eventos adversos (EA) eran cualquier observación desfavorable o no intencionada y que ocurría en cualquier momento durante el período de dosificación (después del día 0). Los eventos adversos graves (EAG) se definieron como EA que fueron fatales o potencialmente mortales.
El consumo de alimentos se determinó pesando los alimentos antes y después de alimentar a cada animal diariamente desde el día 7 hasta el final del estudio. Las muestras de sangre se recogieron en tubos separadores de suero (2 mL de sangre total), tubo de citrato de sodio (2,7 mL de sangre total) y tubo de EDTA (1,0 mL de sangre entera) de animales en ayunas en los días -9, 14, 28, 56, 90 y 104 para patología clínica. El suero del tubo separador se dejó reposar a temperatura ambiente durante 1 h antes de la separación. El plasma del tubo de citrato de sodio se separó después de centrifugar durante 10 minutos a temperatura ambiente, luego el plasma se separó y se congeló a -60 °C a -90 °C antes de transportarlo al laboratorio. El tubo de EDTA no fue procesado. Los análisis incluyeron parámetros de hematología, química sérica y coagulación. Los parámetros hematológicos fueron: eritrocitos, hemoglobina, leucocitos, MCH, MCHC, MCV, PCV y recuento de plaquetas. Los parámetros químicos séricos fueron ALT, albúmina, ALP, amilasa, AST, calcio, cloruro, colesterol, creatina quinasa, creatinina, globulina, GGT, glucosa, LDH, magnesio, fosfato, potasio, sodio, proteína total y nitrógeno ureico. Los análisis de química sérica se realizaron con un Roche Cobas c501 (Roche Diagnostics, Indianápolis, IN, EE. UU.) y los análisis hematológicos se completaron con un Siemens Advia 2120i (Siemens Medical Solutions USA, Inc. Malvern, PA USA). Los parámetros de coagulación fueron el tiempo de protrombina, el fibrinógeno y el tiempo de tromboplastina activada. Los parámetros de coagulación se analizaron con un Diagnostica Stago STA Compact Max (Diagnostica Stago S.A.S., Francia). La orina se recolectó mediante recolección pasiva por la mañana los días −8 /−7, 28, 90 y 104. Las muestras de orina se analizaron para determinar la turbidez, la gravedad específica, el pH, las proteínas, la glucosa, las cetonas, la sangre y la bilirrubina utilizando un Siemens Clinitek Advantus (Siemens Medical Solutions USA, Inc. Malvern, PA EE. UU.). Todas las muestras se enviaron para su análisis el día de la recolección y se analizaron en el plazo de 1 día.
2.5 Análisis estadístico
Los procedimientos de análisis estadístico se basaron en la Directriz GL43 de la Cooperación Internacional para la Armonización de los Requisitos Técnicos para el Registro de Medicamentos Veterinarios (VICH): Seguridad de los animales objetivo para los productos farmacéuticos veterinarios. Los datos basales se consideraron el último valor no faltante para cada parámetro antes de la dosificación. Los parámetros individuales de hematología y química sérica fueron reportados con estadística descriptiva: media, DE, coeficiente de variación, media geométrica, mediana, mínimo, máximo y número de observaciones (n) en ese grupo de tratamiento. Para identificar los valores de los parámetros que justifican una revisión clínica adicional, se definió un rango de referencia como los valores mínimo y máximo para cada parámetro al inicio del estudio en todos los grupos de perros del estudio actual. Debido a que la intención principal de este estudio fue evaluar la tolerabilidad de cada formulación, se calculó la magnitud de los cambios desde el inicio (CFB) hasta cada uno de los días posteriores a la administración para los parámetros de hematología y química sérica. Si un parámetro para cualquier individuo en cualquier día posterior a la administración estaba fuera del rango de referencia, el CFB para el grupo de tratamiento se comparó con el CFB para el grupo de control, y se verificó la significación del CFB dentro del grupo de tratamiento. Si todo lo anterior era estadísticamente significativo, se completaba una revisión clínica adicional. Dentro de cada tratamiento, los valores post-administración se compararon con los basales mediante ANOVA con el animal y el tiempo de observación como efectos para todos los parámetros de laboratorio. Las comparaciones entre tratamientos de CFB en cada día posterior a la administración se realizaron utilizando un modelo lineal mixto con la administración de AT como efecto fijo y el bloque de aleatorización como efecto aleatorio. Los resultados de todos los demás parámetros medidos u observados (exámenes clínicos, observaciones generales, peso corporal y consumo de alimentos) se informan descriptivamente y se tabulan cuando corresponde. El nivel de significación de todas las pruebas formales se fijó en el 5% y todas las pruebas fueron bilaterales. Para todos los análisis estadísticos se utilizó la versión 9.4 de SAS.
3 Resultados
Todos los animales completaron el estudio y no se informó somnolencia, EA o SAE durante el estudio. Se informó de hipersalivación esporádica en algunos animales en los tratamientos con CBD + CBG y CBD + CBDA, pero no se consideraron un EA. En todos los grupos, se notificaron hallazgos anormales e incidentales en algunos animales durante los exámenes visuales diarios o los exámenes clínicos más detallados. Se consideró que no estaban relacionados con la exposición al artículo de prueba o control y no tuvieron un impacto negativo en los resultados del estudio. La observación anormal más común fue la diarrea. No hubo diferencias estadísticamente significativas en el peso corporal entre los grupos control y tratamiento al inicio del estudio, y todos los grupos tuvieron un peso corporal medio más alto en el día 104 en comparación con los valores basales al inicio del estudio (Tabla suplementaria S1). La mayoría de los animales consumieron su ración diaria cada día y las diferencias en el consumo medio de alimentos dentro de todos los grupos fueron esporádicas y no se consideraron un hallazgo adverso (Tabla Suplementaria S2). Los datos de patología clínica (incluyendo hematología y química sérica) se presentan como media ± DE para cada punto de tiempo analizado. Se observaron cambios estadísticamente significativos dentro del grupo de tratamiento en algunos parámetros de hematología (Tabla Suplementaria S3) y química clínica (Tabla Suplementaria S4) evaluados en comparación con el valor basal. La mayoría de los cambios notificados en los parámetros hematológicos evaluados fueron transitorios, no presentaron signos clínicos concurrentes ni cambios correlativos en otros parámetros patológicos clínicos relacionados, o se encontraban dentro de los rangos de referencia y no se consideraron un efecto adverso clínicamente relevante del tratamiento con material de prueba. El día 14, un animal que recibió el tratamiento con CBD + CBDA tenía un valor de hemoglobina ligeramente por debajo del rango de referencia y en el día 56, un animal del mismo grupo de tratamiento tenía un valor de leucocitos ligeramente por encima del rango de referencia. Estos cambios no se consideraron clínicamente relevantes debido a la naturaleza transitoria y/o aislada de los cambios.
En cada momento, se calculó el CFB y se realizaron comparaciones entre los grupos control y tratamiento con respecto al CFB para determinar la significación. Se notificaron cambios estadísticamente significativos en los valores medios de CFB de una serie de parámetros de química clínica en los grupos de tratamiento con cannabinoides en comparación con los valores medios de CFB del grupo de control (Tabla suplementaria S5). Estos cambios fueron de baja magnitud y/o transitorios y/o estuvieron dentro de los rangos de referencia y/o no tuvieron cambios correlacionados en los parámetros relacionados, por lo que se determinó que no tenían relevancia clínica.
Algunos de los cambios en los parámetros de química clínica en animales individuales estaban fuera de los rangos de referencia y se discuten. El día 14, un animal en el grupo de tratamiento con CBD + CBDA tenía un valor de urea que estaba ligeramente por debajo del rango de referencia. Un animal en el grupo de tratamiento con CBD + CBG tenía un valor de potasio que estaba ligeramente por debajo del rango de referencia en los días de estudio 14 y 28, mientras que un animal en el grupo de tratamiento con CBD + CBDA tenía un valor de potasio que era ligeramente inferior al rango de referencia solo en el día 28 del estudio. Un animal en el grupo de tratamiento con CBD + CBDA tenía un valor de hierro inferior al rango de referencia en el día 28 del estudio y un nivel de sodio ligeramente superior al rango de referencia en el día 56 del estudio. Dos animales mostraron un aumento del valor de cloruro que estaba por encima del rango de referencia en el día 56 del estudio en el grupo de tratamiento con CBD + CBDA. El sodio se elevó a niveles por encima del rango de referencia en un animal en el grupo de tratamiento con CBD + CBDA en el día de estudio 56 y en un animal diferente en el mismo grupo el día de estudio 90, así como en un animal en el grupo de tratamiento con CBD + CBG en el día de estudio 90. En el día 104 del estudio, se encontró que los valores de creatinina quinasa estaban esporádicamente elevados por encima del rango de referencia, incluso en 2 animales del grupo de control. En el día 104 del estudio, la albúmina en un animal en el grupo de tratamiento con CBD + CBG estaba ligeramente por debajo del rango de referencia. Dada la baja magnitud de los cambios observados en los parámetros de química clínica, la naturaleza transitoria y la falta de cambios clínicos o clinicopatológicos correspondientes, los cambios descritos se consideraron sin relevancia clínica.
Durante el estudio se informaron cambios en ALT, ALP y GGT. Para los grupos de tratamiento, el BCF se comparó con el BCF para el grupo control para el día específico del estudio (Tabla 2). El único cambio estadísticamente significativo en los valores de GGT CFB se informó el día 28 del estudio en el grupo de tratamiento con CBD, que disminuyó menos que los controles concurrentes. Los valores medios de CFB para la ALP mostraron un aumento desde el inicio y fueron significativamente más altos en el grupo de tratamiento con CBD en los días de estudio 28, 56 y 90 y en el grupo de tratamiento con CBD + CBDA en el día 56 del estudio en comparación con los valores medios de CFB en el grupo de control, que disminuyeron desde el inicio. Dentro de estos grupos, todos los valores de FA estaban dentro de los rangos de referencia de laboratorio (rango de 7 a 115 U/L) con la excepción de un animal en el grupo de tratamiento con CBD en los días de estudio 28 (314 U/L), 56 (227 U/L) y 90 (205 U/L) y un animal en el grupo de tratamiento con CBD + CBDA en el día de estudio 56 (123 U/L) en el que los valores estaban por encima del rango de referencia. De los valores que estaban fuera del rango de referencia superior para el único animal en el grupo de tratamiento con CBD, dos de los tres estaban por debajo de un aumento del doble y el valor restante alcanzó un máximo de 314 U/L el día 28 del estudio, pero luego disminuyó en cada una de las siguientes evaluaciones y estuvo dentro del rango de referencia después del período de recuperación de 14 días. El valor para el único otro animal con un valor por encima del rango de referencia se produjo el día de estudio 56 y fue inferior a un aumento del doble, y los valores estaban dentro del rango de referencia en la siguiente evaluación el día de estudio 90. Los valores medios de ALT de CFB para todos los grupos de tratamiento disminuyeron desde el inicio, mientras que en el grupo de control, los valores disminuyeron desde el inicio el día 14 y aumentaron desde el inicio en todos los demás momentos. Esto resultó en un CFB significativo en el grupo de tratamiento con CBD + CBG en los días de estudio 28, 56 y 104, en comparación con el grupo control, sin embargo, ninguno de los valores medios estuvo fuera del rango de referencia en ningún momento (Tabla suplementaria S4).
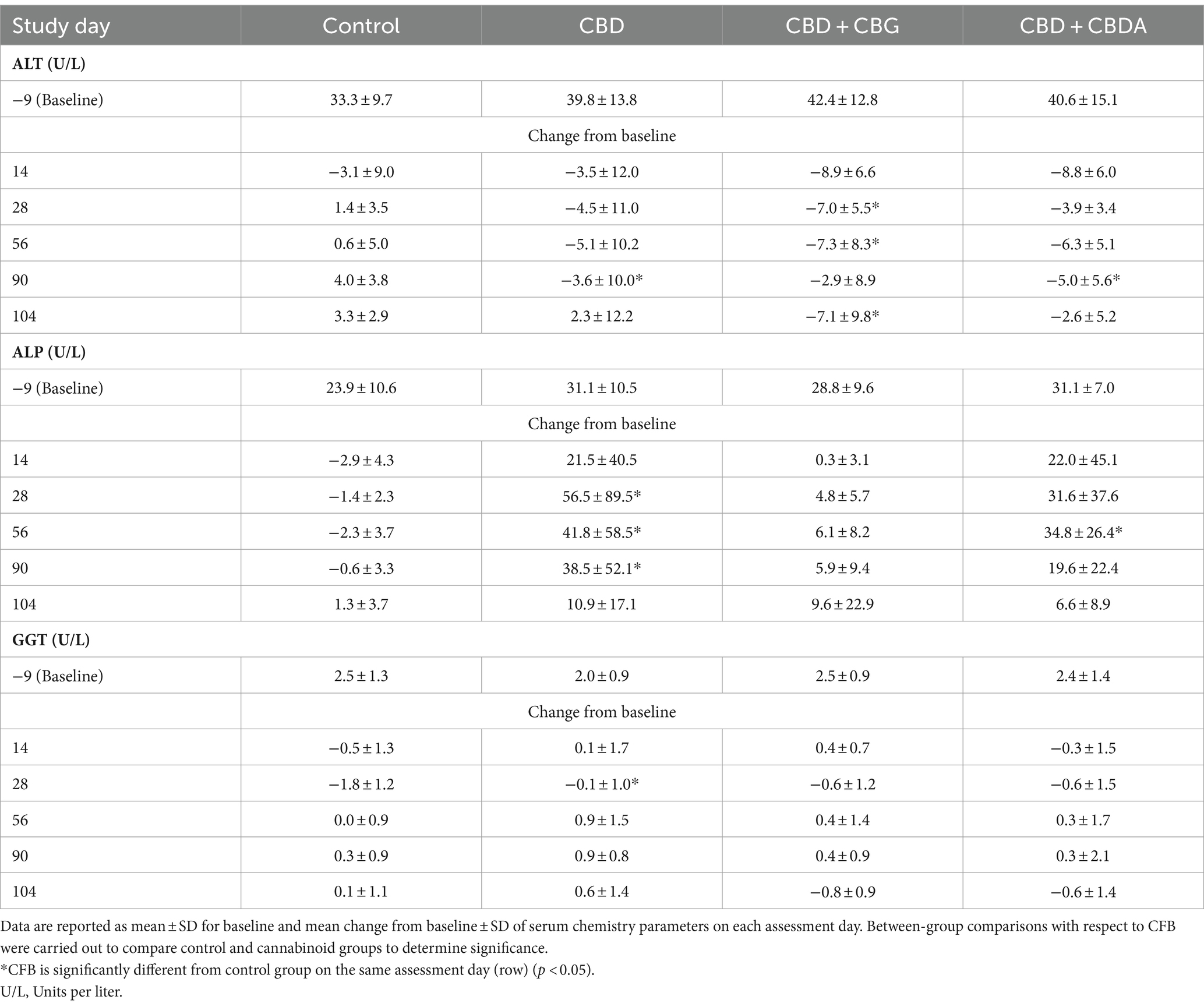 Tabla 2. Cambio basal y medio de los resultados séricos basales (CFB) de ALT, ALP y GGT para beagles sanos tratados por vía oral con aceite de triglicéridos de cadena media (MCT) (Control; n = 8) o 5 mg/kg de peso corporal/día de CBD (n = 8), CBD + CBG (n = 8) o CBD + CBDA (n = 8) durante 90 días, seguidos de 14 días sin dosis.
Tabla 2. Cambio basal y medio de los resultados séricos basales (CFB) de ALT, ALP y GGT para beagles sanos tratados por vía oral con aceite de triglicéridos de cadena media (MCT) (Control; n = 8) o 5 mg/kg de peso corporal/día de CBD (n = 8), CBD + CBG (n = 8) o CBD + CBDA (n = 8) durante 90 días, seguidos de 14 días sin dosis.
Hubo cambios estadísticamente significativos en algunos de los parámetros de coagulación evaluados, sin embargo, todos los valores medidos estuvieron dentro de los rangos de referencia, excepto para un animal en el grupo de tratamiento con CBD, que tenía un valor elevado de fibrinógeno que se consideró clínicamente irrelevante (Tabla suplementaria S6). La orina se recolectó antes de la administración y luego en los días de estudio 28, 90 y 104 y no se informaron cambios clínicamente relevantes en ninguno de los grupos de tratamiento en comparación con los controles. La gravedad específica y el pH de la orina se resumen en la Tabla Suplementaria S7. No se registraron anomalías significativas en ninguno de los parámetros de análisis de orina evaluados. Todos los animales fueron devueltos a la colonia del sitio de prueba al final del estudio.
4 Discusión
En el estudio actual, la exposición diaria a CBD, CBD + CBG y CBD + CBDA a 5 mg/kg de peso corporal de cannabinoides totales durante 90 días consecutivos fue bien tolerada. Los cambios significativos observados en algunos parámetros de patología clínica fueron transitorios, dentro de los rangos de referencia, de baja magnitud, presentes en un número reducido de animales o de naturaleza esporádica y todos se consideraron no clínicamente relevantes. La variabilidad biológica se discute en Flatland et al., donde los autores concluyeron que un solo valor clínico debe interpretarse dentro de tres aspectos de la variación: individual, grupal y método analítico (21). En el presente estudio, la revisión de la relevancia clínica se determinó utilizando un rango de referencia establecido por los valores basales de los animales en el estudio, como se describió anteriormente. Si un parámetro de cualquier individuo en cualquier día posterior a la administración caía fuera de este rango de referencia, se comparaba el CFB para el grupo de tratamiento con el CFB para el grupo de control, y se comprobaba la significación del CFB dentro del grupo de tratamiento. Si todo lo anterior era estadísticamente significativo, se completaba una revisión clínica adicional. Siguiendo este método, la variación individual y grupal se tiene en cuenta a través de la determinación del rango de referencia y poniendo énfasis en el CFB como indicativo de un cambio relacionado con el tratamiento, pero solo si el CFB del grupo de tratamiento era diferente del grupo de control CFB para cualquier parámetro. La variación analítica no es aplicable en este estudio, ya que todas las mediciones se realizaron en las mismas condiciones que como parte de un estudio de investigación, y no en un entorno clínico donde la variación entre el equipo, el personal, etc. podría ser notable.
Los resultados de este estudio se correlacionan con otros estudios realizados con CBD en perros sanos que han concluido que el CBD, el CBG y el CBD con CBDA son bien tolerados. Bradley et al. (22) realizaron un estudio aleatorizado, controlado con placebo y ciego con CBD de amplio espectro en perros sanos. Los perros tratados con CBD recibieron 4 mg/kg de peso corporal/día durante 6 meses sin ningún efecto adverso sobre la salud y el bienestar. Se informó de una elevación transitoria de la FA en aproximadamente la mitad de los perros tratados con CBD, que volvieron a la línea de base al final del período de recuperación de 4 semanas. La FA ósea se evaluó para determinar la fuente tisular de la FA y se elevó significativamente en comparación con los controles al final de las 26 semanas de tratamiento, con una correlación positiva significativa y fuerte entre la FA y la FA ósea. Basándose en estos y otros resultados, los autores concluyeron que el aumento de la FA no era un biomarcador clínicamente relevante de deterioro de la salud hepática en perros sanos después del tratamiento con CBD (22). Vaughn et al. (23) también evaluaron la seguridad del CBD en perros sanos en un ensayo de dosis repetidas de 28 días. En el estudio aleatorizado, ciego y controlado con placebo, los perros sanos recibieron un placebo o 1, 2, 4 o 12 mg de CBD/kg de peso corporal/día, que fue bien tolerado. Todos los EA informados fueron leves y autolimitados y ocurrieron en todos los grupos, incluido el grupo placebo. Se notificó un aumento de la FA sérica por encima del límite superior de referencia en los grupos de 2, 4 y 12 mg/kg de peso corporal/día, que comenzó a disminuir después de 2 semanas de la administración, pero estos animales no tuvieron ningún aumento concomitante en otros marcadores hepáticos. Al igual que en el estudio actual, la hipersalivación se observó con mayor frecuencia en los grupos tratados con CBD, pero esto no se consideró un EAG en ninguno de los estudios (23). Deabold et al. (8) evaluaron la seguridad y los efectos adversos de un producto de cáñamo que contiene CBD en perros sanos durante un período de dosificación de 12 semanas. A los perros se les administró 2 mg de CBD/kg de peso corporal/día y las evaluaciones de química sérica y hematología no mostraron cambios clínicamente relevantes durante el estudio (8).
En un estudio realizado por Amstutz et al. (14), se probaron CBG y CBGA en perros alimentados y en ayunas (n = 6 beagles machos intactos) a 2 mg/kg de peso corporal dos veces al día durante 2 semanas. El estado de ayuno se probó inicialmente durante dos semanas, seguido de un lavado de dos semanas y luego se administró tratamiento en el estado alimentado durante dos semanas. El primer día de tratamiento en ambos estados, se completó un análisis farmacocinético de 24 horas de los cannabinoides séricos. Los autores informaron que no hubo diferencias estadísticamente significativas en los parámetros farmacocinéticos entre los estados alimentados y en ayunas, sin embargo, señalan que la concentración sérica de CBG tendió a ser mayor en el estado de ayuno. La FA sérica disminuyó tanto en estado alimentado como en ayunas en la semana 2, lo que es contrario a otros estudios sobre cannabinoides. Los autores sospechan que esto puede estar relacionado con las diferencias en el efecto del CBG y el CBD sobre el citocromo P450, aunque no se discuten más pruebas. El único EA reportado fue el vómito de un perro durante la fase de ayuno sin otros síntomas clínicos. Los autores concluyeron que el CBG y el CBGA a 2 mg/kg de peso corporal dos veces al día fueron bien tolerados en perros beagle sanos alimentados y en ayunas (14). En el estudio actual, el elemento de prueba contenía CBD + CBG en una proporción de 1:2. Aunque no es clínicamente relevante, los grupos de tratamiento con CBD y CBD/CBDA mostraron cada uno al menos una medición que fue estadísticamente diferente del grupo de control para la ALP, mientras que el grupo de CBD/CBG no difirió del grupo de control.
Dos estudios evaluaron productos de cannabinoides mixtos de CBD/CBDA. Tittle et al. (13) evaluaron la farmacocinética de un extracto de CBD/CBDA que también incluía un bajo nivel de THC/THCA cuando se dosificaba en aceite frente a una cápsula de gel. A los beagles (7 machos y una hembra) se les administró una dosis de 2 mg/kg de peso corporal dos veces al día con la comida. El tratamiento inicial fue el producto cannabinoide en una cápsula. Los parámetros farmacocinéticos se midieron durante 24 h el primer día de administración y durante 7 días posteriores, seguidos de un período de lavado de 2 semanas antes del siguiente tratamiento (cannabinoides en aceite) y mediciones farmacocinéticas durante 7 días. No se evaluaron criterios de valoración de seguridad, sin embargo, se observó que los EA eran leves e incluían vómitos, diarrea, lamidos y sacudidas de cabeza. También se observaron vómitos y diarrea en tres perros durante el período de lavado (13). Wakshlag et al. (11) evaluaron un producto de CBD/CBDA que contenía una pequeña cantidad de THC y THCA, así como CBGA y cannabicromeno medibles. La intención de este estudio fue evaluar dos vehículos de aceite diferentes y un formato de masticación blanda con tratamientos de 2 semanas seguidos de períodos de lavado de 3 semanas, lo que resultó en un ensayo de 12 semanas. Seis hembras de beagle intactas recibieron una dosis de 2 mg/kg de peso corporal (aceite) o 2,0-2,3 mg/kg de peso corporal (masticable suave) de CBD/CBDA dos veces al día. Los criterios de valoración de seguridad medidos incluyeron ALP, AST y ALT, albúmina, bilirrubina total, colesterol y glucosa. No se observaron cambios en estos parámetros durante el tratamiento ni entre tratamientos sucesivos, y no se reportaron alteraciones en el comportamiento o la salud durante el ensayo (11). Una diferencia clave en el elemento de prueba para estos estudios en comparación con el estudio actual fue la presencia de THC en un nivel bajo, sin embargo, al igual que en el estudio actual, no se informó de EA relacionado con la administración de CBD/CBDA.
Varios estudios evaluaron la eficacia clínica del CBD y otros cannabinoides en enfermedades y condiciones de comportamiento. Es posible que los criterios de valoración evaluados en estos estudios no estén dirigidos específicamente a la seguridad, pero pueden proporcionar información valiosa sobre la tolerabilidad. Por ejemplo, se han realizado estudios para evaluar el efecto analgésico del CBD en perros con artrosis espontánea a diferentes niveles de dosis y duraciones, así como en perros que se sometieron recientemente a una cirugía ortopédica. Los perros recibieron hasta 5 mg/kg de peso corporal por vía oral durante 4 semanas después de la cirugía, lo que demostró ser bien tolerado (12, 24-27). Se evaluó la eficacia del tratamiento con CBD-CBDA en las crisis epilépticas refractarias, la epilepsia idiopática intratable, la dermatitis atópica y la respuesta inmunitaria (28-31). También se evaluó el efecto del CBD en condiciones de comportamiento como la agresión hacia el personal del refugio de animales, la ansiedad por separación y los viajes en automóvil, el miedo inducido por el ruido y la actividad voluntaria (32-35). En todos los estudios, se informaron pocos EA menores o nulos y no se informó ningún EAG que pudiera atribuirse al tratamiento.
En los Estados Unidos, los «suplementos para mascotas», también llamados productos para la salud animal en forma de dosificación, son medicamentos para animales no aprobados y están disponibles para los consumidores, ya sea a través de regulaciones a nivel estatal o a discreción de la FDA (3). Los productos que contienen CBD se venden en cantidades sustanciales y los datos de vigilancia posteriores a la comercialización respaldan la seguridad de los cannabinoides administrados por vía oral. En 2022, se vendieron 274.129.622 administraciones, en perros, de cáñamo y productos derivados del cáñamo, según determinó el Consejo Nacional de Suplementos Animales (NASC). La NASC es una asociación comercial sin fines de lucro 501 (c) (6) que representa a la mayor parte de la industria que vende productos que contienen cáñamo, compuestos derivados del cáñamo y cannabinoides en los EE. UU. La NASC requiere que todas las empresas miembros que comercializan productos ingresen la información del producto, carguen las etiquetas de los productos y reporten EA mensualmente a través de su Sistema de Notificación de Eventos Adversos (NAERS,™ por sus siglas en inglés), que es una poderosa herramienta para la vigilancia posterior a la comercialización. Las empresas individuales también están obligadas a registrar, informar y evaluar la EA mensualmente. Tanto los EA graves como los no graves se notifican en el sistema NAERS™. Cada EA se evalúa y se le asigna una puntuación de riesgo utilizando el formulario de notificación de eventos adversos de la NASC, que también se mantiene en el sistema NAERS™.
En el sistema NAERS™, AE y SAE se definen de la siguiente manera:
• Evento adverso: «Un evento adverso es un tipo de queja en el que un paciente ha sufrido cualquier efecto físico negativo o problema de salud que PUEDE estar relacionado o asociado con el uso del producto».
• Evento adverso grave: «Un evento adverso con un efecto incapacitante transitorio (es decir, que hace que el animal no pueda funcionar normalmente incluso durante un corto período de tiempo, como una convulsión) o un efecto no transitorio (es decir, permanente) en la salud. Los vómitos transitorios o la diarrea no constituyen eventos adversos graves. Un supuesto Evento Adverso Grave requiere seguimiento con un veterinario. Un diagnóstico de lego no constituye un Evento Adverso Grave».
Los datos de cada empresa se agregan, se procesan estadísticamente y se compilan en un Informe de riesgo de ingredientes que proporciona información relacionada con los ingredientes con los EA notificados, tanto graves como no graves. Las tasas de eventos se informan en función del número de administraciones en cada contenedor vendido y los datos de las unidades se actualizan trimestralmente.
Los datos de los productos de los miembros de la NASC también se utilizaron para determinar el nivel de dosificación utilizado en el estudio actual, 5 mg/kg de peso corporal de perros, que se basa en productos reales actualmente en el mercado. Sobre la base de la información del Informe de Riesgo de Ingredientes, se determinó que las dosis medias y medias ponderadas para todos los productos de cáñamo y derivados del cáñamo eran de 6,97 y 9,91 mg/kg de peso corporal. En comparación, la media directa y las dosis medias ponderadas para todos los productos de CBD fueron de 0,83 mg/kg y 0,67 mg/kg (máximo 2,10 mg/kg). Esto proporciona información importante que es difícil de determinar a partir de encuestas a consumidores. Alvarenga et al. (1) informaron que cuando se les preguntó sobre la dosis, los encuestados dieron respuestas empíricas de volumen sin concentración o falta de una unidad de medida, lo que hizo inviable el análisis y la notificación (1).
El uso de CBD en forma de dosificación de productos para la salud animal ha ido creciendo; sin embargo, la seguridad del uso a largo plazo ha sido cuestionada y se ha considerado deficiente (8, 22). Una revisión reciente de la literatura actual disponible para el uso de CBD en perros documentó 19 estudios de tolerabilidad, 10 estudios farmacocinéticos con productos orales de CBD, siete ensayos clínicos para la eficacia en el control del dolor, tres para la epilepsia, tres para trastornos del comportamiento y tres para enfermedades de la piel (20) Las limitaciones de este cuerpo de evidencia son que el número de tipos de extractos, La población de estudio y la duración del uso están limitadas por la necesidad. La vigilancia posterior a la comercialización de EA y SAE en la base de datos NAERS™ ayuda en la evaluación de la seguridad del CBD a través de datos de uso en el mundo real y respalda la conclusión de los estudios mencionados anteriormente de que los productos de CBD son bien tolerados.
La información recopilada del informe del sistema NAERS™ para todos los productos que contienen cáñamo y compuestos derivados del cáñamo muestra que la tasa general de notificación por millón de administraciones vendidas de 2010 a 2023 (al 20 de noviembre de 2023) para EA y SAE en perros es de 2,19 y 0,01, respectivamente, de más de mil millones de administraciones (Tabla 3). Cuando se limita a los productos que especifican CBD, las administraciones totales en perros para 2015-2023 (al 18 de noviembre de 2023) fueron de 86.081.473, con tasas de EA y SAE de 1,61 y 0,02 por millón de administraciones, respectivamente.
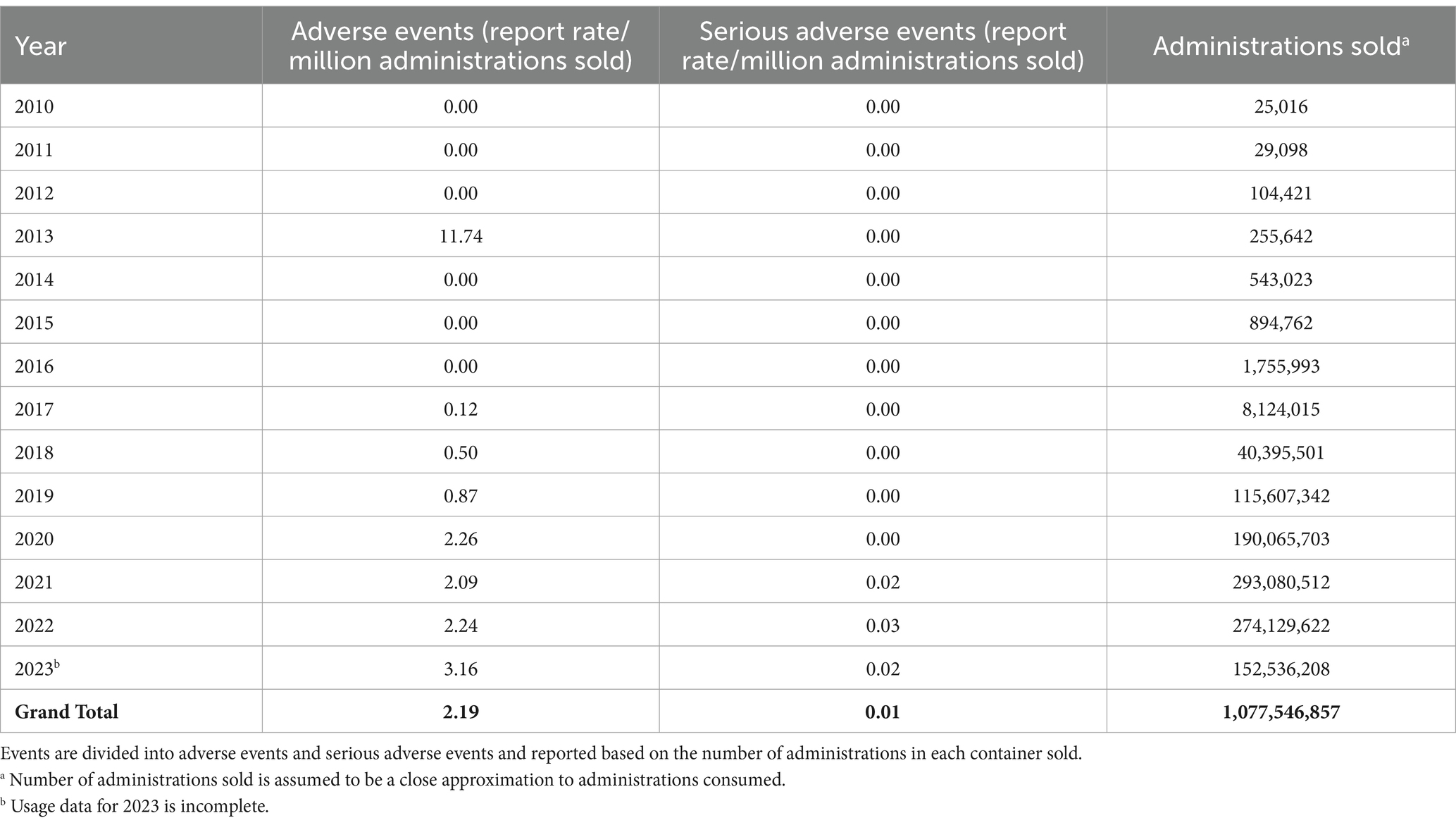 Tabla 3. Informe de riesgo de ingredientes del Consejo Nacional de Suplementos Animales (NASC) para cáñamo y compuestos derivados del cáñamo en perros a partir del 20 de noviembre de 2023.
Tabla 3. Informe de riesgo de ingredientes del Consejo Nacional de Suplementos Animales (NASC) para cáñamo y compuestos derivados del cáñamo en perros a partir del 20 de noviembre de 2023.
Para la interpretación de estos resultados, es importante tener en cuenta que las restricciones reglamentarias sobre las declaraciones en las etiquetas afectan a la clasificación de los productos zoosanitarios en forma de dosificación en el sistema NAERS™, ya que la clasificación de los insumos está determinada por la etiqueta del productor o minorista. Un producto que contiene CBD puede etiquetarse solo como cáñamo o puede incluir un calificativo como amplio espectro o espectro completo, y no todos los productos etiquetados como cáñamo contienen CBD. NASC proporciona orientación a sus miembros de que un extracto de cáñamo de amplio espectro contiene «algunos o todos los compuestos que se encuentran naturalmente en la planta, donde el THC se ha procesado a niveles inferiores al 0,3%» y un extracto de espectro completo contiene «todos los compuestos que se encuentran naturalmente en la planta, incluidos, entre otros, terpenos, cannabinoides y THC, donde el nivel de THC del cultivar se cultiva o diluye para ser inferior al 0,3%». Las administraciones notificadas para productos de cáñamo de amplio espectro para perros fueron 84.306.219 y para productos de cáñamo de espectro completo para perros fueron 287.828.119. El informe de cáñamo y derivados del cáñamo incluye EA para productos de cáñamo de amplio espectro y espectro completo, pero las tasas de EA y SAE cuando se calculan por separado de la categoría más grande son similares. Los productos de cáñamo de amplio espectro tuvieron una tasa de AE y SAE de 2,40 y 0,02 por millón de administraciones, respectivamente, y los productos de espectro completo tuvieron una tasa de AE y SAE de 2,83 y 0,03 por millón de administraciones, respectivamente. Efectivamente, las administraciones totales calculadas para el cáñamo y los derivados del cáñamo sobreestiman la exposición posterior a la comercialización de los perros a los productos de CBD, y las administraciones totales de CBD subestiman la exposición posterior a la comercialización. Sobre la base de esta información, es razonable suponer que la tasa de EA se sitúa entre 1,6 y 2,8 por millón de administraciones.
También es importante separar los EA de los productos para la salud animal de la toxicosis aguda debida a los productos de marihuana (Cannabis sativa L. con un contenido de THC superior al 0,3% en peso seco; definido en 21 CFR 1308.11) destinados al consumo humano. Howard-Azzeh et al. analizaron los factores que influyen en la intoxicación por cannabis de perros en los Estados Unidos entre 2009 y 2014 (4). Los autores informaron que un promedio del 1,12% de todas las llamadas al Centro de Control de Envenenamiento de Animales se debieron al consumo de cannabis y concluyeron que a medida que los productos de cannabis estaban más disponibles para el consumo humano, la tasa de envenenamiento en perros aumentó.
La baja tasa de EA reportada en el sistema NAERS™ está respaldada por los datos de la encuesta a los consumidores (1). De los encuestados que le habían dado CBD a su mascota, el 45,3% indicó que no observó efectos secundarios. El resto de las opciones de efectos secundarios incluyeron letargo y somnolencia como los más comunes (24,2%, n = 116 cada uno, los participantes podían elegir más de una respuesta). El <2% de los encuestados indicó otros efectos secundarios. En 2016, una encuesta similar de dueños de mascotas en los EE. UU. a través de un enlace en el sitio web de una empresa de productos de cáñamo para mascotas informó que el 58,8% de los encuestados (n = 631) estaban usando actualmente un producto de cáñamo para su perro. En esta encuesta, los dueños de mascotas informaron que la sedación fue el efecto significativo más común (53/278 encuestados informaron que la sedación era un «efecto significativo» frente a 4/278 que informaron que «no tenían efecto», sin embargo, 190/278 informaron este efecto como «NA o no lo saben»). Aunque se informaron otros efectos secundarios, los autores informaron que el gasto y la ineficacia fueron las razones más comunes para la interrupción de un producto (36).
La variación en la composición y calidad de los productos de cáñamo podría ser responsable de las diferencias en la eficacia y la seguridad. Los extractos botánicos preparados a partir del cáñamo contienen una serie de fitoquímicos, incluidos cannabinoides y terpenos, cuyos niveles pueden variar entre extractos y pueden tener una serie de bioactividades potenciales (37). Los extractos son susceptibles a problemas con la calidad del producto, como el incumplimiento de las buenas prácticas de fabricación, el control de calidad deficiente, la falta de detección de metales pesados, la contaminación de otros productos vegetales, etc. En un análisis reciente de productos cannabinoides específicos para mascotas, las concentraciones de CBD oscilaron entre 0 y 66 mg/ml (incluyendo solo las formas de administración de aceite), lo que representó entre el 0 y el 154% de la concentración declarada en la etiqueta. Además, se encontró CBDA en altos niveles en dos productos (38). Si bien los problemas de control de calidad están fuera de la intención de este estudio, la falta de productos estandarizados es un obstáculo importante para evaluar la seguridad de los productos de CBD y respalda la necesidad de una vigilancia posterior a la comercialización.
Los datos de vigilancia posterior a la comercialización y los sistemas que proporcionan una vigilancia continua son fundamentales para controlar el riesgo del uso de productos cannabinoides en animales. Incluso los estudios clínicos mejor definidos y cuidadosamente realizados no pueden duplicar todos los escenarios posibles o posibles ocurrencias negativas debido al uso de productos en el mercado más amplio. El estudio actual utiliza dosis clínicamente relevantes en un estudio de tolerabilidad para proporcionar datos de referencia de apoyo para la evaluación de los cannabinoides en perros domésticos. Una limitación de este estudio es que solo se utiliza un único nivel de dosis para cada producto, aunque el nivel de dosis se eligió para que fuera representativo del uso real de suplementos de cannabinoides en perros. Para los médicos y los dueños de mascotas, la información sobre la tolerabilidad de diferentes combinaciones de cannabinoides puede respaldar el uso informado de estos productos. Este estudio contribuye a un conjunto de datos que demuestran la seguridad de los cannabinoides, que pueden utilizarse para respaldar futuras investigaciones en animales propiedad de clientes.
Los resultados del estudio actual indican que el CBD, el CBD + CBG y el CBD + CBDA en las proporciones y dosis utilizadas fueron bien tolerados cuando se administraron dosis a beagles machos y hembras sanos durante 90 días consecutivos. Estas conclusiones clínicamente determinadas también están respaldadas por los datos de NAERS™, que es el sistema más avanzado del mundo para este tipo de productos administrados a animales de compañía (específicamente animales no destinados a su uso en la cadena alimentaria humana).
Sobre la base de los datos disponibles, los autores concluirían que las sustancias no suponen un riesgo significativo para los perros en el uso a largo plazo.
Declaración de disponibilidad de datos
Las contribuciones originales presentadas en el estudio están incluidas en el artículo/Material complementario, las consultas posteriores pueden dirigirse al autor correspondiente.
Declaración ética
El estudio en animales fue aprobado por el Comité Institucional de Cuidado y Uso de Animales de ClinVet USA LLC, un centro acreditado por la Asociación para la Evaluación y Acreditación del Cuidado de Animales de Laboratorio. El estudio se llevó a cabo de acuerdo con la legislación local y los requisitos institucionales.
Contribuciones de los autores
WB: Conceptualización, Obtención de Fondos, Recursos, Redacción – Revisión y Edición. MD: Metodología, Administración de proyectos, Supervisión, Validación, Redacción – borrador original, Redacción – revisión y edición. KV: Administración de proyectos, redacción, revisión y edición. JK-N: Escritura – borrador original.
Financiación
El/los autor/es declaran/n que se recibió apoyo financiero para la investigación, autoría y/o publicación de este artículo. Este estudio fue financiado por el Consejo Nacional de Suplementos Animales (NASC), Sun City West, AZ, EE. UU.
Reconocimientos
Los autores desean agradecer al personal de ClinVet International (Pty) Ltd. que llevó a cabo el estudio. Los autores también desean agradecer a KND Labs (Lakewood, CO, EE. UU.) y Open Book Extracts (Roxboro, Carolina del Norte, EE. UU.) por proporcionar los extractos botánicos utilizados en el estudio. También nos gustaría agradecer a Dan McChesney, Director (jubilado) del Centro de Medicina Veterinaria de la FDA, Director de Vigilancia y Cumplimiento.
Conflicto de intereses
MD, KV y JK-N recibieron una compensación de la NASC por sus actividades en la finalización del estudio y la redacción del manuscrito.
El autor restante declara que la investigación se llevó a cabo en ausencia de relaciones comerciales o financieras que pudieran interpretarse como un potencial conflicto de intereses.
Nota del editor
Todas las afirmaciones expresadas en este artículo son únicamente las de los autores y no representan necesariamente las de sus organizaciones afiliadas, ni las del editor, los editores y los revisores. Cualquier producto que pueda ser evaluado en este artículo, o afirmación que pueda ser hecha por su fabricante, no está garantizado ni respaldado por el editor.
Material complementario
El material complementario para este artículo se puede encontrar en línea en: https://www.frontiersin.org/articles/10.3389/fvets.2024.1349590/full#supplementary-material
Referencias
1. Alvarenga, IC , MacQuiddy, B , Duerr, F , Elam, LH y McGrath, S . Evaluación del uso de cannabidiol en mascotas según una encuesta nacional en EE. UU. J Pequeña Anim Pract. (2023) 64:513–21. doi: 10.1111/jsap.13619
2. Kogan, L , Schoenfeld-Tacher, R , Hellyer, P y Rishniw, M . El conocimiento, la experiencia y la percepción de los veterinarios estadounidenses sobre el uso del cannabidiol para las afecciones médicas caninas. Front Vet Sci. (2019) 5:1–11. doi: 10.3389/fvets.2018.00338
Resumen de PubMed | Texto completo de Crossref | Google Académico
3. De Briyne, N , Holmes, D , Sandler, I , Stiles, E , Szymanski, D , Moody, S, et al. Cannabis, aceites de cannabidiol y tetrahidrocannabinol: ¿qué deben saber los veterinarios? Animales. (2021) 11:1–19. doi: 10.3390/ani11030892
Resumen de PubMed | Texto completo de Crossref | Google Académico
4. Howard-Azzeh, M , Perla, DL , Swirski, A , Ward, M , Hovdey, R , O’Sullivan, TL, et al. El impacto de la legislación estatal sobre el cannabis, las características socioeconómicas a nivel de condado y a nivel de perro en las intoxicaciones por cannabis reportadas de perros de compañía en los EE. UU. (2009-2014). PLoS Uno. (2021) 16:e0250323. doi: 10.1371/journal.pone.0250323
Resumen de PubMed | Texto completo de Crossref | Google Académico
5. Marx, TK , Reddeman, R , Clewell, AE , Endres, JR , Beres, E , Vertesi, A, et al. Evaluación de la genotoxicidad y toxicidad subcrónica de un extracto fluido supercrítico de las partes aéreas del cáñamo. J Toxicol. (2018) 2018:1–26. doi: 10.1155/2018/8143582
Resumen de PubMed | Texto completo de Crossref | Google Académico
6. Dziwenka, M , Coppock, R , McCorkle, A , Palumbo, E , Ramírez, C y Lerner, S . Evaluación de la seguridad de un extracto de cáñamo mediante estudios de genotoxicidad y toxicidad oral por dosis repetidas en ratas Sprague-Dawley. Toxicol Rep. (2020) 7:376–85. doi: 10.1016/j.toxrep.2020.02.014
Resumen de PubMed | Texto completo de Crossref | Google Académico
7. Dziwenka, M , Dolan, L y Mitchell, J . Seguridad toxicológica del aceite de cáñamo Voho; Un extracto fluido supercrítico de las partes aéreas del cáñamo. PLoS Uno. (2021) 16:e0261900. doi: 10.1371/journal.pone.0261900
Resumen de PubMed | Texto completo de Crossref | Google Académico
8. Deabold, KA , Schwark, WS , Lobo, L y Wakshlag, JJ . Farmacocinética de dosis única y evaluación preliminar de la seguridad con el uso de nutracéuticos de cáñamo ricos en CBD en perros y gatos sanos. Animales. (2019) 9:1–13. doi: 10.3390/ani9100832
Resumen de PubMed | Texto completo de Crossref | Google Académico
9. Alvarenga, IC , Gustafson, D , Bancos, K , Wilson, K y McGrath, S . Determinación plasmática de cannabidiol y farmacocinética realizada al principio, medio y final de la suplementación a largo plazo de un aceite de cáñamo de amplio espectro a perros adultos sanos. Front Vet Sci. (2023) 10:1–7. doi: 10.3389/fvets.2023.1279926
Resumen de PubMed | Texto completo de Crossref | Google Académico
10. Della Rocca, G , Paoletti, F , Conti, MB , Galarini, R , Chiaradia, E , Sforna, M, et al. Farmacocinética del Cannabidiol después de la administración única oral y transmucosa oral en perros. Front Vet Sci. (2022) 9:1–9. doi: 10.3389/fvets.2022.1104152
Resumen de PubMed | Texto completo de Crossref | Google Académico
11. Wakshlag, JJ , Schwark, WS , Deabold, KA , Talsma, BN , Cital, S , Lyubimov, A, et al. Farmacocinética del cannabidiol, ácido cannabidiólico, Δ9-tetrahidrocannabinol, ácido tetrahidrocannabinólico y metabolitos relacionados en suero canino después de la dosificación con tres formas orales de extracto de cáñamo. Front Vet Sci. (2020) 7:1–12. doi: 10.3389/fvets.2020.00505
Resumen de PubMed | Texto completo de Crossref | Google Académico
12. Apuesta, LJ , Boesch, JM , Frye, CW , Schwark, WS , Mann, S , Wolfe, L, et al. Farmacocinética, seguridad y eficacia clínica del tratamiento con Cannabidiol en perros con artrosis. Front Vet Sci. (2018) 5:1–9. doi: 10.3389/fvets.2018.00165
Resumen de PubMed | Texto completo de Crossref | Google Académico
13. Título, DJ , Wakshlag, JJ , Schwark, WS , Lyubimov, A , Zakharov, A y Gómez, B . Farmacocinética en estado estacionario de veinticuatro horas y una semana de cannabinoides en dos formulaciones de cannabidiol y cáñamo rico en ácido cannabidiólico en perros. Med Res Arch. (2022) 10:1–10. doi: 10.18103/mra.v10i7.2907
14. Amstutz, K , Schwark, WS , Zakharov, A , Gómez, B , Lyubimov, A , Ellis, K, et al. Administración oral única y crónica de cannabigerol y extracto de cáñamo rico en ácido cannabigerólico en perros alimentados y en ayunas: efecto fisiológico y evaluación farmacocinética. J Vet Pharmacol Ther. (2022) 45:245–54. doi: 10.1111/jvp.13048
Resumen de PubMed | Texto completo de Crossref | Google Académico
15. Bartner, LR , McGrath, S , Rao, S , Hyatt, LK y Wittenburg, LA . Farmacocinética del Cannabidiol administrado por 3 métodos de administración en 2 dosis diferentes a perros sanos. Can J Vet Res. (2018) 82:178–83.
16. Polidoro, D , Temmerman, R , Devreese, M , Charalambous, M , Jamón, LV , Cornelis, I, et al. Farmacocinética del cannabidiol después de la administración intranasal, intrarrectal y oral en perros sanos. Front Vet Sci. (2022) 9:1–8. doi: 10.3389/fvets.2022.899940
Resumen de PubMed | Texto completo de Crossref | Google Académico
17. Samara, E , Bialer, M y Mechoulam, R . Farmacocinética del Cannabidiol en perros. Medicamentos Metab Dispos. (1987) 16:469–72.
18. Chicoine, A , Illing, K , Vuong, S , Pinto, KR , Alcorn, J y Cosford, K . Evaluación farmacocinética y de seguridad de varias dosis orales de un nuevo extracto herbal de cannabis 1:20 THC: CBD en perros. Front Vet Sci. (2020) 7:1–12. doi: 10.3389/fvets.2020.583404
Resumen de PubMed | Texto completo de Crossref | Google Académico
19. Fernández-Trapero, M , Pérez-Díaz, C , Espejo-Porras, F , de Lago, E y Fernández-Ruiz, J . Farmacocinética de Sativex® en perros: hacia una posible terapia basada en cannabinoides para trastornos caninos. Biomol Ther. (2020) 10:1–8. doi: 10.3390/biom10020279
Resumen de PubMed | Texto completo de Crossref | Google Académico
20. Di Salvo, A , Conti, MB y Della Rocca, G . Farmacocinética, eficacia y seguridad del Cannabidiol en perros: una actualización de los conocimientos actuales. Front Vet Sci. (2023) 10:1–15. doi: 10.3389/fvets.2023.1204526
Resumen de PubMed | Texto completo de Crossref | Google Académico
21. Planilandia, B , Baral, RM y Freeman, KP . Conceptos actuales y emergentes en variación biológica y analítica aplicados en la práctica clínica. J Veterinario Pasante Med. (2020) 34:2691–700. doi: 10.1111/jvim.15929
Resumen de PubMed | Texto completo de Crossref | Google Académico
22. Bradley, S , Joven, S , Bakke, AM , Holcombe, L , Waller, D , Hunt, A, et al. La alimentación diaria a largo plazo con cannabidiol es bien tolerada por perros sanos. Front Vet Sci. (2022) 9:1–15. doi: 10.3389/fvets.2022.977457
Resumen de PubMed | Texto completo de Crossref | Google Académico
23. Vaughn, DM , Paulionis, LJ y Kulpa, JE . Evaluación aleatoria, controlada con placebo, de seguridad y farmacocinética de 28 días de la administración repetida de cannabidiol oral en perros sanos. Am J Vet Res. (2021) 82:405–16. doi: 10.2460/ajvr.82.5.405
Resumen de PubMed | Texto completo de Crossref | Google Académico
24. Verrico, CD , Wesson, S , Konduri, V , Hofferek, CJ , Vázquez-Pérez, J , Blair, E, et al. Un estudio aleatorizado, doble ciego y controlado con placebo de cannabidiol diario para el tratamiento del dolor de la osteoartritis canina. Dolor. (2020) 161:2191–202. doi: 10.1097/j.pain.000000000000001896
25. Klatzkow, S , Davis, G , Shmalberg, J , Gallastegui, A , Miscioscia, E , Tarricone, J, et al. Evaluación de la eficacia de un extracto de cáñamo rico en cannabidiol y ácido cannabidiólico para el dolor en perros después de una osteotomía de nivelación de meseta tibial. Front Vet Sci. (2023) 9:1–10. doi: 10.3389/fvets.2022.1036056
Resumen de PubMed | Texto completo de Crossref | Google Académico
26. Brioschi, FA , Di Cesare, F , Gioeni, D , Rabbogliatti, V , Ferrari, F , D’Urso, ES, et al. Formulación oral transmucosa de aceite de cannabidiol como parte de un régimen analgésico multimodal: efectos sobre el alivio del dolor y la mejora de la calidad de vida en perros afectados por osteoartritis espontánea. Animales. (2020) 10:1–14. doi: 10.3390/ani10091505
Resumen de PubMed | Texto completo de Crossref | Google Académico
27. Kogan, L , Hellyer, P y Downing, R . El uso del extracto de aceite de cáñamo rico en cannabidiol para tratar el dolor relacionado con la osteoartritis canina: un estudio piloto. Sci Rep. (2020) 58:35–45.
28. García, GA , Kube, S , Carrera-Justiz, S , Título, DJ y Wakshlag, JJ . Seguridad y eficacia del extracto de cáñamo rico en cannabidiol-ácido cannabidiólico en el tratamiento de las crisis epilépticas refractarias en perros. Front Vet Sci. (2022) 9:1–12. doi: 10.3389/fvets.2022.939966
Resumen de PubMed | Texto completo de Crossref | Google Académico
29. McGrath, S , Bartner, LR , Rao, S , Packer, RA y Gustafson, D . Ensayo clínico aleatorizado, ciego y controlado para evaluar el efecto de la administración oral de cannabidiol además del tratamiento antiepiléptico convencional sobre la frecuencia de las convulsiones en perros con epilepsia idiopática intratable. J Am Vet Med Assoc. (2019) 254:1301–8. doi: 10.2460/javma.254.11.1301
30. Loewinger, M , Wakshlag, JJ , Bowden, D , Peters-Kennedy, J y Rosenberg, A . El efecto de un aceite mixto a base de cannabidiol y ácido cannabidiólico en perros con dermatitis atópica. Veterinario Dermatol. (2021) 33:329–E77. doi: 10.1111/vde.13077
Resumen de PubMed | Texto completo de Crossref | Google Académico
31. Morris, EM , Kitts-Morgan, SE , Spangler, DM , McLeod, KR , Suckow, MA y Harmon, DL . La alimentación con golosinas que contenían cannabidiol (Cbd) no alteró la respuesta inmunitaria canina a la inmunización con un nuevo antígeno. Res Vet Sci. (2022) 143:13–9. doi: 10.1016/j.rvsc.2021.12.012
32. Corsetti, S , Borruso, S , Malandrucco, L , Spalluci, V , Maragliano, L , Perino, R, et al. Puede reducir el comportamiento agresivo hacia los humanos en los perros de refugio. Sci Rep. (2021) 11:1–10. doi: 10.1038/s41598-021-82439-2
Resumen de PubMed | Texto completo de Crossref | Google Académico
33. Caza, ABG , Pedernal, HE , Logan, DW y Rey, T . Una sola dosis de Cannabidiol (Cbd) influye positivamente en las medidas de estrés en los perros durante la separación y los viajes en automóvil. Front Vet Sci. (2023) 10:1–18. doi: 10.3389/fvets.2023.1112604
Resumen de PubMed | Texto completo de Crossref | Google Académico
34. Morris, EM , Kitts-Morgan, SE , Spangler, DM , McLeod, KR , Costa, JHC y Harmon, DL . El impacto de la alimentación con golosinas que contienen cannabidiol (Cbd) en la respuesta canina a una prueba de respuesta al miedo inducida por ruido. Front Vet Sci. (2020) 7:1–13. doi: 10.3389/fvets.2020.569565
Resumen de PubMed | Texto completo de Crossref | Google Académico
35. Morris, EM , Kitts-Morgan, SE , Spangler, DM , Gebert, J , Vanzant, ES , McLeod, KR, et al. La alimentación con golosinas que contienen cannabidiol (Cbd) no afectó la actividad voluntaria diaria canina. Front Vet Sci. (2021) 8:1–10. doi: 10.3389/fvets.2021.645667
Resumen de PubMed | Texto completo de Crossref | Google Académico
36. Kogan, L , Hellyer, P y Robinson, NG . Percepciones de los consumidores sobre los productos de cáñamo para animales. Sci Rep. (2016) 42:40–8.
37. Andrés, CM , Hausman, JF y Guerriero, G . Cannabis Sativa: la Planta de las Mil y Una Moléculas. Planta Frontal Sci. (2016) 7:1–17. doi: 10.3389/fpls.2016.00019
Resumen de PubMed | Texto completo de Crossref | Google Académico
38. Wakshlag, JJ , Cital, S , Eaton, SJ , Prussin, R y Hudalla, C . Análisis de cannabinoides, terpenos y metales pesados de 29 suplementos comerciales de cáñamo veterinario de venta libre. Veterinario Med. (2020) 11:45–55. DOI: 10.2147/VMRR. S248712
Resumen de PubMed | Texto completo de Crossref | Google Académico
Palabras clave: cannabinoide, canino, CBD, CBDA, CBG, cannabis, cáñamo, NASC
Cita: Bookout W, Dziwenka M, Valm K y Kovacs-Nolan J (2024) Estudio de seguridad de los productos de cannabidiol en perros sanos. Frente. Vet. Sci. 11:1349590. doi: 10.3389/fvets.2024.1349590
Recibido: 04 de diciembre de 2023; Aceptado: 19 de febrero de 2024;
Publicado: 01 Marzo 2024.
Editado por:
Robin Temmerman, Colegio Europeo de Farmacología y Toxicología Veterinaria (ECVPT), Bélgica
Revisado por:
Dai Nagakubo, Universidad de Tokio, Japón
Katerina Tomsič, Universidad de Liubliana, Eslovenia
Derechos de autor © 2024 Bookout, Dziwenka, Valm y Kovacs-Nolan. Este es un artículo de acceso abierto distribuido bajo los términos de la Licencia Creative Commons Attribution License (CC BY).
*Correspondencia: Margitta Dziwenka, dziwenka@gras-associates.com
Renuncia: Todas las afirmaciones expresadas en este artículo son únicamente las de los autores y no representan necesariamente las de sus organizaciones afiliadas, ni las del editor, los editores y los revisores. Cualquier producto que pueda ser evaluado en este artículo o afirmación que pueda hacer su fabricante no está garantizado ni respaldado por el editor.
Date de alta y recibe nuestro 👉🏼 Diario Digital AXÓN INFORMAVET ONE HEALTH
Date de alta y recibe nuestro 👉🏼 Boletín Digital de Foro Agro Ganadero
Noticias animales de compañía
Noticias animales de producción
Trabajos técnicos animales de producción
Trabajos técnicos animales de compañía


