Células madre mesenquimales alogénicas preparadas equinas en caballos con lesiones naturales de tendones y ligamentos
Evaluación de la seguridad de las células madre mesenquimales alogénicas preparadas equinas en caballos con lesiones naturales de tendones y ligamentos
 Stephanie Carlier1,2,3*
Stephanie Carlier1,2,3*  Eva Depuydt4
Eva Depuydt4  Lore Van Hecke4
Lore Van Hecke4  Ann Martens2
Ann Martens2  Jimmy Saunders3
Jimmy Saunders3  Jan H. Spaas3,5
Jan H. Spaas3,5- 1Stephanie Carlier, Kortrijk, Bélgica
- 2Departamento de Cirugía de Grandes Animales, Anestesia y Ortopedia, Facultad de Medicina Veterinaria, Universidad de Gante, Merelbeke, Bélgica
- 3Departamento de Morfología, Imagenología, Ortopedia, Rehabilitación y Nutrición, Facultad de Medicina Veterinaria, Universidad de Gante, Merelbeke, Bélgica
- 4Boehringer Ingelheim Medicina Veterinaria Bélgica, Evergem, Bélgica
- 5Boehringer Ingelheim Animal Health USA, Athens, GA, Estados Unidos
Fondo: Las células madre mesenquimales proporcionan una valiosa opción de tratamiento en lesiones ortopédicas en caballos.
Objetivos: El objetivo de este estudio fue evaluar los parámetros hematológicos, bioquímicos, inmunológicos e inmunomoduladores después del tratamiento intralesional con células madre mesenquimales derivadas de sangre periférica equina (tpMSC) preparadas tenogénicas en caballos propiedad de clientes con lesiones naturales del tendón flexor digital superficial (SDFT) y del ligamento suspensorio (SL).
Métodos: Se evaluó la inmunogenicidad y las capacidades inmunomoduladoras de las tpMSC en una reacción linfocitaria mixta modificada, incluidas las células mononucleares de sangre periférica (PBMC) de 14 caballos con lesiones por SDFT y SL después del tratamiento con tpMSC. En un segundo estudio, 18 caballos con lesiones de SDFT y SL recibieron una inyección intralesional con tpMSC (n = 9) o ningún tratamiento (n = 9).
Resultados: Las tpMSCs no provocaron una respuesta inmune celular (p < 0,001) y fueron capaces de inmunomodular los linfocitos T estimulados (p < 0,001) in vitro. El uso terapéutico de las tpMSC no dio lugar a anomalías hematológicas o bioquímicas relevantes.
Principales limitaciones: Ambos estudios tuvieron un tamaño muestral pequeño. No se realizaron análisis estadísticos en el segundo estudio. El fibrinógeno solo se analizó en un solo caballo antes del tratamiento.
Conclusión: La co-incubación de tpMSCs y PBMCs de caballos que han estado previamente expuestos a tpMSCs no provocó una respuesta inmune celular y las tpMSCs fueron capaces de inmunomodular los linfocitos T estimulados. El tratamiento intralesional con tpMSCs no provocó cambios anormales en los parámetros hematológicos y bioquímicos.
1 Introducción
Las lesiones de tendones y ligamentos son una de las lesiones ortopédicas más comunes en caballos (1-5). La cicatrización de estas lesiones a menudo resulta en la formación de tejido cicatricial, lo que conduce a una reducción de la fuerza y la flexibilidad (6). Este tejido inferior puede tener un impacto perjudicial tanto en la capacidad atlética del caballo debido a su naturaleza rigurosa y desorganizada (7), como también actúa como un «punto débil», lo que hace que el tendón o ligamento sea propenso a volver a lesionarse (2-4, 6).
Recientemente, se han realizado más investigaciones para mejorar la calidad de la cicatrización de los tendones (8). El interés en la ortobiología ha sido especialmente alto, con numerosos estudios que investigan el efecto de las MSC (1, 9, 10), el plasma rico en plaquetas (PRP) (11-13) y la solución de proteínas autólogas (APS) (14) en un modelo tendinoso. Una variedad de fuentes de recolección de MSC han sido el foco de varios artículos, siendo las MSC derivadas de la médula ósea (BM-MSC) las más frecuentes (15-18). En este estudio se describe el uso de MSCs alogénicas tenogénicas preparadas equinas (tpMSCs) derivadas de sangre periférica. Los beneficios del uso de tpMSC como un producto alogénico «listo para usar» es la eliminación del tiempo de espera asociado con la cosecha, el aislamiento y el cultivo de MSC autólogas. Además, el uso de donantes alogénicos permite un proceso de selección meticuloso que garantiza una alta calidad constante de sus MSC. Varios estudios han encontrado que la capacidad de crecimiento y la potencia de las MSC están inversamente asociadas con la edad y un estado de salud en declive (19-21). Además, se ha demostrado que los caballos de edad avanzada en trabajo activo son más propensos a la degeneración de los tendones (22, 23), lo que indica la necesidad de utilizar caballos más jóvenes y sanos como donantes. El uso de sangre periférica como fuente de MSC tiene varias ventajas, a saber, una recolección fácil y poco invasiva de la vena yugular, y una baja inmunogenicidad de las células, como lo demostró previamente la expresión negativa a baja del Complejo Mayor de Histocompatibilidad (MHC) tipo I y II (24). Esto contrasta con una expresión más heterogénea descrita en las MSC derivadas del tejido adiposo y la médula ósea (25-27).
Estudios previos realizados por este grupo han demostrado que las tpMSC eran clínicamente efectivas y seguras en 66 caballos de deporte con lesiones naturales del tendón flexor digital superficial (SDFT) y el ligamento suspensorio (SL) (28). Sin embargo, el uso clínico único y repetido de MSC alogénicas justifica una evaluación más profunda de la seguridad in vitro e in vivo, que se investiga en el presente estudio.
2 Materiales y métodos
El estudio se llevó a cabo de acuerdo con las normativas nacionales e internacionales de bienestar animal [Directiva 2001/82/CE modificada, legislación belga en materia de bienestar animal (KB 29/05/2013), Directiva 2010/63/UE y EMEA/CVMP/816/00-Final, VICH GL9 (GCP)]. La extracción de sangre de los caballos donantes (EC_2018_002) fue aprobada por el comité de ética con miembros independientes que evaluaron la solicitud según lo aprobado por el gobierno flamenco (número de permiso: LA1700607). El estudio se realizó bajo la autorización de ensayo clínico número 0004791 y se disponía de un consentimiento firmado por el propietario para cada caballo.
2.1 Producto en investigación y control, administración del tratamiento, aleatorización y criterios de inclusión
El producto en investigación (IVP) consistió en una formulación patentada de células madre mesenquimales preparadas (tpMSC) derivadas de sangre periférica alogénica equina y se fabricó y calificó como se describió anteriormente (10, 21, 28, 29). En resumen, los donantes potenciales se sometieron a un riguroso proceso de calificación, que incluyó la salud general, la detección de enfermedades infecciosas y la calidad de las células madre. La sangre periférica se recolectó asépticamente de la vena yugular en tubos estériles de ácido etilendiaminotetraacético (EDTA). A continuación, se realizó una centrifugación en gradiente y se aisló la interfase, se sembró y se cultivó en un medio de cultivo. En el pasaje 5, las MSC se caracterizaron como se describió anteriormente (21) y se congelaron como un stock celular intermedio (CSI). A continuación, se caracterizaron las células y, para una mayor diferenciación, se descongelaron y cultivaron las MSC de ICS. Se añadió medio de cebado tenogénico durante el último paso de paso durante 3 días consecutivos y se tripsinizó al 80% de confluencia. Posteriormente, las MSC se resuspendieron en la glucosa media baja modificada Eagle de Dulbecco (Life Technologies) y se suplementaron con dimetilsulfóxido al 10% (Sigma-Aldrich) antes de la criopreservación a -80 °C, hasta su uso posterior. Todo el proceso de fabricación se realizó bajo los mismos altos estándares que para los productos farmacéuticos.
En el primer estudio, se utilizaron dos lotes de tpMSC aislados de dos caballos donantes diferentes. El producto control (PC) consistió en 1 mL de solución salina inyectable estéril (NaCl al 0,9%). La asignación del tratamiento se basó en un plan de aleatorización, utilizando una proporción de 2:1 (IVP:CP) para la asignación del grupo de tratamiento. En este estudio, un total de 66 caballos fueron tratados con PIV y 34 con PC (28). Catorce caballos del grupo IVP fueron seleccionados aleatoriamente para la extracción de sangre para el aislamiento de células mononucleares de sangre periférica (PBMC).
En el segundo estudio, se utilizó un solo lote de tpMSC de un solo caballo donante. La asignación del tratamiento fue aleatoria. Un total de 18 caballos fueron incluidos en este estudio, con nueve caballos que recibieron una inyección intralesional con tpMSCs y nueve caballos que no recibieron tratamiento intralesional. La asignación del tratamiento fue aleatoria.
Cada caballo cumplió con los siguientes criterios de inclusión: una lesión tendinosa o ligamentosa unilateral por primera vez por lesión por sobreesfuerzo, con los siguientes hallazgos por ecografía: una lesión que ocupa el >10% del área de la sección transversal (CSA) del tendón en la zona de lesión máxima (MIZ), con al menos hipoecogenicidad moderada (igual cantidad de hiperecogenicidad o normo-ecogenicidad e hipoecogenicidad) y 25-49% o menos haces de fibras paralelas en la lesión en la zona de lesión máxima. Se realizó una puntuación clínica basada en la hinchazón local, el dolor a la presión y al calor basado en un sistema de puntuación de 4 puntos (0 = no presente, 1 = leve, 2 = moderado, 3 = grave) y la cojera [puntuación de la American Association of Equine Practitioners (AAEP); 0 = no perceptible bajo ninguna circunstancia, 1 = difícil de observar y no es consistentemente evidente, independientemente de las circunstancias, 2 = difícil de observar al caminar, o al trotar en línea recta, pero consistentemente aparente bajo ciertas circunstancias, 3 = consistentemente observable al trote en todas las circunstancias, 4 = obvio al caminar, 5 = carga mínima de peso en movimiento y/o en reposo o una completa incapacidad para moverse]. La suma de estas puntuaciones debía ser de al menos 3 para cumplir con los criterios de inclusión. Se excluyeron del estudio las lesiones bilaterales, el pretratamiento, la participación previa en un estudio con células madre, los caballos con antecedentes de lesiones en la misma estructura tendinosa/ligamentosa o problemas ortopédicos previos que impidieran el regreso al entrenamiento y la competición completos o los caballos con una afección médica grave que comprometiera la participación segura del paciente. No hubo limitación en la duración (aguda, subaguda o crónica) de las lesiones.
Antes de la inyección intralesional, cada caballo fue sedado (clorhidrato de detomidina a 20 μg/kg de peso corporal) y la región de inyección fue recortada y preparada asépticamente. En el primer estudio, la PIV o PC se administró por vía intralesional bajo guía ecográfica. En el segundo estudio, el grupo de PC no recibió una inyección intralesional. Para facilitar el cumplimiento del propietario y evitar o reducir la posible hinchazón local causada por la inserción de la aguja, todos los caballos recibieron una inyección intravenosa de AINE de acción corta de acuerdo con su peso corporal.
No se permitieron terapias auxiliares (p. ej., ondas de choque, láser de clase 4) ni tratamientos concomitantes (aparte de la inyección única de AINE de acción corta en el día 0) durante el estudio.
2.2 Evaluaciones de seguridad y diseño del estudio
2.2.1 Estudio 1: ensayo clínico multicéntrico, ciego, controlado con placebo y aleatorizado (112 ± 3 días)
El primer estudio fue parte de un ensayo clínico multicéntrico, ciego, controlado con placebo y aleatorizado, con una duración de 112 ± 3 días. Este estudio incluyó a 100 caballos propiedad de clientes con una lesión unilateral natural por primera vez del SDFT o SL (28). Para el presente estudio, se evaluó la inmunogenicidad celular y las capacidades inmunomoduladoras de las tpMSC en 14 de estos 100 caballos.
Dentro de este estudio, se seleccionaron aleatoriamente los 14 caballos tratados con tpMSC. La sangre se recolectó a través de la venopunción yugular aproximadamente 26,6 semanas después del tratamiento (rango 25,7–27,4 semanas). La sangre se centrifugó, la capa de leucocitismo se recolectó y se diluyó en la solución salina equilibrada de Hank (HBSS, Life Technologies). A continuación, la suspensión se colocó en capas sobre un volumen igual de Percoll y la interfase se recolectó después de la centrifugación en gradiente. Las células mononucleares de sangre periférica (PBMC) se lavaron y resuspendieron en HBSS a una concentración de 1 ×106 PBMCs/mL. Posteriormente, las PBMC fueron marcadas con éster de carboxifluoresceína succinimidil (Life Technologies), de acuerdo con las instrucciones del fabricante, con el fin de evaluar la proliferación celular. Finalmente, las PBMC se diluyeron en medio de cultivo [DMEM suplementado con suero fetal bovino, antibióticos/antimicóticos y β-mercapto-etanol (Sigma)] hasta una concentración final de 2 ×106 células/mL. A continuación, se añadieron 100 μL a los pocillos designados de la placa de cultivo de tejidos de 96 pocillos de fondo en U (= 2 × 105 PBMCs/pozo). Para las muestras de co-incubación, las tpMSCs del mismo caballo donante y aislado se descongelaron, lavaron y resuspendieron en medio de cultivo a una concentración final de 2 ×105 tpMSCs/mL. Las tpMSC se sembraron en una relación de 1:10 tpMSC:PMBC. Como control negativo, se realizó un cultivo de PBMC de cada caballo para evaluar la proliferación basal de PBMC. Como control positivo, las PBMC de cada caballo fueron estimuladas con el mitógeno concanavalina A (5 μg/mL; Sigma). Los cultivos se mantuvieron durante 4 días en una incubadora humidificada a 37°C y 95% O2 / 5% CO2. Después del período de incubación, se recolectaron PBMC, teñidas con 7-aminoactinomicina D (7-AAD; 1:100; BioLegend) para la discriminación de células vivas y muertas. En la población viable, la proliferación se analizó mediante citómetro de flujo (BD FACSCanto II, BD Biosciences, Estados Unidos). La proliferación observada indicaría una respuesta inmune positiva de los linfocitos T que reconocen las moléculas MHC I y II en la superficie de las MSC.
2.2.2 Estudio 2: Estudio monocéntrico controlado con placebo (21 días)
Se realizó un estudio controlado con placebo de un solo centro, que incluyó 18 caballos y una duración de 21 días, en caballos que sufrían lesiones naturales de SDFT o SL.
La sangre se recolectó el día 0 (antes del tratamiento en el grupo IVP), el día 7 y el día 21. La sangre se analizó para un panel general proporcionado por el laboratorio seleccionado e incluyó los siguientes parámetros: glóbulos blancos (leucocitos), glóbulos rojos (RBC), ancho de distribución de glóbulos rojos (RDW), hemoglobina corpuscular media (MCH), concentración media de hemoglobina corpuscular (MCHC), volumen corpuscular medio (MCM), concentración media de hemoglobina celular (CHCM), hemoglobina (Hg), hematocrito (hct), neutrófilos, eosinófilos, linfocitos, monocitos, reticulocitos, contenido de hemoglobina (CHr) de los reticulocitos, recuento de plaquetas, proteínas totales (TP), albúmina, relación albúmina/globulina, alfa-1-globulina, alfa-2-globulina, bèta-globulina, gammaglobulina, fosfatasa alcalina (ALP), aspartato transaminasa (AST), bilirrubina total, creatina quinasa (CK), creatinina, ureum, lactato deshidrogenasa (LDH), gamma-glutamil transpeptidasa (GGT), glutamato deshidrogenasa (GLDH), triglicéridos, fibrinógeno, amiloide sérico A (SAA), sodio, calcio, magnesio, fosfato, potasio y hierro.
Los signos vitales se evaluaron como parte de una buena práctica veterinaria en el día 0, el día 7 y el día 21. El veterinario examinador sólo estaba obligado a informar de los acontecimientos adversos. Por lo tanto, no se registraron los exámenes clínicos normales.
2.3 Análisis de datos
Para los análisis estadísticos de la reacción de linfocitos mixtos, se comprobó la hipótesis de distribución normal mediante la prueba de Kolmogorov-Smirnov. Los datos no distribuidos normalmente se analizaron mediante la prueba U de Mann-Whitney de muestras independientes con un nivel de significación del 5%.
Los valores medios y las desviaciones estándar del estudio de patología clínica se calcularon en Microsoft Excel.®
3 Resultados
3.1 Estudio 1: Ensayo clínico multicéntrico, ciego, controlado con placebo y aleatorizado (112 ± 3 días)
Durante el experimento in vitro, se encontró que el porcentaje medio de proliferación de linfocitos T del ensayo de inmunogenicidad (PBMCs + tpMSCs; 1,8% ± 1,3%) fue significativamente menor en comparación con el control negativo (PBMCs; 7,8% ± 1,5%; p < 0,001). Además, el porcentaje medio de proliferación de linfocitos T en el ensayo de inmunomodulación (PBMC estimuladas + tpMSC; 8,6% ± 5,5%) fue significativamente menor en comparación con el control positivo (PBMC estimuladas; 63,5% ± 7,6%; p < 0,001; Figura 1).
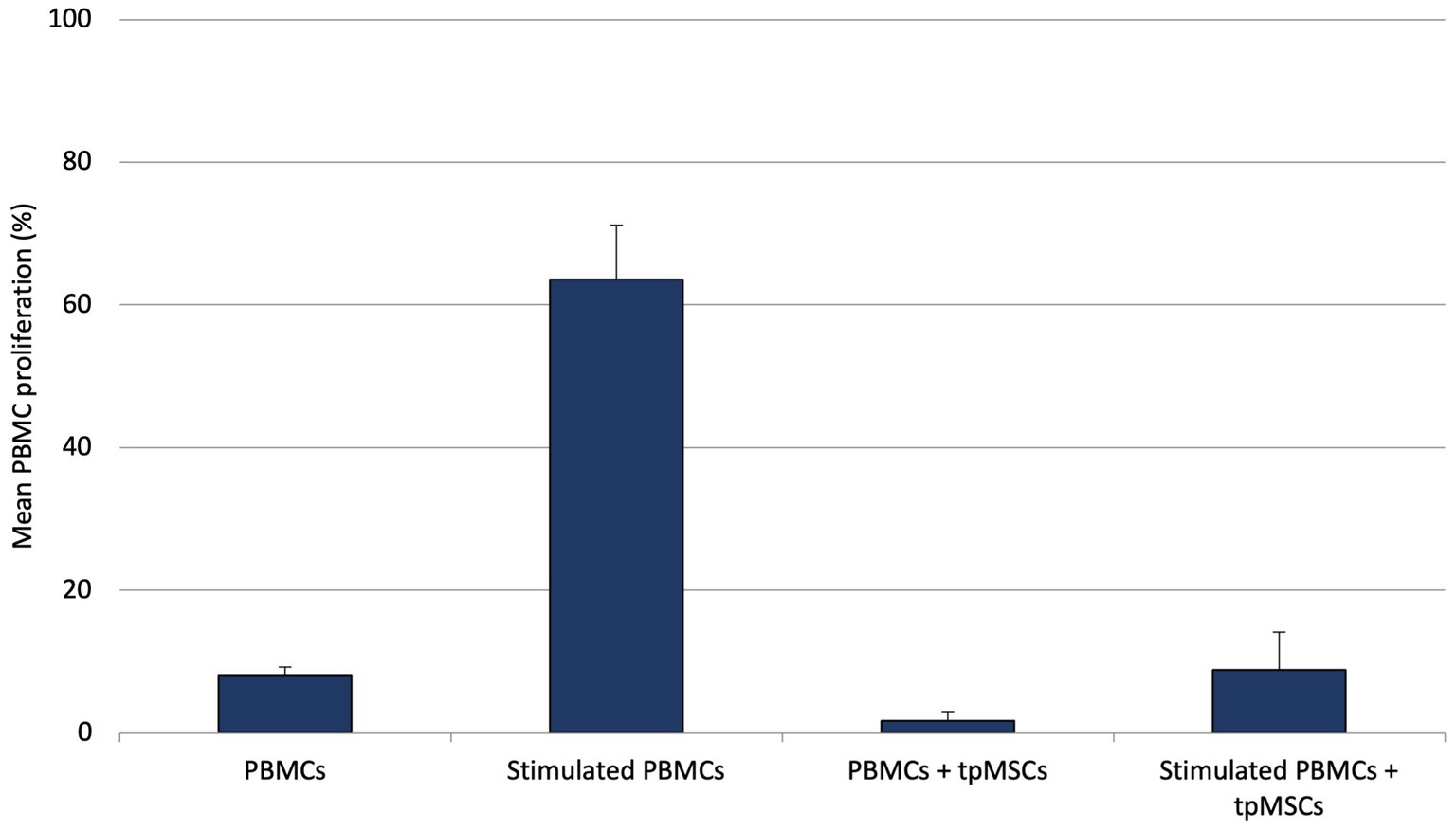 Figura 1. Proliferación media de PBMC (%) de PBMC equinos, PBMC estimuladas, inmunogenicidad (PBMC + tpMSC) e inmunomodulación (PBMC estimuladas + tpMSC). *Valores de p ≤0,05.
Figura 1. Proliferación media de PBMC (%) de PBMC equinos, PBMC estimuladas, inmunogenicidad (PBMC + tpMSC) e inmunomodulación (PBMC estimuladas + tpMSC). *Valores de p ≤0,05.
3.2 Estudio 2: estudio controlado con placebo de un solo centro (21 días)
Los rangos de referencia para la patología clínica fueron proporcionados por el laboratorio, excepto para los reticulocitos y CHr.
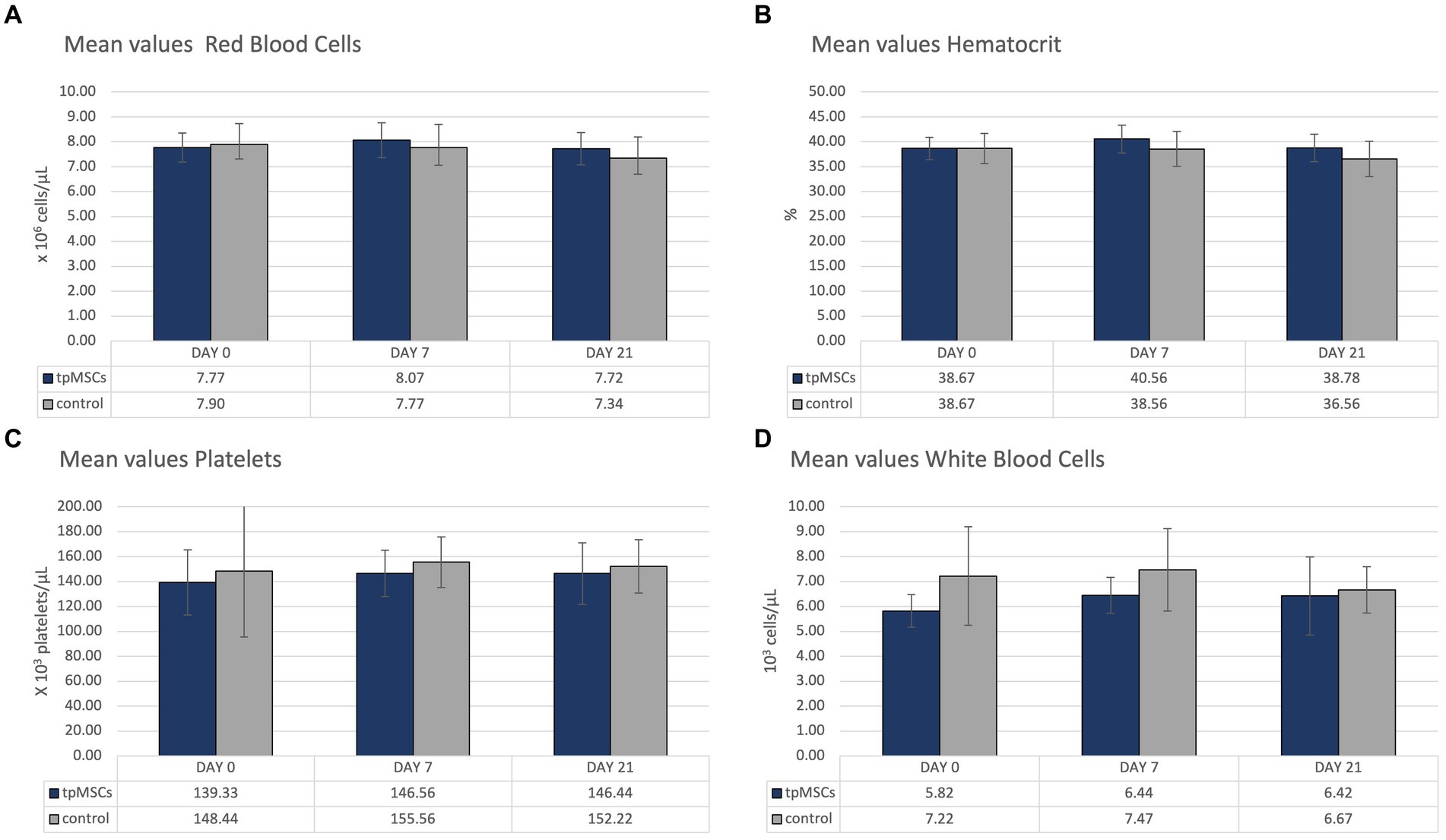
Todos los parámetros hematológicos se encontraban dentro de los límites normales (Tabla 1; Figura 2).
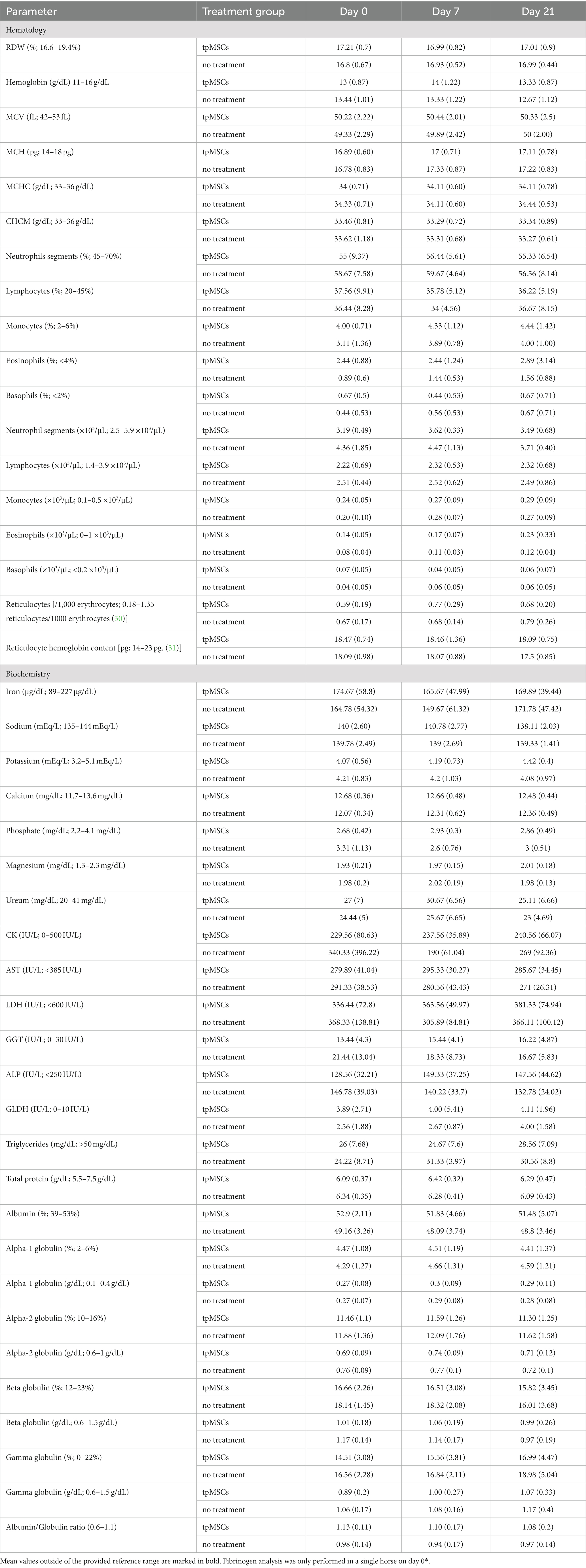 Tabla 1. La tabla representa los valores medios (desviación estándar) de los parámetros hematológicos y bioquímicos (excepto hematíes, hematocrito, plaquetas, leucocitos, fibrinógeno, creatinina, bilirrubina total, AAS y albúmina; ver Figuras 2 y 3).
Tabla 1. La tabla representa los valores medios (desviación estándar) de los parámetros hematológicos y bioquímicos (excepto hematíes, hematocrito, plaquetas, leucocitos, fibrinógeno, creatinina, bilirrubina total, AAS y albúmina; ver Figuras 2 y 3).
Los parámetros bioquímicos que estaban fuera del rango de referencia se representan en la Figura 3. Todos los demás valores medios se encontraban dentro del rango de referencia proporcionado (Tabla 1). No se encontraron anomalías en los exámenes clínicos en ninguno de los caballos durante el estudio.
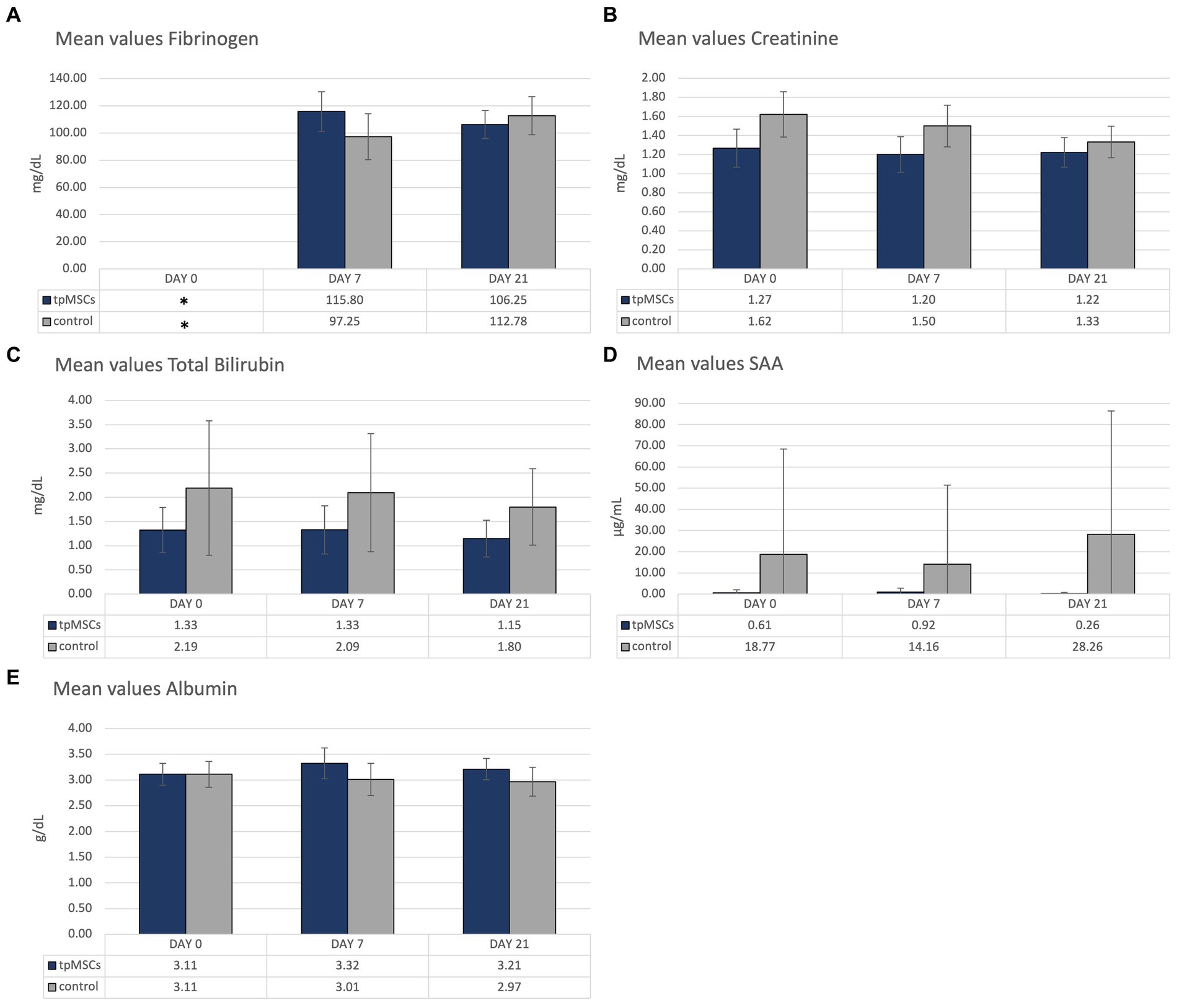 Figura 3. Bioquímica: valores medios de fibrinógeno (A), creatinina (B), bilirrubina total (C), SAA (D) y albúmina (E) de los caballos tratados con tpMSCs y de los caballos que no recibieron tratamiento (control). *En el día 0, el fibrinógeno solo se analizó en un solo caballo.
Figura 3. Bioquímica: valores medios de fibrinógeno (A), creatinina (B), bilirrubina total (C), SAA (D) y albúmina (E) de los caballos tratados con tpMSCs y de los caballos que no recibieron tratamiento (control). *En el día 0, el fibrinógeno solo se analizó en un solo caballo.
Debido a un error humano, el fibrinógeno en el día 0 solo se analizó en un caballo, en el grupo IVP. Por lo tanto, el fibrinógeno del día 0 se excluye de la figura (Figura 3A). En ambos grupos, se produjeron valores fuera del rango de referencia de fibrinógeno (100-200 mg/dL). Como se mencionó anteriormente, se analizó el fibrinógeno día 0 en un solo caballo, del grupo IVP, y tuvo un valor de 72 mg/dL. En el grupo de PC, el valor medio de fibrinógeno en el día 7 fue de 97,25 ± 16,96 mg/dl (Figura 3A). El valor medio de creatinina estuvo ligeramente por encima del rango de referencia (1,62 ± 0,24 mg/dL; rango de referencia: 0,8-1,5 mg/dL; Figura 3B). La bilirrubina total media en el grupo control estuvo fuera del rango de referencia (0,5-2,0 mg/dL) en los días 0 y 7 (2,19 ± 1,39 mg/dL y 2,09 ± 1,22 mg/dL, respectivamente; Figura 3C). La media de AAS en el grupo control se incrementó en todos los puntos temporales (referencia <4 μg/mL; 18,77 ± 49,74 μg/mL, 14,16 ± 37,31 μg/mL y 28,26 + 58,14 μg/mL en los días 0, 7 y 21, respectivamente; Figura 3D). Finalmente, la concentración media de albúmina se incrementó marginalmente en el día 7 en el grupo de PIV (3,32 ± 0,30 g/dL; rango de referencia: 2,4-3,3 g/dL; Figura 3E). Todos los demás valores medios se encontraban dentro del rango de referencia proporcionado (Tabla 1). Todos los caballos se encontraban en buen estado de salud clínica.
4 Discusión
En este artículo se analizan las capacidades inmunogénicas e inmunomoduladoras de las tpMSCs in vitro y se investiga su seguridad a través de parámetros hematológicos y bioquímicos en caballos tratados con lesiones naturales de tendones y ligamentos.
Para apoyar la hipótesis de que las tpMSC están desprovistas de MHC tipo II y bajas en tipo I y, por lo tanto, evaden el rechazo inmunológico, se realizó un ensayo in vitro que evaluó la respuesta de las PBMC en presencia de tpMSC. Las respuestas mediadas por MHC tipo I y II incluyen principalmente la activación de los linfocitos T, incluidas las células T de memoria (32), lo que las hace más sensibles a la exposición posterior al antígeno. Con el fin de evaluar el aumento de la sensibilidad de las PBMC debido a la exposición previa a las tpMSC, se utilizaron PBMC de caballos que ya habían sido tratados con tpMSC para la coincubación con tpMSC del mismo aislado de células madre (y, por lo tanto, del mismo caballo donante) que se utilizó para el tratamiento. La co-incubación de PMBCs y tpMSCs no provocó una respuesta inmune celular. Además, las tpMSC fueron capaces de reducir la proliferación de PBMC estimuladas en una respuesta inflamatoria in vitro, lo que sugiere que las MSC tienen un efecto amortiguador de la inflamación. Esto se corresponde con el hallazgo de que la inactivación de MHC tipo I y II conduce a la hipoinmunidad en células madre pluripotentes (33) y a las capacidades inmunomoduladoras descritas de las MSC (34-36). Se ha descrito que el tratamiento de las MScs con factores de crecimiento puede influir potencialmente en la expresión del MHC (37, 38). Sin embargo, la hipoinmunidad de las tpMSC en un entorno in vitro se confirma in vivo por la falta de eventos adversos relacionados con el tratamiento después de la inyección intralesional de tpMSC en lesiones del tendón equino, tanto en entornos naturales como experimentales (10, 28, 39).
Los estudios uno y 2 difirieron en el diseño de la PC, donde se inyectó solución salina intralesional en el estudio 1 y no se optó por ningún tratamiento por parte de los médicos tratantes en el estudio 2. En el primer estudio esto era imperativo como control, ya que la inyección de un cierto volumen podría conducir potencialmente al agravamiento de la lesión (40).
El objetivo del estudio de patología clínica controlado con placebo de un solo centro fue evaluar la seguridad de las tpMSC mediante la evaluación de la aparición de posibles cambios anormales en los parámetros hematológicos y bioquímicos después del tratamiento con tpMSC. Durante el estudio, no se informaron eventos adversos y todos los parámetros medios del grupo IVP se mantuvieron dentro de los rangos de referencia después del tratamiento, con la excepción de la albúmina media en el día 7. En el día 7, el nivel medio (absoluto) de albúmina aumentó marginalmente (3,32 g/dL; rango de referencia: 2,4-3,3 g/dL) en el grupo de PIV. Se ha informado que los rangos de albúmina en caballos sanos son de hasta 4,2 g/dL (41). Además, los valores relativos medios de la albúmina se encontraban dentro del rango de referencia. La hiperalbuminemia se asocia más comúnmente con la deshidratación (42, 43). Sin embargo, no hubo indicios de que los caballos del grupo de PIV estuvieran deshidratados en función de los demás parámetros hematológicos y bioquímicos. Además, la pertinencia es cuestionable, ya que el valor puede considerarse normal, sobre la base de los valores de referencia publicados.
Por error, el fibrinógeno solo se analizó en un solo caballo el día 0. Este caballo pertenecía al grupo IVP y tenía un valor por debajo del rango de referencia (72 mg/dL; rango de referencia: 100-200 mg/dL). La hipofibrinogenemia puede indicar insuficiencia hepática y coagulación intravascular diseminada (44). Sin embargo, el caballo se encontraba en buen estado general de salud y no había ninguna otra indicación (ni en la presentación clínica ni en la patología clínica) ni enfermedad hepática o CID. El nivel de fibrinógeno del caballo era más bajo de lo normal antes del tratamiento y se había normalizado en el siguiente momento. Además, el fibrinógeno medio del grupo IVP se mantuvo dentro del rango de referencia después del tratamiento. En conclusión, el fibrinógeno medio en el grupo IVP solo estaba fuera de referencia antes del tratamiento y, por lo tanto, no está relacionado con el tratamiento. En el grupo control hubo una media de fibrinógeno ligeramente inferior (97,25 mg/dL) el día 7.
Los valores medios de creatinina, bilirrubina total y AAS estuvieron fuera del rango en uno o más puntos temporales en el grupo control. Como ninguno de los caballos del grupo de control recibió el tratamiento con IVP, estos valores atípicos se consideran no relacionados con el tratamiento con tpMSC.
Cabe destacar que este estudio incluyó un tamaño muestral pequeño y que no se realizaron análisis estadísticos. Para evaluar cambios o tendencias significativas en comparación con los valores basales y un grupo de control, se justifican estudios adicionales con tamaños de muestra más grandes. En cualquier caso, el objetivo de este estudio fue identificar la posible aparición de cambios anormales en los parámetros hematológicos o bioquímicos con el fin de evaluar la seguridad del uso intralesional de tpMSCs en la tendinitis o desmitis natural. Por lo tanto, podemos concluir que solo la media de un solo parámetro aumentó marginalmente después del tratamiento con tpMSC y puede considerarse normal en función de los rangos de referencia publicados, mientras que varios parámetros estaban fuera del rango en el grupo de control.
Se administró una dosis única de AINE por razones de bienestar animal, para evitar dolor e hinchazón innecesarios debido a la inserción de la aguja en todos los animales tratados con inyección intralesional (PIV y PC). Sin embargo, el uso de AINE podría tener un impacto negativo en la potencia de las MSC (45, 46). No está claro si el uso concomitante de AINE interfiere con el mecanismo de trabajo de las tpMSC. En el ensayo clínico de campo realizado anteriormente, se demostró la eficacia de la tpMSC en lesiones naturales de tendones y ligamentos, con diferencias estadísticamente significativas en todos los parámetros clínicos y ultrasonográficos entre los grupos, así como una tasa de relesión significativamente menor en los caballos tratados con tmMSC a largo plazo (28). Estos datos sugieren que los AINE no afectaron la potencia de las tpMSC. Se debe realizar un estudio ciego adicional para confirmar esta hipótesis.
5 Conclusión
Las TpMSC no provocaron una respuesta celular de los linfocitos T en los caballos tratados previamente, y fueron capaces de inmunomodular los linfocitos T estimulados en un entorno in vitro. La exposición previa in vivo a las tpMSC no pareció afectar a los linfocitos T en la coincubación posterior con las tpMSC. Además, el uso de tpMSCs no causó anomalías hematológicas o bioquímicas. Sobre la base de estos hallazgos y de las evaluaciones clínicas de seguridad informadas anteriormente, las tpMSC pueden considerarse un tratamiento seguro para las lesiones de tendones y ligamentos en caballos.
Declaración de disponibilidad de datos
Los datos brutos que respaldan las conclusiones de este artículo serán puestos a disposición por los autores, sin reservas indebidas.
Declaración ética
Los estudios en animales fueron aprobados por LA1700607 (Comité de Ética de Boehringer Ingelheim Veterinary Medicine Belgium). Los estudios se llevaron a cabo de acuerdo con la legislación local y los requisitos institucionales. Se obtuvo el consentimiento informado por escrito de los propietarios para la participación de sus animales en este estudio.
Contribuciones de los autores
SC: Investigación, Escritura – borrador original. ED: Conceptualización, Investigación, Escritura – revisión y edición, LV: Escritura – revisión y edición. AM: Escritura – revisión y edición. JS: Escritura – revisión y edición. JHS: Conceptualización, Escritura – revisión y edición.
Financiación
El/los autor/es declara(n) haber recibido apoyo financiero para la investigación, autoría y/o publicación de este artículo. Esta investigación fue financiada por Boehringer-Ingelheim y apoyada por una subvención de Flanders Innovation & Entrepreneurship (número de proyecto Vlaio HBC.2020.2227).
Conflicto de intereses
SC, ED, LV y JHS eran empleados de Boehringer-Ingelheim o de una empresa afiliada en el momento del estudio. El contenido de este manuscrito contiene un producto de células madre disponible comercialmente (RenuTend©) propiedad y patentado por Boehringer-Ingelheim. El financiador tuvo la siguiente participación en el estudio: los estudios se realizaron para recopilar datos adicionales para la autorización de comercialización.
El resto de los autores declaran que la investigación se llevó a cabo en ausencia de relaciones comerciales o financieras que pudieran interpretarse como un potencial conflicto de intereses.
Uno de los autores declaró que era miembro del consejo editorial de Frontiers, en el momento de la presentación. Esto no tuvo ningún impacto en el proceso de revisión por pares ni en la decisión final.
Nota del editor
Todas las afirmaciones expresadas en este artículo son únicamente las de los autores y no representan necesariamente las de sus organizaciones afiliadas, ni las del editor, los editores y los revisores. Cualquier producto que pueda ser evaluado en este artículo, o afirmación que pueda ser hecha por su fabricante, no está garantizado ni respaldado por el editor.
Referencias
1. Geburek, F, Roggel, F, Van Schie, HTM, Beineke, A, Estrada, R, Weber, K, et al. Efecto del tratamiento intralesional único de las lesiones del núcleo del tendón flexor digital superficial equino inducidas quirúrgicamente con células estromales mesenquimales derivadas del tejido adiposo: un ensayo experimental controlado. Células madre Res ther. (2017) 8:129. doi: 10.1186/s13287-017-0564-8
Resumen de PubMed | Texto completo de Crossref | Google Académico
2. Sloet Van Oldruitenborgh-Oosterbaan, MM, Genzel, W, y van Weeren, PR. Un estudio piloto sobre los factores que influyen en la carrera de los caballos de deporte holandeses. Veterinario Equino J. (2010) 42:28–32. doi: 10.1111/j.2042-3306.2010.00251.x
Resumen de PubMed | Texto completo de Crossref | Google Académico
3. Murray, RC, Dyson, SJ, Tranquille, C, y Adams, V. Asociación del tipo de deporte y el nivel de rendimiento con el sitio anatómico del diagnóstico de lesiones ortopédicas. Veterinario Equino J. (2006) 38:411–6. doi: 10.1111/j.2042-3306.2006.tb05578.x
4. Williams, RB, Harkins, LS, Hammond, CJ y Wood, JLN. Lesiones de caballos de carreras, problemas clínicos y muertes registradas en los hipódromos británicos de carreras planas y carreras de National Hunt durante 1996, 1997 y 1998. Veterinario Equino J. (2001) 33:478–86. doi: 10.2746/042516401776254808
Resumen de PubMed | Texto completo de Crossref | Google Académico
5. Johnston, AS, Riggs, CM, Cogger, N, Benschop, J, Rogers, CW y Rosanowski, SM. Uso de técnicas de análisis de series temporales para mejorar la comprensión de las lesiones musculoesqueléticas en caballos de carreras pura sangre. Veterinario Equino J. (2020) 52:699–708. doi: 10.1111/evj.13220
Resumen de PubMed | Texto completo de Crossref | Google Académico
6. Dowling, BA, Dart, AJ, Hodgson, DR, y Smith, RKW. Tendinitis flexora digital superficial en el caballo. Veterinario Equino J. (2000) 32:369–78. doi: 10.2746/042516400777591138
Resumen de PubMed | Texto completo de Crossref | Google Académico
7. Smith, RKW, y Goodship, AE. Fisiología de tendones y ligamentos. Cirugía Médica Deportiva Equina (2004):130–51. doi: 10.1016/B978-0-7020-2671-3.50012-X
8. Spaas, JH, Guest, DJ, y van de Walle, GR. Regeneración tendinosa en atletas humanos y equinos: Ubi Sumus-quo Vadimus (¿dónde estamos y hacia dónde vamos)? Medicina Deportiva. (2012) 42:871–90. doi: 10.1007/BF03262300
Resumen de PubMed | Texto completo de Crossref | Google Académico
9. Ahrberg, AB, Horstmeier, C, Berner, D, Brehm, W, Gittel, C, Hillmann, A, et al. Efectos de las células estromales mesenquimales frente al suero en la cicatrización de los tendones en un ensayo experimental controlado en un modelo equino. BMC Musculoskelet Disord. (2018) 19:230. doi: 10.1186/s12891-018-2163-y
Resumen de PubMed | Texto completo de Crossref | Google Académico
10. Depuydt, E, Broeckx, SY, van Hecke, L, Chiers, K, van Brantegem, L, van Schie, H, et al. La evaluación de células madre mesenquimales tenógenas alogénicas equinas en un modelo de lesión del tendón flexor digital superficial inducida quirúrgicamente. Front Vet Sci. (2021) 8:8. doi: 10.3389/fvets.2021.641441
11. Bosch, G, Moleman, M, Barneveld, A, van Weeren, PR, y van Schie, HTM. Efecto del plasma rico en plaquetas sobre la neovascularización de lesiones del tendón flexor digital superficial equino creadas quirúrgicamente. Scand J Med Sci Deportes. (2011) 21:554–61. doi: 10.1111/j.1600-0838.2009.01070.x
Resumen de PubMed | Texto completo de Crossref | Google Académico
12. Bosch, G, van Schie, HTM, de Groot, MW, Cadby, JA, van de Lest, CHA, Barneveld, A, et al. Efectos del plasma rico en plaquetas sobre la calidad de la reparación de lesiones centrales inducidas mecánicamente en tendones flexores digitales superficiales equinos: un estudio experimental controlado con placebo. J Orthop Res. (2010) 28:211–7. doi: 10.1002/jor.20980
Resumen de PubMed | Texto completo de Crossref | Google Académico
13. Geburek, F, Gaus, M, van Schie, HTM, Rohn, K y Stadler, PM. Efecto del tratamiento con plasma rico en plaquetas (PRP) intralesional sobre los parámetros clínicos y ultrasonográficos en las tendinopatías flexoras digitales superficiales de origen natural equino: un ensayo clínico controlado prospectivo aleatorizado. BMC Vet Res. (2016) 12:191. doi: 10.1186/s12917-016-0826-1
Resumen de PubMed | Texto completo de Crossref | Google Académico
14. Gaesser, AM, Underwood, C, Linardi, RL, Even, KM, Reef, VB, Shetye, SS, et al. Evaluación de la inyección de solución proteica autóloga para el tratamiento de la tendinitis flexora digital superficial en un modelo equino. Front Vet Sci. (2021) 8:8. doi: 10.3389/fvets.2021.697551
15. Frisbie, DD, y Smith, RKW. Actualización clínica sobre el uso de células madre mesenquimales en ortopedia equina. Veterinario Equino J. (2010) 42:86–9. doi: 10.2746/042516409X477263
16. Godwin, EE, Young, NJ, Dudhia, J, Beamish, IC y Smith, RKW. La implantación de células madre mesenquimales derivadas de la médula ósea demuestra un mejor resultado en caballos con lesión por sobreesfuerzo del tendón flexor digital superficial. Veterinario Equino J. (2012) 44:25–32. doi: 10.1111/j.2042-3306.2011.00363.x
Resumen de PubMed | Texto completo de Crossref | Google Académico
17. Richardson, LE, Dudhia, J, Clegg, PD y Smith, R. Células madre en medicina veterinaria: intentos de regenerar el tendón equino después de una lesión. Tendencias Biotechnol. (2007) 25:409–16. doi: 10.1016/j.tibtech.2007.07.009
Resumen de PubMed | Texto completo de Crossref | Google Académico
18. del Bue, M, Riccò, S, Ramoni, R, Conti, V, Gnudi, G, y Grolli, S. Células madre mesenquimales derivadas del tejido adiposo equino y concentrados de plaquetas: su asociación in vitro e in vivo. Vet Res Commun. (2008) 32:51–5. doi: 10.1007/s11259-008-9093-3
19. Bertolo, A, Steffen, F, Malonzo-Marty, C, y Stoyanov, J. Potencial de las células madre mesenquimales caninas y la importancia de la raza canina: implicación para las terapias basadas en células. Trasplante de células. (2015) 24:1969–80. doi: 10.3727/096368914X685294
20. Lee, KS, Cha, SH, Kang, HW, Song, JY, Lee, KW, Ko, KB, et al. Efectos del paso serial sobre las características y la diferenciación condrogénica de células madre mesenquimales derivadas de la matriz del cordón umbilical canino. Asiático-Australas. J Anim Sci. (2013) 26:588–95. doi: 10.5713/ajas.2012.12488
21. Spaas, JH, Schauwer, CD, Cornillie, P, Meyer, E, Soom, AV y van de Walle, GR. Cultivo y caracterización de células estromales mesenquimales de sangre periférica equina. Veterinario J. (2013) 195:107–13. doi: 10.1016/j.tvjl.2012.05.006
Resumen de PubMed | Texto completo de Crossref | Google Académico
22. Thorpe, CT, Udeze, CP, Birch, HL, Clegg, PD, y Screen, HRC. La capacidad de deslizamiento entre los fascículos tendinosos disminuye con el envejecimiento en los tendones equinos propensos a lesiones: ¿un posible mecanismo para la tendinopatía relacionada con la edad? Eur Cell Mater. (2013) 25:48–60. doi: 10.22203/eCM.v025a04
Resumen de PubMed | Texto completo de Crossref | Google Académico
23. Ribitsch, I, Gueltekin, S, Keith, MF, Minichmair, K, Peham, C, Jenner, F, et al. Cambios relacionados con la edad de la micromorfología fibrilar tendinosa y la expresión génica. J Anat. (2020) 236:688–700. doi: 10.1111/joa.13125
Resumen de PubMed | Texto completo de Crossref | Google Académico
24. Broeckx, S, Zimmerman, M, Crocetti, S, Suls, M, Mariën, T, Ferguson, SJ, et al. Terapias regenerativas para la enfermedad articular degenerativa equina: un estudio preliminar. PloS Uno. (2014) 9:1–11. doi: 10.1371/journal.pone.0085917
25. Broeckx, SY, Maes, S, Martinello, T, Aerts, D, Chiers, K, Mariën, T, et al. Epidermis equina: una fuente de células madre/progenitoras de tipo epitelial con capacidades regenerativas in vitro e in vivo. desarrollo de células madre. (2013) 23:1134–48. doi: 10.1089/scd.2013.0203
26. Tan, K, Zheng, K, Li, D, Lu, H, Wang, S y Sun, X. Impacto del tejido adiposo o las células madre mesenquimales derivadas del cordón umbilical en la inmunogenicidad de las células progenitoras endoteliales derivadas de la sangre del cordón umbilical humano. PloS Uno. (2017) 12:e0178624. doi: 10.1371/journal.pone.0178624
Resumen de PubMed | Texto completo de Crossref | Google Académico
27. Schnabel, L, Pezzanite, LM, Antczak, DF, Felippe, MJB, y Fortier, LA. Las células estromales mesenquimales derivadas de la médula ósea equina son heterogéneas en la expresión del MHC de clase II y capaces de inducir una respuesta inmunitaria in vitro. Células madre Res ther. (2014) 5:13. doi: 10.1186/scrt402
Resumen de PubMed | Texto completo de Crossref | Google Académico
28. Carlier, S, Depuydt, E, Suls, M, Bocqué, C, Thys, J, Vandenberghe, A, et al. Células madre mesenquimales tenógenas alogénicas equinas: un estudio de campo clínico en caballos que sufren lesiones naturales del tendón flexor digital superficial y del ligamento suspensorio. Veterinario Equino J. (2023). doi: 10.1111/evj.14008 [En línea antes de imprimir].
Resumen de PubMed | Texto completo de Crossref | Google Académico
29. Broeckx, S. Tenogénesis de células madre mesenquimales derivadas de sangre periférica equina: in vitro versus in vivo. J Tissue Sci Eng. (2012) C11:1-6. doi: 10.4172/2157-7552.S11-001
30. Balan, M, McCullough, M, y O’Brien, PJ. Reticulocitos sanguíneos equinos: intervalos de referencia, cambios fisiológicos y patológicos. Comp Clin Pathol. (2019) 28:53–62. doi: 10.1007/s00580-018-2820-4
31. Giordano, A, Rossi, G, Pieralisi, C, y Paltrinieri, S. Evaluación de hemogramas equinos utilizando el ADVIA 120 en comparación con un contador de impedancia y conteo diferencial manual. Veterinario Clin Pathol. (2008) 37:21–30. doi: 10.1111/j.1939-165X.2008.00012.x
Resumen de PubMed | Texto completo de Crossref | Google Académico
32. Wang, Y, Tian, M, Wang, F, Heng, BC, Zhou, J, Cai, Z, et al. Comprensión de los mecanismos inmunológicos de las células madre mesenquimales en el trasplante alogénico: desde el punto de vista del complejo mayor de histocompatibilidad clase I. Desarrollo de células madre. (2019) 28:1141–50. doi: 10.1089/scd.2018.0256
33. Deuse, T, Hu, X, Gravina, A, Wang, D, Tediashvili, G, De, C, et al. Los derivados hipoinmunogénicos de las células madre pluripotentes inducidas evaden el rechazo inmunitario en receptores alogénicos totalmente inmunocompetentes. Nat Biotechnol. (2019) 37:252–8. doi: 10.1038/s41587-019-0016-3
Resumen de PubMed | Texto completo de Crossref | Google Académico
34. Baraniak, PR, y McDevitt, TC. Acciones paracrinas de las células madre y regeneración de tejidos. Regen Med. (2010) 5:121–43. doi: 10.2217/rme.09.74
Resumen de PubMed | Texto completo de Crossref | Google Académico
35. Nöth, U, Steinert, AF, y Tuan, RS. Conocimiento tecnológico: células madre mesenquimales adultas para el tratamiento de la artrosis. Nat Clin Pract Rheumatol. (2008) 4:371–80. doi: 10.1038/ncprheum0816
Resumen de PubMed | Texto completo de Crossref | Google Académico
36. Weiss, ARR, y Dahlke, MH. Inmunomodulación por células madre mesenquimales (MSCs): mecanismos de acción de las MSCs vivas, apoptóticas y muertas. (2019) 10:1191 doi: 10.3389/fimmu.2019.01191
Resumen de PubMed | Texto completo de Crossref | Google Académico
37. Berglund, AK, Long, JM, Robertson, JB y Schnabel, LV. El TGF-β2 reduce la inmunogenicidad mediada por células de las células madre mesenquimales derivadas de la médula ósea equina MHC sin alterar las propiedades inmunomoduladoras. Front Cell Dev Biol. (2021) 9:628382. doi: 10.3389/fcell.2021.628382
Resumen de PubMed | Texto completo de Crossref | Google Académico
38. Berglund, AK, Fisher, MB, Cameron, KA, Poole, EJ y Schnabel, LV. La transformación del factor de crecimiento-β2 regula a la baja la expresión superficial del complejo mayor de histocompatibilidad (MHC) I y MHC II en células madre mesenquimales derivadas de la médula ósea equina sin alterar otros marcadores fenotípicos de la superficie celular. Front Vet Sci. (2017) 4:272065. doi: 10.3389/fvets.2017.00084
39. Beerts, C, Suls, M, Broeckx, SY, Seys, B, Vandenberghe, A, Declercq, J, et al. Células madre mesenquimales alogénicas de sangre periférica inducidas tenogénicamente en plasma alogénico rico en plaquetas: seguimiento de 2 años después del tratamiento de tendones o ligamentos en caballos. Front Vet Sci. (2017) 4:1–10. doi: 10.3389/fvets.2017.00158
40. van den Belt, AJM, Keg, PR, Dik, KJ, y Barneveld, A. La correlación entre la dosis y la distribución de las inyecciones de líquido intratendinoso en los tendones/ligamentos flexores del caballo. J Vet Med A Physiol Pathol Clin Med. (1993) 40:713–9. doi: 10.1111/j.1439-0442.1993.tb00688.x
Resumen de PubMed | Texto completo de Crossref | Google Académico
41. Southwood, LL. Rangos normales para hematología y química de palsma y tabla de conversión de unidades. Guía práctica para el cólico equino. (2013):339–42. doi: 10.1002/9781118704783.app3
42. Walsh, KA. Proteínas. Hematol equino, Citología, Clin Chem. (2020):95–102. doi: 10.1002/9781119500186.ch8
43. Tyler, RD, Cowell, RL, y Meinkoth, JH. Trastornos y evaluación de laboratorio. Veterinario Clin Patol Secretos. (2004):51–60. doi: 10.1016/B978-1-56053-633-8.50014-0
44. Mueller, MM, Bomke, B y Seifried, E. Plasma fresco congelado en pacientes con coagulación intravascular diseminada o en pacientes con enfermedades hepáticas. Res. de trombos. (2002) 107:S9-S17. doi: 10.1016/S0049-3848(02)00146-9
45. Sok, D, Raval, S, McKinney, J, Drissi, H, Mason, A, Mautner, K, et al. Los AINE reducen la eficacia terapéutica de la terapia con células estromales mesenquimales en un modelo de osteoartritis postraumática en roedores. Am J Sports Med. (2022) 50:1389–98. doi: 10.1177/03635465221083610
Resumen de PubMed | Texto completo de Crossref | Google Académico
46. Müller, M, Raabe, O, Addicks, K, Wenisch, S, y Arnhold, S. Efectos de los antiinflamatorios no esteroideos sobre la proliferación, diferenciación y migración en células madre mesenquimales equinas. Cell Biol Int. (2011) 35:235–48. doi: 10.1042/CBI20090211
Resumen de PubMed | Texto completo de Crossref | Google Académico
Palabras clave: equino, tendinitis, desmitis, células madre mesenquimales, MSCs cebadas
Cita: Carlier S, Depuydt E, Van Hecke L, Martens A, Saunders J y Spaas JH (2024) Evaluación de la seguridad de las células madre mesenquimales preparadas alogénicas alogénicas equinas en caballos con lesiones naturales de tendones y ligamentos. Frente. Vet. Sci. 11:1282697. doi: 10.3389/fvets.2024.1282697
Recibido: 24 de agosto de 2023; Aceptado: 07 de febrero de 2024;
Publicado: 26 Febrero 2024.
Editado por:
Louis Charles Penning, Universidad de Utrecht, Países Bajos
Revisado por:
Stefano Grolli, Universidad de Parma, Italia
Iris Gerner, Universidad de Medicina Veterinaria de Viena, Austria
Derechos de autor © 2024 Carlier, Depuydt, Van Hecke, Martens, Saunders y Spaas. Este es un artículo de acceso abierto distribuido bajo los términos de la Licencia Creative Commons Attribution License (CC BY).
*Correspondencia: Stephanie Carlier, stephaniecarlier@outlook.com
Renuncia: Todas las afirmaciones expresadas en este artículo son únicamente las de los autores y no representan necesariamente las de sus organizaciones afiliadas, ni las del editor, los editores y los revisores. Cualquier producto que pueda ser evaluado en este artículo o afirmación que pueda hacer su fabricante no está garantizado ni respaldado por el editor.
Date de alta y recibe nuestro 👉🏼 Diario Digital AXÓN INFORMAVET ONE HEALTH
Date de alta y recibe nuestro 👉🏼 Boletín Digital de Foro Agro Ganadero
Noticias animales de compañía
Noticias animales de producción
Trabajos técnicos animales de producción
Trabajos técnicos animales de compañía