Colonización en Escherichia coli productora de toxina Shiga

Variación en la distribución de factores putativos de virulencia y colonización en Escherichia coli productora de toxina Shiga aislada de diferentes categorías de ganado
 María E. Cáceres1,
María E. Cáceres1,  Analía I. Etcheverría1*,
Analía I. Etcheverría1*,  Daniel Fernández2,
Daniel Fernández2,  Edgardo M. Rodríguez3 y
Edgardo M. Rodríguez3 y  Nora L. Padola1
Nora L. Padola1- 1Laboratorio de Inmunoquímica y Biotecnología, Departamento de Sanidad Animal y Medicina Preventiva, Centro de Investigación Veterinaria Tandil, CONICET, CICPBA, Tandil, Argentina
- 2Laboratorio de Inmunoquímica y Biotecnología, Departamento de Sanidad Animal y Medicina Preventiva, Facultad de Ciencias Veterinarias, Tandil, Argentina
- 3Área de Bioestadística, Departamento Sanidad Animal y Medicina Preventiva, Centro de Investigación Veterinaria, Facultad de Ciencias Veterinarias, Tandil, Argentina
La Escherichia coli productora de toxina Shiga (STEC) son patógenos de gran preocupación para la salud pública. Varios estudios han confirmado que el ganado bovino es el principal reservorio de STEC en Argentina y otros países. Aunque las toxinas Shiga representan los principales factores de virulencia de STEC, la adherencia y colonización del intestino también son importantes en la patogénesis de las bacterias. El objetivo de este estudio fue analizar y comparar la presencia de supuestos factores de virulencia codificados en plásmidos –katP, espP, subA, stcE– y adhesinas implicadas en la colonización de bovinos –efa1, iha– en 255 cepas nativas de STEC aisladas de diferentes categorías de ganado de diferentes sistemas de producción. El gen más prevalente en todas las cepas fue espP, y el menos prevalente fue stcE. katP se detectó altamente en cepas aisladas de terneros jóvenes y de cría (33,3%), mientras que subA fue predominante en las aisladas de adultos (71,21%). Las cepas de terneros jóvenes mostraron el mayor porcentaje de efa1 (72,46%), mientras que iha mostró una alta distribución en cepas de terneros y adultos (87,04 y 98,48% respectivamente). Se observó que espP e iha estaban ampliamente distribuidas en todas las cepas, mientras que katP, stcE y efa1 estaban más asociadas con la presencia de eae y subA con las cepas eae-negativas. Una gran proporción de cepas negativas para eae se aislaron de adultos -granjas lecheras y de pastoreo- y de terneros de cría -lechera y corral de engorde-, mientras que la mayoría de las cepas eae-positivas se aislaron de terneros jóvenes lecheros. Los datos expuestos indican una correlación entre la categoría del animal y los sistemas de producción con la presencia o ausencia de varios genes implicados en la adherencia y virulencia de STEC.
Introducción
La Escherichia coli productora de toxina Shiga (STEC) son patógenos endémicos en Argentina con un alto impacto en el sistema de salud. STEC se ha asociado con brotes y casos esporádicos de enfermedades humanas, causando diarrea, colitis hemorrágica (HC) y síndrome urémico hemolítico (SUH) (Paton y Paton, 1998).
Los principales factores de virulencia de STEC son las toxinas Shiga (stx), sin embargo, la adherencia y colonización del intestino también son importantes y constituyen el primer paso en la patogénesis de las bacterias (Szalo et al., 2002). Otro factor de virulencia típico es Intimin, una proteína de adherencia a la membrana externa codificada por eae, ubicada en el locus de borramiento de enterocitos (LEE), que es responsable de la lesión histopatológica llamada «unión y efación» (A/E) (Nataro y Kaper, 1998). La isla de patogenicidad LEE está presente en un conjunto de serotipos STEC considerados altamente virulentos, sin embargo, LEE no parece ser esencial para la patogénesis, ya que un gran número de cepas LEE-negativas se ha asociado con brotes esporádicos de HC y HUS (Cergole-Novella et al., 2007; Cundon et al., 2015). Se han descrito otros factores de colonización más allá de la Intimin: una proteína que confiere adherencia similar a la Vibrio cholerae IrgA (iha) que confiere la capacidad de adherirse a las células epiteliales en un patrón difuso (Tarr et al., 2000) y un factor enterohemorrágico de Adherencia por E. coli (efa1) implicado en la colonización intestinal de terneros (Nicholls et al., 2000; Stevens y otros, 2002).
Existen factores de virulencia putativos adicionales codificados por plásmidos que contribuyen a la supervivencia y citotoxicidad del STEC, como una hemolisina (ehxA) codificada por el plásmido pO157 con actividad citotóxica en líneas celulares humanas y bovinas (Schmidt et al., 1995), una katalasa-peroxidasa (katP) que forma parte de los mecanismos de defensa bacteriana contra el estrés oxidativo, una serina proteasa extracelular (espP ) que es capaz de escindir la pepsina y el factor V de coagulación, lo que sugiere que podría ser un factor de virulencia accesorio que exacerba la HC (Caprioli et al., 2005; Brockmeyer et al., 2007), y una metaloproteasa zink (stcE), que modifican la capa protectora del intestino huésped para ayudar a la formación de pedestal-actina codificada por LEE contribuyendo a la adherencia íntima a las células (Grys et al., 2005). Se ha reportado la presencia de otras toxinas además de Stx, como la citotoxina subtilasa (subAB) codificada por el plásmido pO113 particularmente transportado por cepas STEC eae-negativas. Esta toxina es letal para los ratones, inhibe la síntesis de proteínas, tiene propiedades proinflamatorias y puede desempeñar un papel importante en la patogénesis de la enfermedad STEC (Paton y Paton, 2010).
Varios estudios han confirmado que el ganado bovino es el principal reservorio de serotipos STEC O157 y no O157 en Argentina y otros países, con una prevalencia variable que osciló entre 22 y 62,7% en diferentes categorías de bovinos (Sanz et al., 1998; Blanco y otros, 2004; Padola y otros, 2004). En bovinos jóvenes, se mostró una prevalencia de STEC en 25, 43 y 58% en terneros recién nacidos, alimentados con leche y terneros lecheros en crecimiento, respectivamente. La presencia de STEC en terneros recién nacidos de <24 h de edad sugiere que están expuestos a esta bacteria rápidamente después del nacimiento, que juega un papel importante en la transmisión vertical de STEC (Fernández et al., 2012). Asimismo, se ha detectado una alta prevalencia de STEC en vacas lecheras, ganado prefasto y ganado sano de pastoreo -37,5, 44 y 22%, respectivamente- (Sanz et al., 1998; Fernández et al., 2009). Estudios recientes confirman la edad del ganado como un factor importante que influye significativamente en la cobertizo de STEC, más que otros factores fisiológicos, como la raza, el sexo o el aumento de peso. Los datos revelaron que los terneros tenían más probabilidades de perder STEC durante los primeros 6 meses, alcanzaron su punto máximo a los 2 años de edad y disminuyeron a medida que el animal maduraba. Se encontró que la diversidad de la microflora intestinal podría ser una razón para esa variación (Mir et al., 2014, 2016).
El contacto con las heces del ganado, el contacto directo con los animales o su entorno y el consumo de carne contaminada de res, leche, productos lácteos, agua, jugos de manzana no pasteurizados y verduras, son posibles rutas para la exposición humana y la enfermedad STEC (Cody et al., 1999; Olsen y otros, 2002; Jure y otros, 2010; Brusa et al., 2013). Debido a que la mayoría de las infecciones humanas por STEC son causadas por el consumo de productos animales contaminados, el conocimiento de los perfiles de virulencia y los factores de colonización de STEC entre diferentes categorías de animales podría proporcionar información para evaluar algunas estrategias para controlar la muda de ganado con el fin de disminuir la incidencia de enfermedades en humanos. Por lo tanto, el objetivo de este estudio fue analizar y comparar la presencia de supuestos factores de virulencia codificados en megaplásmidos y adhesinas involucradas en la colonización de ganado en una colección de cepas STEC aisladas de diferentes categorías de ganado y diferentes sistemas de producción de Argentina.
Materiales y métodos
Aislamientos bacterianos
Se analizaron un total de 255 cepas STEC ehxA positivas del Laboratorio de Inmunoquímica y Biotecnología (UNCPBA, Tandil, Buenos Aires, Argentina). Todas las cepas STEC se aislaron previamente de muestras fecales de ganado de diferentes categorías, nombradas en este estudio como: terneros jóvenes (0-2 meses), terneros de cría (2-8 meses) y adultos (>8 meses), que provenían de diferentes sistemas de producción regionales (granja lechera, corral de engorde y pastoreo). Las cepas STEC fueron serotipadas y caracterizadas para la detección de factores de virulencia típicos –stx1, stx2, eae, ehxA– y saa (Sanz et al., 1998; Padola y otros, 2004; Fernández et al., 2010, 2012).
PCR
Para la detección de genes megaplásmidos –katP, espP, subA, stcE– se realizó una PCR multiplex según la metodología descrita por Bustamante et al. (2011). Se realizaron dos PCR para la detección de efa1 e iha según lo descrito por Nicholls et al. (2000) y Szalo et al. (2002), con algunas modificaciones. Los cebadores y el tamaño de los productos de PCR se muestran en la Tabla 1. Los productos de PCR se visualizaron mediante electroforesis en gel de agarosa (2%), con tinción de bromuro de etidio.
Análisis estadístico
Con el fin de describir la distribución de genes plásmidos y adhesinas entre diferentes categorías de bovinos, los datos se analizaron mediante la prueba de Chi2, o la prueba exacta de Fisher si fuera necesario y posible, utilizando el procedimiento PROC FREQ de Statistical Analysis Systems, Versión 9.3 (SAS Institute, Cary, NY).
Resultados
Distribución de los genes de plásmidos y adhesinas en STEC según la categoría de bovinos
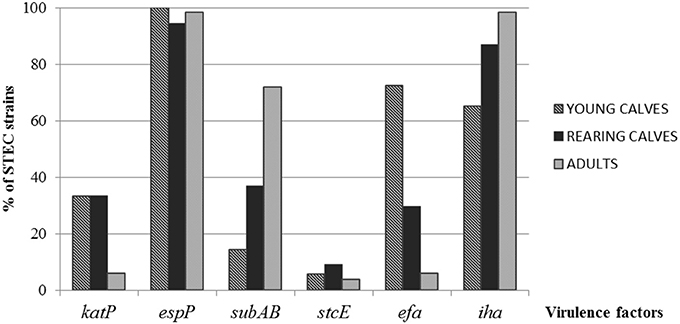
El gen más prevalente detectado entre todas las cepas, independientemente de la categoría de ganado, fue espP, mientras que stcE fue el menos prevalente (p = 0,0679 y p = 0,2670, respectivamente). Para katP, las diferencias observadas entre categorías, terneros jóvenes, terneros de cría y adultos (33,3, 33,3 y 6,1%, respectivamente) fueron estadísticamente significativas (p < 0,0001). SubA se encontró principalmente en cepas aisladas de adultos (71,21%; p < 0,0001; Figura 1).
FIGURA 1. DISTRIBUCIÓN DE FACTORES DE VIRULENCIA EN CEPAS STEC ENTRE LAS DIFERENTES CATEGORÍAS DE BOVINOS.
Se observaron diferencias significativas en la distribución de efa1, con un mayor porcentaje en cepas de terneros jóvenes (72,46%) que de terneros (29,63%) y adultos (6,06%) (p < 0,0001). La distribución de iha mostró la mayor proporción en cepas aisladas de adultos (98,48%; p = 0,0126; Figura 1).
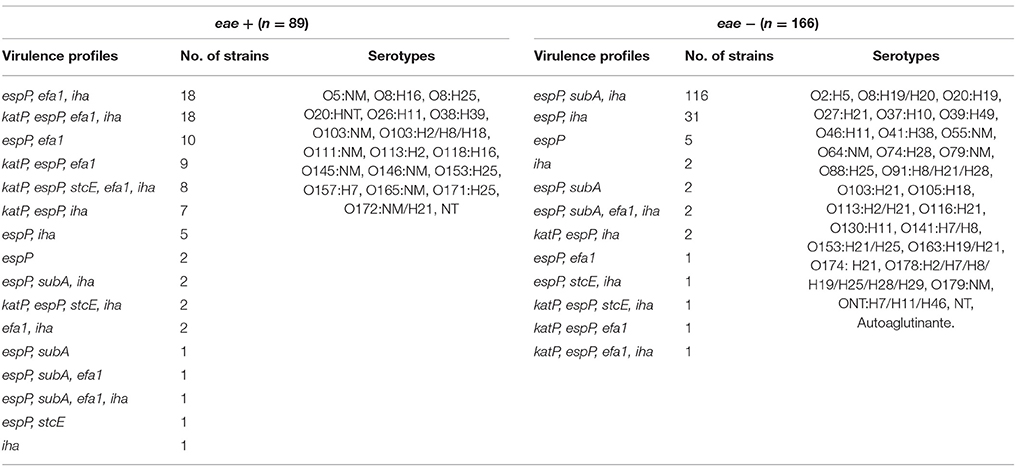
El perfil de virulencia más prevalente en cepas STEC aisladas de terneros jóvenes fue espP, efa1, iha (21,73%), mientras que espP, subA, iha fue el más prevalente en terneros y adultos (37 y 68,3% respectivamente) (Tabla 2).
Comparación de la distribución génica entre cepas según presencia o ausencia de eae
La mayoría de las cepas eae positivas se aislaron de terneros jóvenes de granjas lecheras y terneros de cría de corrales de engorde; mientras que los serotipos negativos para EAE se aislaron principalmente de adultos lecheros y de pastoreo. katP, efa1 y stcE fueron predominantes en los serotipos eae-positivos, mientras que subA e iha fueron prevalentes en los serotipos eae-negativos (Tabla 3).
Discusión
Dado que el ganado ha sido reconocido como el principal reservorio de STEC, varias cepas de diferentes fuentes y sistemas de producción han sido aisladas por nuestro grupo de investigación (Sanz et al., 1998; Parma y otros, 2000; Padola y otros, 2004; Fernández et al., 2009, 2010, 2012). El aislamiento y caracterización de STEC de bovinos es esencial para el desarrollo de herramientas de diagnóstico y control para evitar la transmisión de STEC a los humanos a través del consumo de alimentos contaminados de origen bovino. En estudios recientes, se investigó la prevalencia de STEC en ganado de carne y se encontró una fuerte correlación entre la edad y la muda (Mir et al., 2014). Los terneros han sido identificados como los principales excretores de STEC disminuyendo con el crecimiento del animal. Del mismo modo, la presencia de stx se ha correlacionado con la edad, especialmente stx2, detectada en terneros jóvenes. El genotipado de factores adicionales en STEC aislados de animales con diferentes edades es necesario para un conocimiento más adecuado de su riesgo para la salud humana (Mir et al., 2016).
En este estudio, se demostró la edad como un factor de influencia significativa en la distribución de algunos factores de virulencia y colonización de STEC. De acuerdo con Bustamante et al. (2011) encontramos una mayor prevalencia de espP entre todas las cepas STEC independientemente de la categoría de ganado y el sistema de producción, y stcE fue la menos prevalente. Mientras que la espP se detectó ampliamente entre los serotipos eae-positivos y eae-negativos, stcE se detectó en unos pocos serotipos eae-positivos, como O157:H7, O64:NM y NT. Hasta donde sabemos, este es el primer informe de la presencia de stcE en O64:NM. Se encontró una mayor prevalencia de katP en STEC aislado de terneros jóvenes y de cría. Todas las cepas katP positivas también contenían espP, y algunas de ellas albergaban stcE.
La citotoxina subtitasa (SubAB) se describió por primera vez en STEC O113:H21 responsable de un brote de SUH (Paton et al., 1999). Luego, se identificó el gen subA en varios serotipos STEC eae-negativos aislados de bovinos, alimentos y pacientes humanos (Cergole-Novella et al., 2007; Galli y otros, 2010; Wu et al., 2010). En este estudio, los serotipos STEC negativos para eae O113:H21, O116:H21, O130:H11, O178:H19 y ONT:H7 portaban subA y se aislaron principalmente de terneros y adultos de sistemas lecheros y de pastoreo y, de acuerdo con Bustamante et al. (2011), ninguno de los STEC subA positivos albergaba ni stcE ni katP.
Se han descrito algunas adhesinas putativas para investigar los mecanismos subyacentes a la adherencia de las cepas STEC a las células epiteliales. En este estudio, se encontraron grandes diferencias entre las categorías de ganado con respecto a las adhesinas investigadas. En aquellas cepas STEC aisladas de terneros lecheros jóvenes y terneros de engorde, se detectaron altos porcentajes de efa1, disminuyendo con el aumento de la edad. De acuerdo con informes anteriores (Nicholls et al., 2000; Toma y otros, 2004; Galli et al., 2010) El 89,5% de las cepas positivas para EFA1 también fueron EAE-positivas. Varios autores han detectado una alta prevalencia de iha en cepas STEC aisladas de animales, alimentos y humanos, la mayoría de ellas eae-negativas (Cergole-Novella et al., 2007; Galli et al., 2010). Nuestros resultados muestran que se detectó iha en todas las cepas de STEC en cuanto a la categoría de bovinos, aunque fue más prevalente en aquellos aislados de adultos, y en serotipos STEC eae-negativos. Sin embargo, Kobayashi et al. (2013) encontraron altos porcentajes de iha en cepas STEC eae-positivas, lo que sugiere que este gen podría tener una amplia distribución en STEC más allá de la presencia de eae.
Las diferencias en las características genéticas de las cepas STEC en referencia a la edad pueden explicarse por la composición de la microflora de la diversidad intestinal, la baja concentración de microflora normal de Enterobacteriaceae que debería influir en la supervivencia, adherencia y colonización de STEC en el intestino del ganado (Zhao et al., 2013). En animales adultos, la prevalencia de STEC disminuye mientras que la microflora comensal aumenta su diversidad, posiblemente influenciada por la dieta de los animales que cambia a medida que el animal desteta, crece y comienza a incorporar pastos, o dieta específica según el sistema de producción (Mir et al., 2016).
Data exposed indicate a correlation between the category of the animal and the production systems with the presence or absence of several genes implicated in adherence and virulence of STEC. Further studies are necessary to better understand the involvement of these genes in the dynamic of colonization and survival of this pathogen in cattle in order to establish control strategies to reduce the transmission of STEC from animals to humans.
Contribuciones del autor
MC diseñó y realizó los experimentos, analizó los datos, escribió el artículo. DF realizó los experimentos, revisó el manuscrito. ER analizó estadísticamente los datos. AE y NP diseñaron los experimentos y revisaron críticamente el manuscrito.
Declaración de conflicto de intereses
Los autores declaran que la investigación se llevó a cabo en ausencia de cualquier relación comercial o financiera que pudiera interpretarse como un posible conflicto de intereses.
Reconocimientos
Los autores agradecen a María R. Ortiz, del Laboratorio de Inmunoquímica y Biotecnología (UNCPBA, Tandil, Buenos Aires, Argentina) por su asistencia técnica. Este trabajo fue apoyado por PICT 2015/2666 y PICT 2013/1749 y SECAT, UNCPBA.
Referencias
Blanco, M., Blanco, J. E., Mora, A., Dahbi, G., Alonso, M. P., González, E. A., et al. (2004). Serotipos, genes de virulencia y tipos de intimina de aislados de Escherichia coli productora de toxina Shiga (verotoxina) de bovinos en España e identificación de un nuevo gen variante de la intimina (eae-ξ). J. Clin. Microbiol. 42, 645–651. doi: 10.1128/JCM.42.2.645-651.2004
Resumen de PubMed | Texto completo de CrossRef | Google Académico
Brockmeyer, J., Bielaszewska, M., Fruth, A., Bonn, M. L., Mellmann, A., Humpf, H.-U., et al. (2007). Subtipos de la serina proteasa EspP codificada por plásmidos en Escherichia coli productora de toxina shiga: distribución, secreción y actividad proteolítica. Aplicación. Entorno. Microbiol. 73, 6351–6359. doi: 10.1128/AEM.00920-07
Resumen de PubMed | Texto completo de CrossRef | Google Académico
Brusa, V., Aliverti, V., Aliverti, F., Ortega, E. E., de la Torre, J. H., Linares, L. H., et al. (2013). Escherichia coli productora de toxina Shiga en mercados minoristas de carne de Argentina . Frente. Celda. Infecta. Microbiol. 2:171. doi: 10.3389/fcimb.2012.00171
Resumen de PubMed | Texto completo de CrossRef | Google Académico
Bustamante, A. V., Sanso, A. M., Lucchesi, P. M. A. y Parma, A. E. (2011). Ensayo de PCR multiplex para la detección de cinco genes de virulencia putativos codificados en plásmidos verotoxigénicos de Escherichia coli. Curr. Microbiol. 62, 1411–1415. DOI: 10.1007/S00284-011-9877-5
Caprioli, A., Morabito, S., Brugère, H. y Oswald, E. (2005). Escherichia coli enterohemorrágica: problemas emergentes sobre virulencia y modos de transmisión. Vet. 36, 289–311. doi: 10.1051/vetres:2005002
Cergole-Novella, M. C., Nishimura, L. S., Fernando dos Santos, L., Irino, K., Vaz, T. M., Bergamini, A. M., et al. (2007). Distribución de perfiles de virulencia relacionados con nuevas toxinas y adhesinas putativas en Escherichia coli productora de toxina Shiga aislada de diversas fuentes en Brasil. FEMS Microbiol. Lett. 274, 329–334. doi: 10.1111/j.1574-6968.2007.00856.x
Resumen de PubMed | Texto completo de CrossRef | Google Académico
Cody, S. H., Glynn, M. N., Farrar, J. A., Cairns, K. L., Griffin, P. M., Kobayashi, J., et al. (1999). Un brote de infección por Escherichia coli O157: H7 de jugo de manzana comercial no pasteurizado. Ann. Pasante Med. 130, 202–209. DOI: 10.7326/0003-4819-130-3-199902020-00005
Resumen de PubMed | Texto completo de CrossRef | Google Académico
Cundon, C., Marey, E., Roldán, F., Canosa Montero, C. S., Navarro, A., Padola, N. L., et al. (2015). Detección y Caracterización Preliminar de Escherichia coli O174 Productor de Toxina. Buenos Aires: SNS Publicación periodística científico-tecnológica, 2314–2901.
Fernández, D., Irino, K., Sanz, M. E., Padola, N. L. y Parma, A. E. (2010). Caracterización de Escherichia coli productora de toxina Shiga aislada de vacas lecheras en Argentina. Aplicación. Microbiol. 51, 377–382. doi: 10.1111/j.1472-765X.2010.02904.x
Resumen de PubMed | Texto completo de CrossRef | Google Académico
Fernández, D., Rodríguez, E. M., Arroyo, G., Padola, N. L. y Parma, A. E. (2009). Variación estacional de genes codificadores de toxina Shiga (stx) y detección de E. coli O157 en ganado lechero de Argentina. J. App. Microbiol. 106, 1260–1267. doi: 10.1111/j.1365-2672.2008.04088.x
Resumen de PubMed | Texto completo de CrossRef | Google Académico
Fernández, D., Sanz, M. E., Parma, A. E. y Padola, N. L. (2012). Comunicación corta: caracterización de Escherichia coli productora de toxina Shiga aislada de terneros recién nacidos, alimentados con leche y en crecimiento en Argentina. J. Dairy Sci. 95, 5340–5343. DOI: 10.3168/JDS.2011-5140
Resumen de PubMed | Texto completo de CrossRef | Google Académico
Galli, L., Miliwebsky, E., Irino, K., Leotta, G. y Rivas, M. (2010). Comparación del perfil de virulencia entre cepas de Escherichia coli productoras de toxina Shiga LEE-negativas (STEC) aisladas de bovinos y humanos. Veterinario Microbiol. 143, 307–313. doi: 10.1016/j.vetmic.2009.11.028
Resumen de PubMed | Texto completo de CrossRef | Google Académico
Grys, T. E., Siegel, M. B., Lathem, W. W. y Welch, R. A. (2005). La proteasa StcE contribuye a la adherencia íntima de Escherichia coli O157:H7 enterohemorrahic a las células huésped. Infecta. Inmun. 73, 1295–1303. doi: 10.1128/IAI.73.3.1295-1303.2005
Resumen de PubMed | Texto completo de CrossRef | Google Académico
Jure, M. A., Condorí, S., Leotta, G. A., Chinen, I., Miliwebsky, E., Allori, C., et al. (2010). Detección, aislamiento y caracterización de Escherichia coli productor de toxina Shiga a partir de carne molida fresca proveniente de carnicerías de Concepción, provincia de Tucumán. Rev. Microbiol. 42, 284–287. doi: 10.1590/S0325-75412010000400009
Kobayashi, N., Lee, K., Yamazaki, A., Saito, S., Furukawa, I., Kono, T., et al. (2013). Perfiles genéticos de virulencia y análisis genético poblacional para la exploración de serogrupos patógenos de Escherichia coli productora de toxina Shiga. J. Clin. Microbiol. 51, 4022–4028. doi: 10.1128/JCM.01598-13
Resumen de PubMed | Texto completo de CrossRef | Google Académico
Mir, R. A., Weppelmann, T. A., Elzo, M., Ahn, S., Driver, J. D. y Jeong, K. C. (2016). Colonización del ganado de carne por Escherichia coli productora de toxina Shiga durante el primer año de vida: un estudio de cohorte. PLoS ONE 11:e0148518. doi: 10.1371/journal.pone.0148518
Resumen de PubMed | Texto completo de CrossRef | Google Académico
Mir, R. A., Weppelmann, T. A., Kanga, M., Bliss, T. M., DiLorenzo, N., Lamb, G. C., et al. (2014). Asociación entre la edad animal y la prevalencia de Escherichia coli productora de toxina Shiga en una cohorte de ganado vacuno. Veterinario Microbiol. 175, 325–331. doi: 10.1016/j.vetmic.2014.12.016
Resumen de PubMed | Texto completo de CrossRef | Google Académico
Nataro, J. P., y Kaper, J. B. (1998). Escherichia coli diarreicogénica. Clin. Microbiol. Apocalipsis 11, 142–201.
Nicholls, L., Grant, T. H. y Robins-Browne, R. M. (2000). Identificación de un nuevo locus genético necesario para la adhesión in vitro de un aislado clínico de Escherichia coli enterohemorrágica a células epiteliales. Mol. Microbiol. 35, 275–288. doi: 10.1046/j.1365-2958.2000.01690.x
Resumen de PubMed | Texto completo de CrossRef | Google Académico
Olsen, S. J., Miller, G., Breuer, T., Kennedy, M., Higgins, C., Walford, J., et al. (2002). Un brote transmitido por el agua de infecciones por Escherichia coli O157: H7 y síndrome urémico hemolítico: implicaciones para los sistemas de agua rurales. Emerg. Infecta. Dis. 8, 370–375. DOI: 10.3201/EID0804.000218
Resumen de PubMed | Texto completo de CrossRef | Google Académico
Padola, N. L., Sanz, M. E., Blanco, J. E., Blanco, M., Blanco, J., Etcheverría, A. I., et al. (2004). Serotipos y genes de virulencia de aislados de Escherichia coli shigatoxigénica (STEC) de un corral de engorde en Argentina. Veterinario Microbiol. 100, 3–9. doi: 10.1016/S0378-1135(03)00127-5
Parma, A. E., Sanz, M. E., Blanco, J. E., Blanco, J., Vi-as, M. R., Blanco, M., et al. (2000). Genotipos de virulencia y serotipos de Escherichia coli verotoxigénica aislada de bovinos y alimentos en Argentina. Importancia en salud pública. Eur. J. Epidemiol. 16, 757–762. doi: 10.1023/A:1026746016896
Resumen de PubMed | Texto completo de CrossRef | Google Académico
Paton, A. W., y Paton, J. C. (2005). PCR multiplex para la detección directa de cepas de Escherichia coli shiga toxigénicas que producen la nueva citotoxina subtilasa. J. de Clin. Microbiol. 43, 2944–2947. doi: 10.1128/JCM.43.6.2944-2947.2005
Resumen de PubMed | Texto completo de CrossRef | Google Académico
Paton, A. W., y Paton, J. C. (2010). Escherichia coli Citotoxina subtilasa. Toxinas (Basilea). 2, 215–228. doi: 10.3390/toxinas2020215
Resumen de PubMed | Texto completo de CrossRef | Google Académico
Paton, A. W., Woodrow, M. C., Doyle, R. M., Lanser, J. A. y Paton, J. C. (1999). Caracterización molecular de una cepa Shiga-toxigénica de Escherichia coli O113:H21 que carece de eae responsable de un grupo de casos de síndrome urémico hemolítico. J. Clin. Microbiol. 37, 3357–3361.
Paton, J. C., y Paton, A. W. (1998). Patogénesis y diagnóstico de infecciones por Escherichia coli productoras de toxina Shiga. Clin. Microbiol. Apocalipsis 11, 450–479.
Sanz, M. E., Vi-as, R. M. y Parma, A. E. (1998). Prevalencia de Escherichia coli productora de verotoxinas bovinas en Argentina. Eur. J. Epidemiol. 14, 399–403. doi: 10.1023/A:1007427925583
Resumen de PubMed | Texto completo de CrossRef | Google Académico
Schmidt, H., Beutin, L. y Karch, H. (1995). Análisis molecular de la hemolisina codificada por plásmidos de Escherichia coli O157:H7 cepa EDL933. Infecta. Inmun. 63, 1055–1061.
Stevens, M. P., van Diemen, P. M., Frankel, G., Philips, A. D. y Wallis, T. S. (2002). Efa1 Influye en la colonización del intestino bovino por los serotipos O5 y O111 de Escherichia coli productores de toxina Shiga. Infectar. Inmune. 70, 5158–5166. doi: 10.1128/IAI.70.9.5158-5166.2002
Resumen de PubMed | Texto completo de CrossRef | Google Académico
Szalo, I. M., Goffaux, F., Pirson, V., Piérard, D., Ball, H. y Mainil, J. (2002). Presencia en Escherichia coli enteropatógena bovina (EPEC) y enterohemorrágica (EHEC) de genes que codifican para supuestas adhesinas de cepas humanas de EHEC. Res. Microbiol. 153, 653–658. doi: 10.1016/S0923-2508(02)01379-7
Resumen de PubMed | Texto completo de CrossRef | Google Académico
Tarr, P. I., Bilge, S. S., Vary, J. C. Jr., Jelacic, S., Habeeb, R. L., Ward, T. R., et al. (2000). Iha: una nueva molécula que confiere adherencia a Escherichia coli O157:H7 codificada en una isla cromosómica de estructura conservada recientemente adquirida. Infectar. Inmune. 68, 1400–1407. doi: 10.1128/IAI.68.3.1400-1407.2000
Resumen de PubMed | Texto completo de CrossRef | Google Académico
Toma, C., Martínez Espinosa, E., Song, T., Miliwebsky, E., Chinen, I., Iyoda, S., et al. (2004). Distribución de supuestas adhesinas en Escherichia coli productora de toxina Shiga de diferentes seropatotipos. J. Clin. Microbiol. 42, 4937–4946. doi: 10.1128/JCM.42.11.4937-4946.2004
Wu, Y., Hinenoya, A., Taguchi, T., Nagita, A., Shima, K., Tsukamoto, T., et al. (2010). Distribución de genes de virulencia relacionados con adhesinas y toxinas en cepas de Escherichia coli productoras de toxina Shiga aisladas de ganado sano y pacientes con diarrea en Japón. J. Vet. Med. Sci. 72, 589–597. DOI: 10.1292/JVMS.09-0557
Resumen de PubMed | Texto completo de CrossRef | Google Académico
Zhao, L., Tyler, P. J., Starnes, J., Bratcher, C. L., Rankins, D., McCaskey, T. A., et al. (2013). Análisis de correlación de la excreción de Escherichia coli productora de toxina Shiga y composición bacteriana fecal en ganado vacuno. J. Appl. Microbiol. 115, 591–603. doi: 10.1111/jam.12250
Resumen de PubMed | Texto completo de CrossRef | Google Académico
Palabras clave: Escherichia coli productora de toxina shiga, categoría de bovinos, genes plásmidos, adhesinas, sistemas de producción
Cita: Cáceres ME, Etcheverría AI, Fernández D, Rodríguez EM y Padola NL (2017) Variación en la distribución de factores putativos de virulencia y colonización en Escherichia coli productora de toxina Shiga aislada de diferentes categorías de ganado. Frente. Celda. Infecta. Microbiol. 7:147. DOI: 10.3389/fcimb.2017.00147
Recibido: 22 de febrero de 2017; Aprobado: 10 de abril de 2017;
Publicado: 28 abril 2017.
Editado por:
Alfredo G. Torres, Rama Médica de la Universidad de Texas, EE.UU.
Revisado por:
Séamus Fanning, University College Dublin, Irlanda
Grzegorz Wegrzyn, Universidad de Gdańsk, Polonia
Copyright © 2017 Cáceres, Etcheverría, Fernández, Rodríguez y Padola. Este es un artículo de acceso abierto distribuido bajo los términos de la Licencia de Atribución Creative Commons (CC BY).
*Correspondencia: Analía I. Etcheverría, analiain@vet.unicen.edu.ar
Renuncia: Todas las afirmaciones expresadas en este artículo son únicamente las de los autores y no representan necesariamente las de sus organizaciones afiliadas, o las del editor, los editores y los revisores. Cualquier producto que pueda ser evaluado en este artículo o reclamo que pueda ser hecho por su fabricante no está garantizado ni respaldado por el editor.
Date de alta y recibe nuestro 👉🏼 Diario Digital AXÓN INFORMAVET ONE HEALTH
Date de alta y recibe nuestro 👉🏼 Boletín Digital de Foro Agro Ganadero
Noticias animales de compañía
Noticias animales de producción
Trabajos técnicos animales de producción
Trabajos técnicos animales de compañía