Comparación del efecto de diferentes antibióticos en el esperma de carnero congelado: ¿es posible evitar su adición?
Comparación del efecto de diferentes antibióticos en el esperma de carnero congelado: ¿es posible evitar su adición?
 Luis Anel-López1,2, Marta F. Riesco1,3*, Rafael Montes-Garrido1,2, Marta Neila-Montero1,2, Juan C. Boixo1,2, César Chamorro1,2, Cristina Ortega-Ferrusola4, Ana Carvajal5, José R. Altonaga2, Paulino de Paz1,3, Mercedes Álvarez1,2 y Luis Anel1,2
Luis Anel-López1,2, Marta F. Riesco1,3*, Rafael Montes-Garrido1,2, Marta Neila-Montero1,2, Juan C. Boixo1,2, César Chamorro1,2, Cristina Ortega-Ferrusola4, Ana Carvajal5, José R. Altonaga2, Paulino de Paz1,3, Mercedes Álvarez1,2 y Luis Anel1,2- 1Investigación en Técnicas de Reproducción Asistida – Universidad de León, Instituto de Desarrollo Ganadero y Sanidad Animal, Universidad de León, León, España
- 2Departamento de Medicina Veterinaria, Cirugía y Anatomía, Universidad de León, León, España
- 3Biología celular, Departamento de Biología Molecular, Universidad de León, León, España
- 4Laboratorio de Reproducción Equina y Espermología Equina, Hospital de Enseñanza Veterinaria, Universidad de Extremadura, Cáceres, España
- 5Departamento de Sanidad Animal, Facultad de Veterinaria, Universidad de León, León, España
Es crucial realizar un estudio profundo sobre los antibióticos más utilizados en los extensores de esperma. La mayoría de los protocolos y concentraciones utilizados en el carnero son extrapolaciones directas de otras especies. Es importante establecer tratamientos antibióticos específicos para la especie para optimizar su uso y si es posible reducir la cantidad. Los estudios de vista previa han evaluado algunos aspectos de la calidad de los espermatozoides in vitro, pero este estudio tuvo como objetivo ir más allá y evaluar el efecto de tres tratamientos antibióticos diferentes, que son los más utilizados, no solo en la calidad de los espermatozoides o en la evaluación del efecto inhibitorio sobre el crecimiento bacteriano, sino también para evaluar estos importantes parámetros de productividad como la El tratamiento con Gentamicyn (G) mostró los peores resultados, no solo en relación con la calidad de los espermatozoides, sino también en los ensayos reproductivos que exhiben un efecto tóxico en la concentración del experimento, y siendo el más potente inhibidor del crecimiento bacteriano. Por su parte, la lincomicina-espectinomicina (LS) mostró resultados similares que inhibieron el crecimiento bacteriano, pero no mostró un efecto perjudicial ni en la calidad de los espermatozoides ni en los parámetros reproductivos. La penicilina-estreptomicina (PS) mostró buenos resultados en la calidad de los espermatozoides y en los ensayos in vivo reproductivos, pero mostró un efecto muy pobre que inhibió el crecimiento bacteriano, probablemente debido a algún tipo de resistencia a los antibióticos. Según nuestros resultados, no hay una relación positiva significativa entre la mayor actividad inhibitoria bacteriana de las muestras de LS y PS, y el respeto de la calidad de los espermatozoides. Las muestras de control (sin antibióticos). En el caso de G, que se mostró el más eficaz como antibacteriano, observamos un efecto tóxico en la calidad de los espermatozoides que podría traducirse en los parámetros de productividad. Nuestros resultados sugieren que el control de la contaminación bacteriana en el semen congelado descongelado puede ser posible sin el uso de antibióticos, aunque los efectos de períodos más largos de almacenamiento en refrigeración y las diferentes temperaturas de almacenamiento deben investigarse más a fondo para el semen animal. En este punto, es obligatoria una reflexión sobre una reducción drástica en el uso de tratamientos antibióticos en la criopreservación de espermatozoides, ya que las condiciones de congelación podrían mantener la contaminación de las dosis de espermatozoides dentro de los niveles recomendados por las agencias de salud reguladoras.
Introducción
La recolección de semen y la manipulación de espermatozoides no son procesos estériles, y no se puede evitar la contaminación bacteriana, especialmente las especies ambientales y no patológicas, pero también patológicas, de las muestras de esperma (1, 2). En el carnero, el eyaculado final recogido suele estar contaminado al menos con bacterias del técnico, vagina artificial, pene y prepucio. De esta manera, la contaminación bacteriana podría afectar no solo a la calidad de los espermatozoides, sino también al rendimiento final de la producción. La interacción bacteria-esperma ha sido ampliamente estudiada, especialmente en el esperma humano con E. coli como modelo de contaminación, concluyendo que el efecto espermicida depende de la concentración (3). Se han reportado varios efectos negativos de la contaminación bacteriana en la calidad de los espermatozoides, como la motilidad de los espermatozoides afectada por la adhesión bacteriana y la aglutinación (4, 5), induciendo cambios morfológicos (6) alterando la función de los espermatozoides, aumentando la translocación de la fosfatidiserina y la activación de la apoptosisAdemás, algunos estudios sugieren que la contaminación bacteriana puede aumentar la producción de anticuerpos que afectan al complejo glicocalyx en la superficie espermática (3, 8). Para prevenir la transmisión de enfermedades en la mayoría de las especies domésticas, la adición de antibióticos a los extensores de esperma es obligatoria en la Unión Europea y tan común en otros países fuera (9). En este contexto, la suplementación con antibióticos como aditivo en la mayoría de los extensores de esperma de manipulación y conservantes se ha utilizado ampliamente en muchas especies; en especies domésticas como el carnero (10), el toro (11), el semental (12) o el jabalí (13) y las especies silvestres: ciervo rojo (14) o oso pardo (15). Muchos estudios han demostrado el efecto beneficioso de los antibióticos que inhiben la proliferación bacteriana en las muestras de esperma durante su almacenamiento (1, 16-18). La mayoría de estos estudios se han llevado a cabo en diferentes especies que el carnero, sin estudios específicos de la especie, que podrían generar efectos inesperados en aspectos de producción relevantes como la fertilidad, la prolicidad, la fecundidad o la relación sexual. Del mismo modo, la mayoría de estos estudios se han centrado en la evaluación del efecto de los antibióticos en la calidad de los espermatozoides evaluados in vitro en búfalos, toros y carneros (10, 11, 19). Es importante tener en cuenta que el uso de dosis de inseminación espermática con contaminación podría estar relacionado con efectos nocivos en el tracto reproductivo femenino y el estado del estro (20, 21), reduciendo la supervivencia embrionaria o incluso reduciendo el tamaño de la camada (22) en cerdos. Sin embargo, los efectos de los antibióticos en parámetros productivos importantes como la fertilidad, la prolicidad, la fecundidad o la relación sexual no se han estudiado ampliamente en el carnero, por lo general son extrapolaciones y copias de otras especies. Para obtener un conocimiento profundo sobre los efectos de los antibióticos no solo en la calidad de los espermatozoides, sino también en la producción futura de las dosis de espermatozoides, es muy importante optimizar los protocolos y reducir el uso de antibióticos, ya que la resistencia a los antimicrobianos supone un peligro global y grave no solo para la salud humana o animal, sino también para la economía (23)
Este estudio tuvo como objetivo ir más allá y evaluar el efecto de tres tratamientos antibióticos diferentes, que son los más utilizados, no solo en la calidad de los espermatozoides o en la evaluación del efecto inhibitorio en el crecimiento bacteriano, sino también en la evaluación de estos importantes parámetros de productividad, como la fertilidad, la frecuencia de lamidas múltiples, la prolificación, la fecundidad y
Materiales y métodos
Reactivos y medios de comunicación
Todos los productos utilizados en este documento eran al menos de grado reactivo y se adquirieron de Sigma Aldrich (Madrid, España) a menos que se indique lo contrario. El medio para la evaluación de la citometría fue PBS.
Colección de animales y esperma
Se recogieron muestras de espermatozoides de machos de carnero maduros durante la temporada de reproducción. Los eyaculados se recogieron mediante vagina artificial a 40 °C (Minitüb, Tiefenbach, Alemania), y los tubos se mantuvieron a 35 °C durante la evaluación inicial de la calidad de los espermatozoides. El volumen se calculó utilizando las marcas de graduación de los tubos de recogida. La motilidad de la masa se evaluó mediante microscopía (etapa de calentamiento a 38 °C, 40x; puntuación: 0-5; Labophot-2, Nikon, Tokio, Japón), y la concentración de espermatozoides se evaluó utilizando un Nucleocounter n-100 (DADOS MARCAETC). Solo se utilizaron y procesaron eyaculados de buena calidad (volumen: ≥0,5 ml; motilidad de masa: ≥4; concentración de espermatozoides ≥3.000 × 106 ml−1) para el experimento.
Diseño experimental
Antes de la congelación, las muestras (1 eyaculado válido por macho) se diluyeron hasta una concentración final de 100 × 106 espermatozoides/ml en sus respectivos extensores (Tes-Tris-Fructose 20% yema de huevo_4% glycerol_320mOsm/Kg) de la siguiente manera: sin antibióticos (Control Después de esto, las muestras se congelaron y descongelaron como se explicó en el punto de criopreservación de esperma. Las muestras se evaluaron in vitro justo después de la descongelación (T0) y después de someterlas a una prueba de esfuerzo de 2 h de incubación a 37 °C (T2), a excepción de la evaluación microbiana, que se llevó a cabo justo después de la descongelación (T0). Para el ensayo in vivo (inseminación artificial), las muestras se procesaron como se describe en la declaración Fertility Trials.
Criopreservación de espermatozoides
Las muestras extendidas de esperma se criopreservaron siguiendo el protocolo (24) modificado por Álvarez et al. (25). Las muestras se refrigeraron a -0,25 °C/min de 30 a 5 °C en la cámara refrigerada. Después de 2 horas de equilibrio a 5 °C, las muestras se empaquetaron en pajitas de 0,25 ml y luego se congelaron en un biocongelador programable (Kryo 10 Series III; Planer PLC, Sunbury-on-Thames, Reino Unido) a -20 °C/min hasta -100 °C, se transfirieron a contenedores de nitrógeno La descongelación se realizó dejando caer pajitas en el agua a 65 °C durante 6 s. Una parte de las muestras se utilizó para llevar a cabo las inseminaciones artificiales; otra parte de las pajitas se utilizó para llevar a cabo la evaluación de los espermatozoides in vitro, justo después del deshielo (T0) y después de 2 h de incubación a 37 °C como una prueba de esfuerzo (T2). La última parte de las muestras se utilizó para realizar el cultivo microbiano.
Evaluación in vitro del esperma
Se utilizaron pajitas de 9 machos (un eyaculado por macho) para la evaluación in vitro de la siguiente manera.
Análisis de espermatozoides asistido por ordenador
Las muestras se diluyeron a 30 × 106 espermatozoides/ml en su extensor de congelación para comprobar la motilidad. Se cargó una cámara de conteo de Makler calentada con 5 μL de la muestra. El análisis se llevó a cabo utilizando un sistema CASA (Computer Assisted Sperm Analysis), que consiste en un microscopio óptico de contraste de fase (Nikon Labophot-2) (adaptado con objetivos negativos de contraste de fase y una etapa de calentamiento a 37 °C), una cámara Basler A312fc (Basler, Alemania) y un PC con el software de análisis de clase de esperma ( 1.2; Proiser, Valencia, España). El aumento fue de 100 ×. Se adquirieron al menos cinco campos por muestra a una tasa de adquisición de 25 imágenes por segundo, registrando un total de 200 espermatozoides móviles. Para el estudio se utilizaron los siguientes parámetros: motilidad total (%; TM), motilidad progresiva (%; PM), velocidad media de la trayectoria (μm/seg; VAP) velocidad de línea recta (rectilínea) (μm/s; VSL) y amplitud del desplazamiento de la cabeza lateral (μm; AHL).
Las secuencias de imágenes se guardaron y analizaron después utilizando las instalaciones de edición proporcionadas por ISAS. Los espermatozoides se consideraron móviles cuando VCL > 10 μm/s y progresivo si VCL >10 y recta (STR) >80%. Las subpoblaciones de esperma progresivas se clasificaron de acuerdo con las velocidades de la siguiente manera: Lenta (VCL <25), Media (VCL >25 y <65) y Rápida (VCL >65). Se eliminaron otros eventos diferentes de los espermatozoides y se ajustaron los ajustes en cada caso para asegurar un análisis de la pista correcto.
Citometría de flujo
La adquisición de la citometría de flujo se realizó en un citómetro de flujo (MACSQuant Analyser 10, Miltenyi Biotech, Madrid, España) equipado con tres láseres que emiten a 405, 488 y 635 nm y 10 tubos fotomultiplicadores (PMT): V1 (excitación 405 nm, emisión 450/50 nm), V2 (excitación 405 nm, emisión El sistema se controló utilizando el software MACS Quantify (Miltenyi Biotech, Madrid, España). Estas longitudes de onda de excitación y emisión nos permitieron encontrar combinaciones de sondas que pueden evaluar simultáneamente múltiples parámetros en un gran número de espermatozoides (se adquirieron un total de 40.000 eventos por muestra y al menos 20.000 espermatozoides, a una velocidad de flujo de 200-300 células por segundo). Los datos se analizaron utilizando FlowJo v.10.2 (Ashland, EE. UU.).
Evaluación citométrica de flujo simultáneo de la viabilidad, la actividad de caspasa 3 y 7 y la actividad metabólica (generación de ROS)
Las muestras de esperma de diferentes grupos experimentales se diluyeron en medio PBS para obtener un total de 2 × 106 de esperma por muestra; estas muestras se lavaron y centrifugaron a 500 g durante 10 minutos a temperatura ambiente (RT). El tinte liofilizado Zombie VioletTM (Biolegend, San Diego, California, EEUU) se reconstituyó en DMSO siguiendo las instrucciones del fabricante (100 μl de DMSO a un vial de tinte Zombie VioletTM). CellEventTM Caspase-3/7 y CellROXTM Deep Red (Invitrogen, Eugene, Oregón, EEUU) se compraron como una solución estabilizada de 2 mM y 2,5 mM, respectivamente. Las soluciones de stock de sondas de fluorescencia se prepararon a 1 μL y se mantuvieron a -20 °C en la oscuridad hasta que fuera necesario.
Las soluciones de stock de Zombie VioletTM se re suspendieron en 1 ml de PBS, mientras que CellEventTM Caspase-3/7 y CellROXTM en 10 μL. Después de la centrifugación de muestras, se descartó el sobrenadante, y el gránulo de esperma se incubó en RT durante 30 minutos en la oscuridad con 96 μL de Zombie VioletTM (sonda de integridad de la membrana) (1: 1.000 dilución final), 2 μL de CellEventTM Caspase-3/7 (marcador Después de eso, se realizó otro paso de lavado para detener la tinción celular, y el gránulo se resuspendió en 1 ml de PBS, llevando a cabo el análisis inmediatamente mediante citometría de flujo.
Las subpoblaciones de esperma de interés evaluadas se trazaron de la siguiente manera: espermatozoides viables no apoptóticos (Zombie de baja intensidad, Caspase 3 y 7 negativos), espermatozoides apóticos (Zombie de baja intensidad -alive-, Caspase 3 y 7 positivos) y espermatozoides de alto metabolismo activo (
Evaluación bacteriológica
Las pajitas de 8 hombres para cada tratamiento, sin antibióticos (control), con penicilina-estreptomicina, con Lincomicina-especttinomicina o con gentamicina, se descongelaron y 150 μL de cada muestra se colocaron en placas de agar sanguíneo (Oxoid, Wesel, Alemania). El inóculo se extendió rápidamente sobre toda la superficie del agar con un esparcidor Digralsky estéril. Las placas se incubaron a 37 °C en condiciones aeróbicas e inspeccionadas después de 48 horas de incubación. El crecimiento bacteriano se expresó como unidades formadoras de colonias UFC/ml. Las subculturas se realizaron hasta que se obtuvieron culturas puras. La identificación primaria se basó en la tinción de Gram y las pruebas de catalasa y oxidasa, mientras que la confirmación se llevó a cabo mediante espectrometría de masas de tiempo de vuelo por ionización por desorción láser asistida por matriz (MALDI-TOF MS, Bruker, Madrid, España).
Ensayos de fertilidad
Para el ensayo de fertilidad, se utilizaron dosis de esperma (25 x 106 esperma/pácarcha), congeladas y descongeladas como se describió anteriormente (2,4), de 10 machos maduros (raza Churra). Las muestras experimentales se distribuyeron de forma aleatoria y secuencial a través de 7 granjas comerciales siguiendo un programa comercial de inseminación artificial (programa de mejora de la raza Churra) bajo la estricta supervisión de nuestro grupo de investigación. Las ovejas Churra adultas (852 hembras de entre 2 y 5 años de edad previamente atada) se sometieron a tratamiento para la inducción y sincronización del estrosa utilizando esponjas intravaginales con 20 mg de acetato de fluorogestone (Chronogest®, MSD) durante 14 días. Se retiraron las esponjas y se inyectaron 500 UI de eCG -IM- (Folligon®, MSD). Las inseminaciones laparoscópicas fueron realizadas por dos veterinarios con amplia experiencia, entre 64 y 67 horas después de la extracción de las esponjas. Los animales, después de haber ayunado durante las 24 horas anteriores, estaban atados a una cuna especial (IMV), colocada en un plano inclinado (45°), y el área frente al teat se afeitaba y se limpió. Se aplicó anestesia local (mepivacaína HCL 2%, BraunTM) a los puntos de punción. Luego se insertaron dos portales (para la visión y la manipulación/inyección) mediante la realización de un neumoperitoneo (CO2). El semen, colocado en un aplicador especial (Transcap®, IMV), se inyectó bajo inspección visual en cada cuerno uterino (0,12 ml, 12,5 × 106 spz). La fertilidad [(wewes lambing/wewe inseminada) × 100] se calculó de acuerdo con los nacimientos registrados entre 137 y 154 días después de la inseminación. Además, se registraron la descendencia y el sexo viables, y se calcularon la prolicidad (lambs/webed), la frecuencia de lambing múltiple [(masculp/masculp total) × 100], la fecundidad (lambs/wes inseminadas) y la relación sexual [(lamos hembras/lamos totales) × 100].
Análisis estadístico
Para la calidad in vitro, los datos se analizaron utilizando el paquete SASTM V.9.1 (SAS Institute Inc., Cary, NC, EE. UU.). Los resultados se muestran como medios y errores estándar de la media. La normalidad de los datos fue verificada por las pruebas de Kolmogorov-Smirnov. Los análisis de los datos se llevaron a cabo utilizando modelos lineales de efectos mixtos (procedimiento MIXTO, método ML), incluido el tipo de antibiótico (C, PS, LS y G) y el tiempo de incubación después de la descongelación (0 frente a 2 h) como factores fijos, y los machos como efecto aleatorio. Los efectos fijos significativos se analizaron más a fondo utilizando múltiples comparaciones de medios con contrastes de Tukey. Se utilizó un nivel de significación de P < 0,05; P < 0,1 se consideró una tendencia.
Los datos de fertilidad, frecuencia de lamida múltiple y la relación de sexos se compararon utilizando un procedimiento GENMOD considerando un modelo de respuesta binaria. El modelo estadístico incluyó el tipo de antibiótico (C, PS, LS y G) como factor, y la fertilidad, la frecuencia de lamida múltiple y la relación sexo como variable de respuesta. Las diferencias entre grupos en la frecuencia se probaron utilizando Wald Chi-Square. Para la relación sexo, se completó el estudio comparando cada grupo experimental con el «valor esperado» (50:50). Los datos de prolificación y fecundidad se compararon utilizando un procedimiento de GLM utilizando el tipo de antibiótico como factor; las diferencias entre grupos se probaron mediante la prueba Duncan. El nivel de significación se estableció en P < 0,05.
Resultados
Motilidad del esperma
La media, el error estándar y la distribución masculina de varios parámetros de motilidad espermática se muestran en la Figura 1. Justo después de la descongelación, se observaron diferencias no significativas (P > 0,05) para la TM o para el PM entre los diferentes tratamientos antibióticos (Figuras 1A, B). Después de 2 h de incubación a 37 °C, todas las muestras mostraron una disminución significativa de 0 h, pero no se observó diferencia entre los tratamientos. Por el contrario, al evaluar el PM rápido, las muestras de G mostraron valores significativamente más bajos (P < 0,05) que C justo después de la descongelación (Figura 1C). De la misma manera, al evaluar las muestras de ALH y VSL G mostraron valores significativamente más bajos (P < 0,05) que las muestras de C no solo después de la descongelación, sino también después de 2 h de incubación a 37 °C (Figuras 1D, E). Además, las muestras tratadas con PS mostraron valores significativamente más bajos de ALH que las muestras de C después de enviar las muestras a la incubación. Del mismo modo, las muestras tratadas con LS mostraron valores más bajos (P < 0,05) de VSL con respecto al control justo después de la descongelación. Finalmente, justo después de la descongelación, PS y G tenían valores significativamente más bajos de VAP (P < 0,05) que la C (Figura 1F). Después de la incubación, estas diferencias significativas desaparecieron.
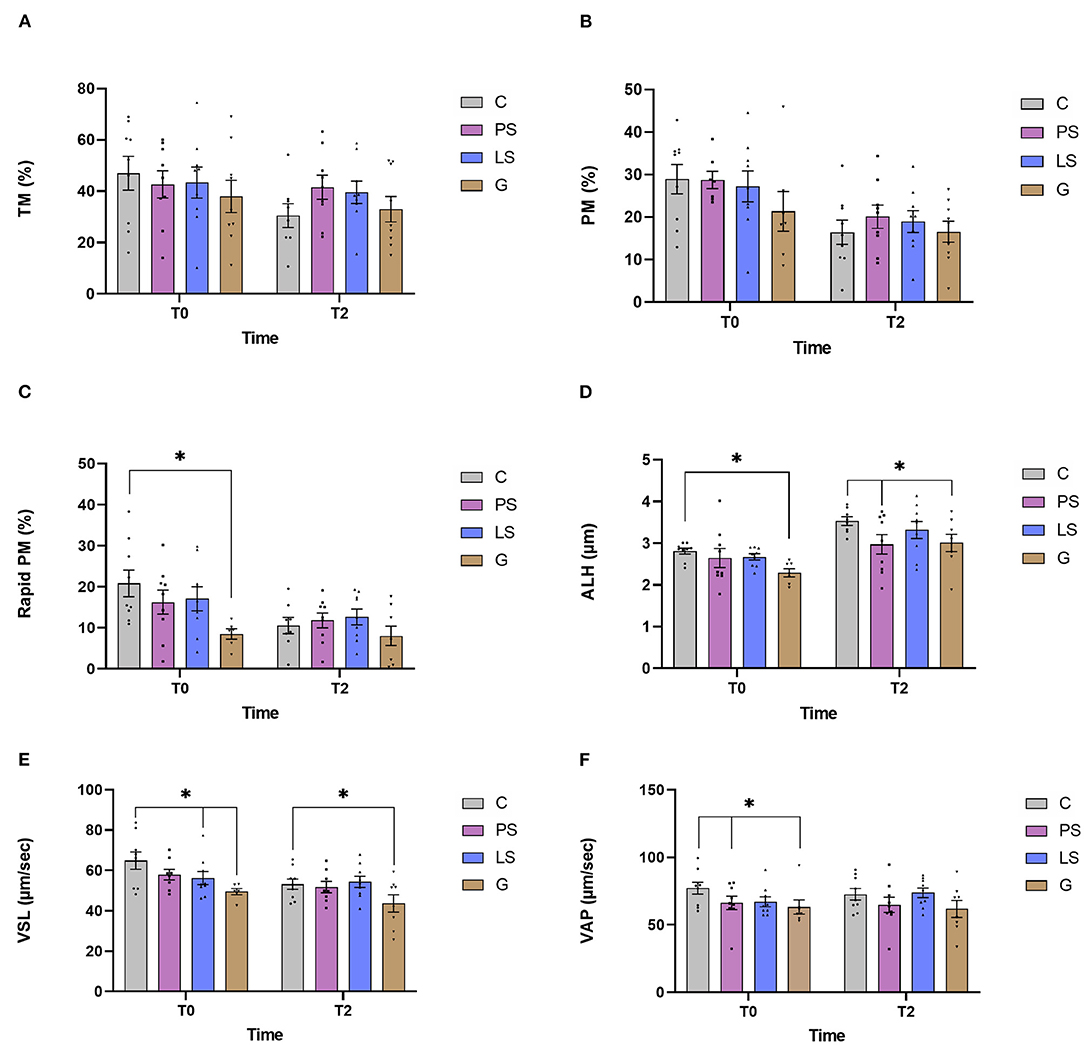 FIGURA 1. Datos de motilidad de los espermatozoides de Ram en los cuatro grupos experimentales por tiempo (justo después del descongelación -T0- y después de 2 h de incubación a 37°C -T2-): Control (C), sin antibióticos; Penicilina-Streptomicina (PS); (500 UI)−625 μg/ A) Motilidad total (TM, %); (B) motilidad progresiva (PM, %); (C) esperma motídula progresivo rápido (PM rápida, %), (D) amplitud del movimiento de la cabeza lateral (ALH, μm), (E) velocidad de acuerdo con la trayectoria recta (VSL, μm/s) YSe analizaron nueve machos (1 eyaculado por varón) incluyendo los mismos machos en cada grupo experimental. Los puntos gráficos representan el eyaculado masculino individual. Las diferencias significativas (P < 0,05) se representan con un asterisco entre el tratamiento antibiótico y la muestra de control sin antibióticos.
FIGURA 1. Datos de motilidad de los espermatozoides de Ram en los cuatro grupos experimentales por tiempo (justo después del descongelación -T0- y después de 2 h de incubación a 37°C -T2-): Control (C), sin antibióticos; Penicilina-Streptomicina (PS); (500 UI)−625 μg/ A) Motilidad total (TM, %); (B) motilidad progresiva (PM, %); (C) esperma motídula progresivo rápido (PM rápida, %), (D) amplitud del movimiento de la cabeza lateral (ALH, μm), (E) velocidad de acuerdo con la trayectoria recta (VSL, μm/s) YSe analizaron nueve machos (1 eyaculado por varón) incluyendo los mismos machos en cada grupo experimental. Los puntos gráficos representan el eyaculado masculino individual. Las diferencias significativas (P < 0,05) se representan con un asterisco entre el tratamiento antibiótico y la muestra de control sin antibióticos.
Integridad de la membrana (viabilidad delsperma), actividad de caspasa 3 y 7 y actividad metabólica
La media, el error estándar y la distribución masculina de los diferentes parámetros espermáticas evaluados se muestran en la Figura 2. No se encontraron diferencias significativas al evaluar la viabilidad justo después de la descongelación entre el control y cada tratamiento (Figura 2A). La viabilidad de todos los grupos fue significativamente menor (P < 0,05) después de 2 h de incubación. Después de esta incubación, PS mantuvo valores más altos de esperma viable no apótico que C (P < 0,05). Al evaluar el porcentaje de células apoptóticas, no hubo diferencias significativas entre los tratamientos ni después de la descongelación (T0) ni después de la incubación (T2) con respecto a la C (Figura 2B). Finalmente, después de evaluar el estado metabólico de las mitocondrias de espermatozoides a través de la generación de ROS, los datos indicaron un valor de tendencia más alto (P < 0,06) en PS que el Control, sin aumentar la importancia, justo después de la descongelación. Todos los tratamientos tuvieron una disminución significativa (P < 0,05) después de 2 h de incubación. Sin embargo, PS mostró valores significativamente más altos de actividad metabólica que la C después de 2 h de incubación (P < 0,05). Por el contrario, LS y G no mostraron ninguna diferencia significativa (P > 0,05) en comparación con C (Figura 2C) para este parámetro.
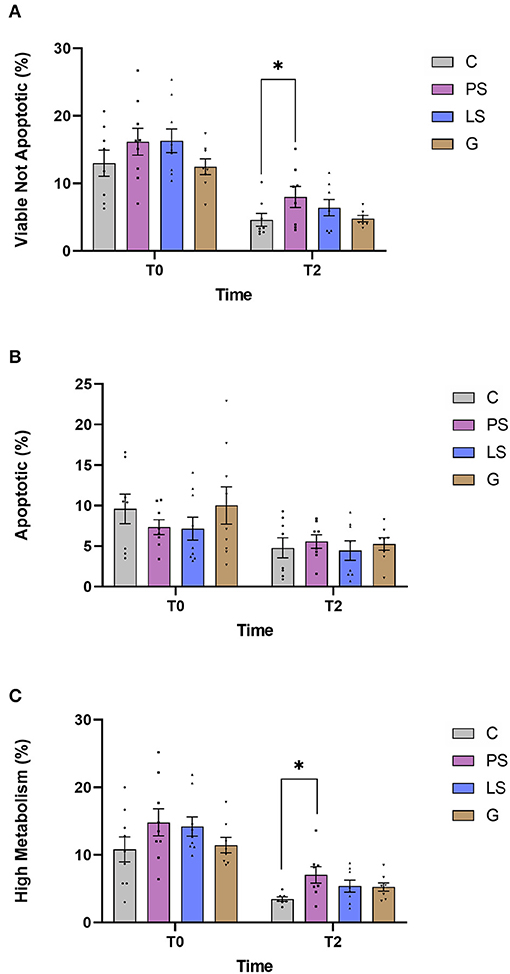 FIGURA 2. Datos de citometría de flujo multiparamétrico de esperma de Ram en los cuatro grupos experimentales por tiempo (justo después de la descongelación -T0- y después de 2 h de incubación a 37 °C -T2-): Control (C), sin antibióticos; Penicilina-Streptomicina (PS); (500 UI) −625 � (A) Células zombi de baja intensidad y células negativas de Caspasa 3 y 7 (espermatozoides no apoptóticos viables, %); (B) Células de baja intensidad zombi y células positivas de Caspasa 3/7 (apoptosis, %); (C) Células de baja intensidad zombis y células positivas para CellROX (Sperma con alta actividad metabólica, Se analizaron nueve machos (1 eyaculado por varón) incluyendo los mismos machos en cada grupo experimental. Los puntos gráficos representan el eyaculado masculino individual. Las diferencias significativas (P < 0,05) se representan con un asterisco entre el tratamiento antibiótico y la muestra de control sin antibióticos.
FIGURA 2. Datos de citometría de flujo multiparamétrico de esperma de Ram en los cuatro grupos experimentales por tiempo (justo después de la descongelación -T0- y después de 2 h de incubación a 37 °C -T2-): Control (C), sin antibióticos; Penicilina-Streptomicina (PS); (500 UI) −625 � (A) Células zombi de baja intensidad y células negativas de Caspasa 3 y 7 (espermatozoides no apoptóticos viables, %); (B) Células de baja intensidad zombi y células positivas de Caspasa 3/7 (apoptosis, %); (C) Células de baja intensidad zombis y células positivas para CellROX (Sperma con alta actividad metabólica, Se analizaron nueve machos (1 eyaculado por varón) incluyendo los mismos machos en cada grupo experimental. Los puntos gráficos representan el eyaculado masculino individual. Las diferencias significativas (P < 0,05) se representan con un asterisco entre el tratamiento antibiótico y la muestra de control sin antibióticos.
Evaluación bacteriológica
La media y el error estándar de la media de UFC/ml recuperada para cada tratamiento se muestran en la figura 3. Se registró una reducción significativa en el número de bacterias viables después de los tratamientos con G y LS en comparación con la C sin antibióticos (P < 0,05). El tratamiento con PS también disminuye la concentración bacteriana, aunque las diferencias no alcanzan significación estadística en comparación con el control (P = 0,345; Figura 3).
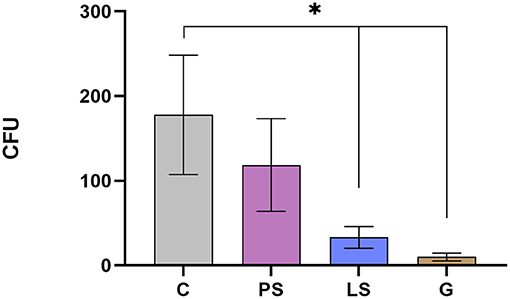 FIGURA 3. Total de bacterias aeróbicas viables (unidades formadoras de colonias) en los cuatro grupos experimentales: Control (C), sin antibióticos; Penicilina-Streptomicina (PS); (500 UI) −625 μg/ml, respectivamente; Lincomicina-Especttinomicina (LS) 300-600 μg/ml, Se analizaron ocho machos (1 eyaculado por macho) incluyendo los mismos machos en cada grupo experimental. Las diferencias significativas (P < 0,05) se representan con un asterisco entre el tratamiento antibiótico y la muestra de control sin antibióticos.
FIGURA 3. Total de bacterias aeróbicas viables (unidades formadoras de colonias) en los cuatro grupos experimentales: Control (C), sin antibióticos; Penicilina-Streptomicina (PS); (500 UI) −625 μg/ml, respectivamente; Lincomicina-Especttinomicina (LS) 300-600 μg/ml, Se analizaron ocho machos (1 eyaculado por macho) incluyendo los mismos machos en cada grupo experimental. Las diferencias significativas (P < 0,05) se representan con un asterisco entre el tratamiento antibiótico y la muestra de control sin antibióticos.
La mayoría de las muestras dieron lugar al crecimiento de una población mixta de microorganismos con hasta 16 especies diferentes. El mayor número de diferentes especies bacterianas se identificó en el grupo C sin antibióticos, seguido de PS, LS y finalmente G con el menor número de diferentes especies bacterianas (Figura 4). Se identificaron un total de 10 géneros y 16 especies bacterianas (Figura 4) con Pseudomonas (3 aislados) y Staphylococcus (3 aislados) como los géneros más comunes seguidos de E. coli. En este sentido, G fue el tratamiento con los espectros antimicrobianos más altos (4 especies supervivientes), seguido de LS (8 especies supervivientes) y PS (10 especies supervivientes) (Figura 4).
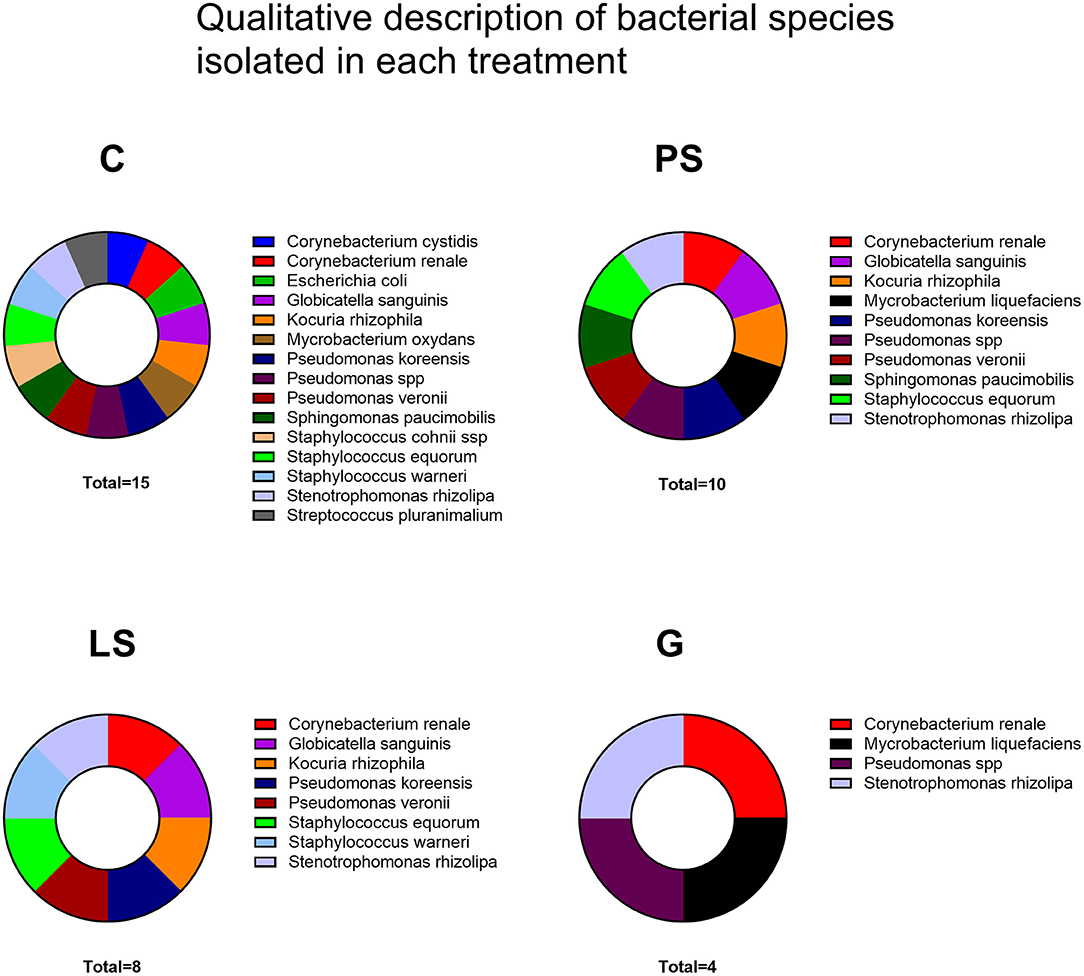 FIGURA 4. Especies bacterianas aisladas en cada tratamiento después del descongelación: Control (C), sin antibióticos; Penicilina-Estreptomicina (PS), (500 UI) −625 μg/ml, respectivamente; Lincomicina-Especttinomicina (LS), 300-600 μg/ml, respectivamente; y Gentamicina Se analizaron ocho machos (1 eyaculado por macho) incluyendo los mismos machos en cada grupo experimental.
FIGURA 4. Especies bacterianas aisladas en cada tratamiento después del descongelación: Control (C), sin antibióticos; Penicilina-Estreptomicina (PS), (500 UI) −625 μg/ml, respectivamente; Lincomicina-Especttinomicina (LS), 300-600 μg/ml, respectivamente; y Gentamicina Se analizaron ocho machos (1 eyaculado por macho) incluyendo los mismos machos en cada grupo experimental.
Ensayos de fertilidad
Las muestras tratadas con PS, el tratamiento estándar, mostraron una fertilidad del 52,0 %. De la misma manera, las muestras tratadas con LS (50,5%) y C (52,9%) mostraron resultados similares (P > 0,05). Por el contrario, las muestras tratadas con G mostraron los peores resultados (38,8%) siendo significativamente más bajos (P < 0,05) que los otros tratamientos (Tabla 1).
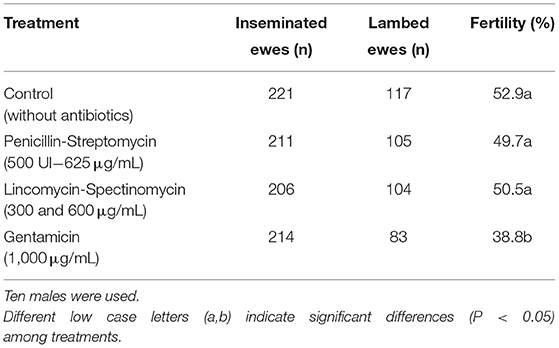 TABLA 1. Resultados de fertilidad (we ewebe / owe inseminado / o león / owe inseminado) por la siguiente manera: Control (sin antibióticos), penicilina-Streptomicina; con penicilina (500 UI) y Stretomicina a una concentración final de 625 μg/ml; Lincomicina-especttinomicina a una concentración final de 300 y
TABLA 1. Resultados de fertilidad (we ewebe / owe inseminado / o león / owe inseminado) por la siguiente manera: Control (sin antibióticos), penicilina-Streptomicina; con penicilina (500 UI) y Stretomicina a una concentración final de 625 μg/ml; Lincomicina-especttinomicina a una concentración final de 300 y
Se observaron resultados de prolificación similares entre C, G y LS (P > 0,05), mientras que PS (1,67 ± 0,07) mostró resultados significativamente más altos (P < 0,05) que LS. La frecuencia múltiple de lamida siguió exactamente la misma distribución de significación entre los tratamientos que la prolificación (Tabla 2). Los resultados obtenidos en fecundidad mostraron una vez más la tasa más baja en esas muestras evaluadas con G (0,59± 0,006), siendo significativamente más baja (P < 0,05) que la C y PS (0,81 ± 0,06 y 0,83 ± 0,07, respectivamente). Por su parte, las muestras tratadas con LS (0,74 ± 0,06) no mostraron diferencias significativas con respecto a los otros tratamientos (Tabla 2).
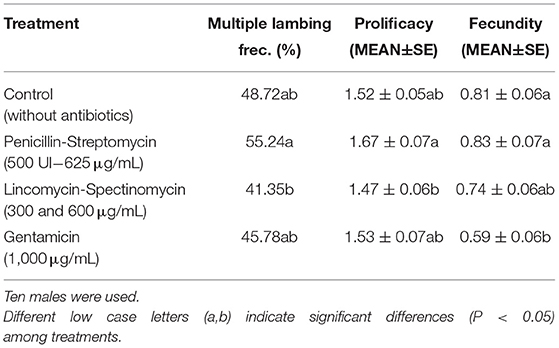 TABLA 2. Frecuencia múltiple de atado (%), prolificación (lambs/peya de la cama) y resultados de fecundidad (lambs/ovejas inseminadas) mediante el tratamiento de la siguiente manera: Control (sin antibióticos), Penicilina-Streptomicina; con Penicilina (500 UI) y estreptomicina a una concentración final de 625 μ
TABLA 2. Frecuencia múltiple de atado (%), prolificación (lambs/peya de la cama) y resultados de fecundidad (lambs/ovejas inseminadas) mediante el tratamiento de la siguiente manera: Control (sin antibióticos), Penicilina-Streptomicina; con Penicilina (500 UI) y estreptomicina a una concentración final de 625 μ
No hubo una distorsión significativa de la relación sexual (P > 0,05) con el valor esperado (50:50) en cada grupo experimental. La C obtuvo el 54,7 % de las mujeres, siendo el tratamiento con la mayor desviación de la relación sexual con respecto a las mujeres (P < 0,05). Por el contrario, el porcentaje de mujeres al nacer fue menor (P < 0,05) para las muestras tratadas con G (42,4%) y LS (38,4%) que C (Figura 5). El resultado obtenido para las muestras tratadas con PS fue el más cercano a una proporción esperada del 50 % (48,4 % de mujeres) y no fue significativamente diferente (P > 0,05) de los otros 3 tratamientos (Figura 5).
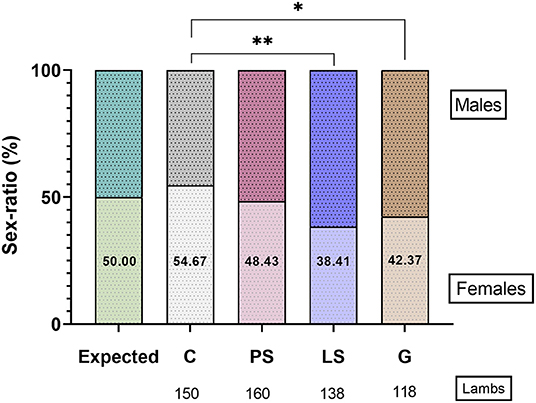 FIGURA 5. La proporción de sexo es la proporción de resultados para las hembras (hembras/100 corderos) en los cuatro grupos experimentales: Control (C), sin antibióticos; Penicilina-Estreptomicina (PS), (500 UI) −625 μg/ml, respectivamente; Lincomicina-Especttinomicina (LS), 300-600 � *P ≤ 0,05, **P ≤ 0,01.
FIGURA 5. La proporción de sexo es la proporción de resultados para las hembras (hembras/100 corderos) en los cuatro grupos experimentales: Control (C), sin antibióticos; Penicilina-Estreptomicina (PS), (500 UI) −625 μg/ml, respectivamente; Lincomicina-Especttinomicina (LS), 300-600 � *P ≤ 0,05, **P ≤ 0,01.
Discusión
El creciente desafío para la atención médica atribuible a la resistencia a los antimicrobianos, y la posterior ausencia de acceso a tratamientos eficaces, es una preocupación mundial. De la misma manera, el uso de antibióticos como aditivo en el extensor de esperma es un estándar hoy en día. El semen normalmente está colonizado por una gran variedad de microorganismos que pueden reducir la calidad de los espermatozoides. Sin embargo, se pueden encontrar resultados contradictorios sobre el efecto de la flora bacteriana, así como sobre el efecto de diferentes familias de antibióticos dependiendo de factores tan importantes como la especie, la composición del extensor de esperma o incluso los protocolos de criopreservación (26). En este contexto, es importante llevar a cabo una evaluación intensiva, no solo evaluando los parámetros de los espermatozoides in vitro, sino también los parámetros productivos importantes, de las principales familias de antibióticos utilizadas hoy en día en los extensores de esperma y tener una idea clara de su efecto y la idoneidad de su uso. En este estudio, se identificaron un total de 10 géneros y 16 especies bacterianas con Pseudomonas y Staphylococcus como los géneros más comunes seguidos de E. coli. También se aislaron otras especies bacterianas en un número menor, como Sphingomonas paucimobilis, Deftia acidovorans, Mycrobacterium oxydans, Kocuria y Corynebacterium. Yániz et al. (10) también encontraron algunas de estas bacterias en el esperma de carnero. De la misma manera, E.coli, que es una de las especies más comunes aisladas en el experimento actual, también se ha detectado como la especie bacteriana más frecuente en dosis de espermatozoides humanas (6), equinas (18), caninas (27) y porcinas (20).
Como hemos descrito anteriormente, el efecto de los antibióticos en la calidad de los espermatozoides tiene resultados controvertidos que atienden factores como la especie, el tipo de extensor o el protocolo de criopreservación. Muchos autores recomendaron algunos antibióticos como la gentamicina como aditivo adecuado para el almacenamiento de semen (18, 28, 29). En el presente estudio, la gentamicina fue el antibiótico que mostró el efecto más poderoso que inhibió el crecimiento bacteriano junto con el LS. Por el contrario, la gentamicina también fue el tratamiento con una menor calidad de los espermatozoides evaluada in vitro. Jasko et al. (29) mostraron un efecto negativo en la motilidad de los espermatozoides cuando se utilizaron concentraciones de gentamicina >1 mg/ml en espermatozoides equinos. Por el contrario, Yániz et al. (10) encontraron que la concentración de gentamicina en el extensor de esperma hasta 0,5 g/l no afectaba a la motilidad y viabilidad del esperma después de almacenarlo a 15 °C durante 48 h en carnero. En este punto, 1 g/L de concentración de gentamicina parecía el límite de seguridad para este tipo de antibiótico en equinos. Sin embargo, nuestros resultados informan de una disminución significativa en la fertilidad y fecundidad cuando se utilizó esta concentración de gentamicina. Podría ser posible que los espermatozoides de carnero sean más sensibles a este tipo de antibiótico a esta concentración que el semental. Debe tenerse en cuenta que nuestro estudio es la primera vez que se ha descrito un efecto negativo en la fertilidad en el carnero cuando se utiliza gentamicina como extensor aditivo. Con la misma concentración (1 g/L) de Gentamicin, Aurich y Spergser (1) mostraron que la motilidad de los espermatozoides evaluada in vitro se redujo significativamente y la inhibición bacteriana no fue tan alta como se esperaba en los espermatozoides de sementales. Este hecho muestra que hay un factor específico de especie muy importante que puede determinar la eficiencia de las sustancias antibióticas en el extensor de esperma entre las especies. De esta manera, y después de evaluar nuestros resultados, podemos concluir que nuestra concentración de gentamicina inhibe en gran medida el crecimiento bacteriano, pero dio lugar a un efecto tóxico en algunas evaluaciones de calidad del esperma (milidad progresiva rápida y diferentes parámetros cinéticos: VAP, VSL y ALH, Figura 2). Esta alteración de la calidad de los espermatozoides podría estar afectando negativamente a parámetros importantes del ganado, como la fertilidad. Este hecho se correlaciona con la disminución de la motilidad progresiva evaluada in vitro. En este contexto, se han demostrado que los altos valores de espermatozoides móviles progresivos son un buen factor de correlación con la fertilidad en humanos (30, 31). Probablemente este efecto negativo se deba a algunos efectos nocivos a nivel estructural, ya que el metabolismo de los espermatozoides no se vio afectado por la gentamicina en relación con las muestras de C. Un estudio reciente realizado por Riesco et al. (32) demostró una nueva proteína espermática (ProAKAP4) como un parámetro de diagnóstico prometedor de la calidad de los espermatozoides en los espermatozoides de carnero, que durante tanto tiempo se correlacionó con la motilidad de los espermatozoides. Esta proteína es la proteína más expresada de la vaina fibrosa espermática, siendo una parte importante del flagelo (33, 34). Este tipo de proteína también se ha relacionado con la calidad de los espermatozoides en varias especies, como los humanos (35), los ratones (36) o los jabalíes (37). En este sentido, se deben llevar a cabo más investigaciones para identificar el mecanismo exacto de toxicidad de la gentamicina. En cualquier caso, y en vista de los resultados obtenidos en el presente estudio, está claro que la gentamicina no es una opción adecuada, en estas condiciones, teniendo en cuenta sus efectos negativos, especialmente en los parámetros productivos.
El PS fue el tratamiento con menor eficacia que inhibió el crecimiento bacteriano. Obtiene un menor número de UFC, pero esta disminución no fue significativa con respecto a las muestras de control. Este tratamiento (PS) ha sido uno de los antibióticos más comunes y extendidos desde que se descubrió en 1928, por lo que este uso intensivo durante muchas décadas podría haber producido un mecanismo de resistencia a este tipo de tratamiento (38, 39). Por el contrario, cuando las muestras de esperma se evaluaron in vitro, las muestras tratadas con PS mostraron los mejores resultados en la fisiología de los espermatozoides manteniendo valores más altos de esperma viables después de enviar muestras descongeladas a una prueba de esfuerzo. El mismo efecto se encontró al evaluar el esperma con alta actividad mitocondrial, obteniendo el mejor resultado del experimento en ambos momentos de 0 y 2 h. Este hecho podría sugerir que el PS a esta concentración es un tratamiento adecuado, ya que inhibe en parte el crecimiento bacteriano, no afecta a la calidad de los espermatozoides. De la misma manera y después de los ensayos de campo, PS sigue mostrando resultados similares a las muestras de Controls en fertilidad y prolificación, sin mostrar ningún efecto adverso o tóxico como el G en la fertilidad, o el LS en la prolificación.
Finalmente, el tratamiento LS mostró resultados muy interesantes y complejos. Después de evaluar la calidad de los espermatozoides in vitro, LS no mostró ningún efecto perjudicial ni en la fisiología de los espermatozoides ni en la motilidad de los espermatozoides con respecto a las muestras de C. Además, fue después de la G, el tratamiento con la mayor actividad inhibitoria bacteriana, pero que no mostró efectos adversos en la calidad de los espermatozoides in vitro. Este hecho podría sugerir que este tratamiento (LS) a esta concentración tiene un equilibrio perfecto entre los efectos inhibitorios bacterianos, no afectando a la fisiología de los espermatozoides en el carnero. En este estudio, se obtuvieron resultados similares a Azawi e Ismaeel (16), al evaluar la calidad de los espermatozoides in vitro, pero resultados opuestos al evaluar el efecto inhibidor del crecimiento bacteriano, encontrando a estos autores un efecto antimicrobiano deficiente utilizando una concentración de 1 mg/ml de lincomicina en carnero. Estas diferencias podrían deberse a varios factores, como el uso de Lincomicyn sola (no combinada con especttinomicina) o el diseño experimental (muestras refrigeradas a 5 °C hasta 96 h). En cualquier caso, Lincomicyn parece ser más eficiente cuando se usa en combinación con spectinomicina, lo que nos permite usar concentraciones más bajas, obtener resultados similares en la calidad de los espermatozoides in vitro y realizar una inhibición muy alta en el crecimiento bacteriano. De la misma manera, Akhter et al. (19) han demostrado la superioridad de LS en comparación con las combinaciones de PS que inhiben el crecimiento bacteriano en muestras de esperma de búfalo. Estos y nuestros resultados están en consonancia con los obtenidos por Aleem et al. (40) en búfalo, donde esos autores están de acuerdo en que varias especies bacterianas exhibieron resistencia antimicrobiana a combinaciones de PS, mientras que LS y otras mostraron un mayor efecto antimicrobiano. Después de las pruebas de campo, se observaron algunos efectos interesantes. Ni la fertilidad ni la prolificación ni la fecundidad se vieron afectadas como se esperaba. Sin embargo, después de evaluar la prolificación, podemos observar que este parámetro fue menor con respecto a las muestras sin antibióticos. Este efecto podría deberse a algún tipo de efecto subletal, ya que no es capaz de detectarlo in vitro como ocurría anteriormente en especies como el jabalí (41) o el búfalo (19). Por otro lado, cuando se evaluó la fecundidad, esta prolicidad inferior se compensó porque la fecundidad es un parámetro complejo en el que la fertilidad y la prolificación se combinan. Esta es la primera vez que estos tratamientos antibióticos se han probado en condiciones de campo en carnero con un gran número de ovejas inseminadas.
Se sabe que la membrana plasmática del esperma X o Y es diferente. Korchunjit et al. (42) encontraron que diferentes combinaciones definidas de criomedios y extensores de esperma alteran significativamente la relación de supervivencia del esperma X-Y congelado-descongelado. En este sentido, se observaron algunos resultados interesantes en nuestro estudio cuando se evaluó la proporción de sexos. Las muestras sin antibióticos se han desviado a las mujeres, pero LS y G se habían desviado a los hombres. Ni el grupo experimental ni el grupo de control tienen diferencias con respecto a la proporción de sexos esperada (50:50). Si observamos los resultados obtenidos en la UFC y la proporción de sexos, podemos observar que las muestras de esperma con mayor carga microbiana dan como resultado un mayor número de hembras, y los tratamientos con la menor contaminación microbiana (LS y G) dieron lugar a un número significativamente menor de hembras, lo que es negativo en las especies lácteas donde las hembras tienen el En este punto, parece que el esperma X tiene algún tipo de resistencia a la contaminación microbiana, o que el esperma en Y es más resistente a algún posible efecto perjudicial o tóxico de LS y G. Para esta preocupación, estos resultados allanan el camino para nuevas investigaciones sobre la interacción bacteria/esperma, y para evaluar el diferente efecto de los tratamientos antibióticos en las diferentes subpoblaciones de espermatozoides (Y o X-sperma).
La proporción de sexos es un parámetro complejo que depende de muchos factores biológicos y ambientales. Los estudios de vista previa han encontrado factores tanto antes como después de la fertilización. Además, el sesgo de la proporción de sexos puede estar relacionado tanto con el semen como con el entorno uterino en los seres humanos (43). Los estudios que vinculan la calidad de los espermatozoides y la proporción de sexos son controvertidos. Algunos estudios realizados en humanos no encontraron diferencias en la relación sexual entre muestras seminales con una calidad normal o con alteraciones moderadas o graves (oligozoospermia, atenozoospermia y teratozoospermia) (44) o al menos, esta relación es débil. Sin embargo, en humanos, Bae et al. (45) observaron que el porcentaje de esperma bicéfalo se asoció significativamente con el aumento de hembras nacidas. De la misma manera, Arikawa et al. (46), utilizando la FIV, observaron que las muestras con baja motilidad espermática (<40%) tenían una proporción menor de machos en comparación con aquellas muestras con motilidad espermática normal. Esta variación en la proporción de sexos (menos hombres) observada con semen de baja calidad podría estar asociada con una menor proporción de esperma en Y en el eyaculado, como sugieren Eisenberg et al. (47) en humanos. Por el contrario, en nuestro estudio las muestras con VAP, ALH, VSL y PM rápida más bajo aumentan el porcentaje de machos nacidos según Mossman et al. (48) en humanos. El grupo G tenía menos espermatozoides progresivos rápidos in vitro y esto podría perjudicar el transporte de espermatozoides que contienen X in vivo. Un estudio realizado por Balli et al. (49) en humanos mostró una asociación de una mayor velocidad espermática en el semen de pacientes que concibieron descendencia predominantemente hembra en comparación con pacientes con crías masculina después del tratamiento de tecnología reproductiva asistida (TAR).
Por último, podría ser interesante hacer una reflexión profunda sobre el uso de antibióticos como aditivos en los extensores de esperma. Como se mencionó anteriormente, la reducción del uso de antibióticos es una preocupación mundial. Entre las principales causas de la resistencia bacteriana, hay algunos problemas sociales como la superpoblación o la migración global, pero también el creciente uso de antibióticos en las clínicas y la producción animal (50, 51). Estudios recientes realizados en esperma de jabalí (52) están tratando de optimizar los protocolos de manejo de espermatozoides para evitar o reducir el uso de antibióticos. Teniendo en cuenta los resultados obtenidos en el presente estudio, cuando se utilizan donantes de semen sano en condiciones satisfactorias de higiene ypatología y cuando las muestras van a seguir un proceso de descongelación congelado, se han observado efectos no perjudiciales en la calidad de los espermatozoides evaluada in vitro o en los parámetros productivos (fertilidad, prolificación o fecundidad) cuando se utilizan Nuestros resultados sugieren que el control de la contaminación bacteriana en el semen congelado descongelado puede ser posible sin el uso de antibióticos, aunque los efectos de períodos más largos de almacenamiento en refrigeración y las diferentes temperaturas de almacenamiento deben investigarse más a fondo para el semen animal.
Declaración de disponibilidad de datos
Los autores pondrán a disposición los datos sin procesar que respaldan las conclusiones de este artículo, sin reservas indebidas.
Declaración ética
El estudio actual se realizó de acuerdo con las Directrices del Consejo de la Unión Europea (86/609/UE, modificadas por 2010/62/UE), siguiendo las regulaciones españolas (RD/1201/2005, derogadas por RD/2013) para el uso de animales de laboratorio. Todos los protocolos y procedimientos experimentales fueron aprobados por el Comité Institucional de Cuidado y Uso de Animales de la Universidad de León (España) (ÉTICA-ULE-013-2018).
Contribuciones del autor
LA-L: conceptualización, metodología, análisis formal, investigación, recursos, redacción (proyecto original, curación de datos, redacción), revisión y edición, visualización, supervisión y administración de proyectos. MR: metodología, investigación, supervisión, curación de datos, análisis formal y redacción: revisión y edición. RM-G, MN-M, JB, CC, CO-F y JA: metodología e investigación. AC: curación de datos, metodología e investigación. PP: análisis formal, investigación, recursos, redacción, borrador original, curación de datos, redacción, revisión y edición, visualización, supervisión y adquisición de fondos. MA: conceptualización, metodología, investigación, recursos, redacción: borrador original, curación de datos, redacción, revisión y edición, visualización y adquisición de fondos. LA: conceptualización, recursos, análisis formal, recursos, redacción (proyecto original, curación de datos, redacción), revisión y edición, visualización, supervisión, administración de proyectos y adquisición de fondos. Todos los autores contribuyeron al artículo y aprobaron la versión presentada.
Financiación
Los autores reconocen el contrato de investigación JCyL-LE253P18 y la beca ORDEN EDU/556/2019 (Junta Castilla y León), FPU17/04142 (MCIU) y PRE2018-086400 (MEC), los técnicos de ITRA-ULE (Ainoa Jordán, Pedro de Vega y Cecilia Pérez), ANCHE y el personal de Ovigén.
Conflicto de intereses
Los autores declaran que la investigación se llevó a cabo en ausencia de cualquier relación comercial o financiera que pudiera interpretarse como un posible conflicto de intereses.
Referencias
1. Aurich C, Spergser J. Influencia de las bacterias y la gentamicina en los espermatozoides de sementales refrigerados. Teriogenología. (2007) 67:912–8. doi: 10.1016/j.theriogenology.2006.11.004
Resumen de PubMed | Texto completo de CrossRef | Google Scholar
2. Bielanski A. Procedimientos de desinfección para controlar los microorganismos en el semen y los embriones de humanos y animales de granja. Teriogenología. (2007) 68:1-22. doi: 10.1016/j.theriogenology.2007.03.025
Resumen de PubMed | Texto completo de CrossRef | Google Scholar
3. Auroux MR, Jacques L, Mathieu D, Auer J. ¿Es la relación bacteriana de los espermatozoides un factor determinante en el deterioro de la motilidad de los espermatozoides? Un estudio in vitro en hombres con Escherichia coli. Int J Androl. (1991) 14:264-70. doi: 10.1111/j.1365-2605.1991.tb01091.x
Resumen de PubMed | Texto completo de CrossRef | Google Scholar
4. Kaur S, Prabha V, Sarwal A. Aglutinación mediada por el receptor de los espermatozoides humanos por el factor de espermatozoidesa aislado de Staphylococcus aureus. J Urol. (2010) 184:2586-90. doi: 10.1016/j.juro.2010.07.031
Resumen de PubMed | Texto completo de CrossRef | Google Scholar
5. Monga M, Robertst JA. Spermaglutinación por bacterias: interacciones específicas del receptor. J Androl. (1994) 15:151-6.
6. Diemer H, Michelmann M, Schiefer W. Alteraciones de los espermatozoides humanos inducidas por Escherichia coli. Un análisis de microscopía electrónica. Int J Androl. (2000) 23:178–86. doi: 10.1046/j.1365-2605.2000.00224.x
Resumen de PubMed | Texto completo de CrossRef | Google Scholar
7. Villegas J, Schulz M, Soto L, Sánchez R. Las bacterias inducen la expresión de la apoptosis en los espermatozoides humanos. Apoptosis. (2005) 10:105–10. doi: 10.1007/s10495-005-6065-8
Resumen de PubMed | Texto completo de CrossRef | Google Scholar
8. Kurpisz M, Alexander NJ. Porciones de carbohidratos en la superficie de los espermatozoides: relevancia fisiológica. Fertilil Steril. (1995) 63:158-65. doi: 10.1016/S0015-0282(16)57312-9
Resumen de PubMed | Texto completo de CrossRef | Google Scholar
9. EUR-Lex−31992L0065-END-EUR-Lex [Documento WWW]. Disponible en línea en: https://eur-lex.europa.eu/legal-content/EN/ALL/? uri=celex:31992L0065 (consultado el 9 de abril de 2020).
10. Yániz JL, Marco-Aguado MA, Mateos JA, Santolaria P. Contaminación bacteriana del semen de carnero, sensibilidades a los antibióticos y efectos en la calidad de los espermatozoides durante el almacenamiento a 15oC. Anim Reprod Sci. (2010) 122:142–9. doi: 10.1016/j.anireprosci.2010.08.006
Resumen de PubMed | Texto completo de CrossRef | Google Scholar
11. Gloria A, Contri A, Wegher L, Vignola G, Dellamaria D, Carluccio A. Los efectos de las adiciones de antibióticos a los extensores sobre el semen de toro fresco y congelado. Anim Reprod Sci. (2014) 150:15-23. doi: 10.1016/j.anireprosci.2014.08.012
12. Ortega-Ferrusola C, Johannisson A, Peña Vega FJ, Tapia JA, Rodríguez-Martinez H, Dalin AM, et al. Efecto de diferentes extensores de plasma seminal en la susceptibilidad de los espermatozoides equinos a la peroxidación lipídica después de la centrifugación de una sola capa, a través de Androcoll-E. J Equine Vet Sci. (2011) 31:411–6. doi: 10.1016/j.jevs.2011.01.010
13. Schulze M, Grobbel M, Riesenbeck A, Brüning S, Schaefer J, Jung M, et al. Tasas de dosis de sustancias antimicrobianas en el tiempo de preservación del semen de jabalí para establecer nuevos protocolos. Reproducción Domest Anim. (2017) 52:397-402. doi: 10.1111/rda.12921
Resumen de PubMed | Texto completo de CrossRef | Google Scholar
14. Anel-López L, García-Álvarez O, Parrilla I, Del Olmo D, Maroto-Morales A, Fernandez-Santos MRR, et al. Efecto de la clasificación sexual y la criopreservación en la calidad de los espermatozoides posteriores al deshielo de los espermatozoides de ciervo rojo ibérico.Teriogenología. (2017) 89:206-13. doi: 10.1016/j.theriogenology.2016.11.010
Resumen de PubMed | Texto completo de CrossRef | Google Scholar
15. López-Urueña E, Alvarez M, Gomes-Alves S, Manrique P, Anel-López L, Chamorro CA, et al. Procedimientos alternativos para la criopreservación de los eyaculados de oso pardo dependiendo de la flexibilidad del período de «en enfriamiento» (5 °C). Criobiología. (2014) 69:434–41. doi: 10.1016/j.cryobiol.2014.10.001
Resumen de PubMed | Texto completo de CrossRef | Google Scholar
16. Azawi OI, Ismaeel MA. Influencia de la adición de diferentes antibióticos en el diluyente de semen en el recuento bacteriano viable y la viabilidad espermatozoide del semen awassi ram. Mundo veterinario. (2012) 5:75–9. doi: 10.5455/vetworld.2012.75-79
17. Madeira E, Goularte K, Pradieé J, Mondadori R, Lucia J, Bianchi I, et al. El uso de antibióticos en la criopreservación de espermatozoides de carnero. Int J Vet Med Res Reports. (2014) 2014:154947. doi: 10.5171/2014.154947
18. Varner DD, Scanlan CM, Thompson JA, Brumbaugh GW, Blanchard TL, Carlton CM, et al. Bacteriología del semen de semental conservado y antibióticos en extensores de semen. Teriogenología. (1998) 50:559–73. doi: 10.1016/S0093-691X(98)00161-7
Resumen de PubMed | Texto completo de CrossRef | Google Scholar
19. Akhter S, Ansari MS, Andrabi SMH, Ullah N, Qayyum M. Efecto de los antibióticos en el extensor sobre la calidad bacteriana y espermatozoidea del semen toro de búfalo refrigerado (Bubalus bubalis). Reproducir Domest Anim. (2008) 43:272–8. doi: 10.1111/j.1439-0531.2007.00890.x
Resumen de PubMed | Texto completo de CrossRef | Google Scholar
20. Althouse GC, Kuster CE, Clark SG, Weisiger RM. Investigaciones de campo de contaminantes bacterianos y sus efectos en el semen porcino extendido. Teriogenología. (2000) 53:1167–76. doi: 10.1016/S0093-691X(00)00261-2
Resumen de PubMed | Texto completo de CrossRef | Google Scholar
21. Maes D, Nauwynck H, Rijsselaere T, Mateusen B, Vyt P, de Kruif A, et al. Enfermedades en cerdos transmitidas por inseminación artificial: una visión general. Teriogenología. (2008) 70:1337-45. doi: 10.1016/j.theriogenology.2008.06.018
Resumen de PubMed | Texto completo de CrossRef | Google Scholar
22. Maroto Martín LO, Muñoz EC, De Cupere F, Van Driessche E, Echemendia-Blanco D, Rodríguez JMM, et al. La contaminación bacteriana del semen de jabalí afecta al tamaño de la camada. Anim Reprod Sci. (2010) 120:95-104. doi: 10.1016/j.anireprosci.2010.03.008
Resumen de PubMed | Texto completo de CrossRef | Google Scholar
23. Aslam B, Wang W, Arshad MI, Khurshid M, Muzammil S, Rasool MH, et al. Resistencia a los antibióticos: un resumen de una crisis global. Infectar. Resistencia a las drogas. (2018) 11:1645–58. doi: 10.2147/IDR.S173867
Resumen de PubMed | Texto completo de CrossRef | Google Scholar
24. Anel L, de Paz P, Alvarez M, Chamorro C, Boixo J, Manso A, et al. Ensayo de campo e in vitro de tres métodos para congelar el semen de carnero. Teriogenología. (2003) 60:1293–308. doi: 10.1016/S0093-691X(03)00140-7
Resumen de PubMed | Texto completo de CrossRef | Google Scholar
25. Alvarez M, Chamorro CAA, Kaabi M, Anel-Lopez L, Boixo JCC, Anel E, et al. Diseño y evaluación «in vivo» de dos catéteres adaptados para la inseminación intrauterina transcervical en ovejas. Anima Reprod Sci. (2012) 131:153–9. doi: 10.1016/j.anireprosci.2012.03.001
Resumen de PubMed | Texto completo de CrossRef | Google Scholar
26. Morrell JM, Wallgren M. Alternativas a los antibióticos en los extensores de semen: una revisión. Patógenos. (2014) 3:934-46. doi: 10.3390/patógenos3040934
Resumen de PubMed | Texto completo de CrossRef | Google Scholar
27. Bjurström L, Linde-Forsberg C. Estudio a largo plazo de bacterias aeróbicas del tracto genital en perros sementales. Am J Vet Res. (1992) 53:670-3.
28. Clément F, Vidament M, Guérin B. Contaminación microbiana del semen de semental. Biol Reprod. (1995) 52:779–86. doi: 10.1093/biolreprod/52.monograph_series1.779
29. Jasko DJ, Bedford SJ, Cook NL, Mumford EL, Squires EL, Pickett BW. Efecto de los antibióticos en las características de movimiento de los espermatozoides de sementales enfriados. Teriogenología. (1993) 40:885–93. doi: 10.1016/0093-691X(93)90356-A
Resumen de PubMed | Texto completo de CrossRef | Google Scholar
30. Vasan SS. Análisis de semen y pruebas de función espermática: ¿cuánto probar? Indio J Urol.(2011) 27:41-48. doi: 10.4103/0970-1591.78424
Resumen de PubMed | Texto completo de CrossRef | Google Scholar
31. Zhao Y, Vlahos N, Wyncott D, Petrella C, Garcia J, Zacur H, et al. Impacto de las características del semen en el éxito de la inseminación intrauterina. J Assist Reprod Genet.(2004) 21:143–8. doi: 10.1023/B:JARG.0000031246.76666.f6
Resumen de PubMed | Texto completo de CrossRef | Google Scholar
32. Riesco MF, Anel-Lopez L, Neila-Montero M, Palacin-Martinez C, Montes-Garrido R, Alvarez M, et al. ProAKAP4 como nuevo marcador molecular de la calidad del esperma en el carnero: un estudio integrador en espermatozoides frescos, enfriados y criopreservados.Biomoléculas. (2020) 10:1046. doi: 10.3390/biom10071046
Resumen de PubMed | Texto completo de CrossRef | Google Scholar
33. Huang Z, Somanath PR, Chakrabarti R, Eddy EM, Vijayaraghavan S. Cambios en la distribución intracelular y la actividad de la proteína fosfatasa PP1γ2 y sus proteínas reguladoras en los espermatozoides que carecen de AKAP41. Biol Reprod. (2005) 72:384-92. doi: 10.1095/biolreprod.104.034140
Resumen de PubMed | Texto completo de CrossRef | Google Scholar
34. Pereira R, Sá R, Barros A, Sousa M. Principales mecanismos reguladores involucrados en la motilidad de los espermatozoides. Asian J Androl. (2017) 19:5-14. doi: 10.4103/1008-682X.167716
Resumen de PubMed | Texto completo de CrossRef | Google Scholar
35. Rahamim Ben-Navi L, Almog T, Yao Z, Seger R, Naor Z. La proteína de anclaje A-Kinasa 4 (AKAP4) es un sustrato ERK1/2 y una molécula de interruptor entre cAMP/PKA y PKC/ERK1/2 en los espermatozoides humanos. Representante de ciencia ficción (2016) 6:37922. doi: 10.1038/srep37922
Resumen de PubMed | Texto completo de CrossRef | Google Scholar
36. Fang X, Huang LL, Xu J, Ma CQ, Chen ZH, Zhang Z, et al. La proteómica y el análisis de ARN unicelular del modelo de ratones Akap4-knockout confirman el papel indispensable de Akap4 en la espermatogénesis. Dev Biol. (2019) 454:118-27. doi: 10.1016/j.ydbio.2019.06.017
Resumen de PubMed | Texto completo de CrossRef | Google Scholar
37. Kwon WS, Oh SA, Kim YJ, Rahman MS, Park YJ, Pang MG. Enfoques proteómicos para perfilar marcadores de fertilidad negativos en los espermatozoides de jabalí inferiores.Representante de ciencia ficción (2015) 5:13821. doi: 10.1038/srep13821
Resumen de PubMed | Texto completo de CrossRef | Google Scholar
38. Sengupta S, Chattopadhyay MK, Grossart HP. Las funciones multifacéticas de los antibióticos y la resistencia a los antibióticos en la naturaleza. Microbiol frontal. (2013) 4:47. doi: 10.3389/fmicb.2013.00047
Resumen de PubMed | Texto completo de CrossRef | Google Scholar
39. Spellberg B, Gilbert DN. El futuro de los antibióticos y la resistencia: un homenaje a una carrera de liderazgo de John Bartlett. Clin Infect Dis. (2014) 59:S71–5. doi: 10.1093/cid/ciu392
Resumen de PubMed | Texto completo de CrossRef | Google Scholar
40. Aleem M, Chaudhry R, Khan N, Rizvi A, Ahmad R. Presencia de bacterias patógenas en el semen de búfalo. Búfalo J. (1990) 6:93–8.
41. Waberski D, Weitze KF, Meding S, Leiding C, Weiskopf S. Examen de compatibilidad con esperma y fertilidad de la solución de linspecspecíl como aditivo antibiótico en el semen líquido de jabalí.Reproest Domest Anim. (1990) 25:291–5. doi: 10.1111/j.1439-0531.1990.tb00476.x
42. Korchunjit W, Kaeoket K, Kitiyanant Y, Taylor J, Wongtawan T. Las combinaciones definidas de criomedios y extensores de descongelación influyen en la viable relación de espermatozoides de jabalí X-Y in vitro. Cryo Lett. (2017) 38:160-5.
43. Graffelman J, Fugger EF, Keyvanfar K, Schulman JD. Se comparan las proporciones de nacimiento vivo humano y esperma-sexo. Hum Reprod. (1999) 14:2917–9. doi: 10.1093/humrep/14.11.2917
Resumen de PubMed | Texto completo de CrossRef | Google Scholar
44. Jacobsen R, Bostofte E, Skakkebæk NE, Hansen J, Møller H. Proporción de sexos descendientes de hombres subfértiles y hombres con características espermatozoides anormales. Hum Reprod. (2000) 15:2369-70. doi: 10.1093/humrep/15.11.2369
45. Bae J, Kim S, Chen Z, Eisenberg ML, Buck Louis GM. Calidad del semen humano y la proporción de sexos secundarios. Asiático J Androl. (2016) 18:374–81. doi: 10.4103/1008-682X.173445
Resumen de PubMed | Texto completo de CrossRef | Google Scholar
46. Arikawa M, Jwa SC, Kuwahara A, Irahara M, Saito H. Efecto de la calidad del semen en la proporción de sexos humanos en la fertilización in vitro y la inyección de espermatozoides intracitoplásmicos: Un análisis de 27.158 bebés singletones nacidos después de una nueva transferencia de un solo embrión. Fértil fértil. (2016) 105:897-04. doi: 10.1016/j.fertnstert.2015.12.009
Resumen de PubMed | Texto completo de CrossRef | Google Scholar
47. Eisenberg ML, Murthy L, Hwang K, Lamb DJ, Lipshultz LI. El recuento de espermatozoides y la proporción de sexos de espermatozoides en pacientes con infertilidad masculina. Asiático J Androl. (2012) 14:683-6. doi: 10.1038/aja.2012.58
Resumen de PubMed | Texto completo de CrossRef | Google Scholar
48. Mossman JA, Slate J, Birkhead TR, Moore HD, Pacey AA. La velocidad del esperma está asociada con el sesgo sexual de los hermanos en una población humana. Asiático J Androl.(2013) 15:152–4. doi: 10.1038/aja.2012.109
Resumen de PubMed | Texto completo de CrossRef | Google Scholar
49. Balli KS, Patton WC, Jacobson JD, Corselli J, King A, Chan PJ. Velocidad del esperma en el plasma seminal y la asociación con el género de la descendencia. Arco Androl. (2004) 50:37-40. doi: 10.1080/01485010490250560
Resumen de PubMed | Texto completo de CrossRef | Google Scholar
50. Marshall BM, Levy SB. Alimentos, animales y antimicrobianos: Impactos en la salud humana.Clin Microbiol Rev. (2011) 24:718-33. doi: 10.1128/CMR.00002-11
Resumen de PubMed | Texto completo de CrossRef | Google Scholar
51. Cantante AC, Shaw H, Rhodes V, Hart A. Revisión de la resistencia a los antimicrobianos en el medio ambiente y su relevancia para los reguladores ambientales. Microbiol frontal. (2016) 7:1728. doi: 10.3389/fmicb.2016.01728
Resumen de PubMed | Texto completo de CrossRef | Google Scholar
52. Waberski D, Luther AM, Grünther B, Jäkel H, Henning H, Vogel C, et al. Función de los espermatozoides in vitro y fertilidad después de un almacenamiento hipotérmico libre de antibióticos del semen de jabalí conservado en líquido.Sci Rep. (2019) 9:14748. doi: 10.1038/s41598-019-51319-1
Resumen de PubMed | Texto completo de CrossRef | Google Scholar
Palabras clave: semen ovino, inseminación artificial, antibióticos, fertilidad, relación sexual, prolicidad, resistencia a los antibióticos
Cita: Anel-Lopez L, Riesco MF, Montes-Garrido R, Neila-Montero M, Boixo JC, Chamorro C, Ortega-Ferrusola C, Carvajal A, Altonaga JR, de Paz P, Alvarez M y Anel L (2021) Comparación del efecto de los diferentes antibióticos en el esperma de carnero congelado: ¿Es posible evitar su adición? Frente. Veterinario. Sci. 8:656937. doi: 10.3389/fvets.2021.656937
Editado por:
Szabolcs Nagy, Universidad de Panonia, Hungría
Revisado por:
Jane Morrell, Universidad Sueca de Ciencias Agrícolas, Suecia
María Ignacia Carretero, Universidad de Buenos Aires, Argentina
Copyright © 2021 Anel-Lopez, Riesco, Montes-Garrido, Neila-Montero, Boixo, Chamorro, Ortega-Ferrusola, Carvajal, Altonaga, de Paz, Álvarez y Anel.
*Correspondencia: Marta F. Riesco, mferrs@unileon.es
Descargo de responsabilidad: Todas las afirmaciones expresadas en este artículo son únicamente las de los autores y no representan necesariamente las de sus organizaciones afiliadas, o las del editor, los editores y los revisores. Cualquier producto que pueda ser evaluado en este artículo o reclamación que pueda ser fabricado por su fabricante no está garantizado ni respaldado por el editor.
Date de alta y recibe nuestro 👉🏼 Diario Digital AXÓN INFORMAVET ONE HEALTH
Date de alta y recibe nuestro 👉🏼 Boletín Digital de Foro Agro Ganadero
Noticias animales de compañía
Noticias animales de producción
Trabajos técnicos animales de producción
Trabajos técnicos animales de compañía

