Comportamiento farmacocinético de cuatro preparados de cannabidiol tras la administración oral única en perros
Comportamiento farmacocinético de cuatro preparados de cannabidiol tras la administración oral única en perros
 Sasithorn Limsuwan1
Sasithorn Limsuwan1  Natthaporn Phonsatta2
Natthaporn Phonsatta2  Atikorn Panya2
Atikorn Panya2  Rathapon Asasutjarit3
Rathapon Asasutjarit3  Natthasit Tansakul4*
Natthasit Tansakul4*- 1Instituto de Investigación Alimentaria y Desarrollo de Productos, Universidad de Kasetsart, Bangkok (Tailandia)
- 2Centro Nacional de Ingeniería Genética y Biotecnología (BIOTEC), Agencia Nacional de Desarrollo de la Ciencia y la Tecnología (NSTDA), Pathum Thani, Tailandia
- 3Unidad de Investigación en Medicamentos, Desarrollo y Aplicación de Productos Sanitarios de la Universidad de Thammasat (DHP-DA), Departamento de Ciencias Farmacéuticas, Facultad de Farmacia, Universidad de Thammasat, Pathum Thani, Tailandia
- 4Departamento de Farmacología, Facultad de Medicina Veterinaria, Universidad de Kasetsart, Bangkok, Tailandia
El cannabidiol (CBD) es un agente fitoquímico natural y uno de los más abundantes que se encuentran en el Cannabis sativa. Se sabe que exhibe propiedades farmacológicas en diversas afecciones, como el alivio de la inflamación, el dolor, la epilepsia y el efecto de ansiedad. Ha habido una tendencia creciente a nivel mundial en el uso de CBD como suplemento en mascotas. En consecuencia, hay varios productos de CBD que se comercializan y que están disponibles específicamente para mascotas. A los veterinarios y dueños de mascotas les preocupa que, después de la ingestión, diferentes formulaciones de CBD puedan dar lugar a un nivel de CBD circulando en la sangre que puede afectar el uso seguro y la eficacia del CBD en las mascotas. Varios estudios de farmacocinética en animales se han llevado a cabo principalmente con una forma aceitosa de CBD. Hasta la fecha, hay una falta de datos sobre las comparaciones directas en animales entre los perfiles cinéticos del plasma de CBD a partir de una administración oral de las diversas formas de preparación. Por lo tanto, el presente estudio evaluó y comparó los niveles plasmáticos de CBD de una sola administración oral utilizando cuatro preparaciones de CBD diferentes: líquidas (una forma a base de aceite, una forma de nanoemulsión o una forma soluble en agua) o una forma semisólida (como CBD mezclado en una golosina) en perros. En total, 32 perros sanos mestizos fueron asignados aleatoriamente en 4 grupos y tratados de acuerdo con un diseño paralelo de 1 período y 4 tratamientos. Las tres formas líquidas se dosificaron a 5 mg/kg de peso corporal, mientras que la forma semisólida única se administró a 50 mg/golosina/perro. Los resultados mostraron que el perfil plasmático de CBD de la administración de una forma soluble en agua era comparable al del grupo a base de aceite. La forma basada en nanoemulsión tendía a absorberse rápidamente y alcanzaba su punto máximo antes que las demás. Sin embargo, el CBD en todas las preparaciones alcanzó la concentración plasmática máxima dentro de las 3 h posteriores a la dosis, con un rango promedio de 92-314 μg/L. Hubo diferencias significativas entre ciertos parámetros entre las formas líquida y semisólida. Este fue el primer estudio que proporcionó datos farmacocinéticos sobre el CBD en formas solubles en agua, basadas en nanoemulsiones y semisólidas para perros como animales de compañía. Los datos actuales deberían facilitar el escrutinio de los perfiles plasmáticos de CBD basados en diferentes formulaciones a través de una vía oral en perros.
Introducción
Desde que se descubrió el sistema endocannabinoide y su receptor a finales de la década de 1960, se han realizado extensos estudios para comprender los mecanismos, funciones e interrelaciones químicas asociadas (1, 2). Los cannabinoides son compuestos químicos, producidos principalmente por Cannabis sativa L., que supuestamente interactúan con el sistema endocannabinoide y ejercen un efecto biológico en los mamíferos (1). Hay más de 90 compuestos en 10 subclases que han sido clasificados como fitocannabinoides (2). Entre estos, el cannabidiol (CBD), un componente no ficotrópico del cannabis, ha sido de interés por su uso potencial para curar enfermedades y mejorar la calidad de vida de los animales (3). Han sido numerosas las publicaciones sobre los efectos farmacológicos in vitro e in vivo del CBD en humanos y animales, como las propiedades antiinflamatorias, analgésicas, dermatológicas e inmunomoduladoras (2-5). En concreto, los primeros estudios sobre la administración de CBD en perros han demostrado su potencial en el alivio del dolor y el síntoma clínico de la artrosis (6). Recientemente, se informó que la administración de una dosis baja de CBD junto con un protocolo analgésico en caballos mostró un alivio satisfactorio del dolor con una mejor calidad de vida de los animales (7). Clínicamente, se ha descrito la eficacia del CBD para reducir la frecuencia y la gravedad de las convulsiones en un perro epiléptico (8, 9). Además, se ha demostrado que el CBD es útil como tratamiento coadyuvante para aliviar el prurito en un perro con dermatitis atópica (10).
A pesar de que el CBD tiene un potencial terapéutico sustancial en animales, sus perfiles farmacocinéticos (PK) en animales de compañía, especialmente perros, aún no se han descrito claramente (11). El CBD es una molécula químicamente lipofílica de absorción pobre y variable (12). Se ha informado que la biodisponibilidad oral del CBD en perros es inferior al 20% (13). En particular, se planteó la hipótesis de que el metabolismo de primer paso es una de las principales preocupaciones con respecto a la baja biodisponibilidad del CBD a través de la administración oral (14). Por lo tanto, ha habido mucho interés en aumentar el nivel plasmático de CBD e identificar vías alternativas y diferentes formas de administración de dosis.
Se han estudiado varias formas farmacéuticas de CBD en animales (11), como el aceite líquido, las cápsulas, los masticables blandos (15-17), las perlas de aceite microencapsuladas y la crema transdérmica (18), por vía intranasal y como supositorio (19). Hoy en día, hay una variedad de productos de CBD disponibles para mascotas, con un consumo creciente en el mercado global (11, 20). La preparación a base de aceite de CBD es una de las formas más comunes consumidas por vía oral por las mascotas y se ha estudiado su comportamiento cinético (11). Sin embargo, la propiedad altamente lipofílica de los productos a base de aceite afecta el nivel de CBD para un efecto biológico óptimo, ya que tiene baja solubilidad acuosa y biodisponibilidad. Se han desarrollado otras opciones de CBD para mejorar la solubilidad y la entrega del CBD a la circulación sanguínea y al tejido diana, como las formas solubles en agua y las nanoemulsiones (5, 21-23). Se ha estudiado la comparación de los perfiles de PK de diferentes preparados solubles en agua y a base de aceite en humanos y se ha confirmado la influencia del preparado de CBD en su biodisponibilidad (5). La farmacocinética describe la concentración de un fármaco en el transcurso del tiempo en todo el cuerpo y puede utilizarse como una herramienta interpretativa y predictiva del comportamiento químico exógeno. El destino de cualquier medicamento puede cambiar según el sitio de administración, la formulación y la dosis. Los perfiles de farmacocinética de las diferentes formas farmacéuticas en animales diana deben estudiarse teniendo en cuenta los diversos factores que afectan al nivel plasmático de CBD.
El objetivo del presente estudio fue determinar el nivel óptimo de CBD utilizando GC-TQ/MS, con el objetivo principal de evaluar los perfiles cinéticos plasmáticos de CBD en perros maduros mestizos. Para ello, el estudio investigó una administración de dosis única de CBD de cuatro formas farmacéuticas diferentes de CBD infundido en una base de aceite (OM), una base de nanoemulsión (NM), una base soluble en agua (WM) y una forma semisólida como golosina (CM). La investigación actual debería proporcionar información que sea relevante para el uso y la práctica prudentes de la administración de CBD y para las estrategias de eficacia a través de la administración oral en perros.
Materiales y métodos
Preparación química y de CBD
El estándar de CBD se compró a Cerliliant (código de producto: 13956-29-1). El polvo de CBD certificado se obtuvo de Salus Bioceutical (Thailand) Co., Ltd. con una pureza superior al 99%, según lo informado por un laboratorio de pruebas certificado de terceros. Se compraron grados HPLC y LC/MS de acetonitrilo y metanol a Labscan Co. Ltd. (Bangkok, Tailandia).®
El CBD a base de aceite se preparó disolviendo el polvo de CBD en aceite de coco virgen natural (100% prensado en frío). En resumen, se pesaron 1,5 g de polvo aislado de CBD en un matraz aforado y se disolvieron en 30 ml de aceite y se dispersaron con un agitador magnético en una placa caliente a aproximadamente 45°C durante 30 min.
La formulación de nanoemulsiones no fue el objetivo principal de este estudio. Por lo tanto, se realizó una prueba del potencial de una nanoemulsión para la administración de CBD siguiendo un método desarrollado internamente para formulaciones orales de aceite de hierbas. En resumen, se preparó una nanoemulsión de aceite en agua utilizando una técnica de homogeneización a alta presión (15.000 psi, 5 ciclos), compuesta por gotas de aceite con diámetros en el rango de 150-200 nm. La nanoemulsión se logró mezclando una fase acuosa (que comprende agua purificada, propilenglicol, EDTA sódico, concentrado de parabenos, Tween 80) y una fase oleosa (que comprende CBD, triglicéridos de cadena corta y media, alfa-tocoferol y Span 80).
El CBD a base de agua estaba compuesto por un 20% de CBD en polvo soluble en agua en una mezcla modificada de almidón de maíz y tapioca como emulsionante. Brevemente, se añadieron 7,5 g de polvo soluble en agua de CBD a un matraz aforado de 50 ml. A continuación, se añadieron 30 mL de agua purificada y se mezcló con un agitador magnético durante 15 min para conseguir una concentración final de 50 mg/mL. En particular, antes de administrar formas líquidas a cada animal, se volvió a analizar la concentración de CBD de cada preparación mediante HPLC y se corrigió el volumen cuando fue necesario para una dosis de 5 mg/kg. En resumen, el método de validación interno HPLC-DAD (sistemas de HPLC Thermo Scientific™ Vanquish™ Core) para la cuantificación del CBD mostró linealidad en el rango de 0,01 a 0,4 mg/L, con un coeficiente de determinación ≥0,999 y un LLOQ de 0,01 mg/L. Los valores porcentuales de precisión y exactitud estuvieron entre el 3,60 y el 4,18 % y entre el 95,6 y el 102,4 %, respectivamente.
El CBD en forma de golosina se preparó mezclando pequeños trozos de los ingredientes (maíz, salvado de arroz, aceite de coco y agua). Luego, el resultado mixto se cargó individualmente para proporcionar aceite de CBD a 50 mg / tratamiento. Todas las muestras de golosinas se colocaron en un horno a 100 °C durante 30 min. Para probar el nivel de CBD en la golosina, se tomaron muestras de 10 muestras de la golosina del mismo lote, y los resultados mostraron que el nivel de CBD en todas las muestras estaba en la concentración esperada con una desviación estándar de menos del 1,8%. Todas las preparaciones de CBD se guardaron en recipientes bien sellados y se colocaron en un refrigerador (4 ° C) antes de ser utilizadas para la ingestión animal dentro de los 7 días.
Los animales y las consideraciones éticas
El estudio se realizó de acuerdo con el permiso del Comité para la Aprobación del Cuidado y Uso de Animales para la Investigación Científica de la Facultad de Medicina Veterinaria de la Universidad de Kasetsart, Bangkok, Tailandia (número de aprobación ACKU 62-VET-058).
En total, 32 perros sanos, cruzados e intactos con identificación numerada individualmente (de 1 a 5 años, peso de 11 a 23 kg) fueron igualmente aleatorizados en 4 grupos de tratamiento de diseño paralelo (4 machos y 4 hembras en cada grupo). Los animales no habían sido tratados con ningún medicamento durante las 4 semanas anteriores y se habían aclimatado durante al menos 14 días antes del tratamiento. Los animales fueron alojados en perreras separadas, y las condiciones de alojamiento y los animales se manejaron de acuerdo con el estándar de operación de la Universidad. Durante la aclimatación se realizó examen físico, observación clínica, hematología y química sanguínea. Todos los animales fueron ayunados durante la noche antes de la dosis. Se observaron indicios de signos clínicos relevantes o eventos adversos dos veces al día durante 3 días antes y después del tratamiento.
Diseño de dosificación
Se administró una dosis oral única de CBD en forma líquida: para una base de aceite (MO), una base de nanoemulsión (NM), una base soluble en agua (WM), a cada animal en ayunas en función del peso corporal real (PC) del animal, con el objetivo de 5 mg/kg de peso corporal en volúmenes de dosificación ajustados individualmente. En la forma semisólida (CM), cada porción contenía 50 mg de CBD por perro que se administró a mano directamente en el mes del animal en ayunas para su autoingestión con una bandeja debajo que recogía cualquier pieza derramada del elemento de prueba, que luego se reinsertaba en la cavidad bucal del animal y se observaba cuidadosamente al animal para asegurarse de que se había tragado toda la golosina.
Especímenes y colección
Las muestras de sangre se recogieron y almacenaron en un tubo que contenía heparina de litio mediante venopunción cefálica o safena con un catéter intravenoso n.º 22″ en los siguientes momentos: -1 día, 0, 30 min, y luego 1, 2, 3, 6, 10, 24 y 30 h después de una sola ingestión oral. Tras la recogida, las muestras se colocaron inmediatamente en hielo y se protegieron de la luz directa hasta la centrifugación. Después de la centrifugación a 3.000 × g durante 10 min a una temperatura controlada de 4 °C, el plasma se recolectó en alícuotas etiquetadas codificadas en laboratorio. A continuación, las alícuotas se transportaron en una caja de hielo para ser congeladas a -80 °C en una caja de cubierta oscura a la espera de su análisis en un plazo de 65 días.
Medición cuantitativa del CBD que contiene plasma
Se estudiaron los perfiles de concentración plasmática y tiempo de CBD de los grupos de ocho animales por tratamiento utilizando un método de cromatografía de gases validado internamente modificado de lo descrito anteriormente (24). En resumen, se extrajeron 100 μL de muestra de plasma con 400 μL de metanol y luego se triplicaron en vórtice a 2.200 rpm durante 10 min. Las muestras se centrifugaron a 10.000 × g durante 10 min a 4°C. Una porción de los 100 μL de sobrenadante se transfirió a un vial de vidrio GC de 2 mL. Se añadió un patrón interno con ácido mirístico-D27 en hexano (1 μmol/mL) para 20 μL. La mezcla se secó a 60 °C durante 2 h, luego se agregó con 50 μL de diclorometano y se secó nuevamente durante 30 min para eliminar el agua residual. Para la reacción de trimetilsililación, se realizó un método modificado siguiendo un ensayo descrito (24, 25). En resumen, se añadieron 50 μL de N-metil-N-(trimetilsilil) trifluoroacetamida (MSTFA), que contenía un 1% de trimeticlorosilano, a cada mezcla y se incubaron a 37 °C durante 30 min. Las muestras derivadas se enfriaron a temperatura ambiente y se transfirieron a viales de vidrio con microinsertos y se taparon inmediatamente para su análisis. Cada muestra se analizó mediante cromatografía de gases, espectrometría de masas en tándem de triple cuadrupolo (GC-TQ/MS; GC 7890B/MSD 7000D; Agilent Technologies; Estados Unidos) acoplado a un sistema de muestreo automático PAL3 (CTC Analytics AG; Suiza).
Se analizó un volumen de inyección de 2 μL de las muestras derivadas utilizando el GC-TQ/MS en modo dividido con una temperatura del inyector de 250 °C, una relación de división de 10:1, con una columna DB-5MS UI (30 m, 0,25 mm de diámetro interior; Agilent Technologies; Estados Unidos). Se utilizó helio como gas portador con un caudal constante de 1,0 mL/min. El horno GC se programó con una temperatura inicial de 60 °C, luego se aumentó de 60 °C a 325 °C a una velocidad de 10 °C/min, y se mantuvo durante 10 minutos. La línea de transferencia, la fuente de iones y el cuadrupolo se establecieron a 325 °C, 240 °C y 180 °C, respectivamente. El espectrómetro de masas se operó en modo de monitoreo dinámico de reacciones múltiples (dMRM) y se detectó la transición a m/z 389.9 > 301.2 m/z para CBD y 312.0 > 119.9 > 73 m/z para el ácido mirístico-D27. Para lograr una precisión y exactitud aceptables para la cuantificación del CBD, las muestras derivatizadas se limitaron a 30 muestras (inyecciones) al día con un procedimiento adecuado de eliminación de humedad. Todas las muestras se almacenaron a <10 °C utilizando una pila y una bandeja Peltier PAL3 para garantizar la estabilidad de los compuestos objetivo. Además, el ajuste del detector de masas y la curva de calibración se realizaron diariamente antes de comenzar la operación de la nueva secuencia. Los datos se adquirieron utilizando el software MassHunter (versión 10.0; Agilent Technologies; Estados Unidos) sobre la base de tres réplicas para calcular la media y el error estándar. Las curvas de calibración se determinaron utilizando CBD a diferentes concentraciones en el rango de 1 a 800 ng/mL en plasma con ácido mirístico-d27 como patrón interno (coeficiente de determinación = 0,9999). Los análisis cuantitativos se realizaron utilizando el software Agilent MassHunter (versión 10.0; Agilent Technologies; Estados Unidos) y exportado al software Excel (Microsoft Corp.; Estados Unidos) para su posterior tratamiento de datos.
Evaluación farmacocinética
Los parámetros farmacocinéticos de este estudio se evaluaron siguiendo un enfoque típico independiente del modelo mediante análisis no compartimental (ANC). La NCA se realizó utilizando el software R [versión 4.3.2; R Core Team, (2022-10-31)], centrándose en los parámetros clave de la concentración plasmática máxima (Cmáximo), tiempo hasta la concentración máxima (Tmáximo), área bajo la curva hasta el último punto temporal cuantificable (AUC0-t), área bajo la curva extrapolada al infinito (AUC0-inf), constante de la tasa de eliminación de la fase terminal (Ke), volumen aparente de distribución durante la fase terminal (Vz/F), aclaramiento aparente (CL/F) después de la administración no intravenosa (suponiendo que la relación entre el aclaramiento y la biodisponibilidad es constante sin comparación IV), tiempo medio de residencia extrapolado hasta el infinito (TRMInf), y la vida media de eliminación (T1/2). La dosis normalizada Cmáximo y se calcularon los parámetros del AUC para facilitar la evaluación de la proporcionalidad de la dosis. Los valores relativos de biodisponibilidad se calcularon después de la normalización de la dosis utilizando AUC(otra forma)/AUC(Formulario OM) × 100.
Análisis estadístico
Microsoft Excel y GraphPad Prism versión 9.5.1 (733) para Windows (GraphPad Software; Estados Unidos) se utilizaron para calcular los análisis estadísticos descriptivos e inferenciales (cuando correspondía), incluidos todos los datos de cálculo de resultados de la mitad de un conjunto de datos (valores medianos), la medida de la tendencia central (promedio; media), la variabilidad (desviación estándar, media de error estándar) y las cifras. La distribución de la normalidad se determinó mediante la prueba de Shapiro-Wilk, mientras que las diferencias entre los grupos para el AUC0-t, Cmáximo, Tmáximoy los parámetros de Ke se analizaron mediante un ANOVA de Brown-Forsythe siguiendo una prueba de comparaciones múltiples T3 de Dunnett post hoc. Distribuciones de no normalidad para la T1/2AUC0-inf, Vz/F, CL/F y MRTInf Los parámetros se probaron utilizando el sistema de Kruskal-Wallis con una prueba post hoc de Dunn-Bonferroni para obtener datos de comparación múltiple por pares. Se definió como significativo un valor de p ≤ 0,05.
Resultados
Este estudio se llevó a cabo para investigar la farmacocinética del CBD en perros mestizos intactos después de una sola dosis. Se logró una validación interna del método GC-TQ/MS para plasma de perro fortificado con un límite de detección del instrumento de 0,05 μg/L y un LLOQ de 1 μg/L de plasma sanguíneo, con una precisión intradía satisfactoria basada en el coeficiente de variación y los resultados de precisión en los rangos 5,8-10,8% y 85,2-110,3%, respectivamente. La precisión y la exactitud entre días se situaron en los rangos del 9,8-10,1% y del 92,6-102,45%, respectivamente.
El tratamiento consistió en que los perros recibieran una dosis única de CBD en forma líquida infundida en una base de aceite (OM), una base de nanoemulsión (NM) o una base soluble en agua (WM), o de forma semisólida como golosina (CM). Todos los animales completaron este experimento sin que se produjeran eventos clínicos adversos durante el estudio. A la dosis estudiada, no hubo signos de trastornos gastrointestinales o nerviosos graves en los perros durante y después de la dosis. Una sola ingesta de cada porción contenía 50 mg de CBD por cada perro en el grupo CM. El conjunto de datos de C normalizado por dosismáximo y los parámetros del AUC se compararon con los de otros grupos. En particular, solo un perro en el grupo de MC pareció producir más saliva de lo habitual al masticar, pero se recuperó poco después de la ingestión. No se identificó la causa raíz de esto. En la Tabla 1 se resumen los parámetros de farmacocinética, mediante análisis no compartimental, del CBD en los 4 preparados tras una única administración oral a perros en ayunas durante la noche. Se calcularon las concentraciones plasmáticas de CBD (media ± SEM) para cada punto de tiempo de todos los grupos y se presentan como un gráfico semilogarítmico en la Figura 1. Ciertos parámetros farmacocinéticos fueron estadísticamente significativos, como se muestra en la Figura 2. De hecho, tras la estimación farmacocinética, se excluyó un perro del grupo OM y dos perros de cada uno de los grupos restantes en el resumen descriptivo posterior debido a la insuficiencia de puntos de datos en la fase de eliminación. Además, los datos excluidos dieron lugar a una estimación inexacta de la Ke, T1/2, Vz/F y extrapolación del AUC0-inf. También podría afectar a los cálculos de MRT y CL/F, ya que se calculan utilizando el AUC0-inf.
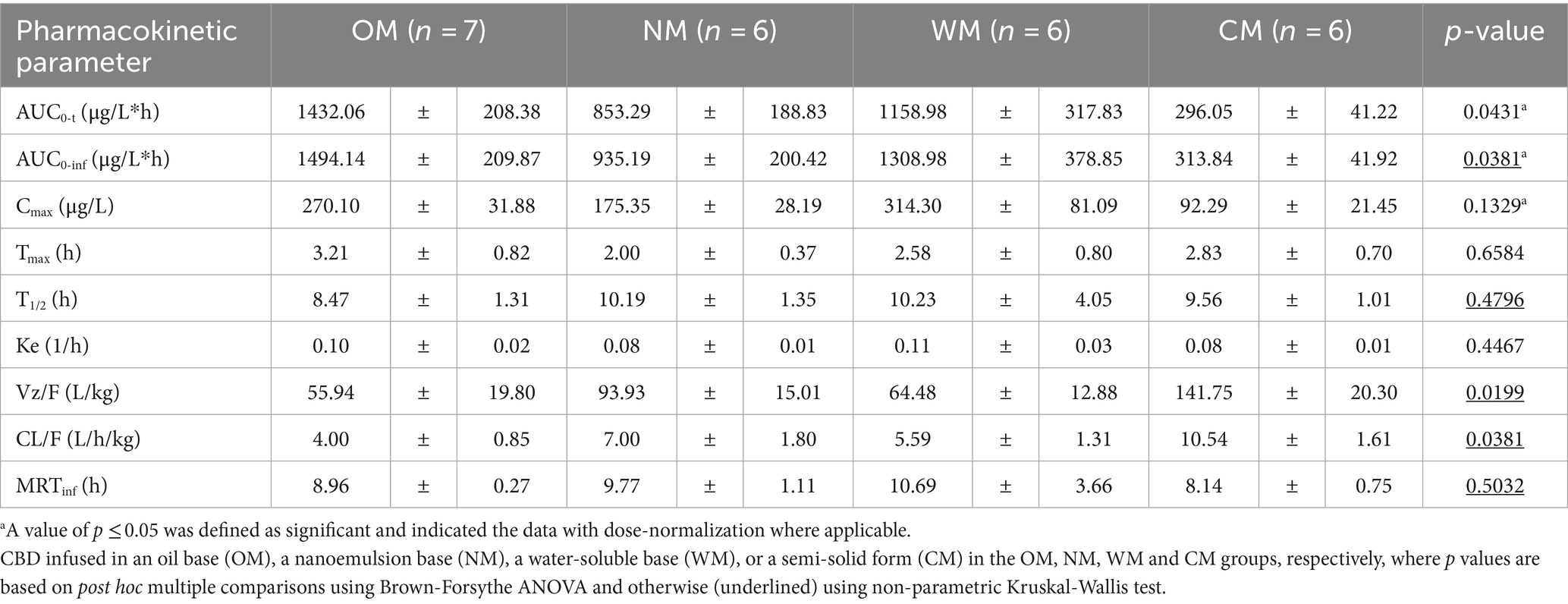 Tabla 1. Parámetros farmacológicos (media ± SEM) del CBD tras la administración de una sola dosis oral de una de las cuatro formas farmacéuticas diferentes.
Tabla 1. Parámetros farmacológicos (media ± SEM) del CBD tras la administración de una sola dosis oral de una de las cuatro formas farmacéuticas diferentes.
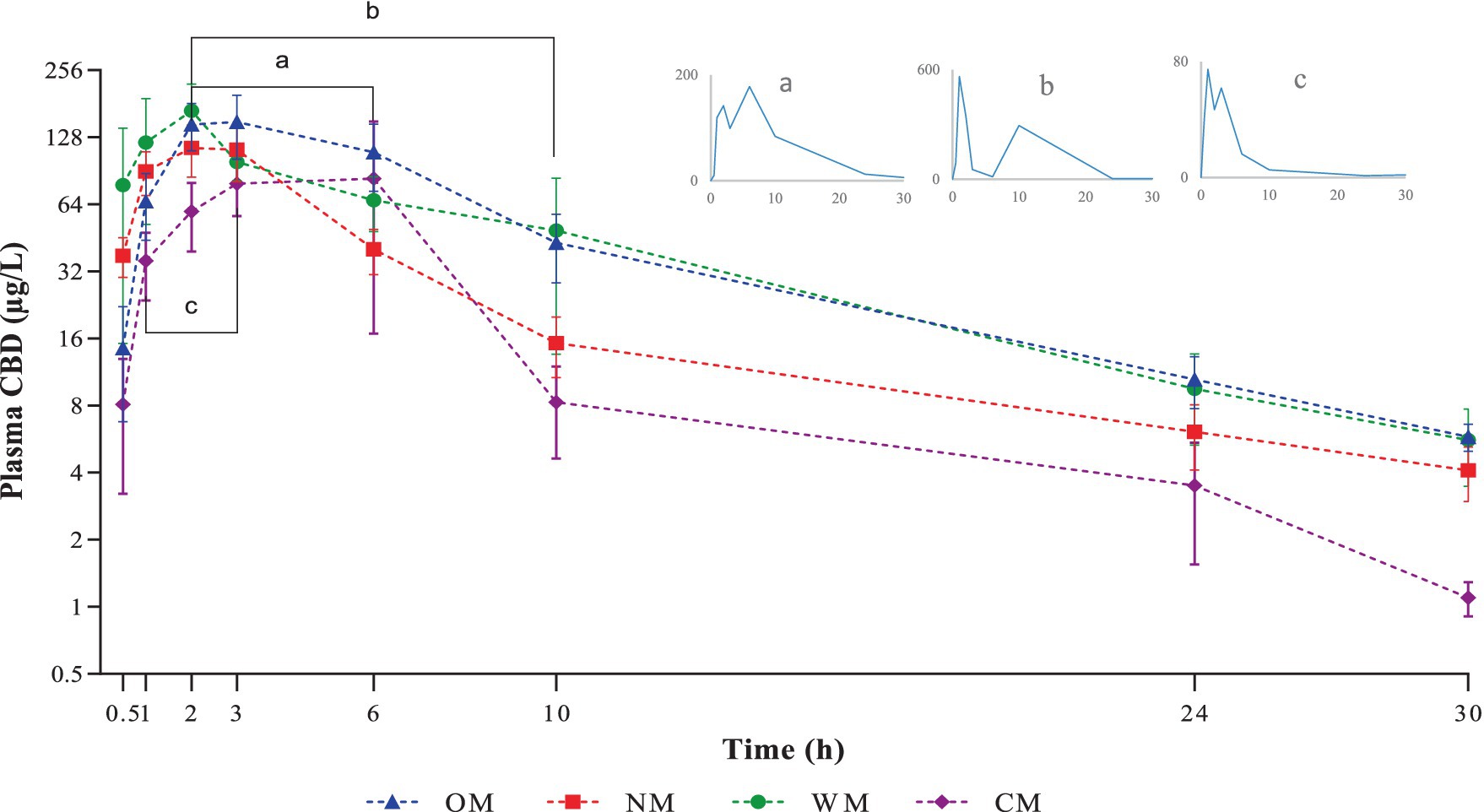 Figura 1. Representación gráfica de la escala semilogarítmica de los niveles plasmáticos de CBD (media ± SEM) después de la administración de una sola dosis oral de una de las cuatro formas farmacéuticas diferentes: CBD infundido en una base de aceite (MO), una base de nanoemulsión (NM), una base soluble en agua (WM) o una forma semisólida (CM). La barra de línea y las subfiguras con letras a, b y c indican los puntos de tiempo en los que se observaron picos secundarios en un perro de los grupos OM, WM y CM, respectivamente.
Figura 1. Representación gráfica de la escala semilogarítmica de los niveles plasmáticos de CBD (media ± SEM) después de la administración de una sola dosis oral de una de las cuatro formas farmacéuticas diferentes: CBD infundido en una base de aceite (MO), una base de nanoemulsión (NM), una base soluble en agua (WM) o una forma semisólida (CM). La barra de línea y las subfiguras con letras a, b y c indican los puntos de tiempo en los que se observaron picos secundarios en un perro de los grupos OM, WM y CM, respectivamente.
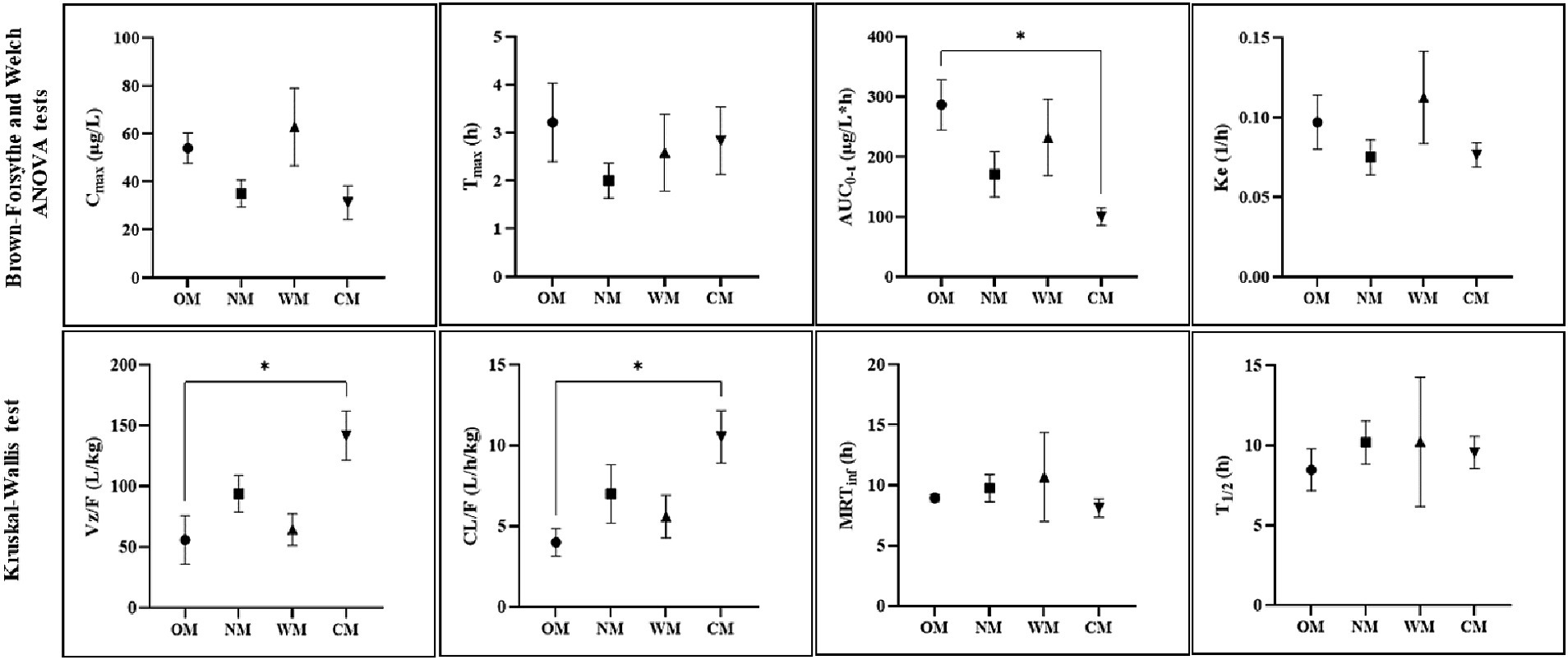 Figura 2. Parámetros representativos de PK (media ± SEM) para cuatro formas diferentes: CBD en una base oleosa (MO), una base de nanoemulsión (NM), una base soluble en agua (WM), una forma semisólida (CM), con significación indicada por p < 0,05 (normalizada por dosis: mg/kg, C*máximo y parámetros de AUC).
Figura 2. Parámetros representativos de PK (media ± SEM) para cuatro formas diferentes: CBD en una base oleosa (MO), una base de nanoemulsión (NM), una base soluble en agua (WM), una forma semisólida (CM), con significación indicada por p < 0,05 (normalizada por dosis: mg/kg, C*máximo y parámetros de AUC).
Tras la normalización de la dosis, los resultados no mostraron diferencias significativas entre el Cmáximo del CBD en el plasma después de la administración de todos los grupos. Sin embargo, el C más altomáximo del CBD en el plasma (314,30 ± 81,09 μg/L) se obtuvo de la administración del grupo WM, mientras que el menor Cmáximo del CBD en el plasma se encontraba en el grupo CM (92,29 ± 21,45 μg/L).
Los valores del AUC medio0-t y AUC0-inf de la formulación MO fueron 1432,06 ± 208,38 y 1494,14 ± 209,87 (μg/L*h), que mostraron el mayor grado de exposición al CBD en comparación con los otros tratamientos. El grupo CM proporcionó la menor extensión de CBD en el plasma de alrededor de 296,05 ± 41,22 y 313,84 ± 41,92 (μg/L*h) para la media del último punto de tiempo cuantificable y la curva al tiempo infinito, respectivamente. Los niveles relativos de biodisponibilidad después de la normalización de la dosis de las otras formulaciones en comparación con la formulación de MO fueron de 80,9, 59,5 y 34,8% para los grupos de WM, NM y MC, respectivamente.
Entre las preparaciones, hubo una rápida absorción en el grupo de NM, con concentraciones plasmáticas máximas que ocurrieron dentro de las 2 h posteriores a la ingestión. Las concentraciones plasmáticas de CBD de las formas líquidas alcanzaron un pico de más de 100 μg/L en 6 h en todos los perros. Por el contrario, solo tres de los ocho perros del grupo CM lograron una Cmáximo más de 100 μg/L. La exposición utilizando la forma farmacéutica semisólida (CM) representada por el AUC fue mucho menor que la de las otras formas farmacéuticas.
La T1/2 de CBD plasmático en el grupo OM fue de 8,47 ± 1,31 h, que fue más corto que para los demás, pero no significativamente diferente. A las 30 h después de la dosis, el CBD fue detectable en todos los perros del grupo OM, pero no se detectó en 1 de los 8 perros de cada uno de los grupos NM, WM y CM. Todo el MRTInf tuvo un rango de nivel similar (8,14-10,69 h). Hubo diferencias significativas entre las formas líquida y semisólida para ciertos parámetros (AUC0-t, Vz/F y CL/F). Como resultado, los perfiles cinéticos del CBD en las formas líquidas fueron relativamente similares, en particular para los grupos de MO y WM. Como tal, los resultados demostraron que los principales parámetros de PK del CBD dentro de las formas líquidas no eran tan sencillos como se esperaba. El impacto de la forma farmacéutica se trata en la discusión a continuación.
Discusión
La utilización de productos relacionados con el cannabis para lograr impactos favorables en la salud está aumentando rápidamente después de su legalización en algunas partes del mundo. En junio de 2022, Tailandia eliminó la marihuana de su lista de estupefacientes y se convirtió en la primera nación asiática en aprobar el cannabis para uso medicinal e industrial (26). El consumo de cannabis es de interés no solo en la medicina humana, sino también en la medicina veterinaria, donde se justifica una amplia investigación para comprender mejor el comportamiento y el impacto de la droga después de la administración en animales, ya que las diferencias entre especies son un factor principal que influye en la variación de la PK (27). Los perros han sido las principales especies de animales de compañía estudiadas; sin embargo, los estudios de PK publicados se han centrado principalmente en el CBD a base de aceite (11, 15, 28).
El presente estudio fue diseñado para explorar los patrones de PK del CBD en el plasma de diferentes formas de preparación: líquida (los grupos OM, NM y WM) y semisólida (el grupo CM), después de una sola administración oral en perros cruzados en ayunas durante la noche. Se sabe que el CBD es un compuesto lipofílico con absorción limitada en la sangre circulante (12). Varios informes sobre la PK del CBD en perros han estudiado el CBD en formulaciones a base de aceite, perlas microencapsuladas, cápsulas blandas masticables y cápsulas de gelatina blanda (11, 15-18). Sin embargo, los datos comparativos de los perfiles orales de CBD en animales de compañía con diferentes formulaciones son escasos. Según el conocimiento de los autores, este es el primer informe sobre el CBD en nanoemulsión y formas solubles en agua en perros. Además, de acuerdo con la limitada información disponible sobre el CBD en forma semisólida, este estudio ha presentado el comportamiento del CBD plasmático después de la ingestión de bocadillos como golosina en perros.
La variación en el patrón de PK del CBD plasmático surge de un metabolismo extenso de primer paso y su baja solubilidad acuosa que conduce a una biodisponibilidad deficiente y un efecto biológico deficiente (12, 14). Comúnmente, la exposición sistémica inconsistente y variable a los medicamentos se ve afectada por múltiples factores, incluida la vía de administración, la forma de dosificación, el rango de dosis y el estado de salud y alimentación. Se ha observado que las diferencias en el diseño del estudio, incluida la señalización del animal (raza, sexo, edad) y el estado, el momento de muestreo y el método de determinación, pueden afectar los resultados de la farmacocinética; por lo tanto, no es apropiado comparar directamente esos parámetros de farmacocinética estimados entre varios experimentos (29).
Se ha estimado que la biodisponibilidad oral del CBD en perros está en el rango del 13-19% (13). Mejorar la administración de CBD en el torrente sanguíneo y su eficacia por vía oral es un reto para lograr una respuesta terapéutica. En concreto, se han llevado a cabo numerosos estudios con diversos preparados de CBD desarrollados para aumentar la biodisponibilidad oral y la evaluación de la farmacocinética en perros (11, 15-18).
Los resultados actuales indicaron que no había diferencias significativas entre todos los perfiles de PK en el CBD administrado en forma líquida. Sin embargo, la comparación del CBD en forma líquida frente a la forma semisólida identificó diferencias en el Vz/F, CL/F, AUC0-ty AUC0-inf Parámetros. Los hallazgos actuales mostraron que los perfiles de comportamiento del CBD en el grupo de WM eran comparables a los del grupo de OM. A pesar de que el C más altomáximo fue en el grupo de WM, fue una variación notablemente alta, incluso para el MRTInf, T1/2, y parámetros de AUC. Esto podría indicar que la tasa estimada de absorción en la forma farmacéutica soluble en agua tuvo una mayor variación de biodisponibilidad que para la forma a base de aceite. Casualmente, otro estudio informó que una formulación de CBD a base de agua, que tenía una composición similar a la WM preparada en el estudio actual, también informó parámetros de PK estadísticamente comparables en plasma humano en comparación con los del CBD en plasma humano después de la administración oral de la formulación a base de aceite de CBD (5).
Se ha informado de una amplia gama de la concentración máxima de CBD tras la administración oral de formulaciones de CBD a base de aceite (11). En comparación con otro experimento, en el que se administró aceite a la misma dosis en perros en ayunas, el Cmáximo El valor en el grupo de OM en el informe actual fue aproximadamente el doble que en el informe anterior (30). Por el contrario, otro experimento que involucró la administración de medicamentos a perros alimentados con una dosis ajustada igual de aceite con infusión de CBD tenía una Cmáximo Eso fue aproximadamente el doble que en el estudio actual (18).
Varios factores influyen en la biodisponibilidad y disposición del CBD, lo que da lugar a una variabilidad intra e interindividual relativamente alta en los perfiles de farmacocinética. El consumo conjunto de CBD con alimentos, especialmente en una comida grasa, puede alterar la velocidad y el grado de absorción. Se ha informado que en humanos, los niveles plasmáticos de CBD aumentaron cuando se administró concomitantemente con alimentos o en un estado alimentado (31, 32). Del mismo modo, los efectos positivos de los alimentos se han asociado con un aumento de la exposición sistémica máxima sin afectar al AUC0-t en perros; sin embargo, un C más altomáximo y se observaron niveles de AUC en uno de cada tres perros en ayunas (30). Contrariamente a estos resultados, Vaughn et al. (20) argumentaron que el ayuno nocturno con perros podría mejorar la absorción sistémica de CBD. En conejos, se ha informado que la alimentación disminuyó la absorción sistémica de CBD (33). De hecho, la variabilidad de la alimentación en ayunas se ve afectada por varios factores, como la condición fisiológica, los factores demográficos y genéticos, los factores químicos y los factores relacionados con la formulación (34).
La administración de una sola dosis en el estudio actual presentó fluctuaciones de las concentraciones plasmáticas de CBD tanto dentro como entre los grupos. Recientemente, se ha sugerido que administrar CBD dos veces al día puede reducir la variación en la concentración plasmática (28). Además, se ha informado de que la concentración plasmática máxima de CBD aumenta de forma dependiente de la dosis, pero algunos estudios parecen no ser lineales (16, 28-30).
En particular, los hallazgos actuales corroboraron el fenómeno del llamado «pico secundario», ya que se encontró en un perro en todos los grupos, excepto en el grupo de NM. En un primer momento, esto se consideró como un posible error en la preparación de la muestra o relacionado con el proceso de laboratorio; sin embargo, se confirmó tras una doble comprobación y determinación con diferentes instrumentos de detección. La explicación de este fenómeno aún no se comprende claramente. Se ha sugerido que el doble pico de CBD que se encuentra en el plasma ha sido causado por un mecanismo combinado, como el reciclaje enterohepático y la absorción linfática intestinal (35). Además, se ha informado del pico secundario de CBD en perros a los que se les administra una dosis media (5 mg/kg) o alta (10 mg/kg) en lugar de una dosis baja (2 mg/kg), siendo la coprofagia una posible explicación (29).
Sin embargo, la ausencia de un pico secundario de CBD en el plasma del perro después de tomar forma de NM por vía oral puede deberse al pequeño tamaño de las gotas de aceite en la nanoemulsión. En consecuencia, tenían una mayor superficie y, por lo tanto, estaban expuestos de manera eficiente a la lipasa intestinal en sus sitios de unión (36). Por lo tanto, el CBD en las gotas de aceite de la nanoemulsión se absorbió después de que el aceite fue digerido y se transformó rápidamente en los derivados primarios (CBD-7-COOH y OH-7-CBD) a través de un proceso de metabolismo de primer paso que resultó en una rápida disminución de la concentración de CBD en el plasma (37). Por último, el contenido del plasma de CBD en la forma NM no pudo detectarse como un segundo pico, como ocurrió con el CBD en las otras formas farmacéuticas.
En las cuatro formas farmacéuticas, el CBD se absorbió rápidamente con concentraciones plasmáticas máximas medias que se produjeron en el rango de 2 a 3,2 h después de la dosis. Esto estuvo de acuerdo con otros informes, en los que los tiempos para alcanzar la concentración plasmática máxima fueron de 1 a 4 h, sin efecto de la cantidad de dosis o la duración de la exposición (6, 15, 16, 29).
Los resultados actuales mostraron que el alcance y la tasa de exposición sistémica al CBD en el grupo OM fueron altamente absorbidos. El grado de absorción más bajo para la formulación de MC en comparación con las otras formulaciones fue confirmado por el valor de biodisponibilidad relativa. Los bajos niveles plasmáticos del grupo CM podrían deberse a la baja biodisponibilidad oral de la formulación semisólida, considerando que el AUC fue significativamente menor que para la formulación a base de aceite (grupo MO), siendo el valor de Vz/F y CL/F significativamente mayor que para el grupo MO. Se descartó la degradación del CBD de la merienda de golosinas en el grupo CM después del proceso de calor en la preparación porque la concentración de CBD se volvió a comprobar antes de administrarla a los perros. A diferencia de la preparación de forma semisólida en el experimento actual, otro estudio encontró que el CBD en un formato de masticación blanda tenía una alta absorción con un tiempo retrasado para alcanzar su punto máximo, lo que confirma que las preparaciones formuladas de manera diferente afectan el resultado de PK (15). Como tal, las formas líquidas y sólidas pueden alterar la velocidad de absorción y la biodisponibilidad total.
En particular, el CBD en el grupo NM seguido por el grupo WM alcanzó su punto máximo antes que el CBD en el grupo OM, lo que puede respaldar el rápido inicio de un efecto. El efecto de la nanoemulsión basada en la rápida absorción oral del CBD encontrado en el presente estudio fue consistente con los resultados reportados por Yen et al. (38), quienes encontraron que una nanoemulsión cargada de andrografólidos se absorbía rápidamente a través del tracto gastrointestinal porque las moléculas de surfactante en la formulación (Tween 80 y Span 80) podían suprimir la función de P-gp, que inhibió la secreción de fármacos por el proceso de eflujo mediado por P-gp en el tejido intestinal. Por lo tanto, el menor tiempo para alcanzar el pico de CBD de la administración oral del grupo NM puede deberse al efecto de estos tensioactivos en particular.
De hecho, la absorción oral de los fármacos depende de las condiciones del tracto gastrointestinal. En consecuencia, era posible que el ayuno de los animales durante la noche en el estudio actual pudiera haber acortado el tiempo hasta la concentración máxima para las formas NM y WM. La interacción de las propiedades de la PK y las características fisiológicas en el tracto gastrointestinal vacío, incluido el epitelio entérico y los transportadores de flujo de flujo y eflujo, pueden haber dificultado este fenómeno; sin embargo, el mecanismo aún no ha sido bien dilucidado.
En la actualidad, existe una falta de investigación sobre el uso de un enfoque basado en nanopartículas con diferentes técnicas y vías de aplicación para mejorar la absorción de CBD (12). Se ha destacado el desarrollo y la producción a escala comercial de nanoemulsiones cargadas de cannabinoides para mejorar la tasa de absorción y la eficacia con fines terapéuticos (39). Los hallazgos actuales mostraron que el CBD en una formulación basada en nanoemulsiones tendía a lograr una rápida absorción, evitando cualquier fluctuación en el comportamiento cinético. Recientemente se informó de un hallazgo similar, según el cual una formulación nanoemulsionante de CBD tenía un tiempo más corto para alcanzar el Cmáximo en comparación con el CBD en forma de aceite (35). Además, se ha mencionado que la nanoemulsión formulada puede haber mejorado la velocidad y la variabilidad de la absorción (40). Sin embargo, cabe destacar que los diferentes nanoportadores de CBD liberaron diferentes Cmáximo y Tmáximo, resultados en un lugar particular de acción (21).
Hay poca información disponible sobre la distribución del volumen de CBD en perros. Los valores más altos del volumen aparente de distribución en las formas líquidas en el estudio actual parecen sugerir que es más probable que el CBD se retenga en el cuerpo que circule en la sangre. Los resultados actuales tenían un valor de Vz/F casi el triple que el de un tratamiento a base de aceite con la misma dosis en otro estudio (28). En los seres humanos, es evidente que el CBD se distribuye rápidamente por los tejidos, lo que resulta en un volumen de distribución muy alto (41). En particular, el tratamiento basado en nanoemulsiones tuvo un volumen de distribución significativamente mayor en comparación con la forma semisólida. La modificación del modo de administración en la formulación de nanotransportadores puede haber mejorado la dispersión del CBD en todo el cuerpo. Clínicamente, el CBD podría administrarse en múltiples dosis durante varios días hasta un mes para obtener un efecto terapéutico (18). Por lo tanto, se debe considerar la relación de distribución tisular del CBD disperso entre el tejido fisiológico y acumulado en partes del cuerpo (20). Debería estudiarse más a fondo la biodistribución de diferentes preparados de CBD dentro de los sitios terapéuticos de interés en el animal objetivo.
A pesar de la escasa información científica, el uso del CBD en perros ha sido de gran interés para los propietarios, basándose en la evidencia anecdótica de sus beneficios terapéuticos. En particular, el presente estudio se llevó a cabo con una raza que no es Beagle, lo que puede no ser directamente comparable con los estudios reportados con una raza Beagle. Sin embargo, según la evaluación visual, los parámetros de PK de los perros cruzados de CBD no mostraron diferencias significativas con respecto a los del estudio realizado con perros Beagle (11, 28). La población de perros mestizos se estima entre el 31 y el 53% en los Estados Unidos, Alemania y el Reino Unido (42). En Tailandia, según los datos de encuestas nacionales de los dueños de mascotas, los perros mestizos constituyen aproximadamente el 29%. Una limitación del presente estudio fue el pequeño número de perros mestizos, con solo 8 por grupo. Otra limitación es que es menos frecuente en la toma de muestras de sangre después de 10 h después de la dosis, lo que puede causar puntos de datos insuficientes en la fase de eliminación. Dado que existe una amplia gama de perros mestizos, con indudables diferencias en la respuesta al comportamiento farmacológico, no está claro si las concentraciones plasmáticas en el presente estudio pueden considerarse representativas de la población general de perros mestizos o de diferentes tamaños. Las diferencias en la tasa de absorción de CBD y su acción metabólica entre perros han dado lugar a una gran variabilidad en las concentraciones plasmáticas (20). Debe investigarse más a fondo la interpretación y el uso práctico de los datos farmacocinéticos disponibles del presente estudio de dosis única. No obstante, la novedad de este estudio es la generación de datos relevantes para diferentes formas de CBD y su comportamiento en perros.
Declaración de disponibilidad de datos
Las contribuciones originales presentadas en el estudio se incluyen en el artículo/material complementario, las consultas adicionales pueden dirigirse al autor correspondiente.
Declaración ética
Los estudios en animales fueron aprobados por el Comité para la Aprobación del Cuidado y Uso de Animales para la Investigación Científica de la Facultad de Medicina Veterinaria de la Universidad de Kasetsart, Bangkok, Tailandia (número de aprobación ACKU 62-VET-058). Los estudios se llevaron a cabo de acuerdo con la legislación local y los requisitos institucionales. Se obtuvo el consentimiento informado por escrito de los propietarios para la participación de sus animales en este estudio.
Contribuciones de los autores
SL: Redacción – revisión y edición, Validación, Administración de proyectos, Análisis formal, Curación de datos. NP: Escritura – revisión y edición, Análisis formal. AP: Redacción – revisión y edición, validación, análisis formal. RA: Redacción – revisión y edición, Validación, Metodología, Análisis formal, Curación de datos. NT: Redacción – revisión y edición, Redacción – borrador original, Visualización, Validación, Supervisión, Software, Recursos, Administración de proyectos, Metodología, Investigación, Obtención de fondos, Análisis formal, Curación de datos, Conceptualización.
Financiación
El/los autor/es declaran/n que se recibió apoyo financiero para la investigación, autoría y/o publicación de este artículo. Los autores declaran que este ensayo fue parcialmente financiado por la Universidad de Kasetsart, Bangkok, Tailandia y apoyado financieramente por la Facultad de Medicina Veterinaria de la Universidad de Kasetsart: FFK. El financiador no participó en el diseño, la recopilación, el análisis o la interpretación de los datos del estudio. La tasa de procesamiento del artículo fue pagada en parte por la Facultad de Medicina Veterinaria y el Instituto de Investigación y Desarrollo de la Universidad de Kasetsart (KURDI). No hubo condiciones para la asignación de fondos para este estudio.
Reconocimientos
Vipada Khaowroongrueng ayudó con el análisis e interpretación de los datos farmacocinéticos. Phannicha Kosukwatthana, Phattharakan Kamutchat y Nattaya Leewichit proporcionaron asistencia en la visualización de los datos estadísticos, en la sujeción y el cuidado de los animales, y en la recolección de sangre y la extracción de muestras. Nos gustaría agradecer a los veterinarios y al cuidador de animales de laboratorio por sus contribuciones al cuidado de los animales, la evaluación de la salud y la ayuda en la recolección de sangre.
Conflicto de intereses
Los autores declaran que la investigación se llevó a cabo en ausencia de relaciones comerciales o financieras que pudieran interpretarse como un posible conflicto de intereses.
Nota del editor
Todas las afirmaciones expresadas en este artículo son únicamente las de los autores y no representan necesariamente las de sus organizaciones afiliadas, ni las del editor, los editores y los revisores. Cualquier producto que pueda ser evaluado en este artículo, o afirmación que pueda ser hecha por su fabricante, no está garantizado ni respaldado por el editor.
Referencias
1. Plata, RJ . El sistema endocannabinoide de los animales. Animales. (2019) 9:686. doi: 10.3390/ani9090686
Resumen de PubMed | Texto completo de Crossref | Google Académico
2. Andre, CM, Hausman, J-F, y Guerriero, G. Cannabis sativa: la planta de las mil y una moléculas. Planta Frontal Sci. (2016) 7:19. doi: 10.3389/fpls.2016.00019
Resumen de PubMed | Texto completo de Crossref | Google Académico
3. Corsato Alvarenga, I, Panickar, KS, Hess, H, y McGrath, S. Validación científica del cannabidiol para el manejo de enfermedades de perros y gatos. Annu Rev Anim Biosci. (2023) 11:227–46. doi: 10.1146/annurev-animal-081122-070236
Resumen de PubMed | Texto completo de Crossref | Google Académico
4. Coelho, MPRC, Leme, FDOP, Moreira, FA, Branco, SEMT, Melo, MM y de Melo, EG. Revisión actual de los medicamentos a base de cáñamo en perros. J Vet Pharmacol Ther. (2021) 44:870–82. doi: 10.1111/jvp.13016
Resumen de PubMed | Texto completo de Crossref | Google Académico
5. Williams, NNB, Ewell, TR, Abbotts, KSS, Harms, KJ, Woelfel, KA, Dooley, GP, et al. Comparación de cinco preparaciones orales de cannabidiol en humanos adultos: farmacocinética, composición corporal y variabilidad de la frecuencia cardíaca. Productos farmacéuticos. (2021) 14:35. doi: 10.3390/ph14010035
Resumen de PubMed | Texto completo de Crossref | Google Académico
6. Gamble, LJ, Boesch, JM, Frye, CW, Schwark, WS, Mann, S, Wolfe, L, et al. Farmacocinética, seguridad y eficacia clínica del tratamiento con Cannabidiol en perros con artrosis. Front Vet Sci. (2018) 5:165. doi: 10.3389/fvets.2018.00165
Resumen de PubMed | Texto completo de Crossref | Google Académico
7. Interlandi, C, Tabbì, M, Di Pietro, S, D’Angelo, F, Costa, GL, Arfuso, F, et al. Mejora de la calidad de vida y alivio del dolor en caballos maduros con osteoartritis después de la administración de aceite de cannabidiol transmucosa oral como parte de un régimen analgésico. Front Vet Sci. (2024) 11:11. doi: 10.3389/fvets.2024.1341396
Resumen de PubMed | Texto completo de Crossref | Google Académico
8. McGrath, S, Bartner, LR, Rao, S, Packer, RA, y Gustafson, DL. Ensayo clínico aleatorizado, ciego y controlado para evaluar el efecto de la administración oral de cannabidiol además del tratamiento antiepiléptico convencional sobre la frecuencia de las convulsiones en perros con epilepsia idiopática intratable. J Am Vet Med Assoc. (2019) 254:1301–8. doi: 10.2460/javma.254.11.1301
Resumen de PubMed | Texto completo de Crossref | Google Académico
9. Potschka, H, Bhatti, SFM, Tipold, A y McGrath, S. Cannabidiol en la epilepsia canina. Veterinario J. (2022) 290:105913. doi: 10.1016/j.tvjl.2022.105913
Resumen de PubMed | Texto completo de Crossref | Google Académico
10. Loewinger, M, Wakshlag, JJ, Bowden, D, Peters-Kennedy, J, y Rosenberg, A. El efecto de un aceite mixto a base de cannabidiol y ácido cannabidiólico en perros con dermatitis atópica. Veterinario Dermatol. (2022) 33:329–E77. doi: 10.1111/vde.13077
Resumen de PubMed | Texto completo de Crossref | Google Académico
11. Di Salvo, A, Conti, MB y della Rocca, G. Farmacocinética, eficacia y seguridad del cannabidiol en perros: una actualización de los conocimientos actuales. Front Vet Sci. (2023) 10:1204526. doi: 10.3389/fvets.2023.1204526
Resumen de PubMed | Texto completo de Crossref | Google Académico
12. Reddy, TS, Zomer, R y Mantri, N. Nanoformulaciones como estrategia para superar las limitaciones de administración de los cannabinoides. Phytother Res. (2023) 37:1526–38. doi: 10.1002/ptr.7742
Resumen de PubMed | Texto completo de Crossref | Google Académico
13. Samara, E, Bialer, M y Mechoulam, R. Farmacocinética del cannabidiol en perros. Medicamentos Metab Dispos. (1988) 16:469–72.
14. della Rocca, G, Paoletti, F, Conti, MB, Galarini, R, Chiaradia, E, Sforna, M, et al. Farmacocinética del cannabidiol tras la administración oral única y transmucosa oral en perros. Front Vet Sci. (2023) 9:1104152. doi: 10.3389/fvets.2022.1104152
15. Wakshlag, JJ, Schwark, WS, Deabold, KA, Talsma, BN, Cital, S, Lyubimov, A, et al. Farmacocinética del cannabidiol, ácido cannabidiólico, 19-tetrahidrocannabinol, ácido tetrahidrocannabinólico y metabolitos relacionados en suero canino después de la dosificación con tres formas orales de extracto de cáñamo. Front Vet Sci. (2020) 7:505. doi: 10.3389/fvets.2020.00505
Resumen de PubMed | Texto completo de Crossref | Google Académico
16. Vaughn, DM, Paulionis, LJ, y Kulpa, JE. Evaluación aleatoria, controlada con placebo, de 28 días de seguridad y farmacocinética de la administración oral repetida de cannabidiol en perros sanos. Am J Vet Res. (2021) 82:405–16. doi: 10.2460/ajvr.82.5.405
Resumen de PubMed | Texto completo de Crossref | Google Académico
17. Tittle, DJ, Wakshlag, JJ, Schwark, WS, Lyubimov, A, Zakharov, A y Gomez, B. Farmacocinética de cannabinoides en estado estacionario de veinticuatro horas y una semana en dos formulaciones de cannabidiol y cáñamo rico en ácido cannabidiólico en perros. Med Res Archiv. (2022) 10:7. doi: 10.18103/mra.v10i7.2907
18. Bartner, LR, McGrath, S, Rao, S, Hyatt, LK y Wittenburg, LA. Farmacocinética del cannabidiol administrado por 3 métodos de administración en 2 dosis diferentes a perros sanos. Can J Vet Res. (2018) 3:178–83.
19. Polidoro, D, Temmerman, R, Devreese, M, Charalambous, M, Ham, LV, Cornelis, I, et al. Farmacocinética del cannabidiol después de la administración intranasal, intrarrectal y oral en perros sanos. Front Vet Sci. (2022) 9:899940. doi: 10.3389/fvets.2022.899940
Resumen de PubMed | Texto completo de Crossref | Google Académico
20. Vaughn, D, Kulpa, J y Paulionis, L. Investigación preliminar de la seguridad del aumento de las dosis de cannabinoides en perros sanos. Front Vet Sci. (2020) 7:51. doi: 10.3389/fvets.2020.00051
Resumen de PubMed | Texto completo de Crossref | Google Académico
21. Muresan, P, Woodhams, S, Smith, F, Taresco, V, Shah, J, Wong, M, et al. Evaluación de la biodistribución de nanopartículas y nanoemulsiones de cannabidiol en el sistema nervioso central tras la administración intratecal para el tratamiento del dolor. Nanomedicina. (2023) 49:102664. doi: 10.1016/j.nano.2023.102664
Resumen de PubMed | Texto completo de Crossref | Google Académico
22. Nakano, Y, Tajima, M, Sugiyama, E, Sato Vilasinee, H y Sato, H. Desarrollo de una nueva formulación de nanoemulsión para mejorar la absorción intestinal de cannabidiol. Cannabinoides de cannabis medicinal. (2019) 2:35–42. doi: 10.1159/000497361
Resumen de PubMed | Texto completo de Crossref | Google Académico
23. Hossain, KR, Alghalayini, A, y Valenzuela, SM. Desafíos y oportunidades actuales para mejorar la solubilidad del cannabidiol. Int J Mol Sci. (2023) 24:14514. doi: 10.3390/ijms241914514
Resumen de PubMed | Texto completo de Crossref | Google Académico
24. Andrenyak, DM, Moody, DE, Slawson, MH, O’Leary, DS y Haney, M. Determinación de ∆-9-tetrahidrocannabinol (THC), 11-hidroxi-THC, 11-nor-9-carboxi-THC y cannabidiol en plasma humano mediante cromatografía de gases-espectrometría de masas en tándem. J Toxicol anal. (2017) 41:277–88. doi: 10.1093/jat/bkw136
Resumen de PubMed | Texto completo de Crossref | Google Académico
25. Fiehn, O . Metabolómica por cromatografía de gases-espectrometría de masas: perfilado combinado dirigido y no dirigido. Curr Protoc Mol Biol. (2016) 114:30.4.1. doi: 10.1002/0471142727.MB3004S114
Resumen de PubMed | Texto completo de Crossref | Google Académico
26. Kalayasiri, R, y Boonthae, S. Tendencias del consumo de cannabis y daños relacionados antes y después de la legalización con fines recreativos en un país en desarrollo de Asia. BMC Salud Pública. (2023) 23:911. doi: 10.1186/s12889-023-15883-6
Resumen de PubMed | Texto completo de Crossref | Google Académico
27. Toutain, P-L, Ferran, A y Bousquet-Mélou, A. Diferencias de especies en farmacocinética y farmacodinamia En: F Cunningham, J Elliott y P Lees, editores. Farmacología comparada y veterinaria. Berlín, Heidelberg: Springer Berlin Heidelberg (2010). 19–48.
28. Corsato Alvarenga, I, Gustafson, D, Banks, K, Wilson, K y McGrath, S. Determinación plasmática y farmacocinética de cannabidiol realizada al principio, medio y final de la suplementación a largo plazo de un aceite de cáñamo de amplio espectro en perros adultos sanos. Front Vet Sci. (2023) 10:1279926. doi: 10.3389/fvets.2023.1279926
Resumen de PubMed | Texto completo de Crossref | Google Académico
29. Chicoine, A, Illing, K, Vuong, S, Pinto, KR, Alcorn, J y Cosford, K. Evaluación farmacocinética y de seguridad de varias dosis orales de un nuevo extracto de hierbas de cannabis THC:CBD 1:20 en perros. Front Vet Sci. (2020) 7:583404. doi: 10.3389/fvets.2020.583404
Resumen de PubMed | Texto completo de Crossref | Google Académico
30. Doran, CE, McGrath, S, Bartner, LR, Thomas, B, Cribb, AE y Gustafson, DL. Interacción farmacológica entre cannabidiol y fenobarbital en perros sanos. Am J Vet Res. (2022) 83:86–94. doi: 10.2460/ajvr.21.08.0120
Resumen de PubMed | Texto completo de Crossref | Google Académico
31. Taylor, L, Gidal, B, Blakey, G, Tayo, B, y Morrison, G. Un ensayo de fase I, aleatorizado, doble ciego, controlado con placebo, dosis única ascendente, dosis múltiple y efecto alimentario de la seguridad, tolerabilidad y farmacocinética del cannabidiol altamente purificado en sujetos sanos. Fármacos para el SNC. (2018) 32:1053–67. doi: 10.1007/s40263-018-0578-5
Resumen de PubMed | Texto completo de Crossref | Google Académico
32. Millar, SA, Maguire, RF, Yates, AS, y O’Sullivan, SE. Hacia una mejor administración de cannabidiol (CBD). Productos farmacéuticos. (2020) 13:219. doi: 10.3390/ph13090219
Resumen de PubMed | Texto completo de Crossref | Google Académico
33. Rooney, TA, Carpenter, JW, KuKanich, B, Gardhouse, SM, Magnin, GC y Tully, TN. La alimentación disminuye la biodisponibilidad oral del cannabidiol y el ácido cannabidiólico en el aceite de cáñamo en conejos blancos de Nueva Zelanda (Oryctolagus cuniculus). Am J Vet Res. (2022) 83:6. doi: 10.2460/ajvr.22.01.0006
Resumen de PubMed | Texto completo de Crossref | Google Académico
34. Rangaraj, N, Sampathi, S, Junnuthula, V, Kolimi, P, Mandati, P, Narala, S, et al. Variabilidad de alimentación rápida: información sobre la administración de fármacos, las manifestaciones moleculares y los aspectos regulatorios. Farmacia. (2022) 14:1807. doi: 10.3390/pharmaceutics14091807
Resumen de PubMed | Texto completo de Crossref | Google Académico
35. Kok, LY, Bannigan, P, Sanaee, F, Evans, JC, Dunne, M, Regenold, M, et al. Desarrollo y evaluación farmacocinética de un sistema de administración de fármacos auto-nanoemulsionante para la administración oral de cannabidiol. Eur J Pharm Sci. (2022) 168:106058. doi: 10.1016/j.ejps.2021.106058
Resumen de PubMed | Texto completo de Crossref | Google Académico
36. Salvia-Trujillo, L, Martín-Belloso, O, y McClements, DJ. Nanoemulsiones de excipientes para mejorar la biodisponibilidad oral de bioactivos. Nano. (2016) 6:17. doi: 10.3390/nano6010017
Resumen de PubMed | Texto completo de Crossref | Google Académico
37. ElSohly, MA, Shahzadi, I y Gul, W. Absorción y biodisponibilidad de la nueva nanoemulsión UltraShear de cannabidiol en ratas. Cannabinoides de cannabis medicinal. (2023) 6:148–59. doi: 10.1159/000534473
Resumen de PubMed | Texto completo de Crossref | Google Académico
38. Yen, CC, Chen, YC, Wu, MT, Wang, CC y Wu, YT. Nanoemulsión como estrategia para mejorar la biodisponibilidad oral y la actividad antiinflamatoria del andrografólido. Int J Nanomedicina. (2018) 13:669–80. doi: 10.2147/IJN. S154824
Resumen de PubMed | Texto completo de Crossref | Google Académico
39. Leibtag, S, y Peshkovsky, A. Nanoemulsiones de extracto de cannabis producidas por ultrasonidos de alta intensidad: desarrollo y escalado de formulaciones. J Drug Deliv Sci Tech. (2020) 60:101953. doi: 10.1016/j.jddst.2020.101953
40. Azmi, NAN, Elgharbawy, AAM, Motlagh, SR, Samsudin, N, y Salleh, HM. Nanoemulsiones: fábrica para alimentos. Proceso Pharma Cosmet. (2019) 7:617. doi: 10.3390/pr7090617
41. Solinas, M, Massi, P, Cantelmo, AR, Cattaneo, MG, Cammarota, R, Bartolini, D, et al. El cannabidiol inhibe la angiogénesis por múltiples mecanismos. J Med Chem. (2012) 63:12137–55. doi: 10.1021/acs.jmedchem.0c00724
Resumen de PubMed | Texto completo de Crossref | Google Académico
42. Turcsán, B, Miklósi, Á, y Kubinyi, E. El propietario percibió diferencias entre los perros mestizos y de raza pura. PLoS Uno. (2017) 12:e0172720. doi: 10.1371/journal.pone.0172720
Resumen de PubMed | Texto completo de Crossref | Google Académico
Palabras clave: farmacocinética, CBD, cannabidiol, cáñamo, perro, cannabis
Cita: Limsuwan S, Phonsatta N, Panya A, Asasutjarit R y Tansakul N (2024) Comportamiento farmacocinético de cuatro preparaciones de cannabidiol después de la administración oral única en perros. Frente. Vet. Sci. 11:1389810. doi: 10.3389/fvets.2024.1389810
Recibido: 22 de febrero de 2024; Aceptado: 17 de abril de 2024;
Publicado: 25 de abril de 2024.
Editado por:
Wayne S. Schwark, Universidad de Cornell, Estados Unidos
Revisado por:
Wolfgang Bäumer, Universidad Libre de Berlín, Alemania
Claudia Interlandi, Universidad de Messina, Italia
Derechos de autor © 2024 Limsuwan, Phonsatta, Panya, Asasutjarit y Tansakul. Este es un artículo de acceso abierto distribuido bajo los términos de la Licencia Creative Commons Attribution License (CC BY).
*Correspondencia: Natthasit Tansakul, natthasit.t@ku.th
Renuncia: Todas las afirmaciones expresadas en este artículo son únicamente las de los autores y no representan necesariamente las de sus organizaciones afiliadas, ni las del editor, los editores y los revisores. Cualquier producto que pueda ser evaluado en este artículo o afirmación que pueda hacer su fabricante no está garantizado ni respaldado por el editor.
Date de alta y recibe nuestro 👉🏼 Diario Digital AXÓN INFORMAVET ONE HEALTH
Date de alta y recibe nuestro 👉🏼 Boletín Digital de Foro Agro Ganadero
Noticias animales de compañía
Noticias animales de producción
Trabajos técnicos animales de producción
Trabajos técnicos animales de compañía


