Criopreservación comparativa de hepatocitos primarios bovinos y porcinos

Criopreservación comparativa de hepatocitos primarios bovinos y porcinos
 Sandra Andrés1
Sandra Andrés1  Babett Bartling1
Babett Bartling1  Vera Stiensmeier1
Vera Stiensmeier1  Alejandro Starke2
Alejandro Starke2  Marion Schmicke1,3*
Marion Schmicke1,3*- 1Instituto de Ciencias Agrícolas y Nutricionales, Gestión de la Salud Animal, Universidad Martin Luther Halle-Wittenberg, Halle (Saale), Alemania
- 2Departamento de Rumiantes y Porcinos, Facultad de Medicina Veterinaria, Universidad de Leipzig, Leipzig, Alemania
- 3Clínica de Ganado, Endocrinología, Universidad de Medicina Veterinaria de Hannover, Hannover, Alemania
El aislamiento de hepatocitos primarios del tejido hepático de animales de granja produce un número muy alto de células, y una parte de ellas puede almacenarse mediante criopreservación para futuros experimentos. Como no existe experiencia con la criopreservación de hepatocitos de bovinos, nuestro estudio tuvo como objetivo la criopreservación de hepatocitos bovinos mediante el uso de diferentes protocolos en comparación con la criopreservación de hepatocitos de cerdo. Probamos diferentes medios de congelación (William’s Medium E vs. solución de la Universidad de Wisconsin), crioprotectores (dimetilsulfóxido con vs. sin trehalosa como aditivo adicional), sistemas de congelación (contenedor de congelación estándar vs. congelador de velocidad controlada) y tiempos de congelación (4 vs. 28 d). Estas pruebas identificaron una influencia general de las especies y los sistemas de congelación, mientras que la influencia de los medios de congelación, el aditivo de trehalosa y el tiempo de congelación fue menor o no obvia. En este sentido, determinamos una recuperación media del 30% de los hepatocitos bovinos y del 55% de los hepatocitos porcinos criopreservados en un congelador de tasa controlada, mientras que las tasas fueron aproximadamente un 10% menores cuando los hepatocitos se congelaron en un contenedor de congelación estándar. De acuerdo con esta observación, el cultivo de hepatocitos criopreservados de ganado fue menos efectivo que el de hepatocitos porcinos. Los hepatocitos del ganado pueden ser criopreservados con éxito y parcialmente cultivados después de la criopreservación, pero con un porcentaje menor que los hepatocitos porcinos.
Introducción
Los hepatocitos son células del parénquima hepático y contribuyen principalmente a la masa hepática total. Son células altamente funcionales siendo responsables de diversas vías anabólicas y catabólicas, y de la desintoxicación de sustancias exógenas y endógenas. Los cultivos celulares de hepatocitos primarios derivados de humanos y roedores son importantes en modelos in vitro para estudiar los mecanismos básicos en estas células (1, 2). Además, se utilizan en aplicaciones médicas, farmacéuticas y toxicológicas, reemplazando o, al menos, reduciendo los estudios in vivo (1, 2). La investigación básica y relacionada con la aplicación también se realiza mediante el uso de hepatocitos aislados de animales de granja, especialmente cerdos y pollos (2-4). Como los hepatocitos derivados del ganado rara vez se utilizan en estudios de investigación, nuestro grupo estableció un modelo de hepatocitos bovinos primarios en monocultivo y en cocultivo con otras células hepáticas para reducir esta brecha (5-7).
Los hepatocitos se aislaron comúnmente del tejido hepático mediante la digestión enzimática del tejido con una fracción cruda de colagenasa que contiene actividades colagenolíticas y proteolíticas (2). En el caso del tejido hepático de ganado vacuno y porcino, esto produce un número muy alto de hepatocitos debido a la masa relativamente grande del hígado. Como no todos ellos se pueden usar en un entorno experimental, quedan muchos hepatocitos y podrían almacenarse para experimentos posteriores.
Un método común para almacenar células, incluidos los hepatocitos, durante más tiempo es la criopreservación mediante la congelación de células en agentes crioprotectores por debajo de -130 ° C (8-10). Los agentes crioprotectores previenen la formación de cristales de hielo intracelulares y reducen el estrés osmótico causado por la deshidratación celular durante el proceso de congelación (10, 11). Se clasifican en agentes crioprotectores penetrantes y no penetrantes. Los agentes penetrantes [por ejemplo, glicerina, dimetilsulfóxido (DMSO), etilenglicol, propilenglicol] entran a través de la membrana celular y evitan la formación de cristales de hielo intracelulares, mientras que los agentes no penetrantes (por ejemplo, glucosa, sacarosa, trehalosa, polivinilpirrolidona) permanecen extracelularmente y reducen el estrés osmótico (10, 11). Tanto los agentes penetrantes como los no penetrantes también reducen los daños celulares durante el proceso de descongelación.
El agente crioprotector más eficiente para las células humanas y animales es el disolvente orgánico DMSO y, por lo tanto, se utiliza principalmente para congelar células, incluidos los hepatocitos primarios (10, 11). A diferencia de los crioprotectores penetrantes, los crioprotectores no penetrantes se aplican menos en la rutina. Sin embargo, varios estudios indican el efecto beneficioso de la trehalosa en la reducción del estrés osmótico durante la congelación y descongelación de las células (12-14).
Los crioprotectores siempre se diluyen en medio de congelación con una concentración final del 5-20% en caso de DMSO (10, 11). Los medios de congelación generalmente corresponden a los medios de cultivo celular específicos del tipo de célula. A menudo se complementan con suero bovino fetal (FBS) (10, 11). Además, la solución de la Universidad de Wisconsin se utiliza con frecuencia como medio de congelación (15, 16). Esta solución fue desarrollada en la década de 1980 para su aplicación clínica (16). Como permite una preservación adecuada de los injertos de hígado humano, la solución de la Universidad de Wisconsin a menudo sirve como medio de congelación para la criopreservación de hepatocitos (8, 15).
Finalmente, las células suspendidas en medio de congelación con crioprotector se congelan a -80 ° C en un recipiente de congelación lleno de espuma de poliestireno o alcohol, lo que permite una velocidad de congelación lenta y permanente (17). La velocidad de congelación en tales contenedores sigue siendo demasiado rápida en el rango de temperatura superior a -10 ° C y, por lo tanto, se forman cristales de hielo intracelulares, mientras que es demasiado lenta en el rango de temperatura por debajo de -10 ° C y, por lo tanto, las células sufren un alto estrés osmótico (17-19). Como también se libera calor de solidificación cuando una sustancia cambia de líquido a sólido, la temperatura en el recipiente no corresponde a la del criovial (17, 18, 20). Por lo tanto, congelar celdas en tales contenedores es una técnica bastante incontrolada. Estos problemas se han resuelto mediante la introducción de congeladores de velocidad controlada para criopreservar las células (17). Los congeladores de velocidad controlada suministran nitrógeno líquido a una cámara cerrada en la que se coloca el criovial con suspensión celular, y la velocidad de congelación específica del tipo de célula se programa y se controla bien mediante el uso de un vial de referencia (17).
El sistema de congelación de velocidad controlada también se utiliza para la criopreservación de hepatocitos recién aislados de humanos y cerdos (18-22). Sin embargo, no hay experiencia con la criopreservación de hepatocitos del ganado. Los hepatocitos de rumiantes como el ganado difieren en su metabolismo celular de los hepatocitos de animales no rumiantes (23). Por lo tanto, nuestro estudio tuvo como objetivo la criopreservación de hepatocitos del ganado bovino mediante el uso de diferentes medios de congelación, crioprotectores y sistemas de congelación, y su comparación con la criopreservación de hepatocitos de cerdo.
Materiales y métodos
Animales
Este estudio utilizó tejidos hepáticos sanos de animales donantes que fueron sacrificados debido a un pronóstico desfavorable o una razón experimental (números de expediente 33.9-42502-04-18/2752 y H1-2//1-20 de las comisiones locales de bienestar animal). Los animales donantes fueron bovinos Holstein Frisian (3 semanas a 7 años de edad) y cerdos domésticos (8-10 semanas de edad) de ambos sexos. La eutanasia se realizó con pentobarbital en dos departamentos clínicos (Departamento de Rumiantes y Porcinos, Facultad de Medicina Veterinaria, Universidad de Leipzig; Clínica para el ganado, Universidad de Medicina Veterinaria de Hannover) y en el Centro de Investigación de Ciencias Agrícolas y Nutricionales de la Universidad Martin Luther Halle-Wittenberg. Inmediatamente después de la determinación del paro cardiorrespiratorio y la posterior apertura quirúrgica de la cavidad abdominal, el tejido hepático del lóbulo caudado (30 a 40 g) se diseccionó y se enjuagó bien con la solución salina equilibrada de Hank (HBSS) helada con HEPES, NaHCO3, CaCl2, MgCl2, MgSO4, nutrientes y heparina (500 I.E./l). El tejido enjuagado se mantuvo en este HBSS / HEPES / NaHCO3-tampón basado en hielo hasta el aislamiento de hepatocitos en la unidad de laboratorio local.
Aislamiento y cultivo de hepatocitos
Los hepatocitos primarios de bovinos y porcinos se aislaron 2,0-4,0 h y 1,5-3,5 h, respectivamente, después de la disección hepática de acuerdo con un protocolo establecido (6) con algunas modificaciones. En resumen, el tejido hepático frío se recalentó a 37 ° C enjuagándolo con HBSS / HEPES / NaHCO caliente.3 tampón y luego sometido a una perfusión de colagenasa en dos pasos. La perfusión se realizó con HBSS/HEPES/NaHCO3 tampón suplementado con EGTA durante 5 min, CaCl2 durante 5 min y finalmente CaCl2 y colagenasa (1,5 unidades de Wünsch/g de tejido hepático) durante 5-7 min hasta que el tejido estuvo blando. La colagenasa NB 4G (Nordmark Pharma GmbH, Uetersen, Alemania) se utilizó para digerir el hígado bovino, mientras que la colagenasa P (Roche, Mannheim, Alemania) se utilizó para el hígado porcino. La colagenasa NB 4G tuvo un efecto menos dañino sobre los hepatocitos del ganado que la colagenasa P, pero no fue lo suficientemente digestiva para el tejido hepático porcino (observaciones preliminares). Además, utilizamos menos EGTA para perfundir el hígado bovino (0,5 mM) que el hígado porcino (1,0 mM) debido a las diferencias de tamaño en las agregaciones de hepatocitos después del aislamiento (Figura 1). Después de la perfusión, los hepatocitos se extrajeron cortando el tejido hepático con un bisturí y girándolo en el Medio E de William (PAN-Biotech, Aidenbach, Alemania) que se complementó con un 20% de FBS (PAN-Biotech). Finalmente, los hepatocitos se filtraron a través de una malla de nylon de 200 μm, se centrifugaron a 60 × g durante 3 min y se resuspendieron en el Medio E de William con FBS al 10%. Todos los pasos se realizaron a 37°C.
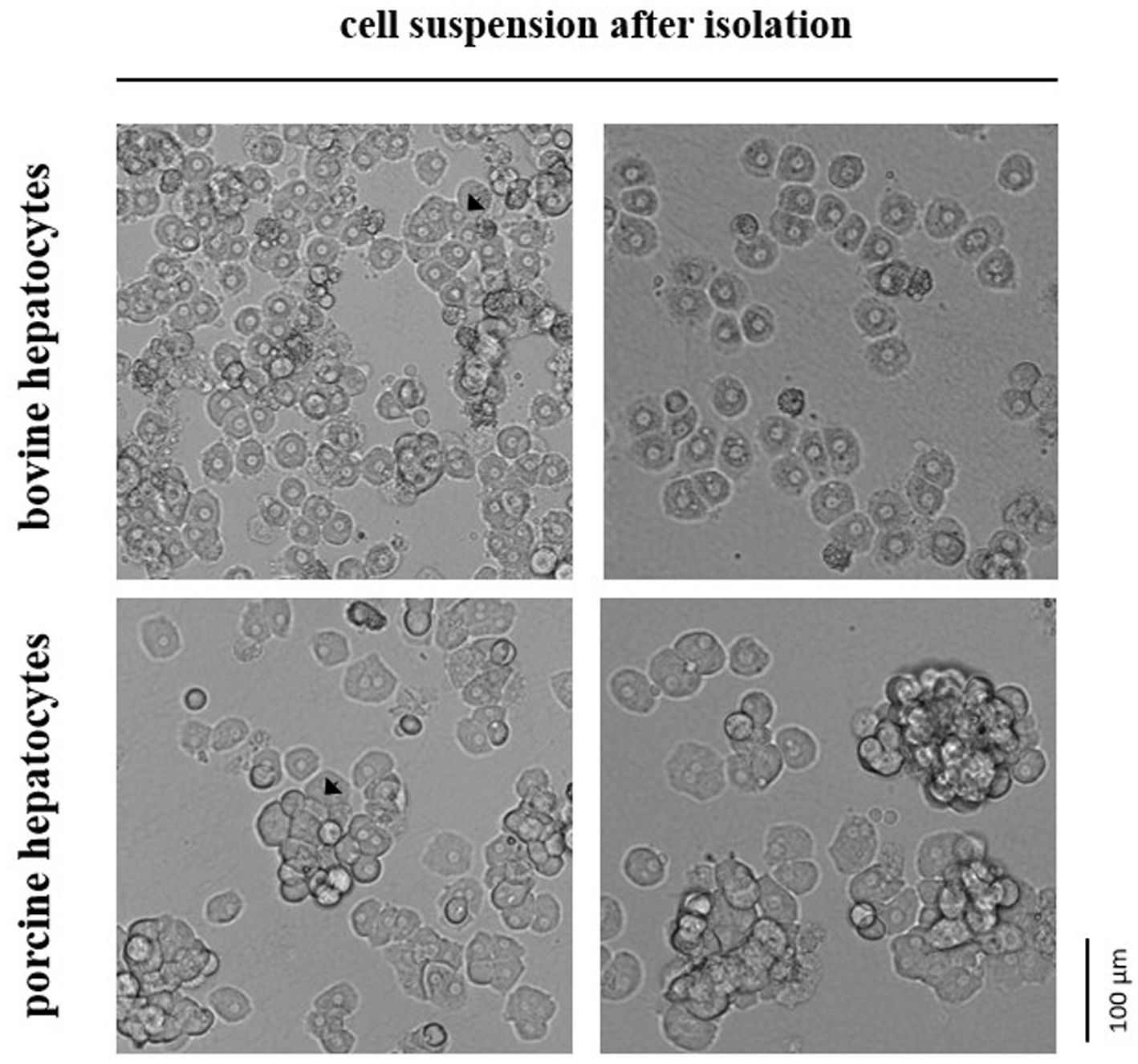 Figura 1. En suspensión hepatocitos inmediatamente después del aislamiento enzimático del tejido hepático de ganado bovino o porcino. Las flechas indican esferoides seleccionados formados por los hepatocitos primarios.
Figura 1. En suspensión hepatocitos inmediatamente después del aislamiento enzimático del tejido hepático de ganado bovino o porcino. Las flechas indican esferoides seleccionados formados por los hepatocitos primarios.
El número y la vitalidad de los hepatocitos se evaluaron tiñendo las células con una solución de azul de tripano al 0,4% (Sigma-Aldrich, Deisenhofen, Alemania) y contando las células positivas y negativas para el azul de tripano por separado en una cámara de recuento de células de Neubauer. Mientras que la mayoría de los hepatocitos fueron sometidos a un procedimiento de criopreservación, una pequeña parte de los hepatocitos fue sembrada recién en placas de 12 pocillos (140 × 103 células vitales/cm2) que había sido recubierto con colágeno del tendón de la cola de rata (Roche, Mannheim, Alemania). Los hepatocitos se cultivaron en el Medio E de William con FBS al 10%, 1 × solución de insulina-transferrina-selenio (Sigma-Aldrich) y 40 ng/mL de dexametasona (Sigma-Aldrich) durante las primeras 4 h y luego en el mismo medio sin FBS.
Criopreservación de hepatocitos
Utilizamos dos medios básicos diferentes para la criopreservación: William’s Medium E y la solución de la Universidad de Wisconsin (Bridge to Life Ltd., Londres, Reino Unido). Cada medio básico se complementó con 40% FBS, 20% DMSO (PanReac Applichem, Darmstadt, Alemania) y, en casos seleccionados, 200 mM de trehalosa (Carl Roth, Karlsruhe, Alemania) para preparar una solución de criopreservación de 2 ×. La concentración de DMSO del 20% en la solución de criopreservación de 2 × se ha identificado como óptima en experimentos preliminares (no se muestra). Como los hepatocitos se suspenden en el Medio E de William con FCS al 10% después del aislamiento celular, se centrifugaron a 60 × g durante 1 minuto y luego se resuspendieron en un volumen respectivo de solución Heliada de William Medium E o helada de la Universidad de Wisconsin para alcanzar una concentración de 2 × 106 células vitales/ml. Posteriormente, esta suspensión celular se mezcló escalonadamente en hielo con el mismo volumen de la solución de criopreservación de 2 × respectiva para alcanzar una solución de 1 ×, alícuota (1 × 106 células vitales/crioviales) y transferido al proceso de criopreservación. El proceso de criopreservación se realizó en un recipiente de congelación lleno de propan-2-ol (Nalgene Mr. Frosty; Thermo Fisher Scientific, Waltham, MA, Estados Unidos) colocado a -80 °C o en un congelador de velocidad controlada (Consarctic GmbH, Westerngrund, Alemania) con un enfriamiento de hasta -100 °C. Los contenedores de congelación llenos de propan-2-ol colocados a -80 ° C alcanzan una velocidad de enfriamiento de aproximadamente -1 ° C / min, mientras que el congelador de velocidad controlada comienza con una velocidad de enfriamiento más baja seguida de un paso de enfriamiento de choque y termina con una velocidad de enfriamiento más alta (Figura suplementaria). Nuestro protocolo utilizado para la congelación de la tasa de control corresponde al reportado para los hepatocitos de rata (20) y se asemeja al reportado para los hepatocitos porcinos (18). Todos los hepatocitos se transfirieron posteriormente y se almacenaron en nitrógeno líquido en fase vapor (por debajo de -135 ° C).®
Los hepatocitos de ganado vacuno o porcino se descongelaron 4 y 28 días después de la criopreservación. En detalle, cada criovial se giró en agua caliente (80 ° C) hasta que el 80% de la suspensión celular se descongeló. La suspensión celular se transfirió a un vial más grande y se diluyó paso a paso con el medio E de William helado que contenía 10% de FBS en 3 minutos. Posteriormente, los hepatocitos se centrifugaron (30 × g durante 3 min), se resuspendieron en el Medio E de William helado con FBS al 10% y se sometieron al procedimiento de recuento celular. Además, los hepatocitos se sembraron y cultivaron en placas de 12 pocillos recubiertas con colágeno como se describió anteriormente.
Estadística
Todas las criopreservaciones de hepatocitos se realizaron por duplicado. El número relativo de células vitales de una fracción celular total se calculó como el número de células azul de tripano negativo por número de células azul de tripano negativo y positivo × 100%. La tasa de recuperación de los hepatocitos se calculó como el número de células azul negativo de tripano antes de la criopreservación por número de células azul negativo de tripano después de la criopreservación × del 100%. Las estadísticas y la presentación de datos se realizaron mediante el uso del software OriginPro 2019 (OriginLab Corporation; Northampton, MA). Las diferencias significativas (p ≤ 0,05) entre dos o más grupos fueron probadas por ANOVA con la prueba post-hoc de Bonferroni. Para obtener más información, consulte las leyendas de las figuras.
Resultados
Nuestro estudio evaluó el número total y la viabilidad celular de los hepatocitos bovinos y porcinos mediante tinción celular con solución de azul de tripano seguida de recuento microscópico manual de células. Se prefirió la técnica de conteo manual sobre las técnicas automatizadas porque los hepatocitos a menudo permanecen en agregaciones celulares estables (es decir, esferoides) después del aislamiento. Estos esferoides eran comúnmente más pequeños y se formaban con menos frecuencia en el caso de los hepatocitos aislados del ganado en comparación con los hepatocitos del cerdo (Figura 1). Sin embargo, la proporción de hepatocitos vivos y muertos directamente después del aislamiento del tejido hepático no difirió entre ambas especies (media de todas las pruebas realizadas; Tabla 1). Después de la criopreservación y posterior proceso de descongelación, el número relativo de hepatocitos con membrana celular intacta y, por lo tanto, impermeable al azul de tripano disminuyó con mayor disminución para los hepatocitos bovinos que para los porcinos (Tabla 1).
 Tabla 1. Trypan blue-evaluó la viabilidad celular antes de la criopreservación y después de la descongelación de hepatocitos primarios de ganado vacuno y porcino.
Tabla 1. Trypan blue-evaluó la viabilidad celular antes de la criopreservación y después de la descongelación de hepatocitos primarios de ganado vacuno y porcino.
El número relativo de células vitales de una fracción celular total no es un parámetro absoluto que indique el éxito de un procedimiento de criopreservación. Por lo tanto, calculamos la tasa de recuperación de células exclusivamente azul de tripano negativo para evaluar la influencia simultánea de especies (bovinos y porcinos), sistema de congelación (no controlado y controlado), medio de congelación (medio E de William y solución de la Universidad de Wisconsin suplementada con DMSO y FCS), suplementación con trehalosa y tiempo (4 y 28 días) en la criopreservación de hepatocitos. Todos los datos de las pruebas de criopreservación individuales se resumen en la Figura 2. Este resumen indica un efecto exclusivo de la especie o del sistema de congelación sobre la tasa de recuperación de los hepatocitos blancos de tripano, mientras que el tiempo o el medio de congelación no tienen un efecto significativo (Figura 2). La recuperación post-criopreservación de hepatocitos bovinos fue comúnmente menor que la recuperación de hepatocitos porcinos (Figura 2). Sin embargo, los hepatocitos del ganado a menudo respondieron mejor al efecto beneficioso del sistema de congelación controlada que los hepatocitos del cerdo (Figura 2). En un solo caso, la suplementación del medio de congelación con trehalosa tuvo un beneficio adicional en la tasa de recuperación (ver hepatocitos del ganado en el medio E de William; Figura 2). Debido al efecto primario de la especie o del sistema de congelación en la recuperación de los hepatocitos primarios después de la criopreservación, la Figura 3 muestra la recuperación de las células azul de tripano negativo en dependencia de estos dos parámetros solamente.
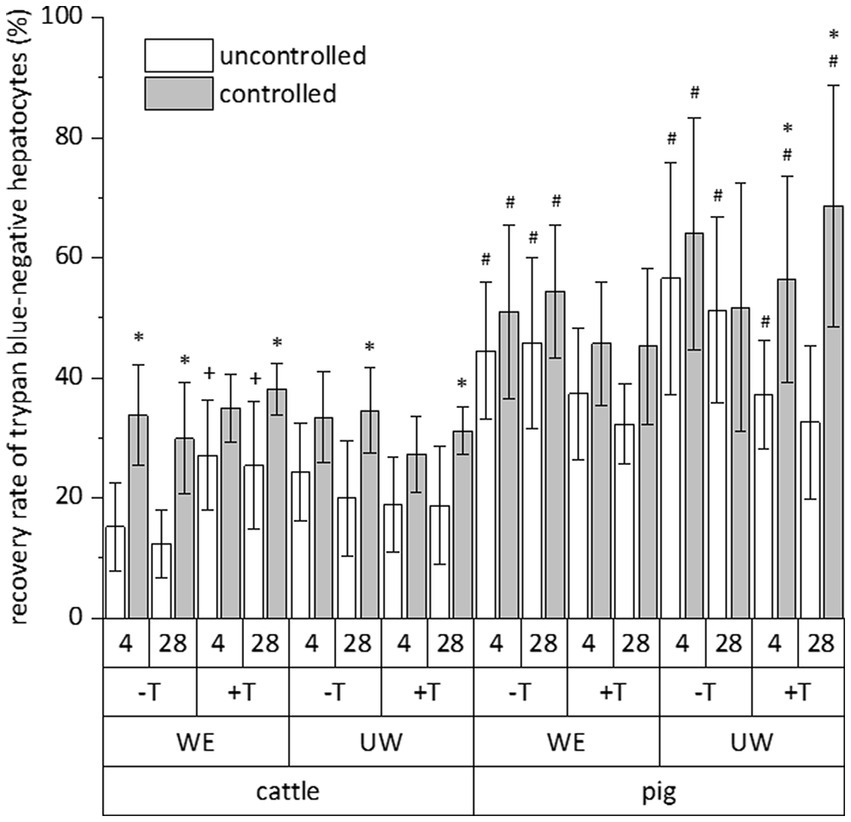 Figura 2. Influencia comparativa de la criopreservación mediante técnicas no controladas (recipiente de congelación lleno de propan-2-ol) o controladas (congelador de velocidad controlada) en la tasa de recuperación de hepatocitos primarios de ganado vacuno o porcino, que han sido congelados con (+) o sin (-) adición de trehalosa (T) en DMSO/FCS que contienen medio de William (WE) o solución de la Universidad de Wisconsin (UW) y almacenados por debajo de -135 °C durante 4 o 28 días. Esta evaluación solo incluyó hepatocitos con membrana celular intacta después de la tinción con solución de azul de tripano. Los datos son medias ± DE (n = 6) con p < 0,001 para especies y proceso de congelación (múltiples pruebas ANOVA de tres vías) y p < 0,05 vs. proceso de congelación incontrolada, bovinos, y sin trehalosa del grupo de ensayo individual (prueba post-hoc de Bonferroni).*#+
Figura 2. Influencia comparativa de la criopreservación mediante técnicas no controladas (recipiente de congelación lleno de propan-2-ol) o controladas (congelador de velocidad controlada) en la tasa de recuperación de hepatocitos primarios de ganado vacuno o porcino, que han sido congelados con (+) o sin (-) adición de trehalosa (T) en DMSO/FCS que contienen medio de William (WE) o solución de la Universidad de Wisconsin (UW) y almacenados por debajo de -135 °C durante 4 o 28 días. Esta evaluación solo incluyó hepatocitos con membrana celular intacta después de la tinción con solución de azul de tripano. Los datos son medias ± DE (n = 6) con p < 0,001 para especies y proceso de congelación (múltiples pruebas ANOVA de tres vías) y p < 0,05 vs. proceso de congelación incontrolada, bovinos, y sin trehalosa del grupo de ensayo individual (prueba post-hoc de Bonferroni).*#+
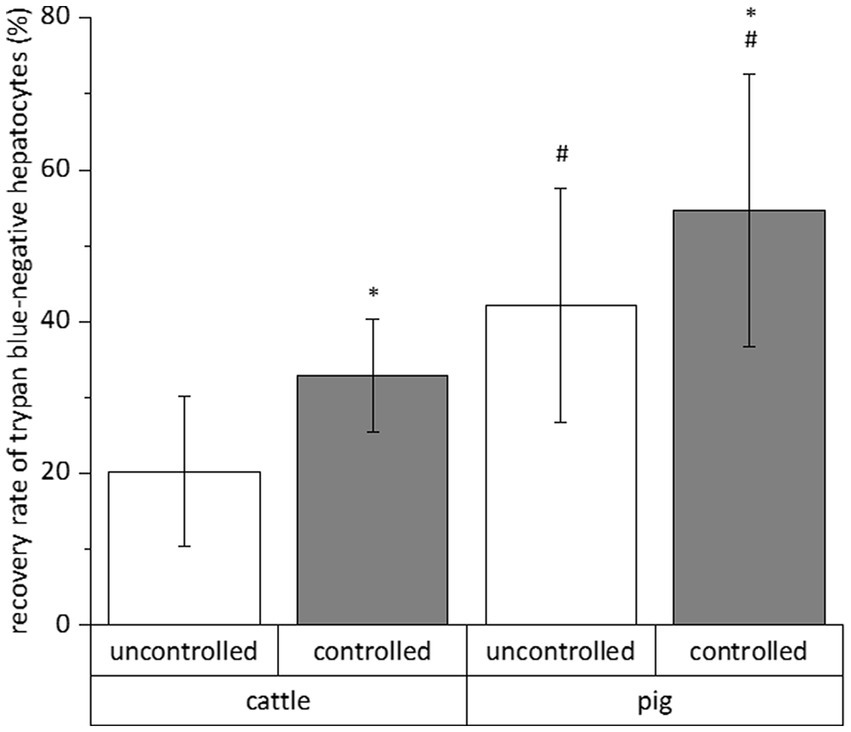 Figura 3. Influencias medias del proceso de congelación y especies en la tasa de recuperación de hepatocitos primarios después de la criopreservación en diferentes soluciones durante 4 y 28 días. Sólo se contaron los hepatocitos con membrana celular intacta después de la tinción celular con solución de azul de tripano. Los datos son medias ± DE (n = 48 utilizando 6 animales cada especie) con p < 0,001 vs. no controlado y bovinos (ANOVA bidireccional con prueba post-hoc de Bonferroni).*#
Figura 3. Influencias medias del proceso de congelación y especies en la tasa de recuperación de hepatocitos primarios después de la criopreservación en diferentes soluciones durante 4 y 28 días. Sólo se contaron los hepatocitos con membrana celular intacta después de la tinción celular con solución de azul de tripano. Los datos son medias ± DE (n = 48 utilizando 6 animales cada especie) con p < 0,001 vs. no controlado y bovinos (ANOVA bidireccional con prueba post-hoc de Bonferroni).*#
La impermeabilidad de las células al azul de tripano u otras manchas de vida/muertas en el momento de la investigación no indica la viabilidad y funcionalidad celular más adelante en el cultivo. Como los hepatocitos son células bien polarizadas que se adhieren con su membrana celular basolateral a compuestos de matriz extracelular y células adyacentes, también probamos la capacidad de post-criopreservación de nuestros hepatocitos para la adherencia y propagación celular. Estas pruebas revelaron que el número de hepatocitos bovinos que muestran una adherencia celular adecuada y se propagan sobre el colágeno después de la criopreservación es menor que el número de hepatocitos porcinos (Figura 4). Sin embargo, el número de hepatocitos porcinos que se pueden cultivar con éxito después de la criopreservación fue demasiado pequeño para alcanzar las capas celulares confluentes (Figura 4).
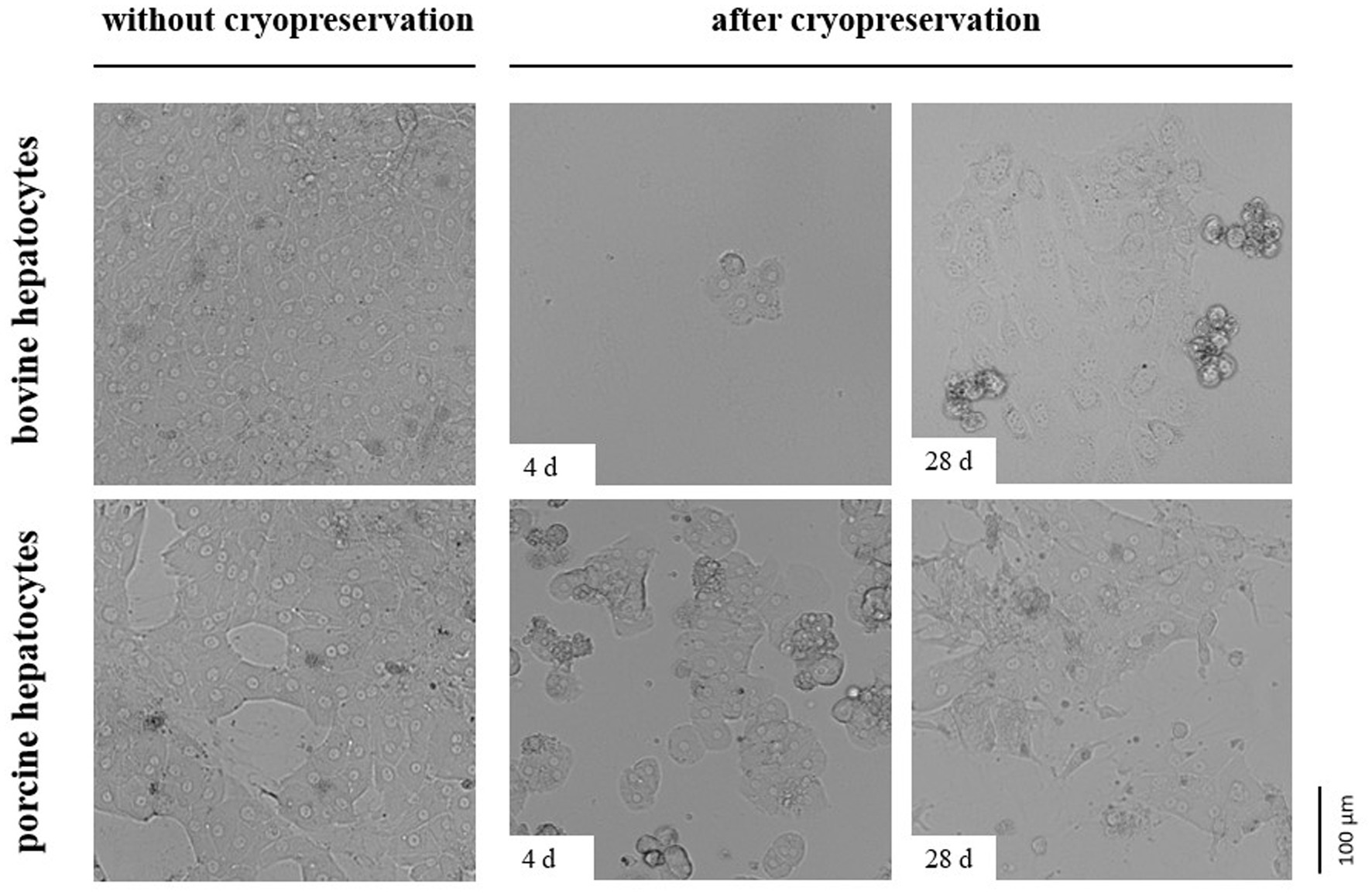 Figura 4. Imágenes comparativas que muestran hepatocitos primarios de ganado vacuno o porcino sembrados en una capa de colágeno directamente después del aislamiento celular (sin criopreservación) o después de la criopreservación controlada en una solución de la Universidad de Wisconsin que contiene DMSO / FCS con trehalosa. La criopreservación se realizó durante 4 o 28 días. Todas las células fueron fotografiadas 2 días después de la siembra.
Figura 4. Imágenes comparativas que muestran hepatocitos primarios de ganado vacuno o porcino sembrados en una capa de colágeno directamente después del aislamiento celular (sin criopreservación) o después de la criopreservación controlada en una solución de la Universidad de Wisconsin que contiene DMSO / FCS con trehalosa. La criopreservación se realizó durante 4 o 28 días. Todas las células fueron fotografiadas 2 días después de la siembra.
Discusión
Este estudio mostró que los hepatocitos recién aislados del ganado pueden ser criopreservados con éxito y parcialmente cultivados después de la criopreservación. Sin embargo, el número relativo de hepatocitos bovinos que se recuperan de la criopreservación es bajo y mucho menor en comparación con los hepatocitos criopreservados de cerdo. Aunque la tasa de recuperación fue comúnmente mejor cuando los hepatocitos de ambos animales se congelaron en un congelador de tasa controlada que en un recipiente de congelación lleno de alcohol, esta tasa no fue lo suficientemente alta como para alcanzar capas celulares confluentes para cultivos celulares posteriores. La suplementación del medio de congelación con trehalosa mejoró la criopreservación de los hepatocitos bovinos solo si el medio E de William sirvió como medio básico, mientras que la trehalosa no tuvo ningún efecto beneficioso si se complementó con la solución de la Universidad de Wisconsin. Los hepatocitos porcinos no se beneficiaron de la suplementación con trehalosa. Además, no determinamos diferencias claras entre los medios básicos E de William y la solución de la Universidad de Wisconsin, así como el momento de la criopreservación.
La digestión enzimática del tejido hepático da como resultado la liberación de hepatocitos individuales y esferoides de hepatocitos de diferente tamaño. Sin embargo, esta liberación no solo está mediada por la acción enzimática de la fracción cruda de colagenasa utilizada para el aislamiento de hepatocitos, sino también por la perfusión anterior del tejido hepático con EGTA. EGTA es un agente quelante con alta afinidad por el Ca2+ iones. Su uso interrumpe irreversiblemente el Ca2+-desmosomas dependientes, estructuras especializadas de la superficie celular para la adhesión de célula a célula (24). En 2012, Lee y sus colegas demostraron claramente que los hepatocitos porcinos agregados en esferoides se recuperan mejor de la criopreservación que los hepatocitos individuales (22). Como los hepatocitos aislados del ganado forman esferoides más pequeños o incluso sin esferoides después del aislamiento en comparación con los hepatocitos porcinos, eventualmente explica su menor tasa de recuperación posterior a la criopreservación. Esta diferencia dependiente de la especie en el tamaño del esferoide no pudo igualarse mediante el uso de una concentración más baja de EGTA y otra fracción de colagenasa cruda que tiene una menor actividad proteolítica durante el procedimiento de aislamiento de los hepatocitos bovinos. Esta observación sugiere diferencias significativas en los complejos de adhesión célula-célula entre los hepatocitos del ganado vacuno y porcino. Eventualmente, los hepatocitos porcinos expresan más Ca2+-desmosomas independientes o más otras uniones célula-célula (es decir, uniones de adherencia, uniones de muslos) que los hepatocitos bovinos. Además, las diferencias dependientes de la especie en las uniones célula-matriz son bien posibles.
Otra diferencia dependiente de la especie es el metabolismo hepático del ganado vacuno y porcino (23). Sin embargo, utilizamos el mismo medio básico (es decir, el medio E de William y la solución de la Universidad de Wisconsin) para congelar hepatocitos bovinos y porcinos. Como ambos medios se habían desarrollado para conservar o cultivar hepatocitos primarios de especies no rumiantes, su uso también podría explicar la menor recuperación posterior a la criopreservación de los hepatocitos bovinos. Aunque esto sugiere el desarrollo de medios básicos específicos para el ganado para congelar hepatocitos, el medio básico finalmente no es tan crítico porque los almacenamientos celulares por debajo de -135 ° C minimizan el metabolismo hepático en un grado muy bajo. Esta suposición está indirectamente respaldada por varios estudios que no muestran diferencias en la recuperación posterior a la criopreservación de hepatocitos humanos o de rata congelados a concentraciones altamente divergentes de FBS (0 a 90%) y, por lo tanto, proporciones divergentes del medio básico (15, 25, 26).
La tasa de recuperación de los hepatocitos después de la criopreservación depende en gran medida de su viabilidad en el momento del aislamiento del tejido hepático. Nuestro estudio evaluó la viabilidad celular mediante la tinción con azul de tripano de los hepatocitos. Aunque este método común no reveló diferencias entre la viabilidad de los hepatocitos bovinos y porcinos inmediatamente después del aislamiento del tejido hepático, la tinción con azul de tripano solo evalúa la integridad de la membrana plasmática externa de las células. Por lo tanto, las diferencias dependientes de la especie en las vías de muerte celular que preceden a los daños de la membrana plasmática externa también podrían ser responsables de la criopreservación menos exitosa de los hepatocitos bovinos en comparación con los hepatocitos porcinos. Las diferencias medias en la edad y el tiempo de los animales entre la disección hepática y el aislamiento de hepatocitos son posibles razones para las diferencias relacionadas con las especies en los mecanismos de muerte celular aguas arriba de los daños de la membrana. Sin embargo, la criopreservación de los hepatocitos bovinos ha mejorado parcialmente mediante la suplementación del medio de congelación con trehalosa, confirmando así su beneficio potencial como agente crioprotector no penetrante (12-14).
Además de las diferencias dependientes de la especie en la recuperación posterior a la criopreservación de hepatocitos de ganado bovino y porcino, comúnmente observamos mejores tasas de recuperación si los hepatocitos se congelaron en condiciones controladas en un congelador de tasa controlada. Esta observación apoya la ventaja de esta tecnología en la criopreservación de hepatocitos (18-22). Alrededor del 50-60% de los hepatocitos porcinos congelados en condiciones controladas se recuperaron de la criopreservación. Esta tasa corresponde a los hallazgos de otros estudios con cerdos (15, 18, 22). Sin embargo, la tasa de recuperación disminuye aún más cuando los hepatocitos se transfirieron a los sistemas de cultivo celular. Esta observación ha sido hecha por nosotros y otros investigadores utilizando hepatocitos de varias especies (15, 18, 27-31). La regulación a la baja mediada por la temperatura de la β1-integrina es un factor crucial que explica el cultivo celular limitado de hepatocitos criopreservados porque contribuye esencialmente a las interacciones célula-matriz (27). Otro factor crucial es la citotoxicidad del DMSO (11).
En resumen, nuestro estudio mostró que la criopreservación de hepatocitos bovinos es posible pero menos exitosa que la criopreservación de hepatocitos porcinos. Además, demostramos un cultivo limitado de hepatocitos criopreservados de ambas especies en comparación con los hepatocitos de rata. Por lo tanto, se requieren nuevos crioprotectores y protocolos de criopreservación adaptados a estos nuevos agentes para la criopreservación de hepatocitos primarios de ganado bovino y porcino también. Con respecto a la recuperación de hepatocitos criopreservados en cultivo posterior al deshielo, ensayos adicionales como la tinción de células descongeladas para marcadores apoptóticos pueden dilucidar aún más la causa de la recuperación celular deficiente en el cultivo posterior al deshielo.
Declaración de disponibilidad de datos
Las contribuciones originales presentadas en el estudio se incluyen en el artículo / material complementario, las consultas adicionales pueden dirigirse al autor correspondiente.
Declaración ética
El estudio en animales fue revisado y aprobado por el uso de material animal fue aceptado por las comisiones locales de bienestar animal bajo los números de archivo 33.9-42502-04-18/2752 y H1-2//1-20.
Contribuciones del autor
MS, SA y BB contribuyeron a la concepción y diseño del estudio. SA organizó la base de datos y escribió secciones del manuscrito. SA y VS realizaron los experimentos. BB realizó el análisis estadístico y escribió el primer borrador del manuscrito. Todos los autores contribuyeron a la revisión del manuscrito, leyeron y aprobaron la versión presentada.
Financiación
Este trabajo fue apoyado por el proyecto Horizon 2020 de la Unión Europea «BovReg» bajo el número de subvención 815668.
Reconocimientos
Agradecemos a Martina Hoedemaker de la Clínica de Ganado, Universidad de Medicina Veterinaria, Hannover, Alemania y AS del Departamento de Rumiantes y Porcinos, Facultad de Medicina Veterinaria, Universidad de Leipzig, Alemania, por apoyar el tejido hepático.
Conflicto de intereses
Los autores declaran que la investigación se llevó a cabo en ausencia de cualquier relación comercial o financiera que pudiera interpretarse como un posible conflicto de intereses.
Nota del editor
Todas las afirmaciones expresadas en este artículo son únicamente las de los autores y no representan necesariamente las de sus organizaciones afiliadas, o las del editor, los editores y los revisores. Cualquier producto que pueda ser evaluado en este artículo, o reclamo que pueda ser hecho por su fabricante, no está garantizado ni respaldado por el editor.
Material complementario
El material complementario para este artículo se puede encontrar en línea en: https://www.frontiersin.org/articles/10.3389/fvets.2023.1211135/full#supplementary-material
Referencias
1. Gebhardt, R, Hengstler, JG, Muller, D, Glockner, R, Buenning, P, Laube, B, et al. Nuevos sistemas de hepatocitos in vitro para el metabolismo de fármacos: capacidad metabólica y recomendaciones para su aplicación en investigación básica y desarrollo de fármacos, procedimientos de operación estándar. Drogas Metab Rev. (2003) 35:145–213. DOI: 10.1081/DMR-120023684
Resumen de PubMed | Texto completo de CrossRef | Google Académico
2. de Hoyos-Vega, JM, Hong, HJ, Stybayeva, G, and Revzin, A. Hepatocyte cultures: from collagen gel sandwiches to microfluic devices with integrated biosensors. APL Bioeng. (2021) 5:041504. doi: 10.1063/5.0058798
Resumen de PubMed | Texto completo de CrossRef | Google Académico
3. Gerbal-Chaloin, S, Briolotti, P, Daujat-Chavanieu, M, y Rasmussen, MK. Los hepatocitos primarios aislados de donantes humanos y porcinos muestran patrones similares de expresión del citocromo p450 después de la exposición a activadores prototípicos de AhR, CAR y PXR. Curr Res Toxicol. (2021) 2:149–58. doi: 10.1016/j.crtox.2021.03.002
Resumen de PubMed | Texto completo de CrossRef | Google Académico
4. Barna, RF, Mackei, M, Paszti-Gere, E, Neogrady, Z, Jerzsele, A, y Matis, G. Los efectos de la inhibición de la matriptasa en la homeostasis inflamatoria y redox de modelos de cultivo de células hepáticas de pollo. Biomedicina. (2021) 9:450. DOI: 10.3390/Biomedicines9050450
Resumen de PubMed | Texto completo de CrossRef | Google Académico
5. Endriß, KJ, Meyerholz, MM, Fischbach, T, Brimmers, L, Pfarrer, C, Marth, CD, et al. Efectos in vitro de los interferones tipo I (IFNtau e IFNalpha) sobre hepatocitos bovinos cultivados con o sin células de Kupffer. Reprod Fertil Dev. (2021) 33:305–17. doi: 10.1071/RD20278
6. Witte, S, Brockelmann, Y, Haeger, JD, y Schmicke, M. Establecimiento de un modelo de hepatocitos bovinos primarios con expresión sensible del receptor de la hormona del crecimiento. J Dairy Sci. (2019) 102:7522–35. DOI: 10.3168/JDS.2018-15873
Resumen de PubMed | Texto completo de CrossRef | Google Académico
7. Ehrhardt, S, y Schmicke, M. Isolation and cultivation of adult primary bovine hepatocytes from amattoir derived liver. EXCLI J. (2016) 15:858–66. DOI: 10.17179/excli2016-794
8. Gouliarmou, V, Pelkonen, O, and Coecke, S. Differentiation-promoting medium additives for hepatocyte cultivation and cryopreservation. Métodos Mol Biol. (2015) 1250:143–59. DOI: 10.1007/978-1-4939-2074-7_10
Resumen de PubMed | Texto completo de CrossRef | Google Académico
9. Hengstler, JG, Utesch, D, Steinberg, P, Platt, KL, Diener, B, Ringel, M, et al. Hepatocitos primarios criopreservados como un modelo in vitro constantemente disponible para la evaluación del metabolismo de fármacos humanos y animales y la inducción enzimática. Drogas Metab Rev. (2000) 32:81–118. DOI: 10.1081/DMR-100100564
Resumen de PubMed | Texto completo de CrossRef | Google Académico
10. Pegg, DE. Principios de criopreservación. Métodos Mol Biol. (2015) 1257:3–19. DOI: 10.1007/978-1-4939-2193-5_1
11. Raju, R, Bryant, SJ, Wilkinson, BL, y Bryant, G. La necesidad de nuevos crioprotectores y protocolos de criopreservación: información sobre la importancia de la investigación biofísica y la permeabilidad celular. Biochim Biophys Acta Gen Subj. (1865) 1865:129749. doi: 10.1016/j.bbagen.2020.129749
Resumen de PubMed | Texto completo de CrossRef | Google Académico
12. Yoshida, K, Ono, F, Chouno, T, Perocho, BR, Ikegami, Y, Shirakigawa, N, et al. Efecto potenciador crioprotector de muy baja concentración de trehalosa sobre las funciones de los hepatocitos primarios de rata. Regen Ther. (2020) 15:173–9. doi: 10.1016/j.reth.2020.08.003
Resumen de PubMed | Texto completo de CrossRef | Google Académico
13. Katenz, E, Vondran, FW, Schwartlander, R, Pless, G, Gong, X, Cheng, X, et al. Criopreservación de hepatocitos humanos primarios: el beneficio de la trehalosa como agente crioprotector adicional. Hígado Transpl. (2007) 13:38–45. DOI: 10.1002/LT.20921
14. Stokich, B, Osgood, Q, Grimm, D, Moorthy, S, Chakraborty, N, y Menze, MA. Criopreservación de monocapas celulares de hepatocitos (HepG2): impacto de la trehalosa. Criobiología. (2014) 69:281–90. doi: 10.1016/j.cryobiol.2014.08.001
Resumen de PubMed | Texto completo de CrossRef | Google Académico
15. Kunieda, T, Maruyama, M, Okitsu, T, Shibata, N, Takesue, M, Totsugawa, T, et al. Criopreservación de hepatocitos porcinos aislados principalmente con solución UW. Trasplante de células. (2003) 12:607–16. doi: 10.3727/000000003108747217
Resumen de PubMed | Texto completo de CrossRef | Google Académico
16. Southard, JH, van Gulik, TM, Ametani, MS, Vreugdenhil, PK, Lindell, SL, Pienaar, BL, et al. Componentes importantes de la solución UW. Trasplante. (1990) 49:251–7. DOI: 10.1097/00007890-199002000-00004
Resumen de PubMed | Texto completo de CrossRef | Google Académico
17. Hunt, CJ. Criopreservación: vitrificación y enfriamiento de velocidad controlada. Métodos Mol Biol. (2017) 1590:41–77. doi: 10.1007/978-1-4939-6921-0_5
Resumen de PubMed | Texto completo de CrossRef | Google Académico
18. Lee, JH, Jung, DH, Lee, DH, Park, JK y Lee, SK. La velocidad de enfriamiento lenta con un programa de enfriamiento de choque puede criopreservar eficazmente los hepatocitos de cerdo. Trasplante Proc. (2012) 44:1002–4. doi: 10.1016/j.transproceed.2012.01.105
Resumen de PubMed | Texto completo de CrossRef | Google Académico
19. Mitry, RR, Lehec, SC, and Hughes, RD. Cryopreservation of human hepatocytes for clinical use. Métodos Mol Biol. (2010) 640:107–13. doi: 10.1007/978-1-60761-688-7_5
20. Diener, B, Utesch, D, Beer, N, Durk, H, y Oesch, F. Un método para la criopreservación de células del parénquima hepático para estudios de xenobióticos. Criobiología. (1993) 30:116–27. doi: 10.1006/cryo.1993.1011
Resumen de PubMed | Texto completo de CrossRef | Google Académico
21. Saliem, M, Holm, F, Tengzelius, RB, Jorns, C, Nilsson, LM, Ericzon, BG, et al. Mejora de la criopreservación de hepatocitos humanos utilizando una nueva solución crioprotectora libre de xeno. Mundo J Hepatol. (2012) 4:176–83. doi: 10.4254/wjh.v4.i5.176
Resumen de PubMed | Texto completo de CrossRef | Google Académico
22. Lee, JH, Jung, DH, Lee, DH, Park, JK, and Lee, SK. Effect of spheroid aggregation on susceptibility of primary pig hepatocytes to cryopreservation. Trasplante Proc. (2012) 44:1015–7. doi: 10.1016/j.transproceed.2012.03.009
Resumen de PubMed | Texto completo de CrossRef | Google Académico
23. Bergman, EN. Aportes energéticos de ácidos grasos volátiles del tracto gastrointestinal en diversas especies. Physiol Rev. (1990) 70:567–90. doi: 10.1152/physrev.1990.70.2.567
Resumen de PubMed | Texto completo de CrossRef | Google Académico
24. Seglen, PO. Suspensiones y cultivos de hepatocitos como herramientas en la carcinogénesis experimental. J Toxicol Environ Salud. (1979) 5:551–60. doi: 10.1080/15287397909529766
Resumen de PubMed | Texto completo de CrossRef | Google Académico
25. Loretz, LJ, Li, AP, Flye, MW y Wilson, AGE. Optimización de procedimientos de criopreservación para hepatocitos humanos y de rata. Xenobiótica. (1989) 19:489–98. DOI: 10.3109/00498258909042288
26. Son, JH, Kim, KH, Nam, YK, Park, JK, and Kim, SK. Optimization of cryoprotectants for cryopreservation of rat hepatocyte. Biotechnol Lett. (2004) 26:829–33. doi: 10.1023/B:Bile.0000025886.57547.04
Resumen de PubMed | Texto completo de CrossRef | Google Académico
27. Terry, C, Hughes, RD, Mitry, RR, Lehec, SC, and Dhawan, A. Cryopreservation-induced nonattachment of human hepatocytes: role of adhesion molecules. Trasplante de células. (2007) 16:639–47. doi: 10.3727/000000007783465000
Resumen de PubMed | Texto completo de CrossRef | Google Académico
28. Novicki, DL, Irons, GP, Strom, SC, Jirtle, R, and Michalopoulos, G. Cryopreservation of isolated rat hepatocytes. Célula in vitro Dev B. (1982) 18:393–9. doi: 10.1007/BF02796340
29. Alexandre, E, Viollon-Abadie, C, David, P, Gandillet, A, Coassolo, P, Heyd, B, et al. Criopreservación de hepatocitos humanos adultos obtenidos de biopsias hepáticas resecadas. Criobiología. (2002) 44:103–13. DOI: 10.1016/S0011-2240(02)00011-1
Resumen de PubMed | Texto completo de CrossRef | Google Académico
30. Gomez-Lechon, MJ, Lahoz, A, Jimenez, N, Castell, JV, and Donato, MT. Cryopreservation of rat, dog and human hepatocytes: influence of preculture and cryoprotectants on recovery, cytochrome P450 activities and induction upon thawing. Xenobiótica. (2006) 36:457–72. DOI: 10.1080/00498250600674352
Resumen de PubMed | Texto completo de CrossRef | Google Académico
31. Li, AP. Hepatocitos humanos: aislamiento, criopreservación y aplicaciones en el desarrollo de fármacos. Chem Biol interactúa. (2007) 168:16–29. doi: 10.1016/j.cbi.2007.01.001
Resumen de PubMed | Texto completo de CrossRef | Google Académico
Palabras clave: células primarias, hígado, ganado, cerdo, congelador de tasa controlada, medio de congelación, trehalosa
Cita: Andres S, Bartling B, Stiensmeier V, Starke A y Schmicke M (2023) Criopreservación comparativa de hepatocitos primarios bovinos y porcinos. Frente. Vet. Sci. 10:1211135. doi: 10.3389/fvets.2023.1211135
Recibido: 24 de abril de 2023; Aprobado: 09 Junio 2023;
Publicado: 08 agosto 2023.
Editado por:
Fazul Nabi, Universidad de Agricultura, Agua y Ciencias Marinas de Lasbela, Pakistán
Revisado por:
Rui Li, West Pharmaceutical Services, Estados Unidos
Pablo Daniel Cetica, Universidad de Buenos Aires, Argentina
Derechos de autor © 2023 Andrés, Bartling, Stiensmeier, Starke y Schmicke. Este es un artículo de acceso abierto distribuido bajo los términos de la Licencia de Atribución Creative Commons (CC BY).
*Correspondencia: Marion Schmicke, Marion.Schmicke@tiho-hannover.de
Renuncia: Todas las afirmaciones expresadas en este artículo son únicamente las de los autores y no representan necesariamente las de sus organizaciones afiliadas, o las del editor, los editores y los revisores. Cualquier producto que pueda ser evaluado en este artículo o reclamo que pueda ser hecho por su fabricante no está garantizado ni respaldado por el editor.
Date de alta y recibe nuestro 👉🏼 Diario Digital AXÓN INFORMAVET ONE HEALTH
Date de alta y recibe nuestro 👉🏼 Boletín Digital de Foro Agro Ganadero
Noticias animales de compañía
Noticias animales de producción
Trabajos técnicos animales de producción
Trabajos técnicos animales de compañía
