Cuantificación del ADN del hepadnavirus del gato doméstico

Cuantificación del ADN del hepadnavirus del gato doméstico en varios especímenes de fluidos corporales de gatos: las posibles rutas de diseminación viral
 Sabrina Wahyu Wardhani1,2
Sabrina Wahyu Wardhani1,2  Padet Tummaruk3
Padet Tummaruk3  Chutchai Piewbang2,4*†
Chutchai Piewbang2,4*†  Somporn Techangamsuwan2,4*†
Somporn Techangamsuwan2,4*†- 1Programa Internacional de Posgrado en Ciencia y Tecnología Veterinaria, Facultad de Ciencias Veterinarias, Universidad de Chulalongkorn, Bangkok, Tailandia
- 2Unidad de Investigación sobre Virome Animal y Desarrollo Diagnóstico, Facultad de Ciencias Veterinarias, Universidad de Chulalongkorn, Bangkok, Tailandia
- 3Departamento de Obstetricia, Ginecología y Reproducción, Facultad de Ciencias Veterinarias, Universidad de Chulalongkorn, Bangkok, Tailandia
- 4Departamento de Patología, Facultad de Ciencias Veterinarias, Universidad de Chulalongkorn, Bangkok, Tailandia
El hepadnavirus del gato doméstico (DCH) pertenece a la familia Hepadnaviridae junto con el virus de la hepatitis B humana (VHB) que sigue siendo un importante problema de salud en todo el mundo. La transmisión del virión infeccioso del VHB ha sido uno de los factores esenciales que contribuyen al elevado número de infecciones por VHB en humanos. Desde hace tiempo se sabe que varias muestras de fluidos corporales de humanos con infección crónica por VHB contienen ADN del VHB y han demostrado ser infecciosos. En contraste con este conocimiento, la detección de DCH en varias muestras de fluidos corporales de gatos, no ha sido reportada. Este estudio exploró la detección de ADN DCH en varias muestras de fluidos corporales de gatos mediante reacción cuantitativa en cadena de la polimerasa (qPCR) e investigó si la detección de ADN DCH de rutas más amplias se correlacionó con cualquier diversidad genómica mediante análisis filogenético. Se incluyeron un total de 1.209 muestras de fluidos corporales, y se detectó ADN DCH no solo en el 4,70% (25/532) de las muestras de sangre; pero también en muestras de 12,5% (1/8), 1,14% (1/88), 2,54% (10/394) y 1,65% (3/182) de hisopo auricular (EA), hisopo nasal (NS), hisopo oral (SG) e hisopo rectal (RS), respectivamente. Además, el nivel de ADN DCH detectado en la sangre se correlacionó significativamente con la detección de ADN DCH en muestras de SG (P = 0,02) y RS (P = 0,04). El análisis genómico reveló que no había diversidad genómica notable dentro de las secuencias completas del genoma obtenidas en este estudio. En conclusión, este estudio destacó la presencia de ADN DCH en varios especímenes de fluidos corporales de gatos, y el papel potencial de estos especímenes en la transmisión horizontal de DCH dentro de la población de gatos justifica estudios adicionales.
Introducción
El virus de la hepatitis B humana (VHB), un virus de ADN circular relajado, pertenece a la familia Hepadnaviridae y sigue siendo un importante problema de salud en todo el mundo, ya que es responsable de más de 800.000 muertes cada año (1, 2). A pesar de la disponibilidad de una vacuna contra el VHB, se estima que 360 millones de personas sufren de infección crónica por VHB con mayor riesgo de enfermedades potencialmente mortales como la cirrosis y el carcinoma hepatocelular (CHC) (3). En 2018, se detectó en gatos el hepadnavirus del gato doméstico (DCH), un pariente del VHB, y desde entonces, varios estudios han reportado la detección global de DCH en la sangre y el tejido hepático de los gatos, con una prevalencia que oscila entre el 0,78 y el 18,5% (4-10). Una preocupación con respecto al posible papel de DCH en el desarrollo de la enfermedad hepática crónica en gatos se ha planteado e investigado en varios estudios, y sorprendentemente, un estudio temprano reveló que DCH se detectó y localizó solo en el tejido hepático de gatos con hepatitis crónica y CHC, y no se realizó detección en la biopsia hepática de gatos sanos y gatos con colangitis y carcinoma biliar (5). Además, estudios recientes estuvieron de acuerdo en que la DCH estaba fuertemente asociada con un aumento de las actividades de las enzimas hepáticas sugestivas de hepatitis (7, 11), incluso después de descartar otras posibles infecciones virales que comúnmente causan hepatopatía en gatos (9). El posible papel de DCH en el desarrollo de trastornos hepáticos y hepatitis crónica y CHC en gatos, por lo tanto, no puede ser descuidado.
La transmisión de un virión infeccioso, específicamente de individuos infectados crónicamente que son asintomáticos, sirve como un desafío que contribuye a la alta tasa de infección por VHB en humanos. El VHB se transmite principalmente horizontalmente por infección relacionada con la sangre y el contacto sexual y verticalmente de la madre infectada a sus recién nacidos (12). En estos días, sin embargo, hay una creciente evidencia de detección de ADN del VHB de otras fuentes, como la saliva, el sudor, las lágrimas, las heces y el cerumen de individuos infectados, y se ha demostrado que la saliva y las lágrimas son infecciosas en modelos humanos o animales (12-15). En contraste con el creciente conocimiento sobre las rutas de transmisión del VHB en humanos, la detección de DCH en varias muestras de fluidos corporales de gatos rara vez se ha reportado. Capozza et al. investigaron la detección de DCH a partir de rutas más amplias, incluyendo hisopos orales, conjuntivales, prepuciales y rectales de un gato, pero no se obtuvo ningún resultado positivo, a pesar del estado prolongado de viremia DCH del gato que permaneció durante 11 meses (16). Con la tendencia creciente de entornos de múltiples gatos donde el contacto cercano y la lucha son inevitables, es crucial evaluar la posible transmisión de DCH de varias muestras de fluidos corporales que no sean sangre. Por lo tanto, el objetivo de este estudio fue explorar la presencia de DCH en la sangre y otras muestras de fluidos corporales, incluyendo hisopo auricular (AS), hisopo nasal (NS), hisopo oral (OS), hisopo rectal (RS) y orina obtenida de gatos de varias provincias de Tailandia y determinar si la presencia de ADN DCH en varios fluidos corporales se correlaciona con alguna diferencia genotípica utilizando la caracterización genómica de longitud completa.
Materiales y métodos
Recogida de muestras
Para investigar la presencia de DCH en varias muestras clínicas, recolectamos varias muestras de fluidos corporales, incluyendo sangre, AS, NS, OS, RS y orina de hospitales de animales y refugios para gatos en Tailandia. Se recolectaron muestras clínicas de gatos que se sometieron a un examen de salud general o fueron designados para recibir quimioterapia o tratamiento continuo para enfermedades crónicas. Todos los especímenes fueron recolectados con el consentimiento previo del propietario. Los detalles de los especímenes recolectados de cada gato se presentan en el material suplementario S1.
Las muestras de sangre se recolectaron en tubos de recolección de sangre EDTA, mientras que las muestras AS, NS, OS y RS se recolectaron utilizando hisopos de algodón estériles y se sumergieron en 0.6 ml de PBS estéril de 1× en tubos Eppendorf de 1.5 ml. La orina se recolectó mediante un procedimiento no invasivo por el método de captura libre. Todas las muestras se almacenaron posteriormente a -80 ° C antes del procedimiento de extracción.
Todos los procedimientos de investigación se llevaron a cabo de acuerdo con las directrices y reglamentos de Investigación con animales: Informes de experimentos in vivo (ARRIVE). Este estudio fue aprobado por el Comité Institucional de Bioseguridad de la Universidad de Chulalongkorn (IBC No. 2131001) y el Protocolo de Cuidado y Uso de Animales de la Universidad de Chulalongkorn (CU-ACUP No. 2131004).
Además, se realizó una detección longitudinal para cinco gatos que mostraron resultados positivos en el cribado inicial de DCH, a saber, PK-71, PK-74, PK-83, PK-91 y CU-38. El estudio longitudinal se realizó con una recolección de muestras de profesionales basada en la conveniencia, y la duración de la recolección de muestras varió de 13 a 111 días, dependiendo del examen de seguimiento de cada gato.
Extracción de ácidos nucleicos virales y cribado molecular para DCH
Aproximadamente 200 μL de cada muestra se sometieron a un procedimiento de extracción de ácido nucleico viral utilizando el kit de patógenos IndiSpin (QIAGEN GmbH, Alemania) de acuerdo con el protocolo del fabricante. La calidad y cantidad del ácido nucleico extraído se midieron utilizando un espectrofotómetro (Nabi-UV/Vis Nano Spectrophotometer, Corea) con una relación de absorbancia de 260/280. El ácido nucleico extraído se almacenó a -80 ° C hasta que se utilizó más para la detección molecular viral.®®
El cribado de DCH se realizó mediante un ensayo de qPCR dirigido a la región superpuesta conservada de los ORFs P y S, como se describió anteriormente (11). Brevemente, la mezcla maestra de PCR se preparó utilizando el kit KAPA SYBR FAST qPCR Master Mix (Kapa Biosystems, Sigma-Aldrich, Sudáfrica) con la adición de un conjunto de cebadores: DCH-qF (5′-CGTCATCATGGGCTTTAGGAA-3′) y DCH-qR (5′-TCCATATAAGCAAACACCATACAAT-3′). Para la amplificación del ADN DCH, las condiciones de termociclado se establecieron en el ciclador de PCR en tiempo real QIAGEN Rotor-Gene Q (Qiagen, Alemania) con activación de la polimerasa Taq a 95 °C durante 3 min, seguido de 35 ciclos de desnaturalización a 95 °C durante 10 s y recocido a 60 °C durante 20 s. La condición de amplificación fue seguida por el aumento de la temperatura del termociclador de 70 a 95 ° C para adquirir la curva de fusión de cada amplicón. Las muestras que mostraron una curva de amplificación por encima del umbral con un pico de fusión único que varió de 80 a 85 ° C de acuerdo con los plásmidos estándar se consideraron positivas. El número de copias de ADN viral se obtuvo comparando la señal de fluorescencia adquirida de las muestras con el plásmido estándar que contiene el fragmento del gen L de DCH (TOPO™ TA Cloning™ Kit with One Shot™ TOP10 Chemically Competent E. coli; Invitrogen, USA) diseñado utilizando las secuencias DCH disponibles en GenBank (https://www.ncbi.nlm.nih.gov/genbank/) como se describió anteriormente (6).®
Análisis estadístico
Todos los análisis estadísticos en este estudio se realizaron utilizando el software estadístico SAS versión 9.4 (SAS Inst., Cary, NC, EUA). Inicialmente, se realizó el procedimiento MEANS para analizar los datos estadísticos descriptivos, incluyendo la media, desviación estándar (DE), mínimo y máximo nivel de ADN DCH presentado en cada grupo de especímenes. Para los gatos con múltiples detecciones de DCH durante la recolección y prueba longitudinal de muestras, solo se incluyó para el análisis estadístico el único punto de tiempo en el que el nivel de ADN DCH en la sangre fue el más alto. Se llevaron a cabo múltiples análisis de varianza utilizando un procedimiento de modelo lineal general para comparar el nivel de ADN DCH entre grupos de muestras.
Además, 14 gatos virémicos DCH se clasificaron en función del nivel de ADN DCH presente en la sangre de acuerdo con la correlación entre el nivel de ADN del VHB en la sangre y la positividad del ADN del VHB en otras muestras como se describió anteriormente (15). Solo 14 de los 25 gatos virémicos DCH pudieron incluirse en este análisis debido a la falta de otras muestras de fluidos corporales disponibles de los 11 casos restantes. En este estudio, dividimos a los gatos probados en tres grupos diferentes: (1) grupo de baja carga viral, con un nivel de ADN DCH <5 copias logarítmicas (LC) / ml; (2) grupo de carga viral alta, con un nivel de ADN DCH entre 5 y 7 LC/mL; y (3) grupo de carga viral muy alta, con un nivel de ADN DCH > 7 LC/mL. La asociación entre el nivel de ADN DCH en la sangre y la detección en otras muestras de fluidos corporales se analizó posteriormente mediante la prueba exacta de Fisher, y el riesgo relativo (RR) se estimó mediante el procedimiento FREQ. Un valor de p < 0,05 se consideró estadísticamente significativo para todas las pruebas.
Secuenciación completa del genoma y análisis filogenético
Se realizó una caracterización y análisis genómicos para comparar las secuencias genómicas completas obtenidas de la sangre con las obtenidas de otras muestras de fluidos corporales. También comparamos las secuencias completas del genoma obtenidas de gatos para los cuales el ADN DCH se detectó solo en una sola muestra con las obtenidas de gatos para los cuales se detectó ADN DCH en múltiples especímenes. Se recuperaron un total de nueve secuencias genómicas completas de siete muestras de sangre, una muestra de SG y una muestra de RS. Estos casos se seleccionaron en función del mayor número de cargas virales presentes en las muestras y representaron los casos para los cuales se detectó ADN DCH de una sola ruta y aquellos con ADN DCH detectado en múltiples rutas. Se empleó PCR convencional con la adición de tres conjuntos diferentes de cebadores para recuperar el genoma completo de DCH como se describió anteriormente (4, 6). Las secuencias recuperadas se alinearon y compararon con las secuencias DCH de referencia obtenidas de GenBank, utilizando el software de Análisis Genético Evolutivo Molecular (MEGA) 7.0 (http://www.megasoftware.net/) disponible gratuitamente. Todas las secuencias se sometieron a la construcción de un árbol filogenético de máxima verosimilitud utilizando análisis bootstrap con 1.000 replicaciones. El modelo HKY+G+I se implementó como el mejor modelo basado en el número de criterio de información bayesiano más bajo del algoritmo del modelo de mejor ajuste en el software MEGA 7.0. Un conjunto de cebadores para la amplificación completa del genoma DCH y las secuencias DCH descritas previamente utilizadas para construir un árbol filogenético se presentan en las Tablas Suplementarias S2, S3
Resultados
Detección de DCH de varias muestras de fluidos corporales
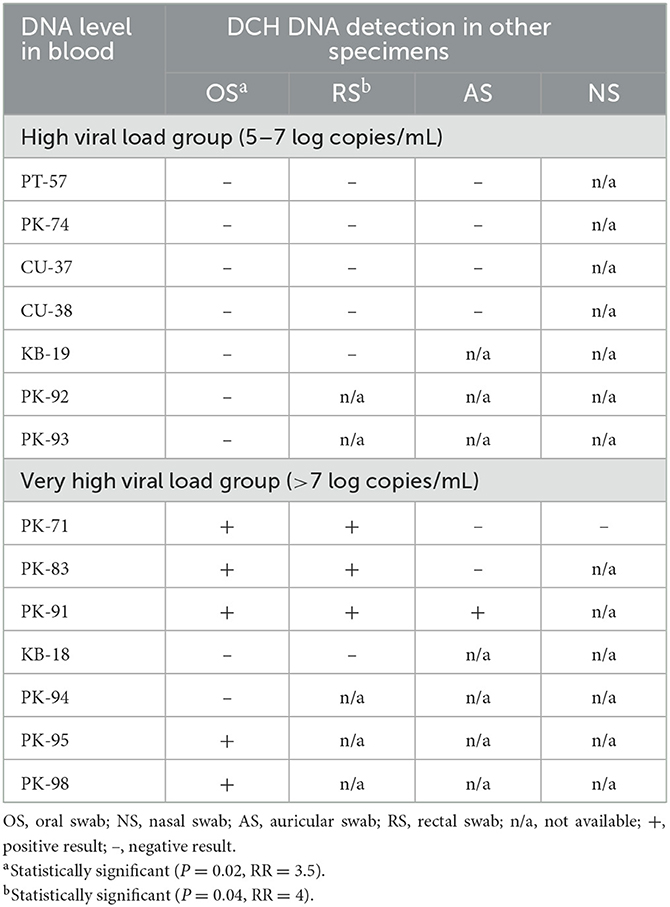
Se recogieron un total de 1.209 muestras clínicas de 921 gatos diferentes. En detalle, las muestras clínicas consistieron en muestras de sangre recolectadas de 532 gatos, SG de 394 gatos, RS de 182 gatos, NS de 88 gatos, AS de 8 gatos y orina de 5 gatos. Un total de 30/921 (3,26%) gatos mostraron un resultado positivo para la detección de ADN DCH por qPCR de al menos una muestra de fluido corporal. Dentro de estos 30 gatos DCH positivos, 20 gatos mostraron un resultado positivo solo en la sangre (en 11/20 gatos, solo había muestras de sangre disponibles; y en los otros 9/20 gatos, varias muestras de fluidos corporales adicionales a la sangre estaban disponibles, pero mostraron resultados negativos). Además de estos 20 casos que mostraron positivo solo en la sangre, cuatro gatos revelaron detección positiva solo en la SG (las muestras de sangre no estaban disponibles en estos casos), y seis gatos mostraron un resultado positivo en más de una muestra de fluido corporal. De los seis gatos con detección de DCH en más de un espécimen, dos gatos (casos Nº PK-95 y PK-98) revelaron un resultado positivo en sangre y SG; otros dos gatos (casos Nº PK-71 y PK-83) mostraron un resultado positivo en sangre, SG y RS; un gato (caso No. PK-91) reveló un resultado positivo en sangre, SG, RS y EA; y un gato (Caso No. S-191) mostró un resultado positivo en la SG y NS (no se disponía de muestra de sangre).
En cuanto al nivel de la muestra clínica, la qPCR para la detección de DCH empleada en este estudio reveló un resultado positivo en 40/1.209 (3,31%) de las muestras recogidas. Específicamente, se detectó ADN DCH en muestras 25/532 (4.70%), 10/394 (2.54%), 3/182 (1.65%), 1/88 (1.14%) y 1/8 (12.5%) sangre, OS, RS, NS y AS, respectivamente. No se encontró ningún resultado positivo para DCH en las muestras de orina. El resultado general de la detección de DCH en gatos y los detalles de la disponibilidad de muestras de cada gato con DCH positivo se presentan en la Tabla 1.
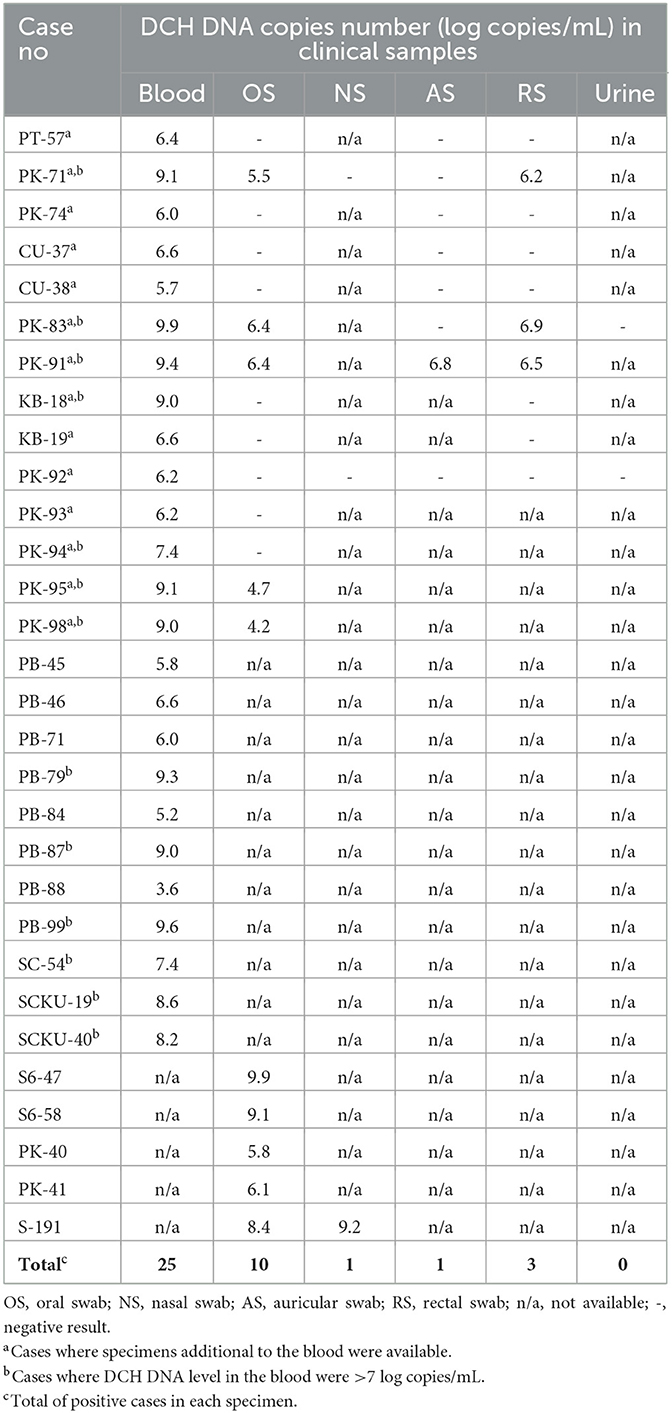 Tabla 1. Detección de DCH en varias muestras de fluidos corporales con los detalles de la disponibilidad de la muestra.
Tabla 1. Detección de DCH en varias muestras de fluidos corporales con los detalles de la disponibilidad de la muestra.
Cuantificación de ADN DCH
El nivel de ADN DCH detectado en la sangre varió de 3,6 a 9,9 LC/mL, con una media (±DE) de 7,4 ± 1,7 LC/mL. En las muestras de SG y RS, se detectó ADN DCH con números de copias que variaron de 4,2 a 9,9 LC/mL y 6,2 a 6,9 LC/mL, respectivamente, mientras que las medias (±DE) fueron 6,7 ± 1,9 LC/mL y 6,5 ± 0,3 LC/mL. En cuanto a las muestras AS y NS, se encontró un resultado positivo en una sola muestra de cada muestra, con un nivel de ADN de 6,8 y 9,2 LC/mL, respectivamente (Figura 1). Los múltiples análisis de varianza empleados en este estudio revelaron que no hubo diferencias significativas en el nivel de ADN DCH entre las muestras de sangre, OS, RS, NS y AS.
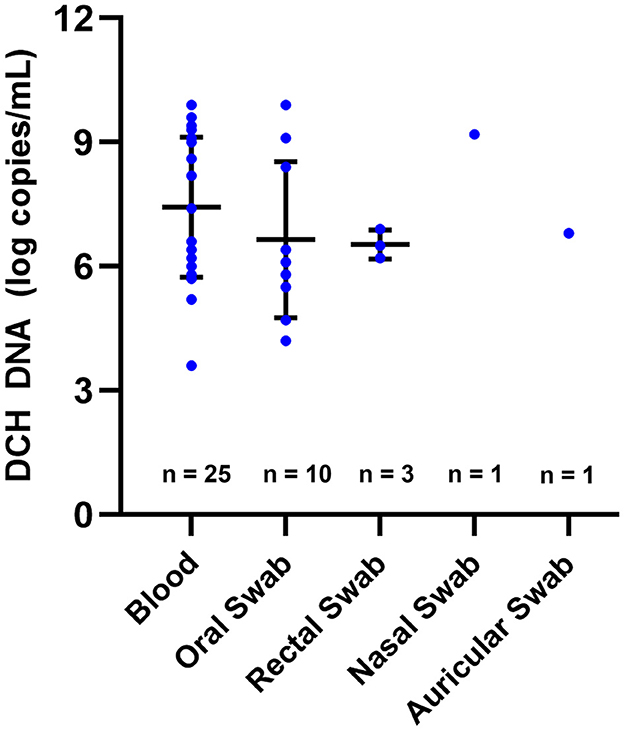 Figura 1. Niveles de ADN DCH detectados en varias muestras. El nivel de ADN DCH detectado en sangre, hisopo oral, hisopo rectal, hisopo nasal e hisopo auricular no mostró diferencias significativas. En esta figura, las medias y los SD se indican mediante barras horizontales y verticales, respectivamente.
Figura 1. Niveles de ADN DCH detectados en varias muestras. El nivel de ADN DCH detectado en sangre, hisopo oral, hisopo rectal, hisopo nasal e hisopo auricular no mostró diferencias significativas. En esta figura, las medias y los SD se indican mediante barras horizontales y verticales, respectivamente.
Dentro de los 25 gatos virémicos DCH, varias muestras de fluidos corporales, además de las muestras de sangre, estaban disponibles solo en 14 gatos que se agruparon uniformemente en los grupos de carga viral alta (7/14; 50%) y carga viral muy alta (7/14; 50%). Sorprendentemente, un nivel de ADN DCH en la sangre superior a 7 LC / ml (es decir, grupo de carga viral muy alta) se correlacionó significativamente con la detección de DCH en las muestras de SG y RS (P = 0.02; RR = 3,5 y P = 0,04; RR = 4, respectivamente), mientras que no hubo correlación significativa entre el nivel de ADN DCH en la sangre con la presencia de ADN DCH en las muestras de AS (Tabla 2). El espécimen NS fue excluido del análisis estadístico debido a la falta de disponibilidad de muestra.
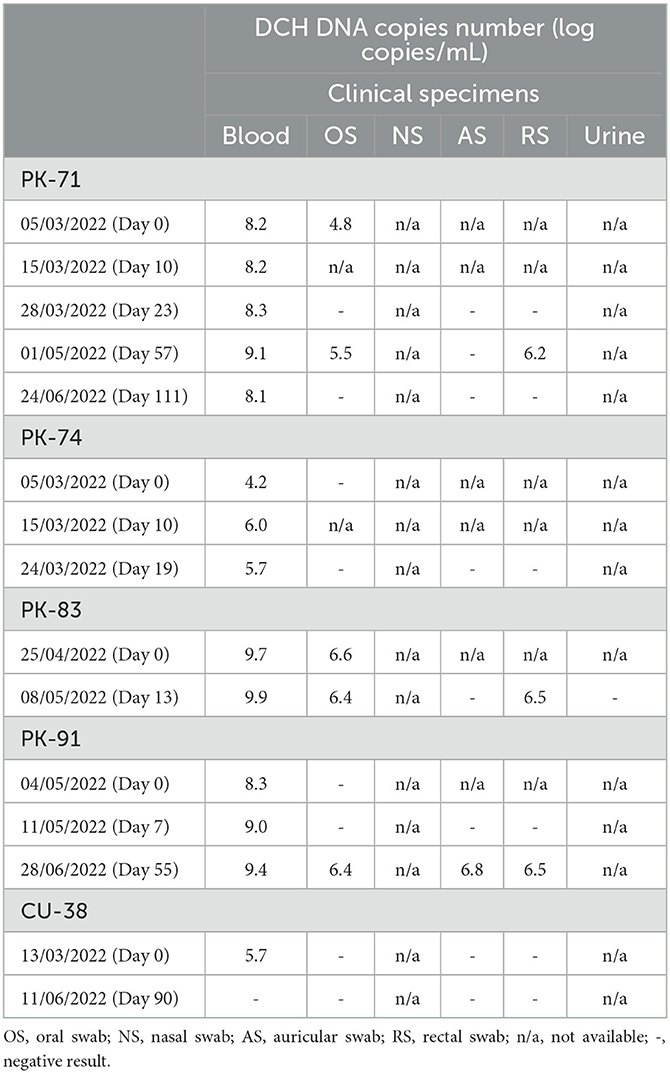
Detección longitudinal de DCH
Un total de 4/5 gatos incluidos en el estudio longitudinal de detección de DCH (PK-71, PK-74, PK-83 y PK-91) mostraron viremia durante todo el período de recolección (13-111 días), mientras que un gato (CU-38) mostró viremia DCH solo en la primera muestra (día 0) y fue negativa en la siguiente muestra (día 90). El nivel de ADN DCH detectado en la sangre de los cinco gatos durante el estudio longitudinal varió de 4.2 a 9.9 LC / ml. Se observó una detección más amplia de DCH en las muestras distintas de la sangre de 3/5 gatos (PK-71, PK-83 y PK-91), mientras que no se observó una detección más amplia de los gatos PK-74 y CU-38.
Además, cat PK-71 mostró positividad DCH en la SG el día 0 con un número de copias virales de 4,8 LC/ml y fue negativo en el siguiente muestreo (día 23). En el día 57, sin embargo, se observó positividad recurrente de DCH en la SG, con un nivel de ADN DCH de 5,5 LC/mL, y en el día 111, la muestra de SG dio negativo. Además de la muestra de SG, también se detectó ADN DCH en el RS el día 57, con un número de copias virales de 6.2 LC / ml. La detección de DCH fue negativa en el AS en tres momentos de recolección de muestras (día 23, día 57 y día 111), y no hubo muestras de SN y orina disponibles de cat PK-71.
Cat PK-83 se examinó dos veces, y solo se dispuso de muestras de sangre y SG en la primera evaluación (día 0). Aparte de la sangre, se observó positividad de DCH en las muestras de SG durante todo el período de recolección de muestras. El número de copias virales detectadas en las muestras de SG fue de 6,6 y 6,4 LC/ml el día 0 y el día 13, respectivamente. También se detectó ADN DCH en la muestra RS el día 13 a un nivel de 6.5 LC / ml, y no se encontró detección en las muestras de AS y orina. Un espécimen NS no estaba disponible durante la recolección longitudinal de muestras de gato PK-83.
Cat PK-91 se examinó tres veces, el día 0, el día 7 y el día 55. El ADN DCH no se detectó en muestras de fluidos corporales que no fueran sangre en el día 0 y el día 7. En contraste, todas las muestras disponibles, incluyendo sangre, AS, OS y RS, mostraron positividad de DCH en el día 55. El número de copias virales detectadas en las muestras de AS, OS y RS en el día 55 fue de 6,8, 6,4 y 6,5 LC/ml, respectivamente. No se dispuso de ningún espécimen NS del gato PK-91 durante todo el período de recolección de muestras. Los resultados generales de la detección longitudinal de DCH en este estudio se presentan en la Tabla 3.
Genoma completo y análisis filogenético
Se caracterizaron con éxito nueve secuencias genómicas completas de 3.184 pb a partir de siete muestras de sangre, designadas como DCH/KB18-B/THA/2022, DCH/PK98-B/THA/2022, DCH/PK83-B/THA/2022, DCH/PK71-B/THA/2022, DCH/PK74-B/THA/2022, DCH/PK95-B/THA/2022 y DCH/PK91-B/THA/2022; un espécimen de OS, designado como DCH/S647-OS/THA/2016; y un espécimen RS, designado como DCH/PK83-RS/THA/2022 (GenBank Accesion Nos. OQ362106-OQ362114). Todas las secuencias completas de DCH recuperadas en este estudio mostraron un alto porcentaje de identidad de nucleótidos (96-100%) entre sí, y no se observó ninguna secuencia distintiva (datos no mostrados).
El árbol filogenético construido reveló que nueve secuencias de este estudio se agruparon en dos linajes diferentes (Figura 2). Seis secuencias (OQ362107, OQ362108, OQ362109, OQ362111, OQ362113 y OQ362112) compartieron el mismo linaje con cepas anteriores de DCH de Tailandia (Accesiones Nos. MT506042.1, MT506043.1, MT506044.1 y MT506045.1). En contraste, otras tres secuencias (OQ362106, OQ362110 y OQ362114) se agruparon en diferentes linajes junto con algunas cepas de DCH de Tailandia (Accesion Nos. MT506047.1 y MT506041.1) y cepas de DCH de Malasia, Australia, Japón, Italia y Hong Kong (Accesion Nos. MK902920.1, MH307930.1, LC668427.1, OK574326.1 y OP643851.1—OP643862.1, respectivamente). Además, el filograma demostró que las secuencias completas de nucleótidos obtenidas de casos en los que el ADN DCH se detectó solo en la sangre (casos KB-18 y PK-74; Los números de acceso OQ362110 y OQ362111) no eran distintos de los casos que expresaban ADN DCH en la sangre y otras muestras (casos Nº PK-71, PK-83, PK-91, PK-95 y PK-98; Números de Acceso OQ362109, OQ362107, OQ362112, OQ362113 y OQ362114).
 Figura 2. Árbol filogenético construido a partir de las secuencias completas de nucleótidos de DCH recuperadas en este estudio. El árbol filogenético de máxima verosimilitud se construyó con la adición de secuencias DCH disponibles en GenBank y demostró que nueve secuencias obtenidas en este estudio (etiquetadas con
Figura 2. Árbol filogenético construido a partir de las secuencias completas de nucleótidos de DCH recuperadas en este estudio. El árbol filogenético de máxima verosimilitud se construyó con la adición de secuencias DCH disponibles en GenBank y demostró que nueve secuencias obtenidas en este estudio (etiquetadas con  ) se agruparon en dos linajes diferentes.
) se agruparon en dos linajes diferentes.
Discusión
Se ha descrito durante mucho tiempo que los hepadnavirus están asociados con enfermedades hepáticas crónicas en algunas especies, incluidos los humanos y las marmotas (17, 18). En 2018, se descubrió por primera vez un nuevo hepadnavirus en gatos, tentativamente llamado DCH (4). Hasta la fecha, se han realizado varios estudios para investigar el potencial de patogenicidad de DCH en especies felinas, y se ha sugerido una asociación entre la infección por DCH y los trastornos hepáticos en gatos (5, 6, 9, 11). El papel potencial de DCH en los gatos domésticos, por lo tanto, no puede ser descuidado.
En los seres humanos, la transmisión horizontal desempeña un papel contributivo en el creciente número de infecciones por VHB, y la preocupación por la transmisibilidad del VHB de varias muestras de fluidos corporales distintos de la sangre ha aumentado en la última década (12, 19). Esta preocupación se destacó especialmente en entornos donde el contacto cercano con pacientes con infección crónica que no mostraban signos clínicos aparentes era inevitable, como en guarderías infantiles o escuelas preliminares (12, 13). En consecuencia, la detección de ADN del VHB en varias muestras de fluidos corporales distintos de la sangre, incluidos cerumen, sudor, hisopo nasofaríngeo, orina, saliva y lágrimas, se ha informado en numerosos estudios (3, 12, 14, 15, 20, 21). En contraste con la amplia evidencia que demuestra la detección de ADN del VHB en varias muestras de fluidos corporales de pacientes infectados, hasta la fecha, no ha habido ningún informe sobre la detección de ADN DCH en muestras de fluidos corporales que no sean sangre en gatos, aunque tal investigación se intentó en un estudio anterior (16). En este estudio, por lo tanto, investigamos la detección de ADN DCH en muestras de sangre y otros fluidos corporales de gatos. En particular, nuestro resultado mostró que el ADN DCH podría detectarse en varias muestras de fluidos corporales, incluida la sangre, AS, NS, OS y RS, mientras que no se observó una detección positiva en la orina. El bajo número de muestras de orina disponibles podría explicar la ausencia de positividad DCH de la muestra de orina en este estudio, sin embargo, la detección de otros hepadnavirus a partir de muestras de orina se ha documentado en varios estudios (22, 23).
La prevalencia de ADN DCH detectado en muestras clínicas en este estudio varió de 1,14 a 4,70%, con la prevalencia más baja observada en las muestras NS y la mayor prevalencia obtenida de la sangre. En el VHB, se ha evidenciado una detección más amplia de ADN viral en varias muestras de fluidos corporales en varios estudios, y la saliva y el semen primero demostraron experimentalmente que eran infecciosos (20). Más tarde, un experimento in vivo mostró que las lágrimas de los pacientes con infección crónica también se consideran altamente infecciosas (12). Con respecto al riesgo de transmisión horizontal del VHB desde varias rutas distintas de la sangre, con la adición de la tendencia creciente de entornos de múltiples gatos donde las peleas y el contacto cercano entre gatos son inevitables, la detección de ADN DCH en varios especímenes en este estudio es fascinante. Sin embargo, hasta qué punto el ADN DCH detectable de varias rutas desempeña un papel en la infectividad y la transmisión horizontal en las poblaciones de gatos, requiere más estudios experimentales.
El potencial infeccioso de los hepadnavirus también se correlaciona directamente con la carga viral expresada en las muestras (12). En este estudio, la carga viral media de DCH detectada en la sangre, AS, NS, OS y RS fue de >6 LC/mL, mientras que en el VHB, se ha descrito que los fluidos corporales que contienen ADN del VHB > 5 LC/mL tienen el potencial de ser vehículos de transmisión, especialmente en áreas altamente endémicas (12, 14, 15). El riesgo infeccioso de fluidos corporales como la saliva y muestras de hisopado nasofaríngeo que contienen títulos altos de ADN HVB también se ha destacado en entornos multiindividuales, como aquellos en las cercanías de cuidado infantil donde la transmisión horizontal entre niños ha sido preocupante (24). Aunque el resultado en el que se detectó ADN DCH en títulos altos de varias muestras de fluidos corporales es intrigante, las implicaciones clínicas aún no se han explicado porque la prevalencia de DCH en este estudio también es menor en comparación con la observada en estudios previos en Tailandia (6).
En este estudio, debe tenerse en cuenta que aunque los procedimientos de recolección de muestras se realizaron con precaución adicional para prevenir cualquier trauma, no se pudo descartar la presencia de sangre de trauma y / o microtrauma previamente existente. Sin embargo, durante la prueba longitudinal de la muestra, las muestras de SG recolectadas del número de gato PK-71 revelaron positividad recurrente del ADN DCH (en la cuarta prueba) junto con el aumento del nivel de ADN en la sangre y luego fueron negativas nuevamente en la siguiente prueba con una disminución del nivel de ADN en la sangre (Tabla 3). Por lo tanto, la presencia de ADN DCH en muestras de fluidos corporales distintos de la sangre en este caso podría indicar la propagación hematógena del ADN DCH. Este resultado concuerda con la evidencia en humanos que muestra que el ADN viral del VHB puede estar presente de forma independiente en las muestras de cerumen sin ninguna contaminación de la sangre, ya que descartaron la presencia de sangre en las muestras recolectadas utilizando una prueba de Meyer específica (21).
También vale la pena señalar que de 14 gatos en los que se disponía de varias muestras además de la sangre, la detección de ADN DCH en el OS, RS, NS y AS solo se observó en el grupo que contenía más de 7 LC / ml en la sangre, mientras que no se observó ninguna detección en el grupo donde el ADN DCH en la sangre osciló entre 5 y 7 LC / ml o menos. Un estudio previo que investigó la presencia de ADN DCH en hisopos orales, conjuntivales, prepuciales y rectales también reveló resultados negativos en todas las muestras recolectadas de gatos con niveles de ADN DCH en la sangre que van de 5.2 a 6.3 LC / ml (16). En consecuencia, hubo correlaciones positivas entre el nivel de ADN DCH en la sangre y la detección en muestras de SG y RS. Estadísticamente, este estudio reveló que los gatos con viremia DCH con niveles de ADN DCH en la sangre superiores a 7 LC / ml tienen 3.5 y 4 veces más probabilidades de expresar ADN DCH en muestras de SG y RS, respectivamente. El resultado en este estudio planteó evidencia de apoyo que refleja la característica del VHB, donde se ha documentado una correlación entre la presencia de altos niveles de ADN del VHB en el suero con la presencia de ADN del VHB en otros fluidos corporales como cerumen, saliva, hisopo nasofaríngeo, lágrimas y sudor en humanos infectados crónicamente (12, 21, 24–26). El aumento del nivel de ADN del VHB en la sangre de los pacientes con infección crónica por el VHB se observa comúnmente durante el período de reactivación del VHB debido a diversas causas subyacentes que promueven afecciones inmunosupresoras, como la infección previa por el virus de la inmunodeficiencia humana, las enfermedades crónicas, la intervención terapéutica y / o la quimioterapia, y la respuesta inmune inadecuada del huésped (27). En este estudio, la correlación directa entre las presentaciones clínicas y el estado de inmunosupresión de los gatos con niveles de ADN DCH en el suero no se pudo establecer debido a la historia limitada en el momento de la recolección de la muestra y justifica una investigación adicional.
En contraste con la SG y la RS, no hubo correlación positiva entre la carga viral en la sangre con la detección de ADN DCH en las muestras de AS. Este resultado podría representar el número real de detecciones en las muestras, que era muy bajo, y/o podría deberse al número limitado de muestras. En cuanto a la asociación entre la carga viral de DCH en la sangre con la presencia de ADN de DCH en la muestra NS, no se pudo determinar la correlación debido a la falta de disponibilidad de la muestra. Debido a que este es el único estudio que describe la detección de ADN DCH en varias muestras de fluidos corporales distintos de la sangre en gatos, se necesitan estudios epidemiológicos más amplios para dilucidar aún más la correlación entre la presencia de títulos virales altos en la sangre y la expresión de ADN DCH en otros fluidos corporales en gatos.
Además, este estudio reveló que cuatro de cada cinco gatos incluidos en el estudio longitudinal permanecieron positivos para la detección de ADN DCH en la sangre durante toda la línea de tiempo de recolección de muestras, que van desde 1 a 4 meses. La detección longitudinal de ADN DCH en la sangre también se documentó en un estudio previo realizado por Capozza et al., quienes detectaron ADN DCH en la sangre de un gato DCH positivo durante 11 meses (16). La detección del ADN del VHB en suero implica cierta importancia clínica en humanos, incluido el diagnóstico de reactividad en la infección crónica, así como un predictor de riesgo independiente del desarrollo de CHC cuando se combina con la observación de alanina aminotransferasa y aspartato aminotransferasa (28, 29).
Finalmente, el análisis filogenético en este estudio reveló que todas las secuencias completas del genoma obtenidas de muestras de sangre, OS y RS mostraron un alto porcentaje de identidad entre sí. Además, no hubo una distancia genómica significativa entre las secuencias genómicas completas obtenidas de casos en los que el ADN DCH estaba presente solo en la sangre, en comparación con los casos con detección de DCH en sangre y otras vías. Este resultado sugiere que la diversidad genómica probablemente no jugaría un papel en la positividad del ADN DCH en otras muestras de fluidos corporales. El resultado en este estudio apoya un resultado previo en el que se detectó ADN del VHB en saliva e hisopos nasofaríngeos de niños con infección crónica, pero no se presentó una diferencia genotípica del VHB en estos pacientes (24). Aunque los diferentes genotipos del VHB promueven una progresión diferente de la enfermedad, es poco probable que afecten la expresión del ADN viral en las muestras de fluidos corporales (30).
En conclusión, este estudio reveló la detección de ADN DCH en varias muestras de fluidos corporales de gatos, incluyendo la sangre, AS, NS, OS y RS. El riesgo de que los gatos expresaran ADN DCH en la SG y RS fue significativamente mayor cuando el nivel de ADN DCH presentado en la sangre fue de >7 LC/ml. El nivel relativamente alto de ADN DCH en varias muestras además de la sangre podría representar la verdadera expresión del ADN viral o la presencia de sangre debido a un trauma durante o antes de la recolección de la muestra. Sin embargo, de acuerdo con la correlación directa entre el nivel de ADN en las muestras y el potencial de transmisibilidad, no se puede descuidar el riesgo infeccioso de varias muestras, si lo hay. La detección de ADN DCH en rutas más amplias no se asoció con ninguna diversidad genómica. Hasta qué punto la expresión del ADN DCH en varias muestras de fluidos corporales de gatos desempeña un papel en la transmisión horizontal en las poblaciones de gatos justifica una mayor investigación.
Declaración de disponibilidad de datos
Los conjuntos de datos presentados en este estudio se pueden encontrar en repositorios en línea. Los nombres del repositorio o repositorios y los números de acceso se pueden encontrar a continuación: https://www.ncbi.nlm.nih.gov/; OQ362106—OQ362114.
Declaración ética
Los estudios en animales fueron aprobados por el Comité Institucional de Bioseguridad de la Universidad de Chulalongkorn (IBC No. 2131001) y el Protocolo de Cuidado y Uso de Animales de la Universidad de Chulalongkorn (CU-ACUP No. 2131004). Los estudios se realizaron de acuerdo con la legislación local y los requisitos institucionales. Se obtuvo el consentimiento informado por escrito de los propietarios para la participación de sus animales en este estudio.
Contribuciones del autor
CP y ST diseñaron la investigación y finalizaron el manuscrito. SWW realizó los experimentos, analizó el resultado y escribió el primer borrador del manuscrito. PT realizó análisis estadísticos. Todos los autores leyeron y aprobaron el manuscrito final.
Financiación
SWW fue apoyado por el Second Century Fund (C2F), Universidad de Chulalongkorn. El POP fue apoyado por el Fondo Ratchadapisek Somphot para Becas Postdoctorales, Universidad de Chulalongkorn. ST fue parcialmente apoyado por el Consejo Nacional de Investigación de Tailandia (NRCT): R. Thanawongnuwech NRCT Senior scholar 2022 #N42A650553. Esta investigación fue financiada por el Consejo Nacional de Investigación de Tailandia (NRCT) (N41A640175) (a CP) y la Subvención para la Financiación Conjunta del Proyecto de Investigación Externa y el Fondo de Investigación de Ciencias Veterinarias (RES_65_005_31_005), la Universidad de Chulalongkorn (a CP) y el 90 aniversario del Fondo de la Universidad de Chulalongkorn (Fondo de Dotación Ratchadaphiseksomphot) (a SWW).
Conflicto de intereses
Los autores declaran que la investigación se llevó a cabo en ausencia de cualquier relación comercial o financiera que pudiera interpretarse como un posible conflicto de intereses.
Nota del editor
Todas las afirmaciones expresadas en este artículo son únicamente las de los autores y no representan necesariamente las de sus organizaciones afiliadas, o las del editor, los editores y los revisores. Cualquier producto que pueda ser evaluado en este artículo, o reclamo que pueda ser hecho por su fabricante, no está garantizado ni respaldado por el editor.
Material complementario
El material complementario para este artículo se puede encontrar en línea en: https://www.frontiersin.org/articles/10.3389/fvets.2023.1248445/full#supplementary-material
Referencias
1. Tsukuda S, Watashi K. Biología y ciclo de vida del virus de la hepatitis B. Antiviral Res. (2020) 182:104925. doi: 10.1016/j.antiviral.2020.104925
Resumen de PubMed | Texto completo de CrossRef | Google Académico
2. Karayiannis P. Virus de la hepatitis B: virología, biología molecular, ciclo de vida y propagación intrahepática. Hepatol Int. (2017) 11:500–8. DOI: 10.1007/S12072-017-9829-7
Resumen de PubMed | Texto completo de CrossRef | Google Académico
3. Meo SA, Assad AA, Sanie FM, Baksh ND, Al-Qahtani A, Shaikh ZA. Transmisión del virus de la hepatitis B a través de antígenos del grupo sanguíneo salival en la saliva. J Coll Médicos Surg Pak. (2010) 20:444–8.
4. Aghazadeh M, Shi M, Barrs VR, McLuckie AJ, Lindsay SA, Jameson B, et al. Un nuevo hepadnavirus identificado en un gato doméstico inmunocomprometido en Australia. Virus. (2018) 10:269. DOI: 10.3390/v10050269
Resumen de PubMed | Texto completo de CrossRef | Google Académico
5. Pesavento PA, Jackson K, Hampson TSTTB, Munday JS, Barrs VR, Beatty JA. Un nuevo hepadnavirus se asocia con hepatitis crónica y carcinoma hepatocelular en gatos. Virus. (2019) 11:969. DOI: 10.3390/v11100969
Resumen de PubMed | Texto completo de CrossRef | Google Académico
6. Piewbang C, Wardhani SW, Chaiyasak S, Yostawonkul J, Chai-in P, Boonrungsiman S, et al. Información sobre la diversidad genética, la recombinación y las infecciones sistémicas con evidencia de maduración intracelular del hepadnavirus en gatos. PLoS ONE. (2020) 15:E0241212. doi: 10.1371/journal.pone.0241212
Resumen de PubMed | Texto completo de CrossRef | Google Académico
7. Anpuanandam K, Selvarajah GT, Choy MMK, Ng SW, Kumar K, Ali RM, et al. Detección molecular y caracterización del Hepadnavirus del Gato Doméstico (DCH) a partir de tejidos sanguíneos y hepáticos de gatos en Malasia. BMC Vet Res. (2021) 17:9. DOI: 10.1186/S12917-020-02700-0
Resumen de PubMed | Texto completo de CrossRef | Google Académico
8. Jeanes EC, Wegg ML, Mitchell JA, Priestnall SL, Fleming L, Dawson C. Comparación de la prevalencia de Hepadnavirus del gato doméstico en una población de gatos con uveítis y en una población sana de gatos donantes de sangre en el Reino Unido. veterinario, oftalmol. (2022) 25:165–72. DOI: 10.1111/vop.12956
Resumen de PubMed | Texto completo de CrossRef | Google Académico
9. Piewbang C, Dankaona W, Poonsin P, Yostawonkul J, Lacharoje S, Sirivisoot S, et al. Hepadnavirus del gato doméstico asociado con hepatopatía en gatos: un estudio retrospectivo. J Vet Pasante Med. (2022) 36:1648–59. DOI: 10.1111/JVIM.16525
Resumen de PubMed | Texto completo de CrossRef | Google Académico
10. Takahashi K, Kaneko Y, Shibanai A, Yamamoto S, Katagiri A, Osuga T, et al. Identificación del hepadnavirus del gato doméstico a partir de una muestra de sangre de gato en Japón. J Vet Med Sci. (2022) 84:648–52. DOI: 10.1292/JVMS.22-0010
Resumen de PubMed | Texto completo de CrossRef | Google Académico
11. Lanave G, Capozza P, Diakoudi G, Catella C, Catucci L, Ghergo P, et al. Identificación de hepadnavirus en sueros de gatos. (2019) 9:10668. DOI: 10.1038/S41598-019-47175-8
Resumen de PubMed | Texto completo de CrossRef | Google Académico
12. Komatsu H, Inui A, Sogo T, Tateno A, Shimokawa R, Fujisawa T. Las lágrimas de niños con infección crónica por el virus de la hepatitis B (VHB) son vehículos infecciosos de transmisión del VHB: transmisión experimental del VHB por lágrimas, utilizando ratones con hígados humanos quiméricos. J Infectar Dis. (2012) 206:478–85. doi: 10.1093/infdis/jis293
Resumen de PubMed | Texto completo de CrossRef | Google Académico
13. Heiberg IL, Hoegh M, Ladelund S, Niesters HGM, Hogh B. ADN del virus de la hepatitis B en saliva de niños con infección crónica por hepatitis B: implicaciones para la saliva como un modo potencial de transmisión horizontal. J Pediatr Infect Dis. (2010) 29:465–7. doi: 10.1097/INF.0b013e3181d8e009
Resumen de PubMed | Texto completo de CrossRef | Google Académico
14. Gholami-Parizad E, Taherikalani M, Mozaffar-Sabet NA, Asmar M, Gholami-Parizad S, Khosravi A, et al. El cerumen como riesgo potencial de transmisión del virus de la hepatitis B. Acta Microbiol Immunol colgado. (2011) 58:105–12. doi: 10.1556/amicr.58.2011.2.3
Resumen de PubMed | Texto completo de CrossRef | Google Académico
15. Gholami Parizad E, Gholami Parizad E, Khosravi A, Amraei M, Valizadeh A, Davoudian A. Comparación de la carga viral del VHB en suero, cerumen y saliva y correlación con el estado sérico de HBeAg en pacientes con infección crónica por hepatitis B. Hepat Mon. (2016) 16:E30385. doi: 10.5812/hepatmon.30385
Resumen de PubMed | Texto completo de CrossRef | Google Académico
16. Capozza P, Lanave G, Diakoudi G, Stasi F, Ghergo P, Ricci D, et al. Un estudio observacional longitudinal en dos gatos infectados naturalmente con hepadnavirus. Veterinario Microbiol. (2021) 254:108999. doi: 10.1016/j.vetmic.2021.108999
Resumen de PubMed | Texto completo de CrossRef | Google Académico
17. Ryu W-S. Capítulo 18 – Hepadnavirus. En: Ryu W-S, editor. Virología molecular de virus patógenos humanos. Boston, MA: Academic Press (2017). págs. 247–60.
18. Hu K-Q. Hepadnavirus: características virológicas y clínicas. Módulo de Referencia en Ciencias Biomédicas. Ámsterdam: Elsevier (2019). págs. 1–9.
19. Komatsu H, Inui A, Sogo T, Hiejima E, Kudo N, Fujisawa T. Fuente de transmisión en niños con infección crónica por hepatitis B después de la implementación de una estrategia para la prevención en aquellos con alto riesgo. Hepatol Res. (2009) 39:569–76. doi: 10.1111/j.1872-034X.2009.00496.x
Resumen de PubMed | Texto completo de CrossRef | Google Académico
20. Scott RM, Snitbhan R, Bancroft WH, Alter HJ, Tingpalapong M. Transmisión experimental del virus de la hepatitis B por semen y saliva. J Infectar Dis. (1980) 142:67–71. doi: 10.1093/infdis/142.1.67
Resumen de PubMed | Texto completo de CrossRef | Google Académico
21. Eftekharian A, Moghaddasi H, Gachkar L, Amlashi SSA. Detección del virus de la hepatitis B en el cerumen de pacientes con infección crónica por hepatitis B. J Laryngol Otol. (2013) 127:1065–6. doi: 10.1017/S0022215113002314
Resumen de PubMed | Texto completo de CrossRef | Google Académico
22. Jain S, Su Y-H, Su Y-P, McCloud S, Xue R, Lee T-J, et al. Caracterización del ADN del virus de la hepatitis B detectado en orina de pacientes con hepatitis B crónica. BMC Gastroenterol. (2018) 18:40. DOI: 10.1186/S12876-018-0767-1
Resumen de PubMed | Texto completo de CrossRef | Google Académico
23. Lin SY, Su YP, Trauger ER, Song BP, Thompson EGC, Hoffman MC, et al. Detección de secuencias de unión virus-huésped de la hepatitis B en orina de pacientes infectados. Hepatol Commun. (2021) 5:1649–59. DOI: 10.1002/HEP4.1783
Resumen de PubMed | Texto completo de CrossRef | Google Académico
24. Kidd-Ljunggren K, Holmberg A, Bläckberg J, Lindqvist B. High levels of hepatitis B virus DNA in body fluids from chronic carriers. J Hosp Infectar. (2006) 64:352–7. doi: 10.1016/j.jhin.2006.06.029
Resumen de PubMed | Texto completo de CrossRef | Google Académico
25. Kalcioglu MT, Durmaz R, Ozturan O, Bayindir Y, Direkel S. ¿El cerumen tiene riesgo de transmisión de la hepatitis B? Laringoscopio. (2004) 114:577–80. doi: 10.1097/00005537-200403000-00035
Resumen de PubMed | Texto completo de CrossRef | Google Académico
26. Goh EK, Son BH, Kong SK, Chon KM, Cho KS. Análisis del virus de la hepatitis B en el cerumen y la otorrea de pacientes infectados crónicamente por el VHB: ¿existe una infectividad por el virus de la hepatitis B? Otol Neurotol. (2008) 29:929–32. doi: 10.1097/MAO.0b013e31817fdfc3
Resumen de PubMed | Texto completo de CrossRef | Google Académico
27. Chang Y, Jeong SW, Jang JY. Reactivación del virus de la hepatitis B asociada a intervenciones terapéuticas. Front Med. (2022) 8:770124. DOI: 10.3389/FMED.2021.770124
Resumen de PubMed | Texto completo de CrossRef | Google Académico
28. Chen CF, Lee WC, Yang HI, Chang HC, Jen CL, Iloeje UH, et al. Los cambios en los niveles séricos de ADN del VHB y alanina aminotransferasa determinan el riesgo de carcinoma hepatocelular. Gastroenterología. (2011) 141:1240–8.e2. doi: 10.1053/j.gastro.2011.06.036
Resumen de PubMed | Texto completo de CrossRef | Google Académico
29. Xu X, Jiang J, Song C, Yu C, Zhu L, Qian J, et al. Asociación de cambios dinámicos en los niveles séricos de ADN del VHB y riesgo de carcinoma hepatocelular. Curr Med. (2022) 1:5. DOI: 10.1007/S44194-022-00008-9
30. Sunbul M. Genotipos del virus de la hepatitis B: distribución global e importancia clínica. Mundo J Gastroenterol. (2014) 20:5427–34. doi: 10.3748/wjg.v20.i18.5427
Resumen de PubMed | Texto completo de CrossRef | Google Académico
Palabras clave: DCH, muestras de fluidos corporales, detección, transmisión horizontal, rutas de desprendimiento
Cita: Wardhani SW, Tummaruk P, Piewbang C y Techangamsuwan S (2023) Cuantificación del ADN del hepadnavirus del gato doméstico en varios especímenes de fluidos corporales de gatos: las posibles rutas de diseminación viral. Frente. Vet. Sci. 10:1248445. doi: 10.3389/fvets.2023.1248445
Recibido: 27 de junio de 2023; Aprobado: 21 de agosto de 2023;
Publicado: 04 septiembre 2023.
Editado por:
Shixing Yang, Universidad de Jiangsu, China
Revisado por:
Mario Frías, Instituto de Investigaciones Biomédicas Maimónides de Córdoba (IMIBIC), España
Xiaochun Wang, Universidad de Jiangsu, China
Derechos de autor © 2023 Wardhani, Tummaruk, Piewbang y Techangamsuwan. Este es un artículo de acceso abierto distribuido bajo los términos de la Licencia de Atribución Creative Commons (CC BY).
*Correspondencia: Chutchai Piewbang, alkaline_eart@hotmail.com; Somporn Techangamsuwan, somporn.t@chula.ac.th
†Estos autores han contribuido igualmente a este trabajo
Renuncia: Todas las afirmaciones expresadas en este artículo son únicamente las de los autores y no representan necesariamente las de sus organizaciones afiliadas, o las del editor, los editores y los revisores. Cualquier producto que pueda ser evaluado en este artículo o reclamo que pueda ser hecho por su fabricante no está garantizado ni respaldado por el editor.
Date de alta y recibe nuestro 👉🏼 Diario Digital AXÓN INFORMAVET ONE HEALTH
Date de alta y recibe nuestro 👉🏼 Boletín Digital de Foro Agro Ganadero
Noticias animales de compañía
Noticias animales de producción
Trabajos técnicos animales de producción
Trabajos técnicos animales de compañía