Integración farmacocinética/farmacodinámica de tilmicosina contra Pasteurella multocida en un modelo de jaula de tejido de lechón

Integración farmacocinética/farmacodinámica de tilmicosina contra Pasteurella multocida en un modelo de jaula de tejido de lechón
 Yuqin Chen
Yuqin Chen Xuan Ji
Xuan Ji  Suiling Zhang Wenxiang Wang
Suiling Zhang Wenxiang Wang  Huilin Zhang
Huilin Zhang 
 Huanzhong Ding*
Huanzhong Ding*- Laboratorio clave de Guangdong para el desarrollo de medicamentos veterinarios y evaluación de la seguridad, Facultad de Medicina Veterinaria, Universidad Agrícola del Sur de China, Guangzhou, China
La tilmicosina es un macrólido semisintético para uso veterinario con un fuerte efecto antibacteriano sobre las bacterias respiratorias. En este estudio, se evaluó la integración farmacocinética/farmacodinámica (PK/PD) de tilmicosina contra Pasteurella multocida (P. multocida) mediante el establecimiento de un modelo de infección en jaulas de tejido de lechones. Se monitorizó la concentración de tilmicosina y el número bacteriano de P. multocida en el líquido de la jaula de tejido. Después de que la población de P. multocida era igual o superior a 107 UFC/ml en una jaula de tejido, los lechones recibieron una administración oral de tilmicosina a una dosis de 30, 40, 50 y 60 mg/kg de peso corporal, una vez al día durante 3 días, respectivamente. Las bacterias se contaron cada 24 h después de la administración del fármaco y a las 48 y 72 h después de la última administración. Una E sigmoidal.max se utilizó para ajustar la relación entre los parámetros PK/PD y el efecto antibacteriano. AUC24h/CMI fue el mejor índice PK/PD que se correlacionó con la efectividad de la tilmicosina contra P. multocida. La magnitud de las AUC24h/CMI requerida para reducciones continuas de 1/3 log, 1/2-log y 3/4-log fueron 19,65 h, 23,86 h y 35,77 h, respectivamente, durante cada período de tratamiento de 24 h. En este estudio, cuando la dosis fue de >50 mg/kg, el AUC24h/CMI seguía siendo >35,77 h en el período de 24-48 h después de la última administración debido a la lenta eliminación, es decir, la tilmicosina exhibió un potente efecto antibacteriano contra P. multocida después de tres administraciones diarias sucesivas. Los datos proporcionan una guía significativa para optimizar los regímenes de tilmicosina para tratar las infecciones del tracto respiratorio causadas por P. multocida.
1. Introducción
Pasteurella multocida (P. multocida) causó enfermedades infecciosas agudas como septicemia hemorrágica o neumonía infecciosa en varios animales. La infección a menudo se acompañaba del riesgo de otras bacterias, causando el complejo de enfermedad respiratoria porcina (PRDC). Los serotipos múltiples y la tipificación compleja dificultan la prevención y el control mediante la vacuna (1). La tilmicosina es un macrólido sintetizado a partir de tilosina, que mostró una fuerte actividad antibacteriana contra Actinobacillus pleuropneumoniae, P. multocida y Mycoplasma (2-4).
La farmacocinética de la tilmicosina se caracterizó por una rápida absorción, una eliminación lenta y un gran volumen aparente de distribución (Vd). Además, la mayor concentración en los pulmones en relación con el plasma lo convierte en una valiosa opción de tratamiento para las infecciones respiratorias. Según Zhang et al. (5), el C.max de tilmicosina en los tejidos pulmonares fue 14,28 veces mayor que en el plasma en pollos. En conejos, las concentraciones alcanzadas en el tejido pulmonar superaron a las del plasma en 7 veces después del segundo día de tratamiento (6). Foster et al. (7) determinaron que en terneros, la concentración de tilmicosina en muestras de lavado broncoalveolar excedió la concentración plasmática en un 776%. El medio tiempo de absorción (T1/ka) y la vida media de eliminación (T1/2kel) de tilmicosina en cerdos sanos fueron de 2,27 h y 43,53 h después de la administración oral, respectivamente, y de 1,64 h y 20,69 h en otro estudio (8, 9). La Vd en cerdos fue de 48,36 L/kg después de una sola administración oral y el Vd tanto en ovejas como en bovinos fueron de 25,0 L/kg cuando se normalizó el peso corporal del animal, lo que indica la extensa distribución tisular de tilmicosina (10, 11).
Los estudios indicaron que la tilmicosina exhibió una mayor eficacia en el tratamiento de la infección del tracto respiratorio bovino en comparación con la oxitetraciclina (12). El alimento mixto con tilmicosina se usaba a menudo para tratar y prevenir enfermedades respiratorias en cerdos. Sin embargo, el uso irracional de antimicrobianos conduce a una resistencia adquirida severa de las bacterias, lo que resulta en el fracaso del tratamiento (13). El análisis PK/PD podría describir la relación entre la cinética y el efecto para establecer regímenes de dosificación racionales de agentes antimicrobianos. El modelado PK / PD en medicina veterinaria se puede utilizar para definir la relación entre las concentraciones, el tiempo y los resultados terapéuticos para describir más verdaderamente la relación dinámica entre medicamentos, huéspedes y patógenos. El modelo de jaula de tejido es un método común para estudiar PK/PD in vivo. Una jaula de tejido hecha de tubo de silicona, de pequeño volumen, es adecuada para animales con piel apretada, principalmente cerdos. El modelo se ha utilizado para estudiar la integración PK/PD de cefquinoma y tulatromicina en P. multocida in vivo (14, 15). Por lo tanto, es de gran importancia estudiar la farmacocinética y farmacodinamia de la tilmicosina contra P. multocida en cerdos para garantizar el uso racional de los fármacos.
Para los cerdos, es difícil obtener las concentraciones del fármaco y la carga bacteriana en el tejido diana en los pulmones de P. multocida en la fección. El modelo de jaula de tejido es un modelo ideal para estudiar la relación entre los parámetros PK/PD y el efecto antibacteriano, que considera la interacción del fármaco, el huésped y el patógeno. El objetivo del estudio fue determinar la relación entre los índices farmacocinéticos/farmacodinámicos y la eficacia antibacteriana de la tilmicosina contra P. multocida. Además, los hallazgos podrían informar el desarrollo de regímenes de dosificación de tilmicosina para el tratamiento de enfermedades respiratorias causadas por la infección por P. multocida.
2. Materiales y métodos
2.1. Cepas bacterianas, antimicrobianos y productos químicos
La cepa C44-15 (serovar D:7) de P. multocida se obtuvo del Instituto de Control de Medicamentos Veterinarios de China (Beijing, China). El fosfato de timicosina con una pureza del 80,4% (tilmicosina) fue proporcionado por Guangdong Dahuanong Animal Health Products (Guangdong, China). El pentobarbital sódico fue comprado a Xiangbo Biotechnology Co., Ltd. El clorhidrato de procainamida fue suministrado por Shangdong Fangming pharmaceutical Co., Ltd. El caldo de soja tríptico (TSB) y el agar de soja tríptico (TSA) se compraron a Guangdong Huankai Microbial Technology (Guangzhou, China). El suero bovino recién nacido fue suministrado por Guangzhou Ruite Biotechnology (Guangzhou, China).
2.2. Modelo de infección por animales y jaulas de tejidos
El estudio utilizó 10 lechones cruzados sanos (Duroc × Landrace × Yorkshire) que pesaban entre 25 y 30 kg adquiridos en la granja porcina de raza fina de Guangzhou. Los lechones recibieron alimento y agua libres de antibióticos en el transcurso del experimento. Todos los procedimientos experimentales que involucran a los animales fueron aprobados por el Comité de Ética de los Animales de la Universidad Agrícola del Sur de China (número de aprobación: 2018A001).
Las especificaciones y los procedimientos de implantación quirúrgica para las jaulas tisulares (CT) coincidieron con los descritos anteriormente (16). Los TC se construyeron a partir de tubos de silicona de grado alimenticio que miden 65 mm de longitud, 13 mm de diámetro interior y 18 mm de diámetro exterior. Se hicieron doce agujeros en cada extremo de los tubos. Los CT se implantaron quirúrgicamente bajo anestesia general inducida por pentobarbital sódico y anestesia local con clorhidrato de procainamida. Se insertaron TC estériles por vía subcutánea a ambos lados del cuello de los cerdos, colocados equidistantemente entre la vena yugular y la médula espinal. Después de la cirugía, los sitios de incisión se trataron con penicilina y ungüento de tetraciclina durante 3-5 días para prevenir la infección. Después de un período de recuperación de 4 semanas, los TC contenían líquido claro y amarillo de la jaula de la jaula (TCF). El TCF se recolectó para pruebas bacteriológicas, y se utilizaron TC libres de bacterias para el experimento.
Los CT estériles fueron inoculados con 1 mL de una suspensión de P. multocida que contenía aproximadamente 1,5 × 108 UFC/ml. Después de 48 h de incubación, se extrajeron 0,5 ml de TCF de cada jaula de tejido para cuantificar las bacterias. CTs con recuentos bacterianos alrededor de 107 Se seleccionaron UFC/ml para su uso en el experimento posterior.
2.3. Determinación de la concentración inhibitoria mínima
La CMI de tilmicosina frente a P. multocida se determinó mediante una técnica de microdilución siguiendo las directrices del Clinical and Laboratory Standards Institute (CLSI, 2013). El valor de CMI se derivó de TSB suplementado con suero de ternera al 5% y cultivos de TCF.
2.4. Diseño experimental y recogida de muestras
Diez lechones se dividieron aleatoriamente en cuatro grupos de tratamiento (dos lechones y cuatro jaulas de tejidos cada grupo) y un grupo de control (infectados pero no tratamiento). Un cerdo macho y una hembra estaban contenidos en cada grupo. Cada grupo de tratamiento se administró por vía oral con tilmicosina en las dosis de 30, 40, 50 y 60 mg / kg respectivamente, una vez al día durante 3 días. El grupo control fue tratado con la misma cantidad de solución salina normal.
Para la farmacocinética, se obtuvieron alrededor de 0,5 ml de TCF a las 1, 3, 6, 9, 12 y 24 h después de cada administración, y se recogieron muestras adicionales a las 48 y 72 h después de la dosis final. Las muestras se sometieron a centrifugación a 3000 × g durante 10 minutos para eliminar las partículas y se mantuvieron congeladas a -20 ° C hasta que se analizaron.
Para la farmacodinámica, se recogieron aproximadamente 0,1 ml de TCF para el recuento bacteriano a las 24 h después de cada administración y a las 48 y 72 h después de la última administración. La suspensión se diluyó en serie 10 veces en solución salina, con 100 μL utilizados inicialmente. Posteriormente, 20 μL de las diluciones se dispersaron en placas de agar y se incubaron durante 12 h para enumerar la población bacteriana.
2.5. Cuantificación de la tilmicosina en el líquido de la jaula tisular
La concentración de tilmicosina se midió mediante cromatografía líquida de alta resolución y pectrometría de masas en tándem (HPLC-MS/MS) utilizando un sistema de Agilent Technologies (Santa Clara, CA, Estados Unidos). La separación se logró en una C18 columna (150 mm × 2,0 mm, 5 μm; Phenomenex, Torrance, CA, Estados Unidos). La fase móvil consistió en la solución A (agua con 0,1% de ácido fórmico, V/V) y la solución B (acetonitrilo) a un caudal de 0,25 mL/min. El gradiente de elución fue: 0–1,5 min, 10% B; 1,5–6 min, 95% B; 6–6,5 min, 5% B; 6.5–12.5 min, 5% B. El volumen de inyección fue de 5 μL.
Se permitió que las muestras se descongelaran a temperatura ambiente antes del análisis. Se agregaron alícuotas de 200 μL de TCF a un tubo de microcentrífuga de 1,5 ml y luego se agregó acetonitrilo de igual volumen para precipitar la proteína. Después de vortexing durante 2 minutos y centrifugación a 12000 × g durante 10 min, el sobrenadante transparente se filtró a través de un filtro de jeringa de nylon de 0,22 μm (JinTeng Experiment Equipment Company) y luego se inyectó en un vial de muestreador automático. Se estableció una curva de calibración con concentraciones de tilmicosina (0,005-0,5 μg/ml). Los parámetros PK se calcularon utilizando el software WinNonlin versión 6.1 (Pharsight, Mountain View, CA, Estados Unidos).
2.6. Integración y modelización de PK/PD
Los parámetros PK/PD se calcularon en base a la farmacocinética individual de cada CT infectado tratado: AUC24h/MIC (AUC24h, área bajo la curva concentración-tiempo entre 0 y 24 h después de cada dosis), C.max/MIC (C.max, concentración máxima de tilmicosina después de cada dosis), y %T > CMI (el porcentaje de tiempo que la concentración de tilmicosina por encima de la CMI después de cada intervalo de dosificación). La relación entre los índices PK/PD y la eficacia se evaluó mediante el efecto máximo sigmoidal (E.max) Modelo PD. La fórmula era la siguiente:
Donde E representa el efecto antibacteriano, definido como el cambio en el recuento bacteriano (log10UFC/ml) durante un intervalo de dosificación de 24 h; E0 denota el cambio del recuento bacteriano en la muestra de control; E.max es el efecto antibacteriano máximo durante el intervalo de dosificación; Ce significa el valor de un índice PK/PD (C.max/MIC, AUC24h/MIC y %T > MIC); EC50 representa el valor del índice PK/PD que produce el 50% del efecto máximo; y N es el coeficiente de Hill que define la pendiente de la curva de efecto.
3. Resultados
3.1. Concentración inhibitoria mínima
Los valores de CMI de tilmicosina contra P. multocida (D:7) tanto en caldo TCF como TSB fueron de 0,25 μg/mL.
3.2. Farmacocinética de la tilmicosina en el modelo de infección tisular en jaulas de lechones
Los perfiles de concentración-tiempo de tilmicosina en TCF después de múltiples dosificaciones se representan en la Figura 1. Los valores medios para el AUC24h, C.maxy %T > CMI se presentan en la Tabla 1. El análisis farmacocinético se realizó utilizando métodos no compartimentales en el software WinNonlin. El AUC determinado24h varió de 3,57 ± 0,20 a 13,65 ± 0,38 μg h/ml. C.max Los valores se obtuvieron directamente de las curvas concentración-tiempo, abarcando 0,20 ± 0,03 a 0,63 ± 0,03 μg/mL. Los valores %T > CMI cubrieron un rango de 0 a 100%. En concreto, los valores de AUC de 24-48 h después de la dosis final a 30, 40, 50 y 60 mg/kg fueron 6,31 ± 0,51, 8,35 ± 0,36, 11,69 ± 0,33 y 12,87 ± 0,22 μg h/mL, respectivamente.
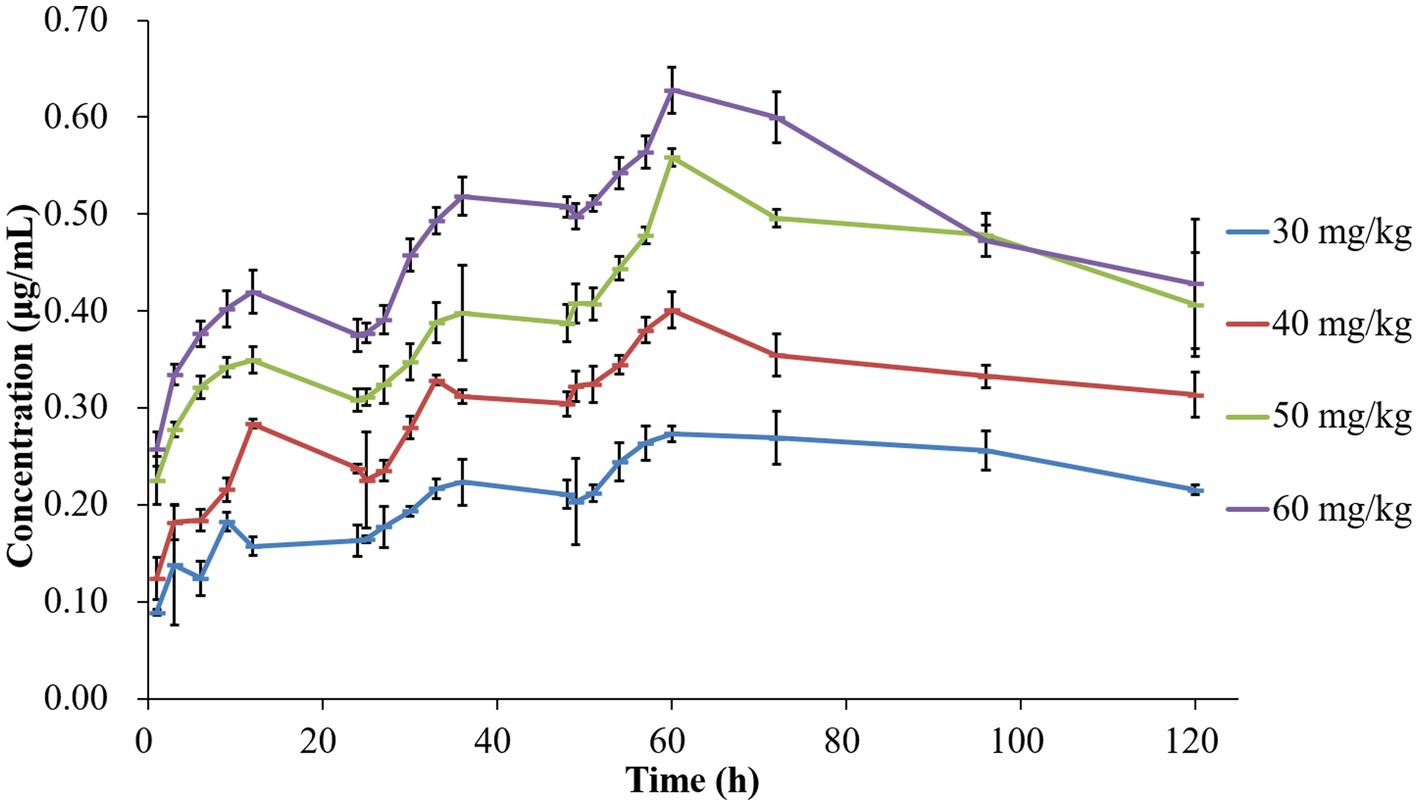 Figura 1. Curvas de concentración-tiempo de tilmicosina en jaulas de tejido infectado después de diferentes dosis múltiples de administración.
Figura 1. Curvas de concentración-tiempo de tilmicosina en jaulas de tejido infectado después de diferentes dosis múltiples de administración.
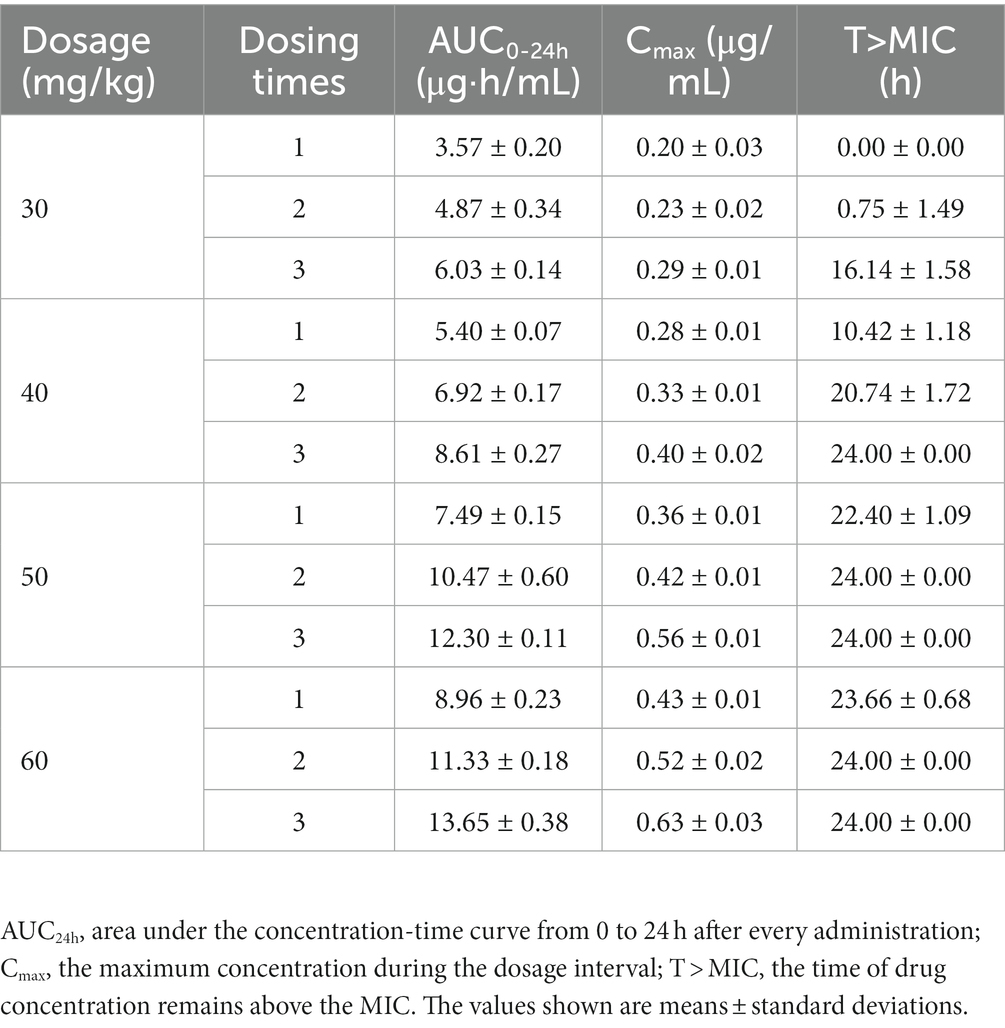 Tabla 1. Parámetros farmacocinéticos de tilmicosina en líquido de jaula tisular infectado después de administración múltiple.
Tabla 1. Parámetros farmacocinéticos de tilmicosina en líquido de jaula tisular infectado después de administración múltiple.
3.3. Estudios antibacterianos in vivo de tilmicosina contra Pasteurella multocida
Las curvas de tiempo de muerte representadas en la Figura 2 demuestran la eficacia antibacteriana de la tilmicosina contra P. multocida en el modelo de infección por jaulas de tejido de lechones a través de dosis variables. Los recuentos bacterianos para el grupo de control no tratado se mantuvieron alrededor de 107 UFC/ml. Después de la administración de tilmicosina a 30, 40, 50 y 60 mg/kg durante 3 días, las reducciones totales de bacterias (log10 UFC/ml) fueron 1,48 ± 0,13, 2,82 ± 0,10, 3,39 ± 0,11 y 3,52 ± 0,15, respectivamente. La tilmicosina exhibió actividad bactericida a dosis de 50 y 60 mg/kg después de múltiples administraciones.
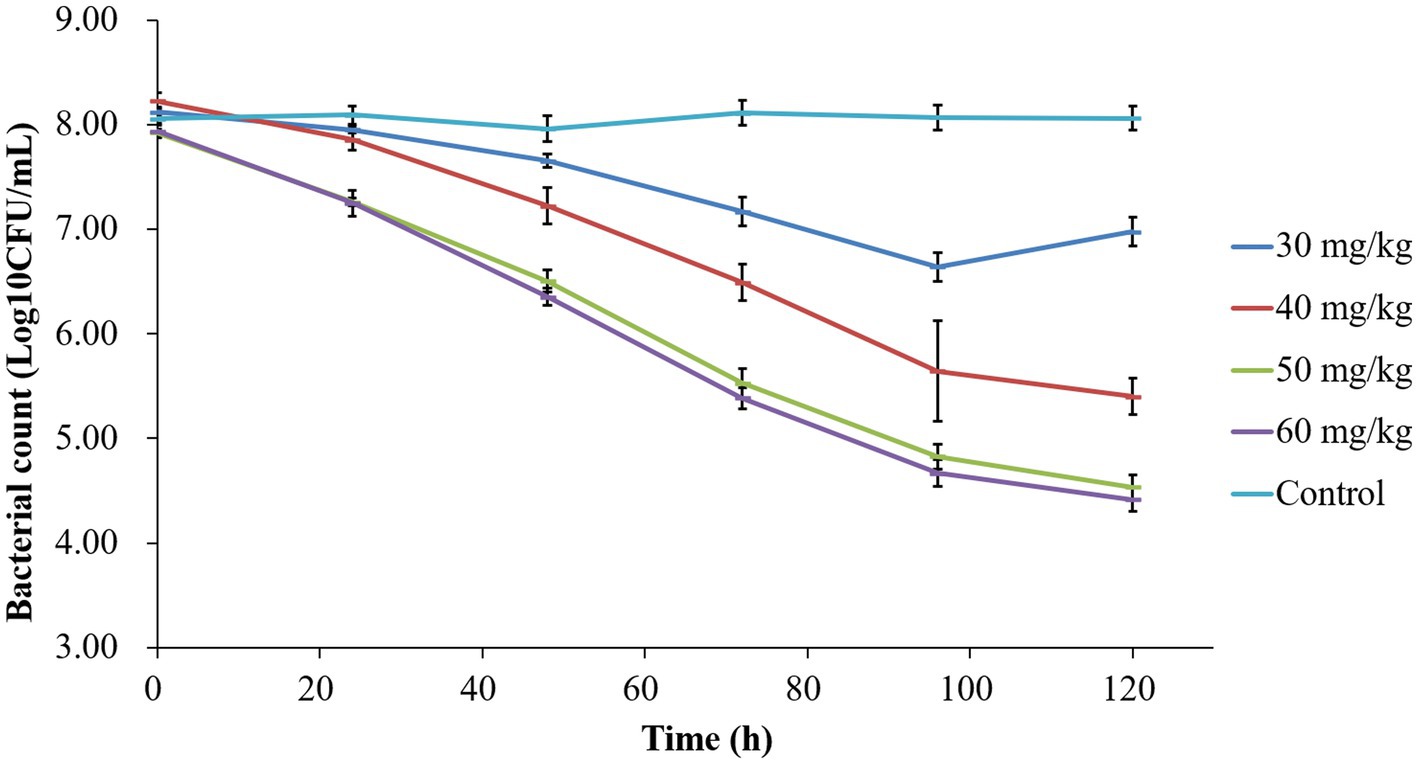 Figura 2. Curvas que matan el tiempo de tilmicosina contra P. multocida en diferentes dosis en el modelo de jaula de tejido.
Figura 2. Curvas que matan el tiempo de tilmicosina contra P. multocida en diferentes dosis en el modelo de jaula de tejido.
3.4. Integración farmacocinética/farmacodinámica in vivo y modelización
La correlación entre tres parámetros PK/PD (AUC24h/MIC, C.max/MIC, y %T > MIC) y actividad antibacteriana de tilmicosina contra P. multocida en TCF derivada de Sigmoid E.max modelo se mostró en la Figura 3. La R2 de las AUC24h/MIC, C.max/CMI y %T > CMI con efecto antibacteriano fueron 0,92, 0,90 y 0,83, respectivamente. Los parámetros obtenidos de E0, E.maxEC50, y el coeficiente de Hill se enumeran en la Tabla 2. El AUC estimado24hValores /MIC para un registro de 1/310UFC/ml, 1/2 log10UFC/ml y 3/4 log10La reducción de UFC/ml fue de 19,64 h, 33,45 h y 35,64 h, respectivamente, durante la administración de tilmicosina a las 24 h. La figura 3 ilustra la correlación entre tres índices PK/PD (AUC24h/MIC, C.max/MIC, y %T > MIC) y la actividad antibacteriana de la tilmicosina contra P. multocida en el líquido de la jaula tisular, según el modelo utilizando el Sigmoid E.max modelo. Los coeficientes de determinación (R2) para AUC24h/MIC, C.max/CMI y %T > CMI con efecto antibacteriano fueron 0,92, 0,90 y 0,83, respectivamente. La E derivada0, E.maxEC50, y los parámetros del coeficiente de Hill se tabulan en la Tabla 2. Según el modelo, el AUC estimado24hValores /MIC necesarios para un registro de 1/310UFC/ml, 1/2 log10UFC/ml y 3/4 log10La reducción bacteriana de UFC/ml en 24 h fue de 19,64 h, 33,45 h y 35,64 h, respectivamente.
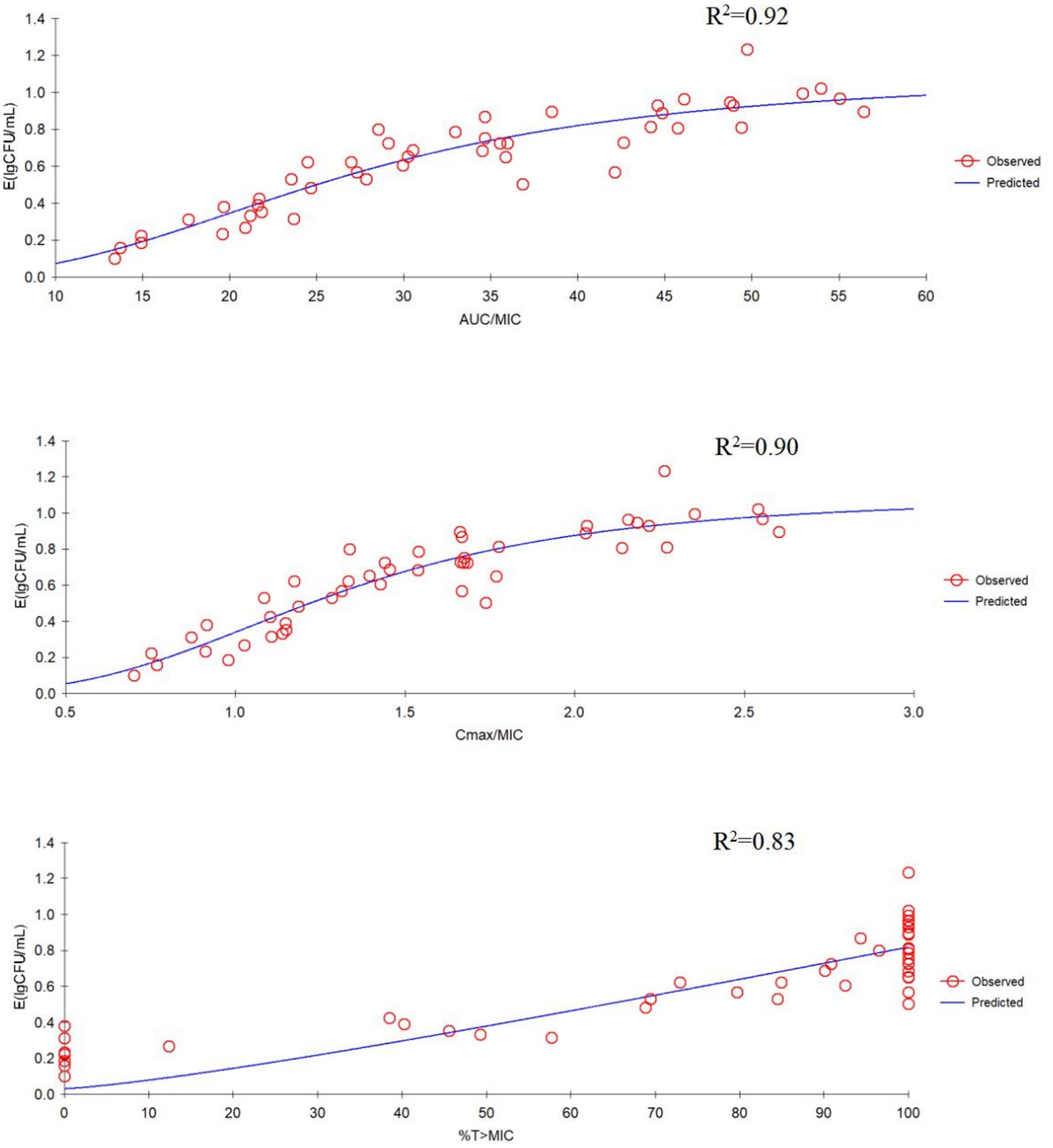 Figura 3. E.max relaciones para los tres parámetros farmacocinéticos/farmacodinámicos (PK/PD) versus efecto antibacteriano.
Figura 3. E.max relaciones para los tres parámetros farmacocinéticos/farmacodinámicos (PK/PD) versus efecto antibacteriano.
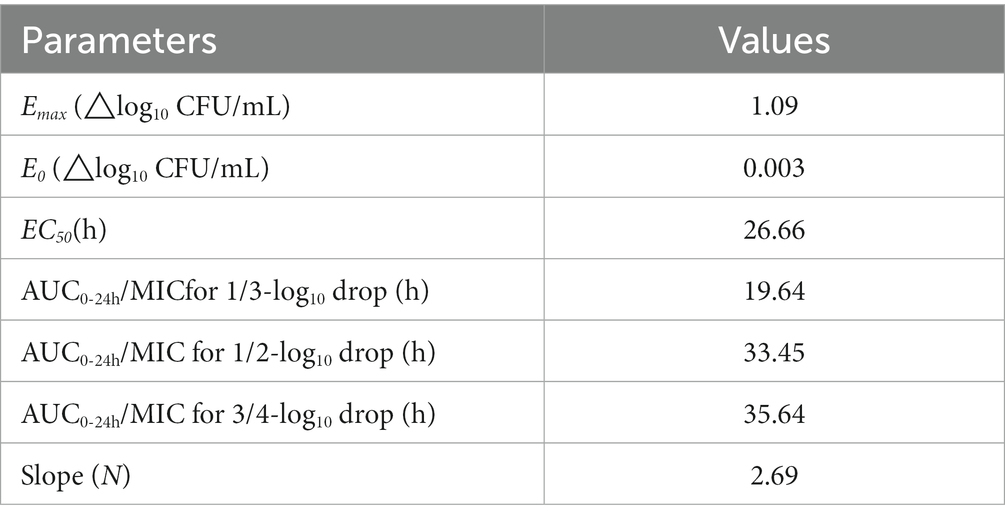 Tabla 2. Los valores de los parámetros PK/PD y el AUC24h/CMI requerido para los efectos antibacterianos indicados.
Tabla 2. Los valores de los parámetros PK/PD y el AUC24h/CMI requerido para los efectos antibacterianos indicados.
4. Discusión
P. multocida es una de las especies bacterianas más comunes entre las enfermedades respiratorias porcinas, que afecta en gran medida la producción y la salud de los cerdos y resulta en altas pérdidas económicas. El modelado PK/PD ofrece una oportunidad para la optimización de la dosis de la terapia antimicrobiana. El modelo de jaula tisular se ha utilizado para estudiar la integración PK/PD de tulatromicina, marbofloxacino y cefquinoma en P. multicida (14, 15, 17). La dosis de otros fármacos comúnmente utilizados en clínicas veterinarias, como danofloxacina, florfenicol, ceftiofur y oxitetraciclina, también se ha estudiado utilizando el modelo PK/PD (18–21). AUC24h/CMI fue reconocido como un parámetro PK/PD importante del antibiótico macrólido tulatromicina para la eficacia antibacteriana (14). Como antibiótico macrólido semisintético con actividad de amplio espectro, la tilmicosina demuestra una potente eficacia contra patógenos del tracto respiratorio, incluidos Actinobacillus pleuropneumoniae, Haemophilus parasuis e incluso neumonía por Mycoplasma (3, 22, 23). El estudio sobre el efecto de la tilmicosina en P. multocida será útil para el tratamiento de la infección respiratoria en cerdos.
Puede haber diferencias en el efecto antibacteriano en el medio de cultivo artificial o en el suero o líquido tisular. Las CIM de tiamulina contra varias cepas de Actinobacillus pleuropneumoniae en medio de cultivo y suero porcino fueron 12 y 24, 14 y 24, 12 y 32, y 12 y 24 μg/mL, respectivamente (24). La marbofloxacina tiene el mismo efecto antibacteriano sobre Mannheimia haemolytica en caldo medio y suero de oveja, CMI 0,035 μg/ml y MBC 0,045 μg/ml (25). Para el cefquinoma contra P. multocida, la CMI fue similar en medio caldo y fluido corporal, 0,03 μg/ml en medio y 0,04 μg/ml tanto en suero como en líquido tisular (26). Se encontró que las CMI de tulatromicina contra P. multocida CVCC430 en suero, trasudado y exudado eran de 0,03 μg/ml, mientras que en el medio MHB era de 0,25 μg/ml, y las concentraciones de tulatromicina en el trasudado y el exudado eran menores que las del suero (14). La determinación de CMI en diferentes medios es necesaria para estudiar la actividad antibacteriana de los fármacos. En este estudio, las CMI de tilmicosina contra P. multocida (D:7) tanto en TCF como en TSB fueron de 0,25 μg/ml, que también se utilizó para el análisis in vivo de PK/PD. En este estudio, los datos derivados del fluido tisular en el modelo de jaula tisular pueden integrar mejor la farmacocinética y la farmacodinámica.
La administración oral de tilmicosina fue adoptada en este estudio. El estudio indicó que la inyección subcutánea de tilmicosina causó inflamación en el sitio de la inyección (27, 28), y los efectos secundarios como respiración acelerada, vómitos, convulsiones o incluso la muerte pueden producirse después de su administración intravenosa e intramuscular o administración repetida de dosis altas (29). La aplicación potencial de una formulación inyectable de tilmicosina para el tratamiento o control de la enfermedad respiratoria porcina estaba contraindicada debido a un bajo margen de seguridad. En la práctica clínica, la administración de alimentación mixta de tilmicosina a 200-400 mg/kg demostró un buen efecto sobre la prevención y el tratamiento de la neumonía causada por Actinobacillus pleuropneumoniae y P. multocida (30, 31). Estudios previos han encontrado que la mayoría de los fármacos macrólidos exhibieron actividad antibacteriana dependiente del tiempo, y dos parámetros PK / PD utilizados para ilustrar el efecto antibacteriano son AUC24h/MIC y %T > MIC. Antes del presente estudio, teníamos un estudio preliminar para diseñar el régimen de dosis. Cuando la dosis es inferior a 20 mg/kg, la concentración del fármaco es siempre inferior a la CMI. No se pueden obtener los parámetros farmacocinéticos/PD ideales de T > CMI por lo que el rango de dosis para este estudio es de 30 mg/kg a 60 mg/kg.
A veces es confuso seleccionar los mejores parámetros PK/PD para evaluar la eficacia de los fármacos en función de las características antibacterianas (dependientes del tiempo o dependientes de la concentración), porque las características del fármaco en sí tienen mucho que ver con ello. La clasificación de los fármacos no es la única referencia para seleccionar parámetros que describan el efecto antibacteriano. Para fármacos con vida media de eliminación prolongada, AUC del parámetro PK/PD24h/CMI suele ser apropiado para describir el efecto. La t1/2β de tilmicosina probablemente permite que T > MIC supriman adecuadamente el rebrote de la población bacteriana predominante. Esto sugiere que las AUC24h/MIC es el índice óptimo de PK/PD para predecir la actividad antibacteriana. La azitromicina, dependiente del tiempo, debido a su larga vida media de eliminación, el mejor parámetro para predecir la eficacia es el AUC/CMI (32). Los parámetros PK/PD que describen el efecto de florfenicol son AUC24h/CMI para animales con vida media de eliminación prolongada y %T > CMI también podrían adoptarse para animales con vida media de eliminación corta (33, 34). Los ensayos in vitro de muerte en el tiempo demostraron un efecto antibacteriano dependiente de la concentración de tilmicosina contra Haemophilus parasuis (22). El efecto de la tilmicosina contra Lawsonia intracellularis fue dependiente de la concentración, por lo tanto, se utilizó AUC/CMI para formular el régimen de dosificación (35). En el presente estudio, la correlación entre el índice PK/PD del AUC24h/CMI y efecto antibacteriano fue el más alto (R2 = 0,92), lo que puede deberse a la lenta eliminación de tilmicosina en cerdos. Esta es también una razón importante por la que es inapropiado utilizar % T > CMI para guiar la administración de tilmicosina.
La relación entre las AUC24h/MIC y el cambio bacteriano se ajustaron mediante el modelo Sigmoide, y la magnitud del AUC24h/MIC requerido para un registro de 3/410UFC/ml de destrucción bacteriana durante 24 h fue de 35,64 h. La actividad bactericida se definió como >3-log10 reducción de UFC/ml. En este estudio, la tilmicosina se administró una vez al día durante 3 días. Cuando la dosis fue de >50 mg/kg, el AUC24h/CMI todavía estaba >35,64 h en el período de 24-48 h después de la última administración debido a la lenta eliminación de tilmicosina, es decir, el número de bacterias podría reducirse en 3 log10UFC/ml dentro de las 96 h después de la administración y se pueden lograr efectos bactericidas. En este estudio, los recuentos de bacterias menores de 50 y 60 mg/kg no fueron diferencias significativas (Figura 3). La posible razón es que para los medicamentos dependientes de la concentración, el efecto aumenta con el aumento de la concentración del fármaco dentro de un cierto rango. Cuando la dosis es de 50 mg/kg, se ha logrado el efecto máximo. Además, la tilmicosina pertenece a los medicamentos macrólidos, que son medicamentos antibacterianos, y no pueden eliminar completamente el P. multocida.
Aunque se obtuvieron algunos datos farmacocinéticos / PD útiles in vivo al establecer el modelo de infección de la jaula tisular en el estudio, existen algunas limitaciones de este modelo. Después de todo, el pulmón y no la jaula de tejido era el sitio de la infección. Compare con el modelo PK / PD convencional, la farmacocinética de base fisiológica (PBPK) y el modelo de infección de fibra hueca (HFIM) mostraron el poder en flexibilidad y predicción. Por ejemplo, las concentraciones bajo diferentes dosis de tilmicosina en diferentes tejidos, incluso en cerdos con diferentes edades, se pueden predecir aplicando un modelo PBPK. En un HFIM, excepto los recuentos totales de bacterias, se pueden detectar los recuentos de subpoblación resistente y subpoblación resistente no heredada (células persistentes y biopelículas). En estudios futuros, se deben considerar el modelo PBPK y el modelo HFIM.
5. Conclusión
El estudio actual investigó la integración PK/PD de tilmicosina contra P. multocida cepa D:7 se estudió mediante el establecimiento de un modelo de infección en jaulas tisulares en cerdos. Los resultados demostraron que las AUC24h/MIC (R2 = 0,92) fue el índice óptimo PK/PD para describir la actividad antibacteriana. Un análisis más detallado indicó que un AUC24h/MIC valor de 35,64 h fue necesario para que la tilmicosina alcanzara un log de 3/410Reducción de CFU/mL en TCF. La eficacia bactericida de tilmicosina contra P. multocida se alcanzó a dosis de 50 mg/kg o superiores, administradas una vez al día durante 3 días. Estos hallazgos facilitarán la orientación y optimización de los regímenes de dosificación clínica para el tratamiento de las infecciones por P. multocida en lechones.
Declaración de disponibilidad de datos
Las contribuciones originales presentadas en el estudio se incluyen en el artículo / material complementario, las consultas adicionales pueden dirigirse al autor correspondiente.
Declaración ética
El estudio en animales fue aprobado por el Comité de Ética de los Animales de la Universidad Agrícola del Sur de China. El estudio se realizó de acuerdo con la legislación local y los requisitos institucionales.
Contribuciones del autor
YC: Redacción – borrador original, curación de datos, software. XJ: Validación, Escritura – borrador original. SZ: Validación, Redacción – borrador original. WW: Escritura – revisión y edición. HZ: Escritura – borrador original. HD: Conceptualización, adquisición de fondos, administración de proyectos, redacción – borrador original, redacción – revisión y edición.
Financiación
Este trabajo fue apoyado por la Fundación Nacional de Ciencias Naturales de China (subvención no. 31972733).
Conflicto de intereses
Los autores declaran que la investigación se llevó a cabo en ausencia de cualquier relación comercial o financiera que pudiera interpretarse como un posible conflicto de intereses.
Nota del editor
Todas las afirmaciones expresadas en este artículo son únicamente las de los autores y no representan necesariamente las de sus organizaciones afiliadas, o las del editor, los editores y los revisores. Cualquier producto que pueda ser evaluado en este artículo, o reclamo que pueda ser hecho por su fabricante, no está garantizado ni respaldado por el editor.
Referencias
1. Smith, E, Miller, E, Aguayo, JM, Figueroa, CF, Nezworski, J, Studniski, M, et al. Diversidad genómica y epidemiología molecular de Pasteurella Multocida. PLoS One. (2021) 16:E0249138. doi: 10.1371/journal.pone.0249138
2. Garmyn, A, Vereecken, M, De Gussem, K, Depondt, W, Haesebrouck, F, and Martel, A. Efficacy of Tylosin and Tilmicosin against experimental Mycoplasma Gallisepticum infection in chickens. Avian Dis. (2019) 63:359–65. doi: 10.1637/11991-110818-reg.1
Resumen de PubMed | Texto completo de CrossRef | Google Académico
3. Dong, Z, Zhou, XZ, Sun, JC, Meng, XB, Li, HS, Cheng, FS, et al. Eficacia de los gránulos de tilmicosina con recubrimiento entérico en cerdos infectados artificialmente con Actinobacillus Pleuropneumoniae serotipo 2. Vet Med Sci. (2020) 6:105–13. DOI: 10.1002/VMS3.198
Resumen de PubMed | Texto completo de CrossRef | Google Académico
4. Moore, GM, Basson, RP, and Tonkinson, LV. Clinical field trials with Tilmicosin phosphate in feed for the control of naturally acquired pneumonia caused by Actinobacillus Pleuropneumoniae and Pasteurella Multocida in swine. Am J Vet Res. (1996) 57:224–8.
5. Zhang, N, Liu, Z, Wei, Y, Zhang, C, Mao, C, Cai, Q, et al. Comparación de la farmacocinética de la tilmicosina en plasma y tejido pulmonar en pollos sanos y pollos infectados experimentalmente con Mycoplasma Gallisepticum. J Vet Pharmacol Ther. (2020) 43:347–54. DOI: 10.1111/JVP.12847
Resumen de PubMed | Texto completo de CrossRef | Google Académico
6. Gallina, G, Lucatello, L, Drigo, I, Cocchi, M, Scandurra, S, Agnoletti, F, et al. Cinética y disposición intrapulmonar de tilmicosina después de administraciones únicas y repetidas en bolo oral a conejos. Vet Res Commun. (2010) 34 Suppl 1:S69–72. DOI: 10.1007/S11259-010-9385-2
Resumen de PubMed | Texto completo de CrossRef | Google Académico
7. Foster, DM, Sylvester, HJ y Papich, MG. Comparación del muestreo directo y el lavado brocoalveolar para determinar las concentraciones activas del fármaco en el líquido de revestimiento epitelial pulmonar de terneros inyectados con enrofloxacino o tilmicosina. J Vet Pharmacol Ther. (2017) 40:E45–53. DOI: 10.1111/JVP.12412
8. Shen, J, Li, C, Jiang, H, Zhang, S, Guo, P, Ding, S, et al. Farmacocinética de la tilmicosina después de la administración oral en cerdos. Am J Vet Res. (2005) 66:1071–4. doi: 10.2460/ajvr.2005.66.1071
Resumen de PubMed | Texto completo de CrossRef | Google Académico
9. Zhang, L, Zhao, L, Liu, Y, Liu, J, and Li, X. Pharmacokinetics of Tilmicosin in healthy pigs and in pigs experimentally infected with Haemophilus Parasuis. J Vet Sci. (2017) 18:431–7. DOI: 10.4142/JVS.2017.18.4.431
Resumen de PubMed | Texto completo de CrossRef | Google Académico
10. Zhang, N, Ba, J, Wang, S, Xu, Z, Wu, F, Li, Z, et al. Farmacocinética y biodisponibilidad de la formulación de dispersión sólida de tilmicosina en cerdos. J Vet Pharmacol Ther. (2021) 44:359–66. DOI: 10.1111/JVP.12929
Resumen de PubMed | Texto completo de CrossRef | Google Académico
11. Modric, S, Webb, AI, and Derendorf, H. Pharmacokinetics and pharmacodynamics of Tilmicosin in sheep and botle. J Vet Pharmacol Ther. (1998) 21:444–52. doi: 10.1046/j.1365-2885.1998.00177.x
Resumen de PubMed | Texto completo de CrossRef | Google Académico
12. Musser, J, Mechor, GD, Gröhn, YT, Dubovi, EJ y Shin, S. Comparación de la tilmicosina con la oxitetraciclina de acción prolongada para el tratamiento de la enfermedad del tracto respiratorio en terneros. J Am Vet Med Assoc. (1996) 208:102–6.
13. Klima, CL, Holman, DB, Cook, SR, Conrad, CC, Ralston, BJ, Allan, N, et al. Resistencia a múltiples fármacos en Pasteurellaceae asociada con mortalidades por enfermedades respiratorias bovinas en América del Norte de 2011 a 2016. Microbiol frontal. (2020) 11:606438. DOI: 10.3389/fmicb.2020.606438
Resumen de PubMed | Texto completo de CrossRef | Google Académico
14. Zhou, Q, Zhang, G, Wang, Q, Liu, W, Huang, Y, Yu, P, et al. Modelado farmacocinético/farmacodinámico de Tulatromicina frente a Pasteurella Multocida en un modelo de jaula de tejido porcino. Frente Pharmacol. (2017) 8:392. doi: 10.3389/fphar.2017.00392
Resumen de PubMed | Texto completo de CrossRef | Google Académico
15. Zhang, L, Wu, X, Huang, Z, Kang, Z, Chen, Y, Shen, X, et al. Integración farmacocinética/farmacodinámica de cefquinoma frente a Pasteurella Multocida en un modelo de jaula de tejido de lechón. J Vet Pharmacol Ther. (2019) 42:60–6. DOI: 10.1111/JVP.12705
Resumen de PubMed | Texto completo de CrossRef | Google Académico
16. Zhang, BX, Lu, XX, Gu, XY, Li, XH, Gu, MX, Zhang, N, et al. Farmacocinética y farmacodinámica ex vivo de cefquinoma en suero porcino y fluidos de jaulas tisulares. Veterinario J. (2014) 199:399–405. doi: 10.1016/j.tvjl.2013.12.015
Resumen de PubMed | Texto completo de CrossRef | Google Académico
17. Zeng, QL, Mei, X, Su, J, Li, XH, Xiong, WG, Lu, Y, et al. Modelo farmacocinético-farmacodinámico integrado (Pk/Pd) para evaluar la actividad antimicrobiana in vivo de Marbofloxacino frente a Pasteurella Multocida en lechones. BMC Vet Res. (2017) 13:178. DOI: 10.1186/S12917-017-1099-Z
Resumen de PubMed | Texto completo de CrossRef | Google Académico
18. Zhou, YF, Sun, Z, Wang, RL, Li, JG, Niu, CY, Li, XA, et al. Comparación de objetivos de Pk/Pd y valores de corte para Danofloxacino contra Pasteurella Multocida y Haemophilus Parasuis en lechones. Front Vet Sci. (2022) 9:811967. DOI: 10.3389/FVETS.2022.811967
Resumen de PubMed | Texto completo de CrossRef | Google Académico
19. Dorey, L, Pelligand, L, Cheng, Z, and Lees, P. Pharmacokinetic/pharmacodynamic integration and modelling of Florfenicol for the pig pneumonia pathogens Actinobacillus Pleuropneumoniae and Pasteurella Multocida. PLoS One. (2017) 12:E0177568. doi: 10.1371/journal.pone.0177568
Resumen de PubMed | Texto completo de CrossRef | Google Académico
20. Mi, K, Pu, S, Hou, Y, Sun, L, Zhou, K, Ma, W, et al. Optimización y validación del régimen de dosificación de Ceftiofur frente a Pasteurella Multocida en cerdos mediante modelo farmacocinético-farmacodinámico de base fisiológica. Int J Mol Sci. (2022) 23:3722. DOI: 10.3390/IJMS23073722
Resumen de PubMed | Texto completo de CrossRef | Google Académico
21. Dorey, L, Pelligand, L, Cheng, Z, and Lees, P. Pharmacokinetic/pharmacodynamic integration and modelling of Oxytetracycline for the porcine pneumonia pathogens Actinobacillus Pleuropneumoniae and Pasteurella Multocida. J Vet Pharmacol Ther. (2017) 40:505–16. DOI: 10.1111/JVP.12385
Resumen de PubMed | Texto completo de CrossRef | Google Académico
22. Zhang, P, Hao, H, Li, J, Ahmad, I, Cheng, G, Chen, D, et al. Los valores de corte epidemiológicos y farmacodinámicos de tilmicosina contra Haemophilus Parasuis. Microbiol frontal. (2016) 7:385. DOI: 10.3389/fmicb.2016.00385
Resumen de PubMed | Texto completo de CrossRef | Google Académico
23. Huang, Z, Hu, Z, Zheng, H, Xia, X, Gu, X, Shen, X, et al. La integración Pk/Pd y la resistencia de la tilmicosina contra Mycoplasma Hyopneumoniae. Patógenos. (2020) 9:487. doi: 10.3390/pathogens9060487
Resumen de PubMed | Texto completo de CrossRef | Google Académico
24. Pridmore, A, Burch, D, and Lees, P. Determination of minimum inhibitory and minimum bactericidal concentration of Tiamulin against field isolates of Actinobacillus Pleuropneumoniae. Veterinario Microbiol. (2011) 151:409–12. doi: 10.1016/j.vetmic.2011.03.016
Resumen de PubMed | Texto completo de CrossRef | Google Académico
25. Sidhu, PK, Landoni, MF, Aliabadi, FS, and Lees, P. Pharmacokinetic and Pharmacodynamic modelling of Marbofloxacin administrado solo y en combinación con ácido tolfenámico en cabras. Veterinario J. (2010) 184:219–29. doi: 10.1016/j.tvjl.2009.02.009
Resumen de PubMed | Texto completo de CrossRef | Google Académico
26. Shan, Q, Yang, F, Wang, J, Ding, H, He, L, and Zeng, Z. Pharmacokinetic/pharmacodynamic relationship of Cefquinome against Pasteurella Multocida in a tissue-cage model in yellow cattle. J Vet Pharmacol Ther. (2014) 37:178–85. DOI: 10.1111/JVP.12076
Resumen de PubMed | Texto completo de CrossRef | Google Académico
27. Van Donkersgoed, J, Dubeski, PL, VanderKop, M, Aalhus, JL, Bygrove, S, y Starr, WN. El efecto de los productos de salud animal en la formación de lesiones en el lugar de inyección en subprimarios de terneros inyectados experimentalmente. Can Vet J. (2000) 41:617–22.
28. Clark, C, Dowling, PM, Ross, S, Woodbury, M, y Boison, JO. Farmacocinética de la tilmicosina en tejidos equinos y plasma. J Vet Pharmacol Ther. (2008) 31:66–70. doi: 10.1111/j.1365-2885.2007.00909.x
Resumen de PubMed | Texto completo de CrossRef | Google Académico
29. Jordan, WH, Byrd, RA, Cochrane, RL, Hanasono, GK, Hoyt, JA, Main, BW, et al. Una revisión de la toxicología del antibiótico Micotil 300. Veterinario Hum Toxicol. (1993) 35:151–8.
30. Paradis, MA, Vessie, GH, Merrill, JK, Dick, CP, Moore, C, Charbonneau, G, et al. Eficacia de la tilmicosina en el control de la infección por Actinobacillus Pleuropneumoniae inducida experimentalmente en cerdos. Can J Vet Res. (2004) 68:7–11.
31. Nerland, EM, LeBlanc, JM, Fedwick, JP, Morck, DW, Merrill, JK, Dick, P, et al. Efectos de la administración oral de tilmicosina sobre la inflamación pulmonar en lechones infectados experimentalmente con Actinobacillus Pleuropneumoniae. Am J Vet Res. (2005) 66:100–7. doi: 10.2460/ajvr.2005.66.100
Resumen de PubMed | Texto completo de CrossRef | Google Académico
32. Van Bambeke, F, y Tulkens, PM. Macrólidos: farmacocinética y farmacodinámica. Int J Agentes antimicrobianos. (2001) 18:17–23. DOI: 10.1016/S0924-8579(01)00406-X
33. Lei, Z, Liu, Q, Yang, S, Yang, B, Khaliq, H, Li, K, et al. Modelado de integración Pk-Pd y valor de corte de Florfenicol frente a Streptococcus Suis en cerdos. Frente Pharmacol. (2018) 9:2. DOI: 10.3389/FPHAR.2018.00002
Resumen de PubMed | Texto completo de CrossRef | Google Académico
34. Zhang, H, Huang, Y, Yu, J, Liu, X, and Ding, H. Pk/Pd integration of Florfenicol alone and in combination with doxycycline against Riemerella Anatipestifer. Front Vet Sci. (2022) 9:975673. DOI: 10.3389/FVETS.2022.975673
Resumen de PubMed | Texto completo de CrossRef | Google Académico
35. Luo, W, Qin, H, Chen, D, Wu, M, Meng, K, Zhang, A, et al. La formulación del régimen de dosis de tilmicosina contra Lawsonia Intracellularis en cerdos por modelo farmacocinético-farmacodinámico (Pk-Pd). Microb Pathog. (2020) 147:104389. doi: 10.1016/j.micpath.2020.104389
Resumen de PubMed | Texto completo de CrossRef | Google Académico
Palabras clave: Pasteurella multocida, Tilmicosina, relación PK/PD, modelo de infección en jaula tisular, in vivo
Cita: Chen Y, Ji X, Zhang S, Wang W, Zhang H y Ding H (2023) Integración farmacocinética / farmacodinámica de tilmicosina contra Pasteurella multocida en un modelo de jaula de tejido de lechón. Frente. Vet. Sci. 10:1260990. doi: 10.3389/fvets.2023.1260990
Recibido: 18 de julio de 2023; Aprobado: 17 de agosto de 2023;
Publicado: 04 septiembre 2023.
Editado por:
Fan Yang, Universidad de Ciencia y Tecnología de Henan, China
Revisado por:
Yingchun Liu, Academia China de Ciencias Agrícolas, China Kaixiang Zhou, Universidad Agrícola de China, China
Derechos de autor © 2023 Chen, Ji, Zhang, Wang, Zhang y Ding. Este es un artículo de acceso abierto distribuido bajo los términos de la Licencia de Atribución Creative Commons (CC BY). S
*Correspondencia: Huanzhong Ding, hzding@scau.edu.cn
Renuncia: Todas las afirmaciones expresadas en este artículo son únicamente las de los autores y no representan necesariamente las de sus organizaciones afiliadas, o las del editor, los editores y los revisores. Cualquier producto que pueda ser evaluado en este artículo o reclamo que pueda ser hecho por su fabricante no está garantizado ni respaldado por el editor.
Date de alta y recibe nuestro 👉🏼 Diario Digital AXÓN INFORMAVET ONE HEALTH
Date de alta y recibe nuestro 👉🏼 Boletín Digital de Foro Agro Ganadero
Noticias animales de compañía
Noticias animales de producción
Trabajos técnicos animales de producción
Trabajos técnicos animales de compañía

