Detección del cáncer en perros mediante análisis rápido de orina
Detección del cáncer en perros mediante análisis rápido de orina molecular Raman
 John L. Robertson1,2*
John L. Robertson1,2*  Nikolas Dervisis3
Nikolas Dervisis3  John Rossmeisl3
John Rossmeisl3  Marlie Nightengale3
Marlie Nightengale3  Daniel Campos3
Daniel Campos3  Cameron Dedrick3
Cameron Dedrick3  Lacey Ngo1
Lacey Ngo1  Amr Sayed Issa2
Amr Sayed Issa2  Georgi Guruli4
Georgi Guruli4  Giuseppe Orlando5
Giuseppe Orlando5  Ryan S. Senger2,6*
Ryan S. Senger2,6*- 1Departamento de Ingeniería Biomédica y Mecánica, Facultad de Ingeniería, Virginia Tech, Blacksburg, VA, Estados Unidos
- 2Rametrix Technologies Inc., Blacksburg, VA, Estados Unidos
- 3Facultad de Medicina Veterinaria de Virginia Maryland, Virginia Tech, Blacksburg, VA, Estados Unidos
- 4Departamento de Cirugía, VCU Health, Richmond, VA, Estados Unidos
- 5Departamento de Cirugía General, Facultad de Medicina de la Universidad de Wake Forest, Winston-Salem, Carolina del Norte, Estados Unidos
- 6Departamento de Ingeniería de Sistemas Biológicos, Facultad de Agricultura y Ciencias de la Vida y Facultad de Ingeniería, Virginia Tech, Blacksburg, VA, Estados Unidos
Introducción: La presencia de cáncer en perros se detectó mediante espectroscopia Raman de muestras de orina y análisis quimiométrico de datos espectroscópicos. El procedimiento creó una huella espectral multimolecular con cientos de características relacionadas directamente con la composición química de la muestra de orina. A continuación, se utilizaron para detectar la amplia presencia de cáncer en la orina de perro, así como la presencia específica de linfoma, carcinoma urotelial, osteosarcoma y tumor de mastocitos.
Métodos: Se recolectaron muestras de orina mediante micción, cistocentesis o cateterismo de 89 perros sin antecedentes ni evidencia de enfermedad neoplásica, 100 perros diagnosticados con cáncer y 16 perros diagnosticados con enfermedad renal o del tracto urinario no neoplásico. Se obtuvieron espectros Raman de las muestras de orina líquida a granel no procesadas y se analizaron mediante ISREA, se aplicó el análisis de componentes principales (PCA) y el análisis discriminante de componentes principales (DAPC) utilizando el software RametrixToolbox.®
Resultados y discusión: El procedimiento identificó una huella espectral para el cáncer en la orina canina, lo que dio como resultado una prueba de detección de orina con una precisión general del 92,7 % para una designación de cáncer frente a una designación libre de cáncer. El cribado de orina se realizó con una sensibilidad del 94,0%, una especificidad del 90,5%, un valor predictivo positivo (VPP) del 94,5%, un valor predictivo negativo (VPN) del 89,6%, un cociente de verosimilitud positivo (LR+) de 9,9 y un cociente de verosimilitud negativo (LR-) de 0,067. Del análisis se extrajeron las bandas Raman responsables de discernir el cáncer y se obtuvieron asociaciones biomoleculares. El análisis de orina fue más eficaz para distinguir el carcinoma urotelial de los otros cánceres mencionados anteriormente. La detección y clasificación del cáncer en perros mediante un análisis de orina simple, no invasivo y rápido (en comparación con las biopsias líquidas que utilizan muestras de sangre periférica) es un avance crítico en el manejo y tratamiento de casos, especialmente en razas predispuestas a tipos específicos de cáncer.
1 Introducción
El cáncer es común en los perros. Según la Asociación Americana de Medicina Veterinaria, «Aproximadamente 1 de cada 4 perros, en algún momento de su vida, desarrollará neoplasia. Casi la mitad de los perros mayores de 10 años desarrollarán cáncer» (1). Los perros, sus dueños y veterinarios se beneficiarían de las pruebas que diferencian el cáncer de otros procesos patológicos en perros enfermos. Del mismo modo, la detección temprana del cáncer, cuando el tratamiento y la atención podrían producir mejores resultados, sería especialmente útil en razas predispuestas a una alta incidencia de cánceres específicos (p. ej., bóxers, golden retrievers, terriers escoceses, perros pastores alemanes, muchos otros) (2-4).
Recientemente, se han descrito en la literatura varios métodos basados en muestras de sangre para la detección del cáncer canino. Una prueba se basa en la secuenciación genómica de próxima generación para la detección de fragmentos de ADN libre de células asociados al cáncer en el plasma (5, 6). La sensibilidad relativa observada de la prueba de sangre notificada fue del 61,5 %, con una especificidad del 97,5 % y un valor predictivo positivo del 75 % para los pacientes de cribado. Un ensayo basado en orina, basado en la quimiotaxis olfativa reactiva a moléculas orgánicas volátiles y otras moléculas de orina por el nematodo Caenorhabditis elegans, indicó que este nematodo podía detectar cáncer en perros con una especificidad del 90% en una comparación de 48 muestras de perros con cáncer y 30 muestras de perros «no cancerosos» (7). En la literatura de investigación se han descrito otras pruebas y tecnologías, específicamente para la detección del linfoma canino (microARN plasmático, pequeñas vesículas extracelulares circulantes), pero no se utilizan de forma general ni están disponibles comercialmente para la detección/tratamiento del cáncer (8, 9).
La orina es una «biopsia líquida» producida continuamente del tracto urinario, así como de todo el cuerpo. La producción y composición de la orina está meticulosamente regulada en la salud y puede estar significativamente desregulada en la enfermedad sistémica y renal (10). Se sabe que el cáncer y el tratamiento del cáncer desregulan la estructura y función renal y afectan la composición de la orina. Esto se ha reconocido en humanos desde hace más de un siglo (11) y en perros desde mediados de la década de 1960 (12). Los cánceres localizados en el riñón, como el linfoma y el carcinoma de células renales, alteran físicamente la estructura renal y alteran la función renal a medida que crecen. En los seres humanos, las neoplasias malignas en otros órganos (pulmón, colon, próstata), que pueden estar liberando neoantígenos tumorales y productos solubles, se asocian con cambios inflamatorios y reactivos en la estructura y función renal (13-16); Estos han sido descritos como síndromes paraneoplásicos renales asociados a neoplasias malignas (17-21). Es evidente que las quimioterapias potencialmente nefrotóxicas pueden alterar la estructura y la función renal durante el tratamiento (22-24).
Desarrollamos una tecnología novedosa, basada en la espectroscopia Raman de precisión de orina, que distingue rápidamente (en 15 s) entre las vibraciones moleculares, causadas por la irradiación láser no destructiva, en cientos de moléculas discretas en muestras de orina (25-28). El perfil de vibración molecular resultante se muestra como una imagen espectral y se puede analizar computacional y estadísticamente, lo que permite la comparación de espectros de individuos sanos y pacientes con enfermedades, como el cáncer.
Hemos informado previamente sobre este uso de una tecnología basada en espectroscopia Raman (Rametrix) (29, 30) para la detección de enfermedad renal crónica (31), nefropatía diabética (32), efectos renales de la enfermedad COVID19 (33), microhematuria (34), cáncer de vejiga (35) y enfermedad de Lyme crónica (36), validado mediante la comparación de patrones espectrales Raman en más de 3.000 muestras de orina derivadas de pacientes humanos y más de 200 individuos humanos sanos sin evidencia clínica o de laboratorio de enfermedad renal.®
En este estudio planteamos la hipótesis de que la tecnología de Rametrix® detectaría efectos metabólicos, inflamatorios, inmunológicos y fisiológicos (es decir, paraneoplásicos) del cáncer, que alteran la composición de la orina. Esto crearía «huellas dactilares espectrales» únicas compuestas por señales de cientos de moléculas presentes en la orina de perros con cáncer.
Aquí, informamos los resultados del análisis Raman de muestras de orina de 100 perros con uno de los cuatro tipos comunes de cáncer (linfoma, carcinoma urotelial, osteosarcoma y tumor de mastocitos), en comparación con el análisis Raman de 89 perros clínicamente sanos y 16 perros con enfermedad del tracto urinario no neoplásico. Demostramos la detección de huellas espectrales Raman multimoleculares asociadas al cáncer, que reflejan los efectos locales y sistémicos de la enfermedad. Estos resultados indican que este método simple, rápido, no invasivo / mínimamente invasivo podría usarse como ayuda para la detección y el manejo del cáncer en perros.
2 Métodos
2.1 Población de estudio
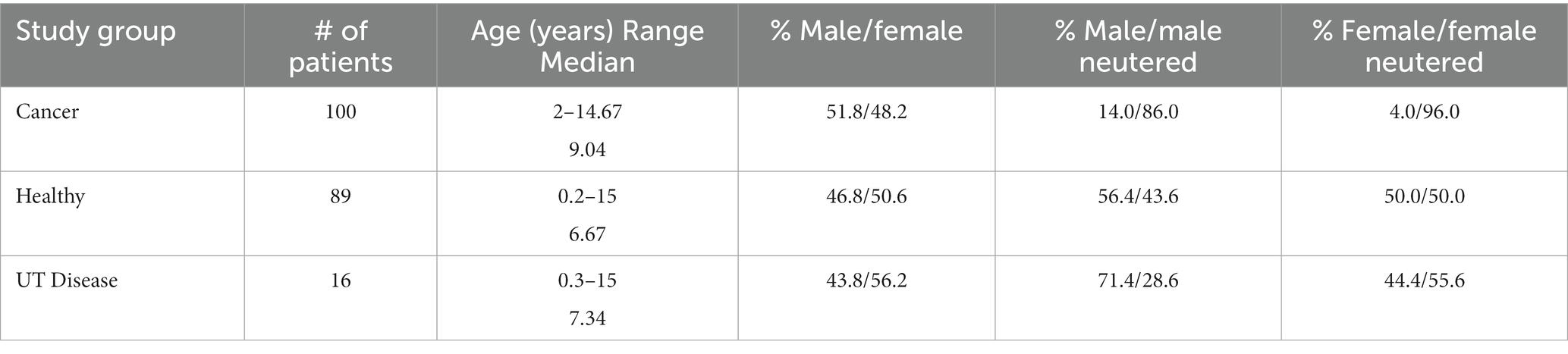
Se obtuvo el consentimiento informado por escrito para la recolección y análisis de muestras de orina de los dueños de perros, siguiendo los protocolos aprobados 15-217, 17-011 y 19-240 de Virginia Tech IACUC. Se inscribieron un total de 292 perros y se recolectaron muestras de orina en el Hospital Docente Veterinario [VTH] (Blacksburg, VA), el Centro de Investigación y Atención del Cáncer Animal [ACCRC] (Roanoke, VA) o de veterinarios remitentes afiliados al estudio. Se pidió a los veterinarios remitentes que proporcionaran información sobre si las muestras eran de perros generalmente sanos (según las evaluaciones físicas y de laboratorio actuales) o de perros con un diagnóstico confirmado de enfermedad neoplásica (cáncer). Todos los perros inscritos en VTH o ACCRC fueron remitidos a estos hospitales en base a evaluaciones físicas y de laboratorio previas. De las muestras incluidas en este análisis, 100 eran de perros con diagnóstico de cáncer [grupo neoplásico (cáncer)], 89 eran de perros clínicamente sanos (grupo sano) y 16 de perros con enfermedad del tracto urinario (UT) no neoplásica (grupo de enfermedad UT) (ver Tabla 1).
La confirmación histológica de todos los tumores fue realizada por patólogos veterinarios certificados por la junta y con gran experiencia asociados con laboratorios de diagnóstico veterinario. La pericia en la clasificación histológica (microscópica óptica) y la subtipificación de variaciones sutiles en la morfología del linfoma canino varió entre los miembros de la cohorte de patólogos. Se utilizó tinción inmunohistoquímica (IHQ) suplementaria y análisis de citometría de flujo (FC) para proporcionar información diagnóstica adicional para algunos perros con linfoma (según la participación del propietario).
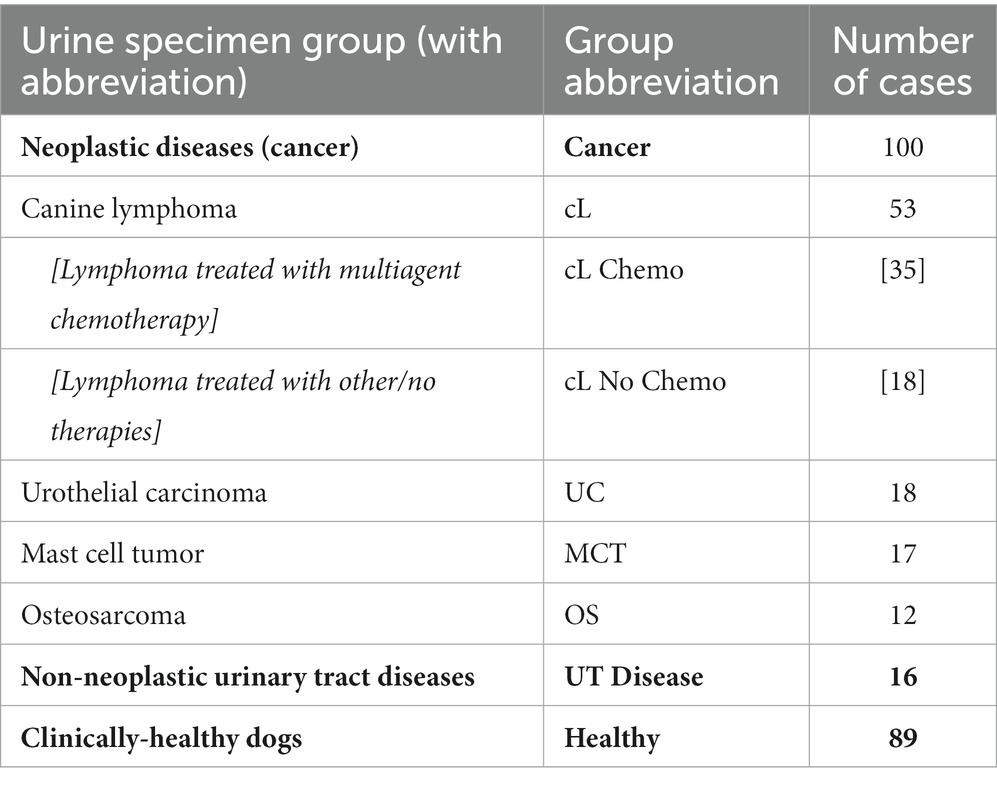
Como se muestra en la Tabla 2, de los 100 perros con cáncer neoplásico incluidos en este estudio, 53 fueron diagnosticados con linfoma canino (lC). Se dispuso de clasificación histológica/IHQ/FC de los subtipos de lL para 43/53 pacientes; 33/43 perros se clasificaron como linfoma de células B, 7 perros con linfoma de células T y 3 perros se clasificaron como «histotipo mixto». Treinta y cinco (35) perros con cL se inscribieron en protocolos de quimioterapia multifarmacológica; sin embargo, ninguno se sometió a tratamiento inmediatamente antes de la recolección de la muestra. Otros dieciocho (18) perros con diagnóstico de cL no estaban recibiendo quimioterapia en el momento de la recolección de la muestra. No se evaluó si los fármacos individuales o las combinaciones de ellos pueden haber afectado los resultados de la prueba, ni de qué manera. Nuestro estudio fue diseñado como el primer piloto en perros de esta tecnología como herramienta de cribado, y la evaluación del efecto de diferentes quimioterápicos en el rendimiento de la prueba no estaba en el alcance de este estudio piloto.
Dieciocho (18) pacientes fueron diagnosticados con carcinoma urotelial (CU), 17 con tumor de mastocitos (TCM) y 12 con osteosarcoma (SG). De los pacientes con TCM, estos incluían tumores cutáneos o viscerales que no se distinguieron en este estudio. Del mismo modo, el grupo de SG incluyó tumores apendiculares, axiales y extraesqueléticos. También se incluyeron en el estudio dieciséis (16) pacientes con enfermedad del tracto urinario no neoplásico. Estos incluyeron 8 pacientes con enfermedad de la vejiga no tumoral (cistitis), 5 con cálculos renales y 3 con anomalías del desarrollo, estenosis/retención uretral o prostática asociada. Se obtuvieron múltiples muestras de orina de algunos pacientes durante el tratamiento, pero el número de perros muestreados de esta manera fue insuficiente para correlacionarse con la eficacia del tratamiento (es decir, remisión o enfermedad estable). Esto se está estudiando ahora con otros casos.
2.2 Recogida y preparación de muestras
Las muestras de orina se recolectaron como muestras miccionales de «captura libre» en recipientes estériles para muestras de orina o con cistocentesis, según fuera necesario. Los métodos de recolección de orina utilizados representan el estándar de atención en un medicamento veterinario. El objetivo de nuestro estudio fue probar una nueva herramienta de cribado para su uso en escenarios del mundo real. Creemos que el uso de ambas metodologías de recolección de orina basadas exclusivamente en la necesidad clínica (los perros que no proporcionarían orina a través de la captura libre la proporcionarían a través de la cistocentesis) refleja la práctica común y la realidad clínica. Las muestras de orina se almacenaron congeladas (-30 °C) en viales estériles durante no más de 4 semanas.
Para prepararse para el escaneo Raman, las muestras se descongelaron en una incubadora a 27 °C y luego se pipetearon aproximadamente 1 ml en viales de vidrio de sílice con tapa de rosca de 1,5 ml (Thermo Fisher Scientific, Waltham, MA) y se sellaron. Las muestras se mezclaron para suspender los sólidos disueltos y los restos celulares y luego se realizó una espectroscopia Raman en el líquido a granel. La señal Raman se adquirió a través del costado del frasco de vidrio.
2.3 Espectroscopía Raman
Las muestras de orina se analizaron mediante espectroscopía Raman en fase líquida a granel utilizando un espectrómetro PeakSeeker PRO-785 (Agiltron, Woburn, MA) equipado con soporte para viales líquidos y cable de fibra óptica. Se utilizó un láser de 785 nm con excitación de 30 s y potencia de 30 mW. El tamaño del punto láser fue de 0,2 mm y la resolución espectral fue de 8 cm−1. Los espectros se recogieron a lo largo de los 200-2.000 cm−1 y se obtuvieron 10 barridos espectrales replicados por muestra. Se utilizó el software RSIQ (Agiltron) para recolectar espectros y realizar el procesamiento inicial. Surina™ Se utilizó el control negativo de orina (Dyna-Tek Industries, Lenexa, KS) para alinear los espectros Raman y garantizar la calibración del espectrómetro Raman.
2.4 Análisis quimiométrico y estadístico
Los espectros Raman se analizaron utilizando Rametrix Toolbox v2.0 con MATLAB (R2018a) y Statistics and Machine Learning Toolbox. Rametrix Toolbox v2.0 está disponible a través de GitHub y combina elementos de las cajas de herramientas Rametrix LITE (29) y PRO (30) publicadas anteriormente. La caja de herramientas de Rametrix se utilizó para leer archivos espectrales, promediar réplicas y truncar espectros a 400-1.800 cm®®®®−1. También se utilizó para aplicar la línea base, la calibración del número de onda con Surine™, la normalización de vectores, el análisis de componentes principales (PCA), el análisis discriminante de componentes principales (DAPC), el análisis multivariado de varianza (MANOVA) y la validación cruzada con el análisis de dejar uno fuera. Se aplicaron dos métodos diferentes de línea de base con Rametrix Toolbox. El primero fue Savitzky-Golay (en lo sucesivo abreviado SG) usando un 3®Rd polinomio de orden y longitud de fotograma de 301. El segundo fue ISREA (37), que inserta una spline cúbica a lo largo de nodos definidos (nudos) de un espectro. Las ubicaciones de los nodos se ajustaron para mejorar el ajuste de la línea de base y las capacidades predictivas. Hemos aplicado métodos similares en varios de nuestros estudios previos con orina humana (32-34, 36).
2.5 Contribuciones moleculares
Se utilizaron los valores de carga de PCA y MANOVA para identificar los desplazamientos Raman responsables de las separaciones de agrupamiento observadas entre los grupos. Estos valores de carga se obtuvieron a partir de los procedimientos PCA y MANOVA realizados en MATLAB (utilizando las funciones pca y manova1, respectivamente). Para identificar una banda Raman significativa, se utilizó un punto de corte del 0,3% en las cargas de PCA y del 0,2% en las de MANOVA. Estas bandas se consideraron significativamente diferentes entre los grupos analizados, y se utilizaron las bibliotecas Raman disponibles (38, 39) para determinar las moléculas biológicas asociadas con estas bandas. También hemos aplicado este enfoque en otros estudios de orina humana y hemos encontrado correlaciones con los datos metabolómicos disponibles basados en espectrometría de masas (35, 36).
2.6 Validación cruzada y desarrollo de métodos de cribado
Para validar el modelo descrito anteriormente, se utilizó un método de validación cruzada de dejar uno fuera. Aquí, una muestra se dejó fuera del proceso de construcción del modelo con PCA, MANOVA y DAPC. A continuación, se utilizó el modelo completo para predecir el grupo (p. ej., cL, Sano, CU, etc.) de la muestra que quedó fuera. Se registró la predicción y se repitió el procedimiento hasta que todas las muestras del conjunto de datos se dejaron fuera de la construcción del modelo una vez. Teniendo en cuenta los grupos reales y predichos de cada muestra, se calcularon las métricas generales de rendimiento de: precisión de la predicción, sensibilidad, especificidad, valor predictivo positivo (VPP) y valor predictivo negativo (VPN) de acuerdo con las definiciones y fórmulas publicadas en Trevethan (40). Además, se calcularon los cocientes de probabilidad positivos y negativos (LR+ y LR−, respectivamente) resultantes (41) y se incluyeron como métricas de rendimiento.
2.7 Objetivos de estudio para la prueba de hipótesis
Este estudio buscó responder a las siguientes preguntas:
Un. ¿Puede la espectroscopia Raman detectar diferencias en los metabolomas de la orina de perros con cáncer de perros sanos o de aquellos con otras enfermedades del tracto urinario no neoplásico?
B. ¿Se puede usar la espectroscopia Raman de orina canina para distinguir entre linfoma canino (lC), carcinoma urotelial (CU), osteosarcoma (SG) y tumores de mastocitos (TCM)?
C. ¿La presencia de agentes quimioterapéuticos perjudica o influye en la prueba de orina?
D. ¿Se puede utilizar la espectroscopia Raman de orina canina para identificar la presencia de enfermedades del tracto urinario no neoplásicas?
Estas preguntas se utilizaron para compilar el diagrama de flujo general de la prueba de detección para el cáncer canino y las enfermedades del tracto urinario no neoplásico que se muestran en la Figura 1. Es importante tener en cuenta que la prueba de detección de orina descrita aquí está destinada a complementar los métodos de prueba, los exámenes físicos y los métodos de tratamiento establecidos como estándar de oro.
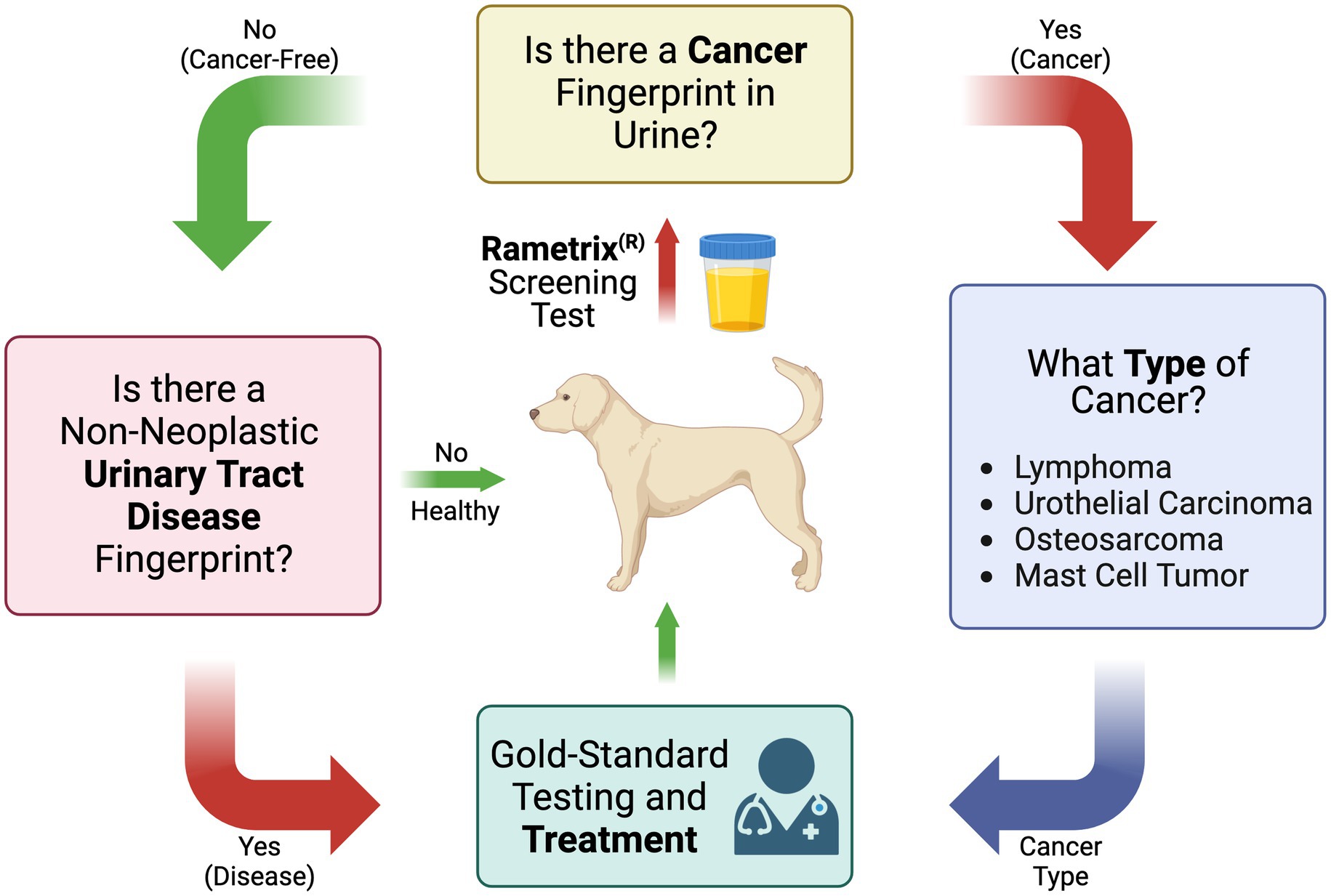 Figura 1. Diagrama de flujo de la prueba de detección de orina canina basada en espectroscopia Raman para cáncer, tipo de cáncer y otras enfermedades del tracto urinario no neoplásico.
Figura 1. Diagrama de flujo de la prueba de detección de orina canina basada en espectroscopia Raman para cáncer, tipo de cáncer y otras enfermedades del tracto urinario no neoplásico.
3 Resultados
3.1 Enfoque procedimental y computacional
El escaneo de muestras de orina individuales se realizó en menos de cinco (5) minutos por muestra (múltiples escaneos con láser), sin necesidad de preparación de la muestra. Las muestras de orina se alícuota en viales de vidrio de borosilicato de 1,5 ml y luego se escanearon. En la Figura 2 se muestra el procedimiento general desde el escaneo Raman hasta la obtención de información médica sobre una muestra de orina. Una vez implementados en la práctica, el procesamiento espectral, la línea de base y los cálculos quimiométricos asociados con Rametrix fueron casi instantáneos.®
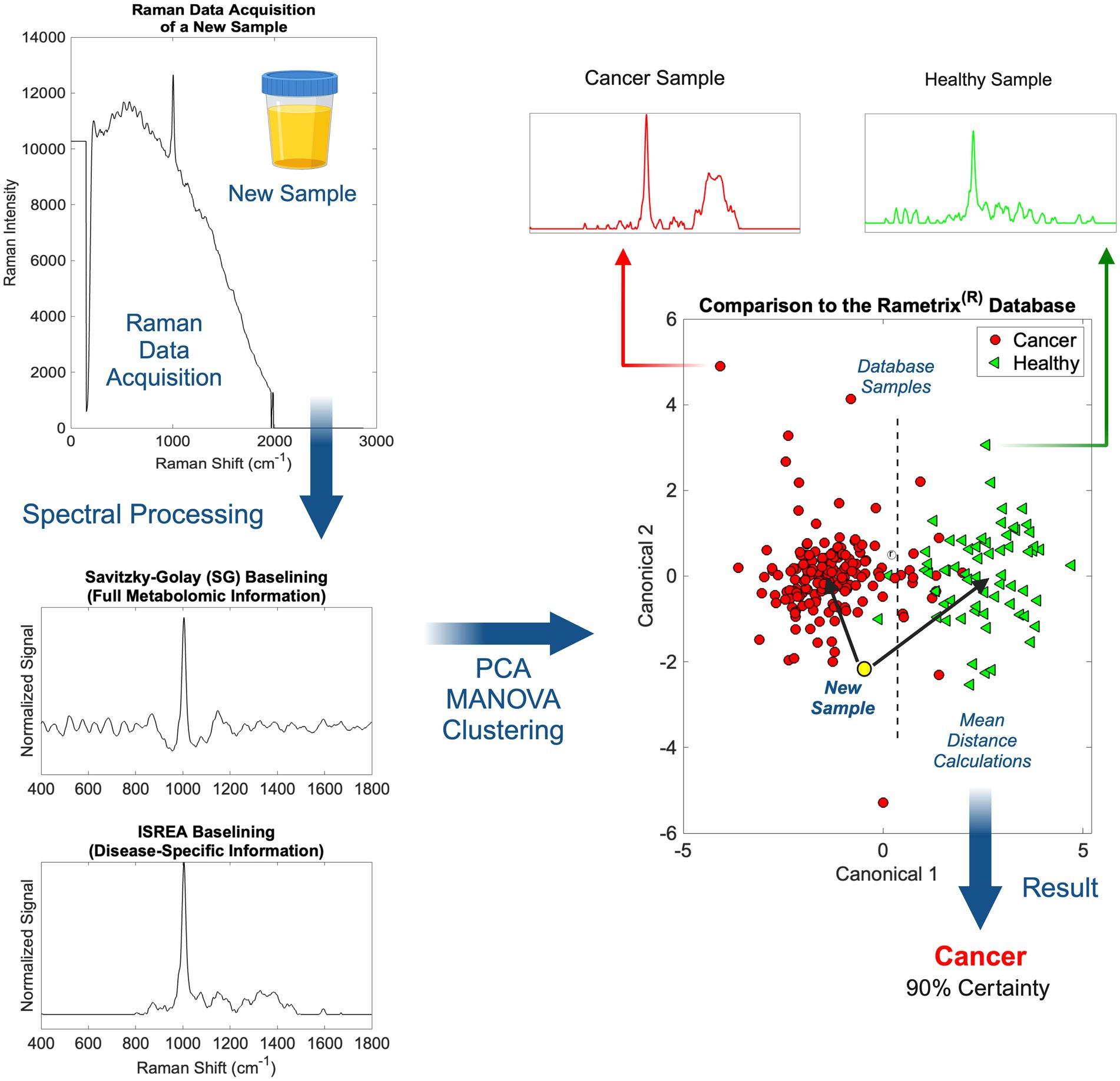 Figura 2. Una descripción general del procesamiento espectral Raman y los cálculos de Rametrix con la línea de base ISREA y SG.®
Figura 2. Una descripción general del procesamiento espectral Raman y los cálculos de Rametrix con la línea de base ISREA y SG.®
Tras la adquisición de un espectro Raman urinario, se transformó mediante la línea de base (Figura 2). Esto permitió la eliminación de la fluorescencia de fondo y la normalización de la señal Raman. Para ello, se utilizaron dos métodos: (i) Savitzky-Golay (SG) y (ii) ISREA. SG es un algoritmo ampliamente conocido en química analítica, e ISREA es un desarrollo relativamente nuevo (37). Mientras que la SG conserva todo el espectro Raman, ISREA puede amplificar las regiones de los espectros que contienen información relacionada con la enfermedad, al tiempo que minimiza las regiones conservadas. Esto ha servido para mejorar la precisión de la predicción de espectros de muestras desconocidas en estudios anteriores (32, 33, 36). Los resultados obtenidos con el uso de ISREA se presentan aquí, y los resultados obtenidos con el uso de SG se dan en el material complementario.
Después de la línea de base, se produjeron modelos quimiométricos utilizando PCA, MANOVA y DAPC. El objetivo del modelado quimiométrico era asociar espectros completos (compuestos por señales de cientos/miles de moléculas) con una condición de enfermedad (por ejemplo, cáncer, cL, CU, etc.). Al hacer esto, se identificó una «huella dactilar» espectral para una enfermedad específica. Se ha demostrado que esto identifica una enfermedad en la orina sin cuantificar todas las moléculas del metaboloma subyacente (25, 36, 42-45).
En los modelos PCA y DAPC (Figura 2), cada espectro de referencia se redujo a un solo punto de datos. El agrupamiento reveló las similitudes o diferencias entre los espectros de los grupos de muestras, al igual que con la espectroscopia Raman, el espectro de una muestra es representativo de su metaboloma. Tras la construcción de los modelos PCA y DAPC, los modelos se validaron de forma cruzada con el análisis de dejar uno fuera, como se describió anteriormente. Se determinó su identidad (p. ej., un miembro del grupo cL, grupo sano, etc.) y se comparó con su clasificación real. A partir de estos cálculos, se derivaron e informaron las métricas de rendimiento (precisión, sensibilidad, especificidad, VPP, VPN, LR+ y LR−) (40, 41) del procedimiento de cribado en orina de Rametrix.®
3.2 Espectros Raman
En la Figura 3 se muestran los espectros Raman para los grupos cL, UC, OS, MCT, UT Disease y Healthy. Aquí también se muestran los espectros de todas las muestras de Surine™ analizadas a lo largo del estudio. En todos los espectros, las líneas de color representan el espectro promedio del grupo. La región gris sombreada representa la desviación total observada en cada desplazamiento Raman (o número de onda). Esto ayuda a inferir una cantidad total de variabilidad observada entre las muestras. Por ejemplo, se observó relativamente poca variabilidad entre las 18 muestras y exploraciones de Surine™ (Figura 3) adquiridas. Estos resultados confirmaron el buen funcionamiento y calibración del espectrómetro Raman durante todo el estudio.
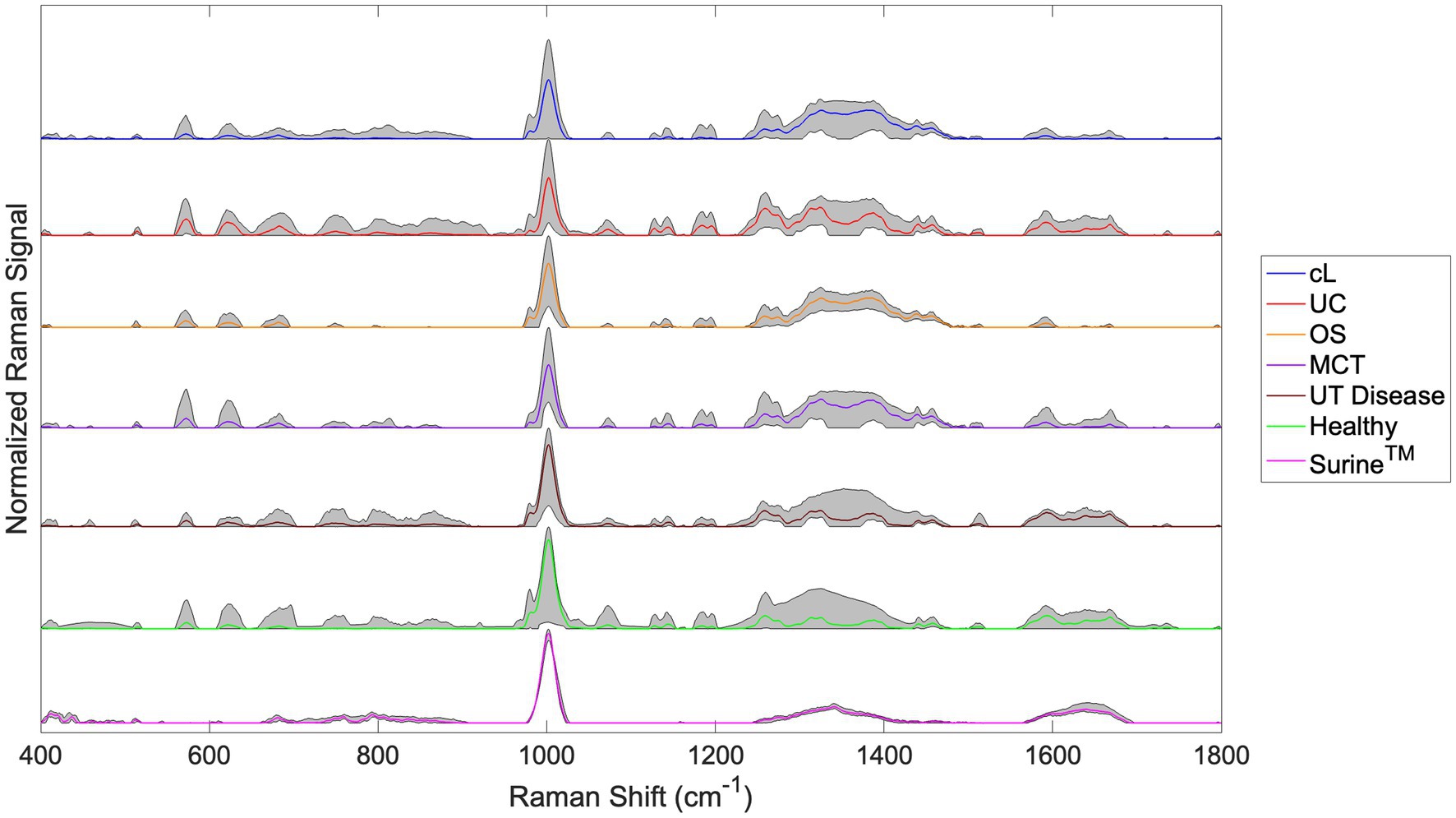 Figura 3. Espectros Raman en orina para los grupos de linfoma canino (lL), carcinoma urotelial (CU), osteosarcoma (SG), tumor de mastocitos (TCM), enfermedad del tracto urinario no neoplásico (enfermedad UT), perros sanos y grupos de surina™ definidos en la Tabla 2. Las líneas de color representan el espectro de grupo promedio y las regiones sombreadas muestran el rango de la señal Raman para el grupo. Todos los espectros se truncaron a 400-1.800 cm−1, con una línea de base con SG y un vector normalizado.
Figura 3. Espectros Raman en orina para los grupos de linfoma canino (lL), carcinoma urotelial (CU), osteosarcoma (SG), tumor de mastocitos (TCM), enfermedad del tracto urinario no neoplásico (enfermedad UT), perros sanos y grupos de surina™ definidos en la Tabla 2. Las líneas de color representan el espectro de grupo promedio y las regiones sombreadas muestran el rango de la señal Raman para el grupo. Todos los espectros se truncaron a 400-1.800 cm−1, con una línea de base con SG y un vector normalizado.
Para las muestras del grupo de enfermedades neoplásicas (cáncer) (cL, CU, OS, y MCT), se observó una región de variabilidad relativamente alta en la región de desplazamiento Raman de 1.200 a 1.400 cm−1. Esta región está dominada rutinariamente por bandas Raman de amida asociadas con β� -Estructuras laminares y colágeno (entre otros) (38). Tras la inspección visual de los espectros, se observaron muchas similitudes y diferencias. El análisis quimiométrico con Rametrix Toolbox se utilizó para determinar cuál de ellas daba lugar a huellas dactilares espectrales únicas que podrían utilizarse para determinar la identidad de una muestra de orina desconocida. Para ello, se abordaron las cuatro preguntas del estudio identificadas anteriormente.®
3.3 ¿Puede la espectroscopia Raman detectar diferencias en los metabolomas de la orina de perros con cáncer de perros sanos o de aquellos con otras enfermedades del tracto urinario no neoplásico?
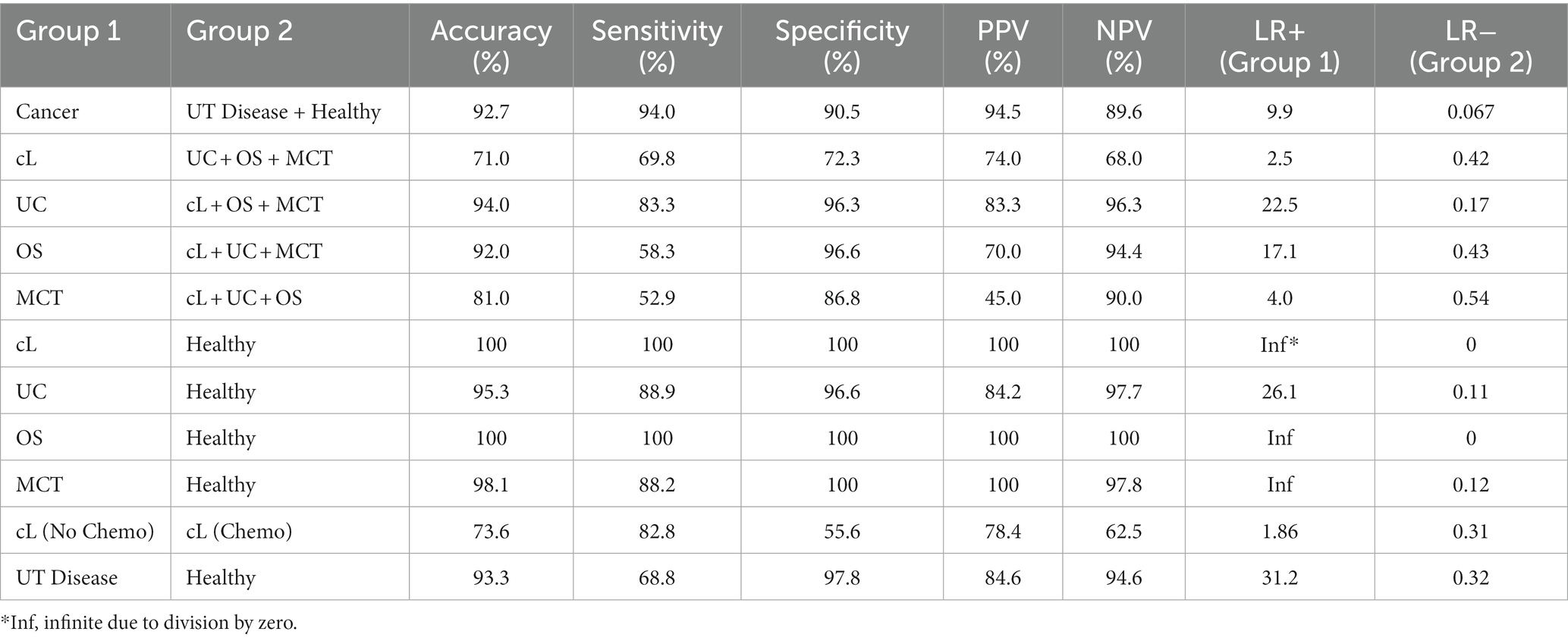
Esto responde a la primera pregunta de la Figura 1 (¿Hay una huella dactilar de cáncer en la orina [canina]?). Los espectros Raman de orina del grupo de cáncer se compararon con los grupos de enfermedad sana y UT (ambos libres de cáncer) utilizando la caja de herramientas de Rametrix. Se construyeron modelos quimiométricos, como se muestra en la Figura 2, para extraer una huella dactilar espectral única asociada con el cáncer en perros. El modelo se validó de forma cruzada con el análisis de dejar uno fuera, como se describió anteriormente, para producir un modelo de cribado de orina para el cáncer. Las métricas de rendimiento (precisión, sensibilidad, especificidad, VPP, VPN, LR+ y LR−) se indican en la Tabla 3. Todas las métricas basadas en porcentajes superaron el 90% (excepto el VAN, que fue del 89,6%). El LR+ fue de 9,9 y el LR− de 0,067. Cabe señalar que un LR+ > 10 y un LR− < 0,1 han sido identificados como «muy útiles para establecer o excluir un diagnóstico» (41). Los nodos ISREA utilizados se indican en la Tabla complementaria S1, y las métricas de rendimiento cuando se utiliza SG se indican en la Tabla complementaria S2. La línea de base ISREA proporcionó una ventaja sobre la SG en la extracción de una huella espectral única para el cáncer a partir de la orina canina. Por ejemplo, la precisión global con ISREA fue del 92,7% (Tabla 3) y del 85,1% con SG (Tabla Suplementaria S2). A continuación, en la Figura 4, se muestran los gráficos de los espectros de referencia ISREA, PCA y MANOVA. En la Figura 4C, los resultados que se muestran son las predicciones cuando cada muestra se trató como una incógnita y el resto de las muestras se utilizaron para construir el modelo predictivo.®
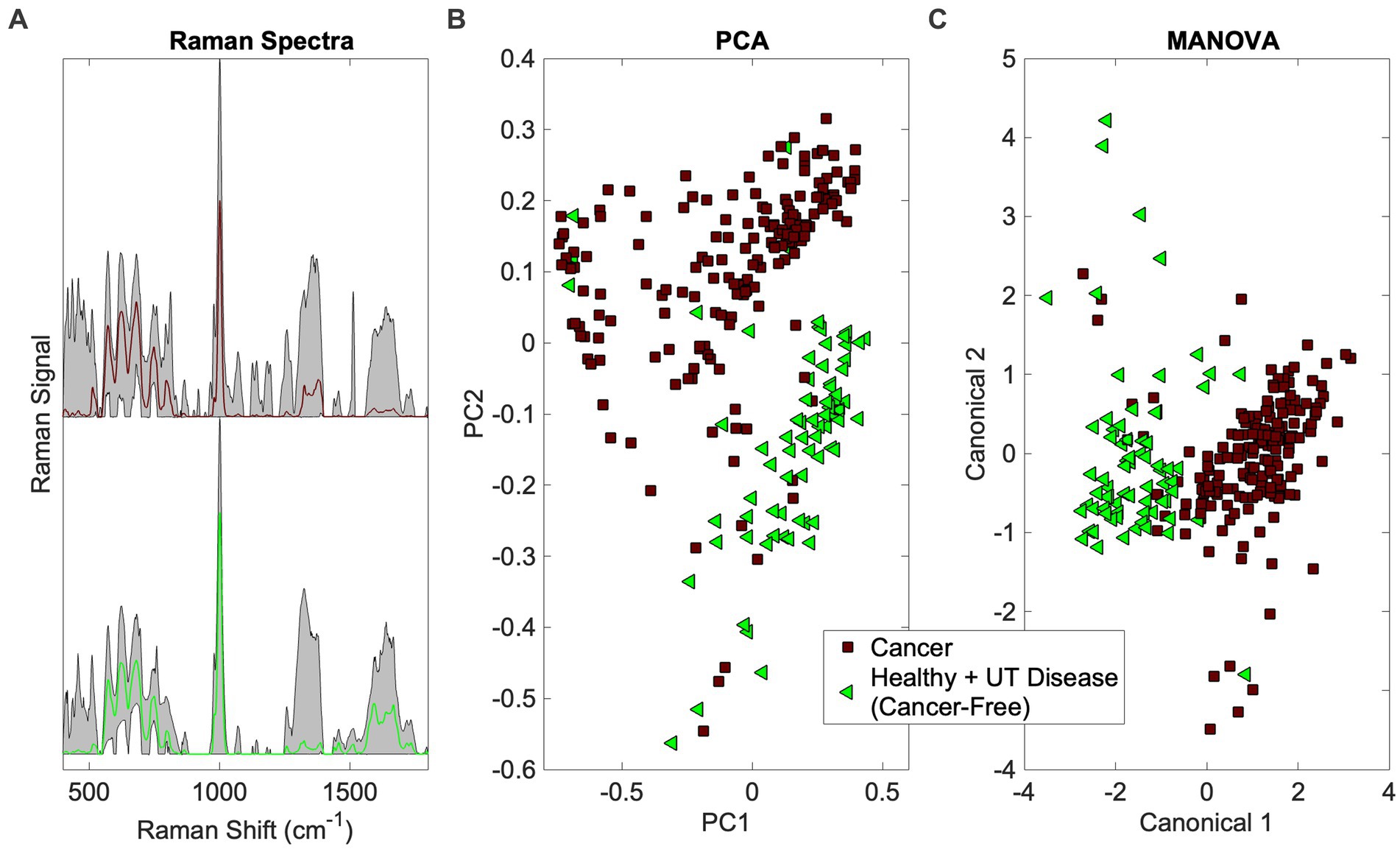 Figura 4. Identificación de la firma espectral del cáncer en orina canina. (A) espectros Raman (espectro promedio en color con rango total sombreado), (B) PCA y (C) agrupamiento MANOVA.
Figura 4. Identificación de la firma espectral del cáncer en orina canina. (A) espectros Raman (espectro promedio en color con rango total sombreado), (B) PCA y (C) agrupamiento MANOVA.
También se investigaron las cargas de PCA y MANOVA para determinar qué bandas Raman eran responsables de componer la huella dactilar del cáncer en la orina canina. Aquí, se investigaron las 27 cargas principales. De estos, 11 se asociaron con bandas Raman presentes en las cargas de PCA y MANOVA. Uno de ellos fue asignado, según Talari et al. (38) y Movasaghi et al. (39), a fosfatidilinositol (576 cm)−1) y seis se asociaron con proteínas (especialmente colágeno) (621, 1.011, 1.160, 1.260, 1.313, 1.344 cm−1). Además, dos bandas se asociaron con ácidos grasos y lípidos (1.300 y 1.313 cm−1), uno con glucosa (1.344 cm−1), y tres bandas estaban indefinidas (685, 983, 1.644 cm−1). Entre las cargas de MANOVA se destacan las asignaciones de glóbulos rojos (991 cm−1) (46) y tejidos malignos (1.450 cm−1) (47 y 48).
3.4 ¿Se puede utilizar la espectroscopia Raman de orina canina para distinguir entre linfoma canino (lL), carcinoma urotelial (CU), osteosarcoma (SG) y tumores de mastocitos (TCM)?
A continuación, tratamos de determinar si Rametrix podía distinguir entre los diferentes tipos de cáncer. Esto se muestra en la Figura 1, donde se determinaría el tipo de cáncer en caso de que una muestra diera positivo para cáncer (consulte la sección anterior). Para ello, se analizó un grupo de cáncer en particular (p. ej., cL) en comparación con la combinación de los otros grupos de cáncer (p. ej., CU + SG + MCT) para determinar si existía una huella espectral única para ese cáncer en particular. Los resultados se muestran en la Tabla 3 (y en la Tabla Suplementaria S2 para la línea de base de SG). La colitis ulcerosa fue el cáncer más reconocible, con todas las métricas de predicción superando el 83%. Como se describe en Trevethan (40) y Ranganathan y Aggarwal (41), la idoneidad de un método de cribado está determinada por todas sus métricas de rendimiento basadas en porcentajes (precisión, sensibilidad, especificidad, VPP y VPN), así como por LR+ y LR−. Por lo tanto, al considerar un cribado de orina de Rametrix para CU, lo hacemos por la métrica mínima basada en porcentajes (sensibilidad y VPP del 83,3%) a pesar de que otras métricas (especificidad y VPN) alcanzaron el 96,3%. Esto ayuda a evaluar casos, como la SG, que tuvo una precisión general similar a la CU (92,0 vs. 94,0 %), pero tuvo una métrica mínima del 58,3 % (sensibilidad). Esto también es evidente en los valores LR+ y LR−, pero estos valores calculados incorporan solo sensibilidad y especificidad. Por lo tanto, la prueba de detección de CU se consideró superior a la de la SG. Es probable que esto sea un reflejo de la interacción directa del carcinoma urotelial y la patología asociada al cáncer (reacción inflamatoria local y hemorragia) con la muestra de orina. El cribado de cL tenía una métrica mínima del 68,0 %, y el de MCT tenía una métrica mínima del 52,9 %.®®
Los cánceres individuales también se compararon con el grupo sano. Estos resultados también se presentan en la Tabla 3 y en la Tabla Suplementaria S2. Aquí, las métricas mínimas para CL, UC, OS, y MCT fueron 100%, 84,2%, 100% y 88,2%, respectivamente. Esto sugiere que cuando se realiza la detección de un tipo particular de cáncer, en ausencia de enfermedades UT no neoplásicas, existen pruebas de detección de orina más efectivas.
3.5 ¿La presencia de agentes quimioterapéuticos perjudica o influye en el análisis de orina?
Era necesario demostrar que los agentes quimioterápicos en la orina de los pacientes con cáncer no eran responsables de la huella espectral del cáncer detectada antes. Para verificar nuestro resultado, comparamos el grupo de cL Quimio (pacientes con cL que reciben quimioterapia) con el grupo cL Sin quimioterapia (pacientes con cL que reciben tratamiento que no incluye quimioterapia). Una vez más, las métricas de predicción de la prueba de orina de Rametrix se dan en la Tabla 3 y en la Tabla Suplementaria S2. Como se mostró anteriormente, la métrica mínima para la detección del cáncer fue del 89,6% (VPN). Al distinguir los grupos cL Quimio de cL No Chemo, la métrica mínima fue de 55,6% (especificidad). Además, la precisión general de los exámenes de detección fue del 92,7 % y del 73,6 % para la detección del cáncer y la quimioterapia, respectivamente. Además, los gráficos espectrales (véase la Figura Suplementaria S1) parecen casi idénticos para los grupos cL Chemo y cL No Quimio. Debido a esto, concluimos que el cL (y probablemente otros cánceres) tiene una huella espectral que es independiente de los quimioterápicos (o sus productos de descomposición) que podrían residir en la orina. Claramente, esto requerirá más estudios con un mayor número de perros sometidos a recolección secuencial de orina durante la quimioterapia.®
También se investigaron las cargas de PCA y MANOVA para saber qué bandas Raman son significativas en la separación de los grupos cL, Sin quimioterapia y Sano. Se buscaron bandas Raman únicas que no aparecieran en la huella dactilar del cáncer anterior. Se investigaron 10 cargas únicas. De estos, cuatro estaban relacionados con ácidos nucleicos (particularmente citosina) (1.287, 1.293, 1.325, 1.423 cm−1). Tres estaban relacionados con la proteína (700, 1.602, 1.660 cm−1), y uno se relacionó con la porfirina (1.620 cm−1) (49). La banda de tejido maligno (1.450 cm−1) se reconoció en este análisis. Además, se reconocieron numerosas bandas en la firma espectral cL que coincidió con la firma general del cáncer discutida anteriormente.
3.6 ¿Se puede utilizar la espectroscopia Raman de orina canina para identificar la presencia de enfermedades del tracto urinario no neoplásicas?
Como se muestra en la Figura 1, si una muestra de orina dio negativo para cáncer, se realizará una prueba de detección adicional para detectar la presencia de enfermedad del tracto urinario no neoplásica. Por lo tanto, el grupo de la enfermedad de UT se analizó contra el grupo de sanos para determinar si había una huella dactilar de la enfermedad de UT. Observamos que el grupo de cáncer no se incluye aquí, ya que el cáncer se examina primero y se le da la máxima prioridad en nuestro modelo de detección. Los resultados se presentan en la Tabla 3 y en la Tabla Suplementaria S2. La precisión global para la detección de la enfermedad UT, como los urolitos y la cistitis inflamatoria/infecciosa fue del 93,3%, con una métrica mínima del 68,8% (sensibilidad), LR+ de 31,2 y un LR− de 0,32. Por lo tanto, la detección de una huella dactilar de cáncer produjo mejores métricas generales que la de una enfermedad del tracto urinario no neoplásico dado el conjunto de datos analizado.
4 Discusión
Una prueba de detección de orina simple, rápida y económica, comparable en costo ($ 75 a $ 150) a las pruebas de hematología / química / análisis de orina de rutina (individualmente), para identificar la presencia de cáncer, utilizando orina de perro, debería ser de gran interés para los dueños de perros, criadores y veterinarios. Los dueños de mascotas claramente quieren disfrutar de los muchos beneficios de sus mascotas y tienen un interés sincero y bien fundado en mantener la salud de su perro. La mayoría son conscientes de que la enfermedad neoplásica es común en perros de mediana edad y mayores, y los propietarios de algunas «razas de alto riesgo» (Golden Retrievers, Boxers, por ejemplo) son muy conscientes de la realidad siempre presente del cáncer con la edad avanzada de sus mascotas. La mayoría de los dueños de perros y sus veterinarios entienden que, en muchos casos, la detección temprana del cáncer está potencialmente correlacionada con mejores resultados en términos de control tumoral y calidad de vida. De la misma manera, cuando se les presenta un perro que tiene cáncer, los dueños y sus veterinarios se enfrentan a decisiones difíciles, incluyendo si tratar o no y cómo pueden evaluar si el tratamiento está funcionando. Nuestras herramientas actuales (observación clínica, imágenes y estudios de laboratorio) son, en el mejor de los casos, imprecisas (y costosas) para determinar la eficacia del tratamiento. El método descrito aquí está diseñado para informar a los veterinarios utilizando un análisis de orina rápido y económico que podría aplicarse ampliamente. Es probable que los veterinarios opten por complementar estos resultados con más pruebas, incluidas imágenes, biopsias y otras pruebas de laboratorio. No estamos proponiendo reemplazar ningún método de referencia o práctica aceptada.
Aquí, hemos demostrado que nuestro enfoque con la espectroscopia Raman y el modelado quimiométrico Rametrix puede llenar los vacíos y proporcionar un método fácilmente accesible, simple y preciso para la detección del cáncer. En este estudio piloto «primero en perros», cuando se realizó una prueba con un grupo de cáncer que consistía en 100 muestras que representaban cuatro cánceres comunes en caninos, se detectó la huella espectral amplia del cáncer con una precisión superior al 92 % (con una sensibilidad del 94 %, una especificidad del 90 %, LR+ de 9,9 y LR− de 0,067).®
Las pruebas de detección de orina canina resultantes podrían implementarse en la práctica de la siguiente manera. Cada cribado (p. ej., Cáncer vs. Enfermedad de UT + Sano en la Tabla 3) consta de un conjunto de nodos ISREA, una matriz de coeficientes de PCA, un vector de PCA de valores medios, una matriz de vectores propios MANOVA y una puerta lógica para separar los conglomerados por puntuaciones canónicas (Figura 4C). Estos valores numéricos comprenden el modelo de cribado de Rametrix y se pueden entregar a escáneres Raman remotos. Por lo tanto, los grandes conjuntos de datos de espectros Raman de orina canina solo deben compilarse en una ubicación centralizada. Una vez instalado, el modelo de cribado Rametrix resultante permitirá el cribado de una muestra de orina obtenida localmente con nuestra gran base de datos de muestras. A medida que nuestra base de datos siga creciendo, el modelo de cribado de Rametrix se actualizará y distribuirá fácilmente a los escáneres Raman (ya sea en un servicio comercial de laboratorio de patología veterinaria o en consultorios veterinarios). También hemos desarrollado métodos para calibrar y sincronizar escáneres implementados de forma remota e incluso hemos desarrollado dispositivos Raman personalizados para automatizar el escaneo de múltiples muestras de orina y proporcionar resultados del modelo de detección de Rametrix. Sin embargo, la implementación de esta visión a largo plazo es un esfuerzo futuro que va más allá del alcance del estudio descrito en este documento.®®®®
Desde el punto de vista del modelado de datos, observamos en este estudio una ventaja de la línea de base ISREA sobre un método SG estándar de la industria. Destacamos la comparación de estos dos métodos porque ISREA sigue siendo relativamente nuevo y ha aparecido en un número limitado de nuestras publicaciones recientes de resultados que analizan muestras de orina de pacientes humanos. SG, por otro lado, ha estado bien establecido en el procesamiento de señales y la química analítica durante muchos años. Se cuestionarían los resultados si se detectaran diferencias discernibles y huellas dactilares del cáncer con ISREA pero ausentes con la línea de base de SG. Aquí, observamos la identificación de huellas dactilares con ambos métodos, pero vimos ventajas aparentemente significativas de ISREA, lo que la convierte en una inclusión necesaria en el modelo de detección de Rametrix. Además, este método nos permitió identificar numerosas bandas Raman (y biomoléculas asociadas) que difieren en la orina de perros con cáncer y perros sanos. Por lo tanto, la identificación del cáncer en la orina se realizó aquí mediante el reconocimiento de firmas espectrales de varias moléculas, en lugar de un biomarcador de cáncer singular. Además, la firma de cL compartía muchas similitudes con la firma general del cáncer; sin embargo, se observaron características únicas para la lC.®
Existen limitaciones de este estudio que afectan la interpretación y generalizaciones amplias de los resultados:
i. El grupo de cáncer de este estudio consistió en muestras de perros con lL, COLITIS ULCEROSA, TCM y SG. Estos se incluyeron porque fueron remitidos con mayor frecuencia a nosotros para su evaluación y tratamiento; por lo tanto, estaban más representados en nuestro conjunto de datos más grande. En estudios futuros, el grupo de Cáncer contendrá muestras de perros con otras enfermedades neoplásicas.
ii. Aunque más que adecuado para una prueba de concepto de la metodología de huellas dactilares espectrales Raman, se obtuvieron muestras de un grupo relativamente pequeño y heterogéneo de casos de cáncer. Por ejemplo, no se buscaron diferencias entre los tumores apendiculares, axiales o extraesqueléticos en el grupo de SG debido al pequeño número de muestras en el conjunto de datos. Esto se remediará mediante la acumulación y el análisis continuos de casos en los próximos años. Otro ejemplo es el grupo de la enfermedad de UT en este estudio. Este grupo estaba infrarrepresentado en el número de pacientes en relación con los grupos de cáncer y sanos. Nuestra hipótesis es que con una población más grande y mejor definida, la detección de enfermedades del tracto urinario no neoplásico con nuestro cribado mejorará. Reconocemos que necesitamos realizar investigaciones adicionales sobre las huellas espectrales asociadas con la enfermedad renal crónica, una morbilidad muy común en perros de mediana edad y mayores (50-57).
iii. Es posible que algunos perros que estaban clínicamente sanos hayan tenido una enfermedad neoplásica no diagnosticada u otras comorbilidades en evolución. Los estudios futuros incluirán disposiciones para el contacto continuo con los dueños de perros y sus veterinarios para definir el contexto de «sano» en el momento de la toma de muestras. De hecho, un uso realista y deseable de esta tecnología basada en espectroscopía Raman puede ser el cribado periódico de enfermedades neoplásicas no diagnosticadas en perros sanos (es decir, la detección precoz a través del cribado). Sin embargo, basándonos en los resultados presentados aquí, no podemos determinar si nuestros métodos son lo suficientemente sensibles como para detectar la enfermedad neoplásica incipiente. Estamos comprometidos, en estudios planificados, a ver si la detección temprana es realmente posible.
iv. Reconocemos que aproximadamente el 95% de las muestras de orina se recolectaron mediante «captura libre» miccional, mientras que las demás se recolectaron de catéteres o cistocentesis. Una vez más, el número de muestras era demasiado pequeño en este estudio de prueba de concepto para probar el método de recolección en detalle. No se observaron diferencias significativas en los espectros según el método de recolección por inspección visual. Además, no se observaron diferencias significativas para las colecciones de orina miccionadas frente a las de catéter de pacientes humanos en estudios previos (33, 58).
v. No se documentaron, con muestreos seriados, los efectos de los tratamientos antineoplásicos para perros en este estudio. Unos pocos perros, bajo tratamiento, proporcionaron múltiples muestras tanto durante como al final del tratamiento (debido a la remisión, el retiro del estudio o la progresión de la enfermedad). Sin embargo, el número de perros de los que se disponía de datos de muestreo en serie era insuficiente para sacar conclusiones significativas. El muestreo en serie durante el tratamiento se incluirá en futuros protocolos y estudios de muestreo, especialmente en los estudios que pretendemos realizar sobre el linfoma, en los que planteamos la hipótesis de que habría cambios en la huella molecular de la orina Raman correlacionados con la remisión de la enfermedad, la estabilización o, por el contrario, con la progresión y el fracaso del tratamiento.
vi. Reconocemos fácilmente que los resultados de nuestro análisis de orina molecular basado en espectroscopia Raman deben conservarse y utilizarse en un contexto clínico de historia, examen físico, estudios de laboratorio e imágenes concurrentes y observación del paciente. Sería inapropiado y desaconsejable que una huella dactilar espectral de orina Raman positiva (positiva para cáncer) desencadene pruebas costosas y quizás innecesarias, o que se utilice como una métrica única y definitiva para decidir si se sacrifica o no a un perro.
Esperamos que la novedosa tecnología descrita aquí pueda estar disponible, en beneficio de los perros, sus dueños, criadores y veterinarios, por igual, a través de dispositivos de escaneo Raman de orina distribuidos y el modelo de detección Rametrix. Para que tenga un valor real en el manejo del cáncer en los perros, se necesita mucho trabajo futuro.®
5 Conclusión
Aquí se presenta una prueba de detección de orina precisa y rápida para detectar el cáncer en perros. El ensayo utiliza espectroscopía Raman para discernir huellas dactilares espectrales, compuestas por cientos de moléculas (no biomarcadores individuales), en la orina. Podría usarse como parte de las evaluaciones regulares de bienestar, como una ayuda en la detección temprana del cáncer, especialmente en razas altamente predispuestas al desarrollo de ciertos tipos de cáncer. También puede ser útil para evaluar las respuestas al tratamiento y, potencialmente, para evaluar la recurrencia o la progresión de los tumores. Aunque en este estudio nos centramos en el linfoma, el cáncer hematológico más frecuente en perros, y en otras neoplasias malignas comunes y graves (carcinoma urotelial, mastocitos y osteosarcoma), pretendemos ampliar nuestros estudios a perros de todas las edades y razas, incluidos los que padecen otras neoplasias malignas. Las principales ventajas del enfoque presentado aquí son que es económico, rápido y requiere una preparación mínima de la muestra. Las numerosas moléculas de la huella espectral del cáncer se pueden medir en un solo ensayo.
Declaración de disponibilidad de datos
Los datos brutos que respaldan las conclusiones de este artículo serán puestos a disposición por los autores, sin reservas indebidas.
Declaración ética
Los estudios en animales fueron aprobados por los protocolos 15-217, 17-011 y 19-240 de Virginia Tech IACUC. Los estudios se llevaron a cabo de acuerdo con la legislación local y los requisitos institucionales. Se obtuvo el consentimiento informado por escrito de los propietarios para la participación de sus animales en este estudio.
Contribuciones de los autores
JLR: Conceptualización, Obtención de Fondos, Investigación, Metodología, Administración de Proyectos, Recursos, Supervisión, Validación, Visualización, Redacción – borrador original, Redacción – revisión y edición. ND: Conceptualización, Investigación, Metodología, Recursos, Supervisión, Validación, Redacción – revisión y edición. JR: Investigación, Metodología, Recursos, Supervisión, Validación, Redacción, Revisión y Edición, Curación de Datos. MN: Investigación, Metodología, Recursos, Redacción – revisión y edición. DF: Investigación, Curación de datos, Redacción, revisión y edición. CD: Curación de datos, Investigación, Redacción – revisión y edición. LN: Curación de datos, investigación, redacción, revisión y edición. IA: Curación de datos, Investigación, Análisis formal, Metodología, Software, Supervisión, Redacción, revisión y edición. GG: Conceptualización, Validación, Escritura – Revisión y Edición. GO: Conceptualización, Validación, Escritura – Revisión y Edición. RS: Conceptualización, Validación, Curación de datos, Análisis formal, Obtención de fondos, Investigación, Metodología, Administración de proyectos, Recursos, Software, Supervisión, Visualización, Redacción – borrador original, Redacción – revisión y edición.
Financiación
El/los autor/es declara(n) haber recibido apoyo financiero para la investigación, autoría y/o publicación de este artículo. Se agradece el apoyo financiero y de investigación (muestras de orina) de la Fundación Westie de América y la Asociación Americana de Perros Pastores de Shetland.
Reconocimientos
También se reconoce con gratitud la meticulosa recolección de muestras de orina de perros que se someten a tratamiento contra el cáncer por parte del personal del Centro de Investigación y Atención del Cáncer Animal, Roanoke, VA, y el Servicio de Oncología de la Facultad de Medicina de Virginia-Maryland, Blacksburg, VA. También se agradece la participación de David Grant en la acumulación de casos, la recolección de muestras y la revisión de manuscritos. Las figuras 1 y 2 se crearon utilizando biorender.com.
Conflicto de intereses
JLR y RS cofundaron Rametrix Technologies, Inc. para comercializar algunos o todos los hallazgos descritos en este documento. La IA fue empleada por Rametrix Technologies, Inc.
El resto de los autores declaran que la investigación se llevó a cabo en ausencia de relaciones comerciales o financieras que pudieran interpretarse como un potencial conflicto de intereses.
El/los autor/es declararon, en el momento de la presentación, ser miembro del consejo editorial de Frontiers. Esto no tuvo ningún impacto en el proceso de revisión por pares ni en la decisión final.
Nota del editor
Todas las afirmaciones expresadas en este artículo son únicamente las de los autores y no representan necesariamente las de sus organizaciones afiliadas, ni las del editor, los editores y los revisores. Cualquier producto que pueda ser evaluado en este artículo, o afirmación que pueda ser hecha por su fabricante, no está garantizado ni respaldado por el editor.
Material complementario
El material complementario para este artículo se puede encontrar en línea en: https://www.frontiersin.org/articles/10.3389/fvets.2024.1328058/full#supplementary-material
Referencias
1. Cáncer en mascotas | Asociación Americana de Medicina Veterinaria. Disponible en: https://www.avma.org/resources/pet-owners/petcare/cancer-pets (consultado el 16 de enero de 2024).
2. Grüntzig, K, Graf, R, Boo, G, Guscetti, F, Hässig, M, Axhausen, KW, et al. Registro suizo de cáncer canino 1955-2008: aparición de los diagnósticos tumorales más comunes e influencia de la edad, la raza, el tamaño corporal, el sexo y el estado de castración en el desarrollo tumoral. J Comp Pathol. (2016) 155:156–70. doi: 10.1016/j.jcpa.2016.05.011
Resumen de PubMed | Texto completo de Crossref | Google Académico
3. Comazzi, S, Marelli, S, Cozzi, M, Rizzi, R, Finotello, R, Henriques, J, et al. Los riesgos asociados a la raza para desarrollar linfoma canino difieren entre países: un estudio de la Red Europea de Linfoma Canino. BMC Vet Res. (2018) 14:232. doi: 10.1186/s12917-018-1557-2
4. Schwartz, SM, Urfer, SR, White, M, Megquier, K y Shrager, SDog Aging Project Consortium, et al. Prevalencia a lo largo de la vida de tumores malignos y benignos en perros de compañía: análisis transversal de la encuesta de línea de base del proyecto de envejecimiento canino. Veterinario Comp Oncol. (2022) 20:797–804. doi: 10.1111/vco.12839
5. Kruglyak, KM, Chibuk, J, McLennan, L, Nakashe, P, Hernandez, GE, Motalli-Pepio, R, et al. Biopsia líquida basada en sangre para el perfil genómico completo del cáncer mediante secuenciación de próxima generación: un paradigma emergente para la detección y el tratamiento no invasivos del cáncer en perros. Front Vet Sci. (2021) 8:704835. doi: 10.3389/fvets.2021.704835
Resumen de PubMed | Texto completo de Crossref | Google Académico
6. Rafalko, JM, Kruglyak, KM, McCleary-Wheeler, AL, Goyal, V, Phelps-Dunn, A, Wong, LK, et al. Edad en el momento del diagnóstico de cáncer por raza, peso, sexo y tipo de cáncer en una cohorte de más de 3.000 perros: determinación de la edad óptima para iniciar el cribado del cáncer en pacientes caninos. PLoS Uno. (2023) 18:e0280795. doi: 10.1371/journal.pone.0280795
Resumen de PubMed | Texto completo de Crossref | Google Académico
7. Namgong, C, Kim, JH, Lee, MH y Midkiff, D. Detección no invasiva del cáncer en orina canina a través de la quimiotaxis de Caenorhabditis elegans. Front Vet Sci. (2022) 9:932474. doi: 10.3389/fvets.2022.932474
Resumen de PubMed | Texto completo de Crossref | Google Académico
8. Craig, KKL, Wood, GA, Keller, SM, Mutsaers, AJ y Wood, RD. Perfil de microARN en el linfoma multicéntrico canino. PLoS Uno. (2019) 14:e0226357. doi: 10.1371/journal.pone.0226357
Resumen de PubMed | Texto completo de Crossref | Google Académico
9. Garnica, TK, Lesbon, JCC, Ávila, ACFCM, Rochetti, AL, Matiz, ORS, Ribeiro, RCS, et al. La biopsia líquida basada en pequeñas vesículas extracelulares predice la respuesta quimioterápica de los linfomas multicéntricos caninos. Sci Rep. (2020) 10:20371. doi: 10.1038/s41598-020-77366-7
10. Bouatra, S, Aziat, F, Mandal, R, Guo, AC, Wilson, MR, Knox, C, et al. El metaboloma de la orina humana. PLoS Uno. (2013) 8:e73076. doi: 10.1371/journal.pone.0073076
Resumen de PubMed | Texto completo de Crossref | Google Académico
11. Galloway, J. Observaciones sobre la enfermedad de Hodgkin. Hno. Med J. (1922) 2:1201–8. doi: 10.1136/bmj.2.3234.1201
12. Hottendorf, GH y Nielsen, SW. Necrosis de colágeno en mastocitomas caninos. Am J Pathol. (1966) 49:501–13.
13. Cambier, J-F, y Ronco, P. Onco-nefrología: enfermedades glomerulares con cáncer. Clin J Am Soc Nephrol. (2012) 7:1701–12. doi: 10.2215/CJN.03770412
14. Berns, JS, y Rosner, MH. Onconefrología: lo que el nefrólogo debe saber sobre el cáncer y el riñón. Clin J Am Soc Nephrol. (2012) 7:1691. doi: 10.2215/CJN.03240312
15. Chan, S, Oliver, KA y Gray, NA. Una asociación entre la glomerulonefritis membranoproliferativa y el carcinoma colorrectal metastásico: reporte de un caso. J Med Caso Rep. (2016) 10:199. doi: 10.1186/s13256-016-0979-3
Resumen de PubMed | Texto completo de Crossref | Google Académico
16. Pani, A, Porta, C, Cosmai, L, Melis, P, Floris, M, Piras, D, et al. Enfermedades glomerulares y cáncer: evaluación de la neoplasia maligna subyacente. J Nefrol. (2016) 29:143–52. doi: 10.1007/s40620-015-0234-9
Resumen de PubMed | Texto completo de Crossref | Google Académico
17. Bacchetta, J, Juillard, L, Cochat, P, y Droz, J-P. Enfermedades glomerulares paraneoplásicas y neoplasias malignas. Crit Rev Oncol Hematol. (2009) 70:39–58. doi: 10.1016/j.critrevonc.2008.08.003
18. Ahmed, M, Solangi, K, Abbi, R y Adler, S. Síndrome nefrótico, insuficiencia renal y neoplasia maligna renal: una glomerulonefritis inusual asociada a un tumor. J Am Soc Nephrol. (1997) 8:848–52. doi: 10.1681/ASN. V85848
Resumen de PubMed | Texto completo de Crossref | Google Académico
19. Lee, JC, Yamauchi, H, y Hopper, J. La asociación del cáncer y el síndrome nefrótico. Ann Intern Med. (1966) 64:41–51. doi: 10.7326/0003-4819-64-1-41
20. Pai, P, Bone, JM, McDicken, I, y Bell, GM. Tumor sólido y glomerulopatía. QJM Int J Med. (1996) 89:361–8. doi: 10.1093/qjmed/89.5.361
21. Usalan, C, y Emri, S. Glomerulonefritis membranoproliferativa asociada con carcinoma de pulmón de células pequeñas. Int Urol Nephrol. (1998) 30:209–13. doi: 10.1007/BF02550579
Resumen de PubMed | Texto completo de Crossref | Google Académico
22. Porta, C, Bamias, A, Danesh, FR, Dębska-Ślizień, A, Gallieni, M, Gertz, MA, et al. Conferencia de controversias KDIGO sobre onconefrología: comprensión de la insuficiencia renal y las neoplasias malignas de órganos sólidos, y manejo del cáncer de riñón. Riñón Int. (2020) 98:1108–19. doi: 10.1016/j.kint.2020.06.046
Resumen de PubMed | Texto completo de Crossref | Google Académico
23. Soomro, Z, Youssef, M, Yust-Katz, S, Jalali, A, Patel, AJ y Mandel, J. Síndromes paraneoplásicos en el cáncer de pulmón de células pequeñas. J Dis. de tórax. (2020) 12:6253–63. doi: 10.21037/jtd.2020.03.88
Resumen de PubMed | Texto completo de Crossref | Google Académico
24. Higashihara, T, Okada, A, Nakamura, Y, Saigusa, H, Homma, S, Matsumura, M, et al. Glomerulonefritis proliferativa con depósitos de inmunoglobulinas monoclonales sin proliferación mesangial conspicua, complicada con carcinoma de pulmón de células escamosas. Médico Pasante. (2020) 59:557–62. doi: 10.2169/internalmedicine.2993-19
Resumen de PubMed | Texto completo de Crossref | Google Académico
25. Senger, RS y Scherr, D. Resolución de fenotipos complejos con espectroscopía Raman y quimiometría. Curr Opin Biotechnol. (2020) 66:277–82. doi: 10.1016/j.copbio.2020.09.007
26. Butler, HJ, Ashton, L, Bird, B, Cinque, G, Curtis, K, Dorney, J, et al. Uso de la espectroscopia Raman para caracterizar materiales biológicos. Nat Protoc. (2016) 11:664–87. doi: 10.1038/nprot.2016.036
27. Cialla-May, D, Schmitt, M y Popp, J. Principios teóricos de la espectroscopia Raman. Phys Sci Rev. (2019):4. doi: 10.1515/psr-2017-0040
28. Shen, Y, Hu, F y Min, W. Imágenes Raman de pequeñas biomoléculas. Annu Rev Biophys. (2019) 48:347–69. doi: 10.1146/annurev-biophys-052118-115500
29. Fisher, AK, Carswell, WF, Athamneh, AIM, Sullivan, MC, Robertson, JL, Bevan, DR, et al. La caja de herramientas Rametrix™ LITE v1.0 para MATLAB®. J Raman Spectrosc. (2018) 49:885–96. doi: 10.1002/jrs.5348
30. Senger, RS, y Robertson, JL. La caja de herramientas de Rametrix™ PRO v1.0 para MATLAB®. PeerJ. (2020) 8:e8179. doi: 10.7717/peerj.8179
Resumen de PubMed | Texto completo de Crossref | Google Académico
31. Senger, RS, Sullivan, M, Gouldin, A, Lundgren, S, Merrifield, K, Steen, C, et al. Características espectrales de la orina de pacientes con enfermedad renal terminal analizadas mediante análisis de orina quimiométrico Raman (Rametrix). PLoS Uno. (2020) 15:e0227281. doi: 10.1371/journal.pone.0227281
Resumen de PubMed | Texto completo de Crossref | Google Académico
32. Kavuru, V, Senger, RS, Robertson, JL y Choudhury, D. Análisis de las diferencias en los espectros Raman de orina de pacientes con diabetes mellitus y patologías renales. PeerJ. (2023) 11:e14879. doi: 10.7717/peerj.14879
Resumen de PubMed | Texto completo de Crossref | Google Académico
33. Robertson, JL, Senger, RS, Talty, J, Du, P, Sayed-Issa, A, Avellar, ML, et al. Alteraciones en la composición molecular de la orina de pacientes con COVID-19, detectadas mediante análisis espectroscópico/computacional Raman. PLoS Uno. (2022) 17:e0270914. doi: 10.1371/journal.pone.0270914
Resumen de PubMed | Texto completo de Crossref | Google Académico
34. Carswell, W, Robertson, J y Senger, R. Detección espectroscópica Raman y cuantificación de macro y microhematuria en orina humana. Appl Spectrosc. (2022) 76:273–83. doi: 10.1177/00037028211060853
Resumen de PubMed | Texto completo de Crossref | Google Académico
35. Huttanus, HM, Vu, T, Guruli, G, Tracey, A, Carswell, W, Said, N, et al. Análisis quimiométrico de orina Raman (Rametrix) como prueba de detección del cáncer de vejiga. PLoS Uno. (2020) 15:e0237070. doi: 10.1371/journal.pone.0237070
Resumen de PubMed | Texto completo de Crossref | Google Académico
36. Senger, RS, Sayed Issa, A, Agnor, B, Talty, J, Hollis, A, y Robertson, JL. Firma multimolecular asociada a la enfermedad en la orina de pacientes con enfermedad de Lyme detectada mediante espectroscopia Raman y quimiometría. Appl Spectrosc. (2022) 76:284–99. doi: 10.1177/00037028211061769
Resumen de PubMed | Texto completo de Crossref | Google Académico
37. Xu, Y, Du, P, Senger, R, Robertson, J y Pirkle, JL. ISREA: un algoritmo eficiente de corrección de la línea de base que preserva los picos para los espectros Raman. Appl Spectrosc. (2021) 75:34–45. doi: 10.1177/0003702820955245
Resumen de PubMed | Texto completo de Crossref | Google Académico
38. Talari, ACS, Movasaghi, Z, Rehman, S, y Rehman, IU. Espectroscopía Raman de tejidos biológicos. Appl Spectrosc Rev. (2015) 50:46–111. doi: 10.1080/05704928.2014.923902
39. Movasaghi, Z, Rehman, S, y Rehman, DIU. Espectroscopía Raman de tejidos biológicos. Appl Spectrosc Rev. (2007) 42:493–541. doi: 10.1080/05704920701551530
40. Trevethan, R. Sensibilidad, especificidad y valores predictivos: fundamentos, flexibilidades y escollos en la investigación y la práctica. Frente Salud Pública. (2017) 5:5. doi: 10.3389/fpubh.2017.00307
41. Ranganathan, P, y Aggarwal, R. Comprensión de las propiedades de las pruebas diagnósticas – parte 2: cocientes de verosimilitud. Perspect Clin Res. (2018) 9:99–102. doi: 10.4103/PICR. PICR_41_18
Resumen de PubMed | Texto completo de Crossref | Google Académico
42. Guo, S, Popp, J y Bocklitz, T. Análisis quimiométrico en espectroscopia Raman desde el diseño experimental hasta el modelado basado en aprendizaje automático. Nat Protoc. (2021) 16:5426–59. doi: 10.1038/s41596-021-00620-3
Resumen de PubMed | Texto completo de Crossref | Google Académico
43. Guo, S, Rösch, P, Popp, J y Bocklitz, T. PCA y PLS modificados: hacia una mejor clasificación en aplicaciones biológicas basadas en espectroscopia Raman. J Chemom. (2020) 34:e3202. doi: 10.1002/cem.3202
44. Krafft, C, y Popp, J. Las múltiples facetas de la espectroscopia Raman para el análisis biomédico. Químico Bioanal Anal. (2015) 407:699–717. doi: 10.1007/s00216-014-8311-9
45. Ralbovsky, NM, y Lednev, IK. Espectroscopía Raman y quimiometría: un posible método universal para el diagnóstico del cáncer. Spectrochim Acta A Mol Biomol Spectrosc. (2019) 219:463–87. doi: 10.1016/j.saa.2019.04.067
Resumen de PubMed | Texto completo de Crossref | Google Académico
46. Nawaz, H, Bonnier, F, Meade, AD, Lyng, FM, y Byrne, HJ. Comparación de las respuestas subcelulares para la evaluación y predicción de la respuesta quimioterapéutica al cisplatino en adenocarcinoma de pulmón mediante espectroscopia Raman. Analista. (2011) 136:2450–63. doi: 10.1039/C1AN15104E
47. Gazi, E, Dwyer, J, Gardner, P, Ghanbari-Siahkali, A, Wade, AP, Miyan, J, et al. Aplicaciones de la microespectroscopia infrarroja por transformada de Fourier en estudios de próstata benigna y cáncer de próstata. Un estudio piloto. J Pathol. (2003) 201:99–108. doi: 10.1002/path.1421
Resumen de PubMed | Texto completo de Crossref | Google Académico
48. Bonnier, F, y Byrne, HJ. Comprender la información molecular contenida en el análisis de componentes principales de espectros vibracionales de sistemas biológicos. Analista. (2011) 137:322–32. doi: 10.1039/C1AN15821J
Resumen de PubMed | Texto completo de Crossref | Google Académico
49. Bhattacharjee, T, Kumar, P, Maru, G, Ingle, A y Krishna, CM. Ratones desnudos suizos: un modelo adecuado para estudios espectroscópicos Raman transcutáneos in vivo del cáncer de mama. Láseres Med Sci. (2014) 29:325–33. doi: 10.1007/s10103-013-1347-9
Resumen de PubMed | Texto completo de Crossref | Google Académico
50. Robertson, JL. Lesión glomerular inducida químicamente: una revisión de los mecanismos básicos y xenobióticos específicos. Toxicol Pathol. (1998) 26:64–72. doi: 10.1177/019262339802600109
51. Robertson, JL. Enfermedades de los túbulos y del intersticio En: KC Bovee, editor. Nefrología canina. Medios de comunicación, PA: Harwal Publishing (1983).
52. Robertson, JL. La lesión inmunológica y la respuesta renal En: KC Bovee, editor. Nefrología canina. Medios de comunicación, PA: Harwal Publishing (1983).
53. Robertson, JL. El riñón en el perro envejecido En: Patobiología del perro envejecido. Eds. Mohr, U., Carlton, W. W., Dungworth, D. L., Benjamin, S. A., Capen, C. C., y Hahn, F. F. Aimes, IA: Iowa State University Press (2001).
54. Robertson, JL. Enfermedad renal espontánea en perros. Toxicol Pathol. (1986) 14:101–8. doi: 10.1177/019262338601400112
55. Stone, EA, Littman, MP, Robertson, JL y Bovée, KC. Disfunción renal en perros con piometra. J Am Vet Med Assoc. (1988) 193:457–64.
56. Pomeroy, MJ, y Robertson, JL. Relación de la edad, el sexo y la localización glomerular con el desarrollo de lesiones espontáneas en el riñón canino: análisis de un estudio de esperanza de vida. Toxicol Pathol. (2004) 32:237–42. doi: 10.1080/01926230490274407
Resumen de PubMed | Texto completo de Crossref | Google Académico
57. Littman, MP, Robertson, JL, y Bovée, KC. Hipertensión sistémica espontánea en perros: cinco casos (1981-1983). J Am Vet Med Assoc. (1988) 193:486–94.
Palabras clave: espectroscopia Raman, cáncer, linfoma, orina, quimiometría, osteosarcoma, tumor de mastocitos, carcinoma urotelial (CU)
Cita: Robertson JL, Dervisis N, Rossmeisl J, Nightengale M, Fields D, Dedrick C, Ngo L, Issa AS, Guruli G, Orlando G y Senger RS (2024) Detección de cáncer en perros mediante análisis rápido de orina molecular Raman. Frente. Vet. Sci. 11:1328058. doi: 10.3389/fvets.2024.1328058
Recibido: 26 de octubre de 2023; Aceptado: 18 de enero de 2024;
Publicado: 07 Febrero 2024.
Editado por:
Monica Sforna, Universidad de Perugia, Italia
Revisado por:
Tim Williams, Universidad de Cambridge, Reino Unido
Vittoria Castiglioni, Laboratorios IDEXX, Alemania
Derechos de autor © 2024 Robertson, Dervisis, Rossmeisl, Nightengale, Fields, Dedrick, Ngo, Issa, Guruli, Orlando y Senger. Este es un artículo de acceso abierto distribuido bajo los términos de la Licencia Creative Commons Attribution License (CC BY).
*Correspondencia: John L. Robertson, drbob@vt.edu; robersonj@rametrixtech.com; Ryan S. Senger, senger@vt.edu
Renuncia: Todas las afirmaciones expresadas en este artículo son únicamente las de los autores y no representan necesariamente las de sus organizaciones afiliadas, ni las del editor, los editores y los revisores. Cualquier producto que pueda ser evaluado en este artículo o afirmación que pueda hacer su fabricante no está garantizado ni respaldado por el editor.
Date de alta y recibe nuestro 👉🏼 Diario Digital AXÓN INFORMAVET ONE HEALTH
Date de alta y recibe nuestro 👉🏼 Boletín Digital de Foro Agro Ganadero
Noticias animales de compañía
Noticias animales de producción
Trabajos técnicos animales de producción
Trabajos técnicos animales de compañía