Detección y caracterización molecular del virus de la enfermedad hemorrágica del conejo

Primera detección y caracterización molecular del virus de la enfermedad hemorrágica del conejo (RHDV) en Argelia
 Lynda Sahraoui1
Lynda Sahraoui1  Hichem Lahouassa1
Hichem Lahouassa1  Samia Maziz-Bettahar1,2
Samia Maziz-Bettahar1,2  Ana M. Lopes3,4,5,6
Ana M. Lopes3,4,5,6  Tereza Almeida3,4
Tereza Almeida3,4  Hacina Ainbaziz1
Hacina Ainbaziz1  Joana Abrantes3,4,7*
Joana Abrantes3,4,7*- 1Laboratorio de Sanidad y Producción Animal, Escuela Nacional Superior de Veterinaria de Argel, Argel, Argelia
- 2Instituto de Ciencias Veterinarias, Universidad Saad Dahlab de Blida1, Blida, Argelia
- 3CIBIO, Centro de Investigação em Biodiversidade e Recursos Genéticos, InBIO Laboratório Associado, Campus de Vairão, Universidade do Porto, Vairão, Portugal
- 4Programa BIOPOLIS en Genómica, Biodiversidad y Ordenamiento Territorial, CIBIO, Vairão, Portugal
- 5UMIB – Unidad de Investigación Multidisciplinar en Biomedicina, ICBAS – Facultad de Medicina y Ciencias Biomédicas, Universidad de Oporto, Oporto, Portugal
- 6ITR – Laboratorio de Investigación Integrativa y Traslacional en Salud de la Población, Oporto, Portugal
- 7Departamento de Biologia, Faculdade de Ciências da Universidade do Porto, Porto, Portugal
Desde la primera detección de la enfermedad hemorrágica del conejo (RHD), el virus de la enfermedad hemorrágica del conejo (RHDV) ha sido responsable de una alta morbilidad y mortalidad en todo el mundo, tanto en conejos domésticos como en conejos silvestres. A pesar del aparente control de RHD en conejos a través de la vacunación, varios estudios destacaron la rápida evolución del RHDV por recombinación, lo que puede facilitar la aparición de nuevas cepas patógenas. El objetivo de este estudio fue confirmar la presencia y caracterizar el RHDV en Argelia. Para ello, se recogieron muestras de conejos en el norte de Argelia, entre 2018 y 2021, de pequeñas granjas donde se sospechaba el virus tras la muerte súbita de un elevado número de conejos, y de conejos salvajes cazados sanos. Los conejos domésticos revelaron signos clínicos y lesiones que eran sugestivas de RHD. La RT-PCR mostró que el 79,31% de las muestras de conejos domésticos fueron positivas para RHDV, mientras que en el 20,69%, incluidos los conejos cazados, no se detectó el virus. El análisis filogenético de las cepas argelinas permitió la confirmación e identificación como GI.2 (RHDV2), y mostró una estrecha relación con las cepas recombinantes GI.3P-GI.2, lo que sugiere una posible introducción de otros países, con una cepa más antigua potencialmente originada en el vecino Túnez, mientras que los aislados más recientes se agruparon con cepas de América del Norte. Nuestro estudio informa por primera vez de la presencia de GI.2 (RHDV2) en Argelia con múltiples vías de introducción. En consecuencia, proponemos que el control del RHDV en Argelia se base en encuestas epidemiológicas en asociación con un programa profiláctico adecuado.
Introducción
La enfermedad hemorrágica del conejo (RHD) es una enfermedad altamente contagiosa y mortal y, por lo tanto, una grave amenaza para la industria de producción de conejos y las poblaciones de conejos silvestres. Los animales afectados por RHD muestran lesiones histopatológicas en el hígado, los pulmones, el bazo, el corazón y los riñones, asociadas con coagulación intravascular diseminada y hepatitis aguda (1).
El virus RHD (RHDV) es el agente etiológico de esta enfermedad, y pertenece al género Lagovirus, familia Caliciviridae (2). Según (3), este género abarca una sola especie, Lagovirus europaeus, separada en dos genogrupos, GI (lagovirus de conejo) y GII (lagovirus de liebre), que circulan en poblaciones de lepóridos. El genogrupo GI se subdivide en los genotipos patógenos GI.1 (RHDV clásico), con variantes GI.1a a GI.1d y GI.2 (RHDV2/b), y los genotipos no patógenos GI.3 (calicivirus de conejo, RCV-E1) y GI.4 (RCV-A1 y RCV-E2) (3).
El creciente número de secuencias completas del genoma del RHDV permite análisis detallados de la diversidad genética. De hecho, se han descubierto varias cepas recombinantes, lo que sugiere que la recombinación conduce a una rápida evolución del virus y a la aparición de nuevas cepas patógenas (4-6). Estas cepas a menudo combinan genes no estructurales y estructurales de diferentes genotipos, por ejemplo, GI.3P-GI.1d, GI.1bP-GI.2, GI.3P-GI.2 y GI.4P-GI.2 (4, 5, 7-11). Además, se han descrito recombinantes triples, compuestos por el p16 de GI.4, los genes no estructurales restantes de GI.1b o GI.3, y los genes estructurales de GI.2 (10).
El primer brote de RHD, causado por RHDV GI.1c, se describió en China en 1984 en un grupo de conejos importados de Alemania (12). A continuación, el virus se propagó rápidamente por todo el mundo. Se detectó por primera vez en Europa (Italia) en 1986 (13), en las Américas (México) en 1988 (14) y en África (Egipto) en 1988 (15). RHDV GI.2 se detectó por primera vez en Francia en el verano de 2010 (16) y luego se dispersó por todo el mundo (17-22). A diferencia de GI.1, GI.2 es capaz de causar la muerte en gatitos (<2 meses de edad) (23). Además, el rango de huéspedes de RHDV GI.1 se limita casi exclusivamente a conejos europeos (Oryctolagus cuniculus), mientras que RHDV GI.2 se sabe que afecta a diferentes especies de liebres, colas de algodón y liebres (22, 24-29). El ARN GI.2 también se ha encontrado en especies no lepóridas (30, 31).
En Argelia, la producción de carne de conejo se estima en 8.250 toneladas/año, ocupando el décimo lugar a nivel mundial, lo que representa el 10,0% de la producción mundial (7). Sin embargo, como país africano, Argelia está por detrás de Egipto, que ocupa el sexto lugar con 32.48 toneladas / año (000). El consumo anual de carne de conejo es muy bajo, con 32,0 kg/cápita (36). De hecho, la cría de conejos en Argelia tiene una importancia débil debido a la ausencia de estructura del sector, a diferencia de los otros sectores cárnicos como el ovino, bovino y avícola. Los conejos domésticos argelinos están representados por una población local, criada en el centro norte del país, donde la vacunación contra RHD y / o mixomatosis no se aplica sistemáticamente en la cría de conejos y, si se realiza, no sigue un programa regular (Ain-Baziz, comunicación personal). Paralelamente a los conejos domésticos, los conejos salvajes son cazados y consumidos, pero aún no habían sido estudiados y descritos adecuadamente.
Recientemente, se han registrado brotes de RHD en países del norte de África, incluidos Marruecos (8), Túnez (33, 34) y Egipto (35-37). Además, se sospechaba fuertemente RHD en Argelia debido a la observación de altas tasas de mortalidad y signos clínicos en conejos domésticos, lo que sugiere la presencia del virus desde al menos 2018, pero nunca se ha confirmado. Este estudio describe la identificación y caracterización del RHDV por primera vez en Argelia.
Materiales y métodos
Recolección y examen de muestras
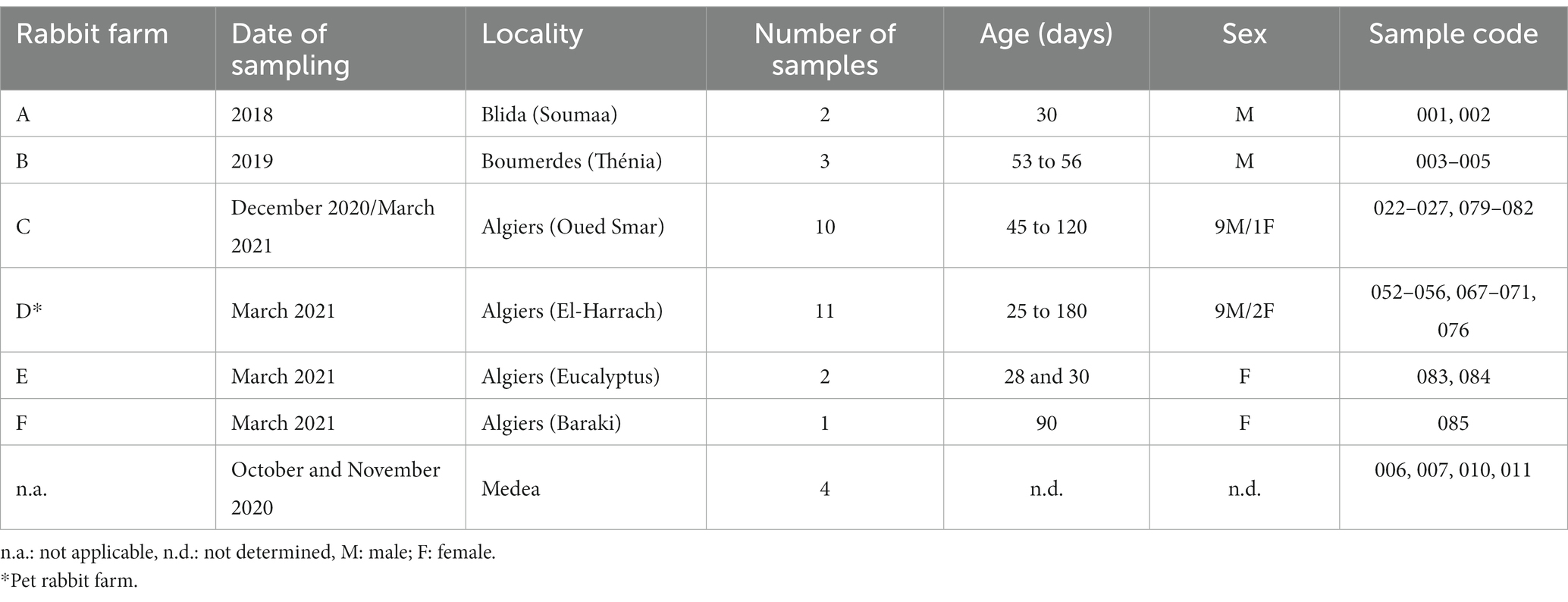
Se recogieron muestras de conejos entre 2018 y 2021 de conejos domésticos y silvestres en cuatro provincias de la región centro-norte de Argelia: Argel, Blida, Boumerdes y Medea (Figura 1; Tabla 1).
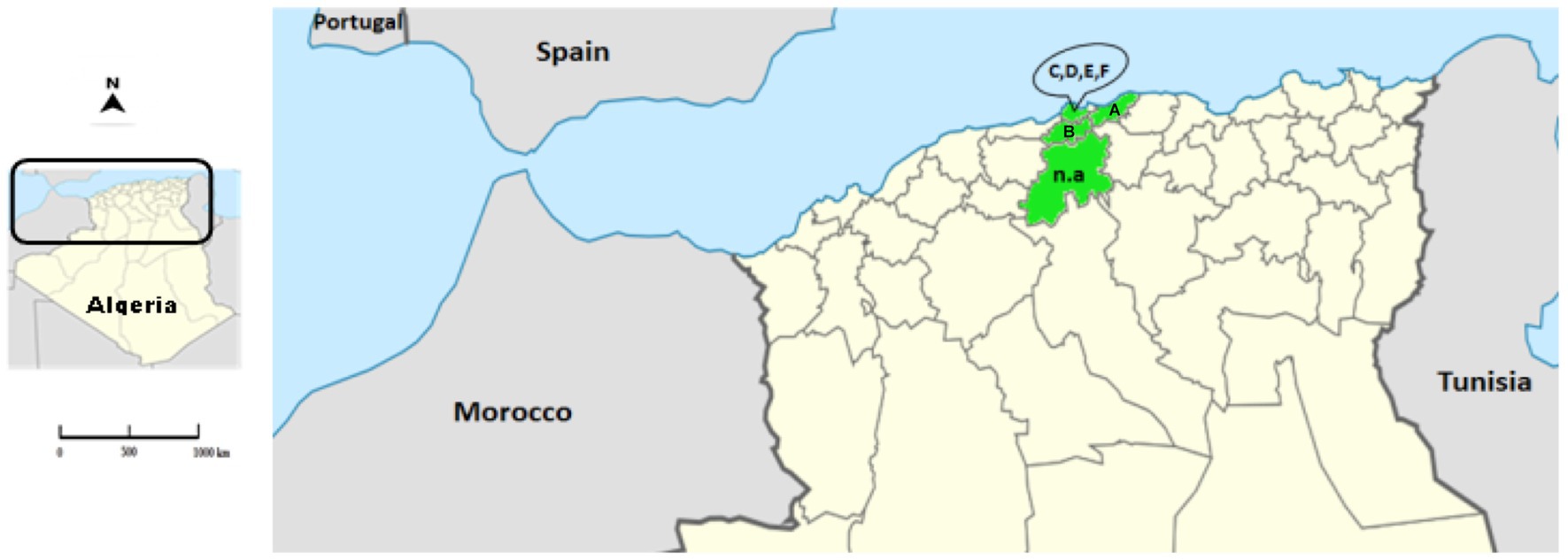 Figura 1. Localización de los casos sospechosos de RHD argelinos. El mapa representa la ubicación de las muestras recogidas (las provincias aparecen en verde) en el norte de Argelia. Las letras corresponden a la ubicación de las fincas (A: Blida; B: Boumerdes; C-F: Argel). La abreviatura n.a. (no aplicable) representa las muestras de animales salvajes de Medea.
Figura 1. Localización de los casos sospechosos de RHD argelinos. El mapa representa la ubicación de las muestras recogidas (las provincias aparecen en verde) en el norte de Argelia. Las letras corresponden a la ubicación de las fincas (A: Blida; B: Boumerdes; C-F: Argel). La abreviatura n.a. (no aplicable) representa las muestras de animales salvajes de Medea.
Análisis virológico
Se recogieron muestras de hígado de conejos domésticos sospechosos de RHD, tanto machos como hembras, con edades comprendidas entre 25 y 120 días (n = 29). Los animales procedían de seis granjas rurales donde no se aplicaban programas de vacunación contra el RHDV. Además, se obtuvieron muestras de hígado de conejos salvajes aparentemente sanos (n = 4) de cazadores durante octubre y noviembre de 2020. Todas las muestras se recogieron asépticamente, se colocaron individualmente en bolsas estériles y se almacenaron a -20 ° C hasta su posterior procesamiento.
Examen clínico e histopatológico
En los casos sospechosos de RHD, el diagnóstico clínico se basó en la historia clínica obtenida de ganaderos y veterinarios. Las necropsias se realizaron en las granjas o en el laboratorio de la escuela veterinaria (ENSV, Argelia). En los animales domésticos, tres no fueron sospechosos de estar infectados por RHDV, mientras que 26 presentaron cadáveres sospechosos. A partir de estos, se recolectaron muestras de hígado, pulmón, timo, tráquea, riñón y bazo para el examen histopatológico. Las muestras de tejido se fijaron en formalina tamponada al 10% e incrustadas en parafina. Las secciones de 3 μm de espesor se tiñeron con hematoxilina y eosina para el examen microscópico de rutina.
Análisis molecular
Las muestras de hígado (n = 33) se enviaron a CIBIO-InBIO/UP, Portugal, donde se realizó la extracción de ARN, la amplificación del genoma y la secuenciación. El ARN total se extrajo utilizando el kit de purificación de ARN GeneJET (Thermo Fisher Scientific) y se transcribió inversamente con el kit de síntesis de ADNc de primera cadena de NZY (Nzytech) de acuerdo con el protocolo del fabricante. La presencia de RHDV se confirmó con dos pares de cebadores: RHDV4831F + EBHSV_VP60_0467R, que amplifican un fragmento de ~900 pb y que incluye el sitio de recombinación entre RdRp/VP60, y RHDV6186F + RHDV6748R, que amplifican un fragmento de 563 pb del gen de la cápside (38). Para un subconjunto de las muestras (n = 7) elegidas de acuerdo con su fecha de muestreo, la secuencia restante del gen de la cápside se amplificó por PCR utilizando la metodología descrita en (4) (cebadores y condiciones de PCR disponibles de los autores a pedido). Todas las PCR se realizaron con 1 μl de la reacción de ADNc en un volumen final de 10 μl que contenía 5 μl de Phusion Flash High-Fidelity PCR Master Mix (Thermo Fisher Scientific) y 2 pmol de cada oligonucleótido. Los productos de PCR positivos se purificaron y secuenciaron en un secuenciador automático (ABI PRISM 3130xl Genetic Analyzer, PE Applied Biosystems) utilizando los cebadores de amplificación.
Análisis filogenético
Las secuencias de las cepas argelinas se alinearon con las secuencias de lagovirus recuperadas de GenBank1 en BioEdit versión 7.2 (39). Los análisis filogenéticos se realizaron utilizando MEGA 11 (40). Se dedujeron árboles filogenéticos de máxima verosimilitud para el gen VP60 de longitud completa y para el fragmento parcial de RdRp. Para ambos árboles ML, se utilizó el modelo GTR + G + Γ4 de sustitución de nucleótidos, determinado en el mismo software y de acuerdo con el valor AICc más bajo, y se obtuvo soporte de ramificación a partir de 1.000 réplicas bootstrap. La opción de eliminación parcial (95%) se utilizó para manejar los datos faltantes.
Resultados
Examen clínico y post mortem de conejos con sospecha de RHD
Los conejos domésticos sospechosos de RHD (n = 29) se sometieron a una evaluación de los signos clínicos y a un examen post mortem (véase la figura complementaria 1). Los conejos afectados revelaron anorexia, apatía, postración y dificultades respiratorias. En conejos destetados, se observaron signos neurológicos, con algunos casos de epistaxis y sangrado anal en adultos.
El examen post mortem de las canales reveló alteraciones compatibles con RHD, con lesiones que afectan a un gran número de órganos (datos no mostrados). De hecho, todos los cadáveres, excepto los de conejos 003, 004 y 005, mostraron agrandamiento y hemorragias de los pulmones, el corazón y el timo. Los riñones y el bazo estaban congestionados y agrandados. Se observaron hemorragias petequiales en la superficie del ciego. Las tráqueas eran hiperémicas y la mucosa traqueal contenía líquido espumoso. Además, se observó decoloración ictérica de la mucosa visceral y coagulación intravascular diseminada (CID) en la mayoría de los casos. El hígado parecía pálido y con consistencia reducida. El examen histológico también reveló alteraciones patológicas en los tejidos. El hígado mostró lesiones degenerativas en hepatocitos y necrosis multifocal. También se observaron signos de degeneración y necrosis en los riñones, el bazo y el corazón. En los pulmones y la tráquea, se observaron signos de hemorragia y edema.
Detección de RHDV y caracterización genética preliminar
Los exámenes clínicos e histopatológicos fueron compatibles con la RHD. Posteriormente, se realizó un análisis molecular para confirmar la presencia de RHDV en muestras de hígado. Las RT-PCR mostraron que 23 de 29 (79,31%) muestras fueron positivas para RHDV, mientras que en 6 (20,69%) no se detectó el virus. Los cuatro conejos salvajes cazados estaban entre las muestras negativas.
Combinación de los resultados de la secuenciación de VP60 (n = 7; Argelia 002, 024, 027, 083, 076, 068 y 053; Número de acceso de GenBank OR296430-OR296436, respectivamente) y análisis de BLAST de nucleótidos2 permitió caracterizar todos estos casos positivos de RHD como infectados por GI.2.
Análisis filogenético
Con el fin de establecer aún más las relaciones evolutivas de las cepas argelinas con las cepas de lagovirus patógenas y no patógenas disponibles, y, en particular, con los aislados africanos recientes, se construyeron árboles filogenéticos ML con secuencias codificantes completas del gen VP60 (Figura 2A) y con secuencias parciales del RdRp no estructural (Figura 2B).
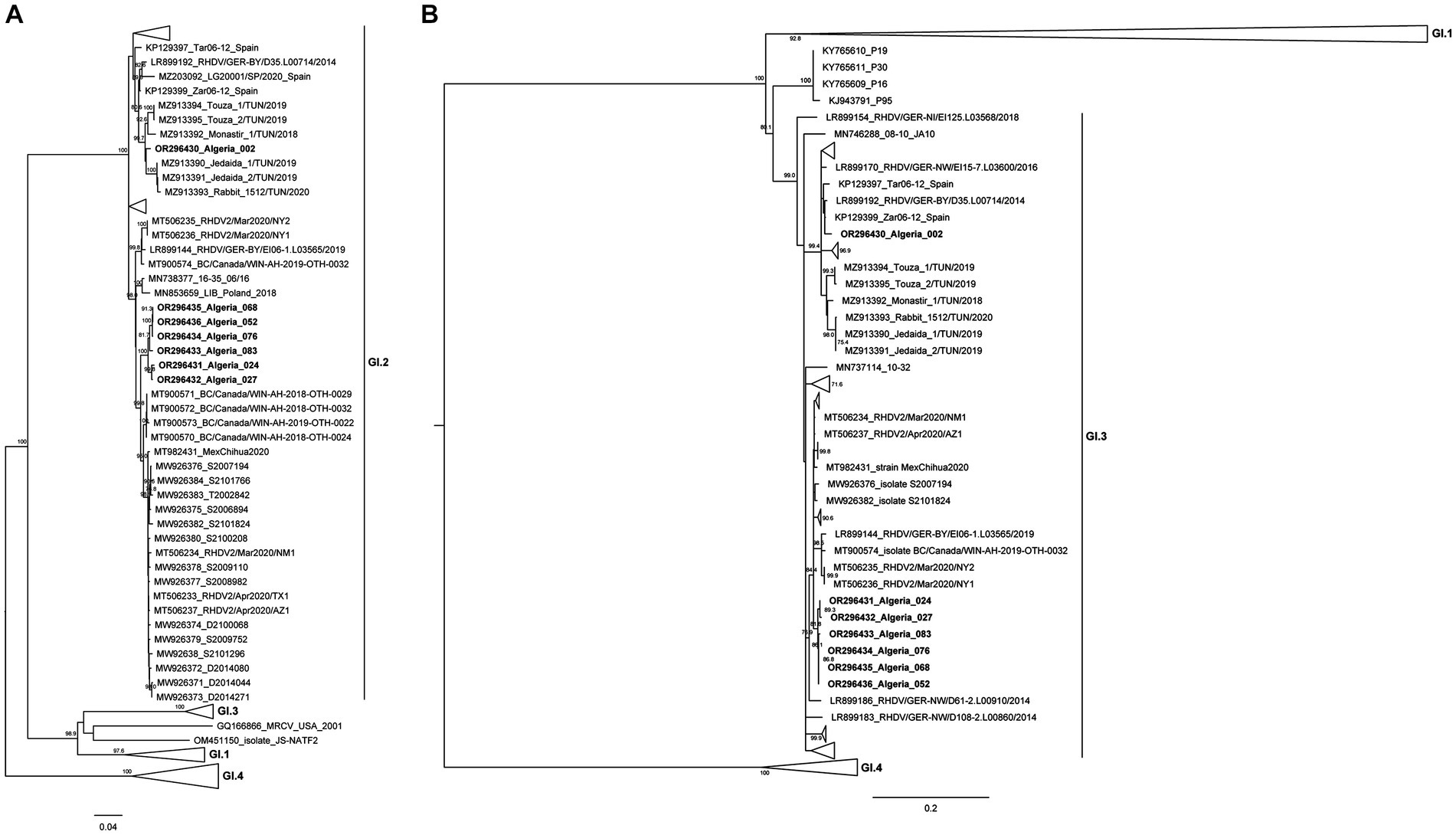 Figura 2. Análisis filogenéticos de máxima verosimilitud (ML). (A) Árbol ML para secuencias completas del gen VP60 (n = 758 secuencias; posiciones de nucleótidos 5,296–7,038; modelo de sustitución de nucleótidos GTR + G + Γ4). (B) árbol ML para secuencias parciales de RdRp (n = 758 secuencias; posiciones de nucleótidos 4,621–5,295; modelo de sustitución de nucleótidos GTR + G + Γ4). Para una mejor visualización, los grupos se contraen. Las longitudes horizontales de las ramas se dibujan a escala de sustituciones de nucleótidos por sitio y los árboles están enraizados en el punto medio. El porcentaje de árboles en los que los taxones asociados se agruparon se determinó a partir de 1.000 réplicas de bootstrap y se muestra junto a las ramas (solo se muestran los valores de bootstrap ≥70).
Figura 2. Análisis filogenéticos de máxima verosimilitud (ML). (A) Árbol ML para secuencias completas del gen VP60 (n = 758 secuencias; posiciones de nucleótidos 5,296–7,038; modelo de sustitución de nucleótidos GTR + G + Γ4). (B) árbol ML para secuencias parciales de RdRp (n = 758 secuencias; posiciones de nucleótidos 4,621–5,295; modelo de sustitución de nucleótidos GTR + G + Γ4). Para una mejor visualización, los grupos se contraen. Las longitudes horizontales de las ramas se dibujan a escala de sustituciones de nucleótidos por sitio y los árboles están enraizados en el punto medio. El porcentaje de árboles en los que los taxones asociados se agruparon se determinó a partir de 1.000 réplicas de bootstrap y se muestra junto a las ramas (solo se muestran los valores de bootstrap ≥70).
El análisis del árbol VP60 ML reveló que todas las cepas argelinas se agruparon dentro del grupo GI.2 fuertemente apoyado (valor de arranque 100), pero se distribuyeron en dos grupos distintos. De hecho, la cepa Argelia 002 se agrupó con las cepas GI.2 tunecinas aisladas de 2018 a 2020 (valor de arranque de 99) (33). Las seis cepas restantes aisladas entre 2020 y 2021 (Argelia 024, 027, 052, 068, 076 y 083) parecían estar estrechamente relacionadas con las cepas GI.2 de América del Norte (de 2020 a 2021; valor de arranque de 99.8). El árbol ML para la secuencia parcial de RdRp (Figura 2B) mostró que las cepas argelinas se agruparon dentro de un grupo fuertemente apoyado (valor de bootstrap 99) compuesto por cepas GI.3 conocidas. La combinación de los resultados de ambos árboles indica que todas las cepas argelinas son recombinantes GI.3P-GI.2. Los análisis de nucleótidos están en línea con los resultados de los árboles de ML (ver Tablas suplementarias 1, 2). De hecho, para los genes VP60 y VP10 y la secuencia parcial de RdRp, la cepa argelina 002 fue más similar a las cepas europeas recolectadas entre 2011 y 2016 y las cepas tunecinas de 2018 a 2020 (identidad de nucleótidos: 96.48-98.38%), lo que sugiere un origen europeo. Para las cepas argelinas 052, 068, 076, 083, 027 y 024, tanto las secuencias VP60 y VP10 como la secuencia parcial de RdRp fueron más similares a las cepas de los EE. UU., México y Canadá recolectadas a partir de 2018 (identidad de nucleótidos 98.67-97.15%). Para estas cepas argelinas más recientes, parece haber un vínculo con los países de América del Norte.
La distribución espacio-temporal de las cepas argelinas parece coincidir con su agrupación en el árbol filogenético VP60. De hecho, Argelia 002 se recolectó en Blida en 2018, lo que representa la cepa más antigua de este estudio. Las cepas argelinas 024, 027, 052, 068, 076 y 083 pertenecen al mismo grupo y se pueden subdividir en dos subgrupos bien soportados: el primero incluye las cepas argelinas 024 y 027 que se recolectaron en Argel-Oued-Smar en 2020, mientras que el segundo contiene las cepas argelinas 052, 068, 076 y 083 que se tomaron muestras en 2021 de una granja de conejos domésticos en Argel-El Harrach.
Discusión
La RHD es una de las enfermedades con mayor impacto negativo en conejos salvajes y domésticos. En conejos, el control de la RHD se logra a través de protocolos de vacunación adecuados, que deben adaptarse a la situación epidemiológica. Con el fin de comprender y controlar mejor la RHD en Argelia, realizamos un estudio para caracterizar la diversidad de cepas de RHDV que circulan en conejos domésticos y salvajes argelinos.
Sobre la base de los signos clínicos, las lesiones y la epidemiología encontrados en los conejos muestreados, que son coherentes con los descritos anteriormente para RHD en otros países (41), este parece ser el primer informe de RHD en Argelia. De hecho, se observaron signos similares en nuestro estudio, incluyendo muerte súbita, alta mortalidad, epistaxis, ictericia y signos respiratorios y neurológicos. Estas alteraciones clínicas se deben a la alta patogenicidad del RHDV. Tanto GI.1 como GI.2 inducen síntomas similares; sin embargo, este último induce una enfermedad más prolongada en comparación con GI.1 (42). Si bien las lesiones macroscópicas observadas fueron variables, los pulmones y el hígado fueron consistentemente los órganos más afectados, de acuerdo con las descripciones anteriores (4, 23). Además, ictericia ictericia estaba presente en varios cadáveres. Las alteraciones reportadas fueron consecuencia de insuficiencia orgánica múltiple resultante de edema pulmonar y hemorragias, necrosis adrenocortical, trastorno circulatorio de los riñones y necrosis hepática (43). Hubo una buena concordancia entre los resultados del examen clínico y la caracterización molecular, con 26 y 23 muestras identificadas como RHD y RHDV positivas, respectivamente. La diferencia en los resultados podría atribuirse a la degradación de la muestra debido a la mala conservación o la presencia de cargas virales bajas que dificultaron la detección del ARN viral.
Nuestro estudio describe los primeros casos confirmados de GI.2 en Argelia. Desde su detección en Francia en 2010, GI.2 se extendió rápidamente por todo el mundo (5, 6, 19, 44) y parece haber reemplazado a GI.1 (19). En el norte de África, GI.2 se ha encontrado en conejos domésticos y silvestres. De hecho, el virus se notificó con tasas de detección variables que van desde el 32% en Egipto hasta más del 87% en Marruecos y el 96% en Túnez (n = 50, 57 y 24, respectivamente) (8, 34, 35). La detección de GI.2 en nuestras muestras parece estar asociada con una alta tasa de mortalidad (aproximadamente el 80%, según lo informado por veterinarios y ganaderos). De acuerdo con nuestros hallazgos, se ha informado que las cepas GI.2 indujeron, al menos, un 80% de mortalidad (45). Además, en este estudio, se recolectaron muestras positivas para RHDV de conejos de diferentes edades y sexos, lo que contribuyó a confirmar que GI.2 infecta conejos machos y hembras en todas las edades (5, 6, 8, 19, 33, 46).
En cuanto a las relaciones evolutivas de las cepas argelinas, la inclusión de secuencias de otros países africanos (8, 33, 34), americanos y europeos en nuestros análisis filogenéticos (5) potencialmente elucidó el origen de las cepas argelinas. De hecho, las cepas argelinas parecen tener dos orígenes distintos, como resultado de introducciones independientes. La cepa Algeria 002 posiblemente se originó en Túnez, mientras que las cepas argelinas restantes están más relacionadas con las cepas norteamericanas. Esto está en línea con las múltiples rutas de introducción de IG.2 en África ya sugeridas por otros estudios, pero contrasta con hallazgos previos en otras cepas GI.3P-GI.2, ya que se derivaron de una sola introducción con un probable origen europeo (33). El supuesto papel de los países de América del Norte en la propagación de la IG.2 en Argelia está posiblemente asociado con las rutas comerciales de conejos. Canadá y Argelia tienen una fuerte relación comercial, con Argelia clasificada como el segundo mercado más grande de Canadá.3 Los otros países africanos en los que se ha notificado la GI.2, como Marruecos (8), Ghana y Nigeria (47), no tuvieron ningún papel en la epidemiología de la enfermedad en Argelia, ya que sus cepas no estaban estrechamente relacionadas con las cepas argelinas.
Durante la última década, la rápida expansión de la industria del conejo en Argelia, asociada con una mayor popularidad de los conejos como mascotas, en particular la raza de conejos extranjeros, podría haber contribuido a la incursión de GI.2 en Argelia. Hallazgos recientes sugieren que, después de una infección GI.2, los conejos sobrevivientes pueden actuar como portadores del virus durante varias semanas (48). Por lo tanto, la importación de conejos aparentemente sanos podría ser una fuente de IG.2 del RHDV a Argelia y, por lo tanto, debería estar muy regulada.
En conclusión, nuestro estudio detectó y caracterizó, por primera vez, RHDV, en particular GI.2, en conejos argelinos. Las cepas GI.2 argelinas parecen tener orígenes distintos, posiblemente relacionados con el comercio de conejos. La detección de GI.2 en Argelia, con diferentes orígenes y en un tiempo relativamente corto, pone de relieve la existencia de múltiples vías de introducción de GI.2 y refuerza la importancia de implementar una vigilancia epidemiológica intensiva y un programa profiláctico nacional adaptado contra las cepas circulantes de RHDV.
Declaración de disponibilidad de datos
Los datos producidos en este estudio están disponibles en GenBank (https://www.ncbi.nlm.nih.gov/genbank/) bajo los números de acceso OR296430-OR296436.
Declaración ética
El estudio en animales fue aprobado por la Direction Générale des Forêts, Ministère de l’Agriculture et du Développement Rural, République Algérienne Démocratique et Populaire (N4529/BOG/DPFF/DGF-20) para las muestras de animales salvajes. No se requirió revisión ética y aprobación para los animales domésticos porque las muestras para el diagnóstico de laboratorio se obtuvieron de animales fallecidos. El estudio se realizó de acuerdo con la legislación local y los requisitos institucionales.
Contribuciones del autor
LS y SM-B realizaron las necropsias, recolectaron las muestras y caracterizaron las lesiones macroscópicas y microscópicas. JA, AL y TA realizaron el análisis virológico y revisaron el manuscrito. LS, HL, SM-B, AL, JA y TA analizaron los datos. LS, HL, SM-B y HA-B escribieron el manuscrito. Todos los autores contribuyeron al artículo y aprobaron la versión presentada.
Financiación
Este trabajo es el resultado del proyecto LAGMED (www.lagmed.eu) apoyado por la Fundação para a Ciência e Tecnologia, FCT Portugal (PRIMA/0003/2018) y la Dirección General de Investigación Científica y Desarrollo Tecnológico (DGRSDT) en Argelia, programa PRIMA, una iniciativa Art. 185 apoyada y financiada por Horizonte 2020, el Programa Marco de Investigación e Innovación de la Unión Europea. FCT también apoyó la beca Investigador Junior de AL (CEECIND/01388/2017) y la beca de Investigador Asistente de JA (CEECIND/00078/2017).
Conflicto de intereses
Los autores declaran que la investigación se llevó a cabo en ausencia de cualquier relación comercial o financiera que pudiera interpretarse como un posible conflicto de intereses.
Nota del editor
Todas las afirmaciones expresadas en este artículo son únicamente las de los autores y no representan necesariamente las de sus organizaciones afiliadas, o las del editor, los editores y los revisores. Cualquier producto que pueda ser evaluado en este artículo, o reclamo que pueda ser hecho por su fabricante, no está garantizado ni respaldado por el editor.
Material complementario
El material complementario para este artículo se puede encontrar en línea en: https://www.frontiersin.org/articles/10.3389/fvets.2023.1235123/full#supplementary-material
Notas
1. ^https://www.ncbi.nlm.nih.gov/genbank
2. ^https://blast.ncbi.nlm.nih.gov/Blast.cgi
3. ^https://www.international.gc.ca/country-pays/algeria-algerie/relations.aspx?lang=eng
Referencias
1. Fuchs, A , y Weissenbock, H . Estudio histopatológico comparativo de la enfermedad hemorrágica del conejo (RHD) y el síndrome de liebre parda europea (EBHS). J Comp Pathol. (1992) 107:103–13. DOI: 10.1016/0021-9975(92)90100-9
Resumen de PubMed | Texto completo de CrossRef | Google Académico
2. Vinje, J , Estes, MK , Esteves, P , Verde, KY , Katayama, K , Knowles, NJ, et al. ICTV virus taxonomy profile: Caliciviridae. J Gen Virol. (2019) 100:1469–70. DOI: 10.1099/jgv.0.001332
Resumen de PubMed | Texto completo de CrossRef | Google Académico
3. Le Pendu, J , Abrantes, J , Bertagnoli, S , Guitton, JS , Le Gall-Recule, G , Lopes, AM, et al. Propuesta de sistema unificado de clasificación y nomenclatura de lagovirus. J Gen Virol. (2017) 98:1658–66. DOI: 10.1099/jgv.0.000840
Resumen de PubMed | Texto completo de CrossRef | Google Académico
4. Pendientes, AM , Dalton, KP , Magalhaes, MJ , Parra, F , Esteves, PJ , Holmes, EC, et al. El análisis genómico completo de la nueva variante del virus de la enfermedad hemorrágica del conejo reveló múltiples eventos de recombinación. J Gen Virol. (2015) 96:1309–19. doi: 10.1099/vir.0.000070
5. Abrantes, J , Droillard, C , Lopes, AM , Lemaitre, E , Lucas, P , Blanchard, Y, et al. Recombinación ante la aparición del virus patógeno de la enfermedad hemorrágica del conejo Lagovirus europaeus/GI.2. Sci Rep. (2020) 10. DOI: 10.1038/S41598-020-71303-4
6. Mahar, JE , Jenckel, M , Huang, N , Smertina, E , Holmes, CE , Strive, T, et al. La recombinación intergenotípica frecuente entre los genes no estructurales y estructurales es un importante impulsor de la aptitud epidemiológica en los calicivirus. Virus Evol. (2021) 7:1–14. doi: 10.1093/ve/veab080
7. Almeida, T , Lopes, AM , Magalhaes, MJ , Neves, F , Pinheiro, A , Goncalves, D, et al. Seguimiento de la evolución de las cepas recombinantes G1/RHDVb introducidas desde la Península Ibérica hasta las islas Azores, Portugal. Infectar el gen Evol. (2015) 34:307–13. doi: 10.1016/j.meegid.2015.07.010
8. Lopes, AM , Rouco, C , Esteves, PJ , y Abrantes, J . GI.1b/GI.1b/GI.2 virus 2 de la enfermedad hemorrágica recombinante del conejo (Lagovirus europaeus/GI.2) en Marruecos (África). Arco Virol. (2019) 164:279–83. DOI: 10.1007/S00705-018-4052-Y
Resumen de PubMed | Texto completo de CrossRef | Google Académico
9. Hall, RN , Mahar, JE , Leer, AJ , Mourant, R , Gaitero, M , Huang, N, et al. Una RT-PCR multiplex específica de cepa para virus de enfermedad hemorrágica de conejo australiano descubre una nueva variante del virus recombinante en conejos y liebres. Transbound Emerg Dis. (2018) 65:E444–56. doi: 10.1111/tbed.12779
Resumen de PubMed | Texto completo de CrossRef | Google Académico
10. Silverio, D , Lopes, AM , Melo-Ferreira, J , Magalhaes, MJ , Monterroso, P , Serronha, A, et al. Información sobre la evolución de la nueva variante del virus de la enfermedad hemorrágica del conejo (GI.2) y la identificación de nuevas cepas recombinantes. Transbound Emerg Dis. (2018) 65:983–92. doi: 10.1111/tbed.12830
Resumen de PubMed | Texto completo de CrossRef | Google Académico
11. Abrantes, J , Lopes, AM , Lemaitre, E , Ahola, H , Banihashem, F , Droillard, C, et al. El análisis retrospectivo muestra que la mayoría de las cepas RHDV GI.1 circulantes desde finales de la década de 1990 en Francia y Suecia eran cepas GI.3P-GI.1d recombinantes. Genes. (2020) 11:910. doi: 10.3390/genes11080910
Resumen de PubMed | Texto completo de CrossRef | Google Académico
12. Liu, SJ , Xue, HP , Pu, BQ , y Qian, NH . Una nueva enfermedad viral en conejos. Un veterinario de Husb Med. (1984) 16:253–5.
13. Cancellotti, FM , y Renzi, M . Epidemiología y situación actual de la enfermedad hemorrágica viral de conejos y el síndrome de liebre parda europea en Italia. Rev Sci Tech. (1991) 10:409–22. DOI: 10.20506/RST.10.2.558
Resumen de PubMed | Texto completo de CrossRef | Google Académico
14. Gregg, DA , Casa, C , Meyer, R , y Berninger, M . Enfermedad hemorrágica viral de conejos en México: epidemiología y caracterización viral. Rev Sci Tech. (1991) 10:435–51. DOI: 10.20506/RST.10.2.556
Resumen de PubMed | Texto completo de CrossRef | Google Académico
15. Morisse, JP , Le Gall, G , y Boilletot, E . Hepatitis de origen viral en Leporidae: introducción e hipótesis etiológicas. Rev Sci Tech. (1991) 10:269–310. doi: 10.20506/rst.10.2.549
Resumen de PubMed | Texto completo de CrossRef | Google Académico
16. Le Gall-Recule, G , Zwingelstein, F , Boucher, S , Le Normand, B , Plassiart, G , Portejoie, Y, et al. Detección de una nueva variante del virus de la enfermedad hemorrágica del conejo en Francia. Veterinario Rec. (2011) 168:137–8. DOI: 10.1136/VR.D697
Resumen de PubMed | Texto completo de CrossRef | Google Académico
17. Hall, RN , Mahar, JE , Haboury, S , Stevens, V , Holmes, CE , y Strive, T . Virus emergente de la enfermedad hemorrágica del conejo 2 (RHDVb), Australia. Emerg infectar dis. (2015) 21:2276–8. doi: 10.3201/eid2112.151210
Resumen de PubMed | Texto completo de CrossRef | Google Académico
18. Martín-Alonso, A , Martin-Carrillo, N , García-Livia, K , Valladares, B , y Foronda, P . Virus emergente de la enfermedad hemorrágica del conejo 2 (RHDV2) a las puertas del continente africano. Infectar Genet Evol. (2016) 44:46–50. doi: 10.1016/j.meegid.2016.06.034
Resumen de PubMed | Texto completo de CrossRef | Google Académico
19. Rouco, C , Aguayo-Adán, JA , Santoro, S , Abrantes, J , y Delibes-Mateos, M . Rápida propagación mundial del nuevo virus de la enfermedad hemorrágica del conejo (GI.2/RHDV2/b). Transbound Emerg Dis. (2019) 66:1762–4. doi: 10.1111/tbed.13189
Resumen de PubMed | Texto completo de CrossRef | Google Académico
20. RHD (2019). Ficha técnica de enfermedad (Conejo hemorrágico) [Internet]. Disponible en: https://www.oie.int/fileadmin/Home/eng/Animal_Health_in_the_World/docs/pdf/Disease_cards/RHD (consultado el 22 de junio de 2022).
21. Hu, B , Wei, H , Ventilador, Z , Canción, Y , Chen, M , Qiu, R, et al. Aparición del virus de la enfermedad hemorrágica del conejo 2 en China en 2020. Vet Med Sci. (2021) 7:236–9. DOI: 10.1002/VMS3.332
Resumen de PubMed | Texto completo de CrossRef | Google Académico
22. Asin, J , Nyaoke, AC , Moore, JD , González-Astudillo, V , Clifford, DL , Lantz, EL, et al. Brote del virus de la enfermedad hemorrágica 2 del conejo en el suroeste de los Estados Unidos: primeras detecciones en el sur de California. J Vet Diagn Investig. (2021) 33:728–31. doi: 10.1177/10406387211006353
Resumen de PubMed | Texto completo de CrossRef | Google Académico
23. Dalton, KP , Nicieza, I , Balseiro, A , Muguerza, MA , Rosell, JM , Casais, R, et al. Variante del virus de la enfermedad hemorrágica del conejo en conejos jóvenes, España. Emerg infectar dis. (2012) 18:2009–12. DOI: 10.3201/EID1812.120341
Resumen de PubMed | Texto completo de CrossRef | Google Académico
24. Neimanis, AS , Ahola, H , Larsson Pettersson, U , Lopes, AM , Abrantes, J , Zohari, S, et al. Superando las barreras de especies: un brote de Lagovirus europaeus GI.2/RHDV2 en una población aislada de liebres de montaña (Lepus timidus). BMC Vet Res. (2018) 12:367. DOI: 10.1186/S12917-018-1694-7
25. Velarde, R , Abrantes, J , Lopes, AM , Estruch, J , Côrte-Real, JV , Esteves, PJ, et al. Evento de derrame de Lagovirus europaeus/GI.2 recombinante en la liebre ibérica (Lepus granatensis) en España. Transbound Emerg Dis. (2021) 68:3187–93. doi: 10.1111/tbed.14264
Resumen de PubMed | Texto completo de CrossRef | Google Académico
26. Lankton, J , Knowles, S , Keller, S , Shearn-Bochsler, VI , e IP, SA . Patología de Lagovirus europaeus GI.2/RHDV2/b (virus de la enfermedad hemorrágica del conejo 2) en lagomorfos nativos de América del Norte. J Wildl Dis. (2021) 57:694–700. doi: 10.7589/JWD-D-20-00207
Resumen de PubMed | Texto completo de CrossRef | Google Académico
27. Puggioni, G , Cavadini, P , Maestrale, C , Scivoli, R , Botti, G , Ligios, C, et al. El nuevo virus francés de la enfermedad hemorrágica del conejo de 2010 causa una enfermedad similar a RHD en la liebre del cabo de Cerdeña (Lepus capensis mediterraneus). Vet Res. (2013) 44:96. doi: 10.1186/1297-9716-44-96
Resumen de PubMed | Texto completo de CrossRef | Google Académico
28. Hall, RN , Pavo real, DE , Kovaliski, J , Mahar, JE , Mourant, R , Piper, M, et al. Detección de RHDV2 en liebres pardas europeas (Lepus europaeus) en Australia. Veterinario Rec. (2017) 180:121. DOI: 10.1136/VR.104034
Resumen de PubMed | Texto completo de CrossRef | Google Académico
29. Camarda, A , Pugliese, N , Cavadini, P , Circella, E , Capucci, L , Caroli, A, et al. Detección del nuevo virus emergente de la enfermedad hemorrágica del conejo tipo 2 (RHDV2) en Sicilia a partir de conejo (Oryctolagus cuniculus) y liebre italiana (Lepus corsicanus). Res Vet Sci. (2014) 97:642–5. doi: 10.1016/j.rvsc.2014.10.008
Resumen de PubMed | Texto completo de CrossRef | Google Académico
30. Calvete, C , Mendoza, M , Sarto, diputado , Bagues, MPJ , Luján, L , Molin, J, et al. Detección del virus de la enfermedad hemorrágica del conejo GI.2/RHDV2/b en el topillo del pino mediterráneo (Microtus duodecimcostatus) y musaraña de dientes blancos (Crocidura russula). J Wildl Dis. (2019) 55:467–72. doi: 10.7589/2018-05-124
Resumen de PubMed | Texto completo de CrossRef | Google Académico
31. Abade Dos Santos, FA , Pinto, A , Burgoyne, T , Dalton, KP , Carvalho, CL , Ramilo, DW, et al. Eventos indirectos del virus 2 de la enfermedad hemorrágica del conejo (GI.4P-GI.2 recombinante) de Lagomorpha al tejón euroasiático. Transbound Emerg Dis. (2022) 69:1030–45. doi: 10.1111/tbed.14059
Resumen de PubMed | Texto completo de CrossRef | Google Académico
32. Autores (2013). Disponible en: https://www.fao.org/faostat/en/#home (consultado el 21 de marzo de 2023).
33. Ben Chehida, F , Lopes, AM , Corte-Real, JV , Sghaier, S , Aouini, R , Messadi, L, et al. Introducciones múltiples del virus de la enfermedad hemorrágica del conejo Lagovirus europaeus/GI.2 en África. Biología. (2021) 10:883. doi: 10.3390/biología10090883
Resumen de PubMed | Texto completo de CrossRef | Google Académico
34. Rahali, N , Sghaier, S , Kbaier, H , Zanati, A , y Bahloul, C . Caracterización genética y análisis filogenético del virus de la enfermedad hemorrágica del conejo aislado en Túnez de 2015 a 2018. Arco Virol. (2019) 164:2327–32. DOI: 10.1007/S00705-019-04311-Z
Resumen de PubMed | Texto completo de CrossRef | Google Académico
35. Erfan, AM , y Shalaby, AG . Genotipado del virus de la enfermedad hemorrágica del conejo detectado en conejos enfermos en provincias egipcias mediante secuenciación VP60. Mundo veterinario. (2020) 13:1098–107. doi: 10.14202/vetworld.2020.1098-1107
Resumen de PubMed | Texto completo de CrossRef | Google Académico
36. Naglaa, FA , y Gamelat, KK . Caracterización genética del virus de la enfermedad hemorrágica del conejo de conejos infectados naturalmente en la gobernación de Sharkia, Egipto. J Virol Sci. (2018) 3:10–9.
37. Magouzi, AF , Elsayed, EA , y Metwally, AY . Detección y caracterización de cepas del virus de la enfermedad hemorrágica del conejo que circulan en Egipto. Bulg J Vet Med. (2019) 22:409–18. DOI: 10.15547/BJVM.2085
38. Rouco, C , Abrantes, J , Serronha, A , Lopes, AM , Maio, E , Magalhães, MJ, et al. Epidemiología de RHDV2 (Lagovirus europaeus/GI.2) en conejos europeos salvajes de vida libre en Portugal. Transbound Emerg Dis. (2017) 65:E373–82. doi: 10.1111/tbed.12767
39. Hall, TA (1999). BioEdit: Un editor de alineación de secuencias biológicas fácil de usar y un programa de análisis para Windows 95/98/NT; 41:95–98.
40. Tamura, K , Stecher, G , y Kumar, S . MEGA11: análisis de genética evolutiva molecular versión 11. Mol Biol Evol. (2021) 38:3022–7. DOI: 10.1093/molbev/msab120
Resumen de PubMed | Texto completo de CrossRef | Google Académico
41. Lavazza, A , y Capucci, L (2006). Enfermedad hemorrágica del conejo (RHD). Avances recientes en las ciencias del conejo.
42. Le Gall-Recule, G , Lavazza, A , Marchandeau, S , Bertagnoli, S , Zwingelstein, F , Cavadini, P, et al. Aparición de un nuevo lagovirus relacionado con el virus de la enfermedad hemorrágica del conejo. Vet Res. (2013) 44:81. DOI: 10.1186/1297-9716-44-81
Resumen de PubMed | Texto completo de CrossRef | Google Académico
43. Marcato, PS , Benazzi, C , Vecchi, G , Galeotti, M , Della Salda, L , Sarli, G, et al. Características clínicas y patológicas de la enfermedad hemorrágica viral de conejos y el síndrome de la liebre parda europea. Rev Sci Tech. (1991) 10:371–92. DOI: 10.20506/rst.10.2.560
Resumen de PubMed | Texto completo de CrossRef | Google Académico
44. Buehler, M , Jesse, ST , Kueck, H , Lange, B , Koenig, P , Jo, WK, et al. Infección por Lagovirus europeus GI.2 (virus de la enfermedad hemorrágica del conejo 2) en liebres de montaña cautivas (Lepus timidus) en Alemania. BMC Vet Res. (2020) 16:166. DOI: 10.1186/S12917-020-02386-4
45. Capucci, L , Cavadini, P , Schiavitto, M , Lombardi, G , y Lavazza, A . Aumento de la patogenicidad en el virus de la enfermedad hemorrágica del conejo tipo 2 (RHDV2). Veterinario Rec. (2017) 180:426. DOI: 10.1136/VR.104132
Resumen de PubMed | Texto completo de CrossRef | Google Académico
46. Katayama, A , Miyazaki, A , Okazaki, N , Nakayama, T , y Mikami, O . Un brote de enfermedad hemorrágica del conejo (RHD) causada por Lagovirus europaeus GI.2/virus de la enfermedad hemorrágica del conejo 2 (RHDV2) en Ehime, Japón. J Vet Med Sci. (2021) 83:931–4. DOI: 10.1292/JVMS.21-0128
Resumen de PubMed | Texto completo de CrossRef | Google Académico
47. Daodu, OB , Shaibu, JO , Richards, AB , Folaranmi, EB , Adegoke, S , Ajadi, A, et al. Detección y caracterización molecular de un primer aislado del virus de la enfermedad hemorrágica del conejo en Nigeria. Trop Anim Health Prod. (2021) 53:185. DOI: 10.1007/S11250-021-02606-5
Resumen de PubMed | Texto completo de CrossRef | Google Académico
48. Calvete, C , Sarto, diputado , Iguacel, L , y Calvo, JH . Infectividad del virus de la enfermedad hemorrágica del conejo excretado en gránulos fecales de conejo. Veterinario Microbiol. (2021) 257:109079. doi: 10.1016/j.vetmic.2021.109079
Resumen de PubMed | Texto completo de CrossRef | Google Académico
Palabras clave: Argelia, conejos, virus de la enfermedad hemorrágica del conejo, epidemiología, RHDV2, GI.2
Cita: Sahraoui L, Lahouassa H, Maziz-Bettahar S, Lopes AM, Almeida T, Ainbaziz H y Abrantes J (2023) Primera detección y caracterización molecular del virus de la enfermedad hemorrágica del conejo (RHDV) en Argelia. Frente. Vet. Sci. 10:1235123. doi: 10.3389/fvets.2023.1235123
Recibido: 05 Junio 2023; Aprobado: 11 de agosto de 2023;
Publicado: 31 agosto 2023.
Editado por:
Veasna Duong, Instituto Pasteur de Camboya, Camboya
Revisado por:
Andrzej Fitzner, Instituto Nacional de Investigación Veterinaria (NVRI), Polonia
Jie Zhu, Academia China de Ciencias Agrícolas, China Hu Bo, Academia Jiangsu de Ciencias Agrícolas (JAAS), China Qui Rulong, Academia Jiangsu de Ciencias Agrícolas (JAAS), China
, en colaboración con el revisor HB
Copyright © 2023 Sahraoui, Lahouassa, Maziz-Bettahar, Lopes, Almeida, Ainbaziz y Abrantes. Este es un artículo de acceso abierto distribuido bajo los términos de la Licencia de Atribución Creative Commons (CC BY).
*Correspondencia: Joana Abrantes, jabrantes@cibio.up.pt
Renuncia: Todas las afirmaciones expresadas en este artículo son únicamente las de los autores y no representan necesariamente las de sus organizaciones afiliadas, o las del editor, los editores y los revisores. Cualquier producto que pueda ser evaluado en este artículo o reclamo que pueda ser hecho por su fabricante no está garantizado ni respaldado por el editor.
Date de alta y recibe nuestro 👉🏼 Diario Digital AXÓN INFORMAVET ONE HEALTH
Date de alta y recibe nuestro 👉🏼 Boletín Digital de Foro Agro Ganadero
Noticias animales de compañía
Noticias animales de producción
Trabajos técnicos animales de producción
Trabajos técnicos animales de compañía