Ecocardiografía de color en modo M para la evaluación no invasiva de la presión intraventricular en perros antes y después de la oclusión del conducto arterial: un estudio retrospectivo
Ecocardiografía de color en modo M para la evaluación no invasiva de la presión intraventricular en perros antes y después de la oclusión del conducto arterial: un estudio retrospectivo
 Ahmed S. Mandour1,2*†, Seijirow Goya3, Lina Hamabe1,
Ahmed S. Mandour1,2*†, Seijirow Goya3, Lina Hamabe1, Katsuhiro Matsuura1,
Katsuhiro Matsuura1, Tomohiko Yoshida1, Momoko Watanabe1, Kazumi Shimada1, Akiko Uemura4, Ken Takahashi5 y
Tomohiko Yoshida1, Momoko Watanabe1, Kazumi Shimada1, Akiko Uemura4, Ken Takahashi5 y Ryou Tanaka1*
Ryou Tanaka1*- 1Departamento de Cirugía Veterinaria, Universidad de Agricultura y Tecnología de Tokio, Tokio, Japón
- 2Departamento de Medicina Animal (Medicina Interna), Facultad de Medicina Veterinaria, Universidad del Canal de Suez, Ismailia, Egipto
- 3Departamento de Ciencias de los Recursos Biorrecursos, Universidad de Nihon, Fujisawa, Japón
- 4División de Investigación Veterinaria, Departamento de Cirugía Veterinaria, Universidad de Agricultura y Medicina Veterinaria de Obihiro, Obihiro, Japón
- 5Departamento de Pediatría y Medicina del Adolescente, Escuela de Posgrado de Medicina de la Universidad de Juntendo, Bunkyo, Japón
Antecedentes: La nueva evaluación no invasiva de las diferencias y gradientes de presión intraventricular (IVPD e IVPG) mediante ecocardiografía en modo M de color (CMME) es un método prometedor en la evaluación de la función diastólica. El conducto arterioso persistente (PDA) es un defecto cardíaco congénito que se asocia con un aumento de la precarga. El presente trabajo proporciona un ensayo clínico para la evaluación de los cambios en la IVPD y la IVPG en perros antes y después de la oclusión quirúrgica de la PDA.
Materiales y métodos: se inscribieron en este estudio un total de 12 perros propiedad de los clientes. La PDA se confirmó mediante ecocardiografía y todos los perros se sometieron a la oclusión de la PDA. La ecocardiografía convencional y la CMME se realizaron en cada paciente el día de la operación (Pre-PDA) y 48 horas después de su oclusión (Post-PDA). La IVPD total y la IVPG total, así como la presión intraventricular segmentaria (basal, media a apical, media y apica) se midieron a partir de la ecuación de Euler utilizando un software específico (MATLAB). Se analizaron los datos en busca de variabilidad y diferencia entre antes y después de la PDA. El efecto de la oclusión de PDA en las variables medidas se calculó utilizando la correlación clasificada bieral (rc).
Resultados: Hubo una reducción significativa en el volumen diastólico final, el acortamiento de la fracción, el volumen de la carrera y las velocidades de entrada mitral (temprano y tardío) después del cierre de la PDA. La CMME fue factible en todos los perros, y los índices de CMME mostraron una variabilidad moderada, excepto en el segmento apical de IVPD y IVPG. Después del cierre de la PDA, en comparación con la oclusión previa a la PDA, hubo una reducción significativa en el total de IVPD (2,285 ± 0,374 vs. 1.748 ± 0,436 mmHg; P = 0,014), IVPD basal (1,177 ± 0,538 vs. 0,696 ± 0,144 mmHg; P = 0,012), IVPG total (1,141 ± 0,246 vs. 0,933 ± 0,208 mmHg; P = 0,0232) y IVPG basal (0,578 ± 0,199 vs. 0,377 ± 0,113 mmHg; P = 0,001); mientras tanto, los segmentos medio, medio a apical y apical tanto de IVPD como de IVPG mostraron una diferencia no significativa. La magnitud de la oclusión de PDA en las variables medidas fue clínicamente relevante y se asoció con un gran tamaño de efecto en IVPD y IVPG totales y basales (rc > 0,6).
Conclusión: El estudio clínico actual reveló una respuesta coincidente de IVPD y IVPG a la precarga reducida en lugar de a la relajación del ventrículo izquierdo. Este resultado es un paso inicial en la utilidad clínica de las mediciones IVPD e IVPG derivadas de CMME en la evaluación de la función diastólica en perros con PDA que justifica más estudios clínicos.
Introducción
Durante la vida fetal, el túnel vascular, conocido como «ductus arterioso», deriva la sangre entre la aorta y la arteria pulmonar principal para evitar los pulmones fetales inmaduros no funcionales. Al nacer, el aumento abrupto del contenido de oxígeno en sangre y la reducción de los niveles de prostaglandina en sangre estimulan el cierre del conducto. En los perros, el cierre funcional del conducto se produce 4 días después del parto y se completa a los 7-8 días de edad (1 a 3). Sin embargo, la hipoplasia y la asimetría de la arquitectura ductal dan como resultado el conducto arterioso patente (PDA), que es el defecto cardíaco congénito notificado con más frecuencia que afecta a una amplia gama de razas de perros. La PDA representa entre el 20 y el 30 % de los defectos cardíacos congénitos en perros, dependiendo de la detección geográfica (4). La PDA se diagnostica de forma rutinaria en un examen clínico con ecocardiografía que muestra una sobrecarga de volumen (5, 6). Dependiendo del tamaño de la PDA, los signos clínicos de la PDA son variables, desde síntomas vanos o síntomas leves hasta signos graves de insuficiencia cardíaca congestiva, como disnea, soplos cardíacos continuos, pulsos anormales e intolerancia al ejercicio. La PDA en perros se puede controlar médicamente u ocluida quirúrgicamente a través de un catéter transvenoso o mediante toracotomía. La interferencia rápida para la oclusión quirúrgica del túnel PDA es preferible antes de los síntomas clínicos opreses y el daño cardíaco irreversible (2).
Recientemente, las diferencias de presión intraventricular (IVPD) y los gradientes de presión intraventricular (IVPG) derivadas de la CMME se han inventado como herramientas prometedoras para el examen de la función cardíaca. Los estudios revelaron la utilidad de la IVPD y/o la IVPG para el diagnóstico de disfunción diastólica. La viabilidad del nuevo enfoque se ha utilizado en varios modelos experimentales de animales (7-13), así como en algunos estudios en humanos (14-16). Estudios recientes mostraron que la IVPG no invasiva podría ser un indicador de insuficiencia cardíaca en niños, así como en perros que reciben quimioterapia (12, 15). IVPG también explicó el mecanismo subyacente a la disfunción diastólica en la tetralogía de Fallot, que se asoció con una fuerza de succión reducida, como se indica mediante una reducción de la IVPG media a a ópica (14). Otro estudio sugirió que los índices IVPD e IVPG podrían reflejar las condiciones de precarga (9). Sin embargo, todavía se necesitan más estudios para la validación de IVPD/IVPG en el entorno clínico.
La investigación cardiovascular actual se centra en el desarrollo de diagnósticos no invasivos para la disfunción diastólica. Esto se debe a que se sabe que la insuficiencia cardíaca con fracción de eyección conservada (HFpEF) representa la mitad de los pacientes diagnosticados con insuficiencia cardíaca en etapa terminal, y los métodos de diagnóstico precisos son desafiantes y aún no se han establecido (17). La evaluación de la función diastólica mediante ecocardiografía convencional es limitada, ya que las mediciones se ven afectadas por la frecuencia cardíaca y las arritmias. Es necesaria una combinación de varias técnicas ecocardiográficas para evitar la sobreestimación de las mediciones ecocardiográficas (18). Además, el uso práctico de un método de cateterismo cardíaco fiable es invasivo y requiere procedimientos perioperatorios, incluida la anestesia y técnicas quirúrgicas (19, 20). Hasta donde sabemos, no hay informes de estudios clínicos que se hayan centrado en la importancia del análisis IVPD y IVPG obtenido de la CMME en la cardiopatía congénita canina. La PDA es un buen ejemplo de sobrecarga de volumen, que resultó en una profunda derivación de izquierda a derecha desde la aorta hasta la arteria pulmonar que condujo a la dilatación del lado izquierdo, aumento de la presión diastólica final, insuficiencia miocárdica y edema pulmonar abierto (6, 21). Planteamos la hipótesis de que los cambios hemodinámicos y de contractilidad que se producen antes y después del cierre de la PDA podrían detectarse mediante la medición de IVPD y IVPG utilizando CMME. El presente estudio tiene como objetivo proporcionar una evaluación a corto plazo de los cambios de IVPD/IVPG en perros con PDA.
Materiales y métodos
Animales y protocolo de estudio
En este estudio se inscribieron un total de 12 perros de propiedad de clientes diagnosticados ecocardiográficamente con PDA y sometidos a oclusión transvascular de PDA. El estudio se llevó a cabo entre enero de 2018 y abril de 2021 en el Centro Médico Animal de la Universidad de Agricultura y Tecnología de Tokio, Japón. Antes de la inscripción, se obtuvo el consentimiento informado de todos los propietarios.
Examen clínico y diagnóstico de PDA
El diagnóstico y la decisión para el tratamiento quirúrgico de la PDA se determinaron a través de una evaluación clínica exhaustiva que incluyó una historia clínica detallada, examen físico (incluyendo auscultación cardíaca, color de la membrana mucosa, condición respiratoria, etc.), así como radiografía torácica, electrocardiografía y ecocardiografía. En la auscultación cardíaca, se detectó soplo sistólico basátero izquierdo continuo de grado IV en todos los casos. Los objetos/parámetros específicos que se evaluarán antes de la cirugía fueron los siguientes: señalización (edad, raza, sexo y peso corporal), caracterización anatómica de la PDA, existencia y gravedad de la insuficiencia cardíaca, así como disfunción sistólica y/o diastólica.
Cierre de PDA
La oclusión del conducto arterioso persistente se realizó mediante toracotomía intercostal bajo anestesia general. Todos los procedimientos preoperatorios, intraoperatorios y postoperatorios se llevaron a cabo como se describe en informes anteriores (22-24). Todos los perros fueron sedados con clorhidrato de buprenorfina (Lepetan; Otsuka Pharmaceutical Co., Ltd., Tokio, Japón, 0,02 mg/kg, por vía intravenosa), clorhidrato de midazolam (Dormicum; Astellas Pharma Inc., Tokio, Japón, 0,2 mg/kg, por vía intravenosa) y sulfato de atropina (sulfat Después de la intubación traqueal, la anestesia se indujo con propofol (Propofol Mylan; Mylan Seiyaku, Tokio, Japón, 4 mg/kg, por vía intravenosa) y se mantuvo por inhalación de isoflurano (isoflurano para uso animal; Intervet, Osaka, Japón, concentración de marea final de 1,5 ± 0,1 %). El conducto arterioso se ocluyó con un doble clip hemostático (clip de ligadura de titanio DS, Aesculap, Japón). Durante la cirugía, se realizó una ecocardiografía transesofágica con ProSound SSD-α10 (Hitachi Aloka Medical, Ltd., Japón) utilizando una sonda sectorial (UST-52119S, Hitachi Aloka Medical, Ltd., Japón). La confirmación postoperatoria del clip y la fuga hemostáticos se evaluó mediante ecocardiografía Doppler.
Ecocardiografía convencional
La ecocardiografía estándar se realizó en todos los perros sin adeudar en la línea de base el día de la operación antes de la oclusión quirúrgica de la PDA (Pre-PDA) y 48 horas después de su oclusión (Post-PDA). La ecocardiografía se realizó utilizando ALOKA prosonido α10 (Hitachi Aloka Medical, Ltd., Japón) con una sonda transductor de matriz de fase de 5 MHz (UST52108, Hitachi Aloka Medical, Ltd., Japón). Los perros se colocaron en recumbencia lateral y el examen ecocardiográfico convencional de las ventanas cardíacas derecha e izquierda estándar se registró utilizando una técnica ecocardiográfica estándar bien conocida (25). Se informaron las siguientes mediciones desde la vista del eje corto parasternal derecha a nivel del músculo papilar: diámetros diastólico final del ventrículo izquierdo (LV) y sistólico final (LVIDd, LVIDs), grosor del tabique interventricular en la diástole y la sístole (IVSd, IVSs), grosor de la pared libre Desde la vista del eje corto parasternal derecho en la base del corazón en la sístole tardía, el diámetro de la aurícula izquierda (LAD), el diámetro aórtico (Ao) y la relación entre el diámetro auricular izquierdo y el diámetro aórtico (LA/Ao) se obtuvieron mediante ecocardiografía bidimensional. Además, el tracto de salida del ventrículo derecho (RVOT) se midió mediante ecocardiografía Doppler de onda pulsada de la arteria pulmonar principal. En la vista apical izquierda, el tracto de salida del ventrículo izquierdo (LVOT) y los índices de velocidad de entrada mitral (velocidad temprana, Ev; velocidad tardía, Av) se midieron utilizando la ecocardiografía Doppler de onda pulsada, mientras que las imágenes Doppler tisulares (TDI) se utilizaron para medir los índices de velocidad del tejido Las mediciones de TDI incluyen la velocidad sistólica (Sm), así como las velocidades tempranas y tardías del tejido diastólico (Em y Am) de IVS (septal, Sep) y LVPW (parla libre, FW). Luego se calculó la relación correspondiente entre Em/Am, así como E y Em (E/Em) de IVS y LVPW.
Ecocardiografía en modo M de color para la evaluación de IVPD y IVPG
Todo el protocolo de ecocardiografía, incluido el CMME, se realizó en 15 minutos, en los que se rastreó el CMME en 5 minutos. Para evitar las imágenes erróneas relacionadas con el estrés, el examen se detuvo temporalmente cuando hubo un aumento abrupto de la frecuencia respiratoria y cardíaca. La sonda de ultrasonido se estableció para rastrear IVPG desde la vista apical izquierda de dos cámaras con una visualización adecuada de todo el tracto de entrada mitral hasta el ápice del VI. Para aumentar el límite de Nyquist, se ajustó un ajuste de máquina anterior que incluía una velocidad de barrido de 300 mm/s y un desplazamiento de línea de base de color en -64. Durante el procesamiento de imágenes para IVPD y IVPG utilizando el MATLAB, el tiempo desde la apertura de la válvula aórtica hasta su cierre, el tiempo desde el inicio de la onda Q hasta el inicio de la entrada mitral temprana (ola E) y el tiempo desde el inicio de la onda Q hasta la onda máxima E se recogieron de la ecocardiografía convencional y se insertar El mismo observador seleccionó y analizó por separado cinco imágenes de alta calidad de latidos cardíacos consecutivos, y se consideró la medición media de cada paciente para el análisis.
El IVPD y el IVPG derivados del CMME se calcularon sobre la base de la técnica de mediciones del IVPD previamente validada (14, 26, 27). IVPD se calculó a partir de la ecuación de Euler después de procesar las imágenes obtenidas a través del CMME utilizando MATLAB (The MathWorks, Natick, MA, EE. UU.) de la siguiente manera:
(∂ P)/(∂s) = –ρ((∂v)/(∂ t) + v (∂v)/(∂ s)).
donde ∂ es el cambio en el elemento seguido, P es la presión, ρ es la densidad sanguínea constante (1,060 kg/m3), v es la velocidad, s es la posición junto con la línea de color M-mode y t es el tiempo. Los valores de IVPG se derivaron del IVPD de acuerdo con la siguiente fórmula (14, 26-28):
IVPG (mmHg/cm) = longitud IVPD/LV.
El IVPG y el IVPD se dividieron automáticamente en segmentos basal, medio a apical, medio y apical, que corresponden a su ubicación en el VI (11, 12, 14).
Análisis estadístico
El tamaño de la muestra de perros antes y después del cierre de la PDA se midió en función de los resultados y cálculos realizados con el software G*Power 3.1.9.2 (Universidad de Kiel, Alemania, 1992-2014) (29) asumiendo un efecto moderado de la oclusión de la PDA en las variables de CMME de acuerdo con Cohen con un tamaño de efecto de 0,37 (30). La normalidad de los datos se probó mediante la prueba de Shapiro-Wilk y se informó del coeficiente del 95 % de variaciones (CV) y del intervalo de confianza (IC) del 95 % de las medias. Se utilizó la prueba de rango firmado de pares emparejados de Wilcoxon para comparar todos los datos ecocardiográficos antes y después de la oclusión de la PDA utilizando GraphPad Prism Versión 8 (GraphPad Software Inc., San Diego, CA, EE. UU.). Las variables analizadas que mostraban P < 0,05 se consideraron estadísticamente significativas. La correlación de rango de Spearman se midió entre los parámetros cardíacos convencionales y los índices de CMME. Para examinar el efecto del cierre de PDA en los parámetros obtenidos, el tamaño del efecto para los datos no paramétricos se calculó mediante correlación de rango-biserial (rc) utilizando un programa de software JASP gratuito. La interpretación del tamaño del efecto se realizó en base a los valores de rc de la siguiente manera (31): efecto pequeño (rc ≥ 0,1), efecto medio (rc ≥ 0,4) y efecto grande (rc ≥ 0,6).
Resultados
Hallazgos y resultados clínicos
Doce perros de raza pequeña se sometieron a tratamiento quirúrgico para PDA. En este estudio se incluyeron cinco razas de perros: Pomeranias (33,3 %, n = 4), Chihuahua (25 %, n = 3), maltés (16,7 %, n = 2), Mix (16,6 %, n = 2) y Caniches de juguete (8,3 %, n = 1). En total, se incluyeron siete hombres (58,3%) y 5 mujeres (41,7%). El día del diagnóstico, la mediana del peso corporal fue de 1,49 kg (rango: 0,92–2.16) y la mediana de edad fue de 4,5 meses (rango: 2–7). Un perro tenía diarrea y la clínica de referencia le recetó medicamentos antidiarrea y antibióticos antes de la cirugía. Además, un perro mostró tos y otro tenía poliuria y polidipsia. Ningún perro mostró síntomas graves de insuficiencia cardíaca ni recibió otros medicamentos.
Ecocardiografía convencional
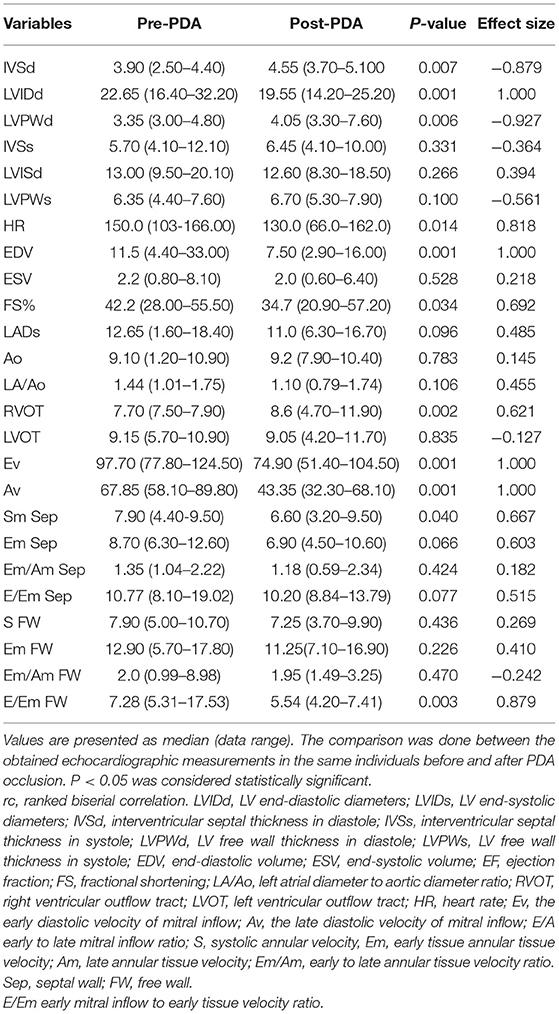
La figura 1 ilustra los hallazgos ecocardiográficos convencionales en perros diagnosticados con PDA. La derivación PDA izquierda-derecha se detectó desde la ubicación paraesternal craneal izquierda después de obtener la base del corazón en el eje corto. La tabla 1 muestra las mediciones funcionales de la ecocardiografía convencional. Los datos revelaron un aumento significativo en el grosor de IVSd y LVPWd, y una reducción significativa en LVIDd, frecuencia cardíaca, EDV, FS y ondas de entrada mitral (Ev y Av). Por TDI, el Sm del tabique y el E/Em de la pared libre se redujeron significativamente. El tamaño del efecto en los parámetros de función cardíaca antes mencionados fue grande (rc > 0,6). Antes de la operación, la mediana de velocidad de la PDA era de 536,3 cm/s (rango: 434,3–59,9 cm/s). Se observaron las siguientes anomalías en los entornos postoperatorios: se encontró regurgitación mitral (MR) en ocho perros (velocidad media de la RM: 571,5 cm/s, dp/dt: 3,123,7 mmHg/s); regurgitación pulmonar (PR) en cuatro perros (mediana de PR: 146,0 cm/s); Todos los perros fueron dados de alta del hospital 48 horas después de mostrar estabilidad hemodinámica.
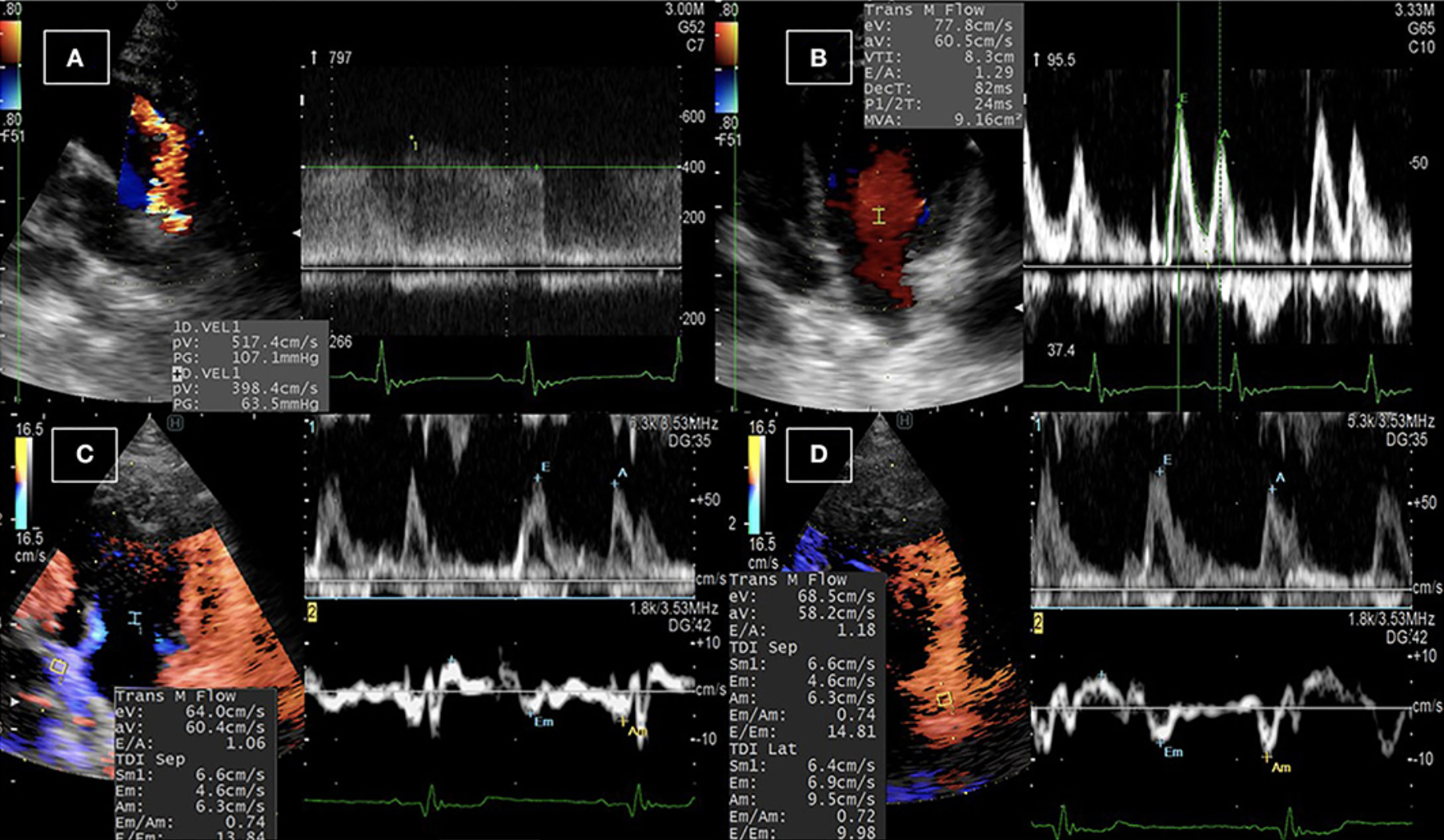
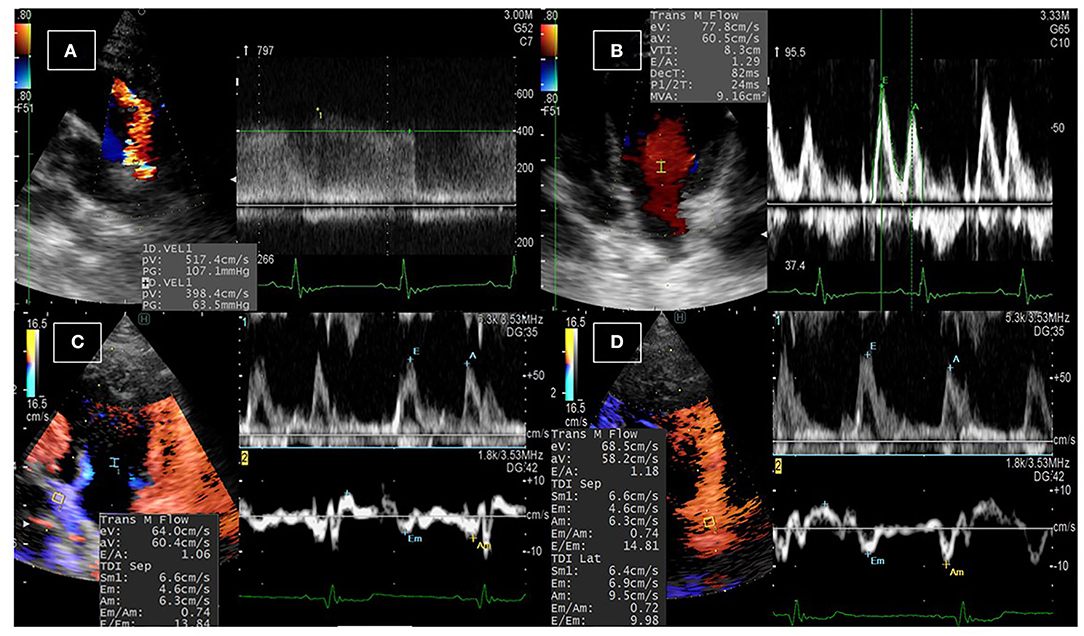 FIGURA 1. Examen ecocardiográfico convencional en perros con PDA. (A) La derivación de PDA se detectó tras el examen ecocardiográfico desde la vista del eje corto paraesternal izquierdo en la base del corazón mediante ecocardiografía Doppler en color, y la velocidad del flujo sanguíneo a través del derivación se detectó mediante ecocardiografía Doppler de onda continua. (B) Se utilizó la ecocardiografía Doppler de onda pulsada del flujo transmisral para medir los picos diastólicos tempranos y tardíos. (C,D) Imágenes Doppler duales del flujo transmisral y las imágenes Doppler tisulares en el tabique (C) y la pared libre (D) DEL ventrículo izquierdo para medir la velocidad de entrada temprana a la relación de velocidad tisular temprana (E/Em).
FIGURA 1. Examen ecocardiográfico convencional en perros con PDA. (A) La derivación de PDA se detectó tras el examen ecocardiográfico desde la vista del eje corto paraesternal izquierdo en la base del corazón mediante ecocardiografía Doppler en color, y la velocidad del flujo sanguíneo a través del derivación se detectó mediante ecocardiografía Doppler de onda continua. (B) Se utilizó la ecocardiografía Doppler de onda pulsada del flujo transmisral para medir los picos diastólicos tempranos y tardíos. (C,D) Imágenes Doppler duales del flujo transmisral y las imágenes Doppler tisulares en el tabique (C) y la pared libre (D) DEL ventrículo izquierdo para medir la velocidad de entrada temprana a la relación de velocidad tisular temprana (E/Em).
Ecocardiografía en modo M de color
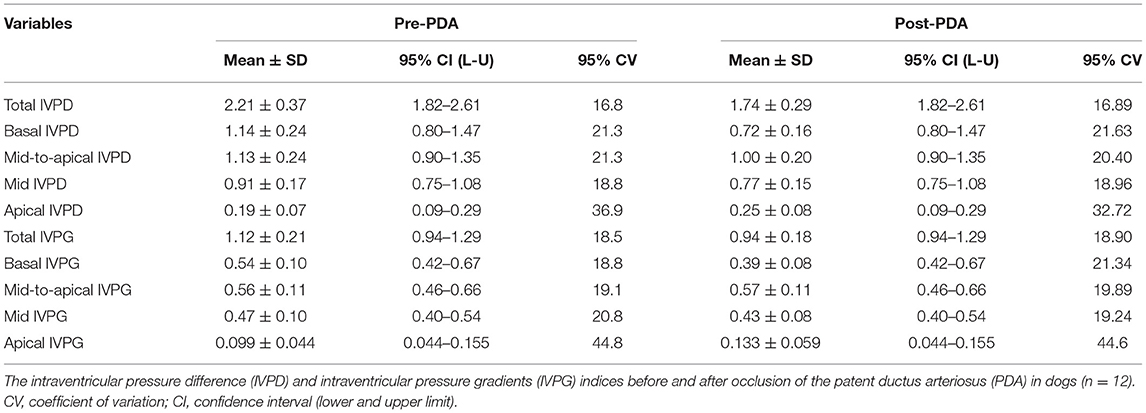
El CMME se realizó con éxito en todos los perros (Figura 2). Todos los perros mostraron ondas de entrada mitral espectral estándar de CMME con la apertura y el cierre de la válvula mitral. Los resultados de IVPD y IVPG obtenidos de MATLAB produjeron cinco índices diferentes, total, basal, medio a apical, medio y apical. La tabla 2 muestra las estadísticas descriptivas de las variables de CMME en perros antes y después de la oclusión de PDA. Todos los datos de CMME se distribuyeron normalmente, excepto el IVPD de medio a ático. La variabilidad de los datos de CMME de antes y después de la PDA se calculó por separado, lo que mostró un CV comparable del 95 %. Todos los índices IVPD e IVPG obtenidos de pre y post-PDA mostraron una variabilidad moderada (95% CV <25%), excepto el IVPD apical y el IVPG apical (95% CV = 36,9 y 44,8, respectivamente). La variabilidad de los datos de IVPD y IVPG entre los ciclos cardíacos no fue significativa.
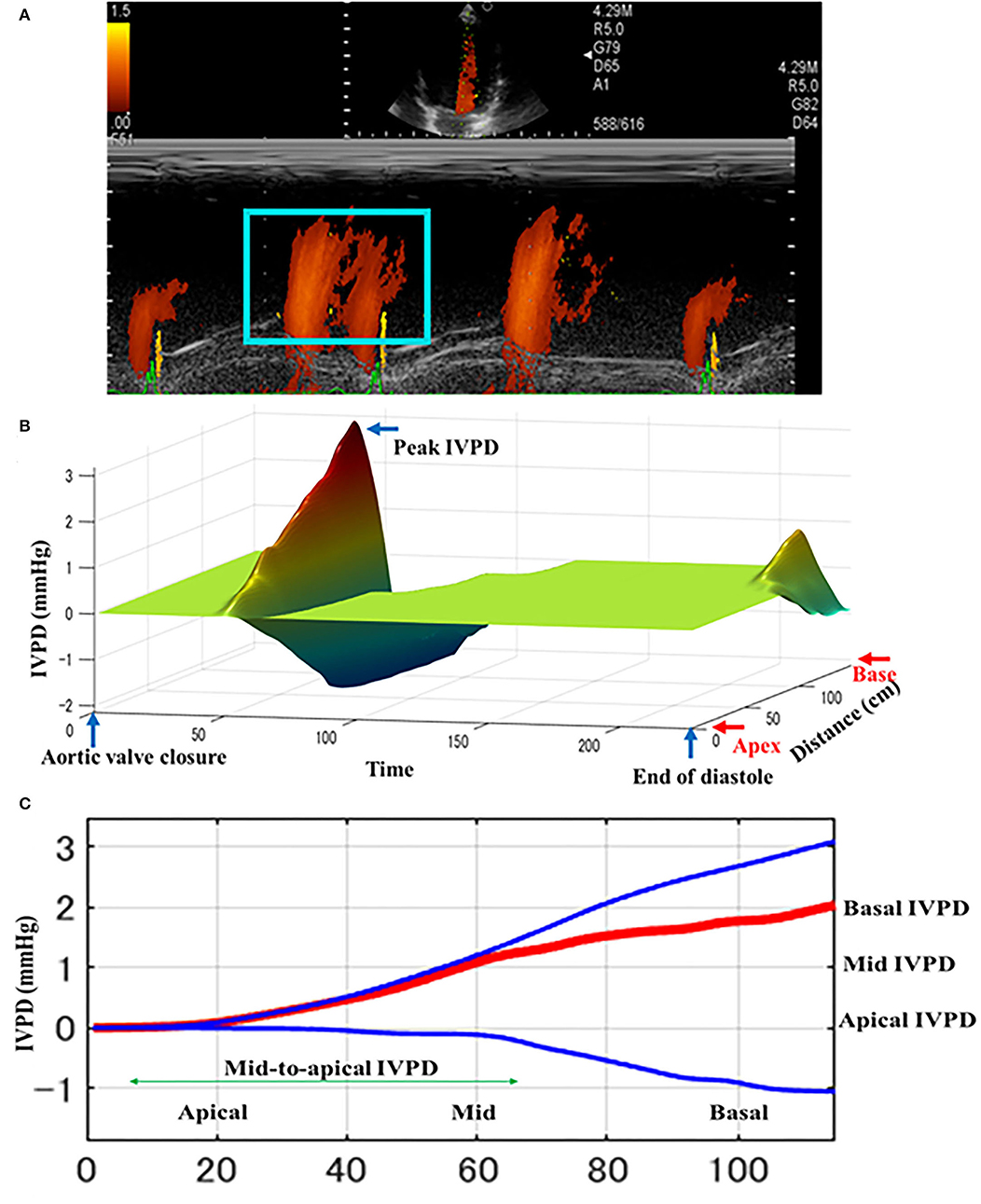 FIGURA 2. Ilustración esquemática de la diferencia intraventricular (IVD) medida por ecocardiografía de modo m de color (CMME) en perros antes de la oclusión de PDA. La entrada mitral se optimizó en primer lugar desde la vista apica izquierda de cuatro cámaras. Después de eso, se encendió la configuración de la máquina para que CMME mida IVPD (IVPG) y se capturaron fotos (A).Las fotos guardadas sin conexión fueron procesadas posteriormente por el software MATLAB para el cálculo de IVPD y IVPG. El perfil tridimensional de IVPD se calculó después de la extracción de los elementos de velocidad, temporales y espaciales de la región de interés (caja azul) (B). Distribución espacial del IVPD a lo largo de todo el ventrículo izquierdo desde la base hasta el ápice (C). Las líneas superior (azul), media (roja) e inferior (azul) representan la IVPD inercial, total y convectiva, respectivamente.
FIGURA 2. Ilustración esquemática de la diferencia intraventricular (IVD) medida por ecocardiografía de modo m de color (CMME) en perros antes de la oclusión de PDA. La entrada mitral se optimizó en primer lugar desde la vista apica izquierda de cuatro cámaras. Después de eso, se encendió la configuración de la máquina para que CMME mida IVPD (IVPG) y se capturaron fotos (A).Las fotos guardadas sin conexión fueron procesadas posteriormente por el software MATLAB para el cálculo de IVPD y IVPG. El perfil tridimensional de IVPD se calculó después de la extracción de los elementos de velocidad, temporales y espaciales de la región de interés (caja azul) (B). Distribución espacial del IVPD a lo largo de todo el ventrículo izquierdo desde la base hasta el ápice (C). Las líneas superior (azul), media (roja) e inferior (azul) representan la IVPD inercial, total y convectiva, respectivamente.
Efecto del cierre de PDA en las mediciones de IVPD y IVPG
Las figuras 3, 4 representan los resultados de los índices IVPD y IVPG antes y después de la oclusión de PDA. Los datos revelaron una reducción significativa en el IVPD total (Medida ± SD: 2,285 ± 0,373 vs. 1.748 ± 0,436 mmHg; P = 0,014), IVPD basal (1,177 ± 0,538 vs. 0,696 ± 0,144 mmHg; P = 0,012), IVPG total (1,141 ± 0,246 vs. 0,933 ± 0,208 mmHg; P = 0,0232) y IVPG basal (0,578 ± 0,199 vs. 0,377 ± 0,113 mmHg; P = 0,001) después del cierre de la PDA. El porcentaje de reducción en IVPD total, IVPD basal, IVPG total y IVPG basal después del cierre de PDA fue del 23,5% (0,537 mmHg), 40,9% (0,481 mmHg), 18,23 % (0,208 mmHg) y 34,8% (0,201 mmHg), respectivamente. Además, hubo aumentos no significativos en la IVPD apical (0,198 ± 0,157 vs. 0,253 ± 0,180 mmHg) y IVPG apical (0,107 ± 0,088 vs. 0,131 ± 0,089 mmHg) después del cierre de la PDA en comparación con la línea de base (P > 0,05). Además, no hubo ningún cambio significativo en el IVPD y IVPG de mediados y medios a áticos. Con respecto al tamaño del efecto, las diferencias en los datos observados (Pre y Post-PDA) fueron clínicamente relevantes y mostraron una asociación con un gran tamaño de efecto en el IVPD total (rc = 1,0), el IVPD basal (rc = 0,889), el IVPG total (rc = 0,944) y el IVPG basal (rc = 1,0).
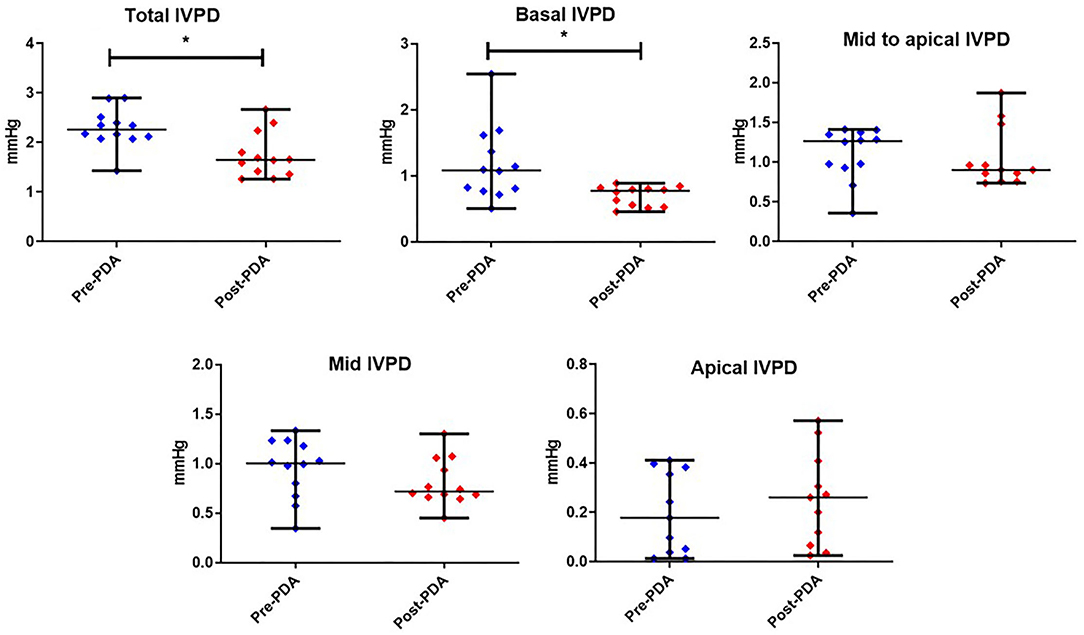 FIGURA 3. Variables de diferencia de presión intraventricular (IVPD) derivadas de CMME antes y después de la oclusión del conducto arterioso patente (pre-PDA, post-PDA) en perros (n = 12). Gráficos de puntos que muestran la mediana y el rango. *indica la significación estadística (P < 0,05).
FIGURA 3. Variables de diferencia de presión intraventricular (IVPD) derivadas de CMME antes y después de la oclusión del conducto arterioso patente (pre-PDA, post-PDA) en perros (n = 12). Gráficos de puntos que muestran la mediana y el rango. *indica la significación estadística (P < 0,05).
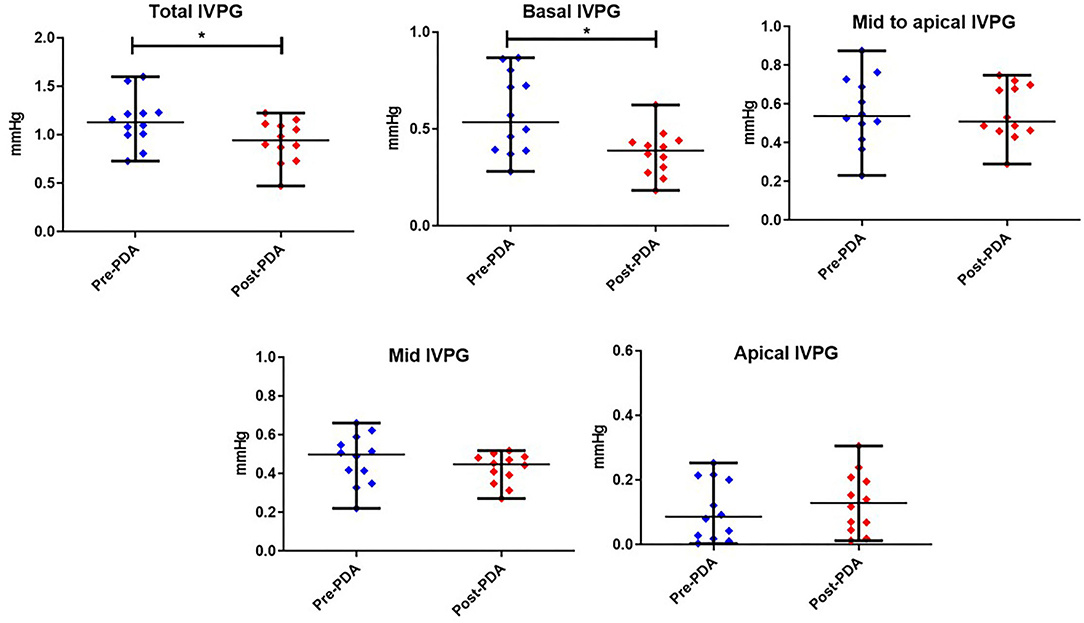 FIGURA 4. Gráficos de puntos que muestran la mediana y el rango de los índices de gradientes de presión intraventricular (IVPG) antes y después del cierre de la PDA en perros (n = 12). *revela la significación estadística (P < 0,05).
FIGURA 4. Gráficos de puntos que muestran la mediana y el rango de los índices de gradientes de presión intraventricular (IVPG) antes y después del cierre de la PDA en perros (n = 12). *revela la significación estadística (P < 0,05).
Correlación entre los índices IVPD/IVPG y las mediciones ecocardiográficas
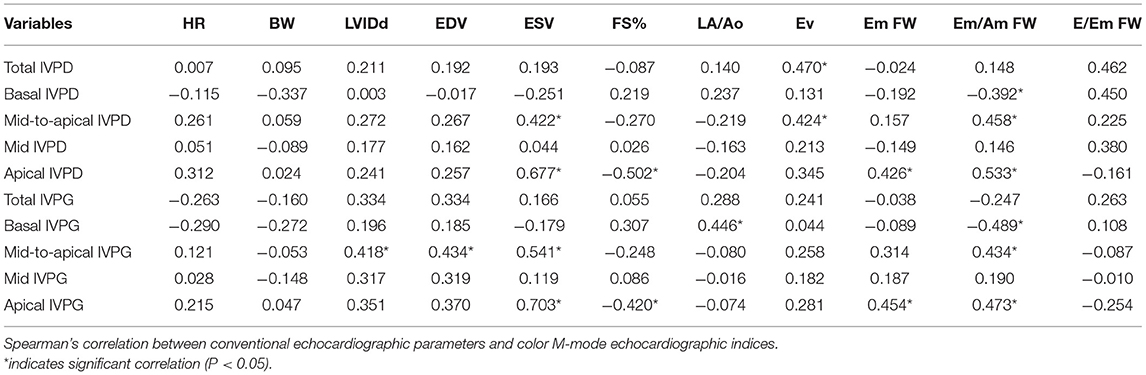
Los resultados de la correlación se presentan en la tabla 3. El IVPD total se correlacionó positivamente con Ev (r = 0,470,P = 0,021). El IVPD basal tuvo una tendencia positiva con la pared libre de E/Em (r = 0,450, P = 0,071). El IVPD medio-apical se correlacionó con ESV (r = 0,422, P = 0,040) y Ev (r = 0,424, P = 0,040). Apical IVPD se correlacionó positivamente con ESV (r = 0,677, P = 0,001) y negativamente con FS (r = −0,502, P = 0,017). El IVPG basal se correlacionó con LA/Ao (r = 0,446, p = 0,033). El IVPG medio-apical se correlacionó con LVIDd (r = 0,418, P = 0,042), EDV (r = 0,434, P = 0,034) y ESV (r = 0,541, P = 0,022). Apical IVPG se correlacionó con Em de la pared libre (r = 0,454, P = 0,026). La pared libre Em/Am se correlacionó negativamente con la IVPD basal y la IVPG basal, y se correlacionó positivamente con la IVPD media a la apical, la IVPD apical, la IVPG media a la apical y la IVPG apical. Ni el peso corporal ni la FC se correlacionaron significativamente con los índices de CMME.
Discusión
En las cardiopatías congénitas como la PDA, es importante considerar la función diastólica y la precargar por separado para comprender la fisiopatología y formular un plan de tratamiento (32, 33). Hasta la fecha, la evaluación de IVPD e IVPG a través de CMME todavía se encuentra en la etapa de investigación, y el uso generalizado de estos nuevos métodos requiere ensayos experimentales y clínicos intensivos (7, 12, 15). Estudios recientes han comenzado a revelar la eficiencia de los índices IVPD e IVPG derivados de CMME para la evaluación de la función cardíaca. Sin embargo, este es el primer estudio clínico que exploró los cambios a corto plazo en la IVPD y la IVPG en perros antes y rápidamente después de la oclusión de la PDA.
Con respecto a los parámetros ecocardiográficos convencionales, la oclusión de PDA dio lugar a una reducción significativa de LVIDd, HR, EDV, FS, Ev, Av, tabique Sm y pared libre E/Em, así como una disminución leve no significativa de Em y E/Em en el tabique interventricular. Estos cambios se han notificado previamente después del cierre de la PDA, y la disfunción sistólica temporal puede ocurrir en algunos perros, lo que parece ser clínicamente poco importante (5, 6, 34). Según la Ley de Frank-Starling, la contractilidad del VI aumenta secundaria a una precarga elevada a través de la derivación existente a través del estiramiento de las fibras musculares para mantener una circulación sistémica efectiva. Por lo tanto, la reducción de la condición de carga del VI después del cierre de la PDA reduce el estiramiento miofibrilar y la contractilidad. En los casos de PDA humano, se ha informado de que una reducción grave en el FS preoperatorio es un factor de riesgo para la muerte postoperatoria (35). Las muertes postoperatorias improbables se encuentran menos en los perros diagnosticados con PDA, ya que generalmente se ingresan a los <1 año de edad antes de cualquier reducción significativa en el FS%. En este estudio, el FS% fue >35% (mediana del 41,9%), excepto en un caso en el que el FS fue del 28,0%, lo que indica que no había reducción del FS preoperatorio%. La reducción del Em (para el tabique) podría explicarse por el hecho de que puede verse afectado por la FC y la precarga (36). Además, la velocidad de Em puede no reflejar la función de todo el ventrículo, ya que es altamente dependiente del ángulo y también está ampliamente influenciada por el movimiento de traslación cardíaca y la atadura (17).
La ecocardiografía de color en modo M se puede utilizar para evaluar por separado la función diastólica y la precarga cardíaca. Ya se ha informado de la viabilidad de CMME para la evaluación de IVPD e IVPG en perros (11, 12). Al igual que en estudios anteriores, IVPD y IVPG se calcularon utilizando un programa en MATLAB, que se modificó aún más a partir de informes anteriores (14, 16, 26-28). Para permitir una evaluación detallada de la fisiopatología de cada fracción de IVPD y IVPG en el VI, el VI se dividió en tres secciones de acuerdo con su localización anatómica, lo que refleja colectiva o parcialmente la función específica del VI, lo que implica que el IVPD y el IVPG se pueden interpretar de manera integral (26). En este estudio, la CMME fue factible en todos los perros y mostró una variabilidad moderada (95 % CV <25%) en todos los índices, excepto el IVPD apical y el IVPG apical. Esos resultados podrían atribuirse a condiciones de carga variables que pueden verse influidas por diferentes factores en los perros, como la edad, el peso corporal y la raza de los perros (11). Dado que todos los datos ecocardiográficos se recopilaron sin sedación previa, los movimientos corporales pueden haber dado lugar a la variabilidad de los datos. La mayor variabilidad en el segmento apical se informó previamente (37), lo que podría explicarse por la variación en la resolución de color de la parte superior de las imágenes de CMME en comparación con la parte inferior.
En el estudio actual, hubo una disminución significativa en la IVPD y la IVPG post-PDA total y basal en comparación con las mediciones previas a la ligadura. Esto se debe presumiblemente a la reducción en el estado de carga secundario a la disminución de la precarga en los perros después de la PDA (9). Esta explicación está respaldada por la reducción observada en LVIDd, Ev y E/Em, que se conocen como indicadores convencionales de la precarga (25). El segmento apical de IVPD y IVPG, por otro lado, aumentó ligeramente pero no significativamente en nuestro estudio. Además, no hubo cambios significativos en la IVPD o IVPG de media y media a la apía. En general, el cierre de la PDA mostró una disminución síncrona en la precarga del VI y un incremento en la poscarga. El aumento de la poscarga está relacionado con la circulación pulmonar de baja resistencia en comparación con la salida del VI (34, 38, 39). Anteriormente se informó de una reducción temporal de la función cardíaca después de la ligadura de PDA (5). Asumimos una disminución en los segmentos medios y/o medios a áticos de presión del VI obtenida a través de CMME como indicación de relajación activa del VI después del cierre de la PDA (7). Sin embargo, esto no se demostró en nuestro estudio, lo que puede deberse al grupo de pequeño tamaño, la ausencia de ICC en nuestros pacientes y la falta de seguimiento a largo plazo por parte de CMME. En otras palabras, 48 horas fueron insuficientes para observar cambios significativos en la relajación activa del VI por CMME. Un estudio previo en humanos requirió un seguimiento a largo plazo para la recuperación de la función cardíaca después del cierre de la PDA (38). Además, la recuperación de la función diastólica después del cierre de la PDA es lenta y difícil de evaluar (40). Por lo tanto, las observaciones a largo plazo de IVPD e IVPG pueden permitir una mejor evaluación de los cambios en la capacidad de mitigación del VI. Sobre la base de nuestros resultados, creemos que la capacidad de relajación del ventrículo izquierdo es menos susceptible a los cambios hemodinámicos repentinos que pueden ser detectables por CMME durante un tiempo más largo de seguimiento del paciente.
En nuestro estudio, hubo algunas correlaciones entre los índices derivados de la CMME y los parámetros ecocardiográficos convencionales, particularmente los que son importantes para la función diastólica, como se observó anteriormente en otros estudios (7, 9-12, 16, 37). Los índices IVPD e IVPG reportados en el presente estudio fueron comparables a los informes anteriores en perros y gatos (11, 15, 37). Un estudio anterior informó de índices IVPD e IVPG derivados de CMME en un grupo de perros sanos de raza pequeña a grande de diferentes edades y BW y encontró que el IVPD estaba influenciado por el tamaño del corazón (11). En nuestro estudio, hubo una correlación significativa entre el IVPG medio-apical y el LVIDd, que podría atribuirse a los estrechos rangos de edad y BW de nuestro grupo. Otro estudio felino mostró que el IVPG total se vio afectado por la FC (37), que no se encontró en nuestro estudio. No hubo mucha diferencia en el rango de FC entre los perros en este estudio y los gatos en el otro estudio (37). A diferencia de los perros, los gatos pueden excitarse mucho durante el examen, y la consiguiente fluctuación de la FC y el aumento de la función sistólica pueden notarse bajo la influencia de un alto tono simpático (37, 41). En nuestro estudio, el coeficiente de correlación era casi débil. Por lo tanto, la interpretación adecuada de estas relaciones puede estar sesgada debido al pequeño tamaño de la muestra y al seguimiento a corto plazo, y nos gustaría acumular un mayor número de casos de PDA a lo largo de una observación longitudinal para aumentar el poder estadístico de nuestros hallazgos en el futuro.
Implicaciones clínicas
Este es el primer estudio clínico que utiliza los índices de CMME en perros para comparar los cambios observados antes y después de la oclusión de PDA. La relevancia clínica del resultado es clara y se ha asociado con un gran tamaño de efecto en los segmentos totales y basales de IVPD y IVPG en lugar de en las partes medias a apicales. El resultado de este estudio no proporcionó evidencia clara de un cambio significativo en el IVPD/IVPG de medio a apáptico, el punto de referencia para una mayor relajación del VI, porque la evaluación después de 48 h después de la oclusión de PDA es demasiado corta para restaurar completamente la función diastólica del ventrículo izquierdo. Esto probablemente se deba a los cambios más rápidos en la hemodinámica en lugar de en los cambios morfológicos en la función cardíaca poco después de la oclusión de la PDA, y es necesaria una mayor observación longitudinal en diferentes momentos.
Limitaciones
El número de perros incluidos en el estudio es pequeño; sin embargo, los datos proporcionados y su relevancia clínica son bastante sólidos. Dado que la operación de PDA se realizó mediante toracotomía intercostal, no se realizó cateterismo ni angiografía para este estudio. Un estudio anterior mostró que el IVPD y el IVPG derivados de la CMME estaban fuertemente correlacionados con el tau medido por cateterismo invasivo, por lo que en este estudio no se realizó una evaluación comparativa del IVPD entre el CMME y el cateterismo (7, 12, 28). Además, las publicaciones recientes utilizaron CMME para la evaluación no invasiva de IVPD y/o IVPG que se ha realizado en perros y gatos sin cateterismo (15, 37).
Conclusión
Una observación a corto plazo de IVPD y IVPG refleja los cambios en la precarga en lugar de la relajación miocárdica, y un seguimiento continuo a diferentes intervalos de tiempo después de la oclusión de PDA justifica otro estudio. En general, IVPD y IVPG derivados de CMME se pueden utilizar para una evaluación adicional de la función cardíaca en perros, y los índices apicales deben considerarse con precaución.
Declaración de disponibilidad de datos
Los autores pondrán a disposición los datos sin procesar que respaldan las conclusiones de este artículo, sin reservas indebidas.
Declaración ética
El estudio de animales fue revisado y aprobado por el Comité Ético del Centro Médico Animal de la Universidad de Agricultura y Tecnología de Tokio. Se obtuvo el consentimiento informado por escrito de los propietarios para la participación de sus animales en este estudio.
Contribuciones del autor
MH, SG y RT concibieron y diseñaron el experimento. RT, SG y KS: procedimientos quirúrgicos. MH, ASM, KM, LH, KT y TY: ecocardiografía y análisis de software. MH y ASM: análisis estadístico, redacción del manuscrito y redacción del manuscrito final. LH, AU, KS, KT y RT revisaron y editaron el manuscrito. Todos los autores han leído y aceptado la versión publicada del manuscrito.
Conflicto de intereses
Los autores declaran que la investigación se llevó a cabo en ausencia de cualquier relación comercial o financiera que pudiera interpretarse como un posible conflicto de intereses.
El editor de manejo HS declaró una coautoría anterior con los autores ASM y RT.
Nota del editor
Todas las afirmaciones expresadas en este artículo son únicamente las de los autores y no representan necesariamente las de sus organizaciones afiliadas, o las del editor, los editores y los revisores. Cualquier producto que pueda ser evaluado en este artículo, o reclamo que pueda ser hecho por su fabricante, no está garantizado ni respaldado por el editor.
Referencias
1. Hew KW, Keller KA. Desarrollo anatómico y funcional postnatal del corazón: una comparación de especies.Defectos de nacimiento Res B Dev Reprod Toxicol. (2003) 68:309al y Reson. 1002/bdrb.10034
2. Buchanan JW, Patterson DF. Etiología del conducto arterioso patente en perros. J Vet Intern Med. (2003) 17:167fctus arterio1111/j.1939-1676.2003.tb02429.x
3. Hsu H-W, Lin T-Y, Liu Y-C, Yeh J-L, Hsu J-H. Mecanismos moleculares subyacentes a la remodelación del conducto arterioso: mirando más allá de la vía de la prostaglandina. Int J Mol Sci. (2021) 22:3238. doi: 10.3390/ijms22063238
Resumen de PubMed | Texto completo de CrossRef | Google Scholar
4. Oliveira P, Domenech O, Silva J, Vannini S, Bussadori R, Bussadori C. Revisión retrospectiva de la cardiopatía congénita en 976 perros. J Vet Intern Med. (2011) 25:477f congénito 1111/j.1939-1676.2011.0711.x
5. Hamabe L, Kim S, Yoshiyuki R, Fukayama T, Nakata TM, Fukushima R, et al. Evaluación ecocardiográfica de los cambios miocárdicos observados después del cierre del conducto arterioso patente en perros. J Vet Intern Med. (2015) 29:126tern Medluati1111/jvim.12517
6. Saunders AB, Gordon SG, Boggess MM, Miller MW. Resultado a largo plazo en perros con conducto arterioso patente: 520 casos (1994-2009). J Vet Intern Med. (2014) 28:401f10. doi: 10.1111/jvim.12267
Resumen de PubMed | Texto completo de CrossRef | Google Scholar
7. Nagueh SF. Insuficiencia cardíaca con fracción de eyección conservada: información sobre el diagnóstico y la fisiopatología. Cardiaca Res. (2021) 117:999c1014. doi: 10.1093/cvr/cvaa228
Resumen de PubMed | Texto completo de CrossRef | Google Scholar
8. Thomas JD, Choong CY, Flachskampf FA, Weyman AE. Análisis de la curva de velocidad Doppler transmitral temprana: efecto de los cambios fisiológicos primarios y ajuste compensatorio de la precarga. J Am Coll Cardiol. (1990) 16:644l Cardiolt. ,1016/0735-1097(90)90356-T
9. Nagueh SF. Función diastólica del ventrículo izquierdo. Imagen cardiovascular de JACC. (2020) 13:228-44. doi: 10.1016/j.jcmg.2018.10.038
Resumen de PubMed | Texto completo de CrossRef | Google Scholar
10. Flachskampf FA, Biering-Sctionmpf FA, Weyman AE. Análisis de la primera transth OA. Imágenes cardíacas para evaluar la función diastólica del ventrículo izquierdo. JACC Cardiovasc Imag. (2015) 8:1071–07115asco ev1016/j.jcmg.2015.07.004
11. Matsuura K, Shiraishi K, Sato K, Shimada K, Goya S, Uemura A, et al. Vérbellino ventricular izquierdo y diferencia de presión intraventricular en perros en diversas condiciones de carga. Am J Physiol Heart Circul Physiol. (2019) 316:H88238. doi: 10.1152/ajpheart.00686.2018
Resumen de PubMed | Texto completo de CrossRef | Google Scholar
12. Sasaki K, Ma D, Mandour AS, Ozai Y, Yoshida T, Matsuura K, et al. Evaluación de los cambios en la función cardíaca antes y después de la reparación de la válvula mitral de borde a borde del transcatéter en perros sanos: ecocardiografía convencional y nueva. Anim Open Acc J MDPI. (2021) 12:56. doi: 10.3390/ani12010056
Resumen de PubMed | Texto completo de CrossRef | Google Scholar
13. Ma D, Mandour AS, Hendawy H, Yoshida T, El-Husseiny HM, Ozai Y, et al. Cambios cardíacos inducidos por la hipertensión renal en un modelo de ratas: viabilidad de la ecocardiografía convencional y reciente. J Hipertens. (2021) 39:e40339:1rtens. e1097/01.hjh.0000749268.15046.a5
14. Ma D, Mandour AS, Yoshida T, Matsuura K, Shimada K, Kitpipatkun P, et al. Los gradientes de presión intraventricular cambian durante el desarrollo de la hipertrofia ventricular izquierda: efecto del ácido salvianólico B y el betabloqueante. Ultrasonido. (2021) 29:229-40. doi: 10.1177/1742271X20987584
Resumen de PubMed | Texto completo de CrossRef | Google Scholar
15. Matsuura K, Sato K, Shimada K, Goya S, Uemura A, Iso T, et al. Cambios en el flujo sanguíneo del ventrículo izquierdo durante la diástole debido a diferencias en el tamaño de la cámara en perros sanos. Representante de ciencia ficción (2020) 10:1106. doi: 10.1038/s41598-019-57180-6
Resumen de PubMed | Texto completo de CrossRef | Google Scholar
16. Matsuura K, Shiraishi K, Mandour AS, Sato K, Shimada K, Goya S, et al. La utilidad del gradiente de presión intraventricular para la detección temprana de la disfunción cardíaca subclínica inducida por la quimioterapia en perros. Anim Open Access J MDPI. (2021) 11:122. doi: 10.3390/ani11041122
Resumen de PubMed | Texto completo de CrossRef | Google Scholar
17. Yairo A, Mandour AS, Matsuura K, Yoshida T, Ma D, Kitpipatkun P, et al. Efecto de los cambios de carga en la presión intraventricular medida por la ecocardiografía de color en modo M en ratas. Diagnósticos. (2021) 11:403. doi: 10.3390/diagnostics11081403
Resumen de PubMed | Texto completo de CrossRef | Google Scholar
18. Ma D, Mandour AS, Elfadadny A, Hendawy H, Yoshida T, El-Husseiny HM, et al. Cambios en la función cardíaca durante el desarrollo de la miocardiopatía urémica y el efecto de la administración de ácido salvianólico b en un modelo de rata. Front Vet Sci Vet Imag. (2022) 9:905759. doi: 10.3389/fvets.2022.905759
Resumen de PubMed | Texto completo de CrossRef | Google Scholar
19. Kobayashi M, Takahashi K, Yamada M, Yazaki K, Matsui K, Tanaka N, et al. Evaluación del gradiente de presión intraventricular diastólica temprana en el ventrículo izquierdo entre pacientes con tetralogía reparada de Fallot.Vasos cardíacos. (2017) 32:1364–74. doi: 10.1007/s00380-017-1011-6
Resumen de PubMed | Texto completo de CrossRef | Google Scholar
20. Shigemitsu S, Takahashi K, Yazaki K, Kobayashi M, Yamada M, Akimoto K, et al. Nueva visión del gradiente de presión intraventricular como indicador sensible de disfunción cardíaca diastólica en pacientes con cáncer infantil después de la terapia con antraciclina. Vasos cardíacos. (2019) 34:992s1001. doi: 10.1007/s00380-018-01332-7
Resumen de PubMed | Texto completo de CrossRef | Google Scholar
21. Takahashi K, Nii M, Takigiku K, Toyono M, Iwashima S, Inoue N, et al. Desarrollo de la fuerza de succión durante la diastole temprana desde la aurícula izquierda hasta el ventrículo izquierdo en bebés, niños y adolescentes. Vasos cardíacos. (2019) 34:296–306. doi: 10.1007/s00380-018-1239-9
Resumen de PubMed | Texto completo de CrossRef | Google Scholar
23. Takeuchi A, Uemura A, Goya S, Shimada K, Yoshida T, Hara S, et al. La utilidad del cierre del conducto arterioso patentado con clip hemostático en perros. Pol J Vet Sci. (2020) 23:255t Sc doi: 10.24425/pjvs.2020.133640
Resumen de PubMed | Texto completo de CrossRef | Google Scholar
24. Ozai Y, Uemura A, Tanaka R, Takeuchi A, Hamabe L, Shimada K, et al. Ligadura de clip para el tratamiento de la oclusión del conducto arterioso patente en tres gatos. J Vet Sci. (2022) 23. (inpress). doi: 10.4142/jvs.21314
Resumen de PubMed | Texto completo de CrossRef | Google Scholar
25. Tanaka R, Soda A, Saida Y, Sugihara K, Takashima K, Shibazaki A, et al. Evaluación de la eficacia y seguridad de la oclusión en espiral para el conducto arterioso patente en perros. J Vet Med Sci. (2007) 69:857fion del 1292/jvms.69.857
26. De Madron E, Chetboul V, Bussadori C. Ecocardiografía clínica del perro y el gato. Países Bajos: Elsevier Health Sciences (2015).
27. Popovi6514ealth Sciencesnd Cat-E-Book y de oclusión de bobina para paté. El escalado de los gradientes de presión intraventricular diastólica está relacionado con la duración del tiempo de llenado. Am J Physiol Heart Circul Physiol. (2006) 291:H762291: de d1152/ajpheart.00081.2006
28. Yotti R, Bermejo J, Antoranz JC, Desco MM, Cortina C, Rojo-Alvarez JL, et al. Un método no invasivo para evaluar la disorción diastólica alterada en pacientes con miocardiopatía dilatada. Circulación. (2005) 112:2921–9212:ationt1161/CIRCULATIONAHA.105.561340
29. Greenberg NL, Vandervoort PM, Firstenberg MS, Garcia MJ, Thomas JD. Estimación de los gradientes de presión intraventricular diastólica mediante ecocardiografía en modo Doppler M. Am J Physiol Heart Circul Physiol.(2001) 280:H250780: ofhy. Va1152/ajpheart.2001.280.6. H2507
30. Faul F, Erdfelder E, Buchner A, Lang AG. Análisis de potencia estadística utilizando G*Power 31: pruebas para análisis de correlación y regresión. Behav Res Methods. (2009) 41:1149–149:9tical p3758/BRM.41.4.1149
31. Cohen J. Análisis estadístico del poder para las ciencias del comportamiento. 2a ed. Erlbaum (1988).
32. Fritz CO, Morris PE, Richler JJ. Estimaciones del tamaño del efecto: uso actual, cálculos e interpretación. J Exp Psychol Gen. (2012) 141:2al Morris PE,1037/a0024338
33. Ja, J-W, Oh, JK. Estrategias terapéuticas para la disfunción diastólica: una perspectiva clínica. J Ultrasonido Cardiovascular. (2009) 17:86–95. doi: 10.4250/jcu.2009.17.3.86
Resumen de PubMed | Texto completo de CrossRef | Google Scholar
34. Stauthammer CD Tobias AH Leeder DB Krsize estimaciones: cálculos e interpretación de uso actual. gradientes de presión cular bg oclusión del conducto arterioso patent intervencionista en perros: 24 casos (2000-2006). J Am Vet Med Assoc. (2013) 242:1722–7222:et Med2460/javma.242.12.1722
35. Hou M, Qian W, Wang B, Zhou W, Zhang J, Ding Y, et al. Predicción ecocardiográfica de la disfunción ventricular izquierda después del cierre del conducto arterioso del transcatéter en niños. Pediatr delantero. (2019) 7:409. doi: 10.3389/fped.2019.00409
Resumen de PubMed | Texto completo de CrossRef | Google Scholar
36. Firstenberg MS, Greenberg NL, Main ML, Drinko JK, Odabashian JA, Thomas JD, et al. Determinantes de las velocidades Doppler del tejido miocárdico diastólica: influencias de la relajación y la precarga. J Appl Physiol. (2001) 90:299hysiol de dias1152/jappl.2001.90.1.299
37. Matsuura K, Bach MBT, Takahashi K, Willesen JL, Koch J, Tanaka R. Evaluación no invasiva de la propiedad de relajación del ventrículo izquierdo utilizando gradientes de presión intraventricular derivados del modo M de color en gatos. J Vet Cardiol. (2022) 41:236-48. doi: 10.1016/j.jvc.2022.03.006
Resumen de PubMed | Texto completo de CrossRef | Google Scholar
38. Galal MO, Amin M, Hussein A, Kouatli A, Al-Ata J, Jamjoom A. Disfunción ventricular izquierda después del cierre del conducto arterioso de gran patente. Ana torácica cardiovasculares asiática (2005) 13:24c Andoi: 10.1177/021849230501300106
Resumen de PubMed | Texto completo de CrossRef | Google Scholar
39. Abdel-Bary M, Abdel-Baseer KA, Abdel-Latif AF, Abdel-Naser MA, Nafie M, Eisa KM. Disfunción ventricular izquierda, ligadura del conducto arterioso preoperatorio postquirúrgica en niños: análisis de factores predictores. J Cardiothorac Surg. (2019) 14:168. doi: 10.1186/s13019-019-0990-z
Resumen de PubMed | Texto completo de CrossRef | Google Scholar
40. Gupta SK, Krishnamoorthy K, Tharakan JA, Sivasankaran S, Sanjay G, Bijulal S, et al. Cierre percutáneo del conducto arterioso persistente en niños: cambios inmediatos y a corto plazo en la función sistólica y diastólica del ventrículo izquierdo. Ann Pediatr Cardiol. (2011) 4:139lCarddoi: 10.4103/0974-2069.84652
Resumen de PubMed | Texto completo de CrossRef | Google Scholar
41. Abbott JA. Frecuencia cardíaca y variabilidad de los gatos sanos en entornos domésticos y hospitalarios. J Feline Med Surg. (2005) 7:195e Med doi: 10.1016/j.jfms.2004.12.003
Resumen de PubMed | Texto completo de CrossRef | Google Scholar
Palabras clave: perro, conducto arterioso, ecocardiografía Doppler, presión intraventricular, diástole, sobrecarga
Cita: Hirose M, Mandour AS, Goya S, Hamabe L, Matsuura K, Yoshida T, Watanabe M, Shimada K, Uemura A, Takahashi K y Tanaka R (2022) Ecocardiografía de color en modo M para la evaluación no invasiva de la presión intraventricular en perros antes y después de la oclusión arterial del conducto cerebrovascular Frente. Veterinario. Sci. 9:908829. doi: 10.3389/fvets.2022.908829
Editado por:
Haney Samir, Universidad de El Cairo, Egipto
Revisado por:
Carlos Fernando Agudelo, Universidad de Ciencias Veterinarias y Farmacéuticas Brno, Chequia
Samar Elsharkawy, Universidad de El Cairo, Egipto
Copyright © 2022 Hirose, Mandour, Goya, Hamabe, Matsuura, Yoshida, Watanabe, Shimada, Uemura, Takahashi y Tanaka. Este es un artículo de acceso abierto distribuido bajo los términos de la Licencia de Atribución de Creative Commons (CC BY).
*Correspondencia: Ahmed S. Mandour, dr_mandour@vet.suez.edu.eg; Ryou Tanaka, ryo@vet.ne.jp
†Estos autores han contribuido por igual a este trabajo
Descargo de responsabilidad: Todas las afirmaciones expresadas en este artículo son únicamente las de los autores y no representan necesariamente las de sus organizaciones afiliadas, o las del editor, los editores y los revisores. Cualquier producto que pueda ser evaluado en este artículo o reclamación que pueda ser fabricado por su fabricante no está garantizado ni respaldado por el editor.
Date de alta y recibe nuestro 👉🏼 Diario Digital AXÓN INFORMAVET ONE HEALTH
Date de alta y recibe nuestro 👉🏼 Boletín Digital de Foro Agro Ganadero
Noticias animales de compañía
Noticias animales de producción
Trabajos técnicos animales de producción
Trabajos técnicos animales de compañía