Efecto de miR-17 sobre el polisacárido Polygonum Cillinerve contra el virus de la gastroenteritis transmisible
Efecto de miR-17 sobre el polisacárido Polygonum Cillinerve contra el virus de la gastroenteritis transmisible
 Xueqin Duan1†
Xueqin Duan1†  Mengxin Xu2†
Mengxin Xu2†  Yunying Wang1
Yunying Wang1  Nishang Liu1
Nishang Liu1  Xingchen Wang1
Xingchen Wang1  Yingqiu Liu1
Yingqiu Liu1  Weimin Zhang1
Weimin Zhang1  Wuren Ma1
Wuren Ma1  Lin Ma1*
Lin Ma1*  Ventilador de Yunpeng1*
Ventilador de Yunpeng1*- 1Facultad de Medicina Veterinaria, Universidad Northwest A&F, Yangling, China
- 2Facultad de Medicina Integrativa, Universidad de Medicina Tradicional China de Tianjin, Tianjin, China
El virus de la gastroenteritis transmisible (TGEV) podría causar diarrea, vómitos, deshidratación e incluso la muerte en lechones, el miRNA jugó un papel importante en la interacción entre el virus y la célula. El estudio tuvo como objetivo investigar el impacto de miR-17 en el polisacárido de Polygonum Cillinerve (PCP) en la lucha contra el TGEV. Se realizó el cribado de miR-17 y la validación de la transfección se realizó mediante PCR en tiempo real. La función de miR-17 en células PK15 infectadas con TGEV y tratadas con PCP se investigó mediante sonda de carga DCFH-DA, tinción JC-1 y tinción de fluorescencia de Hoechst. Además, se midió el efecto de miR-17 sobre la PCP inhibiendo la replicación de TGEV y las vías de señalización de apoptosis durante la PCP contra la infección por TGEV a través de PCR en tiempo real y Western blot. Los resultados mostraron que el imitador y el inhibidor de miR-17 podían transferirse a las células PK15 y la expresión de miR-17 aumentó y disminuyó significativamente respectivamente en comparación con el imitador y el inhibidor de miR-17 (P < 0,05). Un total de 250 μg/mL de PCP podría inhibir la apoptosis celular después de la transfección con miR-17. La PCP (250 μg/mL y 125 μg/mL) inhibió significativamente la disminución del potencial de membrana mitocondrial inducida por TGEV después de la transfección con miR-17 (P < 0,05). Después de la transfección de miR-17 mimic, la PCP a concentraciones de 250 μg/mL y 125 μg/mL promovió significativamente la expresión de ARNm de P53, cyt C y caspasa 9 (P < 0,05). En comparación con el grupo control, la replicación del ARNg TGEV y el gen N fue inhibida significativamente por la PCP a concentraciones de 250 μg/mL y 125 μg/mL después de la transfección tanto del imitador como del inhibidor de miR-17 (P < 0,05). La PCP a 62,5 μg/mL inhibió significativamente la replicación del gen S después de la transfección con el inhibidor de miR-17 (P < 0,05). Estos resultados sugirieron que la PCP podría inhibir la replicación de TGEV y la apoptosis inducida por TGEV mediante la regulación de miR-17.
1 Introducción
El microARN (miARN) es la molécula de ARN corta con un tamaño de 19-25 nucleótidos, que tiene la capacidad de regular la expresión génica a nivel postranscripcional mediante la inhibición de la traducción del ARN mensajero (ARNm) o la promoción de la degradación del ARNm (1). Mientras tanto, los miARN, como una clase importante de ARN no codificantes (2), juegan un papel importante en las interacciones de las células virales (3). La infección por virus podría provocar una serie de cambios en las células. Por ejemplo, el virus de la peste del pato podría inducir la detención del ciclo celular en la fase S, lo que conduce a la apoptosis a través de la activación de caspasas y el aumento del nivel de ROS intracelular (4); Sin embargo, los medicamentos podrían mejorar estos cambios. Por ejemplo, los polisacáridos derivados de las algas verdes antárticas en Duvelia podrían reducir la apoptosis celular, inhibir significativamente la producción de citoquinas proinflamatorias y lograr la capacidad de inhibir la infección por H1N1 (5); La cefalosporina y la curcumina podrían aliviar la apoptosis mitocondrial inducida por el circovirus porcino tipo 2 al reducir los niveles de ROS y MMP en diversos grados (6).
La gastroenteritis transmisible (TGE) es una enfermedad infecciosa intestinal aguda y altamente contagiosa causada por el virus de la gastroenteritis transmisible porcina (TGEV). Los principales síntomas clínicos causados por el TGEV incluyen diarrea, vómitos, deshidratación y pérdida progresiva de peso, lo que resulta en graves pérdidas económicas para la industria porcina mundial (7, 8). En la actualidad, no existe ningún fármaco antiviral eficaz para tratar esta enfermedad. Por lo tanto, es imperativo fortalecer el desarrollo de fármacos para TGEV. Polygonum Cillinerve es una medicina china de uso común con funciones como la hipotermia y la desintoxicación, la promoción de la circulación sanguínea, la detención de hemorragias y diarreas, el alivio del reumatismo y el fortalecimiento de la cintura y las rodillas. En la práctica clínica, Polygonum Cillinerve se usa ampliamente para tratar el dolor de estómago agudo, gastroenteritis, disentería, amigdalitis, infecciones del tracto urinario y caídas, dolor de espalda reumático, etc. Liu et al. (9). También se ha demostrado que el extracto de Polygonum Cillinerve tiene una fuerte actividad antiviral, inactivación directa de la cepa PR8 del virus de la influenza, inhibición significativa de la proliferación del VEN en embriones de pollo e inhibición in vitro de la replicación de los virus HSV – I y VHS – II (10-13). Además, Polygonum Cillinerve también tiene los efectos del virus antiparainfluenza tipo I, adenovirus, virus de la estomatitis vesicular, virus de la hepatitis B, etc. Ma (14). El polisacárido Polygonum Cillinerve (PCP) es un componente activo importante de Polygonum Cillinerve. Los estudios farmacológicos modernos han demostrado que la PCP exhibe efectos significativos como antioxidante, antibacteriano, anticancerígeno y antiviral (15, 16). Investigaciones anteriores han revelado que la PCP estaba compuesta principalmente de glucosa, era α-d-glucano y la columna vertebral estaba formada por unidades repetidas de (1 → 4)-α-d-glucosa (17). Además, la investigación también ha demostrado que el polisacárido Polygonum Cillinerve podría disminuir significativamente la tasa de apoptosis celular y la expresión de ROS inducida por TGEV, reducir la replicación de TGEV, aumentar los niveles de expresión de Bcl-2 y Bax mRNA, aumentar la expresión de Bcl-2, reducir la proteína Cyt C e inhibir la degradación de la caspasa 3 (18).
En un estudio anterior, un gen diana relacionado con la vía de la apoptosis, miR-17, se cribó mediante la secuenciación de alto rendimiento de los cambios en el perfil de expresión de miRNA en células PK15 infectadas con TGEV. En este estudio, el objetivo fue investigar si el tratamiento de las células PK15 con PCP y TGEV después de la transfección con miR-17 imitador o inhibidor afectaría los cambios en la morfología celular, la apoptosis, la producción de ROS y el potencial de membrana mitocondrial. El propósito es explorar más a fondo el mecanismo de la PCP en la inhibición del TGEV y proporcionar la base teórica para el desarrollo de medicamentos antivirales.
2 Materiales y métodos
2.1 Fármacos, células y virus
Polygonum Cillinerve fue recolectado de la montaña Taibai y preservado en el Laboratorio Veterinario de la Universidad Northwest A&F. Fue identificado por el profesor Song Xiaoping de la Facultad de Medicina Veterinaria de la Universidad Northwest A&F como el tubérculo raíz de Polygonum Cillinerve (Nakai) Ohwl, una planta de la familia de las poligonáceas. El polisacárido Polygonum Cillinerve se preparó en el laboratorio y sus estructuras han sido identificadas en estudios previos (17), TGEV fue donado por el Dr. Wang Xuefei del Instituto de Economía Animal de Henan; Las células PK15 (número de colección: GDC0061) se compraron en el Centro de Recolección de Cultivos Típicos de China de la Universidad de Wuhan.
2.2 Reactivos principales
DMEM medio con alto contenido de azúcar y bromuro de 3- (4,5-dimetiltiazol-2)−2,5-difeniltetrazolio (MTT), Beijing Solaybao Technology Co., Ltd; El suero fetal bovino (FBS) se compró a Sigma Company; El miR-17 imitador, el inhibidor miR-17, el control negativo mímico (mímico NC), el inhibidor negativo (inhibidor NC) fueron sintetizados por Guangzhou Ruibo Biotechnology Co., Ltd; Reactivo de transfección Lipofectamine 2000 (Número de catálogo: 11668019), producido por Thermo Fisher Scientific; TRIzol, kit RT MasterMix integrado de 5 ×, kit de cuantificación de fluorescencia de mezcla maestra de qPCR rápida (verde) de 2 ×, kit de extracción de ARN, kit de transcripción inversa, productos de Beijing Dining Biotechnology Co., Ltd; Los cebadores para el ARNg de TGEV, el gen TGEV N, miR-17 y U6 (referencia interna) fueron diseñados y sintetizados por Bioengineering (Shanghai) Co., Ltd; Kit de detección de potencial de membrana mitocondrial (JC-1), kit de detección de especies reactivas de oxígeno y solución de tinción Hoechst 33258, producidos por Beijing Solaybao Technology Co., Ltd; P53, cyt C, caspasa 9, cebador de β-actina (referencia interna), sintetizado por Shenggong Biotechnology (Shanghai) Co., Ltd; El primer anticuerpo P53, el primer anticuerpo cyt C, el primer anticuerpo de caspasa 9, el primer anticuerpo de β-actina, la IgG anti conejo de oveja y la IgG anti ratón de oveja son productos de CST Company en los Estados Unidos.
2.3 Métodos experimentales
2.3.1 Reanimación y cultivo de células PK15
Las células PK15 se retiraron del tanque de nitrógeno líquido y se fundieron en el baño de agua del termostato a 37 °C. Después de la fusión completa, las células se agregaron con 3 mL de medio de cultivo completo que contenía 10% de suero fetal bovino y se mezclaron completamente. A continuación, las células se centrifugaron a 1000 r/min durante 5 min, se desechó el medio de cultivo, se añadió con el medio de cultivo completo, se resuspendieron y mezclaron por completo. Estas células se transfirieron a la placa de cultivo celular y se cultivaron a 37 °C y 5% de CO2 (MCO-18AC, Puwa Corporation, Japón).
2.3.2 Validación del miR-17 diferencial mediante RT-qPCR
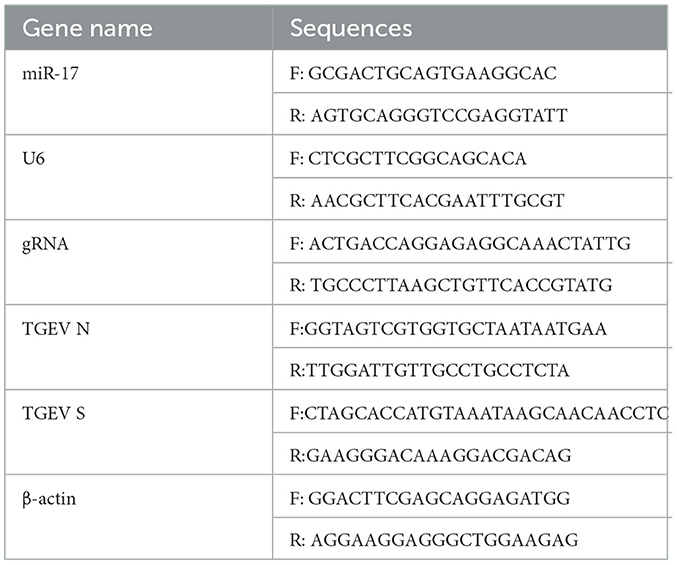
Las células PK15 ajustaron la concentración a 1,6 × 105 células/mL, inoculadas en la placa celular, luego cultivadas a 37 °C y 5% de CO2 hasta que la abundancia de células fue de alrededor del 80%, y luego se agregaron TGEV y PCP en la placa, las células se incubaron a 37 ° C durante 1.5 h, luego las células se lavaron 3 veces con PBS y se reemplazaron con medio de mantenimiento fresco. Mientras tanto, se estableció el grupo de control del virus. Las células se recolectaron para extraer el ARN de acuerdo con las instrucciones del kit de extracción TRIzol después de un cultivo adicional durante 48 h, y el ARN total extraído se sintetizó ADNc en el sistema de reacción y el procedimiento de reacción del kit de transcripción inversa de mezcla maestra RT integrado de 5 × y cebador de transcripción inversa miR-17 5 ‘- GTCGTTCACAGTG CAGGGTCGAGGTATCGACTACAA-3’ (instrumento de amplificación de PCR, tipo TC-XP, Hangzhou Bori Technology Co., Ltd., China); Se utilizó ADNc como plantilla, se siguió el sistema de reacción del kit de 2 × PCR en tiempo real rápido (verde) y el procedimiento se utilizó para la amplificación por PCR (instrumento de amplificación de genes cuantitativos de fluorescencia, CFX Connect, Bole Company, EE. UU.). Los cebadores se mostraron en la Tabla 1. Los resultados de la PCR en tiempo real fueron analizados por 2−ΔΔCt método.
2.3.3 La expresión de miR-17 después de la transfección con mímico o inhibidor por PCR en tiempo real
Las células PK15 se colocaron en las placas de 12 pocillos, cambiaron el medio básico y se dejaron morir de hambre durante 30 minutos cuando las células crecieron al 30%-40%. Siguiendo los pasos del manual del producto de miRNA y del manual del reactivo de transfección Lipofectamine 2000, miR-17 mimic y su NC correspondiente se transfectaron por separado a una concentración de 50 nM; El inhibidor de miR-17 y su correspondiente NC se transfectaron por separado a una concentración de 100 nM. Después de 4 h de transfección, las células se cambiaron por el medio completo, continuaron cultivando durante 24 h, luego se lavaron con PBS 3 veces, se agregaron 0,5 mL de reactivo TRIpure para extraer el ARN. El ARN total extraído se sometió a transcripción inversa y amplificación por PCR según el método descrito en 2.3.2. Los resultados de la PCR en tiempo real se analizaron mediante el uso de 2−ΔΔCt método.
2.3.4 Transfección celular y tratamiento farmacológico
Las células PK15 se colocaron en buenas condiciones en placas celulares, cambiaron el medio de cultivo básico y se privaron de alimentos durante 30 minutos cuando las células crecieron al 30%-40%. Siguiendo los pasos del manual del producto miRNA y del manual del reactivo de transfección Lipofectamine 2000, miR-17 mimic y su NC correspondiente se transfectaron por separado a la concentración de 50 nM. El inhibidor de miR-17 y su correspondiente NC se transfectaron por separado a una concentración de 100 nM. Después de 4 h de transfección, las células cambiaron completamente el medio de cultivo y continuaron cultivando durante 24 h. A continuación, se añadieron TGEV y diferentes concentraciones de PCP (62,5 μg/mL, 125 μg/mL, 250 μg/mL) a las células transfectadas de miR-17 imitador o inhibidor, y las células de NC y mímico (o inhibidor) se transfectaron con el volumen correspondiente de TGEV, se cultivaron durante 1,5 h, se lavaron con PBS 3 veces, se sustituyó el medio de mantenimiento y se continuó cultivando durante 24 h antes de proceder a las operaciones posteriores.
2.3.5 Observación de la morfología celular al microscopio invertido
Las células PK15 se trataron de acuerdo con el método descrito en el punto 2.3.4. Después de cultivar las células PK15 durante 24 h, se observó la morfología celular mediante el uso de un microscopio (microscopio invertido CX23, OLYMPUS, Japón).
2.3.6 Observación por microscopía de fluorescencia de la producción de ROS en células
Las células PK15 se trataron de acuerdo con el método descrito en el punto 2.3.4. A continuación, las células PK15 se lavaron dos veces con DMEM sin suero, y luego se añadieron con sondas cargadas con DCFH-DA diluidas con medio de cultivo libre de suero 1:1000, y se incubaron a 37 °C durante 20 min. A continuación, las células PK15 se lavaron 3 veces con medio de cultivo celular libre de suero para eliminar completamente el DCFH-DA que no había entrado en las células. Finalmente, las células fueron tomadas aleatoriamente de diferentes campos de visión para tomar fotografías y registrar (Microscopio Invertido Fluorescente ICX41, Shunyu Optical Technology Co., Ltd., China).
2.3.7 Método de tinción de fluorescencia para observar el potencial de membrana mitocondrial
Las células PK15 se trataron siguiendo el procedimiento descrito en el punto 2.3.4. A continuación, se añadieron 1 ml de medio de cultivo completo y 1 ml de solución de trabajo de tinción JC-1 a las células después de succionar suavemente el medio de cultivo y lavarlo con PBS una vez por pocillo. Después de la incubación, se retiró el sobrenadante y las células se lavaron dos veces con tampón de tinción JC-1 en baño de hielo, adicionado con 2 mL de medio de cultivo completo. Finalmente, las células fueron observadas y fotografiadas por el microscopio de fluorescencia invertida, y luego se analizó la intensidad de fluorescencia.
2.3.8 Tinción de Hoechst 33258 para la detección de la apoptosis celular
Las células PK15 se trataron de acuerdo con el método descrito en el punto 2.3.4. A continuación, se succionó suavemente el medio de cultivo de cada pocillo y se lavaron cuidadosamente las células con PBS 3 veces, se añadieron 0,5 ml de fijador para fijar a temperatura ambiente durante 15 min. A continuación, se retiró el fijador y se lavaron las células con PBS tres veces. Después de succionar todo el líquido, se añadieron 0,5 ml de solución de tinción Hoechst 33258 a las celdas para equilibrarlas a temperatura ambiente durante 30 minutos y se incubaron durante 5 minutos antes de agitarlas. Después de la eliminación de la solución de tinción, las células se limpiaron dos veces con PBS durante 3 minutos cada vez y se succionó todo el líquido. Finalmente, se añadió una gota de la solución de sellado de extinción antifluorescencia por pocillo, y las células se observaron y fotografiaron bajo el microscopio de fluorescencia invertida (UV).
2.3.9 Detección por PCR en tiempo real de los niveles de expresión de P53, cyt C y caspasa 9 a nivel de ARNm
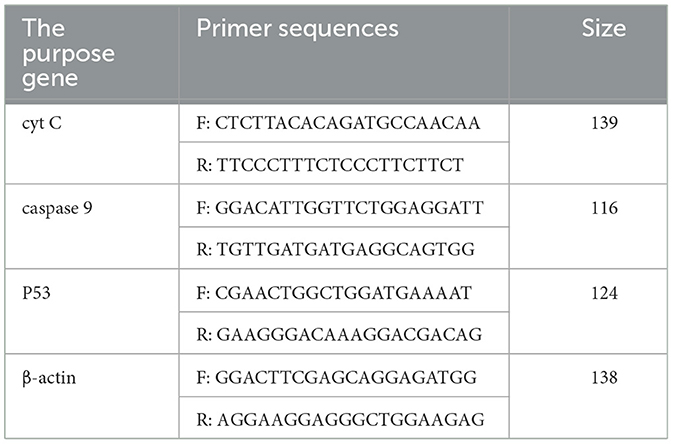
De acuerdo con los métodos de 2.3.2, el ARN se extrajo mediante el kit de extracción TRIzol, y el ARN total extraído se sintetizó ADNc en el sistema de reacción y el procedimiento del kit de transcripción inversa RT Master Mix integrado de 5 ×. La amplificación por PCR se realizó de acuerdo con el sistema de reacción y el procedimiento del kit de mezcla maestra de PCR rápida en tiempo real de 2 × (verde) utilizando ADNc como plantillas. Los cebadores se mostraron en la Tabla 2. Los resultados de la PCR en tiempo real se analizaron mediante el uso de 2−ΔΔCt método.
2.3.10 Detección de la expresión de moléculas señal clave en la vía de la apoptosis mediante Western blot
Las células PK15 se trataron de acuerdo con el método descrito en el punto 2.3.4. Después de cultivarlas durante 24 h, las células se centrifugaron después de la digestión de la tripsina y se eliminó el sobrenadante. Y luego, las células se agregaron con 100 μL de solución de lisis, se dividieron en hielo durante 1 h, se centrifugaron a 12000 r/min durante 15 min, y luego se retiró el sobrenadante. La concentración de la proteína en el sobrenadante se midió mediante el método BCA y se ajustó. A continuación, se utilizó un manual de instrucciones de tampón de carga de proteínas de 5 × (incluida la DTT) para el tratamiento de inactivación de proteínas, y se almacenó a -20 °C después de la inactivación. La proteína desnaturalizada se agregó al dispositivo de electroforesis y el voltaje se ajustó a 80 V inicialmente, luego el voltaje se cambió a 120 V durante 80 minutos cuando la muestra corrió entre el gel concentrado y el gel de separación (aproximadamente 20 minutos). Después de la electroforesis, se retiró el gel y se transfirió la película. La pinza de transferencia de película instalada se colocó en el tanque de electroforesis. Se agregó una cantidad adecuada de fluido de transferencia de membrana preenfriado y la membrana se transfirió a una presión constante de 100 V durante 66 min. Una vez completada la transferencia de la membrana, se retiró la membrana de PVDF, se enjuagó con una solución de TBST y luego se selló en leche desnatada en polvo al 5% preparada con una solución de TBST. Se agitó y selló durante 1 h a 37°C. La membrana de PVDF se lavó 4 veces con solución de TBST durante 15 min cada vez, y luego se colocó en una solución de incubación de anticuerpos primarios diluida con TBST a la concentración adecuada y se incubó durante la noche a 4 °C. Después de lavar la membrana del primer anticuerpo durante 4 veces, cada vez durante 15 minutos, se colocó en la segunda solución de incubación de anticuerpos diluida con solución TBST, luego se incubó a temperatura ambiente durante 1 h. La membrana se incubó con el anticuerpo secundario específico durante 1 h después de lavarse 4 veces con TBST. Finalmente, la membrana se lavó 4 veces con TBST, la señal se observó con ECL (Chemiluminescence gel imager, JS-M6, Shanghai Peiqing Technology Co., Ltd., China) y la membrana se expuso en la película de rayos X.
2.3.11 Niveles de expresión del genoma y subgenoma de TGEV mediante PCR en tiempo real
Las células PK15 se trataron de acuerdo con el método descrito en el punto 2.3.4. El ARN se extrajo mediante el kit de extracción TRIzol, y el ARN total extraído se sometió a transcripción inversa y amplificación por PCR según el método de 2.3.2. Los cebadores se mostraron en la Tabla 1. Los resultados de la PCR en tiempo real se analizaron mediante el uso de 2−ΔΔCt método.
2.3.12 Análisis de datos
Los datos fueron analizados con el software estadístico IBM SPSS Statistics 21.0. Los datos se expresaron como media ± desviación estándar (media ± DE) y se utilizó el ANOVA de un factor para la comparación entre grupos. P < 0,05 fue estadísticamente significativo, P < 0,05, P < 0,01, P < 0,001 . Los datos y los resultados del análisis se trazaron como un gráfico de columnas utilizando GraphPad Prism 7.00.*******
3 Resultados
3.1 Los resultados de la validación del miR-17 expresado diferencialmente
En los resultados de la secuenciación, el miR-17 expresado diferencialmente fue significativamente menor en el grupo experimental que en el grupo control. Los resultados de la PCR en tiempo real se mostraron en la Figura 1, y la expresión relativa de miR-17 en el grupo experimental fue significativamente menor que en el grupo control TGEV (P < 0,05), lo que consiste en los resultados de secuenciación. Y los niveles de miR-17 en el grupo de control en blanco y en el grupo de PCP fueron significativamente más bajos que los del grupo TGEV (P < 0,01).
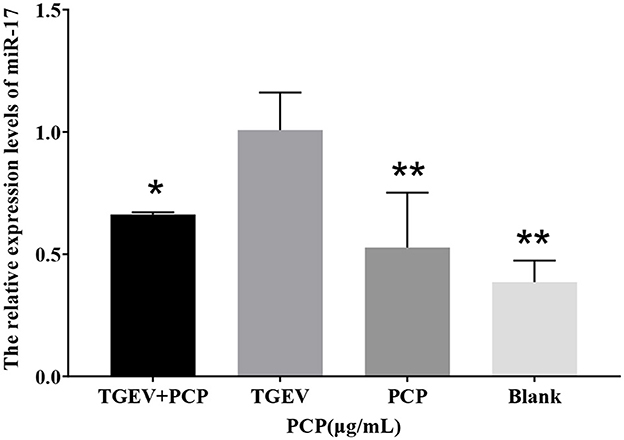 Figura 1. La expresión relativa de miR-17 diferencial. P < 0,05 fue estadísticamente significativo, P < 0,05, P < 0,01. ***
Figura 1. La expresión relativa de miR-17 diferencial. P < 0,05 fue estadísticamente significativo, P < 0,05, P < 0,01. ***
3.2 Expresión de miR-17 después de la transfección con mímico o inhibidor
Como se muestra en la Figura 2, la expresión de miR-17 aumentó significativamente después de la transfección del imitador de miR-17 en comparación con el grupo de imitación NC (P < 0,001) (Figura 2A). En comparación con el grupo inhibidor NC, la expresión de miR-17 se redujo significativamente después de la transfección con el inhibidor de miR-17 (P < 0,001) (Figura 2B). No todos los grupos fueron tratados con PCP y TGEV.
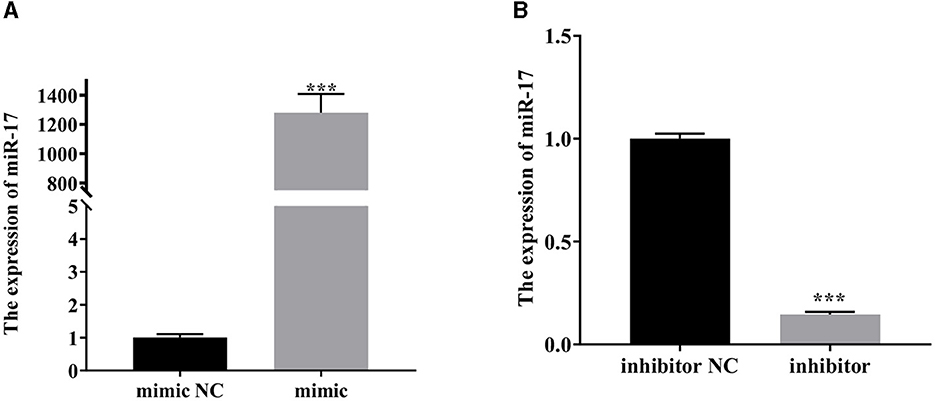 Figura 2. La expresión relativa de miR-17. Las células PK15 fueron tratadas con miR-17 mimic, mimic NC, inhibidor e inhibidor NC, respectivamente, y sin utilizar PCP y TGEV. (A) El nivel de expresión de miR-17 en células PK15 transfectadas con miR-17 imitado (n = 3); (B) El nivel de expresión de miR-17 en células PK15 transfectadas con inhibidor de miR-17 Las células PK15 fueron tratadas con miR-17 mimic, mimic NC, inhibidor e inhibidor NC, respectivamente, y sin usar PCP y TGEV (n = 3). P < 0,05 fue estadísticamente significativo, P < 0,001.***
Figura 2. La expresión relativa de miR-17. Las células PK15 fueron tratadas con miR-17 mimic, mimic NC, inhibidor e inhibidor NC, respectivamente, y sin utilizar PCP y TGEV. (A) El nivel de expresión de miR-17 en células PK15 transfectadas con miR-17 imitado (n = 3); (B) El nivel de expresión de miR-17 en células PK15 transfectadas con inhibidor de miR-17 Las células PK15 fueron tratadas con miR-17 mimic, mimic NC, inhibidor e inhibidor NC, respectivamente, y sin usar PCP y TGEV (n = 3). P < 0,05 fue estadísticamente significativo, P < 0,001.***
3.3 Cambios en la morfología celular después de la transfección con miR-17 o inhibidor de miR-17
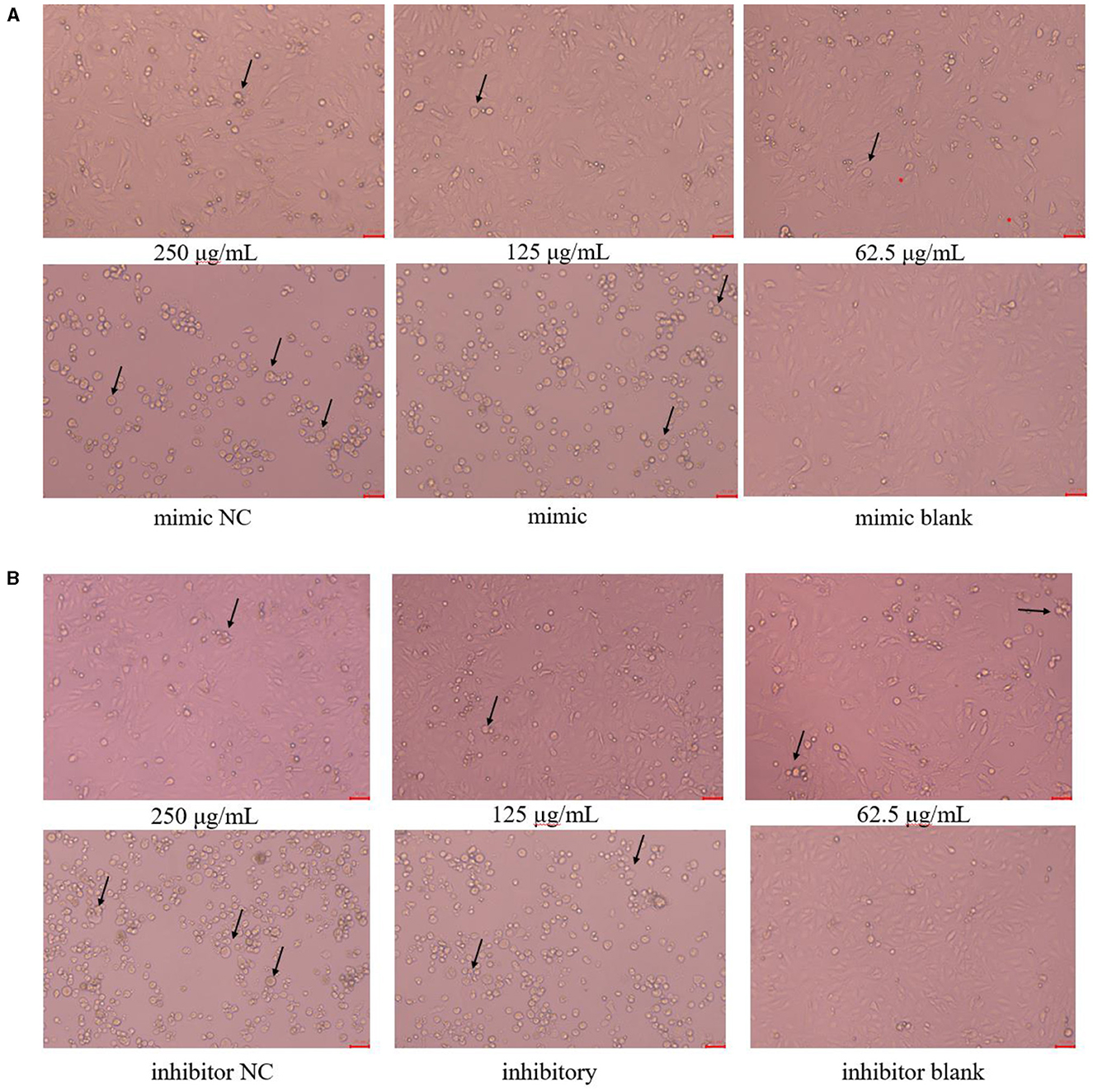
La morfología celular se muestra en la Figura 3. Las células PK15 del grupo en blanco tenían un tamaño uniforme, eran irregularmente poligonales y estaban estrechamente conectadas entre sí, lo que tenía muy pocas células flotantes; Las células PK15 en los grupos de PCP de 250 μg/mL y 125 μg/mL tenían la morfología celular homogénea y podían formar una monocapa de células con un pequeño número de células flotantes; Las células PK15 del grupo PCP (62,5 μg/mL) crecieron lentamente y no formaron una monocapa continua de células adherentes, pero hubo un pequeño número de grupos celulares; Las células PK15 en los grupos NC y control fueron circulares, fragmentadas y separadas, observándose un número muy pequeño de células adherentes. Sin embargo, las células flotantes en el grupo NC imitador fueron menos que las del grupo imitador (Figura 3A), por el contrario, las células flotantes en el grupo NC inhibidor fueron más que las del grupo inhibidor (Figura 3B). Por lo tanto, se pudo ver que miR-17 tuvo un impacto en la morfología celular después de la infección por TGEV; Al mismo tiempo, después de la transfección simultánea de miR-17, los grupos de fármacos tuvieron un buen efecto inhibidor sobre el TGEV.
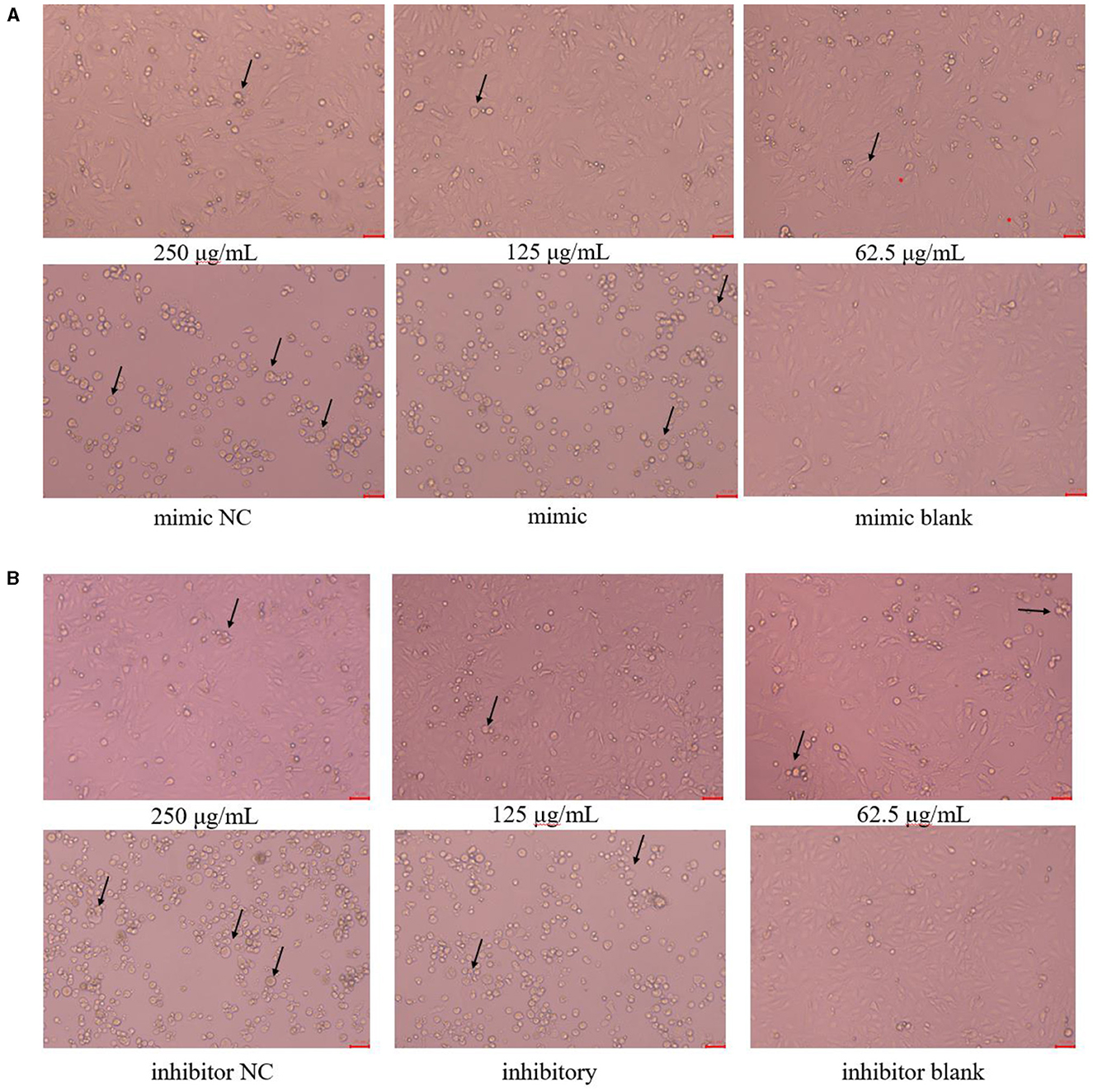 Figura 3. Morfología celular (× 200). La flecha se refería a las células PK15 que se han hinchado, roto y desprendido en grupos. (A) Morfología celular de grupos PCP (250, 125, 62,5 μg/mL) transfectados con miR-17 mimic, mimic group, mimic NC group y mimic blank group (× 200); (B) Morfología celular de grupos PCP (250, 125, 62,5 μg/mL) transfectados con inhibidor de miR-17, grupo inhibidor, grupo inhibidor NC e grupo inhibidor en blanco (× 200). La escala fue de 20 μm.
Figura 3. Morfología celular (× 200). La flecha se refería a las células PK15 que se han hinchado, roto y desprendido en grupos. (A) Morfología celular de grupos PCP (250, 125, 62,5 μg/mL) transfectados con miR-17 mimic, mimic group, mimic NC group y mimic blank group (× 200); (B) Morfología celular de grupos PCP (250, 125, 62,5 μg/mL) transfectados con inhibidor de miR-17, grupo inhibidor, grupo inhibidor NC e grupo inhibidor en blanco (× 200). La escala fue de 20 μm.
3.4 Efectos sobre las ROS después de la transfección con miR-17 imitador o inhibidor de miR-17
Como se muestra en la Figura 4, después de la transfección con miR-17 imitador e inhibidor, la fluorescencia verde del grupo NC fue mayor que la del grupo control, y la fluorescencia verde de los grupos PCP (250 μg/mL−62,5 μg/mL) fue menor que la del grupo control, y cuanto menor era la concentración del fármaco, mayor era la fluorescencia (Figuras 4A, B). Reveló que la transfección de miR-17 inhibió la producción de ROS causadas por TGEV; Mientras tanto, la PCP inhibió la producción de ROS inducida por TGEV después de la transfección de miR-17.
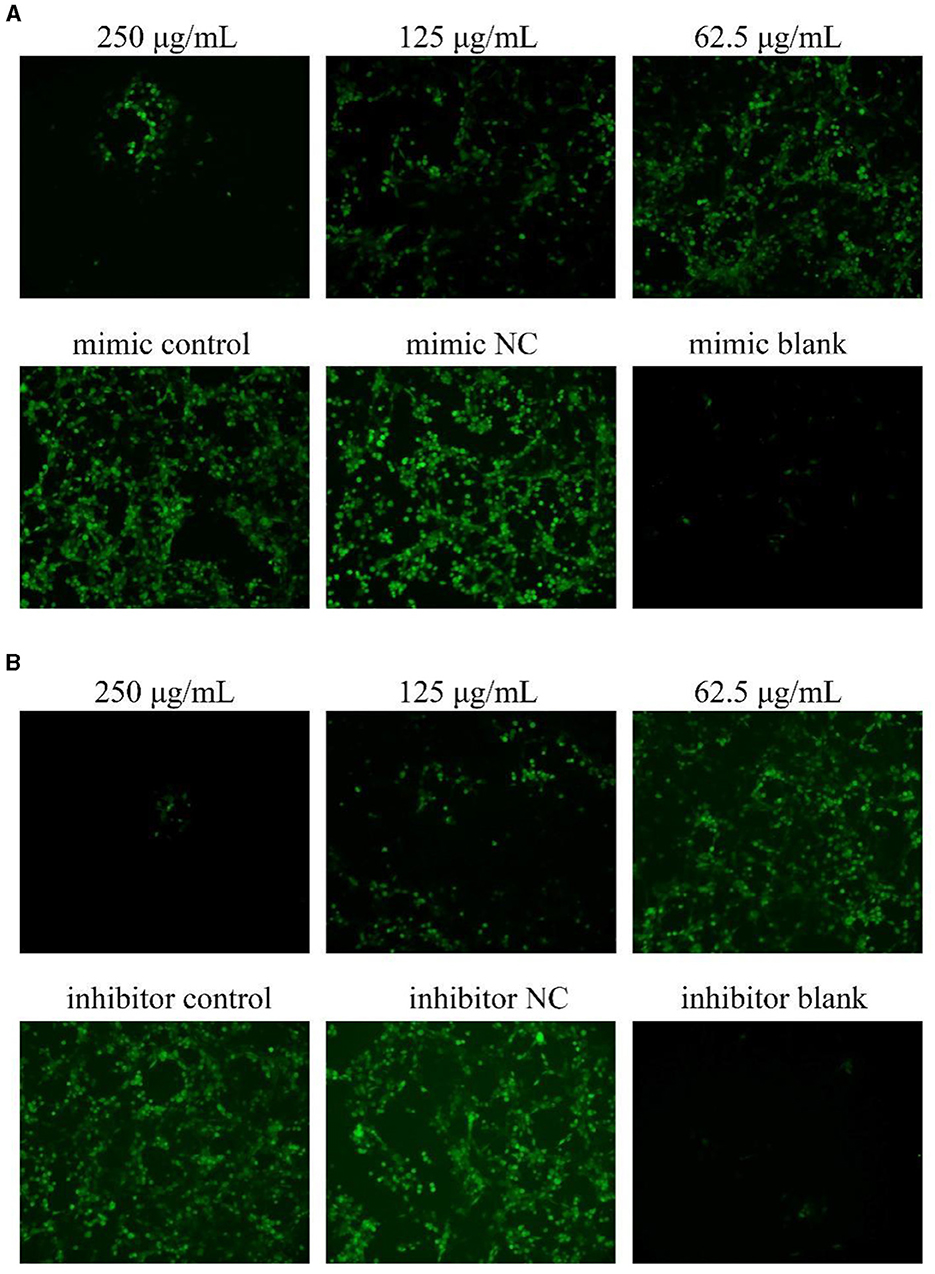 Figura 4. Producción de ROS en células PK15. El nivel de producción de ROS en las células PK15 fue detectado por DCFH-DA. La parte verde representaba los niveles de ROS. Los grupos PCP, imitador, imitador de NC, inhibidor e inhibidor NC fueron tratados con TGEV, mientras que el grupo en blanco no fue tratado. (A) Nivel de ROS de los grupos PCP (250, 125, 62,5 μg/mL) transfectados con miR-17 mimic, mimic group, mimic NC group y mimic blank group (× 200); (B) Nivel de ROS de los grupos PCP (250, 125, 62,5 μg/ml) transfectados con el inhibidor de miR-17, el grupo inhibidor, el grupo inhibidor NC y el grupo blanco inhibidor (× 200).
Figura 4. Producción de ROS en células PK15. El nivel de producción de ROS en las células PK15 fue detectado por DCFH-DA. La parte verde representaba los niveles de ROS. Los grupos PCP, imitador, imitador de NC, inhibidor e inhibidor NC fueron tratados con TGEV, mientras que el grupo en blanco no fue tratado. (A) Nivel de ROS de los grupos PCP (250, 125, 62,5 μg/mL) transfectados con miR-17 mimic, mimic group, mimic NC group y mimic blank group (× 200); (B) Nivel de ROS de los grupos PCP (250, 125, 62,5 μg/ml) transfectados con el inhibidor de miR-17, el grupo inhibidor, el grupo inhibidor NC y el grupo blanco inhibidor (× 200).
3.5 Efecto de la transfección de miR-17 imitador o inhibidor sobre los cambios potenciales de la membrana mitocondrial
Los resultados se mostraron en la Figura 5. En la Figura 5A, se puede ver que después de la transfección del mímico miR-17, la fluorescencia roja de los grupos de 250 μg/mL y los grupos en blanco fueron los más altos en comparación con los otros grupos, mientras que la fluorescencia verde de los grupos imitadores NC y mímicos también fue la más alta en comparación con los otros grupos. Después del análisis y cálculo de la relación de fluorescencia roja y verde de cada grupo en la Figura 5A, no hubo diferencia entre el grupo NC imitador y el grupo imitador. La relación de fluorescencia roja y verde del grupo blanco fue significativamente mayor que la del grupo mímico (P < 0,001) y, al mismo tiempo, la relación de fluorescencia roja y verde del grupo de 250 μg/mL y el grupo de 125 μg/mL fue significativamente mayor que la del grupo mímico (P < 0,05) (Figura 5C). Después de la transfección del inhibidor de miR-17, la fluorescencia roja del grupo de 250 μg/mL y del grupo de 125 μg/mL fue la más alta en comparación con los otros grupos, mientras que la fluorescencia verde del inhibidor NC y los grupos inhibidores también fue la más alta en comparación con los otros grupos. De acuerdo con el análisis y cálculo de la relación de fluorescencia roja y verde de cada grupo de células en la Figura 5B, no hubo diferencia entre el grupo inhibidor NC y el grupo inhibidor, la relación de fluorescencia roja y verde del grupo de 250 μg/mL, el grupo de 125 μg/mL y el grupo en blanco fue significativamente mayor que la del grupo inhibidor (P < 0,05) (Figura 5D). La transfección del imitador e inhibidor de miR-17 no afectó los cambios en el potencial de membrana mitocondrial causados por TGEV; Mientras tanto, la PCP inhibió el fenómeno de disminución del potencial de membrana mitocondrial en células PK15 infectadas con TGEV después de la transfección con miR-17 imitador o inhibidor.
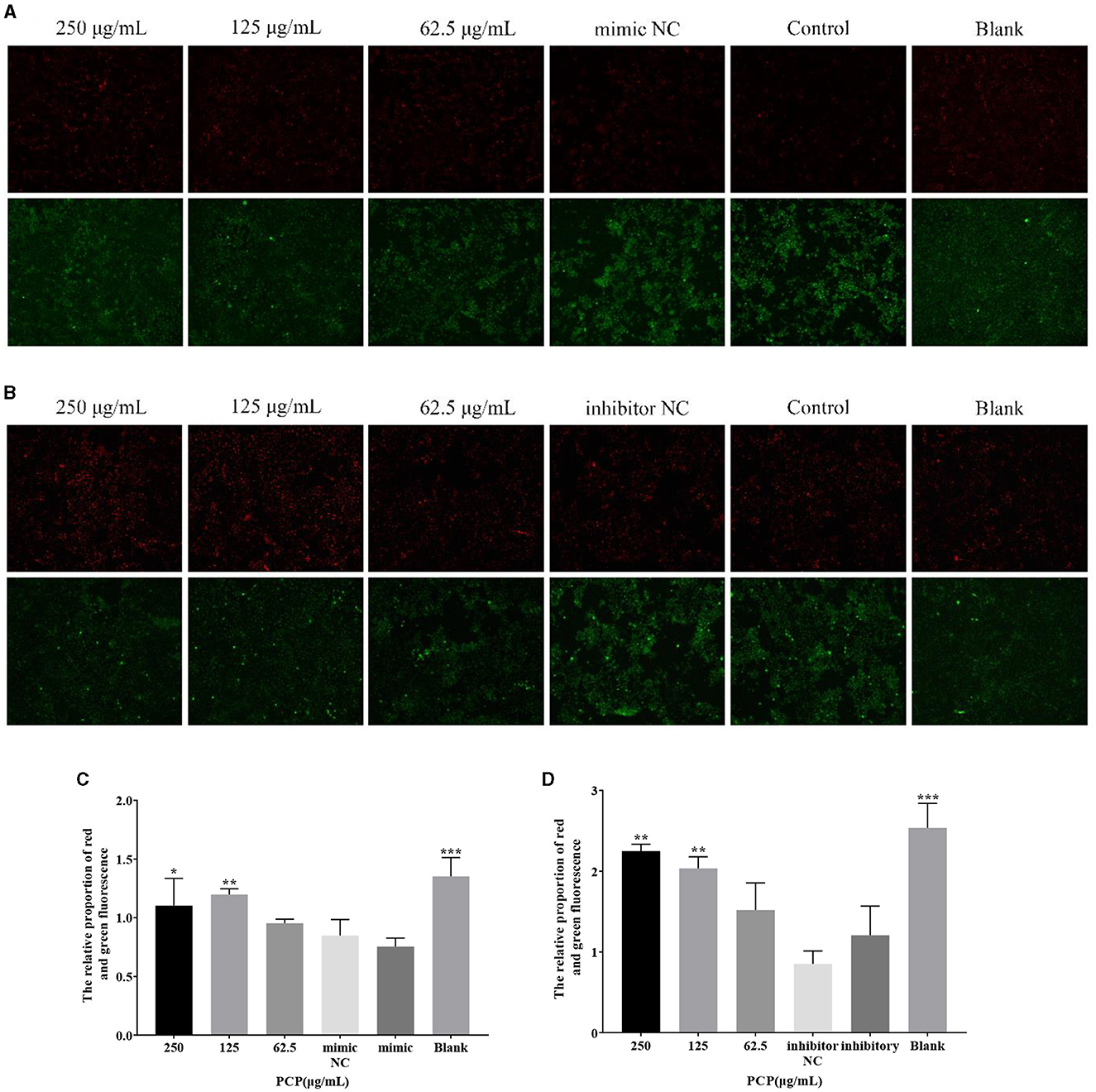 Figura 5. Potencial de membrana mitocondrial. El potencial de membrana mitocondrial de las células PK15 fue detectado por JC-1. La parte roja representaba las mitocondrias normales y la parte verde representaba las mitocondrias con potencial de membrana disminuido. Los grupos PCP, imitador, imitador de NC, inhibidor e inhibidor NC fueron tratados con TGEV, mientras que el grupo en blanco no fue tratado. (A) Potencial de membrana mitocondrial de los grupos PCP (250, 125, 62,5 μg/mL) transfectados con miR-17 mimic, mimic NC group, mimic group y blank group (× 200); (B) Potencial de membrana mitocondrial de los grupos PCP (250, 125, 62,5 μg/mL) transfectados con inhibidor de miR-17, grupo inhibidor, grupo inhibidor NC y grupo blanco inhibidor (× 200); (C) La relación relativa de fluorescencia roja y verde de los grupos PCP transfectados con mimímica de miR-17; (D) La relación relativa de fluorescencia roja y verde de los grupos de PCP transfectados con el inhibidor de miR-17. P < 0,05 fue estadísticamente significativo, *P < 0,05, **P < 0,01, ***P < 0,001.
Figura 5. Potencial de membrana mitocondrial. El potencial de membrana mitocondrial de las células PK15 fue detectado por JC-1. La parte roja representaba las mitocondrias normales y la parte verde representaba las mitocondrias con potencial de membrana disminuido. Los grupos PCP, imitador, imitador de NC, inhibidor e inhibidor NC fueron tratados con TGEV, mientras que el grupo en blanco no fue tratado. (A) Potencial de membrana mitocondrial de los grupos PCP (250, 125, 62,5 μg/mL) transfectados con miR-17 mimic, mimic NC group, mimic group y blank group (× 200); (B) Potencial de membrana mitocondrial de los grupos PCP (250, 125, 62,5 μg/mL) transfectados con inhibidor de miR-17, grupo inhibidor, grupo inhibidor NC y grupo blanco inhibidor (× 200); (C) La relación relativa de fluorescencia roja y verde de los grupos PCP transfectados con mimímica de miR-17; (D) La relación relativa de fluorescencia roja y verde de los grupos de PCP transfectados con el inhibidor de miR-17. P < 0,05 fue estadísticamente significativo, *P < 0,05, **P < 0,01, ***P < 0,001.
3.6 Efectos de la transfección mímica o inhibidora de miR-17 en la apoptosis celular
Los resultados se mostraron en la Figura 6. Después de la transfección del grupo imitador de miR-17, los núcleos del grupo NC imitador de miR-17 fueron más blancos que los del grupo imitador, y se observó que los estados celulares de los grupos de 250, 125 μg/ml y blanco eran óptimos sin blanqueamiento nuclear significativo, lo que indica una apoptosis celular mínima; El fenómeno de apoptosis celular fue significativo en el grupo de 62,5 μg/mL, y el fenómeno de blanqueamiento nuclear fue más débil que en el grupo mímico (Figura 6A). Después de la transfección del inhibidor de miR-17, el inhibidor NC tenía más núcleos blanquecinos que el grupo inhibidor. En comparación con el grupo inhibidor, los grupos de 250 μg/mL−62,5 μg/mL no mostraron un blanqueamiento nuclear significativo y menos células apoptóticas (Figura 6B).
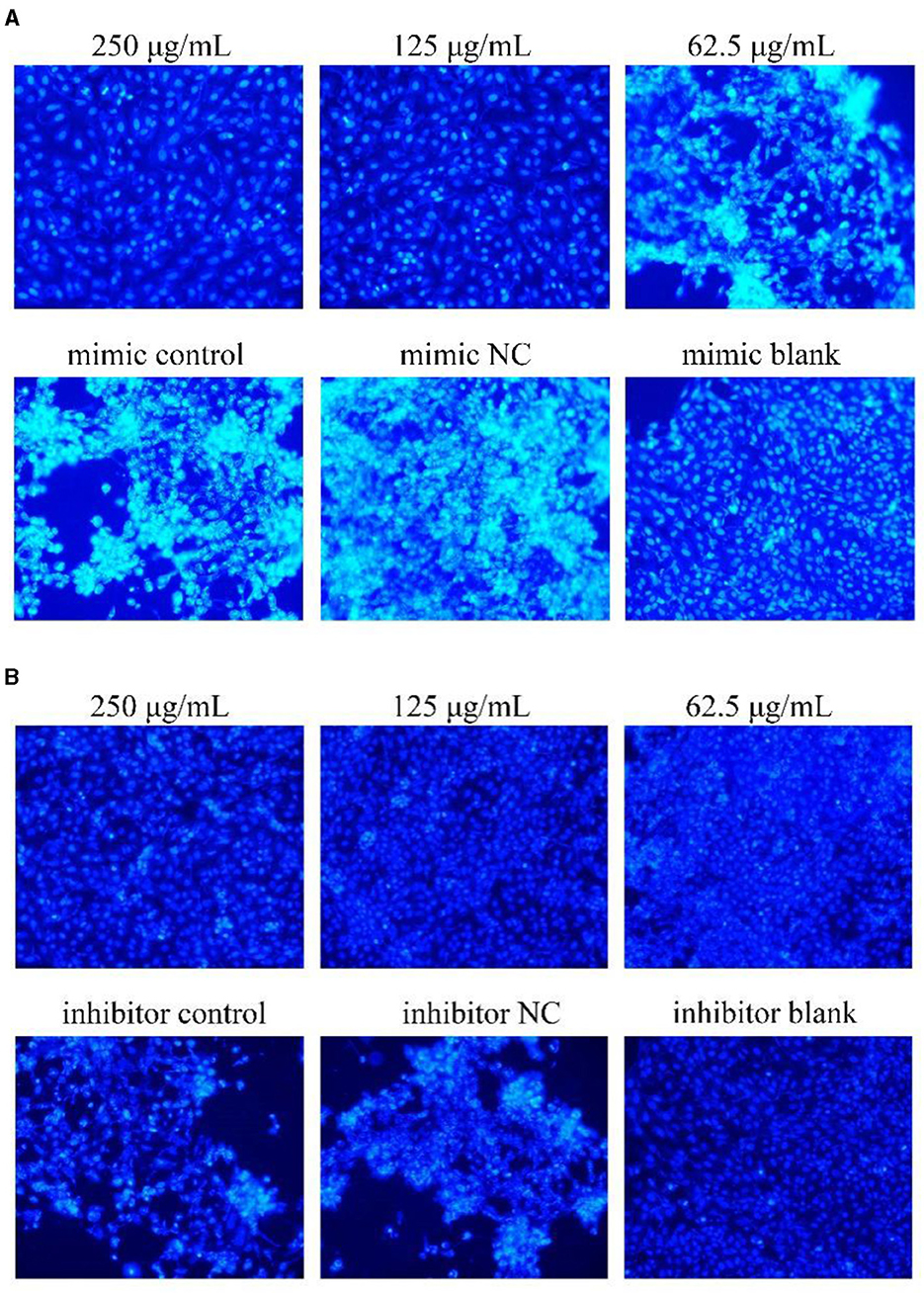 Figura 6. Hoechst 33258 detectó el efecto sobre la apoptosis celular (× 200). La parte blanca representaba las células apoptóticas. Los grupos PCP, imitador, imitador de NC, inhibidor e inhibidor NC fueron tratados con TGEV, mientras que el grupo en blanco no fue tratado. (A) Nivel de apoptosis de grupos PCP (250, 125, 62,5 μg/mL) transfectados con miR-17 imitador, grupo imitador, grupo mímico NC e imitador grupo blanco (× 200); (B) Nivel de apoptosis de los grupos PCP (250, 125, 62,5 μg/mL) transfectados con el inhibidor de miR-17, el grupo inhibidor, el grupo inhibidor NC y el grupo blanco inhibidor (× 200).
Figura 6. Hoechst 33258 detectó el efecto sobre la apoptosis celular (× 200). La parte blanca representaba las células apoptóticas. Los grupos PCP, imitador, imitador de NC, inhibidor e inhibidor NC fueron tratados con TGEV, mientras que el grupo en blanco no fue tratado. (A) Nivel de apoptosis de grupos PCP (250, 125, 62,5 μg/mL) transfectados con miR-17 imitador, grupo imitador, grupo mímico NC e imitador grupo blanco (× 200); (B) Nivel de apoptosis de los grupos PCP (250, 125, 62,5 μg/mL) transfectados con el inhibidor de miR-17, el grupo inhibidor, el grupo inhibidor NC y el grupo blanco inhibidor (× 200).
3.7 Efecto de la transfección con miR-17 imitador o inhibidor sobre la expresión de ARNm de moléculas de señalización clave
Los resultados se mostraron en la Figura 7. Después de la transfección del imitador de miR-17, no se observaron diferencias en la expresión de ARNm de P53, cyt C y caspasa 9 entre el grupo imitador y el grupo imitador NC; Los grupos PCP (250 y 62,5 μg/mL) promovieron significativamente la expresión de ARNm de P53 (P < 0,01); El grupo PCP de 125 μg/mL promovió significativamente la expresión de ARNm de P53 (P < 0,05) (Figura 7A); Los grupos de PCP de 250 y 125 μg/mL promovieron significativamente la expresión de ARNm del cyt C (P < 0,001) (Figura 7B); Los grupos PCP de 250 μg/mL−62,5 μg/mL promovieron significativamente la expresión de ARNm de caspasa 9 (P < 0,001) (Figura 7C). Después de la transfección del inhibidor de miR-17, la expresión de ARNm de la caspasa 9 en el grupo inhibidor NC fue significativamente menor que en el grupo inhibidor (P < 0,01) (Figura 8C); El grupo PCP de 250 μg/mL promovió significativamente la expresión del ARNm de P53 (P < 0,001) (Figura 8A); El grupo PCP de 125 μg/mL promovió significativamente la expresión de ARNm de P53 (P < 0,05) (Figura 8A); Los grupos PCP de 125 y 62,5 μg/mL promovieron significativamente la expresión de ARNm de cyt C (P < 0,001) (Figura 8B); Los grupos PCP de 250 y 125 μg/mL promovieron significativamente la expresión de ARNm de la caspasa 9 (P < 0,001) (Figura 8C).
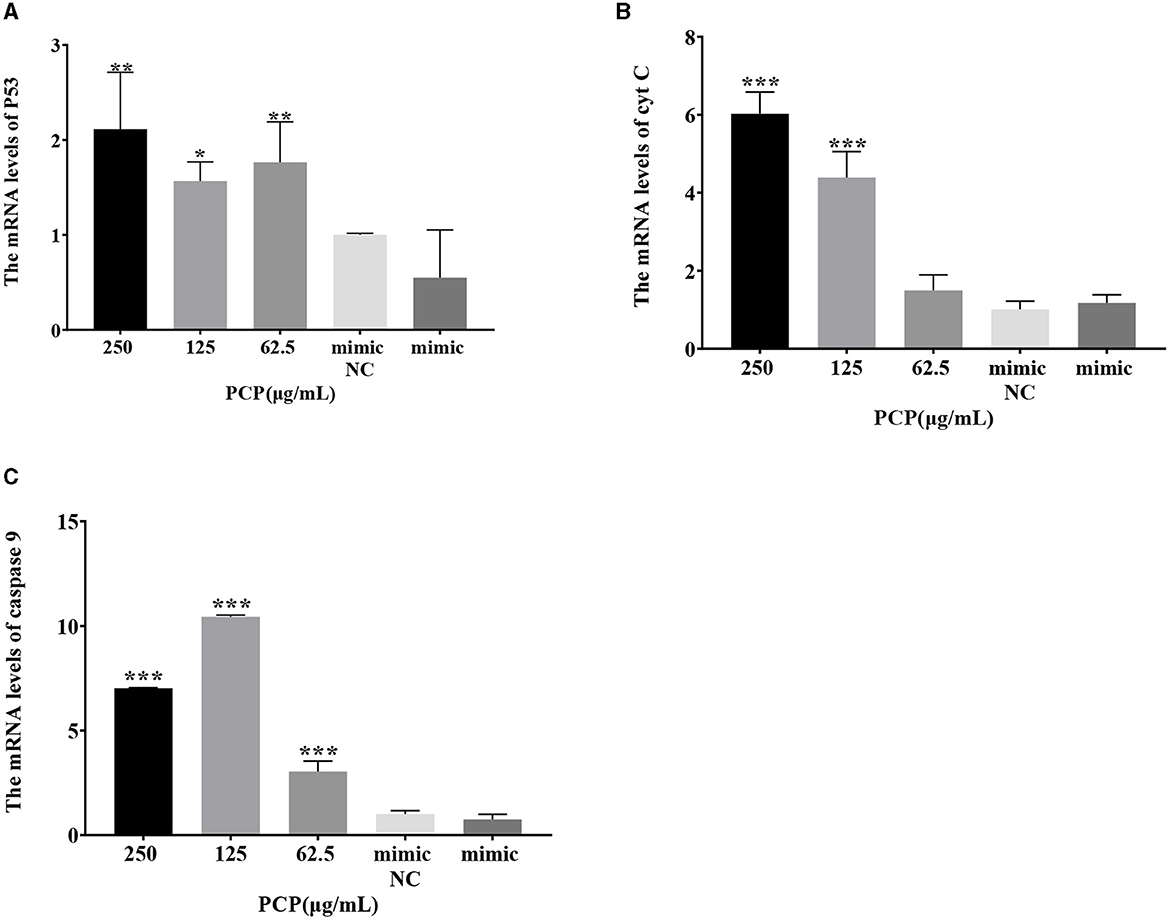 Figura 7. Efecto de la expresión de la molécula de señalización clave después de la transfección de miR-17 imit. Los niveles de expresión de ARNm de P53, cyt C y caspasa-9 se midieron mediante RT-qPCR. Los grupos PCP, imitador y NC imitador fueron tratados con TGEV. (A) El nivel de expresión de ARNm de P53 (n = 3); (B) El nivel de expresión de ARNm de cyt C (n = 3); (C) El nivel de expresión de ARNm de caspasa-9 (n = 3). P < 0,05 fue estadísticamente significativo para el grupo imitador, *P < 0,05, **P < 0,01, ***P < 0,001.
Figura 7. Efecto de la expresión de la molécula de señalización clave después de la transfección de miR-17 imit. Los niveles de expresión de ARNm de P53, cyt C y caspasa-9 se midieron mediante RT-qPCR. Los grupos PCP, imitador y NC imitador fueron tratados con TGEV. (A) El nivel de expresión de ARNm de P53 (n = 3); (B) El nivel de expresión de ARNm de cyt C (n = 3); (C) El nivel de expresión de ARNm de caspasa-9 (n = 3). P < 0,05 fue estadísticamente significativo para el grupo imitador, *P < 0,05, **P < 0,01, ***P < 0,001.
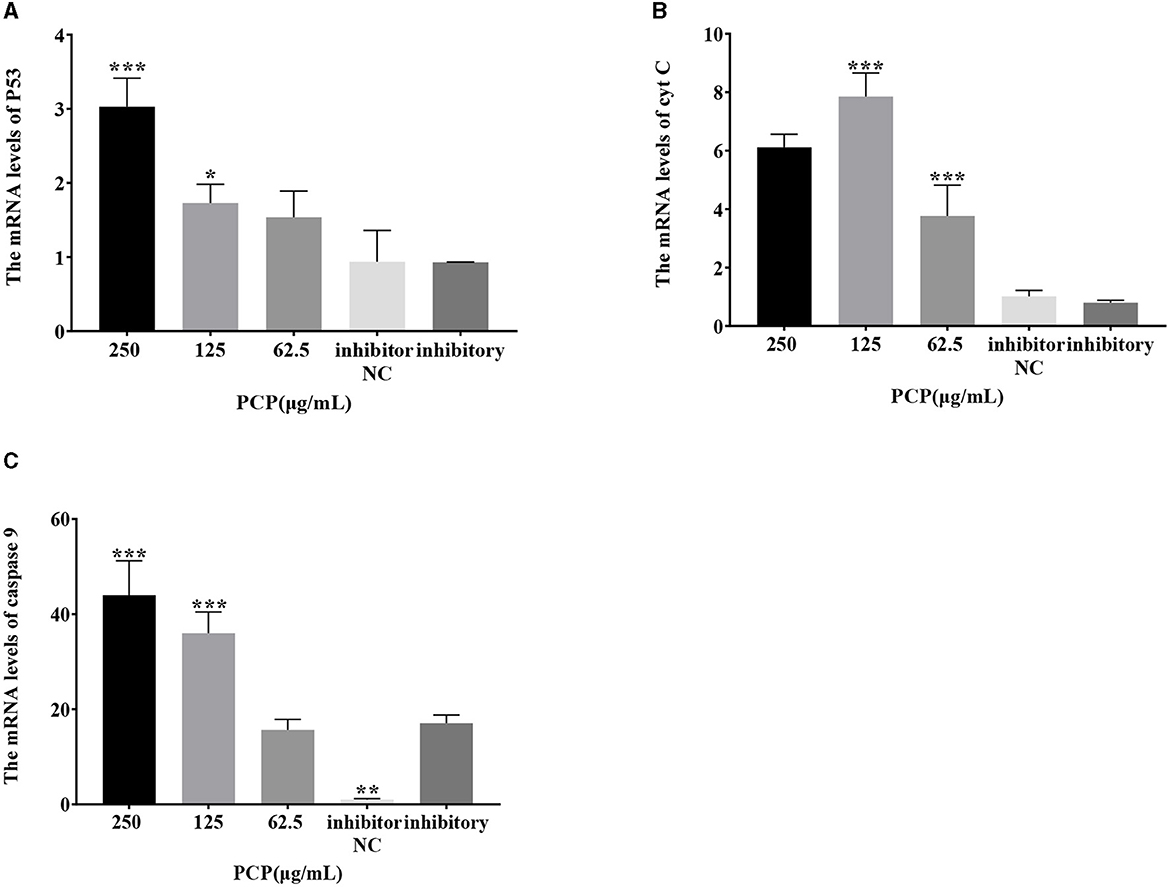 Figura 8. Efecto de la expresión de la molécula de señalización clave después de la transfección del inhibidor de miR-17. Los niveles de expresión de ARNm de P53, cyt C y caspasa-9 se midieron mediante RT-PCR. Los grupos PCP, inhibidor e inhibidor NC fueron tratados con TGEV. (A) El nivel de expresión de ARNm de P53 (n = 3); (B) El nivel de expresión de ARNm de cyt C (n = 3); (C) El nivel de expresión de ARNm de caspasa-9 (n = 3). P < 0,05 fue estadísticamente significativo para el grupo inhibitorio, *P < 0,05, **P < 0,01, ***P < 0,001.
Figura 8. Efecto de la expresión de la molécula de señalización clave después de la transfección del inhibidor de miR-17. Los niveles de expresión de ARNm de P53, cyt C y caspasa-9 se midieron mediante RT-PCR. Los grupos PCP, inhibidor e inhibidor NC fueron tratados con TGEV. (A) El nivel de expresión de ARNm de P53 (n = 3); (B) El nivel de expresión de ARNm de cyt C (n = 3); (C) El nivel de expresión de ARNm de caspasa-9 (n = 3). P < 0,05 fue estadísticamente significativo para el grupo inhibitorio, *P < 0,05, **P < 0,01, ***P < 0,001.
3.8 Efecto de la transfección con miR-17 o inhibidor de miR-17 en la expresión de proteínas de moléculas de señalización clave
Los resultados se mostraron en las Figuras 9 y 10. Las figuras 9A y 10A muestran las bandas proteicas de P53, cyt C y caspasa escindida9. Después de la transfección del imitador de miR-17, la expresión de cyt C (Figura 9B), caspasa 9 escindida (Figura 9C) y P53 (Figura 9D) en el grupo imitador no fue significativamente diferente de la del grupo imitador NC. En comparación con el grupo imitador, la expresión de cyt C y caspasa 9 escindida se inhibió significativamente en el grupo de PCP de 125 μg/mL (Figuras 9B, C) (P < 0,05). La expresión de P53 se inhibió significativamente en los grupos de PCP de 250 y 125 μg/mL (P < 0,001) (Figura 9C). Después de la transfección del inhibidor de miR-17, la expresión de cyt C en el grupo inhibidor NC fue significativamente mayor que en el grupo inhibidor (P < 0,01) (Figura 10B), mientras que no hubo diferencias significativas en las expresiones de caspasa escindida 9 (Figura 10C) y P53 (Figura 10D). En comparación con el grupo inhibidor, el grupo de PCP de 125 μg/mL promovió significativamente la expresión de cyt C (Figura 10B) (P < 0,05); La expresión de P53 se inhibió significativamente en el grupo de PCP de 125 μg/mL (Figura 10D) (P < 0,05). La explicación indicaba que el inhibidor de miR-17 suprimía la expresión de cyt C; Al mismo tiempo, la PCP restringió la expresión de cyt C, escindió la caspasa 9 y P53 en células PK15 infectadas con TGEV después de la transfección de miR-17 imit. Mientras tanto, la PCP restringió la expresión de P53 y promovió la expresión de cyt C después de la transfección del inhibidor de miR-17.
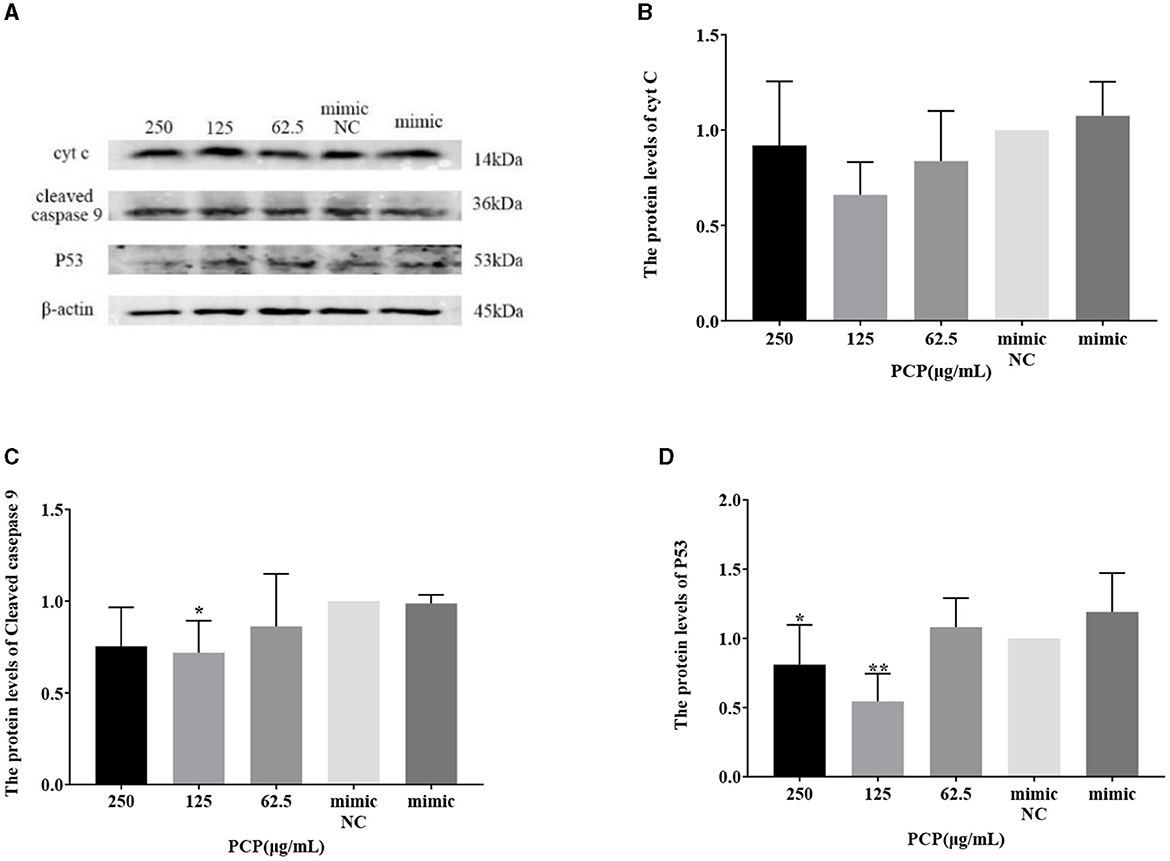 Figura 9. Efecto del miR-17 transfectado sobre la expresión de proteínas en las células. Los niveles de expresión proteica de cyt C, caspasa-9 y P53 se midieron mediante Western blot. El PCP, el MIMIC y el MIMIC NC fueron tratados con TGEV. (A) Bandas de proteínas; (B) Los niveles de expresión proteica de cyt C (n = 3); (C) Los niveles de expresión proteica de la caspasa-9 escindida (n = 3); (D) Los niveles de expresión de la proteína P53 (n = 3). P < 0,05 fue estadísticamente significativo para el grupo imitador, P < 0,05, P < 0,01. Los datos y los resultados del análisis se trazaron como gráficos de barras utilizando GraphPad Prism 7.00.***
Figura 9. Efecto del miR-17 transfectado sobre la expresión de proteínas en las células. Los niveles de expresión proteica de cyt C, caspasa-9 y P53 se midieron mediante Western blot. El PCP, el MIMIC y el MIMIC NC fueron tratados con TGEV. (A) Bandas de proteínas; (B) Los niveles de expresión proteica de cyt C (n = 3); (C) Los niveles de expresión proteica de la caspasa-9 escindida (n = 3); (D) Los niveles de expresión de la proteína P53 (n = 3). P < 0,05 fue estadísticamente significativo para el grupo imitador, P < 0,05, P < 0,01. Los datos y los resultados del análisis se trazaron como gráficos de barras utilizando GraphPad Prism 7.00.***
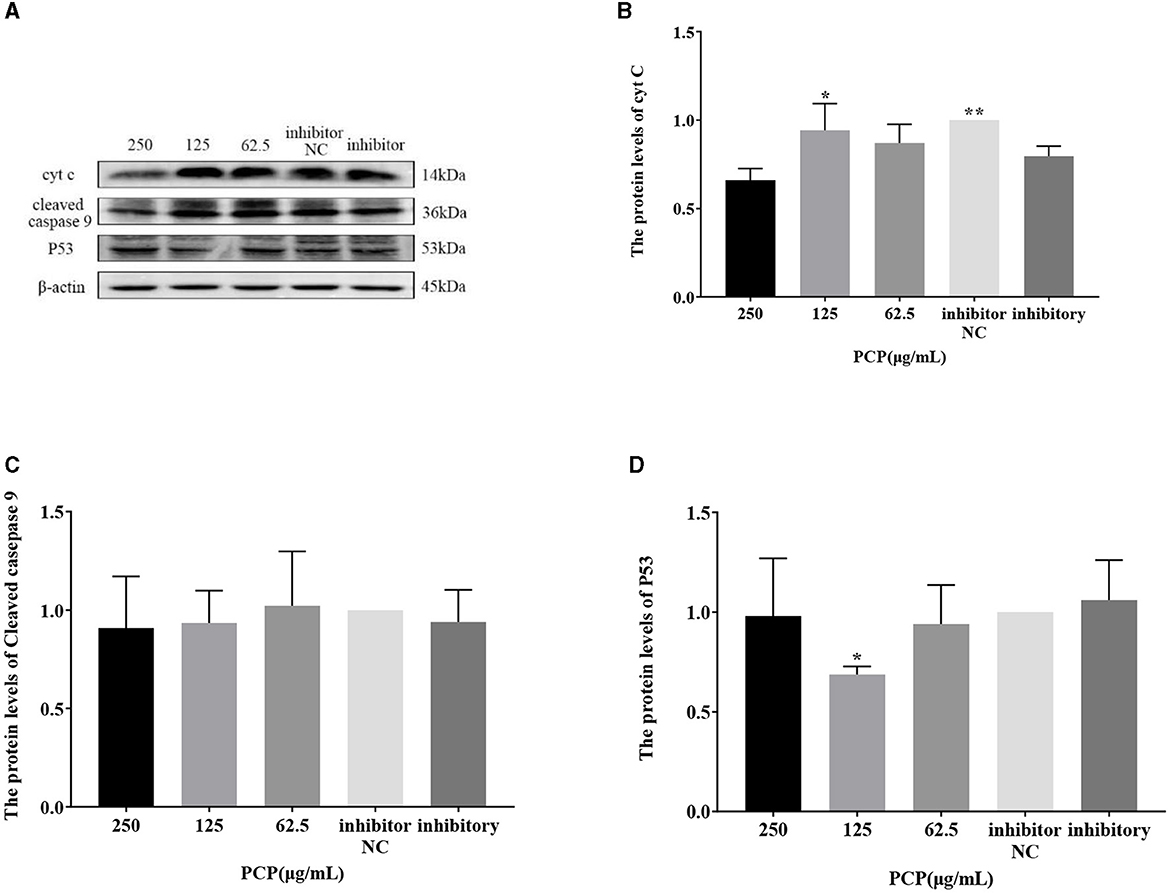 Figura 10. Efecto del inhibidor de miR-17 transfectado sobre la expresión de proteínas en células. Los niveles de expresión proteica de cyt C, caspasa-9 y P53 se midieron mediante Western blot. Los grupos PCP, inhibidor e inhibidor NC fueron tratados con TGEV. (A) Bandas de proteínas; (B) Los niveles de expresión proteica de cyt C (n = 3); (C) Los niveles de expresión proteica de la caspasa-9 escindida (n = 3); (D) Los niveles de expresión de la proteína P53 (n = 3). P < 0,05 fue estadísticamente significativo para el grupo inhibitorio, *P < 0,05, **P < 0,01. Los datos y los resultados del análisis se trazaron como gráficos de barras utilizando GraphPad Prism 7.00.
Figura 10. Efecto del inhibidor de miR-17 transfectado sobre la expresión de proteínas en células. Los niveles de expresión proteica de cyt C, caspasa-9 y P53 se midieron mediante Western blot. Los grupos PCP, inhibidor e inhibidor NC fueron tratados con TGEV. (A) Bandas de proteínas; (B) Los niveles de expresión proteica de cyt C (n = 3); (C) Los niveles de expresión proteica de la caspasa-9 escindida (n = 3); (D) Los niveles de expresión de la proteína P53 (n = 3). P < 0,05 fue estadísticamente significativo para el grupo inhibitorio, *P < 0,05, **P < 0,01. Los datos y los resultados del análisis se trazaron como gráficos de barras utilizando GraphPad Prism 7.00.
3.9 Efecto de la PCP en la replicación de TGEV después de la transfección de miR-17 o inhibidor de miR-17
Los resultados se mostraron en las Figuras 11 y 12. Después de la transfección del imitador de miR-17, la expresión relativa del ARNg de TGEV en el grupo de imitación de NC fue significativamente menor que la del grupo de imitación (P < 0,001) (Figura 11A), y la expresión relativa del gen N de TGEV en el grupo de imitación de NC fue significativamente menor que la del grupo de imitación (P < 0,01) (Figura 11B). La expresión relativa del gen S del TGEV fue significativamente mayor que la del grupo imitador (P < 0,05) (Figura 11C). En comparación con el grupo imitador, los grupos de PCP de 250 μg/mL−62,5 μg/mL inhibieron significativamente la replicación del ARNg TGEV (P < 0,001) (Figura 11A). Los grupos PCP a 250 y 125 μg/mL inhibieron significativamente la replicación N del gen TGEV (P < 0,001) y la replicación N del gen TGEV a 62,5 μg/mL (P < 0,01) (Figura 11B). La PCP promovió significativamente la replicación del gen TGEV S a concentraciones de 250 y 125 μg/mL (P < 0,001) y la replicación del gen TGEV S a 62,5 μg/mL (P < 0,05) (Figura 11C). Después de la transfección del inhibidor de miR-17, la expresión relativa del ARNg de TGEV en el grupo inhibidor NC fue significativamente mayor que en el grupo inhibidor (P < 0,01) (Figura 12A). La expresión relativa del gen N de TGEV en el grupo inhibidor NC fue significativamente mayor que en el grupo inhibidor (P < 0,01) (Figura 12B); No hubo diferencias significativas con el gen S del TGEV entre el grupo inhibidor NC y el grupo inhibidor (Figura 12C). En comparación con el grupo inhibidor, la PCP inhibió significativamente la replicación del ARNg de TGEV a concentraciones de 250 y 125 μg/ml (P < 0,001) (Figura 12A). La PCP inhibió significativamente la replicación del gen TGEV N a concentraciones de 250 y 62,5 μg/mL (P < 0,05) y la replicación del gen TGEV N a 125 μg/mL (P < 0,01) (Figura 12B). La PCP promovió significativamente la replicación del gen TGEV S a la concentración de 250 μg/mL (P < 0,001) y 125 μg/mL (P < 0,01), e inhibió significativamente la replicación del gen TGEV S a la concentración de 62,5 μg/mL (P < 0,01) (Figura 12C). Esto indicó que el miR-17 imitador promovió la replicación del ARNg TGEV y el gen N, mientras que el inhibidor miR-17 inhibió la replicación del ARNg TGEV y el gen N; Al mismo tiempo, la PCP inhibió la replicación del ARNg de TGEV y el gen N después de la transfección del imitador e inhibidor de miR-17, promoviendo la replicación del gen S de TGEV después de la transfección con mimímico de miR-17. Después de la transfección con el inhibidor de miR-17, la replicación del gen S de TGEV se promovió a altas concentraciones de PCP y se inhibió a bajas concentraciones.
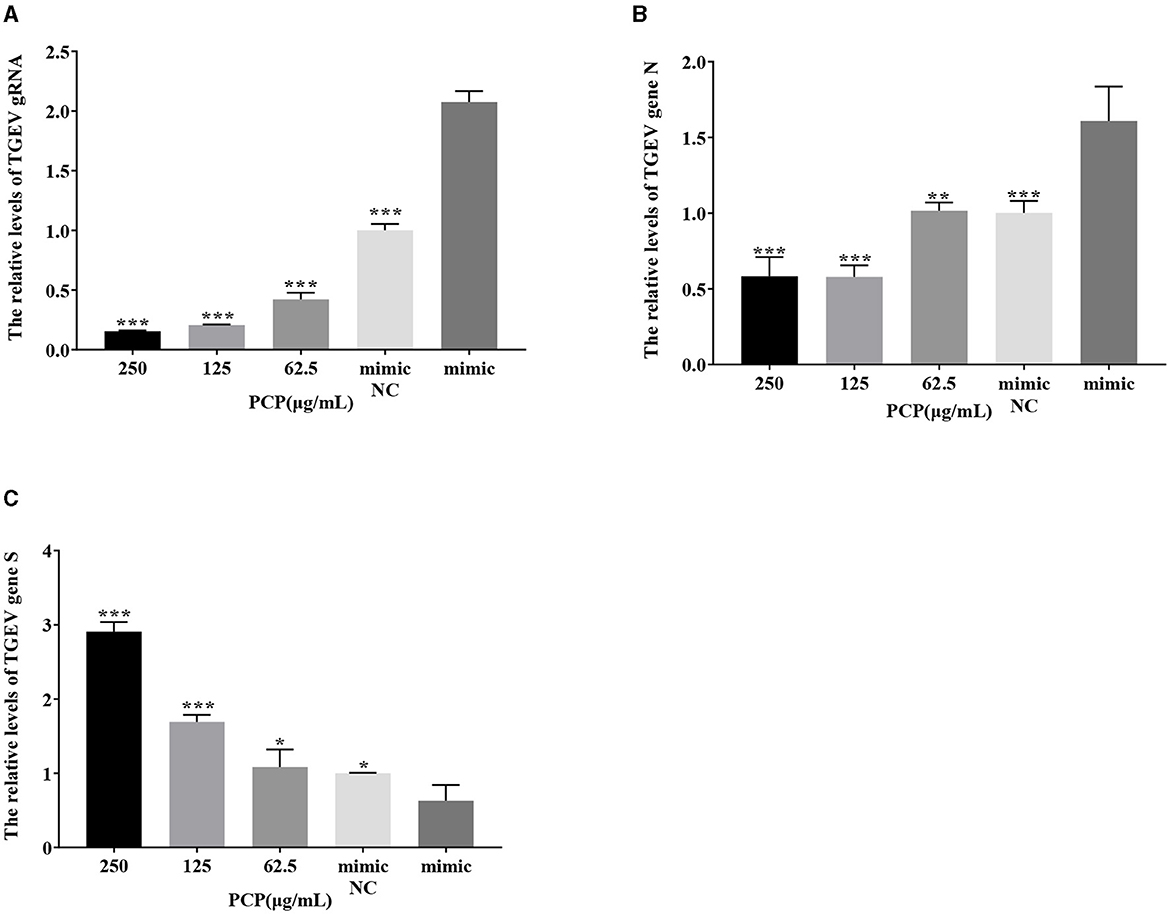 Figura 11. El efecto de miR-17 mimic en la replicación de TGEV. Los niveles de expresión de ARNm del ARNg TGEV, el gen N y el gen S se midieron mediante RT-qPCR. El PCP, el MIMIC y el MIMIC NC fueron tratados con TGEV. (A) Los niveles de expresión de ARNm del ARNg TGEV (n = 3); (B) Los niveles de expresión de ARNm del gen TGEV N (n = 3); (C) Los niveles de expresión de ARNm del gen TGEV S (n = 3). P < 0,05 fue estadísticamente significativo para el grupo imitador, *P < 0,05, **P < 0,01, ***P < 0,001. Los datos y los resultados del análisis se trazaron como gráficos de barras utilizando GraphPad Prism 7.00.
Figura 11. El efecto de miR-17 mimic en la replicación de TGEV. Los niveles de expresión de ARNm del ARNg TGEV, el gen N y el gen S se midieron mediante RT-qPCR. El PCP, el MIMIC y el MIMIC NC fueron tratados con TGEV. (A) Los niveles de expresión de ARNm del ARNg TGEV (n = 3); (B) Los niveles de expresión de ARNm del gen TGEV N (n = 3); (C) Los niveles de expresión de ARNm del gen TGEV S (n = 3). P < 0,05 fue estadísticamente significativo para el grupo imitador, *P < 0,05, **P < 0,01, ***P < 0,001. Los datos y los resultados del análisis se trazaron como gráficos de barras utilizando GraphPad Prism 7.00.
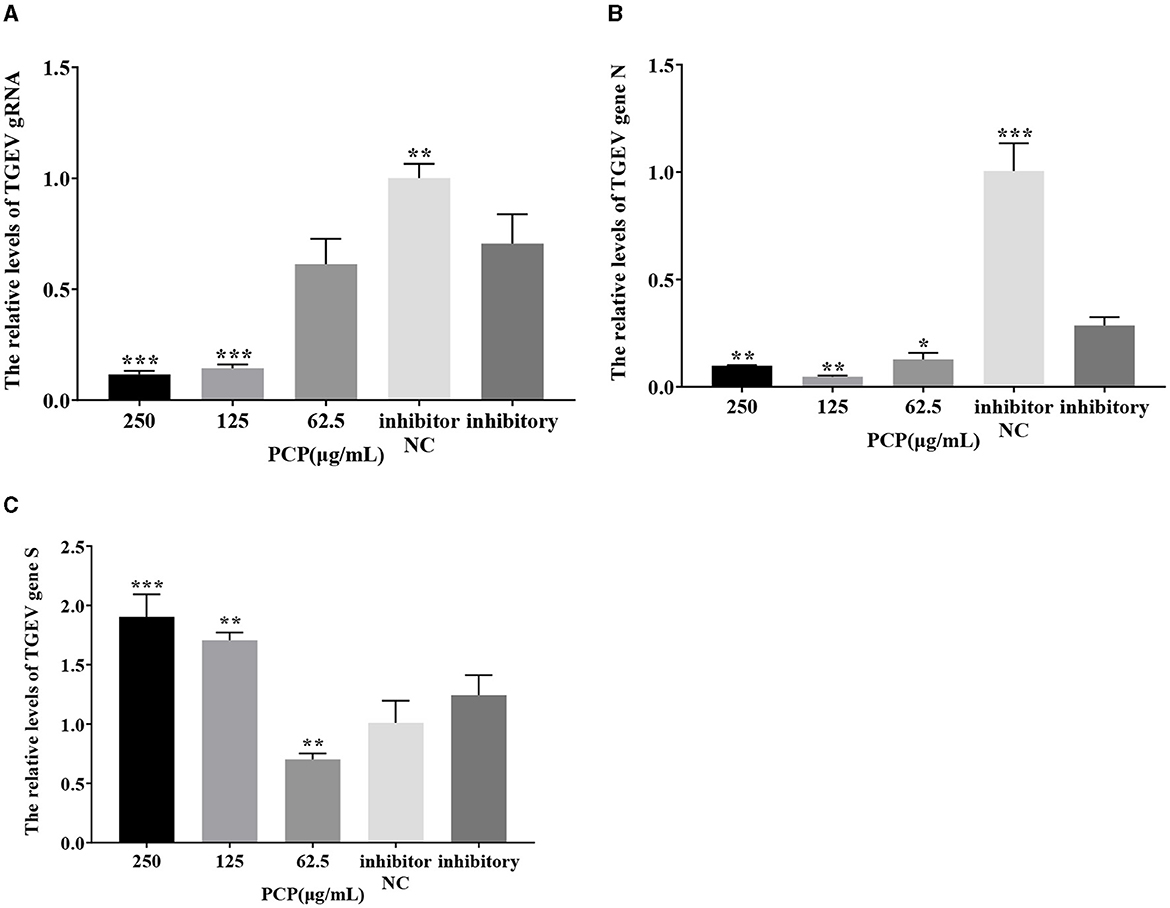 Figura 12. Efecto del inhibidor de miR-17 en la replicación de TGEV. Los niveles de expresión de ARNm del ARNg TGEV, el gen N y el gen S se midieron mediante RT-qPCR. La PCP, la NC inhibitoria y la inhibidora fueron tratadas con TGEV. (A) Los niveles de expresión de ARNm del ARNg TGEV (n = 3); (B) Los niveles de expresión de ARNm del gen TGEV N (n = 3); (C) Los niveles de expresión de ARNm del gen TGEV S (n = 3). P < 0,05 fue estadísticamente significativo para el grupo inhibitorio, *P < 0,05, **P < 0,01, ***P < 0,001. Los datos y los resultados del análisis se trazaron como gráficos de barras utilizando GraphPad Prism 7.00.
Figura 12. Efecto del inhibidor de miR-17 en la replicación de TGEV. Los niveles de expresión de ARNm del ARNg TGEV, el gen N y el gen S se midieron mediante RT-qPCR. La PCP, la NC inhibitoria y la inhibidora fueron tratadas con TGEV. (A) Los niveles de expresión de ARNm del ARNg TGEV (n = 3); (B) Los niveles de expresión de ARNm del gen TGEV N (n = 3); (C) Los niveles de expresión de ARNm del gen TGEV S (n = 3). P < 0,05 fue estadísticamente significativo para el grupo inhibitorio, *P < 0,05, **P < 0,01, ***P < 0,001. Los datos y los resultados del análisis se trazaron como gráficos de barras utilizando GraphPad Prism 7.00.
4 Discusión
La infección por virus representa una amenaza significativa para la salud humana y animal. En consecuencia, la búsqueda de medicamentos antivirales seguros, eficaces y específicos sigue siendo un área importante de investigación. Los polisacáridos, como uno de los principales componentes de los fármacos, tienen múltiples funciones en los organismos vivos. Los estudios han revelado que una multitud de polisacáridos tienen actividad antiviral, al mismo tiempo que poseen baja toxicidad y baja resistencia (19). Según muchos informes, el polisacárido Isatidis Radix tiene efectos antivirales sobre el virus de la pseudorrabia (20), y el polisacárido Glycyrrhiza y Panax otoginseng podría interferir con la adhesión e internalización del virus, inhibir la adsorción y replicación de PRV y ejercer efectos antivirales (21, 22). Los polisacáridos presentes en las algas podrían resistir el VIH-1, inhibir el VHS-I y II, y reducir la infectividad de la cepa Cooper del virus BoHV-1 y la cepa Bartha del SuHV-1 (23). Por lo tanto, el polisacárido, como componente antiviral eficaz y de baja toxicidad, tiene amplias perspectivas medicinales. En la actualidad, los medicamentos utilizados para prevenir o tratar enfermedades virales son principalmente hierbas medicinales chinas, medicamentos chinos patentados y medicamentos químicos. Las investigaciones han confirmado que algunas medicinas tradicionales chinas poseen efectos antivirales muy fuertes. Las únicas medicinas tradicionales chinas para la prevención clínica y el tratamiento de enfermedades virales, como el medicamento antipirético Isatidis radix, Scutellaria baicalensis, Coptis chinensis, Forsythia suspensa, Flos lonicerae, etc. (24-28). Los principales medicamentos chinos patentados incluyen las píldoras Tongxuan Lifei, la decocción de Jiuwei Qianghuo, las píldoras Yinqiao Jiedu, la cápsula Ganke Shuangqing, la inyección de Shuanghuanglian, etc. (29-33). Por lo tanto, enriquecer los tipos y mecanismos de los medicamentos antivirales podría proporcionar más garantías de seguridad para las infecciones virales. Se ha demostrado que el polisacárido Polygonum Cillinerve tiene actividad antiviral a través de este estudio, y se necesita más investigación sobre su mecanismo de acción contra el TGEV.
Se ha demostrado que las enfermedades infecciosas virales animales están asociadas con la apoptosis (34-36), en el caso de la infección por TGEV, las células experimentaron apoptosis a través de vías endógenas y exógenas para inhibir la replicación del virus. La vía endógena de la apoptosis es iniciada por las mitocondrias, y la infección viral puede causar daño mitocondrial (37, 38). El papel principal de las mitocondrias es depender de OXPHOS para producir ATP para las células, y el subproducto de este proceso es la producción de ROS (39). La homeostasis de las ROS es esencial para mantener los procesos biológicos normales. El papel de las ROS en la apoptosis inducida por virus ha sido demostrado por numerosos estudios. Por ejemplo, después de que el parvovirus H-1 infecta el cuerpo, la apoptosis fue inducida por la mediación de la acumulación de ROS (40), y la levistilida A puede inhibir la replicación del PEDV al inducir la producción de ROS (41). Al mismo tiempo, también hay estudios que han demostrado que el miRNA podría afectar a la producción de ROS, como la sobreexpresión de miR-27 podría inhibir la producción de ROS (42). Por lo tanto, después de la transfección de miARN, se detectaron ROS para explorar los efectos de PCP y TGEV. Los resultados mostraron que la PCP inhibió la producción de ROS inducida por TGEV después de la transfección de miR-17.
El potencial de membrana mitocondrial (ΔΨm) generado por la bomba de protones (complejos I, III y IV) constituye un elemento crucial en el proceso de almacenamiento de energía durante la fosforilación oxidativa (43). Los niveles de ΔΨm en las células permanecen relativamente estables, lo que refleja una actividad fisiológica normal (44-46). Sin embargo, las alteraciones persistentes en estos dos factores pueden tener efectos perjudiciales, y una disminución o aumento prolongado de ΔΨm en comparación con los niveles normales puede resultar en una disminución innecesaria de la viabilidad celular y servir como causa subyacente de diversas patologías (47). En este estudio, después de la transfección de miARN, cada grupo de células se cargó con sondas fluorescentes JC-1, y la disminución del potencial de membrana celular pudo detectarse fácilmente mediante la transición de JC-1 de fluorescencia roja a fluorescencia verde, que también podría usarse como un índice de detección temprana de apoptosis. El análisis estadístico de la relación relativa de fluorescencia roja y verde reveló que la tinción de JC-1 podría demostrar que la PCP podría proteger a las células PK15 infectadas con TGEV de una disminución en el potencial de membrana mitocondrial después de la transfección de miR-17, y podría aumentar significativamente el potencial de membrana mitocondrial a altas concentraciones (P < 0,05).
Hoechst 33258 es un colorante fluorescente azul que puede penetrar en las membranas celulares, incrustarse en el ADN bicatenario y liberar fluorescencia azul intenso. Fue de baja citotoxicidad y ampliamente utilizado para evaluar el ciclo celular y la apoptosis (48). Durante la apoptosis, la cromatina condensa el blanco bajo microscopía de fluorescencia. Los estudios han demostrado que las fórmulas de la MTC o los ingredientes activos de la MTC podrían regular la apoptosis mediante la modulación del miARN. Por ejemplo, la decocción de Ditan Huoxue Shubi puede regular al alza la expresión de miR-148, regular a la baja la expresión de TXNIP y reducir el nivel de autofagia inducida por H/R y la apoptosis de los cardiomiocitos (49). Los polisacáridos platycodon mejoran la apoptosis inducida por el virus respiratorio sincitial y las respuestas inflamatorias en las células epiteliales mediante la activación de las vías Hippo y SIRT1 mediadas por miR-181 (50). Esto fue similar a los resultados de este estudio, donde el blanqueamiento nuclear en el grupo de PCP después de la transfección de miR-17 fue dependiente de la dosis con la concentración del fármaco, lo que sugiere que las altas concentraciones del fármaco inhibieron la apoptosis. Además, los resultados del experimento también mostraron que la PCP podría inhibir la apoptosis celular inducida por TGEV después de la transfección de miR-17 solo. Así, se demostró que la PCP era capaz de inhibir la apoptosis inducida por TGEV mediante la regulación negativa de la expresión de miR-17.
El estudio encontró que miR-17 estaba altamente expresado en pacientes con mieloma múltiple y cáncer de colon, y bajo expresado en lesiones cutáneas y sangre periférica de pacientes con tumores del estroma gástrico y psoriasis vulgar, y estaba involucrado en la regulación del desarrollo de ovarios porcinos desde la etapa folicular hasta la etapa lútea, la diferenciación de adipocitos y el depósito adiposo porcino (51). No se ha demostrado que esté implicado en la regulación de la infección viral. En este estudio, después de la secuenciación de alto rendimiento, se encontró que miR-17 se expresó diferencialmente durante la apoptosis causada por la infección por PCP y TGEV, por lo que después de la transfección del imitador e inhibidor de miR-17, la expresión de ARNm de la caspasa 9 en el grupo mímico fue menor que en el grupo NC, pero no hubo diferencia significativa (Figura 7). La expresión de ARNm de la caspasa 9 en el grupo inhibidor fue significativamente mayor que la del grupo NC (P < 0,01) (Figura 8), lo que indica que, en circunstancias ideales, el inhibidor se une a miR-17 y no puede unirse a la UTR 3′ de la caspasa 9, o se une menos, lo que resulta en una alta expresión de ARNm de la caspasa 9. Por lo tanto, se especula que miR-17 podría ser el gen diana de la caspasa 9. Después del tratamiento con PCP, hubo diferencias significativas en los niveles de expresión de ARNm de los tres ganglios de la vía de apoptosis (P53, cyt C, caspasa 9) (Figuras 7, 8), lo que indica que PCP promovió la expresión de ARNm de factores relacionados con la apoptosis. Pero a nivel proteico, mostró resultados diferentes. MiR-17 no tuvo ningún efecto sobre el nivel de proteína de la caspasa 9, posiblemente debido a varios mecanismos reguladores, desde los genes hasta la función de la proteína, que incluyen, entre otros, la modificación del ADN, la modificación de histonas, la regulación del elemento de transcripción, la modificación del ARN, la edición del ARN, la modificación postraduccional de la proteína, etc. Después del tratamiento con PCP y la transfectación del inhibidor, el nivel de proteína de P53 disminuyó, mientras que el nivel de proteína de cyt C aumentó. Sin embargo, la caspasa 9, como molécula efectora aguas abajo, no mostró ninguna diferencia; Al mismo tiempo, la PCP inhibió significativamente los niveles de proteína de P53, cyt C y caspasa 9 escindida después de la transfección con mímica (Figuras 9, 10). Este experimento sugiere que la caspasa 9 podría ser un gen diana para miR-17, y se necesitaba una validación adicional para confirmar esta relación. Sin embargo, la PCP después de la transfección de miR-17 podría inhibir la apoptosis causada por TGEV a través de la vía P53.
Dado que los miARN celulares están involucrados en el ciclo de vida de muchos virus, su importancia en las interacciones virus-huésped es cada vez más evidente, además de su papel clave en la regulación de la expresión génica en células normales (52-54). Al mismo tiempo, los estudios han confirmado que la infección por TGEV inicia el mecanismo de la apoptosis, y aún se necesita más investigación sobre cómo la apoptosis afecta la proliferación y propagación de TGEV. Por lo tanto, en este estudio, se investigaron los efectos de miR-17 expresado diferencialmente en el genoma viral y la replicación subgenómica durante el proceso de PCP anti-TGEV, y se exploró más a fondo el mecanismo del miRNA en el proceso de PCP anti-TGEV. Se encontró que la sobreexpresión de miR-17 facilitó la replicación de TGEV, lo cual fue similar al estudio de Castillo et al. (3) la sobreexpresión de miRNA-133 podría influir en la replicación de DENV-2, afectar el porcentaje de células infectadas y el número de copias de ARN viral (3, 55). El TGEV es un patógeno importante para los cerdos que puede causar diarrea severa en los cerdos (especialmente en los lechones recién nacidos) y enormes pérdidas económicas. Además, los resultados de este estudio también demuestran que los miRNAs del huésped podrían afectar a la replicación del gen N, el gen S y el ARNg del TGEV, y que la PCP podría inhibir la replicación del TGEV mediante la regulación negativa de la expresión de miR-17. Estos hallazgos resaltan aún más el importante papel del miARN de los mamíferos en la respuesta antiviral y enriquecen aún más el mecanismo antiviral de la medicina tradicional china, que puede ser de gran importancia para el mecanismo molecular del miARN en el proceso anti-TGEV de la medicina tradicional china.
5 Conclusión
Este estudio demostró que la PCP inhibió los cambios morfológicos celulares inducidos por TGEV, la producción de ROS, la reducción del potencial de membrana mitocondrial y la apoptosis celular después de la transfección con miR-17. Después de la transfección de miR-17, la PCP podría inhibir la apoptosis de las células PK15 inducida por TGEV a través de la vía P53. Además, miR-17 afectó a la replicación de TGEV en células PK15, y la PCP podría inhibir la replicación de TGEV mediante la regulación negativa de la expresión de miR-17.
Declaración de disponibilidad de datos
Las contribuciones originales presentadas en el estudio están incluidas en el artículo/Material complementario, las consultas adicionales pueden dirigirse a los autores correspondientes.
Declaración ética
El estudio en animales fue aprobado por el Comité de Ética y Bienestar Animal de la Universidad del Noroeste A&F, China. El estudio se llevó a cabo de acuerdo con la legislación local y los requisitos institucionales.
Contribuciones de los autores
XD: Curación de datos, Análisis formal, Investigación, Metodología, Visualización, Escritura – borrador original. MX: Redacción – borrador original, Redacción – revisión y edición. YW: Escritura – borrador original. NL: Validación, Redacción – revisión y edición. XW: Validación, Redacción – revisión y edición. YL: Redacción – revisión y edición. WZ: Escritura – revisión y edición. WM: Redacción – revisión y edición. LM: Supervisión, Redacción – Revisión y Edición. YF: Conceptualización, Obtención de Fondos, Administración de Proyectos, Supervisión, Redacción, Revisión y Edición.
Financiación
El/los autor/es declara(n) haber recibido apoyo financiero para la investigación, autoría y/o publicación de este artículo. El proyecto contó con el apoyo de la Fundación Nacional de Ciencias Naturales de China (Subvención n.º 31772788) y la Fundación Nacional de Ciencias Naturales de la provincia de Shaanxi (Subvención n.º 2020JM-161).
Reconocimientos
Agradecemos a todo el personal del Instituto de Medicina Veterinaria Tradicional China de la Universidad Northwest A&F por su ayuda con estos experimentos.
Conflicto de intereses
Los autores declaran que la investigación se llevó a cabo en ausencia de relaciones comerciales o financieras que pudieran interpretarse como un posible conflicto de intereses.
Nota del editor
Todas las afirmaciones expresadas en este artículo son únicamente las de los autores y no representan necesariamente las de sus organizaciones afiliadas, ni las del editor, los editores y los revisores. Cualquier producto que pueda ser evaluado en este artículo, o afirmación que pueda ser hecha por su fabricante, no está garantizado ni respaldado por el editor.
Material complementario
El material complementario para este artículo se puede encontrar en línea en: https://www.frontiersin.org/articles/10.3389/fvets.2024.1360102/full#supplementary-material
Referencias
1. Lu TX, Rothenberg ME. MicroARN. J Alergia Clin Immunol. (2018) 141:1202–7. doi: 10.1016/j.jaci.2017.08.034
2. Chaulk SG, Ebhardt HA, Fahlman RP. Correlaciones de microARN: los patrones de expresión de microARN revelan información sobre los grupos de microARN y los patrones globales de expresión de microARN. Mol Biosyst. (2016) 12:110–9. doi: 10.1039/C5MB00415B
Resumen de PubMed | Texto completo de Crossref | Google Académico
3. Castillo JA, Castrillón JC, Diosa-Toro M, Betancur JG, St Laurent G. 3º, Smit JM, Urcuqui-Inchima S. Interacción compleja entre la replicación del virus del dengue y la expresión de miRNA-133a. BMC infecta dis. (2016) 16:29. doi: 10.1186/s12879-016-1364-y
Resumen de PubMed | Texto completo de Crossref | Google Académico
4. Zhao C, Wang M, Cheng A, Yang Q, Wu Y, Jia R, et al. El virus de la peste del pato promueve la apoptosis de las células DEF mediante la activación de caspasas, el aumento de los niveles intracelulares de ROS e induce la detención de la fase S del ciclo celular. Virus. (2019) 11:196. doi: 10.3390/v11020196
Resumen de PubMed | Texto completo de Crossref | Google Académico
5. Su J, Chen D, Zheng R, Liu X, Zhao M, Zhu B, et al. El polisacárido antártico de Duvira inhibió la apoptosis inducida por el virus de la influenza H1N1 a través de la vía de señalización ERK y STAT-3 mediada por ROS. Mol Biol Rep. (2022) 49:6225–33. DOI: 10.1007/S11033-022-07418-W
Resumen de PubMed | Texto completo de Crossref | Google Académico
6. Xu Y, Zheng J, Sun P, Guo J, Zheng X, Sun Y, et al. La cefarantina y la curcumina inhibieron la apoptosis mitocondrial inducida por PCV2. BMC Vet Res. (2020) 16:345. doi: 10.1186/s12917-020-02568-0
Resumen de PubMed | Texto completo de Crossref | Google Académico
7. He DW, Wei X, Ma Y. Diagnóstico y medidas de prevención de la gastroenteritis infecciosa en cerdos. Jilin Veterinario de Ganado Med. (2021) 42:15.
8. Sun Y, Wang N, Gao C, Zhou H, Jiang YP, Cui W, et al. Cribado e identificación de anticuerpos de cadena simple derivados del cerdo contra el virus de la gastroenteritis infecciosa porcina. Chin J Vet Sci. (2021) 51:695–704.
9. Liu XJ, Zhang EH, Guo HL. Resumen de la investigación sobre el polisacárido Polygonum Cillinerve. J Shaanxi Univ Tradit Chin Med. (2003) 3:62–3.
10. Guo HL, Deng YL, Chu YL. Estudio experimental sobre el efecto anti virus de la gripe A de la antraquinona total y la emodina del polisacárido Polygonum Cillinerve in vitro. J Shaanxi Univ Tradit Chin Med. (2005) 5:63–4.
11. Zhang WM, Zhang YM, Guo KK, Hu J. Detección de sitios activos antibacterianos y antivirales in vitro a partir de extractos de polisacárido Polygonum Cillinerve. Chin J Vet Med. (2011) 31:710–19.
12. Zhao Q, Feng BP, Hu R, Zhu XX, Wang HD, Yuan WH, et al. Estudio in vitro del polisacárido Polygonum Cillinerve frente al virus del herpes simple tipo II. Farmacología del mentón Clin. (2012) 28:79–81.
13. Zhao Q, Feng BP, Zhu XX, Wang HD, Wei H. Estudio experimental in vitro sobre el efecto del virus antiherpes simple tipo I del polisacárido Polygonum Cillinerve. J Modern Integr Tradit Chin West Med. (2012) 21:2870–91.
14. Ma ZY. Investigación sobre los efectos antivirales y antibacterianos de la medicina tradicional china. Pekín: China Med Sci Tech Press (2005).
15. Hu R, Guo HJ, Cao Z, Sheng J, Guo KK, Ning PB, et al. Inhibición in vitro del polisacárido Polygonum Cillinerve en el virus de la gastroenteritis transmisible porcina (TGEV). Chin J Agric Biotechnol. (2015) 23:253–61.
16. Wang XM, Li ZX, Ren LJ. Estudio de la actividad antioxidante del polisacárido en Polygonum Cillinerve (Nakai) Ohwi. J Anhui Agric Sci. (2010) 38:19346–510.
17. Zhou Y, Ma WR, Wang LB, Sun WJ, Li M, Zhang WM, et al. Caracterización y actividad antioxidante de la fracción oligo-maltosa de Polygonum Cillinerve. Carbohydr Polym. (2019) 226:115307. doi: 10.1016/j.carbpol.2019.115307
Resumen de PubMed | Texto completo de Crossref | Google Académico
18. Pan X, Zhou Y, Duan X, Cui J, Liu J, Song X, et al. El efecto inhibidor del polisacárido Polygonum Cillinerve sobre el virus de la gastroenteritis transmisible de los cerdos. Res Vet Sci. (2021) 140:47–55. doi: 10.1016/j.rvsc.2021.08.005
Resumen de PubMed | Texto completo de Crossref | Google Académico
19. Faccin-Galhardi LC, Yamamoto KA, Ray S, Ray B, Carvalho Linhares RE, Nozawa C, et al. La propiedad antiviral in vitro de los polisacáridos de Azadirachta indica para el virus de la poliomielitis. J Etnofarmaco. (2012) 142:86–90. doi: 10.1016/j.jep.2012.04.018
Resumen de PubMed | Texto completo de Crossref | Google Académico
20. Tong C, Chen Z, Liu F, Qiao Y, Chen T, Wang X, et al. Actividades antivirales del polisacárido Radix isatidis contra el virus de la pseudorrabia en células testiculares porcinas. BMC complementa a Med Ther. (2020) 20:48. doi: 10.1186/s12906-020-2838-4
Resumen de PubMed | Texto completo de Crossref | Google Académico
21. Huan C, Xu Y, Zhang W, Ni B, Gao S. El polisacárido de la glicirrina inhibe la infección por el virus de la pseudorrabia al interferir con la adhesión e internalización del virus. Virus. (2022) 14:1772. doi: 10.3390/v14081772
Resumen de PubMed | Texto completo de Crossref | Google Académico
22. Huan C, Zhou Z, Yao J, Ni B, Gao S. El efecto antiviral de los polisacáridos panax notoginseng mediante la inhibición de la adsorción y replicación de PRV in vitro. Moléculas. (2022) 27:1254. doi: 10.3390/moléculas27041254
Resumen de PubMed | Texto completo de Crossref | Google Académico
23. Rengasamy KR, Mahomoodally MF, Aumeeruddy MZ, Zengin G, Xiao J, Kim DH, et al. Compuestos bioactivos en algas marinas: una visión general de sus propiedades biológicas y seguridad. Toxicol químico alimentario. (2020) 135:111013. doi: 10.1016/j.fct.2019.111013
Resumen de PubMed | Texto completo de Crossref | Google Académico
24. Ley AH, Yang CL, Lau AS, Chan GC. Efecto antiviral del forsitósido A de Forsythia suspensa (Thunb.) Fruta de Vahl contra el virus de la gripe A mediante la reducción de la proteína viral M1. J Etnofarmaco. (2017) 209:236–47. doi: 10.1016/j.jep.2017.07.015
Resumen de PubMed | Texto completo de Crossref | Google Académico
25. Lee BH, Chathuranga K, Uddin MB, Weeratunga P, Kim MS, Cho WK, et al. El extracto de rizoma de Coptidis inhibe la replicación del virus respiratorio sincitial in vitro e in vivo mediante la inducción del estado antiviral. J Microbiol. (2017) 55:488–98. doi: 10.1007/s12275-017-7088-x
Resumen de PubMed | Texto completo de Crossref | Google Académico
26. Zhao T, Tang H, Xie L, Zheng Y, Ma Z, Sun Q, et al. Baicalensis georgi. (Lamiaceae): una revisión de sus usos tradicionales, botánica, fitoquímica, farmacología y toxicología. J Pharm Pharmacol. (2019) 71:1353–69. doi: 10.1111/jphp.13129
Resumen de PubMed | Texto completo de Crossref | Google Académico
27. Li M, Wang Y, Jin J, Dou J, Guo Q, Ke X, et al. Actividad inhibitoria de los extractos de madreselva frente al virus de la gripe A in vitro e in vivo. Virol Sin. (2021) 36:490–500. doi: 10.1007/s12250-020-00302-6
Resumen de PubMed | Texto completo de Crossref | Google Académico
28. Chen Q, Lan HY, Peng W, Rahman K, Liu QC, Luan X, et al. Isatis indigotica: una revisión de la fitoquímica, las actividades farmacológicas y las aplicaciones clínicas. J Pharm Pharmacol. (2021) 73:1137–50. doi: 10.1093/jpp/rgab014
Resumen de PubMed | Texto completo de Crossref | Google Académico
29. Tan YZ, Zhao SY, Lv WQ. Estudio farmacodinámico de gránulos de Tongxuan lifei. Pharmacol Clin Chin Mater Med. (1995) 2:11–3.
30. Chen XD, Zhou XL, Chen XL. Experiencia en el tratamiento de la fiebre epidémica bovina con Jiuwei Qianghuo Tang. Chin J Vet Med. (2004) 1:17–8.
31. Yang HY, Zhang TE, Liu WW, Xu ZH, Ding WJ. Yinqiao Jiedu Wan en el tejido pulmonar de ratones infectados con el virus de la influenza β- La influencia de la expresión de defensina1. J Chengdu Univ Tradit Chin Med. (2013) 36:33–6.
32. Ma Q, Liang D, Song S, Yu Q, Shi C, Xing X, et al. Estudio comparativo de la actividad antivirus del polvo inyectable Shuang-Huang-Lian y su mezcla de compuestos bioactivos frente al adenovirus III humano in vitro. Virus. (2017) 9:79. doi: 10.3390/v9040079
Resumen de PubMed | Texto completo de Crossref | Google Académico
33. Jin J, Lv J, Wang ZF, Xie YM, Sun MH. Evaluación sistemática y metaanálisis de la eficacia y seguridad de las cápsulas de Ganke Shuangqing en el tratamiento de infecciones agudas del tracto respiratorio superior. World Tradit Chin Med. (2020) 15:24–9.
34. Chen S, Cheng AC, Wang MS, Peng X. Detección de la apoptosis inducida por el nuevo tipo de virus de la enteritis viral de Gosling in vitro a través del doble marcaje de fluoresceína anexina V-FITC/PI. Mundo J Gastroenterol. (2008) 14:2174–8. doi: 10.3748/wjg.14.2174
Resumen de PubMed | Texto completo de Crossref | Google Académico
35. Si F, Hu X, Wang C, Chen B, Wang R, Dong S, et al. El virus (PEDV) ORF3 aumenta la proliferación viral al inhibir la apoptosis de las células infectadas. Virus. (2020) 12:214. doi: 10.3390/v12020214
Resumen de PubMed | Texto completo de Crossref | Google Académico
36. Li T, Zhao G, Zhang T, Zhang Z, Chen X, Song J, et al. El virus de la peste porcina africana pE199L induce la apoptosis mitocondrial-dependiente. Virus. (2021) 13:2240. doi: 10.3390/v13112240
Resumen de PubMed | Texto completo de Crossref | Google Académico
37. Jeong SY, Seol DW. El papel de las mitocondrias en la apoptosis. BMB Rep. (2008) 41:11–22. doi: 10.5483/BMBRep.2008.41.1.011
38. Orzalli MH, Prochera A, Payne L, Smith A, Garlick JA, Kagan JC, et al. La inactivación mediada por virus de los miembros antiapoptóticos de la familia Bcl-2 promueve la piroptosis dependiente de Gasdermin-E en las células epiteliales de barrera. Inmunidad. (2021) 54:1447–62. doi: 10.1016/j.immuni.2021.04.012
Resumen de PubMed | Texto completo de Crossref | Google Académico
39. Annesley SJ, Fisher PR. Mitocondrias en la salud y la enfermedad. Células. (2019) 8:680. doi: 10.3390/cells8070680
40. Hristov G, Krämer M, Li J, El-Andaloussi N, Mora R, Daeffler L, et al. A través de su proteína no estructural NS1, el parvovirus H-1 induce la apoptosis a través de la acumulación de especies reactivas de oxígeno. J Virol. (2010) 84:5909–22. doi: 10.1128/JVI.01797-09
Resumen de PubMed | Texto completo de Crossref | Google Académico
41. Zeng W, Ren J, Li Z, Jiang C, Sun Q, Li C, et al. Levistolide A inhibe la replicación de PEDV a través de la inducción de la generación de ROS. Virus. (2022) 14:258. doi: 10.3390/v14020258
Resumen de PubMed | Texto completo de Crossref | Google Académico
42. Zhang H, Xia J, Hu Q, Xu L, Cao H, Wang X, et al. El XIST de ARN largo no codificante promueve la lesión por isquemia/reperfusión cerebral mediante la modulación de la señalización miR-27a-3p/FOXO3. Mol Med Rep. (2021) 24:566. doi: 10.3892/mmr.2021.12205
Resumen de PubMed | Texto completo de Crossref | Google Académico
43. Zorova LD, Popkov VA, Plotnikov EY, Silachev DN, Pevzner IB, Jankauskas SS, et al. Potencial de membrana mitocondrial. Bioquímica anal. (2018) 552:50–9. doi: 10.1016/j.ab.2017.07.009
44. Zamzami N, Marchetti P, Castedo M, Decaudin D, Macho A, Hirsch T, et al. Reducción secuencial del potencial transmembrana mitocondrial y generación de especies reactivas de oxígeno en la muerte celular programada temprana. J Exp Med. (1995) 182:367–77. doi: 10.1084/jem.182.2.367
Resumen de PubMed | Texto completo de Crossref | Google Académico
45. Yaniv Y, Juhaszova M, Nuss HB, Wang S, Zorov DB, Lakatta EG, et al. Adaptación de la oferta y la demanda de ATP en el corazón de los mamíferos: perspectivas in vivo, in vitro e in silico. Ann N Y Acad Sci. (2010) 1188:133–42. doi: 10.1111/j.1749-6632.2009.05093.x
Resumen de PubMed | Texto completo de Crossref | Google Académico
46. Zorov DB, Juhaszova M, Sollott SJ. Especies reactivas de oxígeno (ROS) mitocondriales y liberación de ROS inducida por ROS. Physiol Rev. (2014) 94:909–50. doi: 10.1152/physrev.00026.2013
Resumen de PubMed | Texto completo de Crossref | Google Académico
47. Izyumov DS, Avetisyan AV, Pletjushkina OY, Sakharov DV, Wirtz KW, Chernyak BV, et al. «Salarios del miedo»: la disminución transitoria de tres veces en el nivel de ATP intracelular impone la apoptosis. Biochim Biophys Acta. (2004) 1658:141–7. doi: 10.1016/j.bbabio.2004.05.007
Resumen de PubMed | Texto completo de Crossref | Google Académico
48. Zhang X, Chen J, Davis B, Kiechle F. Hoechst 33342 induce la apoptosis en las células HL-60 e inhibe la topoisomerasa I in vivo. Arch Pathol Lab Med. (1999) 123:921–7. doi: 10.5858/1999-123-0921-HIAIHC
Resumen de PubMed | Texto completo de Crossref | Google Académico
49. Wang S, Xu MM, Ye ZH, Tu JJ. Estudio sobre el mecanismo molecular de la regulación positiva de la expresión de microRNA-148a por Ditan Huoxue Shubi Tang para aliviar la lesión por isquemia-reperfusión miocárdica. Zhejiang J Integr Tradit Chin West Med. (2022) 32:1084–9.
50. Li JJ, Liu ML, Lv JN, Chen RL, Ding K, He JQ, et al. Los polisacáridos de Platycodonis Radix mejoraron la apoptosis y la inflamación de las células epiteliales inducidas por el virus respiratorio sincitial a través de la activación de las vías Hippo y SIRT1 mediadas por miR-181a. Int Immunopharmacol. (2022) 104:108510. doi: 10.1016/j.intimp.2021.108510
Resumen de PubMed | Texto completo de Crossref | Google Académico
51. Zhao ZX, Xing K, Chang XR, Qi XL, Sheng XH, Ni HM, et al. Análisis bioinformático de genes diana que regulan la deposición de grasa mediante sc-miR-17-3p. J Beijing Agric Coll. (2021) 36:6–10.
52. Ahluwalia JK, Khan SZ, Soni K, Rawat P, Gupta A, Hariharan M, et al. El microARN celular humano has-miR-29a interfiere con la expresión de la proteína NEF viral y la replicación del VIH-1. Retrovirología. (2008) 5:117. doi: 10.1186/1742-4690-5-117
Resumen de PubMed | Texto completo de Crossref | Google Académico
53. Otsuka M, Jing Q, Georgel P, New L, Chen J, Mols J, et al. La hipersusceptibilidad a la infección por el virus de la estomatitis vesicular en ratones deficientes en Dicer1 se debe a una alteración de la expresión de miR24 y miR93. Inmunidad. (2007) 27:123–34. doi: 10.1016/j.immuni.2007.05.014
Resumen de PubMed | Texto completo de Crossref | Google Académico
54. Lecellier CH, Dunoyer P, Arar K, Lehmann-Che J, Eyquem S, Himber C, et al. Un microARN celular media la defensa antiviral en las células humanas. Ciencia. (2005) 308:557–60. doi: 10.1126/science.1108784
Resumen de PubMed | Texto completo de Crossref | Google Académico
55. Wang H, Gao H, Duan S, Song X. La inhibición del microRNA-199a-5p reduce la replicación del VHC a través de la regulación de la vía pro-supervivencia. Virus Res. (2015) 208:7–12. doi: 10.1016/j.virusres.2015.05.002
Resumen de PubMed | Texto completo de Crossref | Google Académico
Palabras clave: Polygonum Cillinerve polisacárido, virus de la gastroenteritis transmisible, miR-17, apoptosis, replicación del virus
Cita: Duan X, Xu M, Wang Y, Liu N, Wang X, Liu Y, Zhang W, Ma W, Ma L y Fan Y (2024) Efecto de miR-17 en el polisacárido Polygonum Cillinerve contra el virus de la gastroenteritis transmisible. Frente. Vet. Sci. 11:1360102. doi: 10.3389/fvets.2024.1360102
Recibido: 22 de diciembre de 2023; Aceptado: 05 de febrero de 2024;
Publicado: 20 febrero 2024.
Editado por:
Mujeeb Ur Rehman, Departamento de Desarrollo Ganadero y Lechero, Pakistán
Revisado por:
Jinyang Zhang, Universidad de Ciencia y Tecnología de Kunming, China Adelijiang Wusiman, Universidad Agrícola de Xinjiang, China
Derechos de autor © 2024 Duan, Xu, Wang, Liu, Wang, Liu, Zhang, Ma, Ma y Fan. Este es un artículo de acceso abierto distribuido bajo los términos de la Licencia Creative Commons Attribution License (CC BY).
*Correspondencia: Yunpeng Fan, ypfan@nwsuaf.edu.cn; Lin Ma, linma@nwafu.edu.cn
†Estos autores han contribuido igualmente a este trabajo
Renuncia: Todas las afirmaciones expresadas en este artículo son únicamente las de los autores y no representan necesariamente las de sus organizaciones afiliadas, ni las del editor, los editores y los revisores. Cualquier producto que pueda ser evaluado en este artículo o afirmación que pueda hacer su fabricante no está garantizado ni respaldado por el editor.
Date de alta y recibe nuestro 👉🏼 Diario Digital AXÓN INFORMAVET ONE HEALTH
Date de alta y recibe nuestro 👉🏼 Boletín Digital de Foro Agro Ganadero
Noticias animales de compañía
Noticias animales de producción
Trabajos técnicos animales de producción
Trabajos técnicos animales de compañía