Efecto de una reciente administración parenteral dexametasona y ketoprofeno en el diagnóstico inmunológico de tuberculosis en cabras

Efecto de una reciente administración parenteral dexametasona y ketoprofeno en el diagnóstico inmunológico de tuberculosis en cabras
 Javier Ortega1,2,
Javier Ortega1,2, Lucía de Juan1,2,
Lucía de Juan1,2, Iker A. Sevilla3,
Iker A. Sevilla3, Joseba M. Garrido3,
Joseba M. Garrido3, Álvaro Roy2,
Álvaro Roy2, Carlos Velasco2,
Carlos Velasco2, Beatriz Romero1,2,
Beatriz Romero1,2, Mercedes Domínguez4,
Mercedes Domínguez4, Bernat Pérez de Val5,
Bernat Pérez de Val5, Carolina Nebot6,
Carolina Nebot6, José Luis Sáez-Llorente7,
José Luis Sáez-Llorente7, Julio Álvarez1,2 y
Julio Álvarez1,2 y Javier Bezos1,2*
Javier Bezos1,2*- 1Departamento de Sanidad Animal, Facultad de Veterinaria, Universidad Complutense de Madrid, Madrid, España
- 2VISAVETCentro de Vigilancia de la Salud, Universidad Complutense de Madrid, Madrid, España
- 3Departamento de Salud Animal, NEIKER-Instituto Vasco de Investigación y Desarrollo Agrícola, Alianza Vasca de Investigación y Tecnología (BRTA), Derio, España
- 4Unidad de Inmunología Microbiana, Centro Nacional de Microbiología, Instituto de Investigación Carlos III, Madrid, España
- 5IRTA Centre de Recerca en Sanitat Animal (CReSA, IRTA-UAB), Universitat Autònoma de Barcelona, Barcelona, España
- 6Laboratorio de Higiene, Inspección y Control de Alimentos (LHICA), Facultad de Veterinaria, de Santiago de Compostela (Campus de Lugo), Lugo, España
- 7Ministerio de Agricultura, Pesca y Alimentación, Madrid, España
La tuberculosis caprina (TB) es una zoonosis causada por miembros del complejo Mycobacterium tuberculosis (MTBC). Los programas de erradicación de la tuberculosis Caprine se basan principalmente en las pruebas de tuberculina intradérmica y la vigilancia de los mataderos. Diferentes factores pueden afectar el rendimiento de las pruebas de diagnóstico de tuberculosis utilizadas en los rebaños caprinos y, por lo tanto, su capacidad para detectar animales infectados. El presente estudio evalúa el efecto de la administración fraudulenta de dos sustancias antiinflamatorias, la dexametasona y el ketoprofeno, en el rendimiento de las técnicas de diagnóstico de la tuberculosis utilizadas en cabras, así como la idoneidad de la cromatografía líquida de alto rendimiento (HPLC) para su detección en muestras de cabello. Los animales (n = 90) se distribuyeron en tres grupos: (1) un grupo tratado con dexametasona (n = 30); un segundo grupo tratado con ketoprofeno (n = 30); y un tercer grupo de control no tratado (n = 30). Tanto los grupos de dexametasona como de ketoprofeno fueron sometidos a inoculación intramuscular con las sustancias 48 horas después de la administración de derivados proteicos purificados bovinos y aviarios (PPD), es decir, 24 horas antes de que se interpretaran las pruebas. Todos los animales fueron sometidos a pruebas de tuberculina intradérmica únicas y comparativas (SIT y CIT, respectivamente), ensayo de liberación de interferón-gamma (IGRA) y ELISA P22. El número de reactores de prueba SIT fue significativamente menor en los grupos de dexametasona (p = 0,001) y ketoprofeno (p < 0,001) 72 horas después de la inoculación de PPD en bovino en comparación con el grupo de control. Se detectó un número significativamente mayor de reactores positivos para IGRA dentro del grupo de dexametasona (p = 0,016) 72 horas después de la administración de PPD en comparación con el grupo de control. La detección de dexametasona y ketoprofeno en muestras de cabello o suero fue un desafío cuando se usó HPLC, ya que estas sustancias no se detectaron en animales cuyo grosor de pliegue de la piel (SFT) se redujo, lo que podría ser un problema si se utilizan con fines fraudulentos. En conclusión, la administración parenteral de dexametasona o ketoprofeno 48 horas después de la administración de PPD puede reducir significativamente el aumento de SFT (mm) y, posteriormente, el número de reactores positivos para la prueba SIT.
Introducción
La tuberculosis de Caprine (TB) es una enfermedad zoonótica crónica causada por miembros del complejo Mycobacterium tuberculosis (MTBC), y principalmente la variante de Mycobacterium tuberculosis bovis (M. bovis) y la variante de M. tuberculosis caprae (M. caprae), siendo M. caprae el principal agente causal en España (1). Se sabe que la tuberculosis es una enfermedad multihuésped que afecta a una amplia gama de especies domésticas y silvestres y a los seres humanos (2-5). Además, la presencia de tuberculosis en el ganado conduce a pérdidas económicas debido a la reducción del rendimiento de leche y la fertilidad, las condenas en los mataderos, las restricciones a los mercados y el costo del diagnóstico (3-8). En el caso de España, cuya población caprina es una de las más grandes de la Unión Europea (UE) (9), ciertas regiones han implementado programas regionales de erradicación (10). Estos programas de erradicación de la tuberculosis caprina se basan principalmente en estrategias de prueba y sacrificio que utilizan las pruebas de tuberculina intradérmica únicas y comparativas (SIT y CIT, respectivamente) como piedra angular del diagnóstico ante mortem y la vigilancia en el matadero (6). El ensayo de liberación de interferón-gamma (IGRA), en casos específicos, también se ha utilizado para diagnosticar la tuberculosis en cabras (6, 10, 11). Además, el diagnóstico previo de tuberculosis en rumiantes se considera un requisito para los movimientos entre Estados miembros por la legislación europea actual (Reglamento UE 2016/429). Esta legislación también considera la IGRA como una prueba oficial para permitir el movimiento de animales dentro de la UE.
Ambas técnicas, que se basan en la respuesta inmune celular, son herramientas de diagnóstico valiosas, aunque no son perfectas en términos de sensibilidad y especificidad, y varios factores podrían afectar su rendimiento (11-15). Uno de estos factores es la administración de sustancias antiinflamatorias, que, según estudios anteriores en cabras (16) y ganado (17, 18), son capaces de modificar los resultados de las pruebas oficiales de diagnóstico de tuberculosis realizadas en rumiantes. Un estudio reciente en cabras demostró que una aplicación tópica reciente de un corticosteroide (betametasona) en el sitio de inyección de PPD puede reducir significativamente el número de reactores para las pruebas SIT/CIT (16). Este efecto no se observó en los resultados de IGRA y P22 ELISA, y este hallazgo se asoció con la aplicación tópica de betametasona (16). Sin embargo, estudios anteriores han demostrado que la administración parenteral de dexametasona reduce la producción de IFN-γ en el ganado infectado por la tuberculosis, lo que resulta en reactores falsos negativos para el IGRA (17, 18). Por lo tanto, estos resultados sugieren que la administración de corticosteroides puede interferir con el diagnóstico de tuberculosis en rumiantes de diferentes maneras dependiendo de la ruta de administración (16-18). La administración parenteral de sustancias antiinflamatorias podría usarse con fines fraudulentos con el fin de interferir con el diagnóstico de la tuberculosis al inhibir las reacciones inflamatorias locales (pruebas SIT/CIT) y sistémicas (IGRA) en cabras. Sin embargo, hasta el mejor conocimiento de los autores, ningún estudio previo ha evaluado el efecto de la administración parenteral de sustancias antiinflamatorias en el resultado de las pruebas de diagnóstico de tuberculosis en cabras. De hecho, no solo los corticosteroides, sino también otras sustancias antiinflamatorias podrían utilizarse para este propósito de acuerdo con la comunicación personal de los servicios veterinarios oficiales de España. En este contexto, en los últimos años, las autoridades de diferentes regiones de España han comenzado a investigar el uso fraudulento de diferentes sustancias administradas por vía parenteral con el fin de modificar el resultado de las pruebas oficiales de diagnóstico de tuberculosis en rumiantes (19). Además, es importante destacar las dificultades que implica demostrar este tipo de actividades fraudulentas debido a la gran variedad de sustancias y protocolos de administración que se pueden aplicar en rumiantes para modificar el resultado de las pruebas de diagnóstico de tuberculosis. El desarrollo y la evaluación de metodologías, con el fin de establecer protocolos eficaces para la detección de estas sustancias, son, por lo tanto, de suma importancia. Por lo tanto, el objetivo del presente estudio era determinar, por primera vez, si la administración parenteral de dexametasona o ketoprofeno 48 horas después de la administración de PPD interfiere con el diagnóstico de la tuberculosis caprina mediante pruebas intradérmicas, y si este protocolo también afecta a los resultados de otras técnicas de diagnóstico como las pruebas basadas en IGRA y También se desarrolló y aplicó un protocolo específico para la detección de dexametasona y ketoprofeno en muestras de suero y cabello con el fin de demostrar la presencia de estas sustancias en las cabras de los diferentes grupos experimentales.
Materiales y métodos
Diseño experimental
El estudio se llevó a cabo en una manada de cabras lecheras de la raza Guadarrama infectada con tuberculosis ubicada en el centro de España. Este rebato (n = 161) había sido confirmado previamente como infectado por tuberculosis mediante un cultivo bacteriológico (M. bovis SB0121). Los animales fueron sometidos a la prueba SIT, la prueba CIT, IGRA (en muestras de plasma) y P22 ELISA (en muestras de suero) 3 meses antes del inicio de este estudio y hubo una prevalencia aparente del 40,9% (IC del 95% 33.7-48,7), del 7,5% (IC del 95% 4.3–12.6), del 50,3% (IC del 95% de IC 42 Según estos resultados, esta rebato se consideraba una reba de alta prevalencia. Además, esta rebaza se había sometido a un programa de vacunación contra Mycobacterium avium subsp. paratuberculosis (MAP), utilizando la vacuna Gudair (CZ Vaccines, Porriño, España) en animales de 6 meses de edad. Las cabras se seleccionaron sobre la base de los resultados anteriores de las pruebas de tuberculosis utilizando la prueba SIT e IGRA en paralelo. Los animales (n = 90) se distribuyeron al azar en tres grupos experimentales: (1) tratados con dexametasona (n = 30); (2) tratados con ketoprofeno (n = 30) y (3) grupos de control (n = 30) (Figura 1). Todos los animales fueron sometidos a las pruebas SIT y CIT por medio de la inyección intradérmica de PPD bovinos y aviares (día 0), y se realizaron dos lecturas: una en el día 2 (48 h después de las inyecciones de PPD) y la lectura oficial en el día 3 (72 h después de las inyecciones de PPD). Justo después de la primera lectura, las dosis recomendadas (en un volumen final de 1,5 ml) de dexametasona (fosfato de sodio dexametasona 2 mg/ml, Cenmetasona, CENASIVA S.L., Reus, España) o ketoprofeno (Ketoprofeno 100 mg/ml, Ketink, Industrial Veterinaria S.A IGRA y P22 ELISA se realizaron utilizando plasma y suero, respectivamente, ambos obtenidos de muestras de sangre entera recogidas en los días 0 y 3 (Figura 1). Además, se recogieron muestras de cabello y suero en el día 3 (Figura 1) para detectar dexametasona y ketoprofeno mediante cromatografía líquida de alto rendimiento y espectrometría de masas (HPLC-MS). Se utilizaron cuchillas de afeitar para recoger quince muestras de pelo de los lados izquierdo y derecho del cuello y otras 15 de los lados izquierdo y derecho de la espalda de los animales de los grupos dexametasona, ketoprofeno y control. Se recogieron muestras de suero de todos los animales de cada grupo experimental. Además, se analizaron muestras de suero de 10 animales de cada grupo para el análisis del patrón de producción de citocinas/quimiocinas en los tres grupos experimentales.
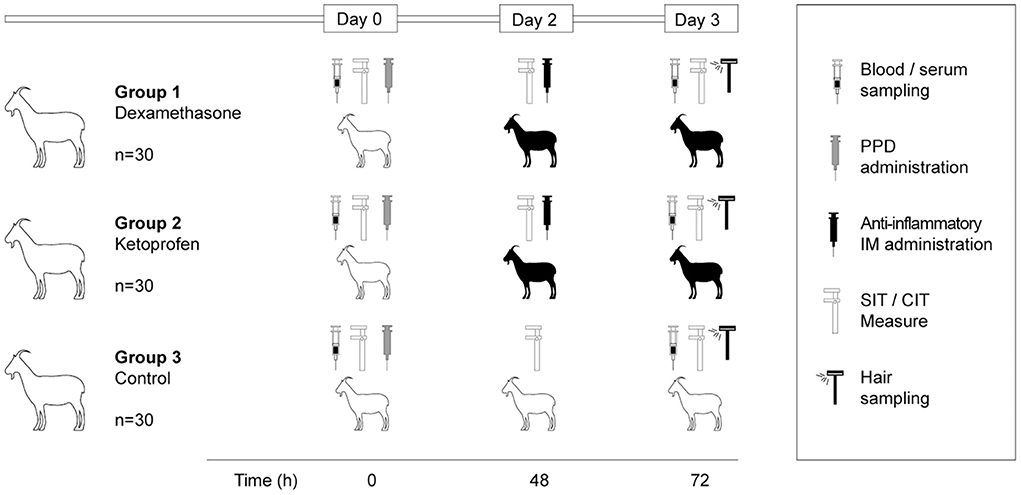 Figura 1. Resumen del diseño experimental. Las siluetas blancas representan cabras sin tratar y las siluetas de cabras negras representan cabras tratadas con dexametasona (0,06 mg/kg) o ketoprofeno (3 mg/kg).
Figura 1. Resumen del diseño experimental. Las siluetas blancas representan cabras sin tratar y las siluetas de cabras negras representan cabras tratadas con dexametasona (0,06 mg/kg) o ketoprofeno (3 mg/kg).
Todos los procedimientos de manipulación, prueba y muestreo fueron llevados a cabo por veterinarios cualificados de conformidad con la legislación europea (86/609/CEE) y española (RD 53/2013). Los procedimientos empleados en el estudio actual fueron aprobados de manera similar por un comité de ética institucional y ratificados por la autoridad local (PROEX11/18; Comunidad de Madrid).
Pruebas de tuberculina intradérmica
Los animales fueron sometidos a pruebas SIT y CIT, que se llevaron a cabo inoculando por vía intradérmo con 0,1 ml de PPD bovino y aviar (CZ Vaccines, Porriño, España) utilizando una jeringa Dermojet (AkraDermojet, Francia) en el lado izquierdo-medial y derecho-medial del cuello, respectivamente. La inoculación intradérmica de PPD se llevó a cabo el día 0 en todos los grupos y las reacciones fueron interpretadas 48 h (día 2) y 72 h (día 3) más tarde por el mismo veterinario (Figura 1).Las pruebas SIT y CIT se realizaron de acuerdo con el protocolo publicado por el Laboratorio de Referencia de la Unión Europea (EU-RL) para la tuberculosis bovina siguiendo el Reglamento UE 2016/429, el Reglamento Delegado de la Comisión UE 2020/688 y el Real Decreto 2611/1996. La interpretación de los resultados se llevó a cabo como se describió anteriormente (20).
Ensayo de liberación de interferón-gamma
Se recogieron muestras de sangre de la vena yugular mediante punción venosa utilizando tubos evacuados (BD Vacutainer Becton, Dickinson and Company, Franklin Lakes, EE. UU.) con heparina de litio en los días 0 y 3 para la detección de la producción de IFN-γ (Figura 1). En el laboratorio, las muestras de sangre se estimularon con PPD bovinos y aviares (CZ Vaccines, Porriño, España) a una concentración final de 20 μg/ml cada una y se procesaron como se describe en otra parte (11). La producción de IFN-γ en plasma se midió utilizando un kit comercial (Bovigam TB, Thermo Fisher Scientific, Waltham, EE. UU.) siguiendo las instrucciones del fabricante, y los resultados se interpretaron como se describió anteriormente (21).
P22 ELISA
Se detectaron anticuerpos específicos contra el MTBC utilizando un ensayo interno de inmunoabsorción indirecta ligada a enzimas basada en el complejo multiproteínas P22 (P22 ELISA) obtenido por la inmunopurificación de PPD bovina (CZ Vaccines, Porriño, España). Los PPD bovinos y aviares utilizados tradicionalmente para el diagnóstico de la tuberculosis en rumiantes contienen 456 y 1019 proteínas, respectivamente, reducidas a 118 en P22. Hay 143 proteínas que están presentes tanto en los PPD bovinos como aviales, potencialmente responsables de la reactividad cruzada, que se reducen a 43 en el complejo P22, lo que explica la mayor especificidad obtenida con P22 (22). Se recogieron muestras de sangre de la vena yugular utilizando tubos de suero de plástico (BBD Vacutainer Becton, Dickinson and Company, Franklin Lakes, EE. UU.) en los días 0 y 3 (Figura 1). El ELISA se realizó en estas muestras de suero como se describió anteriormente (23). Los resultados de la muestra de suero se expresaron como un porcentaje de ELISA (E%), calculado de acuerdo con la siguiente fórmula:
Muestra E% = [mué media de OD / (2 x media de control negativo OD)] × 100
Las muestras de suero con valores de E% >150 o 100 se consideraron positivas para las interpretaciones estándar y severas, respectivamente, como se describe en otra parte (20, 23).
Cromado líquido de alto rendimiento-espectrometría de masas
La dexametasona (pureza > 98 %), el ketoprofeno (pureza > 99 %), el ácido fórmico (pureza > 99 % para el análisis) y el acetato de sodio (pureza > 98 % para el análisis) se compraron a Sigma-Aldrich (St. Louis, MO, EE. UU.), mientras que los diferentes disolventes orgánicos (grado HPL) se obtuvieron de Merk (Darmstadt, Alemania). El agua empleada en la fase móvil y para la solución de sodio 1M se obtuvo del agua Milli-Q del sistema Millipore (Bedford, MA, EE. UU.). Nitrógeno generado por un generador de nitrógeno obtenido de Peak Scientific Instruments, Ltd. (Chicago, IL, EE. UU.) se empleó para la detección de EM y la evaporación de disolventes. Las soluciones de stock de dexametasona (0,8 mg/ml) y ketoprofeno (0,8 mg/ml) se prepararon en metanol (Merk, Darmstadt, Alemania) y se almacenaron en la oscuridad a -18 °C. Estas soluciones de stock de cada sustancia se mezclaron varias veces con metanol para obtener una mezcla de solución estándar de trabajo de los medicamentos seleccionados a 1 y 0,1 μg/ml.
Las muestras de suero y cabello de los grupos dexametasona y ketoprofeno se analizaron en un sistema LC-MS/MS (Bruker Bremen, Alemania). Los analitos se separaron en una columna cromatográfica Acquity UPLC BEH C18 (2,1 × 100 mm, 1,7 μm) obtenida de Waters (Milford, EE. UU.) para la detección de dexametasona y en una columna Intensity Solo HPLC C18 (2,0 × 100 mm, 2 μm) para el keto La separación de los analitos se logró para ambas sustancias en una mezcla de fase A de modo gradiente (0,1% de agua acidificada con ácido fórmico) y una mezcla de fase B (metanol 0,1 % acidificado con ácido fórmico para ketoprofeno y acetonitrilo 0,1% acidificado con ácido fórmico para dexametasona).
HPLC-MS en muestras de suero
Quinicientos μl de muestra de suero se transfirieron a tubos desechables de Eppendorf de 2 ml, y se añadieron 1,5 ml de acetonitrilo (ketoprofeno) y 800 μl de acetonitrilo (dexametasona) (Merk, Darmstadt, Alemania). Las muestras de suero de cabra sin analito se aumentaron con ketoprofeno a 20, 50, 100, 150 y 300 ng/ml o con dexametasona a 1, 5, 10, 25, 50 y 100 ng/ml para su cuantificación. El límite de detección fue de 10 ng/muestra para la detección de dexametasona y ketoprofeno en muestras de suero.
HPLC-MS en muestras de cabello
El ketoprofeno y la dexametasona se extrajeron como se describió anteriormente para la betametasona (16). Luego se inyectaron quince μl del extracto en la columna de HPLC para su análisis por medio de HPLC-MS/MS. Cada día de análisis, se prepararon curvas de calibración con 5 ml de acetonitrilo en tubos Falcon de 15 ml, a los que se añadieron diferentes cantidades de ketoprofeno para obtener una concentración final de 0,1, 0,2, 2, 5 y 10 ng/ml. En el caso de la dexametasona, con el fin de cuantificar el producto farmacéutico, cada día de análisis, las soluciones tampón se aumentaron con dexametasona a concentraciones finales de 0,1, 0,5, 1, 20, 40 y 80 ng/ml, se aplicó el protocolo de extracción y se registró el área máxima. Al igual que las muestras de suero, el límite de detección fue de 10 ng/muestra de ambas sustancias en las muestras de cabello.
Detección de patrones de producción de citocinas/quimiocinas
Se aplicó una matriz de citoquinas/quimiocinas basada en Luminex que detecta 15 citocinas y quimiocinas a las muestras de suero recogidas en el día 3 de 10 cabras seleccionadas al azar de cada grupo. Las citocinas/quequiminas presentes en las muestras de suero se cuantificaron utilizando un kit de ensayo múltiplex bovino (MILLIPLEX MAP Kit Bovine Cytokine/Chemokine Magnetic Bead Panel 1, 96-Well Plate Assay, Merck Millipore, Reino Unido). Las muestras de suero se centrifugaron a 10.000 g durante 5 minutos. El suero se diluyó posteriormente (1:2 en el tampón de ensayo proporcionado en el kit). Luego se analizaron veinticinco μl de cada mezcla (suero y tampón) por duplicado en Bio-Plex® 200 (Bio-Rad Laboratories, S.A., Alcobendas, España) para determinar la cantidad (expresada en pg/ml) de IFN-γ, IL-1α, IL-1β, IL-6, IL Este resultado fue la media de dos análisis de cada muestra y se multiplicó por el factor de dilución.
Análisis estadístico
Los análisis de datos se realizaron utilizando SPSS Statistics 25 (IBM, Nueva York, NY, EE. UU.) y el software R versión 4.0.5 (24) y se interpretaron utilizando un valor p de 0,05 para determinar la significación estadística. Los intervalos de confianza del 95% de Wilson (IC del 95%) se calcularon para el porcentaje de reactores a las diferentes técnicas de diagnóstico utilizando la versión 11.6 de WinPepi (25). La comparación de las proporciones de reactores de prueba dentro de un grupo determinado entre los días 0 y 3 (IGRA y P22 ELISA) y 2 y 3 (pruebas de tuberculina intradérmica) se realizó utilizando la prueba de McNemar. La comparación de las proporciones de reactores de prueba entre los diferentes grupos en un punto de muestreo dado se realizó utilizando un modelo de regresión logística con el resultado de la prueba (positivo/negativo) como variable de resultado y el grupo experimental (dexametasona/cetoprofeno/control como categoría de referencia) como predictor. Las diferencias cuantitativas en el aumento del grosor del pliegue de la piel (SFT), la densidad óptica (OD) y el E% entre los días 0, 2 y 3 se analizaron mediante la prueba de rango firmado de Wilcoxon. Los valores cuantitativos, como el aumento de la SFT (expresado en mm), los niveles de IFN-γ (OD), el porcentaje de ELISA (E%) y la cantidad de citocinas/quequiminas (expresadas en pg/ml) en las cabras en los diferentes grupos en un punto de muestreo dado, se compararon utilizando la prueba de Con respecto a los niveles de IFN-γ, se utilizó el coeficiente de correlación de rango (rs) de Spearman para evaluar la relación entre las OD en el plasma y el pg/ml de citocina observada en las muestras de suero. El análisis de agrupación de mapas de calor de citocinas/quequiminas en muestras de suero se llevó a cabo utilizando una herramienta en línea (Heatmapper, 164www.heatmapper.ca) (26).
Resultados
Pruebas de diagnóstico basadas en células
El número y el porcentaje de reactores positivos obtenidos utilizando las diferentes pruebas de diagnóstico se resumen en la Tabla 1. Mientras que en el día 2 (antes de la inoculación de los medicamentos) no hubo una asociación significativa (p = 0,27) entre el grupo y el resultado de la prueba, la probabilidad de encontrar un reactor de prueba SIT fue significativamente menor (p < 0,001) en los grupos de dexametasona (OR = 0,11, IC del 95% 0,02-40) y ketoprofeno Este hallazgo se debió a un menor aumento de la SFT en los grupos dexametasona (p = 0,005) y ketoprofeno (p < 0,001) en comparación con el grupo de control (Figura 2A).
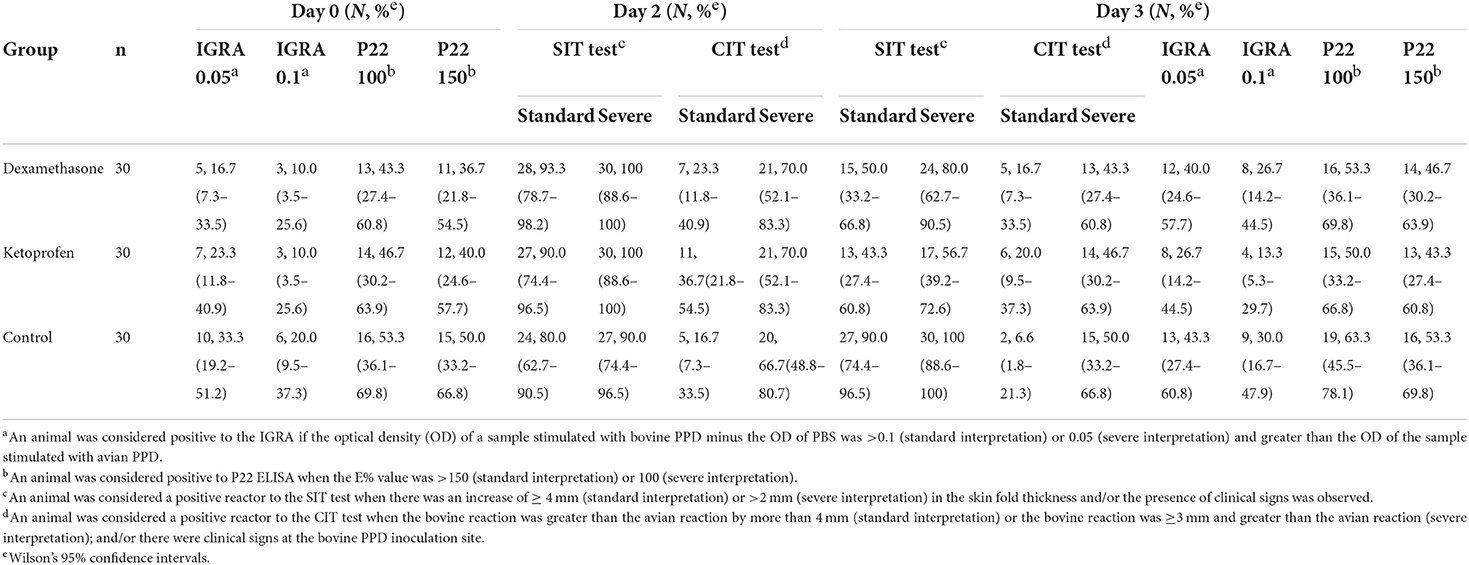 Tabla 1. Número de reactores positivos (incluido el porcentaje y el IC de Wilson al 95%) para las pruebas de diagnóstico en cada grupo experimental.
Tabla 1. Número de reactores positivos (incluido el porcentaje y el IC de Wilson al 95%) para las pruebas de diagnóstico en cada grupo experimental.
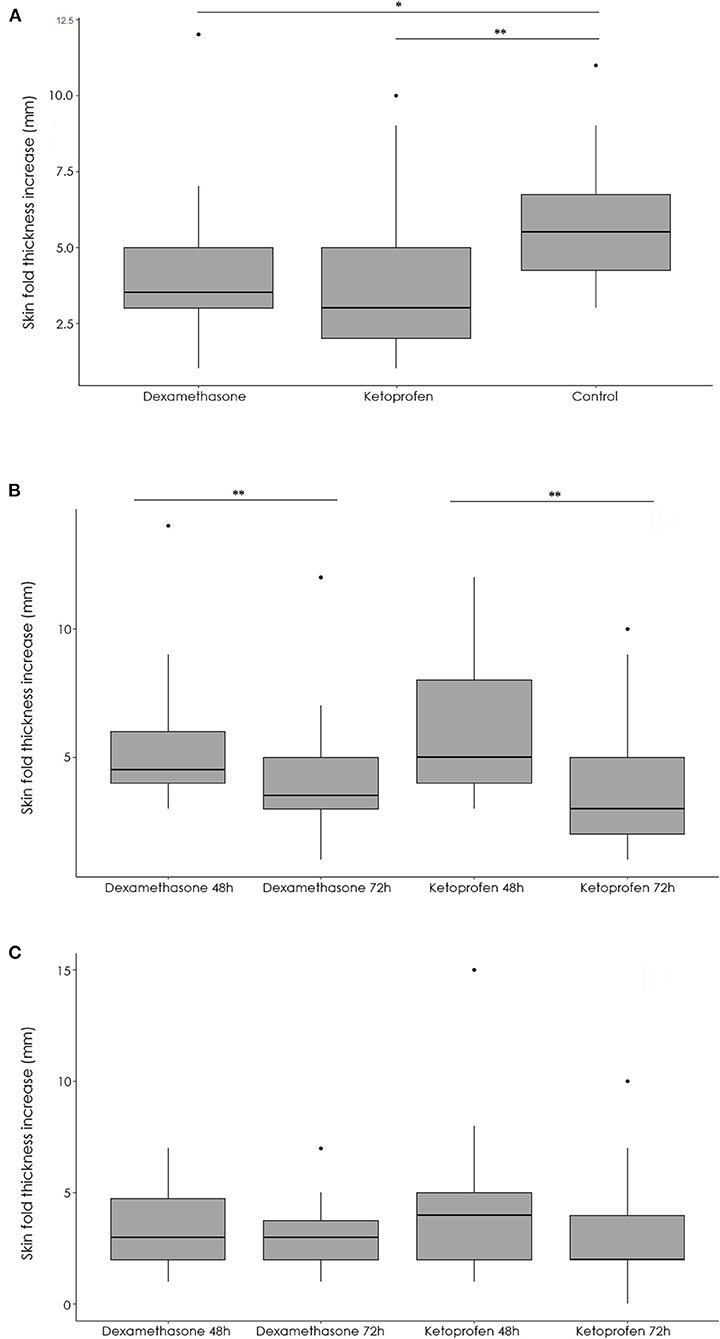 Figura 2. Resumen de las diferencias entre el grosor medio del pliegue de la piel (mm) después de la inyección de PPD en bovino en los grupos dexametasona, ketoprofeno y control en el día 3(A), y después de la inyección de PPD en bovino (B) y aviar (C) en los grupos dexametasona y ketoprofeno
Figura 2. Resumen de las diferencias entre el grosor medio del pliegue de la piel (mm) después de la inyección de PPD en bovino en los grupos dexametasona, ketoprofeno y control en el día 3(A), y después de la inyección de PPD en bovino (B) y aviar (C) en los grupos dexametasona y ketoprofeno
Cuando se compararon las medidas obtenidas en el día 2 (48 h, tiempo de aplicación) y 3 (72 h, tiempo de interpretación de la prueba SIT) para cada grupo experimental, la SFT en el sitio de inoculación en bovino se redujo tanto en los grupos de dexametasona como en ketoprofeno (Figura 2B). Esta reducción en el SFT condujo a una disminución significativa (p < 0,001) tanto en el número de reactores en el día 3 respetados con respecto a los observados en el día 2 utilizando la interpretación estándar de la prueba SIT (Tabla 1, Figura 3). Curiosamente, las reducciones en el SFT en el sitio de inoculación de PPD aviar no fueron significativas en los grupos de dexametasona (p = 0,085) y ketoprofeno (p = 0,05) entre el día 2 y el día 3 (Figura 2C).
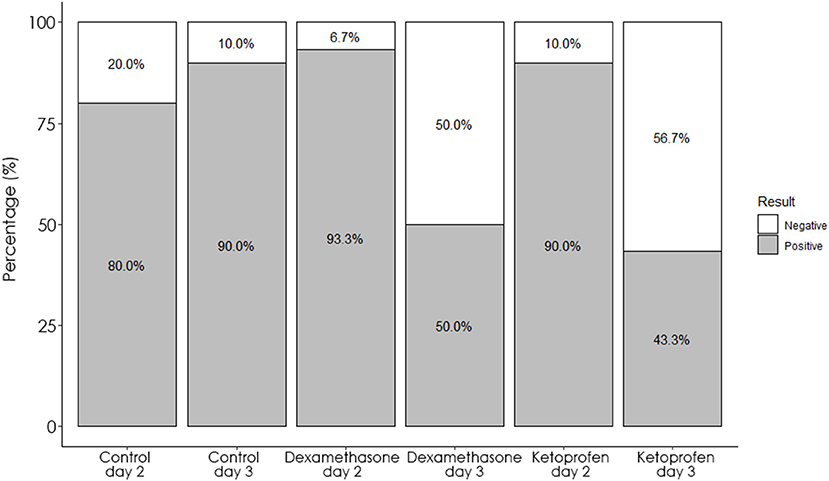 Figura 3. Porcentaje de animales que fueron positivos (gris) y negativos (blanco) a la prueba SIT en los grupos de dexametasona, ketoprofeno y control en el día 2 y el día 3.
Figura 3. Porcentaje de animales que fueron positivos (gris) y negativos (blanco) a la prueba SIT en los grupos de dexametasona, ketoprofeno y control en el día 2 y el día 3.
Por el contrario, se observó un aumento significativo en el SFT en el sitio de inoculación de PPD bovino (p = 0,002) y aviar (p = 0,01) entre el día 2 y el día 3 en el grupo de control. Además, el aumento de la SFT fue significativamente mayor en el sitio de inoculación de PPD en bovino en comparación con el sitio de inoculación de PPD de aves en los grupos dexametasona (p = 0,01) y ketoprofeno (p = 0,006). En esta línea, la reducción en el número de reactores a la prueba CIT no fue significativa en los grupos de dexametasona (p = 0,50) y ketoprofeno (p = 0,06) entre el día 2 y el día 3 cuando se utiliza la interpretación estándar de la prueba CIT (Tabla 1). El aumento en el SFT fue significativamente (p < 0,001) más alto en el sitio de inoculación de PPD en bovino en comparación con las reacciones observadas en el sitio de inoculación de PPD de aves en los reactores a la prueba de CIT cuando se utilizó la interpretación estándar 48 horas después de la administración de PPD en los tres grupos.
La inyección intramuscular de dexametasona y ketoprofeno no se asoció con los resultados de IGRA, ya que no se observó una asociación significativa (p = 0,35) entre el grupo y el resultado de la prueba (dexametasona: OR = 0,87, IC del 95% 0,31-4,44; ketoprofeno: OR = 0,47, Del mismo modo, las diferencias entre los resultados de IFN-γ (OD) en el día 3 en los grupos no fueron significativas (p = 0,47, Figura 4A). Se detectó un número significativamente mayor de reactores positivos para IGRA (p = 0,01) dentro del grupo de dexametasona cuando la prueba se realizó en el día 3 en comparación con el día 0 (Tabla 1). Con respecto a los resultados cuantitativos, se observó un aumento significativo (p = 0,02) en las medidas de IFN-γ entre el día 0 y el día 3 en el grupo de dexametasona. Sin embargo, no se observaron diferencias significativas en los resultados de IGRA (OD) entre el día 0 y el día 3 en los grupos de control (p = 0,58) y ketoprofeno (p = 0,06).
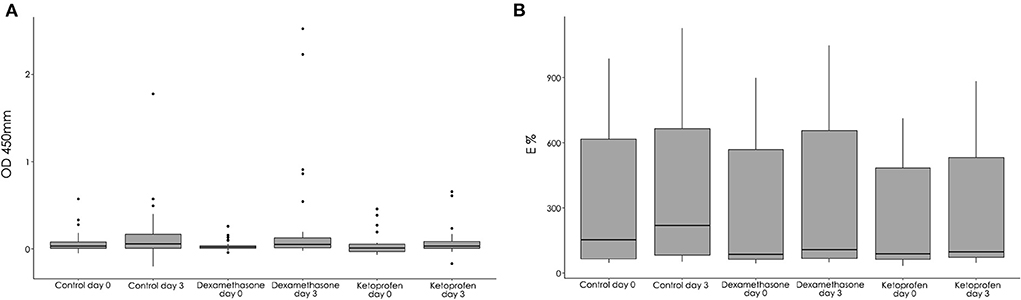 Figura 4. Valores del ensayo de liberación gamma de interferón (IGRA) expresados como densidad óptica (OD) en los grupos de dexametasona, ketoprofeno y control en el día 0 y el día 3 (A) y valores de ELISA P22 expresados como porcentaje de ELISA (E%) en los grupos dexametasona, ketoprofeno y control en el día
Figura 4. Valores del ensayo de liberación gamma de interferón (IGRA) expresados como densidad óptica (OD) en los grupos de dexametasona, ketoprofeno y control en el día 0 y el día 3 (A) y valores de ELISA P22 expresados como porcentaje de ELISA (E%) en los grupos dexametasona, ketoprofeno y control en el día
Prueba de diagnóstico basada en anticuerpos
La reciente administración intramuscular de dexametasona o ketoprofeno no se asoció con el resultado del ELISA P22, ya que las diferencias entre los grupos en términos cuantitativos (E%) y cualitativos (reactores positivos) no fueron significativas en el día 3 (p = 0,52 y p = 0,55, respectivamente). A este respecto, se observó un aumento significativo en el E% entre el día 0 y el día 3 en los grupos de dexametasona (p < 0,001), ketoprofeno (p = 0,001) y control (p < 0,001) (Figura 4B). Sin embargo, este aumento significativo en el E% no condujo a un aumento significativo en el número de cabras positivas entre el día 0 y el día 3 utilizando el estándar (p = 0,25, p = 1 y p = 1 en los grupos dexametasona, ketoprofeno y control, respectivamente) o una interpretación severa (p = 0,25, p = 1 y p = 0,25
Detección de patrones de producción de citocinas/quimiocinas
Se observó un patrón similar para las 15 citocinas y quimiocinas medidas en el día 3 (Figura 5). No se observaron diferencias significativas (p > 0,05) entre los diferentes grupos en términos de la cantidad (p/ml) de cada citocina/quimiocina en las muestras de suero. Doce de las quince citocinas analizadas se detectaron en todos los animales, independientemente del grupo. Sin embargo, se detectó IL-1β en 9 de cada 30 cabras, mientras que IL-17A y MIP-1β se detectaron en 16 animales. Sin embargo, esta falta de detección no se asoció con un grupo específico. Por el contrario, se observaron altos niveles de IL-8, IP-10 y TNFα en muestras de suero tomadas de animales de todos los grupos (Figura 5), lo que sugiere una respuesta proinflamatoria basal más fuerte a la infección por tuberculosis en estos animales, independientemente del grupo. Finalmente, la correlación (coeficiente de correlación del rango de Spearman) entre la cantidad de IFN-γ en las muestras de plasma observadas después de la estimulación de PPD bovina (OD) y los niveles de esta citocina en las muestras de suero analizadas utilizando el ensayo múltiplex fue pobre (rs = 0,215).
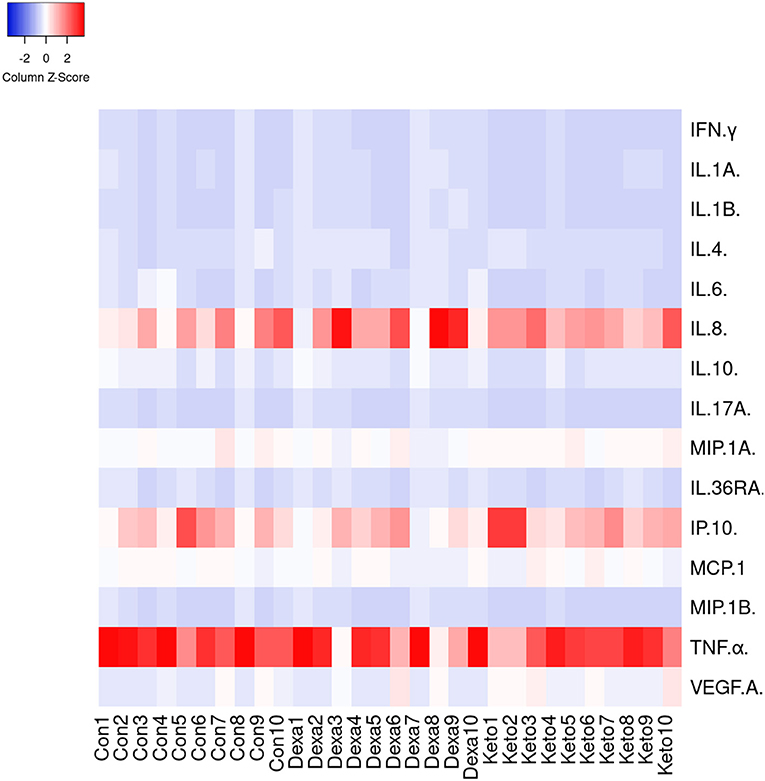 Figura 5. Mapa de calor del análisis de agrupación para diferentes citocinas y quimiocinas analizadas en muestras de suero recogidas en el día 3 de 10 cabras seleccionadas al azar de cada grupo (26).
Figura 5. Mapa de calor del análisis de agrupación para diferentes citocinas y quimiocinas analizadas en muestras de suero recogidas en el día 3 de 10 cabras seleccionadas al azar de cada grupo (26).
Detección dexametasona y ketoprofeno por HPLC
La presencia de residuos de dexametasona y ketoprofeno en las muestras de cabello y suero recogidas en el día 3 no se detectó cuando se empleó el HPLC-MS. Se observó una cantidad mínima de residuos de estas sustancias en las muestras de pelo de solo cuatro animales del grupo de dexametasona. Sin embargo, la cantidad detectada estaba muy por debajo del límite que se suele aplicar para el análisis oficial (10 ng/ml), que oscilaba entre 0,85 y 1,4 ng/muestra.
Discusión
La administración parenteral de dexametasona o ketoprofeno 48 horas después de la inoculación de PPD en estos grupos experimentales redujo significativamente el aumento de SFT en comparación con el grupo de control. Esta reducción, por lo tanto, llevó a un aumento de los resultados falsos negativos en las pruebas intradérmicas. A este respecto, varios estudios anteriores han evidenciado el efecto de diferentes sustancias antiinflamatorias en la respuesta inmunológica en el ganado (17, 18, 27-29). Algunos de estos estudios han evaluado el efecto de la dexametasona en las técnicas de diagnóstico de tuberculosis en el ganado, como la prueba de tuberculina intradérmica (17) y la IGRA (17, 18). Otros estudios anteriores han evaluado el efecto in vitro de la dexametasona, el meloxicam o la flunixina meglumina en diferentes poblaciones celulares en el ganado (27-29). Sin embargo, a lo que saben los autores, este es el primer estudio que informa sobre el efecto de la administración de corticosteroides parenterales recientes y sustancias antiinflamatorias no esteroideas en diferentes técnicas de diagnóstico antemortem TB utilizadas en cabras. En este estudio hemos demostrado la capacidad de la dexametasona y el ketoprofeno administrados recientemente para alterar el diagnóstico de tuberculosis caprina al reducir considerablemente el número de reactores para la prueba SIT. Nuestros resultados están respaldados por un estudio previo de Doherty y colaboradores en el que se observó una reducción significativa de la SFT en el ganado infectado por TB tratado con dexametasona en comparación con el ganado de control no tratado (17). La principal diferencia entre el mencionado estudio con el ganado y nuestro experimento fue la estrategia de administración empleada. La administración parenteral de dexametasona o ketoprofeno 48 horas después de la administración de PPD demostró el uso potencial de estas sustancias con fines fraudulentos. En este sentido, las autoridades de diferentes regiones de España han comenzado a investigar la posible administración parenteral con fines fraudulentos utilizando diferentes sustancias, como sustancias antiinflamatorias, en los últimos años (19). Hay una gran variedad de sustancias y protocolos de administración que se pueden aplicar en rumiantes con el fin de modificar los resultados de las pruebas de diagnóstico de la tuberculosis y la falta de conocimiento de su efecto en las técnicas in vitro. Hasta la fecha, no hay evidencia para recomendar IGRA o pruebas de diagnóstico basadas en la respuesta humoral para evitar las interferencias causadas por actividades fraudulentas en las pruebas intradérmicas. Recientemente, IGRA se incluyó como prueba oficial para el diagnóstico de animales caprinos en el contexto de la Nueva Ley de Sanidad Animal (Reglamento 2016/429) y, por lo tanto, sería valioso evaluar el efecto de diferentes estrategias fraudulentas en los resultados de IGRA en cabras.
Por lo tanto, la actividad fraudulenta evaluada en el presente estudio podría dirigirse a animales específicos (aquellos que muestran reacciones evidentes a las 24-48 h) en lugar de todos los animales probados. Es necesario destacar que en nuestro estudio, el aumento de la SFT fue aún menor en el sitio de inoculación de PPD en bovino en comparación con el sitio de inoculación de PPD aviar, probablemente como resultado de la administración de ketoprofeno y dexametasona en el mismo lado del cuello que el PPD bovino. De acuerdo con estos hallazgos, el sitio de inoculación de dexametasona o ketoprofeno afectó a los resultados de la prueba SIT, ya que la disminución significativa de la SFT se observó solo en el sitio de inoculación de PPD en bovino (lado izquierdo-medial del cuello en nuestro estudio). Por lo tanto, esto podría explicar la reducción significativa de los reactores a la prueba SIT en el presente estudio. Sin embargo, la administración parenteral de dexametasona o ketoprofeno no condujo a una reducción significativa en el número de reactores para la prueba de CIT, probablemente debido a la SFT significativamente mayor en el sitio de inoculación de PPD en bovino en comparación con los observados en el sitio de inoculación de PPD aviar en los grupos de dexametasona Este hecho y la reducción de la SFT observada en el sitio de inoculación de PPD aviar en ciertos animales podrían explicar la falta de una reducción significativa en los reactores para la prueba de CIT en todos los grupos.
Con respecto al efecto que la inoculación intramuscular de sustancias antiinflamatorias tuvo en los resultados de IGRA obtenidos en animales tratados con medicamentos antiinflamatorios, estudios anteriores han demostrado que la administración intramuscular de dexametasona redujo los niveles de IFN-γ observados en el ganado infectado por tuberculosis (17, 18). Sin embargo, en las condiciones de nuestro estudio, la inoculación intramuscular de dexametasona o ketoprofeno no condujo a un efecto significativo en el número de animales que dieron positivo a IGRA, ya que las diferencias en el número de reactores observados en los grupos de dexametasona o ketoprofeno y el grupo de control no fueron significativas, probablemente debido El aumento en los valores cuantitativos (OD) y, posteriormente, el número de reactores de IGRA que se observaron se deben probablemente a un efecto de refuerzo asociado con la reciente administración anterior de PPD en los grupos dexametasona y ketoprofeno. Estos resultados están de acuerdo con un estudio anterior en cabras infectadas por TB que demostró que una inoculación reciente de PPD anterior tuvo un efecto significativo en los resultados de IGRA al aumentar el número de reactores cuando se recogió sangre 3 días después de la prueba intradérmica (16). Sin embargo, este efecto no se observó en el grupo de control, y probablemente se asocie con el alto número de reactores a IGRA en el día 0 en el grupo de control en comparación con el grupo de dexametasona. Otra posible razón que podría explicar este hallazgo podría ser la posología utilizada: en el estudio con ganado, se recolectó sangre de ambos grupos 72 y 36 h después de la administración de dexametasona (0,2 mg/kg), respectivamente, mientras que en nuestro estudio, la dexametasona (0,06 mg/kg) se aplicó 24 horas antes de la extracción de sangre (17). La dosis utilizada en nuestro estudio fue considerablemente más baja que la utilizada en el ganado, lo que sugiere la posibilidad de que dosis más altas pudieran tener un efecto similar en las cabras que las observadas en el ganado (17, 18). Con respecto a la ausencia de efecto del ketoprofeno en el resultado de IGRA, un estudio in vitro anterior mostró que las sustancias antiinflamatorias no esteroideas como el meloxicam no redujeron el IFN-γ producido por los linfocitos en el ganado, a diferencia de la dexametasona (29). A este respecto, es necesario destacar que el estudio in vitro, que mostró una evaluación de los efectos de la dexametasona y el meloxicam en los linfocitos, empleó grupos de muestras incubadas en ausencia (controles) o presencia de dexametasona o meloxicam, y esta evaluación se realizó in vivo en nuestro estudio (29). En consecuencia, nuestros resultados mostraron la falta de efecto del ketoprofeno en los resultados de IGRA en cabras, al menos en las condiciones de nuestro estudio.
Las diferencias entre el número de positivos a P22 ELISA en el grupo de dexametasona y en el grupo de control y entre el grupo de ketoprofeno y el grupo de control no fueron significativas en el presente estudio, independientemente del corte empleado (100 o 150 %E), probablemente debido a la administración única realizada 24 horas antes de la toma de muestras de estos animales. Por lo tanto, una inoculación parenteral reciente de dexametasona o ketoprofeno no tuvo un efecto inmunosupresor en la respuesta humoral. De hecho, se detectó un aumento significativo en los niveles de Ab, expresado como E%, al usar P22 ELISA en los tres grupos de estudio 3 días después de la administración del PPD. Este efecto potenciador se ha descrito anteriormente y se utiliza en rumiantes domésticos para aumentar la sensibilidad de las pruebas cutáneas en circunstancias específicas (30-35). Aunque los títulos de Ab y, por lo tanto, la sensibilidad del uso en serie de las pruebas serológicas se maximizan entre 15 o 30 días después de la inoculación intradérmica de PPD, el aumento de los títulos de Ab 3 días después de la prueba cutánea que describimos en nuestro estudio se ha observado previamente en cabras (36).
La reciente administración parenteral de la dexametasona y el ketoprofeno no afectó significativamente el perfil de citoquina/quimiocina evaluado, ya que las diferencias en los niveles de cualquier citocina/quimiocina observada en muestras de suero obtenidas de los grupos dexametasona y ketoprofeno no fueron significativas con respecto a las observadas en animales del grupo Nuestro estudio mostró dos citocinas y una quimiocina, que se detectaron con poca frecuencia y a bajas concentraciones en las muestras de suero, independientemente del grupo: IL-1β, MIP-1β e IL-17A. Estos resultados son similares a los observados en un estudio anterior en ganado, en el que se observaron bajas concentraciones de IL-1β e IL-17A en muestras de líquido intersticial y plasma (37). Sin embargo, estos resultados fueron inesperados, ya que ambas citocinas se han descrito previamente como biomarcadores de la infección por M. bovis (38, 39). Con respecto a la MIP-1β, la baja concentración observada es contraria a la de un estudio anterior en ganado en el que se observaron altos niveles plasmáticos (37) y podría estar asociada con diferencias entre el ganado y la cabra. En nuestro estudio, se detectaron IL-8, IP-10 y TNFα a altas concentraciones en muestras de suero. A este respecto, estudios anteriores han demostrado el uso potencial de IL-8 (40), IP-10 (41-43) y TNFα (39, 44) como biomarcadores de la infección por tuberculosis en el ganado. Es necesario destacar que los bajos niveles de IL-1β, MIP-1β e IL-17A y los altos niveles de IL-8, IP-10 y TNFα no se asociaron con un grupo específico y se observaron en todas las cabras (reactores) aparentemente infectadas con M. bovis. Las concentraciones más altas de IL-8, IP-10 y TNFα (respuesta proinflamatoria) en comparación con IL-4 o IL-10 (respuesta antiinflamatoria) sugirieron una inducción de la respuesta proinflamatoria debido a la infección en estos animales infectados por la tuberculosis, independientemente del grupo de estudio. Con respecto a IFN-γ, la mala correlación observada entre los resultados de IGRA (OD) y los niveles de esta citocina en las muestras de suero probablemente se asoció con la estimulación previa de PPD de muestras de sangre entera durante la realización de IGRA.
Estudios anteriores han demostrado que se puede aplicar una gran variedad de sustancias y protocolos de administración en rumiantes para modificar los resultados de las pruebas de diagnóstico de tuberculosis (16-18). Esto complica la detección de estas actividades fraudulentas. Por lo tanto, el desarrollo y la estandarización de herramientas para detectar estas sustancias es esencial para prevenir aquellas actividades que afectan a los avances en los programas de erradicación de la tuberculosis en rumiantes. A este respecto, es importante destacar que el método de administración afecta a la detección de sustancias utilizadas con fines fraudulentos, como se muestra en un estudio anterior (16). Nuestro estudio demuestra que ciertos medicamentos antiinflamatorios, como la dexametasona y el ketoprofeno, no se pueden detectar en muestras de cabello y suero cuando se utiliza la técnica de HPLC si se administran por vía intramuscular. Sin embargo, la detección de betametasona aplicada tópicamente en el sitio de inyección de PPD utilizando la técnica de HPLC en muestras de cabello recogidas en el sitio de inoculación de PPD ha logrado un excelente resultado anteriormente (16). Usando estos resultados anteriores como base, decidimos usar muestras de cabello en este estudio, ya que esta muestra es fácil de recoger mediante el uso de un método ante mortem y no invasivo. Además, el tiempo de aplicación fue el mismo en ambos estudios: 48 horas después de la inoculación de PPD (16). La detección de sustancias antiinflamatorias, por lo tanto, depende del método de administración (tópico vs. parenteral), y es útil en el caso de la administración tópica. Sin embargo, la reducción significativa en el aumento de la SFT observada en los grupos de dexametasona y ketoprofeno condujo a una reducción en el número de reactores a la prueba intradérmica y, por lo tanto, a un aumento de los falsos negativos en las pruebas intradérmicas. En este contexto, es necesario destacar que la falta de detección de estas sustancias no implica la ausencia de su efecto en los resultados de la técnica de diagnóstico de la tuberculosis caprina, ya que la reducción del aumento de SFT se observó en animales en cuyas muestras de pelo o suero no se detectaron las sustancias.
En conclusión, el presente estudio ha evaluado, por primera vez, el efecto de la reciente administración intramuscular de dexametasona y ketoprofeno en los resultados de las pruebas SIT y CIT, IGRA y P22 ELISA obtenidas en cabras. Nuestro estudio demuestra que los corticosteroides y las sustancias antiinflamatorias no esteroideas pueden modificar los resultados de la prueba SIT en cabras cuando se inoculan 48 horas después de la administración de PPD. Sin embargo, esta reciente administración parenteral de las sustancias antiinflamatorias no afectó significativamente los resultados de las técnicas de diagnóstico de la tuberculosis caprina in vitro. La detección de estas sustancias mediante el uso de HPLC en muestras de suero o cabello fue un desafío, lo que podría ser un problema si se usaran de forma fraudulenta, ya que la realización de estas actividades fraudulentas es difícil de demostrar. Por lo tanto, se requieren estudios adicionales para desarrollar y optimizar un protocolo eficaz para detectar estas sustancias antiinflamatorias en diferentes muestras.
Declaración de disponibilidad de datos
Las contribuciones originales presentadas en el estudio se incluyen en el artículo, se pueden dirigir más consultas al autor correspondiente.
Declaración de ética
El estudio en animales fue revisado y aprobado por todos los procedimientos de manipulación, prueba y muestreo llevados a cabo por veterinarios calificados de conformidad con la legislación europea (86/609/CEE) y española (RD 53/2013). Los procedimientos empleados en el estudio actual fueron aprobados de manera similar por un Comité Ético institucional y ratificados por la autoridad local (PROEX11/18; Comunidad de Madrid). Se obtuvo el consentimiento informado por escrito de los propietarios para la participación de sus animales en este estudio.
Contribuciones del autor
JO y JB escribieron el manuscrito, realizaron la búsqueda de literatura y diseñaron las figuras. JO, CV y CN realizaron los experimentos. JO, LdJ, IS, JG, ÁR, CV, BR, MD, BP, CN, JS-L, JÁ y JB interpretaron los datos. Todos los autores revisaron y aprobaron el manuscrito.
Financiación
Este estudio fue financiado por el Análisis del proceso de erradicación de la tuberculosis caprina a largo plazo y el desarrollo de pruebas de diagnóstico y medidas de control para su mejora (GoaTBfree-UCM) (PID2019-105155RB-C31). JO fue apoyado por una beca por contrato de FPU (Formación de Profesorado Universitario) del Ministerio de Ciencia, Innovación y Universidades (FPU18/05197).
Agradecimientos
Los autores quieren dar las gracias a Ana Belén Martín (ISCIII), Álvaro Fernández (VISAVET-UCM) y Sergio González (VISAVET-UCM) por su asistencia técnica.
Conflicto de intereses
Los autores declaran que la investigación se llevó a cabo en ausencia de cualquier relación comercial o financiera que pudiera interpretarse como un posible conflicto de intereses.
Nota del editor
Todas las afirmaciones expresadas en este artículo son únicamente las de los autores y no representan necesariamente las de sus organizaciones afiliadas, o las del editor, los editores y los revisores. Cualquier producto que pueda ser evaluado en este artículo, o reclamo que pueda ser hecho por su fabricante, no está garantizado ni respaldado por el editor.
Referencias
1. Rodríguez S, Bezos J, Romero B, De Juan L, Álvarez J, Castellanos E, et al. Infección por Mycobacterium caprae en el ganado y la vida silvestre, España. Emerg Infect Dis. (2011) 17:532–5. doi: 10.3201/eid1703.100618
Resumen de PubMed | Texto completo de CrossRef | Google Scholar
2. Gortázar C, CheAmat A, O’Brien DJ. Preguntas abiertas y avances recientes en el control de una enfermedad infecciosa multihuésped: la tuberculosis animal. Mamm Rev. (2015) 45:160–75. doi: 10.1111/mam.12042
3. Malone KM, Gordon SV. Miembros del complejo Mycobacterium tuberculosis adaptados a animales salvajes y domésticos.AdvExp Med Biol. (2017) 1019:135–54. doi: 10.1007/978-3-319-64371-7_7
Resumen de PubMed | Texto completo de CrossRef | Google Scholar
4. Montali RJ, Mikota SK, Cheng LI. Mycobacterium tuberculosis en especies de zoológicos y vida silvestre. Rev Sci Tech. (2001) 20:291–303. doi: 10.20506/rst.20.1.1268
Resumen de PubMed | Texto completo de CrossRef | Google Scholar
5. Pesciaroli M, Alvarez J, Boniotti MB, Cagiola M, Di Marco V, Marianelli C, et al. Tuberculosis en especies de animales domésticos. Res Vet Sci. (2014) (97 Suppl):S78–85. doi: 10.1016/j.rvsc.2014.05.015
Resumen de PubMed | Texto completo de CrossRef | Google Scholar
6. Bezos J, Alvarez J, Romero B, Aranaz A, Juan L. Tuberculosis en cabras: evaluación de los ensayos de diagnóstico actuales mediados por células in vivo y basados en anticuerpos. Veterinario J. (2012) 191:161–5. doi: 10.1016/j.tvjl.2011.02.010
Resumen de PubMed | Texto completo de CrossRef | Google Scholar
7. Collins JD. Tuberculosis en el ganado: planificación estratégica para el futuro. Vet Microbiol. (2006) 112:369-81. doi: 10.1016/j.vetmic.2005.11.041
Resumen de PubMed | Texto completo de CrossRef | Google Scholar
8. Waters WR, Palmer MV, Buddle BM, Vordermeier HM. Investigación sobre la vacuna contra la tuberculosis bovina: perspectivas históricas y avances recientes. Vacuna. (2012) 30:2611-22. doi: 10.1016/j.vaccine.2012.02.018
Resumen de PubMed | Texto completo de CrossRef | Google Scholar
9. Eurostat 2021,. (oficina de Estadística de la Unión Europea). (2021). Disponible en línea en: https://ec.europa.eu/eurostat/web/products-data-sets/-/apro_mt_lsgoat (consultado el 14 de julio de 2022).
10. Roy A, Infantes-Lorenzo JA, de la Cruz ML, Dominguez L, Alvarez J, Bezos J. Precisión de las pruebas de diagnóstico de tuberculosis en pequeños rumiantes: una revisión sistemática y un metanálisis. PrevVetMed.(2020) 182:105102. doi: 10.1016/j.prevetmed.2020.105102
Resumen de PubMed | Texto completo de CrossRef | Google Scholar
11. Bezos J, Alvarez J, Juan L, Romero B, Rodriguez S, Castellanos E, et al. Factores que influyen en el rendimiento de un ensayo de interferón y gamma para el diagnóstico de tuberculosis en cabras. Veterinario J. (2011) 190:131–5. doi: 10.1016/j.tvjl.2010.09.026
Resumen de PubMed | Texto completo de CrossRef | Google Scholar
12. Good M, Bakker D, Duignan A, Collins DM. La historia de las pruebas de tuberculina in vivo en bovinos: tuberculosis, un problema de «una sola salud». Ciencia Veterinaria Frontal. (2018) 5:59. doi: 10.3389/fvets.2018.00059
Resumen de PubMed | Texto completo de CrossRef | Google Scholar
13. Schiller I, Vordermeier HM, Waters WR, Whelan AO, Coad M, Gormley E, et al. Tuberculosis bovina: efecto de la prueba cutánea de tuberculina en las respuestas gamma del interferón in vitro. Vet ImmunolImmunopathol.(2010) 136:1–11. doi: 10.1016/j.vetimm.2010.02.007
Resumen de PubMed | Texto completo de CrossRef | Google Scholar
14. Good M, Clegg TA, Costello E, More SJ. El rendimiento comparativo de la prueba intradérmica única y la prueba de tuberculina comparativa intradérmica única en ganado irlandés, utilizando combinaciones de tuberculina PPD de diferentes potencias. Vet J. (2011) 190:e60–e5. doi: 10.1016/j.tvjl.2011.01.005
Resumen de PubMed | Texto completo de CrossRef | Google Scholar
15. Ghielmetti G, Landolt P, Friedel U, Morach M, Hartnack S, Stephan R, et al. Evaluación de tres ensayos comerciales de interferón-gamma en una población libre de tuberculosis bovina. Ciencia Veterinaria Frontal.(2021) 8:682466. doi: 10.3389/fvets.2021.682466
Resumen de PubMed | Texto completo de CrossRef | Google Scholar
16. Ortega J, Roy A, Díaz-Castillo A, de Juan L, Romero B, Sáez-Llorente JL, et al. Efecto de la administración tópica de corticosteroides y presensibilización con tuberculina en el diagnóstico de tuberculosis en cabras. BMC Vet Res. (2022) 18:58. doi: 10.1186/s12917-022-03156-0
Resumen de PubMed | Texto completo de CrossRef | Google Scholar
17. Doherty ML, Bassett HF, Quinn PJ, Davis WC, Monaghan ML. Efectos de la dexametasona en las respuestas inmunitarias mediadas por células en ganado sensibilizado a Mycobacterium bovis. Am J Vet Res. (1995) 56:1300-6.
18. Goff BS. Efecto del tratamiento con dexametasona en ganado tuberculoso en los resultados de la prueba de interferón gamma para Mycobacterium bovis. Vet ImmunolImmunopathol. (1996) 53:39–47. doi: 10.1016/0165-2427(96)05601-2
Resumen de PubMed | Texto completo de CrossRef | Google Scholar
19. Regal P, Lamas A, Díaz-Bao M, Ortega J, Bezos J, Cepeda A, et al. Tuberculosis bovina en España: perspectivas emergentes de residuos. Conferencia Euro Residuo IX sobre residuos de medicamentos veterinarios en los alimentos. St. Michielsgestel, Países Bajos. (2022). p. 23-25. Disponible en línea en: https://www.euroresidue.eu/posters-2022/various-subjects
20. Ortega J, Roy Á, Álvarez J, Sánchez-Cesteros J, Romero B, Infantes-Lorenzo JA, et al. Efecto del sitio de inoculación de los derivados de proteínas purificadas (PPD) de bovinos y aviales (PPD) en la realización de la prueba de tuberculina intradérmica en cabras de rebanos libres de tuberculosis e infectados. Ciencia Veterinaria Frontal. (2021) 8:722825. doi: 10.3389/fvets.2021.722825
Resumen de PubMed | Texto completo de CrossRef | Google Scholar
21. Roy A, Tome I, Romero B, Lorente-Leal V, Infantes-Lorenzo JA, Domínguez M, et al. Evaluación de la inmunogenicidad y eficacia de las vacunas BCG y MTBVAC utilizando un modelo de transmisión natural de tuberculosis.Vet Res. (2019) 50:82. doi: 10.1186/s13567-019-0702-7
Resumen de PubMed | Texto completo de CrossRef | Google Scholar
22. Infantes-Lorenzo JA, Moreno I, Risalde MA, Roy A, Villar M, Romero B, et al. Caracterización proteómica de derivados proteicos purificados bovinos y aviarios e identificación de antígenos específicos para el serodiagnóstico de la tuberculosis bovina. Clin Proteomics. (2017) 14:36. doi: 10.1186/s12014-017-9171-z
Resumen de PubMed | Texto completo de CrossRef | Google Scholar
23. Infantes-Lorenzo JA, Moreno I, Roy A, Risalde MA, Balseiro A, de Juan L, et al. Especificidad de la prueba serológica para la detección de tuberculosis en ganado, cabras, ovejas y cerdos en diferentes situaciones epidemiológicas. BMC Vet Res. (2019) 15:70. doi: 10.1186/s12917-019-1814-z
Resumen de PubMed | Texto completo de CrossRef | Google Scholar
24. Equipo central de desarrollo de R. Una parte oficial del Proyecto GNU de la Free Software Foundation. (2021). Disponible en línea en: https://www.R-project.org/ (consultado el 8 de septiembre de 2022).
25. Abramson JH, WINPEPI. (PEPI-for-Windows): programas informáticos para epidemiólogos. Epidemiol Perspect Innov. (2004) 1:6. doi: 10.1186/1742-5573-1-6
Resumen de PubMed | Texto completo de CrossRef | Google Scholar
26. Babicki S, Arndt D, Marcu A, Liang Y, Grant JR, Maciejewski A, et al. Heatmapper: mapeo de calor habilitado para la web para todos. Ácidos nucleico Res. (2016). doi: 10.1093/nar/gkw419. [Epub antes de la impresión].
Resumen de PubMed | Texto completo de CrossRef | Google Scholar
27. Maślanka T, Jaroszewski JJ, Markiewicz W, Jakubowski P. Evaluación de la influencia del meloxicam y la flunixinmeglumina en la apoptosis de las células T CD4+ y CD8+ de la sangre periférica en los terneros. Pol J Vet Sci. (2010) 13:3-1.
28. Maslanka T, Jaroszewski JJ. Efectos in vitro de la dexametasona en las células CD25+CD4+ y CD25-CD4+ bovinas.Res Vet Sci. (2012) 93:1367–79. doi: 10.1016/j.rvsc.2012.01.018
Resumen de PubMed | Texto completo de CrossRef | Google Scholar
29. Maslanka T, Jaroszewski JJ, Markiewicz W, Jasiecka A, Ziolkowski H, Jedrzkiewicz D. Efectos de la dexametasona y el meloxicam en las células T CD25+ CD8+ y CD25- CD8+ bovinos, estudio in vitro. Res Vet Sci. (2013) 94:662–74. doi: 10.1016/j.rvsc.2012.12.005
Resumen de PubMed | Texto completo de CrossRef | Google Scholar
30. Bezos J, Roy A, Infantes-Lorenzo JA, González I, Venteo A, Romero B, et al. El uso de pruebas serológicas en combinación con la prueba de tuberculina intradérmica maximiza la detección de cabras infectadas por tuberculosis. Vet ImmunolImmunopathol. (2018) 199:43–52. doi: 10.1016/j.vetimm.2018.03.006
Resumen de PubMed | Texto completo de CrossRef | Google Scholar
31. Buddle BM, Wilson T, Luo D, Voges H, Linscott R, Martel E, et al. Evaluación de un ensayo de inmunoabsorción comercial ligado a enzimas para el diagnóstico de tuberculosis bovina a partir de muestras de leche de vacas lecheras. Clin Vaccine Immunol. (2013) 20:1812–6. doi: 10.1128/CVI.00538-13
Resumen de PubMed | Texto completo de CrossRef | Google Scholar
32. Casal C, Diez-Guerrier A, Alvarez J, Rodriguez-Campos S, Mateos A, Linscott R, et al. Uso estratégico de la serología para el diagnóstico de la tuberculosis bovina después de una prueba cutánea intradérmica. Vet Microbiol. (2014) 170:342–51. doi: 10.1016/j.vetmic.2014.02.036
Resumen de PubMed | Texto completo de CrossRef | Google Scholar
33. Casal C, Infantes JA, Risalde MA, Díez-Guerrier A, Domínguez M, Moreno I, et al. Las pruebas de detección de anticuerpos mejoran la sensibilidad del diagnóstico de tuberculosis en el ganado. Res Vet Sci. (2017) 112:214-21. doi: 10.1016/j.rvsc.2017.05.012
Resumen de PubMed | Texto completo de CrossRef | Google Scholar
34. Gutiérrez M, Tellechea J, García Marín JF. Evaluación de pruebas de diagnóstico celular y serológico para la detección de cabras infectadas con Mycobacterium bovis. Vet Microbiol. (1998) 62:281–90. doi: 10.1016/S0378-1135(98)00217-X
Resumen de PubMed | Texto completo de CrossRef | Google Scholar
35. Waters WR, Palmer MV, Stafne MR, Bass KE, Maggioli MF, Thacker TC, et al. Efectos de las pruebas cutáneas en serie con un derivado de proteína purificada sobre el nivel y la calidad de los anticuerpos contra antígenos complejos y definidos en el ganado infectado por Mycobacterium bovis. Clin Vaccine Immunol. (2015) 22:641-9. doi: 10.1128/CVI.00119-15
Resumen de PubMed | Texto completo de CrossRef | Google Scholar
36. O’Brien A, Whelan C, Clarke JB, Hayton A, Watt NJ, Harkiss GD. Análisis serológico de la tuberculosis en cabras mediante el uso de la prueba múltiplex de tuberculosis enferplex Caprine. Clin Vaccine Immunol. (2017) 24:e00518–16. doi: 10.1128/CVI.00518-16
Resumen de PubMed | Texto completo de CrossRef | Google Scholar
37. Steinbach S, Jalili-Firoozinezhad S, Srinivasan S, Melo MB, Middleton S, Konold T, et al. Dinámica temporal de la respuesta de citocina intradérmica a la tuberculina en el ganado vacunado con Mycobacterium bovis BCG utilizando microagujas de muestreo. Sci Rep. (2021) 11:7074. doi: 10.1038/s41598-021-86398-6
Resumen de PubMed | Texto completo de CrossRef | Google Scholar
38. Aranday-Cortes E, Bull NC, Villarreal-Ramos B, Gough J, Hicks D, Ortiz-Pelaez A, et al. Regulación ascendente de IL-17A, CXCL9 y CXCL10 en granulomas en etapa temprana inducidos por Mycobacterium bovis en el ganado. Transbound Emerg Dis. (2013) 60:525–37. doi: 10.1111/j.1865-1682.2012.01370.x
Resumen de PubMed | Texto completo de CrossRef | Google Scholar
39. Jones GJ, Pirson C, Hewinson RG, Vordermeier HM. La medición simultánea de la producción de interleucina-1 beta y interferón gamma estimulada por antígenos mejora la sensibilidad de la prueba para la detección de la infección por Mycobacterium bovis en el ganado. Clin Vaccine Immunol. (2010) 17:1946–51. doi: 10.1128/CVI.00377-10
Resumen de PubMed | Texto completo de CrossRef | Google Scholar
40. Gao X, Guo X, Li M, Jia H, Lin W, Fang L, et al. La interleucina 8 y la pentaxina (proteína C-reactiva) como nuevos biomarcadores potenciales de la tuberculosis bovina. J Clin Microbiol. (2019) 57:e00274-19. doi: 10.1128/JCM.00274-19
Resumen de PubMed | Texto completo de CrossRef | Google Scholar
41. Bernitz N, Kerr TJ, Goosen WJ, Higgitt RL, de Waal C, Clarke C, et al. Impacto de la patología inducida por Mycobacterium bovis en la interpretación de los resultados del ensayo QuantiFERON(R)-TB Gold en búfalos africanos (Syncerus caffer). Vet Immunol Immunopathol. (2019) 217:109923. doi: 10.1016/j.vetimm.2019.109923
Resumen de PubMed | Texto completo de CrossRef | Google Scholar
42. Palmer MV, Thacker TC, Rabideau MM, Jones GJ, Kanipe C, Vordermeier HM, et al. Biomarcadores de la inmunidad mediada por células a la tuberculosis bovina. Vet Immunol Immunopathol. (2020) 220:109988. doi: 10.1016/j.vetimm.2019.109988
Resumen de PubMed | Texto completo de CrossRef | Google Scholar
43. Parsons SD, McGill K, Doyle MB, Goosen WJ, van Helden PD, Gormley E. La liberación de IP-10 específica del antígeno es un biomarcador sensible de la infección por Mycobacterium bovis en el ganado. PLoS ONE. (2016) 11:e0155440. doi: 10.1371/journal.pone.0155440
Resumen de PubMed | Texto completo de CrossRef | Google Scholar
44. Waters WR, Palmer MV, Whipple DL, Carlson MP, Nonnecke BJ. Implicaciones diagnósticas de la producción alfa de interferón gamma inducida por antígeno, óxido nítrico y factor de necrosis tumoral por células mononucleares de sangre periférica de ganado infectado con Mycobacterium bovis. Clin Diagn Lab Immunol.(2003) 10:960–6. doi: 10.1128/CDLI.10.5.960-966.2003
Resumen de PubMed | Texto completo de CrossRef | Google Scholar
Palabras clave: tuberculosis caprina, dexametasona, ketoprofeno, diagnóstico, prueba de tuberculina intradérmica
Cita: Ortega J, de Juan L, Sevilla IA, Garrido JM, Roy Á, Velasco C, Romero B, Domínguez M, Pérez de Val B, Nebot C, Sáez-Llorente JL, Álvarez J y Bezos J (2022) Efecto de una reciente administración parenteral dexametasona y ketoprofeno en el diagnóstico inmunológico de la tuberculosis en Frente. Veterinario. Sci. 9:1042428. doi: 10.3389/fvets.2022.1042428
Recibido: 12 de septiembre de 2022; Aceptado: 28 de octubre de 2022;
Publicado: 10 de noviembre de 2022.
Editado por:
Jesus Hernandez, Consejo Nacional de Ciencia y Tecnología (CONACYT), México
Revisado por:
Saurabh Gupta, Universidad GLA, India
Raul G. Barletta, Universidad de Nebraska-Lincoln, Estados Unidos
Copyright © 2022 Ortega, de Juan, Sevilla, Garrido, Roy, Velasco, Romero, Domínguez, Pérez de Val, Nebot, Sáez-Llorente, Álvarez y Bezos. Este es un artículo de acceso abierto distribuido bajo los términos de la Licencia de Atribución de Creative Commons (CC BY).
*Correspondencia: Javier Bezos, jbezosga@visavet.ucm.es
Descargo de responsabilidad: Todas las afirmaciones expresadas en este artículo son únicamente las de los autores y no representan necesariamente las de sus organizaciones afiliadas, ni las del editor, los editores y los revisores. Cualquier producto que pueda ser evaluado en este artículo o reclamo que pueda ser hecho por su fabricante no está garantizado ni respaldado por el editor.
Date de alta y recibe nuestro 👉🏼 Diario Digital AXÓN INFORMAVET ONE HEALTH
Date de alta y recibe nuestro 👉🏼 Boletín Digital de Foro Agro Ganadero
Noticias animales de compañía
Noticias animales de producción
Trabajos técnicos animales de producción
Trabajos técnicos animales de compañía

