Efecto terapéutico del extracto de ajo envejecido sobre la gingivitis en perros
Efecto terapéutico del extracto de ajo envejecido sobre la gingivitis en perros
 Kaori Takahashi1†
Kaori Takahashi1†  Hiroshi Nango2†
Hiroshi Nango2†  Mitsuyasu Ushijima2†
Mitsuyasu Ushijima2†  Miyuki Takashima2
Miyuki Takashima2  Masato Nakamoto2
Masato Nakamoto2  Toshiaki Matsutomo2
Toshiaki Matsutomo2  Hiroshi Jikihara3
Hiroshi Jikihara3  Nanami Arakawa4
Nanami Arakawa4  Shinichiro Maki4
Shinichiro Maki4  Akira Yabuki1,4
Akira Yabuki1,4  Yasuyuki Endo1
Yasuyuki Endo1  Osamu Yamato4*
Osamu Yamato4*- 1Hospital Universitario de Enseñanza Veterinaria de la Universidad de Kagoshima, Facultad Conjunta de Medicina Veterinaria, Universidad de Kagoshima, Kagoshima, Japón
- 2Instituto Central de Investigación, Wakunaga Pharmaceutical Co., Ltd., Hiroshima, Japón
- 3Departamento de Administración de Investigación, Wakunaga Pharmaceutical Co., Ltd., Hiroshima, Japón
- 4Laboratorio de Patología Clínica, Departamento de Medicina Veterinaria, Facultad Conjunta de Medicina Veterinaria, Universidad de Kagoshima, Kagoshima, Japón
La enfermedad periodontal es uno de los problemas de salud dental más comunes en los perros. Los estudios clínicos en humanos han demostrado que el extracto de ajo envejecido (AGE), que contiene compuestos bioactivos estables y solubles en agua que contienen azufre, mejora los síntomas de las enfermedades periodontales. Nuestro estudio anterior demostró que la administración oral de AGE en perros Beagle sanos a 90 mg/kg/día durante 12 semanas no tuvo efectos adversos como la anemia hemolítica, que es bien conocida como resultado de la ingestión de especies de Allium, incluidas las cebollas y el ajo, en perros. Sin embargo, el potencial terapéutico de AGE en la enfermedad periodontal canina sigue sin estar claro. En consecuencia, investigamos los efectos terapéuticos de AGE en perros Beagle con gingivitis leve. La administración de 18 mg/kg/día de AGE durante 8 semanas dio como resultado la mejora de la puntuación del índice gingival, el nivel de compuestos volátiles de azufre en el aire exhalado y la actividad enzimática de los patógenos periodontales sin efectos adversos sobre los signos clínicos y los parámetros hematológicos y bioquímicos séricos. Además, AGE aumentó la concentración de catelicidina salival, un péptido antimicrobiano que contribuye a la respuesta inmunitaria innata oral. Estos resultados sugieren que el AGE podría ser un potencial agente terapéutico para la gingivitis canina.
1. Introducción
La enfermedad periodontal, un conjunto de enfermedades inflamatorias dentales iniciadas por la microbiota oral en la superficie dental (1), es uno de los problemas de salud más comunes en los perros (2). La prevalencia de esta enfermedad es del 44 al 100% en todas las razas de perros, según la evaluación clínica y los informes de muestras de necropsia (3). En general, la enfermedad periodontal es más prevalente en las razas de perros pequeños que en las grandes (3, 4), y su incidencia está fuertemente correlacionada con la edad (4-6). La gingivitis se caracteriza por una inflamación reversible y enrojecimiento gingival sin pérdida de la unión del tejido conectivo o del hueso alveolar. Si esta afección no se trata, la mayoría de los casos de gingivitis, pero no todos, progresan a periodontitis. La periodontitis es una inflamación crónica grave de los tejidos dentales de soporte que causa la pérdida de la unión del tejido conectivo y del hueso alveolar, lo que puede provocar una recesión gingival, fístula oronasal, absceso radicular, movilidad dental y pérdida de dientes (7). La periodontitis es causada por la invasión bacteriana y las toxinas bacterianas, pero la extensión de la enfermedad cambia por la reacción inmunitaria del huésped que depende de factores genéticos, inmunológicos y ambientales (8, 9). Además, la enfermedad periodontal se asocia con trastornos sistémicos en los perros, como disfunción cognitiva (10), enfermedad cardíaca (4, 11) y enfermedad renal (12, 13), lo que en última instancia conduce a una mala calidad de vida.
El control de la acumulación de microbiota oral en las superficies dentales y la consiguiente inflamación gingival es importante para la prevención y el tratamiento de las enfermedades periodontales (14). Las estrategias de tratamiento para la enfermedad periodontal generalmente se basan en la atención domiciliaria con cepillado de dientes y limpieza dental profesional, encías dentales y antibióticos según sea necesario. El cepillado diario de los dientes es el método más eficaz para eliminar la placa dental. Un estudio anterior demostró que el cepillado de dientes dos veces al día durante 18 meses previene la acumulación de placa, desechos, cálculos y el posterior desarrollo de gingivitis y periodontitis en perros Beagle de 10 meses de edad (15). El cepillado diario de los dientes y la administración oral de antibióticos a veces son difíciles de lograr debido al mal cumplimiento, la falta de técnica en los propietarios y el temperamento agresivo (16-18). Por lo tanto, se requieren agentes orales más convenientes para la prevención y el tratamiento de la gingivitis en perros domésticos para los propietarios y veterinarios.
Las hierbas y los fitoquímicos se utilizan en odontología humana como agentes antimicrobianos, antisépticos, antineoplásicos, antioxidantes y analgésicos, así como para la eliminación de la halitosis (19, 20). Tales plantas herbales medicinales incluyen el aloe (Aloe vera), el té verde (Camellia sinensis), la cúrcuma (Curcuma longa), el kalonji (Nigella sativa) y el neem (Azadirachta indica), así como el ajo (Allium sativum), que se han sugerido como un remedio alternativo para los problemas orales y dentales en humanos. Los tratamientos a base de hierbas son en su mayoría más seguros que las drogas sintéticas en humanos, pero pueden ocurrir algunos efectos adversos graves (19). Algunos compuestos en el ajo fresco tienen el potencial de causar quemaduras químicas en la piel y las mucosas, incluso en humanos (21). Es bien sabido que la ingesta de ajo causa anemia hemolítica debido a la oxidación de los eritrocitos en perros (22).
El extracto de ajo envejecido (AGE) es uno de los productos de ajo preparados mediante el remojo del ajo con etanol acuoso durante más de 10 meses a temperatura ambiente (23). AGE y sus aminoácidos bioactivos que contienen azufre, S-alilcisteína, S-1-propenilcisteína y S-alilmercaptocisteína, poseen propiedades favorables como antioxidante (24, 25), antiinflamatorio (26-28), inmunomodulación (29-31) y actividades anticancerígenas (32). Varios estudios clínicos en humanos han demostrado que el AGE mejora la hipertensión (33), la aterosclerosis (34) y el síndrome metabólico (35). Más recientemente, se informó que la ingesta diaria de AGE durante 4 y 18 meses mejoró el índice gingival modificado, el índice de sangrado gingival y la profundidad de la bolsa de sondaje en pacientes humanos con enfermedad periodontal leve a moderada (36, 37). En apoyo de estos resultados, AGE y sus aminoácidos bioactivos que contienen azufre suprimieron la expresión de la molécula de adhesión intracelular inducida por el factor de necrosis tumoral-α-1 y la secreción de interleucina-6 en la línea celular epitelial gingival humana Ca9-22 (38). Estos resultados sugieren que el AGE suprime la inflamación gingival y la progresión a enfermedad periodontal. Además, nuestro estudio previo informó que la administración oral de AGE a 45 y 90 mg/kg/día durante 8 y 12 semanas en perros Beagle aumentó la expresión génica del factor nuclear eritroide 2 relacionado con el factor 2 (Nrf2) y las enzimas antioxidantes reguladas por Nrf2 NAD(P)H quinona oxidorreductasa 1 y la subunidad modificadora de glutamato-cisteína ligasa en sangre total sin ningún efecto adverso. incluida la anemia hemolítica inducida por el ajo causada por la lesión oxidativa de los eritrocitos (39).
Aunque la seguridad y la bioactividad favorable de AGE en perros ya están aclaradas como se mencionó anteriormente, su potencial terapéutico para la enfermedad periodontal canina sigue sin estar claro. El objetivo de este estudio fue evaluar los efectos terapéuticos de la suplementación con AGE sobre la gingivitis en perros.
2. Materiales y métodos
2.1. Preparación de polvos antibacterianos y placebo
El AGE se preparó como se describió anteriormente (39). Los dientes de ajo en rodajas cultivados en Japón se remojaron en una mezcla de etanol y agua durante más de 10 meses a temperatura ambiente. A continuación, el extracto se secó con un secador de circulación (HOH-A3; Takabayashi Rika Co., Ltd., Tokio, Japón). El polvo de AGE consistió en 18,0 mg de extracto seco de AGE, 19,0 mg de celulosa cristalina (Ceolus UF-F702; Asahi Kasei Chemicals Corporation, Tokio, Japón), 0,9 mg de carboximetilcelulosa cálcica (E.C.G-FA; Nichirin Chemical Industries Ltd., Itami, Japón) y 5,0 mg de polvo de agar (Ina Food Industry Co., Ltd., Ina, Japón). Se utilizó el placebo en polvo que consiste en celulosa cristalina (37,0 mg), carboximetilcelulosa cálcica (0,9 mg) y agar en polvo (5,0 mg). El polvo se almacenó a 4 °C hasta su posterior uso. El AGE producido a veces se analiza mediante cromatografía líquida de alta resolución para confirmar que tiene varios compuestos que contienen azufre, S-metilcisteína, S-alilcisteína, S-1-propenilcisteína y S-alilmercaptocisteína, que son compuestos de azufre característicos en AGE (40).
2.2. Animales de experimentación y tratamientos
El experimento en animales se llevó a cabo con 10 perros Beagle (4 machos y 6 hembras, de 2 a 9 años de edad, 9,8 a 11,8 kg de peso corporal) alojados en la Corporación Kitayama Labes, Biocentro de Narita (Narita, Japón). Antes de los experimentos, se confirmó que todos los perros estaban clínicamente sanos en base a un examen físico y análisis bioquímicos hematológicos y séricos. Todos los perros se alojaron a una temperatura de 23 ± 5°C y una humedad relativa de 55 ± 25% bajo un ciclo de luz/oscuridad de 12 h (fase de luz de 7:00 a 19:00). Los 10 perros se dividieron en dos grupos en función de la puntuación media del índice gingival: el grupo control tratado con placebo denominado grupo placebo (4,6 ± 1,2 años de edad, 10,76 ± 0,41 kg de peso corporal, y la puntuación media del índice gingival de 0,57 ± 0,10) y el grupo tratado con AGE denominado grupo AGE (3,8 ± 0,8 años de edad, 10,76 ± 0,35 kg de peso corporal, La puntuación media del índice gingival es de 0,53 ± 0,13), y cada grupo está formado por cinco perros (2 machos y 3 hembras). Cada perro fue alimentado con 250 g de alimento seco (DS-A; Oriental Yeast Co., Ltd., Tokio, Japón) espolvoreado con 42,9 mg/kg de placebo o polvo de AGE (18 mg/kg de extracto seco de AGE) una vez al día entre las 11:00 y las 12:00 durante 8 semanas. El agua se suministraba ad libitum. Después de la alimentación, confirmamos que todos los perros habían consumido el alimento por completo. Todos los experimentos con animales cumplieron con las Directrices para Experimentos con Animales de Kitayama Labes Corporation y fueron aprobados por el Comité de Bienestar Animal de Kitayama Labes Corporation (Número de aprobación NBC57-024).
2.3. Observación clínica y medición del peso corporal
Los perros fueron inspeccionados todas las mañanas para detectar manifestaciones clínicas, como características fecales, vómitos, estado del pelaje y comportamiento durante el período experimental. Los perros se pesaron al inicio (1 semana antes del tratamiento) y a las 4 y 8 semanas después del tratamiento. Se realizó una inspección visual de la cavidad bucal para comprobar si había dientes, lesiones orales y anomalías dentales y blandas al inicio del estudio, y a las 4 y 8 semanas después del tratamiento.
2.4. Hematología y bioquímica sérica
Se realizaron análisis hematológicos y bioquímicos séricos como se describió anteriormente (39). Durante el período interdigestivo, se recolectaron 4 mL de sangre de la vena cefálica en condiciones no anestesiadas al inicio y 4 y 8 semanas después del tratamiento. Aproximadamente la mitad de la muestra de sangre era miscible con sal dipotásica de ácido etilendiaminotetraacético y se utilizó para análisis hematológico (FUJIFILM VET Systems, Tokio, Japón). De la mitad restante de las muestras de sangre colectadas se obtuvo suero, seguido de un análisis bioquímico con analizador químico (VETSCAN VS2; Zoetis, Florham Park, NJ, Estados Unidos) con un rotor (Comprehensive Diagnostic Profile; Zoetis). La concentración sérica de amiloide A (AAS) se determinó mediante un analizador bioquímico automatizado (Pentra C200; HORIBA ABX SAS, Montpellier, Francia) y un reactivo especial de SAA para suero o plasma animal (reactivo VET-SAA «Eiken»; Eiken Chemical Co. Ltd., Tokio, Japón). La concentración de proteína C reactiva (PCR) se determinó mediante un analizador de inmunoensayo nefelométrico láser (Laser CRP-2; Arrows Co., Ltd., Osaka, Japón).
2.5. Evaluación del índice gingival
La severidad de la gingivitis se evaluó mediante el índice gingival al inicio y a las 4 y 8 semanas después del tratamiento sin sedación ni anestesia como se describió anteriormente (41, 42). El índice gingival se midió en el lado bucal de I3, C, P2, P3, P4 y M1 del maxilar y C, P2, P3, P4 y M1 de la mandíbula. El índice gingival se puntuó de la siguiente manera: 0, sin inflamación gingival; 0,5, ligera inflamación gingival (ligero cambio de color); 1, inflamación gingival leve (enrojecimiento claro y edema, pero sin sangrado al sondaje); 2, inflamación gingival moderada (enrojecimiento fuerte, edema y sangrado al sondaje); y 3, inflamación gingival severa (enrojecimiento marcado, edema, ulceración y tendencia a sangrar espontáneamente). Las puntuaciones fueron evaluadas como un experimento ciego por el mismo experimentador de la Corporación Kitayama Labes. Este experimentador era un Técnico Junior de Animales de Laboratorio certificado por la Sociedad Japonesa de Animales de Laboratorio, había trabajado durante 11 años y había experimentado varios experimentos para la evaluación del índice gingival en perros con gingivitis.
2.6. Medición de los niveles de compuestos volátiles de azufre (VSC)
Los niveles de VSCs en el aire exhalado se midieron utilizando un halímetro RH17K (TAIYO Instruments Inc., Osaka, Japón) al inicio y 8 semanas después del tratamiento. A los perros se les administró por vía subcutánea 1 mg/kg de maropitant (Cerenia; Zoetis) a las 17:00 horas del día anterior a la medición para la prevención de vómitos. El día de la medición, 0,03 mg/ml de medetomidina (Dorbene; Kyoritsu Seiyaku Co., Ltd., Tokio, Japón) y 0,3 mg/kg de midazolam (Dormicum; Maruishi Pharmaceutical Co., Ltd., Osaka, Japón) se administraron por vía intramuscular en el muslo para su sedación. Las muestras de aire oral se obtuvieron insertando una pajita conectada a un halímetro en la cavidad oral, y los niveles de VSC se midieron de acuerdo con las recomendaciones del fabricante. Después de la medición, 0,3 mg/kg de atipamezol (Atipame; Kyoritsu Seiyaku Co., Ltd., Tokio, Japón) se administró por vía intramuscular. Los niveles de tiol, un VSC, se midieron en el margen gingival en C, P2, P3 y P4 en el maxilar bilateral y la mandíbula utilizando OraStrip (DS Pharma Animal Health Co., Ltd., Osaka, Japón) (43, 44) al inicio y 1, 2, 4 y 8 semanas después del tratamiento. La prueba OraStrip se realizó de acuerdo con las instrucciones del fabricante. Las puntuaciones se evaluaron como un experimento ciego utilizando los seis colores de la tabla en la hoja adjunta por el mismo experimentador en la Corporación Kitayama Labes.
2.7. Actividad enzimática de patógenos periodontales
La actividad enzimática de los patógenos periodontales se midió utilizando un hisopo en el margen gingival en C, P2, P3 y P4 en el maxilar bilateral y la mandíbula utilizando ADplit (Kyoritsu Seiyaku Co., Ltd., Tokio, Japón) (45, 46) al inicio y 1, 2, 4 y 8 semanas después del tratamiento. Se promedió la puntuación de cada prueba en el maxilar y la mandíbula bilaterales. Se asignó una puntuación de 1 a 5 de acuerdo con las instrucciones del fabricante. Los núcleos fueron evaluados como un experimento ciego utilizando los cinco colores de la tabla en la hoja adjunta por el mismo experimentador de la Corporación Kitayama Labes.
2.8. Ensayo de inmunoabsorción ligado a enzimas (ELISA)
La saliva se recolectó del exterior del molar posterior utilizando un Salivette (SARSTEDT, Nümbrecht, Alemania) al inicio del estudio y a las 4 y 8 semanas después del tratamiento. La cuantificación de la inmunoglobina A (IgA) y del péptido antimicrobiano catelicidina (CAMP) en la saliva se realizó utilizando el kit ELISA de IgA canina (Novus Biologicals, Centennial, CO, Estados Unidos) y el kit ELISA de péptidos antimicrobianos de catelicidina canina (MyBioSource, San Diego, CA, Estados Unidos), respectivamente, de acuerdo con los protocolos del fabricante. La absorbancia de las muestras se midió a 450 nm utilizando un espectrofotómetro de microplacas Multiskan GO (Thermo Scientific, Vantaa, Finlandia).
2.9. Análisis estadístico
El análisis de los datos se realizó utilizando Kyplot 6.0 (KyensLab Inc., Tokio, Japón). Los datos se expresan como media ± error estándar de la media. La significación estadística entre los grupos placebo y AGE se evaluó mediante la prueba U de Mann-Whitney. Los cambios estadísticos también se evaluaron mediante la prueba de rangos con signo de Wilcoxon y se compararon con la línea de base. Las diferencias a p < 0,05 se consideraron estadísticamente significativas.
3. Resultados
3.1. Peso corporal y condiciones físicas
Todos los perros consumieron alimentos sin vómitos repetidos durante el período experimental. No se observaron cambios significativos en el peso corporal en los grupos Placebo y AGE durante el período experimental (Tabla Suplementaria S1). Además, no hubo cambios en los síntomas clínicos, como heces blandas, muda de pelo, color rojizo de la orina o comportamientos anormales en ninguno de los grupos. No hubo cambios anormales que incluyeran dientes perdidos y fracturados, lesiones orales e hidratación en las inspecciones orales durante el período experimental.
3.2. Parámetros hematológicos y bioquímicos séricos
Durante el período experimental, hubo varios cambios significativos en comparación con los datos basales y varias diferencias significativas entre los grupos Placebo y AGE, aunque no hubo cambios ni diferencias sustanciales (Tabla suplementaria S1). En los datos hematológicos, el recuento de eritrocitos disminuyó significativamente (p < 0,05) en el grupo AGE a las 4 y 8 semanas en comparación con el valor basal. El recuento de leucocitos disminuyó significativamente (p < 0,05) en el grupo placebo a las 8 semanas y en el grupo AGE a las 4 semanas en comparación con el valor basal. El recuento de monocitos disminuyó significativamente (p < 0,05) en ambos grupos a las 8 semanas en comparación con el valor basal. En los datos bioquímicos séricos, la concentración total de proteína fue significativamente mayor (p < 0,05) en el grupo AGE que en el grupo placebo al inicio y a las 4 semanas. La actividad de la alanina aminotransferasa fue significativamente menor (p < 0,01) en el grupo AGE que en el grupo placebo a las 8 semanas. La concentración de calcio fue significativamente mayor (p < 0,05) en el grupo AGE que en el grupo placebo al inicio del estudio, y disminuyó significativamente (p < 0,001) en el grupo AGE a las 8 semanas en comparación con el valor basal. La concentración de sodio fue significativamente mayor (p < 0,05) en el grupo AGE que en el grupo placebo al inicio y a las 4 y 8 semanas.
3.3. Puntuación del índice gingival
La puntuación media del índice gingival obtenida en 22 localizaciones de la cavidad oral disminuyó significativamente (p < 0,05) en el grupo AGE a las 4 (0,39 ± 0,12) y a las 8 semanas (0,25 ± 0,08) en comparación con la basal (0,53 ± 0,13), pero no en el grupo placebo durante el periodo experimental (Figura 1A). Hubo una diferencia significativa (p < 0,05) en el cambio desde el inicio entre los grupos Placebo y AGE a las 4 semanas, pero no (p = 0,095) a las 8 semanas (Figura 1B).
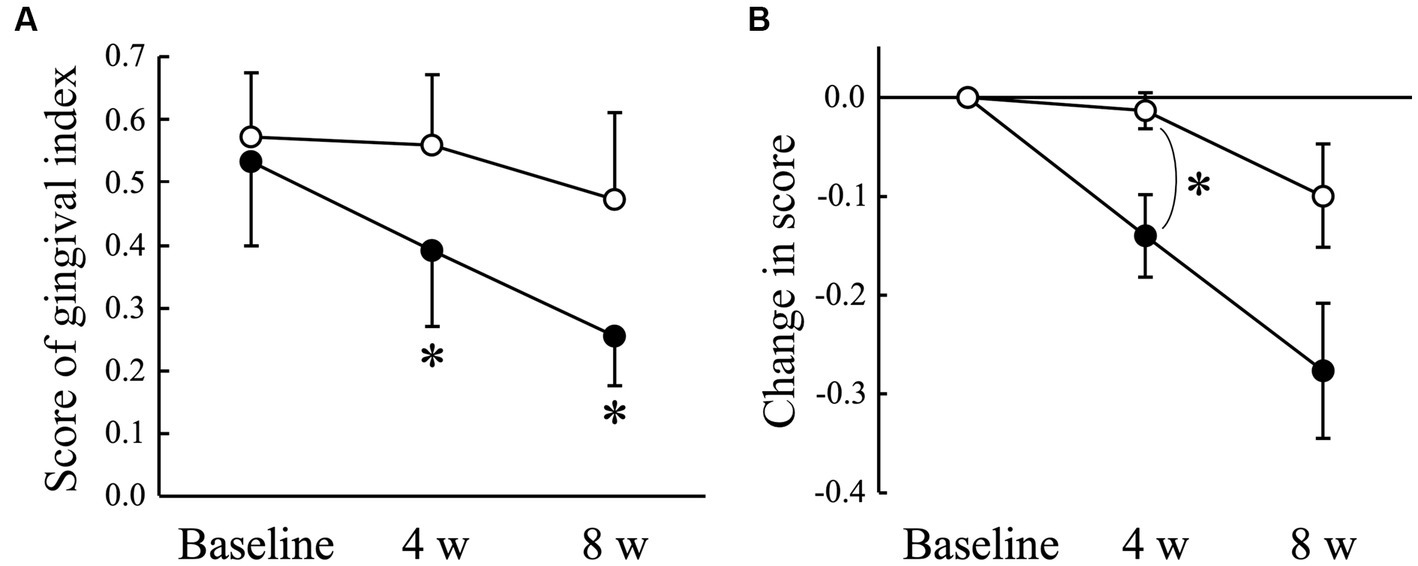 Figura 1. Puntuación del índice gingival (A) y cantidad modificada en la puntuación (B) en perros Beagle con gingivitis leve a los que se les administró extracto de ajo envejecido (●, grupo AGE) y placebo (○, grupo placebo) durante 8 semanas. Las barras verticales indican las medias ± error estándar de la media (n = 5). *p < 0,05, prueba de rangos con signo de Wilcoxon comparada con el valor basal, o prueba U de Mann-Whitney comparada entre los grupos AGE y placebo.
Figura 1. Puntuación del índice gingival (A) y cantidad modificada en la puntuación (B) en perros Beagle con gingivitis leve a los que se les administró extracto de ajo envejecido (●, grupo AGE) y placebo (○, grupo placebo) durante 8 semanas. Las barras verticales indican las medias ± error estándar de la media (n = 5). *p < 0,05, prueba de rangos con signo de Wilcoxon comparada con el valor basal, o prueba U de Mann-Whitney comparada entre los grupos AGE y placebo.
3.4. Nivel de CVS en el aire espirado
El nivel de VSCs del aire exhalado medido con un halímetro aumentó significativamente (p < 0,05) en el grupo de placebo a las 8 semanas en comparación con el de la línea de base, pero no en el grupo de AGE (Figura 2A). Hubo una diferencia significativa (p < 0,05) en el cambio desde el inicio entre los grupos Placebo y AGE a las 8 semanas (Figura 2B). La puntuación media que indica el nivel de tiol estimado con OraStrip disminuyó significativamente (p < 0,05) en el grupo de placebo a las 2 y 8 semanas en comparación con el valor basal, y disminuyó significativamente (p < 0,05) en el grupo AGE a las 4 y 8 semanas en comparación con el valor basal (Figura 3A). Sin embargo, no hubo diferencias significativas en el cambio desde el inicio entre los dos grupos (Figura 3B).
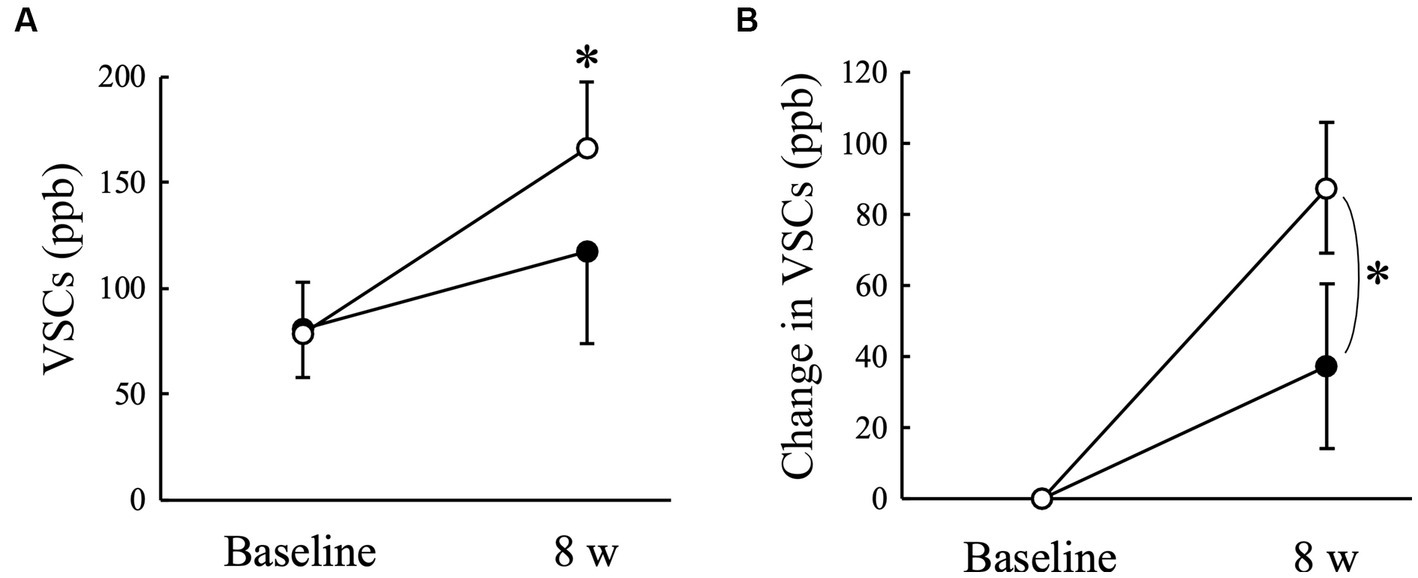 Figura 2. Nivel de compuestos volátiles de azufre (VSC) (A) y cantidad modificada en el nivel (B) en perros Beagle con gingivitis leve a los que se les administró extracto de ajo envejecido (●, grupo AGE) y poder placebo (○, grupo placebo) durante 8 semanas. Las barras verticales indican las medias ± error estándar de la media (n = 5). *p < 0,05, prueba de rangos con signo de Wilcoxon comparada con el valor basal, o prueba U de Mann-Whitney comparada entre los grupos AGE y placebo.
Figura 2. Nivel de compuestos volátiles de azufre (VSC) (A) y cantidad modificada en el nivel (B) en perros Beagle con gingivitis leve a los que se les administró extracto de ajo envejecido (●, grupo AGE) y poder placebo (○, grupo placebo) durante 8 semanas. Las barras verticales indican las medias ± error estándar de la media (n = 5). *p < 0,05, prueba de rangos con signo de Wilcoxon comparada con el valor basal, o prueba U de Mann-Whitney comparada entre los grupos AGE y placebo.
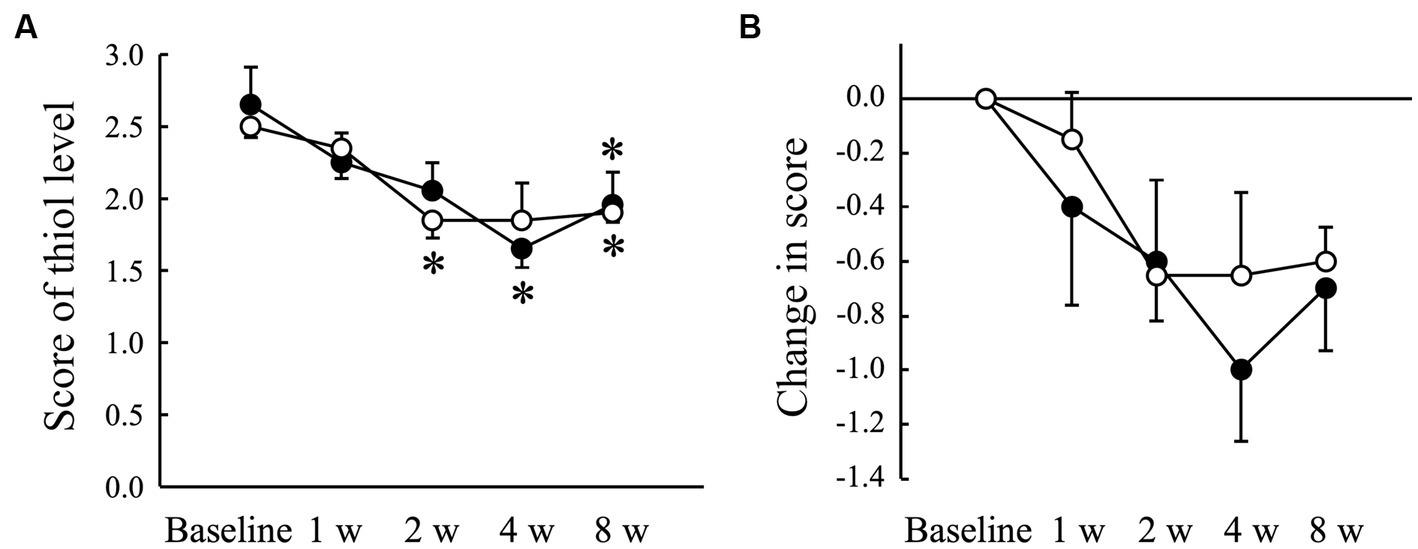 Figura 3. Puntuación que indica el nivel de tiol, un compuesto volátil de azufre, medido mediante la prueba OraStrip (A) y la cantidad modificada en la puntuación (B) en perros Beagle con gingivitis leve a los que se les administró extracto de ajo envejecido (●, grupo AGE) y poder placebo (○, grupo placebo) durante 8 semanas. Las barras verticales indican las medias ± error estándar de la media (n = 5). *p < 0,05, prueba de rango con signo de Wilcoxon en comparación con el valor basal.
Figura 3. Puntuación que indica el nivel de tiol, un compuesto volátil de azufre, medido mediante la prueba OraStrip (A) y la cantidad modificada en la puntuación (B) en perros Beagle con gingivitis leve a los que se les administró extracto de ajo envejecido (●, grupo AGE) y poder placebo (○, grupo placebo) durante 8 semanas. Las barras verticales indican las medias ± error estándar de la media (n = 5). *p < 0,05, prueba de rango con signo de Wilcoxon en comparación con el valor basal.
3.5. Actividad enzimática de las bacterias patógenas periodontales
La puntuación media obtenida con ADplit no mostró cambios significativos en comparación con el valor basal tanto en el grupo Placebo como en el AGE (Figura 4A). Sin embargo, el cambio con respecto al valor basal tendió a aumentar en el grupo placebo a las 2 semanas, mientras que tendió a disminuir en el grupo AGE durante el período experimental (Figura 4B). Hubo una diferencia significativa (p < 0,05) entre los dos grupos a las 2 semanas. La puntuación fue aún más baja en el grupo AGE que en el grupo placebo a las 8 semanas, pero no hubo diferencia significativa (p = 0,095) entre los dos.
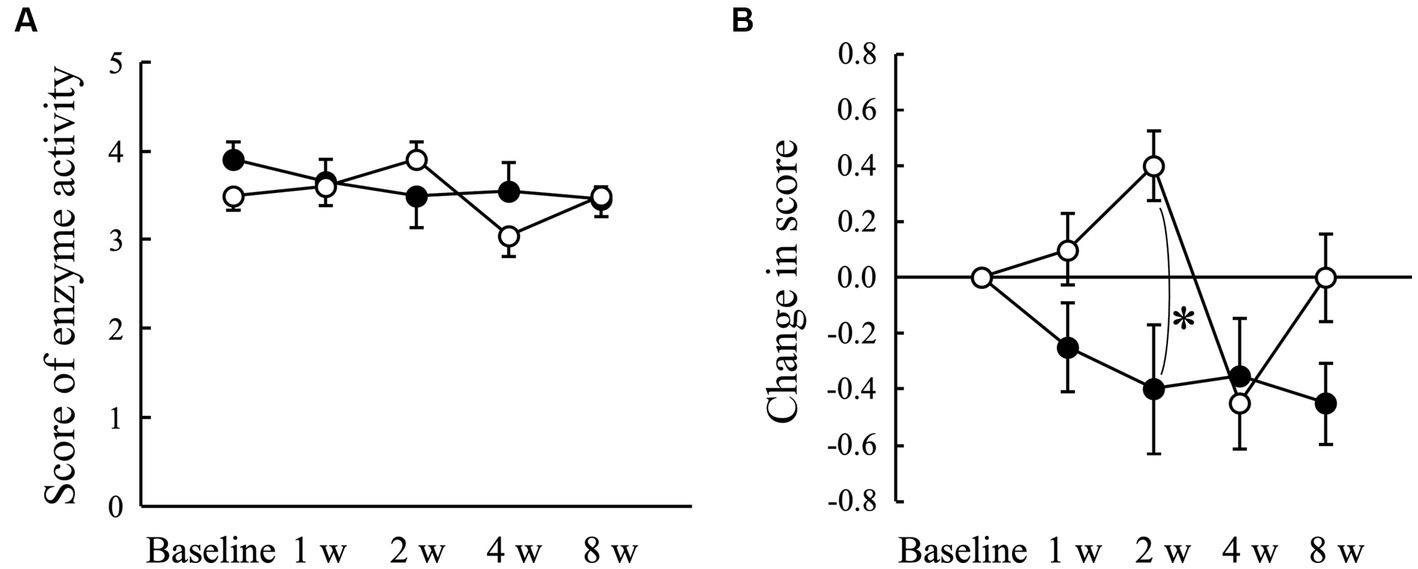 Figura 4. Puntuación que indica la actividad enzimática de los patógenos periodontales medida mediante la prueba ADplit (A) y la cantidad modificada en la puntuación (B) en perros Beagle con gingivitis leve a los que se les administró extracto de ajo envejecido (●, grupo AGE) y potencia placebo (○, grupo placebo) durante 8 semanas. Las barras verticales indican las medias ± error estándar de la media (n = 5). *p < 0,05, prueba U de Mann-Whitney comparada entre los grupos AGE y Placebo.
Figura 4. Puntuación que indica la actividad enzimática de los patógenos periodontales medida mediante la prueba ADplit (A) y la cantidad modificada en la puntuación (B) en perros Beagle con gingivitis leve a los que se les administró extracto de ajo envejecido (●, grupo AGE) y potencia placebo (○, grupo placebo) durante 8 semanas. Las barras verticales indican las medias ± error estándar de la media (n = 5). *p < 0,05, prueba U de Mann-Whitney comparada entre los grupos AGE y Placebo.
3.6. Concentraciones salivales de IgA y CAMP
No hubo cambios significativos en la concentración de IgA salival ni en los grupos de placebo ni en los de AGE durante el período experimental (Figura 5A). Por el contrario, la concentración de CAMP tendió a aumentar en el grupo AGE en comparación con el valor basal, pero no en el grupo placebo (Figura 5B). Hubo una diferencia significativa (p < 0,01) entre los dos grupos a las 4 semanas. El nivel de CAMP fue aún mayor en el grupo AGE que en el grupo placebo a las 8 semanas, pero no hubo diferencia significativa (p = 0,056) entre los dos.
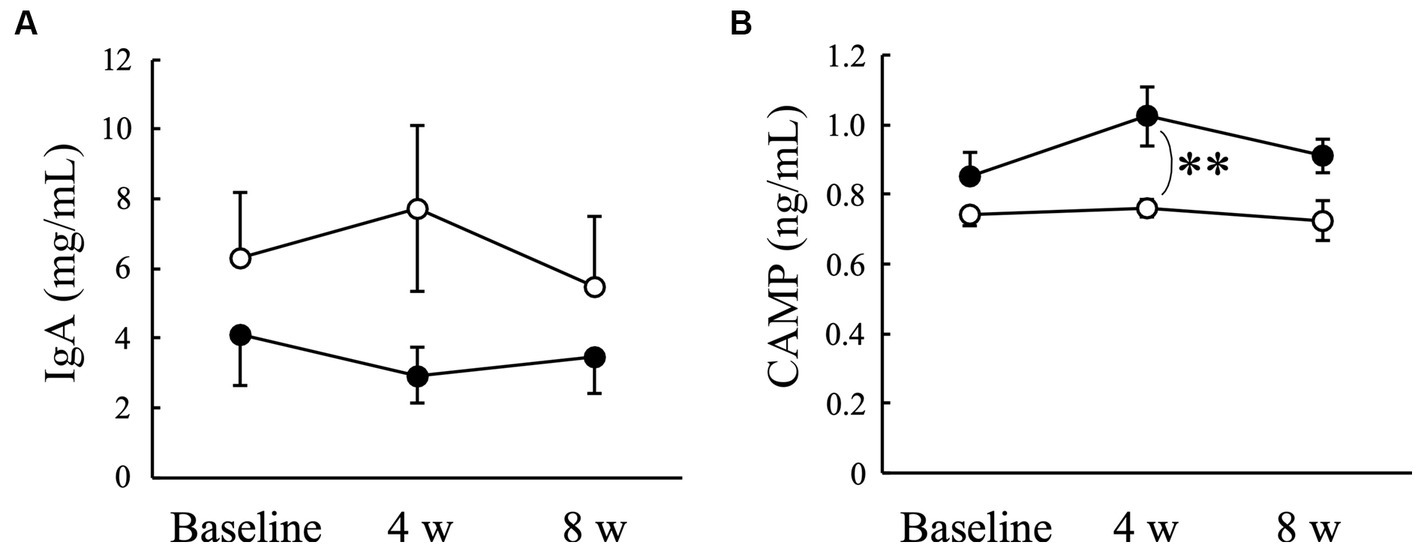 Figura 5. Concentraciones de inmunoglobulina A (IgA) (A) y péptido antimicrobiano catelicidina (CAMP) (B) en perros Beagle con gingivitis leve a los que se les administró extracto de ajo envejecido (●, grupo AGE) y placebo (○, grupo placebo) durante 8 semanas. Las barras verticales indican las medias ± error estándar de la media (n = 5). **p < 0,01, prueba U de Mann-Whitney comparada entre los grupos AGE y Placebo.
Figura 5. Concentraciones de inmunoglobulina A (IgA) (A) y péptido antimicrobiano catelicidina (CAMP) (B) en perros Beagle con gingivitis leve a los que se les administró extracto de ajo envejecido (●, grupo AGE) y placebo (○, grupo placebo) durante 8 semanas. Las barras verticales indican las medias ± error estándar de la media (n = 5). **p < 0,01, prueba U de Mann-Whitney comparada entre los grupos AGE y Placebo.
4. Discusión
La ingesta de ajo induce la oxidación de eritrocitos y hemoglobina en perros (47), lo que resulta en anemia hemolítica (22). Por lo tanto, primero examinamos la seguridad y los efectos adversos de AGE en perros Beagle utilizando los métodos descritos en nuestro estudio anterior (39). Nuestro estudio anterior no demostró efectos adversos, incluida la anemia hemolítica, cuando se administró AGE por vía oral a perros sanos a 90 mg/kg/día durante 12 semanas (39). De acuerdo con un estudio previo, el presente estudio demostró que la alimentación con AGE a una dosis baja de 18 mg/kg/día durante 8 semanas no tuvo efectos adversos sobre la salud general de los perros con gingivitis leve (Tabla suplementaria S1). Aunque la administración de AGE indujo diferencias estadísticamente significativas en varios parámetros hematológicos y bioquímicos séricos, como los recuentos de eritrocitos, leucocitos y monocitos, y la concentración de calcio en comparación con los valores basales, las diferencias fueron bastante pequeñas y todos los parámetros se mantuvieron dentro de los valores de referencia en perros Beagle (48, 49). En nuestro estudio previo, los perros a los que se les administró AGE a 45 y 90 mg/kg/día durante 12 semanas, cuyas dosis y duración fueron más altas y más largas que las de este estudio (18 mg/kg/día durante 8 semanas), no mostraron cambios significativos en el recuento de eritrocitos y otros parámetros asociados a la anemia hemolítica, incluido el recuento de reticulocitos, la actividad de la lactato deshidrogenasa, la concentración de bilirrubina total, y los parámetros de oxidación de los eritrocitos, como los recuentos corporales y eccentrocitos de Heinz (39). Por lo tanto, consideramos que la disminución significativa en el recuento de eritrocitos a las 4 y 8 semanas en el grupo AGE en este estudio fue incidental, inocua y no relacionada con la anemia. Sin embargo, el ajo tiene el potencial de causar anemia hemolítica en perros (22, 47) y, por lo tanto, se necesitan más estudios para confirmar la completa seguridad de AGE para su uso como suplemento.
El objetivo principal de este estudio fue investigar el efecto terapéutico de AGE sobre la gingivitis en perros utilizando múltiples indicadores de evaluación, incluyendo la puntuación del índice gingival (Figura 1), los niveles de VSCs en el aire exhalado (Figura 2), los niveles de tiol (Figura 3), la actividad enzimática de las bacterias patógenas periodontales (Figura 4) y las concentraciones salivales de IgA y CAMP (Figura 5). Con base en los resultados obtenidos de estos indicadores de evaluación, consideramos que el AGE tiene un potencial efecto terapéutico sobre la gingivitis canina, como se describe más adelante.
Los signos clínicos de la enfermedad periodontal canina incluyen inflamación gingival con enrojecimiento, hinchazón y sangrado (8). Por lo tanto, la severidad de la gingivitis se evaluó mediante un índice gingival entre 0 y 3, como se había empleado previamente en otros estudios (41, 42). La puntuación disminuyó significativamente solo en el grupo AGE y fue significativamente menor en el grupo AGE que en el grupo placebo a las 4 semanas (Figura 1). La puntuación en el grupo AGE continuó siendo más baja que en el grupo placebo a las 8 semanas, aunque no hubo diferencias significativas. Esto sugiere que el AGE puede mejorar el grado de inflamación gingival en perros.
El mal olor oral, también conocido como halitosis, es el primer signo clínico de enfermedad periodontal detectado por los dueños de perros (50). Las principales fuentes de halitosis son las VSC, como el sulfuro de hidrógeno, el metil mercaptano y el sulfuro de dimetilo, que son producidos por bacterias orales anaeróbicas (51). Las bacterias anaeróbicas gramnegativas orales pueden degradar los componentes proteicos de la saliva, las células sanguíneas, las células epiteliales orales y los restos de alimentos en cisteína y metionina, lo que resulta en la producción de VSC (52). Los niveles de VSCs en el aire exhalado se correlacionan positivamente con los parámetros clínicos de la enfermedad periodontal, como los índices gingivales y de cálculo en perros Beagle (5). En este estudio, el nivel de VSCs aumentó significativamente en el grupo de placebo y la puntuación de OraStrip disminuyó significativamente en ambos grupos, independientemente de la administración de AGE, posiblemente porque las condiciones inflamatorias gingivales de los perros examinados seguían cambiando activamente durante el período experimental. En tal situación, la administración de AGE suprimió el aumento de los niveles de VSCs en el aire exhalado (Figura 2). Sin embargo, este estudio también mostró que no hubo diferencias significativas en la puntuación de la prueba OraStrip entre los grupos AGE y Placebo (Figura 3), lo que se asocia con los niveles de tiol en el margen gingival. Un estudio clínico en seres humanos indicó una relación entre la halitosis y los microorganismos productores de VSC en la lengua (52). Las bacterias orales asociadas con la halitosis, como las especies Porphyromonas, Fusobacterium y Streptococcus, colonizan la mucosa dorsal de la lengua canina (53). Tomados en conjunto, estos informes sugieren que la producción de VSCs en el aire exhalado es el resultado no solo de la microflora marginal gingival, sino también de la microflora en la lengua. Por lo tanto, la supresión inducida por AGE de los niveles de VSC en el aire exhalado canino puede atribuirse a la prevención de la proliferación bacteriana asociada a la halitosis en la lengua. Se necesitan más estudios para determinar los efectos de AGE en la microflora de la lengua.
Los patógenos periodontales humanos como Porphyromonas gingivalis, Treponema denticola, Tanerella forthysia y Capnocytophaga ochracea producen enzimas similares a la tripsina que hidrolizan la N-benzoil-DL-arginina-2-naftilamida (BANA) (54). Las ayudas diagnósticas que utilizan BANA para indicar la presencia de bacterias periodontopáticas se pueden utilizar convenientemente en el consultorio en medicina dental humana y se ha demostrado que se correlacionan bien con los indicadores clínicos utilizados para diagnosticar la enfermedad periodontal (55, 56). Las bacterias orales presentes en la placa dental desempeñan un papel importante en el inicio y la progresión de la gingivitis y la periodontitis (3, 5). Un estudio transversal informó que las especies patógenas prevalentes identificadas en perros con encía sana, gingivitis y periodontitis leve fueron Peptostreptococcus, Peptostreptococcaceae y especies de Actinomyces, y que Corynebacterium canis fue significativamente más abundante en perros con gingivitis y periodontitis que en perros sanos (57). Otro estudio reveló que los patógenos predominantes fueron Bacteroides heparinolyticus, Pasteurella dagmatis, Actinomyces canis, Porphyromonas cangingivalis y Desulfomicrobium orale en perros con gingivitis o periodontitis (2). En particular, la actividad hidrolítica de BANA por especies de Corynebacterium y Actinomyces se correlaciona positivamente con la gravedad de la enfermedad periodontal en perros Beagle (58). En este estudio, la administración de AGE suprimió la actividad hidrolítica de BANA en comparación con el placebo (Figura 4), aunque esto no es evidencia directa de patógenos periodontales. Los estudios in vitro demostraron que los extractos etanólicos y acuosos de ajo inhibían el crecimiento de patógenos periodontales humanos como Porphyromonas gingivalis y Aggregatibacter actinomycetemcomitans (59). El sulfuro de dialilo, un componente lipofílico en AGE, induce la muerte celular en Aggregatibacter actinomycetemcomitans a través de la inhibición de la glutatión S-transferasa (60). Estos resultados sugirieron que el extracto de ajo y los fitoquímicos derivados del ajo poseen actividad antimicrobiana directa contra los patógenos periodontales. Sin embargo, se desconoce la actividad antimicrobiana de AGE y sus componentes, aparte del sulfuro de dialilo, contra patógenos periodontales. Por lo tanto, se requieren más estudios, particularmente en perros.
La saliva contiene una amplia variedad de sustancias antimicrobianas, y el mantenimiento de la microflora oral por estas sustancias juega un papel importante en la prevención de la enfermedad periodontal (61, 62). Las sustancias antimicrobianas en la saliva entera se derivan de varias células, como las células epiteliales, las glándulas salivales y los neutrófilos (61). La saliva es una rica fuente de células epiteliales orales que expresan receptores funcionales tipo toll (TLR) como TLR-2 y TLR-4, que interactúan con la mayoría de los patógenos periodontales (63). La IgA es comúnmente conocida como una de las primeras líneas de defensa contra la adherencia e invasión de bacterias patógenas (64). Nuestros hallazgos indicaron que la administración de AGE no tuvo ningún efecto sobre las concentraciones salivales de IgA (Figura 5A).
Los péptidos antimicrobianos exhiben un amplio espectro de actividades antibacterianas (65) y desempeñan un papel importante en las respuestas inmunitarias innatas (66). Además, los péptidos antimicrobianos regulan directamente el equilibrio entre proinflamatorios y antiinflamatorios (65). Estos informes sugieren que los péptidos antimicrobianos contribuyen no solo a la defensa contra las bacterias patógenas orales, sino también a la supresión de la inflamación gingival, lo que resulta en la prevención y el tratamiento de la enfermedad periodontal. Las catelicidinas son una familia de péptidos antimicrobianos que se encuentran comúnmente en numerosos mamíferos como humanos, ratones y perros (67). Un estudio proteómico previo detectó CAMP en la saliva de perros sanos (60). En este estudio, la administración de AGE aumentó la concentración de CAMP salival en perros con gingivitis leve (Figura 5B), lo que sugiere que el aumento inducido por AGE en la concentración de CAMP salival podría contribuir en parte a la supresión de la gingivitis (Figura 1), los niveles de VSC en el aire exhalado (Figura 2) y la actividad enzimática de los patógenos periodontales (Figura 4).
Como se mencionó, un ensayo clínico en humanos demostró que el consumo diario de AGE durante 4 meses benefició la salud bucal al reducir la inflamación y el sangrado gingival (36). Un estudio adicional en humanos evaluó la pérdida de apego causada por la formación de bolsas entre el diente y las encías en la periodontitis después del uso de AGE durante 18 meses, en el que el nivel de periodontitis fue significativamente menor en el grupo AGE que en el grupo placebo (37). Estos dos estudios clínicos en humanos indican que el AGE puede llegar a ser importante en la prevención de las enfermedades periodontales (68). Sin embargo, los mecanismos a través de los cuales el AGE ejerce sus efectos beneficiosos contra las enfermedades periodontales aún no se han dilucidado (68, 69). AGE puede ser un candidato prometedor para su uso en el tratamiento de enfermedades periodontales en humanos, pero se requieren más estudios para aclarar los mecanismos moleculares básicos involucrados (69). En este estudio, la duración (8 semanas) de uso en perros con gingivitis fue más corta que la de los estudios clínicos en humanos (4-18 meses), pero hubo resultados significativos que incluyeron una mejora de la gingivitis y la halitosis, la supresión de la actividad hidrolítica de BANA y el aumento del CAMP salival en perros a los que se les administró AGE. Si la duración de la administración se extiende a un nivel mensual o anual, el efecto terapéutico de AGE sobre la gingivitis canina puede ser más claro y se puede ejercer el efecto preventivo de las enfermedades periodontales. Un aumento de la dosis (más de 18 mg/kg/día) puede hacer que el efecto de AGE sea más claro. Además, este estudio podría sugerir que la supresión de la actividad hidrolítica de BANA en patógenos periodontales y el aumento de la concentración de CAMP salival explican en parte los efectos terapéuticos de AGE en enfermedades periodontales en animales y humanos.
En este estudio, examinamos los efectos de AGE sobre la gingivitis en perros Beagle y discutimos su utilidad. Sin embargo, la principal limitación fue que la raza utilizada se limitó a los Beagles y el tamaño de la muestra fue pequeño (cinco perros en cada grupo). Un grupo de investigación realizó un estudio a gran escala sobre los efectos de Ascophyllum nodosum en la salud bucal canina en 60 perros de varias razas, incluidos los chins japoneses, los schnauzers miniatura, los chihuahuas, los pomeranias y los West Highland White Terriers, discutiendo las razas de perros, el peso corporal y el tamaño de la muestra evaluados (70). La evaluación, en comparación con sus resultados previos (71), reveló algunas diferencias entre los estudios. Por lo tanto, se necesitan estudios a gran escala para investigar los efectos terapéuticos de AGE sobre la enfermedad periodontal en una amplia gama de razas y tamaños corporales. En segundo lugar, este estudio examinó el efecto de AGE solo en la gingivitis leve con un índice gingival inferior a 1; Por lo tanto, se necesitan más estudios en perros con gingivitis y periodontitis más severas.
En conclusión, el presente estudio demostró por primera vez que la alimentación con AGE a 18 mg/kg/día durante 8 semanas mejoró la gingivitis y la halitosis en perros Beagle con gingivitis leve. También sugerimos que la propiedad antibacteriana directa de AGE y/o un aumento de la CAMP salival pueden estar implicadas en el mecanismo subyacente. Estos hallazgos pueden respaldar la posible aplicación de AGE como suplemento oral para la prevención y el tratamiento de la gingivitis en perros. Los estudios futuros se centrarán en el papel de AGE en la enfermedad periodontal moderada a grave.
Declaración de disponibilidad de datos
Las contribuciones originales presentadas en el estudio están incluidas en el artículo/Material complementario, las consultas posteriores pueden dirigirse al autor correspondiente.
Declaración ética
El estudio en animales fue aprobado por el Comité de Bienestar Animal de Kitayama Labes Corporation (número de aprobación NBC57-024; fecha de aprobación: 28 de enero de 2021). El estudio se llevó a cabo de acuerdo con la legislación local y los requisitos institucionales.
Contribuciones de los autores
KT: Conceptualización, Curación de datos, Redacción – borrador original. HN: Curación de datos, Investigación, Redacción – borrador original. MU: Conceptualización, Curación de datos, Redacción – borrador original. MT: Investigación, Escritura – Revisión y Edición. MN: Investigación, Redacción – revisión y edición. TM: Investigación, Escritura – Revisión y Edición. HJ: Conceptualización, Investigación, Metodología, Escritura – Revisión y Edición. NA: Investigación, Escritura – Revisión y Edición. SM: Investigación, Redacción – revisión y edición. AY: Investigación, Redacción – revisión y edición. YE: Supervisión, Redacción – revisión y edición. OY: Conceptualización, Investigación, Metodología, Recursos, Supervisión, Redacción – revisión y edición.
Financiación
El/los autor/es declara(n) haber recibido apoyo financiero para la investigación, autoría y/o publicación de este artículo. Wakunaga Pharmaceutical Co. Ltd. proporcionó los fondos para este estudio.
Conflicto de intereses
HN, MU, MT, MN, TM y HJ fueron empleados de Wakunaga Pharmaceutical Co., Ltd.
Los autores declaran que este estudio recibió financiación de Wakunaga Pharmaceutical Co., Ltd. El financiador tuvo la siguiente participación en el estudio: proporcionar el AGE para el estudio.
El/los autor/es declararon, en el momento de la presentación, ser miembro del consejo editorial de Frontiers. Esto no tuvo ningún impacto en el proceso de revisión por pares y en la decisión final de publicar este manuscrito.
Nota del editor
Todas las afirmaciones expresadas en este artículo son únicamente las de los autores y no representan necesariamente las de sus organizaciones afiliadas, ni las del editor, los editores y los revisores. Cualquier producto que pueda ser evaluado en este artículo, o afirmación que pueda ser hecha por su fabricante, no está garantizado ni respaldado por el editor.
Material complementario
El material complementario para este artículo se puede encontrar en línea en: https://www.frontiersin.org/articles/10.3389/fvets.2023.1277272/full#supplementary-material
Abreviaturas
AGE, extracto de ajo envejecido; Nrf2: factor nuclear eritroide 2 relacionado con el factor 2; AAS: amiloide A sérico; PCR: proteína C reactiva; VSC, compuestos volátiles de azufre; IgA: inmunoglobulina A; CAMP: péptido antimicrobiano catelicidina; BANA, N-benzoil-DL-arginina-2-naftilamida.
Referencias
1. Wallis, C, Marshall, M, Colyer, A, O’Flynn, C, Deusch, O, y Harris, S. Una evaluación longitudinal de los cambios en la composición de la comunidad bacteriana asociados con el desarrollo de la enfermedad periodontal en perros. Microbiol veterinario. (2015) 181:271–82. doi: 10.1016/j.vetmic.2015.09.003
Resumen de PubMed | Texto completo de CrossRef | Google Académico
2. Riggio, MP, Lennon, A, Taylor, DJ y Bennett, D. Identificación molecular de bacterias asociadas con la enfermedad periodontal canina. Microbiol veterinario. (2011) 150:394–400. doi: 10.1016/j.vetmic.2011.03.001
3. Wallis, C, y Holcombe, LJ. Una revisión de la frecuencia y el impacto de la enfermedad periodontal en perros. J Pequeña Anim Pract. (2020) 61:529–40. doi: 10.1111/jsap.13218
Resumen de PubMed | Texto completo de CrossRef | Google Académico
4. Pereira dos Santos, JD, Cunha, E, Nunes, T, Tavares, L, y Oliveira, M. Relación entre la enfermedad periodontal y las enfermedades sistémicas en perros. Res Vet Sci. (2019) 125:136–40. doi: 10.1016/j.rvsc.2019.06.007
Resumen de PubMed | Texto completo de CrossRef | Google Académico
5. Iwashita, N, Sugita, K, Murata, S, Ichimura, K, Shirai, M, Hisasue, M, et al. Agravamiento dependiente de la edad del mal olor oral y la enfermedad periodontal en perros. Fundam Toxicol Sci. (2019) 6:75–9. doi: 10.2131/fts.6.75
6. Kortegaard, HE, Eriksen, T y Baelum, V. Enfermedad periodontal en perros beagle de investigación: un estudio epidemiológico. J Pequeña Anim Pract. (2008) 49:610–6. doi: 10.1111/j.1748-5827.2008.00609.x
7. Niemiec, BA. Enfermedad periodontal. El mejor compañero Anim Med. (2008) 23:72–80. doi: 10.1053/j.tcam.2008.02.003
8. Kim, WJ, Soh, Y y Heo, SM. Avances recientes de dianas terapéuticas para el tratamiento de la enfermedad periodontal. Biomol Ther. (2021) 29:263–7. doi: 10.4062/biomolther.2021.001
Resumen de PubMed | Texto completo de CrossRef | Google Académico
9. Albuquerque, C, Morinha, F, Requicha, J, Martins, T, Dias, I, Guedes-Pinto, H, et al. Periodontitis canina: el perro como modelo importante para los estudios periodontales. Veterinario J. (2012) 191:299–305. doi: 10.1016/j.tvjl.2011.08.017
10. Dewey, CW y Rishniw, M. La enfermedad periodontal se asocia con la disfunción cognitiva en perros de edad avanzada: una comparación prospectiva ciega de las puntuaciones del cuestionario periodontal visual y cognitivo. Open Vet J. (2021) 11:210–6. doi: 10.5455/OVJ.2021.v11.i2.4
Resumen de PubMed | Texto completo de CrossRef | Google Académico
11. Glickman, LT, Glickman, NW, Moore, GE, Goldstein, GS, y Lewis, HB. Evaluación del riesgo de endocarditis y otros eventos cardiovasculares en función de la gravedad de la enfermedad periodontal en perros. J Am Vet Med Assoc. (2009) 234:486–94. doi: 10.2460/javma.234.4.486
Resumen de PubMed | Texto completo de CrossRef | Google Académico
12. Rawlinson, JE, Goldstein, RE, Reiter, AM, Attwater, DZ, y Harvey, CE. Asociación de la enfermedad periodontal con índices de salud sistémicos en perros y la respuesta sistémica al tratamiento de la enfermedad periodontal. J Am Vet Med Assoc. (2011) 238:601–9. doi: 10.2460/javma.238.5.601
Resumen de PubMed | Texto completo de CrossRef | Google Académico
13. Glickman, LT, Glickman, NW, Moore, GE, Lund, EM, Lantz, GC y Pressler, BM. Asociación entre la enfermedad renal azotémica crónica y la gravedad de la enfermedad periodontal en perros. Prev Vet Med. (2011) 99:193–200. doi: 10.1016/j.prevetmed.2011.01.011
Resumen de PubMed | Texto completo de CrossRef | Google Académico
14. Bellows, J, Berg, ML, Dennis, S, Harvey, R, Lobprise, HB, Snyder, CJ, et al. 2019 Pautas de cuidado dental de la AAHA para perros y gatos. J Am Anim Hosp Assoc. (2019) 55:49–69. doi: 10.5326/JAAHA-MS-6933
Resumen de PubMed | Texto completo de CrossRef | Google Académico
15. Lindhe, J, Hamp, SE, y Löe, H. Periodontitis experimental en el perro beagle. J Res. Periodontal. (1973) 8:1–10. doi: 10.1111/j.1600-0765.1973.tb00735.x
16. Miller, BR, y Harvey, CE. Cumplimiento de las recomendaciones de higiene bucodental tras el tratamiento periodontal en perros de cliente. J Vet Dent. (1994) 11:18–9. doi: 10.1177/089875649401100103
Resumen de PubMed | Texto completo de CrossRef | Google Académico
17. Grave, K, y Tanem, H. Cumplimiento del tratamiento farmacológico antibacteriano oral a corto plazo en perros. J Pequeña Anim Pract. (1999) 40:158–62. doi: 10.1111/j.1748-5827.1999.tb03781.x
Resumen de PubMed | Texto completo de CrossRef | Google Académico
18. Ray, JD, y Eubanks, DL. Cuidado dental en el hogar: enseñando a tus clientes a cuidar los dientes de sus mascotas. J Vet Dent. (2009) 26:57–60. doi: 10.1177/089875640902600115
Resumen de PubMed | Texto completo de CrossRef | Google Académico
19. Abdolahinia, ED, Hajisadeghi, S, Banan, ZM, Dadgar, E, Delaramifar, A, Izadian, S, et al. Potencial aplicación de hierbas medicinales y fitoquímicos en la salud bucodental: statu quo y perspectivas de futuro. Oral Dis. (2022) 29:2468–82. doi: 10.1111/odi.14276
Resumen de PubMed | Texto completo de CrossRef | Google Académico
20. Singh, V, Gupta, A, Verma, UP, Mishra, T, y Pal, M. Una evaluación de la eficacia del extracto etanólico de Nigella sativa L. (Kalonji) sobre los parámetros clínicos de la gingivitis moderada a grave: un estudio clínico de boca abierta. Ayu. (2019) 40:152–8. DOI: 10.4103/AYU. AYU_68_18
21. Tomo, S, Santos, I, da Cruz, TM, Miyahara, GI, y Simonato, LE. Traumatismo por quemadura de ajo de la mucosa oral en un paciente con neuralgia del trigémino: reporte de un caso. Abolladura Traumatismo. (2022) 38:340–4. doi: 10.1111/edt.12740
22. Lee, KW, Yamato, O, Tajima, M, Kuraoka, M, Omae, S, y Maede, Y. Cambios hematológicos asociados con la aparición de eccentrocitos después de la administración intragástrica de extracto de ajo a perros. Am J Vet Res. (2000) 61:1446–50. doi: 10.2460/ajvr.2000.61.1446
23. Kodera, Y, Kurita, M, Nakamoto, M y Matsutomo, T. Química del ajo envejecido: diversidad de constituyentes en el extracto de ajo envejecido y sus mecanismos de producción a través de la combinación de reacciones químicas y enzimáticas. Exp Ther Med. (2019) 19:1574–84. doi: 10.3892/etm.2019.8393
Resumen de PubMed | Texto completo de CrossRef | Google Académico
24. Borek, C. Efectos antioxidantes para la salud del extracto de ajo envejecido. J Nutr. (2001) 131:1010S–5S. doi: 10.1093/jn/131.3.1010S
25. Tsuneyoshi, T. BACH1 media las propiedades antioxidantes del extracto de ajo envejecido. Exp Ther Med. (2019) 19:1500–3. doi: 10.3892/etm.2019.8380
Resumen de PubMed | Texto completo de CrossRef | Google Académico
26. Morihara, N, Hino, A, Miki, S, Takashima, M y Suzuki, J. El extracto de ajo envejecido suprime la inflamación en ratones knockout de apolipoproteína E. Mol Nutr Food Res. (2017) 61:1700308. doi: 10.1002/mnfr.201700308
Resumen de PubMed | Texto completo de CrossRef | Google Académico
27. Suzuki, J, Kodera, Y, Miki, S, Ushijima, M y Takashima, M. Acción antiinflamatoria del derivado de cisteína S-1-propenilcisteína mediante la inducción de la degradación de MyD88. Sci Rep. (2018) 8:–10. doi: 10.1038/s41598-018-32431-0
28. Miki, S, Suzuki, J, Kunimura, K y Morihara, N. Mecanismos subyacentes a la atenuación de enfermedades inflamatorias crónicas por extracto de ajo envejecido: participación de la activación de la proteína quinasa activada por AMP. Exp Ther Med. (2020) 19:1462–7. doi: 10.3892/etm.2019.8372
Resumen de PubMed | Texto completo de CrossRef | Google Académico
29. Kyo, E, Uda, N, Kasuga, S e Itakura, Y. Efectos inmunomoduladores del extracto de ajo envejecido. J Nutr. (2001) 131:1075S–9S. doi: 10.1093/jn/131.3.1075S
Resumen de PubMed | Texto completo de CrossRef | Google Académico
30. Suzuki, J, Yamaguchi, T, Matsumoto, T, Amano, H, Morihara, N y Kodera, Y. S-1-propenilcisteína promueve la diferenciación de las células B en células productoras de IgA mediante la inducción de la expresión de Xbp1 dependiente de Erk2/1 en los parches de Peyer. Nutrición. (2016) 32:884–9. doi: 10.1016/j.nut.2016.01.026
31. Suzuki, J, Miki, S, Ushijima, M y Kodera, Y. Regulación de la respuesta inmune por S-1-propenilcisteína a través de la degradación de proteínas mediada por autofagia. Exp Ther Med. (2020) 19:1570–3. doi: 10.3892/etm.2019.8392
Resumen de PubMed | Texto completo de CrossRef | Google Académico
32. Lv, Y, So, KF, Wong, NK y Xiao, J. Actividades anticancerígenas de la S-alilmercaptocisteína del ajo envejecido. Chin J Nat Med. (2019) 17:43–9. doi: 10.1016/S1875-5364(19)30008-1
Resumen de PubMed | Texto completo de CrossRef | Google Académico
33. Ried, K. El ajo reduce la presión arterial en sujetos hipertensos, mejora la rigidez arterial y la microbiota intestinal: una revisión y metaanálisis. Exp Ther Med. (2020) 19:1472–8. doi: 10.3892/etm.2019.8374
Resumen de PubMed | Texto completo de CrossRef | Google Académico
34. Gruenwald, J, Bongartz, U, Bothe, G y Uebelhack, R. Efectos del extracto de ajo envejecido sobre la elasticidad arterial en un ensayo clínico controlado con placebo utilizando la tecnología EndoPAT™. Exp Ther Med. (2020) 19:1490–9. doi: 10.3892/etm.2019.8378
35. Gómez-Arbeláez, D, Lahera, V, Oubiña, P, Valero-Muñoz, M, de Las, HN, Rodríguez, Y, et al. El extracto de ajo envejecido mejora los niveles de adiponectina en sujetos con síndrome metabólico: un estudio doble ciego, controlado con placebo, aleatorizado y cruzado. Mediat Inflamm. (2013) 2013:285795:1–6. doi: 10.1155/2013/285795
36. Zini, A, Mann, J, Mazor, S, y Vered, Y. La eficacia del extracto de ajo envejecido en la gingivitis: un ensayo clínico aleatorizado. J Clin Dent. (2018) 29:52–6.
37. Zini, A, Mann, J, Mazor, S y Vered, Y. Efecto beneficioso del extracto de ajo envejecido sobre la periodontitis: un estudio clínico aleatorizado, controlado y doble ciego. J Clin Biochem Nutr. (2020) 67:297–301. doi: 10.3164/jcbn.20-52
Resumen de PubMed | Texto completo de CrossRef | Google Académico
38. Ohtani, M y Nishimura, T. Los aminoácidos que contienen azufre en el extracto de ajo envejecido inhiben la inflamación en las células epiteliales gingivales humanas al suprimir la expresión de la molécula de adhesión intercelular-1 y la secreción de IL-6. Biomed Rep. (2020) 12:99–108. doi: 10.3892/br.2019.1269
Resumen de PubMed | Texto completo de CrossRef | Google Académico
39. Yamato, O, Tsuneyoshi, T, Ushijima, M, Jikihara, H y Yabuki, A. Seguridad y eficacia del extracto de ajo envejecido en perros: regulación positiva de la vía de señalización del factor nuclear eritroide 2 relacionado con el factor 2 (Nrf2) y las enzimas antioxidantes de fase II reguladas por Nrf2. BMC Vet Res. (2018) 14:373. doi: 10.1186/s12917-018-1699-2
Resumen de PubMed | Texto completo de CrossRef | Google Académico
40. Matsutomo, T, y Kodera, Y. Desarrollo de un método analítico para compuestos de azufre en extracto de ajo envejecido utilizando un método de cromatografía líquida de alta resolución posterior a la columna con detección específica de azufre. J Nutr. (2016) 146:450S–5S. doi: 10.3945/jn.114.208520
Resumen de PubMed | Texto completo de CrossRef | Google Académico
41. Yamaki, S, Hachimura, H, Ogawa, M, Kanegae, S, Sugimoto, T y Amimoto, A. Estudio de seguimiento a largo plazo después de la administración de una preparación canina α con interferón para la gingivitis felina. J Vet Med Sci. (2020) 82:232–6. doi: 10.1292/jvms.19-0187
Resumen de PubMed | Texto completo de CrossRef | Google Académico
42. Eubanks, DL. Valoración de la enfermedad periodontal. J Vet Dent. (2010) 27:58–60. doi: 10.1177/089875641002700112
43. Marretta, SM, Leesman, M, Burgess-Cassler, A, McClure, GD Jr, Buelow, M, y Finn, M. Evaluación piloto de una nueva tira reactiva para la evaluación de los niveles de tiol disuelto, como indicador de la salud gingival canina y el estado periodontal. ¿Puede Vet J. (2012) 53:1260–5.
44. Queck, KE, Chapman, A, Horzog, LJ, Shell-Martin, T, Burgess-Cassler, A, y McClure, GD. La prueba de detección de tiol en el fluido oral identifica la enfermedad periodontal activa subyacente no detectada por el examen visual despierto. J Am Anim Hosp Assoc. (2018) 54:132–7. doi: 10.5326/JAAHA-MS-6607
Resumen de PubMed | Texto completo de CrossRef | Google Académico
45. Loesche, WJ, Bretz, WA, Kerschensteiner, D, Stoll, J, Socransky, SS, Hujoel, P, et al. Desarrollo de una prueba diagnóstica de infecciones periodontales anaerobias basada en la hidrólisis en placa de benzoil-DL-arginina-naftilamida. J Clin Microbiol. (1990) 28:1551–9. doi: 10.1128/jcm.28.7.1551-1559.1990
Resumen de PubMed | Texto completo de CrossRef | Google Académico
46. Iwasaki, M, Usui, M, Ariyoshi, W, Nakashima, K, Nagai-Yoshioka, Y, Inoue, M, et al. Un estudio preliminar sobre la capacidad del kit de ensayo de actividad peptidasa similar a la tripsina para detectar periodontitis. Dent J. (2020) 8:8. doi: 10.3390/dj8030098
Resumen de PubMed | Texto completo de CrossRef | Google Académico
47. Yamato, O, Kasai, E, Katsura, T, Takahashi, S, Shiota, T, Tajima, M, et al. Anemia hemolítica del cuerpo de Heinz con eccentrocitosis por ingestión de cebollino chino (Allium tuberosum) y ajo (Allium sativum) en un perro. J Am Anim Hosp Assoc. (2005) 41:68–73. doi: 10.5326/0410068
Resumen de PubMed | Texto completo de CrossRef | Google Académico
48. Sibley, PL, Traina, VM y Parekh, CK. Rango normal y variabilidad de los parámetros hematológicos y hemoquímicos de los perros beagle y los monos rhesus. Toxicol Pathol. (1974) 2:22–8. doi: 10.1177/019262337400200305
49. Matsuzawa, T, Nomura, M y Unno, T. Rangos de referencia de patología clínica de animales de laboratorio. Grupo de trabajo II, Subcomité de evaluación de la seguridad no clínica de la Asociación de Fabricantes Farmacéuticos de Japón. J Vet Med Sci. (1993) 55:351–62. doi: 10.1292/jvms.55.351
50. Rawlings, JM y Culham, N. Halitosis en perros y el efecto de la terapia periodontal. J Nutr. (1998) 128:S2715-6. doi: 10.1093/jn/128.12.2715S
Resumen de PubMed | Texto completo de CrossRef | Google Académico
51. Salako, NO, y Philip, L. Comparación del uso del halímetro y el croma oral en la evaluación de la capacidad de las bacterias anaerobias orales cultivables comunes para producir compuestos de azufre volátiles malolientes a partir de cisteína™ y metionina. Med Princ Pract. (2010) 20:75–9. doi: 10.1159/000319760
52. Hartley, MG, El-Maaytah, MA, Mckenzie, C, y Greenman, J. La microbiota de la lengua de individuos poco olores y malolientes. Microb Ecol Health Dis. (1996) 9:215–23. doi: 10.3109/08910609609166462
53. Ruparell, A, Inu, T, Staunton, R, Walis, C, Deusch, O, y Holcombe, LJ. El microbioma oral canino: variación de las poblaciones bacterianas en diferentes nichos. BMC Microbiol. (2020) 20:42. doi: 10.1186/s12866-020-1704-3
Resumen de PubMed | Texto completo de CrossRef | Google Académico
54. Ishihara, K, Naito, Y, Kato, T, Takazoe, I, Okuda, K, Eguchi, T, et al. Un método enzimático sensible (SK-013) para la detección y cuantificación de periodontopatógenos específicos. J Res. Periodontal. (1992) 27:81–5. doi: 10.1111/j.1600-0765.1992.tb01807.x
Resumen de PubMed | Texto completo de CrossRef | Google Académico
55. Loesche, WJ, Lopatin, DE, Giordano, J, Alcoforado, G, y Hujoel, P. Comparación de la prueba de benzoil-DL-arginina-naftilamida (BANA), sondas de ADN y reactivos inmunológicos para la capacidad de detectar infecciones periodontales anaeróbicas debidas a Porphyromonas gingivalis, Treponema denticola, y Bacteroides forsythus. J Clin Microbiol. (1992) 30:427–33. doi: 10.1128/jcm.30.2.427-433.1992
Resumen de PubMed | Texto completo de CrossRef | Google Académico
56. Mohanty, R, Asopa, SJ, Joseph, MD, Singh, B, Rajguru, JP, Saidath, K, et al. Complejo rojo: conglomerado polimicrobiano en flora oral: una revisión. J Family Med Prim Care. (2019) 8:3480–6. doi: 10.4103/jfmpc.jfmpc_759_19
Resumen de PubMed | Texto completo de CrossRef | Google Académico
57. Davis, IJ, Wallis, C, Deusch, O, Colyer, A, Milella, L, Loman, N, et al. Un estudio transversal de las especies bacterianas en la placa de los perros de los clientes con encía sana, gingivitis. PLoS Uno. (2013) 8:e83158. doi: 10.1371/journal.pone.0083158
Resumen de PubMed | Texto completo de CrossRef | Google Académico
58. Takada, K, y Hirasawa, M. Expresión de la actividad similar a la tripsina por los géneros Corynebacterium y Actinomyces en la periodontitis canina. J Med Microbiol. (2000) 49:621–5. doi: 10.1099/0022-1317-49-7-621
Resumen de PubMed | Texto completo de CrossRef | Google Académico
59. Shetty, S, Thomas, B, Shetty, V, Bhandary, R, y Shetty, RM. Una evaluación in vitro de la eficacia del extracto de ajo como agente antimicrobiano sobre patógenos periodontales: un estudio microbiológico. Ayu. (2013) 34:445–51. doi: 10.4103/0974-8520.127732
60. Velliyagounder, K, Ganeshnarayan, K, Velusamy, SK, y Fine, DH. Eficacia in vitro de sulfuros de dialilo frente al periodontopatógeno Aggregatibacter actinomycetemcomitans. Agentes antimicrobianos quimiotera. (2012) 56:2397–407. doi: 10.1128/AAC.00020-12
61. Torres, SMF, Surco, E, Souza, CP, Granick, JL, de Jong, EP, Griffin, TJ, et al. Proteómica salival de perros sanos: un catálogo en profundidad. PLoS Uno. (2018) 13:E0191307. doi: 10.1371/journal.pone.0191307
Resumen de PubMed | Texto completo de CrossRef | Google Académico
62. Lynge Pedersen, AM, y Belstrøm, D. El papel de las defensas salivales naturales en el mantenimiento de una microbiota oral sana. J Dent. (2019) 80:S3–S12. doi: 10.1016/j.jdent.2018.08.010
Resumen de PubMed | Texto completo de CrossRef | Google Académico
63. Swaminathan, V, Prakasam, S, Puri, V y Srinivasan, M. Papel de los receptores epiteliales salivales tipo toll 2 y 4 en la modulación de las respuestas inmunitarias innatas en la periodontitis crónica. J Res. Periodontal. (2013) 48:757–65. doi: 10.1111/jre.12066
Resumen de PubMed | Texto completo de CrossRef | Google Académico
64. Marcotte, H, y Lavoie, MC. Ecología microbiana oral y el papel de la inmunoglobulina salival a. Microbiol Mol Biol Rev. (1998) 62:71–109. doi: 10.1128/MMBR.62.1.71-109.1998
Resumen de PubMed | Texto completo de CrossRef | Google Académico
65. Prasad, SV, Fiedoruk, K, Daniluk, T, Piktel, E y Bucki, R. Expresión y función de los péptidos de defensa del huésped en los sitios de inflamación. Int J Mol Sci. (2019) 21:104. doi: 10.3390/ijms21010104
66. Hans, M, y Madaan, HV. Péptidos antimicrobianos epiteliales: guardianes de la cavidad bucal. Int J Pept. (2014) 2014:370297. doi: 10.1155/2014/370297
Resumen de PubMed | Texto completo de CrossRef | Google Académico
67. Zanetti, M. El papel de las catelicidinas en las defensas innatas del huésped de los mamíferos. Curr emite Mol Biol. (2005) 7:179–96. doi: 10.21775/cimb.007.179
68. Mann, J, Bernstein, Y, y Findler, M. La enfermedad periodontal y su prevención, por vías tradicionales y nuevas. Exp Therap Med. (2020) 19:1504–6. doi: 10.3892/etm.2019.8381
Resumen de PubMed | Texto completo de CrossRef | Google Académico
69. Ohtani, M, y Nishimura, T. La aplicación preventiva y terapéutica del ajo y otros ingredientes vegetales en el tratamiento de las enfermedades periodontales. Exp Therap Med. (2020) 19:1507–10. doi: 10.3892/etm.2019.8382
Resumen de PubMed | Texto completo de CrossRef | Google Académico
70. Gawor, J, Jank, M, Jodkowska, K, Klim, E y Svensson, Reino Unido. Efectos de las golosinas comestibles que contienen Ascophyllum nodosum en la salud bucal de los perros: un estudio doble ciego, aleatorizado, controlado con placebo y de un solo centro. Front Vet Sci. (2018) 5:168. doi: 10.3389/fvets.2018.00168
Resumen de PubMed | Texto completo de CrossRef | Google Académico
Palabras clave: extracto de ajo envejecido, perro, salud bucal, higiene bucal, cuidado dental domiciliario, índice gingival, halitosis, catelicidina salival
Cita: Takahashi K, Nango H, Ushijima M, Takashima M, Nakamoto M, Matsutomo T, Jikihara H, Arakawa N, Maki S, Yabuki A, Endo Y y Yamato O (2023) Efecto terapéutico del extracto de ajo envejecido sobre la gingivitis en perros. Frente. Vet. Sci. 10:1277272. doi: 10.3389/fvets.2023.1277272
Recibido: 14 de agosto de 2023; Aceptado: 02 de octubre de 2023;
Publicado: 06 Noviembre 2023.
Editado por:
Boaz Arzi, Universidad de California, Davis, Estados Unidos
Revisado por:
Jamie Gail Anderson, Servicios Dentales Veterinarios de Sacramento (SacVDS), Estados
Unidos Michal Aureliusz Jank, Universidad de Ciencias de la Vida de Varsovia, Polonia
Derechos de autor © 2023 Takahashi, Nango, Ushijima, Takashima, Nakamoto, Matsutomo, Jikihara, Arakawa, Maki, Yabuki, Endo y Yamato. Este es un artículo de acceso abierto distribuido bajo los términos de la Licencia Creative Commons Attribution License (CC BY).
*Correspondencia: Osamu Yamato, osam@vet.kagoshima-u.ac.jp
†Estos autores han contribuido igualmente a este trabajo
Renuncia: Todas las afirmaciones expresadas en este artículo son únicamente las de los autores y no representan necesariamente las de sus organizaciones afiliadas, ni las del editor, los editores y los revisores. Cualquier producto que pueda ser evaluado en este artículo o afirmación que pueda hacer su fabricante no está garantizado ni respaldado por el editor.
Date de alta y recibe nuestro 👉🏼 Diario Digital AXÓN INFORMAVET ONE HEALTH
Date de alta y recibe nuestro 👉🏼 Boletín Digital de Foro Agro Ganadero
Noticias animales de compañía
Noticias animales de producción
Trabajos técnicos animales de producción
Trabajos técnicos animales de compañía