Efectos de los líquidos intravenosos en perros y gatos con insuficiencia renal

Efectos de los líquidos intravenosos en perros y gatos con insuficiencia renal
 Cathy Langston* y
Cathy Langston* y  Daniel Gordon
Daniel Gordon- La Facultad de Medicina Veterinaria de la Universidad Estatal de Ohio, Columbus, OH, Estados Unidos
La fluidoterapia intravenosa ha sido durante mucho tiempo el pilar del tratamiento de la enfermedad renal, incluida la lesión renal aguda y la crisis urémica asociada con la enfermedad renal crónica. El manejo cuidadoso de la dosis de líquido es crítico, ya que los animales con enfermedad renal pueden tener trastornos marcados en su capacidad para regular la homeostasis de líquidos y el estado ácido-base. La comprensión de la fisiología del manejo de líquidos renales es necesaria, junto con la atención repetida a los parámetros del estado de los líquidos, los electrolitos y el equilibrio ácido-base, para lograr un estado de hidratación óptimo y evitar daños adicionales o disminución de la función por deshidratación o sobrehidratación.
Introducción
La fluidoterapia es el tratamiento intravenoso más comúnmente administrado para pacientes veterinarios hospitalizados. La rehidratación adecuada es esencial para la restauración del gasto cardíaco, la presión arterial sistémica y la perfusión renal. Lograr un nivel adecuado de manejo del volumen requiere el conocimiento de la fisiopatología subyacente, la evaluación del estado del volumen, la selección de la solución adecuada para la repleción y el mantenimiento del volumen y la modulación de la perfusión tisular (1).
Recientemente, Hoste et al. (2) propusieron cuatro fases distintas (ROSE) de la fluidoterapia intravenosa para humanos con enfermedades críticas: (R) reanimación, (O) optimización, (S) estabilización, (E) evacuación. En resumen, la fase de reanimación anticipa una escalada de la fluidoterapia en pacientes con shock potencialmente mortal (presión arterial baja, signos de perfusión alterada, o ambos) y se caracteriza por el uso de terapia de bolo de líquidos (infusión rápida para corregir el shock hipotensivo; ~ 10 ml / kg de cristaloide isotónico equilibrado durante 15 min; típicamente no excede un total de tres bolos). Al pasar a la fase de optimización, el paciente ya no debe estar en peligro inmediato para la vida, sino en una etapa de shock compensatorio y alto riesgo de descompensación. En este punto, la fluidoterapia adicional se administra con más precaución con la intención de optimizar la función cardíaca y mejorar la perfusión tisular. El objetivo es administrar el volumen necesario para aliviar la disfunción orgánica. Los desafíos de fluidos, definidos como un volumen pequeño durante un corto período de tiempo (~ 5 ml / kg durante 20 min), generalmente se administran en esta fase para probar los efectos de administrar más volumen (3). Algunos pacientes pueden pasar por alto la fase de reanimación (sin evidencia de hipotensión) y presentarse en el hospital en un estado compensado. En estas dos primeras fases, los reflejos neuroendocrinos compensatorios y la posible disfunción renal dan lugar a la retención de sodio y agua, contribuyendo a un balance hídrico positivo. La progresión a la fase de estabilización abarca un punto en el que el paciente está en estado estacionario sin signos de shock. La fluidoterapia en esta fase se utiliza para las pérdidas de mantenimiento continuo (renal, gastrointestinal, insensible); así como la rehidratación si el paciente está experimentando pérdidas continuas debido a una patología no resuelta. Los pacientes pueden experimentar un deterioro temporal y volver a la fase de optimización si se enfrentan a una infección recién desarrollada o disfunción orgánica. Por último, la fase de evacuación se caracteriza por la eliminación de líquidos y promueve un balance negativo de líquidos (2, 4). Esto puede necesitar ser logrado con dosis bajas de diuréticos de asa (los autores sugieren 0.25-0.5 mg / kg IV). La respuesta fisiológica a los líquidos y las condiciones subyacentes son dinámicas a lo largo del tiempo, por lo que la administración de líquidos debe basarse en la evaluación repetida del equilibrio acumulativo de líquidos y el estado hemodinámico. En general, el estado hemodinámico se puede evaluar mediante pruebas dinámicas para evaluar la capacidad de respuesta a los líquidos (5).
El interés en la fluidoterapia intravenosa y sus efectos secundarios ha aumentado en los últimos años. Muchos ensayos han investigado el debate coloide/cristaloide, mientras que otros han proporcionado orientación sobre la selección de la solución cristaloide óptima (6). Además, el papel del cloruro y su efecto perjudicial sobre la función renal ha atraído mucha atención (7-10). Gran parte de la investigación se ha centrado en la fluidoterapia en la fase de reanimación, en la que las personas reciben grandes cantidades de líquido durante un corto período de tiempo. En realidad, las personas hospitalizadas reciben líquidos y electrolitos por otras razones, incluida la terapia de mantenimiento, los medicamentos y el reemplazo de pérdidas existentes o en curso. El suministro acumulado de líquido con frecuencia excede la pérdida de líquido, lo que lleva a un balance neto positivo de líquidos o «fluencia de fluido». Con este principio en su lugar, se deben hacer consideraciones adicionales para los pacientes renales con manipulación alterada de sodio.
Patofisiología
La función principal del riñón es mantener un compartimento extracelular estable mediante la retención / eliminación selectiva de agua, electrolitos y otros solutos. Esto se logra mediante la filtración de la sangre circulante en ultrafiltrado del plasma, la reabsorción selectiva del líquido tubular en la sangre capilar peritubular y la secreción selectiva de la sangre capilar peritubular en el líquido tubular. La filtración glomerular (presión neta de ultrafiltración) está determinada por la diferencia en los gradientes de presión hidrostática y oncótica entre el plasma glomerular y el filtrado en el espacio de Bowman. Cada nefrona tiene su propia tasa de filtración glomerular de una sola nefrona (SNGFR), y la suma de las SNGFR de las nefronas funcionales constituye la tasa de filtración glomerular total (TFG). El mantenimiento de una TFG normal depende de una perfusión renal adecuada.
La lesión renal aguda (LRA) se define como una disminución rápida de la TFG a través de la medición de la creatinina sérica y la producción de orina. Existen desafíos inherentes con esta definición, ya que la creatinina está mal correlacionada con la TFG a niveles bajos de disfunción renal (11). Clínicamente, la LRA se agrupa en tres etiologías: prerrenal, renal y postrenal. La azotemia prerrenal se caracteriza por una disminución de la TFG debido a una disminución de la presión de perfusión renal sin daño al parénquima renal (12). Las causas posrenales de LRA se caracterizan por una obstrucción aguda del flujo urinario, lo que lleva a aumentos en la presión intratubular, alteración del flujo sanguíneo renal y procesos inflamatorios, y disminución de la TFG (13). La azotemia renal se asocia con una aparición repentina de lesión del parénquima renal, caracterizada por la incapacidad de los riñones para satisfacer las demandas excretoras, metabólicas y endocrinas del cuerpo. La LRA representa un continuo de lesión renal desde la pérdida leve de nefronas clínicamente inaparente hasta la insuficiencia renal aguda grave que requiere terapia de reemplazo renal. El esquema de clasificación de LRA de la Sociedad Internacional de Interés Renal (IRIS) se ha desarrollado en medicina veterinaria para determinar la clasificación adecuada en animales con LRA (14).
Las etiologías renales intrínsecas pueden ser difíciles de evaluar debido a una amplia variedad de lesiones que pueden ocurrir en el riñón. En general, el daño renal se puede dividir en cuatro grupos estructurales principales: los túbulos, los glomérulos, el intersticio y los vasos sanguíneos intrarrenales. El daño tubular puede surgir de lesión isquémica (disminución de la perfusión renal) o compuestos nefrotóxicos (exógenos y endógenos). La glomerulonefritis aguda grave secundaria a la enfermedad inmunocompleja causa daño glomerular. El daño intersticial puede resultar de nefritis intersticial aguda secundaria a medicamentos o etiologías infecciosas (leptospirosis, pielonefritis, etc.). Por último, el daño vascular puede ocurrir secundario a una lesión en los vasos intrarrenales (trombosis, hipertensión, etc.), disminuyendo posteriormente la perfusión renal y disminuyendo la TFG (15). La isquemia y los agentes nefrotóxicos (por ejemplo, ciertos medicamentos, plantas, etilenglicol, etc.) representan la mayoría de las lesiones renales en medicina humana y veterinaria (16).
La lesión tubular renal se asocia con una disminución de la TFG y se divide en diferentes fases de IRA, que están directamente relacionadas con los eventos celulares que ocurren durante la lesión y el proceso de recuperación. La fase de inicio ocurre cuando el flujo sanguíneo renal disminuye, lo que resulta en el agotamiento de ATP celular y la posterior lesión de las células epiteliales tubulares. Estos cambios alteran la capacidad de las células epiteliales tubulares y las células endoteliales vasculares para mantener la función renal normal (reabsorción y secreción), así como para regular una variedad de quimiocinas y citoquinas para iniciar una cascada inflamatoria (17). La fase de extensión se caracteriza por hipoxia continua después del evento isquémico inicial y una respuesta inflamatoria, más prominente en la región medular externa del riñón. Durante esta fase, el daño endotelial vascular probablemente juega un papel clave en la isquemia continua del epitelio tubular, así como en la respuesta inflamatoria. Las células en la región medular externa sufren lesiones y muerte a través de necrosis y apoptosis (18). La lesión celular en esta región conduce a la reducción continua de la TFG, mientras que las células del túbulo proximal en la corteza externa, donde ha regresado el flujo sanguíneo, se someten a reparación celular y mejoran morfológicamente (19). La fase de mantenimiento consiste en células sometidas a reparación, migración, apoptosis y proliferación para restablecer y mantener la integridad celular y tubular. La TFG generalmente permanece estable en el nivel determinado por la gravedad del evento inicial. La reparación y reorganización celular da como resultado una mejora lenta de la función celular, preparando el escenario para la mejora en la función de los órganos. El flujo sanguíneo regresa hacia la normalidad y las células epiteliales establecen homeostasis intracelular e intercelular (19). Durante la fase de recuperación, la diferenciación celular continúa, se restablece la polaridad epitelial y vuelve la función celular y orgánica normal (20). Alternativamente, la reparación renal puede ser desadaptativa con inflamación, fibrosis y rarefacción vascular que conduce a un mal funcionamiento persistente de las células y tejidos y, finalmente, a una enfermedad renal crónica (21). La LRA y la enfermedad renal crónica (ERC) se reconocen cada vez más como entidades relacionadas que representan un continuo de enfermedad (22).
La evaluación de la recuperación renal es controvertida con una falta de parámetros claros y definidos. A pesar de las limitaciones, la definición más obvia de recuperación completa de LRA es la ausencia de criterios de LRA. La recuperación parcial se define como una caída en el grado de LRA. La recuperación puede ocurrir temprano, después del insulto (dentro de los 7 días), o más tarde, durante el período propuesto de enfermedad renal aguda (AKD), que se define como LRA que persiste durante 7-90 días (23). La falta de recuperación completa en los primeros 90 días se define como ERC.
La interrupción de la función renal normal perjudica el mantenimiento de la homeostasis. Una acidosis metabólica normoclorémica alta en aniones gap es común, debido a la excreción inadecuada de ácidos orgánicos e inorgánicos como el fosfato y el sulfato. La hiperpotasemia también es común cuando la producción de orina es baja y la secreción tubular distal de potasio se ve afectada. Por el contrario, la hipopotasemia puede desarrollarse con poliuria, ya que el alto flujo de orina a través del túbulo distal mejora la secreción de potasio al mantener un gradiente de concentración entre las células tubulares y el ultrafiltrado en la luz del túbulo. Los trastornos del sodio son variables y dependen del grado de deterioro de la reabsorción de sodio en relación con la excreción de agua. Debido a la alteración de la filtración y, por lo tanto, la excreción de fosfato, lo que lleva a la hiperfosfatemia, una hipocalemia ionizada puede desarrollarse de forma aguda.
Objetivos de la reanimación con líquidos
La justificación fisiológica para la administración de líquidos en LRA y ERC es optimizar el volumen circulante intravascular, aumentar el gasto cardíaco y la presión de perfusión, con el objetivo de mejorar el flujo sanguíneo renal, el suministro renal de oxígeno y la TFG (Tabla 1). La hipotensión es un factor de riesgo fuerte para la IRA, pero preservar la presión arterial sistémica sola no es adecuada para la perfusión renal. La perfusión del tejido renal depende de la presión en las arteriolas postglomerulares, que a menudo es mucho más baja que la PAM sistémica (21). Por el contrario, la reanimación con líquidos más allá de la corrección de la hipovolemia no aumenta las posibilidades de recuperación renal. La administración excesiva de líquidos se ha asociado con el desarrollo de IRA, secundaria al síndrome compartimental intrarrenal y la congestión venosa, atribuida a que los riñones son órganos encapsulados (24, 25). Es imperativo comprender que la respuesta fisiológica a los líquidos y la condición subyacente relacionada con la LRA son dinámicas, por lo que la administración de líquidos debe basarse en evaluaciones repetidas del paciente y biomarcadores relevantes. El estado general de fluidos y hemodinámicos, utilizando pruebas dinámicas de capacidad de respuesta a los fluidos, se utilizan para determinar la necesidad de fluidoterapia adicional (5). El médico se ve obligado a caminar por la cuerda floja entre muy pocos líquidos, lo que puede conducir a una mayor progresión de la LRA por isquemia renal en curso, y demasiados líquidos que conducen a complicaciones sistémicas y disfunción orgánica.
Tipos de fluidos
Los fluidos se diferencian en cristaloides y coloides. Sin tener en cuenta el impacto de la sobrecarga de líquidos, existe una creciente evidencia de que la función renal se ve afectada por el tipo de líquido y ciertos líquidos se asocian con un mayor riesgo de LRA (24, 26, 27).
Cristaloides isotónicos
Los cristaloides isotónicos son el líquido intravenoso de primera línea aceptado en la mayoría de los pacientes de la UCI. Hay investigaciones en curso sobre qué cristaloide isotónico, 0,9% de NaCl frente a un cristaloide tamponado (LRS, Plasma-Lyte, Hartmann), es apropiado en personas con riesgo de LRA. El impacto de la concentración de cloruro en la función renal se ha investigado en un modelo de galgo, mostrando que el aumento de los niveles plasmáticos de cloruro produce vasoconstricción renal progresiva y disminución de la TFG. Estos efectos parecían estar relacionados con la reabsorción tubular de cloruro (28). Tanto la investigación en animales como los estudios en voluntarios humanos sanos sugieren que la hipercloremia puede conducir a vasoconstricción renal, reducción de la perfusión del tejido cortical renal y filtración glomerular, junto con períodos más largos de retención de líquidos en comparación con los cristaloides tamponados (29).
Los ensayos clínicos que comparan varios fluidos cristaloides en personas críticamente enfermas con riesgo de LRA han producido resultados contradictorios (7, 9, 10, 30). Los ensayos SMART y SALT-ED son los ensayos controlados aleatorios más grandes que comparan NaCl al 0,9% y cristaloides tamponados. Ambos encontraron una reducción significativa en el riesgo de eventos renales mayores dentro de los 30 días, en el grupo tratado con soluciones tamponadas (9, 10). A pesar de estos hallazgos, no se ha identificado el líquido óptimo en personas con riesgo de LRA. Es de la opinión de los autores que los cristaloides equilibrados deben usarse para la reanimación y la terapia de reemplazo. Las soluciones que contienen dextrosa no deben usarse como solución de reemplazo a menos que el paciente sea hipoglucémico o un recién nacido / bebé.
Cristaloides hipotónicos
Se administran soluciones de mantenimiento (cristaloides hipotónicos) para satisfacer las necesidades basales de agua y electrolitos del paciente. Las soluciones de mantenimiento específicas están disponibles comercialmente, pero están lejos de ser ideales. Los estudios en personas han demostrado que en el transcurso de una admisión en la UCI, se administra una cantidad sustancial de volumen diario de líquido con líquidos de mantenimiento / reemplazo, medicamentos y nutrición en comparación con los líquidos de reanimación (31). En general, la carga total de sodio y cloruro administrada con líquidos de mantenimiento y reemplazo no se tiene en cuenta, a pesar de que estos líquidos representan una gran parte del volumen diario de líquido en estos pacientes. Existe un debate sobre si se deben usar soluciones isotónicas o hipotónicas para la fluidoterapia de mantenimiento. Gran parte de los datos en niños han mostrado un posible riesgo de hiponatremia (32, 33). Los estudios en adultos humanos indican un balance de líquidos más positivo y una disminución de la producción de orina con soluciones isotónicas en comparación con las soluciones hipotónicas (34, 35). Estos estudios sacan a la luz el concepto de «fluencia de fluidos» secundario a la alta administración diaria de sodio con cristaloides isotónicos que conducen a la retención de líquidos. Se necesitan más estudios en pacientes con LRA para hacer una recomendación, pero en teoría estos pacientes con manipulación alterada de sodio y concentraciones más altas de cloruro que alcanzan la mácula densa se beneficiarían de una solución hipotónica en la fase de estabilización. En esta etapa, los autores utilizan preferentemente soluciones hipotónicas para reducir la carga de sodio en animales con disfunción renal. El monitoreo frecuente de los electrolitos y el estado ácido-base del animal es esencial para prescribir el líquido apropiado durante la fase de reanimación y estabilización temprana.
Coloides sintéticos
En medicina humana, la administración de coloides sintéticos se ha relacionado con el desarrollo de lesión renal aguda (LRA) y la necesidad de terapia de reemplazo renal (TRR) en pacientes de UCI, especialmente aquellos con sepsis (27, 36). Los hallazgos de los metanálisis sugieren que esto puede depender de la cohorte de pacientes, pero confirmaron un mayor riesgo de LRA e informes contradictorios sobre la mortalidad (37). En medicina veterinaria, no hay evidencia concluyente sobre el desarrollo de LRA en perros y gatos tratados con almidones de hidroxietilo (HES). La mayoría de los estudios son retrospectivos, con definiciones inconsistentes de LRA (38-41). Extrapolando de la medicina humana, en la mayoría de las situaciones clínicas, los riesgos superan los beneficios y se deben usar terapias alternativas de reemplazo de volumen en lugar del HES.
Coloides naturales
La albúmina es un coloide natural, específicamente estudiado en reanimación, que no ha demostrado tener un beneficio de supervivencia consistente. Aunque la albúmina se considera segura en personas en riesgo o con LRA establecida, se necesitan estudios para evaluar los beneficios potenciales (24, 26, 42). Las recomendaciones más recientes de la Campaña Sobrevivir a la Sepsis establecen que la albúmina, además de los cristaloides, puede considerarse en cantidades limitadas para la reanimación temprana y el posterior reemplazo de volumen intravascular en personas con sepsis o shock séptico (43). El HES debe evitarse en esta población de pacientes, por lo que otros coloides (PFC y albúmina) pueden considerarse en cantidades limitadas. No hay estudios en medicina veterinaria sobre el uso de PFC o albúmina en perros o gatos con disfunción renal.
Dosis de líquido
Hay pocos estudios basados en la evidencia que evalúen la dosis-respuesta de los líquidos intravenosos en animales con disfunción renal. Las fórmulas estándar para lo que comúnmente se llama una tasa de líquidos intravenosos de mantenimiento hacen dos presunciones, a saber, que los animales tienen pérdidas por evaporación similares y que la producción de orina es «promedio» (1-2 ml / kg / h). En pacientes con disfunción renal, no se aplican fórmulas de mantenimiento estándar y las necesidades de líquidos deben evaluarse de forma individual. Las pérdidas por evaporación en perros y gatos son predominantemente a través del tracto respiratorio, ya que la transpiración es generalmente insignificante, y las pérdidas salivales y fecales generalmente no se tienen en cuenta al determinar el equilibrio de líquidos. Las pérdidas respiratorias pueden ser muy diferentes y se ven afectadas por la temperatura y la humedad ambientales, y por el nivel de actividad del paciente. En un estudio de perros sanos, las pérdidas por evaporación variaron de 8,1 a 75,7 ml/kg/día, con una media de 27 ml/kg/día (44-46). Los ladridos y el jadeo aumentaron la pérdida por evaporación en comparación con las pérdidas en perros tranquilos. En gatos, la pérdida insensible varió de 12,4 a 29 ml/kg/día en diferentes estudios (44, 47, 48). La pérdida insensible generalmente se considera de 22 ml / kg / día, independientemente del comportamiento. En el animal con enfermedad renal, el volumen de orina es muy variable, desde poliuria extrema hasta anuria, lo que requiere un ajuste de las tasas de administración de líquidos en función de los requisitos específicos y cambiantes de líquidos individuales de los animales. La cuantificación precisa del gasto urinario se obtiene mediante la colocación de un catéter urinario. Alternativamente, si la orina no se puede medir con precisión debido a la incapacidad de colocar un catéter urinario, se puede colocar una toalla o pañal con un peso preespecificado en la jaula. La diferencia en el peso de la toalla o pañal cuando el animal orina es aproximadamente igual a la orina producida (1 g de aumento de peso = 1 mL de orina).
Westgren et al. evaluaron a 11 perros con sospecha de enfermedad renal utilizando gammagrafía para medir la TFG antes y después de un bolo intravenoso de líquido cristaloide de 15 ml / kg (49). La TFG pareció aumentar un 31% después del bolo de líquido cuando se calcularon las mediciones en función del peso. Sin embargo, cuando la TFG se evaluó en función del volumen plasmático, no hubo cambios en la TFG después de la fluidoterapia. Dados los efectos que un bolo de líquido puede tener sobre la dinámica renal, este nuevo método de cálculo de la TFG sugiere que la fluidoterapia no aumenta agudamente la TFG, aunque la técnica necesita una validación adicional.
En un estudio de perros sistémicamente sanos sometidos a una cirugía ortopédica y que recibieron tasas de líquidos intraoperatorias estándar (10 ml / kg / h de solución de Ringers lactato), la mediana de producción de orina fue de 0.46 ml / kg / h (50). La TFG fue estable durante la anestesia. Estos perros ganaron una mediana de 1,1 L de líquido (3,4% del peso corporal preanestésico) durante el período anestésico de 4 horas, que se distribuyó principalmente al espacio extracelular, a pesar de tener una función renal normal. Los efectos neurohumorales de la anestesia parecen ser capaces de afectar la hemodinámica renal incluso en animales normales y los efectos de la profundidad de la anestesia en la producción de orina requieren más investigación.
Brandstrup et al. compararon la terapia dirigida por objetivos con un enfoque de equilibrio cero en humanos sometidos a cirugía colorrectal (51). En el enfoque dirigido a objetivos, se administró líquido para mantener el volumen sistólico cercano al máximo, mientras que el enfoque de balance cero solo reemplazó las pérdidas de líquidos. No hubo diferencias en los resultados. Por lo tanto, un enfoque de balance cero parece seguro y requiere un monitoreo menos invasivo. No existen estudios similares en pacientes clínicos veterinarios con enfermedad renal, aunque este enfoque merece investigación. La administración de líquidos de balance cero se puede lograr monitoreando la producción de orina y ajustando la dosis de líquido en consecuencia (Tabla 2).
Complicaciones
La sobrecarga de líquidos es un efecto secundario negativo comúnmente mencionado de la fluidoterapia intravenosa, especialmente en pacientes con disfunción renal inicial. Está bien documentado en humanos, y la escasa evidencia en medicina veterinaria indica que la sobrecarga de líquidos contribuye a la progresión de la disfunción renal y al aumento de la mortalidad (52-58). Además, la sobrecarga de líquidos tiene consecuencias graves que afectan a muchos órganos diferentes, incluidos el sistema nervioso central, el tracto cardiovascular, pulmonar, hepático, renal y gastrointestinal (Figura 1) (4, 59). La administración excesiva de líquidos es una complicación iatrogénica que produce congestión renal, empeorando posteriormente la perfusión renal y la TFG debido al edema intersticial. Esta es un área de daño que se observa en pacientes humanos y veterinarios en intentos de «diuresis» de los riñones, lo que finalmente conduce a una disfunción renal progresiva. El monitoreo de la producción de orina en animales conscientes es un marcador sensible y temprano para la detección de IRA, pero también mejora la capacidad del médico para rastrear la sobrecarga de líquidos y evaluar la respuesta a la terapia. El balance acumulativo de líquidos es la suma total de la acumulación de líquidos durante un período de tiempo determinado y el porcentaje de acumulación de líquidos se define dividiendo el equilibrio acumulado de líquidos por el peso corporal basal del paciente y multiplicando por 100%. Los diuréticos siguen siendo una terapia válida para aliviar los síntomas y mejorar los estados fisiopatológicos de sobrecarga de líquidos, incluso en personas con disfunción renal (60-62). Se ha demostrado que una producción de orina de 3-4 ml / kg / h después del uso de diuréticos rara vez causa depleción del volumen intravascular, ya que la recarga intravascular puede equilibrarse a esa velocidad (25). Con las limitaciones en la detección de signos tempranos de LRA debido a la falta de biomarcadores renales activos en medicina veterinaria, los autores recomiendan colocar un catéter urinario en personas cardiovasculares y azotémicas inestables para controlar con precisión la producción de orina. Debido a que la creatinina sérica y la oliguria a menudo son signos tardíos de IRA significativa, una evaluación funcional de la función tubular renal puede indicar riesgo de progresión de LRA. La furosemida es un diurético de asa con propiedades farmacocinéticas ideales para evaluar la función tubular. No es filtrado eficazmente por el glomérulo, pero se une a las proteínas séricas y obtiene acceso a la luz tubular a través de la secreción activa en el túbulo proximal. Una vez en la luz tubular, la furosemida inhibe el transporte activo de cloruro a través de la extremidad gruesa ascendente de Henle, evitando la reabsorción de sodio e induciendo la naturaleza a aumentar el flujo de orina (63). Se puede administrar una prueba de esfuerzo de furosemida (bolo IV de 1-1,5 mg/kg) a pacientes oligúricos que se evalúan como euvolémicos o sobrecargados de líquidos para determinar con precisión la progresión de la LRA y la necesidad de terapia de reemplazo renal (64). En medicina humana, un corte urinario de 2 horas de <200 ml produjo la mejor sensibilidad (87,1%) y especificidad (84,1%) y fue un predictor en la progresión de la LRA (63). Desafortunadamente, esto no se ha estudiado en medicina veterinaria, pero extrapolando de humanos, una respuesta de 1.5 ml / kg / h equivale aproximadamente a los 200 ml durante el intervalo de tiempo de 2 h. La administración repetida de furosemida en un paciente que no responde puede provocar efectos adversos como ototoxicidad, que se ha informado en humanos.
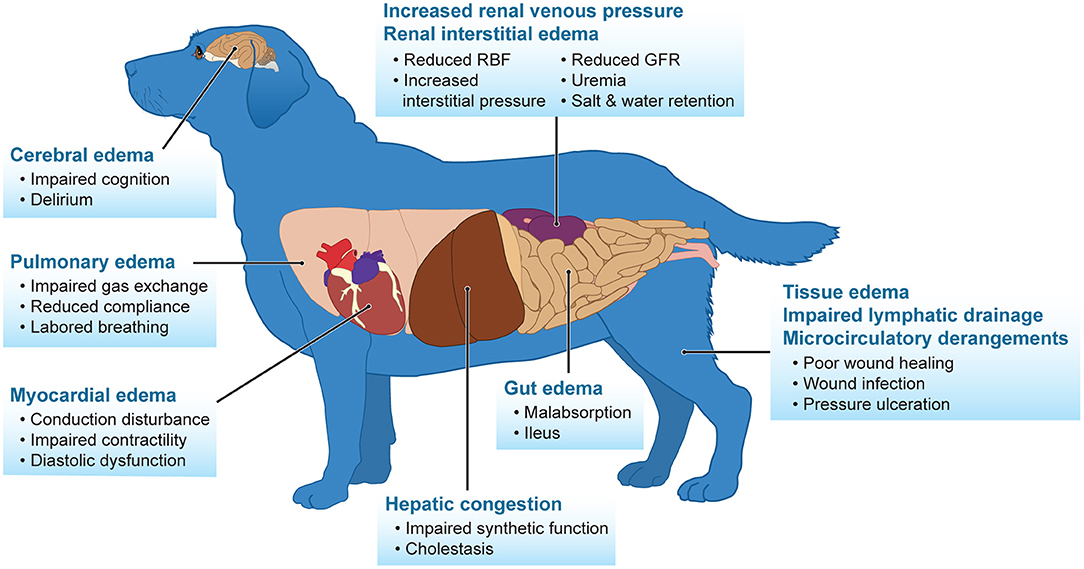 FIGURA 1. La sobrecarga de líquidos afecta negativamente a muchos sistemas del cuerpo. Adaptado de Prowle et al. (25).
FIGURA 1. La sobrecarga de líquidos afecta negativamente a muchos sistemas del cuerpo. Adaptado de Prowle et al. (25).
El uso de diuréticos para aumentar la producción de orina no mejora la función renal. Si la terapia de reemplazo renal no está disponible, los diuréticos pueden ayudar a controlar la hiperpotasemia al aumentar el flujo tubular distal y permitir una administración más liberal de nutrición y medicamentos con menos riesgo de sobrecarga de volumen. A pesar del uso generalizado de diuréticos en medicina humana, hay pocas pautas relacionadas con la dosis y el intervalo de administración de furosemida. Un metaanálisis reciente en humanos mostró que la furosemida continua se asoció con un mayor efecto diurético en la producción total de orina en comparación con la dosis en bolo, aunque ninguno tuvo ninguna diferencia en la mortalidad (65). Los autores recomiendan las siguientes dosis (1-2 mg/kg IV cada 6-8 h o 0,25-0,5 mg/kg/h IV) cuando se administra furosemida. La hiperpotasemia se puede tratar temporalmente causando un cambio intracelular con insulina regular (0,5 u/kg IV con 1 g/kg de dextrosa IV). Los agonistas beta-adrenérgicos (p. ej., terbutalina, albuterol) se pueden usar como terapia adyuvante para cambiar el potasio intracelularmente, pero pueden requerir dosis más altas que las necesarias para la broncodilatación. Se debe considerar la terapia con bicarbonato en perros y gatos con LRA y acidosis metabólica severa (es decir, pH <7.1 o bicarbonato sérico <12 mEq/L). Se ha demostrado un efecto beneficioso significativo en humanos con LRA y acidosis metabólica severa para disminuir la necesidad de terapia de reemplazo renal y la mortalidad general (66, 67).
Contexto clínico
El manejo de perros y gatos con LRA implica tratar la causa subyacente y proporcionar tiempo para que los riñones se reparan a sí mismos. La fluidoterapia adecuada es primordial en el tratamiento médico de la LRA, con el objetivo de restaurar la hidratación y la euvolemia. La noción preconcebida de aumentar la tasa de fluidos y la diuresis forzada en animales con LRA debe evitarse absolutamente. Esto es especialmente cierto en animales con oliguria establecida o una oliguria relativa, en la que no pueden responder adecuadamente aumentando la producción de orina, desarrollando así edema generalizado que exacerba directamente la disfunción orgánica adicional. Si el animal no es capaz de eliminar el exceso de líquido debido a la falta de función renal, la terapia de reemplazo renal está indicada para ayudar a facilitar la eliminación de líquidos y lograr un equilibrio adecuado de líquidos. Es solo una vez que el animal ha establecido una producción de orina consistente y ha avanzado a la fase poliúrica, que se vuelve razonable aumentar la tasa de líquido para que coincida con la producción de orina. Se hace hincapié en la importancia de las evaluaciones frecuentes de los pacientes (balance acumulativo de líquidos) para determinar las necesidades de líquidos de estos pacientes.
Los líquidos deben reducirse gradualmente cuando se restablecen la hidratación y la producción de orina, el líquido «dentro» y la orina «fuera» coinciden, y la creatinina sérica se ha estabilizado (es decir, no hay mejoría adicional en esta etapa). Los autores recomiendan disminuir la tasa de líquidos en un 15-20% cada 8 h, con el objetivo de suspender los líquidos intravenosos en un período de 48 horas. No es raro que los animales con LRA requieran una sonda de alimentación (esofagostomía o gastrostomía) no solo para administrar una nutrición adecuada y satisfacer las demandas del estado hipercatabólico, sino también para complementar los fluidos enterales en un animal marcadamente poliúrico. La sonda de alimentación permite al propietario desempeñar un papel integral en la fase de recuperación de la LRA, así como reducir el tiempo y el costo asociados con la hospitalización. Una opción menos fisiológica para mantener la hidratación en un animal con LRA es el uso de líquidos subcutáneos. Los líquidos subcutáneos implican la administración de grandes cantidades de «agua salada» (LRS, 0,9% NaCl), lo que hace que esta opción sea menos que ideal para animales con disfunción renal intrínseca.
La consideración del tipo de líquido (hipotónico e isotónico equilibrado) junto con la reducción de la carga acumulada de sodio es más fisiológica para los riñones disfuncionales. Se necesitan estudios adicionales para caracterizar la química de la orina de perros y gatos que presentan LRA (68). Nos hemos vuelto más conscientes de los efectos negativos de los fluidos intravenosos y continuaremos haciendo nuevos descubrimientos sobre cómo funcionan los riñones en un estado disfuncional. A medida que recopilamos más datos en animales con lesión renal, la pregunta es realmente ¿qué tipo de fluido se recomienda para estos animales?
Desafortunadamente, la evaluación precisa del peso animal, que se utiliza como sustituto del estado de los líquidos, es un desafío, ya que el cuerpo se convierte a un estado hipercatabólico en LRA establecida y pérdida de masa muscular. Afortunadamente, proporcionar nutrición y agua a través de un tubo de alimentación establecido (E-tube, PEG, G-tube) es una forma ideal de ayudar a controlar el catabolismo del músculo y el requerimiento diario de líquidos. En última instancia, la mejor terapia de fluidos es aquella que mantiene la euvolemia, con el objetivo de administrar líquidos de la manera más fisiológica (a través del tracto gastrointestinal).
Contribuciones del autor
CL y DG contribuyeron a escribir el manuscrito. Todos los autores contribuyeron al artículo y aprobaron la versión presentada.
Conflicto de intereses
Los autores declaran que la investigación se llevó a cabo en ausencia de cualquier relación comercial o financiera que pudiera interpretarse como un posible conflicto de intereses.
El revisor DC declaró una afiliación compartida con los autores al editor de manejo en el momento de la revisión.
Referencias
1. Mehta RL, Bouchard J. Controversias en la lesión renal aguda: efectos de la sobrecarga de líquidos en el resultado. Controv Riñón Agudo Inj. (2011) 174:200–11. doi: 10.1159/000329410
Resumen de PubMed | Texto completo de CrossRef | Google Académico
2. Hoste EA, Maitland K, Brudney CS, Mehta R, Vincent JL, Yates D, et al. Cuatro fases de la fluidoterapia intravenosa: un modelo conceptual†. Br J Anaesth. (2014) 113:740–7. DOI: 10.1093/BJA/AEU300
3. Cecconi M, Hofer C, Teboul JL, Pettila V, Wilkman E, Molnar Z, et al. Desafíos de fluidos en cuidados intensivos: el estudio FENICE: un estudio de cohorte de inicio global. Cuidados intensivos Med. (2015) 41:1529–37. DOI: 10.1007/S00134-015-3850-X
Resumen de PubMed | Texto completo de CrossRef | Google Académico
4. Malbrain MLNG, Van Regenmortel N, Saugel B, De Tavernier B, Van Gaal P-J, Joannes-Boyau O, et al. Principios de manejo de fluidos y administración en shock séptico: es hora de considerar las cuatro D y las cuatro fases de la fluidoterapia. Ann Cuidados Intensivos. (2018) 8:66. DOI: 10.1186/S13613-018-0402-X
Resumen de PubMed | Texto completo de CrossRef | Google Académico
5. Cecconi M, Hernandez G, Dunser M, Antonelli M, Baker T, Bakker J, et al. Administración de líquidos para la disfunción circulatoria aguda mediante monitorización básica: revisión narrativa y recomendaciones de panel de expertos de un grupo de trabajo de ESICM. Cuidados intensivos Med. (2019) 45:21–32. DOI: 10.1007/S00134-018-5415-2
Resumen de PubMed | Texto completo de CrossRef | Google Académico
6. Semler MW, Kellum JA. Soluciones cristaloides equilibradas. Am J Respir Crit Care Med. (2019) 199:952–60. doi: 10.1164/rccm.201809-1677CI
7. Yunos NM, Bellomo R, Hegarty C, Story D, Ho L, Bailey M. Association between a chloride-liberal vs chloride-restrictive intravenous fluid management strategy and kidney injury in critical ill adults. JAMA. (2012) 308:1566–72. doi: 10.1001/jama.2012.13356
Resumen de PubMed | Texto completo de CrossRef | Google Académico
8. Yunos NM, Bellomo R, Taylor DM, Judkins S, Kerr F, Sutcliffe H, et al. Efectos renales de una estrategia de líquidos intravenosos restrictiva con cloruro en el departamento de urgencias en pacientes ingresados en el hospital durante más de 48 horas: estrategia de líquidos restrictivos con cloruro. Emerg Med Australas. (2017) 29:643–9. doi: 10.1111/1742-6723.12821
Resumen de PubMed | Texto completo de CrossRef | Google Académico
9. Semler MW, Self WH, Wanderer JP, Ehrenfeld JM, Wang L, Byrne DW, et al. Cristaloides equilibrados versus solución salina en adultos críticamente enfermos. N Engl J Med. (2018) 378:829–39. doi: 10.1056/NEJMoa1711584
Resumen de PubMed | Texto completo de CrossRef | Google Académico
10. Self WH, Semler MW, Wanderer JP, Wang L, Byrne DW, Collins SP, et al. Cristaloides equilibrados versus solución salina en adultos no críticamente enfermos. N Engl J Med. (2018) 378:819–28. doi: 10.1056/NEJMoa1711586
Resumen de PubMed | Texto completo de CrossRef | Google Académico
11. Ostermann M, Bellomo R, Burdmann EA, Doi K, Endre ZH, Goldstein SL, et al. Controversias en la lesión renal aguda: conclusiones de una conferencia sobre la mejora de los resultados globales de la enfermedad renal (KDIGO). Riñón Int. (2020) 98:294–309. doi: 10.1016/j.kint.2020.04.020
Resumen de PubMed | Texto completo de CrossRef | Google Académico
12. Badr KF, Ichikawa I. Insuficiencia prerrenal: un cambio perjudicial de la compensación renal a la descompensación. N Engl J Med. (1988) 319:623–9. doi: 10.1056/NEJM198809083191007
Resumen de PubMed | Texto completo de CrossRef | Google Académico
13. Hegarty NJ, Young LS, Kirwan CN, O’Neill AJ, Bouchier-Hayes DM, Sweeney P, et al. Óxido nítrico en la obstrucción ureteral unilateral: Efecto sobre el flujo sanguíneo renal regional. Riñón Int. (2001) 59:1059–65. doi: 10.1046/j.1523-1755.2001.00589.x
Resumen de PubMed | Texto completo de CrossRef | Google Académico
14. Cowgill LD, Langston C. Insuficiencia renal aguda. En: Nefrología y Urología de Pequeños Animales (John Wiley & Sons, Ltd) (2011). págs. 472–523. doi: 10.1002/9781118785546.ch49
15. Basile DP, Anderson MD, Sutton TA. Fisiopatología de la lesión renal aguda. Compr Physiol. (2012) 2:1303–53. doi: 10.1002/cphy.c110041
16. Legatti SAM, El Dib R, Legatti E, Botan AG, Camargo SEA, Agarwal A, et al. Lesión renal aguda en gatos y perros: un metanálisis proporcional de estudios de series de casos. PLoS ONE. (2018) 13:E0190772. doi: 10.1371/journal.pone.0190772
Resumen de PubMed | Texto completo de CrossRef | Google Académico
17. Rabb H, O’Meara YM, Maderna P, Coleman P, Brady HR. Leucocitos, moléculas de adhesión celular e insuficiencia renal aguda isquémica. Riñón Int. (1997) 51:1463–8. DOI: 10.1038/KI.1997.200
Resumen de PubMed | Texto completo de CrossRef | Google Académico
18. Kelly KJ, Plotkin Z, Dagher PC. La suplementación con guanosina reduce la apoptosis y protege la función renal en el contexto de una lesión isquémica. J Clin Invest. (2001) 108:1291–8. doi: 10.1172/JCI13018
Resumen de PubMed | Texto completo de CrossRef | Google Académico
19. Sutton TA, Fisher CJ, Molitoris BA. Lesión y disfunción endotelial microvascular durante la insuficiencia renal aguda isquémica. Riñón Int. (2002) 62:1539–49. doi: 10.1046/j.1523-1755.2002.00631.x
Resumen de PubMed | Texto completo de CrossRef | Google Académico
20. Nony PA, Schnellmann RG. Mecanismos de reparación y regeneración de células renales después de insuficiencia renal aguda. J Pharmacol Exp ther. (2003) 304:905–12. DOI: 10.1124/JPET.102.035022
Resumen de PubMed | Texto completo de CrossRef | Google Académico
21. Forni LG, Darmon M, Ostermann M, Oudemans-van Straaten HM, Pettilä V, Prowle JR, et al. Recuperación renal después de una lesión renal aguda. Cuidados intensivos Med. (2017) 43:855–66. DOI: 10.1007/S00134-017-4809-X
22. Cowgill LD, Polzin DJ, Elliott J, Nabity MB, Segev G, Grauer GF, et al. ¿La enfermedad renal crónica progresiva es una lesión renal aguda lenta? Veterinario Clin North am Small Anim Pract. (2016) 46:995–1013. doi: 10.1016/j.cvsm.2016.06.001
Resumen de PubMed | Texto completo de CrossRef | Google Académico
23. Chawla LS, Bellomo R, Bihorac A, Goldstein SL, Siew ED, Bagshaw SM, et al. Enfermedad renal aguda y recuperación renal: informe de consenso del grupo de trabajo 16 de la Iniciativa de Calidad de la Enfermedad Aguda (ADQI). Nat Rev Nephrol. (2017) 13:241–57. doi: 10.1038/NRNEPH.2017.2
Resumen de PubMed | Texto completo de CrossRef | Google Académico
24. Finfer S, Myburgh J, Bellomo R. Terapia de fluidos intravenosos en adultos críticamente enfermos. Nat Rev Nephrol. (2018) 14:541–57. DOI: 10.1038/S41581-018-0044-0
Resumen de PubMed | Texto completo de CrossRef | Google Académico
25. Prowle JR, Echeverri JE, Ligabo EV, Ronco C, Bellomo R. Equilibrio de líquidos y lesión renal aguda. Nat Rev Nephrol. (2010) 6:107–15. doi: 10.1038/NRNEPH.2009.213
26. Perner A, Prowle J, Joannidis M, Young P, Hjortrup PB, Pettilä V. Manejo de fluidos en la lesión renal aguda. Cuidados intensivos Med. (2017) 43:807–15. DOI: 10.1007/S00134-017-4817-X
27. Perner A, Haase N, Guttormsen AB, Tenhunen J, Klemenzson G, Åneman A, et al. Almidón hidroxietil 130/0,42 versus acetato de timbre en la sepsis grave. N Engl J Med. (2012) 367:124–34. doi: 10.1056/NEJMoa1204242
Resumen de PubMed | Texto completo de CrossRef | Google Académico
28. Wilcox CS. Regulación del flujo sanguíneo renal por cloruro plasmático. J Clin Invest. (1983) 71:726–35. doi: 10.1172/JCI110820
Resumen de PubMed | Texto completo de CrossRef | Google Académico
29. Chowdhury AH, Cox EF, Francis ST, Lobo DN. Un estudio cruzado aleatorizado, controlado, doble ciego sobre los efectos de infusiones de 2-L de solución salina al 0,9% y plasma-lyte® 148 sobre la velocidad del flujo sanguíneo renal y la perfusión del tejido cortical renal en voluntarios sanos. Ann Surg. (2012) 256:18–24. doi: 10.1097/SLA.0b013e318256be72
Resumen de PubMed | Texto completo de CrossRef | Google Académico
30. Young P, Bailey M, Beasley R, Henderson S, Mackle D, McArthur C, et al. Efecto de una solución cristaloide tamponada frente a solución salina sobre la lesión renal aguda entre pacientes en la unidad de cuidados intensivos: el ensayo clínico aleatorizado dividido. JAMA. (2015) 314:1701. doi: 10.1001/jama.2015.12334
Resumen de PubMed | Texto completo de CrossRef | Google Académico
31. Van Regenmortel N, Verbrugghe W, Roelant E, Van den Wyngaert T, Jorens PG. La fluidoterapia de mantenimiento y la fluencia de líquidos imponen cargas más significativas de líquidos, sodio y cloruro que los líquidos de reanimación en pacientes críticamente enfermos: un estudio retrospectivo en una población terciaria mixta de UCI. Cuidados intensivos Med. (2018) 44:409–17. DOI: 10.1007/S00134-018-5147-3
Resumen de PubMed | Texto completo de CrossRef | Google Académico
32. McNab S, Duke T, South M, Babl FE, Lee KJ, Arnup SJ, et al. 140 mmol/L de sodio versus 77 mmol/L de sodio en fluidoterapia intravenosa de mantenimiento para niños hospitalizados (PIMS): un ensayo aleatorizado controlado doble ciego. The Lancet. (2015). 385:1190–7. doi: 10.1016/S0140-6736(14)61459-8
Resumen de PubMed | Texto completo de CrossRef | Google Académico
33. Moritz ML, Ayus JC. Mantenimiento de líquidos intravenosos en pacientes gravemente enfermos. N Engl J Med. (2015) 373:1350–60. doi: 10.1056/NEJMra1412877
34. Lobo DN, Stanga Z, Simpson JA, Anderson JA, Rowlands BJ, Allison SP. Dilution and redistribution effects of rapid 2-litre infusions of 0.9% (w/v) saline and 5% (w/v) dextrose on hematological parameters and serum biochemistry in normal subjects: a double-blind crossover study. Clin Sci Lond Engl. (2001). 101:173–9. DOI: 10.1042/CS1010173
Resumen de PubMed | Texto completo de CrossRef | Google Académico
35. Van Regenmortel N, De Weerdt T, Van Craenenbroeck AH, Roelant E, Verbrugghe W, Dams K, et al. Efecto de la terapia de fluidos de mantenimiento isotónica versus hipotónica sobre la producción de orina, el equilibrio de líquidos y la homeostasis electrolítica: un estudio cruzado en voluntarios adultos en ayunas. Br J Anaesth. (2017) 118:892–900. doi: 10.1093/bja/aex118
Resumen de PubMed | Texto completo de CrossRef | Google Académico
36. Kashy BK, Podolyak A, Makarova N, Dalton JE, Sessler DI, Kurz A. Efecto del hidroxietil almidón en la función renal postoperatoria en pacientes sometidos a cirugía no cardíaca. Anestesiología. (2014) 121:730–9. doi: 10.1097/ALN.0000000000000375
Resumen de PubMed | Texto completo de CrossRef | Google Académico
37. Serpa Neto A, Veelo DP, Peireira VGM, de Assunção MSC, Manetta JA, Espósito DC, et al. La reanimación con líquidos con almidones hidroxietilo en pacientes con sepsis se asocia con una mayor incidencia de lesión renal aguda y el uso de terapia de reemplazo renal: una revisión sistemática y metanálisis de la literatura. J Crit Care. (2014) 29:185.e1-185.e7. doi: 10.1016/j.jcrc.2013.09.031
Resumen de PubMed | Texto completo de CrossRef | Google Académico
38. Yozova ID, Howard J, Adamik K-N. Evaluación retrospectiva de los efectos de la administración de tetraalmidón (hidroxietil almidón 130/0,4) sobre la concentración plasmática de creatinina en perros (2010-2013):201 perros. J Vet Emerg Crit Care. (2016) 26:568–77. DOI: 10.1111/VEC.12483
Resumen de PubMed | Texto completo de CrossRef | Google Académico
39. Yozova ID, Howard J, Adamik KN. Efecto del tetraalmidón (hidroxietil almidón 130/0.4) sobre la concentración de creatinina plasmática en gatos: un análisis retrospectivo (2010–2015). J Felino Med Surg. (2017) 19:1073–9. doi: 10.1177/1098612X16676160
Resumen de PubMed | Texto completo de CrossRef | Google Académico
40. Sigrist NE, Kälin N, Dreyfus A. Changes in serum creatinnine concentration and acute kidney injury (AKI) grade in dogs treated with hydroxyethyl starch 130/0.4 from 2013 to 2015. J Vet Pasante Med. (2017) 31:434–41. DOI: 10.1111/JVIM.14645
Resumen de PubMed | Texto completo de CrossRef | Google Académico
41. Hayes G, Benedicenti L, Mathews K. Estudio de cohorte retrospectivo sobre la incidencia de lesión renal aguda y muerte después de la administración de hidroxietil almidón (HES 10% 250/0.5/5:1) en perros (2007–2010). J Vet Emerg Crit Care. (2016) 26:35–40. DOI: 10.1111/VEC.12412
Resumen de PubMed | Texto completo de CrossRef | Google Académico
42. Lewis SR, Pritchard MW, Evans DJ, Butler AR, Alderson P, Smith AF, et al. Coloides versus cristaloides para la reanimación con líquidos en pacientes en estado crítico. Base de datos Cochrane Syst Rev. (2018) 8:CD000567. doi: 10.1002/14651858.CD000567.pub7
Resumen de PubMed | Texto completo de CrossRef | Google Académico
43. Rhodes A, Evans LE, Alhazzani W, Levy MM, Antonelli M, Ferrer R, et al. Campaña Sobrevivir a la sepsis: directrices internacionales para el tratamiento de la sepsis y el shock séptico: 2016. Cuidados intensivos Med. (2017) 43:304–77. DOI: 10.1007/S00134-017-4683-6
Resumen de PubMed | Texto completo de CrossRef | Google Académico
44. Wellman ML, DiBartola SP, Kohn CW. Capítulo 1 – fisiología aplicada de fluidos corporales en perros y gatos. En: DiBartola SP, editor. Trastornos de líquidos, electrolitos y ácido-base en la práctica de pequeños animales. 4ª ed. Saint Louis, MO: W. B. Saunders (2012). págs. 2–25. doi: 10.1016/B978-1-4377-0654-3.00008-1
45. Smith RC, Haschem T, Hamlin RL. Ingesta y producción de agua y electrolitos y cantidad de heces en el perro sano. Vet Med Small Anim Clin. (1964) 59:743–8.
46. O’Connor WJ, Potts DJ. Los intercambios externos de agua de los perros de laboratorio normales. Q J Exp Physiol Cogn Med Sci. (1969) 54:244–65. doi: 10.1113/expphysiol.1969.sp002022
Resumen de PubMed | Texto completo de CrossRef | Google Académico
47. Hamlin R, Tashjian R. Ingesta y producción de agua y electrolitos y cantidad de heces en gatos sanos. Vet Med Small Anim Clin. (1964) 59:746–7.
48. Thrall BE, Miller LG. Rotación de agua en gatos alimentados con raciones secas. Feline Pr. (1976) 6:10–7.
49. Westgren F, Ley CJ, Kampa N, Lord P. Efectos de la hidratación sobre la tasa de filtración glomerular gammagráfica medida utilizando métodos integrales y de volumen plasmático en perros con sospecha de enfermedad renal. Ecografía Radiol Veterinaria. (2014) 55:632–7. DOI: 10.1111/VRU.12173
Resumen de PubMed | Texto completo de CrossRef | Google Académico
50. Boscan P, Pypendop BH, Siao KT, Francey T, Dowers K, Cowgill L, et al. Equilibrio de líquidos, tasa de filtración glomerular y producción de orina en perros anestesiados para un procedimiento quirúrgico ortopédico. Am J Vet Res. (2010) 71:501–7. DOI: 10.2460/AJVR.71.5.501
Resumen de PubMed | Texto completo de CrossRef | Google Académico
51. Brandstrup B, Svendsen PE, Rasmussen M, Belhage B, Rodt SÅ, Hansen B, et al. ¿Qué objetivo para la fluidoterapia durante la cirugía colorrectal es seguido por el mejor resultado: volumen sistólico casi máximo o balance de líquidos cero? Br J Anaesth. (2012) 109:191–9. DOI: 10.1093/BJA/AES163
Resumen de PubMed | Texto completo de CrossRef | Google Académico
52. Cavanagh AA, Sullivan LA, Hansen BD. Evaluación retrospectiva de la sobrecarga de líquidos y la relación con el resultado en perros críticamente enfermos: sobrecarga de líquidos en perros críticamente enfermos. J Vet Emerg Crit Care. (2016) 26:578–86. DOI: 10.1111/VEC.12477
Resumen de PubMed | Texto completo de CrossRef | Google Académico
53. Hung S, Lai Y, Kuo K, Tarng D. Sobrecarga de volumen y resultados adversos en la enfermedad renal crónica: estudios clínicos observacionales y en animales. J Am Heart Assis. (2015) 4:E001918. doi: 10.1161/JAHA.115.001918
Resumen de PubMed | Texto completo de CrossRef | Google Académico
54. Lim LM, Tsai NC, Lin MY, Hwang DY, Lin HYH, Lee JJ, et al. La hiponatremia se asocia con desequilibrio de líquidos y resultado renal adverso en pacientes con enfermedad renal crónica tratados con diuréticos. (2016) 6:36817. doi: 10.1038/srep36817
Resumen de PubMed | Texto completo de CrossRef | Google Académico
55. Tsai Y-C, Tsai J-C, Chen S-C, Chiu Y-W, Hwang S-J, Hung C-C, et al. Asociación de la sobrecarga de líquidos con la progresión de la enfermedad renal en la ERC avanzada: un estudio de cohorte prospectivo. Am J Kidney Dis. (2014) 63:68–75. doi: 10.1053/j.ajkd.2013.06.011
Resumen de PubMed | Texto completo de CrossRef | Google Académico
56. Bouchard J, Soroko SB, Chertow GM, Himmelfarb J, Ikizler TA, Paganini EP, et al. Acumulación de líquido, supervivencia y recuperación de la función renal en pacientes críticos con lesión renal aguda. Riñón Int. (2009) 76:422–7. DOI: 10.1038/KI.2009.159
Resumen de PubMed | Texto completo de CrossRef | Google Académico
57. Woodward CW, Lambert J, Ortiz-Soriano V, Li Y, Ruiz-Conejo M, Bissell BD, et al. La sobrecarga de líquidos se asocia con eventos renales adversos importantes en pacientes críticamente enfermos con lesión renal aguda que requieren terapia de reemplazo renal continua. Crit Care Med. (2019) 47:e753–60. doi: 10.1097/CCM.0000000000003862
Resumen de PubMed | Texto completo de CrossRef | Google Académico
58. Alobaidi R, Morgan C, Basu RK, Stenson E, Featherstone R, Majumdar SR, et al. Asociación entre el equilibrio de líquidos y los resultados en niños críticamente enfermos: una revisión sistemática y metanálisis. JAMA Pediatr. (2018) 172:257. doi: 10.1001/jamapediatrics.2017.4540
Resumen de PubMed | Texto completo de CrossRef | Google Académico
59. Claure-Del Granado R, Mehta RL. Sobrecarga de líquidos en la UCI: evaluación y manejo. BMC Nefrol. (2016) 17:109. DOI: 10.1186/S12882-016-0323-6
Resumen de PubMed | Texto completo de CrossRef | Google Académico
60. Cantarovich F, Rangoonwala B, Lorenz H, Verho M, Esnault VLM. Furosemida en dosis altas para la IRA establecida: un ensayo prospectivo, aleatorizado, doble ciego, controlado con placebo, multicéntrico. Am J Kidney Dis. (2004) 44:402–9. doi: 10.1016/S0272-6386(04)00810-8
Resumen de PubMed | Texto completo de CrossRef | Google Académico
61. Grams ME, Estrella MM, Coresh J, Brower RG, Liu KD. Balance de líquidos, uso de diuréticos y mortalidad en la lesión renal aguda. Clin J Am Soc Nefrol. (2011) 6:966–73. doi: 10.2215/CJN.08781010
Resumen de PubMed | Texto completo de CrossRef | Google Académico
62. Uchino S, Doig GS, Bellomo R, Morimatsu H, Morgera S, Schetz M, et al. Diuréticos y mortalidad en la insuficiencia renal aguda. Crit Care Med. (2004) 32:1669–77. doi: 10.1097/01.CCM.0000132892.51063.2F
Resumen de PubMed | Texto completo de CrossRef | Google Académico
63. Chawla LS, Davison DL, Brasha-Mitchell E, Koyner JL, Arthur JM, Shaw AD, et al. Desarrollo y estandarización de una prueba de esfuerzo de furosemida para predecir la gravedad de la lesión renal aguda. Cuidado crítico. (2013) 17:R207. DOI: 10.1186/CC13015
Resumen de PubMed | Texto completo de CrossRef | Google Académico
64. Chen JJ, Chang CH, Huang YT, Kuo G. Furosemide stress test as a predictive marker of acute kidney injury progression or renal replacement therapy: a systemic review and meta-analysis. Cuidado crítico. (2020) 24:202. DOI: 10.1186/S13054-020-02912-8
Resumen de PubMed | Texto completo de CrossRef | Google Académico
65. Ng KT, Velayit A, Khoo DKY, Mohd Ismail A, Mansor M. Infusión continua versus inyección intermitente en bolo de furosemida en pacientes críticamente enfermos: una revisión sistemática y metanálisis. J Cardiothorac Vasc Anesth. (2018) 32:2303–10. doi: 10.1053/j.jvca.2018.01.004
Resumen de PubMed | Texto completo de CrossRef | Google Académico
66. Jaber S, Paugam C, Futier E, Lefrant J-Y, Lasocki S, Lescot T, et al. Tratamiento con bicarbonato de sodio para pacientes con acidemia metabólica grave en la unidad de cuidados intensivos (UCI-BICAR): un ensayo multicéntrico, abierto, aleatorizado, controlado y de fase 3. Lanceta. (2018) 392:31–40.
67. Zhang Z, Zhu C, Mo L, Hong Y. Efectividad de la infusión de bicarbonato de sodio en la mortalidad en pacientes sépticos con acidosis metabólica. Cuidados intensivos Med. (2018) 44:1888–95. DOI: 10.1007/S00134-018-5379-2
Resumen de PubMed | Texto completo de CrossRef | Google Académico
68. Brown N, Segev G, Francey T, Kass P, Cowgill LD. Tasa de filtración glomerular, producción de orina y aclaramiento fraccional de electrolitos en la lesión renal aguda en perros y su asociación con la supervivencia. J Vet Pasante Med. (2015) 29:28–34. DOI: 10.1111/JVIM.12518
Resumen de PubMed | Texto completo de CrossRef | Google Académico
Palabras clave: renal, riñón, lesión renal aguda, enfermedad renal crónica, oliguria, anuria, poliuria
Cita: Langston C y Gordon D (2021) Efectos de los líquidos intravenosos en perros y gatos con insuficiencia renal. Frente. Vet. Sci. 8:659960. doi: 10.3389/fvets.2021.659960
Recibido: 28 de enero de 2021; Aprobado: 18 de marzo de 2021;
Publicado: 20 de abril de 2021.
Editado por:
William W. Muir, Lincoln Memorial University, Estados Unidos
Revisado por:
Karol Ann Mathews, Universidad de Guelph, Canadá
Dennis Chew, Universidad Estatal de Ohio, Estados Unidos
Derechos de autor © 2021 Langston y Gordon. Este es un artículo de acceso abierto distribuido bajo los términos de la Licencia de Atribución Creative Commons (CC BY).
*Correspondencia: Cathy Langston, Langston.35@osu.edu
Renuncia: Todas las afirmaciones expresadas en este artículo son únicamente las de los autores y no representan necesariamente las de sus organizaciones afiliadas, o las del editor, los editores y los revisores. Cualquier producto que pueda ser evaluado en este artículo o reclamo que pueda ser hecho por su fabricante no está garantizado ni respaldado por el editor.
Date de alta y recibe nuestro 👉🏼 Diario Digital AXÓN INFORMAVET ONE HEALTH
Date de alta y recibe nuestro 👉🏼 Boletín Digital de Foro Agro Ganadero
Noticias animales de compañía
Noticias animales de producción
Trabajos técnicos animales de producción
Trabajos técnicos animales de compañía



