Efectos del zoledronato neoadyuvante y la radioterapia sobre la supervivencia celular
Efectos del zoledronato neoadyuvante y la radioterapia sobre la supervivencia celular, la distribución del ciclo celular y el estado clínico en el osteosarcoma canino
 Carissa J. Norquest1
Carissa J. Norquest1  Anita Rogic1
Anita Rogic1  Phyllis A. Gimotty2
Phyllis A. Gimotty2  Charles A. Maitz1
Charles A. Maitz1  Hansjörg Rindt1
Hansjörg Rindt1  Hayley L. Ashworth1
Hayley L. Ashworth1  Jeffrey N. Bryan1
Jeffrey N. Bryan1  Lindsay L. Donnelly1
Lindsay L. Donnelly1  Angela L. McCleary-Wheeler1
Angela L. McCleary-Wheeler1  Brian K. Flesner1,3*
Brian K. Flesner1,3*- 1Departamento de Medicina y Cirugía Veterinaria, Facultad de Medicina Veterinaria de la Universidad de Missouri, Columbia, MO, Estados Unidos
- 2Departamento de Bioestadística, Epidemiología e Informática, Facultad de Medicina de la Universidad de Pensilvania, Filadelfia, Pensilvania, Estados Unidos
- 3Departamento de Ciencias Clínicas y Medicina Avanzada, Facultad de Medicina Veterinaria de la Universidad de Pensilvania, Filadelfia, Pensilvania, Estados Unidos
Introducción: El ácido zoledrónico (ZOL) es un bifosfonato de tercera generación con una mayor afinidad por las áreas de resorción ósea que los bifosfonatos anteriores (es decir, pamidronato, PAM). En medicina humana, ZOL proporciona un mejor alivio del dolor óseo y un tiempo prolongado para los eventos relacionados con el esqueleto en comparación con sus contrapartes generacionales más antiguas. En estudios preclínicos se investigó su función como agente antineoplásico, tanto de forma independiente como sinérgica, con la radioterapia (RT). ZOL y RT actúan sinérgicamente en varias líneas celulares humanas neoplásicas: próstata, mama, osteosarcoma y fibrosarcoma. Sin embargo, el mecanismo exacto de la radiosensibilización de ZOL no se ha dilucidado completamente.
Métodos: Investigamos la capacidad de ZOL para inducir la apoptosis en líneas celulares de osteosarcoma canino tratadas con varias dosis de radioterapia de haz externo de megavoltaje. En segundo lugar, evaluamos la detención del ciclo celular en células tratadas con ZOL para evaluar varios puntos temporales neoadyuvantes. Por último, tratamos a 20 perros con SG apendicular natural con 0,1 mg/kg de ZOL IV durante 24 h antes de recibir 8 Gy de RT (fracción semanal x 4 semanas).
Resultados: Encontramos que la apoptosis aumentó en todas las líneas celulares tratadas con ZOL en comparación con los controles, y la combinación de ZOL y RT resultó en una apoptosis diferente entre Abrams y las líneas celulares D-17 y HMPOS. La detención del ciclo celular (fase G2/M) fue mínima y variable entre líneas celulares, pero quizás mayor a las 48 h después del tratamiento con ZOL. Solo el 10% de los perros tratados con ZOL y RT desarrollaron fracturas patológicas, en comparación con el 44% de los perros tratados históricamente con PAM y RT (p = 0,027).
Discusión: La ZOL y la RT parecen ser un esquema de tratamiento combinado bien tolerado para los candidatos no quirúrgicos; los estudios futuros deben dilucidar el momento ideal de la ZOL.
1 Introducción
Los bifosfonatos (BP) son potentes inhibidores de la reabsorción osteoclástica; Se unen a cristales de hidroxiapatita en hueso mineralizado con una alta afinidad (1, 2). Esto se debe a un grupo hidroxilo en su R1 posición, que ayuda a anclar las BP a la hidroxiapatita. La potencia de los BP individuales se determina entonces por el grupo químico añadido al R2 posición (3). Etidronato, un BP no nitrogenado con un metilo (CH3) añadido en el grupo R2 posición, tiene una potencia antirresortiva relativa de 1. En comparación, los BP que contienen nitrógeno tienen una eficacia exponencial debido a los compuestos nitrogenados en su R2 Cadenas. El zoledronato (ZOL), un bifosfonato de tercera generación, tiene 10.000 veces la potencia del etidronato y 100 veces la potencia del pamidronato (PAM, otro BP que contiene nitrógeno) debido a su R2 anillo de amina (3). El mecanismo de acción de las BP que contienen nitrógeno se centra en dirigirse a los osteoclastos y a los elocuentes degradadores de la matriz ósea. Los osteoclastos digieren la hidroxiapatita a través del ambiente ácido creado a lo largo de su borde ondulado (4). Esta digestión también engulle las BP unidas a hidroxiapatita; Una vez intracelulares, promueven la apoptosis osteoclástica mediante la inhibición de la farnesil pirofosfato sintasa, una enzima prominente en la vía del mevalonato (1). Esta inducción de la apoptosis es importante para las enfermedades osteolíticas/ostorresortivas. La potencia superior de ZOL permite su uso anual en pacientes humanos con osteoporosis primaria o secundaria (5). Esta inhibición osteoclástica selectiva también puede ser secuestrada para afecciones neoplásicas: tanto hipercalcemia de neoplasia maligna como tumores óseos primarios o metastásicos.
En medicina humana, ZOL proporciona un mejor alivio del dolor óseo y un tiempo prolongado hasta los eventos de malignidad relacionados con el esqueleto en comparación con sus contrapartes generacionales más antiguas; Esto es sumamente importante para los tumores epiteliales con altas tasas de metástasis óseas (1, 6–8). Se ha probado in vitro la sinergia con la radioterapia (RT) de ZOL en múltiples tipos de tumores: próstata, mama, pulmón, mieloma y hueso (9–13). Dado que la RT es la columna vertebral para la paliación del dolor óseo y la prevención de eventos relacionados con el esqueleto en tumores con altas tasas de metástasis óseas (14), se necesitan desesperadamente enfoques de combinación seguros y sinérgicos. Hasta la fecha, se han realizado pocos ensayos combinados, pero hay información prometedora en pacientes con carcinoma de células renales óseas metastásicos y cáncer gastrointestinal (15, 16). Por el contrario, en hombres con cáncer de próstata en estadio avanzado inscritos en un ensayo de fase III, el zoledronato no proporcionó beneficios de supervivencia cuando se agregó a la supresión androgénica y la radioterapia (17). Sin embargo, en estos estudios en humanos, el momento (y la frecuencia de la dosis) de la administración de ZOL en relación con la RT no están estandarizados. Si a esto le añadimos la complejidad del estado hormonal, el estadio de la enfermedad y el protocolo de RT elegido en función del tipo de tumor, es casi imposible encontrar una afirmación concreta sobre la utilidad de la ZOL en combinación con la RT.
El osteosarcoma es un tumor agresivo y doloroso tanto en perros como en humanos (18). En la actualidad, el estándar de atención para la SG apendicular canina depende de la candidatura quirúrgica. Para la mayoría de los perros, la cirugía en forma de amputación es el pilar de la terapia, pero esto depende de las comorbilidades musculoesqueléticas, como la displasia articular, la osteoartritis y la solidez de las extremidades restantes no afectadas. Además, los propietarios de los clientes deben dar su consentimiento para la amputación; De vez en cuando, rechazan las cirugías radicales. En el caso de los candidatos no quirúrgicos, la RT es la pieza central del control del dolor de la enfermedad local. Un ensayo prospectivo previo evaluó el uso de PAM en combinación con un protocolo similar de RT y doxorrubicina adyuvante en perros con SG (19). Si bien el tratamiento combinado se consideró seguro, no hubo una mejora obvia en el alivio del dolor. Los perros que recibieron un placebo tuvieron una mediana de intervalo libre de progresión para el alivio del dolor de 75 días; los perros que recibieron PAM tuvieron una mediana de 76 días (19). Este mismo grupo evaluó ZOL en 6 perros sanos y 20 perros con osteólisis maligna pero sin RT. Todos los perros tuvieron disminuciones significativas en los productos de degradación del colágeno (C-telopéptido, CTx o N-telopéptido, NTx). Además, 5 de cada 10 perros con SG experimentaron un alivio subjetivo del dolor durante >4 meses (20). Los experimentos in vitro que lo acompañan en la SG humana y canina parecen apoyar el uso de ZOL en la SG, posiblemente junto con la RT (12, 13, 21–23). Sin embargo, un experimento in vitro reciente mostró posibles efectos antagónicos de la RT y las BP en dos líneas celulares caninas de SG (24). Estas células se trataron con ZOL y RT el mismo día, con un intervalo de aproximadamente 2 a 4 horas.
El protocolo actual de RT para perros con SG apendicular que se presentaron en nuestra institución y no pudieron someterse a amputación fue una sola fracción de 8 Gy administrada una vez por semana durante 4 semanas consecutivas (C-RT8), como lo describieron previamente Green et al. (25). Nuestro grupo recogió datos retrospectivos de perros que recibieron C-RT8 con o sin PA (26). Encontramos diferentes tasas de fractura entre los perros que recibieron C-RT8 que no recibieron PA (n = 6, 17%), PAM (n = 19, 44%) o ZOL (n = 7, 0%). Estos hallazgos nos motivaron a realizar un ensayo clínico prospectivo.
La ZOL se ha evaluado más a fondo en perros para paliar el dolor óseo, los estadios avanzados de la SG y la hipercalcemia de neoplasia maligna. En una cohorte de 44 perros que recibieron ZOL en la que la mediana del número de dosis administradas fue de 3, se observó lesión renal aguda en el 13,6% de los perros; a dos de estos perros se les suspendió el tratamiento con ZOL debido al desarrollo de azotemia (27). Un segundo grupo evaluó la administración de ZOL en el entorno paliativo de 37 perros: 22 tenían dolor óseo asociado a tumores y 15 tenían hipercalcemia de neoplasia maligna. En perros evaluables (n = 29), un porcentaje sorprendentemente similar de perros desarrolló azotemia, 13,7% (28). Sin embargo, todos los perros (n = 4) que desarrollaron azotemia tuvieron eventos adversos de bajo grado (I y II). Por último, el uso de ZOL en el entorno metastásico manifiesto para perros con metástasis pulmonares de SG mostró una eficacia mínima en la enfermedad en estadio III. No se observó azotemia en una cohorte pequeña (n = 8) de perros evaluados al mes (29). Los autores señalaron posibles eventos adversos novedosos, como fiebre y conjuntivitis, pero estos signos clínicos están bien documentados y probablemente se deban solo a la progresión de la enfermedad de SG (30). También se ha evaluado una combinación de ZOL y RT en gatos con carcinoma oral osteoinvasivo de células escamosas. Sobre la base de estudios in vitro que no mostraron diferencias en el tiempo de ZOL, los gatos fueron tratados simultáneamente con RT. Los autores observaron una tasa de respuesta decente y mostraron disminuciones en la CTx sérica (31).
Para evaluar el efecto combinado de ZOL y RT sobre la apoptosis, el momento de administración de la ZOL neoadyuvante y la eficacia y tolerabilidad in vivo, se diseñaron dos estudios in vitro y un estudio clínico de SG canina. Planteamos la hipótesis de que ZOL y RT tendrían un efecto diferente en la muerte celular apoptótica en tres líneas celulares caninas de SG. Evaluamos esto mediante el tratamiento de las células Abrams, D-17 y HMPOS con concentraciones crecientes de ZOL con o sin radioterapia concurrente. En segundo lugar, planteamos la hipótesis de que el momento de la administración de ZOL afecta a la progresión del ciclo celular del SG canino. Para probar esto, recolectamos células 0, 4, 24 y 48 h después de la administración de ZOL para imitar los tiempos de tratamiento adyuvante alcanzables en la clínica. Finalmente, planteamos la hipótesis de que los perros que recibieron ZOL con RT para su SG apendicular tendrían una tasa de fracturas significativamente menor en comparación con los perros históricos que recibieron PAM y RT (26). Para probar este objetivo, tratamos prospectivamente a 20 perros con SG natural con una combinación de ZOL y RT. Observamos esta cohorte de perros para la mejoría subjetiva del dolor, la tasa de fractura y el tiempo hasta la fractura, el tiempo hasta la progresión tumoral, la supervivencia general y la incidencia de efectos secundarios agudos (es decir, azotemia).
2 Materiales y métodos
2.1 Cultivo celular
En este estudio se utilizaron las líneas celulares de osteosarcoma canino D-17 (32), Abrams (33) y HMPOS (34). Todas las líneas celulares se sometieron a pruebas de ausencia de micoplasma antes de su uso en el estudio. Las células se cultivaron en un medio completo que contenía DMEM con alto contenido de glucosa (Gibco cat# 11965092), 10% de suero fetal bovino (FBS) inactivado por calor (Gibco cat# 16140071) y 1% de penicilina-estreptomicina (10.000 U/mL) (Gibco cat# 15140122) e incubadas a 37°C en 5% de CO2. Para mantener una alta viabilidad, las células se tripsinizaron y se dividieron cada 3-4 días en proporciones de 1:20 (D-17 y HMPOS) o 1:40 (Abrams).
2.2 Apoptosis
Las líneas celulares de osteosarcoma se sembraron en Corning™ Placas de 96 pocillos que contienen paredes opacas de color blanco (cat# 3610) a 400 (Abrams), 500 (D-17) o 1000 (HMPOS) células/pocillo utilizando un medio completo. Las células se dejaron expandir durante la noche y se trataron al día siguiente con un medio completo que contenía concentraciones variables de ZOL (0,1 μM, 1 μM, 10 μM y 100 μM), así como un control de vehículo (PBS). Después de 24 h de tratamiento, las placas se irradiaron a diferentes niveles de radiación (0, Gy, 2 Gy, 4 Gy y 8 Gy), y 24 h después de la radiación, las placas se analizaron para determinar su viabilidad y apoptosis utilizando el Promega ApoLive-Glo™ Ensayo Multiplex (cat# G6411) en triplicados técnicos y réplicas biológicas. Se determinó la relación entre la actividad de las caspasas y las células viables para normalizar el número de células y determinar el grado de activación de las caspasas.
2.3 Citometría de flujo: detención del ciclo celular
Las líneas celulares de osteosarcoma se sembraron en Corning™ Placas de 6 pocillos (cat# 3335) a 200.000 (D-17 y Abrams) o 250.000 (HMPOS) células/pocillo en un medio completo y se dejan adherir durante la noche. Luego, los pocillos se trataron con concentraciones variables de ZOL (0,1 μM, 1 μM, 10 μM y 100 μM), colchicina (0,5 μg/mL) o control de vehículo (PBS). Las células se recolectaron en diferentes momentos después del tratamiento (4, 24 o 48 h) y se prepararon para el análisis citométrico de flujo. En resumen, las células se tripsinizaron y se recolectaron utilizando un medio completo, se centrifugaron a 500 rpm durante 5 minutos y se eliminó el sobrenadante mediante aspiración al vacío. A continuación, las células se lavaron con 1 mL de PBS, se centrifugaron a 1500 rpm durante 5 min, y el exceso de PBS se aspiró a aproximadamente 150 μL. Los gránulos celulares se resuspendieron en este exceso de volumen mediante una combinación de pipeteo y vórtice para garantizar grumos mínimos; Se añadió 1 mL de etanol frío al 70% a tubos cónicos separados de 15 mL y, mientras se vortexaba el etanol vigorosamente, las células resuspendidas se pipetearon lentamente, gota a gota, en el etanol. Después de la incubación a 4 °C durante 18 h, se agregó 1 mL de PBS frío y las celdas fijas se peletizaron por centrifugación a 1650 rpm. Los gránulos celulares se resuspendieron en 150 μL de ARNasa A y se añadió yoduro de propidio a las células a una concentración final de 50 μg/mL. Las células se incubaron a 4°C durante 18 h y se analizaron en un citómetro Beckman Coulter Fortessa X20 con filtro 610/20 a un caudal de 200 eventos/s, utilizando exclusión de dobletes y una escala lineal de intensidad de fluorescencia. El experimento de citometría de flujo también se realizó por triplicado.
2.4 Estudio clínico con perros
Los perros con osteosarcoma natural, en el que se rechazó la amputación, se inscribieron en un estudio observacional prospectivo. El zoledronato (ZOL, 0,1 mg/kg IV durante 15 min) se administró aproximadamente 24 h antes de la primera dosis de RT. Todos los perros fueron tratados con fracciones de 8 Gy de RT administradas una vez a la semana durante 4 semanas (25, 26). Los perros fueron tratados con RT utilizando una técnica de distancia fija entre la fuente y el eje (SAD), con la dosis prescrita en el eje central y las unidades de monitorización calculadas mediante una tabla de relación máxima de tejido (TMR) específica del acelerador. La mayoría de los pacientes fueron tratados con portales paralelos opuestos; El volumen de irradiación incluyó radiográficamente toda la lesión (se evaluaron radiografías diagnósticas y puertos de MT) y al menos la mitad de la longitud del hueso largo. La ZOL podría sincronizarse con una dosis final de radioterapia (día 21) o después de la RT, según las finanzas del propietario y la discreción del médico. La ZOL se continuó aproximadamente cada 28 días, dependiendo del estado de la enfermedad y la respuesta.
Los criterios de inclusión incluyeron imágenes basales de las extremidades (radiografías de las extremidades o TC), estadificación torácica (radiografías torácicas o TC torácica), hemogramas completos y química sérica, con análisis de orina realizados cuando fue necesario, según la interpretación clínica de los valores renales. Otra información evaluada incluyó la edad, el sexo/estado de castración, la raza, la presentación de quejas y la duración de los signos clínicos antes del tratamiento.
Después de terminar la primera dosis de ZOL y la totalidad del protocolo RT, los perros no fueron seguidos de manera estandarizada. Específicamente para ZOL, se evaluaron las dosis totales de ZOL, la dosis acumulada de ZOL y la toxicidad cuando se combinaba con RT. Específico de la RT, se recopiló información sobre los efectos secundarios agudos o tardíos de la radiación, la respuesta dentro de los 30 días posteriores al inicio del tratamiento, la fractura patológica, el tiempo transcurrido hasta la fractura y el histopatología si se realizó la cirugía después de la fractura. Específicamente para la terapia médica adyuvante, se recopiló información binomial (sí o no si los perros recibieron carboplatino y sí o no si los perros recibieron un AINE). La elección de los AINE se dejó a la preferencia del veterinario primario o del clínico en el momento de la derivación. Los datos de los resultados (tasa de fractura, tiempo hasta la fractura, tiempo hasta la progresión tumoral y tiempo de supervivencia general) se compararon con un grupo similar de perros (n = 18) que recibieron PAM y RT (26).
2.5 Análisis estadístico
Los análisis estadísticos se realizaron con el software SAS/STAT, versión 15.2, del SAS System for Windows (SAS Institute Inc., Cary, NC, Estados Unidos). Se consideró estadísticamente significativo un valor de p <0,05.
2.5.1 Apoptosis y detención del ciclo celular
El logaritmo natural de la apoptosis se analizó mediante un análisis de varianza de dos vías (ANOVA), que incluyó dos efectos principales (dosis de ZOL y dosis de radiación) y su interacción. Después de que se utilizó la transformación logarítmica natural, la prueba de igualdad de varianzas no fue significativa. Se utilizó el procedimiento de Tukey en la evaluación de comparaciones por pares. La fase del ciclo celular se presentó de forma descriptiva.
2.5.2 Estudio clínico
Las estadísticas descriptivas de las características basales y los eventos adversos se presentaron mediante estadísticas descriptivas, incluidas medias, rangos y porcentajes. La información descriptiva para el grupo PAM de comparación histórica ha sido reportada previamente (26). Se calculó el tiempo hasta la muerte, la progresión y la fractura entre el inicio del tratamiento y el momento de la muerte para la supervivencia general, o el inicio del tratamiento y el momento del evento para la progresión, y el inicio del tratamiento y la fractura, respectivamente. Los tiempos de los eventos se censuraban si el evento no había ocurrido en el último seguimiento. Para cada grupo de tratamiento (ZOL vs. PAM), se calcularon las curvas de Kaplan-Meier para el tiempo de supervivencia general, el tiempo de supervivencia libre de progresión, el tiempo hasta la fractura y la mediana de los tiempos de los eventos, y se estimaron sus intervalos de confianza del 95 %. Se utilizó la prueba de rango logarítmico para comprobar la igualdad de las curvas de supervivencia para los dos grupos de tratamiento. Para comparar el peso entre las cohortes ZOL y PAM, se utilizó la prueba de Wilcoxon. Para comparar la información demográfica entre las cohortes, se realizó la prueba exacta de Fisher o la prueba exacta de chi-cuadrado de Pearson.
3 Resultados
3.1 La apoptosis difiere entre las líneas celulares caninas de SG tratadas con zoledronato y radiación
Se utilizó el logaritmo natural de la apoptosis para satisfacer la suposición de varianzas iguales al evaluar los efectos de ZOL y RT en un ANOVA de 2 vías (véanse las Tablas Suplementarias S1.1, S1.2). Para Abrams, hubo diferencias significativas en las medias de apoptosis de ln con cada aumento en la concentración de ZOL (por ejemplo, 0 a 0,1, 0,1 a 1 y 1 a 10 μM), pero no hubo diferencias significativas en las medias para 10 y 100 μM. Además, la apoptosis de ln para dosis bajas (0 Gy vs. 2 Gy) y altas (4 Gy vs. 8 Gy) RT no fueron significativas, pero hubo una diferencia significativa entre 2 Gy y 4 Gy. Por el contrario, el HMPOS tuvo una interacción estadística significativa entre ZOL y RT en el ANOVA de 2 vías. Hubo una diferencia significativa en las medias de apoptosis de ln cuando se comparó la concentración de ZOL de 0 μM a 0,1 μM solo cuando la RT fue de 0 Gy. No hubo diferencias significativas en las medias de apoptosis de ln con cada aumento de la concentración de ZOL (p. ej., 0,1 a 1, 1 a 10 y 10 a 100 μM) cuando la dosis de RT fue superior a 0 Gy.
3.2 El zoledronato tiene un efecto mínimo sobre la detención del ciclo celular G2-M en comparación con la colchicina in vitro
El efecto del momento del tratamiento en la detención del ciclo celular de la fase G2-M se evaluó mediante el tratamiento de células con vehículo (control negativo), zoledronato a una concentración biológicamente relevante (10 μM) o colchicina (control positivo) con células «congeladas» en varios puntos de tiempo (4, 24 y 48 h) después del tratamiento con ZOL para imitar los tiempos de tratamiento clínico. La detención del ciclo celular se evaluó mediante citometría de flujo; En la Figura 1 se muestran ejemplos de gráficos de citometría de flujo de células de Abrams congeladas en el punto de tiempo de 24 horas. La Tabla Suplementaria S2 muestra los porcentajes medios (y desviación estándar) del ciclo celular en la fase G0/G1, S o G2/M. Específicamente para la detención de fase G2/M, donde las células son más sensibles a la radioterapia, ZOL no reflejó nuestro control positivo (colchicina) en ninguna línea celular que no sea en el punto de tiempo de 48 h en las células Abrams y HMPOS (Figura 2).
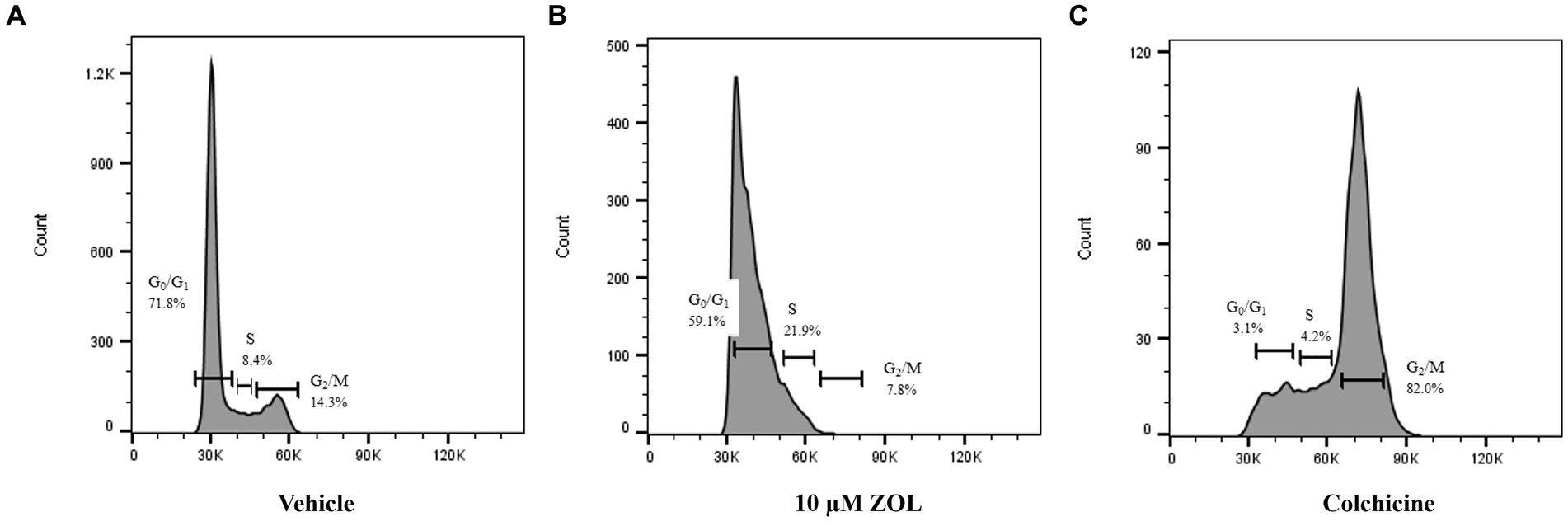 Figura 1. Ejemplos de diagramas de citometría de flujo de células de Abrams recolectadas a las 24 h después del tratamiento con zoledronato. La fase del ciclo celular se evaluó mediante citometría de flujo después de que las células fueran tratadas con control de vehículo (A), 10 μM ZOL (B) o colchicina (C). Se muestra el porcentaje de células en distintas fases del ciclo celular (G0/G1, S y G2/M).
Figura 1. Ejemplos de diagramas de citometría de flujo de células de Abrams recolectadas a las 24 h después del tratamiento con zoledronato. La fase del ciclo celular se evaluó mediante citometría de flujo después de que las células fueran tratadas con control de vehículo (A), 10 μM ZOL (B) o colchicina (C). Se muestra el porcentaje de células en distintas fases del ciclo celular (G0/G1, S y G2/M).
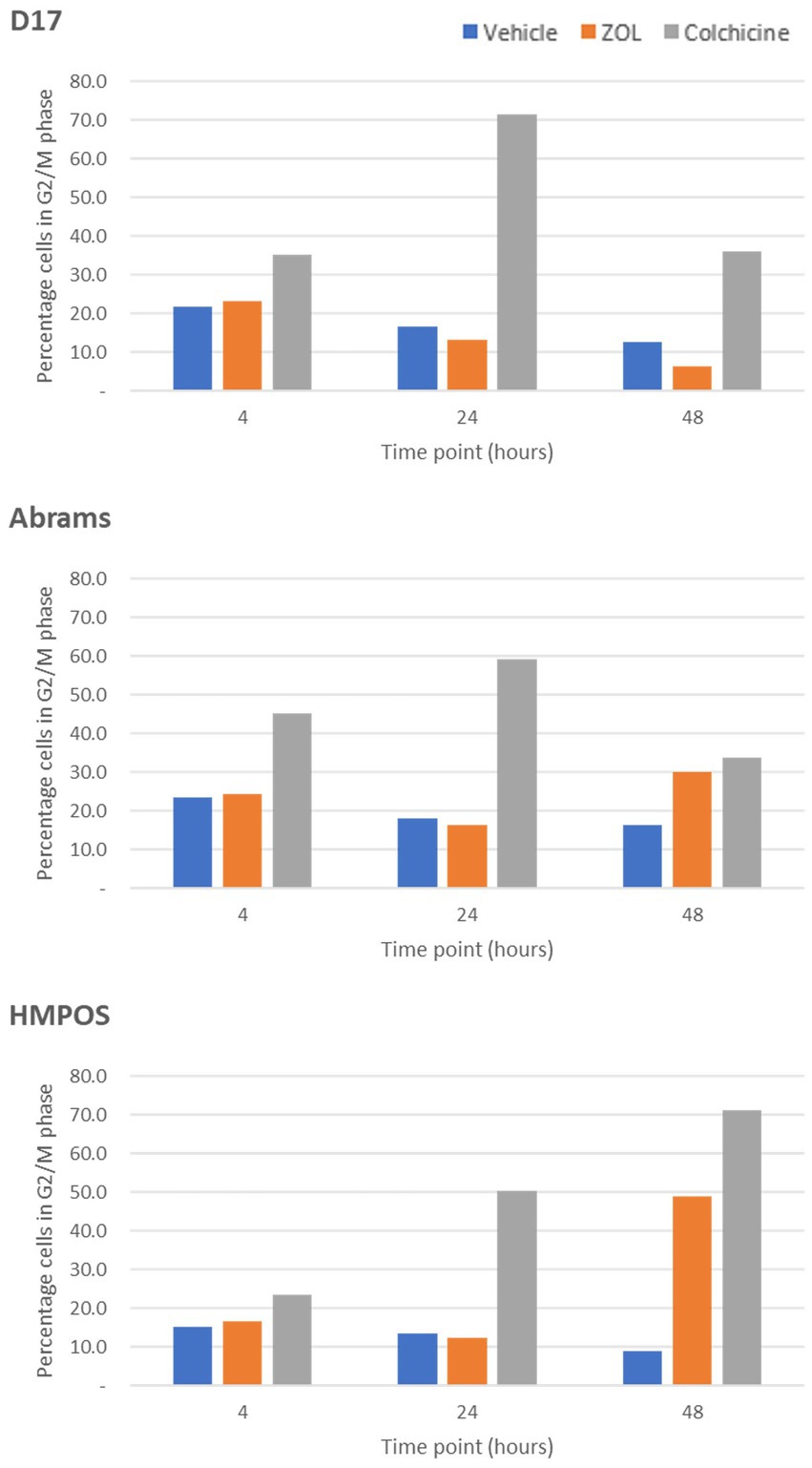 Figura 2. Detención de fase G2-M en células tratadas con control de vehículos, zoledronato o colchicina. Se muestra el porcentaje de células detenidas en la fase G2/M del ciclo celular para las líneas celulares de osteosarcoma canino [D-17, Abrams y HMPOS] tratadas con vehículo, zoledronato o colchicina y radioterapia recolectadas a las 4, 24 y 48 h después del tratamiento.
Figura 2. Detención de fase G2-M en células tratadas con control de vehículos, zoledronato o colchicina. Se muestra el porcentaje de células detenidas en la fase G2/M del ciclo celular para las líneas celulares de osteosarcoma canino [D-17, Abrams y HMPOS] tratadas con vehículo, zoledronato o colchicina y radioterapia recolectadas a las 4, 24 y 48 h después del tratamiento.
3.3 El zoledronato y la radioterapia son seguros y eficaces en perros con osteosarcoma
3.3.1 Contratación
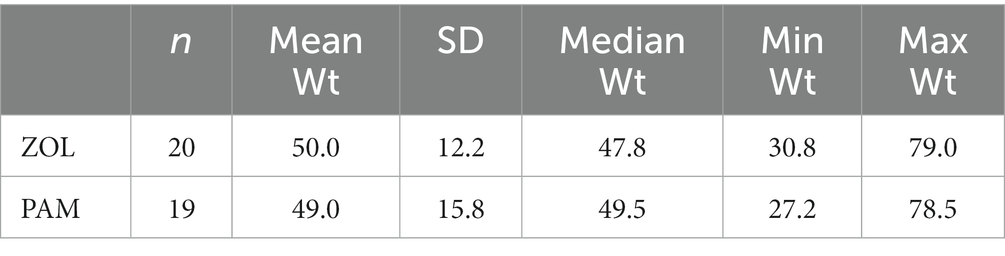
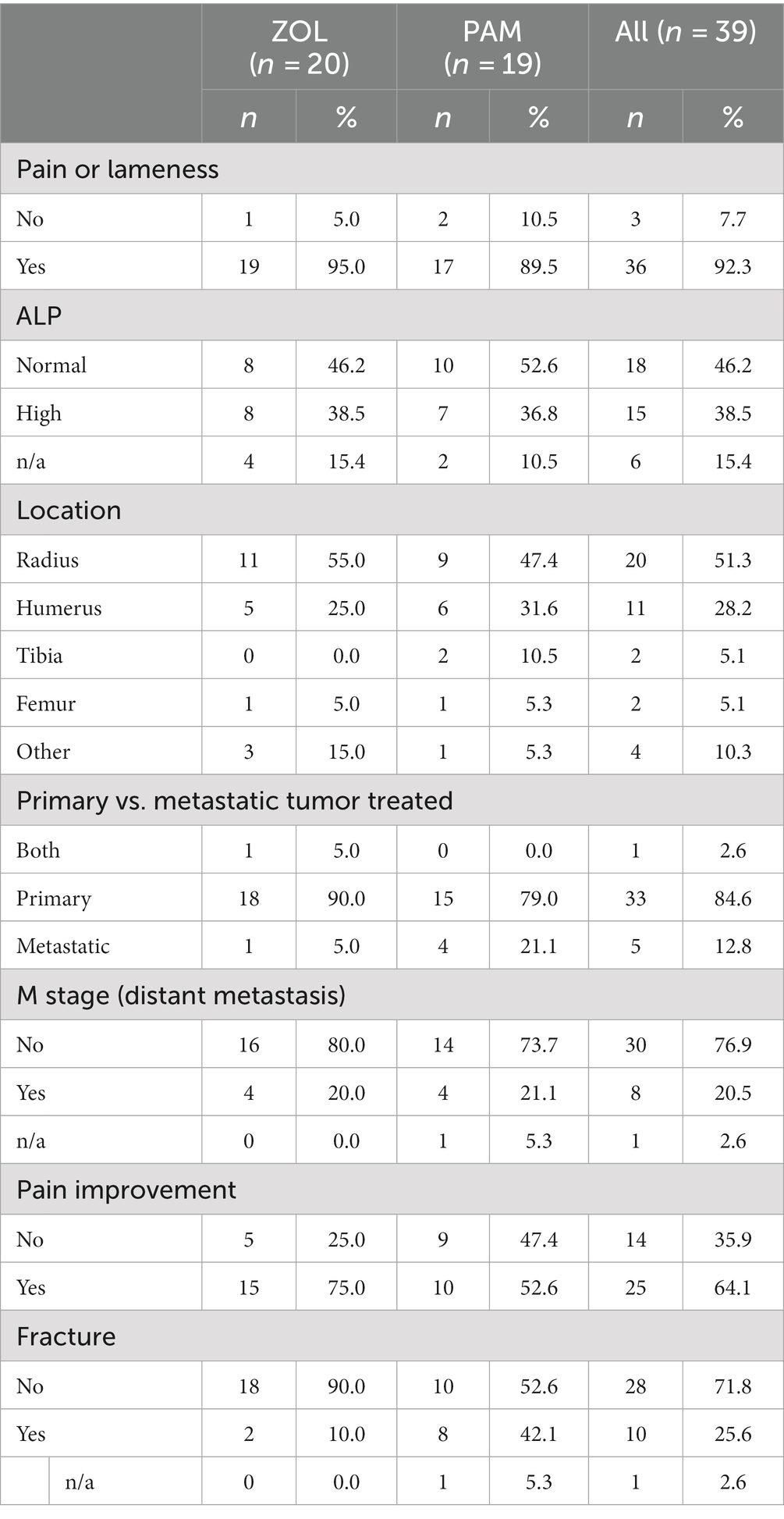
Se inscribieron prospectivamente veinte perros con tumores óseos apendiculares primarios de aparición espontánea. Los 20 perros terminaron el período de investigación de 4 semanas, recibiendo ZOL en el día -1 y radiación (8 Gy una vez a la semana) en los días 0, 7, 14 y 21. El perro #12 recibió ZOL antes de la fracción RT #1 en el mismo día debido a las limitaciones de tiempo del propietario. Predominaron los perros de razas grandes o gigantes; Las razas tratadas incluyeron Golden Retriever (n = 4), mestizo (n = 4), Gran Danés (n = 2), Rottweiler (n = 2), Labrador Retriever (n = 2) y Lobero irlandés (n = 2). Se inscribió una de cada una de las siguientes razas: Bullmastiff, San Bernardo, Pastor alemán, Gran Pirineo. La edad media fue de 8,4 años (rango 2-13 años) y el peso medio fue de 50 kg (rango 30,8-79 kg), similar a publicaciones previas (18). Las localizaciones tumorales incluyeron el radio distal (n = 11), el húmero proximal (n = 5), la pelvis (n = 2), el fémur distal (n = 1) y el húmero y la pelvis (n = 1). El diagnóstico se confirmó con base en citología con positividad para fosfatasa alcalina (35) en 13 casos (65%), histopatología después de biopsia ósea en 4 casos (20%) y en base a la localización del tumor y hallazgos radiográficos en 3 casos (15%). Si bien todos los perros tenían valores renales basales en los paneles químicos séricos o en los paneles renales séricos, cuatro perros no tenían valores basales de FA sérica. Se observó un aumento de los valores de FA en el 50% de los casos (8/16), un indicador de pronóstico negativo conocido en perros (36). En la Tabla 1 (ponderación) y en la Tabla 2 (otra información demográfica) se presentan tablas comparativas entre la cohorte prospectiva de ZOL y la cohorte histórica de PAM. Ningún factor pronóstico negativo conocido (es decir, la ubicación del tumor o el estado de la fosfatasa alcalina) fue significativamente diferente entre las cohortes de ZOL y PAM (Tabla 2).
3.3.2 Seguridad
En el caso específico de la radiación, se observaron efectos secundarios agudos [todos clasificados según los criterios del grupo de oncología radioterápica veterinaria (VRTOG) (37)] en el 25 % (5/20) de los perros. Todos los perros tuvieron efectos secundarios en la piel; dos perros desarrollaron VRTOG grado I, un perro desarrolló grado II y dos perros desarrollaron descamación y dermatitis grado III. Todos los efectos cutáneos fueron transitorios y autolimitados. Se observó que el treinta y tres por ciento (5/15) de los perros tenían efectos secundarios tardíos, observados como alopecia y leukotrichia (grado I, n = 3) o alopecia sola (grado I, n = 2). Dado que la fractura patológica no se ha definido como un efecto secundario tardío para el hueso en el esquema actual de gradación de la EA VRTOG (37), no incluimos los n = 2 perros (sin grado) con fractura patológica detectada en nuestro estudio. Cinco perros no fueron evaluados por efectos secundarios tardíos, ya que no sobrevivieron más de 6 meses para la evaluación.
Para la evaluación de la azotemia y la lesión renal aguda en nuestro estudio observacional, la azotemia se evaluó antes de la administración de ZOL y RT inmediatamente después de la cuarta dosis de RT o antes de una segunda dosis de ZOL. Las comparaciones descriptivas y estadísticas se presentan en la Tabla Suplementaria S3. Al noventa por ciento de los perros (18/20) se les realizaron paneles químicos de referencia. Tres de estos 18 perros tenían evidencia de azotemia (dos aumentaron el BUN (37 y 37 mg/dL, rango de referencia normal 8-29 mg/dL) y uno aumentó la creatinina [1,5 mg/dL, rango de referencia normal 0,7-1,4 mg/dL)]. A los dos perros con aumento de BUN se les realizaron análisis de orina y tenían orina bien concentrada, lo que significa azotemia prerrenal (USG 1.055 y 1.045). Al perro con creatinina aumentada no se le realizó un análisis de orina y su BUN fue normal. Por lo tanto, 1 de los 17 perros (5,9%) tenía potencial azotemia renal antes de recibir ZOL. Dos de los tres perros sin paneles químicos séricos basales se sometieron a una evaluación de seguimiento de sus valores renales, y ninguno de los dos tenía evidencia de azotemia después de la administración de ZOL. En la cohorte n = 18 con información basal, dos perros tenían evidencia de azotemia post-ZOL (BUN y creatinina 42 y 1,4 mg/dL, 30 y 1,6 mg/dL, respectivamente). Se dispuso de análisis de orina, con orina bien concentrada documentada en ambos (USG 1,048 y 1,040, respectivamente), lo que significa azotemia prerrenal. Por lo tanto, la incidencia de lesión renal aguda (azotemia renal) post-administración de ZOL en perros con información química sérica basal fue de 0 en 18 (0%). El único perro con azotemia prerrenal antes y después de la administración de ZOL fue seguido a largo plazo y mantuvo un BUN aumentado con creatinina normal y orina concentrada hasta la muerte. En este grupo de perros con SG, 18 de los 20 perros también recibían un AINE antes de comenzar el protocolo ZOL + RT.
Los niveles de calcio sérico también fueron evaluables en 18 de los 20 perros, y solo un perro tuvo un aumento del calcio total sérico (11,1 mg/dL, rango de referencia normal de 9,1-10,8 mg/dL). Los niveles séricos totales de calcio de seguimiento estaban disponibles inmediatamente antes de la segunda dosis de ZOL. Solo 1 de los 18 perros (5,5%) presentó hipocalcemia después de la administración de ZOL; sin embargo, la disminución de calcio en este paciente fue clínicamente insignificante (sin signos clínicos, calcio total 9,0 mg/dL).
A los perros se les permitió continuar recibiendo ZOL después de terminar su protocolo RT. Todos los perros recibieron al menos 2 dosis de ZOL. La mediana del número de ZOL administrados fue de 4 (rango 2-15) con una dosis acumulada mediana de 0,35 mg/kg (rango 0,14-1,4 mg/kg). Originalmente, a los perros se les prescribía exactamente 0,1 mg/kg en función del peso corporal. Sin embargo, a medida que se disponía de más información sobre la seguridad, la eficacia, la disponibilidad del fármaco y el coste, se dosificó el ZOL en función del peso corporal hasta alcanzar un límite de 4 mg en total. La dosis individual más alta de ZOL administrada antes de este límite fue de 6,8 mg. La evaluación a largo plazo de la azotemia renal no estaba disponible, ya que algunos perros fueron tratados por sus veterinarios de cabecera después de completar sus protocolos de radiación. Sin embargo, tras la revisión de la historia clínica, no se observaron casos de azotemia renal, hipocalcemia clínica u osteonecrosis de la mandíbula (38).
3.3.3 Evolución de la enfermedad
La mayoría de los perros tratados con ZOL y RT (15/20, 75%) tuvieron una mejoría subjetiva en su dolor observada en el día 30. Un perro se consideró no doloroso al inicio del tratamiento y, por lo tanto, no se esperaba que tuviera una «mejoría» en el dolor; este perro tenía una SG del húmero encontrada incidentalmente en el momento de la estadificación de un cáncer separado que no era de OS. Solo el 10% de los perros (2/20) tratados con ZOL y RT desarrollaron una fractura patológica, en comparación con el 44% (8/18) de los perros tratados históricamente con PAM y RT (p = 0,027, Figura 3). La información del caso de un perro en el grupo PAM no pudo probar o refutar el desarrollo de fracturas. La mediana del tiempo hasta la fractura en los perros PAM fue de 218 días, mientras que la mediana del tiempo hasta la fractura en los perros ZOL no se alcanzó (p = 0,015, Figura 3). Los dos perros que desarrollaron fracturas patológicas en el grupo ZOL tenían lesiones en el húmero proximal, con un perro fracturado a los 57 días y el segundo a los 202 días.
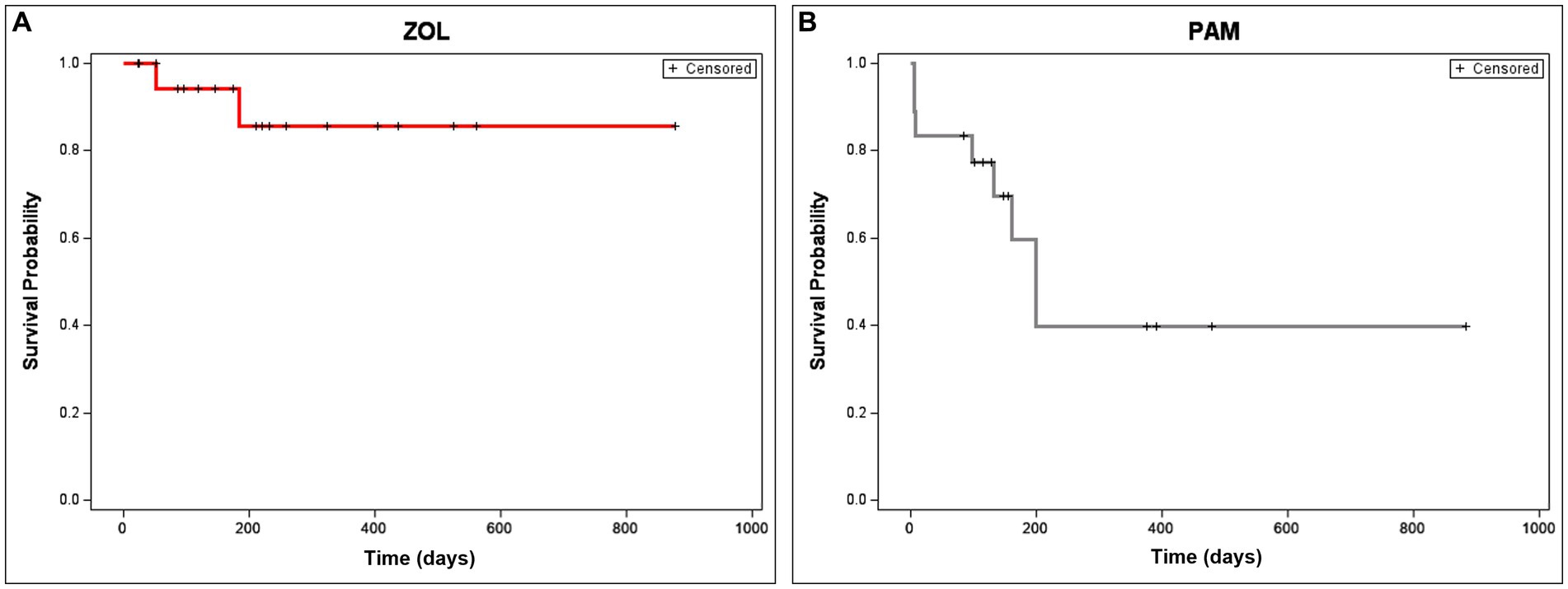 Figura 3. Tiempo hasta la fractura en perros que reciben zoledronato neoadyuvante y radioterapia para el osteosarcoma apendicular. El tiempo hasta la fractura se representa en perros tratados con ZOL (A) o PAM (B). Solo el 10% de los perros (2/20) tratados con zoledronato (ZOL) y RT desarrollaron una fractura patológica, en comparación con el 44% (8/18) de los perros tratados históricamente con pamidronato (PAM) y RT (p = 0,027). La mediana del tiempo hasta la fractura en los perros PAM fue de 218 días, mientras que el tiempo hasta la fractura en los perros ZOL no se alcanzó (p = 0,015). Los perros que fueron censurados (perdidos durante el seguimiento o eliminados del análisis debido a la progresión de la enfermedad no relacionada con la fractura patológica) se muestran como marcas de verificación.
Figura 3. Tiempo hasta la fractura en perros que reciben zoledronato neoadyuvante y radioterapia para el osteosarcoma apendicular. El tiempo hasta la fractura se representa en perros tratados con ZOL (A) o PAM (B). Solo el 10% de los perros (2/20) tratados con zoledronato (ZOL) y RT desarrollaron una fractura patológica, en comparación con el 44% (8/18) de los perros tratados históricamente con pamidronato (PAM) y RT (p = 0,027). La mediana del tiempo hasta la fractura en los perros PAM fue de 218 días, mientras que el tiempo hasta la fractura en los perros ZOL no se alcanzó (p = 0,015). Los perros que fueron censurados (perdidos durante el seguimiento o eliminados del análisis debido a la progresión de la enfermedad no relacionada con la fractura patológica) se muestran como marcas de verificación.
Al evaluar la progresión de la enfermedad o la supervivencia global, no se observaron diferencias estadísticamente significativas entre los grupos. La mediana de tiempo hasta la progresión tumoral (con IC 95 %) para los perros PAM y ZOL fue de 146 (66-148) y 202 (95-284) días, respectivamente (p = 0,311). La mediana del tiempo de supervivencia global (con IC del 95%) para los perros PAM y ZOL fue de 171 (108-412) y 254 (131-354) días, respectivamente (p = 0,616, Figura 4). Solo un perro fue censurado del análisis de supervivencia en el grupo ZOL; esta perra desarrolló peritonitis séptica secundaria a una ovariohisterectomía previa y fue sacrificada a pesar de la marcada mejoría en la cojera después de la ZOL y la RT. A pesar de una reducción en la fractura patológica, la mayoría de los perros tratados con ZOL y RT sucumbieron a su enfermedad, ya sea local o sistémicamente. La mayoría (65%, 13/20) de los perros presentaron progresión de la enfermedad dentro de su campo de radiación. También se observaron metástasis con frecuencia (55%, 11/20), con 4 perros con enfermedad metastásica a distancia al inicio del tratamiento (n = 3 pulmones, n = 1 pelvis). Los 7 perros restantes desarrollaron metástasis pulmonares (n = 4), óseas (n = 1), cutáneas (n = 1) o óseas y cutáneas (n = 1).
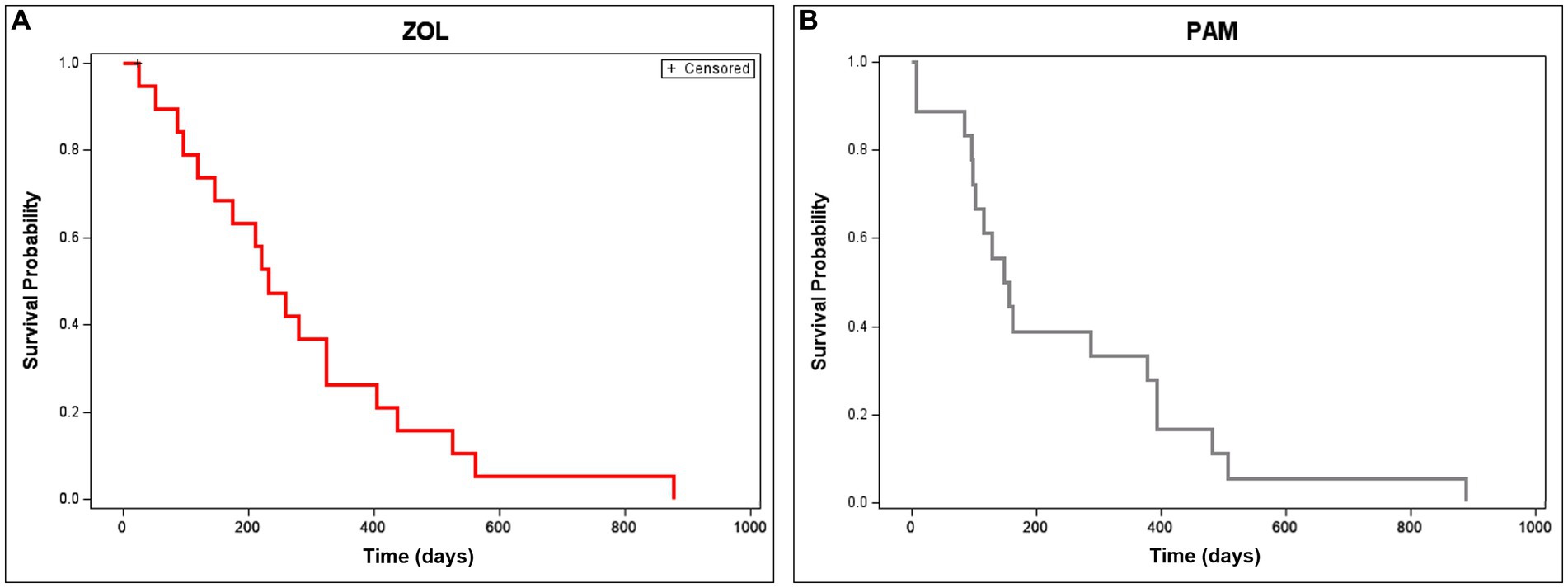 Figura 4. Tiempo de supervivencia general en perros que reciben zoledronato neoadyuvante y radioterapia para el osteosarcoma apendicular. La supervivencia global se representa en perros tratados con ZOL (A) o PAM (B). La mediana del tiempo de supervivencia global (con IC del 95%) para los perros ZOL y PAM fue de 254 (131-354) y 171 (108-412) días, respectivamente (p = 0,616). Los perros que fueron censurados (perdidos durante el seguimiento o que murieron por razones no relacionadas con el cáncer) se muestran como marcas de verificación.
Figura 4. Tiempo de supervivencia general en perros que reciben zoledronato neoadyuvante y radioterapia para el osteosarcoma apendicular. La supervivencia global se representa en perros tratados con ZOL (A) o PAM (B). La mediana del tiempo de supervivencia global (con IC del 95%) para los perros ZOL y PAM fue de 254 (131-354) y 171 (108-412) días, respectivamente (p = 0,616). Los perros que fueron censurados (perdidos durante el seguimiento o que murieron por razones no relacionadas con el cáncer) se muestran como marcas de verificación.
4 Discusión
La mayoría de los perros tratados con ZOL y RT (15/20, 75%) tuvieron una mejoría subjetiva en su dolor. Nos damos cuenta de que la medición objetiva del dolor es superior, y recientemente publicamos la mejoría objetiva del dolor en una pequeña cohorte de perros (n = 4), que recibieron ZOL y RT utilizando cuestionarios validados para propietarios, N-telopéptidos séricos, análisis cinético/de placa de fuerza, y 18Tomografías por emisión de positrones y tomografías computarizadas con F-FDG (39). Esos cuatro perros tuvieron una mejoría tanto subjetiva (evaluación del propietario) como objetiva (cinética y tomografía por emisión de positrones) en su dolor a los 28 días después de iniciar el tratamiento con ZOL y RT. En futuros estudios prospectivos que evalúen el alivio del dolor a partir de intervenciones terapéuticas de SG se deben utilizar medidas validadas subjetivas (40) y objetivas (análisis cinético, imágenes PET/TC y nuevos biomarcadores del dolor), con la salvedad de que las concentraciones de N-telopéptido son solo una parte (actividad osteoclástica) de la ecuación del dolor. Con una baja tasa de fracturas (10%) y una mejoría en el dolor, ZOL y RT son un protocolo de tratamiento atractivo para los perros con SG que son candidatos no quirúrgicos. Además, en nuestro estudio observacional prospectivo, no observamos ningún evento adverso grave, ya que los valores de creatinina y calcio pre y post-ZOL no fueron significativamente diferentes, ni ningún perro interrumpió sus tratamientos con ZOL debido a una lesión renal aguda. Con el ZOL genérico ahora disponible, lo que reduce los costos para los propietarios de clientes, debería reemplazar a otros bifosfonatos en el entorno de atención adyuvante de la SG canina.
Si bien presentamos hallazgos interesantes para perros (y potencialmente personas) con osteosarcoma (SG), entendemos algunas de las limitaciones de nuestro estudio. Elegimos tres de las líneas celulares de SG caninas más estudiadas y enfatizamos las líneas libres de micoplasma que nuestro equipo había tenido éxito en el cultivo y la investigación anteriores. Si bien no exploramos los mecanismos de variabilidad de la línea celular en respuesta a los tratamientos con radiación y zoledronato, el panorama caótico de este tipo de tumor podría dar razón a nuestros hallazgos discrepantes. Trabajos previos de miembros de nuestro grupo evaluaron las alteraciones genómicas en muestras de SG primarias y metastásicas. Estos tejidos se obtuvieron del mismo perro o de perros diferentes. Los autores concluyeron que el panorama mutacional, liderado por la pérdida del número de copias de la heterocigosis en el cromosoma 5 (el hogar de TP53), variaba entre perros, pero a menudo las lesiones dentro del mismo perro eran similares (41). De hecho, la variabilidad genómica entre pacientes en la SG canina y humana a menudo resulta en el fracaso del tratamiento estándar. Si bien TP53 se cita comúnmente como uno de los principales «impulsores» de la mutagénesis de la SG, muchos otros factores se han identificado como contribuyentes culpables. La secuenciación del exoma completo de 31 tumores de SG humanos encontró que la mayoría contenía una pérdida de firmas de heterocigosidad similar a la de la inactivación de BRCA1/2 en los cánceres de mama y ovario (42). Si bien no investigamos el estado mutacional de TP53 o BRCA de las tres líneas celulares utilizadas, se ha descrito la genómica de dos de estas líneas celulares (43). En este estudio, TP53 volvió a ser la mutación más común (cambio de sentido) identificada, y en niveles más altos en comparación con las muestras de tejido de SG de pacientes humanos o caninos secuenciadas. Curiosamente, los autores encontraron que HMPOS tenía la carga mutacional aparente más alta. Sin embargo, afirmaron que la línea celular HMPOS se originó a partir de un perro de aldea cuya ascendencia no estaba bien representada en su panel de referencia genómica canina (44). Debido a la bien descrita participación de TP53 en las vías de reparación del daño del ADN (DDR) en tumores sólidos (45), se puede teorizar fácilmente que varios estados mutacionales de TP53 y DDR podrían permitir diferentes sensibilidades a la radiación ionizante. Los estudios futuros deben comparar la genómica de la línea celular de SG canina de las vías de DDR con la línea celular de SG humana más estudiada, U2OS (46).
También reconocemos el hecho de que nuestro estudio utiliza controles históricos. Nuestro razonamiento para utilizar esta cohorte histórica se basó en nuestro reciente estudio retrospectivo, identificando una posible reducción superior en la señal de fractura patológica en perros que recibieron ZOL en comparación con PAM (26). Nos sentimos éticamente obligados a tratar esta cohorte prospectiva con un bifosfonato más potente de nueva generación (3), especialmente con nuestros datos retrospectivos y el perfil de seguridad de ZOL (27), y no realizamos un ensayo clínico prospectivo aleatorizado. Sin embargo, estudios futuros podrían inscribir prospectivamente a perros y evaluar el momento de la administración de ZOL (neo vs. adyuvante) antes de la RT, ya que el grupo del Dr. Tim Fan presentó hallazgos positivos de ZOL en el entorno de RT adyuvante inmediato para pacientes con SG canina (47). Además, nos damos cuenta de que no todos nuestros pacientes caninos tenían un diagnóstico citológico o histológico definitivo. Esto es común en perros que no reciben amputación, ya que el diagnóstico citológico o histológico definitivo a veces puede ser inalcanzable sin que se evalúe todo el espécimen tumoral (es decir, por amputación), o estos diagnósticos pueden introducir complicaciones novedosas como infección y fractura patológica (35, 48-50). De hecho, estudios históricos bien citados han utilizado diagnósticos radiográficos de SG para pacientes caninos no quirúrgicos sin confirmación celular (citológica o histológica) definitiva (40).
Otra limitación de nuestro ensayo, aunque fue una observación prospectiva, fue que el seguimiento no se estandarizó después de nuestro protocolo inicial de 28 días. Reconocemos el hecho de que la mayoría de los RT en el osteosarcoma canino son de naturaleza retrospectiva, pero los estudios futuros deben esforzarse por lograr intervalos de observación estándar, como el programa del Consorcio de Ensayos de Oncología Comparativa recientemente completado de cada 8 semanas después del tratamiento estándar (51). Además, modificamos la dosis máxima de ZOL en función de la bibliografía disponible y de las discusiones con colegas de oncología veterinaria que utilizaban el fármaco. Si bien las publicaciones originales enumeraban 0,25 mg/kg como dosis (20), presentaciones y conversaciones posteriores discutieron 0,1 mg/kg como una dosis más adecuada (47). Después de tratar a muchos perros (incluyendo n = 13 en el estudio actual a 0,1 mg/kg) sobre una base de peso corporal, limitamos nuestra dosis máxima de zoledronato a 4 mg, ya que las dosis de medicamentos humanos pueden variar, pero a menudo se limitan a 4 mg a pesar de que los pesos corporales suelen ser mucho mayores (52). Además, los protocolos de quimioterapia no estaban estandarizados. Casi de manera uniforme, el carboplatino se utilizó con base en el nivel más alto de evidencia de la literatura que establece la terapia adyuvante «estándar de atención» para perros que reciben amputación como su modalidad local de control del dolor (51). Sin embargo, en un perro, se utilizó clorambucilo adyuvante debido a la preocupación por un tumor simultáneo en la base del corazón y a la preocupación del propietario por la toxicidad. En el único otro perro tratado de forma alternativa, su SG se diagnosticó después de haber recibido vinblastina para un tumor de mastocitos (TCM) de alto grado. El perro recibió carboplatino después de terminar su protocolo de vinblastina para el MCT. Los estudios futuros deben asignar prospectiva y aleatoriamente un agente adyuvante, preferiblemente carboplatino, según el nivel de datos de evidencia, versus ningún agente quimioterapéutico en perros que logren el control local del dolor con RT.
En conclusión, el zoledronato parece reducir el riesgo de fractura patológica en perros que también reciben radioterapia para su osteosarcoma apendicular. Se observó una toxicidad mínima o nula, y los perros tuvieron una mejoría subjetiva en el alivio del dolor. Se debe evaluar la exploración continua del papel del zoledronato en el entorno adyuvante de la RT.
Declaración de disponibilidad de datos
Las contribuciones originales presentadas en el estudio están incluidas en el artículo/Material complementario, las consultas posteriores pueden dirigirse al autor correspondiente.
Declaración ética
No se requirió la aprobación ética para el estudio con animales de acuerdo con la legislación local y los requisitos institucionales porque todos los perros fueron tratados con el estándar de cuidado actual. Todos los propietarios dieron su consentimiento para el tratamiento de cuidado estándar para sus perros. No se necesitó la aprobación de la IACUC para este trabajo.
Contribuciones de los autores
CN, AM-W, AR, HR, CM y BF concibieron y planificaron los experimentos in vitro. CN, AR, HR, CM y AM-W llevaron a cabo los experimentos in vitro. Pacientes clínicos tratados con CN, HA, AM-W, LD, JB, CM y BF. CN, BF y CM crearon el protocolo de tratamiento clínico. CN, HA y BF evaluaron los registros de los pacientes para el análisis de los datos. PG realizó análisis estadístico con la asistencia clínica de BF. AM-W, BF y PG contribuyeron a la interpretación de los resultados. BF tomó la iniciativa de escribir el manuscrito. Todos los autores contribuyeron al artículo y aprobaron la versión enviada.
Reconocimientos
Los autores desean agradecer al equipo veterinario (médicos, enfermeras, estudiantes y personal) de la Universidad de Missouri por su incansable trabajo en el cuidado de nuestros pacientes animales de compañía. Además, un gran agradecimiento a Natalie Sywyj y Alex Cardascio, quienes ayudaron con los proyectos preliminares in vitro de ZOL como becarios veterinarios de verano.
Conflicto de intereses
Los autores declaran que la investigación se llevó a cabo en ausencia de relaciones comerciales o financieras que pudieran interpretarse como un posible conflicto de intereses.
Nota del editor
Todas las afirmaciones expresadas en este artículo son únicamente las de los autores y no representan necesariamente las de sus organizaciones afiliadas, ni las del editor, los editores y los revisores. Cualquier producto que pueda ser evaluado en este artículo, o afirmación que pueda ser hecha por su fabricante, no está garantizado ni respaldado por el editor.
Material complementario
El material complementario para este artículo se puede encontrar en línea en: https://www.frontiersin.org/articles/10.3389/fvets.2024.1237084/full#supplementary-material
Referencias
1. Clézardin, P. Mecanismos de acción de los bifosfonatos en oncología: un concepto científico que evoluciona de las actividades antirresorcionales a las anticancerígenas. Representante de Bonekey. (2013) 2:267–7. doi: 10.1038/bonekey.2013.1
2. Suva, LJ, Cooper, A, Watts, AE, Ebetino, FH, Price, J y Gaddy, D. Bifosfonatos en medicina veterinaria: el nuevo horizonte de uso. Hueso. (2021) 142:115711. doi: 10.1016/j.bone.2020.115711
Resumen de PubMed | Texto completo de Crossref | Google Académico
3. Ventilador, TM. La función de los bifosfonatos en el tratamiento de los pacientes con cáncer. Vet Clin North Am Small Anim Pract. (2007) 37:1091–110; vi. doi: 10.1016/j.cvsm.2007.08.002
4. Väänänen, HK, Zhao, H, Mulari, M, y Halleen, JM. La biología celular de la función de los osteoclastos. J Cell Sci. (2000) 113:377–81. doi: 10.1242/jcs.113.3.377
5. Dhillon, S. Ácido zoledrónico (Reclast(), Aclasta(® ®)): una revisión en osteoporosis. Drogas. (2016) 76:1683–97. doi: 10.1007/s40265-016-0662-4
Resumen de PubMed | Texto completo de Crossref | Google Académico
6. Winter, MC, y Coleman, RE. Bifosfonatos en el cáncer de mama: enseñar nuevos trucos a un perro viejo. Curr Opin Oncol. (2009) 21:499–506. doi: 10.1097/CCO.0b013e328331c794
Resumen de PubMed | Texto completo de Crossref | Google Académico
7. Yang, L y Du, S. Eficacia y seguridad del ácido zoledrónico y el pamidronato disódico en el tratamiento de la metástasis esquelética maligna: un metaanálisis. Medicina (Baltimore). (2015) 94:e1822. doi: 10.1097/MD.000000000000001822
Resumen de PubMed | Texto completo de Crossref | Google Académico
8. Himelstein, AL, Foster, JC, Khatcheressian, JL, Roberts, JD, Seisler, DK, Novotny, PJ, et al. Efecto de la dosificación de ácido zoledrónico en intervalos más largos frente a la dosis estándar sobre los eventos esqueléticos en pacientes con metástasis óseas: un ensayo clínico aleatorizado. JAMA. (2017) 317:48–58. doi: 10.1001/jama.2016.19425
Resumen de PubMed | Texto completo de Crossref | Google Académico
9. Algur, E, Macklis, RM y Häfeli, UO. Efectos citotóxicos sinérgicos del ácido zoledrónico y la radiación en líneas celulares de cáncer de próstata y mieloma humano. Int J Radiat Oncol Biol Phys. (2005) 61:535–42. doi: 10.1016/j.ijrobp.2004.09.065
Resumen de PubMed | Texto completo de Crossref | Google Académico
10. Ural, AU, Avcu, F, Candir, M, Guden, M, y Ozcan, MA. Efectos citorreductores sinérgicos in vitro del ácido zoledrónico y la radiación sobre las células de cáncer de mama. Cáncer de Mama Res. (2006) 8:R52. doi: 10.1186/bcr1543
Resumen de PubMed | Texto completo de Crossref | Google Académico
11. Matsumoto, S, Kimura, S, Segawa, H, Kuroda, J, Yuasa, T, Sato, K, et al. Eficacia del bifosfonato de tercera generación, ácido zoledrónico solo y combinado con agentes anticancerígenos contra líneas celulares de cáncer de pulmón de células pequeñas. Cáncer de pulmón. (2005) 47:31–9. doi: 10.1016/j.lungcan.2004.06.003
Resumen de PubMed | Texto completo de Crossref | Google Académico
12. Kim, EH, Kim, MS, Lee, KH, Koh, JS, Jung, WG y Kong, CB. El ácido zoledrónico es un radiosensibilizante eficaz en el tratamiento del osteosarcoma. Oncotarget. (2016) 7:70869–80. doi: 10.18632/oncotarget.12281
Resumen de PubMed | Texto completo de Crossref | Google Académico
13. Ryu, K, Murata, H, Koto, K, Horie, N, Matsui, T, Nishigaki, Y, et al. Efectos combinados de los bifosfonatos y la radiación en las células del osteosarcoma. Res. Anticancerígeno (2010) 30:2713–20.
14. Lutz, S, Balboni, T, Jones, J, Lo, S, Petit, J, Rich, SE, et al. Radioterapia paliativa para metástasis óseas: actualización de una guía basada en la evidencia de la ASTRO. Pract Radiat Oncol. (2017) 7:4–12. doi: 10.1016/j.prro.2016.08.001
Resumen de PubMed | Texto completo de Crossref | Google Académico
15. Hosaka, S, Katagiri, H, Niwakawa, M, Harada, H, Wasa, J, Murata, H, et al. La radioterapia combinada con zoledronato puede reducir los eventos relacionados con el esqueleto en pacientes con carcinoma de células renales con metástasis óseas. Int J Clin Oncol. (2018) 23:1127–33. doi: 10.1007/s10147-018-1310-7
Resumen de PubMed | Texto completo de Crossref | Google Académico
16. Choi, J, Lee, EJ, Yang, SH, Im, YR y Seong, J. Estudio prospectivo de fase II sobre la eficacia de la radioterapia en combinación con ácido zoledrónico en el tratamiento de metástasis óseas dolorosas de cánceres gastrointestinales. J Radiat Res. (2019) 60:242–8. doi: 10.1093/jrr/rry092
17. Denham, JW, Joseph, D, Lamb, DS, Spry, NA, Duchesne, G, Matthews, J, et al. Supresión androgénica y radioterapia a corto plazo versus supresión androgénica y radioterapia a mediano plazo, con o sin ácido zoledrónico, en hombres con cáncer de próstata localmente avanzado (TROG 03.04 RADAR): resultados a 10 años de un ensayo factorial aleatorizado de fase 3. Lancet Oncol. (2019) 20:267–81. doi: 10.1016/S1470-2045(18)30757-5
Resumen de PubMed | Texto completo de Crossref | Google Académico
18. Withrow, SJ, Powers, BE, Straw, RC y Wilkins, RM. Aspectos comparativos del osteosarcoma: perro versus hombre. Clin Orthop Relat Res. (1991) 270:159–68. doi: 10.1097/00003086-199109000-00023
19. Fan, TM, Charney, SC, de Lorimier, LP, Garrett, LD, Griffon, DJ, Gordon-Evans, WJ, et al. Ensayo doble ciego controlado con placebo de pamidronato adyuvante con radioterapia paliativa y doxorrubicina intravenosa para el dolor óseo del osteosarcoma apendicular canino. J Veterinario Pasante Med. (2009) 23:152–60. doi: 10.1111/j.1939-1676.2008.0221.x
Resumen de PubMed | Texto completo de Crossref | Google Académico
20. Fan, TM, de Lorimier, LP, Garrett, LD, y Lacoste, HI. Los efectos biológicos óseos del zoledronato en perros sanos y perros con osteólisis maligna. J Veterinario Pasante Med. (2008) 22:380–7. doi: 10.1111/j.1939-1676.2008.0046.x
Resumen de PubMed | Texto completo de Crossref | Google Académico
21. Poirier, VJ, Huelsmeyer, MK, Kurzman, ID, Thamm, DH y Vail, DM. Los bifosfonatos alendronato y zoledronato son inhibidores del crecimiento celular del osteosarcoma canino y humano in vitro. Veterinario Comp Oncol. (2003) 1:207–15. doi: 10.1111/j.1476-5810.2003.00026.x
Resumen de PubMed | Texto completo de Crossref | Google Académico
22. Li, S y Li, JJ. El ácido zoledrónico modula la proliferación de células de osteosarcoma humano a través de la activación de GSK-3β. Neoplasia. (2019) 66:766–75. doi: 10.4149/neo_2018_181128N904
23. Iguchi, T, Miyakawa, Y, Saito, K, Nakabayashi, C, Nakanishi, M, Saya, H, et al. Detención y apoptosis de la fase S inducida por zoledronato acompañada de daño en el ADN y activación de la vía ATM/Chk1/cdc25 en células de osteosarcoma humano. Int J Oncol. (2007) 31:285–91. doi: 10.3892/ijo.31.2.285
Resumen de PubMed | Texto completo de Crossref | Google Académico
24. Hoddinott, K, Oblak, ML, Wood, GA, Boston, S, y Mutsaers, AJ. Evaluación de los efectos de la radioterapia combinada con pamidronato o zoledronato en las células del osteosarcoma canino. Can J Vet Res. (2019) 83:3–10.
25. Green, EM, Adams, WM, y Forrest, LJ. Radioterapia paliativa de cuatro fracciones para osteosarcoma en 24 perros. J Am Anim Hosp Assoc. (2002) 38:445–51. doi: 10.5326/0380445
Resumen de PubMed | Texto completo de Crossref | Google Académico
26. Norquest, CJ, Maitz, CA, Keys, DA, Moore, M, Bryan, JN, Ehling, TJ, et al. Tasa de fractura y tiempo hasta la fractura en perros con osteosarcoma apendicular que reciben radioterapia finamente fraccionada en comparación con radioterapia fraccionada gruesa: un estudio de una sola institución. Vet Med Sci. (2022) 8:1013–24. doi: 10.1002/vms3.782
27. Vidal, S.A., Skorupski, KA, Willcox, JL, Palm, CA, y Burton, JH. Evaluación retrospectiva de la lesión renal aguda tras la administración de ácido zoledrónico a perros con osteólisis maligna. Front Vet Sci. (2021) 8:647846. doi: 10.3389/fvets.2021.647846
Resumen de PubMed | Texto completo de Crossref | Google Académico
28. Lopes, MG, Tosi, G, McNaught, K, y Morris, JS. Evaluación retrospectiva de la tolerabilidad y eficacia del zoledronato en el tratamiento paliativo de perros portadores de cáncer. Aust Vet J. (2022) 101:58–64. doi: 10.1111/avj.13218
29. Smith, AA, Lindley, SES, Almond, GT, Bergman, NS, Matz, BM y Smith, AN. Evaluación del zoledronato para el tratamiento del osteosarcoma canino en estadio III: un estudio de fase II. Vet Med Sci. (2022) 9:59–67. doi: 10.1002/vms3.1000
30. Withers, SS, Johnson, EG, Culp, WTN, Rodríguez, CO Jr, Skorupski, KA y Rebhun, RB. Osteopatía hipertrófica paraneoplásica en 30 perros. Veterinario Comp Oncol. (2015) 13:157–65. doi: 10.1111/vco.12026
Resumen de PubMed | Texto completo de Crossref | Google Académico
31. Lundberg, AP, Tran Hoang, C, Billhymer, A, y Selting, KA. Combinación de radioterapia con zoledronato para el tratamiento del carcinoma oral de células escamosas felino osteoinvasivo. Veterinario Comp Oncol. (2022) 20:788–96. doi: 10.1111/vco.12830
Resumen de PubMed | Texto completo de Crossref | Google Académico
32. Modesto, P, Castrillo Fernández, JL, Martini, I, Zoccola, R, Pugliano, MC, de Ciucis, CG, et al. Caracterización de la línea celular de osteosarcoma canino D-17 y evaluación de su capacidad de respuesta a estresores infecciosos utilizados como terapia alternativa contra el cáncer. Animales (Basilea). (2020) 10:1981. doi: 10.3390/ani10111981
33. Legare, ME, Bush, J, Ashley, AK, Kato, T y Hanneman, WH. Caracterización celular y fenotípica de líneas celulares de osteosarcoma canino. J Cáncer. (2011) 2:262–70. doi: 10.7150/jca.2.262
Resumen de PubMed | Texto completo de Crossref | Google Académico
34. Barroga, EF, Kadosawa, T, Okumura, M y Fujinaga, T. Establecimiento y caracterización del crecimiento y la metástasis pulmonar de una línea celular altamente metastásica pulmonar del osteosarcoma canino en ratones desnudos. J Vet Med Sci. (1999) 61:361–7. doi: 10.1292/jvms.61.361
Resumen de PubMed | Texto completo de Crossref | Google Académico
35. Barger, A, Graca, R, Bailey, K, Messick, J, de Lorimier, LP, Fan, T, et al. Uso de tinción con fosfatasa alcalina para diferenciar el osteosarcoma canino de otros tumores positivos para vimentina. Veterinario Pathol. (2005) 42:161–5. doi: 10.1354/vp.42-2-161
36. Boerman, I, Selvarajah, GT, Nielen, M y Kirpensteijn, J. Factores pronósticos en el osteosarcoma apendicular canino: un metanálisis. BMC Vet Res. (2012) 8:56. doi: 10.1186/1746-6148-8-56
Resumen de PubMed | Texto completo de Crossref | Google Académico
37. Ladue, T, y Klein, MK. Criterios de toxicidad del grupo de oncología de radioterapia veterinaria. Ecografía Radiol Veterinaria. (2001) 42:475–6. doi: 10.1111/j.1740-8261.2001.tb00973.x
Resumen de PubMed | Texto completo de Crossref | Google Académico
38. Lundberg, AP, Roady, PJ, Somrak, AJ, Howes, ME y Fan, TM. Osteonecrosis de la mandíbula asociada a zoledronato en un perro con osteosarcoma apendicular. J Veterinario Pasante Med. (2016) 30:1235–40. doi: 10.1111/jvim.13980
Resumen de PubMed | Texto completo de Crossref | Google Académico
39. Flesner, BK, Torres, BT, Hutcheson, KD, Rindt, H, Zalcman, AR, y Maitz, CA. Un estudio piloto del dolor óseo inducido por el cáncer mediante cuestionarios validados para el propietario, concentración sérica de N-telopéptido, análisis cinético y PET/CT. (2021) 8:637195. doi: 10.3389/fvets.2021.637195
40. Brown, DC, Boston, R, Coyne, JC y Farrar, JT. Un enfoque novedoso para el uso de animales en estudios de dolor: validación del inventario de dolor breve canino en cáncer óseo canino. Medicina para el dolor. (2009) 10:133–42. doi: 10.1111/j.1526-4637.2008.00513.x
Resumen de PubMed | Texto completo de Crossref | Google Académico
41. Chu, S, Skidmore, ZL, Kunisaki, J, Walker, JR, Griffith, M, Griffith, OL, et al. Desentrañar el caótico panorama genómico del osteosarcoma apendicular canino primario y metastásico con las tecnologías de secuenciación actuales y los enfoques bioinformáticos. PLoS Uno. (2021) 16:e0246443. doi: 10.1371/journal.pone.0246443
42. Kovac, M, Blattmann, C, Ribi, S, Smida, J, Mueller, NS, Engert, F, et al. La secuenciación del exoma del osteosarcoma revela firmas mutacionales que recuerdan a la deficiencia de BRCA. Nat Commun. (2015) 6:8940. doi: 10.1038/ncomms9940
Resumen de PubMed | Texto completo de Crossref | Google Académico
43. Megquier, K, Turner-Maier, J, Morrill, K, Li, X, Johnson, J, Karlsson, EK, et al. El paisaje genómico de las líneas celulares de osteosarcoma canino revela una complejidad estructural conservada y alteraciones en las vías. PLoS Uno. (2022) 17:e0274383. doi: 10.1371/journal.pone.0274383
Resumen de PubMed | Texto completo de Crossref | Google Académico
44. Shannon, LM, Boyko, RH, Castelhano, M, Corey, E, Hayward, JJ, McLean, C, et al. La estructura genética de los perros de aldea revela un origen de domesticación en Asia central. Proc Natl Acad Sci USA. (2015) 112:13639–44. doi: 10.1073/pnas.1516215112
Resumen de PubMed | Texto completo de Crossref | Google Académico
45. Vodicka, P, Andera, L, Opattova, A, y Vodickova, L. Las interacciones de la reparación del ADN, la homeostasis de los telómeros y el estado mutacional de p53 en cánceres sólidos: riesgo, pronóstico y predicción. Cánceres (Basilea). (2021) 13:479. doi: 10.3390/cancers13030479
Resumen de PubMed | Texto completo de Crossref | Google Académico
46. Grosse, N, van Loon, B, y Rohrer Bley, C. Respuesta al daño del ADN y reparación del ADN: ¿perro como modelo? BMC Cáncer. (2014) 14:203. doi: 10.1186/1471-2407-14-203
Resumen de PubMed | Texto completo de Crossref | Google Académico
47. Garrett, L. B. A., Schmit, J, George, N, Wypij, J y Fan, T. Radioterapia acelerada y zoledronato para el dolor óseo por osteosarcoma. en la reunión anual de la Sociedad de Cáncer Veterinario. (2011). Albequerque, NM.
48. Reinhardt, S, Stockhaus, C, Teske, E, Rudolph, R, y Brunnberg, L. Evaluación de los criterios citológicos para el diagnóstico del osteosarcoma en perros. J Pequeña Anim Pract. (2005) 46:65–70. doi: 10.1111/j.1748-5827.2005.tb00294.x
49. Mankin, HJ, Mankin, CJ y Simon, MA. Los peligros de la biopsia, revisados. Miembros de la Sociedad de Tumores Musculoesqueléticos. J Bone Joint Surg Am. (1996) 78:656–63. doi: 10.2106/00004623-199605000-00004
Resumen de PubMed | Texto completo de Crossref | Google Académico
50. Sabattini, S, Renzi, A, Buracco, P, Defourny, S, Garnier-Moiroux, M, Capitani, O, et al. Evaluación comparativa de la precisión de las biopsias citológicas e histológicas en el diagnóstico de lesiones óseas caninas. J Veterinario Pasante Med. (2017) 31:864–71. doi: 10.1111/jvim.14696
Resumen de PubMed | Texto completo de Crossref | Google Académico
51. LeBlanc, AK, Mazcko, CN, Cherukuri, A, Berger, EP, Kisseberth, WC, Brown, ME, et al. El sirolimus adyuvante no mejora el resultado en perros domésticos que reciben terapia estándar para el osteosarcoma apendicular: un ensayo prospectivo aleatorizado de 324 perros. Clin Cáncer Res. (2021) 27:3005–16. doi: 10.1158/1078-0432.CCR-21-0315
Resumen de PubMed | Texto completo de Crossref | Google Académico
Palabras clave: osteosarcoma, zoledronato, radioterapia, fractura patológica, dolor oncológico
Cita: Norquest CJ, Rogic A, Gimotty PA, Maitz CA, Rindt H, Ashworth HL, Bryan JN, Donnelly LL, McCleary-Wheeler AL y Flesner BK (2024) Efectos del zoledronato neoadyuvante y la radioterapia en la supervivencia celular, la distribución del ciclo celular y el estado clínico en el osteosarcoma canino. Frente. Vet. Sci. 11:1237084. doi: 10.3389/fvets.2024.1237084
Recibido: 08 de junio de 2023; Aceptado: 12 de enero de 2024;
Publicado: 31 enero 2024.
Editado por:
Muhammad Saqib, Universidad de Agricultura, Pakistán
Revisado por:
Rodrigo dos Santos Horta, Universidad Federal de Minas Gerais, Brasil
Lyndah Chow, Universidad Estatal de Colorado, Estados Unidos
Derechos de autor © 2024 Norquest, Rogic, Gimotty, Maitz, Rindt, Ashworth, Bryan, Donnelly, McCleary-Wheeler y Flesner. Este es un artículo de acceso abierto distribuido bajo los términos de la Licencia Creative Commons Attribution License (CC BY).
*Correspondencia: Brian K. Flesner, bflesner@petdx.com
Renuncia: Todas las afirmaciones expresadas en este artículo son únicamente las de los autores y no representan necesariamente las de sus organizaciones afiliadas, ni las del editor, los editores y los revisores. Cualquier producto que pueda ser evaluado en este artículo o afirmación que pueda hacer su fabricante no está garantizado ni respaldado por el editor.
Date de alta y recibe nuestro 👉🏼 Diario Digital AXÓN INFORMAVET ONE HEALTH
Date de alta y recibe nuestro 👉🏼 Boletín Digital de Foro Agro Ganadero
Noticias animales de compañía
Noticias animales de producción
Trabajos técnicos animales de producción
Trabajos técnicos animales de compañía